Метаболіти транскломіфену і їх застосування
Формула / Реферат
1. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і метаболіт транскломіфену, що має структурну формулу, яка вибрана з групи, що складається з:
 ;
;  ;
; 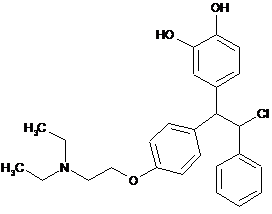 ;
; 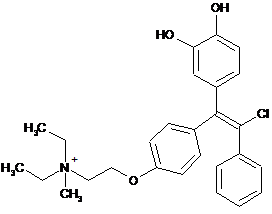 ;
; 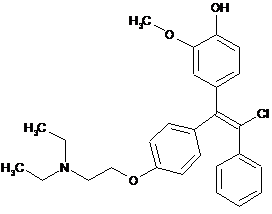 ;
;  i
i 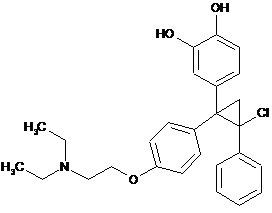
або його фармацевтично прийнятну сіль, де вказана сполука має чистоту більше ніж 95 % на основі вимірювання за допомогою високоефективної рідинної хроматографії (ВЕРХ).
2. Фармацевтична композиція за п. 1 для застосування при лікуванні діабету 2 типу, вторинного гіпогонадизму або пов'язаного з ним порушення у пацієнта чоловічої статі, що потребує цього, що вибраний із зниження м'язової маси, зниження щільності кістки, зниження лібідо, олігоспермії і азооспермії, де композиція містить сполуку в ефективній кількості.
3. Фармацевтична композиція за п. 2, де композицію вводять пацієнтові один раз в інтервалі від 3 до 30 діб, і де рівень тестостерону в сироватці крові, що становить щонайменше 300 нг/дл, підтримують протягом вказаного інтервалу.
4. Фармацевтична композиція за п. 1 для лікування раку молочної залози, ендометріального раку, раку матки, раку яєчників або безпліддя у людини жіночої статі, де фармацевтична композиції містить сполуку в ефективній кількості.
5. Фармацевтична композиція за будь-яким з пп. 1-4, в якій сіль сполуки є сіллю лимонної кислоти.
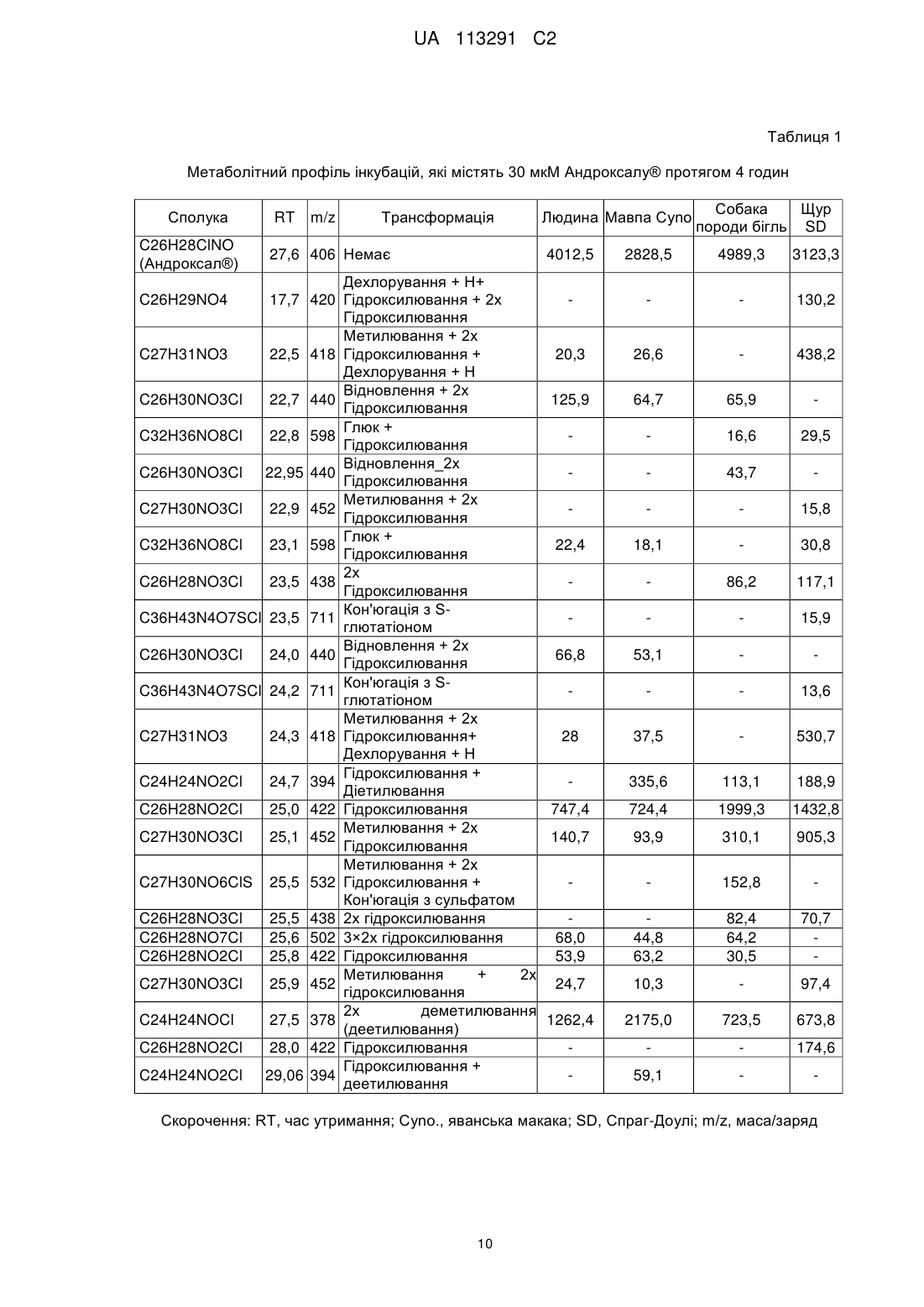
6. Сполука, що має формулу
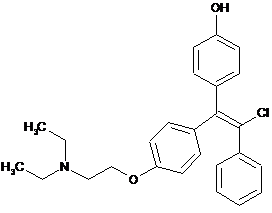 або
або 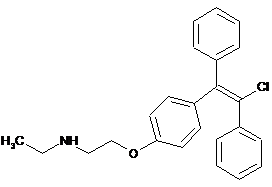 ,
,
або її фармацевтично прийнятна сіль для лікування безпліддя у людини жіночої статі або вторинного гіпогонадизму у людини чоловічої статі шляхом введення ефективної кількості сполуки або її фармацевтично прийнятної солі пацієнту жіночої або чоловічої статі.
Текст
Реферат: UA 113291 C2 (12) UA 113291 C2 Даний винахід стосується істотно чистих метаболітів транскломіфену. Винахід також стосується фармацевтичних композицій, які містять ці метаболіти, і їх застосування для лікування розладів, що включають вторинний гіпогонадизм, діабет 2 типу, підвищений холестерин, підвищені тригліцериди, виснаження, ліподистрофію, жіночу і чоловічу безплідність, доброякісну гіпертрофію передміхурової залози, рак передміхурової залози, рак молочної залози, рак яєчників і рак ендометрія. UA 113291 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ За даною заявкою запитується пріоритет, згідно 35 USC 119(е), попередньою патентною заявкою U.S. No. 61/515278, зареєстрованою 4 серпня 2011 року, повний зміст якої включений в цей документ як посилання. Даний винахід стосується метаболітів транс-кломіфену в по суті чистій формі, фармацевтичних композицій, які містять те ж саме, і способів лікування різних гормонозалежних порушень. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Кломіфен є селективним модулятором рецептора естрогену, що належить до тамоксифену. Кломіфен зв'язується з рецепторами естрогену і блокує нормальний зворотний зв'язок естрогену з гіпоталамусом і подальший негативний зворотний зв'язок з гіпофізом. Це призводить до збільшення рівня лютеїнізуючого гормону (LH) і фолікулостимулюючого гормону (FSH). У чоловіків ці підвищені рівні гонадотропінів стимулюють клітини Лейдіга сім'яників і призводять до вироблення більш високих рівнів тестостерону. Наприклад, Tenover et al., J. Clin. Endocrinol. Metab. 64: 1103, (1987) і Tenover et al., J. Clin. Endocrinol. Metab. 64: 1118 (1987) виявили підвищення FSH, LH як у молодих, так і немолодих чоловіків після лікування кломіфеном. Вони також виявили підвищення вільного і загального тестостерону у чоловіків, причому молоді чоловіки показали значне збільшення. У жінок кломіфен в цей час схвалюють як суміш цис- і транс-ізомерів, цис-ізомер присутній в кількості від приблизно 30 % до приблизно 50 % (довідник Merck) для індукування овуляції у жінок з ановуляторними циклами. Підвищення LH і FSH у жінок з ановуляторними циклами після введення кломіфену призводить до зростання фолікула і, зрештою, до овуляції. Цей лікарський засіб рекомендують вводити протягом 5 діб в дозі до 100 мг на добу. Ernst et al., J. Pharmaceut. Sci. 65: 148 (1976), показали, що кломіфен є сумішшю двох геометричних ізомерів, які відносяться до цис, -Z-, кломіфену (цис-кломіфен або zu-кломіфен) і транс, -Е-, кломіфену (транс-кломіфен або en-кломіфен). Відповідно до Ernst, et al. транс-кломіфен HCI має температуру плавлення 149 °C-150,5 °C, в той час, як цис-кломіфен HCI має температуру плавлення 156,5 °C-158 °C. Ernst et al. також зазначали, що (транс-ізомер) є протиестрогенним (AE), в той час, як цис-ізомер є більш високоактивною і більш естрогенною формою, а також повідомляли, що вона має протиестрогенну активність. Автори приписують вплив лікарського засобу на овуляторну активність обом формам, зазначаючи, що їх суміш є більш ефективною, ніж транс-кломіфен окремо. Транс-ізомер сприяє овуляції на рівні гіпоталамуса. Естрогенний ізомер цис-кломіфену сприяє підвищеній овуляції повсюди протягом фізіологічного шляху, який веде до овуляції. Крім того, вони повідомляли, що ізомери мають різний час напівжиття in vivo. Повідомляли, що цисізомер залишає залишкові рівні в крові протягом більш ніж одного місяця після одноразової дози. Кломіфен асоціювали з численними побічними ефектами, що включають: розфокусовний зір, дискомфорт у черевній ділянці, гінекомастію, тестикулярні пухлини, вазомоторні припливи, нудоту і головні болі. Крім того, інші дослідження дозволяють припускати, що кломіфен має як генотоксичну дію, так і дію, яка збільшує пухлину. Сума цих спостережень зводиться до того, що кломіфен в своєму поточному форматі, який має від 30 % до 50 % цис-ізомеру, був би неприйнятний для застосування при тривалій терапії у чоловіків під час лікування недостатності тестостерону. Було показано, що пероральне введення транс-ізомеру кломіфену (транс-кломіфен або enкломіфен) є ефективним при лікуванні множини порушень, починаючи від вторинного гіпогонадизму у чоловіків до викликання овуляції у жінок з ановуляторними циклами. Однак пресистемний метаболізм лікарського засобу через печінку вимагає відносно високих доз для перорального введення, щоб досягнути терапевтичного ефекту. Значний прогрес у даній галузі буде досягнутий, якщо будуть відкриті активні метаболіти транс-кломіфену. СУТЬ ВИНАХОДУ Даний винахід стосується по суті чистих метаболітів транс-кломіфену і їх солей, переважно солей лимонної кислоти. Він також стосується фармацевтичних композицій, які містять по суті чистий метаболіт транс-кломіфену або його солі і фармацевтично прийнятний носій. Крім того, даний винахід стосується способів лікування і/або профілактики порушень, які поліпшують стан за допомогою введення ефективної кількості транс-кломіфену. Іншими словами, даний винахід стосується способу лікування будь-якого порушення, яке можна лікувати за допомогою транс-кломіфену, що містить введення терапевтично ефективної кількості по суті чистого метаболіту транс-кломіфену або фармацевтичної композиції, яка містить те ж саме, пацієнту, який потребує такого лікування. 1 UA 113291 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади порушень, стани яких поліпшуються за допомогою введення ефективної кількості транс-кломіфену (і які, таким чином, можна лікувати за даним винаходом), як необмежуюючі приклади включають вторинний гіпогонадизм, діабет 2 типу, підвищений холестерин, підвищені тригліцериди, виснаження, ліподистрофію, жіночу і чоловічу безплідність, доброякісну гіпертрофію передміхурової залози, раку передміхурової залози, раку молочної залози, раку матки і раку яєчників. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 представлений графічний зразок профілів нормального секреторного загального тестостерону в сироватці у здорових чоловіків (молодих і немолодих). На фіг. 2 представлена хімічна структура транс-кломіфену. ДЕТАЛЬНИЙ ОПИС Оскільки даний винахід може мати варіанти здійснення в різних формах, нижче наведений опис декількох варіантів здійснення з розумінням того, що даний опис повинен розглядатися як ілюстративний приклад за винаходом, і не призначений обмежувати винахід специфічними варіантами здійснення. Заголовки представлені тільки для зручності і не призначені бути витлумачені як такі, що обмежують винахід яким-небудь способом. Варіанти здійснення, ілюстровані під будь-яким заголовком, можна комбінувати з варіантами здійснення, ілюстрованими під будь-яким іншим заголовком. Потрібно розуміти, що будь-які діапазони, співвідношення і діапазони співвідношень, які можна утворити за допомогою будь-яких присутніх в цьому документі чисел або даних, представляють додаткові варіанти здійснення даного винаходу. Це включає діапазони, які можна утворити, які включають або не включають кінцеву верхню і/або нижню межу. Таким чином, фахівець оцінить, що багато таких співвідношень, діапазонів і діапазонів співвідношень можуть бути однозначно отримані з даних і чисел, наведених в даному винаході, і всі вони представляють варіанти здійснення даного винаходу. Перед тим, як описати і пояснити дані сполуки, композиції і способи, потрібно розуміти, що термінологія, яка використовується в цьому документі, слугує меті опису тільки конкретних варіантів здійснення і не призначена бути обмежуючою. Повинно бути зазначено, що, як застосовують у даному описі і прикладеній формулі винаходу, форми однини включають множинні об'єкти, якщо з контексту не випливає інше. Визначення Термін "пероральне" введення означає, що активний засіб знаходиться в фармацевтичному складі, призначеному для засвоєння, тобто призначеному бути доставленим у шлунковокишкову систему для поглинання. Термін "ефективне дозування" означає кількість активного компонента композиції, яка достатня для лікування конкретного стану. Як застосовують у цьому документі, термін "лікувати" або "лікування" відноситься будь-якого лікування будь-якого прогестерон-залежного порушення або захворювання, і в ролі необмежуючих прикладів включає інгібування порушення або захворювання, блокування розвитку порушення або захворювання; полегшення порушення або захворювання, наприклад, викликаючи ремісію порушення або захворювання; або полегшення стану, спричиненого захворюванням або порушенням, полегшення симптомів захворювання або порушення. Термін "запобігати" або "запобігання" відносно прогестерон-залежного порушення або захворювання означає запобігання початку розвитку порушення або захворювання, якщо воно ще не сталося, або запобігання подальшому розвитку порушення або захворювання, якщо таке порушення або захворювання вже присутнє. Термін "по суті чистий" означає сполуку за даним винаходом, яка має чистоту більше, ніж приблизно 80 %, переважно більше, ніж приблизно 90 %, більш переважно більше, ніж 95 %, і найбільш переважно таку, що має чистоту більше, ніж приблизно 99 %, на основі вимірювання за допомогою високоефективної рідинної хроматографії (ВЕРХ). Термін "фармацевтично прийнятна сіль" стосується солі, отриманої з фармацевтично прийнятної нетоксичної неорганічної або органічної кислоти. Неорганічні кислоти як необмежуючі приклади включають соляну, бромистоводневу, йодистоводневу, азотну, сірчану і фосфорну. Органічні кислоти як необмежуючі приклади включають аліфатичні, ароматичні, карбоксильні і сульфонові органічні кислоти, включаючи, як необмежуючі приклади, мурашину, оцтову, пропіонову, бурштинову, бензойну, камфоросульфонову, лимонну, фумарову, глюконову, ізетіонову, молочну, яблучну, муцинову, винну, пара-толуолсульфонову, гліколеву, глюкуронову, малеїнову, фуранкарбонову, глутамінову, антранілову, саліцилову, фенілоцтову, мигдалеву, ембонову (памову), метансульфонову, етансульфонову, пантотенову, 2 UA 113291 C2 5 10 15 20 25 30 35 40 бензолсульфонову, стеаринову, сульфанілову, альгінову і галактуронову кислоти. Переважно сіль є сіллю лимонної кислоти. У різних варіантах здійснення даний винахід стосується метаболітів транс-кломіфену в по суті чистій формі. Метаболіти можна очищати від відповідного джерела або можна отримувати синтетично в чистій та ізольованій формі. Наприклад, метаболіти за винаходом можуть бути ідентифіковані і виділені або відділені від тканин або рідин тіла піддослідної тварини одразу після введення транс-кломіфену. Альтернативно метаболіти за винаходом можуть бути ідентифіковані і виділені з гепатоцитів тварини після інкубації з транс-кломіфеном. В одному з аспектів метаболіт може бути результатом дії ферментів печінки сімейства цитохромів P450 (CYP). Метаболізм пероральних препаратів часто відбувається завдяки дії цих ферментів, які розташовуються в гепатоцитах. Такий пресистемний метаболізм, в якому лікарські засоби проходять через печінку перед їх поширенням в організмі, є потенційним бар'єром для переміщення активних фармацевтичних засобів із шлунково-кишкового тракту в кровотік. CYP-ферменти поділяються на окремі класи і мають аналогічні члени у всіх ссавців. У різних варіантах здійснення даний винахід стосується метаболіту транс-кломіфену, отриманого за допомогою каталізу члена сімейства CYP2 або CYP3. У переважних варіантах здійснення метаболіт отримують переважно за допомогою каталізу CYP2D6 і/або CYP3A4, і/або CYP3A5. В одному з варіантів здійснення даний винахід стосується метаболіту транс-кломіфену, який має хімічну формулу, вибрану з: C26H29NO4; C27H31NO3; C26H30NO3Cl; C32H36NO8Cl; C26H30NO3Cl; C27H30NO3Cl; C32H36NO8Cl; C26H28NO3Cl; C36H43N4O7SCl; C26H30NO3Cl; C36H43N4O7SCl; C27H31NO3; C24H24NO2Cl; C26H28NO2Cl; C27H30NO3Cl; C27H30NO6ClS; C26H28NO3Cl; C26H28NO7Cl; C26H28NO2Cl; C27H30NO3Cl; C24H24NOCl; C26H28NO2Cl; і C24H24NO2Cl. У переважному варіанті здійснення метаболіт транс-кломіфену має хімічну формулу, вибрану з: C26H30NO3C1, C26H28NO2Cl, C27H30NO3Cl і C24H24NOCl. В особливо переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, 4-гідрокси-транс-кломіфену (або 4-OH-транс-кломіфену), отриманого за допомогою каталітичної дії CYP2D6, що має формулу і його фармацевтично прийнятних солей. Цей метаболіт утворений за допомогою 4гідроксилювання в пара-положенні фенільного кільця транс-кломіфену. У переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, 4'-гідрокси-транс-кломіфену (або 4'-OH-транс-кломіфену), отриманого за допомогою каталітичної дії CYP2B6, що має формулу і його фармацевтично прийнятних солей. Цей метаболіт утворюють за допомогою 4'гідроксилювання в пара-положенні фенільного кільця транс-кломіфену. У іншому переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, 3-гідрокси-транс-кломіфену (або 3-OH-транс-кломіфену), отриманого за допомогою каталітичної дії CYP3A4 або CYP3A5, який має формулу 3 UA 113291 C2 5 10 15 20 і його фармацевтично прийнятних солей. В інших особливо переважних варіантах здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену N-дезетил-транс-кломіфену, отриманого за допомогою каталітичної дії CYP3A4 або CYP3A5, який має формулу і його фармацевтично прийнятних солей. Цей метаболіт утворюють за допомогою Nдезалкілування етилової групи з транс-кломіфену. В іншому переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, 3,4-дигідрокси-транс-кломіфену, отриманого за допомогою послідовної каталітичної дії CYP3A4/5 і CYP2D6, який має формулу і його фармацевтично прийнятних солей. У пов'язаному з ним переважному варіанті здійснення метаболіт, отриманий за допомогою послідовної каталітичної дії CYP3A4/5 і CYP2D6, додатково модифікують таким чином, щоб відновити подвійний зв'язок. Таким чином, даний винахід також стосується по суті чистого метаболіту транс-кломіфену, що має формулу В іншому, пов'язаному з ним переважному варіанті здійснення, метаболіт, отриманий за допомогою послідовної каталітичної дії CYP3A4/5 і CYP2D6, є моно-метильованим. Таким чином, даний винахід також стосується по суті чистого метаболіту транс-кломіфену, який має хімічну формулу C27H30NO3Cl. Моно-метильований метаболіт може мати будь-яку одну з наступних структурних формул: 4 UA 113291 C2 В іншому переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, отриманого за допомогою послідовної каталітичної дії CYP3A4/5 і CYP2B6, що має формулу 5 10 15 20 25 і його фармацевтично прийнятних солей. В іншому переважному варіанті здійснення даний винахід стосується по суті чистого метаболіту транс-кломіфену, отриманого за допомогою послідовної каталітичної дії CYP2D6 і CYP2B6, що має формулу і його фармацевтично прийнятних солей. У різних варіантах здійснення даний винахід також стосується фармацевтичних композицій, які містять один або декілька метаболітів транс-кломіфену або їх солей, як описано, і фармацевтично прийнятний носій, який можна використати в способах, описаних в даному документі. У різних варіантах здійснення даний винахід також стосується застосування метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) при лікуванні пацієнта від порушення, чутливого до транс-кломіфену. В одному з варіантів здійснення представлений спосіб підняття рівнів тестостерону, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) пацієнту, який потребує такого лікування. У пов'язаному з ним варіанті здійснення представлений спосіб лікування порушення, пов'язаного з дефіцитом тестостерону, включаючи, як необмежуючі приклади, олігоспермію, азооспермію, виснаження і депресію. Застосування транс-кломіфену для підвищення рівнів тестостерону у ссавця описане в патенті США № 7759360, повний зміст якого включений в даний документ як посилання, зокрема від стовпця 4, рядок 51 до стовпця 6, рядок 5. В одному переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транс-кломіфеном. В іншому 5 UA 113291 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважному варіанті здійснення пацієнт є людиною чоловічої статі з вторинним гіпогонадизмом. У пов'язаному з ним варіанті здійснення представлений спосіб лікування вторинного гіпогонадизму у людини чоловічої статі, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) пацієнту, який потребує такого лікування. У переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транс-кломіфеном. В іншому варіанті здійснення представлений спосіб зниження рівнів холестерину, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) пацієнту, який потребує такого лікування. Застосування транс-кломіфену для зниження рівнів холестерину описане в патенті США № 7368480, повний зміст якого, таким чином, включений як посилання, зокрема від стовпця 4, рядок 66 до стовпця 6, рядок 10. В одному переважному варіанті здійснення метаболіт транскломіфену є 4-OH-транс-кломіфеном. В іншому переважному варіанті здійснення пацієнт є людиною чоловічої статі з вторинним гіпогонадизмом. В іншому варіанті здійснення представлений спосіб лікування і/або запобігання патологічному стану, вибраному з групи, яка складається з доброякісної гіпертрофії передміхурової залози, раку передміхурової залози і підвищених тригліцеридів, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) пацієнту, який потребує такого лікування. Застосування транс-кломіфену для лікування доброякісної гіпертрофії передміхурової залози, раку передміхурової залози і підвищених тригліцеридів описано в публікації патентної заявки США № 2008/0242726, повний зміст якої, таким чином, включений як посилання, зокрема від сторінки 3, параграф [0030] до сторінки 4, параграф [0041]. В одному переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транс-кломіфеном. В іншому переважному варіанті здійснення пацієнт є людиною чоловічої статі з вторинним гіпогонадизмом. В іншому варіанті здійснення представлений спосіб лікування безпліддя у людини чоловічої статі, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) людині чоловічої статі, яка потребує такого лікування. Застосування транс-кломіфену для лікування чоловічого безпліддя описане в публікації патентної заявки США №2009/0215906, повний зміст якої включений як посилання, зокрема від сторінки 2, параграф [0029] до сторінки 3, параграф [0034]. В одному переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транс-кломіфеном. В іншому переважному варіанті здійснення пацієнт є людиною чоловічої статі з вторинним гіпогонадизмом. В іншому варіанті здійснення представлений спосіб запобігання переходу від метаболічного синдрому до діабету 2 типу, який містить введення ефективної кількості метаболіту транскломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) людині чоловічої статі з вторинним гіпогонадизмом. Застосування транс-кломіфену для запобігання переходу від метаболічного синдрому до цукрового діабету 2 типу у такої популяції пацієнтів описане в публікації патентної заявки США № 2009/0099265, повний зміст якої включений в даний документ як посилання, зокрема на сторінці 3, параграф [0040]. У переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транс-кломіфеном. У ще одному варіанті здійснення представлений спосіб зниження рівнів глюкози в крові натщесерце, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) людині чоловічої статі з вторинним гіпогонадизмом. Застосування транс-кломіфену для зниження рівнів глюкози в крові натщесерце в такій популяції пацієнтів описано в параграфі [0041] в публікації патентної заявки США № 2009/0099265. У переважному варіанті здійснення метаболіт транс-кломіфену є 4-OHтранс-кломіфеном. У ще одному варіанті здійснення представлений спосіб лікування цукрового діабету 2 типу, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) людині чоловічої статі з вторинним гіпогонадизмом. Застосування транс-кломіфену для лікування цукрового діабету 2 типу у такої популяції пацієнтів описане в параграфі [0042] публікації патентної заявки США № 2009/0099265. У переважному варіанті здійснення метаболіт транс-кломіфену є 4-OH-транскломіфеном. В іншому варіанті здійснення представлений спосіб лікування жіночого безпліддя, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) жінці, яка потребує такого лікування. 6 UA 113291 C2 5 10 15 20 25 30 35 40 45 50 55 Переважно метаболіт транс-кломіфену вводять як добову дозу на ранній фолікулярній фазі менструального циклу протягом 5 послідовних діб. Наприклад, графік введення міг би включати введення з 5 до 9 діб або з 3 до 7 діб менструального циклу. Переважно пацієнт є жінкою з ановуляторними циклами. В іншому варіанті здійснення представлений спосіб лікування і/або запобігання раку молочної залози, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) жінці, яка потребує такого лікування. Відповідно до цього варіанту здійснення метаболіт транс-кломіфену можна вводити жінці з підвищеним ризиком розвитку раку молочної залози, щоб запобігти розвитку раку молочної залози. Альтернативно, метаболіт транс-кломіфену можна вводити жінці з раком молочної залози для лікування раку молочної залози. Метаболіт транс-кломіфену також можна вводити як ад'ювантну терапію, яка йде за початковим лікуванням за допомогою хірургії, щоб мінімізувати можливість рецидиву. Переважно при введенні в ролі ад'юванта транс-кломіфен вводять протягом періоду, що становить приблизно 5 років. В іншому варіанті здійснення представлений спосіб лікування ендометріального раку (або раку матки), який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) жінці, яка потребує такого лікування. У ще одному варіанті здійснення представлений спосіб лікування раку яєчників, який містить введення ефективної кількості метаболіту транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) жінці, яка потребує такого лікування. У різних варіантах здійснення винахід стосується періодичних процедур введення дози препарату, які застосовуються в способах лікування, що описуються в цьому документі. Під "періодичним введенням" мають на увазі період введення терапевтично ефективної дози метаболіту транс-кломіфену, після якого настає період переривання, після якого настає інший період введення терапевтично ефективної дози і т. д. Період введення терапевтично ефективної дози може містити безперервне дозування, як, наприклад, склад із тривалим вивільненням, або може містити щодобове, щотижневе, щомісячне, або дозування між ними, як, наприклад, одну, дві або більше таблеток на добу, за умови, що інтервал дозування протягом періоду введення коротший, ніж період переривання. Переважна тривалість періоду переривання залежить від концентрації і частоти введення ефективної дози протягом періоду введення і в будь-якому випадку повинна бути вибрана таким чином, щоб бажаний терапевтичний ефект був досягнутий протягом лікувального періоду. Наприклад, там, де метаболіт транс-кломіфену або його солі (або фармацевтичної композиції, яка містить те ж саме) вводять для підвищення рівнів тестостерону, період переривання повинен бути продовжений перед тим, як рівні тестостерону впадуть нижче приблизно 300 нг/дл. Фармацевтичні композиції за даним винаходом можуть містити або складатися головним чином з метаболіту транс-кломіфену за винаходом в дозуванні від приблизно одного мг до приблизно 200 мг (хоч визначення оптимального дозування пов'язане з рівнем звичайного досвіду в даній галузі). Композиція може містити метаболіт транс-кломіфену за винаходом у дозуванні від приблизно 1 мг, 2 мг, 3, мг, 4 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг, 200 мг або між ними. Фармацевтичні композиції можуть містити 100 % мас./мас. метаболіту транс-кломіфену або можуть додатково містити інші активні речовини, які застосовуються при отриманні бажаного терапевтичного ефекту. Там, де фармацевтична композиція містить 100 % мас./мас. метаболіту транс-кломіфену, для досягнення бажаного терапевтичного ефекту можна послідовно або одночасно вводити окремо одну або декілька додаткових активних речовин. Дозування переважно (але не обов'язково) вводять як частину режиму дозування, спланованого для підвищення рівнів тестостерону в сироватці крові, які подібні або відповідають нормальному секреторному профілю загального тестостерону в сироватці крові, описаному на фіг. 1, протягом періоду введення і також переважно протягом періоду переривання. Наприклад, відповідно до фіг. 1 дозування переважної композиції може бути введене в фармацевтичному складі, який підвищить до піка рівні тестостерону в сироватці крові приблизно о 8 ранку. Такі фармацевтичні склади можуть бути в формі складів із тривалим вивільненням, отримані, як описано, наприклад, у патенті США № 6221399, патент Японії 4312522, Meshali et al, Int. J. Phar. 89: 177-181 (1993), Kharenko et al, Intern. Symp. Control Rel. Bioact. Mater. 22:232-233 (1995), WO 95/35093, Dangprasit et al, Drug. Devel. і Incl. Pharm. 21. 7 UA 113291 C2 5 10 15 20 25 30 35 40 45 50 55 60 (20):2323-2337 (1995); патенти США №№ 6143353, 6190591, 6096338, 6129933, 6126969, 6248363 і інших складів із тривалим вивільненням, добре відомих у даній галузі. Терміни "лікувати" або "лікування", як застосовують у даній заявці, відносяться як до терапевтичного лікування, так і до профілактичних або запобіжних засобів, де метою є запобігання або сповільненню (зменшення) небажаної фізіологічної або психологічної зміни або порушення, такої, як симптоми, пов'язані з вторинним гіпогонадизмом. Для цілей за даним винаходом сприятливі або бажані клінічні результати, як необмежуючі приклади, включають пом'якшення симптомів, зменшення тривалості захворювання, стабілізований (тобто такий, що не погіршується) стан захворювання, відстрочку або сповільнення прогресування захворювання, поліпшення стану або тимчасове полегшення стану хвороби і ремісію (часткову або повну), або таку, що визначається, або таку, що не визначається. "Лікування" також може означати пролонговане виживання порівняно з очікуваним виживанням без отримання лікування. Індивідууми, які потребують лікування, включають тих, хто вже знаходиться в патологічному стані або має порушення, а також тих, хто схильний до розвитку патологічного стану або порушення, або тих, у кого патологічний стан або порушення повинен бути відвернений. Придатні фармацевтичні композиції або стандартні лікарські форми можуть бути в формі твердих тіл, таких, як таблетки, або заповнених капсул або рідин, таких, як розчини, суспензії, емульсії, настойки або капсули, заповнені тим же, всі для перорального застосування. Композиції можуть такожбути в формі стерильних ін'єкційних розчинів або емульсій для парентерального (включаючи підшкірне) застосування. Крім того, композиції можуть бути складені для місцевого введення. Наприклад, композицію можна формулювати у вигляді лосьйону, крему, мазі, гелю, піни або трансдермального пластиру. В одному переважному варіанті здійснення композицію формулюють у вигляді гелю (наприклад, водно-спиртового гелю) для трансдермального введення (наприклад, у мошонку). Такі фармацевтичні композиції і їх стандартні лікарські форми можуть містити інгредієнти в загальноприйнятих пропорціях. Хоч пероральне введення є переважним шляхом, композиції за даним винаходом можна вводити будь-яким іншим шляхом введення, включаючи, як необмежуючі приклади, внутрішньовенний, підшкірний, букальний, черезслизовий, інтратекальний, інтрадермальний, інтрацистернальний, внутрішньом'язовий, трансдермальний, інтраперитонеальний, епідуральний, вагінальний, ректальний, інтраназальний, сублінгвальний, внутрішньосуглобовий, інтрацереброспинальний і інтрасиновіальний. Після введення композиції рівні тестостерону в сироватці крові можна вимірювати, як описано вище, і дозування можна змінювати, щоб досягнути достатнього підвищення рівнів тестостерону в сироватці крові, щоб досягнути бажаних фізіологічних результатів, пов'язаних із нормальним тестостероном, як описано вище. Композиції за даним винаходом також можна вводити в складах з швидким вивільненням, складах з уповільненим вивільненням або сумішах складів зі швидким і уповільненим вивільненням, таких, як багатошарова таблетка, що містить щонайменше один шар із швидким вивільненням і щонайменше один шар з уповільненим вивільненням. Всі посилання, описані в цьому документі, повністю включені як посилання. Наступні приклади призначені проілюструвати винахід і не призначені для обмеження обсягу винаходу, як заявлено в прикладеній формулі винаходу. ПРИКЛАД 1 Профіль метаболітів андроксалу® (транс-кломіфену) in vitro Для визначення метаболічного профілю андроксалу® проводили дослідження в кріоконсервованих гепатоцитах із щура Спрага-Доулі, собаки породи бігль, яванської макаки і людини. Печінка є основним місцем метаболізму лікарських засобів, і повний набір ферментів печінки, які метаболізують лікарські засоби (включаючи ферменти печінки сімейства CYP P450), підтримується в інтактній клітині. Ізольовані гепатоцити печінки складають фізіологічно релевантну експериментальну модель для оцінки таких якостей лікарського засобу, пов'язаних із печінкою, як метаболізм. Кріоконсервація гепатоцитів багато в чому підвищує їх придатність для дослідження. Первинні гепатоцити, виділені від декількох донорів кожного виду тварин і п'яти осіб, об'єднали відповідно до видів і кріоконсервували. Гепатоцити розморозили, піддали центрифугуванню в градієнті щільності Перкола для усунення дебрису і підрахували вихід клітин. Життєздатність вимірювали із застосуванням ексклюзії трипанового синього. Гепатоцити розбавляли за допомогою буфера для аналізу CYP (буфер Кребса-Хенселейта) для отримання 6 2х клітинної суспензії 2,0×10 життєздатних клітин/мл. Аліквоти 2х суспензій гепатоцитів (0,5 мл, 8 UA 113291 C2 6 5 10 15 20 25 30 35 40 45 50 55 що містять 1,0×10 клітин) переносили у відповідну ямку для кінцевої щільності 1х щільності 6 клітин 1,0×10 клітин/ямка. Всі інкубації проводили при 37+1 °C, 95 % повітря/5 % CO2, і насиченої вологості в 12-ямкових непокритих культуральних планшетах. Аліквоти дозувальних розчинів 2х Андроксалу® (0,5 мл, що містять 6 і 60 мкМ Андроксалу®) додавали в кожну відповідну ямку до повного остаточного об'єму 1 мл. Культури інкубували протягом 1 і 4 годин. Розмір зразка складав N=2 повтору. Контрольні зразки матриксу включали як джерело супутніх компонентів матриксу для сприяння ідентифікації метаболіту. Рівні об'єми 2х суспензії гепатоцитів і буфера для аналізу CYP без Андроксалу® об'єднували і інкубували протягом 4 годин. Контрольні зразки хімічної деградації були включені для оцінки можливості хімічної деградації Андроксалу® за відсутності клітин. Рівні об'єми 2х дозувального розчину Андроксалу® (6 і 60 мкМ) і буфера CYP об'єднували і інкубували протягом 1 і 4 годин. Метаболічні позитивні контрольні зразки включали для оцінки метаболічної здатності кріоконсервованих гепатоцитів від кожного виду. Рівні об'єми 2х дозувальних розчинів 7етоксикумарину (150 мкМ) і 2х суспензії гепатоцитів об'єднували і інкубували протягом 1 і 4 годин. Інкубації завершували таким чином: метаболічні позитивні контрольні інкубації зупиняли за допомогою додавання рівного об'єму метанолу. Всі інші інкубації завершували шляхом розміщення планшетів на льоду. Вміст кожної ямки ретельно перемішували і розділяли на п'ять кріопробірок. Рівний об'єм органічного розчинника додавали до кожної кріопробірки. Зразки або негайно аналізували, або зберігали в кріопробірках при -70°+1 °C до проведення аналізу. Всі зразки аналізували за допомогою обернено-фазової ВЕРХ. УФ-профіль зразків отримували після рідинної хромато-мас-спектрометрії (LC/MS) із застосуванням масспектрометра Micromass® Q-Tof-2, здатного проводити точні вимірювання маси. Попередню ідентифікацію метаболіту проводили із застосуванням програмного забезпечення Metabolynx®. Метаболічну здатність гепатоцитів від кожного виду оцінювали за допомогою вимірювання складу 7-гідроксикумарину і його кон'югованих похідних, 7-гідроксикумарин глюкуроніду і 7гідроксикумарин сульфату, в метаболічно позитивних контрольних зразках із застосуванням валідованого ВЕРХ біоаналітичного способу. Кріоконсервовані гепатоцити, які застосовуються в дослідженні, вважали метаболічно активними і допустимими для інкубації. Нижче в таблицях 1-4 повідомляються відносні кількості Андроксалу і його метаболітів після 1 і 4 годин інкубацій. За чотирма головними метаболітами Андроксалу® (C26H30NO3Cl (M3), C26H28NO2Cl (M14), C27H30NO3Cl (M15) і C24H24NOCl (M22); див. таблиці 1-4 нижче) спостерігали під час інкубацій з гепатоцитами людини, з гідроксилюванням, деалкілуванням і дегідруванням як основних метаболічних трансформацій, які спостерігаються. Крім того, спостерігали метаболіти C24H24NO2Cl, C26H28NO2Cl, C27H30NO3Cl і C24H24NOCl в інкубаціях з гепатоцитами щура, собаки і мавпи. C26H30NO3Cl спостерігали при інкубаціях гепатоцитів мавпи і собаки при дозі Андроксалу® 30 мМ. При низькій дозі Андроксалу®, порівнянній з рівнями крові, виявленими в клінічних випробуваннях (3 мкМ), переважають гідроксильовані метаболіти (див. таблиці 3 і 4 нижче). Визначили, що 85 % і 91 % всіх відновлених метаболітів були гідроксильованими сполуками через 1 і 4 години інкубації відповідно при низькій дозі (наприклад, C26H28N02C1). При більш високій дозі Андроксалу® (30 мкМ) стає важливим діетилювання, і приблизно половина всіх відновлених метаболітів були діетильованими (2х диметильованими) сполуками (наприклад, C24H24NOCl). Не маючи теоретичного обґрунтування, вважають, що CYP3A4 може мати більш високу константу зв'язування/більш низьку афінність для транс-кломіфену. Альтернативно, більш високі концентрації транс-кломіфену можуть перевантажити місткість системи CYP 2D6 в цих гепатоцитах. CYP 2D6 багато в чому відповідальний за гідроксилювання, і діетилювання проводять головним чином за допомогою CYP 3A4. Ці дані дозволяють припускати, що первинні активні метаболіти транс-кломіфену є 4-OH-транскломіфеном, який отриманий за допомогою каталітичної дії CYP 2D6 і N-дезетил-транскломіфену, який отриманий за допомогою каталітичної дії CYP 3A4. Очікують, що терапевтичне введення цих метаболітів поліпшить стан при порушенні, що описується в цьому документі, в той же час скорочуючи побічні ефекти, які супроводжують введення транс-кломіфену і є результатом індивідуальних дій транс-кломіфену та його метаболічних компонентів, представлених нижче. 9 UA 113291 C2 Таблиця 1 Метаболітний профіль інкубацій, які містять 30 мкМ Андроксалу® протягом 4 годин Сполука C26H28ClNO (Андроксал®) RT m/z Трансформація 27,6 406 Немає Людина Мавпа Cyno Собака Щур породи бігль SD 4012,5 Дехлорування + Н+ 17,7 420 Гідроксилювання + 2х Гідроксилювання Метилювання + 2х C27H31NO3 22,5 418 Гідроксилювання + Дехлорування + Н Відновлення + 2х C26H30NO3Cl 22,7 440 Гідроксилювання Глюк + C32H36NO8Cl 22,8 598 Гідроксилювання Відновлення_2х C26H30NO3Cl 22,95 440 Гідроксилювання Метилювання + 2х C27H30NO3Cl 22,9 452 Гідроксилювання Глюк + C32H36NO8Cl 23,1 598 Гідроксилювання 2х C26H28NO3Cl 23,5 438 Гідроксилювання Кон'югація з SC36H43N4O7SCl 23,5 711 глютатіоном Відновлення + 2х C26H30NO3Cl 24,0 440 Гідроксилювання Кон'югація з SC36H43N4O7SCl 24,2 711 глютатіоном Метилювання + 2х C27H31NO3 24,3 418 Гідроксилювання+ Дехлорування + Н Гідроксилювання + C24H24NO2Cl 24,7 394 Діетилювання C26H28NO2Cl 25,0 422 Гідроксилювання Метилювання + 2х C27H30NO3Cl 25,1 452 Гідроксилювання Метилювання + 2х C27H30NO6ClS 25,5 532 Гідроксилювання + Кон'югація з сульфатом C26H28NO3Cl 25,5 438 2х гідроксилювання C26H28NO7Cl 25,6 502 3×2х гідроксилювання C26H28NO2Cl 25,8 422 Гідроксилювання Метилювання + 2х C27H30NO3Cl 25,9 452 гідроксилювання 2х деметилювання C24H24NOCl 27,5 378 (деетилювання) C26H28NO2Cl 28,0 422 Гідроксилювання Гідроксилювання + C24H24NO2Cl 29,06 394 деетилювання C26H29NO4 2828,5 4989,3 3123,3 130,2 20,3 26,6 438,2 125,9 64,7 65,9 16,6 29,5 43,7 15,8 22,4 18,1 30,8 86,2 117,1 15,9 66,8 53,1 13,6 28 37,5 530,7 335,6 113,1 188,9747,4 724,4 1999,3 1432,8 140,7 93,9 310,1 905,3 152,8 68,0 53,9 44,8 63,2 82,4 64,2 30,5 70,7 24,7 10,3 97,4 1262,4 2175,0 723,5 673,8 174,6 59,1 Скорочення: RТ, час утримання; Cyno., яванська макака; SD, Спраг-Доулі; m/z, маса/заряд 10 UA 113291 C2 Таблиця 2 Метаболітний профіль інкубацій, які містять 30 мМ Андроксалу® протягом 1 години Сполука C26H28ClNO (Андроксал®) RT Трансформація m/z Собака породи Щур SD бігль Людина 4297,8 27,6 406 Немає Метилювання + 2х 22,5 418 Гідроксилювання + Дехлорування + Н Відновлення + 2х C26H30NO3Cl 22,7 440 Гідроксилювання C26H28NO3Cl 23,5 438 2х гідроксилювання Відновлення + 2х C26H30NO3Cl 24,0 440 Гідроксилювання Метилювання + 2х C27H31NO3 24,3 418 Гідроксилювання + Дехлорування + Н Гідроксилювання + C24H24NO2Cl 24,7 394 Деетилювання C26H28NO2Cl 25,0 422 Гідроксилювання Метилювання + 2х C27H30NO3Cl 25,1 452 Гідроксилювання Метилювання + 2х C27H30NO6ClS 25,5 532 Гідроксилювання+ Кон'югація з сульфатом C26H28NO3Cl 25,5 438 2х гідроксилювання C26H28NO7Cl 25,6 502 3×2х гідроксилювання C26H28NO2Cl 25,8 422 Гідроксилювання Метилювання + 2х C27H30NO3Cl 25,9 452 гідроксилювання 2х деметилювання C24H24NOCl 27,5 378 (деетилювання) Гідроксилювання + C24H24NO2Cl 29,06 394 деетилювання C27H31NO3 Мавпа Cyno 3166,4 6227,3 3166,8 18,1 19,3 346,1 56,1 43,3 117,3 70,0 39,8 32,9 44,9 30,0 28,9 420,3 22,0 54,0 36,7 45,2 538,8 455,5 1535,2 992,7 36,4 22,6 199,7 445,8 24,9 25,4 27,9 102,2 20,8 16,2 41,7 699,8 1029,8 336,6 10,5 Скорочення: RT, час утримання; Cyno., яванська макака; SD, Спраг-Доулі; m/z, маса/заряд Таблиця 3 Метаболітний профіль інкубацій, який містить 3 мкМ Андроксалу® протягом 4 годин Сполука RT C26H28ClNO (Андроксал®) 27,6 406 Немає C26H30NO3Cl 22,7 440 C26H28NO3Cl 23,5 438 C24H24NO2Cl 24,7 394 C26H28NO2Cl 25,0 422 C27H30NO3Cl 25,1 452 C27H30NO3Cl 25,5 452 C27H30NO6ClS 25,5 532 C24H24NOCl 378 27,5 Відновлення + 2х Гідроксилювання 2х Гідроксилювання Гідроксилювання + Деетилювання Гідроксилювання Метилювання + 2х Гідроксилювання Метилювання + 2х Гідроксилювання Метилювання + 2х Гідроксилювання Кон'югація з сульфатом 2х деметилювання (деетилювання) Людина Мавпа Cyno 285,4 Трансформація m/z Собака Щур SD породи бігль 84,2 103,2 182,5 49,3 27,9 29,4 14,3 247,0 43,4 103,4 31,1 148,4 41,5 256,1 134,5 15,7 27,5 43,4 18,6 Скорочення: RT, час утримання; Cyno., яванська макака; SD, Спрага-Доулі; m/z, маса/заряд 11 UA 113291 C2 Таблиця 4 Метаболітний профіль інкубацій, який містить 3 мкМ Андроксалу® протягом 1 години Сполука RT C26H28ClNO (Андроксал®) 27,6 C26H29NO4 17,7 C27H31NO3 22,5 C26H30NO3Cl 22,7 C26H28NO3Cl 23,5 C27H31NO3 24,3 C24H24NO2Cl 24,7 C26H28NO2Cl 25,0 C27H30NO3Cl 25,1 C27H30NO3Cl 25,4 C27H30NO3Cl 25,9 C24H24NOCl 27,5 m/z Собака породи бігль Щур SD 279,1 148,9 240,0 36,7 24,2 24,5 52,5 27,1 13,6 12,2 240,3 239,4 218,8 100,9 34,9 107,4 232,9 255,8 12,2 16,2 48,3 Дехлорування + Н+ 420 Гідроксилювання +2х Гідроксилювання Метилювання +2х 418 Гідроксилювання + Дехлорування + Н Відновлення + 2х 440 Гідроксилювання 438 2х Гідроксилювання Метилювання + 2х 418 Гідроксилювання + Дехлорування + Н Гідроксилювання + 394 Деетилювання 422 Гідроксилювання Метилювання + 2х 452 Гідроксилювання Метилювання + 2х 452 Гідроксилювання Метилювання + 2х 452 Гідроксилювання 2х Деметилювання 378 (Деетилювання) Мавпа Cyno 406 Немає Людина 625,8 Трансформація 22,3 25,9 Скорочення: RT, час утримання; Cyno., яванська макака; SD, Спраг-Доулі; m/z, маса/заряд 5 ФОРМУЛА ВИНАХОДУ 1. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і метаболіт транскломіфену, що має структурну формулу, яка вибрана з групи, що складається з: 12 UA 113291 C2 HO Cl H3C H3C Cl H3 C N O H3 C HO N O ; ; OH OH HO HO Cl Cl H3C H3C H3C N H3C O N + CH3 O ; ; H3C H3C OH O O HO Cl Cl H3C H3C H3C N H3C O N O ; OH HO Cl H3C H3C 5 N O i або його фармацевтично прийнятну сіль, де вказана сполука має чистоту більше ніж 95 % на основі вимірювання за допомогою високоефективної рідинної хроматографії (ВЕРХ). 13 UA 113291 C2 5 10 2. Фармацевтична композиція за п. 1 для застосування при лікуванні діабету 2 типу, вторинного гіпогонадизму або пов'язаного з ним порушення у пацієнта чоловічої статі, що потребує цього, що вибраний із зниження м'язової маси, зниження щільності кістки, зниження лібідо, олігоспермії і азооспермії, де композиція містить сполуку в ефективній кількості. 3. Фармацевтична композиція за п. 2, де композицію вводять пацієнтові один раз в інтервалі від 3 до 30 діб, і де рівень тестостерону в сироватці крові, що становить щонайменше 300 нг/дл, підтримують протягом вказаного інтервалу. 4. Фармацевтична композиція за п. 1 для лікування раку молочної залози, ендометріального раку, раку матки, раку яєчників або безпліддя у людини жіночої статі, де фармацевтична композиції містить сполуку в ефективній кількості. 5. Фармацевтична композиція за будь-яким з пп. 1-4, в якій сіль сполуки є сіллю лимонної кислоти. 6. Сполука, що має формулу OH Cl Cl H3C H3C 15 N O H3 C NH O або , або її фармацевтично прийнятна сіль для лікування безпліддя у людини жіночої статі або вторинного гіпогонадизму у людини чоловічої статі шляхом введення ефективної кількості сполуки або її фармацевтично прийнятної солі пацієнту жіночої або чоловічої статі. 20 14 UA 113291 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюTrans-clomiphene metabolites and uses thereof
Автори англійськоюPodolski, Joseph, S., Wiehle, Ronald, D.
Автори російськоюПодольски Джозэф С., Виле Роналд Д.
МПК / Мітки
МПК: A61K 31/138, C07C 217/18
Мітки: метаболіти, транскломіфену, застосування
Код посилання
<a href="https://ua.patents.su/17-113291-metaboliti-transklomifenu-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Метаболіти транскломіфену і їх застосування</a>