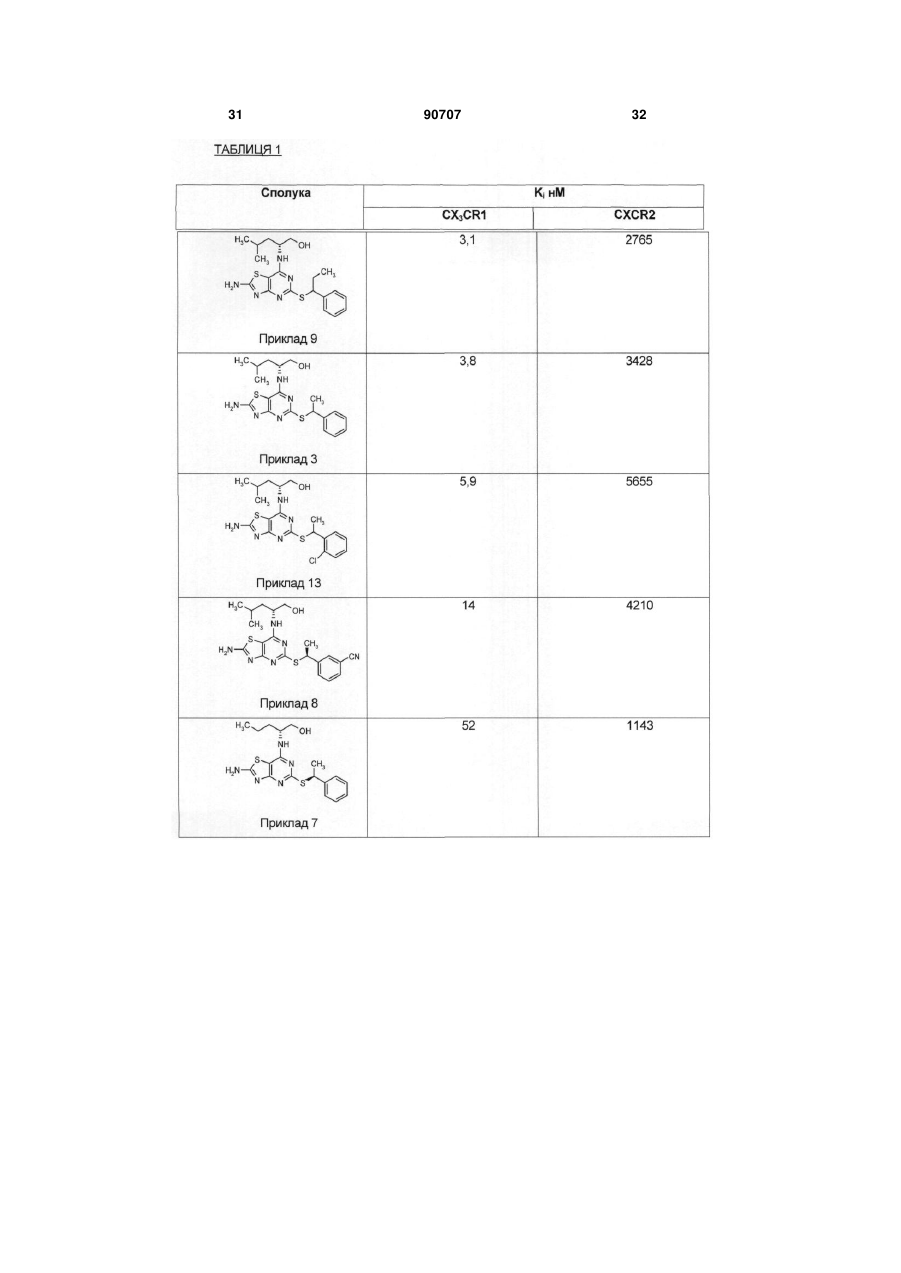
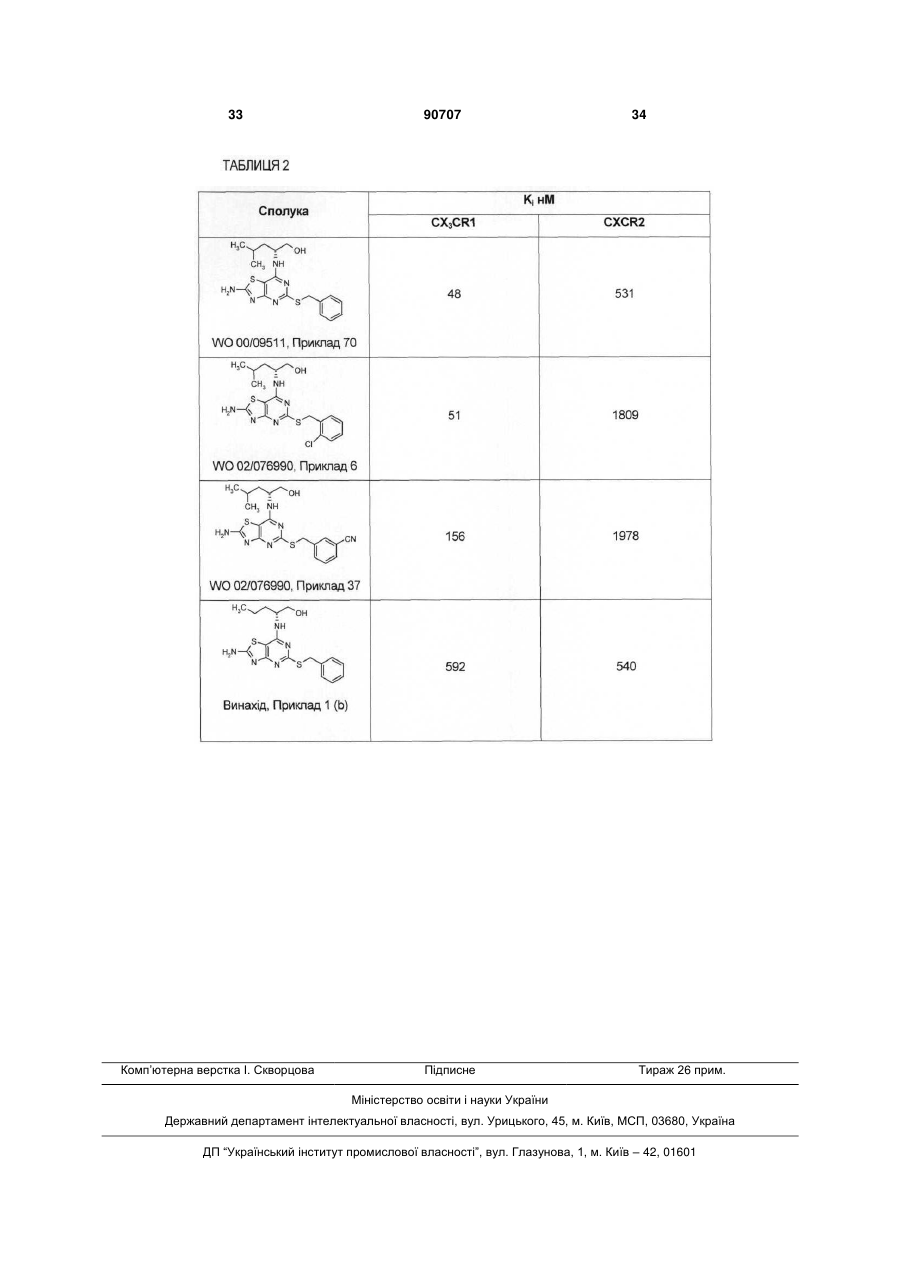
5-заміщені похідні 7-аміно-[1,3]тіазоло[4,5-d]піримідину
Номер патенту: 90707
Опубліковано: 25.05.2010
Автори: Рей Колін, Рейн Тобіас, Нордвалль Ґуннар, Сон Деніел
Формула / Реферат
1. Сполука формули (І)
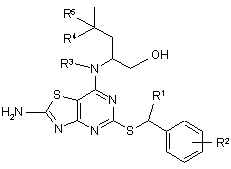 , (I)
, (I)
де R1 означає CH3 або СН3СН2;
R2 означає Н, 2-F, 2-Сl, 3-F, 3-OCH3, 3-CN, 3-CF3, 3-CONH2 або 3-SO2CH3;
R3 означає Н або СН3;
R4 означає Н або СН3; і
R5 означає Н;
або, коли R4 означає CH3, R5 означає Н або F;
і її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що R3 означає Н.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що R1 означає СН3.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що R2 означає Н, 2-F або 3-CN.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R4 означає Н.
6. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R4 означає СН3.
7. Сполука за п. 6, яка відрізняється тим, що R5 означає F.
8. Сполука за п. 6, яка відрізняється тим, що R5 означає Н.
9. Сполука за п. 1, яка відрізняється тим, що R1 означає СН3; R2 означає Н, 2-F або 3-CN; R3 означає Н; R4 означає Н або СН3 і R5 означає Н.
10. Сполука формули (І) за п. 1, яка відрізняється тим, що вибрана з таких сполук:
(2R)-2-[(2-аміно-5-{[(1S)-1-(2-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]пентан-1-ол;
(2R)-2-[(2-аміно-5-{[(1S)-1-(2-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
(2R)-2-({2-амiно-5-[(1-фенiлетил)тiо][1,3]тiазоло[4,5-d]пiримідин-7іл}аміно)-4-метилпентан-1-ол;
(2R)-2-[(2-aміно-5-{[(1R)-1-фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
3-{(1S)-1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)бутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5-іл)тіо]етил}бензонітрил;
(2R)-2-{[2-аміно-5-({(1S)-1-[3-(метилсульфоніл)феніл]етил}тіо)[1,3]тіазоло[4,5-d]піримідин-7-іл]аміно}-4-метилпентан-1-ол;
(2R)-2-[(2-аміно-5-{[(1S)-1-фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]пентан-1-ол;
3-{(1S)-1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)-3-метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5-іл)тіо]етил}бензонітрил;
(2R)-2-({2-аміно-5-[(1-фенілпропіл)тіо][1,3]тіазоло[4,5-фіримідин-7-іл}аміно)-4-метилпентан-1-ол;
3-{1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)-3-метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5-іл)тіо]етил}бензамід;
(2R)-2-{[2-аміно-5-({1-[3-(трифлуорметил)феніл]етил}тіо)[1,3]тіазоло[4,5-d]піримідин-7-іл]аміно}-4-метилпентан-1-ол;
(2R)-2-[{2-аміно-5-[(1-фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7-іл}(метил)аміно]-4-метилпентан-1-ол;
(2R)-2-[(2-аміно-5-{[1-(2-хлорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
(2R)-2-[(2-аміно-5-{[1-(3-метоксифеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
(2R)-2-[(2-aміно-5-{[(1S)-1-фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
(2R)-2-[(2-aміно-5-{[(1S)-1-фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-флуор-4-метилпентан-1-ол;
(2R)-2-[(2-аміно-5-{[(1S)-1-(2-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-флуор-4-метилпентан-1-ол;
(2R)-2-[(2-аміно-5-{[(1S)-1-(3-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4-метилпентан-1-ол;
або їх фармацевтично прийнятних солей.
11. Сполука формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль, призначена для застосування як медикаменту.
12. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятну сіль з домішкою фармацевтично прийнятного розріджувача або носія.
13. Застосування сполуки формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики у людини хвороб або станів, при яких сприятливим є антагонізм до рецептора CX3CR1.
14. Застосування сполуки формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики нейродегенеративних розладів, демієлінізаційної хвороби, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій, ревматоїдного артриту, пульмонарних хвороб, наприклад, COPD, астми або болю.
15. Застосування сполуки формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики множинного склерозу.
16. Застосування сполуки формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу.
17. Застосування сполуки формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 90707 4 (2R)-2-{[2-аміно-5-({1-[3(трифлуорметил)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно}-4-метилпентан-1-ол; (2R)-2-[{2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}(метил)аміно]-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[1-(2хлорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[1-(3метоксифеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-ол; (2R)-2-[(2-aміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол; (2R)-2-[(2-aміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-флуор-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-флуор-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1-(3флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-ол; або їх фармацевтично прийнятних солей. 11. Сполука формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль, призначена для застосування як медикаменту. 12. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-10 або її фармацевтично прийнятну сіль з домішкою фармацевтично прийнятного розріджувача або носія. 13. Застосування сполуки формули (І) за будьяким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики у людини хвороб або станів, при яких сприятливим є антагонізм до рецептора CX3CR1. 14. Застосування сполуки формули (І) за будьяким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики нейродегенеративних розладів, демієлінізаційної хвороби, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій, ревматоїдного артриту, пульмонарних хвороб, наприклад, COPD, астми або болю. 15. Застосування сполуки формули (І) за будьяким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики множинного склерозу. 16. Застосування сполуки формули (І) за будьяким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу. 17. Застосування сполуки формули (І) за будьяким з пп. 1-10 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок. Винахід стосується нових 5-заміщених похідних 7-аміно-[1,3]тіазоло[4,5-d]піримідину, способів їх приготування, фармацевтичних рецептур, що містять їх, і їх застосування у терапії. Хемокіни грають важливу роль в імунних і запальних реакціях у різних хворобах і розладах, включаючи астму, атеросклероз і алергічні хвороби, а також аутоімунні патології, наприклад, ревматоїдний артрит і множинний склероз. Ці малі молекули (8-14 кДа) є членами зростаючої надродини і створюються секрецією і характеризуються фрагментом консервації цистеїну. Наразі надродина хемокінів включає чотири групи, що відрізняються структурами, а саме, родини С-Х-С, С-С і СХ3-С і ХС. Родини С-Х-С і С-С мають подібні послідовності і відрізняються одна від одної єдиною амінокислотною вставкою у NH-проксимальній парі цистеїнових залишків. Родина С-Х3-С відрізняється від інших двох родин тим, що має потрійну амінокислотну вставку у NH-проксимальній парі цистеїнових залишків. Члени родини ХС не мають одного з двох цистеїнових залишків. Хемокіни С-Х-С включають декілька потужних хамоатрактантів і активаторів нейтрофілів, наприклад, інтерлейкін-8 (IL-8) і активуючий нейтрофільний пептид 2 (NAP-2). Хемокіни С-С включають потужні хемоатрактанти моноцитів, лімфоцитів і нейтрофілів. Приклади включають хемотактичні протеїни моноциту людини 1-3 (МСР-1, МСР-2 і МСР-3), RANTES (Регульовані після активації, нормальні експресовані Т-коітинами і створені секрецією), еотаксин і макрофагові запальні протеїни 1а і 1β (ΜΙΡ-1α і ΜΙΡ1β). Хемокіни С-Х3-С (відомі також як фракталкіни) є потужними хемоатрактантами і активаторами мікрогліїу ЦНС, а також моноцитів, Т-клітин, NKклітин і мас-Т-клітин. Дослідження показали, що дія хемокінів опосередковується субродинами приєднаних Gпротеїнами рецепторів, серед яких є рецептори, позначені CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 і CCR11 (для родини С-С); CXCR1, CXCR2, CXCR3, CXCR4 і CXCR5 (для родини С-Х-С) і CX3CR1 (для родини С-Х3-С). Ці рецептори є важливим об'єктом при розробці ліків, оскільки агенти, що модулюють ці рецептори, можуть бути корисними у лікуванні згаданих вище розладів і хвороб. У WO 00/09511 описано деякі 2-заміщені похідні 4-аміно-тіазолопіримідину, які можуть бути використані як антагоністи рецепторів, приєднаних до хемокінних родин С-С і С-Х-С, зокрема, як антагоністи рецептора CX3CR2. Винахід стосується групи сполук, що частково входять в об'єм WO 00/09511, але мають тип структури, не описаний конкретно там. У порівнянні з Прикладами, наведеними у WO 00/09511, сполуки 5 винаходу мають незвичайно корисні якості як антагоністи рецептора CX3CR1. Винахід стосується сполук формули (І) де: R1 означає СН3 або СН3СН2; R2 означає Н, 2-F, 2-СІ, 3-F, 3-OCH3, 3-CN, 3CF3, 3-CONH2 або 3-SO2CH3; R3 означає Η або СН3; R4 означає Η або СН3; and R5 означає Н; або, коли R4 є СН3, R5 означає Η або F; і їх фармацевтично прийнятних солей. Сполуки формули (І) можуть існувати у стереоізомерній і/або таутомерній формах. Всі енантіомери, діастереомери, рацемати, таутомери і їх суміші входять в об'єм винаходу. В одному з втілень, R1 означає СН3. В іншому втіленні R1 означає СН3СН2. В одному з втілень, R2 означає Н, 2-F, 3-F, 22 СІ, 3-ОСН3, 3-CN або 3-CF3. В іншому втіленні R означає Н, 2-F або 3-CN. В іншому втіленні R2 означає Н. В іншому втіленні, R2 означає 2-F. В іншому втіленні R2 означає 3-CN. В одному з втілень R3 означає Н. В одному з втілень R4 означає СН3. В іншому втіленні R4 означає Н. В одному з втілень R5 означає Н. В одному з втілень R4 означає СН3 і R5 означає F. В одному з втілень R4 означає СН3І R5 означає Н. В одному з втілень R1 означає СН3; R2 означає Н, 2-F, 3-F, 2-СІ, 3-ОСН3, 3-CN або 3-CF3; R3 означає Н; R4 означає Η або СН3; і R5 означає Н. В іншому втіленні R1 означає СН3; R2 означає Н, 2-F або 3-CN; R3 означає Н; R4 означає Η або СН3; і R5 означає Н. В іншому втіленні R1 означає СН3; R2 означає Н, 2-F або 3-CN; R3 означає Н; R4 означає Н; і R5 означає Н. В іншому втіленні R1 означає СН3; R2 означає Н, 2-F або 3-CN; R3 означає Н; R4 означає СН3; і R5 означає Η або F. В іншому втіленні, R1 означає СН3; R2 означає Н; R3 означає Н; R4 означає СН3; і R5 означає Н. Зокрема, сполуки формули (І) включають: (2R)-2-[(2-аміно-5-{[(1S)-1 -(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]пентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1 -ол; 90707 6 (2R)-2-({2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}аміно)-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1R)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол; 3-{(1S)-1-[(2-аміно-7-{[(1R)-1(гідроксиметил)бутил]аміно}[1,3]тіазоло[4,5d]піримідин-5-іл)тіо]етил}бензонітрил; (2R)-2-{[2-аміно-5-({(1S)-1-[3(метилсульфоніл)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно}-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]пентан-1-ол; 3-{(1S)-1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)-3метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5іл)тіо]етил}бензонітрил; (2R)-2-({2-аміно-5-[(1фенілпропіл)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}аміно)-4-метилпентан-1-ол; 3-{1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)-3метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5іл)тіо]етил}бензамід; (2R)-2-{[2-аміно-5-({1-[3(трифлуорметил)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно}-4-метилпентан-1 -ол; (2R)-2-[{2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}(метил)аміно]-4-метилпентан-1 -ол; (2R)-2-[(2-аміно-5-{[1-(2хлорфеніл)етил]тіо}[1,3]тіазоло[4,5-с(1піримідин-7іл)аміно]-4-метил пентан-1 -ол; (2R)-2-[(2-аміно-5-{[1-(3метоксифеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1 -ол; (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-флуор-4-метилпентан-1 -ол; (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-флуор-4-метилпентан-1-ол; (2R)-2-[(2-аміно-5-{[(1S)-1-(3флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1 -ол; і їх фармацевтично прийнятні солі. Порівняно з сполуками, описаними у WO 00/09511, сполуки винаходу відрізняються наявністю розгалуженої тіобензильної групи у позиції 5 тіазолопіримідинової кільцевої системи, тобто сполуки винаходу мають групу R1, яка не є гідрогеном. Винахід включає також спосіб приготування сполуки формули (І) або її фармацевтично прийнятної солі, який включає: a) введення сполуки формули (II): 7 де R3, R4 і R5 є такими, що були визначені у формулі (І), у реакцію з сполукою формули (III): де R1 і R2 є такими, що були визначені у формулі (І), a L1 означає відщеплювану групу, або b) введення сполуки формули (IV) де R1 і R2 є такими, що були визначені у формулі (І), a L2 означає відщеплювану групу, у реакцію з сполукою формули (V) де R3, R4 і R5 є такими, що були визначені у формулі (І); і, якщо необхідно, перетворення отриманої сполуки формули (І) або її солі у її фармацевтично прийнятну сіль; або перетворення отриманої сполуки формули (І) в іншу сполуку формули (І); і, за бажання, перетворення отриманої сполуки формули (І) в її оптичний ізомер. В операції (а) реагенти (II) і (III) з'єднуються у придатному для цього органічному розчиннику, наприклад, диметилсульфоксиді (ДМСО), ацетонітрилі або 1-метил-2-піролідиноні (NMP). Реакцію бажано проводити у присутності додаткової органічної або неорганічної основи, наприклад, тріетиламіну, Ν,Ν-діізопропілетиламіну (ДІПЕА) або гідриду натрію. Реакцію бажано проводити у присутності слабого відновлювального агента, наприклад, боргід-риду натрію, при належній температурі, звичайно, від кімнатною до точки кипіння розчинника. Реакція звичайно триває приблизно від 1 год. до 1 тижня або доки аналіз не покаже повне утворення бажаного продукту. В операції (b), реагенти (IV) і (V) з'єднуються у придатному для цього органічному розчиннику, наприклад, ТГФ, ацетонітрилі, ДМСО або 1-метил 90707 8 2-піролідиноні. Реакцію бажано проводити з доданням основи, якою може бути органічна основа, наприклад, тріетиламін або Ν,Νдіізопропілетиламін, або неорганічна основа, наприклад, карбонат калію, при належній температурі, звичайно, від кімнатної до точки кипіння розчинника, хоча припустимими є і вищі температури, якщо реакцію проводять у герметичній реакційній посудині. Реакція звичайно триває приблизно від 1 год. до 1 тижня або доки аналіз не покаже повне утворення бажаного продукту. Придатною відщеплюваною групою L1, L2 є галоген, зокрема, хлор або бром. В одному з втілень, L1 і L2 кожна репрезентують хлор. Фахівцю зрозуміло, що в описаних вище операціях може бути бажаним або необхідним захистити амінову, гідроксильну або іншу важливу реактивну групу. Захисні групи і операції з введення і видалення таких груп описано, наприклад, у "Protective Groups in Organic Synthesis", 3rd EdiTion (1999), Greene and Wuts. Винахід включає сполуки формули (І) у формі солей. Придатні солі включають солі органічних або неорганічних кислот, або органічних або неорганічних основ. Звичайно такі солі є фармацевтично прийнятними, хоча солі фармацевтично неприйнятних кислот або основ можуть використовуватись у приготуванні і очищенні сполук. Солі сполуки формули (І) можуть бути приготовлені реакцією вільної сполуки або її солі, енантіомеру або рацемату з одним або більше еквівалентами відповідної кислоти або основи. Реакцію можна проводити у розчиннику або середовищі, в яких ця сіль є нерозчинною, або у розчиннику, в якому сіль є розчинною, наприклад, воді, діоксані, етанолі, ТГФ або діетилетері або у суміш розчинників, які можуть бути видалені in vacuo або сушінням виморожуванням. Реакція може бути обмінною або може бути проведена на іонообмінній смолі. Сполуки формули (II) є відомими з WO 00/09511 або можуть бути приготовлені відомими методами. Сполуки формули (IV) можуть бути приготовлені методами, подібними описаним у WO 00/09511, або іншими відомими методами. Сполуки формул (III) і (V) є у продажу або є відомими з літератури, або можуть бути приготовлені відомими методами. Придатні конкретні методи приготування сполук формули (II), (III), (IV) і (V) розглядаються у Прикладах і є конкретними втіленнями способів згідно з винаходом. Наприклад, сполуки формули (II) і, отже, формули (І), можуть бути приготовлені згідно з Схемою 1: Схема 1 9 90707 10 Проміжні сполуки можуть бути використані як такі або у захищеній формі. Придатні захисні групи і операції з введення і видалення таких груп є відомими (див., наприклад, "Protective Groups in Organic Synthesis", 3rd Еdітіоn (1999), Greene and Wuts. Сполуки винаходу і інтермедіати для них можуть бути ізольовані з реакціцної суміші і, якщо потрібно, очищені з використанням стандартних процедур. Сполуки формули (І) можуть існувати у стереоізомерних формах. Всі енантіомери, діастере омери, рацемати і їх суміші входять в об'єм винаходу. Різні оптичні ізомери можуть бути ізольовані сепарацією стереоізомерної суміші сполук за відомими процедурами, наприклад, фракційною кристалізацією або ВЕРХ. В іншому варіанті різні оптичні ізомери можуть бути приготовлені безпосередньо з оптично активних вихідних матеріалів. Сполуки формули (І) мають два стереогенні центри і тому можуть існувати у чотирьох дискретних стереоізомерних формах (формули (la) - (Id)) Всі ці стереоізомери і їх суміші входять в об'єм винаходу. В одному з втілень сполуки формули (І) мають стереохімію, ілюстровану формулою (Іа). В іншому втіленні сполуки формули (І) мають стереохімію, ілюстровану формулою (Іb). Проміжні сполуки також можуть існувати у стереоізомерних формах і можуть бути використані як очищені енантіомери, діастереомери, рацемати або їх суміші. 11 Сполуки формули (І) і їх фармацевтично прийнятні солі є корисними, оскільки мають фармакологічну активність як антагоністи рецептора CX3CR1. Зокрема, порівняно з сполуками описаними у WO 00/09511, сполуки формули (І) згідно з винаходом мають значно вищу активність як інгібітори рецептора CX3CR1 і/або меншу здатність пригнічувати рецептор CXCR2. Бажані сполуки винаходу виявляють краще пригнічення CX3CR1 і менше пригнічення CXCR2. В одному з аспектів винахід включає сполуку формули (І) або її фармацевтично прийнятну сіль, призначені для використання як медикамент. В іншому аспекті винахід включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики хвороб або станів в яких сприятливим є антагонізм до рецептора CX3CR1. В іншому аспекті винахід включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики нейро-дегенеративних розладів, демієлінизаційних хвороб, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій, ревматоїдного артриту, пульмонар-них хвороб, наприклад, COPD, астми або болю. В іншому аспекті винахід включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики множинного склерозу (MS). В іншому аспекті винахід включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок. В іншому аспекті винахід включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування або профілактики атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу. Винахід включає також спосіб лікування або зниження ризику хвороб або станів, в яких сприятливим є антагонізм до рецептора CX3CR1, який включає введення особі, що страждає або знаходиться у стані ризику зазначеної хвороби або стану, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Винахід також включає спосіб лікування або зниження ризику нейродегенеративних розладів, демієлінизаційної хвороби, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій, ревматоїдного артриту, пульмонарних хвороб, наприклад, COPD, астми або болю, який включає введення особі, що страждає або знаходиться у стані ризику зазначеної хвороби або стану, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. 90707 12 Винахід, крім того, включає спосіб лікування або зниження ризику множинного склерозу (MS), який включає введення особі, що страждає або знаходиться у стані ризику зазначеної хвороби або стану, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Крім того, винахід включає спосіб лікування, або зниження ризику атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок, який включає введення особі, що страждає або знаходиться у стані ризику зазначеної хвороби або стану, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Винахід також включає спосіб лікування, або зниження ризику атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу, який включає введення особі, що страждає або знаходиться у стані ризику зазначеної хвороби або стану, терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. В іншому аспекті винахід включає фармацевтичну рецептуру, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі з доміш-ком фармацевтично прийнятного ад'юванту, розріджувача або носія і призначена для лікування або профілактики хвороб або станів, в якиз сприятливим є антагонізм до рецептора CX3CR1. В іншому аспекті винахід включає фармацевтичну рецептуру, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі з доміш-ком фармацевтично прийнятного ад'юванту, розріджувача або носія і призначена для лікування або профілактики нейродегенеративних розладів, демієлінизаційної хвороби, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій, ревматоїдного артрит, COPD, астми або болю. В іншому аспекті винахід включає фармацевтичну рецептуру, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі з доміш-ком фармацевтично прийнятного ад'юванту, розріджувача або носія і призначена для лікування або профілактики множинного склерозу. В іншому аспекті винахід включає фармацевтичну рецептуру, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі з доміш-ком фармацевтично прийнятного ад'юванту, розріджувача або носія і призначена для лікування або профілактики атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок. В іншому аспекті винахід включає фармацевтичну рецептуру, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі з доміш-ком 13 фармацевтично прийнятного ад'юванту, розріджувача або носія і призначена для лікування або профілактики атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу. Сполуки формули (І) і їх фармацевтично прийнятні солі показані у лікуванні або профілактиці хвороб або станів, в яких бажаною є модуляція активності рецептора CX3CR1. Зокрема, сполуки бажано використовувати у лікуванні нейродегенеративних розладів або демієлінизаційної хвороби у ссавців, включаючи людину. Сполуки винаходу особливо бажано використовувати у лікуванні множинного склерозу, а також болю, ревматоїдного артриту, остеоартриту, кардіо- і цереброваскулярних атеросклеротичних розладів, хвороби периферійних артерій і пульмонарної артеріальної гіпертонії. Станами, які можуть бути окремо відзначені, є: нейродегенеративні хвороби і слабоумство, наприклад, хвороба Альцгеймера, аміотропічний латеральний склероз і інші моторні нейронні хвороби, хвороба Кройцфельдта-Якоба і інші пріонні хвороби, ВІЛ-енцефалопатія, хорея Хантингтона, лобно-скронева деменція, тілесна деменція Леві і вас-кулярна деменція; полінейропатії, наприклад, синдром Плена-Барра, хронічна запальна демієлінизаційна полірадикулонейропатія, мультифокальна моторна нейропатія і плексо-патії; демієлінація ЦНС, наприклад, гострий розсіяний/геморагічний енцефаломієліт і субгострий склеротичний паненцефаліт; нейром'язові розлади, наприклад, астенічний буль-барний параліч і синдром Ламберта-Ітона; спинальні розлади, наприклад, тропікальний спастичний парапарез і синдром закостенілої людини; паранеопластичні синдроми, наприклад, церебральна дегенерація і енцефаломієліт; травма мозку; мігрень; рак; відторгнення трансплантату; системний склероз; вірусні інфекції; хвороби, що переносяться паразитами, наприклад, малярія; періодонтальні хвороби; інфаркт міокарду; інсульт; коронарна хвороба серця; ішемічна хвороба серця; рестеноз; ревматоїдний артрит; пульмонарна хвороба, наприклад, COPD; астма або біль. Сполуки винаходу також показані у лікуванні атеросклерозу через відвертання і/або зниження утворення нових атеросклеротичних пошкоджень або бляшок, і/або відвертання або уповільнення розвитку існуючих пошкоджень і бляшок. Сполуки винаходу також показані у лікуванні атеросклерозу зміною розташування бляшок для зниження ризику розриву бляшки і виникнення атеротромбозу. Сполуки винаходу показані також у лікуванні запальних кишкових хвороб (IBD), наприклад, хвороби Крона і виразкового коліту, викликанням ремісії і/або підтриманням ремісії IBD. Профілактика є бажаною для осіб, що вже страждали від певного розладу або розглядаються як особи з підвищеним ризиком певної хвороби або стану. Особи з ризиком розвитку певної хвороби або стану звичайно є тими, що мають родинну історію цих хвороби або стану, або тими, в яких 90707 14 генетичне тестування або скринінг показали схильність до певних хвороби або стану. В усіх зазначених терапевтичних показаннях доза введення залежить від сполуки, що використовується, способу введення і бажаного лікування. Взагалі задовільні результати досягаються, коли ці сполуки вводять пацієнту у твердій формі дозою від 1 мг до 2000 мг на день. Сполуки формули (І) і їх фармацевтично прийнятні похідні можна використовувати як такі або у формі відповідних фармацевтичних композицій, які містять сполуку або її похідну з домішком фармацевтично прийнятних ад'юванту, розріджувача або носія. Введення може бути (але без обмеження) ентеральним (включаючи пероральне, під'язичне або ректальне), внутрішньоносовим, внутрішньовенним, топічним або іншим. Звичайні процедури вибору і приготування потрібних фармацевтичних рецептур описано, наприклад, у "Farmaceuticals - Science of Dosage Form Designs", Μ. Ε. Aulton, Churchill Livingstone, 1988. Бажано, щоб фармацевтична композиція містила менше 80%, більш бажано, менше 50% сполуки формули (І) або її фармацевтично прийнятної солі. Забезпечено спосіб приготування фармацевтичної композиції, що містить змішані інгредієнти. Винахід, крім того, стосується комбінованих терапій, в яких сполуку формули (І) або її фармацевтично прийнятну сіль, або фармацевтичну композицію або рецептуру, яка містить сполуку формули (І), вводять одночасно або у певній послідовності з терапією і/або агентом для лікування будь-яких кардіо- і цереброваскулярних атеросклеротичних розладів і хвороб периферійних артерій. Зокрема, сполуку формули (І) або її фармацевтично прийнятну сіль можна вводити у сполученні з однією або декількома такими сполуками: 1) антизапальні агенти, наприклад, a)NSAID (наприклад, ацетилсаліцилова кислота, ібупрофен, напроксен, флурбіпро-фен, диклофенак, індометацин); b) інгібітори синтезу лейкотрієну (інгібітори 5LO, наприклад, АZD4407, Zileuton, лікофелон, інгібітори CJ13610, CJ13454; FLAP, наприклад, BAYY-1015, DG-031, MK591, МК886, А81834; інгібітори гідролази LTA4, наприклад, SC56938, SC57461A); c) антагоністи рецептора лейкотрієну ( наприклад, СР195543, амелубант, LY293111, аколат, МК571); 2) анти-гіпертонічні агенти, наприклад, a) бета-блокери (наприклад, метопролол, атенолол, зоталол); b) інгібітори ензиму перетворення ангіотензину (наприклад, каптоприл, раміприл, хіна-прил, еналаприл); c) блокери каналу кальцію (наприклад, верапаміл, дильтіазем, фелодипін, амлодипін); d) антагоністи рецептора ангіотензину II (наприклад, ірбесартан, кандесартан, телемі-сартан, лосартан); 3) антикоагулянти, наприклад, a) інгібітори тромбіну (наприклад, ксимелагвтран), гепарини, інгібітори фактору Ха; 15 b) інгібітори агрегації тромбоцитів (наприклад, клопідрогрель, тикпопідин, празугель, AZ4160); 4) модулятори ліпідного метаболізму, наприклад, а) інсулінові сенсибілізатори, наприклад, агоністи PPAR (наприклад, піоглітазон, роз-иглітазон, Galida, мурагдітозар, гафемрозил, фенофібрат); b) інгібітори редукгази HMG-CoA, статини (наприклад, симвастатин, правастатин, аторвастатин, розувастатин, флувастатин, пітавастатин); c) інгібітори абсорбції холестеролу (наприклад, езетиміб); d) інгібітори ІВАТ (наприклад, AZD-7806); е)агоністи LXR (наприклад, GW-683965A, Т0901317); f) модулятори рецептора FXR; g) інгібітори фосфоліпази; 5) анти-стенокардійні агенти, наприклад, нітрати і нітрити; 6) модулятори оксилативного стресу, наприклад, антиоксиданти (пробукол), інгібітори мієлопереоксидази. Винахід ілюструється наведеними далі (не обмежуючими) прикладами: Загальні методи Всі розчинники мають аналітичну якість; для реакцій звичайно використовуються комерційні безводні розчинники. Реакції звичайно проводять в інертній атмосфері нітрогену або аргону. Спектри 1Н і 13С ЯМР реєструють при 400 МГц для протону і 100 МГц для карбону-13 на Varian Unity+ 400 NMR Spectrometer, обладнаному 5-мм пробником ВВО з Z-градієнтами або на спектрометрі Avance 400 NMR, обладнаному 60-мкл подвійним пробником зворотного потоку з Z-градієнтами, або на спектрометрі Bruker DPX400 NMR, обладнаному 4-ядерним пробником, обладнаним Zградієнтами. Спектри 1Н ЯМР на 600 МГц отримують на спектрометрі Bruker av600 NMR, обладнаному 5-мм пробною головкою з Z-градієнтами. 1 Спектри Н ЯМР на 300 МГц отримують Varian Gemini 300 NMR, обладнаному 5-мм пробною головкою. Якщо не зазначено інше, спектри 1Н і 13С ЯМР реєструють при 400 МГц для протону і 100 МГц для карбону-13. Використовуються такі еталонні сигнали: середня лінія ДМСО-d6 δ 2,50 (1Н), δ 39,51 (13С); середня лінія CD3OD δ 3,31 (1Н) або δ 49,15 (13С); ацетон-d6 2,04 (1Н), 206,5 (13С); і CDCI3 δ 7,26 (1Н), середня лінія CDCI3 δ 77,16 (13С) (якщо не зазначено інше). Енантіомерний надлишок визначають GC на колонці Cyclodex В (ізотермічне елюювання при 100°С). Мас-спектри реєструють на Waters LCMS, що складається з Alliance 2795 (РХ) і одного квадрупольного мас-спектрометра ZQ. Мас-спектрометр обладнано іонним джерелом електророзпилювання (ESI), що працює у режимах позитивних або негативних іонів. Капілярна напруга становить 3 кВ і мас-спектрометр сканують від m/z 100-700 з часом сканування 0,3 або 0,8 сек. Сепарації проводять на колонках Waters X-Terra MS, С8 (3,5 мкм, 50 або 100 мм x 2,1 мм вн. діам.) або колонці ScantecLab АСЕ 3 AQ (100 мм x 2,1 мм вн. діам.). Температура колонки - 40°С. Застосовується лінійний градієнт з використанням нейтраль 90707 16 ної або кислотної мобільної систем, з обробкою органічної фази при 0% -100% протягом 4-5 хвил., витрата потоку - 0,3 мл/хвил. Система нейтральної мобільної фази: ацетонітрил /[10 мМ NH4OAc (водн./МеСN (95:5)], або [10 мМ NH4OAc (водн.)/МеСN (1/9)]/10 мМ NH4OAc (водн.)/ MeCN(9/1)]. Система кислотної мобільної фази: [133 мМ НСООН (водн.)/MeCN (5/95)]/ [8 мМ НСООН (водн.)/МеСN (98/2)]. В іншому варіанті мас-спектри реєструють на GC-MS (GC 6890, 5973N MSD, Agilent Technologies) з колонкою VF-5 MS (вн. діам. 0,25 мм x 30 м, 0,25 мкм (Varian Inc.)). Застосовується лінійний температурний градієнт (40°С - 300°С), 25°С/хвил. МС обладнано іонним джерелом СІ, газ-реагент - метан. МС сканують між m/z 50-500 с швидкістю сканування 3,25 скан./сек. Аналізи ВЕРХ проводять на системі Agilent HP1000, що складається з G1379A Micro Vacuum Degasser, G1312A Binary Pump, G1367A Wellplate autosampler, G1316A Thermostatted Column Compartment і G1315B Diode Array Detector. Колонка: X-Terra MS, Waters, 4,6 x 50 мм, 3,5 мкм. Температура колонки - 40°С, витрата потоку -1,5 мл/хвил. Діо-дно-матричний детектор сканують з 210-300 нм, шаг і ширина піку - 2 нм і 0,05 хвил., відповідно. Лінійний градієнт - від 0% до 100% ацетонітрилу за 4 хвил. Мобільна фаза: ацетонітрил/10 мМ ацетату амонію у 5% ацетонітрилу у MilliQ Water. Типова завершальна процедура після реакції полягає в екстрагуванні продукту розчинником, наприклад, етилацетатом, промиванні водою і сушінні органічної фази над MgSO4 або Na2SO4 і концентрації розчину in vacuo. Тонкошарову хроматографію (ТШХ) виконують на ТШХ-платах Merck (Silica gel 60 F254) і для розгляду плям застосовують УФ. Флеш-хроматографію проводять на Combi Flash® Companion™ з нормально-фазовими флеш-колонками RediSep™ або на Merck Silica gel 60 (0,040-0,063 мм). Типовими розчинниками для флеш-хроматографії є суміші хлороформ/метанол, толуол/етилацетат і етилацетат/гексани. Препаративну хроматографію проводять на аутопрепаративній Gilson HPLC з діодноматричним детектором. Колонка: XTerra MS С8, 19 x 300 мм, 7 мкм. Градієнт - ацетоніт-рил/0,1М ацетату амонію у 5% ацетонітрилі у MilliQ Water, від 20% до 60% ацетонітрилу за 13 хвил. Потік: 20 мл/хвил. В іншому варіанті очищення проводять на напів препаративній Shimadzu LC-8A HPLC з Shimadzu SPD-10A УФ-візуал- детектором, обладнаним колонкою Waters Symmetry® (C18, 5 мм, 100 мм x 19 мм). Градієнт - ацетонітрил/0,1% трифлуороцто-вої кислоти у MilliQ Water, від 35% до 60% ацетонітрилу за 20 хвил. Потік: 10 мл/хвил. Рекристалізацію звичайно проводять розчинниках або сумішах розчинників, наприклад, етері, етилацетат/гептанах і метанол/воді. Абревіатури: ДХМ = дихлорметан; DIPCI = хлордіізопінокамфенілборан (DIP-Хлорид™); ДІПЕА = N,N-діізопропілетиламін; ДМФ = N,Nдиметилформамід; ДМСО = диме-тилсульфоксид; NCS = N-хлорсукцинімід; NMP = 1-метил-2 17 піролідинон; ТГФ = тетрагідро-фуран; aq = водн.; соnc = концентрований. Вихідні матеріали є у продажу або можуть бути приготовлені за процедурами, відомими з літератури, а експериментальні дані відповідають оприлюдненим. Далі наведено приклади вихідних матеріалів, що можуть бути приготовлені: (1S)-1-(2-флуорфеніл)етанол: Garrett, С. Е. Tetrahedron: Asymmetry 2002, 13, 1347-1349; Doucet, H. Chem. Eur. J. 1999, 5, 1320-1330; (R)-N-метиллейцинол: Aitali, M.; Allaoud, S.; Karim, Α.; Meliet, C; Mortreux, A. Tetrahedron: Asymmetry 2000, 11, 1367-1374; (2R)-2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5d]піримідин-7-іл)аміно]-4-метилпентан-1-ол: WO 02/076990; 5-(бензилтіо)-7-хлор[1,3]тіазоло[4,5d]піримідин-2-амін: WO 00/09511; 3-(1-гідроксиетил)бензамід: Watson, С.Υ; Whish, W.J.D; Threadgill, M.D. Bioorg. Med. Chem. 1998 6(6) 721-34; 1-[3-(метилсульфоніл)феніл]етанон: Т. Fujita, J. Iwasa і С. Hansch, Journal of Амернаn Chemical Society 1964, 86, 5175-5180; (1-хлорпропіл)бензол: Desai, V. R.; Nechvatal, Α.; Tedder, J. M. J. Chem. Soc. (B) 1969, 30-32; 3-[(1S)-1-гідроксиетил]бензонітрил: Belley, M. Bioorg. Med. Chem., 1999, 7, 2697-2704; 1-(3-метоксифеніл)етанол: Handa, S. J. Chem. Soc. Perkin Trans. 11995, 1623-1633; (2R)-2-аміно-4-флуор-4-метилпентан-1-ол: Truong, V.L; Gauthier, J.Y; Boyd, M; Roy, B; Scheigetz, J. Synlett 2005, 8, 1279-1280; за процедурою для S- енантіомеру: (1S)-1-(3-флуорфеніл)етанол: Pastor, I. M. Chem. Eur. J. 2003, 9, 4031-4045. Загальний метод А Боргідрид натрію (0,1 еквів.), ДІПЕА (1,5 еквів.) і сполуку загальної формул (III) (1,2 ек-вів.) додають до сполуки загальної формули (II) (1,0 еквів.) у ДМСО в атмосфері нітрогену. Отриману реакційну суміш перемішують при 40°С до завершення реакції (згідно з моніторингом РХ-МС, ВЕРХ або ТШХ). Суміш вливають у лід-воду і продукт екстрагують ДХМ або ЕtOАс. Об'єднані органічні фази сушать і концентрують in vacuo. Сирий продукт, якщо необхідно, очищають препаративною ВЕРХ або колонною флеш-хроматографією. Загальний метод В B1 (1,0 еквів.) у ТГФ додають при 0°С до (+)DIPCI (для отримання В2) або (-)-DIPCI (для отримання В3) (1,5 еквів.) у ТГФ в атмосфері аргону. Реакційну суміш залишають повільно досягти кімнатної температури протягом ночі. Розчинник випарюють і потім додають Et2O і діетаноламін (2,2 еквів.). Суміш перемішують до завершення реакції 90707 18 (згідно з моніторингом РХ-МС, ВЕРХ або ТШХ). Осад відфільтровують, промивають Et2O і фільтрат концентрують in vacuo. Сирий продукт, якщо необхідно, очищають препаративною ВЕРХ або колонною флеш-хроматографією. Загальним метод С Трифенілфосфін (1,3 еквів.) у ТГФ додають при 0°С до NCS (1,3 еквів.) у ТГФ в атмосфері аргону. Отриману суміш перемішують при зовнішній температур 30 хвил. Додають С1 або С2 (1 еквів.) при 0°С і реакційну суміш перемішують при зовнішній температурі до завершення реакції (згідно з моніторингом РХ-МС, ВЕРХ або ТШХ). Розчинник випарюють, потім додають гексан і видаляють осад фільтрацією. Фільтрат концентрують in vacuo і сирий продукт, якщо необхідно, очищають препаративною ВЕРХ або колонною флешхроматографією. Приклад 1 (2R)-2-[(2-аміно-5-{[(1 S)-1 -(2флуорфеніл)етил]тіо)[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]пентан-1 -ол а) 1-[(1S)-1-хлоретил]-2-флуорбензол Названу сполуку отримують з 65%-м виходом і з 93%-м енантіомерним надлишком, згідно з загальним методом С з (1S)-1-(2-флуорфеніл)етанолу (3,56 г, 25 ммоль). 1 Н ЯМР (CDCI3) δ 7,53 (td, 1Н), 7,28 (m, 1H), 7,16 (m, 1H), 7,04 (m, 1H), 5,42 (q, 1H), 1,84 (d, 3Н); MS(ESI+) m/z 158 [M+H]+. b) (2R)-2-{[2-аміно-5(бензилтіо)[1,3]тіазоло[4,5-d]піримідин-7іл]аміно}пентан-1-ол 5-(бензилтіо)-7-хлор[1,3]тіазоло[4,5d]піримідин-2-амін (6,0 г, 19,4 ммоль) розчиняють у NMP (30 мл). ДІПЕА (8,4 мл, 48,5 ммоль) і додають 2-аміно-(2R)-1-пентанол (3,5 г, 33,9 ммоль). Суміш нагрівають до 110°С протягом 4 днів. Після охолодження до зовнішньої температури суміш вливають у воду (200 мл). Осад збирають фільтрацією, промивають водою і використовують у наступній операції без очищення (7,0 г, вихід 97%). MS (ESI+) m/z 376 [М+Н]+. c) (2R)-2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5d]піримідин-7-іл)аміно]пентан-1-ол Круглодонну колбу з льодоетанольним конденсатором занурюють у сухольодоетанольну охолоджувальну ванну. У колбі конденсують аміак (250 мл) і додають (2R)-2-{[2-аміно-5(бензилтіо)[1,3]тіазоло[4,5-d]піримідин-7іл]аміно}пентан-1-ол (6,8 г, 18,1 ммоль). Отриману суміш залишають нагрітись до -33°С і невеликими шматочками додають металевий натрій до появи блакитного кольору і продовжують ще 30 сек. Реа 19 кцію гасять доданням ложки твердого хлориду амонію. Аміак випарюють і додають воду (250 мл) до залишку. Отриману суміш нейтралізують 1М НСІ (водн.). Осад збирають фільтрацією, промивають водою і сушать in vacuo, отримуючи 4,15 г (вихід 80%) названої сполуки. MS (ESI+) m/z 286 [М+Н]+. d) (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піридимід7-іл)аміно]пентан-1-ол Названу сполуку отримують з 96%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]пентан-1-олу (703 мг, 2,46 ммоль) і 1[(1R)-1-хлоретил]-2-флуорбензолу (469 мг, 2,96 ммоль). 1 Н ЯМР (ДМСО-СІ6) δ 8,38 (br s, 2H), 7,55 (td, 1H), 7,32 (m, 1H), 7,20 (m, 1H), 7,18 (d, 1H), 5,26 (q, 1Н), 4,19 (br s, 1Н), 3,43 (dd, 5,6 Гц, 1Н), 3,35 (dd, 1Н), 1,69 (d, 3Н), 1,66-1,42 (m, 2H), 1,39-1,21 (m, 2Н), 0,86 (t, 3Н); MS(ESI+) m/z 408 [M+H]+. Приклад 2 (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил1тіо)[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-ол Названу сполуку отримують з 41%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (800 мг, 2,67 ммоль) і 1-[(1R)-1хлоретил]-2-флуорбензолу (509 мг, 3,21 ммоль). 1 Н ЯМР (ДMCO-d6) δ 7,97 (s, 2H), 7,53 (td, 1H), 7,29 (m, 1H), 7,17 (m, 1H), 7,15 (d, 1H), 6,89 (d, 1Н), 5,22 (q, 1Н), 4,61 (t, 1Н), 4,24 (br s, 1Н), 3,38 (dt, 1Н), 3,28 (т, 1Н), 1,65 (d, 3Н), 1,59 (т, 1Н), 1,49-1,32 (т, 2Н), 0,87 (d, 3Н), 0,84 (d, 3Н); MS(ESI+) m/z 422[M+H]+. Приклад 3 (2R)-2-({2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d](1піримідин-7іл}аміно)-4-метилпентан-1 -ол Названу сполуку отримують як суміш двох діастереомерів з 67%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-фіримідин-7-іл)аміно]-4метилпентан-1-олу (320 мг, 1,01 ммоль) і (1брометил)-бензолу (245 мг, 1,21 ммоль). 1 Н ЯМР (ДМСО-d6) δ 7,94 (s, 2Н), 7,16 (m, 2Н), 7,14 (гл, 2Н), 6,97 (m, 1H), 6,77 (d, 1H), 4,74 (т, 1Н), 4,49 (т, 1Н), 4,03 (т, 1Н), 3,87 (т, 2Н), 3,22 (т, 2Н), 1,72 (dd, 1Н), 1,61 (т, 1Н), 1,42 (т, 2Н), 0,87 (d, 3Н), 0,85 (т, 3Н); MS(ESI+) m/z 405[M+H]+. Приклад 4 (2R)-2-[(2-аміно-5-{[(1R)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол Очищення ВЕРХ (2R)-2-({2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}аміно)-4-метилпентан-1-олу (Приклад 3) (500 мг) дає названий одиночний діастереомер (150 мг). 1 Н ЯМР (ДМСО-d6) δ 7,98 (s, 2H), 7,45 (m, 2H), 7,32 (m, 2H), 7,24 (m, 1H), 6,87 (d, 1H), 4,95 (q, 1Н), 4,24 (br s, 1Н), 3,45 (m, 1Н), 3,35 (m, 1Н), 1,68 (d, 90707 20 3Н), 1,62 (т, 1Н), 1,42 (т, 2Н), 0,88 (d, 3Н), 0,82 (d, 3Н); MS(ESI+)m/z405[M+H]+. Приклад 5 3-{(1S)-1-[(2-аміно-7{[(1R)-1(гідроксиметил)бутил]аміно}[1,3]тіазоло[4,5d]піримідин-5-іл)тіо]етил}бензонітрил a) 3-[(1R)-1-хлоретил]бензонітрил Названу сполуку отримують з 79%-м виходом згідно з загальним методом С з 3-[(1S)-1гідроксиетил]бензонітрилу (3,35 г, 22,8 ммоль). 1 Н ЯМР (ДMCO-d6): δ 7,97 (s, 1Н), 7,82 (m, 2Н), 7,60 (t, 1H), 5,40 (q, 1H), 1,80 (d, 3Н); 13 С ЯМР (ДMCO-d6): δ 144,1, 131,2, 131,6, 130,3, 129,9, 118,4, 111,6, 57,41, 25,5; MS (ESI+) m/z 166 [M+H]+. b) 3-{(1S)-1-[(2-аміно-7-{[(1R)-1(гідроксиметил)бутил]аміно}[1,3]тіазоло[4,5d]піримідин-5-іл)тіо]етил}бензонітрил Названу сполуку отримують з 75%-м виходом згідно з загальним методом А з 2-аміно-7-{[(1R)-1(гідроксиметил)бутил]аміно}[1,3]тіазоло[4,5d]піримідин-5(6H)-тіону (2,87 г, 10,0 ммоль) і 3[(1R)-1-хлоретил]бензонітрилу (2,31 г, 13,9 ммоль). 1 Н ЯМР (ДMCO-d6): δ 8,00 (s, 2H), 7,91 (s, 1H), 7,82 (m, 1H), 7,69 (m, 1H), 7,52 (t, 1H), 6,90 (d, 1Н), 5,00 (q, 1Н), 4,63 (t, 1Н), 4,13 (br s, 1Н), 3,41 (m, 1Н), 3,30 (m, 1Н), 1,66 (d, 3Н), 1,57 (m, 1Н), 1,43 (m, 1Н), 1,29 (m, 2Н), 0,86 (t, 3Н); 13 С ЯМР (ДМСО-d6): δ 170,8, 168,7, 165,1, 155,7, 145,9, 132,3, 130,8, 130,6, 129,5, 118,7, 111,2, 63,3, 59,7, 51,8, 42,3, 33,0, 21,8, 18,8, 14,0; MS(ESI+) m/z 415 [M+H]+. Приклад 6 (2R)-2-{[2-аміно-5-({(1S)-1-[3(метилсульфоніл)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно)-4-метилпентан-1-ол a) (1S)-1-[3-(метилсульфоніл)феніл]етанол Названу сполуку приготовляють з 58%-м виходом з 1-[3-(метилсульфоніл)феніл]етанону (2,00 г, 10,1 ммоль) згідно з загальним методом В. MS(ESI+)m/z201 [M+H]+ b) 1-[(1R)1-хлоретил]-3(метилсульсроніл)бензол Названу сполук приготовляють з 21%-м виходом з (1S)-1-[3-(метилсульфоніл)-феніл]етанолу (100 мг, 0,50 ммоль) згідно з загальним методом С. MS(ESI+) m/z 219[M+H]+. c) (2R)-2-{[2-аміно-5-({(1 S)-1 -[3(метилсульфоніл)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно)-4-метилпентан-1-ол Названу сполуку приготовляють з (2R)-2-[(2аміно-5-меркапто[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-олу (16,5 г, 55,3 ммоль) і 1-[(1R)-1-хлоретил]-3-(метилсульфоніл)бензолу (12,1g, 55,3 ммоль) згідно з загальним методом А. 1 Н ЯМР (600 МГц, ДМСО-d6): δ 8,00 (m, 3Н) 7,81 (m, 2H) 7,60 (t, 1H) 6,91 (d, 1H) 5,06 (q, 1Н) 4,66 (t, 1Н) 4,24 (brs, 1Н) 3,38 (m, 1Н) 3,28 (m, 1Н) 3,23 (s, 3Н) 1,69 (d, 3Н) 1,59 (m, 1H) 1,34 -1,46 (m, 2H) 0,86 (m, 6H); MS(ESI+)m/z482[M+H]+. Приклад 7 21 (2R)-2-{[2-аміно-5-({(1 S)-1фенілетил1тіо}][1,3]тіазоло[4,5-d]піримідин-7іл)аміно]пентан-1-ол a) [(1R)-1-хлоретил]бензол Названу сполуку отримують з 67%-м виходом згідно з загальним методом С з (1S)-1фенілетанолу (25 г, 0,20 моль). 1 H ЯМР (CDCI3) δ 7,42 (m, 2Н), 7,36 (m, 2Н), 7,30 (m, 1Н), 5,09 (q, 1Н), 1,85 (d, 3Н); MS (СІ) m/z 141 [M+1]+. b) (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]пентан-1-ол Названу сполуку отримують з 23%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]пентан-1-олу (100 мг, 0,35 ммоль) і [(1R)1-хлоретил]бензол (54 мг, 0,38 ммоль). 1 Н ЯМР (ДМСО-d6) δ 1/млн 7,96 (brs, 1Н), 7,43 (d, 1Н), 7,31 (т, 2Н), 7,22 (т, 1Н), 6,86 (d, 1Н), 4,95 (т, 1Н), 4,64 (t, 1Н), 4,17 (br s, 1Н), 3,44 (т, 1Н), 3,35 (т, 1Н), 1,66 (d, 3Н), 1,58 (т, 1Н), 1,44 (т, 1Н), 1,361,21 (т, 2Н), 0,85 (t, 3Н); MS (ESI+) m/z 390 [М+Н]+. Приклад 8 3-{(1S)-1-[(2-аміно-7-([(1R)-1-(гідроксиметил)-3метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5іл)тіо]етил}бензонітрил Названу сполуку приготовляють з 31%-м виходом з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (200 мг, 0,67 ммоль) і 3-[(1R)-1хлоретил]бензонітрил (166 мг, 1,0 ммоль) згідно з загальним методом А. 1 Н ЯМР (CD3OD) δ 7,89- 7,76 (m, 2Н) 7,57 (d, 1Н) 7,49 (m, 1 Η) 5,12 (q, 1H) 4,42 (brs, 1H) 3,53 (m, 1 Η) 3,44 (m, 1 Η) 1,63 -1,76 (m, 4H) 1,41 -1,60 (m, 2H) 0,96 (t, 6H); MS (ESI+) m/z 429 [M+H]+. Приклад 9 (2R)-2-({2-аміно-5-[(1фенілпропіл)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}аміно)-4-метилпентан-1 -ол Названу сполуку синтезують як суміш двох діастереомерів загальним методом А реакцією (2R)2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-олу (30 мг, 100 мкмоль) з (1-хлорпропіл)бензолом (15,5 мкл, 100 мкмоль), отримуючи 13 мг (з 31%-м виходом) у вигляді масла. 1 Н ЯМР (CD3OD) δ 7,39 (t, 2H) 7,28 (m, 2H) 7,20 (t, 1H) 4,85 (dd, 1H) 4,57 - 4,40 (m, 1Н) 3,62 (m, 1H) 3,59 - 3,48 (m, 1H) 2,25 - 2,11 (m, 1H) 2,01 (m, 1H) 1,79 - 1,65 (m, 1H) 1,63-1,53 (m, 1H) 1,53-1,42 (m, 1H) 1,01-0,87 (m, 9H); MS(ESI+) m/z 418 [M+H]+. Приклад 10 3-{(1R)-1-[(2-аміно-7-{[(1R)-1-(гідроксиметил)-3метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5іл)тіо]етил}бензамід a) 3-(1-хлоретил)бензамід Діетиланілін (390 мкл, 2,45 ммоль) додають до 3-(1-гідроксиетил)бензаміду (400 мг, 2,45 ммоль) суспендованого у ДХМ (20 мл) і реакційну суміш охолоджують у льодяній ванні. Додають краплями 90707 22 тіонілхлорид ((255 мкл, 2,47 ммоль) і реакцію на ніч вносять у холодильник. Додають воду, реакційну суміш екстрагують двічі ДХМ, промивають 10%-м розчином НСІ, нейтралізують насиченим бікарбонатним розчином, обробляють розсолом, сушать (MgSO4), фільтрують і випарюють до сухості. Сирий продукт рекристалізують з діетилетеру/гексану, отримуючи 335 мг (з 75%-м виходом) названої сполуки як білу тверду речовину. 1 Н ЯМР (Хлороформ-d) δ 7,90 (s, 1Н) 7,73 (d, 1Н) 7,62 (d, 1Н) 7,46 (t, 1 Η) 5,14 (q, 1H) 1,88 (d, 3H) 1,60(s,2H); MS (ESI+) m/z 183, 185 [M+H]+. b) 3-{(1R)-1-[(2-аміно-7-{[(1R)-1(гідроксиметил)-3метилбутил]аміно}[1,3]тіазоло[4,5-d]піримідин-5іл)тіо]етил}бензамід Названу сполуку синтезують як суміш двох діастереомерів загальним методом А реакцією (2R)2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-олу (30 мг, 100 мкмоль) з 3-(1-хлоретил)бензамідом (20 мг, 100 мкмоль). Розділення суміші препаративною ВЕРХ дає єдиний діастереомер (6 мг, з 13%-м виходом) у вигляді масла. 1 Н ЯМР (CD3OD) δ 7,99 (s, 1Н) 7,73 (d, 1Н) 7,69 (d, 1Н) 7,41 (t, 1 Η) 5,15 (q, 1H) 4,43 -4,52 (m, 1 Η) 3,54 (m, 1 Η) 3,47 (m, 1 Η) 1,74 (d, 3Н) 1,70 (m, 1 Η) 1,59 -1,42 (m, 2H) 0,96 (t, 6H); MS(ESI+)m/z 447 [M+H]+. Приклад 11 (2R)-2-{[2-аміно-5-({1-[3(трифлуорметил)феніл]етил}тіо)[1,3]тіазоло[4,5d]піримідин-7-іл]аміно}-4-метил пентан-1 -ол Названу сполуку синтезують як суміш двох діастереомерів загальним методом А реакцією (2R)2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан-1-олу (30 мг, 0,1 ммоль) з 3-(1-брометил)трифлуорметилбензолом (15,5 мкл, 0,1 ммоль), отримуючи 38 мг (з 81%-м виходом) у вигляді масла. 1 Н ЯМР (600 МГц, CD3OD) δ 7,81 - 7,71 (m, 2H) 7,57 - 7,44 (m, 2H) 5,16 (q, 1H) 4,43 (s, 0,5Н) 4,31 (s, 0,5Н) 3,59 (m, 1H) 3,55 - 3,40 (m, 1H) 1,74 (t, ЗН) 1,69 (m, 0,5Н) 1,63 (m, 0,5Н) 1,54 (m, 1H) 1,49 -1,37 (m, 1H) 0,96 (dd, 3Н) 0,86 (dd, 1,5Н); MS (ESI+) m/z 472 [M+H]+. Приклад 12 (2R)-2-[{2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл)(метил)аміно]-4-метилпентан-1-ол a) (2R)-2-[[2-аміно-5(бензилтіо)тіо][1,3]тіазоло[4,5-d]піримідин-7іл)(метил)аміно]-4-метилпентан-1-ол 5-(бензилтіо)-7-хлор[1,3]тіазоло[4,5d]піримідин-2-амін (1,5 г, 4,86 ммоль), ДІПЕА (691 мг, 5,35 ммоль) і (R)-N-метиллейцинол (956 мг, 7,29 ммоль) змішують у NMP (7,5 мл). Отриманий розчин перемішують при 110°С в атмосфері нітрогену 2 дні. Після охолодження до кімнатної температури реакційну суміш вливають у лід. Отриманий жовтий осад збирають фільтрацією, промивають водою і сушать in vacuo. Сирий продукт очищають колонною флеш-хроматографією на кремнеземі (ДХМ:ЕtOАс 50:50 до 0:100), отри 23 муючи 1,42 г (з 72%-м виходом) названої сполуки як жовтої твердої речовини. 1 Н ЯМР (ДMCO-d6) δ 7,97 (br s, 2H), 7,40 (m, 2H), 7,28 (m, 2H), 7,21 (m, 1H), 4,73 (dd, 1Н), 4,64 (br s, 1H), 4,32 (br s, 2H), 3,52-3,37 (m, 2H), 3,00 (s, 3H), 1,55-1,35 (m, 2H), 1,27 (m, 1H), 0,88 (d,3H), 0,80 (d,3H); MS(ESI+) m/z 404 [M+H]+. b) (2R)-2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5d]піримідин-7-іл)(метил)аміно]-4-метилпентан- 1ол Тригорлу круглодонну колбу занурюють у сухольодоетанольну охолоджувальну ванну і обладнують сухольодоетанольним конденсатором. Систему продувають нітрогеном і у колбі конденсують аміак (приблизно 50 мл). Додають (2R)-2-[[2-аміно5-(бензилтіо)[1,3]тіазоло[4,5-d]піримідин-7іл](метил)аміно]-4-метилпентан-1-ол (1 г, 2,5 ммоль) і отримують прозорий жовтий розчин. По одному додають невеликі шматки металевого натрію (розміром 2-3 мм). Після появи стійкого блакитного кольору (>20 сек.) додають ложку твердого NH4CI для гасіння реакції. Аміак випарюють, додають воду (50 мл) і суміш нейтралізують 1Μ НСІ (водн.) до рН 7. Жовтий твердий осад збирають фільтрацією, промивають водою і сушать in vacuo, отримуючи 630 мг названої сполук (з 80%-м виходом). 1 Н ЯМР (ДMCO-d6) δ 12,78 (brs, 1H), 8,43 (br s, 2H), 4,84 (br, 2H), 3,52-3,38 (m, 2H), 3,01 (s, 3Н), 1,55-1,33 (m, 2H), 1,32-1,20 (m, 1H), 0,87 (m, 6H); + + MS(ESI ) m/z 314[M+H] . c) (2R)-2-[{2-аміно-5-[(1фенілетил)тіо][1,3]тіазоло[4,5-d]піримідин-7іл}(метил)аміно]-4-метилпентан-1 -ол Названу сполук синтезують як суміш двох діастереомерів загальним методом А реакцією (2R)2-[(2-аміно-5-меркапто[1,3]тіазоло[4,5-d]піримідин7-іл)(метил)аміно]-4-метилпентан-1-олу (31,4 мг, 0,1 ммоль) з 1-брометилбензолом (13,5 мкл, 0,1 ммоль), отримуючи 26 мг (з 62%-м виходом). 1 Н ЯМР (ДМСО-d6) δ 7,96 (s, 2Н) 7,43 (t, 2Н) 7,32 (т, 2Н) 7,23 (t, 1Н) 5,02-4,92 (т, 1Н) 4,83 - 4,71 (т, 1Н) 4,64 (s, 1Н) 3,53 - 3,38 (т, 2Н) 3,01 (d, 3Н) 1,68 (dd, ЗН) 1,52 (т, 1Н) 1,43 (т, 1Н) 1,35-1,24 (т, 1Н) 0,88 (d, 3Н) 0,83 (d, 3Н); MS(ESI+) m/z 418[M+H]+. Приклад 13 (2R)-2-[(2-аміно-5-{[1-(2хлорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол a) 1-хлор-2-(1-хлоретил)бензол Тіонілхлорид (1,49 г, 12,6 ммоль) додають до 1-(2-хлорфеніл)етанолу (1,0 г, 6,3 ммоль) у толуолі (50 мл) і суміш залишають перемішуватись при кімнатній температурі на 2 год. Додають до реакційної суміші 10%-й водний розчин НСІ (20 мл), органічні фази відділяють і промивають іншою порцією 10%-го водного розчину НСІ, розсолом (20 мл), потім розділяють, сушать і випарюють, отримуючи 1-хлор-2-(1-хлоретил)бензол з 72%-м виходом. 1 H ЯМР (ДМСО-d6) δ 7,72 (1Н, d), 7,48 (1Н, т), 7,39 (2Н, т), 5,59 (1Н, q), 1,84 (3Н, d). 90707 24 b) (2R)-2-[(2-аміно-5-{[1-(2хлорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол Названу сполуку отримують як суміш двох діастереомерів з 24%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (20 мг, 0,047 ммоль) і 1-хлор-2(1-хлоретил)бензолу (10 мг, 0,057 ммоль). 1 Н ЯМР (ДМСО-d6) δ 7,83 (2Н, т), 7,48 (1Н, d), 7,32 (1Н, т), 7,15 (1Н, т), 7,14 (1Н, т), 6,79 (1Н, d), 5,22 (1Н, гл), 4,13 (1Н, т), 3,29-3,17 (2Н, т), 1,52 (3Н, dd), 1,47 (1Н, т), 1,31 (1Н, т), 1,25 (1Н, т), 0,76 (3Н, dd), 0,73 (3Н, dd); 13 С ЯМР (ДМСО-d6) δ 171,18, 169,14, 165,75, 165,64, 155,97, 140,63, 132,62, 129,91, 129,04, 128,96, 127,94, 64,08, 63,88, 50,59, 24,70, 23,67, 22,33, 22,22, 22,01; MS (ESI+) m/z 438, 440 [M+H]+. Приклад 14 (2R)-2-[(2-аміно-5-{[1-(3метоксифеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно1-4-метилпентан-1 -ол a) 1-(1-хлоретил)-3-метоксибензол Названу сполуку отримують з 59%-м виходом з 1-(3-метоксифеніл)етанолу (0,5 г, 3 ммоль) згідно з методом Прикладу 13 (а). 1 Н ЯМР (CDCI3) δ 7,22 (1Н, m), 6,76 (2Н, m), 6,62 (1Н, dd), 4,81 (1Н, q), 3,57 (ЗН, s), 1,62 (3Н, d). b) (2R)-2-[(2-аміно-5-{[1-(3метоксифеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-метилпентан- 1-ол Названу сполуку отримують як суміш двох діастереомерів з 25%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (20 мг, 0,07 ммоль) і 1-(1хлоретил)-3-метоксибензолу (9,7 мг, 0,06 ммоль). 1 Н ЯМР (ДМСО-d6) δ 7,89 (2Н, s), 7,13 (1Н, т), 6,87 (2Н, т), 6,80 (1Н, т), 6,71 (1Н, т), 4,86 (1Н, т), 4,55 (1Н, brs), 4,17 (1Н, т), 3,64 (3Н, s), 1,51 (3Н, d), 1,48 (1Н, т), 1,31 (2Н, т), 0,76 (6Н, т); MS(ESI+) m/z 434[M+H]+. Приклад 15 (2R)-2-[(2-аміно-5-{[(1 S)-1 – фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-метилпентан-1-ол і) Операція (а) (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно1-4-метилпентан-1-ол Названу сполуку отримують з 42%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (27 г, 90 ммоль) і [(1R)-1хлоретил]бензолу (19 г, 135 ммоль). 1 Н ЯМР (ДМСО-d6) δ 7,95 (br s, 2H), 7,43 (m, 2H), 7,31 (m, 2H), 7,22 (m, 1H), 6,85 (d, 1H), 4,96 (q, 1Н), 4,64 (t, 1 Η), 4,27 (br s, 1H), 3,44 - 3,30 (m, 2H), 1,66 (d, 3Н), 1,59 (m, 1H), 1,41 (m, 2H), 0,87 (d, 3Н), 0,84 (d, 3Н); MS(ESI+) m/z 404 [M+H]+. ii) Операція (b) a) 6-аміно-2-{[(1S)-1-фенілетил]тіо}піримідин-4ол 25 NaH (60% у маслі) (0,5 г, 12,5 ммоль) і потім NaBH4 (40 мг, 1 ммоль) додають до моногідрату 6аміно-2-меркаптопіримідин-4-олу (1,6 г, 10 ммоль) у ДМФ (20 мл). Через 30 хвил. додають [(1R)-1хлоретил]бензол (1,4 г, 10 ммоль) і реакційну суміш перемішують 16 год. Реакцію концентрують in vacuo до об'єму прибл. 10 мл і вливають у воду (прибл. 50 мл). Твердий осад відфільтровують і промивають водою і етером, отримуючи названу сполуку (1,15 г, з 46%-м виходом). 1 Н ЯМР (ДMCO-d6) δ 7,46-7,22 (m, 5H), 6,53 (br s, 2H), 4,99 (q, 1H), 4,92 (s, 1H), 1,67 (d, 3Н). b) 2-аміно-5-{[(1 S)-1 – фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин- 7-ол Піридин (0,6 г, 7,6 ммоль) додають до 6-аміно2-{[(1S)-1-фенілетил]тіо}піримідин-4-олу (1 г, 4 ммоль) і KSCN (1,7 г, 16 ммоль) у ДМФ (20 мл). Реакційну суміш охолоджують до 0°С і однією порцією додають бром (0,65 г, 4,0 ммоль). Реакційну суміш через 2 год. вливають у воду і оранжевий осад відфільтровують і промивають водою. Тверду речовину суспендують у суміші ДМФ (6 мл) і води (2 мл) і нагрівають до 110°С. Через 30 год. реакційну суміш вливають у воду, жовтуватий осад відфільтровують і промивають водою і етером. Тверду речовину сушать у вакуумі при 40 °С, отримуючи названу сполуку (0,8 г, з 65%-м виходом). 1 Н ЯМР(ДМСO d6) 8,16 (br s, 1Н), 7,47-7,24 (т, 5Н), 5,05 (q, 1H), 1,71 (d, 3Н). c) 7-хлор-5-{[(1S)-1фенілетил]тіо}[1,31тіазоло[4,5-d]піримідин-2-амін РОСІ3 (1 мл) додають до ДМФ (1 мл) у діоксані (6 мл). Додають 2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-ол (1 г, 3,3 ммоль) однією порцією. Додають РОСІ3 (1 мл) і реакційну суміш нагрівають до 80°С протягом приблизно 30 хвил. Реакцію охолоджують до кімнатної температури і вливають у лід. Отриману суміш нагрівають під зворотним холодильником протягом приблизно 5 год. Суміш залишають досягти кімнатної температури і екстрагують ЕtOАс. Органічний шар пропускають через шар силікагелю і концентрують до сухості, отримуючи названу сполуку (1 г, з 95%-м виходом). 1 Н ЯМР (ДМСО-d6) δ 8,91 (br s, 2Н), 7,47-7,20 (m, 5Н), 4,95 (q, 1Н), 1,69 (d, 3Н). d) (2R)-2-[(2-аміно-5-{[(1S)1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-метилпентан-1-ол ДІПЕА (400 мг, 3 ммоль) і D-лейцинол (400 мг, 3,4 ммоль) додають до 7-хлор-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-2-аміну (300 мг, 0,9 ммоль) у ΝΜΡ (6 мл) і суміш нагрівають до 120°С протягом 24 год. Суміш вливають у воду і екстрагують етилацетатом. Органічну фазу сушать (MgSO4), випарюють і залишок очищають колонною флеш-хроматографією (ЕtOАс), отримуючи названу сполуку (200 мг, з 54%-м виходом). 1 Н ЯМР (ДМСО-d6) δ 7,95 (brs, 2H), 7,43 (m, 2H), 7,31 (m, 2H), 7,22 (m, 1H), 6,85 (d, 1H), 4,96 (q, 1Н), 4,64 (t, 1Н), 4,27 (br s, 1Н), 3,44 - 3,30 (m, 2Н), 1,66 (d, 3Н), 1,59 (m, 1H), 1,41 (m, 2Н), 0,87 (d, 3Н), 0,84 (d, 3Н); MS(ESI+) m/z 404 [M+H]+. 90707 26 Приклад 16 (2R)-2-[(2-аміно-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-7іл)аміно]-4-флуор-4-метилпентан-1 -ол ДІПЕА (0,83 мл, 4,75 ммоль) додають до розчину 7-хлор-5-{[(1S)-1фенілетил]тіо}[1,3]тіазоло[4,5-d]піримідин-2-аміну (0,49 г, 1,52 ммоль) і (2R)-2-аміно-4-флуор-4метилпентан-1-олу (2 ммоль) у NMP (2 мл) і реакційну суміш перемішують при 120°С протягом 22 год. Очищення ВЕРХ дає названу сполуку (0,22 г, з 17%-м виходом). 1 H ЯМР (400 МГц, CD3OD): δ 7,48 (m, 2H), 7,32 (m, 2H), 7,23 (m, 1H), 5,09 (q, 1H), 4,66 (brs, 1H), 3,61-3,47 (m,2H), 2,12-1,89 (m,2H), 1,75 (d, 3Н), 1,40 (m,6H); MS(ESI+) m/z 422 [M+H]+. Приклад 17 (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-флуор-4-метилпентан-1-ол а) 6-аміно-2-{[(1S)-1-(2флуорфеніл)етил]тіо}піримідин-4-ол NaH (60% у маслі, 1,05 г, 26,3 ммоль) додають порціями і потім NaBH4 (0,099 г, 2,7 ммоль) до моногідрату 6-аміно-2-меркаптопіримідин-4-олу (4,23 г, 26,3 ммоль) у ДМФ (40 мл). Через 30 хвил. додають 1-[(1R)-1-хлоретил]-2-флуорбензол (5,0 г, 31,5 ммоль) у ДМФ (10 мл) і реакційну суміш перемішують 24 год., після чого концентрують і розділяють між водою і ДХМ, органічну фазу сушать (MgSO4) і випарюють. Залишок очищають колонною флеш-хроматографією (ступінчастий градієнт 5-10% МеОН у СНСІ3), отримуючи названу сполуку (5,20 г, 75%-м виходом). 1 Н ЯМР (400 МГц, ДМСО-d6): δ 7,35 (m, 1H), 7,13 (m, 1H), 6,99 (m, 2H), 6,29 (s, 2H), 5,00 (q, 1 Η), 4,76 (br s, 1 Η), 1,49 (d, 3H); MS(ESI+) m/z 266 [M+H]+. b) 2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-ол KSCN (10,76 г, 110,7 ммоль) і піридин (3,9 мл, 49,2 ммоль) додають до 6-аміно-2-{[(1S)-1-(2флуорфеніл)етил]тіо}піримідин-4-ол (6,53 г, 24,6 ммоль) у ДМФ (70 мл). Суміш охолоджують до 0°С і краплями додають Вr2. Через 3,5 год. реакційну суміш вливають у воду і утворений осад збирають фільтрацією. Тверду речовину суспендують у суміші ДМФ (75 мл) і води (15 мл) і нагрівають до 120°С протягом 8 год. Реакційну суміш вливають у воду і тверду речовину збирають фільтрацією і сушать у вакуумі при 40°С, отримуючи названу сполуку (6,42 г, з 81%-м виходом). MS (ESI+) m/z 323 [М+Н]+. c) 7-хлор-5-{[(1S)1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин2-амін РОСІ3 (2,77 мл, 29,7 ммоль) додають до ДМФ (3,07 мл, 39,6 ммоль) у діоксані (30 мл). Через 30 хвил. цю суміш додають до розчину 2-аміно-5-{[(1S)-1-(2-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-7-олу (6,38 г, 19,8 ммоль) у діоксані (100 мл). Через 30 хвил. додають РОСІ3 (2,77 мл, 29,7 ммоль) і реакційну 27 суміш нагрівають до 80°С протягом 2 год. Після охолодження до кімнатної температури обережно додають воду (20 мл) і отриману суміш перемішують при 80°С протягом 30 хвил. і при кімнатній температурі ще 2 год. Реакційну суміш вливають у воду і осад збирають. Тверду речовину очищають колонною флеш-хроматографією (5% МеОН у СНСІ3), отримуючи названу сполуку (5,91 г, з 88%м виходом). 1 Н ЯМР (400 МГц, ДМСО-d6): δ 8,94 (s, 2H), 7,58 (m, 1H), 7,32 (m, 1H), 7,20 (m, 2Н), 5,22 (q, 1H), 1,71 (d,3H); MS (ESI+) m/z 341 [M+H]+. d) (2R)-2-[(2-аміно-5-{[(1S)-1-(2флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно]-4-флуор-4-метилпентан-1-ол ДІПЕА (2,09 мл, 12,0 ммоль) додають до 7хлор-5-{[(1S)-1-(2-флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин-2-аміну (1,36 г, 4,0 ммоль) і (2R)-2-аміно-4-флуор-4-метилпентан-1олу (4 ммоль) у NMP (3 мл). Після перемішування реакційної суміші при 120°С протягом 22 год. її вливають у воду і осад збирають фільтрацією. Тверду речовину очищають колонною флешхроматографією (ступінчастий градієнт 5%-10% МеОН у СНСІ3) і препаративною ВЕРХ, отримуючи названу сполуку (0,22 г, з 13%-м виходом). 1 H ЯМР (400 МГц, CD3OD): δ 7,35 (m, 1H), 7,03 (m, 1H), 6,91 (m, 2H), 5,15 (q, 1H), 4,40 (m, 1 Η), 3,35-3-21 (m, 2H), 1,82-1,72 (m, 2H), 1,50 (d, ЗН), 1,17 (m, 6Η); + + MS(ESI ) m/z 440 [M+H] Приклад 18 (2R)-2-[(2-аміно-5{[(1S)-1-(3флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]1піримідин7-іл)аміно1-4-метилпентан-1 -ол a) 1-[(1R)-1-хлоретил]-3-флуорбензол Названу сполук отримують з 49%-м виходом з 94,5%-м енантіомерним надлишком згідно з загальним методом С з (1S)-1-(3-флуорфеніл)етанолу (4,20 г, 30 ммоль). 1 Н ЯМР (300 МГц, ДМСО-d6) δ 7,47-7,30 (m, 3Н); 7,16 (t, 1Н); 5,36 (q, 1Н); 1,78 (d, 3Н). b)(2R)-2-[(2-аміно-5-{[(1S)-1-(3флуорфеніл)етил]тіо}[1,3]тіазоло[4,5-d]піримідин7-іл)аміно1-4-метилпентан-1-ол Названу сполуку отримують з 61%-м виходом згідно з загальним методом А з (2R)-2-[(2-аміно-5меркапто[1,3]тіазоло[4,5-d]піримідин-7-іл)аміно]-4метилпентан-1-олу (0,30г, 1,0ммоль), 1-[(1R)-1хлоретил]-3-флуорбензолу (0,17 г, 1,1 ммоль) і NaBH4 (0,019 г, 0,5 ммоль). 1 Н ЯМР (400 МГц, CD3OD): δ 7,23 (m, 2H), 7,13 (m, 1H), 6,86 (m, 1H), 5,01 (q, 1H), 4,38 (m, 1H), 3,43 (m, 2H), 1,63 (d, 3Н), 1,44 (m, 2H), 0,88 (m, 6H); MS(ESI+)m/z422[M+H]+ Фармакологічні скринінги Матеріали Рекомбінантний людський фракталкін (hCX3CL1) і рекомбінантний людський інтерлейкін-8 (IL-8 або hCXCL8) від PeproTech Inc., UK. Рекомбінантн [125І]-фракталкін (людський) і [125І] hlL-8 з питомою активністю 2200 імп./ммоль від NEN® Life Science Products, Inc., UK. Fluo4-AM 90707 28 dsl Molecular Probes, US. Всі інші хімікати - аналітичної якості. Клітини Повну людську кДНК CX3CR1 (GenBank № U20350) екстрагують з мРНК мозку людини (Superscript, Life Technologies) і лігують у вектор pCR-Blunt II ТОРО (InVitrogen). Вставку, що відповідає hCX3CR1, ізолюють і додатково субклонують у pCDNA3,1zeo. Приготовляють плазмід ДНК, використовуючи комплект Plasmid Midi Kit (Qiagen). Використовуючи Superfect TransfecTion Reagent (Qiagen) згідно з протоколом виробника експресійний плазмід для hCX3CR1 вводять у суспензію клітинної лінії 293 нирок ембріону людини, яка містить вектор для стабільної експресії хімерного Gпротеїну G qi5. Створюють стабільний клон, використовуючи селекцію зеоцином (500 мкг/мл) і гідроміцином (100 мкг/мл). Для подальшого застосування клітини витримують у модифікованому середовищі/живильній суміші Ham F12 (DMEM/F12) Dulbecco, що містить піроксидин, додають 10% (об'єм/об'єм) сироватки зародка теляти, 2мМ L-глютаміну, 100 од. /мл пеніциліну і 100 мг/мл стрептоміцину, 250 мкг /мл зео-цину і 100 мкг/мл гідроміцину. Клітини, що експресують людський CXCR2, отриманий від AstraZeneca Charnwood культурують у ЕМЕМ з Glutamax і додають 10% FBS (від РАА, Austria), 1% несуттєвихі амінокислот (NEAA), 100 од./мл пеніциліну і 100 мкг /мл стрептоміцину (PEST) і 500 мкг /мл генетицину/G418. Приготування мембран Клітини вирощують при 37°С і 5% СО2 і збирають при 60-80%-й конфлюентності у буфер, що містить 10 мМ Tris-HCI pH 7,4, 5 мМ EDTA, 0,1 мг/мл бацитрацину. Клітини центрифугують при 300 x g протягом 10 хвил. і гранул суспендують у збиральному буфері (10 мМ Tris-HCI, pH 7,4, 5 мМ етилендіамінтетраоцтової кислоти (EDTA) і 0,1 мг/мл бацитрацину), об'єднують і гоиогенізують гомогенізатором Dounce. Гомогенат центрифугують при 48000 χ g протягом 10 хвил. і суспендують у збиральному буфері, використовуючи UltraTurrax T8. Аліквоти мембрани зберігають при 80°С. Концентрацію протеїну визначають у мікротитру-вальних планшетах згідно з Harrington (1990, Anal. Biochem. 186, 285-287). Аналіз на зв'язування рецептора in vitro Порівняльні дослідження зв'язування [125І]фракталкіну проводили у планшетах з 96 2-мл глибокими комірками (Beckman, Germany) у повному об'ємі 1000 мкл /комірка. Кожна комірка містила 10 пкМ [125І]фракталкіну і мембрани у кількості, еквівалентній концентрації рецептора 1 мкМ у аналітичному буфері (50 мМ Hepes-KOH, pH 7,4, 10 мМ МгСІ2, 1 мМ EDTA, 0,1% (маса/об'єм) желатину). Десять концентрацій (2 пунктів на логарифмічну одиницю) тестованих сполук були розчинені у ДМСО і додані для досягнення кінцевої концентрації 1% (об'єм/об'єм) ДМСО. Аналіз ініціювали доданням мембрани і проводили інкубацію при 25 °С протягом 24 год. Реакції припиняли швидкою фільтрацією через скловолоконні фільтри Whatman GF/B оброблені 0,3%-м поліетилімином і подальшим промиванням льодоводяним буфером 29 (10мМ Hepes-KOH pH 7,4, 500 мМ NaCI) з використанням збирача Brandel зв'язаного рецептора. Додавали сцинтиляційний коктейль і радіоактивність визначали рідинним лічильником сцинтиляцій Packard 2500TR (Perkin Elmer, USA) Порівняльні дослідження зв'язування [125l]-hlL8 проводили у синглікатах у 96-коміркових ізопланшетах з прозорим дном при повному об'ємі 200 мкл, причому у кожну комірку вносили 150 пкМ [125l]-hlL-8 (питома активність 2200 імп./ммоль), препарат мембрани-SPA, еквівалентний 20 пкМ рецепторів, і 1,5 мг гранул SPA в аналітичному буфері [50 мМ HEPES-KOH pH 7,4, 10 мМ МгСІ2, 1 мМ EDTA, 0,5% (маса/об'єм) желатину]. Тестсполуки обробляли, як було описано вище. Неспецифічне зв'язування визначали у присутності 500 нМ неміченого hlL-8. У кожному тесті як еталонну сполуку використовували агоніст hlL-8 (крива залежності від концентрації від 3 пкМ до 30 нМ). Пептидна крива не містить ДМСО. Реакціє зв'язування ініціювали доданням 140 мкл препарату мембрани-SPA і зразки інкубу-вали у темріві при кімнатній температурі протягом 4 год. Відлік в аналітичних планшетах здійснювали лічильником сцинтиляцій Wallac MicroBeta® TriLux 1450 від PerkinElmer, USA). Зв'язування [35S]GTP S Зв'язування [35S]GTP S досліджували у мікротитрувальних планшенах з прозорим дном у двох примірниках з 10 концентраціями інгібітору (2 конц. на логарифмічну одиницю) з розрідженням ДМСО (кінцева концентрація 1%) при кімнатній темпера 90707 30 турі. Мембрани, що експресують рецептор hCX3CR1 (кінцева концентрація протеїну 20 мкг/комірка) додавали разом з гранулами SPA (кінцева концентрація 1 мг/well) і все суспендували у буфері зв'язування GTP S (50 мМ Tris-HCI, 100 мМ NaCI, 0,1% желатину, 15 мкг/мл сапоніну і 3 мкМ GDP, рН 7,4 при кімнатній температурі). Мембрани, гранули SPA і ліки заздалегідь інкубували протягом 30 хвилин і потім додавали 310 пкМ фракталкіну для максимальної стимуляції. Базову активність визначали як активність, виявлену без стимуляції фракталкіном (буфері зв'язування GTPyS). Через 30 хвил. реакцію ініціювали доданням [35S]GTP S до кінцевої концентрації 0,1 нМ і кінцевого об'єму аналізу 0,2 мл. Експеримент припиняли через 30 хвил. центрифугуванням при 2000 об./хвил. протягом 2x5 хвил. (у різних напрямках) і радіоактивність визначали рідинним лічильником сцинтиляцій Wallac MicroBeta® TriLux 1450. Результати Дані зв'язування рецептора для вибраних сполук винаходу наведено у табл. 1. Для порівняння табл. 2 містить дані для еталонних сполук. Порівняння даних табл. 1 і 2 показує, що сполуки винаходу, в яких R1 є Me або Et, є більш потужними антагоністами рецептора CX3CR1 і менш потужними антагоністами рецептора CXCR2, ніж відповідні еталонні сполуки, в яких R1 є Н. Така поліпшена селективність антагонізму до рецептора CX3CR1 може бути корисною у терапії. 31 90707 32 33 Комп’ютерна верстка І. Скворцова 90707 Підписне 34 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel 5-substituted 7-amino-[1,3]thiazolo[4,5-d]pyrimidine derivatives
Автори англійськоюNordvall Gunnar, Ray Colin, Rein Tobias, Sohn Daniel
Назва патенту російською5-замещенные производные 7-амино-[1,3]тиазоло[4,5-d]пиримидина
Автори російськоюНордвалл Гуннар, Рей Колин, Рейн Тобиас, Сон Дениэл
МПК / Мітки
МПК: C07D 513/04, A61P 11/06, A61P 9/10, A61P 25/00, A61K 31/519
Мітки: 5-заміщені, 7-аміно-[1,3]тіазоло[4,5-d]піримідину, похідні
Код посилання
<a href="https://ua.patents.su/17-90707-5-zamishheni-pokhidni-7-amino-13tiazolo45-dpirimidinu.html" target="_blank" rel="follow" title="База патентів України">5-заміщені похідні 7-аміно-[1,3]тіазоло[4,5-d]піримідину</a>
Попередній патент: Антагоністи рецептора pgd2 для лікування запальних захворювань
Наступний патент: Таблетки з поліпшеною дисперсністю лікарської речовини
Випадковий патент: Спосіб безперервного виробництва електрозварних холоднодеформованих труб з корозійностійких сталей