Антитіла проти il-17
Номер патенту: 94245
Опубліковано: 26.04.2011
Автори: Ханг Ліха, Аллан Барретт, Лу Цзіжон, Нг Кінгман, Уернер Ендрю Гордон, Лю Лін, Тетро Джонатан Уенделл, Чоу Чі-кінь
Формула / Реферат
1. Гуманізоване моноклональне антитіло проти IL-17, де згадане антитіло зв'язує людський IL-17 з КD, меншою за 7,0 пМ.
2. Антитіло за п. 1, яке додатково має константу швидкості дисоціації або швидкість koff, меншу за 5´10-5 с-1.
3. Антитіло за будь-яким з пп. 1-2, яке специфічно зв'язує нелінійну антигенну детермінанту людського IL-17, яка містить поліпептид з ПОСЛІДОВНІСТЮ № 276.
4. Антитіло за будь-яким із пп. 1-3, яке нейтралізує біологічну активність IL-17 у in vitro аналізі IL-8 "репортерної" групи з ІС50, меншою за 1 нМ.
5. Моноклональне антитіло проти IL-17, яке конкурує за зв'язування з гуманізованим IL-17 з гуманізованим антитілом проти IL-17, яке містить два поліпептиди з амінокислотними послідовностями, представленими ПОСЛІДОВНІСТЮ № 241 і ПОСЛІДОВНІСТЮ № 118.
6. Моноклональне антитіло проти IL-17 за п. 5, яке містить два поліпептиди з амінокислотними послідовностями ПОСЛІДОВНІСТЬ № 241 і ПОСЛІДОВНІСТЬ № 118.
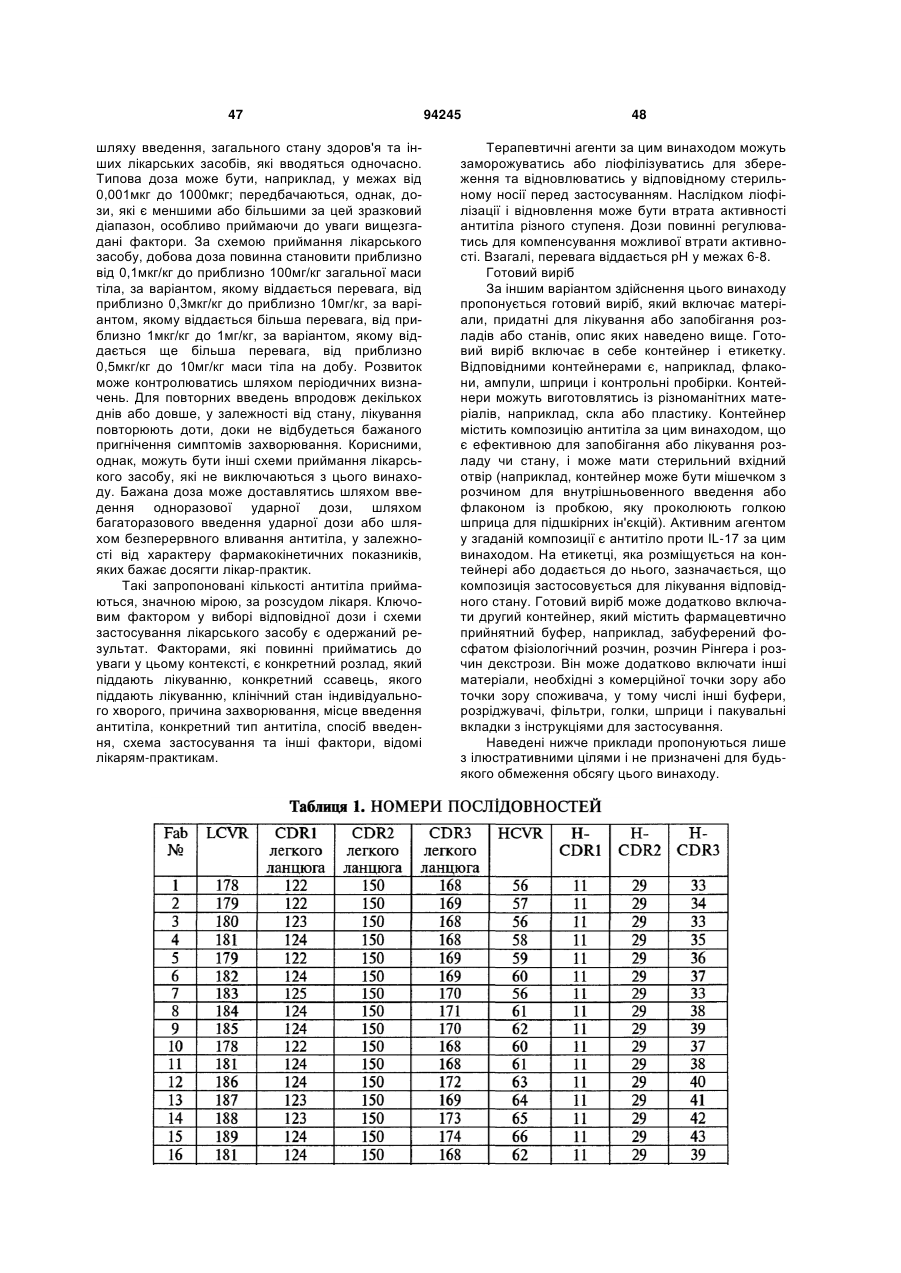
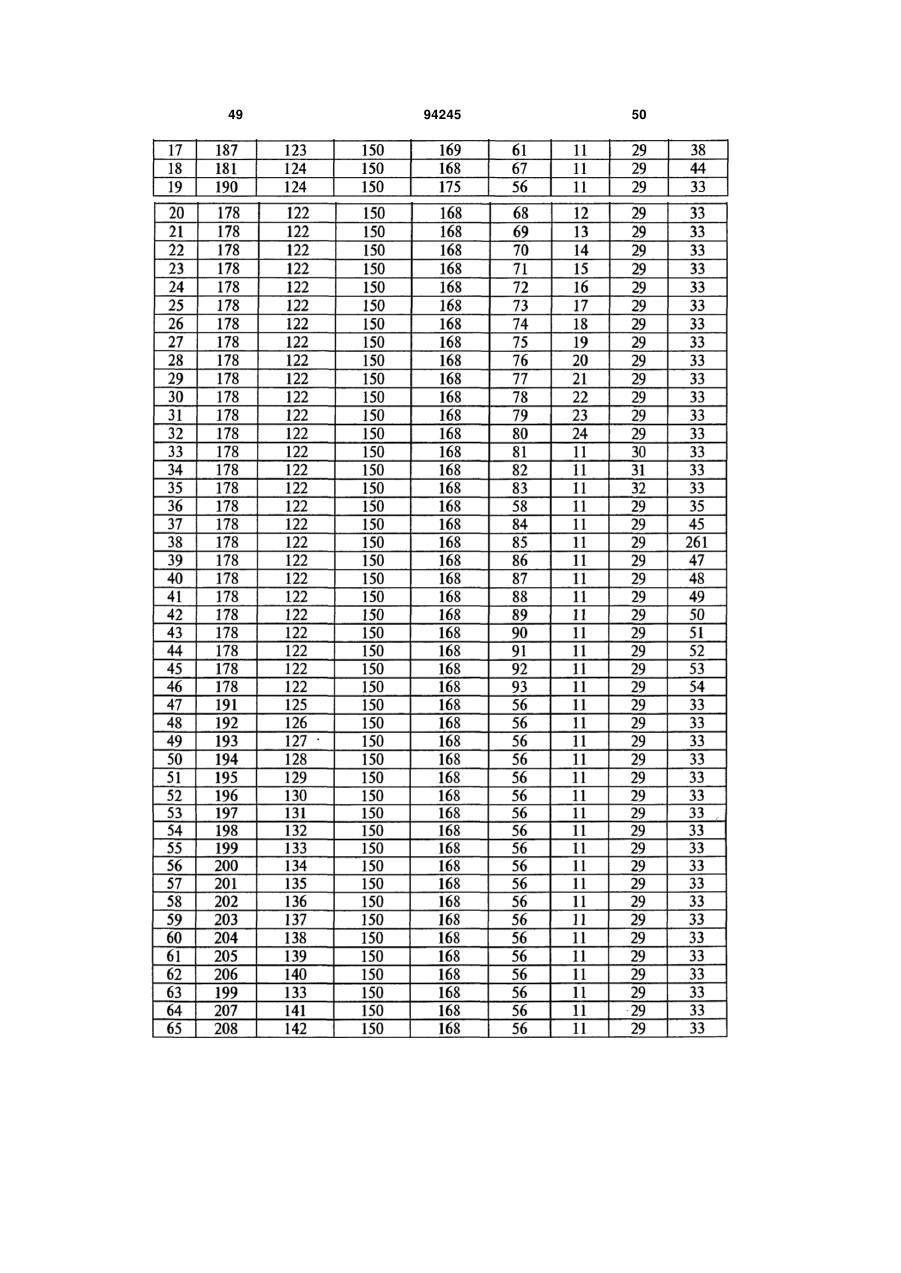
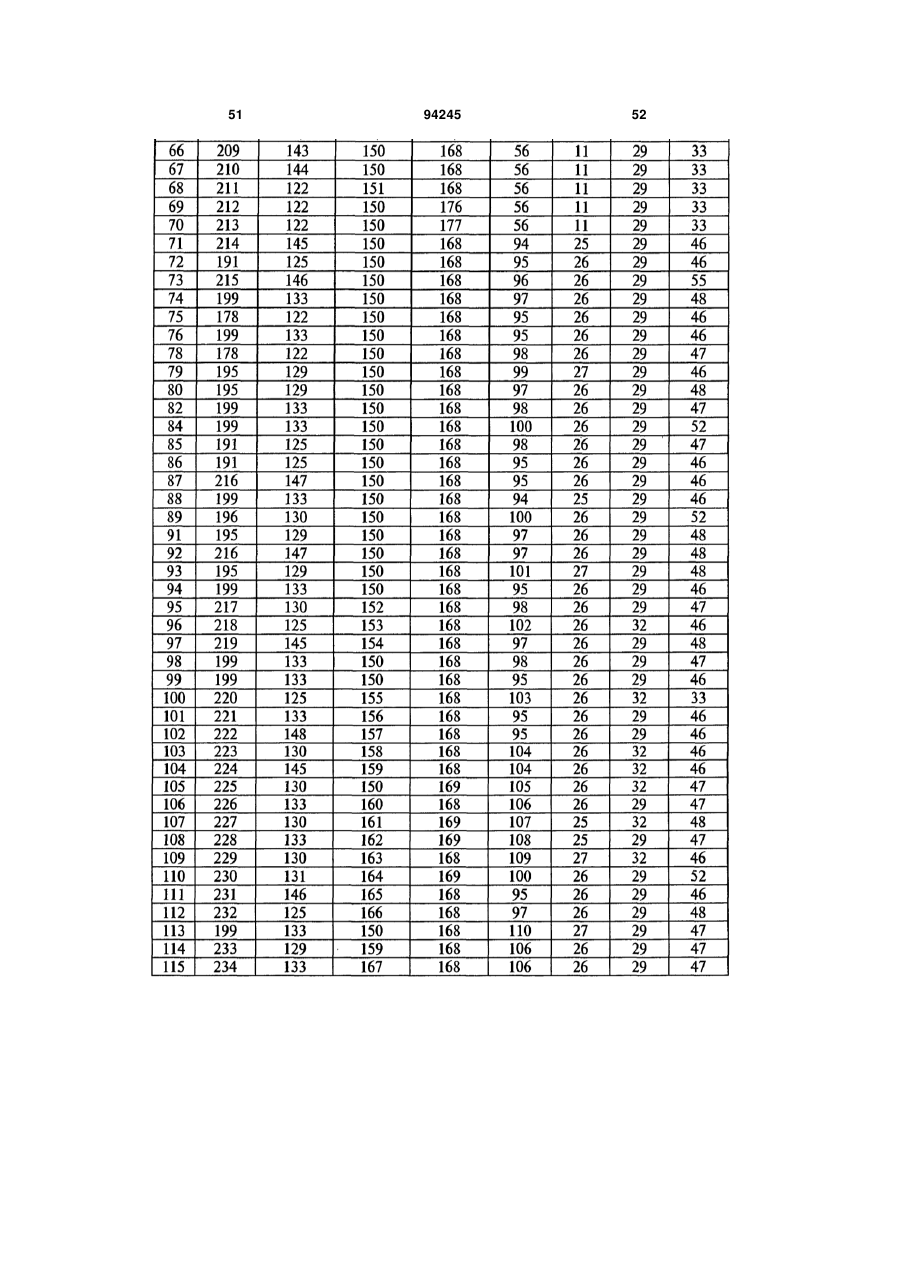
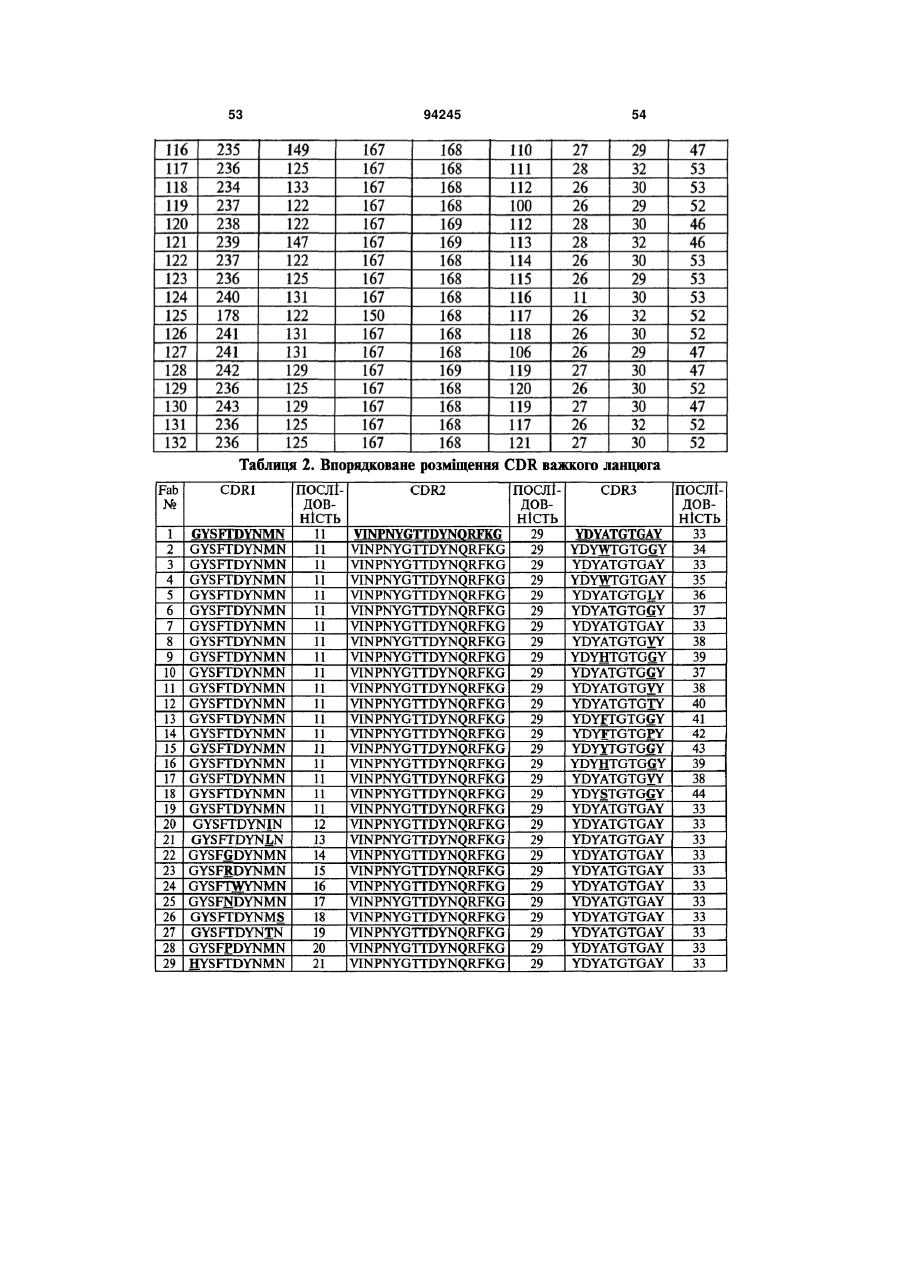
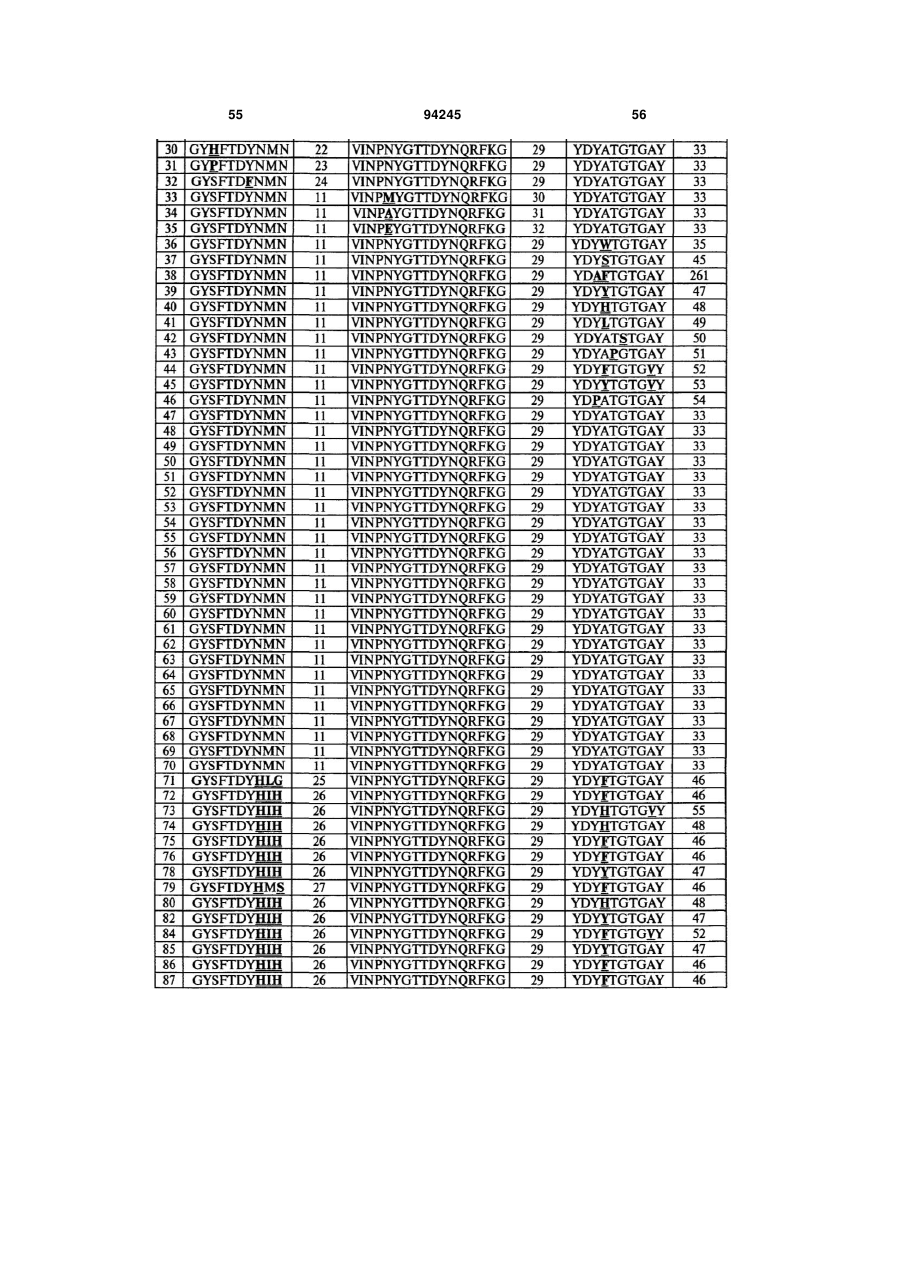
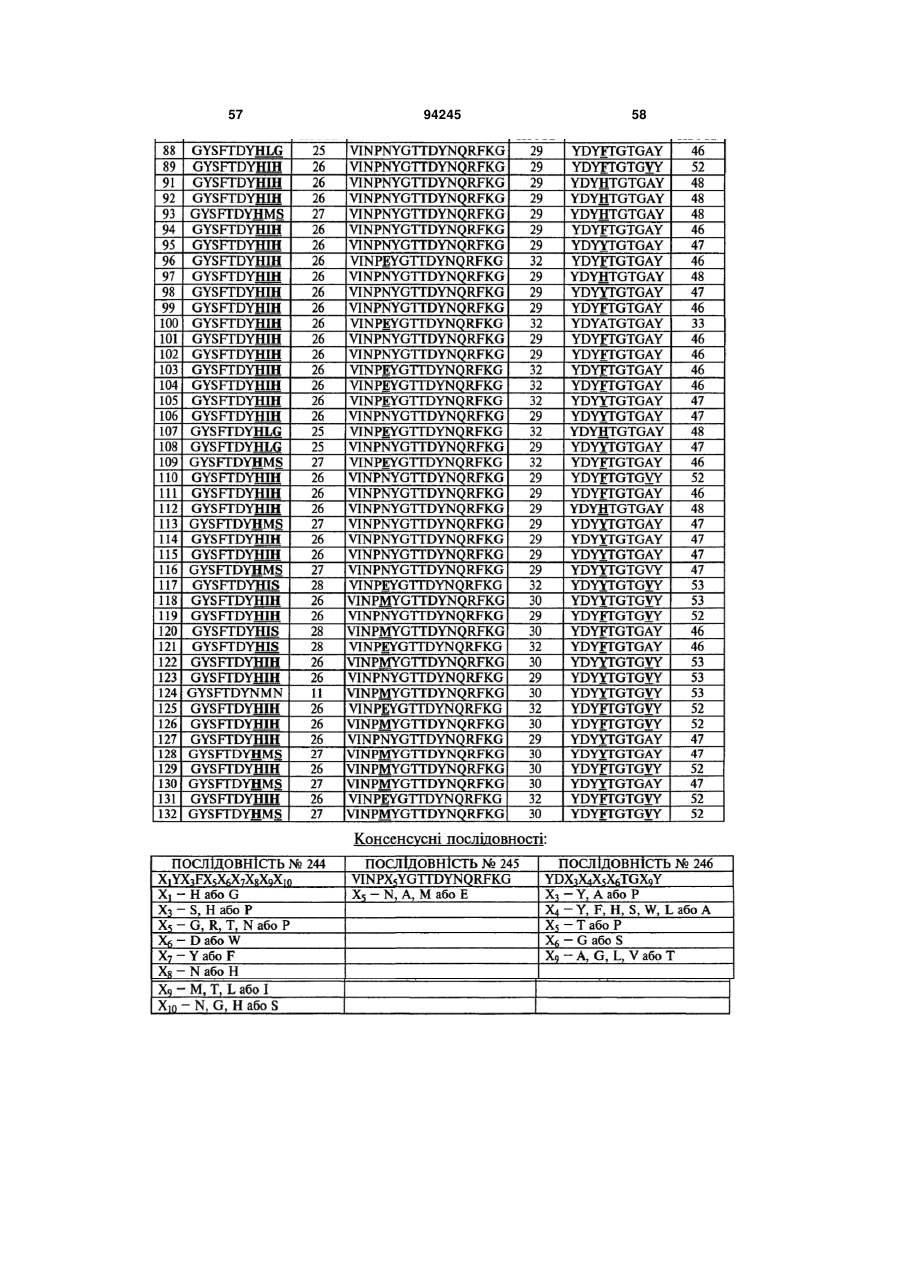
7. Гуманізоване моноклональне антитіло проти IL-17, яке містить варіабельну ділянку важкого ланцюга (HCVR), яка містить поліпептид з амінокислотною послідовністю, вибраною з групи, яку складають ПОСЛІДОВНОСТІ №№ 56-121.
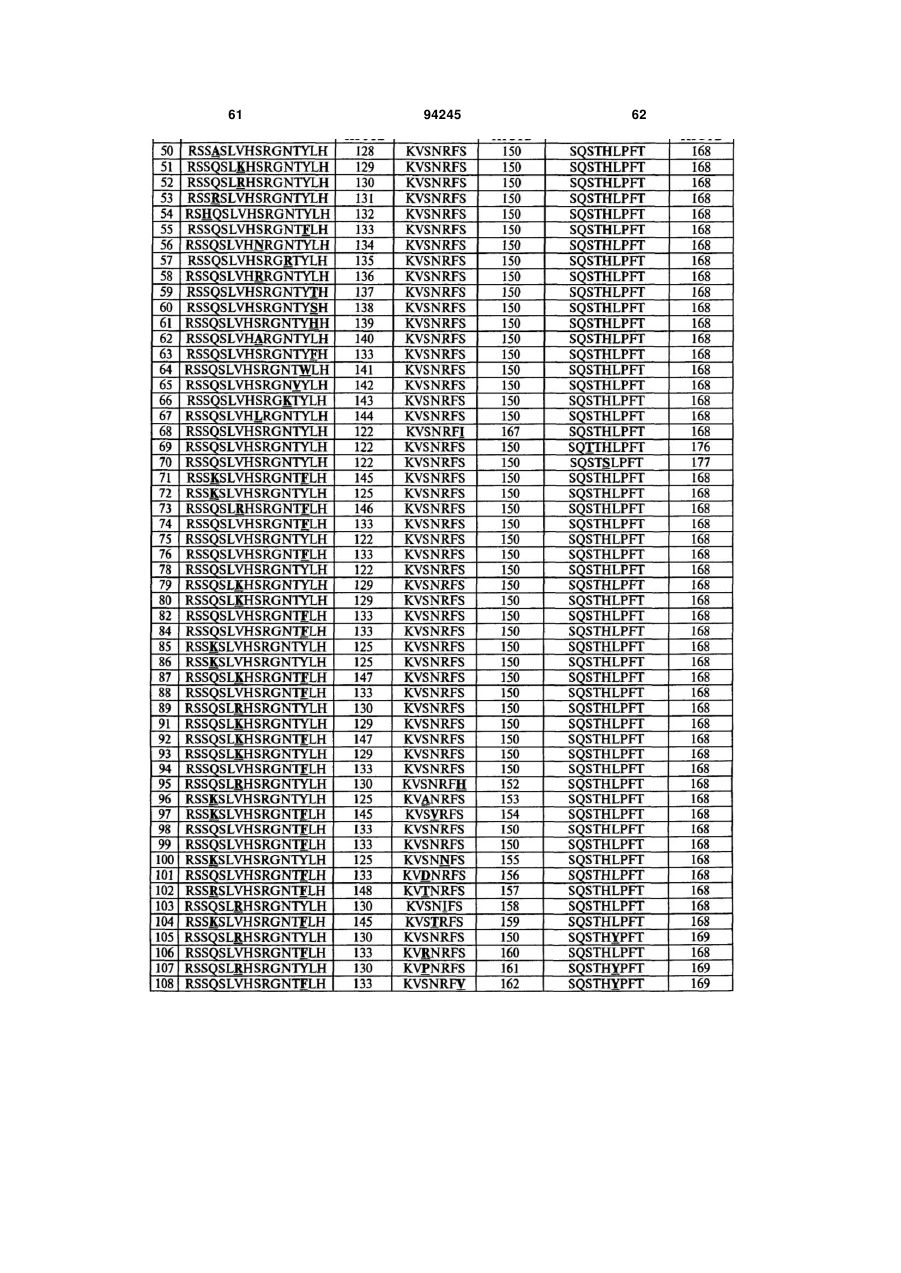
8. Гуманізоване моноклональне антитіло проти IL-17, яке містить варіабельну ділянку легкого ланцюга (LCVR), яка містить поліпептид з амінокислотною послідовністю, вибраною з групи, яку складають ПОСЛІДОВНОСТІ №№ 178-243.
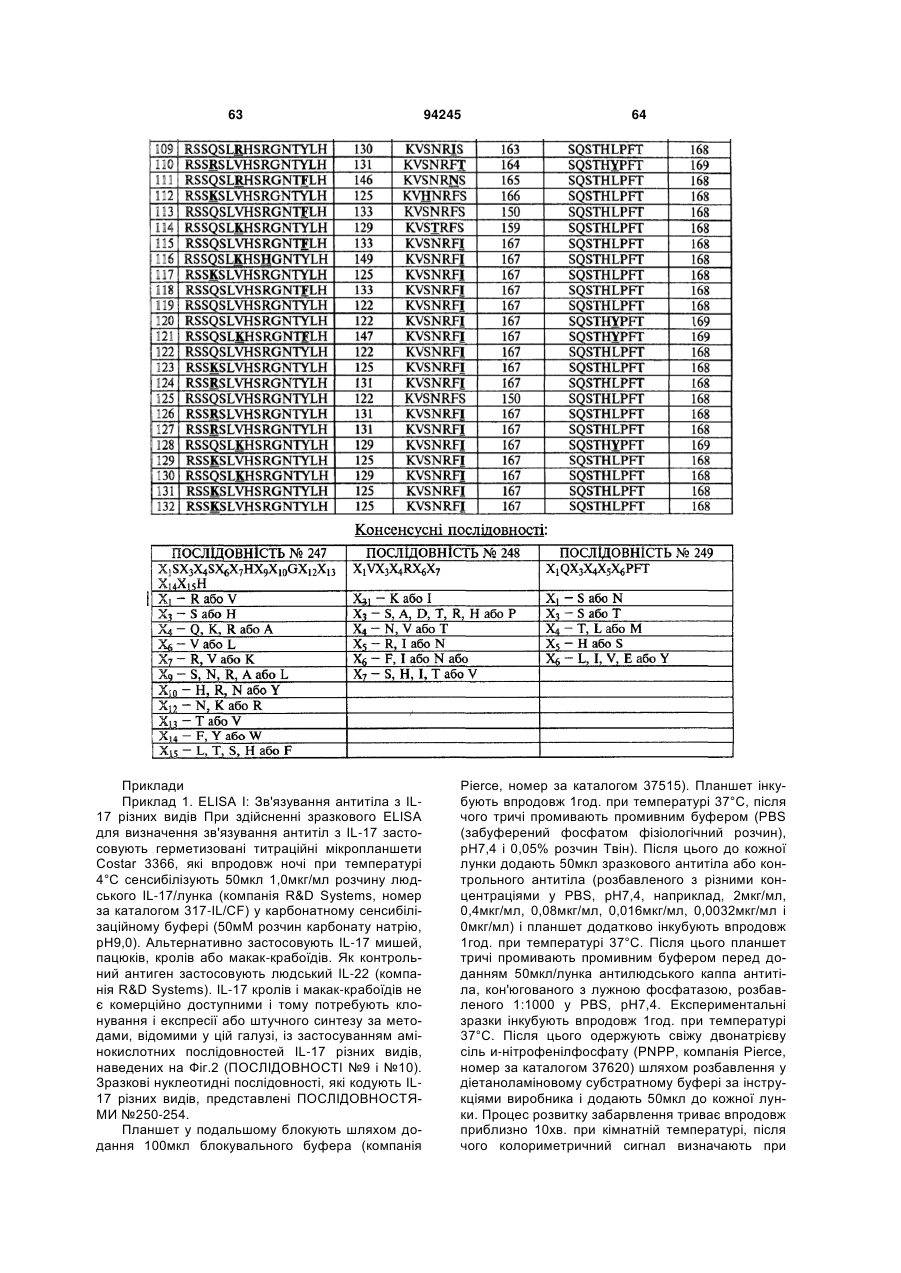
9. Гуманізоване антитіло проти IL-17, яке містить CDRL1 поліпептид із ПОСЛІДОВНІСТЮ № 247, поліпептид CDRL2 із ПОСЛІДОВНІСТЮ № 248, поліпептид CDRL3 із ПОСЛІДОВНІСТЮ № 249, поліпептид CDRH1 із ПОСЛІДОВНІСТЮ № 244, поліпептид CDRH2 із ПОСЛІДОВНІСТЮ № 245 і поліпептид CDRH3 із ПОСЛІДОВНІСТЮ № 246.
10. Гуманізоване моноклональне антитіло за будь-яким із пп. 1-9, яке являє собою гуманізоване або повністю людське антитіло або його антигензв'язувальний фрагмент.
11. Антитіло за будь-яким з пп. 1-10, яке являє собою гуманізоване непроцесоване антитіло, гуманізоване по суті інтактне антитіло, Fab-фрагмент, F(аb')2-фрагмент або одноланцюговий Fv-фрагмент.
12. Антитіло за будь-яким з пп. 1-11, яке містить константну ділянку важкого ланцюга, вибрану з групи, яку складають IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM та IgD.
13. Композиція, яка містить антитіло за будь-яким із пп. 1-12 та додатково містить фармацевтично прийнятний носій.
14. Антитіло за будь-яким із пп. 1-12 для застосування як лікарського засобу.
15. Застосування ефективної кількості антитіла за будь-яким із пп. 1-12 для одержання лікарського засобу для лікування одного або декількох станів, вибраних з групи, до складу якої входить ревматоїдний артрит, запальна хвороба кишечнику, псоріаз і розсіяний склероз.
Текст
1. Гуманізоване моноклональне антитіло проти IL-17, де згадане антитіло зв'язує людський IL17 з КD, меншою за 7,0 пМ. 2. Антитіло за п. 1, яке додатково має константу швидкості дисоціації або швидкість koff, меншу за 510-5 с-1. 3. Антитіло за будь-яким з пп. 1-2, яке специфічно зв'язує нелінійну антигенну детермінанту людсько 2 (19) 1 3 94245 4 13. Композиція, яка містить антитіло за будь-яким із пп. 1-12 та додатково містить фармацевтично прийнятний носій. 14. Антитіло за будь-яким із пп. 1-12 для застосування як лікарського засобу. 15. Застосування ефективної кількості антитіла за будь-яким із пп. 1-12 для одержання лікарського засобу для лікування одного або декількох станів, вибраних з групи, до складу якої входить ревматоїдний артрит, запальна хвороба кишечнику, псоріаз і розсіяний склероз. Цей винахід належить до галузі медицини, зокрема, до галузі моноклональних антитіл проти людського IL-17. Цей винахід має відношення до нейтралізуючих моноклональних антитіл проти IL17, які з високою афінністю зв'язуються з нелінійною або конформаційною антигенною детермінантою IL-17, яка містить амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276). Антитіла за цим винаходом можуть бути химерними, гуманізованими або людськими антитілами, імунокон'югатами антитіл або їхніх антигензв'язувальних фрагментів і придатні як лікарський засіб для лікування автоімунних, запальних, клітинопроліферативних розладів та розладів розвитку. Родина цитокінів IL-17 на цей час включає IL17A, IL-17B, IL-17C, IL-17D, IL-17E та IL-17F. Усі члени родини IL-17 мають чотири висококонсервативні залишки цистеїну, залучені до утворення міжланцюгових дисульфідних зв'язків, і мають два або декілька залишків цистеїну, які можуть бути залучені до міжланцюгових дисульфідних зв'язків. Члени родини IL-17 не мають подібності послідовності до будь-яких інших відомих цитокінів. Однак у відкритій рамці зчитування 13 вірусу герпесу саймірі було знайдено вірусний гомолог IL-17A (Яо З. (Yao Z.) та інші, Immunity, 3:811, 1995), який має 72% ідентичність амінокислотних залишків із людським IL-17A. Повідомлялось про численні функції членів родини IL-17, які охоплюють, головним чином, регуляцію імунної реакції. Інтерлейкін 17 (IL-17, який називають також IL17A) являє собою гомодимерний глікопротеїн масою 20-30кДа, продукований, головним чином, активованими CD4+ Т-клітинами, який функціонує як передзапальний цитокін. Коли конкретний член родини IL-17 згадується просто як «IL-17» слід розуміти, що згадуваним членом родини є IL-17A. IL-17 секретується активованими Т-клітинами на ділянках запалення, які знаходяться за межами великого кола кровообігу. IL-17 зв'язується з трансмембранним рецептором типу І, який називають IL-17R, що являє собою великий повсюдно експресований білок, який не має значної подібності послідовності до інших відомих рецепторів цитокінів. IL-17 має численні біологічні властивості, у тому числі активації фактора адгезії та індукції продукування численних запальних цитокінів і хемокінів клітинами різних типів, у тому числі синовіоцитами, хондроцитами, фібробластами, ендотеліальними клітинами, епітеліальними клітинами, кератиноцитами і макрофагами. Окрім того, IL-17 індукує рекрутинг нейтрофілів до місця запалення шляхом індукції виділення хемокінів, стимулює продукування простагландинів та металопротеїназ і пригнічує синтез протеогліканів. На додаток до цього, IL-17 відіграє важливу роль у визріванні гемопоетичних клітин-попередників. Було показано, що IL-17 здійснює передавання сигналів у різних органах і тканинах, у тому числі у легенях, суглобовому хрящі, кістковій тканині, головному мозку, гемопоетичних клітинах, нирках, шкірі і кишечнику. Огляд біологічної активності IL-17 дивись, наприклад, у роботі Коллз (Kolls) та Лінден (Linden), Immunity 21:467-476, 2004, або Фосс'є (Fossiez) та інші, Int. Rev. Immunol. 16:541, 1998. Підвищені рівні IL-17 (тобто IL-17A) пов'язуються з декількома станами, захворюваннями або розладами, у тому числі запаленням дихальних шляхів, ревматоїдним артритом ("RA"), остеоартритом, ерозією кісток, внутрішньоочеревинними абсцесами та спайками, запальною хворобою кишечнику ("IBD"), відторгненням алотрансплантата, псоріазом, раком певних типів, ангіогенезом, атеросклерозом і розсіяним склерозом ("MS") (дивись оглядову статтю Вітковскі (Witkowski) та інші, Cell. Моl. Life Sci. 61:567-579, 2004). Як IL-17, так і IL17R активовані у синовіальній тканині хворих на RA. Блокування біологічної активності IL-17 шляхом зв'язування специфічним антитілом проти IL17 або розчинним рецептором IL-17 зменшує тяжкість запалення і ступінь ерозії кісток у багатьох тваринних моделях артриту. (Дивись, наприклад, Лаббертс (Lubberts) та інші, Arthritis & Rheumatism, 50:650-659, 2004). На додаток до цього, IL-17 має незалежний від IL-1β вплив на розпад колагенового матриксу, запалення і пошкодження суглобів, у той час як наслідком спільної дії IL-17 з TNF-α є посилення запального процесу. Таким чином, IL-17, приймаючи до уваги його локалізований розподіл на ділянці запалення, видається новою мішенню для лікування RA та інших запальних або автоімунних захворювань із потенційно більш високим профілем безпечності, порівняно з лікарськими засобами, мішенню для яких є передзапальні цитокіни у великому колі кровообігу, наприклад, TNF-α. Сучасні біопродукти, схвалені Управлінням із санітарного нагляду за харчовими продуктами і медикаментами (США) (антитіла ENBREL®, REMICADE® and HUMIRA®), які зв'язуються з TNF-α та нейтралізують його, продемонстрували ефективність щодо зменшення тяжкості ознак і симптомів RA та уповільнення розвитку захворювання у підгрупі хворих на RA. Не усі хворі на RA, однак, однаково реагують на пригнічення біологічної активності TNF-α цими біологічними продуктами. На додаток до цього, рівень мРНК IL17 зростає у численних склеротичних ураженнях та в мононуклеарах крові і цереброспінальної рі 5 дини хворих на MS, зокрема, під час клінічного загострення. Відповідно, існує потреба у композиціях, які антагонізують або нейтралізують активність IL-17, для лікування розладів, захворювань або станів, у разі яких присутність біологічної активності IL-17 впливає або додає свій внесок до небажаного патологічного впливу або у разі яких зниження біологічної активності IL-17 додає свій внесок до бажаного терапевтичного впливу, у тому числі запальних захворювань, клітинопроліферативних розладів, розладів розвитку та автоімунних розладів, наприклад, RA, MS та IBD. Існує потреба у нейтралізуючому антитілі проти IL-17, яке специфічно зв'язує IL-17 людського походження, а також IL-17 ссавця окрім людини, із уможливленням, тим самим, застосування згаданого антитіла у in vivo передклінічних та клінічних дослідженнях. На додаток до цього, існує потреба у специфічному антитілі проти IL-17, яке зв'язує IL17 із високою спорідненістю та/або має низьку швидкість дисоціації, із уможливленням зниження до мінімального рівня ефективної терапевтичної дози, наслідком чого є рідше введення дози з таким антитілом, аніж з антитілом, яке зв'язує IL-17 з меншою спорідненістю (тобто більш високим значенням KD) та/або має більш високу швидкість дисоціації. Специфічне антитіло проти IL-17 з високим рівнем спорідненості також є бажаним, оскільки воно може уможливити введення згаданого антитіла хворому підшкірним, а не внутрішньовенним шляхом. Існує також потреба у специфічному антитілі проти IL-17 із низьким значенням ІС50 У аналізах біологічної активності IL-17 для одержання терапевтичного антитіла проти IL-17 із мінімальною ефективною терапевтичною дозою. Бажано також надати антитіло, специфічне по відношенню до IL-17, де будь-яка імунна реакція на антитіло, яка виникає у хворого, який одержує згадане антитіло, зведена до мінімального рівня. Цей винахід задовольняє ці потреби і забезпечує відповідні переваги. Антитілами за цим винаходом є химерні, гуманізовані або повністю людські моноклональні антитіла проти IL-17 та їхні антигензв'язувальні фрагменти, які зв'язують нелінійну антигенну детермінанту, яка містить амінокислоти IL-17 DGNVDYH (ПОСЛІДОВНІСТЬ №276), і антагонізують або нейтралізують щонайменше одну in vitro або in vivo біологічну активність, яка пов'язується з IL-17 або його частиною. За одним із варіантів здійснення антитіла за цим винаходом мають ІС50 меншу за або таку, що дорівнює приблизно 1нМ, 900пМ, 800пМ, 700пМ, 600пМ, 560пМ або 500пМ у in vitro аналізі IL-8 "репортерної" групи, як описано, наприклад, у наведеному Прикладі 6А, або меншу за чи таку, що дорівнює 560пМ у in vitro аналізі GROα "репортерної" групи, як описано, наприклад, у наведеному Прикладі 6В. За іншим варіантом здійснення цього винаходу антитіла за цим винаходом відрізняються сильною зв'язувальною спорідненістю (KD) до людського IL17, тобто меншою за приблизно 7пМ, 6,5пМ, 6,0пМ, 5,5пМ, 5,0пМ, 4,5пМ або 4,0пМ. За альтернативним варіантом антитіла за цим винаходом 94245 6 відрізняються KD до людського IL-17, який не перевищує приблизно 7пМ, 6,5пМ, 6,0пМ, 5,5пМ, 5,0пМ, 4,5пМ або, за варіантом, якому віддається перевага, не перевищує приблизно 4,0пМ. За варіантом, якому віддається перевага, антитіла за цим винаходом додатково відрізняються швидкістю koff з людським IL-17, що є меншою за 2×10-5 с-1. За іншим варіантом здійснення антитіло проти IL-17 за цим винаходом відрізняється тим, що специфічно зв'язує людський IL-17, а також IL-17 макак-крабоїдів, і не зв'язує IL-17 мишей або пацюків із рівнями, які перевищують фонові. На додаток до цього, антитіло проти IL-17 за цим винаходом зв'язує людський IL-17 (тобто IL-17A), але не зв'язує людський IL-17B, IL-17C, IL-17D, IL-17E або IL-17F. За одним із варіантів здійснення моноклональне антитіло проти IL-17 за цим винаходом містить поліпептид варіабельної ділянки легкого ланцюга ("LCVR"), що містить 3 послідовності гіперваріабельних ділянок (CDR), присутні разом у Fab-фрагментах, представлених у наведеній нижче Таблиці 3, і які присутні у антитілі за цим винаходом у тому самому положенні у CDR, що і у Fabфрагменті, представленому у Таблиці 3. За варіантом, якому віддається перевага, моноклональне антитіло проти IL-17 за цим винаходом містить LCVR поліпептид з амінокислотною послідовністю, вибраною з групи, до складу якої входять ПОСЛІДОВНОСТІ №178-243. За іншим варіантом здійснення моноклональне антитіло проти IL-17 за цим винаходом містить поліпептид варіабельної ділянки важкого ланцюга ("HCVR"), що містить 3 гіперваріабельні ділянки (CDR), присутні разом у Fab-фрагментах, представлених у наведеній нижче Таблиці 2, і які присутні у антитілі за цим винаходом у тому самому положенні у CDR, що і у Fab-фрагменті, представленому у Таблиці 2. За варіантом, якому віддається перевага, моноклональне антитіло проти IL-17 за цим винаходом містить HCVR поліпептид з амінокислотною послідовністю, вибраною з групи, до складу якої входять ПОСЛІДОВНОСТІ №56-121. За іншим варіантом здійснення моноклональне антитіло проти IL-17 за цим винаходом містить LCVR поліпептид, який містить 3 гіперваріабельні ділянки, присутні разом у Fab-фрагментах, представлених у Таблиці 3, і які присутні у антитілі за цим винаходом у тому самому положенні у CDR, що і у Fab-фрагменті, представленому у Таблиці 3, і додатково містить HCVR поліпептид, який містить 3 гіперваріабельні ділянки, присутні разом у Fabфрагментах, представлених у Таблиці 2, і які присутні у антитілі за цим винаходом у тому самому положенні у CDR, що і у Fab-фрагменті, представленому у Таблиці 2. За варіантом, якому віддається перевага, 6 гіперваріабельних ділянок антитіла за цим винаходом або їхні функціональні фрагменти існують разом у Fab-фрагментах, представлених у наведеній нижче Таблиці 1, і присутні у антитілі за цим винаходом у тому самому положенні у CDR, що і у Fab-фрагменті, представленому у Таблиці 1. За варіантом здійснення, якому віддається перевага, моноклональне антитіло проти IL-17 за цим винаходом містить (і) LCVR поліпептид, який 7 містить амінокислотну послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №178-243, та (іі) HCVR поліпептид, який містить амінокислотну послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №56-121. За варіантом здійснення, якому віддається більша перевага, антитіло за цим винаходом, яке містить LCVR поліпептид, який містить амінокислотну ПОСЛІДОВНІСТЬ, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №178-243, додатково містить HCVR поліпептид, вибраний з групи, до складу якої входять ПОСЛІДОВНОСТІ №56-121, представлений у Fab-фрагменті, який наведено у Таблиці 1, що містить конкретну LCVR, присутню у згаданому антитілі. За іншим варіантом здійснення моноклональним антитілом за цим винаходом є антитіло, яке може конкурувати за зв'язування з людським IL-17 або частиною людського IL-17 із конкуруючим антитілом, де згадане конкуруюче антитіло містить два поліпептиди з амінокислотними ПОСЛІДОВНОСТЯМИ №241 та №118. За іншим варіантом здійснення LCVR моноклонального антитіла проти IL-17 за цим винаходом містить 1 пептид, 2 пептиди або 3 пептиди, за варіантом, якому віддається перевага, 3 пептиди, вибрані з групи, до складу якої входять пептиди з послідовністю, яка показана (а) ПОСЛІДОВНОСТЯМИ №122-149; (Ь) ПОСЛІДОВНОСТЯМИ №150167, та (с) ПОСЛІДОВНОСТЯМИ №168-177 (тобто один пептид з (а), один пептид з (b) і один пептид з (с) для антитіла, яке містить 3 згадані пептиди). Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №122-149, у разі присутності у антитілі за цим винаходом, знаходиться на CDRL1. Пептид з послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №150-167, у разі присутності у антитілі за цим винаходом, знаходиться на CDRL2. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №150-167, у разі присутності у антитілі за цим винаходом, знаходиться на CDRL3. За іншим варіантом здійснення HCVR моноклонального антитіла проти IL-17 за цим винаходом містить 1 пептид, 2 пептиди або 3 пептиди, за варіантом, якому віддається перевага, 3 пептиди, вибрані з групи, до складу якої входять пептиди з послідовністю, яка показана (а) ПОСЛІДОВНОСТЯМИ №11-28; (b) ПОСЛІДОВНОСТЯМИ №29-32, та (с) ПОСЛІДОВНОСТЯМИ №33-55 (тобто один пептид з (а), один пептид з (b) і один пептид з (с) для антитіла, яке містить 3 згадані пептиди). Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №11-28, у разі присутності у згаданому антитілі знаходиться на CDRH1. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №29-32, у разі присутності у згаданому антитілі знаходиться на CDRH2. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №33-55 та №261, у разі присутності у згаданому антитілі знаходиться на CDRL3. Цей винахід додатково пропонує моноклональне антитіло проти IL-17, яке містить шість пептидів, вибраних із групи, до складу якої входять пептиди з послідовністю, яка показана (а) ПОСЛІДОВНОСТЯМИ №122-149; (b) ПОСЛІДОВНОС 94245 8 ТЯМИ №150-167, (с) ПОСЛІДОВНОСТЯМИ №168177, (d) ПОСЛІДОВНОСТЯМИ №11-28; (e) ПОСЛІДОВНОСТЯМИ №29-32, та (f) ПОСЛІДОВНОСТЯМИ №33-55 та №261 (тобто один пептид із кожної групи (a-f)); за варіантом, якому віддається перевага, шість пептидів одночасно існують у Fabфрагментах, представлених у Таблиці 1. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №122-149, у разі присутності у згаданому антитілі знаходиться на CDRL1. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №150-167, у разі присутності у згаданому антитілі знаходиться на CDRL2. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №33-55 та №261, у разі присутності у згаданому антитілі знаходиться на CDRL3. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №11-28, у разі присутності у згаданому антитілі знаходиться на CDRH1. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №29-32, у разі присутності у згаданому антитілі знаходиться на CDRH2. Пептид із послідовністю, яка показана ПОСЛІДОВНОСТЯМИ №33-55 та №261, у разі присутності у згаданому антитілі знаходиться на CDRH3. Цей винахід додатково пропонує моноклональне антитіло проти IL-17, яке містить шість пептидів із послідовностями, які показані ПОСЛІДОВНОСТЯМИ №247, №248, №249, №244, №245 та №246. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №247, знаходиться на CDRL1. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №248, знаходиться на CDRL2. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №249, знаходиться на CDRL3. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №244, знаходиться на CDRH1. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №245, знаходиться на CDRH2. Пептид із послідовністю, яка показана ПОСЛІДОВНІСТЮ №246, знаходиться на CDRH3. Моноклональне антитіло проти IL-17 за цим винаходом може містити або являти собою інтактне (тобто непроцесоване) антитіло, по суті інтактне антитіло або його антигензв'язувальний домен, наприклад, Fab-фрагмент, F(аb')2-фрагмент або одноланцюговий Fv-фрагмент. На додаток до цього, антитіло за цим винаходом може мітитись виявною міткою, іммобілізуватись на твердій фазі та/або кон'югуватись із гетерологічною сполукою, наприклад, ферментом, токсином або молекулою поліетиленгліколю. За іншим варіантом здійснення цей винахід пропонує спосіб одержання моноклонального антитіла проти IL-17 за цим винаходом, який включає збереження клітини-хазяїна за цим винаходом (тобто клітини-хазяїна, яка була трансформована, трансдукована або інфікована вектором (або векторами) за цим винаходом, яка експресує антитіло за цим винаходом) за умов, прийнятних для експресії моноклонального антитіла за цим винаходом, завдяки чому таке антитіло експресується. Згаданий спосіб може додатково включати стадію виділення моноклонального антитіла за цим винаходом із клітини або, за варіантом, якому віддається перевага, з культуральних середовищ, на яких вирощують згадану клітину. 9 Передбачаються діагностичні варіанти застосування моноклональних антитіл за цим винаходом. За одним із діагностичних варіантів застосування цей винахід пропонує спосіб визначення рівня білка IL-17 у зразку, що включає піддання експериментального зразка, призначеного для випробування, впливу антитіла проти IL-17 за цим винаходом за умов зв'язування та визначення специфічного зв'язування антитіла із зразком. Антитіло проти IL-17 за цим винаходом може застосовуватись для визначення рівнів IL-17 у експериментальних зразках шляхом порівняння значень експериментального зразка зі стандартною кривою, яку одержали шляхом зв'язування згаданого антитіла зі зразками з відомими кількостями IL-17. Цей винахід додатково пропонує набір, до складу якого входять антитіло за цим винаходом, і за варіантом, якому віддається перевага, інструкції із застосування антитіла для виявлення білка IL-17 у зразку. Цей винахід пропонує композицію, за варіантом, якомувіддається перевага, фармацевтичну композицію, яка містить моноклональне антитіло проти IL-17 за цим винаходом. Фармацевтична композиція за цим винаходом може додатково містити фармацевтично прийнятний носій, наповнювач та/або розріджувач. У згаданій фармацевтичній композиції моноклональне антитіло проти IL-17 за цим винаходом являє собою єдиний активний інгредієнт. За варіантом, якому віддається перевага, фармацевтична композиція містить гомогенну або по суті гомогенну популяцію моноклонального антитіла проти IL-17 за цим винаходом. Композиція для терапевтичного застосування є фізіологічно сумісною, стерильною і може ліофілізуватись та за варіантом, якому віддається перевага, поставлятись із відповідним розріджувачем. Цей винахід пропонує спосіб пригнічення щонайменше однієї біологічної активності IL-17 у тварини, за варіантом, якому віддається перевага, у ссавця, за варіантом, якому віддається більша перевага, у людини, яка цього потребує, що включає введення терапевтично ефективної кількості або кількості, що нейтралізує IL-17, моноклонального антитіла проти IL-17 за цим винаходом згаданій тварині. Цей винахід додатково пропонує спосіб лікування захворювання або розладу, які поліпшуються шляхом нейтралізування або антагонізування біологічної активності IL-17, наприклад, пригнічення трансдукції сигналу, що є наслідком зв'язування IL-17 з його рецептором, який включає введення хворому (наприклад, людині), який потребує такого лікування або запобігання, терапевтично ефективної кількості або кількості, яка нейтралізує IL-17, моноклонального антитіла за цим винаходом. Цей винахід пропонує моноклональне антитіло проти IL-17 за цим винаходом для застосування при виготовленні лікарського засобу для введення ссавцю, за варіантом, якому віддається перевага, людині, для лікування, наприклад, автоімунного розладу або запального розладу чи клітиннопроліферативного розладу. Цей винахід додатково пропонує готовий виріб, до складу якого входять пакувальний матеріал 94245 10 і антитіло за цим винаходом, яке знаходиться у згаданому пакувальному матеріалі, де згаданий пакувальний матеріал включає пакувальну вкладку, на якій вказується, що згадане антитіло специфічно нейтралізує активність IL-17 або знижує рівень функціонального IL-17, присутнього у системі. Цей винахід додатково пропонує виділені молекули нуклеїнової кислоти, яка кодує антитіло за цим винаходом або його легкий ланцюг чи важкий ланцюг; вектор (або вектори), що містить(-ять) згадану нуклеїнову кислоту, за факультативним варіантом функціонально зв'язаний(-і) з контрольними послідовностями, які розпізнаються клітиною-хазяїном, трансформованою згаданим вектором; клітину-хазяїна, яка містить згаданий вектор; спосіб продукування антитіла за цим винаходом, який включає культивування згаданої клітинихазяїна таким чином, що згадана нуклеїнова кислота експресується, і факультативне виділення згаданого антитіла із культурального середовища клітини-хазяїна. Цей винахід додатково пропонує виділені молекули нуклеїнової кислоти, яка кодує IL-17 макаки-крабоща (ПОСЛІДОВНІСТЬ №253) або IL-17 кроля (ПОСЛІДОВНІСТЬ №251); білок IL-17, який кодується нуклеїновою кислотою макаки-крабоїда або кроля (ПОСЛІДОВНОСТІ №10 або №9, відповідно); вектори, які містять згадану молекулу нуклеїнової кислоти; клітину-хазяїна, яка містить згаданий вектор; і спосіб продукування IL-17 макакикрабоїда або IL-17 кроля. На Фіг.1 представлено впорядковане розміщення амінокислотних послідовностей членів родини людських білків IL-17 (IL-17, IL-17B, IL-17C, IL-17D, IL-17E та IL-17F). На Фіг.2 представлено впорядковане розміщення IL-17 людини, кроля, пацюка, макакикрабоїда і миші. Цей винахід представляє химерні, гуманізовані або повністю людські моноклональні антитіла проти IL-17 або їхні антигензв'язувальні домени, здатні нейтралізувати або антагонізувати щонайменше одну активність IL-17 in vitro та/або in vivo. За варіантом, якому віддається перевага, такі антитіла за цим винаходом додатково відрізняються тим, що мають ІС50 меншу за приблизно 600пМ або 560 пм у in vitro аналізі IL-8 "репортерної" групи або у аналізі GROα "репортерної" групи (дивись,наприклад, Приклад 6), та/або за варіантом, якому віддається перевага, демонструють високу зв'язувальну спорідненість до IL-17, меншу за 4пМ. Антитіла за цим винаходом додатково відрізняються тим, що вони специфічно зв'язують IL-17 людини та макаки-крабоїда (ПОСЛІДОВНОСТІ №1 та №10, відповідно), але не зв'язують IL-17 миші або пацюка (ПОСЛІДОВНОСТІ №7 та №8, відповідно). Антигенна детермінанта, з якою зв'язуються моноклональні антитіла за цим винаходом, являє собою нелінійну антигенну детермінанту IL-17 людини (і макаки-крабоїда) і містить залишки DGNVDYH (ПОСЛІДОВНІСТЬ №276) IL-17. Антитіло за цим винаходом контактує з пептидом DGNVDYH (ПОСЛІДОВНІСТЬ №276) у тому разі, 11 коли він знаходиться у контексті непроцесованого IL-17. Визначення «Інтерлейкін 17», який називають також «IL17» або «IL-17A», являє собою глікозилований гомодимерний білок масою 20-30кДа. Ген людського IL-17 кодує білок довжиною 155 амінокислот, який має сигнальну послідовність довжиною 19 амінокислот і зрілий фрагмент довжиною 136 амінокислот. Людський IL-17 демонструє 62,5% та 58% ідентичність амінокислотної послідовності з амінокислотними послідовностями IL-17 мишей і пацюків, відповідно, як показано на Фіг.2. Людський IL-17 демонструє 97,4% ідентичність амінокислотної послідовності з IL-17 макак-крабоїдів. Непроцесоване антитіло у тому вигляді, у якому воно існує за природних умов, являє собою молекулу імуноглобуліну, яка складається із чотирьох поліпептидних ланцюгів, двох важких (Н) ланцюгів (приблизно 50-70кДа у непроцесованому вигляді) та двох легких (L) ланцюгів (приблизно 25кДа у непроцесованому вигляді), взаємно зв'язаних дисульфідними зв'язками. Амінокінцева частина кожного ланцюга містить варіабельну ділянку довжиною приблизно 100-110 амінокислот або більше, яка відповідає, головним чином, за розпізнавання антигену. На карбоксильному кінці кожного ланцюга знаходиться константна ділянка, яка відповідає головним чином за ефекторну функцію. Легкі ланцюги підрозділяються на ланцюги типу каппа або типу лямбда і відрізняються конкретною константною ділянкою. Кожен легкий ланцюг містить N-кінцеву варіабельну ділянку легкого ланцюга (у цьому описі "LCVR") і константну ділянку легкого ланцюга, яка складається з одного домену, CL. Важкі ланцюги підрозділяються на ланцюги типу гамма, мю, альфа, дельта або епсилон і визначають ізотип антитіла як IgG, IgM, IgA, IgD та IgE відповідно, і декілька з них можуть додатково підрозділятись на субкласи (ізотипи), наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 та IgA2. Важкий ланцюг кожного типу відрізняється конкретною константною ділянкою. Кожен важкий ланцюг містить Nкінцеву варіабельну ділянку важкого ланцюга (у цьому описі "HCVR") і константну ділянку важкого ланцюга. Константна ділянка важкого ланцюга складається з трьох доменів (СН1, СН2 та СН3) у разі IgG, IgD та IgA; і 4 доменів (СН1, СН2, СН3 та СН4) у разі IgM та IgE. HCVR та LCVR можуть додатково підрозділятись на гіперваріабельні ділянки, які називають ділянками, які обумовлюють комплементарність ("CDR"), що чергуються з більш консервативними ділянками, які називаються каркасними ділянками ("FR"). Кожна HCVR та LCVR складається з трьох CDR та чотирьох FR, які розміщуються у напрямку від аміно-кінця до карбоксильного кінця таким чином: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. У разі непроцесованих антитіл за цим винаходом легкі ланцюги за варіантом, якому віддається перевага, містять у 5'-3' напрямку відносно FR4 поліпептид із послідовністю, представленою ПОСЛІДОВНІСТЮ №277. У разі непроцесованих антитіл за цим винаходом важкі ланцюги за варіантом, якому віддається перевага, містять у 5'-3' напрям 94245 12 ку відносно FR4 поліпептид із послідовністю, представленою ПОСЛІДОВНІСТЮ. №278. У цьому описі З CDR важкого ланцюга позначають як "CDRH1, CDRH2 і CDRH3", а 3 CDR легкого ланцюга позначають як "CDRL1, CDRL2 і CDRL3". Гіперваріабельні ділянки (CDR) містять більшість залишків, які вступають у специфічні взаємодії з антигеном. Номенклатура і положення амінокислотних залишків у межах гіперваріабельних ділянок HCVR та LCVR відповідають добре відомій номенклатурі Кебота. Термін "антитіло" у відношенні до моноклонального антитіла проти IL-17 за цим винаходом (або просто "антитіло за цим винаходом") у значенні, вживаному у цьому описі, означає моноклональне антитіло. Термін "моноклональне антитіло" у значенні, вживаному у цьому описі, означає антитіло гризуна, за варіантом, якому віддається перевага, мишаче антитіло, химерне антитіло, гуманізоване антитіло або повністю людське антитіло, якщо у цьому описі не зазначено інше. Моноклональні антитіла за цим винаходом можна одержати за допомогою, наприклад, методу гібридом, добре відомого у цій галузі, а також рекомбінантними методами, методами проявлення у фагах, синтетичними або генно-інженерними методами чи комбінаціями таких методів, добре відомими у цій галузі. Термін «моноклональне антитіло» у значенні, вживаному у цьому описі, не обмежується антитілами, які одержують методом гібридом. "Моноклональне антитіло" означає антитіло, яке одержують з унікальної копії або клону, у тому числі, наприклад, з еукаріотного, прокаріотного або фагового клону, а не спосіб, за допомогою якого його продукують. "Моноклональним антитілом" може бути інтактне антитіло (яке містить повну або непроцесовану Fc-ділянку), по суті інтактне антитіло або частина чи фрагмент антитіла, що містить антигензв'язувальну ділянку, наприклад, Fab-фрагмент, Fab'-фрагмент або F(аb')2-фрагмент мишачого антитіла або химерного, гуманізованого чи людського антитіла. Fab-фрагмент містить варіабельний і константний домени легкого ланцюга та варіабельний домен і перший константний домен (СНІ) важкого ланцюга. F(аb')2-фрагменти антитіла містять пару Fab-фрагментів, як правило, ковалентно зв'язаних поблизу карбоксильних кінців шарнірними цистеїновими залишками, які знаходяться між ними. У цій галузі відомі також інші хімічні зв'язки фрагментів антитіла. Варіабельна ділянка кожної пари легкий/важкий ланцюг утворює антигензв'язувальний домен антитіла. Так, інтактне антитіло IgG має два зв'язувальні домени. За виключенням біфункціональних або біспецифічних антитіл, два зв'язувальні домени є однаковими. У значенні, вживаному у цьому описі, термін "антигензв'язувальний домен" або "антигензв'язувальна ділянка" чи "антигензв'язувальний фрагмент" у цьому описі взаємозамінно означає ту частину молекули антитіла, яка містить амінокислотні залишки, які взаємодіють з антигеном і наділяють антитіло його специфічністю та спорідненістю до згаданого антигену. Цей фрагмент антитіла включає «каркасні» амінокислотні залишки, необхідні для підтримання відпові 13 дної конформації антигензв'язувальних залишків. За варіантом, якому віддається перевага, гіперваріабельні ділянки антигензв'язувального домену антитіл за цим винаходом мають повністю або значною мірою мишаче походження, факультативно з певними зміненими амінокислотними залишками, наприклад, заміненими на інший амінокислотний залишок (дивись, наприклад, Таблицю 2 і Таблицю 3) для оптимізації конкретної властивості антитіла, наприклад, KD, koff, ІС50. За варіантом, якому віддається перевага, каркасні ділянки антитіл за цим винаходом мають людське походження або по суті людське походження (людське походження щонайменше на 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99%). Каркасні ділянки антитіл за цим винаходом, яким віддається перевага, мають наведені нижче послідовності: ПОСЛІДОВНОСТІ №262 (HCVR FR1), №263 (HCVR FR2), №264 (HCVR FR3), №265 (HCVR FR4), №266 (LCVR FR1), №267 (LCVR FR2), №268 (LCVR FR3), №269 (LCVR FR4) і відповідають номенклатурі Кебота. За іншими варіантами здійснення антигензв'язувальний домен антитіла проти IL-17 за цим винаходом може бути одержаний від інших видів окрім людини, у тому числі (але без обмеження) від кроля, пацюка або хом'ячка. За альтернативним варіантом антигензв'язувальний домен може бути одержаний з людської послідовності. Окрім того, термін "моноклональне антитіло" у значенні, вживаному у цьому описі, може означати одноланцюговий Fv-фрагмент, який можна одержати шляхом об'єднання ДНК, яка кодує LCVR, і ДНК, яка кодує HCVR, з лінкерною послідовністю (дивись Плактан (Pluckthun), The Pharmacology of Monoclonal Antibodies, том 113, Розенбург (Rosenburg) та Мур (Moore) (редактори), SpringerVerlag, New York, стор.269-315, 1994). Слід розуміти, що, незалежно від того, чи вказуються конкретно фрагменти, термін "антитіло" у значенні, вживаному у цьому описі, включає такі фрагменти, а також одноланцюгові форми. Доти, доки білок зберігає здатність до специфічного або переважного зв'язування своєї гаданої мішені (тобто антигенної детермінанти або антигену), він входить до обсягу терміна "антитіло". Антитіла можуть бути або можуть не бути глікозилованими і, незважаючи на це, все ще знаходитись у межах цього винаходу. Словосполучення "популяція моноклональних антитіл" означає гомогенну або значною мірою гомогенну популяцію антитіл (тобто щонайменше приблизно 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, за варіантом, якому віддається більша перевага, щонайменше приблизно 97% чи 98% або за варіантом, якому віддається найбільша перевага, щонайменше 99% антитіл у згаданій популяції могли б конкурувати при проведенні твердофазного імуноферментного аналізу за той самий антиген або антигенну детермінанту) або за варіантом, якому віддається більша перевага, антитіла є ідентичними за амінокислотною послідовністю. Антитіла можуть бути або можуть не бути глікозилованими і, незважаючи на це, все ще знаходитись у межах цього винаходу. Моноклональні антитіла можуть бути гомогенними, якщо вони мають ідентичну амінокислотну послідовність, хоча вони мо 94245 14 жуть різнитись за посттрансляційною модифікацією, наприклад, схемою глікозилування. "Варіантне" антитіло означає у цьому описі молекулу, амінокислотна послідовність якої відрізняється від амінокислотної послідовності "вихідного" антитіла унаслідок додання, делеції та/або заміни одного або декількох амінокислотних залишків послідовності вихідного антитіла. За варіантом здійснення, якому віддається перевага, варіантне антитіло містить додання, делецію та/або заміну щонайменше однієї (наприклад, від однієї до приблизно десяти, а за варіантом, якому віддається перевага, 2, 3, 4, 5, 6, 7 або 8) амінокислоти на гіперваріабельних ділянках вихідного антитіла. Ідентичність або гомологія відносно послідовності варіантного антитіла визначається у цьому описі як відсоток амінокислотних залишків у послідовності варіантного антитіла, які є ідентичними із залишками вихідного антитіла після впорядкованого розміщення послідовностей і введення розривів, у разі необхідності, для досягнення максимального відсотка ідентичності послідовностей. Варіантне антитіло зберігає здатність до зв'язування антигену або за варіантом, якому віддається перевага, антигенної детермінанти, з якою зв'язується вихідне антитіло, і за варіантом, якому віддається перевага, має щонайменше одну властивість або біологічну активність, яка перевищує властивість або активність вихідного антитіла. Наприклад, варіантне антитіло за варіантом, якому віддається перевага, має більшу зв'язувальну спорідненість, меншу швидкість дисоціації, меншу ІС5о або підвищену здатність до пригнічення біоактивності антигену порівняно з вихідним антитілом. Варіантним антитілом, яке викликає особливий інтерес у цьому описі, є антитіло, яке демонструє щонайменше приблизно двократне, за варіантом, якому віддається перевага, щонайменше приблизно п'ятикратне, десятикратне або двадцятикратне посилення властивості або біоактивності, у разі порівняння з вихідним антитілом. «Вихідним» антитілом у цьому описі є антитіло, яке кодується амінокислотною послідовністю, яку застосовують для одержання варіантного антитіла. Вихідне антитіло може мати каркасну послідовність мишачого походження, однак за варіантом, якому віддається перевага, каркасна послідовність повністю або по суті повністю має людське походження. Вихідним антитілом може бути мишаче, химерне, гуманізоване або людське антитіло. Термін "специфічно зв'язується" у значенні, вживаному у цьому описі, означає ситуацію, за якої один член специфічної зв'язувальної пари значною мірою зв'язується лише з молекулами, які є його специфічним зв'язувальним партнером(ами). Згаданий термін вживається також у тому разі, наприклад, коли антигензв'язувальний домен антитіла за цим винаходом є специфічним для конкретної антигенної детермінанти, яку несе ряд антигенів. У цьому разі специфічне антитіло, яке несе антигензв'язувальний домен, буде здатним до зв'язування різних антигенів, які несуть згадану антигенну детермінанту. Відповідним чином, моноклональне антитіло за цим винаходом специфічно 15 зв'язує людський IL-17 (тобто IL-17A), у той час як воно специфічно не зв'язує людський IL-17B, IL17C, IL-17D, IL-17E, IL-17F. Окрім того, моноклональне антитіло за цим винаходом специфічно зв'язує людський IL-17 та IL-17 макак-крабоїдів, але специфічно не зв'язує IL-17 пацюків або IL-17 мишей. На додаток до цього, моноклональне антитіло за цим винаходом специфічно зв'язує нелінійну або конформаційну антигенну детермінанту людського IL-17, що містить амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276). але не зв'язує антигенної детермінанти людського IL-17, що не містить амінокислот DGNVDYH (ПОСЛІДОВНІСТЬ №276). Термін "переважно зв'язується" у значенні, вживаному у цьому описі, означає ситуацію, за якої антитіло зв'язує специфічний антиген щонайменше приблизно на 20% більше, за варіантом, якому віддається перевага, щонайменше на 50%, у 2 рази, 20 разів, 50 разів або 100 разів більше ніж воно зв'язує інший антиген, як визначається методами, доступними у цій галузі, наприклад, конкурентним ELISA або шляхом визначення KD за допомогою аналізу BIACORE або KINEXA. Антитіло може переважно зв'язувати одну антигенну детермінанту у межах антигену порівняно з іншою антигенною детермінантою у межах того самого антигену. Відповідним чином, антитіло за цим винаходом переважно зв'язує людський IL-17 порівняно з кролячим IL-17. Термін "антигенна детермінанта" означає частину молекули, яка може розпізнаватись і зв'язуватись антитілом на одному або декількох антигензв'язувальних центрах антитіла. Антигенні детермінанти часто складаються з хімічно активного поверхневого угруповання молекул, наприклад, амінокислот або бічних ланцюгів цукрів, і мають специфічні об'ємні структурні характеристики, а також специфічні зарядові характеристики. Словосполучення "пригнічення антигенної детермінанти" та/або "нейтралізація антигенної детермінанти" має відношення до антигенної детермінанти, наслідком зв'язування якої, у разі знаходження її у контексті інтактної молекули (у цьому разі, міостатину), антитілом, специфічним щодо згаданої антигенної детермінанти, є втрата або зниження біологічної активності молекули або організму, який містить згадану молекулу in vivo або in vitro. Термін "антигенна детермінанта", у значенні, вживаному у цьому описі, додатково означає частину поліпептиду, що має антигенну та/або імуногенну активність у тварини, за варіантом, якому віддається перевага, у ссавця, наприклад, миші або людини. Термін "антигенна детермінанта", у значенні, вживаному у цьому описі, визначається як частина поліпептиду, з якою може специфічно зв'язуватись антитіло, що визначається будь-яким методом, добре відомим у цій галузі, наприклад, традиційними імуноаналізами. Антигенні детермінанти не обов'язково повинні бути імуногенними, однак можуть бути імуногенними. Термін "імуногенна антигенна детермінанта", у значенні, вживаному у цьому описі, визначається як частина поліпептиду, яка викликає гуморальну імунну відповідь 94245 16 у тварини, що визначається будь-яким методом, відомим у цій галузі. «Нелінійна антигенна детермінанта» або «конформаційна антигенна детермінанта» містить несуміжні поліпептиди (або амінокислоти) у межах антигенного білка, з яким зв'язується антитіло, специфічне відносно згаданої антигенної детермінанти. Словосполучення "біологічна властивість" або "біологічна характеристика" чи терміни "активність" або "біологічна активність" по відношенню до антитіла за цим винаходом вживаються у цьому описі взаємозамінно і означають (але без обмеження) афінність і специфічність антигенної детермінанти/антигену, здатність нейтралізувати або антагонізувати активність IL-17 in vivo або in vitro, ІС50, in vivo стабільність антитіла та імуногенні властивості антитіла. Іншими визнаними у цій галузі біологічними властивостями або характеристиками антитіла, які піддаються встановленню, є наприклад, перехресна реактивність (тобто з нелюдськими гомологами пептиду-мішені або, взагалі, з іншими білками чи тканинами) і здатність до збереження високих рівнів експресії білка у клітинах ссавців. Вищезгадані властивості або характеристики можуть спостерігатись або визначатись чи оцінюватись за допомогою визнаних у цій галузі методів, у тому числі (але без обмеження) ELISA, конкурентного ELISA, аналізу поверхневого плазмонного резонансу BIACORE або KINEXA, аналізів нейтралізації in vitro та in vivo без обмеження, зв'язування рецептора, продукування та/або секреції цитокіна або фактора росту, трансдукції сигналів та імуногістохімії зі зрізами тканин із різних джерел, у тому числі від людини, примата або будьякого іншого джерела. Термін "пригнічувати" або "нейтралізувати" у значенні, вживаному у цьому описі відносно активності антитіла за цим винаходом, означає здатність значною мірою антагонізувати, пригнічувати, запобігати, стримувати, уповільнювати, переривати, ліквідувати, припиняти або обертати, наприклад, розвиток або тяжкість того, що пригнічується, у тому числі (але без обмеження) біологічної активності (наприклад, активності IL-17) або властивості, захворювання або стану. Ступінь пригнічення або нейтралізації активності IL-17 унаслідок зв'язування антитіла за цим винаходом з IL-17 за варіантом, якому віддається перевага, становить щонайменше приблизно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% або більше. Термін "виділена(-ий)" у разі вживання по відношенню до нуклеїнової кислоти або білка (наприклад, антитіла) означає нуклеїновокислотну молекулу або білок, яку(який) ідентифікують і відокремлюють від щонайменше однієї домішки, з якою вона(він) є зазвичай зв'язана(-ий) у її(його) природному джерелі. За варіантом, якому віддається перевага, "виділеним антитілом" є антитіло, яке є по суті вільним від інших антитіл, які мають інші антигенні специфічності (наприклад, фармацевтичні композиції за цим винаходом містять виділене антитіло, яке специфічно зв'язує IL-17 і є по суті вільними від антитіл, які специфічно зв'язують інші антигени окрім IL-17). 17 Терміни "позначення за Кеботом" та "номенклатура за Кеботом" вживаються у цьому описі взаємозамінно. Ці терміни, визнані у цій галузі, означають систему позначення амінокислотних залишків,які є більш змінними (тобто гіперваріабельними), аніж інші амінокислотні залишки у варіабельних ділянках важких і легких ланцюгів антитіла (Кебот (Kabat) та інші, Ann. NYAcad. Sci., 190:382-393 (1971); Кебот (Kabat) та інші, Sequences of Proteins of Immunological Interest, п'яте видання, U.S. Department of Health and Human Services, NIH Publication №91-3242 (1991)). Полінуклеотид є "функціонально зв'язаним" з іншим полінуклеотидом у разі його знаходження у функціональному взаємозв'язку з іншим полінуклеотидом. Наприклад, промотор або енхансер є функціонально зв'язаним із кодувальною послідовністю, якщо він впливає на транскрипцію послідовності. Пептид є "функціонально зв'язаним" з іншим пептидом, коли функціонально зв'язаними є полінуклеотиди, які їх кодують, за варіантом, якому віддається перевага, вони знаходяться у тій самій відкритій рамці зчитування. Терміни "індивід", "суб'єкт" і "хворий", які вживаються у цьому описі взаємозамінно, означають ссавця, у тому числі (але без обмеження) мишей, мавп, людей, сільськогосподарських тваринссавців, спортивних тварин-ссавців і хатніх тваринссавців; за варіантом, якому віддається перевага, цей термін означає людей. За певним варіантом здійснення суб'єкт, за варіантом, якому віддається перевага, людина, додатково характеризується захворюванням або розладом чи станом, для якого благотворною була б зменшена біологічна активність IL-17. Термін "вектор" означає нуклеїновокислотну молекулу, здатну до транспортування іншої нуклеїнової кислоти, з якою вона зв'язана, у тому числі (але без обмеження) плазміди і вектори на основі вірусного геному. Певні вектори здатні до автономної реплікації у клітині-хазяїні, до якої їх вводять, у той час як інші вектори можуть інтегруватись до геному клітини-хазяїна після введення до неї і, завдяки цьому, їх реплікація відбувається разом із геномом згаданої клітини. Більш того, певні вектори здатні до спрямування експресії генів, з якими вони функціонально зв'язані. Такі вектори у цьому описі називаються "рекомбінантними експресійними векторами" (або просто "експресійними векторами"), і зразкові вектори добре відомі у цій галузі. Словосполучення "клітина", "клітина-хазяїн", "клітинна лінія" та "культура клітин" вживаються у цьому описі взаємозамінно і означають окрему клітину або культуру клітин, яка є реципієнтом будь-якого виділеного полінуклеотиду за цим винаходом або будь-якого рекомбінантного(-их) вектора(-ів), що містить(-ять) послідовність, яка кодує HCVR, LCVR або моноклональне антитіло за цим винаходом. Клітини-хазяї являють собою нащадків однієї клітини-хазяїна, і нащадки не обов'язково можуть бути повністю ідентичними (за морфологією або за загальним комплементом ДНК) вихідній клітині-хазяїну унаслідок природної, випадкової або навмисної мутації та/або зміни. Клітина-хазяїн включає клітини трансформовані, трансдуковані 94245 18 або інфіковані in vivo або in vitro одним або декількома рекомбінантними векторами або полінуклеотидом, що експресує моноклональне антитіло за цим винаходом або його легкий чи важкий ланцюг. Клітина-хазяїн, що містить рекомбінантний вектор за цим винаходом (стабільно або нестабільно включений до хромосоми хазяїна), може також називатись "рекомбінантною клітиною-хазяїном". Переважними клітинами-хазяями для застосування за цим винаходом є клітини СНО (культура клітин яєчника китайського хом'ячка) (наприклад, АТСС (американська колекція типових культур) CRL-9096), клітини NS0, клітини SP2/0 та клітини COS (культура клітин яєчника мавпи) (наприклад, АТСС CRL-1650, CRL-1651), HeLa (АТСС CCL-2). Додатковими клітинами-хазяями для застосування за цим винаходом є рослинні клітини, дріжджові клітини, клітини інших ссавців і прокаріотні клітини. Визначення характеристик антитіла Цей винахід стосується виділених моноклональних антитіл, які специфічно зв'язують IL-17 (тобто IL-17A) з високою афінністю. Антитіла за цим винаходом за варіантом, якому віддається перевага, є химерними, гуманізованими або людськими антитілами абр їхніми антигензв'язувальними доменами. На додаток до цього, антитіла за цим винаходом нейтралізують або антагонізують щонайменше одну біологічну активність IL-17 in vivo та/або in vitro. Специфічне зв'язування моноклональних антитіл проти IL-17 за цим винаходом (у тому числі їхніх антигензв'язувальних доменів) з IL-17 дозволяє застосовувати згадані антитіла як терапевтичний засіб для пов'язаних з IL-17 захворювань або розладів, тобто станів, захворювань або розладів, корисним для яких було б пригнічення біологічної активності IL-17. Антигенна детермінанта IL-17, з якою зв'язуються антитіла за цим винаходом, являє собою нелінійну антигенну детермінанту, яка містить амінокислоти ADGNVDYHMN (ПОСЛІДОВНІСТЬ №275), за варіантом, якому віддається більша перевага, амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276) людського IL-17. Антитіла, які зв'язують згадану антигенну детермінанту, специфічно і переважно зв'язують людський IL-17 та IL-17 макак-крабоїдів, порівняно з їх зв'язуванням IL-17 мишей або IL-17 пацюків. Моноклональні антитіла за цим винаходом зв'язують людський IL-17 щонайменше у 5 разів, 10 разів, 20 разів, 30 разів, 40 разів, 50 разів, 60 разів, 70 разів, 80 разів, 90 разів або 100 разів сильніше (наприклад, з більшою спорідненістю або більшою специфічністю) порівняно зі ступенем їх зв'язування IL-17 мишей або IL-17 пацюків; за варіантом, якому віддається більша перевага, щонайменше у 150 разів, 200 разів, 250 разів, 300 разів, 350 разів, 400 разів, 450 разів, 500 разів, 550 разів або 600 разів сильніше порівняно зі ступенем їх зв'язування IL-17 мишей або IL-17 пацюків; за варіантом, якому віддається ще більша перевага, вони зв'язують IL-17 мишей або IL-17 пацюків на рівнях, які не перевищують фонові рівні, що визначається, наприклад, ELISA, конкурентним ELISA або значеннями KD, які визначають за допомогою аналізу BIACORE або KINEXA. 19 За варіантом здійснення, якому віддається перевага, цей винахід пропонує моноклональне антитіло проти IL-17, яке має сильну зв'язувальну спорідненість до людського IL-17, тобто зв'язує людський IL-17 або його частину, яка містить DGNVDYH (ПОСЛІДОВНІСТЬ №276) [тобто антитіло контактує з DGNVDYH (ПОСЛІДОВНІСТЬ №276) поліпептидом], із зв'язувальною спорідненістю (Κβ) до людського IL-17 меншою за приблизно 7пМ, 6,5пМ або 6пМ, за варіантом, якому віддається перевага, меншою за приблизно 5,5пМ, 5пМ або 4,5пМ і за варіантом, якому віддається найбільша перевага, меншою за приблизно 4пМ. За альтернативним варіантом антитіла за цим винаходом відрізняються KD до людського IL-17, яке не перевищує приблизно 7пМ, 6,5пМ або 6пМ, за варіантом, якому віддається перевага, не перевищує приблизно 5,5пМ, 5пМ або 4,5пМ і за варіантом, якому віддається найбільша перевага, не перевищує приблизно 4пМ. Спорідненість антитіл може визначатись, як описано у прикладах, наведених нижче, або за допомогою інших методів, доступних у цій галузі. За варіантом, якому віддається перевага, антитіла проти IL-17 за цим винаходом, які мають сильну зв'язувальну спорідненість, як описано вище, зв'язують також нелінійну антигенну детермінанту людського IL-17, що містить амінокислоти ADGNVDYHMN (ПОСЛІДОВНІСТЬ №364275), за варіантом, якому віддається більша перевага, амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276), де згадане антитіло контактує з поліпептидом DGNVDYH (ПОСЛІДОВНІСТЬ №276). За одним із варіантів здійснення антитіла за цим винаходом мають швидкість дисоціації (koff) з людським IL-17 меншу за 5×10-5с-1, 4×10-5с-1, 3×105 -1 с або 2×10-5с-1. За варіантом, якому віддається перевага, антитіла за цим винаходом, які відрізняються сильною зв'язувальною спорідненістю до людського IL-17, як описано вище у цьому описі (значення KD менше за приблизно 7пМ або 6пМ, за варіантом, якому віддається перевага, менше за приблизно 5пМ або 4,5пМ і за варіантом, якому віддається найбільша перевага, менше за приблизно 4пМ), також мають швидкість дисоціації (koff) з людським IL-17 меншу за 5×10-5с-1, 4×10-5c-1, 3×105 -1 с або 2×10-5с-1, і за варіантом, якому віддається ще більша перевага, також зв'язують нелінійну антигенну детермінанту людського IL-17, яка містить амінокислоти ADGNVDYHMN (ПОСЛІДОВНІСТЬ №275), за варіантом, якому віддається більша перевага, амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №367-276) людського IL-17. За іншим варіантом здійснення антитіла за цим винаходом мають ІС50 меншу за 1нМ, 900пМ, 800пМ, 700пМ, 650пМ, 600пМ, 560пМ, 550пМ або 500пМ у, наприклад, in vitro аналізі IL-8 "репортерної" групи або меншу за приблизно 560пМ у аналізі GROα «репортерної» групи (дивись Приклад 6). За варіантом, якому віддається ще більша перевага, антитіла за цим винаходом відрізняються сильною зв'язувальною спорідненістю до людського IL-17, як описано вище (значення KD менше за приблизно 7пМ або 6пМ, за варіантом, якому віддається перевага, менше за приблизно 5пМ або 4,5пМ і за варіантом, якому віддається найбільша перевага, 94245 20 менше за приблизно 4пМ), а також мають ІС50 меншу за 1нМ, 900пМ, 800пМ, 700пМ, 650пМ, 600пМ, 560пМ, 550пМ або 500пМ у, наприклад, in vitro аналізі IL-8 "репортерної" групи або меншу за приблизно 560пМ у аналізі GROα «репортерної» групи і за варіантом, якому віддається ще більша перевага, також мають швидкість дисоціації (код) з людським IL-17 меншу за 5×10-5с-1, 4×10-5 с-1, 3×105 -1 с або 2×10-5с-1, і за варіантом, якому віддається ще більша перевага, також зв'язують нелінійну антигенну детермінанту людського IL-17, яка містить амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №367-276) людського IL-17, де згадане антитіло контактує з DGNVDYH (ПОСЛІДОВНІСТЬ №276) поліпептидом. Варіантом здійснення цього винаходу, якому віддається найбільша перевага, є антитіло проти IL-17, яке містить амінокислотну послідовність легкого ланцюга, представлену ПОСЛІДОВНІСТЮ №279, і амінокислотну послідовність важкого ланцюга, представлену ПОСЛІДОВНІСТЮ №280. За варіантом, якому віддається перевага, це антитіло містить два ідентичні легкі ланцюги і два ідентичні важкі ланцюги. За варіантом, якому віддається перевага, легкий ланцюг з амінокислотною послідовністю, яка представлена ПОСЛІДОВНІСТЮ №279, кодується нуклеїновою кислотою, яка має послідовність, представлену ПОСЛІДОВНІСТЮ №281 (з включенням сигнальної послідовності) або ПОСЛІДОВНІСТЮ №283 (без сигнальної послідовності). За варіантом, якому віддається перевага, важкий ланцюг з амінокислотною послідовністю, яка представлена ПОСЛІДОВНІСТЮ №280, кодується нуклеїновою кислотою, яка має послідовність, представлену ПОСЛІДОВНІСТЮ №282 (з включенням сигнальної послідовності) або ПОСЛІДОВНІСТЮ №284 (без сигнальної послідовності). Моноклональні антитіла ("mAbs") можна одержати за допомогою методу гібридом, широко відомого у цій галузі (дивись, наприклад, Колер (КоЫег) та інші, Nature, 256:495, 1975) або їх можна одержати методами рекомбінантних ДНК (наприклад, за патентом США №4,816,567). Взагалі, гібридому можна одержати шляхом злиття відповідної лінії імморталізованих клітин (наприклад, лінії клітин мієломи, наприклад, SP2/0) з клітинами імунізованих тварин, які продукують антитіла. Клітини, які продукують антитіла, за варіантом, якому віддається перевага, клітини селезінки або лімфовузлів, одержують від тварин, імунізованих антигеном, який становить інтерес. Гібридні клітини (гібридоми) можна виділити шляхом селективного культивування і клонувати методом серійних розведень. Культуральне середовище, у якому вирощують клітини гібридом, аналізують на продукування моноклональних антитіл, спрямованих проти згаданого антигену. За варіантом, якому віддається перевага, зв'язувальну специфічність моноклональних антитіл (mAb), які продукуються клітинами гібридом, визначають імунопреципітацією або аналізом зв'язування in vitro. наприклад, радіоімуноаналізом або ELISA. Клітини, які продукують антитіла з бажаними зв'язувальними властивостями, можуть відбиратись за допомогою від 21 повідного відбіркового аналізу. Методи такого виділення і відбирання є добре відомими у цій галузі. Можуть застосовуватись інші придатні методи одержання або виділення антитіл за цим винаходом, у тому числі людських або штучних антитіл, у тому числі, наприклад, методи, за допомогою яких відбирають рекомбінантне антитіло (наприклад, одноланцюгове Fv або Fab) із бібліотеки, або які базуються на імунізації трансгенних тварин (наприклад, мишей), здатних до продукування репертуару людських антитіл (дивись, наприклад, Джакобовіц (Jakobovits) та інші, Рrос. Natl. Acad. Sci. USA, 90:2551-2555, 1993; Джакобовіц (Jakobovits) та інші, Nature, 362:255-258, 1993; патент США №5,545,806; патент США №5,545,807). Цим винаходом і терміном "антитіло" передбачаються також одноланцюгові антитіла та химерні, гуманізовані або приматизовані (CDRтрансплантовані) антитіла, а також химерні або CDR-трансплантовані одноланцюгові антитіла тощо, які містять частини, одержані від різних видів. Різні частини цих антитіл можуть об'єднуватись хімічним шляхом за допомогою традиційних методів, синтетичним шляхом або одержуватись у вигляді безперервного білка за допомогою генноінженерних методів. Наприклад, для продукування безперервного білка можуть експресуватись нуклеїнові кислоти, що кодують химерний або гуманізований ланцюг. Дивись, наприклад, патент США №4,816,567; Європатент №125,023 В1; Патент США №4,816,397; Європатент №120,694 В1; WO 86/01533; Європатент №194,276 В1; Патент США №5,225,539; Європатент №239,400 В1 та патенти США №5,585,089 та №5,698,762. На додаток до цього функціональні фрагменти антитіл (тобто антигензв'язувальні фрагменти), у тому числі фрагменти химерних, гуманізованих, приматизованих або одноланцюгових антитіл можуть також продукуватись і входити до обсягу цього винаходу. Функціональні фрагменти, яким віддається перевага, зберігають антигензв'язувальну функцію відповідного непроцесованого антитіла. Функціональні фрагменти, яким віддається особлива перевага, зберігають здатність до пригнічення однієї або декількох функцій або біоактивностей, характерних для зрілого IL-17 ссавців, за варіантом, якому віддається перевага, людського IL-17, наприклад, зв'язувальної активності, сигнальної активності та/або стимулювання або пригнічення клітинної відповіді. Наприклад, за одним із варіантів здійснення, функціональний фрагмент може пригнічувати взаємодію зрілого IL-17 з його рецептором та/або може пригнічувати одну або декілька функцій, опосередкованих рецептором. Частини або фрагменти антитіл, здатні до зв'язування людського IL-17, включають (але без обмеження) Fv, Fab, Fab' та F(аb')2-фрагменти і охоплюються цим винаходом. Такі фрагменти можуть продукуватись шляхом ферментативного розщеплення або методами рекомбінантних ДНК. Наприклад, шляхом розщеплення папаїном або пепсином можна одержати Fab- або F(аb')2фрагменти відповідно. Результатом розщеплення антитіл папаїном є одержання двох ідентичних антигензв'язувальних фрагментів, які називають 94245 22 «Fаb»-фрагментами, кожен з яких має один антигензв'язувальний домен. Fab-фрагмент містить також константний домен легкого ланцюга і перший константний домен (СН1) важкого ланцюга. Наслідком обробки пепсином є одержання F(аb')2фрагмента, який має два антигензв'язувальних центри і все ще зберігає здатність до перехресного зв'язування антигену. Fv являє собою мінімальний фрагмент, який містить повний антигенрозпізнавальний і антигензв'язувальний центр антитіла. Згаданий центр являє собою димер, який складається з одного варіабельного домену важкого ланцюга і одного варіабельного домену легкого ланцюга, які знаходяться у тісному нековалентному зв'язку. Саме у цій конфігурації три гіперваріабельні ділянки кожного варіабельного домену взаємодіють із утворенням антигензв'язувального центру на поверхні VH-VL димеру. Шість гіперваріабельних ділянок сукупно визначають антигензв'язувальну специфічність антитіла. Для подолання схильності нековалентно зв'язаних HCVR та LCVR доменів у Fv до дисоціації у разі коекспресії у клітині-хазяїні може бути сконструйований одноланцюговий Fvфрагмент (scFv), у якого гнучкий поліпептид відповідної довжини зв'язує С-кінець HCVR з N-кінцем LCVR або С-кінець LCVR з N-кінцем HCVR. Найпоширенішим лінкером є пептид довжиною у 15 залишків (Gly4Ser)3. Огляд sFv дивись у Плактан (Pluckthun), The Pharmacology of Monoclonal Antibodies, том 113, Розенбург (Rosenburg) та Мур (Мооrе) (редактори), Springer-Verlag, New York, стор.269-315, (1994). Антитіла можуть також продукуватись у вигляді різноманітних скорочених форм за допомогою генів антитіл, до яких у 3'-5'напрямку відносно природного стоп-сайта був введений один або декілька стоп-кодонів. Наприклад, химерний ген, який кодує частину важкого ланцюга F(ab')2, може конструюватись таким чином, щоб включати послідовності ДНК, які кодують СН1 домен і шарнірну ділянку важкого ланцюга. Вибір фрагментів антитіл із бібліотек за допомогою методів збагачення, наприклад, проявлення у фагах (Меттьюз Д.Дж. (Matthews D.J.), Уеллс Дж.А. (Wells J.Α.), Science, 260:1113-7, 1993), проявлення у рибосомах (Хейнс (Hanes) та інші, Ргос. Nail. Acad. Sci. (USA), 95:14130-5, 1998), проявлення у бактеріях (Семюелсон П. (Samuelson P.) та інші, Journal of Biotechnology, 96:129-154, 2002) або проявлення у дріжджах (Кік М.К. (Kieke M.C.) та інші, Protein Engineering, 10:1303-1310, 1997), виявився успішною альтернативою класичній гібридомній технології (нещодавня оглядова стаття: Літл М. (Little Μ.) та інші, Immunology Today, 21:364-370, 2000). Варіантні антитіла Вихідним антитілом може бути мишаче моноклональне антитіло або людське антитіло (яке одержали, наприклад, у трансгенній миші), яке одержали проти IL-17. Вихідне антитіло може додатково змінюватись для одержання химерної або гуманізованої форми антитіла чи іншої варіантної форми антитіла за допомогою методів, доступних у цій галузі, наприклад, ПЛР мутагенезу. Такі химерні, гуманізовані або іншим чином змінені 23 антитіла можуть правити за вихідні антитіла для додаткової варіації або мутагенезу. Вихідні антитіла за цим винаходом можуть додатково зазнавати мутагенезу, наприклад, у межах гіперваріабельної ділянки(-ок) (дивись, наприклад, Таблицю 2 і Таблицю 3) для одержання варіантних антитіл, які можуть перевірятись на присутність властивості, яка становить інтерес, наприклад, зв'язувальної спорідненості (нижче значення ΚD), IC50, специфічності, переважного зв'язування тощо. За варіантом, якому віддається перевага, властивістю, яка становить інтерес у варіантного антитіла є поліпшення порівняно з властивістю вихідного антитіла. Перевага віддається варіантному антитілу із амінокислотною заміною, у якого щонайменше 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 амінокислотних залишків молекули вихідного антитіла були видалені, і на їх місце вставлені інші залишки. Сайтом найбільшого інтересу для замісного мутагенезу є одна або декілька гіперваріабельних ділянок, однак передбачаються також зміни каркасної ділянки. Перевага віддається замінам консервативних амінокислот, хоча, для більш суттєвих змін можуть вводитись заміни неконсервативних амінокислот з перевіркою одержаних антитіл на властивість, яка становить інтерес. Зручним способом одержання замісних варіантів є "визрівання афінності" із застосуванням проявлення у фагах. Стисло, одну або декілька гіперваріабельних ділянок полінуклеотидної молекули, що кодує вихідне антитіло, піддають мутації із здійсненням усіх можливих амінокислотних замін на кожному амінокислотному залишку, на якому бажаним є здійснення заміни. Варіанти антитіл, які одержують таким чином, проявляються моновалентним чином із нитчастих фагових частинок як гібриди з продуктом гена III Μ13, які заповнюють кожну частинку. Після цього варіанти з проявленням у фагах перевіряють на їхню біологічну активність (наприклад, зв'язувальну спорідненість, специфічність, ІС50). Для ідентифікування сайтівкандидатів гіперваріабельної ділянки для модифікування може здійснюватись мутагенез методом ідентифікування аланіну для ідентифікування залишків гіперваріабельної ділянки, які значною мірою сприяють зв'язуванню антигену. За альтернативним варіантом або на додаток до цього корисним може бути проведення аналізу кристалічної структури комплексу антиген-антитіло для ідентифікування ділянок контактування між антитілом і IL-17. Такі контактні залишки і сусідні залишки є кандидатами на заміну за методами, розробленими за цим винаходом або відомими у цій галузі. За альтернативним варіантом або на додаток до цього неспецифічний мутагенез або точковий мутагенез може здійснюватись на одній або декількох полінуклеотидних молекулах, які кодують щонайменше одну гіперваріабельну ділянку. Мутагенез може здійснюватись у одному або декількох положеннях у той час, коли CDR є функціонально зв'язаною з каркасною ділянкою у межах варіабельної ділянки, або у той час, коли CDR є незалежною від іншої послідовності варіабельної ділянки з подальшим повертанням зміненої CDR до варіабельної ділянки за допомогою методу ре 94245 24 комбінантних ДНК. Після одержання таких варіантних антитіл панель варіантів піддають перевірці на властивість або активність, яка становить інтерес, і антитіла з найкращими властивостями у одному або декількох відповідних аналізах можуть відбиратись для додаткової розробки. Будь-який залишок цистеїну, не залучений до підтримання відповідної конформації антитіла проти IL-17 за цим винаходом, може замінюватись, як правило, на серин, для поліпшення стійкості згаданої молекули до окиснення та запобігання хибного перехресного зв'язування. І, навпаки, цистеїновий(-і) зв'язок(-ки) може(-уть) додаватись до згаданого антитіла для поліпшення його стійкості (зокрема, коли згадане антитіло являє собою фрагмент антитіла, наприклад, Fv-фрагмент). Амінокислотний варіант згаданого антитіла іншого типу змінює вихідну схему глікозилування згаданого антитіла. Термін "змінює" означає видалення однієї або декількох вуглеводних складових, присутніх у складі антитіла, та/або додання одного або декількох сайтів глікозилування, не присутніх у вихідному антитілі. Глікозилування антитіл є, як правило, N-зв'язаним або О-зв'язаним. N-зв'язане означає приєднання вуглеводної складової до бічного ланцюга залишку аспарагіну. Трипептидні послідовності аспарагін-Х-серин та аспарагін-Хтреонін, де X являє собою будь-яку амінокислоту окрім проліну, є визнаними послідовностями для ферментативного приєднання вуглеводної складової до бічного ланцюга аспарагіну. Таким чином, присутність будь-якої із цих трипептидних послідовностей у поліпептиді створює потенційний сайт глікозилування. О-зв'язане глікозилування означає приєднання одного із цукрів, Nацетилгалактозаміну, галактози або ксилози, до оксіамінокислоти, найчастіше, серину або треоніну, хоча застосовуватись може також 5гідроксипролін або 5-гідроксилізин. Додання сайтів глікозилування до антитіла, як правило, супроводжується зміною амінокислотної послідовності таким чином, що вона містить одну або декілька з вищеописаних трипептидних послідовностей (для N-зв'язаних сайтів глікозилування). Зміна може також здійснюватись шляхом додання або заміни одного або декількох залишків серину або треоніну на послідовність вихідного антитіла (для О-зв'язаних сайтів глікозилування). Послідовність Моноклональне антитіло за цим винаходом, якому віддається перевага, має LCVR, що містить пептид із послідовністю, вибраною з групи,яка включає ПОСЛІДОВНОСТІ №178-243, та/або HCVR, що містить пептид із послідовністю, вибраною з групи, яка включає ПОСЛІДОВНОСТІ №56121. За варіантом здійснення, якому віддається перевага, антитіло за цим винаходом містить LCVR, що являє собою пептид з послідовністю, вибраною з групи, до складу якої входять ПОСЛІДОВНОСТІ №178-243, і додатково містить HCVR, що являє собою пептид із послідовністю, вибраною з групи, до складу якої входять ПОСЛІДОВНОСТІ №56-121, де HCVR та LCVR, присутні у антитілі за цим винаходом, існують разом у Fab, наведених у Таблиці 1. Наприклад, антитіло за 25 цим винаходом, яке містить LCVR поліпептид з амінокислотною ПОСЛІДОВНІСТЮ №178, за варіантом, якому віддається перевага, додатково містить HCVR поліпептид, який містить амінокислотну послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №56, №60, №68-93 та №95. На додаток до цього, антитіло за цим винаходом, яке містить LCVR поліпептид з амінокислотною ПОСЛІДОВНІСТЮ №241, за варіантом, якому віддається перевага, додатково містить HCVR поліпептид, який містить амінокислотну послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №118 та №106. Досвідченому фахівцю буде зрозуміло, що антитіла за цим винаходом не обмежуються вказаними послідовностями HCVR та LCVR, які представлені у наведеній у цьому описі Таблиці 1, але включають також варіанти цих послідовностей, які, у разі присутності у антитілі проти IL-17 за цим винаходом, зберігають або мають поліпшену антигензв'язувальну здатність та щонайменше одну з інших функціональних властивостей вихідного антитіла, наприклад, специфічність антигенної детермінанти, здатність до конкурування з вихідним антитілом за зв'язування з IL-17, значення ІС5о та/або Кр чи k^ для зв'язування людського IL-17. На додаток до цього моноклональне антитіло за цим винаходом являє собою антитіло, зв'язування якого з людським IL-17 (або його частиною, що містить DGNVDYH (ПОСЛІДОВНІСТЬ №276» конкурентно пригнічується конкурентним моноклональним антитілом, яке містить два поліпептиди з амінокислотними послідовностями, представленими ПОСЛІДОВНОСТЯМИ №241 (LCVR) та №118 (HCVR). Таке конкурентне пригнічення між антитілами може визначатись за допомогою аналізів, відомих у цій галузі, наприклад, за допомогою конкурентного ELISA. За варіантом, якому віддається перевага, антитіло за цим винаходом, яке конкурує з конкурентним антитілом, визначеним вище, додатково відрізняється специфічним зв'язуванням з IL-17, і не зв'язуванням з IL-17B, IL-17C, IL-17D, IL-17E або IL-17F. На додаток до цього, антитіло відрізняється специфічним зв'язуванням людського IL-17 та IL-17 макак-крабоїдів, але не зв'язуванням 1L-17 пацюків або IL-17 мишей на рівнях, які перевищують фонові. За варіантом, якому віддається більша перевага, антитіло за цим винаходом, яке конкурує за зв'язування людського IL-17 з конкурентним антитілом, яке містить амінокислотні послідовності, представлені ПОСЛІДОВНОСТЯМИ №241 та №118, додатково відрізняється зв'язуванням нелінійної антигенної детермінанти людського IL-17, що містить амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276). За варіантом, якому віддається ще більша перевага, антитіло за цим винаходом, яке конкурує за зв'язування людського IL-17 з конкурентним антитілом, яке містить амінокислотні послідовності, представлені ПОСЛІДОВНОСТЯМИ №241 та №118, додатково відрізняється KD до людського IL-17, меншою за приблизно 7пМ, 6,5пМ або 6рМ, за варіантом, якому віддається перевага, меншою за приблизно 5,5пМ, 5пМ або 4,5пМ, і за варіантом, якому віддається найбі 94245 26 льша перевага, меншою за приблизно 4пМ, а також має IC50, за варіантом, якому віддається перевага, у in vitro аналізі IL-8 "репортерної" групи, меншу за 700пМ, 650пМ, 600пМ, 560пМ, 550пМ або 500пМ чи ІС50, У in vitro аналізі GROα «репортерної» групи, меншу за приблизно 560пМ та/або має швидкість дисоціації (koff) з людським IL-17 меншу за 5×10-5с-1, 4×10-5с-1, 3×10-5с-1 або 2×10-5с-1. За одним із варіантів здійснення антитіло проти 1L-17 за цим винаходом має варіабельну ділянку важкого ланцюга і варіабельну ділянку легкого ланцюга, де варіабельна ділянка важкого ланцюга містить гіперваріабельні ділянки з наведеними нижче амінокислотними послідовностями: CDRH1 (ПОСЛІДОВНІСТЬ №244), CDRH2 (ПОСЛІДОВНІСТЬ №245) та CDRH3 (ПОСЛІДОВНІСТЬ №246), та/або де варіабельна ділянка легкого ланцюга містить гіперваріабельні ділянки з наведеними нижче амінокислотними послідовностями: CDRL1 (ПОСЛІДОВНІСТЬ №247), CDRL2 (ПОСЛІДОВНІСТЬ №248) та CDRL3 (ПОСЛІДОВНІСТЬ №249). За варіантом, якому віддається перевага, шість гіперваріабельних ділянок антитіла за цим винаходом існують разом, як представлено у Fab, наведених у представленій у цьому описі Таблиці 1. За варіантом, якому віддається ще більша перевага, гіперваріабельні ділянки важкого ланцюга знаходяться у контексті наведених нижче каркасних послідовностей: FR1 з ПОСЛІДОВНІСТЮ №262, FR2 з ПОСЛІДОВНІСТЮ №263, FR3 з ПОСЛІДОВНІСТЮ №264 та FR4 з ПОСЛІДОВНІСТЮ №265, а гіперваріабельні ділянки легкого ланцюга знаходяться у контексті наведених нижче каркасних послідовностей: FR1 з ПОСЛІДОВНІСТЮ №266, FR2 з ПОСЛІДОВНІСТЮ №267, FR3 з ПОСЛІДОВНІСТЮ №268 та FR4 з ПОСЛІДОВНІСТЮ №269, де порядок з амінокінця є таким: FR1-CDR1-FR2CDR2-FR3-CDR3-FR4. Додатково передбачається, що антитіло проти IL-17 за цим винаходом містить HCVR, яке містить CDRH1, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №11-28, та/або CDRH2, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №29-32, та/або CDRH3, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №33-55 та №261. За іншим варіантом здійснення антитіло проти IL-17 за цим винаходом містить LCVR, що містить CDRL1, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №122-149, та/або CDRL2, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №150-167, та/або CDRL3, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №168177. За варіантом, якому віддається перевага, антитіло проти IL-17 за цим винаходом містить HCVR, що містить CDRH1, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №11-28, та/або CDRH2, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №29-32, та/або CDRH3, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №33-55 та №261, і додатково містить LCVR, що містить CDRL1, що 27 містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №122-149, та/або CDRL2, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №150167, та/або CDRL3, що містить послідовність, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ №168-177. Структурою для розміщення CDR за цим винаходом буде, як правило, послідовність важкого або легкого ланцюга антитіла або значна їхня частина, у якій CDR займає положення, яке відповідає номенклатурі Кебота. Три гіперваріабельні ділянки (CDR) кожного ланцюга, легкого і важкого, надаються у межах каркасної ділянки як прилегла безперервна послідовність, представлена наведеною нижче формулою: FR1-CDR1-FR2-CDR2-FR3CDR3-FR4. FR1, FR2, FR3 та FR4 важкого ланцюга або легкого ланцюга об'єднуються з утворенням повної каркасної ділянки антитіла у разі розміщення у вигляді прилеглої безперервної послідовності з гіперваріабельними ділянками у зазначеному порядку. За варіантом, якому віддається перевага, каркасні ділянки антитіла за цим винаходом мають людське або по суті людське походження (тобто більше ніж на приблизно 80%, 82%, 85%, 87%, 90%, 92%, 95%, 97%). У гуманізованого антитіла, призначеного для терапевтичного застосування на людях, каркасна послідовність за варіантом, якому віддається перевага, має повністю або значною мірою людське походження. За варіантом, якому віддається перевага, каркасна ділянка легкого ланцюга гуманізованого, людського або химерного антитіла за цим винаходом складається з FR1 з ПОСЛІДОВНІСТЮ №266, FR2 з ПОСЛІДОВНІСТЮ №267, FR3 з ПОСЛІДОВНІСТЮ №268 і FR4 з ПОСЛІДОВНІСТЮ №269. За варіантом, якому віддається перевага, каркасна ділянка важкого ланцюга гуманізованого, людського або химерного антитіла за цим винаходом складається з FR1 з ПОСЛІДОВНІСТЮ №262, FR2 з ПОСЛІДОВНІСТЮ №263, FR3 з ПОСЛІДОВНІСТЮ №264 і FR4 з ПОСЛІДОВНІСТЮ №265. Наприклад, варіант LCVR антитіла 126 за цим винаходом, якому віддається перевага, як описано у наведених у цьому описі Таблиці 1, Таблиці 2 і Таблиці 3, містить (поліпептиди у порядку з Nкінця) FR1 з ПОСЛІДОВНІСТЮ №266, CDR1 з ПОСЛІДОВНІСТЮ №131, FR2 з ПОСЛІДОВНІСТЮ №267, CDR2 з ПОСЛІДОВНІСТЮ №167, FR3 з ПОСЛІДОВНІСТЮ №268, CDR3 з ПОСЛІДОВНІСТЮ №168 і FR4 з ПОСЛІДОВНІСТЮ №269. Послідовність LCVR у цілому, функціонально зв'язана з константною ділянкою людського ланцюга типу каппа, представлена ПОСЛІДОВНІСТЮ №274. На додаток до цього, варіант HCVR антитіла 126 за цим винаходом, якому віддається перевага, містить (у порядку з N-кінця) FR1 з ПОСЛІДОВНІСТЮ №262, CDR1 з ПОСЛІДОВНІСТЮ №26, FR2 з ПОСЛІДОВНІСТЮ №262, CDR2 з ПОСЛІДОВНІСТЮ №ЗО, FR3 з ПОСЛІДОВНІСТЮ №264, CDR3 з ПОСЛІДОВНІСТЮ №52 і FR4 з ПОСЛІДОВНІСТЮ №265. Послідовність HCVR у цілому, функціонально зв'язана з Fc-фрагментом людського IgG4, представлена ПОСЛІДОВНІСТЮ №273. 94245 28 За одним із варіантів здійснення антитіло проти IL-17 за цим винаходом, де уся або частина варіабельної ділянки обмежується конкретною послідовністю, яка представлена наведеною у цьому описі ПОСЛІДОВНІСТЮ (дивись, наприклад, Таблиці 1-3), додатково відрізняється тим, що воно являє собою химерне, гуманізоване або повністю людське антитіло або його антигензв'язувальний домен, що антагонізує або нейтралізує щонайменше одну активність людського IL-17 in vivo або in vitro. Антитіло проти IL-17 за цим винаходом, де уся або частина варіабельної ділянки обмежується конкретною послідовністю, яка представлена наведеною у цьому описі ПОСЛІДОВНІСТЮ, додатково відрізняється специфічним зв'язуванням з IL-17 і не зв'язуванням з IL-17B, IL-17C, IL-17D, IL-17E або IL-17F. На додаток до цього, антитіло відрізняється специфічним зв'язуванням людського IL-17 та IL-17 макак-крабоїдів, але не зв'язуванням IL-17 пацюків або IL-17 мишей на рівнях, які перевищують фонові. За варіантом, якому віддається більша перевага, таке антитіло додатково відрізняється зв'язуванням нелінійної антигенної детермінанти людського IL-17, що містить амінокислоти DGNVDYH (ПОСЛІДОВНІСТЬ №276), де антитіло контактує з поліпептидом з ПОСЛІДОВНІСТЮ №276. За варіантом, якому віддається ще більша перевага, таке антитіло додатково відрізняється KD до людського IL-17 меншою за приблизно 7пМ, 6,5пМ або 6рМ, за варіантом, якому віддається перевага, меншою за приблизно 5,5пМ, 5пМ або 4,5пМ, і за варіантом, якому віддається найбільша перевага, меншою за приблизно 4пМ, та/або відрізняється ІС50, за варіантом, якому віддається перевага, у in vitro аналізі IL-8 "репортерної" групи, меншою за 700пМ, 650пМ, 600пМ, 560пМ, 550пМ або 500пМ, чи ІС50 y in vitro аналізі GROα «репортерної» групи, меншою за приблизно 560пМ, та/або має швидкість дисоціації (koff) з людським IL-17 меншу за 5×10"5 с"1, 4×10-5с-1, -5 -1 -5 -1 3×10 с або 2×10 с . Експресія антитіл Цей винахід спрямовано також на лінії клітин, що експресують моноклональне антитіло проти IL17 за цим винаходом або його частину. Одержання і виділення ліній клітин, що продукують моноклональне антитіло за цим винаходом, може здійснюватись за допомогою стандартних методів, відомих у цій галузі. Лініями клітин, яким віддається перевага, є COS (культура клітин яєчника мавпи), СНО (культура клітин яєчника китайського хом'ячка), SP2/0, NS0 та дріжджові клітини (доступні із загальнодоступних сховищ, наприклад, АТСС (Американська колекція типових культур), Manassas, штат Вірджинія). Для експресії антитіла за цим винаходом можуть застосовуватись найрізноманітніші експресійні системи-хазяї, у тому числі прокаріотні та еукаріотні експресійні системи (наприклад, дріжджі, бакуловірус, рослинні клітини, клітини ссавців та інших тварин, трансгенні тварини та клітини гібридом), а також експресійні системи проявлення у фагах. Прикладом відповідного бактеріального експресійного вектора є pUC119 і відповідним еукаріотним експресійним вектором є модифікова 29 ний вектор pcDNA3.1 з ослабленою системою вибору dhfr (дигідрофолатредуктаза). У цій галузі відомі також інші системи експресії антитіла і вони охоплюються цим винаходом. Антитіло за цим винаходом можна одержати шляхом рекомбінантної експресії імуноглобулінових генів легкого і важкого ланцюгів у клітиніхазяїні. Для експресії антитіла рекомбінантним шляхом, клітина-хазяїн трансформується, трансдукується, інфікується тощо одним або декількома векторами рекомбінантної експресії, що несуть фрагменти ДНК, які кодують імуноглобулінові легкі та/або важкі ланцюги антитіла таким чином, що згадані легкі та/або важкі ланцюги експресуються у клітині-хазяїні. Важкий ланцюг і легкий ланцюг можуть експресуватись незалежно з різних промоторів, з якими вони функціонально зв'язані, у одному векторі, або за альтернативним варіантом важкий ланцюг і легкий ланцюг можуть експресуватись незалежно з різних промоторів, з якими вони функціонально зв'язані, у двох векторах - один із них експресує важкий ланцюг і один із них експресує легкий ланцюг. Факультативно важкий ланцюг і легкий ланцюг можуть експресуватись у різних клітинах-хазяях. За варіантом, якому віддається перевага, рекомбінантні антитіла секретуються до середовища, у якому культивують клітини-хазяї, з якого антитіла можуть бути виділені або очищені. Стандартні методи рекомбінантних ДНК застосовуються для одержання генів важкого і легкого ланцюгів антитіла, включення цих генів до рекомбінантних експресійних векторів і введення цих векторів до клітин-хазяїв. Опис таких стандартних методів рекомбінантних ДНК наведено, наприклад, у Сембрук (Sambrook), Фріч (Fritsch), Маніатіс (Maniatis) (редактори), Molecular Cloning; A Laboratory Manual, друге видання, ColdSpring Harbor, N. Υ., 1989; Осбел (Ausubel) та інші (редактори) Current Protocols in Molecular Biology, Greene Publishing Associates, 1989. Виділена ДНК, що кодує HCVR, може бути перетворена на непроцесований ген важкого ланцюга шляхом функціонального зв'язування ДНК, що кодує HCVR, з іншою молекулою ДНК, що кодує константні ділянки важкого ланцюга (СН1, СН2 та СН3). Послідовності людських генів константної ділянки важкого ланцюга відомі у цій галузі. Дивись, наприклад, Кебот (Kabat) та інші, Sequences of Proteins of Immunological Interest, п'яте видання, U.S. Department of Health and Human Services, публікація NIH №91-3242 (1991). Фрагменти ДНК для цих ділянок можуть бути одержані, наприклад, шляхом стандартної ПЛР-ампліфікації. Константна ділянка важкого ланцюга може бути константною ділянкою будь-якого типу (наприклад, IgG, IgA, IgE, IgM або IgD), класу (наприклад, IgG1, IgG2, IgG3 та IgG4) або підкласу і будь-яким алотиповим варіантом, як описано у Кебот (supra). За альтернативним варіантом антигензв'язувальним фрагментом може бути Fab-фрагмент, Fab'-фрагмент, F(аb')2фрагмент, Fd-фрагмент або одноланцюговий Fvфрагмент (scFv). Для гена Fab-фрагмента важкого ланцюга, ДНК, що кодує HCVR, може функціонально зв'язуватись з іншою молекулою ДНК, що 94245 30 кодує лише константну ділянку СН1 важкого ланцюга. Виділена ДНК, що кодує LCVR, може бути перетворена на непроцесований ген легкого ланцюга (а також ген Fab-фрагмента легкого ланцюга) шляхом функціонального зв'язування ДНК, що кодує LCVR, з іншою молекулою ДНК, що кодує константну ділянку легкого ланцюга, CL. Послідовності людських генів константної ділянки легкого ланцюга відомі у цій галузі. Дивись, наприклад, Кебот (Kabat), supra. Фрагменти ДНК для цих ділянок можуть бути одержані, наприклад, шляхом стандартної ПЛР-ампліфікації. Константна ділянка легкого ланцюга може бути константною ділянкою легкого ланцюга типу каппа або лямбда. Для одержання scFv гена фрагменти ДНК, що кодують HCVR і LCVR, функціонально зв'язують з іншим фрагментом, який кодує гнучкий лінкер, наприклад, який кодує амінокислотну послідовність (Gly4-Ser)3, завдяки чому HCVR та LCVR послідовності можуть експресуватись як суміжний безперервний одноланцюговий білок із LCVR та HCVR ділянками, які з'єднуються гнучким лінкером. Дивись, наприклад, Берд (Bird) та інші, Science, 242:423-426, 1988; Хастон (Huston) та інші, Proc. Natl. Acad. Sci. USA, 85:5879-5883, 1988; Маккафферті (McCafferty) та інші, Nature, 348:552-554, 1990. За одним із варіантів здійснення цей винахід пропонує вектор, за варіантом, якому віддається перевага (але без обмеження), плазміду, рекомбінантний експресійний вектор, експресійний вектор на основі дріжджів або експресійний вектор на основі ретровірусу, який містить полінуклеотид, який кодує моноклональне антитіло проти IL-17 за цим винаходом. За альтернативним варіантом вектор за цим винаходом містить полінуклеотид, який кодує LCVR, та/або полінуклеотид, який кодує HCVR за цим винаходом. У разі, коли у одному й тому самому векторі присутні кодувальні послідовності як LCVR, так і HCVR, вони можуть бути транскрибовані незалежно, кожна з окремого промотору, з яким вона функціонально зв'язана. У разі, якщо послідовності, які кодують LCVR і HCVR, присутні у одному й тому самому векторі і транскрибуються з одного промотору, з яким вони обидві функціонально зв'язані, LCVR може знаходитись у 5' напрямку відносно HCVR або LCVR може знаходитись у 3' напрямку відносно HCVR. На додаток до цього, кодувальна ділянка LCVR і кодувальна ділянка HCVR у векторі може відокремлюватись лінкерною послідовністю будьякого розміру або вмісту. За варіантом, якому віддається перевага, такий лінкер, у разі присутності, являє собою полінуклеотид, який кодує внутрішній аміноацильний сайт рибосоми. Для експресії антитіла за цим винаходом ДНК, яка кодує частковий або повномірний легкий та/або важкий ланцюг, одержану, як було описано вище, вводять до експресійного вектора таким чином, що ген функціонально зв'язується з контрольними послідовностями транскрипції та трансляції. Експресійний вектор та контрольні послідовності експресії вибирають таким чином, щоб вони були сумісними із застосовуваними експресійними 31 клітинами-хазяями. Ген легкого ланцюга антитіла і ген важкого ланцюга антитіла можуть вводитись до окремих векторів або, за більш типовим варіантом, обидва гени вводять до одного й того самого експресійного вектора. Гени антитіла вводять до експресійного вектора за допомогою стандартних методів. На додаток до цього, рекомбінантний експресійний вектор може кодувати сигнальний пептид, що полегшує секрецію легкого та/або важкого ланцюга моноклонального антитіла проти IL17 з клітини-хазяїна. Ген легкого та/або важкого ланцюга моноклонального антитіла проти IL-17 може клонуватись у векторі таким чином, що сигнальний пептид виявляється функціонально зв'язаним у межах рамки зчитування з аміно-кінцем гена ланцюга антитіла. Сигнальним пептидом може бути імуноглобуліновий сигнальний пептид або гетерологічний сигнальний пептид. Окрім гена(-ів) важкого та/або легкого ланцюга антитіла, рекомбінантний експресійний вектор за цим винаходом несе регуляторні послідовності, що контролюють експресію гена(-ів) ланцюга антитіла у клітині-хазяїні. Термін "регуляторна послідовність" означає промотори, енхансери та інші контрольні елементи експресії (наприклад, сигнали поліаденілування) за потребою, що контролюють транскрипцію або трансляцію гена(-ів) ланцюга антитіла. Конструкція експресійного вектора, з включенням вибору регуляторних послідовностей, може залежати від таких факторів, як вибір клітини-хазяїна, яка зазнає трансформування, рівня експресії бажаного білка. Переважними регуляторними послідовностями для експресії клітинамихазяями ссавців є вірусні елементи, які забезпечують високі рівні експресії білка у клітинах ссавців, наприклад, промотори та/або енхансери, які одержують із цитомегаловірусу (CMV), мавпячого вірусу 40 (SV40), аденовірусу (наприклад, головний пізній промотор аденовірусу (AdMLP)) та вірусу поліоми. На додаток до генів важкого та/або легкого ланцюга антитіла і регуляторних послідовностей, рекомбінантні експресійні вектори за цим винаходом можуть нести додаткові послідовності, наприклад, послідовності, які регулюють реплікацію вектора у клітинах-хазяях (наприклад, точки початку реплікації) та один або декілька маркерних селектовних генів. Маркерні селектовні гени полегшують селекцію клітин-хазяїв, до яких було введено вектор. Наприклад, за типовим варіантом, маркерний селектовний ген наділяє стійкістю до лікарського засобу, наприклад, G418, гігроміцину або метотрексату, клітину-хазяїна, до якої було введено згаданий вектор. Маркерними селектовними генами, яким віддається перевага, є ген дигідрофолатредуктази (DHFR) (для застосування у клітинаххазяях без DHFR із селекцією/ампліфікацією метотрексатом), пео ген (для G418 селекції) та глютамат-аміак-лігази (GS) у лінії клітин, яким бракує GS (наприклад, NS0) для селекції/ампліфікації. Для експресії легких та/або важких ланцюгів експресійний(-ні) вектор(-и), що кодує(-ють) важкі та/або легкі ланцюги, вводять до клітини-хазяїна за допомогою стандартних методів, наприклад, шляхом електропорації, осадження фосфатом 94245 32 кальцію, трансфікування DEAE (діетиламіноетилцелюлоза)декстрану, трансдукування, інфікування тощо. Незважаючи на теоретичну можливість експресії антитіл за цим винаходом у прокаріотних або еукаріотних клітинах-хазяях, перевага віддається еукаріотним клітинам і за варіантом, якому віддається найбільша перевага, клітинам-хазяям ссавців, оскільки такі клітини з більшою ймовірністю складають і секретують відповідно укладене і імунологічно активне антитіло. Клітинами-хазяями ссавців для експресії рекомбінантних антитіл за цим винаходом, яким віддається перевага, є клітини яєчника китайського хом'ячка (клітини СНО) [у тому числі dhfr-CHO клітини, опис яких наведено у роботі Урлауб (Urlaub) і Чейсін (Chasin), Proc. Natl. Acad. Sci. USA, 77:4216-4220, 1980, які застосовуються з DHFR селектовним маркером, наприклад, як описано у Кауфман (Kaufman) і Шарп (Sharp), J. Моl. Віоl., 159:601-621, 1982], клітини мієломи лінії NS0, клітини COS та клітини SP2/0. У разі, коли рекомбінантні експресійні вектори, які кодують гени антитіла, вводять до клітин-хазяїв ссавців, антитіла продукуються шляхом культивування клітин-хазяїв впродовж періоду часу, достатнього для забезпечення експресії згаданого антитіла у клітинах-хазяях, або за варіантом, якому віддається більша перевага, секреції антитіла до культурального середовища, у якому клітини-хазяї вирощують за відповідних умов, відомих у цій галузі. Антитіла можуть виділятись із клітини-хазяїна та/або культурального середовища за допомогою стандартних методів очищення. Клітини-хазяї можуть також застосовуватись для продукування частин або фрагментів інтактних антитіл, наприклад, Fab-фрагментів або scFv молекул, за традиційними методами. Досвідченому фахівцю буде зрозуміло, що варіанти вищезгаданих методів входять до обсягу цього винаходу. Наприклад, може виникнути необхідність трансфікування клітини-хазяїна ДНК, яка кодує легкий ланцюг або важкий ланцюг антитіла за цим винаходом. Метод рекомбінантних ДНК може також застосовуватись для видалення певної частини або усієї ДНК, яка кодує будь-який або обидва (легкий і важкий) ланцюги, які не є необхідними для зв'язування з IL-17. Молекули, що експресуються такими скороченими молекулами ДНК, також належать до антитіл за цим винаходом. Цей винахід пропонує клітину-хазяїна, яка містить нуклеїновокислотну молекулу за цим винаходом. За варіантом, якому віддається перевага, клітина-хазяїн за цим винаходом містить один або декілька векторів або генно-інженерних конструкцій, які містять нуклеїновокислотну молекулу за цим винаходом. Клітиною-хазяїном за цим винаходом є клітина, до якої було введено вектор за цим винаходом, де згаданий вектор містить полінуклеотид, який кодує LCVR антитіла за цим винаходом, та/або полінуклеотид, який кодує HCVR за цим винаходом. Цей винахід пропонує також клітину-хазяїна, до якої було введено два вектори за цим винаходом, один з яких містить полінуклеотид, який кодує LCVR антитіла за цим винаходом, і один, який містить полінуклеотид, який кодує HCVR, присутню у антитіла за цим винаходом, 33 кожен з яких є функціонально зв'язаним із промоторною послідовністю. Клітинами-хазяями є клітини ссавців, бактерій, рослин і дріжджів. За варіантом, якому віддається перевага, клітиною-хазяїном є клітина СНО, клітина COS, клітина SP2/0, клітина NS0, дріжджова клітина або похідна чи нащадок клітини будь-якого типу, якому віддається перевага. У системі для рекомбінантної експресії антитіла за цим винаходом, якій віддається перевага, рекомбінантний експресійний вектор, який кодує як важкий ланцюг антитіла, так і легкий ланцюг антитіла, вводять до dhfr-CHO клітин шляхом, наприклад, трансфікування, опосередкованого фосфатом кальцію. У межах рекомбінантного експресійного вектора кожен із генів важкого і легкого ланцюгів антитіла функціонально зв'язаний із енхансерними/промоторними регуляторними елементами (які, наприклад, одержують з SV40, CMV (цитомегаловірус), аденовірусу тощо, наприклад, CMV енхансер/AdMLP промоторний регуляторний елемент або SV40 енхансер/AdMLP промоторний регуляторний елемент) для стимулювання високих рівнів транскрипції генів. Рекомбінантний експресійний вектор несе також dhfr ген, який забезпечує селекцію клітин СНО, які були трансфіковані згаданим вектором шляхом селекції/ампліфікації метотрексатом. Селектовані клітини-хазяїтрансформанти культивують для забезпечення експресії важких і легких ланцюгів антитіла, і інтактне антитіло виділяють із культурального середовища. Для одержання рекомбінантного експресійного вектора, трансфікування клітин-хазяїв, селекції трансформантів, культивування клітинхазяїв та виділення антитіла з культурального середовища застосовують стандартні методи молекулярної біології. Антитіла або їхні антигензв'язувальні частини за цим винаходом можуть експресуватись у тварині (наприклад, миші), що є трансгенною за людськими імуноглобуліновими генами (дивись, наприклад, Тейлор (Taylor) та інші, Nucleic Acids Res., 20:6287-6295, 1992). Після завершення експресії, інтактні антитіла, їхні димери, окремі легкі і важкі ланцюги або інші форми імуноглобулінів за цим винаходом можуть бути очищені за стандартними методами, прийнятими у цій галузі, у тому числі шляхом фракціонування сульфатом амонію, за допомогою іонообмінної, афінної, з оберненою фазою, гідрофобної хроматографії на колонках, гель-електрофорезу тощо. Для фармацевтичного застосування перевага віддається по суті чистим імуноглобулінам, які мають щонайменше приблизно 90%, 92%, 94% або 96% однорідність, і найбільша перевага віддається імуноглобулінам, які мають 98%-99% або більший ступінь однорідності. Після завершення очищення, часткового або до однорідності, за потребою, пептиди у подальшому можуть застосовуватись із терапевтичними або профілактичними цілями, як вказується у цьому описі. Химерне антитіло Термін "химерне антитіло", у значенні, вживаному у цьому описі, означає моновалентні, двовалентні або полівалентні імуноглобуліни. Моновалентне химерне антитіло являє собою димер, 94245 34 утворений химерним важким ланцюгом, зв'язаним через дисульфідні містки з химерним легким ланцюгом. Двовалентне химерне антитіло являє собою тетрамер, утворений двома димерами важкий ланцюг-легкий ланцюг, зв'язаними щонайменше одним дисульфідним містком. Химерний важкий ланцюг антитіла містить антигензв'язувальний домен, який одержують із важкого ланцюга нелюдського антитіла, специфічного відносно IL-17, який є функціонально зв'язаним із принаймні частиною константної ділянки людського або по суті людського (або виду, який відрізняється від того виду, від якого походить антигензв'язувальний домен) важкого ланцюга, наприклад, СН1 або СН2, або за варіантом, якому віддається перевага, з повномірною константною ділянкою важкого ланцюга. Химерний легкий ланцюг антитіла для застосування на людях містить антигензв'язувальний домен, який повністю або значною мірою одержують із легкого ланцюга нелюдського антитіла, специфічного відносно IL-17, який є функціонально зв'язаним із принаймні частиною константної ділянки (CL) людського або по суті людського (або виду, який відрізняється від того виду, від якого походить антигензв'язувальний домен) легкого ланцюга, або, за варіантом, якому віддається перевага, з повномірною константною ділянкою легкого ланцюга. Антитіла, фрагменти або похідні, які мають химерні важкі ланцюги і легкі ланцюги з такою самою або іншою зв'язувальною специфічністю варіабельної ділянки, можуть також одержуватись шляхом відповідного зв'язування окремих поліпептидних ланцюгів за допомогою стадій відомих методів. У разі подібного варіанта підходу хазяїв, які експресують химерні важкі ланцюги, культивують окремо від хазяїв, що експресують химерні легкі ланцюги, а імуноглобулінові ланцюги виділяють окремо з подальшим об'єднанням. Альтернативно хазяї можуть бути сумісно культивовані із забезпеченням умов для спонтанного об'єднання ланцюгів у культуральному середовищі з подальшим виділенням зібраного імуноглобуліну або фрагмента. Методи продукування химерних антитіл є відомими у цій галузі (дивись, наприклад, патенти США №6,284,471; №5,807,715; №4,816,567; та №4,816,397). Гуманізовані антитіла За варіантом, якому віддається перевага, антитіло за цим винаходом, призначене для застосування у терапевтичних цілях, повинно мати послідовність каркаса та константної ділянки (тією мірою, у якій вона існує у антитіла), одержану від ссавця, у якого воно повинно бути застосоване як терапевтичний засіб, для того, щоб зменшити ймовірність того, що у ссавця виникне імунна реакція проти терапевтичного антитіла. Гуманізовані антитіла становлять особливий інтерес, оскільки вони вважаються цінними для терапевтичного застосування і запобігають утворенню людських антимишачих антитіл, що часто спостерігається у разі антитіл гризунів. Окрім того, у гуманізованих антитіл ефекторна частина має людське походження, завдяки чому вона може краще взаємодіяти з іншими частинами людської імунної системи 35 (наприклад, із більшою ефективністю знищувати клітини-мішені шляхом комплементзалежної цитотоксичності або антитілозалежної клітинної цитотоксичності). Окрім того, введені гуманізовані антитіла можуть також мати період напіввиведення, який більше нагадує відповідний показник природних людських антитіл, порівняно з, наприклад, мишачими антитілами, що надає можливість введення менших і рідших доз. Термін "гуманізоване антитіло" у значенні, вживаному у цьому описі, означає антитіло, яке містить частини антитіл різного походження, де щонайменше одна частина має людське походження. Наприклад, гуманізоване антитіло може містити частини, одержані з антитіла нелюдського походження з необхідною специфічністю, наприклад, мишачого, і з антитіла людського походження, об'єднані разом хімічним шляхом за допомогою традиційних методів (наприклад, синтетичних), або одержані у вигляді безперервного суміжного поліпептиду за допомогою методів генної інженерії. За варіантом, якому віддається перевага, "гуманізоване антитіло" має гіперваріабельні ділянки, які походять (або по суті походять) із нелюдського антитіла (за варіантом, якому віддається перевага, мишачого моноклонального антитіла), у той час як каркас і константна ділянка, тією мірою, до якої вона присутня (або її суттєва чи значна частина, тобто щонайменше приблизно 90%, 92%, 94%, 95%, 96%, 97%, 98% або 99%), кодуються інформацією нуклеїновокислотної послідовності, яка знаходиться на людській імуноглобуліновій ділянці ембріонального типу (дивись, наприклад, міжнародну базу даних ImMunoGeneTics) або її рекомбінованих чи мутованих формах, незалежно від того, чи продукуються згадані антитіла у людській клітині. Гіперваріабельні ділянки гуманізованого антитіла можуть змінюватись або оптимізуватись із гіперваріабельних ділянок нелюдського вихідного антитіла, з якого вони походять, для одержання бажаних властивостей, наприклад, специфічності, афінності та/або переважного зв'язування. Змінені або оптимізовані гіперваріабельні ділянки можуть мати амінокислотні заміни, додання та/або делеції порівняно з вихідними гіперваріабельними ділянками, за варіантом, якому віддається перевага, у цілому приблизно 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 у межах шести гіперваріабельних ділянок. Наприклад, амінокислотні положення гіперваріабельних ділянок, підкреслені та виділені жирним шрифтом у Таблиці 2 і Таблиці 3, являють собою положення, які були змінені з вихідних гіперваріабельних ділянок, як показано у Fab 1 Таблиці 2 і Таблиці 3. Альтернативно мишаче антитіло 2321 може бути вихідним антитілом для порівняння гіперваріабельних ділянок антитіла за цим винаходом. Гуманізовані форми нелюдських (наприклад, мишачих) антитіл включають інтактне антитіло, по суті інтактне антитіло, частину антитіла, яка містить антигензв'язувальний домен або частину антитіла, яка містить Fab-фрагмент, Fab'-фрагмент, F(аb')2-фрагмент або одноланцюговий Fvфрагмент. Гуманізовані антитіла за варіантом, якому віддається перевага, містять мінімальну 94245 36 послідовність, яка була одержана з нелюдського імуноглобуліну. Гуманізовані антитіла можуть також містити залишки, яких немає ні у антитілареципієнта, ні у занесених CDR або каркасних послідовностей. Взагалі, гуманізоване антитіло буде містити по суті усі із щонайменше однієї, а як правило, двох варіабельних ділянок, у яких усі або по суті усі амінокислоти гіперваріабельних ділянок відповідають амінокислотам нелюдського імуноглобуліну, і усі або по суті усі амінокислоти каркасних ділянок відповідають амінокислотам консенсусної послідовності людського імуноглобуліну. Гуманізоване антитіло за оптимальним варіантом містить також принаймні частину константної ділянки (Fc) імуноглобуліну, як правило, константної ділянки людського імуноглобуліну. [Джоунс (Jones) та інші, Nature, 321:522-525 (1986); Річмен (Riechmann) та інші, Nature, 332:323-329 (1988); та Преста (Presta), Curr. Op. Struct. Віоl., 2:593-596 (1992)]. Гуманізовані антитіла можуть бути піддані in vitro мутагенезу за методами повсякденного застосування у цій галузі (або, у разі застосування тварини, трансгенної за послідовностями людського Ig, in vivo соматичному мутагенезу) і, таким чином, амінокислотні послідовності каркасної ділянки HCVR та LCVR гуманізованих рекомбінантних антитіл являють собою послідовності, які, незважаючи на походження від послідовностей, споріднених із людськими HCVR та LCVR послідовностями ембріонального типу, можуть не існувати за природних умов у межах репертуару людських антитіл ембріонального типу in vivo. Передбачається, що такі амінокислотні послідовності каркасних ділянок HCVR та LCVR гуманізованих рекомбінантних антитіл є щонайменше на 90%, 92%, 94%, 95%, 96%, 98% або, за варіантом, якому віддається найбільша перевага, щонайменше на 99% ідентичними людській послідовності ембріонального типу. За варіантом, якому віддається перевага, будуть збереженими ті каркасні залишки вихідного антитіла (наприклад, мишачого антитіла або, взагалі, того антитіла, похідним якого є гуманізоване антитіло), які підтримують або впливають на структуру антигензв'язувальних центрів антитіла. Ці залишки можуть ідентифікуватись, наприклад, шляхом рентгенівської кристалографії вихідного антитіла або Fab-фрагмента, з ідентифікацією, тим самим, об'ємної структури антигензв'язувального центру антитіла. Одна зі стратегій гуманізації антитіл полягає у виборі людської послідовності ембріонального типу з максимальною гомологією з каркасом вихідного антитіла, оскільки цей каркас призначається для розміщення донорських гіперваріабельних ділянок. Варіант такого ембріонального підходу базується на такому самому логічному обґрунтуванні, що і стратегія найкращої відповідності, за виключенням лише того, що пошук послідовностей ембріонального типу здійснюють у базах даних. Гуманізоване антитіло за цим винаходом може містити або бути похідним з каркаса легкого ланцюга людської зародкової лінії. За конкретними варіантами здійснення послідовність легкого ланцюга ембріонального типу вибрана з-посеред 37 людських VK послідовностей, у тому числі (але без обмеження) А1, А10, A11, А14, А17, А18, А19, А2, А20, А23, А26, А27, A3, А30, А5, А7, В2, В3, L1, L10, L11, L12, L14, L15, L16, L18, L19, L2, L20, L22, L23, L24, L25, L4/18a, L5, L6, L8, L9, Ο1, O11, O12, O14, O18, O2, O4 та O8. За певними варіантами здійснення цей каркас легкого ланцюга людської зародкової лінії вибраний з-посеред V1-11, V1-13, V1-16, V1-17, V1-18, V1-19, V1-2, V1-20, V1-22, V13, V1-4, V1-5, V1-7, V1-9, V2-1, V2-11, V2-13, V2-14, V2-15, V2-17, V2-19, V2-6, V2-7, V2-8, V3-2, V3-3, V3-4, V4-1, V4-2, V4-3, V4-4, V4-6, V5-1, V5-2, V5-4 та V5-6. За іншими варіантами здійснення гуманізоване антитіло за цим винаходом може містити або бути похідним із каркаса важкого ланцюга людської зародкової лінії. За конкретними варіантами здійснення каркас важкого ланцюга людської зародкової лінії вибирають з-посеред VH1-18, VH1-2, VH1-24, VH1-3, VH1-45, VH1-46, VH1-58, VH1-69, VH1-8, VH2-26, VH2-5, VH2-70, VH3-11, VH3-13, VH3-15, VH3-16, VH3-20, VH3-21, VH3-23, VH3-30, VH3-33, VH3-35, VH3-38, VH3-43, VH3-48, VH3-49, VH3-53, VH3-64, VH3-66, VH3-7, VH3-72, VH3-73, VH3-74, VH3-9, VH4-28, VH4-31, VH4-34, VH4-39, VH4-4, VH4-59, VH4-61, VH5-51, VH6-1 та VH7-81. Дивись опис різних послідовностей ембріонального типу у WO 2005/005604. За конкретними варіантами здійснення варіабельна ділянка легкого ланцюга та/або варіабельна ділянка важкого ланцюга містить каркасну ділянку або принаймні частину каркасної ділянки (таку, наприклад, що містить 2 субрайони або 3 субрайони, наприклад, FR2 та FR3). За певними варіантами здійснення принаймні FRL1, FRL2, FRL3 або FRL4 є повністю людськими. За іншими варіантами здійснення принаймні FRH1, FRH2, FRH3 або FRH4 є повністю людськими. За деякими варіантами здійснення принаймні FRL1, FRL2, FRL3 або FRL4 являють собою послідовність ембріонального типу (наприклад, людської зародкової лінії) або містять людські консенсусні послідовності для конкретного каркаса. За іншими варіантами здійснення принаймні FRH1, FRH2, FRH3 або FRH4 являють собою послідовність ембріонального типу (наприклад, людської зародкової лінії) або містять людські консенсусні послідовності для конкретного каркаса. За варіантами здійснення, яким віддається перевага, каркасна ділянка являє собою людську каркасну ділянку. Взагалі, гуманізовані антитіла можуть продукуватись шляхом одержання нуклеїновокислотних послідовностей, які кодують HCVR та LCVR антитіла, наприклад, мишачого антитіла або антитіла, що продукується гібридомою, яке зв'язує антигенну детермінанту IL-17 за цим винаходом, виявлення гіперваріабельних ділянок на згаданих HCVR та LCVR (нелюдських) і пересадження таких нуклеїновокислотних послідовностей, які кодують гіперваріабельні ділянки, на вибрані нуклеїновокислотні послідовності, які кодують людський каркас. За факультативним варіантом гіперваріабельна ділянка може оптимізуватись шляхом піддання мутагенезу довільно або у конкретних місцях для заміни однієї або декількох амінокислот 94245 38 гіперваріабельної ділянки на іншу амінокислоту перед пересадженням згаданої гіперваріабельної ділянки до каркасної ділянки. За альтернативним варіантом гіперваріабельна ділянка може оптимізуватись після введення до людської каркасної ділянки за допомогою способів, доступних фахівцю у цій галузі. За варіантом, якому віддається перевага, амінокислотні послідовності людського каркаса вибирають таким чином, щоб антитіло, яке одержують, було ймовірно придатним для in vivo введення людям. Це може визначатись, наприклад, виходячи з попереднього застосування антитіл, які містять таку людську каркасну послідовність. За варіантом, якому віддається перевага, людська каркасна послідовність сама по собі не буде мати значної імуногенності. Альтернативно амінокислотні послідовності каркасів для антитіла, яке призначається для гуманізації, можуть порівнюватись з амінокислотними послідовностями відомих людських каркасів, призначених для пересадження гіперваріабельних ділянок, і вибиратись виходячи з того, що вони містять послідовності, дуже подібні до послідовностей вихідного антитіла, наприклад, мишачого антитіла, яке зв'язує IL-17 (наприклад, антитіла, яке містить HCVR з ПОСЛІДОВНІСТЮ №270 і додатково містить LCVR з ПОСЛІДОВНІСТЮ №271). У цій галузі були виділені численні людські каркасні послідовності з повідомленням їхніх послідовностей. Це підвищує ймовірність того, що одержане гуманізоване антитіло з пересадженими гіперваріабельними ділянками, яке містить гіперваріабельні ділянки вихідного (наприклад, мишачого) антитіла або оптимізовані гіперваріабельні ділянки вихідного антитіла, пересаджені на вибрані людські каркаси (і, можливо, також людську константну ділянку), по суті збережуть антигензв'язувальний центр антитіла і тим самим збережуть зв'язувальну афінність вихідного антитіла. Для значного збереження антигензв'язувальної спорідненості вибраними людськими каркасними ділянками будуть, за варіантом, якому віддається перевага, ті ділянки, які, як очікується, придатні для in vivo введення, тобто неімуногенні. За будь-яким методом одержують послідовність ДНК, яка кодує HCVR і LCVR ділянки, за варіантом, якому віддається перевага, мишачого антиміостатинового антитіла. Методи клонування нуклеїновокислотних послідовностей, які кодують імуноглобуліни, є добре відомими у цій галузі. Ці методи можуть, наприклад, включати ампліфікацію послідовностей, які кодують імуноглобуліни, призначених для клонування із застосуванням відповідних праймерів за допомогою полімеразної ланцюгової реакції (PCR). У літературі представлені праймери, придатні для ампліфікування імуноглобулінових нуклеїновокислотних послідовностей і, конкретно, мишачих HCVR та LCVR послідовностей. Після завершення клонування таких послідовностей, які кодують імуноглобуліни, їх піддають секвенуванню за методами, добре відомими у цій галузі. Після перенесення послідовностей, які кодують гіперваріабельні ділянки, на вибрані послідовності, які кодують людський каркас, одержані пос 39 лідовності ДНК, які кодують "гуманізовані" послідовності варіабельних ділянок важкого ланцюга і варіабельних ділянок легкого ланцюга, експресують з одержанням гуманізованого Fv або гуманізованого антитіла, яке зв'язує IL-17. Гуманізовані HCVR і LCVR можуть експресуватись як частина цілої молекули антитіла проти IL-17, тобто як гібридний білок із послідовностями людських константних ділянок, де послідовності ДНК, які їх кодують, були одержані з комерційно доступної бібліотеки або за допомогою, наприклад, одного з вищеописаних методів одержання послідовностей ДНК або таких, які існують у цій галузі. Однак послідовності HCVR та LCVR можуть також експресуватись за відсутності константних послідовностей для продукування гуманізованого Fv проти IL-17. Незважаючи на це, злиття людських константних послідовностей з варіабельною ділянкою є потенційно бажаним, оскільки одержане у результаті цього гуманізоване антитіло проти IL-17 може мати людські ефекторні функції. Методи синтезування ДНК, які кодують білок відомої послідовності, добре відомі у цій галузі. За допомогою таких методів синтезують послідовності ДНК, які кодують цільові гуманізовані послідовності HCVR та LCVR (з константними ділянками або без них), після чого експресують їх у векторній системі, придатній для експресії рекомбінантних антитіл. Це може здійснюватись у будь-якій векторній системі, яка забезпечує можливість експресії цільових гуманізованих послідовностей HCVR та LCVR у вигляді гібридного білка з людськими послідовностями константних ділянок і об'єднання з одержанням функціональних (антигензв'язувальних) антитіл або фрагментів антитіл. Людські послідовності константних ділянок відомі у цій галузі і наведені у літературі. Людськими послідовностями константних ділянок легкого ланцюга, яким віддається перевага, є послідовності константних ділянок легких ланцюгів типу каппа і лямбда. Людськими послідовностями константних ділянок важких ланцюгів, яким віддається перевага, є людський IgG1, людський IgG2, людський IgG3, людський IgG4 (дивись, наприклад, ПОСЛІДОВНОСТІ №257-260, відповідно) та їхні мутовані варіанти, які забезпечують одержання зміненої ефекторної функції, наприклад, збільшеного in vivo періоду напіввиведення, зменшеного зв'язування Fc рецептора або зміненого профілю деамідування тощо. У разі присутності, людські каркасні ділянки за варіантом, якому віддається перевага, одержують із варіабельної ділянки людського антитіла, яке має схожість послідовності з аналогічною або еквівалентною ділянкою донора антигензв'язувального центра (тобто вихідного антитіла). Іншими джерелами каркасних ділянок для частин людського походження гуманізованого антитіла є людські консенсусні послідовності варіабельної ділянки (дивись, наприклад, Кеттлборо К.А. (Kettleborough C.A.) та інші, Protein Engineering, 4:773-783 (1991); Картер (Carter) та інші, WO 94/04679). Наприклад, послідовність антитіла або варіабельної ділянки, яка застосовується для одержання нелюдської частини, може порівнюватись із людськими послі 94245 40 довностями, як описано у Кебот (Kabat) та інші, Sequences of Proteins of Immunological Interest, п'яте видання, NIH, U.S. Government Printing Office (1991). За варіантом здійснення, якому віддається особлива перевага, каркасні ділянки ланцюга гуманізованого антитіла одержують із людської варіабельної ділянки, яка має щонайменше приблизно 60% загальну ідентичність послідовності, за варіантом, якому віддається перевага, щонайменше приблизно 70%, 80% або 90% загальну ідентичність послідовності, і за варіантом, якому віддається більша перевага, щонайменше приблизно 85% загальну ідентичність послідовності з варіабельною ділянкою нелюдського донора. Людська частина може також одержуватись із людського антитіла, яке має щонайменше приблизно 65% ідентичність послідовності, а за варіантом, якому віддається перевага, щонайменше приблизно 70% ідентичність послідовності у межах конкретної частини (наприклад, FR), яка застосовується, у разі порівняння з еквівалентною частиною (наприклад, FR) нелюдського донора. Додатковими джерелами з описом методів, залучених до гуманізації мишачого антитіла, які можуть застосовуватись, є, наприклад, такі як Квін (Queen) та інші, Proc. Natl. Acad. Sci. USA, 88:2869, 1991; патент США №5,693,761; патент США №4,816,397; патент США №5,225,539; комп'ютерні програми ABMOD та ENCAD, опис яких наведено у Левітт М. (Levitt M.), J. Моl. Віоl., 168:595-620, 1983; гуманізація може по суті здійснюватись за методом Вінтер (Winter) та співробітників [Джоунс (Jones) та інші, Nature, 321:522-525 (1986); Річмен (Riechmann) та інші, Nature, 332:323-327 (1988); Веройєн (Verhoeyen) та інші, Science, 239:15341536 (1988)]. Людські антитіла Альтернативою гуманізації є одержання людських антитіл. Людські антитіла можна одержати за допомогою різних методів, відомих у цій галузі, у тому числі за допомогою бібліотек проявлення у фагах. Хугенбум (Hoogenboom), Вінтер (Winter), J. Мої Віоl., 227:381 (1991); Маркс (Marks) та інші, J. Моl. Віоl., 222:581 (1991). Методи Коул (Cole) та інших і Бернер (Boerner) та інших також доступні для одержання людських моноклональних антитіл. Коул (Cole) та інші, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, crop. 77 (1985) та Бернер (Boerner) та інші, J. Immunol, 147(l):86-95 (1991). Подібним же чином людські антитіла можна одержати шляхом введення людських імуноглобулінових локусів трансгенним тваринам, наприклад, мишам, у яких ендогенні імуноглобулінові гени були частково або повністю інактивовані. Після імунізації, наприклад, антигеном, який містить імуногенну антигенну детермінанту за цим винаходом, одержують продукування повного репертуару людських антитіл, яке, в усіх відношеннях, близько нагадує те, що спостерігається у людей, у тому числі реаранжування генів, складання і репертуар антитіл. Цей варіант підходу описано, наприклад, у патентах США №5,545,807; №5,545,806; №5,569,825; №5,589,369; №5,591,669; №5,625,126; №5,633,425; №5,661,016 і у наведених далі наукових публікаціях: Маркс 41 (Marks) та інші, Biotechnology, 10:779-783, 1992; Лонберг (Lonberg) та інші, Nature, 368: 856-859, 1994; Моррісон (Morrison), Nature, 368: 812-813, 1994; Фішвайлд (Fishwild) та інші, Nature Biotechnology, 14:845-851, 1996; Нюбергер (Neuberger), Nature Biotechnology, 14: 826 (1996); Лонберг (Lonberg) та Хушар (Huszar), Intern. Rev. Immunol, 13: 65-93 (1995) і Джобкобовіц (Jobkobovits) та інші, Proc. Natl. Acad. Sci. USA, 90:2551, 1993. Людські імуноглобулінові гени, введені мишам, з одержанням, тим самим, трансгенних мишей, здатних реагувати на антигени антитілами, що мають людські послідовності, описані також у Брюггеманн (Bruggemann) та інші, Proc. Natl. Acad. Sci. USA, 86:6709-6713 (1989)]. Існує декілька стратегій одержання ссавців, що продукують людські антитіла. Зокрема, існує "мінілокусний" підхід, за яким екзогенний Ig локус імітується шляхом включення частинок (окремих генів) Ig локусу (дивись, наприклад, патенти США №5,545,807, №5,545,806, №5,625,825, №5,625,126, №5,633,425, №5,661,016, №5,770,429, №5,789,650 та №5,814,318, №5,612,205, №5,721,367, №5,789,215), введення до YAC (штучна дріжджова хромосома) великих і значною мірою ембріональних фрагментів Ig локусів [дивись Мендес (Mendez) та інші, Nature Genetics, 15:146-156 (1997), Грін (Green) та Джакобовіц (Jakobovits), J. Exp. Med., 188:483-495 (1998)], та введення повних або по суті повних локусів шляхом злиття мініатюрних клітин (дивись заявку на Європатент №ЕР 0 843 961 А1). Будь-яка трансгенна миша, здатна до реагування на імунізацію антитілами, що мають людські послідовності, може застосовуватись для продукування антитіла проти IL-17 за цим винаходом у разі застосування методів, доступних фахівцю у цій галузі, наприклад, коли таку мишу імунізують поліпептидом, який містить імуногенну антигенну детермінанту за цим винаходом. Варіанти застосування Антитіла за цим винаходом придатні для терапевтичного, профілактичного, діагностичного та науково-дослідного застосування, як описано у цьому описі. Антитіло за цим винаходом може застосовуватись для діагностування розладу або захворювання, пов'язаного з експресією людського IL-17. Подібним чином, антитіло за цим винаходом може застосовуватись у аналізі з метою контролювання рівнів IL-17 у суб'єкта, який перевіряється на стан, пов'язаний з IL-17. Варіант науководослідного застосування включає методи, за якими антитіло за цим винаходом і мітку застосовують для виявлення міостатину у зразку, наприклад, у рідині у тілі людини або екстракті з клітин або тканин. Антитіла за цим винаходом можуть застосовуватись із модифікацією або без неї і їх мітять ковалентним або нековалентним приєднанням виявної складової. Виявною складовою може бути будь-яка складова, здатна до продукування, безпосередньо або опосередковано, виявного сигналу. Наприклад, виявною складовою може бути радіоактивний ізотоп, наприклад, 3Н, 14С, 32Р, 35S або 125І, флуоресцентна або хемілюмінесцентна 94245 42 сполука, наприклад, флуоресцеїнізотіоціанат, родамін або люциферин; або фермент, наприклад, лужна фосфатаза, бета-галактозидаза або пероксидаза з хрону. Може застосовуватись будь-який метод, відомий у цій галузі, для окремого кон'югування антитілаз виявною складовою, у тому числі методи, описані Хантер (Hunter) та інші, Nature, 144:945, 1962; Девід (David) та інші, Biochemistry, 13: 1014, 1974; Пейн (Pain) та інші, J. Immunol. Meth., 40: 219, 1981; та Нігрен (Nygren), J. Histochem. And Cytochem., 30: 407, 1982. У цій галузі відомі різноманітні традиційні методи визначення рівнів IL-17, у тому числі, наприклад, ELISA (твердофазний імуноферментний аналіз), RIA (радіоімунологічний аналіз) і FACS (клітинний сортер із збудженням флуоресценції), які надають основу для діагностування змінених або патологічних рівнів експресії IL-17. Нормальні або стандартні рівні експресії встановлюють за допомогою будь-якого відомого у цій галузі методу, наприклад, шляхом об'єднання зразка, який містить поліпептид IL-17 з, наприклад, антитілами, за умов, придатних для утворення комплексу антиген:антитіло. Згадане антитіло безпосередньо або опосередковано мітять виявною речовиною для полегшення виявлення зв'язаного або незв'язаного антитіла. Придатними виявними речовинами є різні ферменти, простетичні групи, флуоресцентні матеріали, люмінесцентні матеріали та радіоактивні матеріали. Приклади придатних ферментів включають пероксидазу з хрону, лужну фосфатазу, β-галактозидазу або ацетилхолінестеразу; приклади придатних комплексів простетичних груп включають стрептавідин/біотин та авідин/біотин; приклади придатних флуоресцентних матеріалів включають умбеліферон, флуоресцеїн, флуоресцеїнізотіоціанат, родамін, дихлоротриазиніламінфлуоресцеїн, дансилу хлорид або фікоеритрин; прикладом люмінесцентного матеріалу є люмінол; приклади радіоактивного матеріалу включають 125 131 35 3 І, І, S або Н. (Дивись, наприклад, Золя (Zola), Monoclonal Antibodies: A Manual of Techniques, CRC Press, Inc. (1987)). Кількісне визначення утвореного стандартного комплексу здійснюють різними методами, наприклад, фотометричним методом. Кількість поліпептида IL-17, експресованого у зразках, після цього порівнюють із стандартними значеннями. Для зручності антитіло за цим винаходом може надаватись у вигляді набору, запакованої комбінації реактивів у попередньо визначених кількостях з інструкціями для здійснення діагностичного аналізу. У разі, коли антитіло мітять ферментом, згаданий набір буде включати субстрати і кофактори, які необхідні для згаданого фермента (наприклад, попередник субстрату, який забезпечує виявний хромофор або флуорофор). Окрім того, можуть включатись інші додаткові речовини, наприклад, стабілізатори, буфери (наприклад, блокувальний буфер або лізисний буфер) тощо. Відносні кількості різних реактивів можуть коливатись у широких межах для забезпечення концентрацій у розчині реактивів, які по суті оптимізують чутливість згаданого аналізу. Зокрема, реактиви можуть постачатись у вигляді сухих порошків, як правило, 43 ліофілізованих, у тому числі наповнювачів, які, у разі розчинення, забезпечать одержання розчину реактивів, який має відповідну концентрацію. Варіанти терапевтичного застосування антитіла IL-17 є передзапальним цитокіном, який секретується активованими Т-клітинами на ділянках запалення, які знаходяться за межами великого кола кровообігу; його важко виявити у сироватці або тканинах здорової особи. IL-17 активує фактор адгезії, індукує продукування численних запальних цитокінів і хемокінів клітинами різних типів, у тому числі синовіоцитами, хондроцитами, фібробластами, ендотеліальними клітинами, епітеліальними клітинами, з індукуванням, тим самим, рекрутингу нейтрофілів до місця запалення, стимулює продукування простагландинів та металопротеїназ і пригнічує синтез протеогліканів. На додаток до цього, IL-17 відіграє важливу роль у визріванні гемопоетичних клітин-попередників. IL-17 здійснює передавання сигналів у різних органах і тканинах, у тому числі у легенях, суглобовому хрящі, кістковій тканині, головному мозку, гемопоетичних клітинах, нирках, шкірі і кишечнику. IL-17 має 15-27% амінокислотну гомологію з IL-17 В, IL-17 С та IL-17 E і 44-50% амінокислотну гомологію з IL-17 D та IL-17 F. IL-17 зв'язується з рецептором IL-17 з низькою спорідненістю (приблизно 1нМ), у той час як інші члени родини IL-17 із рецептором IL-17 не зв'язуються. Підвищені рівні IL-17 (тобто IL-17A) пов'язуються з декількома станами, у тому числі запаленням дихальних шляхів, ревматоїдним артритом (RA), остеоартритом, ерозією кісток, внутрішньоочеревинними абсцесами та спайками, запальною хворобою кишечнику (IBD), відторгненням алотрансплантату, псоріазом, раком певних типів, ангіогенезом, атеросклерозом і розсіяним склерозом (MS). Як IL-17, так і IL-17R активовані у синовіальній тканині хворих на RA. IL-17 відіграє свою роль у патогенезі RA через IL-1-β- та TNF-αзалежні і незалежні шляхи. IL-17 стимулює секрецію інших цитокінів і хемокінів, наприклад, TNF-α, IL-1β, IL-6, IL-8 та Gro-α. IL-17 безпосередньо сприяє розвитку захворювання у разі RA. Введення IL-17 до мишачого коліна стимулює руйнування суглоба незалежно від активності IL-1β (Ann. Rheum. Dis. 59:529-532, 2000). Антитіло проти IL1β не впливає на індуковане IL-17 запалення і пошкодження суглоба (J. Immunol. 167:1004-1013, 2001). У разі індукованої SCW мишачої моделі артриту, IL-17 індукує інфільтрацію запальних клітин і вичерпання протеогліканів у мишей дикого типу та у мишей з блокованим IL-1β і TNF-α. Миші з блокованим IL-17 є фенотипово нормальними за відсутності антигенної стимуляції, але демонструють явно виражене зниження тяжкості артриту після імунізації колагеном типу II (J. Immunol. 171:6173-6177, 2003). Розсіяний склероз («MS») являє собою автоімунне захворювання, яке характеризується запаленням центральної нервової системи («ЦНС») з пошкодженням мієлінової оболонки, яка оточує аксони. Основною ознакою MS є інфільтрація Тклітин до ЦНС. На MS страждає більше за 350000 94245 44 осіб у Сполучених Штатах і 2,5млн у світі. Існує багато форм MS і найпоширенішою є рецидивноремітуюче захворювання ("RRMS) з подальшим вторинним прогресуючим періодом. Сучасним терапевтичним засобом є β-інтерферон (AVONEX, BETASERON та REBIF), який знижує інтенсивність рецидивів/ремісії на 31%-34%, але може спричинювати грипоподібні симптоми та/або синтез нейтралізуючих антитіл (наприклад, приблизно 15% хворих, що одержують AVONEX, продукують нейтралізуючі антитіла впродовж 18 міс). TYSABRI, схвалений Управлінням із санітарного нагляду за харчовими продуктами і медикаментами (США) для застосування у разі RRMS, був у подальшому вилучений з ринку унаслідок проблем з імуносупресією ЦНС. При лікуванні MS все ще існує незадоволена медична потреба. Рівень мРНК IL-17 зростає в ураженнях, спричинених розсіяним склерозом, та в мононуклеарах (MNC) крові і цереброспінальної рідини хворих на MS. Під час клінічного загострення MS, порівняно з ремісією, виявляється підвищена кількість мононуклеарів крові, які експресують мРНК IL-17 {Multiple Sclerosis, 5:101-104, 1999). На додаток до цього, у мишей з блокованим IL-17 значно пригнічується експериментальний автоімунний енцефаломієліт ("ЕАЕ"), який являє собою передклінічну тваринну модель MS. Таким чином, фармацевтична композиція, яка містить моноклональне антитіло проти IL-17 за цим винаходом, може бути корисною для лікування або запобігання станів, у разі яких присутність IL-17 впливає або додає свій внесок до небажаних патологічних ефектів або у разі яких зниження біологічної активності IL-17 має терапевтично сприятливий вплив на ссавців, за варіантом, якому віддається перевага, на людей, у тому числі (але без обмеження) запалення дихальних шляхів, астму, RA, остеоартрит, ерозію кісток, внутрішноочеревинні абсцеси і спайки, IBD, відторгнення алотрансплантату, псоріаз, рак певних типів, ангіогенез, атеросклероз та MS, а також інші запальні розлади, стани або захворювання, у тому числі (але без обмеження) еритематоз, реакцію на алерген, гастрит, пов'язаний з Helicobacter pylori, бронхіальну астму та відторгнення алотрансплантату (наприклад, ниркового), системний червоний вовчак і люпус-нефрит. Цим винаходом передбачається застосування моноклонального антитіла проти IL-17 за цим винаходом для лікування або запобігання щонайменше одного з вищезгаданих розладів, у разі якого активність IL-17 є шкідливою або для якого сприятливим є зниження рівнів біологічно активного IL-17. На додаток до цього передбачається застосування моноклонального антитіла проти IL-17 за цим винаходом для виготовлення лікарського засобу для лікування щонайменше одного з вищезгаданих розладів. Терміни "лікування", "лікувати" тощо, у значенні, вживаному у цьому описі, означає досягнення бажаного фармакологічного та/або фізіологічного ефекту. Згаданий ефект може бути профілактичним з точки зору повного або часткового запобігання захворюванню або його симптому та/або може бути терапевтичним з точки зору час 45 ткового або повного вилікування від захворювання та/або позбавлення від негативного впливу, пов'язаного із захворюванням. Термін "лікування", у значенні, вживаному у цьому описі, означає введення сполуки за цим винаходом для лікування захворювання або стану у ссавця, зокрема, у людини, і включає: (а) запобігання виникненню захворювання у суб'єкта, що є схильним до згаданого захворювання, але який ще не був діагностований як такий, що має згадане захворювання; (b) пригнічення захворювання, тобто припинення його розвитку; і (с) полегшення симптомів захворювання, тобто спричинення зворотного розвитку захворювання або розладу чи полегшення його симптомів або ускладнень. Схеми приймання лікарського засобу можуть підбиратись таким чином, щоб забезпечити оптимальну бажану реакцію (наприклад, терапевтичну або профілактичну реакцію). Наприклад, може вводитись одноразова ударна доза, впродовж певного періоду часу можуть вводитись декілька менших доз або доза може пропорційно зменшуватись або збільшуватись у залежності від вимог терапевтичної ситуації. Фармацевтична композиція Антитіло за цим винаходом може включатись до складу фармацевтичних композицій, придатних для введення суб'єкту (дивись, наприклад, Приклад 14). Сполуки за цим винаходом можуть вводитись самостійно або у поєднанні з фармацевтично прийнятним носієм, розріджувачем та/або наповнювачами у вигляді одно- чи багаторазових доз. Фармацевтичні композиції для введення розробляються таким чином, щоб бути придатними для вибраного способу введення і відповідним чином застосовуються фармацевтично прийнятні розріджувачі, носії, та/або наповнювачі, наприклад, диспергувальні речовини, буфери, поверхневоактивні речовини, консерванти, солюбілізатори, агенти для регулювання ізотонічності тощо (дивись, наприклад, наведений у цьому описі Приклад 14). Згадані композиції розробляються за традиційними методами, опис яких наведено, наприклад, у довіднику Remington, The Science and Practice of Pharmacy, 19-е видання, Gennaro, Ed., Mack Publishing Co., Easton, штат Пенсільванія, 1995, який надає стислий опис способів одержання лікарських форм, які є загальновідомими лікарям-практикам. Фармацевтична композиція, яка містить моноклональне антитіло проти IL-17, може вводитись суб'єкту, який належить до групи ризику або демонструє патології, як описано у цьому описі, за допомогою стандартних способів введення, у тому числі шляхом перорального, внутрішньовенного, внутрішньоочеревинного, підшкірного, долегеневого, черезшкірного, внутрішньом'язового, інтраназального, защічного, сублінгвального або супозиторного введення. Фармацевтична композиція за цим винаходом за варіантом, якому віддається перевага, являє собою "терапевтично ефективну кількість" або "профілактично ефективну кількість" антитіла за цим винаходом. "Терапевтично ефективна кількість" означає кількість, ефективну, у дозах та впродовж необхідних періодів часу, для досягнен 94245 46 ня бажаного терапевтичного результату. Терапевтично ефективна кількість антитіла може змінюватись у залежності від таких факторів, як стан захворювання, вік, стать і маса особи, здатність антитіла або частини антитіла до викликання бажаної реакції у індивіда. Терапевтично ефективною кількістю є також кількість, для якої будь-який токсичний або шкідливий ефекти антитіла переважаються терапевтично сприятливими ефектами. "Профілактично ефективна кількість" означає кількість, ефективну, у дозах та впродовж необхідних періодів часу, для досягнення бажаного профілактичного результату. Як правило, оскільки профілактична доза застосовується до суб'єктів перед або на початковій стадії захворювання, профілактично ефективна кількість буде меншою, аніж терапевтично ефективна кількість. Терапевтично ефективна або профілактично ефективна кількість є принаймні мінімальною дозою, але меншою за токсичну дозу активного агента, яка необхідна для терапевтично корисного впливання на суб'єкта. Інакше кажучи, терапевтично ефективною кількістю антитіла за цим винаходом є кількість, яка у ссавців, за варіантом, якому віддається перевага, людей, зменшує біологічну активність IL-17, наприклад, шляхом зв'язування з IL17R, де присутність IL-17 спричинює або додає свій внесок до небажаних патологічних ефектів або де наслідком зниження рівнів IL-17 є сприятливий терапевтичний ефект у ссавця, за варіантом, якому віддається перевага, у людини. Шлях введення антитіла за цим винаходом може бути пероральним, парентеральним, інгаляційним або місцевим. За варіантом, якому віддається перевага, антитіла за цим винаходом можуть включатись до складу фармацевтичної композиції, придатної для парентерального введення. Термін "парентеральне", у значенні, вживаному у цьому описі, означає внутрішньовенне, внутрішньом'язове, підшкірне, ректальне, вагінальне або внутрішньоочеревинне введення. Перевага віддається периферичній системній доставці шляхом внутрішньовенного, внутрішньоочеревинного або підшкірного введення. Придатні носії для такого введення відомі у цій галузі. Фармацевтична композиція за типовим варіантом повинна бути стерильною і стійкою за умов виготовлення і збереження у наданому контейнері, у тому числі, наприклад, герметизованому флаконі або шприці. Таким чином, фармацевтичні композиції можуть фільтруватись за стерильних умов після їх виготовлення або їх мікробіологічна прийнятність повинна забезпечуватись іншими способами. Типова композиція для внутрішньовенного вливання повинна містити 250-1000мл рідини, наприклад, стерильного розчину Рінгера, фізіологічного розчину, розчину декстрози, розчину Хенкса, і терапевтично ефективну дозу (наприклад, від 1мг/мл до 100мг/мл або більше) концентрації антитіла. Доза може змінюватись у залежності від типу і тяжкості захворювання. Як добре відомо у галузі медицини, дози для будь-якого із суб'єктів залежать від багатьох факторів, у тому числі розміру хворого, площі поверхні тіла, віку, конкретної сполуки, призначеної для введення, статі, часу і 47 шляху введення, загального стану здоров'я та інших лікарських засобів, які вводяться одночасно. Типова доза може бути, наприклад, у межах від 0,001мкг до 1000мкг; передбачаються, однак, дози, які є меншими або більшими за цей зразковий діапазон, особливо приймаючи до уваги вищезгадані фактори. За схемою приймання лікарського засобу, добова доза повинна становити приблизно від 0,1мкг/кг до приблизно 100мг/кг загальної маси тіла, за варіантом, якому віддається перевага, від приблизно 0,3мкг/кг до приблизно 10мг/кг, за варіантом, якому віддається більша перевага, від приблизно 1мкг/кг до 1мг/кг, за варіантом, якому віддається ще більша перевага, від приблизно 0,5мкг/кг до 10мг/кг маси тіла на добу. Розвиток може контролюватись шляхом періодичних визначень. Для повторних введень впродовж декількох днів або довше, у залежності від стану, лікування повторюють доти, доки не відбудеться бажаного пригнічення симптомів захворювання. Корисними, однак, можуть бути інші схеми приймання лікарського засобу, які не виключаються з цього винаходу. Бажана доза може доставлятись шляхом введення одноразової ударної дози, шляхом багаторазового введення ударної дози або шляхом безперервного вливання антитіла, у залежності від характеру фармакокінетичних показників, яких бажає досягти лікар-практик. Такі запропоновані кількості антитіла приймаються, значною мірою, за розсудом лікаря. Ключовим фактором у виборі відповідної дози і схеми застосування лікарського засобу є одержаний результат. Факторами, які повинні прийматись до уваги у цьому контексті, є конкретний розлад, який піддають лікуванню, конкретний ссавець, якого піддають лікуванню, клінічний стан індивідуального хворого, причина захворювання, місце введення антитіла, конкретний тип антитіла, спосіб введення, схема застосування та інші фактори, відомі лікарям-практикам. 94245 48 Терапевтичні агенти за цим винаходом можуть заморожуватись або ліофілізуватись для збереження та відновлюватись у відповідному стерильному носії перед застосуванням. Наслідком ліофілізації і відновлення може бути втрата активності антитіла різного ступеня. Дози повинні регулюватись для компенсування можливої втрати активності. Взагалі, перевага віддається рН у межах 6-8. Готовий виріб За іншим варіантом здійснення цього винаходу пропонується готовий виріб, який включає матеріали, придатні для лікування або запобігання розладів або станів, опис яких наведено вище. Готовий виріб включає в себе контейнер і етикетку. Відповідними контейнерами є, наприклад, флакони, ампули, шприци і контрольні пробірки. Контейнери можуть виготовлятись із різноманітних матеріалів, наприклад, скла або пластику. Контейнер містить композицію антитіла за цим винаходом, що є ефективною для запобігання або лікування розладу чи стану, і може мати стерильний вхідний отвір (наприклад, контейнер може бути мішечком з розчином для внутрішньовенного введення або флаконом із пробкою, яку проколюють голкою шприца для підшкірних ін'єкцій). Активним агентом у згаданій композиції є антитіло проти IL-17 за цим винаходом. На етикетці, яка розміщується на контейнері або додається до нього, зазначається, що композиція застосовується для лікування відповідного стану. Готовий виріб може додатково включати другий контейнер, який містить фармацевтично прийнятний буфер, наприклад, забуферений фосфатом фізіологічний розчин, розчин Рінгера і розчин декстрози. Він може додатково включати інші матеріали, необхідні з комерційної точки зору або точки зору споживача, у тому числі інші буфери, розріджувачі, фільтри, голки, шприци і пакувальні вкладки з інструкціями для застосування. Наведені нижче приклади пропонуються лише з ілюстративними цілями і не призначені для будьякого обмеження обсягу цього винаходу. 49 94245 50 51 94245 52 53 94245 54 55 94245 56 57 94245 58 59 94245 60
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-il-17 antibodies
Автори англійськоюAllan Barrett, Chow Chi-kin, Huang Lihua, Liu Ling, Lu Jirong, Ng Kingman, Tetreault Jonathan Wendell, Werner Andrew Gordon
Назва патенту російськоюАнтитела против il-17
Автори російськоюАллан Барретт, Чоу Чи-кинь, Ханг Лиха, Лю Лин, Лу Цзижон, Нг Кингман, Тетро Джонатан Уэнделл, Уэрнер Эндрю Гордон
МПК / Мітки
МПК: A61K 39/395, C07K 16/24
Код посилання
<a href="https://ua.patents.su/178-94245-antitila-proti-il-17.html" target="_blank" rel="follow" title="База патентів України">Антитіла проти il-17</a>
Попередній патент: Анти-cgrp антагоністичне антитіло та фармацевтична композиція, що його включає
Наступний патент: Похідні індазолу, що інгібують рецептор trpv1
Випадковий патент: Спосіб лапароскопічної герніопластики