Комбінація антагоніста с-мет та аміногетероарилу для лікування раку
Формула / Реферат
1. Фармацевтична композиція, що містить антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, та аміногетероарильну сполуку, у якій:
i) зазначений антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибирають з групи, що складається з:
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:1, 2 і 3; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:10, 11 і 12;
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:4, 5 і 6; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:13, 11 і 14;
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:7, 8 і 9; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:15, 16 і 17; і
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:47, 48 і 49; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:50, 51 і 52,
та
ii) зазначену аміногетероарильну сполуку вибирають з групи сполук формули I:
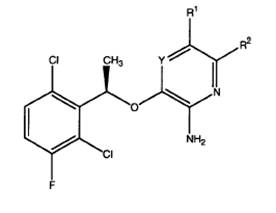 ,
,
у якій:
Y позначає N або CR12;
R1 вибраний з атома водню, галогену, C6-12 арилу, 5-12-членного гетероарилу, C3-12 циклоалкілу, 3-12-членного гетероаліциклу, -O(CR6R7)nR4, -C(O)R4, -C(O)OR4, -CN, -NO2, -S(O)mR4, -SO2NR4R5, -C(O)NR4R5, -NR4C(O)R5, -C(=NR6)NR4R5, C1-8алкілу, C2-8алкенілу та C2-8алкінілу; і кожний атом водню в R1 необов'язково заміщений однією або більш ніж однією групою R3;
R2 позначає атом водню, галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 або -C(O)NR4R5, і кожний атом водню в R2 необов'язково заміщений на R8;
кожний R3 незалежно позначає галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12 циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4-NO2, -NR4R5 -(CR6R7)nOR4, -CN,-C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4-(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 або -C(O)NR4R5, кожний атом водню в R3 необов'язково заміщений на R8, і групи R3 на сусідніх атомах можуть об′єднуватися з утворенням C6-12 арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної або 3-12-членної гетероаліциклічої групи;
кожний R4, R5, R6 і R7 незалежно позначає атом водню, галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-1 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил; або будь-які два з R4, R5, R6 та R7, зв'язані з одним й тим самим атомом азоту, можуть бути об'єднані разом з атомом азоту, з яким вони зв'язані, з утворенням 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи, що необов'язково міститьвід 1 до 3 додаткових гетероатомів, вибраних з N, O і S; або будь-які два з R4, R5, R6 і R7, зв'язані з одним й тим самим атомом вуглецю, можуть бути об'єднані з утворенням C3-12циклоалкільної, C6-12арильної, 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи; і кожний атом водню в R4, R5, R6 і R7 необов'язково заміщений на R8;
кожний R8 незалежно позначає галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -NH2,-CN,-OH,-O-C1-12алкіл, -O-(CH2)nC3-12циклоалкіл, -O-(CH2)nC6-12арил, -O-(CH2)n(3-12-членний гетероаліцикл) або -O-(CH2)n(5-12-членний гетероарил); і кожний атом водню в R8 необов'язково заміщений на R11;
кожний R9 і R10 незалежно позначає атом водню, галоген, C1-1 алкіл, C3-12циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетеро арил-S(O)mR4, -SO2NR4R-(CR6R7)nNCR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 або -C(O)NR4R5; R9 або R10 можуть об′єднуватися з кільцевим атомом A або із замісником A з утворенням C3‑12 циклоалкільного, 3-12-членного гетероаліциклічного, C6-12 арильного або 5-12-членного гетероарильного кільця, конденсованого з A; і кожний атом водню в R9 і R10 необов'язково заміщений на R3;
кожний R11 незалежно позначає галоген, C1-12алкіл, C1-12алкокси, C3-12циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -O-C1-12алкіл,-O-(CH2)nC3-12 циклоалкіл, -O-(CH2)nC6-12арил,-O-(CH2)n(3-12-членний гетероаліцикл), -O-(CH2)n(5-12-членний гетероарил) або-CN, і кожний атом водню в R11 необов'язково заміщений на галоген, -OH,-CN,-C1-12алкіл, що може бути частково або повністю галогенованим,-O-C1-12алкіл, що може бути частково або повністю галогенованим, -CO,-SO або-SO2;
R12 позначає атом водню, галоген, C1-1алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2,-NR4R5, -(CR6R7)nOR4, -CN,-C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6 -NR4S(O)PR5 або -C(O)NR4R5, і кожний атом водню в R12 необов'язково заміщений на R3;
кожний R13 незалежно позначає галоген, C1-12алкіл, C2-12 алкеніл, C2-12алкеніл, C3‑12 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5, -C(O)NR4R5, -(CR6R7)n(3-12-членний гетероаліцикл), -(CR6R7)n(C3-12циклоалкіл), -(CR6R7)n(C6-12арил), -(CR6R7)n(5-12-членний гетероарил), -(CR6R7)nC(O)NR4R5 або -(CR6R7)nC(O)R4, групи R13 на сусідніх атомах можуть об′єднуватися з утворенням C6-12арильної, 5-12-членної гетероарильної, C3-1 циклоалкільної або 3-12-членної гетероаліциклічної групи, і кожний атом водню в R13 необов'язково заміщений на R3;
кожний m незалежно дорівнює 0, 1 або 2;
кожний n незалежно дорівнює 0, 1, 2, 3 або 4;
кожний p незалежно дорівнює 1 або 2;
або її фармацевтично прийнятною сіллю, гідратом чи сольватом.
2. Композиція за п. 1 як ліки.
3. Фармацевтична композиція, яка містить щонайменше:
i) один антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, як визначено у п. 1, і
ii) аміногетероарильну сполуку, як визначено у п. 1,
у вигляді комбінованих препаратів для одночасного застосування.
4. Композиція за будь-яким з пп. 1-3, де антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибраний з групи, що складається з:
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:18, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:21;
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО: 19, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:22;
- антитіла або його антигензв′язуючого фрагмента, важкий ланцюг якого містить амінокислотну послідовність SEQ ID NО:20, а легкий ланцюг містить амінокислотну послідовність SEQ ID NО:23; і
- антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:53, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:54.
5. Композиція за будь-яким з пп. 1-4, де антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибраний з групи, що складається з моноклональних антитіл, секретованих гібридомами, депонованими в Collection Nationale de Cultures de Microorganismes (CNCM, Institut Pasteur, Rue du Docteur Roux, Paris, France) 14 березня 2007 за номерами I-3724, I-3731, I-3732 і 6 липня 2007 за номером I-3786.
6. Композиція за п. 5, де антагоніст c-Met, що є антитілом, є моноклональним антитілом, називаним 224G11, секретованим гібридомою, депонованою в CNCM 14 березня 2007 за номером I-3731, або антитілом чи його антигензв′язуючим фрагментом, утвореним з даного антитіла 224G11, який включає:
- щонайменше 6 CDR, що мають послідовності SEQ ID NО:1, 2, 3, 10, 11 і 12; або
- щонайменше важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:18, і легкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:21.
7. Композиція за будь-яким з пп. 1-6, де сполуку аміногетероарилу вибрано зі сполук амінопіридину або амінопіразину.
8. Композиція за будь-яким з пп. 1-7, де сполука аміногетероарилу є сполукою формули Ib:
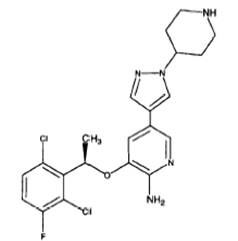 .
.
9. Композиція за будь-яким з пп. 1-8 для лікування раку.
10. Застосування фармацевтичної композиції за п. 3, що містить у вигляді комбінованих препаратів для одночасного застосування щонайменше антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, і сполуку аміногетероарилу, як визначено в будь-якому з пп. 1-9, для отримання ліків для лікування раку.
11. Композиція за п. 9, де рак вибраний з раків з гіперекспресією c-Met та/або таких, що виявляють аутофосфорильований c-Met.
12. Композиція за п. 9, де рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрія, гліобластоми або раку ободової кишки.
13. Композиція за будь-яким з пп. 9, 11 і 12 для лікування раку у ссавця, краще, людини.
14. Застосування за п. 10, де рак вибраний з раків з гіперекспресією c-Met та/або таких, що виявляють аутофосфорильований c-Met.
15. Застосування за п. 10, де рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрія, гліобластоми або раку ободової кишки.
16. Застосування за будь-яким з пп. 10, 14 та 15 для лікування раку у ссавця, краще, людини.
Текст
Реферат: Винахід стосується фармацевтичної композиції, що містить антагоніст c-Met, який є антитілом, і сполуку аміногетероарилу, зокрема, як ліки; фармацевтичної композиції, що містить антитіло анти-c-Met і сполуку аміногетероарилу у вигляді комбінованих препаратів для одночасного застосування; застосування вказаних композицій для лікування раку у ссавця. UA 104144 C2 (12) UA 104144 C2 UA 104144 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до композиції, що містить антагоніст c-Met, який є антитілом, і сполуку аміногетероарилу, зокрема, як ліків. Даний винахід також включає фармацевтичну композицію, що містить антитіло анти-c-Met і сполуку аміногетероарилу у вигляді комбінованих препаратів для одночасного, роздільного або послідовного застосування. Винахід стосується застосування композиції за винаходом для лікування раку у ссавця. c-Met є прототиповим членом підродини RTK, яка також включає RON і SEA. Родина c-Met RTK є структурно відмінним від інших родин RTK і є єдиним відомим рецептором високої спорідненості до фактора росту гепатоцитів (HGF), також називаному розсіюючим фактором (scater factor, SF) [D.P. Bottaro et al., Science 1991, 251: 802-804; L. Naldini et al., Eur. Mol. Biol. Org. J. 1991, 10:2867-2878]. c-Met і HGF широко експресуються в ряді тканин, і їх експресія в нормі обмежена клітинами епітеліального і мезенхімного походження, відповідно [M.F. Di Renzo et al., Oncogene 1991, 6:1997-2003; E. Sonnenberg et al., J. Cell. Biol. 1993, 123:223-235]. Обидва вони є необхідними для нормального розвитку ссавця, і показано, що вони особливо важливі в клітинній міграції, морфогенетичній диференціації та організації тривимірних тубулярних структур, а також у рості та ангіогенезі [F. Baldt et al., Nature 1995, 376:768-771; C. Schmidt et al., Nature. 1995:373:699-702; Tsarfaty et al., Science 1994, 263:98-101]. Хоча показано, що контрольована регуляція c-Met і HGF важлива при розвитку ссавця, підтриманні та репарації тканин [Nagayama T., Nagayama M., Kohara S., Kamiguchi H., Shibuya M., Katoh Y., Itoh J., Shinohara Y., Brain Res. 2004, 5;999(2):155-66; Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi K, Tsubouchi H., J Pharmacol Exp Ther. 2003, 307(1):146-51], порушення їх регуляції зв'язують із прогресуванням раків. Аберантна передача сигналу, що направляється невідповідною активацією c-Met, є однією з найбільш частих змін, спостережуваних при раках людини, і відіграє критичну роль у канцерогенезі та метастазах [Birchmeier et al., Nat. Rev. Mol. Cell Biol. 2003, 4:915-925; L. Trusolino and Comoglio P.M., Nat Rev. Cancer. 2002, 2(4):289-300]. Активація c-Met може бути результатом різних механізмів, що включають i) зв'язування ліганду, ii) гіперекспресію рецептора, яка приводить до спонтанної, незалежної від ліганду димеризації, або iii) мутації, що в основному зустрічаються у внутрішньоклітинному домені c-Met і приводять в результаті до підвищеного та постійного фосфорилування c-Met або до конститутивної активації рецептора [J. G. Christensen, Burrows J. and Salgia R., Cancer Letters. 2005, 226:1-26]. Активований c-Met рекрутує ефектори передачі сигналу в їх множинному стикувальному сайті, локалізованому в цитоплазматичному домені, що приводить в результаті до активації декількох ключових біохімічних шляхів передачі сигналу, включаючи Ras-MAPK, PI3K, Src та Stat3 [Gao CF, Vande Woude GF, Cell Res. 2005, 15(1):49-51; Furge KA, Zhang YW, Vande Woude GF, Oncogene. 2000, 19(49):5582-9]. Ці біохімічні шляхи є суттєвими для проліферації пухлинних клітин, інвазії та ангіогенезу і для уникнення апоптозу [Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000, 19(49):5582-9; Gu H, Neel BG, Trends Cell Biol. 2003 Mar, 13(3):122-30; Fan S, Ma YX, Wang JA, Yuan RQ, Meng Q, Cao Y, Laterra JJ, Goldberg ID, Rosen EM, Oncogene. 2000 Apr 27, 19(18):2212-23]. Крім того, унікальним аспектом передачі сигналу c-Met відносно інших RTK є його описана взаємодія з фокальними адгезіонними комплексами та некіназними партнерами зв'язування, такими як інтегріни 64 [Trusolino L, Bertotti A, Comoglio PM, Cell. 2001, 107:643-54], CD44v6 [Van der Voort R, Taher TE, Wielenga VJ, Spaargaren M, Prevo R, Smit L, David G, Hartmann G, Gherardi E, Pals ST, J Biol Chem. 1999, 274(10):6499-506], плексин B1 або семафорини [Giordano S, Corso S, Conrotto P, Artigiani S, Gilestro G, Barberis D, Tamagnone L, Comoglio PM, Nat Cell Biol. 2002, 4(9):720-4; Conrotto P, Valdembri D, Corso S, Serini G, Tamagnone L, Comoglio PM, Bussolino F, Giordano S, Blood. 2005, 105(11):4321-9; Conrotto P, Corso S, Gamberini S, Comoglio PM, Giordano S, Oncogene. 2004, 23:5131-7], які можуть додатково ускладнювати регуляцію клітинної функції їх рецептором. Нарешті, останні дані демонструють, що c-Met може бути залучений у стійкість пухлини до гефітинібу або ерлотинібу, дозволяючи припустити, що комбінація сполуки, спрямована як на EGFR, так і на c-Met, могла б становити значний інтерес [Engelman JA at al., Science, 2007, 316:1039-43]. Більш ніж 20 мутацій відкрито в межах c-Met RTK [Ma P. C. et al. Cancer and metastasis rev. 2003, 22:309-25]. Більшість цих мутацій є місенс-мутаціями, локалізованими у внутрішньоклітинній ділянці c-Met, в межах тирозинкіназного домену, і які можуть порушувати спорідненість або зв’язуючі властивості терапевтичних сполук, спрямованих на цей тирозинкіназний домен. Таким чином, мутації c-Met можуть у більшому або меншому ступені реагувати на терапевтичні інгібірування. Наприклад, у доклінічних дослідженнях SU11274 (низькомолекулярного інгібітора тирозинкінази проти c-Met) деякі мутації були розділені на чутливі та стійкі до дії цього агента [Schmidt L. et al. Nat Genet. 1997, 16:68-73; Zhuang Z. et al. 1 UA 104144 C2 5 10 15 20 25 30 35 40 45 50 55 60 Nat Genet. 1998, 20:66-9]. M1268T і H1112Y є чутливими мутаціями, що виявляють знижений клітинний ріст і рухливість. Інші мутації, такі як L1213V і Y1248, були знайдені стійкими та несприйнятливими до впливу SU11274 [Hahn O. et al. Hematol Oncol Clin N Am. 2005, 19:343-67]. У цих дослідженнях продемонстрований прямий вплив конкретних мутацій на терапії, спрямовані на c-Met. Однак олігомеризація c-Met у присутності або за відсутності ліганду є потрібною для регуляції зв’язуючої спорідненості та кінетики зв'язування кінази по відношенню до АТФ та тирозинвмісних пептидних субстратів [Hays J.l., Watowich SJ, Biochemistry. 2004, 43:10570-8]. За останні кілька років розроблено багато різних стратегій з ослаблення передачі сигналу cMet у ракових клітинних лініях. Ці стратегії включають i) нейтралізуючі антитіла проти c-Met або HGF/SF [Cao B, Su Y, Oskarsson M, Zhao P, Kort EJ, Fisher RJ, Wang LM, Vande Woude GF, Proc Natl Acad Sci U S A. 2001, 98(13):7443-8; Martens T, Schmidt NO, Eckerich C, Fillbrandt R, Merchant M, Schwall R, Westphal M, Lamszus K, Clin Cancer Res. 2006, 12(20):6144-52] або використання HGF/SF антагоніста NK4 для запобігання зв'язування ліганду з c-Met [Kuba K, Matsumoto K, Date K, Shimura H, Tanaka M, Nakamura T, Cancer Res., 2000, 60:6737-43], ii) низькомолекулярні інгібітори АТФ-зв’язуючого сайта c-Met, які блокують кіназну активність [Christensen JG, Schreck R, Burrows J, Kuruganti P, Chan E, Le P, Chen J, Wang X, Ruslim L, Blake R, Lipson KE, Ramphal J, Do S, Cui JJ, Cherrington JM, Mendel DB, Cancer Res. 2003, 63:7345-55], iii) сконструйований поліпептид SH2 домену, який перешкоджає доступу до множинного стикувального сайта та РНКi або рибозим, який знижує експресію рецептора або лиганду. Більшість цих підходів проявляє селективне інгібування c-Met, що приводить в результаті до інгібування пухлини, і показує, що c-Met може становити інтерес для терапевтичного втручання при раку. Серед молекул, створених для спрямованості на c-Met, деякі є антитілами. Одним з найбільш широко описаних є антитіло анти-c-Met 5D5, створене Genentech [WO96/38557], яке діє як сильний агоніст, коли його додають окремо в різних моделях, і як антагоніст, коли його використовують у вигляді Fab фрагмента. Інше антитіло, спрямоване на cMet, описане Pfizer як антитіло, що діє “переважно як антагоніст c-Met і в деяких випадках як агоніст c-Met” [WO 2005/016382]. Автор винаходу продемонстрував, що антитіла, які є антагоністами c-Met, названі 224G11, 227H1, 223C4 і 11E1, або їх функціональний фрагмент, описані в даній заявці і також описані в заявках на патенти EP 073012312, поданій 12 липня 2007, та US 61/020639, поданій 11 січня 2008, мають властивість інгібування димеризації c-Met і є активнми in vivo. Таким чином, проблемою, що має бути вирішена винаходом, можна вважати розробку реальної, а не тільки гаданої комбінації, корисної для лікування раку. Більш конкретно, метою винаходу є розробка нової та несподіваної комбінації, здатної впливати на всі фактори, залучені в активацію c-Met, як описано вище. У загальному аспекті винахід відноситься до способу лікування раку у ссавця, який включає введення ссавцю терапевтично ефективної кількості комбінації активних інгредієнтів, що містить антагоніст c-Met і сполуку аміногетероарилу. В іншому загальному аспекті даний винахід спрямований на композицію, що містить антагоніст c-Met, який є антитілом або його функціональним фрагментом, і сполуку аміногетероарилу, переважно для її застосування як ліків. Далі даний винахід спрямований на фармацевтичну композицію, яка містить щонайменше: i) один антагоніст c-Met, що є антитілом або його функціональним фрагментом; і ii) сполуку аміногетероарилу, у вигляді комбінованих препаратів для одночасного, окремого або послідовного застосування. “Одночасне застосування” розуміють як таке, що означає введення двох сполук композиції згідно з винаходом у єдиній та ідентичній фармацевтичній формі. “Окреме застосування” розуміють як таке, що означає введення одночасно двох сполук композиції згідно з винаходом в окремих фармацевтичних формах. “Послідовне застосування” розуміють як таке, що означає послідовне введення двох сполук композиції згідно з винаходом, кожну в окремій фармацевтичній формі. Згідно з винаходом комбінацію краще змішують з ексципієнтом та/або з фармацевтично прийнятним носієм. Також описана та заявлена композиція згідно з винаходом як ліки. В іншій формі здійснення комбінація за винаходом може перебувати у формі набору із частин. Винахід, таким чином, включає препарат, що містить антагоніст c-Met, який є антитілом або одним з його функціональних фрагментів, і сполуку аміногетероарилу, краще, здатний до 2 UA 104144 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібування протеїнкіназної активності c-Met, як визначено вище, у вигляді комбінованого препарату для одночасної, окремої або послідовної доставки для лікування раку у ссавця, що потребує цього. В одній формі здійснення препарат містить антагоніст c-Met, що є антитілом або його функціональним фрагментом, і сполуку аміногетероарилу, як визначено вище, у вигляді комбінованого препарату для одночасного, окремого або послідовного застосування при лікуванні раку у ссавця, що потребує цього. В одній формі здійснення у винаході запропоновано фармацевтичну упаковку, що включає курс протиракової терапії для одного індивідуального ссавця, яка містить (a) щонайменше одну одиницю антагоніста c-Met, що є антитілом, і (б) щонайменше одну одиницю сполуки аміногетероарилу в стандартній лікарській формі. У більш конкретному аспекті винахід відноситься до способу лікування раку у ссавця, який включає введення ссавцю терапевтично ефективної кількості комбінації активних інгредієнтів відповідно до даного винаходу, яка містить антагоніст c-Met, що є антитілом або його функціональним фрагментом, і сполуку аміногетероарилу. Також у більш конкретному аспекті винахід відноситься до композиції, яка містить антагоніст c-Met, що є антитілом або його функціональним фрагментом, і аміногетероарил згідно з даним винаходом, для лікування раку, краще, у ссавця, ще краще, у людини. Протиракова терапія включає введення ссавцю терапевтично ефективної кількості композиції за даним винаходом. Краще, композиція додатково містить фармацевтично прийнятний носій та/або ексципієнт. У кращій формі здійснення сполука аміногетероарилу є здатною до інгібування протеїнкінази c-Met. Кращими є сполуки аміногетероарилу, які володіють щонайменше 25%, краще, 40%, 50%, 60%, 75% і 85% інгібіруючої активності протеїнкінази c-Met, продемонстрованої для сполуки аміногетероарилу, називаної PF-02341066, в умовах такої ж саме аналітичної методики (див. у даній заявці повну структуру цієї сполуки PF-02341066). Серед аналітичних методик, які можна використовувати для визначення рівня активності протеїнкінази c-Met у присутності сполуки аміногетероарилу, автори винаходу можуть процитувати методику аналізу, називану “безперервний спряжений спектрофотометричний аналіз HGFR”, описану на стор. 100 у заявці на патент PCT, опублікованій за номером WO 2006/021884. Терміни “антитіло”, “антитіла” або “імуноглобулін” використовують взаємозамінно в найширшому розумінні, і вони включають моноклональні антитіла (наприклад, повнорозмірні або інтактні моноклональні антитіла), поліклональні антитіла, полівалентні антитіла або мультиспецифічні антитіла (наприклад, біспецифічні антитіла, наскільки вони виявляють бажану біологічну активність). Більш конкретно, така молекула є глікопротеїном, який містить щонайменше два важкі (H) ланцюги та два легкі (L) ланцюги, взаємно з'єднані дисульфідними зв'язками. Кожний важкий ланцюг включає варіабельну область (або домен) важкого ланцюга (скорочену тут як HCVR або VH) і константну область важкого ланцюга. Константна область важкого ланцюга включає три домени, CH1, CH2 і CH3. Кожний легкий ланцюг включає варіабельну область легкого ланцюга (скорочену тут як LCVR або VL) і константну область легкого ланцюга. Константна область легкого ланцюга складається з одного домена, CL. Області VH і VL можуть бути додатково підрозділені на ділянки гіперваріабельності, називані ділянками визначення комплементарності (CDR), розділені більш консервативними ділянками, називаними каркасними областями (FR). Кожна VH і VL складається з трьох CDR і чотирьох FR, розташованих від аміно-кінця до карбокси-кінця в такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні області важкого та легкого ланцюга містять зв’язуючий домен, що взаємодіє з антигеном. Константні області антитіл можуть опосередковувати зв'язування імуноглобуліну з тканинами або факторами хазяїна, включаючи різні клітини імунної системи (наприклад, ефекторні клітини) і перший компонент (Clq) класичної системи комплементу. Вони можуть також включати деякі фрагменти антитіл, як більш докладно описано в даній заявці, які можуть мати бажану зв’язуючу специфічність та спорідненість, незалежно від джерела або типу імуноглобуліну (тобто, IgG, IgE, IgM, IgA і т.д.). Як правило, для одержання моноклональних антитіл або їх функціональних фрагментів, зокрема, мишачого походження, можна посилатися на методики, описані, зокрема, у посібнику “Antibodies” (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988), або на методику одержання з гібридом, описану Kohler and Milstein (Nature, 256:495-497, 1975). Вираз “антагоніст” повинен позначати сполуку, яка здатна прямо чи опосередковано протидіяти, знижувати або інгібувати біологічну активність c-Met. Як правило, “терапевтично ефективна кількість” відноситься до мінімальних концентрацій 3 UA 104144 C2 5 10 15 20 25 30 35 40 45 50 55 60 або кількостей сполуки чи сполук, які є ефективними для попередження, ослаблення, зменшення або полегшення симптомів захворювання або для продовження життя пацієнта, що потребує лікування. Більш конкретно, при посиланні на лікування раку, терапевтично ефективна кількість відноситься до такої кількості, яка має ефект (1) зменшення розміру (або краще, усунення) пухлини; (2) інгібування (тобто, вповільнення до певного ступеня, краще, зупинення) метастазів пухлини; (3) інгібування до певного ступеня (тобто вповільнення до певного ступеня, краще, зупинення) пухлинного росту; та/або (4) ослаблення до певного ступеня (або краще, усунення) одного чи більш ніж одного симптому, обумовленого раком. Більш конкретно, антагоніст c-Met, який є антитілом або його функціональним фрагментом, вибраний з групи, що складається з: - антитіла (утвореного з антитіла 224G11) або його функціонального фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID No. 1, 2 і 3; та легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID No. 10, 11 і 12; - антитіла (утвореного з антитіла 227H1) або його функціонального фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3 , що відповідно містять амінокислотні послідовності SEQ ID No. 4, 5 і 6; і легкий ланцюг, який відповідно містить CDR-L1, CDR-L2 і CDR-L3, що містять амінокислотні послідовності SEQ ID No. 13, 11 і 14; - антитіла (утвореного з антитіла 223C4), що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID No. 7, 8 і 9; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID No. 15, 16 і 17; і - антитіла (утвореного з антитіла 11E1), що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID No. 47, 48 і 49; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID No. 50, 51 і 52. У ще кращій формі здійснення антагоніст c-Met, який є антитілом або його функціональним фрагментом, вибраний із групи, що складається з: - антитіла (утвореного з антитіла 224G11) або його функціонального фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID No. 18, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID No. 21; - антитіла (утвореного з антитіла 227H1) або його функціонального фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID No. 19, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID No. 22; - антитіла (утвореного з антитіла 223C4), важкий ланцюг якого містить амінокислотну послідовність SEQ ID No. 20, а легкий ланцюг містить амінокислотну послідовність SEQ ID No. 23; і - антитіла (утвореного з антитіла 11E1), що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID No. 53, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID No. 54. В іншому конкретному аспекті антагоніст c-Met, який є антитілом або його функціональним фрагментом, є рекомбінантним, химерним або гуманізованим антитілом або його фрагментом, утвореним з антитіла 224G11, 227H1, 223C4 або 11E1 (під утвореним слід розуміти антитіла або їх фрагменти, які містять щонайменше 6 CDR або щонайменше легкий і важкий ланцюг, як визначено вище, для кожного з цих антитіл). Більш конкретно в кращій формі здійснення даний винахід відноситься до способу або композиції відповідно до винаходу, де антагоніст c-Met, який є антитілом, вибраний з 224G11, 227H1, 223C4 і 11E1. Усі ці моноклональні антитіла були секретовані гібридомами, депонованими в CNCM 03/14/2007 за номерами CNCM I-3724 (відповідає 11E1), I-3731 (відповідає 224G11), I-3732 (відповідає 227H1) і 07/06/2007 за номером I-3786 (відповідає 223C4). Ці гібридоми складаються з мишачої гібридоми, яка є результатом злиття спленоцитів імунізованої миші з клітинною лінією мієломи (Sp20 Ag14). Під CDR ділянками або CDR мають на увазі посилання на гіперваріабельні області важких і легких ланцюгів імуноглобулінів, як визначено IMGT. Унікальна нумерація IMGT визначена для порівняння варіабельних доменів незалежно від рецептора антигену, типу ланцюга або виду [Lefranc M.-P., Immunology Today 18, 509 (1997); Lefranc M.-P., The Immunologist, 7, 132-136 (1999);Lefranc, M.-P., Pommié, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В унікальній нумерації IMGT консервативні амінокислоти завжди мають одне й те саме 4 UA 104144 C2 5 10 15 положення, наприклад, цистеїн 23 (1st-CYS), триптофан 41 (CONSERVED-TRP), гідрофобна амінокислота 89, цистеїн 104 (2nd-CYS), фенілаланін або триптофан 118 (J-PHE або J-TRP). Унікальна нумерація IMGT забезпечує стандартизоване визначення границь каркасних областей (FR1-IMGT: положення 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 і FR4-IMGT: 118-128) та ділянок визначення комплементарності: CDR1-IMGT: 27-38, CDR2-IMGT: 56-65 і CDR3-IMGT: 105-117. Оскільки гепи є незайнятими положеннями, довжини CDR-IMGT (показані між дужками та розділені крапками, наприклад, [8.8.13]) стають критичною інформацією. Унікальну нумерацію IMGT використовують в 2D графічних зображеннях, позначених як IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002); Kaas, Q. and Lefranc, M.P., Current Bioinformatics, 2, 21-30 (2007)], та в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208D210 (2004)]. Існує три CDR важкого ланцюга та 3 CDR легкого ланцюга. Термін ділянка CDR або ділянки CDR використовують у даній заявці для посилання, залежно від ситуації, на одну з цих ділянок чи декілька, або навіть усі ці ділянки в цілому, які містять більшість амінокислотних залишків, відповідальних за зв'язування за рахунок спорідненості антитіла з антигеном або з епітопом, який воно розпізнає. У наведеній нижче таблиці 1 перегруповані елементи, що стосуються кращих антитіл. Таблиця 1 CDR-H1 CDR-H2 CDR-H3 H-ланцюг CDR-L1 CDR-L2 CDR-L3 L-ланцюг 224G11 227H1 223C4 11E1 I-3731 I-3732 I-3786 I-3724 Білок Нукл. к-та Білок Нукл. к-та Білок Нукл. к-та Білок Нукл. к-та SEQ ID SEQ ID SEQ ID SEQ ID SEQ ID SEQ ID SEQ ID SEQ ID 1 24 4 27 7 30 47 55 2 25 5 28 8 31 48 56 3 26 6 29 9 32 49 57 18 41 19 42 20 43 53 61 10 33 13 36 15 38 50 58 11 34 11 34 16 39 51 59 12 35 14 37 17 40 52 60 21 44 22 45 23 46 54 62 20 25 30 35 В іншій кращій формі здійснення способу або композиції згідно з винаходом антагоніст cMet, що є антитілом, є антитілом або одним з його функціональних фрагментів, утвореним від антитіла, називаного 224G11 (яке містить щонайменше 6 CDR SEQ ID No. 1, 2, 3, 10, 11 і 12 або щонайменше SEQ ID No. 18 і 21). Як описано в заявці на патент WO 2006/021884, опублікованій 2 березня 2006 (положення якої включені в дану заявку у вигляді посилання), сполуки аміногетероарилу відомі як інгібітор cMet та присутньої активності протеїнтирозинкінази. Як несподіваний результат, автором даної заявки вперше представлені результати, що ілюструють релевантний синергізм при комбінуванні моноклонального антитіла, антагоністичного до c-Met, як описано вище, зі сполукою аміногетероарилу, такою як описано в опублікованій заявці на патент WO 2006/021884. Винахід відноситься до способу або композиції для лікування раку у ссавця, який включає введення ссавцю терапевтично ефективної кількості комбінації активних інгредієнтів, що містить щонайменше один антагоніст c-Met, який є антитілом, як описано вище, і сполуку аміногетероарилу, краще, вибрану з описаних в опублікованій заявці на патент WO 2006/021884. Як кращий приклад, сполука аміногетероарилу композиції за даним винаходом є енантіомерно чистою сполукою формули I 5 UA 104144 C2 5 10 15 20 25 30 35 40 45 50 Формула I де: 12 Y позначає N або CR ; 1 R вибраний з атома водню, галогену, C6-12 арилу, 5-12-членного гетероарилу, C3-12 6 7 4 4 4 2 циклоалкілу, 3-12-членного гетероаліциклу, -O(CR R )nR , -C(O)R , -C(O)OR , -CN, -NO , 4 4 5 4 5 4 5 6 4 5 S(O)mR , -SO2NR R , -C(O)NR R , -NR C(O)R , -C(=NR )NR R , C1-8 алкілу, C2-8 алкенілу та C2-8 1 алкінілу; і кожний атом водню в R необов'язково заміщений однією або більш ніж однією 3 групою R ; 2 R позначає атом водню, галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 циклоалкіл, C6-12 4 4 5 4 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , 4 5 6 7 4 4 4 6 7 4 4 5 NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , 6 7 4 6 7 R 5 6 4 5 4 5 6 4 5 (CR R )nC(O)OR , -(CR R )nNC 4R , -C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR або 4 5 2 8 C(O)NR R , і кожний атом водню в R необов'язково заміщений на R ; 3 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 4 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , 4 5 4 4 5 6 7 4 4 4 6 7 4 SO2NR R , -S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , 4 5 6 7 4 6 7 4 6 7 4 5 6 7 4 5 NR C(O)R , -(CR R )nC(O)OR , -(CR R )nOR , -(CR R )nC(O)NR R , -(CR R )nNCR R , 6 4 5 4 5 6 4 5 4 5 3 C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR або -C(O)NR R , кожний атом водню в R 8 3 необов'язково заміщений на R , і групи R на сусідніх атомах можуть об’єднуватися з утворенням C6-12 арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної або 3-12-членної гетероаліциклічої групи; 4 5 6 7 кожний R , R , R і R незалежно позначає атом водню, галоген, C1-12 алкіл, C2-12 алкеніл, C212 алкініл, C3-12 циклоалкіл, C 6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил; 4 5 6 7 або будь-які два з R , R , R та R , зв'язані з одним й тим самим атомом азоту, можуть бути об'єднані разом з атомом азоту, з яким вони зв'язані, з утворенням 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи, що необов'язково містить від 1 до 3 4 5 6 7 додаткових гетероатомів, вибраних з N, O і S; або будь-які два з R , R , R і R , зв'язані з одним й тим самим атомом вуглецю, можуть бути об'єднані з утворенням C 3-12 циклоалкільної, C6-12 арильної, 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи; і кожний атом 4 5 6 7 8 водню в R , R , R і R необов'язково заміщений на R ; 8 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -NH2, -CN, -OH, O-C1-12 алкіл, -O-(CH2)nC3-12 циклоалкіл, -O-(CH2)nC6-12 арил, -O-(CH2)n(3-12-членний 8 гетероаліцикл) або -O-(CH2)n(5-12-членний гетероарил); і кожний атом водню в R необов'язково 11 заміщений на R ; 9 10 кожний R і R незалежно позначає атом водню, галоген, C1-12 алкіл, C3-12 циклоалкіл, C6-12 4 4 5 4 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , 4 5 6 7 4 4 4 4 5 6 7 4 NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -NR C(O)R , - (CR R )nC(O)OR , 6 7 4 5 4 5 6 4 5 4 5 9 10 (CR R )nNCR R , -NR C(O)NR R , -NR S(O)PR або -C(O)NR R ; R або R можуть об’єднуватися з кільцевим атомом A або із замісником A з утворенням C 3-12 циклоалкільного, 312-членного гетероаліцикліческого, C6-12 арильного або 5-12-членного гетероарильного кільця, 9 10 3 конденсованого з A; і кожний атом водню в R і R необов'язково заміщений на R ; 11 кожний R незалежно позначає галоген, C1-12 алкіл, C1-12 алкокси, C3-12 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -O-C1-12 алкіл, -O-(CH2)nC3-12 циклоалкіл, -O-(CH2)nC6-12 арил, -O-(CH2)n(3-12-членний гетероаліцикл), -O-(CH2)n(5-12-членний 11 гетероарил) або -CN, і кожний атом водню в R необов'язково заміщений на галоген, -OH, -CN, -C1-12 алкіл, що може бути частково або повністю галогенованим, -O-C1-12 алкіл, що може бути частково або повністю галогенованим, -CO, -SO або -SO2; 12 R позначає атом водню, галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 циклоалкіл, C64 4 5 4 12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , 6 UA 104144 C2 4 5 10 15 20 25 30 35 40 45 5 6 7 4 4 4 6 7 4 4 5 -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , 6 7 4 6 7 4 5 6 4 5 4 5 6 4 5 (CR R )nC(O)OR , -(CR R )nNCR R , -C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR або 4 5 12 3 C(O)NR R , і кожний атом водню в R необов'язково заміщений на R ; 13 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкенил, C2-12 алкеніл, C3-12 4 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , 4 5 4 4 5 6 7 4 4 4 6 7 4 SO2NR R , -S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , 4 5 6 7 4 6 7 4 6 7 4 5 6 7 4 5 NR C(O)R , -(CR R )nC(O)OR , -(CR R )nOR , -(CR R )nC(O)NR R , -(CR R )nNCR R , 6 4 5 4 5 6 4 5 4 5 6 7 C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR , -C(O)NR R , -(CR R )n(3-12-членний 6 7 6 7 6 7 гетероаліцикл), -(CR R )n(C3-12 циклоалкіл), -(CR R )n(C6-12 арил), -(CR R )n(5-12-членний 6 7 4 5 6 7 4 13 гетероарил), -(CR R )nC(O)NR R або -(CR R )nC(O)R , групи R на сусідніх атомах можуть об’єднуватися з утворенням C6-12 арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної 13 або 3-12-членної гетероаліциклічної групи, і кожний атом водню в R необов'язково заміщений 3 на R ; кожний m незалежно дорівнює 0, 1 або 2; кожний n незалежно дорівнює 0, 1, 2, 3 або 4; кожний p незалежно дорівнює 1 або 2; або її фармацевтично прийнятною сіллю, гідратом чи сольватом. В іншому кращому прикладі, сполука аміногетероарилу є енантіомерно чистою сполукою формули Ia: Формула Ia де: Y позначає N або CH; 1 R позначає групу фуран, тіофен, пірол, піролін, піролідин, діоксолан, оксазол, тіазол, імідазол, імідазолін, імідазолідин, піразол, піразолін, піразолідин, ізоксазол, ізотіазол, оксадіазол, триазол, тіадіазол, піран, піридин, піперидин, діоксан, морфолін, дитіан, тіоморфолін, піридазин, піримідин, піразин, піперазин, триазин, тритіан, азитидин або феніл; і 1 3 кожний атом водню в R необов'язково заміщений на R ; 3 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 4 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , 4 5 4 4 5 6 7 4 4 4 6 7 4 SO2NR R , -S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , 4 5 6 7 4 6 7 4 6 7 4 5 6 7 4 5 NR C(O)R , -(CR R )nC(O)OR , -(CR R )nOR , -(CR R )nC(O)NR R , -(CR R )nNCR R , 6 4 5 4 5 6 4 5 4 5 3 C(=NR )NR R , -NR C(O)NR R , -NR S(O)pR або -C(O)NR R , кожний атом водню в R 8 3 необов'язково заміщений на R , і групи R на сусідніх атомах можуть об’єднуватися з утворенням C6-12 арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної або 3-12-членної гетероаліциклічної групи; 4 5 6 7 кожний R , R , R і R незалежно позначає атом водню, галоген, C1-12 алкіл, C2-12 алкеніл, C212 алкініл, C3-12 циклоалкіл, C 6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил; 4 5 6 7 або будь-які два з R , R , R і R , зв'язані з одним й тим самим атомом азоту, можуть бути об'єднані разом з атомом азоту, з яким вони зв'язані, з утворенням 3-12-членної гетероаліциклічної або 5-12-членної гетероарильной групи, що необов'язково містить від 1 до 3 4 5 6 7 додаткових гетероатомів, вибраних з N, O і S; або будь-які два з R , R , R і R , зв'язані з одним й тим самим атомом вуглецю, можуть бути об'єднані з утворенням C 3-12 циклоалкільної, C6-12 арильної, 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи; і кожний атом 4 5 6 7 8 водню в R , R , R і R необов'язково заміщений на R ; 8 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -NH2, -CN, -OH, O-C1-12 алкіл, -O-(CH2)nC3-12 циклоалкіл, -O-(CH2)nC6-12 арил, -O-(CH2)n(3-12-членний 8 гетероаліцикл) або -O-(CH2)n(5-12-членний гетероарил); і кожний атом водню в R необов'язково 11 заміщений на R ; 7 UA 104144 C2 9 5 10 15 20 25 30 35 40 45 50 55 60 10 кожний R і R незалежно позначає атом водню, галоген, C1-12 алкіл, C3-12 циклоалкіл, C6-12 4 4 5 4 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , 4 5 6 7 4 4 4 4 5 6 7 4 NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -NR C(O)R , -(CR R )nC(O)OR , 6 7 4 5 4 5 6 4 5 4 5 9 10 (CR R )nNCR R , -NR C(O)NR R , -NR S(O)PR або -C(O)NR R ; R або R можуть об’єднуватися з кільцевим атомом A або із замісником A з утворенням C 3-12 циклоалкільного, 312-членного гетероаліциклічного, C 6-12 арильного або 5-12-членного гетероарильного кільця, 9 10 3 конденсованого з A; і кожний атом водню в R і R необов'язково заміщений на R ; 11 кожний R незалежно позначає галоген, C1-12 алкіл, C1-12 алкокси, C3-12 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -O-C1-12 алкіл, -O-(CH2)nC3-12 циклоалкіл, -O-(CH2)nC6-12 арил, -O-(CH2)n(3-12-членний гетероаліцикл), -O-(CH2)n(5-12-членний 11 гетероарил) або -CN, і кожний атом водню в R необов'язково заміщений на галоген, -OH, -CN, -C1-12 алкіл, який може бути частково або повністю галогенованим, -O-C1-12 алкіл, який може бути частково або повністю галогенованим, -CO, -SO або -SO2; 13 кожний R незалежно позначає галоген, C1-12 алкіл, C2-12 алкеніл, C2-12 алкініл, C3-12 4 циклоалкіл, C6-12 арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , 4 5 4 4 5 6 7 4 4 4 6 7 4 SO2NR R , -S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , 4 5 6 7 4 6 7 4 6 7 4 5 6 7 4 5 NR C(O)R , -(CR R )nC(O)OR , -(CR R )nOR , -(CR R )nC(O)NR R , -(CR R )nNCR R , 6 4 5 4 5 6 4 5 4 5 6 7 C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR , -C(O)NR R , -(CR R )n(3-12-членний 6 7 6 7 6 7 гетероаліцикл), -(CR R )n(C3-12 циклоалкіл), -(CR R )n(C6-12 арил), -(CR R )n(5-12-членний 6 7 4 5 6 7 4 13 гетероарил), -(CR R )nC(O)NR R або -(CR R )nC(O)R , групи R на сусідніх атомах можуть об’єднуватися з утворенням C6-12 арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної 13 або 3-12-членної гетероаліциклічної групи, і кожний атом водню в R необов'язково заміщений 3 на R ; кожний m незалежно дорівнює 0, 1 або 2; кожний n незалежно дорівнює 0, 1, 2, 3 або 4; кожний p незалежно дорівнює 1 або 2; або її фармацевтично прийнятною сіллю, гідратом або сольватом. Більш конкретно, кращі сполуки аміногетероарилу за винаходом вибрані з сполук амінопіридину або амінопиразину. Сполуку аміногетероарилу, краще, відповідно до форми здійснення винаходу, вибрано з групи, що складається з 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піразин-2-іламіну; 5йод-3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-піридин-2-іламіну; 5-бром-3-[1(R)-(2,6-дихлор-3фторфеніл)етокси]піридин-2-іламіну; 4-{5-аміно-6-[(R)-1-(2,6-дихлор-3фторфеніл)етокси]піразин-2-іл}бензойної кислоти; (4-{5-аміно-6-[(R)-1-(2,6-дихлор-3фторфеніл)етокси]піразин-2-іл}феніл)піперазин-1-ілметанону; 4-(4-{5-аміно-6-[(R)-1-(2,6-дихлор3-фторфеніл)-етокси]піразин-2-іл}бензоїл)-піперазин-1-карбонової кислоти трет-бутилового ефіру; 3-[(1R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-[4-(піперазин-1-ілкарбоніл)-феніл]піридин-2аміну; 4-{6-аміно-5-[(1R)-1-(2,6-дихлор-3-фторфеніл)етокси]-піридин-3-іл}-N-[2(диметиламіно)етил]-N-метилбензаміду; (4-{6-аміно-5-[(1R)-1-(2,6-дихлор-3фторфеніл)етокси]піридин-3-іл}-феніл)метанолу; 4-{6-аміно-5-[(1R)-1-(2,6-дихлор-3фторфеніл)етокси]піридин-3-іл}-N-[3-(диметиламіно)пропіл]-N-метилбензаміду; трет-бутил-4-(4{6-аміно-5-[(1R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-3-іл}бензоїл)піперазин-1карбоксилату; 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-[1-(1-метилпіперидин-4-іл)-1Hпіразол-4-іл]піридин-2-іламіну; 1-[4-(4-{6-аміно-5-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин3-іл}-піразол-1-іл)піперидин-1-іл]-2-гідроксіетанону; 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5(1-піперидин-4-іл-1H-піразол-4-іл)піридин-2-іламину; 3-[(R)-1-(2,6-дихлор-3-фторфеніл)-етокси]5-(1-піперидин-4-іл-1H-піразол-4-іл)піридин-2-іламіну; 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]5-(1-піперидин-4-іл-1H-піразол-4-іл)піразин-2-іламіну; 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]5-(1H-піразол-4-іл)піразин-2-іламіну; 1-[4-(4-{5-аміно-6-[(R)-1-(2,6-дихлор-3фторфеніл)етокси]піразин-2-іл}-піразол-1-іл)піперидин-1-іл]-2-гідроксіетанону; 3-[(R)-1-(2,6дихлор-3-фторфеніл)-етокси]-5-[1-(1-метилпіперидин-4-іл)-1H-піразол-4-іл]піразин-2-іламіну; 1[4-(4-{5-аміно-6-[(R)-1-(2,6-дихлор-3-фторфеніл)-етокси]піразин-2-іл}піразол-1-іл)піперидин-1-іл]2-диметиламіноетанону; 3-[(R)-1-(2-хлор-3,6-дифторфеніл)етокси]-5-(1-піперидин-4-іл-1Hпіразол-4-іл)піридин-2-іламіну; або їх фармацевтично прийнятної солі, сольвату або гідрату. В іншій кращій формі здійснення винаходу сполука аміногетероарилу є 3-[(R)-1-(2,6-дихлор3-фторфеніл)етокси]-5-(1-піперидин-4-іл-1H-піразол-4-іл)-піридин-2-іламіном. Іншою назвою, даною цій хімічній сполуці, є PF-02341066 (також пишуть PF-2341066). Дану конкретну сполуку докладно описано в Прикладі 13 опублікованої заявки на патент WO 2006/021884, і спосіб її одержання описаний в методиці 62, що цитується нижче. Загальна методика 62: 8 UA 104144 C2 5 10 15 20 25 30 35 До розчину 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-2-іламіну (12,83 г, 33,76 ммоль) у безводному ДМФ (100 мл) додавали ди-трет-бутилдикарбонат (21,25 г, 97,35 ммоль) і 4-диметиламінопіридин (0,793 г, 6,49 ммоль). Реакційну суміш перемішували при температурі навколишнього середовища протягом 18 годин в атмосфері азоту. До суміші додавали насичений розчин NaHCO3 (300 мл) і екстрагували EtOAc (3×250 мл). Об'єднані екстракти промивали водою (5×100 мл), насиченим NaHCO3 і розсолом, потім висушували над Na2SO4. Після фільтрування, випарювання та висушування у високому вакуумі ди-Boc-захищений 5бром-3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-2-іламін одержували у вигляді білуватої 1 пінистої твердої речовини (19,59 г, вихід 100%). H ЯМР (ДМСО-d6, 400 МГц) 8,18 (d, 1H), 7,83 (d, 1H), 7,59 (dd, 1H), 7,48 (t, 1H), 6,25 (q, 1H), 1,75 (d, 3H), 1,39 (s, 9H), 1,19 (s, 9H). До розчину ди-Boc-захищеного 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-2іламіну (19,58 г, 33,76 ммоль) в ДМСО (68 мл) додавали ацетат калію (11,26 г, 114,78 ммоль) і біс(пінаколато)дибор (10,29 г, 40,51 ммоль). Суміш дегазували та завантажували азотом три рази, потім додавали Pd(dppf)CI2·CH2CI2 (1,38 г, 1,69 ммоль). Реакційну суміш дегазували та завантажували азотом три рази, а потім перемішували в масляній бані при 80°C в атмосфері азоту протягом 12 годин. Реакційну суміш охолоджували до температури навколишнього середовища, розбавляли етилацетатом (100 мл) і фільтрували через шар целіту, який промивали етилацетатом. Об'єднаний етилацетатний розчин (700 мл) промивали водою (5×100 мл), розсолом (100 мл) і висушували над Na2SO4. Після фільтрування та концентрування залишок очищали на колонці силікагелю, елююючи EtOAc/гексаном (0%-50%), з одержанням диBoc-захищеного 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)піридин-2-іламіну у вигляді пінистої твердої речовини (20,59 г, вихід 1 97%). H ЯМР (ДМСО-d6, 400 МГц) 8,20 (d, 1H), 7,70 (d, 1H), 7,63 (dd, 1H), 7,47 (t, 1H), 6,20 (q, 1H), 1,73 (d, 3H), 1,50-1,13 (m, 30H). До розчину ди-Boc-захищеного 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)піридин-2-іламіну (20,34 г, 32,42 ммоль) в CH2CI2 (80 мл) додавали розчин сухий HCl у діоксані (4 н., 40,5 мл, 162 ммоль). Реакційний розчин перемішували в масляній бані при 40 °C в атмосфері азоту протягом 12 годин. Реакційну суміш охолоджували до температури навколишнього середовища, розбавляли EtOAc (400 мл), потім обережно, але швидко, промивали насиченим NaHCO 3 доти, поки водний шар не робиться основним (pH>8). Органічний шар промивали розсолом і висушували над Na 2SO4. Після фільтрування, випарювання та висушування у високому вакуумі 3-[(R)-1-(2,6-дихлор-3фторфеніл)етокси]-5-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)піридин-2-іламін одержували 1 у вигляді білуватої пінистої твердої речовини (13,48 г, вихід 97%). H ЯМР (ДМСО-d6, 400 МГц) 8,01 (d, 1H), 7,27 (dd, 1H), 7,17 (d, 1H), 7,03 (t, 1H), 6,12 (q, 1H), 5,08 (bs, 2H), 1,81 (d, 3H), 1,30 (s, 6H), 1,28 (s, 6H). До перемішуваного розчину 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-(4,4,5,5-тетраметил 9 UA 104144 C2 5 10 15 20 25 30 35 [1,3,2]діоксаборолан-2-іл)піридин-2-іламіну (4,2711 г, 10,0 ммоль) та 4-(4-бромпіразол-1іл)піперидин-1-карбонової кислоти трет-бутилового ефіру (3,9628 г, 12,0 ммоль) в DME (40 мл) додавали розчин Na2CO3 (3,1787 г, 30,0 ммоль) у воді (10 мл). Розчин дегазували та завантажували азотом три рази. До розчину додавали Pd(PPh 3J2CI2 (351 мг, 0,50 ммоль). Реакційний розчин знову дегазували та завантажували азотом три рази. Реакційний розчин перемішували в масляній бані при 87 °C протягом приблизно 16 годин (або до витрати пінаколового ефіру борану), охолоджували до температури навколишнього середовища та розбавляли EtOAc (200 мл). Реакційну суміш фільтрували через шар целіту та промивали EtOAc. Розчин EtOAc промивали розсолом, висушували над Na2SO4 і концентрували. Сирий продукт очищали на колонці силікагелю, елююючи системою EtOAc/гексан (від 0% EtOAc до 100% EtOAc), з одержанням 4-(4-{6-аміно-5-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-3іл}піразол-1-іл)піперидин-1-карбонової кислоти трет-бутилового ефіру (3,4167 г, вихід 65%, + чистота ~95%) при Rf 0,15 (50% EtOAc/гексани). МС m/e 550 (M+1) . До розчину 4-(4-{6-аміно-5-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]піридин-3-іл}піразол-1іл)піперидин-1-карбонової кислоти трет-бутилового ефіру (566,7 мг, 1,03 ммоль) в метанолі (5 мл) або дихлорметані (30 мл) додавали 4 н. HCI/діоксан (15 мл). Розчин перемішували протягом приблизно 1 години або до повного видалення захисту. Розчинники випарювали, і залишок розчиняли в метанолі та очищали на препаративній ВЕРХ C-18 з оберненою фазою, елююючи сумішшю ацетонітрил/вода з 0,1% оцтової кислоти від 5% до 30% з лінійним градієнтом. Після ліофілізації 3-[(R)-1-(2,6-дихлор-3-фторфеніл)етокси]-5-(1-піперидин-4-іл-1H-піразол-4іл)піридин-2-іламіну ацетат одержували у вигляді білої твердої речовини (410 мг, вихід 78%, 1 100% чистота за ВЕРХ, 96,4% е.н.). H ЯМР (ДМСО-d6, 400 МГц) 7,84 (s, 1H), 7,68 (d, 1H), 7,50 (dd, 1H), 7,46 (s, 1H), 7,37 (t, 1H), 6,83 (d, 1H), 6,02 (q, 1H), 5,57 (bs, 2H), 4,09 (m, 1H), 2,98 (m, + 2H), 2,53 (m, 2H), 1,88 (m, 2H), 1,82 (s, 3H), 1,73 (d, 3H), 1,70 (m, 2H). МС m/e 450 (M+1) . У конкретному аспекті винаходу розглянута композиція за даним винаходом, де сполука аміногетероарилу є сполукою формули Ib: Формула Ib В іншому аспекті винахід відноситься до способу, де рак вибраний з раків з гіперекспресією c-Met та/або таких, що виявляють аутофосфорильований c-Met. Більш конкретно, рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрію, гліобластоми або раку ободової кишки. У кращій формі здійснення винахід відноситься до композиції, як згадано вище, де антагоніст c-Met, який є антитілом, вибраний з антитіл, утворених з 224G11, 227H1, 223C4 і 11E1 або з їх функціональних фрагментів. Більш конкретно, антагоніст c-Met, який є антитілом, утворений з антитіла 224G11. Ще в одній іншій формі здійснення винаходу, в даній заявці описана композиція, де сполуку аміногетероарилу вибрано зі сполук амінопіридину або амінопіразину. Більш конкретно, сполука аміногетероарилу є сполукою формули Ib: 10 UA 104144 C2 5 10 15 20 25 30 35 40 45 Формула Ib Винахід також відноситься до застосування композиції, як визначено в даній заявці, для лікування раку у ссавця. У конкретній кращій формі здійснення рак вибраний з раків з гіперекспресією c-Met та/або з таких, що виявляють аутофосфорильований c-Met. Більш конкретно, рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрію, гліобластоми або раку ободової кишки. Винахід буде зрозумілий краще після прочитання наведених нижче прикладів, де: Фіг. 1 ілюструє активність in vivo 224G11 та активність in vivo PF-2341066 на NCI-H441 NSCLC, і Фіг. 2 ілюструє синергічну активність in vivo комбінації 224G11 і PF-2341066 на NCI-H441 NSCLC. Приклад 1: Активність in vivo 224G11 і PF-02341066 у вигляді окремих терапій Щоб перевірити, що модель NCI-H441 in vivo, доступна в лабораторії, є чутливою як до антитіла 224G11, так і до сполуки PF-2341066, використовували мишей з імунною недостатністю, трансплантованих підшкірно NCI-H441. Коротко, клітини NCI-H441 NSCLC з ATCC культивували в середовищі RPMI 1640, 10% ФСТ, 1% L-глутаміну. Клітини ділили за дві доби до трансплантації, щоб вони перебували в експоненціальній фазі росту. Десять мільйонів клітин NCI-H441 ін’єкувати підшкірно (s.c.) безтимусним мишам. Через п'ять діб після імплантації пухлини були вимірними, і тварин ділили на групи по 6 мишей з порівнянним розміром пухлини. Для обробки антитілом мишей обробляли інтраперитонеально (i.p.) насичуючою дозою 2 мг 224G11 Mab/мишу, а потім двічі на тиждень 1 мг антитіла/мишу. 50 мг/кг PF-02341066 вводили p.o. (пероральний зонд) щодоби протягом тижня, а потім 5 діб на тиждень при подвійній дозі на п'яту добу. Обробку продовжували протягом усього експерименту. Об'єм пухлини вимірювали двічі на тиждень і обчислювали за формулою: /6 × довжина × ширина × висота. Результати, описані на фіг. 1, показали значущу відмінність у пухлинному рості мишей, оброблених як 224G11, так і PF-02341066. У даному експерименті 224G11 і PF2341066 показали порівнянні протипухлинні активності. Приклад 2: Активність in vivo комбінації 224G11 і PF-02341066 Клітини NCI-H441 з ATCC рутинно культивували в середовищі RPMI 1640, 10% ФСТ, 1% Lглутаміну. Клітини ділили за дві доби до трансплантації, щоб вони перебували в експоненціальній фазі росту. Десять мільйонів клітин NCI-H441 ін’єкували s.c. безтимусним мишам. Через п'ять діб після імплантації пухлини були вимірними, і тварин ділили на групи по 6 мишей з порівнянним розміром пухлини. Для обробки антитілом мишей обробляли i.p. насичуючою дозою 2 мг 224G11 Mab/мишу, а потім двічі на тиждень 1 мг антитіла/мишу. 50 мг/кг PF-02341066 вводили p.o. (пероральний зонд), щодоби протягом тижня, а потім 5 діб на тиждень при подвійній дозі на п'яту добу. Групу мишей, що отримують і 224G11, і PF-2341066, обробляли, дотримуючись таких саме способів обробки, як описано вище для кожної сполуки. Об’єм пухлини вимірювали двічі на тиждень і обчислювали за формулою: /6 × довжина × ширина × висота, і моніторинг маси тіла тварин проводили щодоби протягом усього періоду обробки. Статистичний аналіз проводили для кожного виміру, використовуючи критерій Манна-Уітні. В даному експерименті мишей контрольної групи умертвляли на добу 53 з етичних причин. На добу 53 після першої ін'єкції середній розмір пухлини груп, оброблених одним способом, зменшувався на 64%, 73% і 93% для 224G11, PF-2341066 та 224G11+PF-2341066, відповідно. На добу 53 комбінована терапія значущо поліпшувала пухлинний ріст у порівнянні з обробками 11 UA 104144 C2 5 однією терапією (p0,002 у порівнянні з одним PF-2341066 і p0,002 у порівнянні з одним 224G11), причому у однієї з 6 мишей в групі комбінованої терапії не було пухлини. Значущих відмінностей не спостерігали між 2 обробками однією терапією. Ці результати, представлені на фіг. 2, були підтверджені через 14 діб після закінчення обробок (D67), де об'єм пухлин у групі, що отримує комбіновану терапію, залишився значущо більш низьким, ніж у тварин, яким робили ін’єкції способом однієї терапії, і де 16% мишей, що одержують комбіновану терапію, усе ще не мали пухлин. ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 45 1. Фармацевтична композиція, що містить антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, та аміногетероарильну сполуку, у якій: i) зазначений антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибирають з групи, що складається з: - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:1, 2 і 3; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:10, 11 і 12; - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:4, 5 і 6; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:13, 11 і 14; - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:7, 8 і 9; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:15, 16 і 17; і - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить CDR-H1, CDR-H2 і CDR-H3, що відповідно містять амінокислотні послідовності SEQ ID NО:47, 48 і 49; і легкий ланцюг, який містить CDR-L1, CDR-L2 і CDR-L3, що відповідно містять амінокислотні послідовності SEQ ID NО:50, 51 і 52, та ii) зазначену аміногетероарильну сполуку вибирають з групи сполук формули I: , у якій: 12 Y позначає N або CR ; 1 R вибраний з атома водню, галогену, C6-12арилу, 5-12-членного гетероарилу, C3-12циклоалкілу, 6 7 4 4 4 2 4 4 5 3-12-членного гетероаліциклу, -O(CR R )nR , -C(O)R , -C(O)OR , -CN, -NO , -S(O)mR , -SO2NR R , 4 5 4 5 6 4 5 -C(O)NR R , -NR C(O)R , -C(=NR )NR R , C1-8алкілу, C2-8алкенілу та C2-8алкінілу; і кожний атом 1 3 водню в R необов'язково заміщений однією або більш ніж однією групою R ; 2 R позначає атом водню, галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-12арил, 4 4 5 4 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , -NO2, 4 5 6 7 4 4 4 6 7 4 4 5 6 7 4 NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , -(CR R )nC(O)OR , 6 7 R 5 6 4 5 4 5 6 4 5 4 5 (CR R )nNC 4R , -C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR або -C(O)NR R , і кожний атом 2 8 водню в R необов'язково заміщений на R ; 3 кожний R незалежно позначає галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C64 4 5 4 12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR 4 5 6 7 4 4 4 6 7 4 4 5 6 7 4 NO2, -NR R -(CR R )nOR , -CN,-C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , -(CR R )nC(O)OR , 12 UA 104144 C2 6 5 10 15 20 25 30 35 40 45 50 55 7 4 6 7 4 5 6 7 4 5 6 4 5 4 5 6 -(CR R )nOR -(CR R )nC(O)NR R , -(CR R )nNCR R , -C(=NR )NR R , -NR C(O)NR R , 4 5 4 5 3 8 3 NR S(O)PR або -C(O)NR R , кожний атом водню в R необов'язково заміщений на R , і групи R на сусідніх атомах можуть об′єднуватися з утворенням C6-12арильної, 5-12-членної гетероарильної, C3-12 циклоалкільної або 3-12-членної гетероаліциклічої групи; 4 5 6 7 кожний R , R , R і R незалежно позначає атом водню, галоген, C1-12алкіл, C2-12алкеніл, C212алкініл, C3-12циклоалкіл, C6-1арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил; або 4 5 6 7 будь-які два з R , R , R та R , зв'язані з одним й тим самим атомом азоту, можуть бути об'єднані разом з атомом азоту, з яким вони зв'язані, з утворенням 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи, що необов'язково містить від 1 до 3 4 5 6 7 додаткових гетероатомів, вибраних з N, O і S; або будь-які два з R , R , R і R , зв'язані з одним й тим самим атомом вуглецю, можуть бути об'єднані з утворенням C 3-12циклоалкільної, C612арильної, 3-12-членної гетероаліциклічної або 5-12-членної гетероарильної групи; і кожний 4 5 6 7 8 атом водню в R , R , R і R необов'язково заміщений на R ; 8 кожний R незалежно позначає галоген, C1-12алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C612арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -NH2,-CN,-OH,-O-C1-12алкіл, -O(CH2)nC3-12циклоалкіл, -O-(CH2)nC6-12арил, -O-(CH2)n(3-12-членний гетероаліцикл) або -O8 11 (CH2)n(5-12-членний гетероарил); і кожний атом водню в R необов'язково заміщений на R ; 9 10 кожний R і R незалежно позначає атом водню, галоген, C 1-1алкіл, C3-12циклоалкіл, C6-12арил, 34 4 6 7 4 5 12-членний гетероаліцикл, 5-12-членний гетероарил-S(O)mR , -SO2NR R-(CR R )nNCR R , 4 5 6 4 5 4 5 9 10 NR C(O)NR R , -NR S(O)PR або -C(O)NR R ; R або R можуть об′єднуватися з кільцевим атомом A або із замісником A з утворенням C3-12циклоалкільного, 3-12-членного гетероаліциклічного, C6-12арильного або 5-12-членного гетероарильного кільця, конденсованого 9 10 3 з A; і кожний атом водню в R і R необов'язково заміщений на R ; 11 кожний R незалежно позначає галоген, C1-12алкіл, C1-12алкокси, C3-12циклоалкіл, C6-12арил, 312-членний гетероаліцикл, 5-12-членний гетероарил, -O-C1-12алкіл, -O-(CH2)nC3-12циклоалкіл, -O(CH2)nC6-12арил, -O-(CH2)n(3-12-членний гетероаліцикл), -O-(CH2)n(5-12-членний гетероарил) або 11 -CN, і кожний атом водню в R необов'язково заміщений на галоген, -OH, -CN, -C1-12алкіл, що може бути частково або повністю галогенованим, -O-C1-12алкіл, що може бути частково або повністю галогенованим, -CO, -SO або -SO2; 12 R позначає атом водню, галоген, C1-1алкіл, C2-12алкеніл, C2-12алкініл, C3-12циклоалкіл, C6-12арил, 4 4 5 4 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , -S(O)2OR , -NO2, 4 5 6 7 4 4 4 6 7 4 4 5 6 7 4 NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , -(CR R )nC(O)OR , 6 7 4 5 6 4 5 4 5 6 4 5 4 5 (CR R )nNCR R , -C(=NR )NR R , -NR C(O)NR R , -NR S(O)PR або -C(O)NR R , і кожний атом 12 3 водню в R необов'язково заміщений на R ; 13 кожний R незалежно позначає галоген, C1-12алкіл, C2-12алкеніл, C2-12алкеніл, C3-12циклоалкіл, 4 4 5 C6-12арил, 3-12-членний гетероаліцикл, 5-12-членний гетероарил, -S(O)mR , -SO2NR R , 4 4 5 6 7 4 4 4 6 7 4 4 5 S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R , 6 7 4 6 7 4 6 7 4 5 6 7 4 5 6 4 5 (CR R )nC(O)OR , -(CR R )nOR , -(CR R )nC(O)NR R , -(CR R )nNCR R , -C(=NR )NR R , 4 5 6 4 5 4 5 6 7 6 7 NR C(O)NR R , -NR S(O)PR , -C(O)NR R , -(CR R )n(3-12-членний гетероаліцикл), -(CR R )n(C36 7 6 7 6 7 4 5 12циклоалкіл), -(CR R )n(C6-12арил), -(CR R )n(5-12-членний гетероарил), -(CR R )nC(O)NR R або 6 7 4 13 -(CR R )nC(O)R , групи R на сусідніх атомах можуть об′єднуватися з утворенням C6-12арильної, 5-12-членної гетероарильної, C3-1циклоалкільної або 3-12-членної гетероаліциклічної групи, і 13 3 кожний атом водню в R необов'язково заміщений на R ; кожний m незалежно дорівнює 0, 1 або 2; кожний n незалежно дорівнює 0, 1, 2, 3 або 4; кожний p незалежно дорівнює 1 або 2; або її фармацевтично прийнятною сіллю, гідратом чи сольватом. 2. Композиція за п. 1 як ліки. 3. Фармацевтична композиція, яка містить щонайменше: i) один антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, як визначено у п. 1, і ii) аміногетероарильну сполуку, як визначено у п. 1, у вигляді комбінованих препаратів для одночасного застосування. 4. Композиція за будь-яким з пп. 1-3, де антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибраний з групи, що складається з: - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:18, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:21; 13 UA 104144 C2 5 10 15 20 25 30 35 40 - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:19, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:22; - антитіла або його антигензв′язуючого фрагмента, важкий ланцюг якого містить амінокислотну послідовність SEQ ID NО:20, а легкий ланцюг містить амінокислотну послідовність SEQ ID NО:23; і - антитіла або його антигензв′язуючого фрагмента, що включає важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:53, і легкий ланцюг, що містить амінокислотну послідовність SEQ ID NО:54. 5. Композиція за будь-яким з пп. 1-4, де антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, вибраний з групи, що складається з моноклональних антитіл, секретованих гібридомами, депонованими в Collection Nationale de Cultures de Microorganismes (CNCM, Institut Pasteur, Rue du Docteur Roux, Paris, France) 14 березня 2007 за номерами I-3724, I-3731, I-3732 і 6 липня 2007 за номером I-3786. 6. Композиція за п. 5, де антагоніст c-Met, що є антитілом, є моноклональним антитілом, називаним 224G11, секретованим гібридомою, депонованою в CNCM 14 березня 2007 за номером I-3731, або антитілом чи його антигензв′язуючим фрагментом, утвореним з даного антитіла 224G11, який включає: - щонайменше 6 CDR, що мають послідовності SEQ ID NО:1, 2, 3, 10, 11 і 12; або - щонайменше важкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:18, і легкий ланцюг, який містить амінокислотну послідовність SEQ ID NО:21. 7. Композиція за будь-яким з пп. 1-6, де сполуку аміногетероарилу вибрано зі сполук амінопіридину або амінопіразину. 8. Композиція за будь-яким з пп. 1-7, де сполука аміногетероарилу є сполукою формули Ib: . 9. Композиція за будь-яким з пп. 1-8 для лікування раку. 10. Застосування фармацевтичної композиції за п. 3, що містить у вигляді комбінованих препаратів для одночасного застосування щонайменше антагоніст c-Met, який є антитілом або його антигензв′язуючим фрагментом, і сполуку аміногетероарилу, як визначено в будь-якому з пп. 1-9, для отримання ліків для лікування раку. 11. Композиція за п. 9, де рак вибраний з раків з гіперекспресією c-Met та/або таких, що виявляють аутофосфорильований c-Met. 12. Композиція за п. 9, де рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрія, гліобластоми або раку ободової кишки. 13. Композиція за будь-яким з пп. 9, 11 і 12 для лікування раку у ссавця, краще, людини. 14. Застосування за п. 10, де рак вибраний з раків з гіперекспресією c-Met та/або таких, що виявляють аутофосфорильований c-Met. 15. Застосування за п. 10, де рак вибраний з раку простати, остеосарком, раку легені, раку молочної залози, раку ендометрія, гліобластоми або раку ободової кишки. 16. Застосування за будь-яким з пп. 10, 14 та 15 для лікування раку у ссавця, краще, людини. 14 UA 104144 C2 15 UA 104144 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюCombination of a c-met antagonist and an aminoheteroaryl compound for the treatment of cancer
Автори російськоюGoetsch, Liliane
МПК / Мітки
МПК: A61K 31/435, A61K 39/395, A61P 35/00
Мітки: антагоніста, лікування, с-мет, раку, комбінація, аміногетероарилу
Код посилання
<a href="https://ua.patents.su/18-104144-kombinaciya-antagonista-s-met-ta-aminogeteroarilu-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Комбінація антагоніста с-мет та аміногетероарилу для лікування раку</a>
Попередній патент: Пристрій для подрібнювання у шарі матеріалу
Наступний патент: Спосіб одержання марганцевих котунів з некальцинованої марганцевої руди і агломерат, одержаний даним способом
Випадковий патент: Спосіб диференційної діагностики плевриту туберкульозної та ракової етіології












