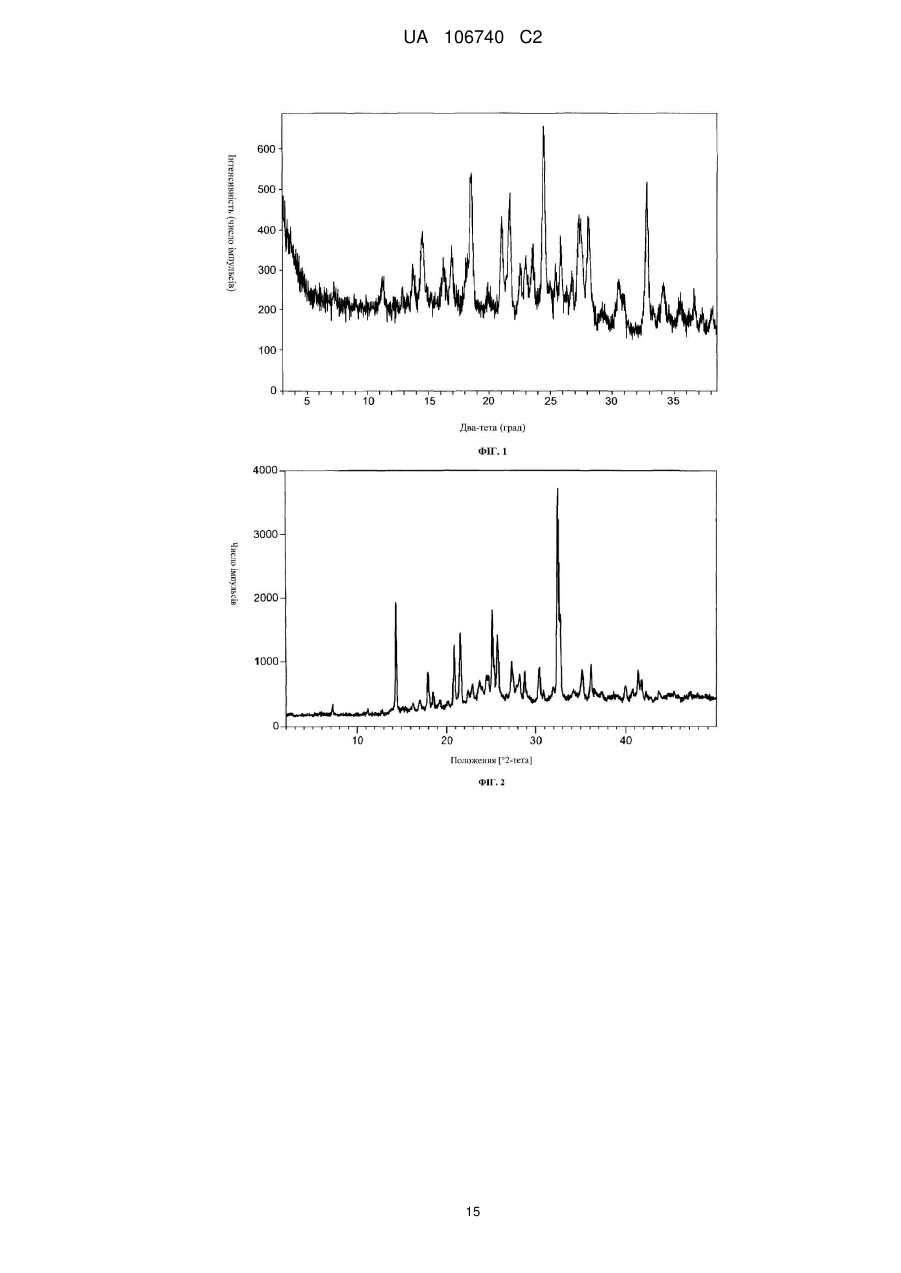
Кристалічний гідрохлорид n-{(1s)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1н-піразол-5-іл)-2-тіофенкарбоксаміду
Формула / Реферат
1. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки при 14,4°±0,3° і 32,4°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKα-випромінювання.
2. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-{4-хлор-1-метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 1, а також характеристичні дифракційні піки при 25,1°±0,3° і 25,7°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKα-випромінювання.
3. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 2, а також характеристичні дифракційні піки при 21,5°±0,3° і 20,8°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKα-випромінювання.
4. Фармацевтична композиція, що включає кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-{4-хлор-1-метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 1, а також фармацевтично прийнятний носій або розчинник.
5. Спосіб лікування або полегшення тяжкості раку у ссавця, який цього потребує, що включає введення вказаному ссавцеві терапевтично ефективної кількості композиції за п. 4.
6. Спосіб за п. 5, де ссавець є людиною.
7. Спосіб за п. 6, де сполуку вводять перорально.
8. Спосіб за п. 5, де вказане ракове захворювання вибране з: раку мозку (гліом), гліобластом, синдрому Баннаяна-Зонана, хвороби Ковдена, хвороби Лермітт-Дюкло, раку грудей, запального раку грудей, пухлини Більма, саркоми Евінга, рабдоміосаркоми, епендимоми, медулобластоми, раку товстої кишки, раку голови й шиї, раку нирок, раку легенів, раку печінки, меланоми, раку яєчників, раку підшлункової залози, раку простати, саркоми, остеосаркоми, гігантоклітинної пухлини кісток, раку щитовидної залози, лімфобластомного Т-клітинного лейкозу, хронічного мієлогенного лейкозу, хронічного лімфоцитарного лейкозу, лейкозу ворсистих клітин, гострого лімфобластомного лейкозу, гострого мієлогенного лейкозу, хронічного нейтрофільного лейкозу, гострого лімфобластомного Т-клітинного лейкозу, плазмацитоми, імунобластомного великоклітинного лейкозу, лейкозу клітин мантійної зони, множинної мієломи, мегакаріобластомного лейкозу, множинної мієломи, гострого мегакаріоцитарного лейкозу, промієлоцитарного лейкозу, еритролейкозу, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластомної клітинної лімфоми, лімфоми Беркітта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелію, раку легенів, раку вульви, раку шийки матки, раку ендометрія, раку нирок, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоклітинного раку, раку шлунка, раку носоглотки, раку щік, раку ротової порожнини, GIST (шлунково-кишкових стромальних пухлин) і раку яєчок.
Текст
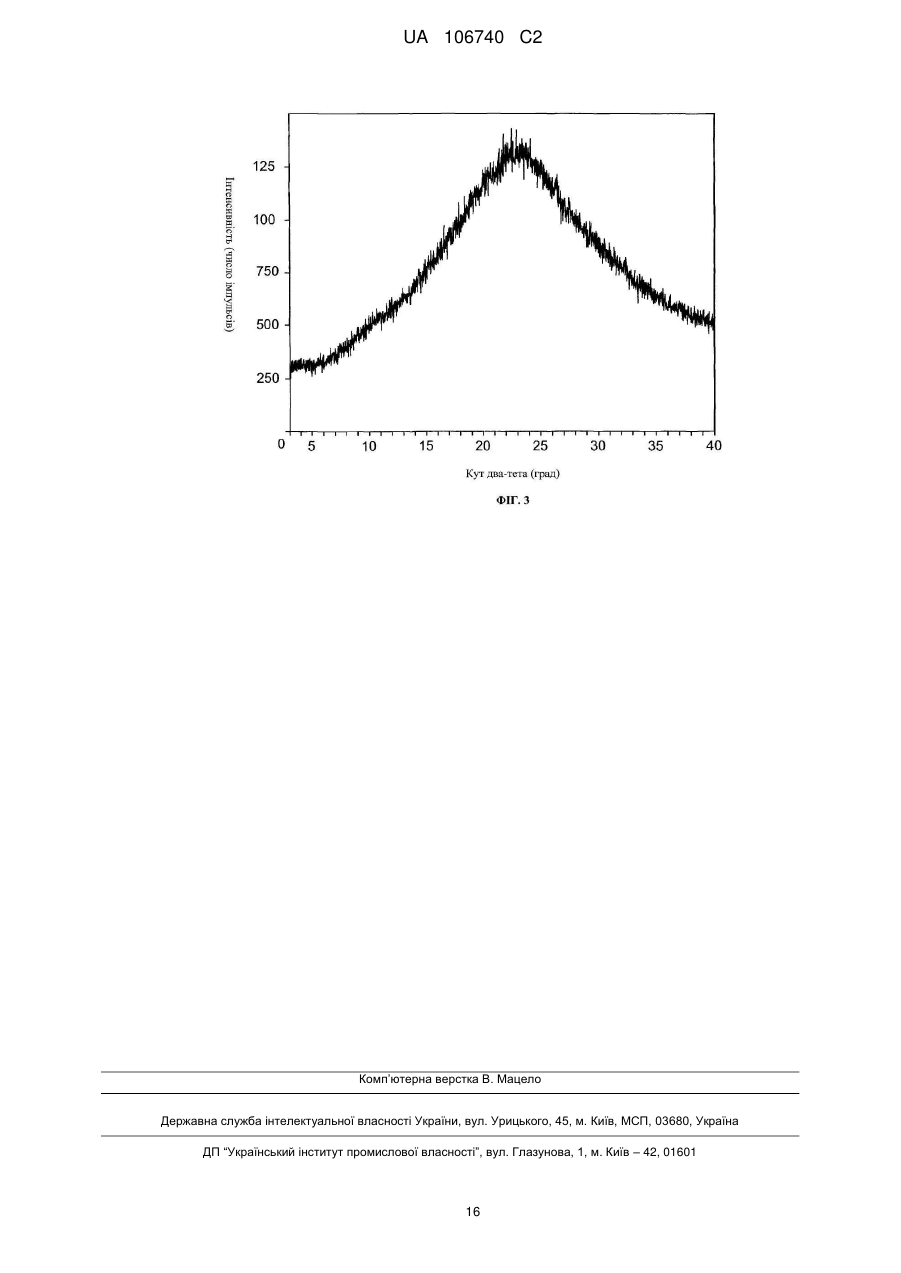
Реферат: У винаході розроблений вдосконалений інгібітор АКТ, а саме кристалічний гідрохлорид N-{(1S)2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1Н-піразол-5-іл)-2тіофенкарбоксаміду. UA 106740 C2 (12) UA 106740 C2 UA 106740 C2 Даний винахід відноситься до вдосконаленого інгібітору протеїн кінази B (далі за текстом PKB/Akt, PKB або AKT), а саме гідрохлориду N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду в кристалічній формі. Ця сполука представлена структурною формулою (I): 5 10 15 20 25 30 35 40 45 50 . Сполука за даним винаходом застосовна як інгібітор активності AKT і при лікуванні ракових захворювань і артриту. КОРОТКИЙ ОПИС ФІГУР КРЕСЛЕНЬ На фіг.1 подана картина дифракції рентгенівських променів (PXRD) для N-{(1S)-2-аміно-1[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду в кристалічній формі. На фіг.2 подана картина дифракції рентгенівських променів (PXRD) для N-{(1S)-2-аміно-1[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду в кристалічній формі. На фіг.3 подана картина дифракції рентгенівських променів (PXRD) для N-{(1S)-2-аміно-1[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду в аморфній формі. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2тіофенкарбоксамід є сполукою, яка було розкрита й заявлена, поряд зі своїми фармацевтично прийнятними солями, як придатна для вживання як інгібітор активності AKT, зокрема при лікуванні раку й артриту, в міжнародній заявці №PCT/US08/053269, з міжнародною датою подачі 7 лютого 2008 р.; міжнародній патентній публікації № WO 08/098104 з датою міжнародної публікації 14 серпня 2008 р. (сполука прикладу 96). Вміст указаних документів повністю включений у дану заявку за допомогою посилання. В міжнародній заявці № PCT/US08/053269 розкритий спосіб одержання гідрохлориду N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду. Проте гідрохлорид, отриманий за способом прикладу 96 міжнародної заявки № PCT/US08/053269, має аморфну форму. В даному винаході було виявлено, що гідрохлорид N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду може бути отриманий у кристалічній формі, і що кристалічна форма має низку переваг у порівнянні з вільною кислотою та іншими сольовими формами, в т.ч. гідрохлоридом в аморфній формі. Кристалічну форму гідрохлориду N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду легко вводити до складу фармацевтичних дозованих форм, зокрема пігулок, і вона має підвищену хімічну стійкість. Кристалічна форма за даним винаходом є негігроскопічною, безводною формою й демонструє хорошу розчинність у біологічних середовищах. Аморфна форма є гігроскопічною. Хоча сполуку у вільній формі можна з успіхом застосовувати як інгібітор активності AKT, в т.ч. при лікуванні ракових захворювань і артриту, кристалічна форма гідрохлориду N-{(1S)-2аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2тіофенкарбоксаміду має додаткові переваги. Сполука за даним винаходом, тобто гідрохлорид N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду в кристалічній формі (далі по тексту - «активний інгредієнт» або «сполука A»), застосовна як інгібітор активності AKT, зокрема при лікуванні ракових захворювань і артриту. Активний інгредієнт за даним винаходом можна вводити у складі звичайних дозованих форм, отриманих змішуванням активного інгредієнта зі звичайним фармацевтично прийнятним носієм або розчинником відповідно до методик, добре відомих фахівцеві в даній галузі техніки, наприклад, описаних у міжнародній заявці № PCT/US08/053269. Відповідно, в обсяг даного винаходу входять фармацевтичні композиції, що включають гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол5-іл)-2-тіофенкарбоксаміду у кристалічній формі як активний інгредієнт у поєднанні з фармацевтично прийнятним носієм або розчинником. Сполуку A за даним винаходом можна вводити пероральним, парентеральним, інтрадермальним або місцевим шляхом. Термін 1 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 «парентеральний» у даній заявці включає внутрішньовенне, внутрішньом'язове, підшкірне, інтраназальне, інтраректальне, інтравагінальне й інтраперитонеальне введення. В основному переважне пероральне введення. Сполуку A можна включати до складу дозованих форм, відповідних для кожного зі шляхів введення, в т.ч. капсул, пігулок, пілюль, порошків і гранул. У таких твердих дозованих формах, активна сполука, як правило, змішана, щонайменше, з одним інертним розчинником. Пероральні дозовані форми можуть також включати, як звичайна практика, додаткові речовини, окрім інертних розчинників, наприклад, змащувальні засоби, ковзкі засоби й антиоксиданти. В разі капсул, пігулок і пілюль, дозовані форми можуть включати також буферні засоби. Крім того, пігулки й пілюлі можуть мати такий склад, який забезпечує тривале вивільнення. Препарати за даним винаходом призначені для парентерального введення, включають стерильні водні розчини, хоча можуть застосовуватися й неводні суспензії або емульсії. Ці дозовані форми можуть також включати ад’юванти, наприклад консервуючі, зволожуючі, осмотичні, буферизуючі, емульгуючі та диспергуючі агенти. Їх можна стерилізувати, наприклад, за допомогою фільтрування через фільтр, що утримує бактерії, шляхом включення в композиції стерилізуючих агентів, опроміненням композицій або нагріванням композицій. Вміст активного інгредієнта за даним винаходом у описаних вище дозованих лікарських формах має бути ефективною кількістю, переважно вибраною з діапазону 0,001-100 мг/кг загальної маси тіла, переважно 0,001-50 мг/кг. При лікуванні пацієнта з числа людей, що потребують інгібування AKT за необхідності лікування раку або за необхідності лікування артриту, вибрану дозу переважно вводять від 1 до 6 разів на день, перорально або парентерально. Переважні форми парентерального введення включають місцеве введення, ректальне введення, трансдермальне введення, введення за допомогою ін'єкції або тривале вливання за допомогою інфузії. Пероральні дозовані форми, призначені для прийому людьми, переважно містять від 0,05 до 3500 мг активного інгредієнта, найбільш переважно від 0,5 до 1000 мг активного інгредієнта. Переважним є пероральне введення, при якому застосовуються нижчі дозування. Проте, крім того, можна застосовувати парентеральне введення вищих доз, якщо це безпечно і зручно для пацієнта. Наведені вище дозування відносяться до переважних кількостей активного інгредієнта у формі вільної кислоти. Фахівець у даній галузі техніки зрозуміє, що оптимальна кількість і розподіл індивідуальних доз активного інгредієнта визначатиметься природою й мірою розвитку стану, що піддається лікуванню, формою, шляхом і місцем уведення, а також конкретним пацієнтом, і що цей оптимум можна визначити за допомогою звичайних методик. Крім того, фахівець у даній галузі техніки зрозуміє, що оптимальний курс лікування, тобто кількість доз активного інгредієнта, що вводяться протягом доби впродовж певної кількості днів, може бути визначений фахівцем у даній галузі з використанням звичайних тестів для виявлення належного курсу лікування. Взагалі кажучи, сполуки за даним винаходом отримують розчиненням вільної основи, тобто N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2тіофенкарбоксаміду у відповідному органічному розчиннику, наприклад, метил-трет-бутиловому ефірі (MTBE), з подальшим додаванням до цього розчину HCl, наприклад 4М HCl у діоксані при нагріванні, наприклад, до 42°C протягом 4 годин. Розчину дають остигнути і сполуку за даним винаходом відокремлюють фільтруванням і висушують, наприклад, висушують у вакуумі або на повітрі при підвищеній температурі. Органічні розчинники можна придбати в Aldrich Chemical Company, Milwaukee, Wisconsin. Оскільки фармацевтично активна сполука за даним винаходом виявляє активність як інгібітор AKT, вона демонструє терапевтичну ефективність при лікуванні раку й артриту. Відповідно, даний винахід відноситься до способу лікування або полегшення тяжкості ракового захворювання, вибраного з: раку мозку (гліом), гліобластом, синдрому БаннаянаЗонана, хвороби Ковдена, хвороби Лермітт-Дюкло, раку грудей, запального раку грудей, пухлини Вільма, саркоми Евінга, рабдоміосаркоми, епендимоми, медулобластоми, раку товстої кишки, раку голови й шиї, раку нирок, раку легенів, раку печінки, меланоми, раку яєчників, раку підшлункової залози, раку простати, саркоми, остеосаркоми, гігантоклітинної пухлини кісток, раку щитовидної залози, лімфобластного T-клітинного лейкозу, хронічного мієлогенного лейкозу, хронічного лимфоцитарного лейкозу, лейкозу ворсистих клітин, гострого лімфобластного лейкозу, гострого мієлогенного лейкозу, хронічного нейтрофільного лейкозу, гострого лімфобластного Tклітинного лейкозу, плазмацитоми, імунобластного крупноклітинного лейкозу, лейкозу клітин мантійної зони, множинної мієломи, мегакаріобластного лейкозу, множинної мієломи, гострого мегакаріоцитарного лейкозу, промієлоцитарного лейкозу, еритролейкозу, 2 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 60 злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластної Tклітинної лімфоми, лімфоми Беркітта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелію, раку легенів, раку вульви, раку шийки матки, раку ендометрію, раку нирок, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоклітинного раку, раку шлунку, раку носоглотки, раку щік, раку ротової порожнини, GIST (шлунково-кишкових стромальних пухлин) і раку яєчок. Як зазначено в PCT/US2008/053269, сполуку за даним винаходом, отриману за способом PCT/US2008/053269, тестували на активність в основному відповідно до ферментного аналізу AKT, розкритого в PCT/US2008/053269, і щонайменше в одному експерименті демонстрували значення pIC50, рівне 9,0 для повнорозмірного AKT1; рівне 8,0 для повнорозмірного AKT2; і рівне 8,8 для повнорозмірного AKT3. Під терміном «лікування» і його похідними в даній заявці мається на увазі терапевтичне лікування. Профілактичне лікування підходить, наприклад, у випадку, якщо вважається, що в суб'єкта є високий ризик розвитку раку, або якщо суб'єкт піддається дії канцерогенів. У даному описі термін «ефективна кількість» і його похідні означає таку кількість лікарського засобу або фармацевтичного агента, яка викличе таку біологічну або медичну реакцію тканини, системи, тварини або людини, яка малася на увазі, наприклад, дослідником або клініцистом. Крім того, термін «терапевтично ефективна кількість» і його похідні означає будь-яку кількість, яка, при порівнянні з відповідним суб'єктом, який не отримував цієї кількості, приводить до ефективнішого лікування, профілактики або полегшення захворювання, розладу або побічного ефекту, або до зниження швидкості розвитку захворювання або розладу. Цей термін також охоплює кількості препаратів, ефективні для поліпшення нормальної фізіологічної функції. Під терміном «спільне введення» і його похідними в даній заявці мається на увазі або одночасне введення, або будь-який спосіб роздільного послідовного введення сполуки A та іншого активного інгредієнта або інгредієнтів, про які відомо, що вони застосовні при лікуванні раку, включаючи хіміотерапію й радіаційне лікування, або застосовні при лікуванні артриту. Термін «інший активний інгредієнт або інгредієнти» в даній заявці включає будь-яку сполуку або терапевтичний агент, про який відомо, що він має корисні властивості або який демонструє такі властивості при введенні пацієнтові в разі потреби лікування раку або артриту. Переважно, якщо введення не є одночасним, сполуки вводять протягом мінімального проміжку часу одна відносно одної. Крім того, не важливо, чи вводяться сполуки в тій самій дозованій лікарській формі, наприклад, одну сполуку можна вводити місцево, а іншу сполуку можна вводити перорально. Як правило, при лікуванні раку сполукою за даним винаходом можна здійснювати спільне введення будь-якого анти-неопластичного агента, який має активність проти сприйнятливих до нього пухлин, що піддаються лікуванню. Приклади таких агентів можна знайти в Cancer Principles and Practice of Oncology by V.T.Devita and S.Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Рядовий фахівець у даній галузі міг би розпізнати корисні комбінації агентів на основі конкретних характеристик лікарських препаратів і ракового захворювання. Типові анти-неопластичні агенти, застосовні в даному винаході, включають, не обмежуючись цим, агенти, що порушують утворення мікротрубочок, наприклад дитерпеноїди й алкалоїди барвінку; координаційні комплекси платини; алкілуючі агенти, наприклад азотисті іприти, оксазафосфорини, алкілсульфонати, нітрозосечовини і триазени; антибіотики, наприклад антрацикліни, актиноміцини й блеоміцини; інгібітори топоізомерази II, наприклад епіподофілотоксини; антиметаболіти, наприклад аналоги пурину й піримідину й антифолати; інгібітори топоізомерази I, наприклад камптотецини; гормони й аналоги гормонів; інгібітори шляхів передачі сигналу; нерецепторні тирозинкінази, що є інгібіторами ангіогенезу; імунотерапевтичні агенти; проапоптотичні агенти; й інгібітори передачі сигналів клітинного циклу. Прикладами іншого активного інгредієнта й інгредієнтів (анти-неопластичного агента), придатних для вживання в комбінації або для спільного введення зі сполукою A за даним винаходом, є хіміотерапевтичні засоби. Засоби, що порушують збірку мікротрубочок, або антимітотичні агенти є фазоспецифічними агентами, що виявляють активність проти мікротрубочок пухлинних клітин під час фази M або мітозу клітинного циклу. Приклади таких агентів включають, не обмежуючись цим, дитерпеноїди й алкалоїди барвінку. Дитерпеноїди, які витягують з природних джерел, є фазоспецифічними протираковими агентами, які діють під час фаз G2/M клітинного циклу. Вважається, що дитерпеноїди стабілізують субодиницю β-тубуліну мікротрубочок, за рахунок зв'язування з цим білком. Відсутність білка при збірці мікротрубочки, що виникає після його інгібування, приводить до 3 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 60 зупинки мітозу й подальшої смерті клітини. Приклади дитерпеноїдів включають, не обмежуючись цим, паклітаксел і його аналог доцетаксел. Паклітаксел, тобто 5β,20-епокси-1,2α,4,7β,10β,13α-гексагідрокситакс-11-ен-9-он 4,10діацетат 2-бензоат 13-ефір з (2R,3S)-N-бензоїл-3-фенілізосерином, є природним дитерпеновим продуктом, виділеним з тихоокеанського тису Taxus brevifolia, і його можна придбати у вигляді розчину для ін'єкцій TAXOL®. Він є членом сімейства таксанів, що входить до числа терпенів. Вперше паклітаксел був виділений в 1971 р. Wani і співавторами (J. Am. Chem. Soc., 93:2325, 1971), які встановили його структуру хімічними методами і способом рентгенівської кристалографії. Один з механізмів, що забезпечують активність паклітакселу, пов'язаний з його здатністю зв'язувати тубулін, тим самим інгібуючи зростання ракових клітин. Schiff et al., Proc. Natl. Acad. Sci., USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol. Chem., 256: 10435-10441 (1981). Для ознайомлення з оглядом синтезу й протиракової активності деяких похідних паклітакселу див.: D.G.I.Kingston et al., Studies in Organic Chemistry vol.26, розділ, озаглавлений “New trends in Natural Products Chemistry 1986”, Attaur-Rahman, P.W.Le Quesne, Eds. (Elsevier, Amsterdam, 1986), pp.219-235. Паклітаксел був схвалений для клінічного застосування в Сполучених Штатах при лікуванні рефрактерного раку яєчників (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann. Intem, Med., 111:273, 1989) і для лікування раку грудей (Holmes et al., J. Nat. Cancer Inst., 83:1797, 1991). Паклітаксел є потенційним кандидатом для лікування новоутворень на шкірі (Einzig et al., Proc. Am. Soc. Clin. Oncol., 20:46), а також карцином голови й шийного відділу (Forastire et al., Sem.Oncol., 20:56, 1990). Крім того, ця сполука демонструє потенціал для лікування полікистозної хвороби нирок (Woo et al., Nature, 368:750, 1994), раку легенів і малярії. Лікування пацієнтів паклітакселом приводить до придушення діяльності кісткового мозку (багаточисельні послідовності клітинних поколінь, Ignoff, R.J. et al., Cancer Chemotherapy Pocket Guide, 1998), пов'язаного з тривалим введенням при концентраціях вище порогової (50 нМ) (Kearns, C.M. et al., Seminars in Oncology, 3(6) p.16-23, 1995). Доцетаксел, тобто тригідрат (2R,3S)-N-карбокси-3-фенілізосерину N-трет-бутилового ефіру, 13-ефіру з 5β-20-епокси-1,2α,4,7β,10β,13β-гексагідрокситакс-11-ен-9-он 4-ацетат 2-бензоатом, можна придбати у вигляді розчину для ін'єкцій TAXOTERE®. Доцетаксел показаний для лікування раку грудей. Доцетаксел є напівсинтетичною похідною паклітакселу (див. вище), що отримується з використанням природного синтетичного попередника, а саме 10-деацетилбаккатину III, який екстрагують з голок європейського тиса. Токсичність, що обмежує дозування доцетакселу, пов'язана з нейтропенією. Алкалоїди барвінку є фазоспецифічними анти-неопластичними агентами, що виділяються з рослини барвінок малий. Алкалоїди барвінку діють під час фази M (мітозу) клітинного циклу за рахунок специфічного зв'язування з тубуліном. Внаслідок цього, зв'язані молекули тубуліну не здатні полімеризуватися з утворенням мікротрубочок. Вважається, що мітоз зупиняється в метафазі з подальшою смертю клітини. Приклади алкалоїдів барвінку включають, не обмежуючись цим, вінбластин, вінкристин і вінорелбін. Вінбластин, тобто вінкалейкобластину сульфат, можна придбати під торгівельним найменуванням VELBAN® у формі розчину для ін'єкцій. Хоча є можливість його вживання як терапії другої лінії при лікуванні різних солідних пухлин, він перш за все показаний при лікуванні раку яєчок і різних лімфом, включаючи хворобу Ходжкіна; а також лімфоцитарних і гістоцитарних лімфом. Побічною дією вінбластину, що обмежує його дозування, є мієлосупресія. Вінкристин, тобто вінкалейкобластину, 22-оксо, сульфат, можна придбати під торгівельним найменуванням ONCOVIN® у формі розчину для ін'єкцій. Вінкристин показаний для лікування гострого лейкозу, а також знайшов вживання в схемах лікування Ходжкінських і не Ходжкінських злоякісних лімфом. Облисіння і неврологічні ефекти є найбільш поширеними побічними діями вінкристину, й у меншій мірі виявляється мієлосупресія й дія на слизисту оболонку шлунковокишкового тракту. Вінорелбін, тобто 3’,4’-дидегідро-4’-дезокси-C’-норвінкалейкобластину [R-(R*,R*)-2,3дигідроксибутандіоат] (сіль)(1:2), який можна придбати у формі розчину тартрату вінорелбіну для ін'єкцій (NAVELBINE®), є напівсинтетичним алкалоїдом барвінку. Вінорелбін показаний як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами, наприклад цисплатином, при лікуванні різних солідних пухлин, зокрема недрібноклітинного раку легенів, раку грудей на пізніх стадіях і раку простати, стійкої до гормонотерапії. Найбільш поширеною побічною дією вінорелбіну, що обмежує його дозування, є мієлосупресія. Координаційні комплекси платини є не фазоспецифічними протираковими агентами, які взаємодіють з ДНК. Ці комплекси платини проникають в пухлинні клітини, зазнають гідратації й 4 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 утворюють поперечні зв'язки всередині нитки ДНК і між нитками ДНК, надаючи руйнівної біологічної дії на пухлину. Приклади координаційних комплексів платини включають, не обмежуючись цим, цисплатин і карбоплатин. Цисплатин, тобто цис-діаміндихлорплатину, можна придбати під торгівельним найменуванням PLATINOL® у формі розчину для ін'єкцій. Цисплатин показаний у першу чергу при лікуванні метастатичного раку яєчок і яєчників, а також раку сечового міхура на пізніх стадіях. Основними побічними ефектами цисплатину, що обмежують дозування, є нефротоксичність, яку можна обмежити шляхом насичення організму водою й діурезу, й ототоксичність. Карбоплатин, тобто діамін[1,1-циклобутандикарбоксилат(2-)-O,O’]платину, можна придбати під торгівельним найменуванням PARAPLATIN® у формі розчину для ін'єкції. Карбоплатин показаний для лікування першої й другої лінії карциноми яєчників на пізній стадії. Токсичність карбоплатину, що обмежує дозування, пов'язана з придушенням діяльності кісткового мозку. Алкілуючі агенти є не фазоспецифічними протираковими агентами й сильними електрофілами. Як правило, алкілуючі агенти за рахунок алкілування утворюють ковалентні зв'язки з нуклеофільними фрагментами молекули ДНК, наприклад фосфатними, аміно, сульфгідрильними, гідроксильними, карбоксильними й імідазольними групами. Таке алкілування порушує функції нуклеїнових кислот, приводячи до смерті клітини. Приклади алкілуючих агентів включають, не обмежуючись цим, азотисті іприти, наприклад циклофосфамід, мелфалан і хлорамбуцил; алкілсульфонати, наприклад, бусульфан; нітрозосечовини, наприклад кармустин; і триазени, наприклад дакарбазин. Циклофосфамід, тобто моногідрат 2-[біс(2-хлоретил)аміно]тетрагідро-2H-1,3,2оксазафосфорин-2-оксиду, можна придбати у вигляді розчину для ін'єкцій або пігулок під торгівельним найменуванням CYTOXAN®. Циклофосфамід показаний у вигляді індивідуального лікарського засобу або в комбінації з іншими хіміотерапевтичними засобами при лікуванні злоякісних лімфом, множинної мієломи й лейкозу. Облисіння, нудота, блювота й лейкопенія є найбільш поширеними побічними ефектами, що обмежують дозування циклофосфаміду. Мелфалан, тобто 4-[біс(2-хлоретил)аміно]-L-фенілаланін, можна придбати у вигляді розчину для ін'єкції або пігулок під торгівельним найменуванням ALKERAN®. Мелфалан показаний для паліативного лікування множинної мієломи і неоперабельної карциноми епітелію яєчників. Придушення діяльності кісткового мозку є найбільш поширеним побічним ефектом, що обмежує дозування мелфалану. Хлорамбуцил, тобто 4-[біс(2-хлоретил)аміно]бензолбутанову кислоту, можна придбати у формі пігулок під торгівельним найменуванням LEUKERAN®. Хлорамбуцил показаний для паліативного лікування хронічного лімфатичного лейкозу й злоякісних лімфом, наприклад лімфосарком, гіганто-фолікулярної лімфоми й хвороби Ходжкіна. Придушення діяльності кісткового мозку є найбільш поширеним побічним ефектом, що обмежує дозування хлорамбуцилу. Бусульфан, тобто 1,4-бутандіолдиметансульфонат, можна придбати у вигляді пігулок MYLERAN®. Бусульфан показаний для паліативного лікування хронічного мієлогенного лейкозу. Придушення діяльності кісткового мозку є найбільш поширеним побічним ефектом, що обмежує дозування бусульфану. Кармустин, тобто 1,3-біс-(2-хлоретил)-1-нітозосечовину, можна придбати у формі окремих флаконів з ліофілізованим матеріалом під торгівельним найменуванням BiCNU®. Кармустин, як єдиний лікарський засіб або в комбінації з іншими засобами, показаний для паліативного лікування пухлин мозку, множинної мієломи, хвороби Ходжкіна і не Ходжкінських лімфом. Сповільнене настання мієлосупресії є найбільш поширеним побічним ефектом, що обмежує дозування кармустину. Дакарбазин, тобто 5-(3,3-диметил-1-триазено)імідазол-4-карбоксамід, можна придбати у формі окремих флаконів з препаратом під торгівельним найменуванням DTIC-Dome®. Дакарбазин показаний для лікування метастатичної злоякісної меланоми і в комбінації з іншими агентами для лікування другої лінії хвороби Ходжкіна. Нудота, блювота й анорексія є найбільш поширеними побічними ефектами, що обмежують дозування дакарбазину. Анти-неопластичні засоби з числа антибіотиків є не фазоспецифічними агентами, які зв'язуються з ДНК або вбудовуються в неї. Як правило, це приводить до утворення стійких комплексів з ДНК або руйнування ниток ДНК, що порушує звичайні функції нуклеїнових кислот, приводячи до смерті клітин. Приклади анти-неопластичних засобів з числа антибіотиків включають, не обмежуючись перерахованим, актиноміцини, наприклад дактиноміцин, антроцикліни, наприклад даунорубіцин і доксорубіцин; і блеоміцини. 5 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дактиноміцин, відомий також як актиноміцин D, можна придбати у формі препарату для ін'єкцій під торгівельним найменуванням COSMEGEN®. Дактиноміцин показаний для лікування пухлини Вільма і рабдоміосаркоми. Нудота, блювота й анорексія є найбільш поширеними побічними ефектами, що обмежують дозування дактиноміцину. Даунорубіцин, тобто гідрохлорид (8S-цис)-8-ацетил-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксогексапіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12-нафтацендіону, можна придбати у формі ліпосомального препарату для ін'єкцій під торгівельним найменуванням DAUNOXOME® або у формі препарату для ін'єкцій під торгівельним найменуванням CERUBIDINE®. Даунорубіцин показаний для досягнення ремісії при лікуванні гострого нелімфоцитарного лейкозу й пізніх стадій ВІЛ, пов'язаних з саркомою Капоші. Мієлосупресія є найбільш поширеним побічним ефектом, що обмежує дозування даунорубіцину. Доксорубіцин, тобто гідрохлорид (8S,10S)-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксогексапіранозил)окси]-8-гліколоїл-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12нафтацендіону, можна придбати у формі препарату для ін'єкцій під торгівельним найменуванням RUBEX® або ADRIAMYCIN RDF®. Доксорубіцин у першу чергу показаний для лікування гострого лімфобластного лейкозу й гострого мієлобластного лейкозу, але застосовний також як компонент лікування ряду солідних пухлин і лімфом. Мієлосупресія є найбільш поширеним побічним ефектом, що обмежує дозування доксорубіцину. Блеоміцин, тобто суміш цитотоксичних глікопептидних антибіотиків, виділених зі штаму Streptomyces verticillus, можна придбати під торгівельним найменуванням BLENOXAN®. Блеоміцин показаний для паліативного лікування карциноми плоских клітин, лімфом і карцином яєчок, як єдиний лікарський засіб або в комбінації з іншими засобами. Токсична дія на легені й шкіру є найбільш поширеним побічним ефектом, що обмежує дозування блеоміцину. Інгібітори топоізомерази II включають, не обмежуючись цим, епіподофілотоксини. Епіподофілотоксини є фазоспецифічними анти-неопластичними агентами, що отримуються з рослини мандрагора лікарська. Епіподофілотоксини, як правило, діють на клітини у фазах S і G2 клітинного циклу, шляхом формування потрійного комплексу з топоізомеразою II і ДНК, що приводить до розриву ниток ДНК. Розриви ниток накопичуються, і настає смерть клітини. Приклади епіподофілотоксинів включають, не обмежуючись перерахованим, етопозид і теніпозид. Етопозид, тобто 4’-диметилепіподофілотоксин-9-[4,6-0-(R)-етиліден-β-D-глюкопіранозид], можна придбати у формі розчину для ін'єкцій або капсул під торгівельним найменуванням VePESID® і він широко відомий, як VP-16. Етопозид показаний при лікуванні раку яєчок і недрібноклітинного раку легенів, як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами. Мієлосупресія є найбільш поширеним побічним ефектом етопозиду. Прояв лейкопенії зазвичай буває важчим, ніж тромбоцитопенії. Теніпозид, тобто 4’-диметилепіподофілотоксин-9-[4,6-0-(R)-тієніліден-β-D-глюкопіранозид], можна придбати у формі розчину для ін'єкцій під торгівельним найменуванням VUMON®, і він широко відомий як VM-26. Теніпозид показаний при лікуванні гострого лейкозу в дітей як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами. Мієлосупресія є найбільш поширеним побічним ефектом теніпозиду. Теніпозид може викликати як лейкопенію, так і тромбоцитопенію. Анти-неопластичні антиметаболіти є фазоспецифічними анти-неопластичним агентами, які діють під час S фази (синтезу ДНК) клітинного циклу, за рахунок інгібування синтезу ДНК або за рахунок інгібірування синтезу пуринових або піримідинових основ і внаслідок цього обмеження синтезу ДНК. В результаті цього не здійснюється S фаза і настає смерть клітини. Приклади анти-неопластичних антиметаболітів включають, не обмежуючись перерахованим, фторурацил, метотрексат, цитарабін, мекаптопурин, тіогуанін і гемцитабін. 5-фторурацил, тобто 5-фтор-2,4-(1H,3H)піримідиндіон, можна придбати під торгівельним найменуванням фторурацил. Введення 5-фторурацилу веде до інгібування синтезу тимідилатів і, крім того, він включається до складу як РНК, так і ДНК. Результатом цих процесів, як правило, є смерть клітини. 5-фторурацил показаний при лікуванні карцином грудей, товстої кишки, прямої кишки, шлунку й підшлункової залози, як єдиний лікарський засіб, так і в комбінації з іншими хіміотерапевтичними засобами. Мієлосупресія й мукозит є побічними ефектами, що обмежують дозування 5-фторурацилу. Інші аналоги фторпіримідину включають 5-фтор дезоксіуридин (флоксуридин) і 5-фтордезоксіуридину монофосфат. Цитарабін, тобто 4-аміно-1-β-D-арабінофуранозил-2-(1H)-піримідинон, можна придбати під торгівельним найменуванням CYTOSAR-U®, і він широко відомий під назвою Ara-C. Вважається, що цитарабін виявляє фазоспецифічність, надаючи дію на S-фазі клітинного циклу, 6 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 за рахунок інгібування подовження ланцюга ДНК при включенні цитарабіну в кінець зростаючого ланцюга ДНК. Цитарабін показаний при лікуванні гострого лейкозу як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами. Інші аналоги цитидину включають 5азацитидин і 2’,2’-дифтордезоксицитидин (гемцитабін). Цитарабін викликає лейкопенію, тромбоцитопенію й мукозит. Меркаптопурин, тобто моногідрат 1,7-дигідро-6H-пурин-6-тіону, можна придбати під торгівельним найменуванням PURINETHOL®. Меркаптопурин виявляє фазоспецифічність, діючи під час S-фази клітинного циклу за рахунок інгібування синтезу ДНК по не встановленому до теперішнього часу механізму. Меркаптопурин показаний при лікуванні гострого лейкозу як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами. Очікуваними побічними ефектами меркаптопурину при його високих дозуваннях є мієлосупресія й гастроінтестинальний мукозит. Застосовним аналогом меркаптопурину є азатіоприн. Тіогуанін, тобто 2-аміно-1,7-дигідро-6H-пурин-6-тіон, можна придбати під торгівельним найменуванням TABLOID®. Тіогуанін виявляє фазоспецифічність, діючи під час S-фази клітинного циклу за рахунок інгібування синтезу ДНК по не встановленому до теперішнього часу механізму. Тіогуанін показаний при лікуванні гострого лейкозу як єдиний лікарський засіб або в комбінації з іншими хіміотерапевтичними засобами. Мієлосупресія, в т.ч. лейкопенія, тромбоцитопенія та анемія є найбільш поширеними побічними ефектами введення тіогуаніну, що обмежують його дозування. Проте виявляються і гастроінтестинальні побічні дії, які можуть обмежувати дозування. Інші аналоги пурину включають пентостатин, еритрогідроксиноніладенін, флударабіна фосфат і кладрибін. Гемцитабін, тобто моногідрохлорид 2’-дезокси-2’,2’-дифторцитидину (β-ізомер), можна придбати під торгівельним найменуванням GEMZAR®. Гемцитабін виявляє фазоспецифічність, діючи під час S-фази клітинного циклу й за рахунок блокування просування клітинного циклу через кордон фаз G1/S. Гемцитабін показаний у комбінації з цисплатином при лікуванні місцеворозповсюдженого недрібноклітинного раку легенів і індивідуально при лікуванні місцеворозповсюдженого раку підшлункової залози. Мієлосупресія, в т.ч. лейкопенія, тромбоцитопенія й анемія є найбільш поширеними побічними ефектами введення гемцитабіну, що обмежують його дозування. Метотрексат, тобто N-[4-[[(2,4-діаміно-6-птеридиніл)метил]метиламіно]-бензоїл]-Lглутамінову кислоту, можна придбати під найменуванням метотрексат натрію. Метотрексат демонструє фазоспецифічність, діючи на S-фазі клітинного циклу за рахунок інгібування синтезу, репарації й∕або реплікації ДНК, шляхом інгібування редуктази дигідрофолієвої кислоти, яка необхідна для синтезу пуринових нуклеотидів і тимідилату. Метотрексат показаний при лікуванні хоріокарциноми, менінгеальної лейкемії, не Ходжкінської лімфоми й карцином грудей, голови, шиї, яєчників і сечового міхура, індивідуально або в комбінації з іншими хіміотерапевтичними засобами. Мієлосупресія (лейкопенія, тромбоцитопенія й анемія) і мукозит є очікуваними побічними ефектами введення метотрексату. Камптотецини, включаючи камптотецин і похідні камптотецину, є у продажу або знаходяться на стадії розробки як інгібітори топоізомерази I. Вважається, що цитотоксична активність камптотецинів пов'язана з їх інгібуючою дією на топоізомеразу I. Приклади камптотецинів включають, не обмежуючись перерахованим, іринотекан, топотекан і описані нижче різні оптичні форми 7-(4-метилпіперазино-метилен)-10,11-етилендіокси-20-камптотецину. Гідрохлорид іринотекану, тобто гідрохлорид (4S)-4,11-діетил-4-гідрокси-9-[(4піперидинопіперидино)карбонілокси]-1H-пірано[3’,4’,6,7]індолізино[1,2-b]хінолін-3,14-(4H,12H)діону, можна придбати у вигляді розчину для ін'єкцій CAMPTOSAR®. Ірінотекан є похідною камптотецину, яка, поряд з її активним метаболітом SN-38, зв'язується з комплексом топоізомераза I - ДНК. Вважається, що цитотоксичність виникає в результаті непіддатливих відновленню розривів подвійної спіралі ДНК, викликаної взаємодією потрійного комплексу топоізомераза I:ДНК:іринотекан або SN-38 з реплікативними ферментами. Ірінотекан показаний для лікування метастатичного раку товстої або прямої кишки. Побічними ефектами гідрохлориду іринотекану, що обмежують його дозування, є мієлосупресія, в т.ч. нейтропенія, і гастроінтестинальні ефекти, включаючи діарею. Гідрохлорид топотекану, тобто моногідрохлорид (S)-10[(диметиламіно)метил]-4-етил-4,9дигідрокси-1H-пірано[3’,4’,6,7]індолізино[1,2-b]хінолін-3,14-(4H,12H)-діону, можна придбати у вигляді розчину для ін'єкцій HYCAMTIN®. Топотекан є похідною камптотецину, яка зв'язується з комплексом топоізомераза I - ДНК і запобігає повторному лігуванню розривів окремих ниток, викликаних топоізомеразою I, у відповідь на закручування ниток молекули ДНК. Топотекан показаний для лікування другої лінії метастатичної карциноми яєчників і дрібноклітинного раку 7 UA 106740 C2 легенів. Побічним ефектом гідрохлориду топотекану, що обмежує його дозування, є мієлосупресія, в першу чергу нейтропенія. Крім того, інтерес становить похідна камптотецину наведеної нижче формули A, яка знаходиться у стадії розробки, в т.ч. рацемічна суміш (R,S) форм, а також R і S енантіомери: 5 10 15 20 25 30 35 40 45 відома під хімічним найменуванням «7-(4-метилпіперазинометилен)-10,11-етилендіокси20(R,S)камптотецин (рацемічна суміш)» або «7-(4-метилпіперазинометилен)-10,11етилендіокси-20(R)камптотецин (R енантіомер)» або «7-(4-метилпіперазинометилен)-10,11етилендіокси-20(S)-камптотецин (S енантіомер)». Ці, а також родинні ним сполуки, включаючи способи їх одержання, описані в патентах США №№ 6 063 923; 5 342 947; 5 559 235; 5 491 237 і розглядуваній нині патентній заявці США № 08/977 217, поданій 24 листопада 1997 р. Гормони й аналоги гормонів застосовні для лікування ракових захворювань, для яких існує взаємозв'язок між гормоном (гормонами) і зростанням і або відсутністю зростання ракової пухлини. Приклади гормонів і аналогів гормонів, застосовних при лікуванні ракових захворювань, включають, не обмежуючись цим, адренокортикостероїди, наприклад предизон і преднізолон, які застосовні при лікуванні злоякісної лімфоми і гострого лейкозу у дітей; аміноглутетимід та інші інгібітори ароматази, наприклад анастрозол, летразол, воразол і екземестан, застосовні при лікуванні карциноми надниркових і гормонозалежної карциноми грудей, що містять рецептори естрогену; прогестрини, наприклад мегестролу ацетат, застосовний при лікуванні гормонозалежного раку грудей і карциноми ендометрію; естроген, андрогени й анти-андрогени, наприклад флутамід, нілутамід, бікалютамід, ципротерону ацетат і 5α-редуктази, наприклад фінастерид і дутастерид, застосовні при лікуванні карциноми простати й доброякісної гіпертрофії простати; анти-естрогени, наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен, йодоксифен, а також селективні модулятори рецептора естрогені (SERMS), наприклад, описані в патентах США №№ 5 681 835, 5877219 і 6 207 716, застосовні при лікуванні гормонозалежної карциноми грудей та інших сприйнятливих ракових захворювань; а також гонадотропін-вивільняючий гормон (GnRH) і його аналоги, які стимулюють вивільнення лютеїнізуючого гормону (LH) і∕або фолікуло-стимулюючого гормону (FSH) для лікування карциноми простати, наприклад, агоністи й антагоністи LHRH, такі як госерелину ацетат і люпролід. Інгібіторами шляхів передачі сигналу є такі інгібітори, які блокують або інгібують хімічні процеси, що викликають внутріклітинні зміни. В даній заявці цими змінами є клітинна проліферація або диференціювання. До числа застосовних у даному винаході інгібіторів передачі сигналу входять інгібітори рецепторних тирозинкіназ, не рецепторних тирозинкіназ, блокатори домену SH2/SH3, інгібітори серин/треонін кіназ, фосфатидил інозит-3 кіназ, інгібітори передачі сигналу міо-інозиту й онкогенів Ras. Деякі тирозинові протеїнкінази каталізують фосфорилування певних тирозильних залишків у різних білках, залучених до регулювання клітинного зростання. Ці тирозинові протеїнкінази можна в широкому сенсі розділити на рецепторні й не рецепторні кінази. Рецепторні тирозинкінази є трансмембранними білками, що мають позаклітинний лігандзв’язуючий домен, трансмембранний домен і домен тирозинкінази. Рецепторні тирозинкінази беруть участь у регулюванні зростання клітин та їх часто іменують рецепторами чинників зростання. Було показано, що неадекватна або неконтрольована активація багатьох з цих кіназ, тобто порушення кіназної активності рецепторів чинників зростання, наприклад, унаслідок надлишкової експресії або мутації, приводить до нерегульованого зростання клітин. Відповідно, порушення активності цих кіназ пов'язане із зростанням злоякісної тканини. Отже, виявлення інгібіторів цих кіназ могло б забезпечити способи лікування раку. Рецептори чинників зростання включають, наприклад, рецептор епідермального чинника зростання, (EGFr), рецептор чинника зростання тромбоцитарного походження (PDGFr), erbB2, erbB4, рецептор судинного 8 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 ендотеліального чинника зростання (VEGFr), тирозинкіназу з імуноглобулін-подібним для доменом і доменом, гомологічним епідермальному чиннику зростання (TIE-2), рецептор інсуліноподібного чинника зростання-I (IGFI), макрофаг колонієстимулюючий чинник (cfms), BTK, ckit, cmet, рецептори чинника зростання фібробластів (FGF), рецептори Trk (TrkA, TrkB і TrkC), рецептори еприну (eph) і протоонкоген RET. Деякі інгібітори рецепторів чинників зростання знаходяться в розробці, і до їх числа входять антагоністи лігандів, антитіла, інгібітори тирозинкінази й антисмислові олігонуклеотиди. Рецептори чинників зростання й агенти, які інгібують діяльність рецепторів чинників зростання, описані, наприклад, у Kath, John C., Exp. Opin. Ther.Patents (2000)10(6):803-818; Shawver et al DDT vol.2 №2 February 1997; і Lofts, F.J. et al, “Growth factor receptors as targets”, New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David, CRC press 1994, London. Тирозинкінази, які не є рецепторами чинників зростання, називаються не рецепторними тирозинкіназами. Не рецепторні тирозинкінази, які придатні для застосування в даному винаході, і є мішенями або потенційними мішенями протиракових засобів, включають cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (кіназу фокальної адгезії), тирозинкіназу Брутона і Bcr-Abl. Ці не рецепторні кінази, а також агенти, які інгібують діяльність не рецепторних тирозинкіназ, описані в Sinh, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8(5): 465-80; і Bolen, J.B., Brugge, J.S., (1997) Annual review of Immunology. 15:371-404. Блокатори домену SH2/SH3 є агентами, які порушують зв’язування домену SH2 або SH3 в цілому ряді ферментів або адаптерних білків, включаючи субодиницю PI3-K p85, сімейство кіназ Src, адаптерні молекули (Shc, Crk, Nck, Grb2) і RAS-GAP. Домени SH2/SH3 як мішені для протиракових лікарських засобів обговорюються в Smithgall, T.E. (1995), Journal of Pharmacological and Toxicological Methods, 34(3) 125-32. Інгібітори серин/треонін кіназ включають блокатори каскаду кінази MAP, до числа яких входять блокатори кіназ Raf (rafk), мітоген або позаклітинно-регульованих кіназ (MEKs) і позаклітинно регульованих кіназ (ERKs); а також блокатори членів сімейства C протеїн кіназ, в т.ч. блокатори PKCs (альфа, бета, гамма, іпсилон, мю, лямбда, йота, дзета). Сімейство кіназ IkB (IKKa, IKKb), сімейство кіназ PKB, членів сімейства кіназ akt, і кінази рецептора TGF бета. Ці серин/треонін кінази та їх інгібітори описані в Yamamoto, T., Taya, S., Kaibuchi, K., (1999), Journal of Biochemistry. 126 (5) 799-803; Brodt, P, Samani, A., and Navab, R. (2000), Biochemical Pharmacology, 60. 1101-1 107; Massague, J., Weis-Garcia, F. (1996) Cancer Surveys. 27:41-64; Philip, P.A., and Harris, A.L. (1995), Cancer Treatment and Research. 78: 3-27, Lackey, K. et al Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; U.S. патент № 6268391; і Martinez-lacaci, L., et al, Int. J. Cancer (2000), 88(1 ), 44-52. Інгібітори членів сімейства фосфотидил інозит-3 кіназ, в т.ч. блокатори PI3-кінази, АТМ, DNA-PK і Ku, також можуть застосовуватися в даному винаході. Ці кінази обговорюються в Abraham, RT. (1996), Current Opinion in Immunology. 8 (3) 412-8; Canman, C. E., Lim, D. S. (1998), Oncogene 17 (25) 3301-3308; Jackson, S. P. (1997), International Journal of Biochemistry and Cell Biology. 29 (7):935-8; і Zhong, H. et al, Cancer res, (2000) 60(6), 1541-1545. Крім того, в рамках даного винаходу становлять інтерес інгібітори передачі сигналу міоінозиту, наприклад блокатори фосфоліпази C і аналоги міо-інозиту. Ці інгібітори сигналу описані в Powis, G., and Kozikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., Paul Workman and David Kerr, CRC press 1994, London. Іншою групою інгібіторів шляхів сигнальної трансдукції є інгібітори онкогену Ras. До числа цих інгібіторів входять інгібітори фарнезилтрансферази, гераніл-гераніл трансферази й протеаз CAAX, а також антисмислові олігонуклеотиди, рибозими й імунотерапевтичні засоби. Було показано, що ці інгібітори блокують активацію ras у клітинах, що містять онкоген мутанта ras дикого типу, тим самим діючи як антипроліферативні агенти. Інгібування онкогену ras обговорюється в Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I., Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology, 9(2) 99-102; і BioChim. Biophys. Acta, (19899) 1423(3):19-30. Як вказано вище, антитіла, що є антагоністами зв’язування рецепторної кінази з лігандом, також можуть виконувати функцію інгібіторів передачі сигналу. Ця група інгібіторів шляхів сигнальної трансдукції включає застосування гуманізованих антитіл до позаклітинного лігандзв’язуючого домену рецепторних тирозинкіназ. Наприклад, EGFR-специфічне антитіло Imclone C225 (див. Green, M.C. et al., Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat.Rev., (2000), 26(4), 269-286); антитіло проти erbB2 Herceptin® (див. Tyrosine Kinase Signalling in Breast cancer: erbB Family Receptor Tyrosine Kinases, Breast Cancer Res., 2000, 2(3), 176-183); і VEGFR2-специфічні антитіла 2CB (див. Brekken, R.A. et al., Selective Inhibition of VEGFR2 Activity 9 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 55 60 by а monoclonal ANTI-VEGF antibody blocks tumor growth in mice, Cancer Res. (2000) 60, 51175124). Не рецепторні кінази, що є інгібіторами ангіогенезу, також можуть застосовуватися в даному винаході. Інгібітори ангіогенезу, зв'язані з VEGFR і TIE2, були розглянуті вище у зв'язку з інгібіторами сигнальної трансдукції (обидва рецептори є рецепторними тирозинкінази). Ангіогенез в основному пов'язаний з передачею сигналу erbB2/EGFR, оскільки було показано, що інгібітори erbB2 і EGFR інгібують ангіогенез, у першу чергу експресію VEGF. Відповідно, інгібітори не рецепторних тирозинкіназ можуть застосовуватися в комбінації зі сполуками за даним винаходом. Наприклад, анти-VEGF антитіла, які не розпізнають VEGFR (рецепторну тирозинкіназу), але зв'язуються з лігандом; низькомолекулярні інгібітори інтегрину (альфаvбета3), які інгібуватимуть ангіогенез; ендостатин і ангіостатин (не-RTK) також можуть виявитися застосовними в комбінації з розкритими сполуками (див. Bruns C.J., et al. (2000), Cancer Res., 60: 2926-2935; Schreiber AB, Winkler M.E., and Derynck R. (1986), Science, 232: 1250-1253; Yen L et.al., (2000), Oncogene 19: 3460-3469). Агенти, використовувані в імунотерапевтичних схемах лікування, також можуть знайти застосування в даному винаході. Існує низка імунологічних стратегій для генерування імунної відповіді. Ці стратегії, як правило, належать до області вакцинації пухлин. Ефективність імунологічних підходів можна істотно поліпшити шляхом комбінованого інгібування сигнальних шляхів із застосуванням низькомолекулярних інгібіторів. Обговорення вживання імунологічних/пухлинних вакцин проти erbB2/EGFR є в Reilly R.T., et al., (2000), Cancer Res.60: 3569-3576; і Chen Y, Hu D, Eling D.J., Robbins J and Kipps T.J. (1998), Cancer Res.58: 1965-1971. Агенти, вживані в проапоптотичних схемах лікування (наприклад, антисмислові олігонуклеотиди bcl-2), також можуть застосовуватися в комбінації за даним винаходом. Члени сімейства білків Bcl-2 блокують апоптоз. Тому підвищуючи регуляція bcl-2 пов'язана з несприйнятністю до хімічних препаратів. Дослідження показали, що епідермальний чинник зростання (EGF) стимулює анти-апоптотичні члени сімейства bcl-2 (тобто mcl-1). Внаслідок цього, стратегії, направлені на знижуючу регуляцію експресії bcl-2 в пухлинах, продемонстрували позитивні клінічні результати і в даний час знаходяться на стадії фази II/III випробувань, причому конкретно йдеться про антисмисловий олігонуклеотид для bcl-2 Genta’s G3139. Подібні проапоптотичні стратегії, в яких застосовується антисмисловий олігонуклеотид для білка bcl-2, обговорюються в Water J.S. et al., (2000), J.Clin.Oncol 18: 1812-1823; і Kitada S., et al., (1994), Antisense Res.Dev. 4: 71-79. Інгібітори передачі сигналів клітинного циклу інгібують молекули, що беруть участь в управлінні клітинним циклом. Сімейство протеїн кіназ, називаних циклін-залежними кіназами (CDKs), та їх взаємодія з сімейством білків, називаних циклінами, управляє розвитком клітинного циклу еукаріотичних клітин. Координована активація й інактивація різних комплексів циклін/CDK необхідна для нормального просування по клітинному циклу. В розробці знаходиться декілька інгібіторів передачі сигналів клітинного циклу. Приклади циклін-залежних кіназ, в т.ч. CDK2, CDK4 і CDK6 та їх інгібіторів описані, наприклад, у Rosania et al, Exp.Opin.Ther. Patents (2000) 10(2):215-230. У одному з варіантів здійснення, спосіб лікування раку за даним винаходом включає спільне введення сполуки A і щонайменше одного анти-неопластичного агента, наприклад, вибраного з групи, що складається з агентів, що порушують утворення мікротрубочок, координаційних комплексів платини, алкілуючих агентів, антибіотичних агентів, інгібіторів топоізомерази II, антиметаболітів, інгібіторів топоізомерази I, гормонів та їх аналогів, інгібіторів шляхів передачі сигналу, інгібіторів ангіогенезу, що є не рецепторними тирозинкіназами, імунотерапевтичних агентів, проапоптотичних агентів та інгібіторів передачі сигналів клітинного циклу. Сполука A за даним винаходом застосовна як інгібітор AKT при лікуванні раку й артриту у ссавців, зокрема людини, що потребують такого лікування. Спосіб лікування раку й артриту у ссавців, в т.ч. людини, за даним винаходом включає введення суб'єктові, що потребує цього, терапевтично ефективної кількості сполуки A за даним винаходом. Даний винахід відноситься також до застосування сполуки A для виробництва лікарського засобу, призначеного для вживання в терапії. Даний винахід відноситься також до застосування сполуки A для виробництва лікарського засобу, призначеного для вживання як інгібітор AKT. Крім того, даний винахід відноситься до застосування сполуки А для виробництва лікарського засобу, призначеного для вживання при лікуванні раку. Окрім цього, даний винахід відноситься до застосування сполуки A для виробництва лікарського засобу, призначеного для вживання при лікуванні артриту. 10 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 Крім того, винахід відноситься до фармацевтичної композиції, призначеної для вживання в лікуванні раку, яка містить сполуку A і фармацевтично прийнятний носій. Окрім цього, винахід відноситься до фармацевтичної композиції, призначеної для застосування в лікуванні артриту, яка містить сполуку A і фармацевтично прийнятний носій. Наведені нижче приклади служать додатковою ілюстрацією даного винаходу. Ці приклади не передбачають обмеження обсягу винаходу, який визначений вище за текстом і в наведеній нижче формулі винаходу. Приклад 1: одержання кристалічного гідрохлориду N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду Аморфний N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5іл)-2-тіофенкарбоксамід у формі вільної основи отримували, як описано в Міжнародній патентній заявці № PCT/US08/053269. 1 мл метил-т-бутилового ефіру (MTBE) додавали в судину, що містила 50,8 мг аморфного N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1Hпіразол-5-іл)-2-тіофенкарбоксаміду у формі вільної основи. Велика частина твердої речовини розчинилася. Після додавання до реакційної суміші хлористоводневої кислоти (1 екв., 29,7 мл 4М HCl в 1,4-діоксані), біла тверда речовина швидко випала в осад при кімнатній температурі. Аліквоту реакційної суміші досліджували за допомогою мікроскопії в поляризованому світлі (PLM) і виявили, що ця тверда речовина є аморфною. Потім отриману суспензію нагрівали до 40°C, перемішуючи магнітною мішалкою, для розчинення більшої частини твердої речовини. Не густу суспензію, що утворилася, перемішували протягом ночі при 40°C, потім охолоджували з 40°C до 25°C. Утворювалася густа біла суспензія. Аліквоту реакційної суміші досліджували за допомогою мікроскопії в поляризованому світлі (PLM) і виявили, що тверда речовина, що утворилася, є кристалічною. Отриману білу тверду речовину відокремлювали вакуумним фільтруванням і потім висушували при 50°C протягом ночі. По картині дифракції рентгенівських променів на пороші (PXRD), змальованій на фіг.1, було встановлено, що продукт є твердою кристалічною речовиною. Прилад: Rigaku Miniflex II, порядковий № DD02652 Основні операційні параметри: Метод нормального сканування Зразок сканували, використовуючи наступні параметри: Діапазон сканування: 2-40 градусів по куту два-тета Живлення генератора: 30 КВ, 15 мА Джерело випромінювання: Cu KАльфа Режим сканування: FT Час реєстрації сигналів: 1,0 сік Величина кроку: 0,020 градусів по куту два-тета на крок Осі сканування: 2 тета/тета Оптика падаючого пучка: щілина Соллера з кутом розбіжності ±2,5°, дивергентна щілина 1,25 град., щілина приймача 0,3 мм, щілина розсіяння 1,25 град. Оптика дифрагованого пучка: фіксовані щілини (MiniFlex II), щілини Соллера ±2,5° Тип детектора: Rigaku Miniflex II (Лічильник сцинтиляції) Зразок поміщали у тримач зразків з нульовим фоном (з виїмкою глибиною 100мкм) і обережно розрівнювали за допомогою скляної пластини. Приклад 2: одержання кристалічного гідрохлориду N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду 5 мл MTBE додавали до 213,9 мг аморфного N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду у формі вільної основи (0,500 ммоль). Цю суміш нагрівали до 40°C при перемішуванні магнітною мішалкою протягом 1 години. Чотирма рівними порціями додавали 4М розчин HCl в 1,4-діоксані (1 екв.; 125,1 мкл). Після додавання першої порції (0,25 екв.), суміш нагрівали до 42°C і додавали 1 мл ацетонітрилу для розчинення всієї твердої речовини. Після додавання залишкового розчину HCl виділилася невелика кількість твердої речовини. Отриману суспензію перемішували при 42°C протягом 4 11 UA 106740 C2 5 10 15 20 25 30 35 40 45 50 годин, потім повільно протягом ночі охолоджували до 22°C, витримуючи по 90 хвилин при 35°C, 30°C і 25°C. Білу тверду речовину відокремлювали фільтруванням і висушували у вакуумі при 50°C протягом ночі, продуваючи слабким струмом азоту. Вихід гідрохлориду складав 73,6% (0,3685 ммоль; 170,90 мг). За даними іонної хроматографії було встановлено, що отримана тверда речовина була сіллю з HCl в стехіометричному відношенні 1:1, і картина дифракції рентгенівських променів на порошку солі (PXRD), змальована на фіг. 2 і що характеризується наведеними нижче дифракційними списами, вказала на кристалічну природу продукту, який має температуру плавлення 211°C. Піки PXRD (наведені значення кутів 2-тета в градусах, і в круглих дужках дані міжплощинні відстані d): Прилад: PANalytical X’Pert-Pro MPD з монохроматором Johansson Kα1, в якому використовувався детектор X’Celerator. Основні операційні параметри: Випромінювання: Cu(Kα1), 1,540598 ангстремів (монохроматичне) Детектор: X’Celerator Напруга: 45 КВ Струм: 40 мА Початковий кут: 2,0° 2θ Кінцевий кут: 52,0° 2θ Величина кроку: 0,02° Час/крок: 40,0 сек Швидкість сканування: 0,05°/сек Падаючий пучок: 2° фіксована щілина розсіяння й програмована дивергентна щілина Дифрагований пучок: щілина Соллера 0,02 рад, і програмована щілина розсіяння Зразки готували на кремнієвому тримачі для зразків з нульовим фоном. Приклад 3: одержання аморфного гідрохлориду N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду Гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1Hпіразол-5-іл)-2-тіофенкарбоксаміду отримували в основному, як описано в прикладі 96 міжнародної патентної заявки № PCT/US2008/053269 з міжнародною датою подачі 7 лютого 2008 р., і що має номер міжнародній публікації WO/2008/098104 і дату міжнародної публікації 14 серпня 2008 р., де в загальних рисах вказано, що сполуку у формі вільної основи, тобто N-{(1S)2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2тіофенкарбоксамід, обробляють 4М HCl в діоксані і через 5 хвил отриманий розчин концентрують і висушують у вакуумі, отримуючи гідрохлорид N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду у вигляді аморфної твердої речовини, згідно з картиною дифракції рентгенівських променів на пороші (PXRD), змальованою на фіг.3. Прилад: Rigaku Miniflex II, порядковий № DD02652 Основні операційні параметри: Метод нормального сканування Зразок сканували, використовуючи наступні параметри: Діапазон сканування: 2-40 градусів по куту два-тета Живлення генератора: 30 КВ, 15 мА Джерело випромінювання: Cu KАльфа Режим сканування: FT Час реєстрації сигналів: 1,0 сік Величина кроку: 0,020 градусів по куту два-тета на крок Осі сканування: 2 тета/тета Оптика падаючого пучка: щілина Соллера з кутом розбіжності ±2,5°, дивергентна щілина 1,25 град., щілина приймача 0,3 мм, щілина розсіяння 1,25 град. Оптика дифрагованого пучка: фіксовані щілини (MiniFlex II), щілини Соллера ±2,5° 12 UA 106740 C2 5 Тип детектора: Rigaku Miniflex II (Лічильник сцинтиляції) Зразок поміщали в скляний тримач зразків і обережно розрівнювали за допомогою скляної пластини. Приклад 4: Композиція пігулки Лактозу, мікрокристалічну целюлозу, натрію крохмаль гліколят, стеарат магнію й кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду змішували в пропорціях, показаних нижче в таблиці 1. Потім цю суміш пресували в пігулки. Таблиця 1 Інгредієнт Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду Мікрокристалічна целюлоза Лактоза Крохмаль гліколят натрію Стеарат магнію мг 8,45 112 70 8 2 10 15 20 25 30 35 40 45 50 Приклад 5: Парентеральна композиція для ін'єкцій Форму для ін'єкцій, призначену для введення активного інгредієнта за даним винаходом, отримують перемішуванням 5,0 мг кристалічного гідрохлориду N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду у 1,0 мл нормального сольового розчину. Приклад 6: Гігроскопічність Кристалічний Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду, отриманий в основному по методиці прикладу 1, кристалічна будова якого підтверджена PXRD, тестували за допомогою приладу SGA 100 виробництв VTI, використовуючи наступну методику. Одержання зразка: Розчинник: Вода Температура висушування (°C): Без висушування Температура експерименту (°C): 25 Макс. час досягнення рівноваги(хвил.): 240 Критерій рівноваги (мас.%): 0,0025 за 10 хвил Інтервал реєстрації даних (хвил.): 2 або 0,01 мас.% Використовували 24 стадії відносної вологості. На кожній стадії відносна вологість мала наступні значення: 1-40; 2-50; 3-60; 4-70; 5-80; 6-90; 7-80; 8-70; 9-60; 10-50; 11-40; 12-30; 13-20; 14-10; 15-5; 16-10; 17-20; 18-30; 19-40;20-50; 21-60; 22-70; 23-80; і 24-90. Приріст маси сполуки за даним винаходом за рахунок поглинання вологи складав менше 1 мас.%, що вказує на низьку гігроскопічність сполуки. Аморфна сіль У окремому експерименті, проведеному в інший день, за допомогою приладу SGA 100 виробництва VTI, досліджували аморфний гідрохлорид N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1H-піразол-5-іл)-2-тіофенкарбоксаміду (аморфна будова підтверджена PXRD), використовуючи наступну методику. Одержання зразка: Розчинник: Вода Температура висушування (°C): 60 Швидкість нагрівання (°C/хвил): 1 Максимальний час висушування (хвил): 120 Температура експерименту (°C): 25 Макс. час досягнення рівноваги(хвил): 300 Критерій рівноваги (мас.%): 0,0025 за 10 хвил Інтервал реєстрації даних (хвил.): 2 або 0,01 мас.% Використовували 19 стадій відносної вологості. На кожній стадії відносна вологість мала наступні значення: 1-0; 2-10; 3-20; 4-30; 5-40; 6-50; 7-60; 8-70; 9-80; 10-90; 11-80; 12-70; 13-60; 14-50; 15-40; 16-30; 17-20; 18-10; і 19-0. 13 UA 106740 C2 5 Приріст маси сполуки за рахунок поглинання вологи складав більше 18 мас.%, що вказує на високу гігроскопічність сполуки. Хоча переважні варіанти здійснення даного винаходу проілюстровані наведеним вище описом, слід розуміти, що винахід не обмежується розкритими в описі точними інструкціями, і що обумовлюється право на всі модифікації, що входять в обсяг наведеної нижче формули винаходу. ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 45 1. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки при 14,4°±0,3° і 32,4°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKαвипромінювання. 2. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-{4-хлор-1метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 1, а також характеристичні дифракційні піки при 25,1°±0,3° і 25,7°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKα-випромінювання. 3. Кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 2, а також характеристичні дифракційні піки при 21,5°±0,3° і 20,8°±0,3° на рентгенівській дифрактограмі порошку при використанні СuKα-випромінювання. 4. Фармацевтична композиція, що включає кристалічний гідрохлорид N-{(1S)-2-аміно-1-[(3фторфеніл)метил]етил}-5-хлор-4-{4-хлор-1-метил-1Н-піразол-5-іл)-2-тіофенкарбоксаміду, що має характеристичні дифракційні піки за п. 1, а також фармацевтично прийнятний носій або розчинник. 5. Спосіб лікування або полегшення тяжкості раку у ссавця, який цього потребує, що включає введення вказаному ссавцеві терапевтично ефективної кількості композиції за п. 4. 6. Спосіб за п. 5, де ссавець є людиною. 7. Спосіб за п. 6, де сполуку вводять перорально. 8. Спосіб за п. 5, де вказане ракове захворювання вибране з: раку мозку (гліом), гліобластом, синдрому Баннаяна-Зонана, хвороби Ковдена, хвороби Лермітт-Дюкло, раку грудей, запального раку грудей, пухлини Більма, саркоми Евінга, рабдоміосаркоми, епендимоми, медулобластоми, раку товстої кишки, раку голови й шиї, раку нирок, раку легенів, раку печінки, меланоми, раку яєчників, раку підшлункової залози, раку простати, саркоми, остеосаркоми, гігантоклітинної пухлини кісток, раку щитовидної залози, лімфобластомного Т-клітинного лейкозу, хронічного мієлогенного лейкозу, хронічного лімфоцитарного лейкозу, лейкозу ворсистих клітин, гострого лімфобластомного лейкозу, гострого мієлогенного лейкозу, хронічного нейтрофільного лейкозу, гострого лімфобластомного Т-клітинного лейкозу, плазмацитоми, імунобластомного великоклітинного лейкозу, лейкозу клітин мантійної зони, множинної мієломи, мегакаріобластомного лейкозу, множинної мієломи, гострого мегакаріоцитарного лейкозу, промієлоцитарного лейкозу, еритролейкозу, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластомної клітинної лімфоми, лімфоми Беркітта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелію, раку легенів, раку вульви, раку шийки матки, раку ендометрія, раку нирок, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоклітинного раку, раку шлунка, раку носоглотки, раку щік, раку ротової порожнини, GIST (шлунково-кишкових стромальних пухлин) і раку яєчок. 14 UA 106740 C2 15 UA 106740 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline n-{(1-s)-2-amino-1-[(3-fluorophenyl)methyl]ethyl}-5-chloro-4-(4-chloro-1-methyl-1h-pyrazol-5-yl)-2-thiophenecarboxamide hydrochloride
Автори російськоюChen, Pingyun, Y., Gaulding, Jeffrey
МПК / Мітки
МПК: A61K 31/381, A61P 19/02, A61P 35/00
Мітки: кристалічний, n-{(1s)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1н-піразол-5-іл)-2-тіофенкарбоксаміду, гідрохлорид
Код посилання
<a href="https://ua.patents.su/18-106740-kristalichnijj-gidrokhlorid-n-1s-2-amino-1-3-ftorfenilmetiletil-5-khlor-4-4-khlor-1-metil-1n-pirazol-5-il-2-tiofenkarboksamidu.html" target="_blank" rel="follow" title="База патентів України">Кристалічний гідрохлорид n-{(1s)-2-аміно-1-[(3-фторфеніл)метил]етил}-5-хлор-4-(4-хлор-1-метил-1н-піразол-5-іл)-2-тіофенкарбоксаміду</a>
Попередній патент: Спосіб одержання каталізаторів фішера-тропша та їх застосування
Наступний патент: Піридазинони
Випадковий патент: Пристрій для підводного самомасажу в лікувальних та спортивних басейнах