Спосіб одержання хіральних 1,4-дизаміщених піперазинів, проміжна сполука (варіанти)
Номер патенту: 79774
Опубліковано: 25.07.2007
Автори: Зелдіс Джозеф, Джирковскі Іво, Фейгельсон Грегг Брайан
Формула / Реферат
1. Спосіб стереоселективного одержання 1,4-дизаміщених піперазинів формули IX
 , (IX)
, (IX)
де R являє собою С1-С3-алкільну групу;
Аr являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу; і Aryl являє собою С6-С12-ароматичну групу, необов'язково заміщену до трикратно замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії:
а) взаємодію сполуки формули Іа і сполуки формули Іb з одержанням сполуки формули II
 ,
,
де R' являє собою С1-С3-алкільну групу;
і подальшу взаємодію сполуки формули II з ариламіном Ar-NH2, де Аr має визначені вище значення, з одержанням сполуки формули III
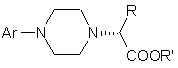 , (III)
, (III)
де R і R', кожен незалежно один від одного, являє собою С1-С3-алкільну групу; Аr має визначені вище значення;
b) відновлення сполуки формули III з одержанням сполуки формули IV
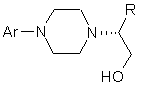 , (IV)
, (IV)
де Аr і R мають визначені вище значення;
с) перетворення сполуки формули IV у сполуку формули V
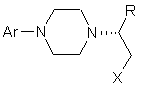 , (V)
, (V)
де Х являє собою придатну групу, що видаляється, незалежно вибрану з групи, що включає бром, хлор, метансульфонілокси, п-толуолсульфонілокси і п-бромфенілсульфонілокси, і Аr і R мають визначені значення;
d) перетворення сполуки формули V у сполуку формули VIII
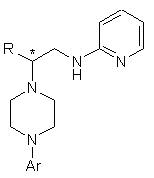 , (VIII)
, (VIII)
де Аr і R мають визначені вище значення, причому вказане перетворення включає стадії:
d1) взаємодію сполуки формули V із сполукою формули VI в апротонному розчиннику
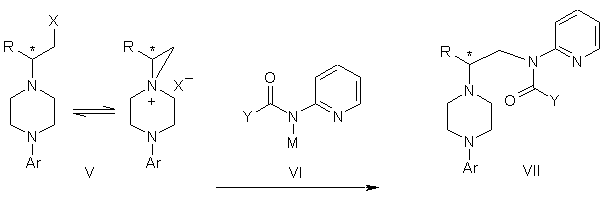 ,
,
де М являє собою лужний метал, і Y являє собою фрагмент, вибраний із групи, що включає С1-С6-алкокси, С1-С6-алкіл, С3-С7-циклоалкіл і С3-С7-циклоалкокси, і Аr і R мають визначені вище значення; і d2) обробку сполуки формули VII протонною кислотою з одержанням сполуки формули VIII;
е) перетворення сполуки формули VIII у сполуку формули IX обробкою сполуки формули VIII ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням сполуки формули IX.
2. Спосіб за п. 1, де стадію а) вказаного способу здійснюють у вигляді послідовного процесу без виділення сполуки формули II.
3. Спосіб за п. 1 або 2, де сполука формули III являє собою по суті чистий S-енантіомер.
4. Спосіб за п. 1 або 2, де сполука формули III являє собою по суті чистий R-енантіомер.
5. Сполука формули II
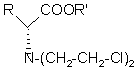 , (II)
, (II)
де R і R', кожен незалежно один від одного, являє собою С1-С3-нижчий алкіл, і її оптичні ізомери і солі.
6. Сполука за п. 5, де вказана сіль являє собою
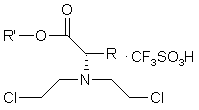 (II).
(II).
7. Сполука формули III
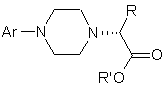 , (III)
, (III)
де R і R', кожен незалежно один від одного, являє собою С1-С3-нижчий алкіл, Аr являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і її оптичні ізомери.
8. Сполука за п. 7, де Аr являє собою 2,3-дигідробензодіоксин-5-іл.
9. Сполука формули IV
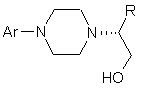 , (IV)
, (IV)
де Аr являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і її оптичні ізомери.
10. Сполука за п. 9, де Аr являє собою 2,3-дигідробензодіоксин-5-іл.
11. Сполука, вибрана з групи, що включає
метиловий ефір N,N-біс(2-хлоретил)-(R)-аланіну, трифторметансульфонат;
етиловий ефір N,N-біс(2-хлоретил)-(R)-аланіну, трифторметансульфонат;
етиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -метил-1-піперазиноцтової кислоти;
-метил-1-піперазиноцтової кислоти;
етиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -етил-1-піперазиноцтової кислоти;
-етил-1-піперазиноцтової кислоти;
метиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -метил-1-пиіперазиноцтової кислоти;
-метил-1-пиіперазиноцтової кислоти;
метиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -етил-1-піперазиноцтової кислоти;
-етил-1-піперазиноцтової кислоти;
(R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -метил-1-піперазинетанол і
-метил-1-піперазинетанол і
(R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-![]() -етил-1-піперазинетанол, і їх оптичні ізомери.
-етил-1-піперазинетанол, і їх оптичні ізомери.
Текст
УКРАЇНА (19) UA (11) 79774 (13) C2 (51) МПК (2006) C07D 295/08 (2007.01) C07B 53/00 C07C 229/12 (2007.01) C07D 213/75 (2007.01) C07D 295/10 (2007.01) C07D 319/00 C07D 405/12 (2007.01) C07D 487/10 (2007.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) СПОСІБ ОД ЕРЖАННЯ ХІРАЛЬНИХ 1,4-ДИЗАМІЩЕНИХ ПІПЕРАЗИНІВ, ПРОМІЖНА СПОЛУКА (ВАРІАНТИ) 1 N N O N Aryl O Cl + O R' Ia Ib N H N Cl . CF SO H 3 3 Cl , де R' являє собою С 1-С3-алкільну гр упу; і подальшу взаємодію сполуки формули II з ариламіном Ar-NH2, де Аr має визначені вище значення, з одержанням сполуки формули III II R Ar N N COOR' , (III) де R і R', кожен незалежно один від одного, являє собою С1-С3-алкільну гр упу; Аr має визначені вище значення; b) відновлення сполуки формули III з одержанням сполуки формули IV R Ar , (IX) де R являє собою С 1-С3-алкільну груп у; Аr являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу; і Aryl являє собою С 6-С12-ароматичну групу, необов'язково заміщену до трикратно замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії: Ar N N H O , (IV) де Аr і R мають визначені вище значення; с) перетворення сполуки формули IV у сполуку формули V R Ar N N (19) N C2 OSO2 C F3 (13) Cl О 79774 * О R' (11) R а) взаємодію сполуки формули Іа і сполуки формули Іb з одержанням сполуки формули II UA (21) 20041008215 (22) 10.03.2003 (24) 25.07.2007 (86) PCT/US03/07176, 10.03.2003 (31) 60/363,458 (32) 12.03.2002 (33) US (46) 25.07.2007, Бюл. №11, 2007р. (72) Джирковскі Іво, US, Зелдіс Джозеф, US, Фейгельсон Грегг Брайан, US (73) УАЙТ, US (56) DE 960203 C, 21.03.1957 (57) 1. Спосіб стереоселективного одержання 1,4дизаміщених піперазинів формули IX 2 X , (V) де Х являє собою придатну групу, що видаляється, незалежно вибрану з групи, що включає бром, хлор, метансульфонілокси, птолуолсульфонілокси і пбромфенілсульфонілокси, і Аr і R мають визначені значення; 3 79774 d) перетворення сполуки формули V у сполуку формули VIII R 4 O R' O R . CF SO H 3 3 N * N H N Cl N Cl (II). 7. Сполука формули III R Ar N , (VIII) де Аr і R мають визначені вище значення, причому вказане перетворення включає стадії: d1) взаємодію сполуки формули V із сполукою формули VI в апротонному розчиннику X R * * N N + N R V X _ N Ar N O Ar R N Ar O Y * N N N M Ar N Y N VI N O VII , де М являє собою лужний метал, і Y являє собою фрагмент, вибраний із групи, що включає С1-С6алкокси, С1-С6-алкіл, С3-С7-циклоалкіл і С 3-С7циклоалкокси, і Аr і R мають визначені вище значення; і d2) обробку сполуки формули VII протонною кислотою з одержанням сполуки формули VIII; е) перетворення сполуки формули VIII у сполуку формули IX обробкою сполуки формули VIII ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням сполуки формули IX. 2. Спосіб за п. 1, де стадію а) вказаного способу здійснюють у вигляді послідовного процесу без виділення сполуки формули II. 3. Спосіб за п. 1 або 2, де сполука формули III являє собою по суті чистий S-енантіомер. 4. Спосіб за п. 1 або 2, де сполука формули III являє собою по суті чистий R-енантіомер. 5. Сполука формули II R COOR' N-(CH 2 -CH 2-Cl)2 , (II) де R і R', кожен незалежно один від одного, являє собою С 1-С3-нижчий алкіл, і її оптичні ізомери і солі. 6. Сполука за п. 5, де вказана сіль являє собою Даний винахід відноситься до способів отримання хіральних 1,4-дизаміщених піперазинів і проміжних сполук, придатних для цих способів. Піперазини формули А R'O , (III) де R і R', кожен незалежно один від одного, являє собою С 1-С3-нижчий алкіл, Аr являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і її оптичні ізомери. 8. Сполука за п. 7, де Аr являє собою 2,3дигідробензодіоксин-5-іл. 9. Сполука формули IV R Ar N N HO , (IV) де Аr являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і її оптичні ізомери. 10. Сполука за п. 9, де Аr являє собою 2,3дигідробензодіоксин-5-іл. 11. Сполука, вибрана з групи, що включає метиловий ефір N,N-біс(2-хлоретил)-(R)-аланіну, трифторметансульфонат; етиловий ефір N,N-біс(2-хлоретил)-(R)-аланіну, трифторметансульфонат; етиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин5-іл)- a -метил-1-піперазиноцтової кислоти; етиловий ефір (R)-4-(2,3-дигідро-1,4-бензодіоксин5-іл)- a -етил-1-піперазиноцтової кислоти; метиловий ефір (R)-4-(2,3-дигідро-1,4бензодіоксин-5-іл)- a -метил-1-пиіперазиноцтової кислоти; метиловий ефір (R)-4-(2,3-дигідро-1,4бензодіоксин-5-іл)- a -етил-1-піперазиноцтової кислоти; (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)- b -метил1-піперазинетанол і (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)- b -етил-1піперазинетанол, і їх оптичні ізомери. 5 79774 де R являє собою нижчий алкіл, Аr являє собою незаміщений або заміщений арил або гетероарил, Q являє собою водень, СО-(нижчий)алкіл, СО-циклоалкіл або СО-арил, є високоефективними засобами, зв'язуючими 5НТ1А-рецептор. У патенті США №6127357 описуються такі похідні піперазину, які придатні для лікування розладів центральної нервової системи (CNS). Похідні піперазину формули Л містять асиметричний атом вуглецю, тому вони можуть знаходитися в двох оптично активних формах. У цей час добре відомо, що енантіомери зв'язуються з рецепторами з різною ефективністю і селективністю, вони можуть мати різний метаболічний шлях і викликати різні побічні ефекти. У заявці [WO 9703982] вказується, що переважні енантіомери піперазинів формули А виявляють поліпшену спорідненість до зв'язування 5НТ1А-рецепторів і біологічну доступність. Тому існує потреба в ефективному, простому, дешевому і безпечному способі отримання оптично переважних піперазинів. У [заявці WO 9533725] описується спосіб синтезу деяких хіральних піперазинів формули А алкілуванням відповідного 1-арилпіперазину енантіомерно чистим 2-(5-метил-2,2-діоксидо-1,2,3оксатіазолідин-3-іл)піридин. Одним з традиційних підходів до отримання 1,4-дизаміщених піперазинів є біс-алкілування первинних амінів біс(2-хлоретил)амінами, так званими азотистими іпритами. Декілька оптично активних піперазинів, стр уктурно відмінних від сполук формули А, були отримані конденсацією Nзаміщеного біс(2-хлоретил)аміну з вибраним хіральним аміном відповідно до методик [Natsuka et al.. J. Med. Chem. 1987, 1779 і WO 9424115], а також з природною амінокислотою відповідно до методик [Acta Pol. Pharm. 1999, 56. p. 41; CA 131:157745]. Однак зберігається потреба в способі отримання синтетично корисних молекул азотистих іпритів. У публікації [Chem.&Pharm.Bulletin Japan 1954. 275] описується перетворення біс(2хлоретил)аміну в N-біс(2хлоретил)аміноацетонітрил. в публікації [Chem.&Pharm. Bulletin Japan 1957, 487] описується безуспішна спроба розділити відповідний рацемічний М-біс(2-хлоретил)аланін, і складне розділення 2-[N-біс(2-хлоретил)аміно]пропанаміду. Поліфункціональні хіральні аміни можуть бути отримані декількома багатостадійними способами, але пряме заміщення реакційноспроможпої функціональної групи звичайно приводить до отримання рацемічних амінів. У публікації Effenberger et al., Angew. Chem. 1983. 95 [1], 50 повідомлялося. що трифлати реагують з простими вторинними амінами в умовах інверсії Вальдена (Walden). Даний спосіб застосовний до синтезу складного ефіру як (R)-, так і (S)-o амінокислот. Він дозволяє отримувати асиметричний С(а), N-зв'язок з високою мірою стереоселективності за допомогою єдиної реакції, і іноді використовувався з дуже незначними видозмінами [Quadri et al., Biorg.&Med.Chem.Letters 2. 1661. 1992; Taylor et al., Tetrahedron Letters 37, 1297, 1996]. У [публікації Huffman and Hwa-Ok Kim, Tetrahedron Letters 31, 2953, 1990] описана заміна 6 трифлатів складними (4-нітробензол)сильфонілоксіефірами в реакції з гідразинами. Даний винахід включає спосіб отримання сполуки формули III де R і R' кожний незалежно являє собою С1-С3 алкільну груп у; Аr являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу; причому вказаний спосіб включає взаємодію сполуки формули Іа і сполуки формули Іb з отриманням сполуки формули II і подальшу взаємодію сполуки формули II з ариламіном Ar-NH2, де Аr приймає значення, визначені вище, з отриманням сполуки формули III. Переважно, дані стадії здійснюються каскадним методом з отриманням сполуки III без виділення проміжної сполуки II. У переважній формі виконання винаходу сполука формули Іа являє собою єдиний (S)- або (R)енантіомер, який приводить до отримання єдиного енантіомеру сполуки формули II, що має зворотну конфігурацію, тобто (R) або (S). Гідридне відновлення сполуки формули III далі протікає із збереженням конфігурації з отриманням проміжної сполуки формули IV. Винахід включає також взаємодію сполуки формули IV з отриманням проміжних продуктів формули V: де X являє собою групу, що видаляється, таку як галоген (зокрема хлор або бром), метансульфонілокси, n-толуолсульфонілокси або пбромфенілсульфонілокси. Винахід включає також нові сполуки, представлені формулами II, III, IV і V, і їх оптичні ізомери. Винахід також включає наступні стадії способу, в яких сполука V використовується для отримання сполук VII, VIII і IX: обробка сполуки формули V сполукою формули VI в апротонному розчиннику 7 79774 8 де М являє собою лужний метал (наприклад, Na, Li, К), і Y являє собою фрагмент, вибраний з групи, що включає С1-С6-алкокси, С1-С6-алкіл. С3С7--циклоалкіл і С 3-С7-циклоалкокси; обробка сполуки формули VII протонною кислотою з отриманням сполуки формули VIII обробка сполуки формули VIII ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду і ароїлангідриду, в присутності основи з отриманням сполуки формули IX де Аr являє собою С6-С12-ароматичну групу, необов'язково замішену до трикратно замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро. аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести а томів вуглецю. Даний винахід розкриває спосіб отримання специфічних енантіомерних сполук як проміжних сполук для отримання 1,4-дизаміщених піперазинів, які придатні як засіб, зв'язуючий серотоніновий 1А рецептор. Як основні реагенти служать хіральні похідні азотистих іпритів. Даний спосіб забезпечує більш просту послідовність реакцій, ніж послідовність, відома з рівня техніки. Новий синтез хіральних 1,4-дизаміщених піперазинів приводить до отримання стабільних при зберіганні проміжних продуктів синтезу сполук формули IX, яка описана више. Різні аспекти переважного здійснення даного винаходу представлені на схемі 1: (S)-2-[(метилсульфоніл)окси]пропіонат, представлений на схемі 1, є комерційно доступним, або такі лактаттрифлати легко можуть бути отримані з відповідних алкіллактатів, наприклад, відповідно до методик, описаних в [публікаціях Prasad et al., J. Chem. Soc. Perkin Trans I, 1991, 3331, і Wang and Xu. Tetrahedron 54, 12597, 1998]. Біс(2хлоретил)амін виділяється у вигляді вільної основи з його гідрохлоридної солі. Реакція першої стадії, показана на схемі 1. проводиться в інертному органічному розчиннику, в якому розчинні вихідні речсгвини, такі як тетрагідрофуран, діоксан, 1,2диметоксіетан, діетиловий ефір, третбутилметиловий ефір, метиленхлорид, хлорбензол, трифторметилбензол або толуол. Температура не є визначальним чинником, і придатною може бути температура в інтервалі від 0°С до приблизно 50°С, переважно в інтервалі від температури крижаної бані до кімнатної температури. Більш високі температури прискорюють небажаний процес відщеплення. Реакція звичайно проводиться протягом 4-6 годин, хоча може використовуватися і більш тривале перемішування протягом 18-24 годин. Виходи відповідної сполуки формули II можуть високими. наприклад, 83%, але, як правило, виходи знаходяться в інтервалі 50-65%. Тетрагідрофуран є оптимальним розчинником, однак він дуже чутливий до присутності слідів трифторметансульфокислоти або ангідриду трифторметансульфокислоти, які можуть ініціювати часткову полімеризацію тетрагідрофурану і приводити до отримання гелеподібної речовини, що ускладнює виділення продукту. Переважне здійснення даного винаходу включає одностадійний процес, в якому сполука II, отримана в хлорбензолі у вигляді кристалічної солі трифторметансульфокислоти, використовується для алкілування 2,3-дигідро-1.4-бензодіоксин-5аміну в хлорбензолі для отримання сполуки НІ. Сполука формули II може зазнавати взаємодії з 2,3-дигідро-1,4-бензодіоксин-5-аміном в киплячому хлорбензолі протягом від приблизно 8 до приблизно 18 годин. Таким чином, отримання сполуки формули III може здійснюватися у вигляді послідовного процесу з використанням хлорбензольно 9 79774 го розчинника без необхідності проміжного виділення сполуки формули II. Складний аміноефір сполуки формули III може виділятися у вигляді вільної основи або перетворюватися в стабільну гідрохлоридну сіль. Альтернативно, сполуку формули III отримують конденсацією 2,3-дигідро-1,4-бензодіоксин-5-аміну з вільною основою сполуки формули II в аналогічних умовах, і обидві проміжні сполуки II і III без додаткового очищення використовуються на подальших стадіях. Переважне здійснення отримання сполуки формули III із сполуки формули II включає взаємодію амінобензодіоксину, як показано на схемі І. В іншому варіанті даного винаходу амінофеніл використовується замість амінобензодіоксану, де феніл може бути заміщеним до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу. Проміжні сполуки формули III можуть зазнавати відновлення до спирту формули IV за допомогою відновників. Реакція проводиться стандартними методами, відомими фахівцеві, наприклад, застосуванням комплексного гідриду металу або борвмісного відновника в умовах, що забезпечують відсутність епімерності. У переважному здійсненні способу даного винаходу відновлення проводиться при кип'ятінні із зворотним холодильником в простому ефірі або в тетрагідрофурані при 20-40°С з використанням алюмогідриду літію. Енатіомерна чистота спирту IV, що виділяється, становить 98% або більше, як визначено на хіральній колонці з використанням зразка рацемічного IV як еталону. У ще одному аспекті даного винаходу спирт сполуки формули IV може оброблятися метансульфонілхлоридом в присутності органічної основи в метиленхлориді для отримання проміжної сполуки формули V. В альтернативному варіанті спирт формули V або його гідрохлоридна сіль нагрівається з тіонілхлоридом в киплячому хлороформі з отриманням гідрохлоридної солі сполуки формули V. У залежності від природи групи X, що видаляється, кислотності середовища, концентрації або полярності розчинника вказані піперазини можуть знаходитися в рівновазі з 6-аза-3азоніаспіро[2,5]октановими похідними. Даний винахід включає також нові сполуки формули II, III і IV. Переважні сполуки включають наступні: метиловий ефір К,N-біс(2-хлоретил)-(R)аланіну, три фторметансульфонат; 10 етиловий ефір М,№-біс(2-хлоретил)-(ІІ)аланіну, три фторметансульфонат; етиловий ефір (R)-4-(2,3-дигідро-1,4бензодіоксин-5-іл)-a-метил-1 - піперазиноцтової кислоти; етиловий ефір (R)-4-(2,3-дигідро-1,4бензодіоксин-5-іл)-a-етил-1 -піперазиноцтової кислоти; метиловий ефір (R)-4-(2,3-дигідро-1.4бензодіоксин-5-іл)-a-метил-1піперазиноцтової кислоти; метиловий ефір (R)-4-(2,3-дигідро-1,4бензодіоксин-5-іл)-a-етил-1-піперазиноцтової кислоти; (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-bметил-1 -піперазинетанол, і (R)-4-(2,3-дигідро-1,4-бензодіоксин-5-іл)-bетил-1-піперазинетанол. Сполука V може зазнавати взаємодії із сполукою формули VI для отримання сполуки формули VII. Y являє собою фрагмент, вибраний з групи, що включає С1-С6-алкокси, С1С6-алкіл, С3-С7-циклоалкіл і С 3-С7-циклоалкокси. Амінопіридильний фрагмент вводиться шляхом заміщення. З попереднього рівня техніки не ясно, наскільки серйозно побічні реакції, описані вище, можуть впливати на проведення такого заміщення. Багато що залежить від конкретного алкілуючого агента. Відповідно до [заявки W09703982], амінопіридин VIa в конкретних умовах може зазнавати обробки сполуками формули Va, де X являє собою груп у, що видаляється, з отриманням сполуки VIla. У ході роботи над даним винаходом авторами було встановлено, що аніон N-алканоїльних сполук (тобто VIb) взаємодіє із сполукою V (Х=СІ ) зі значним (-20%) небажаним алкілуванням по азоту піридильного кільця, результатом якого є сполука X. В переважному варіанті даного винаходу Y являє собою алкоксигрупу. більш переважно С1-С6алкокси. Даний винахід забезпечує практичне здійснення синтезу N-арилпіперазинів. де хіральність вводиться на стадії утворення піперазинового кільця, а 2-амінопіридильне заміщення здійснюється реакцією заміщення. Застосування t-Boc-2-амінопіридину, VI, як описано в даному винаході. приводить до значного зниження кількості (
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of chiral 1,4-disubstituted piperazines, intermediate (variants)
Автори англійськоюJirkovsky Ivo, Feigelson Gregg Brian
Назва патенту російськоюСпособ получения хиральных 1,4-дизамещенных пиперазинов, промежуточное соединение (варианты)
Автори російськоюДжирковски Иво, Фейгельсон Грегг Брайан
МПК / Мітки
МПК: C07D 405/12, C07D 213/75, C07B 53/00, C07D 295/08, C07D 295/10, C07D 319/00, C07C 229/12, C07D 487/10
Мітки: 1,4-дизаміщених, одержання, піперазинів, хіральних, варіанти, сполука, проміжна, спосіб
Код посилання
<a href="https://ua.patents.su/7-79774-sposib-oderzhannya-khiralnikh-14-dizamishhenikh-piperaziniv-promizhna-spoluka-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання хіральних 1,4-дизаміщених піперазинів, проміжна сполука (варіанти)</a>
Попередній патент: Установка для комплексної обробки поверхні виробів у вакуумі
Наступний патент: Керамічний електродний матеріал на основі нітриду алюмінію для електроіскрового легування алюмінію та його сплавів
Випадковий патент: Бункер зернозбирального комбайна











