Похідні піридин-4-ілу
Номер патенту: 115357
Опубліковано: 25.10.2017
Автори: Боллі Мартін, Найлер Олівер, Лескоп Сірілл, Штайнер Беат
Формула / Реферат
1. Сполука формули (І)
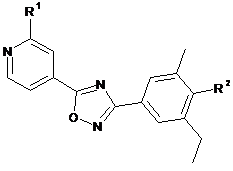 , (I)
, (I)
де
R1 являє собою С2-5-алкіл або циклопентил; та
R2 являє собою -OCH2-CH(OH)-CH2-NHCO-CH2OH;
або її сіль.
2. Сполука за п. 1, де R1 являє собою етил, н-пропіл, ізопропіл, н-бутил, ізобутил, ізопентил, пент-3-ил або циклопентил, або її сіль.
3. Сполука за п. 1, де R1 являє собою н-пропіл, ізопропіл, ізобутил або циклопентил, або її сіль.
4. Сполука за п. 1, де R1 являє собою циклопентил, або її сіль.
5. Сполука за будь-яким з пп. 1-4, де стереоцентр групи R2-OCH2-CH(OH)-CH2-NHCO-CH2OH знаходиться у S-конфігурації, або її сіль.
6. Сполука за п. 1, вибрана з групи, яка складається з наступних:
(S)-N-(3-(2-етил-4-(5-(2-етилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-пропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-ізопропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-бутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-ізобутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-ізопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід;
(S)-N-(3-(2-етил-4-(5-(2-(пентан-3-іл)-піридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід та
(S)-N-(3-(2-етил-4-(5-(2-циклопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід
або сіль таких сполук.
7. Сполука за п. 1, яка являє собою (S)-N-(3-(2-eтил-4-(5-(2-циклопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід або його сіль.
8. Сполука за п. 1, яка являє собою (S)-N-(3-(2-етил-4-(5-(2-етилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2-гідроксипропіл)-2-гідроксіацетамід або його сіль.
9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-8 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
10. Сполука за будь-яким з пп. 1-8 або її фармацевтично прийнятна сіль або фармацевтична композиція за п. 9 для застосування як медикаменту.
11. Сполука за будь-яким з пп. 1-8 або її фармацевтично прийнятна сіль для застосування у профілактиці або лікуванні захворювань або розладів, пов'язаних з активованою імунною системою.
12. Сполука за будь-яким з пп. 1-8 або її фармацевтично прийнятна сіль для застосування у профілактиці або лікуванні захворювань або розладів, вибраних з групи, що складається з наступних: відторгнення трансплантованих органів, таких як печінка, нирки, серце, легені, підшлункова залоза, рогівка та шкіра; захворювання трансплантат-проти-хазяїна, викликані трансплантацією стовбурових клітин; аутоімунні синдроми, включаючи ревматоїдний артрит, розсіяний склероз, запальні захворювання кишечнику, такі як хвороба Крона та неспецифічний виразковий коліт, псоріаз, псоріатичний артрит, тиреоідит, такий як тиреоідит Хашимото, та увеоретиніт; атопічні захворювання, такі як риніт, кон'юнктивіт, атопічний дерматит; астма; діабет І типу; постінфекційні аутоімунні захворювання, включаючи ревматизм та постінфекційний гломерулонефрит; та солідний рак та метастазування пухлини.
13. Сполука за будь-яким з пп. 1-8 або її фармацевтично прийнятна сіль для застосування у профілактиці або лікуванні захворювань або розладів, вибраних з групи, що складається з наступних: відторгнення трансплантованих органів, вибраних з нирок, печінки, серця та легені; захворювання трансплантат-проти-хазяїна, викликані трансплантацією стовбурових клітин; аутоімунні синдроми, вибрані з ревматоїдного артриту, розсіяного склерозу, псоріазу, псоріатичного артриту, хвороби Крона та тиреоідиту Хашимото; та атопічний дерматит.
14. Застосування сполуки за будь-яким з пп. 1-8 або її фармацевтично прийнятної солі у приготуванні фармацевтичної композиції для профілактики або лікування захворювань або розладів, пов'язаних з активованою імунною системою.
Текст
УКРАЇНА (19) UA (11) 115357 (13) C2 (51) МПК (2017.01) C07D 413/04 (2006.01) A61K 31/4433 (2006.01) A61P 37/00 МІНІСТЕРСТВО ЕКОНОМІЧНОГО РОЗВИТКУ І ТОРГІВЛІ УКРАЇНИ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (21) Номер заявки: a 2015 10003 (22) Дата подання заявки: 14.03.2014 (24) Дата, з якої є чинними 25.10.2017 права на винахід: (31) Номер попередньої 13159482.2 (32) Дата подання 15.03.2013 заявки відповідно до Паризької конвенції: попередньої заявки відповідно до Паризької конвенції: (33) Код держави-учасниці EP Паризької конвенції, до якої подано попередню заявку: (41) Публікація відомостей 10.12.2015, Бюл.№ 23 про заявку: (46) Публікація відомостей 25.10.2017, Бюл.№ 20 про видачу патенту: (86) Номер та дата подання міжнародної заявки, поданої відповідно до Договору PCT PCT/IB2014/059794, 14.03.2014 (72) Винахідник(и): Боллі Мартін (CH), Лескоп Сірілл (CH), Найлер Олівер (CH), Штайнер Беат (CH) (73) Власник(и): ІДОРСІЯ ФАРМАСЬЮТІКАЛЗ ЛТД, Hegenheimermattweg 91, CH-4123 Allschwil, Switzerland (CH) (74) Представник: Дубинський Михайло Iллiч, реєстр. №70 (56) Перелік документів, взятих до уваги експертизою: WO 2008/029371 A1, 13.03.2008 HALE J. J. ET AL., "Selecting against S1P3 enhances the acute cardiovascular tolerability of 3-(N-benzyl)aminopropylphosphonic acid S1P receptor agonists", BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, PERGAMON, AMSTERDAM, NL (20040705), vol. 14, no. 13, doi:10.1016/J.BMCL.2004.04.070, ISSN 0960894X, pages 3501-3505, XP002718181 [AD] 1 * tables 1,2,3 * (54) ПОХІДНІ ПІРИДИН-4-ІЛУ (57) Реферат: Винахід стосується сполук формули (І) R 1 N N O R 2 N , (I) 1 2 де R та R є такими, як розкрито у описі, способу їх одержання та способу їх застосування як фармацевтично активних сполук. Зазначені сполуки особливо діють як імуномодулятори. UA 115357 C2 (12) UA 115357 C2 UA 115357 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід відноситься до агоністів S1P1/EDG1 рецепторів формули (I), та способу їх застосування як активних компонентів у одержанні фармацевтичних композицій. Винахід також відноситься до зв'язаних аспектів, включаючи способи одержання сполук, фармацевтичних композицій із вмістом сполуки формули (I), та до способу їх використання як сполуки, що підвищують судинні функції, та як імуномодулятори, або окремо, або у комбінації з іншими активними сполуками або способами лікування. Опис винаходу Імунна система людини призначена для захисту тіла від сторонніх мікроорганізмів та речовин, які викликають інфекції або хвороби. Складні регулюючі механізми забезпечують, щоб імунна реакція була спрямована проти проникаючої речовини або організму, а не проти хазяїна. У деяких випадках, ці механізми контролю не регульовані, та можуть розвиватися аутоімунні реакції. Наслідком неконтрольованої запальної реакції є важке ушкодження органу, клітини, тканини або суглобу. З поточним лікуванням, уся імунна система, як правило, пригнічується, та здатність організму реагувати на інфекції також може мати великі ризики. Типові препарати цього класу містять у собі азатіоприн, хлорамбуцил, циклофосфамід, циклоспорин або метотрексат. Кортикостероїди, які зменшують запалення та пригнічують імунну реакцію, можуть викликати побічні ефекти при використанні у тривалому лікуванні. Нестероїдні протизапальні засоби (НПЗЗ) можуть зменшити біль та запалення, однак, вони мають значні побічні ефекти. Альтернативні методи лікування включають агенти, які активують або блокують сигналізацію цитокінів. Активні при пероральному введенні сполуки з імуномодулюючими властивостями, без шкоди для імунних реакцій та зі зниженими побічними ефектами значно поліпшили б поточні методики лікування неконтрольованих запальних захворювань. У галузі трансплантації органів імунна реакція повинна бути пригнічена, щоб запобігти відторгненню органу. Реципієнти трансплантації органу можуть мати деяке відторгнення, навіть якщо вони приймають імунодепресанти. Відторгнення найбільш часто зустрічається у перші кілька тижнів після трансплантації, але ситуації відторгнення можуть також відбутися через кілька місяців або навіть років після трансплантації. Комбінації до трьох або чотирьох препаратів широко використовуються з одержанням максимального захисту від відторгнення при мінімізації побічних ефектів. Поточні стандартні препарати, використовувані для лікування відторгнення пересаджених органів, втручаються у дискретні внутрішньоклітинні шляхи у активації білих кров'яних клітин Т-типу або B-типу. Приклади таких препаратів являють собою циклоспорин, даклізумаб, базиліксимаб, еверолімус або FK-506, які перешкоджають вивільненню або сигналізації цитокінів; азатіоприн або лефлуномід, які інгібують синтез нуклеотидів; або 15-деоксипергуалін, інгібітор диференціації лейкоцитів. Сприятливий вплив широких методик лікування імунодепресантами відносяться до їхніх ефектів; однак, узагальнена імуносупресія, яку ці препарати викликають, знижує захист імунної системи проти інфекції та злоякісних новоутворень. Крім того, стандартні імуносупресивні препарати часто використовуються у високих дозах та можуть викликати або прискорювати ушкодження органу. Детальний опис винаходу Даний винахід відноситься до нових сполук формули (I), які є агоністами для G білоксполучуваного рецептору S1P1/EDG1 та мають потужний і тривалий імуномодулюючий ефект, який досягається за рахунок зменшення числа циркулюючих та проникаючих Т- та Влімфоцитів, не зачіпаючи їх дозрівання, пам'ять або розширення. Зниження циркулюючих Т- / Влімфоцитів, у результаті агонізму рецептору S1P1/EDG1, можливе у комбінації зі спостережуваним поліпшенням ендотеліальної функції клітинного шару, пов'язаного з активацією рецептору S1P1/EDG1, робить такі сполуки корисними для лікування неконтрольованих запальних захворювань та для поліпшення судинної функціональності. Документ із попереднього рівня техніки WO 2008/029371 (документ D1) описує сполуки, які діють як агоністи рецептору S1P1/EDG1 та демонструють імуномодулюючий ефект, як описано вище. З іншого боку, кілька досліджень припускають, що активація рецептору S1P 3 пов'язана з вазо- та бронхоконстрикцією (наприклад, Salomone et al. Brit. J. Pharmacol. 153 (2008) 140-147; Murakami et al. Mol. Pharmacol. 77 (2010) 704-713; Lucke et al. Cellular Physiology and Biochemistry 26 (2010) 87-96), збільшенням артеріального тиску (наприклад, Fryer et al. PLOS One 7 (2012) e52985), зниженням частоти серцевих скорочень (наприклад, Hamada et. al. J. Med. Chem. 53 (2010) 3154-3168) та легеневим епітеліальним просочуванням (наприклад, Gon et al. PNAS 102 (2005) 9270-9275). Селективність по відношенню до рецептору S1P3 таким чином 1 UA 115357 C2 5 10 вважається перевагою даного агоністу рецептору S1P1 (наприклад, Hale et al. Bioorg. Med. Chem. Lett. 14 (2004) 3501-3505). Неочікувано було виявлено, що сполуки згідно із даним винаходом мають знижену дію на рецептор S1P3 у порівнянні з найближчими аналогами, описаними у документі D1. Це стає очевидним з даних, наведених у Таблиці 1 та Таблиці 2. Сполука прикладу 1 згідно з даним винаходу, наприклад, показує EC50 у 9950 нМ для рецептору S1P3, у той час як її найближчий аналог у документі D1 (приклад 57 з D1) показує значення EC50 у 1540 нМ. Точно так само, сполука прикладу 2 явно менш потужна відносно рецептору S1P3 у порівнянні з її найближчим аналогом, розкритим у документі D1 (приклад 101 з D1). Крім того, приклад 5 згідно із даним винаходом значно менш сильнодіючий на рецептор S1P3 у порівнянні з його аналогом з документу D1 (S-енантіомер рацемату прикладу 22 з D1), та те ж саме і для сполук прикладів 7 та 8 та їх відповідних аналогів у документі D1 (приклад 204 та приклад 233, відповідно, з D1). Таблиця 1: EC50 [нМ] 1 Приклад R 1 2 3 4 5 6 7 8 етил н-пропіл ізопропіл н-бутил ізобутил ізопентил пент-3-ил циклопентил S1P1 2,1 0,7 0,3 1,8 0,2 5,1 0,1 0,1 S1P3 9950 1120 3940 700 757 2600 1340 736 Таблиця 2: Найближчий аналог у D1 R до прикладу 1 (приклад 57 з D1) до прикладу 2 (приклад 101 з D1) до прикладу 5 (S-енантіомер прикладу 22 з D1) до прикладу 7 (приклад 204 з D1) до прикладу 8 (приклад 233 з D1) 1 етил н-пропіл ізобутил пент-3-ил циклопентил S1P1 0,3 0,4 0,1 0,2 0,2 EC50 [нМ] S1P3 1540 310 33 44 47 15 Узяті разом дані, представлені у Таблиці 1 та 2, ясно показують, що по відношенню до зниження активності на рецептор S1P3, похідні піридину згідно із даним винаходом перевершують відповідні аналоги метил-піридину, розкриті у документі D1, незалежно від 2 UA 115357 C2 1 5 10 15 20 природи заміснику R сполук формули (I) згідно із даним винаходом. Сполуки згідно із даним винаходом можуть бути використані окремо або у комбінації зі стандартними препаратами, що інгібують активацію Т-клітин, щоб забезпечити новий спосіб імуномодулюючого лікування зі зменшеною схильністю до інфекцій у порівнянні зі стандартною імуносупресивною терапією. Крім того, сполуки згідно із даним винаходом можуть бути використані у комбінації зі зниженими дозами імунодепресантів традиційного лікування, щоб забезпечити, з одного боку ефективну імуномодулюючу активність, а з іншого боку зменшення кінцевого ушкодження органу, пов'язаного з більш високими дозами стандартних імунодепресантів. Спостереження поліпшеної функції ендотелію клітинного шару, пов'язаного з активацією S1P1/EDG1 рецептору, забезпечує додаткові переваги сполук для поліпшення судинної функції. Нуклеотидна послідовність та амінокислотна послідовність для людських S1P 1/EDG1 та S1P3/EDG3 рецепторів відомі у даній галузі та опубліковані у, наприклад: Hla, T., та Maciag, T., J. Biol Chem. 265 (1990), 9308-9313; WO 91/15583 published 17 October 1991; WO 99/46277 published 16 September 1999; Yamaguchi F., Tokuda M., Hatase O., Brenner S., Biochem. Biophys. Res. Commun. 227 (1996), 608-614; An S., Bleu T., Huang W., Hallmark O.G., Coughlin S.R., Goetzl E.J., FEBS Lett. 417 (1997), 279-282. Потужність та ефективність сполук формули (I) оцінюють за допомогою аналізу GTPγS для визначення значень EC50 та за допомогою вимірювання циркулюючих лімфоцитів у щурів після перорального введення, відповідно (див. у експериментальній частині). 1) У першому варіанті здійснення даний винахід відноситься до сполуки формули (I), формула (I) 25 30 35 40 45 50 де 1 R являє собою C2-5-алкіл, переважно, де атом вуглецю, який приєднаний до кільця піридину, несе, щонайменше, атом водню, або циклопентил; та 2 R являє собою -OCH2-CH(OH)-CH2-NHCO-CH2OH. 2) Інший варіант здійснення винаходу відноситься до сполуки у відповідності з варіантом 1 здійснення 1), де R являє собою етил, н-пропіл, ізопропіл, н-бутил, ізобутил, ізопентил, пент-3ил або циклопентил. 3) Інший варіант здійснення винаходу відноситься до сполуки у відповідності з варіантом 1 здійснення 1), де R являє собою н-пропіл, ізопропіл, ізобутил або циклопентил. 4) Інший варіант здійснення винаходу відноситься до сполуки у відповідності з варіантом 1 здійснення 1), де R являє собою циклопентил. 5) Інший варіант здійснення винаходу відноситься до сполуки у відповідності з будь-яким з 2 варіантів здійснення 1) - 4), де стереоцентр R групи -OCH2-CH(OH)-CH2-NHCO-CH2OH знаходиться у S-конфігурації. Термін C2-5-алкіл означає насичені, алкільні групи розгалуженого або прямого ланцюгу з від двох до п'яти атомами вуглецю. Сполуки формули (I) можуть містити один або декілька стереогенних або асиметричних центрів, таких як один або більше асиметричних атомів вуглецю. Сполуки формули (I) можуть, таким чином, бути представлені у вигляді сумішей стереоізомерів або переважно у вигляді чистих стереоізомерів. Суміші стереоізомерів можуть бути розділені за способом, відомим фахівцям у даній галузі. Якщо форма множини використовується для сполук, солей, фармацевтичних композицій, захворювань і таке інше, це означає також одну сполуку, сіль або тому подібне. Будь-яке посилання вище або далі на сполуки формули (I) слід розуміти як таке, що відноситься також до солей, особливо фармацевтично прийнятних солей, сполук формули (I), у відповідних випадках та коли доцільно. Термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають бажану 3 UA 115357 C2 5 10 15 20 25 30 35 40 45 50 55 60 біологічну активність розглянутої сполуки та демонструють мінімальні небажані токсикологічні ефекти. Такі солі включають неорганічну або органічну кислоту та/або основно-адитивні солі залежно від присутності основної та/або кислотної групи у сполуці згідно з винаходом. Як посилання, див., наприклад "Handbook of Phramaceutical Salts. Properties, Selection and Use.’, P. Heinrich Stahl, Camille G. Wermuth (Eds.), Wiley-vch, 2008 і "Pharmaceutical Salts and Co-crystals", Johan Wouters and Luc Quéré (Eds.), RSC Publishing, 2012. 2 Даний винахід також включає мічені ізотопами, особливо H (дейтерій) мічені сполуки формули (I), де сполуки є ідентичними сполукам формули (I), за винятком того, що один або більше атомів кожен замінений на атом, що має той же атомний номер, але різну атомну масу, 2 що звичайно зустрічається у природі. Мічені ізотопами, особливо H (дейтерій), мічені сполуки формули (I) та їх солі знаходяться у межах обсягу даного винаходу. Заміщення водню більш 2 важким ізотопом H (дейтерій) може привести до більшої метаболічної стабільності, що у результаті приводить, наприклад, до збільшення у природніх умовах напіврозпаду або зниження вимог дозування, або може привести до зниження інгібування ферментів цитохрому P450, що приводить, наприклад, до поліпшеного профілю безпеки. У одному з варіантів здійснення винаходу, сполуки формули (I) не є міченими ізотопами, або вони мічені тільки одним або декількома атомами дейтерію. У під-варіанті здійснення сполуки формули (I) не мічені ізотопами взагалі. Мічені ізотопами сполуки формули (I) можуть бути отримані за аналогією з методом, описаним нижче, але з використанням відповідної ізотопної варіації підходящих реагентів або вихідних речовин. Приклади сполук піридину згідно з формулою (I) є вибраними з наступних: (S)-N-(3-(2-етил-4-(5-(2-етилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метил-фенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-пропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метил-фенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-ізопропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-бутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-ізобутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-ізопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід; (S)-N-(3-(2-етил-4-(5-(2-(пентан-3-іл)-піридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід; та (S)-N-(3-(2-етил-4-(5-(2-циклопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть бути використані як лікарські засоби, наприклад, у вигляді фармацевтичних композицій для ентерального (наприклад, особливо порожнини рота) або парентерального (у тому числі місцевого застосування або інгаляційного) введення, та є підходящими для зменшення кількості циркулюючих лімфоцитів та для профілактики та/або лікування захворювань або порушень, пов'язаних з активованою імунною системою. Виробництво фармацевтичних композицій може бути здійснене за способом, який буде знайомий будь-якому фахівцеві у даній галузі (див., наприклад, Remington, The Science and Practice of Pharmacy, 21st Edition (2005), Part 5, "Pharmaceutical Manufacturing" [published by Lippincott Williams & Wilkins]) за допомогою приведення описаних сполук формули (I) або їх фармацевтично прийнятних солей, необов'язково у комбінації з іншими терапевтично цінними речовинами, у галенову форму разом з відповідними, нетоксичними, інертними, фармацевтично прийнятними твердими або рідкими речовинами-носіями та, при бажанні, звичайними фармацевтичними ад'ювантами. Фармацевтичні композиції, що включають сполуки формули (I), є корисними для профілактики та/або лікування захворювань або порушень, пов'язаних з активованою імунною системою. Такі захворювання або порушення, пов'язані з активованою імунною системою та які повинні бути попереджені/вилікувані сполуками формули (I), являють собою, наприклад, вибрані із групи, що складається з таких як: відторгнення трансплантованих органів, тканин або клітин; захворювання трансплантат-проти-хазяїна, викликані трансплантацією; аутоімунні синдроми, включаючи ревматоїдний артрит; системний червоний вовчак; антифосфоліпідний синдром; тиреоідит Хашимото; лімфоцитарний тиреоідит; розсіяний склероз; важка міастенія; діабет I 4 UA 115357 C2 5 10 15 20 25 30 35 40 45 50 55 60 типу; увеїт; епісклерит; склерит; хвороба Кавасакі, увео-ретиніт; задній увеїт; увеїт, пов'язаний із хворобою Бехчета; увеоменінгіальний синдром; алергійний енцефаломієліт; хронічна васкулопатія алотрансплантату; пост-інфекційні аутоімунні захворювання, включаючи ревматизм та пост-інфекційний гломерулонефрит; запальні та гіперпроліферативні захворювання шкіри; псоріаз; псоріатичний артрит; атопічний дерматит; міопатія; міозит; остеомієліт; контактний дерматит; екзематозний дерматит; себорейний дерматит; червоний плоский лишай; пухирчатка; бульозний пемфігоїд; бульозний епідермоліз; кропив'янка; набряк Квінке; васкуліт; еритема; шкірна еозинофілія; акне; склеродермія; алопеція; кератокон'юнктивіт; весняний кон'юнктивіт; кератит; герпетичний кератит; дистрофія епітелію рогівки; більма рогівки; очна пухирчатка; роз'їдаюча виразка рогівки; виразковий кератит; склерит; офтальмопатія Грейвса; синдром Фогта-Коянагі-Харада; саркоїдоз; алергії на пил; оборотне обструктивне захворювання дихальних шляхів; бронхіальна астма; алергійна астма; внутрішня астма; зовнішня астма; астма на пил; хронічна або застаріла астми; пізня астма та гіперчутливість дихальних шляхів; бронхіоліт; бронхіт; ендометріоз; орхіт; виразки шлунку; ішемічні захворювання кишечнику; запальні захворювання кишечнику; некротичний ентероколіт; кишкові ураження, пов'язані з термічними опіками; глютенова хвороба; проктит; еозинофільний гастроентерит; мастоцитоз; хвороба Крона; виразковий коліт; ушкодження судин від ішемічної хвороби та тромбозу; атеросклероз; ожиріння серця; міокардит; інфаркт міокарда; синдром аортиту; кахексія внаслідок вірусного захворювання; судинний тромбоз; мігрень; риніт; екзема; інтерстиціальний нефрит; IgA-індукована нефропатія; синдром Гудпасчера; гемолітикоуремічний синдром; діабетична нефропатія; гломерулосклероз; гломерулонефрит; тубулоінтерстиціальний нефрит; інтерстиціальний цистит; множинний міозит; синдром ГійєнаБарре; хвороба Мен'єра; поліневрит; множинний неврит; мієліт; мононеврит; радикулопатія; гіпертиреоз; хвороба Базедова; тиреотоксикоз; чиста аплазія червоних клітин; апластична анемія; гіпопластична анемія; ідіопатична тромбоцитопенічна пурпура; аутоімунна гемолітична анемія; аутоімунна тромбоцитопенія; агранулоцитоз; злоякісна анемія; мегалобластна анемія; анеритроплазія; остеопороз; міома легенів; ідіопатична інтерстиціальна пневмонія; дерматоміозит; лейкодерма звичайна; іхтіоз; фотоалергійна чутливість; шкірна лімфома Тклітин; вузелковий поліартрит; хорея Гентінгтона; хорея Сиденгама; кардит; міокардит; склеродермія; гранулематоз Вегенера; синдром Шегрена; ожиріння; еозинофільний фасцит; ураження ясен, періодонту, альвеолярного відростку, субстанції зубної кістки; алопеція або облисіння рогівки чоловічого типу; м'язова дистрофія; піодермія; синдром Сезарі; гіпофізит; хронічна надниркова недостатність; хвороба Адісона; ішемічно-реперфузійне ушкодження органів, яке відбувається при збереженні; ендотоксичний шок; псевдомембранозний коліт; коліт, викликаний ліками або випромінюванням; ішемічна гостра ниркова недостатність; хронічна ниркова недостатність; рак легенів; злоякісне новоутворення лімфоїдного походження; гострі або хронічні лейкози; лімфоцитарна лімфома; емфізема легенів; катаракта; сидероз; пігментний ретиніт; стареча дегенерація жовтої плями; вітреальні фляки; лужний опік рогівки; дерматит еритеми; бульозний дерматит; цементний дерматит; гінгівіт; пародонтит; сепсис; панкреатит; захворювання периферичних артерій; канцерогенез; солідні ракові пухлини; метастази карциноми; гіпобаропатія; аутоімунний гепатит; первинний біліарний цироз печінки; склерозуючий холангіт; часткова резекція печінки; гострий некроз печінки; цироз; алкогольний цироз; печінкова недостатність; блискавична печінкова недостатність; печінкова недостатність із пізнім початком; та "гостра при хронічній" печінкова недостатність. Переважні захворювання або порушення, що підлягають лікуванню та/або профілактиці за допомогою сполук формули (I), є вибраними із групи, що складається з таких як: відторгнення трансплантованих органів, таких як печінка, нирки, серце, легені, підшлункова залоза, рогівка та шкіра; захворювання трансплантат-проти-хазяїна, викликані трансплантацією стовбурових клітин; аутоімунні синдроми, включаючи ревматоїдний артрит, розсіяний склероз, запальні захворювання кишечнику, такі як хвороба Крона та неспецифічний виразковий коліт, псоріаз, псоріатичний артрит, тиреоідит, такий як тиреоідит Хашимото та увео-ретиніт; атопічні захворювання, такі як риніт, кон'юнктивіт, атопічний дерматит та астма; діабет I типу; постінфекційні аутоімунні захворювання, включаючи ревматизм та пост-інфекційний гломерулонефрит; та солідний рак та метастазування пухлини. Особливо кращими захворюваннями або порушеннями, що підлягають лікуванню та/або профілактиці за допомогою сполук формули (I), є вибрані із групи, що складається з таких як: відторгнення трансплантованих органів, вибраних з нирок, печінки, серця та легенів; захворювання трансплантат-проти-хазяїна, викликані трансплантацією стовбурових клітин; аутоімунні синдроми, вибрані з ревматоїдного артриту, розсіяного склерозу, псоріазу, псоріатичного артриту, хвороби Крона та тиреоідиту Хашимото; та атопічний дерматит. 5 UA 115357 C2 5 10 15 20 25 30 35 Найбільш переважно захворювання або порушення, що підлягають лікуванню та/або профілактиці за допомогою сполук формули (I), вибирають з розсіяного склерозу та псоріазу. Даний винахід також відноситься до способу профілактики або лікування захворювання або розладу, зазначеного у даному описі, що включає введення суб'єкту фармацевтично активної кількості сполуки формули (I). Крім того, сполуки формули (I) можуть бути також використані у комбінації з одним або декількома імуномодуляторами, для профілактики та/або лікування захворювань, розладів, згаданих у даному описі. Відповідно до кращого варіанту здійснення винаходу зазначений носій вибирають із групи, що складається з імунодепресантів, кортикостероїдів, НПЗЗ, цитотоксичних лікарських засобів, інгібіторів адгезивних молекул, цитокінів, інгібіторів цитокінів, антагоністів рецепторів цитокінів та рекомбінантних рецепторів цитокінів. Даний винахід також відноситься до способу застосування сполуки формули (I) для одержання фармацевтичної композиції, необов'язково для застосування у комбінації з одним або декількома імуномодуляторами, для профілактики або лікування захворювань та розладів, зазначених у даному описі. Сполуки формули (I) можуть бути виготовлені за допомогою способів, наведених нижче, способів, наведених у прикладах, або аналогічних способів. Оптимальні умови реакції можуть варіюватися залежно від конкретних використовуваних реагентів або розчинників, але такі умови можуть бути визначені фахівцем у даній галузі за допомогою стандартних методик оптимізації. Сполуки формули (I) згідно з даним винаходом можуть бути отримані відповідно до загальної послідовності реакцій, описаної нижче. Лише деякі із синтетичних можливостей, що ведуть до сполук формули (I), є описаними. Сполуки формули (I) отримують шляхом взаємодії сполуки структури 1 у розчиннику, такому як толуол, піридин, ДМФА, ТГФ, діоксан, DME, і т.д., при кт або підвищених температурах у присутності або за відсутності допоміжних сполук, таких як, наприклад, кислоти (наприклад, ТФОК, оцтова кислота, HCl, і т.д.), основи (наприклад, NaH, NaOAc, Na 2CO3, K2CO3, NEt3, і т.д.), солі тетраалкіламонію, агенти для видалення води (наприклад, оксаліл-хлорид, ангідрид карбонової кислоти, POCl3, PCl5, P4O10, молекулярні сита, реагент Берджесса, і т.д.) (літ.: наприклад, A. R. Gangloff, J. Litvak, E. J. Shelton, D. Sperandio, V. R. Wang, K. D. Rice, Tetrahedron Lett. 42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R. F. Poulain, A. L. Tartar, B. P. Déprez, Tetrahedron Lett. 42 (2001), 1495-1498; R. M. Srivastava, F. J. S. Oliveira, D. S. Machado, R. M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E. O. John, J. M. Shreeve, Inorganic Chemistry 27 (1988), 3100-3104; B. Kaboudin, K. Navaee, Heterocycles 60 (2003), 22872292). Структура 1 40 Сполуки структури 1 можуть бути отримані шляхом взаємодії сполуки структури 2 зі сполукою структури 3 у розчиннику, такому як ДМФА, ТГФ, ДХМ, і т.д., у присутності одного або більше зв'язуючих агентів, таких як TBTU, DCC, EDC, HBTU, CDI, і т.д., та у присутності або за відсутності основи, такої як NEt3, DIPEA, NaH, K2CO3, і т.д. (літ.: наприклад, A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003), 7316-7321; та література приведена вище). 6 UA 115357 C2 Структура 2 5 Сполуки структури 3 можуть бути отримані шляхом взаємодії сполуки структури 4 з гідроксиламіном або однією з його солей у розчиннику, такому як MeOH, EtOH, піридин, і т.д., у присутності або за відсутності основи, такої як Na2CO3, K2CO3, трет-бутилат калію, NEt3, і т.д. (Літ.: наприклад, E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905, WO 2004/035538 (Merck & Co., Inc., USA)). Структура 4 10 15 20 25 30 35 40 Структура 3 Структура 5 Сполуки структури 2 можуть бути отримані шляхом взаємодії 2-хлор-ізонікотинової кислоти або її підходящої похідної складного ефіру (структура 5, де R являє собою, наприклад, метил, етил, ізопропіл, і т.д.) з діалкіл-Zn, алкіл-Zn або циклоалкіл-Zn галогеновим реагентом в умовах реакції Негісі (літ.: наприклад, H. Matsushita, E. Negishi, J. Org. Chem. 47 (1982), 4161-4165), з відповідним алкільним або циклоалкільним реактивом Грін'яра, наприклад, у присутності Fe(acac)3 у розчиннику, такому як ТГФ, діоксан, ДМФА, NMP і т.д., або їх комбінації, при температурах у діапазоні від -78 до 25 °C за умов реакції Фюрстерна (літ.: наприклад, A. Fürstner, A. Leitner, M. Mendez, H. Krause, J. Am. Chem. Soc. 124 (2002), 13856-13863; A. Fürstner, A. Leitner, Angew. Chem. 114 (2002), 632-635) або з похідною 1-алкеніл або циклоалкен1-іл-бору (літ.: наприклад, F. Kerins, D. F. O'Shea, J. Org. Chem. 67 (2002), 4968-4971) за умов сполучення Сузукі (літ.: наприклад, H. Doucet, Eur. J. Org. Chem. 2008, 2013-2030). У випадку, 1 коли використовують похідні 1-алкенілбору, щоб ввести вуглецеву структуру R , наступна стадія гідрування потрібна, щоб встановити бажану групу алкілу або циклоалкілу. Нарешті, у випадку, коли був використаний складний ефір піридин-4-карбонової кислоти у описаних вище стадіях, гідроліз складного ефіру у основних або кислих умовах реакції дає бажану сполуку структури 2. Кожен раз, коли сполуки формули (I) отримують у вигляді сумішей стереоізомерів, таких як особливо енантіомери, стереоізомери можуть бути розділені з використанням методів, відомих спеціалістам у даній галузі: наприклад, шляхом формування та розділення диастереомерних солей або за допомогою ВЕРХ над хіральною стаціонарною фазою, наприклад, колонка Daicel Chiralpak AD-H (5 мкм), колонка Daicel Chiralcel OD-H (5 мкм), колонка Daicel Chiralcel OD (10 мкм), колонка Daicel ChiralPak IA (5 мкм), колонка Daicel ChiralPak IB (5 мкм), колонка Daicel ChiralPak IC (5 мкм), або колонка (R, R)-Whelk-01 (5 мкм). Типові умови хіральної ВЕРХ являють собою ізократичну суміш елюенту А (EtOH, у присутності або за відсутності основи, такої як NEt 3 та/або діетиламін, або кислоти, такої як ТФОК) та елюенту В (гептан). Експериментальна частина Наступні приклади ілюструють винахід, але зовсім не обмежують його обсяг. 1 Всі температури вказані у°C. Сполуки характеризуються за допомогою H-ЯМР (300 МГц) 13 або C-ЯМР (75 МГц) (Varian Oxford; хімічні зсуви приведені у м.ч. відносно використовуваного розчиннику; мультиплетності: s = синглет, d = дублет, t = триплет, p = пентуплет, hex = гексет, hept = гептет, m = мультиплет, br = широкий, константи сполучення приведені у Гц); за допомогою РХ-МС (Finnigan Navigator з HP 1100 Binary Pump та DAD, колонка: 4,6 × 50 мм, Zorbax SB-AQ, 5 мкм, 120 Å, градієнт: 5-95 % MeCN у воді, 1 хвил., з 0,04 % ТФОК, потік: 4,5 мл/хвил., tR подана у хвил.; за допомогою ТШХ (ТШХ-планшети фірми Merck, силікагель 60 F254); або за допомогою температури плавлення. Сполуки очищують за допомогою препаративної ВЕРХ (колонка: X-terra RP18, 50 × 19 мм, 5 мкм, градієнт: 10-95 % MeCN у воді з додаванням 7 UA 115357 C2 0,5 % мурашиної кислоти) або за допомогою РХСТ (Labomatic MD-80-100 pump, детектор Linear UVIS-201, колонка: 350 × 18 мм, Labogel-RP-18-5s-100, градієнт: 10 % MeOH у воді до 100 % MeOH). Скорочення (як використовується у даному описі): вод. водний БСА бичачий сироватковий альбумін реагент Берджесса метоксикарбонілсульфамоїл триетиламоній гідроксид СС колонкова хроматографія CDI карбоніл діімідазол DCC Ν,Ν'-дициклогексил карбодіімід ДХМ дихлорметан DEAD діетил-діазодикарбоксилат DIPEA основа Хюнінга, діетилізопропіламін DME 1,2-диметоксиетан ДМФА диметилформамід ДМСО диметилсульфоксид dppf 1,1'-біс(дифенілфосфіно)фероцен ЕА етилацетат EDC N-(3-диметиламінопропіл)-N'-етил-карбодіімід Et етил EtOH етанол Fe(acac)3 залізо(III) ацетилацетон-комплекс год. година(и) нвти O-бензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат HEPES 4-(2-гідроксиетил)-1-піперазинетансульфонова кислота HOBt 1-гідрокси-бензотриазол ВЕРХ високоефективна рідинна хроматографія PX-BPMC рідинна хроматографія-мас-спектрометрія високого розділення РХ-МС рідинна хроматографія - мас-спектрометрія літ. література Me метил MeCN ацетонітрил MeOH метанол хвил. хвилина(и) PXCT NaOAc NEt3 NMP орг. PPh3 преп. кількісн. кт нас. S1P ТВTU трет. ТФОК ТГФ ТШХ tR рідинна хроматографія середнього тиску ацетат натрію триетиламін 1-метил-2-піролідон органічний трифенілфосфін препаративний кількісний кімнатна температура насичений сфінгозин 1-фосфат 2-(1Н-бензотриазол-1-іл)-1,2,3,3-тетраметилуроній тетрафторборат третинний трифтороцтова кислота тетрагідрофуран тонкошарова хроматографія час утримання 5 Одержання проміжних сполук 10 N-((S)-3-[2-етил-4-(N-гідроксикарбамімідоїл)-6-метил-фенокси]-2-гідрокси-пропіл)-2-гідроксиацетамід a) До льодяного розчину H2SO4 (150 мл) у воді (250 мл) додавали 2-етил-6-метиланілін (15,0 8 UA 115357 C2 5 10 15 20 25 30 35 40 45 50 55 60 г, 111 ммоль). Розчин обробляли льодом (150 г) перед тим як по краплях додавали розчин NaNO2 (10,7 г, 155 ммоль) у воді (150 мл) та лід (50 г). Суміш перемішували при 0 °C впродовж 1 год., додавали 50 % вод. H2SO4 (200 мл) та перемішування продовжували при кт впродовж 18 год. Суміш екстрагували за допомогою ДХМ, органічні екстракти сушили над MgSO 4 та упарювали. Сиру речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою суміші гептан:EA 9:1 з одержанням 2-етил-6-метил-фенолу (8,6 г, 57 %) 1 у формі малинового масла; РХ-МС: tR=0,89 хвил.; H ЯМР (CDCl3): δ 7,03-6,95 (m, 2H), 6,80 (t, J=7,6 Гц, 1H), 4,60 (s, 1H), 2,64 (q, J=7,6 Гц, 2H), 2,25 (s, 3H), 1,24 (t, J=7,6 Гц, 3H). б) Розчин 2-етил-6-метил-фенолу (200 г, 1,47 мл) та гексаметилeн тетрааміну (206 г, 1,47 мл) у оцтовій кислоті (1600 мл) та воді (264 мл) нагрівали із зворотним холодильником. Конденсат видаляли з використанням пристрою Dean-Stark до моменту, поки 1200 мл конденсату не зібрано. Реакційну суміш охолоджували до кт та додавали воду (1000 мл). Густу суспензію фільтрували та зібрану тверду речовину сушили при 60 °C в умовах вакууму (10 мбар) з одержанням 3-етил-4-гідрокси-5-метил-бензальдегіду (191 г, 79 %) у формі твердої + 1 речовини помаранчевого кольору; РХ-МС: tR=0,86 хвил., [M+1+CH3CN] = 206,27; H ЯМР (CDCl3): δ 9,84 (s, 1 H), 7,59 (s, 1 H), 7,57 (s, 1 H), 4,64 (s br, 1 H), 2,71 (q, J=7,5 Гц, 2 H), 2,34 (s, 3 H), 1,30 (t, J=7,5 Гц, 3 H). в) Розчин 3-етил-4-гідрокси-5-метил-бензальдегіду (5,32 г, 32,4 ммоль) та гідроксиламін гідрохлориду (3,38 г, 48,6 ммоль) у NMP (35 мл) перемішували впродовж 3 год. при 80 °C в умовах мікрохвильового опромінювання (300 В, постійне охолодження, A. K. Chakraborti, G. Kaur, Tetrahedron 55 (1999) 13265-13268). Суміш розводили водою та екстрагували два рази за допомогою діетилового ефіру. Органічні екстракти промивали за допомогою 2 н. вод. HCl, нас. вод. NaHCO3 розчину та сольового розчину. Органічні екстракти об'єднували, сушили над Na2SO4, фільтрували та концентрували. Сиру речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою суміші гептан:EA 3:2 з одержанням 3-етил4-гідрокси-5-метил-бензонітрилу у формі твердої речовини блідо-жовтого кольору (4,80 г, 92 %); 1 РХ-МС: tR=0,90 хвил.; H ЯМР (CDCl3): δ 1,24 (t, J=7,6 Гц, 3 H), 2,26 (s, 3 H), 2,63 (q, J=7,6 Гц, 2 H), 5,19 (s, 1 H), 7,30 (s, 2 H). г) До розчину 3-етил-4-гідрокси-5-метил-бензонітрилу (5,06 г, 31,4 ммоль) у ТГФ (80 мл) додавали PPh3 (9,06 г, 34,5 ммоль) та (R)-гліцидол (2,29 мл, 34,5 ммоль). Суміш охолоджували до 0 °C перед тим як додавали DEAD у толуолі (15,8 мл, 34,5 ммоль). Суміш перемішували впродовж 18 год. поки здійснювали нагрівання до кт. Розчинник випарювали та сиру речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою суміші гептан:EA 7:3 з одержанням (S)-3-етил-5-метил-4-(оксиран-2-ілметокси)бензонітрилу (5,85 г, + 1 86 %) у формі масла жовтого кольору; РХ-МС: tR=0,96 хвил., [M+42] = 259,08; H ЯМР (CDCl3): δ 7,38 (s, 1 H), 7,35 (s, 1 H), 4,12-4,19 (m, 1 H), 3,73-3,80 (m, 1 H), 3,36-3,42 (m, 1 H), 2,90-2,96 (m, 1 H), 2,68-2,77 (m, 3 H), 2,34 (s, 3 H), 1,26 (t, J=7,6 Гц, 3 H). д) Зазначений вище (S)-3-етил-5-метил-4-(оксиран-2-ілметокси)бензонітрил (5,85 г, 26,9 ммоль) розчиняли у 7 н. NH3 у метанолі (250 мл) та розчин перемішували при 65 °C впродовж 18 год. Розчинник випарювали з одержанням сирого (S)-4-(3-аміно-2-гідроксипропокси)-3-етил5-метилбензонітрилу (6,23 г, кількісн.) у формі масла жовтого кольору; РХ-МС: tR=0,66 хвил., + 1 [M+1] = 235,11; H ЯМР (D6-ДМСО): δ 7,54 (s, 2 H), 4,96 (s br, 1 H), 3,77-3,83 (m, 1 H), 3,68-3,77 (m, 2 H), 2,59-2,75 (m, 4 H), 2,28 (s, 3 H), 1,58 (s br, 2 H), 1,17 (t, J=7,5 Гц, 3 H). ж) До розчину (S)-4-(3-аміно-2-гідроксипропокси)-3-етил-5-метил-бензонітрилу (6,23 г, 26,6 ммоль) додавали гліколеву кислоту (2,43 г, 31,9 ммоль), HOBt (4,31 г, 31,9 ммоль) та EDC гідрохлорид (6,12 г, 31,9 ммоль). Суміш перемішували при кт впродовж 18 год. перед тим, як її розводили нас. вод. NaHCO3 та екстрагували два рази за допомогою EA. Об'єднані органічні екстракти сушили над MgSO4, фільтрували та концентрували. Сиру речовину очищали за допомогою колонкової хроматографії за допомогою ДХМ з додаванням 8 % метанолу з одержанням (S)-N-[3-(4-ціано-2-етил-6-метил-фенокси)-2-гідрокси-пропіл]-2-гідрокси-ацетаміду + 1 (7,03 г, 90 %) у формі масла жовтого кольору; РХ-МС: tR=0,74 хвил., [M+1] = 293,10; H ЯМР (CDCl3): δ 1,25 (t, J=7,5 Гц, 3 H), 2,32 (s, 3 H), 2,69 (q, J=7,5 Гц, 2 H), 3,48-3,56 (m, 3 H), 3,70-3,90 (m, 3 H), 4,19 (s, br, 3 H), 7,06 (m, 1 H), 7,36 (s, 1 H), 7,38 (s, 1 H). з) До розчину (S)-N-[3-(4-ціано-2-етил-6-метил-фенокси)-2-гідрокси-пропіл]-2-гідроксиацетаміду (19,6 г, 67 ммоль) у метанолі (500 мл) додавали гідроксиламін гідрохлорид (9,32 г, 134 ммоль) та NaHCO3 (11,3 г, 134 ммоль). Отриману суспензію перемішували при 65 °C впродовж 18 год. Суміш фільтрували та фільтрат концентрували. Залишок розчиняли у воді (20 мл) та EA (300 мл). Вод. фазу розділяли та екстрагували три рази за допомогою EA. Об'єднані органічні екстракти сушили над MgSO4, фільтрували, концентрували та сушили з одержанням цільової сполуки у формі твердої речовини білого кольору (18,9 г, 87 %); РХ-МС: tR=0,51 хвил., 9 UA 115357 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 1 [M+1] = 326,13; H ЯМР (D6-ДМСО): δ 1,17 (t, J 7,4 Гц, 3 H), 2,24 (s, 3H), 2,62 (q, J 7,4Гц, 2 H), 3,23 (m, 1 H), 3,43 (m, 1 H), 3,67 (m, 2 H), 3,83 (s, 2 H), 3,93 (m, 1 H), 5,27 (s br, 1 H), 5,58 (s br, 1 H), 5,70 (s, 2 H), 7,34 (s, 1 H), 7,36 (s, 1 H), 7,67 (m, 1 H), 9,46 (s br, 1H). 2-етилізонікотинова кислота Цільову сполуку отримували у формі гідрохлориду за аналогією з 2-(пентан-3+ 1 іл)ізонікотиновою кислотою; РХ-МС: tR=0,22 хвил., [M+1] = 152,13; H ЯМР (CD3OD): δ 8,68 (d, J=5,4 Гц, 1 H), 7,99 (s, 1 H), 7,91 (dd, J1=5,3 Гц, J2=1,3 Гц, 1 H), 2,98 (q, J=7,6 Гц, 2 H), 1,37 (t, J=7,6 Гц, 3 H). 2-пропілізонікотинова кислота Цільову сполуку отримували у формі гідрохлориду за аналогією з 2-(пентан-3+ іл)ізонікотиновою кислотою; РХ-МС: tR=0,20 хвил., [M+1] = 166,10. Метил 2-пропілізонікотинат: + 1 РХ-МС: tR=0,43 хвил., [M+1] = 180,33; H ЯМР (CDCl3): δ 8,67 (d, J=5,0 Гц, 1 H), 7,70 (s, 1 H), 7,64 (dd, J1=5,1 Гц, J2=1,5 Гц, 1 H), 3,95 (s, 3 H), 2,82-2,87 (m, 2 H), 1,73-1,84 (m, 2 H), 0,97 (t, J=7,4 Гц, 3 H). 2-ізопропілізонікотинова кислота Цільову сполуку отримували у формі гідрохлориду за аналогією з 2-(пентан-3+ 1 іл)ізонікотиновою кислотою; РХ-МС: tR=0,18 хвил., [M+1] = 166,09; H ЯМР (D7-ДМФА): δ 8,49 (d, J=4,9 Гц, 1 H), 7,82 (s, 1 H), 7,74 (dd, J1=4,9 Гц, J2=1,1 Гц, 1 H), 2,99-3,08 (m, 1 H), 1,25 (d, J=6,9 Гц, 6 H). 2-бутилізонікотинова кислота Цільову сполуку отримували у формі гідрохлориду за аналогією з 2-(пентан-3+ 1 іл)ізонікотиновою кислотою; РХ-МС: tR=0,32 хвил., [M+1] = 180,37; H ЯМР (D7-ДМФА): δ 8,98 (d, J=5,8 Гц, 1 H), 8,38 (s, 1 H), 8,30 (dd, J1=5,8 Гц, J2=1,4 Гц, 1 H), 3,28-3,34 (m, 2 H), 1,83-1,93 (m, 2 H), 1,36-1,48 (m, 2 H), 0,95 (t, J=7,3 Гц, 3 H). 2-ізобутилізонікотинова кислота a) До розчину 2-хлорізонікотинової кислоти (5,00 г, 31,7 ммоль) у толуолі додавали N, Nдиметилформамід ди-трет бутилацеталь (17,9 г, 79,3 ммоль). Суміш перемішували при 90 °C впродовж 20 год. Суміш концентрували, фільтрували та фільтрат розводили за допомогою EA та промивали за допомогою води, сушили над MgSO 4, фільтрували та концентрували. Сиру речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою суміші гептан:EA 5:1 з одержанням трет-бутил 2-хлорізонікотинату (2,23 г, 33 %) у + вигляді безбарвного масла; РХ-МС: tR=0,98 хвил., [M+1+CH3CN] = 255,31. б) У атмосфері аргону, до розчину трет-бутил 2-хлорізонікотинату (2,23 г, 10,4 ммоль) у ТГФ (50 мл) додавали Fe(acac)3 (405 мг, 1,15 ммоль) з наступним NMP (1,45 г, 14,6 ммоль). Суміш охолоджували до -75 °C перед тим як додавали ізобутилмагнію хлорид (8 мл 2 M розчину у ТГФ). Суміш перемішували при -75 °C впродовж 1 год., потім при кт впродовж 1 год. Реакцію гасили шляхом додавання води (100 мл) та суміш екстрагували за допомогою EA. Органічний екстракт сушили над MgSO4, фільтрували та концентрували. Сиру речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою суміші гептан:EA 4:1 з одержанням трет-бутил 2-ізобутилізонікотинату (630 мг, 26 %) у формі масла блідо+ жовтого кольору; РХ-МС: tR=0,82 хвил., [M+1] = 236,39. в) Суміш трет-бутил 2-ізобутилізонікотинату (630 мг, 2,68 ммоль) у 25 % вод. HCl (10 мл) перемішували при 60 °C впродовж 20 год. Суміш концентрували та сушили в умовах високого вакууму з одержанням цільової сполуки (640 мг, кількісн.) у формі гідрохлориду; РХ-МС: tR=0,47 + 1 хвил., [M+1] = 180,09; H ЯМР (CD3OD): δ 8,88 (d, J=5,9 Гц, 1 H), 8,34 (s, 1 H), 8,29 (dd, J1=5,9 Гц, J2=1,4 Гц, 1 H), 3,00 (d, J=7,4 Гц, 2 H), 2,14-2,24 (m, 1 H), 1,03 (d, J=6,6 Гц, 6 H). 2-ізопентилізонікотинова кислота Цільову сполуку отримували за аналогією з 2-ізобутилізонікотиновою кислотою; трет-бутил + 1 2-ізопентилізонікотинату: РХ-МС: tR=0,88 хвил., [M+1] = 250,40; H ЯМР (CDCl3): δ 8,64 (d, J=5,0 Гц, 1 H), 7,66 (s, 1 H), 7,60 (d, J=5,0 Гц, 1 H), 2,82-2,91 (m, 2 H), 1,57-1,70 (m, 12 H), 0,97 (d, J=5,6 + Гц, 6 H). Цільова сполука: РХ-МС: tR=0,58 хвил., [M+1] = 194,30. 2-(пентан-3-іл)ізонікотинова кислота До розчину метил 2-хлорізонікотинату (4,59 г, 26,7 ммоль) у сухому діоксані (120 мл), Pd(dppf) (2,18 г, 2,67 ммоль) додавали у атмосфері аргону. До цієї червоно-коричневої суспензії додавали 3-пентил-цинк (11,6 г, 53,5 ммоль, 107 мл 0,5 M розчину у ТГФ) та суміш перемішували при 100 °C впродовж 18 год. Чорний розчин охолоджували до кт, розводили за допомогою EA (200 мл) та промивали за допомогою води (100 мл) та 2 н. вод. HCl. Промивні рідини екстрагували чотири рази за допомогою ДХМ (4 × 100 мл). Об'єднані органічні екстракти сушили над MgSO4, фільтрували та концентрували. Сиру речовину очищали за допомогою РХСТ на силікагелі, елююючи за допомогою градієнту EA у гептані з одержанням метил 2 10 UA 115357 C2 5 10 15 20 25 30 35 (пентан-3-іл)ізонікотинату (1,15 г, 21 %) у формі масла коричнюватого кольору з утриманням + невеликого відсотку метил 2-(пентан-2-іл)ізонікотинату; РХ-МС: tR=0,62 хвил.; [M+1] = 208,30. Цю речовину розчиняли у ТГФ (30 мл) та 25 % вод. HCl (25 мл) та суміш перемішували при 70 °C впродовж 18 год. перед тим як її концентрували та сушили з одержанням цільової сполуки + (467 мг, 37 %) у формі твердої речовини бежевого кольору; РХ-МС: tR=0,35 хвил., [M+1] = 1 194,28; H ЯМР (CD3OD): δ 8,74 (d, J=5,2 Гц, 1 H), 7,97 (s, 1 H), 7,96 (d, J=6,0 Гц, 1 H), 2,74-2,84 (m, 1 H), 1,71-1,91 (m, 4 H), 0,83 (t, J=7,4 Гц, 6 H). 2-циклопентилізонікотинова кислота Цільову сполуку отримували за аналогією з 2-(пентан-3-іл)ізонікотиновою кислотою; РХ-МС: + 1 tR=0,42 хвил., [M+1] = 192,28; H ЯМР (CDCl3): δ 8,93 (s, 1 H), 8,17-8,37 (m, 2 H), 3,77-3,91 (m, 1 H), 2,36-2,48 (m, 2 H), 1,80-1,94 (m, 4 H), 1,70-1,79 (m, 2 H). Приклади Приклад 1 (S)-N-(3-(2-етил-4-(5-(2-етилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метил-фенокси)-2гідроксипропіл)-2-гідроксиацетамід До розчину N-((S)-3-[2-етил-4-(N-гідроксикарбамімідоїл)-6-метил-фенокси]-2-гідроксипропіл)-2-гідрокси-ацетаміду (290 мг, 1,60 ммоль) у ДМФА (15 мл) додавали EDC HCl (307 мг, 1,60 ммоль) та HOBt (216 мг, 1,60 ммоль). Суміш перемішували при кт впродовж 20 хвил. перед тим як додавали 2-етил-ізонікотинову кислоту (347 мг, 1,07 ммоль). Перемішування продовжували при кт впродовж 1 год. Суміш розводили за допомогою етилацетату (50 мл) та промивали двічі за допомогою нас. вод. NaHCO 3 розчину (2 × 10 мл) та сольового розчину (1 × 10 мл). Органічний екстракт сушили над MgSO 4, фільтрували та концентрували. Решту залишку розчиняли у діоксані (8 мл) та суміш перемішували при 120 °C впродовж 1 год. Суміш концентрували та сиру речовину очищали за допомогою преп. ВЕРХ (Waters XBridge 10 мкм, 75 × 30 мм ID, елююючи за допомогою градієнту ацетонітрилу у воді з додаванням 0,5 % мурашиної кислоти) з одержанням цільової сполуки (114 мг) у формі твердої речовини блідо+ 1 бежевого кольору; РХ-МС: tR=0,63 хвил., [M+1] = 441,23; H ЯМР (CDCl3): δ 8,77 (d, J=5,0 Гц, 1 H), 7,94 (s, 1 H), 7,84-7,88 (m, 3 H), 7,20 (t, J=5,5 Гц, 1 H), 4,18-4,25 (m, 3 H), 3,90 (dd, J1=9,5 Гц, J2=4,5 Гц, 1 H), 3,85 (dd, J1=9,5 Гц, J2=6,3 Гц, 1 H), 3,79 (ddd, J1=14,1 Гц, J2=6,5 Гц, J3=3,3 Гц, 1 H), 3,72 (s br, 1 H), 3,49-3,58 (m, 1 H), 2,99 (q, J=7,6 Гц, 2 H), 2,75 (q, J=7,5 Гц, 2 H), 2,38 (s, 3 H), 1,41 (t, J=7,6 Гц, 3 H), 1,32 (t, J=7,5 Гц, 3 H). Приклад 2 (S)-N-(3-(2-етил-4-(5-(2-пропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метил-фенокси)-2гідроксипропіл)-2-гідроксиацетамід 40 45 Отримували за аналогією з прикладом 1. Тверда речовина бежевого кольору; РХ-МС: + 1 tR=0,68 хвил., [M+1] = 455,22; H ЯМР (CDCl3): δ 8,77 (d, J=5,1 Гц, 1 H), 7,93 (s, 1 H), 7,84-7,89 (m, 3 H), 7,20 (t br, J=5,8 Гц, 1 H), 4,18-4,25 (m, 3 H), 3,90 (dd, J1=9,6 Гц, J2=4,7 Гц, 1 H), 3,85 (dd, J1=9,5 Гц, J2=6,1 Гц, 1 H), 3,79 (ddd, J1=14,1 Гц, J2=6,5 Гц, J3=3,0 Гц, 1 H), 3,49-3,58 (m, 1 H), 2,902,96 (m, 2 H), 2,75 (q, J=7,5 Гц, 2 H), 2,39 (s, 3 H), 1,81-1,91 (m, 2 H), 1,32 (t, J=7,5 Гц, 3 H), 1,04 (t, 13 J=7,3 Гц, 3 H); C ЯМР (CDCl3): δ 173,8, 173,7, 168,9, 164,0, 157,4, 150,2, 137,7, 131,7, 131,5, 128,3, 126,6, 122,3, 120,5, 118,7, 74,2, 70,0, 62,1, 42,3, 40,3, 23,0, 22,8, 16,5, 14,8, 13,9. Приклад 3 (S)-N-(3-(2-етил-4-(5-(2-ізопропілпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2 11 UA 115357 C2 гідроксипропіл)-2-гідроксиацетамід 5 10 Отримували за аналогією з прикладом 1. Тверда речовина бежевого кольору; РХ-МС: + 1 tR=0,71 хвил., [M+1] = 455,20; H ЯМР (CDCl3): δ 8,75 (d, J=5,1 Гц, 1 H), 7,93 (s, 1 H), 7,81-7,86 (m, 3 H), 7,37 (t, J=5,8 Гц, 1 H), 4,16-4,24 (m, 3 H), 3,82-3,92 (m, 2 H), 3,78 (ddd, J1=14,0 Гц, J2=6,5 Гц, J3=3,1 Гц, 1 H), 3,48-3,57 (m, 1 H), 3,22 (hept, J=7,0 Гц, 1 H), 2,73 (q, J=7,5 Гц, 2 H), 2,37 (s, 3 13 H), 1,40 (d, J=6,9 Гц, 6 H), 1,30 (t, J=7,5 Гц, 3 H); C ЯМР (CDCl3): δ 174,0, 173,4, 169,04, 168,99, 157,4, 150,2, 137,7, 131,70, 131,67, 128,4, 126,7, 122,4, 118,9, 118,6, 74,1, 70,1, 62,2, 42,3, 36,5, 22,9, 22,5, 16,5, 14,8. Приклад 4 (S)-N-(3-(2-етил-4-(5-(2-бутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід 15 20 25 Отримували за аналогією з прикладом 1. Тверда речовина бежевого кольору; РХ-МС: + 1 tR=0,75 хвил., [M+1] = 469,19; H ЯМР (CDCl3): δ 8,77 (d, J=5,1 Гц, 1 H), 7,93 (s, 1 H), 7,82-7,89 (m, 3 H), 7,24 (t br, J=5,7 Гц, 1 H), 4,18-4,25 (m, 3 H), 3,90 (dd, J1=9,6 Гц, J2=4,7 Гц, 1 H), 3,85 (dd, J1=9,5 Гц, J2=6,1 Гц, 1 H), 3,79 (ddd, J1=14,2 Гц, J2=6,7 Гц, J3=3,3 Гц, 1 H), 3,49-3,57 (m, 1 H), 3,15 (s br, 2 H), 2,91-2,98 (m, 2 H), 2,74 (q, J=7,5 Гц, 2 H), 2,38 (s, 3 H), 1,76-1,85 (m, 2 H), 1,40-1,50 (m, 13 2 H), 1,31 (t, J=7,5 Гц, 3 H), 0,99 (t, J=7,3 Гц, 3 H); C ЯМР (CDCl3): δ 174,0, 173,2, 169,0, 164,3, 157,4, 150,3, 137,7, 131,7, 131,5, 128,4, 126,7, 122,4, 120,5, 118,7, 74,1, 70,2, 62,2, 42,3, 38,1, 31,9, 22,9, 22,5, 16,5, 14,8, 13,9. Приклад 5 (S)-N-(3-(2-етил-4-(5-(2-ізобутилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід 30 35 40 Отримували за аналогією з прикладом 1. Віск бежевого кольору; РХ-МС: tR=0,73 хвил., + 1 [M+1] = 469,21; H ЯМР (CDCl3): δ 8,79 (d, J=5,1 Гц, 1 H), 7,85-7,91 (m, 4 H), 7,14 (t, J=5,6 Гц, 1 H), 4,17-4,26 (m, 3 H), 3,76-3,94 (m, 3 H), 3,61 (s br, 1 H), 3,49-3,58 (m, 1 H), 3,28 (s br, 1 H), 2,82 (d, J=7,2 Гц, 2 H), 2,75 (q, J=7,5 Гц, 2 H), 2,39 (s, 3 H), 2,14-2,28 (m, 1 H), 1,32 (t, J=7,5 Гц, 3 H), 13 1,00 (d, J=6,6 Гц, 6 H); C ЯМР (CDCl3): δ 173,9, 173,5, 169,0, 163,4, 157,4, 150,3, 137,7, 131,7, 131,4, 128,4, 126,7, 122,4, 121,2, 118,7, 74,2, 70,1, 62,2, 47,5, 42,3, 29,4, 22,9, 22,4, 16,5, 14,8; РХВРМС: tR=1,78 хвил., [M+H]/z=469,2451, знайдено = 469,2446. Приклад 6 (S)-N-(3-(2-етил-4-(5-(2-ізопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід 12 UA 115357 C2 5 10 Отримували за аналогією з прикладом 1. Тверда речовина білого кольору; РХ-МС: tR=0,92 + 1 хвил., [M+1] = 483,18; H ЯМР (CDCl3): δ 8,79 (d, J=5,1 Гц, 1 H), 7,95 (s, 1 H), 7,86-7,90 (m, 3 H), 7,12 (t, J=5,8 Гц, 1 H), 4,17-4,26 (m, 3 H), 3,91 (dd, J1=9,5 Гц, J2=4,8 Гц, 1 H), 3,77-3,88 (m, 2 H), 3,53 (m, 1 H), 2,93-2,99 (m, 2 H), 2,76 (q, J=7,5 Гц, 2 H), 2,40 (s, 3 H), 1,83-1,88 (m, 2 H), 1,66-1,76 13 (m, 1 H), 1,33 (t, J=7,5 Гц, 3 H), 1,01 (d, J=6,2 Гц, 6 H); C ЯМР (CDCl3): δ 173,9, 173,4, 169,0, 164,5, 157,5, 150,3, 137,8, 131,7, 131,6, 128,4, 126,7, 122,4, 120,5, 118,7, 74,1, 70,2, 62,2, 46,4, 42,3, 36,4, 28,0, 22,9, 22,5, 16,5, 14,8. Приклад 7 (S)-N-(3-(2-етил-4-(5-(2-(пентан-3-іл)-піридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід 15 20 25 30 35 40 Отримували за аналогією з прикладом 1. Віск бежевого кольору; РХ-МС: tR=0,80 хвил., + 1 [M+1] = 483,27; H ЯМР (CDCl3): δ 8,80 (d, J=5,1 Гц, 1 H), 7,81-7,90 (m, 4 H), 7,45 (t, J=5,8 Гц, 1 H), 4,57 (s br, 2 H), 4,16-4,25 (m, 3 H), 3,82-3,92 (m, 2 H), 3,78 (ddd, J1=14,0 Гц, J2=6,5 Гц, J3=3,1 Гц, 1 H), 3,48-3,57 (m, 1 H), 2,68-2,78 (m, 3 H), 2,37 (s, 3 H), 1,74-1,87 (m, 4 H), 1,30 (t, J=7,5 Гц, 3 13 H), 0,83 (t, J=7,4 Гц, 6 H); C ЯМР (CDCl3): δ 174,1, 173,4, 169,0, 167,2, 157,4, 150,4, 137,7, 131,7, 131,3, 128,4, 126,7, 122,5, 120,5, 118,8, 74,1, 70,1, 62,2, 51,6, 42,3, 28,2, 22,9, 16,5, 14,8, 12,1; РХВРМС: tR=1,93 хвил., [M+H]/z=483,2607, знайдено = 483,2601. Приклад 8 (S)-N-(3-(2-етил-4-(5-(2-циклопентилпіридин-4-іл)-1,2,4-оксадіазол-3-іл)-6-метилфенокси)-2гідроксипропіл)-2-гідроксиацетамід Отримували за аналогією з прикладом 1. Тверда речовина білого кольору; РХ-МС: tR=0,78 + 1 хвил., [M+1] = 481,06; H ЯМР (CDCl3): δ 8,78 (d, J=5,1 Гц, 1 H), 7,96 (s, 1 H), 7,83-7,88 (m, 3 H), 7,25-7,32 (m, 1 H), 4,17-4,25 (m, 3 H), 3,90 (dd, J1=9,5 Гц, J2=4,5 Гц, 1 H), 3,85 (dd, J1=9,5 Гц, J2=6,0 Гц, 1 H), 3,79 (ddd, J1=14,3 Гц, J2=6,8 Гц, J3=3,3 Гц, 1 H), 3,49-3,58 (m, 1 H), 3,45 (s br, 2 H), 3,29-3,39 (m, 1 H), 2,74 (q, J=7,5 Гц, 2 H), 2,38 (s, 3 H), 2,13-2,27 (m, 2 H), 1,71-1,97 (m, 6 H), 1,31 13 (t, J=7,5 Гц, 3 H); C ЯМР (CDCl3): δ 174,1, 173,1, 169,0, 167,5, 157,4, 150,2, 137,7, 131,7, 131,5, 128,4, 126,7, 122,4, 119,5, 118,7, 74,1, 70,2, 62,2, 48,0, 42,3, 33,6, 25,9, 22,9, 16,5, 14,8; РХ-ВРМС: tR=1,90 хвил., [M+H]/z=481,2451, знайдено = 481,2450. Приклад 9 GTPγS аналіз для визначення значень EC 50 GTPγS аналізи зв'язування виконуються у 96-лункових мікротитрувальних планшетах (Nunc, 442587) у кінцевому об'ємі 200 мкл з використанням препаратів мембран клітин СНО, що експресують рекомбінантний людський рецептор S1P1 або рецептор S1P3 людини. Умови аналізу являють собою 20 мМ HEPES (Fluka, 54461), 100 мМ NaCl (Fluka, 71378), 5 мМ MgCl 2 13 UA 115357 C2 5 10 15 20 (Fluka, 63064), 0,1 % BSA (Calbiochem, 126609), 1 мкМ GDP (Sigma, G-7127), 2,5 % ДМСО (Fluka, 35 41644), 50 пМ S-GTPγS (Amersham Biosciences, SJ1320). Значення pH являє собою 7,4. Тестуємі сполуки розчиняють та розводять у 100 % ДМСО та попередньо інкубують при кімнатній температурі впродовж 30 хвилин у 150 мкл зазначеного вище буферу для аналізу, за 35 35 відсутності S-GTPγS. Після додавання 50 мкл S-GTPγS, суміш, що аналізують, інкубують впродовж 1 год. при кімнатній температурі. Аналіз завершується передачею реакційної суміші у багатоекранні планшети (Millipore, MAHFC1H60) з використанням харвестеру клітин фірми Packard Biosciences, та планшети промивали за допомогою льодяного 10 мМ Na2HPO4/NaH2PO4 (70 %/30 %), сушили, запечатували знизу та, після додавання 25 мкл MicroScint20 (Packard 35 Biosciences, order# 6013621), запечатували згори. Мембрано-зв'язані S-GTPγS вимірюють за допомогою TopCount фірми Packard Biosciences. EC50 являє собою концентрацію агоністу, що викликає 50 % від максимального специфічного 35 S-GTPγS зв'язування. Специфічне зв'язування визначається відніманням неспецифічного зв'язування від максимального зв'язування. Максимальне зв'язування являє собою кількість імпульсів на хвилину, згідно з багатоекранними планшетами у присутності 10мкМ S1P. Не специфічне зв'язування являє собою кількість зв'язування за відсутності агоністу у аналізі. Агоністичні активності (EC50 значення) всіх прикладів сполук були виміряні та знаходяться у діапазоні від 0,1 до 5,1 нМ при середньому значенні 1,3 нМ на S1P 1 рецепторі. Величини ЕС50 на S1P3 рецепторі знаходяться у діапазоні від 700 та 9950 та у середньому 2641 нМ.Агоністичні активності відображені у Таблиці 3. Таблиця 3 1 2 EC50 [нМ] S1P1 S1P3 Сполука прикладу R 1 етил 2,1 9950 2 н-пропіл 0,7 1120 3 ізопропіл 0,3 3940 4 н-бутил 1,8 700 5 ізобутил 0,2 757 6 ізопентил 5,1 2600 R 14 UA 115357 C2 7 10 15 0,1 1340 8 5 пент-3-ил циклопентил 0,1 736 Приклад 10 Оцінка ефективності in vivo Ефективність сполук формули (I) оцінюють шляхом вимірювання циркулюючих лімфоцитів після перорального введення від 3 до 30 мг/кг сполуки формули (I) нормальним самцям щурів лінії Вістар. Тварин розміщають в умовах клімат-контролю з 12 год. циклом світло/темрява, та вони мають вільний доступ до нормального щурячого корму та питної води. Кров збирають до 3, 6 та 24 год. та після введення препарату. Всю кров піддають гематології, використовуючи систему Advia Hematology (Bayer Diagnostics, Zürich, Switzerland). Всі дані представлені у вигляді середнього значення SEM. Статистичні аналізи проводять за допомогою дисперсійного аналізу (ANOVA) з використанням Statistica (StatSoft) та методики Стьюдента-Ньюмена-Койлса для множинних порівнянь. Нульова гіпотеза заперечується при р
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridin-4-yl derivatives
Автори англійськоюBolli, Martin, Lescop, Cyrille, Nayler, Oliver, Steiner, Beat
Автори російськоюБолли Мартин, Лескоп Сирилл, Найлер Оливер, Штайнер Беат
МПК / Мітки
МПК: C07D 413/04, A61K 31/4433
Мітки: похідні, піридин-4-ілу
Код посилання
<a href="https://ua.patents.su/18-115357-pokhidni-piridin-4-ilu.html" target="_blank" rel="follow" title="База патентів України">Похідні піридин-4-ілу</a>
Попередній патент: Спосіб комбінованої дистальної вакуум-терапії з проксимальним пневмопресингом кінцівок
Наступний патент: Система та спосіб одержання даних про профіль паління
Випадковий патент: Фотополімеризаційна колагенова композиція на основі акрилату нікелю












