Похідні 4-ароїл-4,5-дигідропіразоло[3,4-b] піридин-6(7н)-онів
Номер патенту: 73098
Опубліковано: 10.09.2012
Автори: ЛІПСОН ВІКТОРІЯ ВІКТОРІВНА, Замігайло Лалі Лаврентіївна, Петрова Олеся Миколаївна, Бородіна Вікторія Василівна
Формула / Реферат
Похідні 4-ароїл-4,5-дигідропіразоло[3,4-b]піридин-6(7Н)-онів загальної формули:
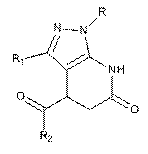 ,
,
де R=Н, R1=Me: R2=Ph; 4-МеС6Н4; 4-МеОС6Н4; 4-СlС6Н4; 4-ВrС6Н4; 4-FC6H4; 2-Br-4-F-C6H3; 4-PhC6H4; R=H, R2=Ph: R1=Ph; R1=4-MeC6H4; R=Me, R1=H: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-BrC6H4; 4-FC6H4; R=циклопентіл, R1=Me: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=H, R1=4-F-C6H4: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=4-MeOC6H4, R1=Me: R2=4-MeC6H4; 4-FC6H4.
Текст
Реферат: Похідні 4-ароїл-4,5-дигідропіразоло[3,4-b]піридин-6(7Н)-онів загальної формули: . UA 73098 U (12) UA 73098 U UA 73098 U 5 10 15 20 25 30 35 40 Корисна модель належить до галузі органічної хімії та стосується нових речовин - похідних 4-ароїл-4,5-дигідропіразоло[3,4-b]піридин-6(7H)-онів. Ці похідні можуть бути напівпродуктами синтезу біологічно активних сполук, які утворюються в результаті хімічної трансформації кето-, вторинної аміно- та амідної груп. Серед похідних піразоло[3,4-b]піридинів виявлені сполуки з вазоділататорною дією, опосередкованою як прямою NO-незалежною активацією розчинної гуанілатциклази [1,2], так і гальмівним впливом щодо фосфодіестерази [3], інгібітори кіназ [4-9], у тому числі глікогенсинтази кінази-3 (GSK-3), перспективні як потенційні засоби впливу на інсулінорезистентність [7,8], антагоністи релізінг-фактора кортикотропіну (CRF) [10], ефективні при стрес-індукованих розладах, депресії, хворобі Альцгеймера, психоанорексії, наркотичній та алкогольній залежності. Існують дві принципові схеми синтезу частково гідрогенізованих 3,4-дизаміщених піразоло[3,4-b]піридин-6-онів: формування піридинового кільця на основі амінопіразолу та добудова азольного фрагмента до вже існуючого піридинового. Останній спосіб є синтетично обмеженим з причин низької доступності придатних для цього дигідроамінопіридинонів. Перша схема є найбільш поширеною і ґрунтується на реакціях 3-заміщених 5-амінопіразолів з 1,3біелектрофільними сполуками або їх синтетичними попередниками чи еквівалентами. Але 4 наявність у молекулі 3-заміщеного 5-амінопіразолу, окрім аміногрупи, ендоциклічних N та С нуклеофільних центрів уможливлює утворення на його основі не лише піразоло[3,4b]піридинової, а й піразоло[1,5-a]піримідинової системи. До того ж, у разі використання несиметричних біелектрофілів не виключено утворення суміші 4- та 6-оксопіразоло[3,4b]піридинів або 5- та 7-оксопіразоло[1,5-а]піримідинів [11-15]. Отже, актуальним є виявлення таких 1,3-біелектрофільних компонентів циклоконденсації, які б забезпечували регіоселективність у формуванні піразоло[3,4-b]піридинової системи. Задачею корисної моделі є одержання похідних 4-ароїл-4,5-дигідро-піразоло[3,4-b]піридин6-ону як потенційно біологічно активних сполук або напівпродуктів їх синтезу, придатних для створення лікарських препаратів для корекції серцево-судинних, нейродегенеративних та ендокринних захворювань. Поставлена задача вирішується тим, що синтезують похідні загальної формули: , де R=Н, R1=Me: R2=Ph; 4-МеС6Н4; 4-МеОС6Н4; 4-СlС6Н4; 4-ВrС6Н4; 4-FC6H4; 2-Br-4-F-C6H3; 4PhC6H4; R=H, R2=Ph: R1=Ph; R1=4-MeC6H4; R=Me, R1=H: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-BrC6H4; 4-FC6H4; R=циклопентіл, R1=Me: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=H, R1=4-F-C6H4: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=4-MeOC6H4, R1=Me: R2=4-MeC6H4; 4-FC6H4. Технічний результат - розширення спектру сполук, які можуть бути використані у створенні ліків. Зазначені сполуки одержують шляхом трикомпонентної конденсації 3(5)-амінопіразолів з гідратами арилгліоксалів і 2,2-диметил-1,3-діоксан-4,6-діоном при нагріванні у середовищі розчинника, зокрема, у спиртах або воді. У результаті каскадного перебігу цієї реакції утворюється 1,3-біелектрофільна сполука - ароїлметиліденпохідна 2,2-диметил-1,3-діоксан-4,6діону, циклоконденсація якої з 3(5)-амінопіразолами є регіоселективною і приводить виключно до тетрагідропіразоло[3,4-b]піридин-6-онів. Спосіб одержання похідних тетрагідропіразоло[3,4-b]піридин-6-онів ілюструється схемою: 1 UA 73098 U + 5 10 15 20 25 30 35 40 45 50 + , де R=Н, R1=Me: R2=Ph; 4-МеС6Н4; 4-МеОС6Н4; 4-СlС6Н4; 4-ВrС6Н4; 4-FC6H4; 2-Br-4-F-C6H3; 4PhC6H4; R=Н, R2=Ph: R1=Ph; R1=4-MeC6H4; R=Me, R1=H: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-BrC6H4; 4-FC6H4; R=циклопентіл, R1=Me: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=H, R1=4-F-C6H4: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=4-MeOC6H4, R1=Me: R2=4-MeC6H4; 4-FC6H4. 1 Хімічну будову синтезованих сполук доведено ЯМР Н, ІЧ, мас-спектрами. Приклад 1. 4-Бензоїл-3-метил-4,5-дигідро-2Н-піразоло[3,4-b]піридин-6(7Н)-он. Суміш 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,1 г (1 ммоль) 5-аміно-3-метил-1Н-піразолу та 0,16 г гідрату фенілгліоксалю у 7 мл етанолу кип'ятять протягом 1,5 год. Реакційну масу охолоджують і відфільтровують осад цільової сполуки, промивають на фільтрі етанолом. Вихід 1 0,17 г (67 %), т. пл. 323-325 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 11,73 (р.с, 1Н, 2 N Hпip), 10,10 (р.с, 1Н, NНамід), 7,99 (д, 2Н, 2o-Ph, J 7,4), 7,64 (т, 1Н, n-Ph, J 7,0), 7,52 (т, 2Н, 2мРh, J 7,4), 4,93-4,96 (д.д, 1Н, СНx, J 6,0, 3,0), 2,57-2,73 (д.д+д.д, 2Н, СНА+СНВ, J 16,2, 6,2, 16,2, 2,8), 1,82 (с, 3Н, Me). Визначено, %: С 65,93; Н 5,08; N 16,38. C 14H13N3O2. Розраховано, %: С 65,87; Н 5,13; N 16,46. Приклад 2. 4-(4-Фторобензоїл-3-метил-4,5-дигідро-2H-піразоло[3,4-b]піридин-6(7H)-он. Суміш 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,1 г (1 ммоль) 5-аміно-3-метил-1Hпіразолу та 0,17 г гідрату n-фторофеніл-гліоксалю у 7 мл етанолу кип'ятять протягом 1 год. Реакційну масу охолоджують і відфільтровують осад цільової сполуки, промивають на фільтрі 1 етанолом. Вихід 0,13 г (49 %), т. пл. 316-318 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 2 11,75 (р.с, 1Н, N Hпip), 10,11 (р. с, 1Н, NHамід), 7,36 (д, 2Н, 2о-Ar, J 8,2), 8,01 (д, 2Н, 2м-Аr, J 7,6), 4,96 (д, 1Н, СНx, J 1,8), 2,56-2,65 (д.д+д.д, 2Н, СНА+СНB, J 17,8, 6,6, 17,8, 1,8), 1,84 (с, 3Н, Me). Визначено, %: С 61,62; Н 4,38; N 15,30. C14H12FN3O2. Розраховано, %: С 61,53; Н 4,43; N 15,38. Приклад 3. 4-(4-Фторобензоїл-3-метил-4,5-дигідро-2H-піразоло[3,4-b]піридин-6(7H)-он. Суміш 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,1 г (1 ммоль) 5-аміно-3-метил-1Hпіразолу та 0,17 г гідрату n-фторофеніл-гліоксалю у 10 мл води перемішують при температурі 25-30 °С протягом 3 год. до утворення білого осаду, який відфільтровують. Вихід 0,11 г (42 %), т. пл. 316-318 °С. Приклад 4. 4-(4-Бромобензоїл)-1-метил-4,5-дигідро-1H-піразоло[3,4-b]піридин-6(7H)-он. До суміші 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,1 г (1 ммоль) 1-метил-1H-піразол-5аміну та 0,23 г гідрату n-бромофенілгліоксалю у 10 мл етанолу кип'ятять протягом 1 год. Після охолодження реакційної суміші, відфільтровують осад цільової сполуки та промивають на фільтрі етанолом. Сполуку синтезовано способом, що наведено у п. 1. Вихід 0,24 г (71 %), т. пл. 1 217-219 °С. Спектр ЯМР Н, (ДМСО-d6, 300 МГц) δ, м.ч.: 10,60 (р.с, 1Н, NH), 8,00 (д, 2Н, 2м-Аr, J 8,7), 7,70 (д, 2Н, 2o-Ar, J 8,7), 6,93 (с, 1Н, СНпір), 4,89 (т, 1Н, СНx, J 5.7, 4,8), 3,60 (с, 3Н, Me), 2,76-2,61 (д.д+д.д, 2Н, СНА+СНВ, J 15,9, 6,3, 15,6, 3,9). Визначено, %: С 50,39; Н 3,58; N 12,64. С14Н12ВrN3О2. Розраховано, %: С 50,32; Н 3,62; N 12,57. Приклад 5. 1-Циклопентил-4-(4-метоксибензоїл)-3-метил-4,5-дигідро-1H-піразоло[3,4b]піридин-6(7H)-он. Суміш 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,17 г (1 ммоль) 1циклопентил-3-метил-1Я-піразол-5-аміну та 0,18 г гідрату n-метоксифенілгліоксалю у 10 мл етанолу кип'ятять 1 год. Реакційну суміш охолоджують і відфільтровують осад цільової сполуки, 1 промивають на фільтрі етанолом. Вихід 0,20 г (56 %), т. пл. 215-217 °С. Спектр ЯМР Н, (ДМСОd6, 300 МГц) δ, м.ч.: 10.36 (р.с, 1Н, NHамід), 8,01 (д, 2H, 2o-Ar, J 8,1), 7.01 (д, 2Н, 2м-Ак, J 8,4), 4,83-4,80 (д.д, 1Н, СНx, J 6,9, 3,6), 4,58 (т, 1Н, CH-N, У 5,7, 8,2), 3,87 (с, 3Н, ОМе), 2,73-2,51 (д.д+д.д, 2Н, СНA+СНB, J 15,6, 6,3, 15,6, 2,4), 1,90-1,63 (м, 9Н, 3СН2+Ме), 1,57 (м, 2Н, СН2). Визначено, %: С 68,02; Н 6,48; N 11,94. С20Н23N3О3. Розраховано, %: С 67,97; Н 6,56; N11,89. Приклад 6. 3-(4-Фторофеніл)-4-(4-метоксибензоїл)-4,5-дигідро-2H-піразоло[3,4-b]піридин6(7H)-он. Суміш 0,15 г (1 ммоль) 2,2-диметил-1,3-діоксан-4,6-діону, 0,18 г (1 ммоль) 5-(4фторофеніл)-1H-піразол-3-аміну та 0,18 г гідрату n-метоксифенілгліоксалю у 10 мл етанолу кип'ятять 1,5 год. Реакційну масу охолоджують і відфільтровують осад цільової сполуки, 1 промивають на фільтрі етанолом. Вихід 0,15 г (41 %), т. пл. 302-304 °С. Спектр ЯМР Н, (ДМСО 2 UA 73098 U 2 5 10 15 20 25 30 35 40 45 50 d6, 300 МГц) δ, м.ч: 12,31 (р.с, 1Н, N Hпip), 10,16 (р.с, 1Н, NНамід), 7,82 (д, 2Н, 2о-Аr, J 8,4), 7,397,44 (д.д, 2Н, 2м-4-F-C6H4, J 8,4), 7,11 (т, 2Н, 2o-4-F-С6Н4, J 8,1), 6,84 (д, 2Н, 2м-Аr, J 8,4), 5,00 (д, 1Н, СНx, J 6,3), 3,83 (с, 3Н, ОМе), 2,93-2,55 (д.д+д, 2Н, СНА+СНВ, J 16,8, 8,4, 16,2). Визначено, %: С 65,82; Н 4,48; N 11,44. C20H16FN3O3. Розраховано, %: С 65,75; Н 4,41; N 11,50. Література: 1. Пат. 1509228 ЕР, МПК А61К 31/505; А61Р 7/02. Derivatives of 2-(1-Benzyl-1H-Pyrazolo[3,4b]pyridine-3-yl)-5(4-pyridinyl)-4-pyrimidine amine and the use thereof as guanylate cyclase stimulators / S. Weigand, E. Bischoff (DE); Bayer Healthcare AG (DE). - № 20030722593; Заявл. 05.05.03; Опубл. 02.03.05, www.ep.esp@cenet.com. 2. Пат. 03097063 WO, МПК C07D 471/0; A61K 31/505. Derivatives of 2-(1-benzyl-lHpyrazolo[3,4-b]pyridine-3-yl)-5-(4-pyridinyl)-4-pyrimidine amine and the use thereof as guanylate cyclase stimulators / J.-P. Stasch, K. Muente (DE). - № 2003EP04668; Заявл. 05.05.03; Опубл. 27.11.03, www.ep.esp@cenet.com. 3. Пат. 2008029829 WO, МПК C07D 471/04; A61K 31/444; A61P 11/00; A61P 11/02. Pyrazolopyridine derivatives and phosphodiesterase (PDE) inhibitor containing the same as active ingredient / Kohno Yasushi, Takita Satoshi (JP). - № WO2007JP67267 Заявл. 05.09.07; Опубл. 13.03.08, www.ep.esp@cenet.com. 4. Пат. 1899333 (E) PT, МПК А61К 31/4162; А61К 31/437; А61Р 25/36; А61Р 9/00; C07D 471/04. Pyrazolopyridine derivatives as inhibitors of beta-adrenergic receptor kinase 1. / H. Steinhagen (DE), K. Ritter (DE), J. Huber (DE), B. Pirard (FR); Sanofi Aventis (FR). - № 20050013774 EP; Заявл. 27.06.05; Опубл. 23.04.09, www.ep.esp@cenet.com. 5. Пат. 2010011772 (A2) WO, МПК A61K 31/437; A61P 29/00; A61P 35/00; C07D 471/04. Tricyclic pyrazolopyridine kinase inhibitors. / J.-M. Jimenez, J. Studley (GB); Vertex Pharma (US). - № WO2009US51437; Заявл. 22.07.09; Опубл. 28.01.10, www.ep.esp@cenet.com. 6. Пат. 2009005377 (Al) US, МПК А61К 31/437; A61K 31/496; A61K 31/506; A61P 35/02; C07D 471/04. Pyrazolopyridine derivatives. / R.C. Almansa, B.M. Virgili (ES); Palau Pharma SA (ES). - № 20080206289. - Заявл. 08.09.08; Опубл. 01.01.09, www.ep.esp@cenet.com. 7. Пат. 2005000304 WO, МПК А61К 31/437; C07D 471/04. Pyrazolo[3,4-b]pyridine-6-ones as GSK-3 inhibitors / T. Wager (US); Pfizer Prod INC (US); King Daniel Weishung (US). - № 2004IB02026; Заявл. 14.06.04; Опубл. 06.01.05, www.ep.esp@cenet.com. 8. 6-Heteroarylpyrazolo[3,4-b]pyridines: potent and selective inhibitors of glycogen synthase kinase-3 (GSK-3) / J. Witherington, V. Bordas, A. Gaiba, A. Naylor // Bioorg. Med. Chem. Lett. - 2003. - Vol. 13, № 18. - P. 3059-3062. 9. Пат. 1020004061288 DE, МПК C07D 471/04; A61K 31/437; A61P 9/00; A61P 13/08. New 3aminopyrazolo[3,4-b]pyridine derivatives are proteine tirosine kinases inhibitors useful e.g. for treating hyperproliferation of body cells, neurodegenerative disease, blood vessel disease and angiogenic disease / W. Schwede, H. Kuenzer, A. Ter Laak et al. (DE); Schering AG (DE). - № 200410061288; Заявл. 14.12.04; Опубл. 29.06.06, www.ep.esp@cenet.com. 10. Пат 6613777 US, МПК А61К 31/44; А61Р 25/00. CRF antagonistic pyrazolo[3,4-b]pyridines / C. Chen, C.Q. Huang (US). - № 200110623634; Заявл. 20.02.01; Опубл. 02.09.03, www.uspto.gov. 11. Ямашкин С.А., Кучеренко Н.Я., Юровская М.А. Реакции ацетоуксусного эфира с арил- и гетариламинами (обзор) // Химия гетероцикл. соед. - 1997. - № 5. - c. 579-597. 12. Нам Н.Л., Грандберг И.И., Сорокин В.И. Конденсация 5-аминопиразолов, не замещенных в положении 1, с эфирами β-кетокислот // Химия гетероцикл. соед. - 2003. - № 9. - c. 1379-1382. 13. Synthesis of pyrazolo[1,5-a]pyrimidines in the reaction of 5-amino-3-aryl-pyrazoles with methoxymethylen Meldrum's acid derivative and thermolysis of their pyrazolylaminomethylen derivatives / J. Quiroga, A. Hormaza, B. Insuasti et al. // J. Heterocycl. Chem. - 1998. - Vol. 35, № 1. P. 61 -64. 14. Lipson V.V., Gorobets N. Yu. One hundred years of Meldrum's acid: advances in the synthesis of pyridine and pyrimidine derivatives // Моl. Divers. - 2009. - Vol. 13. - P. 399-419. 15. Anwar H.F., Elnagdi M.H. Recent developments in aminopyrazole chemistry // Arkivoc - 2009. - Vol. (i). - P. 198-250. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 55 Похідні 4-ароїл-4,5-дигідропіразоло[3,4-b]піридин-6(7Н)-онів загальної формули: 3 UA 73098 U 5 , де R=Н, R1=Me: R2=Ph; 4-МеС6Н4; 4-МеОС6Н4; 4-СlС6Н4; 4-ВrС6Н4; 4-FC6H4; 2-Br-4-F-C6H3; 4PhC6H4; R=H, R2=Ph: R1=Ph; R1=4-MeC6H4; R=Me, R1=H: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-BrC6H4; 4-FC6H4; R=циклопентил, R1=Me: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=H, R1=4-F-C6H4: R2=Ph; 4-MeC6H4; 4-MeOC6H4; 4-FC6H4; R=4-MeOC6H4, R1=Me: R2=4-MeC6H4; 4-FC6H4. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 4-aroyl-4,5-dihydropyrazolo[3,4-b]pyridine-6(7h)-ones
Автори англійськоюLipson Viktoria Viktorivna, Borodina Viktoria Vasylivna, Zamihailo Lali Lavrentiivna, Petrova Olesia Mykolaivna
Назва патенту російськоюПроизводные 4-ароил-4,5-дигидропиразоло[3,4-b] пиридин-6(7н)-онов
Автори російськоюЛипсон Виктория Викторовна, Бородина Виктория Васильевна, Замигайло Лали Лаврентиевна, Петрова Олеся Николаевна
МПК / Мітки
МПК: C07D 401/00
Мітки: піридин-6(7н)-онів, 4-ароїл-4,5-дигідропіразоло[3,4-b, похідні
Код посилання
<a href="https://ua.patents.su/6-73098-pokhidni-4-arol-45-digidropirazolo34-b-piridin-67n-oniv.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-ароїл-4,5-дигідропіразоло[3,4-b] піридин-6(7н)-онів</a>
Попередній патент: Автономна система електроживлення
Наступний патент: Спосіб одержання 4-арил-2,4,5,7-тетрагідро-2н-піразоло[3,4-b]піридин-6-онів
Випадковий патент: Тихохідний електрогенератор










