Похідні індолу, що корисні для лікування розладів цнс, фармацевтична композиція та спосіб лікування захворювань
Номер патенту: 74830
Опубліковано: 15.02.2006
Автори: Кехлер Ян, Банг-Андерсен Бенні, Андерсен Кім, Фелдінг Якоб
Формула / Реферат
1. Заміщені похідні індолу формули I
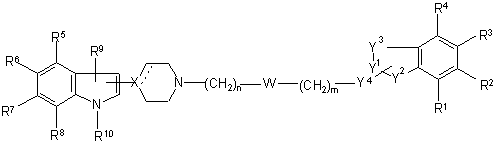 ,
,
де
(а) один з Y1 і Y2 являє собою N, який зв'язаний з Y4, а інший з Y1 і Y2 являє собою CO, CS, SO або SO2, і Y4 являє собою СН2; або
(b) один з Y1 і Y2 являє собою N, який зв'язаний з Y4, а інший з Y1 і Y2 являє собою СН2, і Y4 являє собою CO, CS, SO або SO2;
Y3 являє собою Z-CH2, CH2-Z або CH2CH2, a Z являє собою O або S; за умови, що коли Y1 являє собою N, тоді Y3 не може бути Z-CH2;
W являє собою зв'язок або групу O, S, CO, CS, SO або SO2;
n дорівнює 0 - 5, m дорівнює 0 - 5, а m+n дорівнює 3 - 6 для (а), та m+n дорівнює 1 - 10 для (b); за умови, що коли W являє собою O або S, тоді n ![]() 2, а m
2, а m ![]() 1; коли W являє собою CO, CS, SO або SO2, тоді n
1; коли W являє собою CO, CS, SO або SO2, тоді n ![]() 1, а m
1, а m ![]() 1;
1;
Х являє собою C, CH або N; за умови, що коли Х являє собою С, тоді пунктирна лінія позначає зв'язок, а коли Х являє собою N або CH, тоді пунктирна лінія не є зв'язком;
R1-R9 є незалежно вибраними з водню, галогену, ціаногрупи, нітрогрупи, аміногрупи, гідроксильної групи, C1-6-алкіламіну, ді-C1-6-алкіламіну, C1-6-алкілу, C2-6-алкенілу, C2-6-алкінілу, C1-6-алкокси, C1-6-алкілтіо, C1-6-алкілу, заміщеного гідроксильною групою або тіоловою групою, C3-8-циклоалкілу, C3-8-циклоалкіл-C1-6-алкілу, ацильної групи, тіоацильної групи, арильної групи, трифторметильної групи, трифторметилсульфонільної групи і C1-6-алкілсульфонілу;
R10 являє собою водень, C1-6-алкіл, C2-6-алкеніл, C2-6-алкініл, C1-6-алкіл, заміщений гідроксильною групою або тіоловою групою, C3-8-циклоалкіл, C3-8-циклоалкіл-C1-6-алкіл, арильну групу, арил-C1-6-алкіл, ацильну групу, тіоацильну групу, C1-6-алкілсульфоніл, трифторметилсульфонільну або арилсульфонільну групу,
або їх фармацевтично прийнятні кислотно-адитивні солі.
2. Сполука за п. 1, де індол є зв'язаним з Х по 3 положенню індолу.
3. Сполука за п. 1 або 2, де один з Y1 і Y2 являє собою N, який зв'язаний з Y4, а інший з Y1 і Y2 являє собою СO, і Y4 являє собою СН2.
4. Сполука за п. 3, де Y1 являє собою азот, який зв'язаний з Y4, Y2 являє собою СO, а Y4 являє собою СН2.
5. Сполука за п. 3, де Y2 являє собою атом азоту, який зв'язаний з Y4, Y1 являє собою СO, а Y4 являє собою СН2.
6. Сполука за п. 1 або 2, де один з Y1 і Y2 являє собою N, який зв'язаний з Y4, а інший з Y1 і Y2 являє собою СН2, і Y4 являє собою СO.
7. Сполука за п. 6, де Y1 являє собою азот, який зв'язаний з Y4, Y2 являє собою СН2, а Y4 являє собою СO.
8. Сполука за п. 6, де Y2 являє собою атом азоту, який зв'язаний з Y4, Y1 являє собою СН2, а Y4 являє собою СO.
9. Сполука за будь-яким з пп. 1 - 8, де Y3 являє собою СН2СН2 або СН2Z.
10. Сполука за будь-яким з пп. 1 - 9, де Х являє собою С.
11. Сполука за будь-яким з пп. 1 - 9, де Х являє собою N.
12. Сполука за будь-яким з пп. 1 - 9, де Х являє собою СН.
13. Сполука за будь-яким з пп. 1 - 12, де R1-R9 є незалежно вибраними з водню, галогену, ціаногрупи, нітрогрупи, аміногрупи, C1-6-алкіламіну, ді-C1-6-алкіламіну, C1-6-алкілу, C3-8-циклоалкілу і трифторметильної групи, а R10 являє собою водень, C1-6-алкіл або ацильну групу, або її фармацевтично прийнятна кислотно-адитивна сіль.
14. Сполука за п. 13, де W являє собою зв'язок.
15. Сполука за п. 14, де n+m дорівнює 3 - 6.
16. Сполука за п. 1, яка є вибраною з:
5-фтор-3-{1-[3-(1-оксо-3,4-дигідро-1Н-хінолін-2-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(1-оксо-3,4-дигідро-1Н-хінолін-2-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,4-бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,4-бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пропан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу,
5-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пентан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-1-метил-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-1-метил-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу,
1-(бутан-1-іл)-5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу,
5-фтор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
4-фтор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
4-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
4-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
4-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
4-хлор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індолу,
4-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
6-хлор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
6-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
4-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
4-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
4-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
4-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індолу,
5-фтор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
6-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індолу,
6-хлор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індолу,
7-хлор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індолу та
7-хлор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індолу,
або їх фармацевтично прийнятних солей.
17. Фармацевтична композиція, яка відрізняється тим, що вона містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1 - 16 у поєднанні з одним або декількома фармацевтично прийнятними носіями або розріджувачами.
18. Застосування сполуки за будь-яким з пп. 1 - 16 для виробництва лікарського засобу, придатного для лікування позитивних і негативних симптомів шизофренії, інших психозів, тривожних розладів, таких як генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад, депресії, агресії, побічних ефектів, індукованих звичайними антипсихотичними агентами, мігрені, когнітивних розладів, ADHD, а також для поліпшення сну.
19. Спосіб лікування позитивних і негативних симптомів шизофренії, інших психозів, тривожних розладів, таких як генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад, депресії, агресії, побічних ефектів, індукованих звичайними антипсихотичними агентами, мігрені, когнітивних розладів, ADHD, а також для поліпшення сну, при якому вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1 - 16.
Текст
1. Заміщені похідні індолу формули I 3 74830 4 або їх фармацевтично прийнятні кислотно5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1адитивні солі. іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н2. Сполука за п. 1, де індол є зв'язаним з Х по 3 індолу, положенню індолу. 5-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-13. Сполука за п. 1 або 2, де один з Y1 і Y2 являє іл)пентан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н4 1 2 собою N, який зв'язаний з Y , а інший з Y і Y явіндолу, ляє собою СO, і Y4 являє собою СН2. 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-14. Сполука за п. 3, де Y1 являє собою азот, який іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу, зв'язаний з Y4, Y2 являє собою СO, а Y4 являє со5-фтор-1-метил-3-{1-[3-(2-оксо-3,4-дигідро-2Нбою СН2. хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу, 5. Сполука за п. 3, де Y2 являє собою атом азоту, 5-фтор-1-метил-3-{1-[4-(2-оксо-3,4-дигідро-2Някий зв'язаний з Y4, Y1 являє собою СO, а Y4 являє хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу, собою СН2. 1-(бутан-1-іл)-5-фтор-3-{1-[4-(2-оксо-3,4-дигідро6. Сполука за п. 1 або 2, де один з Y1 і Y2 являє 2Н-хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридинсобою N, який зв'язаний з Y4, а інший з Y1 і Y2 яв4-іл}-1Н-індолу, ляє собою СН2, і Y4 являє собою СO. 5-фтор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-37. Сполука за п. 6, де Y1 являє собою азот, який оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, зв'язаний з Y4, Y2 являє собою СН2, а Y4 являє 7-хлор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-3собою СO. оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, 8. Сполука за п. 6, де Y2 являє собою атом азоту, 5-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4який зв'язаний з Y4, Y1 являє собою СН2, а Y4 явоксобутан-1-іл]піперидин-4-іл}-1Н-індолу, ляє собою СO. 5-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-49. Сполука за будь-яким з пп. 1 - 8, де Y3 являє оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, собою СН2СН2 або СН2Z. 5-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-410. Сполука за будь-яким з пп. 1 - 9, де Х являє оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, собою С. 4-фтор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-311. Сполука за будь-яким з пп. 1 - 9, де Х являє оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, собою N. 4-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-412. Сполука за будь-яким з пп. 1 - 9, де Х являє оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, собою СН. 4-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-613. Сполука за будь-яким з пп. 1 - 12, де R1-R9 є оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, незалежно вибраними з водню, галогену, ціаног4-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-4рупи, нітрогрупи, аміногрупи, C1-6-алкіламіну, ді-C1оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, 4-хлор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-56-алкіламіну, C1-6-алкілу, C3-8-циклоалкілу і трифторметильної групи, а R10 являє собою водень, оксопентан-1-іл]піперидин-4-іл}-1Н-індолу, C1-6-алкіл або ацильну групу, або її фармацевтич4-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-6но прийнятна кислотно-адитивна сіль. оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, 14. Сполука за п. 13, де W являє собою зв'язок. 5-фтор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-515. Сполука за п. 14, д е n+m дорівнює 3 - 6. оксопентан-1-іл]піперидин-4-іл}-1Н-індолу, 16. Сполука за п. 1, яка є вибраною з: 5-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-65-фтор-3-{1-[3-(1-оксо-3,4-дигідро-1Н-хінолін-2оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу, 6-хлор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2-іл)-35-фтор-3-{1-[4-(1-оксо-3,4-дигідро-1Н-хінолін-2оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу, 6-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-65-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу, 7-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2-іл)-45-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-1оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу, 7-хлор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-2-іл)-55-хлор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1оксопентан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу, 7-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2-іл)-65-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу, 4-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-35-хлор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін-1оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу, 4-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-47-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін-1оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу, 4-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-35-фтор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,4оксопропан-1-іл]піперидин-4-іл}-1Н-індолу, бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Н4-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4індолу, оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, 5-хлор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,45-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Ноксопропан-1-іл]піперидин-4-іл}-1Н-індолу, індолу, 5-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-45-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-1оксобутан-1-іл]піперидин-4-іл}-1Н-індолу, іл)пропан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н5-фтор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1-іл)-5індолу, оксопентан-1-іл]піперидин-4-іл}-1Н-індолу, 5 74830 6 5-фтор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6для лікування позитивних і негативних симптомів оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, шизофренії, інших психозів, тривожних розладів, 6-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1-іл)-3таких як генералізований тривожний розлад, паніоксопропан-1-іл]піперидин-4-іл}-1Н-індолу, чний розлад і обсесивно-компульсивний розлад, 6-хлор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6депресії, агресії, побічних ефектів, індукованих оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, звичайними антипсихотичними агентами, мігрені, 7-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1-іл)-4когнітивних розладів, ADHD, а також для поліпоксобутан-1-іл]піперидин-4-іл}-1Н-індолу, шення сну. 7-хлор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1-іл)-519. Спосіб лікування позитивних і негативних симоксопентан-1-іл]піперидин-4-іл}-1Н-індолу та птомів шизофренії, інших психозів, тривожних роз7-хлор-3-{1-[6-(3,4-дигідро-2Н-хінолін-1-іл)-6ладів, таких як генералізований тривожний розлад, оксогексан-1-іл]піперидин-4-іл}-1Н-індолу, панічний розлад і обсесивно-компульсивний розабо їх фармацевтично прийнятних солей. лад, депресії, агресії, побічних ефектів, індукова17. Фармацевтична композиція, яка відрізняється них звичайними антипсихотичними агентами, мігтим, що вона містить терапевтично ефективну рені, когнітивних розладів, ADHD, а також для кількість сполуки за будь-яким з пп. 1 - 16 у поєдполіпшення сну, при якому вводять терапевтично нанні з одним або декількома фармацевтично ефективну кількість сполуки за будь-яким з пп. 1прийнятними носіями або розріджувачами. 16. 18. Застосування сполуки за будь-яким з пп. 1 - 16 для виробництва лікарського засобу, придатного Цей винахід відноситься до нового класу похідних індолу, що мають спорідненість до D4дофамінового рецептора. Ці сполуки мають антагоністичний вплив на D4-дофаміновий рецептор і, таким чином, є придатними для лікування певних психічних і неврологічних розладів, зокрема, психозів. Деякі з цих сполук мають також спорідненість до D3-дофамінового рецептора, 5-НТ2Арецептора та/або 5-НТ2C-рецептора, а деякі з цих сполук є інгібіторами зворотного захоплення серотоніну. Ліганди D4-дофамінових рецепторів, родинні сполукам за цим винаходом, відомі з WO 98/28293. Похідні індану та дигідроіндолу, які описані тут, мають загальну формулу де А являє собою індол, a Y являє собою групу, що завершує індан або дигідроіндол, і інші замісники є такими, як визначено в заявці. WO 00/23441 описує сполуки загальної формули де замісники R1, R2, R3, m, n і p є такими, як визначено в заявці. Говориться про те, що дані сполуки показують високу спорідненість у відношенні D2-дофамінових рецепторів, а також про те, що вони є інгібіторами зворотного захоплення серотоніну. Предметом винаходу, що заявляється, є те, що дані сполуки є придатними для лікування шизофренії й інших психічних розладів. Інші сполуки, структурно родинні сполукам за цим винаходом, описані в WO 99/58525. Йдеться про те, що сполуки, які описані в зазначеному документі, є лігандами 5-НТ2А та інгібіторами зворотного захоплення серотоніну і мають загальну формулу де замісники є такими, як визначено в заявці. Йдеться про те, що дані сполуки є придатними для лікування шизофренії. WO 00/31074 відноситься до сполук загальної формули де X являє собою CO або SO2, a Y являє собою N-R4 або CR4R5, і замісники є такими, як визначено в заявці. Йдеться про те, що дані сполуки є активними у відношенні 5-НТ2A-рецептора, мають інгібуючу активність у відношенні зворотного захоплення 5-НТ і підсилюють вивільнення 5-НТ. Заявки WO 94/18197, ЕР 329168, WO 93/16073, ЕР 732332, WO 98/37893 і WO 95/11680 описують ліганди D4-дофамінових рецепторів, які, подібно сполукам за цим винаходом, являють собою заміщені похідні тетрагідрохінолінону й тетрагідроізохінолінону. Проте, дані сполуки не містять індолу, на відміну від сполук за цим винаходом. Йдеться про те, що дані сполуки є лігандами D4 7 74830 8 дофамінових рецепторів, придатними в якості анстраждають на шизофренію [Gurevich et al., Arch. типсихотичних лікарських засобів. Заявляється Gen. Psychiatry, 1997, 54, 225-32]. також, що сполуки, описані в WO 93/16073, мають Отже, антагоністи D3-рецепторів можуть надаантагоністичну активність у відношенні 5-НТ2вати можливість ефективної антипсихотичної терецепторів. рапії, вільної від екстрапірамідних побічних ефекD4-дофамінові рецептори відносяться до підтів класичних антипсихотичних лікарських засобів, родини D2-дофамінових рецепторів, які, як вважащо виявляють свою дію, головним чином, за доється, відповідальні за антипсихотичну дію нейропомогою блокади D2-рецепторів [Shafer et al., лептиків. Побічна дія нейролептичних лікарських Psychopharmacology, 1998,135, 1-16; Schwartz et засобів, які, насамперед, діють через антагонізм al., Brain Research Reviews, 2000, 31, 277-287]. стосовно D2-рецепторів, обумовлені, як відомо, Більш того, блокада D3-рецепторів призводить антагонізмом у відношенні D2-рецептора в отріардо незначної стимуляції в префронтальній корі них (стріатних) ділянках головного мозку. Проте, головного мозку [Merchant et al. Cerebral Cortex, D4-дофамінові рецептори розташовані, головним 1996, 6, 561-570], яка могла б бути корисною при чином, не в отріарних, а в інших ділянках мозку, і негативних симптомах і порушеннях пізнавальної це дозволяє зробити припущення, що антагоністи здатності, пов'язаних із шизофренією. Крім того, D4-дофамінового рецептора не будуть викликати антагоністи дофамінових D3 можуть повертати D2 екстрапірамідних побічних дій. Це є наочним з анантагоніст-індуковані EPS [Millan et al., Eur. J. типсихотичної дії клозапіну, який виявляє більш Pharmacol., 1997, 321, R7-R9] і не викликають змін високу спорідненість до D4-, ніж до D2-рецепторів, і у пролактині [Reavill et al., J. Pharmacol. Exp. Ther., не викликає екстрапірамідних побічних ефектів 2000, 294, 1154-165]. Отже, D3-антагоністичні вла[Van Тоl et al. Nature 1991, 550,610; Hadley стивості антипсихотичного лікарського засобу могMedicinal Research Reviews 1996,16, 507-526 і ли б знижувати негативні симптоми і порушення Sanner Exp. Opin. Ther. Patents 1998, 8, 383-393). пізнавальної здатності та призводити до поліпшеБуло показано, що ряд D4-лігандів, які, як заяного профілю побічної дії у відношенні EPS і горвлялося, є селективними антагоністами D4мональних змін. рецепторів (L-745,879 і U-101958), мають антипсиАгоністи дофамінових D3 вважалися також хотичну активність [Mansbach et al., придатними для лікування шизофренії [Wustow et Psychopharmacology, 1998,135, 194-200]. Проте, al., Current Pharmaceutical Design, 1997, 3, 391нещодавно повідомлялося, що ці сполуки у різних 404]. дослідах визначення ефективності in vitro виявляВідомі різноманітні ефекти сполук, які є ліганють себе частковими агоністами D4-рецепторів дами різних підтипів рецептора серотоніну. Стосо[Gazi et al. Br. J Pharmacol. 1998,124, 889-896 і вно 5-НТ2А-рецептора, який раніше вказувався як Gazi et al. Br. J. Pharmacol. 1999,128, 613-620]. 5-НТ2-рецептор, відомі наступні ефекти, наприКрім того, було показано, що клозапін, який являє клад: антидепресивний ефект і поліпшення якості собою ефективний антипсихотичний засіб, є також сну [Meert et al. Drug. Dev. Res. 1989,18, 119], прихованим антагоністом [Gazi et al. Br. J. ослаблення негативних симптомів шизофренії та Pharmacol. 1999,128, 613-620]. екстрапірамідних побічних ефектів, викликаних Таким чином, D4-ліганди, що є частковими застосуванням класичних нейролептиків пацієнтаагоністами або антагоністами D4-рецепторів, моми із шизофренією [Gelders British J. Psychiatry жуть мати переваги у відношенні ефективності 1989, 755 (suppl. 5), 33]. Крім того, селективні анпроти психозів. тагоністи 5-НТ2А можуть бути ефективними для Антагоністи дофамінових D4 також можуть бупрофілактики й лікування мігрені [Scrip Report; ти придатними для лікування порушень пізнаваль"Migraine-Current trends in research and treatment"; ної здатності [Jentsch et al., Psychopharmacology, PJB Publications Ltd.; May 1991] і для лікування 1999,142, 78-84]. стану тривоги [Colpart et al. Psychopharmacology Крім того, опубліковане підтвердження генети1985, 86, 303-305 і Perregaard et al. Current Opinion чного зв'язку між підтипом "первинної неуважності" in Therapeutic Patents 1993,1, 101-128]. дефіциту уваги при гіперактивності (ADHD) та поДеякі клінічні дослідження розглядають участь ліморфізмом тандемних копій у гені, що кодує D4підтипу 5-НТ2-рецептора в агресивному поводжендофаміновий рецептор [McCracken et al. Mol. ні. Більш того, атипічні серотонін-дофамінові антаPsychiat. 2000, 5, 531-536]. Це ясно вказує на наягоністи-нейролептики мають антагоністичну дію у вність зв'язку між D4-дофаміновим рецептором і відношенні 5-НТ2-рецептора на додаток до блокуADHD, і ліганди, що діють на цей рецептор, мовальних властивостей стосовно дофаміну і, як жуть бути придатними для лікування цього специописано, мають анти-агресивну поведінку [Connor фічного розладу. et al. Exp. Opin. Ther. Patents. 1998, 8(4), 350-351]. D3-дофамінові рецептори також належать до Недавно також накопичилися докази, які обпідродини D2-дофамінових рецепторів, і вони пеґрунтовують доцільність застосування селективреважно розташовані в лімбічних ділянках головних антагоністів 5-НТ2А в якості препаратів, приданого мозку [Sokoloff et al., Nature, 1990, 347, 146тних для лікування позитивних симптомів психозу 151], таких як nucleus accumbens, причому блока[Leysen et al. Current Pharmaceutical Design 1997, да дофамінових рецепторів асоційована з антип5,367-390 і Carlsson Current Opinion in CPNS сихотичною активністю [Willner, Int. Clinical Investigational Drugs 2000, 2(1), 22-24]. Psychopharmacology, 1997,12, 297-308]. Крім того, Сполуки, що є інгібіторами зворотного захопбуло описано підвищення рівня D3-рецепторів у лення 5-НТ, добре відомі як антидепресанти. лімбічній частині головного мозку пацієнтів, що Ліганди 5-НТ2C, як було встановлено, підси 9 74830 10 люють дію інгібіторів зворотного захоплення 5-НТ SO або SO2, тоді n 1, a m 1; в експериментах з мікродіалізом і на експерименX являє собою С, СН або Ν; за умови, що, котах з тваринами, а сполуки, що мають інгібувальли X являє собою С, тоді пунктирна лінія позначає ний ефект стосовно зворотного захоплення 5-НТ у зв'язок, а коли X являє собою N або СН, тоді пункпоєднанні зі спорідненістю у відношенні 5-НТ2Cтирна лінія не є зв'язком; 1 9 рецептора, можуть, отже, бути особливо придатR -R є незалежно обраними з водню, галогеними для лікування депресії й інших розладів, які ну, ціаногрупи, нітрогрупи, аміногрупи, гідроксильпіддаються лікуванню інгібіторами зворотного заної групи, C1-6-алкіламіну, ди-С1-6-алкіламіну, C1-6хоплення серотоніну (міжнародна заявка алкілу, С2-6-алкенілу, С2-6-алкінілу, C1-6-алкокси, C1PCT/DK00/00671). 6-алкілтіо, С1-6-алкілу, заміщеного гідроксильною Отже, ліганди D4-дофамінового рецептора є групою або тіоловою групою, С3-8-циклоалкілу, С3потенційними лікарськими засобами для лікування 8-циклоалкіл-С1-6-алкілу, ацильної групи, тіоацильшизофренії та інших психозів, а сполуки з комбіноної групи, арильної групи, трифторметильної груваними ефектами у відношенні транспортера 5-НТ пи, трифторметилсульфонільної групи і C1-6можуть мати додаткові переваги у відношенні поалкілсульфонілу; ліпшеного впливу на депресивні й негативні симпR10 являє собою водень, C1-6-алкіл, С2-6томи в пацієнтів, що страждають на шизофренію. алкеніл, С2-6-алкініл, C1-6-алкіл, заміщений гідрокСполуки з комбінованим впливом на D4сильною групою або тіоловою групою, С3-8дофаміновий рецептор і 5-НТ2А-рецептор можуть циклоалкіл, С3-8-циклоалкіл-С1-6-алкіл, арильну мати додаткові переваги у відношенні поліпшеного групу, арил-С1-6-алкіл, ацильну групу, тіоацильну впливу на позитивні й негативні симптоми шизофгрупу, C1-6-алкілсульфоніл, трифторметилсульфоренії, і додаткові переваги у відношенні впливу на нільну або арилсульфонільну групу, або до їх фасимптоми депресії та тривоги. Крім того, антагонісрмацевтично прийнятних кислотно-адитивних сотичні властивості у відношенні D3-дофамінових лей. рецепторів антипсихотичного лікарського засобу У першому конкретному варіанті здійснення можуть зменшити негативні симптоми й когнітивні цього винаходу індол зв'язаний з X по 3 положендефіцити шизофренії та викликати поліпшення ню індолу. профілю побічних ефектів. В другому варіанті здійснення цього винаходу Метою цього винаходу є одержання сполук, які один з Y1 і Y2 являє собою N, який зв'язаний з Y4, а є частковими агоністами або антагоністами D4інший з Y1 і Y2 являє собою СО, і Y4 являє собою дофамінового рецептора, і подібних сполук з комСН2. бінованими ефектами у відношенні D 4У третьому варіанті здійснення цього винаходу 1 2 4 дофамінового рецептора, рецептора D3, 5-НТ2Аодин з Y і Y являє собою N, який зв'язаний з Y , а 1 2 4 рецептора, 5-НТ2C-рецептора та/або 5-НТінший з Y і Y являє собою СН2, і Y являє собою переносника. CO. Ще однією метою цього винаходу є ствоУ четвертому варіанті здійснення цього винарення сполук із зазначеними властивостями, що ходу Y1 являє собою азот, який зв'язаний з Y4, а мають поліпшену розчинність у порівнянні з відоодин з Y4 і Y2 являє собою CO, а інший являє сомими з рівня техніки сполуками. бою СН2. Відповідно, цей винахід відноситься до нових У п'ятому варіанті здійснення цього винаходу сполук формули І Y1 являє собою азот, який зв'язаний з Υ4, Υ2 являє собою CO, a Y4 являє собою СН2. У шостому варіанті здійснення цього винаходу Y1 являє собою азот, який зв'язаний з Υ4, Υ2 являє собою СН2, a Y4 являє собою CO. У сьомому варіанті здійснення цього винаходу Y2 являє собою азот, який зв'язаний з Y4, а один з Y1 і Y4 являє собою CO, а інший являє собою СН2. де У восьмому варіанті здійснення цього винахо(a) один з Y1 і Y2 являє собою N, який зв'язаду Y2 являє собою атом азоту, який зв'язаний з Υ4, ний з Y4, а інший з Y1 і Y2 являє собою CO, CS, SO Υ1 являє собою СН2, a Y4 являє собою CO. або SO2, і Υ4 являє собою СН2; У дев'ятому варіанті здійснення цього винахо(b) один з Υ1 і Υ2 являє собою Ν, який зв'язаду Y2 являє собою атом азоту, який зв'язаний з Υ4, 4 1 2 4 ний з Υ , а інший з Υ і Υ являє собою СН2, і Υ Υ1 являє собою CO, a Y4 являє собою СН2. являє собою CO, CS, SO або SO2; або У десятому варіанті здійснення цього винахо(c) один з Υ1 і Υ2 являє собою Ν, який зв'язаду один з Y1 і Y2 являє собою N, який зв'язаний з ний з Υ4, а інший з Υ1 і Υ2 являє собою СН2, і Υ4 Y4, а інший з Y1 і Y2 являє собою СН2, і Y4 являє являє собою СН2; собою СН2. Зазначені сполуки, переважно, знахоΥ3 являє собою Z- СН2, СН2-Z або СН2 СН2, а Ζ дяться у формі їх фармацевтично прийнятних по1 являє собою О або S; за умови, що, коли Υ являє двійних солей. собою Ν, тоді Υ3 може не бути Z-СН2; У ще одному варіанті здійснення цього винаW являє собою зв'язок або групу О, S, CO, CS, ходу Y3 являє собою СН2СН2 або CH2Z. SO або SO2; У подальших варіантах здійснення цього виn дорівнює 0-5, m дорівнює 0-5, a m+n дорівнаходу X являє собою С, X являє собою N або X нює 1-10; за умови, що коли W являє собою О або являє собою СН. Замісники R1-R9, зокрема, є обраними з водню, S, тоді n 2, a m 1; коли W являє собою CO, CS, 11 74830 12 галогену, ціаногрупи, нітрогрупи, аміногрупи, C1-6нільної, арил-С1-6-алкілкарбонільної, С3-8алкіламіну, ди-С1-6-алкіламіну, С1-6-алкілу, С3-8циклоалкілкарбонільної або С3-8-циклоалкіл-С1-6циклоалкілу та трифторметильної групи, a R10 явалкілкарбонільної групи, а термін "тіоацил" позналяє собою водень, C1-6-алкіл або ацильну групу, чає відповідну ацильну групу, у якій карбонільна та/або W являє собою зв'язок, a n+m дорівнює від група заміщена тіокарбонільною групою. 1 до 6, зокрема, від 3 до 6. Кислотно-адитивними солями сполук за цим Сполуки за цим винаходом є частковими аговинаходом є фармацевтично прийнятні солі, оденістами або антагоністами D4-дофамінового рецержані при взаємодії з нетоксичними кислотами. птора. Багато сполук мають комбіновану дію на Прикладами таких органічних солей є солі малеїD4-дофаміновий рецептор і спорідненість до D3нової, фумарової, бензойної, аскорбінової, буршдофамінового рецептора, спорідненість до 5-НТ2Атинової, щавлевої, біс-метиленсаліцилової, метарецептора, спорідненість до 5-НТ2C-рецептора нсульфонової, етандисульфонової, оцтової, та/або дію щодо інгібування зворотного захопленпропіонової, винної, саліцилової, лимонної, глюконя 5-НТ. нової, молочної, яблучної, мигдалевої, коричної, Відповідно, сполуки за цим винаходом вважацитраконової, аспарагінової, стеаринової, пальміються придатними для лікування позитивних і нетинової, ітаконової, гліколевої, р-амінобензойної, гативних симптомів шизофренії, інших психозів, глютамінової, бензолсульфонової та теофіліноцтривожних розладів, таких як генералізований тової кислот, а також утворені з 8тривожний розлад, панічний розлад і обсесивногалогентеофілінами, наприклад, 8компульсивний розлад, депресії, агресії, побічних бромотеофіліном. Прикладами таких неорганічних ефектів, індукованих звичайними антипсихотичнисолей є солі хлористоводневої, бромистоводневої, ми агентами, мігрені, когнітивних розладів, ADHD, сірчаної, сульфамінової, фосфорної та азотної а також для поліпшення сну. кислот. В іншому аспекті цей винахід відноситься до Фармацевтичні композиції цього винаходу або фармацевтичної композиції, яка включає принайкомпозиції, одержані згідно з цим винаходом, момні одну сполуку формули І, як визначено вище, жуть уводитися будь-яким придатним шляхом, або її фармацевтично прийнятну кислотнонаприклад, перорально у виді таблеток, капсул, адитивну сіль у терапевтично ефективній кількості порошків, сиропів тощо або парентерально у виді та у поєднанні з одним або декількома фармацеврозчину для ін'єкцій. Для одержання подібних комтично прийнятними носіями або розріджувачами. позицій можуть застосовуватися добре відомі в У ще одному аспекті цей винахід відноситься даній галузі способи, і можуть застосовуватися до застосування сполуки формули І, як визначено будь-які фармацевтично прийнятні носії, розріджувище, або її кислотно-адитивної солі для виробнивачі, наповнювачі й інші добавки, які звичайно зацтва фармацевтичного препарату для лікування стосовуються в даній галузі. згаданих вище розладів. Сполуки згідно з винаходом зручно вводити в Сполуки загальної формули І можуть існувати одиничній дозованій формі, що містить зазначені у виді оптичних ізомерів, і зазначені оптичні ізомесполуки в кількості приблизно від 0,01 до 100мг. ри також входять в обсяг цього винаходу. Сумарна добова доза звичайно складає від Термін "C1-6-алкіл" відноситься до розгалужеприблизно 0,05 до 500мг, і найбільш переважно ної або нерозгалуженої алкільної групи, яка має вона складає від приблизно 0,1 до приблизно 50мг від одного до шести атомів вуглецю включно, такої активної сполуки за винаходом. як метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2Сполуки за винаходом можуть бути одержані бутил, 2-метил-2-пропіл, 2-метил-1-пропіл, пентил наступним чином: і гексил. 1) Алкілуванням піперазину, піперидину або Подібним чином, терміни "С2-6-алкеніл" і "С2-6тетрагідропіридину формули II за допомогою алкіалкініл", відповідно, позначають такі групи, що лувального похідного формули III: мають від двох до шести атомів вуглецю, що включають один подвійний зв'язок і потрійний зв'язок, відповідно, такі як етеніл, пропеніл, бутеніл, етиніл, пропініл і бутиніл. Терміни "C1-6-алкокси", "С1-6-алкілтіо", "С1-6алкілсульфоніл", "C1-6-алкіламіно", "C1-6алкілкарбоніл" тощо позначають такі групи, у яких алкільна група являє собою C1-6-алкіл, як визначеде R1-R10, Χ, Υ1, Υ2, Υ3, Υ4, W, n, m і пунктирна но вище. лінія є такими, як визначено вище, a L являє соТермін "С3-8-циклоалкіл" позначає моноциклічбою групу, що видаляється, таку як галоген, мезиний або біциклічний карбоцикл, який має від трьох лат або тозилат; до восьми С-атомів, такий як циклопропіл, цикло2) Відновним алкілуванням аміну формули II пентил, циклогексил тощо. за допомогою реагенту формули IV: Термін "арил" відноситься до карбоциклічної ароматичної групи, такої як феніл, нафтил, зокрема, феніл, включаючи феніл, заміщений метилом, або нафтил. Галоген означає фтор, хлор, бром або йод. Застосовуваний тут термін "ацил" відноситься до формільної, С1-6-алкілкарбонільної, арилкарбо 13 74830 де R1-R10, Χ, Υ1, Υ2, Υ3, Υ4, W, n, m і пунктирна лінія є такими, як визначено вище, а Е являє собою або альдегідну, або активовану карбоксильну групу; 3) Алкілуванням сполуки формули V за допомогою алкілувального похідного формули VI: де R1-R10, Χ, Υ3, W, n, m і пунктирна лінія є такими, як визначено вище, один з Y5 і Y6 являє собою NH або N-, а інший з Y5 і Y6 являє собою CO, CS, SO, SO2 або СН2, a L являє собою групу, що видаляється, таку як галоген, мезилат або тозилат; або 4) Відновленням подвійного зв'язку в тетрагідропіридинільному кільці в похідних наступної формули VII: де R1-R10, Υ1, Υ2, Υ3, Υ4, W, n і m є такими, як визначено вище; 5) Відновленням амідного карбонілу в сполуці формули VIII: де R1-R10, Υ1, Υ2, Υ3, Υ4, n, m, W і пунктирна лінія є такими, як визначено вище; 6) Відновленням амідної групи сполуки формули IX: де R1-R10, Χ, Υ1, Υ2, Υ3, n, m, W і пунктирна лінія є такими, як визначено вище; 7) Відновним алкілуванням похідного формули Va за допомогою ацилювального похідного формули X: 14 де R1-R10, Χ, Υ3, W, n, m і пунктирна лінія є такими, як визначено вище, один з Y7 і Y8 являє собою NH, а інший з Y7 і Y8 являє собою СН2, а Е являє собою альдегід або групу активованої карбонової кислоти; 8) Ацилюванням аміну формули Va за допомогою реагенту формули X: де R1-R10, Χ, Υ3, W, n, m і пунктирна лінія є такими, як визначено вище, один з Y7 і Y8 являє собою NH, а інший з Y7 і Y8 являє собою СН2, a E являє собою альдегід або групу активованої карбонової кислоти; 9) Розщепленням полімерного зв'язку похідного формули XI: де R1-R9, Υ1, Υ2, Υ3, Χ, W, m і n є такими, як визначено вище, a R'OH являє собою гідроксиетилабо гідроксиметилполістирол, смолу Wang або аналогічні поліетиленгліколь-полістиролові смоли; після чого сполуку формули І виділяють у виді вільної основи або її фармацевтично прийнятної кислотно-адитивної солі. Алкілування за способами 1) і 3) зручно проводити в інертному органічному розчиннику, такому як спирт або кетон, який має відповідну температуру кипіння, переважно в присутності органічної або неорганічної основи (карбонат калію, діізопропілетиламін або триетиламін) при температурі дефлегмації. Альтернативно, алкілування може проводитися при фіксованій температурі, яка відрізняється від температури кипіння, в одному з перелічених вище розчинників або у диметилфор 15 74830 16 маміді (ДМФ), диметилсульфоксиді (ДМСО) або Nдля фахівця-хіміка, звичайно приєднують до смоли метилпіролідин-2-оні (НМП), переважно в присут(етил-4-нітрофенілкарбонат, зв'язаний з полістиності основи. ролом), з використанням основи, наприклад, Ν,ΝСинтез амінів формули (II), 3-(піперидин-4-іл)диметиламінопіридину і Ν,Ν-діізопропілетиламіну, 1Н-індолів і 3-(3,6-дигідро-2Н-піридин-4-іл)-1Нпри підвищеній температурі (наприклад, 50-100°С) індолів описаний у літературі [дивіться, наприклад, в апротонному розчиннику (наприклад, ДМФ або ЕР-А1-465398]. Алкілувальні реагенти формули ДМСО), з одержанням (XIII). Після зняття захисту з (III) відомі з літератури [див. Oshiro et al. J. Med. аміногрупи трифторооцтовою кислотою (смола Chem. 2000, 43, 177-189 і ЕР-B 1-512525] або їх XIV), за допомогою алкілування вводять другий можна одержати за способами, очевидними для диверсифікувальний будівельний блок. Алкілуванфахівця в галузі хімії [дивіться, наприклад, ня здійснюють при підвищеній температурі (50Kowalski et al. J. Heterocyclic Chem. 2000, 37, 187100°С) в апротонному розчиннику, такому як ДМФ, 189, Mokrosz et al. Pharmazie 1997, 52, 423-428 і ацетон або ацетонітрил, у результаті чого одерMisztal et al. Med. Chem. Res. 1992, 2, 82-87]. Алкіжують смолу (XV). Після зняття захисту з ефіру лувальні реагенти формули (VI) можуть бути одекарбонової кислоти трифторооцтовою кислотою ржані за способами, відомими фахівцю в галузі (смола XVI), за допомогою стандартної послідовхімії, а аміни формули (V) є комерційно доступниності амідоутворюючих реакцій, наприклад, перетми або описані в літературі. воренням карбонової кислоти у відповідний хлоВідновне алкілування за способами 2) і 7) прорангідрид кислоти з використанням тіонілхлориду водять за стандартними способами, описаними в при низькій температурі в дихлорометані, ацетонілітературі. Реакція може бути проведена в дві трилі або ДМФ, з наступною дією аміном, уводять стадії, наприклад, сполученням похідних формули третій диверсифікувальний будівельний блок фоΘΘ/Va і реагенту формули IV/X за стандартними рмули (Va). Кінцевий продукт відщеплюють від способами за допомогою хлорангідриду карбоносмоли з використанням розведеного метоксиду вої кислоти, або з використанням з'єднувальних натрію в суміші метанол/тетрагідрофуран при кімреагентів, таких як дициклогексилкарбодіімід, з натній температурі. наступним відновленням одержаного аміду за доСхема 1 помогою алюмогідриду літію або алану. Цю реакцію можна також здійснити за стандартним способом в одному реакторі. Карбонові кислоти або альдегіди формули IV/X можна одержати за способами, очевидними для фахівця в галузі хімії. Алкілування за способом 3) зручно проводити, як описано вище, або взаємодією азотного аніона V з VI. Азотний аніон V може бути одержаний в інертному органічному розчиннику, наприклад, диметилформаміді (ДМФ), диметилсульфоксиді (ДМСО) або N-метилпіролідин-2-оні (НМП) за допомогою сильної основи, наприклад, NaH, перед алкілуванням. Відновлення подвійного зв'язку відповідно до способу 4) звичайно проводиться каталітичним гідруванням при низькому тиску (менше 3атм.) в апараті Пара або за допомогою відновлювальних агентів, таких як диборан або бромоводневі похідні, які одержані in situ з NaBH4 у трифторооцтовій кислоті, в інертних розчинниках, таких як тетрагідрофуран (ТГФ), діоксан або діетиловий ефір. ВихіЕкспериментальний розділ дні речовини формули (VII) можуть бути одержані Температури плавлення були визначені на за способами 1), 3), 7) і 8). приладі Büchi B-540 і не корегувалися. МасВідновлення амідних груп за способами 5) і 6) спектри отримували за допомогою системи Quattro найбільш легко відбувається за допомогою алюMS-MS від компанії VG Biotech, Fisons Instruments. могідриду літію або алану в інертному органічному Аналітичні дані РХ-МС були отримані на апараті розчиннику, такому як, наприклад, тетрагідрофуРЕ Sciex API 150EX, постаченим джерелом іонноран (ТГФ) або діетиловий ефір, при температурі го розпилення і РХ системою Shimadzu LCвід 0°С до температури дефлегмації. Вихідні речо8A/SLC-10A. Рідинну хроматографію (РХ) прововини формули (VIII) можуть бути одержані за сподили (50 4,6мм YMC ODS-A з розміром часток собами 2) і 3), тоді як вихідні речовини формули 5мкм) елююванням з лінійним градієнтом сумішшю (IX) можуть бути одержані за способами 1), 7) і 8). вода/ацетонітрил/трифторооцтова кислота (градіВзаємодію за способом 8) зручно проводити єнт від 90:10:0,05 до 10:90:0,03) протягом 7 хвилин за допомогою зв'язувальних реагентів, таких як, при 2мл/хв. Чистота визначалася інтеграцією УФ наприклад, дициклогексилкарбодіімід. сліду (254нм). Час затримки Rt виражали в хвилиПохідні структури (XI) одержують за допомонах. Препаративне РХ-МС-розподілення проводигою послідовності твердофазного синтезу, предли на тому ж апараті. Умови РХ (50 20мм YMC ставленої на схемі 1, нижче. Перший будівельний ODS-A з розміром часток 5мкм) являли собою блок (XII), одержаний за способами, очевидними елюювання з лінійним градієнтом сумішшю во 17 74830 18 да/ацетонітрил/трифторооцтова кислота (градієнт протягом 5 хвилин. Суміш виливали в соляний від 80:20:0,05 до 5:95:0,03) протягом 7 хвилин при розчин і водну фазу екстрагували етилацетатом. 22,7мл/хв. Фракційний збір проводили за допомоОб'єднані органічні фази висушували (MgSО4), гою МС-детектування розгалуженого потоку. фільтрували і концентрували в умовах вакууму. Спектри 1H ЯМР реєстрували при 250,13МГц Залишок очищали флеш-хроматографією на силіна апараті Bruker AC 250 або при 500,13МГц на кагелі (елюент: етилацетат/гептан, 1:1) з одержанапараті Bruker DRX 500. У якості розчинників виконям продукту у вигляді олії червоного кольору ристовували дейтеровані хлороформ (99,8% D) (2,9г). або диметилсульфоксид (99,9% D). Як внутрішній 1-(3-бромпропан-1-іл)-3,4-дигідрохінолін-2(1Н)стандарт використовували TMS. Величини хімічон них зсувів виражали в м.ч. (млн-1). Для позначення Суспензію гідриду натрію (6,8г, 60% у мінерарізних ЯМР сигналів використовували наступні льній олії) і диметилформаміду (200мл) витримуабревіатури: с = синглет, д = дублет, т = триплет, вали при 20-25°С, після чого додавали розчин 3,4кв = квартет, кві = квінтет, г = гептет, дд = подвійдигідрохінолін-2(1Н)-ону (25,0г) у диметилформаний дублет, дт = подвійний триплет, дкв = подвійміді (180мл). Одержану суміш перемішували при ний квартет, тт = триплет триплетів, м = мультипкімнатній температурі протягом 10 хвилин, після лет, шир. = широкий. ЯМР сигналами, що чого додавали розчин 1,3-дибромпропану (172г) у відповідають кислотним протонам, звичайно знедиметилформаміді (150мл) при температурі 20важали. Вміст води в кристалічних сполуках ви35°С. Одержану суміш перемішували при 30°С значали титруванням за Карлом Фішером. Для протягом 20 хвилин і концентрували в умовах вахроматографії на колонках використовували силікууму. Залишок виливали на лід і водну фазу екскагель типу Kieselgel 60, 40-60 меш за ASTM. Для трагували етилацетатом. Об'єднані органічні фази іонообмінної хроматографії використовували напромивали соляним розчином, висушували ступний матеріал: SCX-колонки (1г) від компанії (MgSO4) і концентрували в умовах вакууму. Сирий Varian Mega Bond Elut®, Chrompack, номер за капродукт очищали флеш-хроматографією на силіталогом 220776. Перед використанням SCXкагелі (елюент: етилацетат/гептан, 1:1) з одержанколонки попередньо кондиціювали 10% розчином ням продукту у вигляді олії жовтого кольору (27г). оцтової кислоти в метанолі (3мл). Наступні сполуки одержували аналогічним Приклади способом: Одержання проміжних сполук 1-(4-бромбутан-1-іл)-3,4-дигідрохінолін-2(1Н)А. Алкілувальні реагенти он 1-(2-хлоретил)-3,4-дигідрохінолін-2(1Н)-он з 3,4-дигідрохінолін-2(1Н)-ону і 1,4Суспензію гідриду натрію (3,0г, 60% у мінерадибромбутану льній олії) і диметилформаміду (100мл) витриму1-(5-бромпентан-1-іл)-3,4-дигідрохінолін-2(1Н)вали при 15-18°С, після чого додавали розчин 3,4он дигідрохінолін-2(1Н)-ону (10,0г) у диметилформаз 3,4-дигідрохінолін-2(1Н)-ону і 1,5міді (150мл). Одержану суміш перемішували при дибромпентану кімнатній температурі протягом 60 хвилин, після 4-(4-бромбутан-1-іл)-3,4-дигідро-2Н-1,4чого додавали розчин 2-хлоретилацетату (10,0г) у бензоксазин-3(4Н)-он диметилформаміді (50мл) при температурі 20°С. з 3,4-дигідро-2Н-1,4-бензоксазин-3(4Н)-ону і Одержану суміш нагрівали до 80°С протягом 2,5 1,4-дибромбутану годин, охолоджували і виливали на лід. Водну фа2-(3-гідроксипропан-1-іл)-3,4-дигідроізохінолінзу екстрагували етилацетатом і об'єднані органічні 1(2Н)-он фази промивали соляним розчином, висушували з 3,4-дигідроізохінолін-1(2Н)-ону і 3(MgSO4) і концентрували в умовах вакууму. Сирий бромпропанолу продукт очищали флеш-хроматографією на силі2-(4-бромбутан-1-іл)-3,4-дигідроізохінолінкагелі (елюент: етилацетат/гептан, 1:1) з одержан1(2Н)-он ням сирого 1-(2-ацетоксиетил)-3,4-дигідрохінолінз 3,4-дигідроізохінолін-1(2Н)-ону і 1,42(1Н)-ону (10,2г). Суміш сирого 1-(2дибромбутану ацетоксиетил)-3,4-дигідрохінолін-2(1Н)-ону, мети1-(3-бромпропан-1-іл)-3,4-дигідроізохінолінлату натрію (2,5мл, 30% у метанолі) і метанолу 1(2Н)-он (250мл) перемішували при кімнатній температурі Сполуку 2-(3-гідроксипропан-1-іл)-3,4протягом 16 годин, а потім концентрували в умодигідроізохінолін-1(2Н)-он розчиняли в тетрагідвах вакууму. Залишок очищали флешрофурані (100мл), після чого додавали триетилахроматографією на силікагелі (елюент: етилацемін (5,2мл). Одержану суміш охолоджували до 6тат/гептан, 1:1) з одержанням відповідного спирту 11 С, після чого додавали розчин хлорангідриду у вигляді кристалічної сполуки червоного кольору метансульфонової кислоти (1,4мл) у тетрагідро(4,9г). Даний спирт розчиняли в тетрагідрофурані фурані (25мл). Суміш перемішували при 5°С про(100мл), після чого додавали триетиламін (8,2мл). тягом 10 хвилин, фільтрували і концентрували в Одержану суміш охолоджували до 5-6°С, після умовах вакууму. Залишок розчиняли в ацетоні чого додавали розчин хлорангідриду метансуль(250мл), після чого додавали бромід літію (6,5г) і фонової кислоти (2мл) у тетрагідрофурані (25мл). одержану суміш кип'ятили зі зворотним холодильСуміш фільтрували і випарювали до сухого стану в ником протягом 2 годин. Суміш виливали в соляумовах вакууму. Залишок розчиняли в диметилний розчин і водну фазу екстрагували етилацетаформаміді (50мл), після чого додавали хлорид том. Об'єднані органічні фази висушували літію (4,9г) і одержану суміш нагрівали до 70°С (MgSO4), фільтрували і концентрували в умовах 19 74830 20 вакууму. Залишок очищали флеш-хроматографією використанням потоку азоту для перемішування на силікагелі (елюент: етилацетат/гептан, 1:2) з смоли (попередження: виділення діоксиду вуглеодержанням продукту у вигляді олії жовтого коцю). Смолу відфільтровували та промивали сухим льору (2,7г). дихлорометаном (25мл), 1:1 сумішшю дихлороме3-хлор-1-(3,4-дигідро-1Н-ізохінолін-2тан:триетиламін (3 25мл) і сухим дихлорометаном іл)пропан-1-он (3 25мл). Смолу висушували в умовах вакууму Розчин 3-хлорпропаноїлхлориду (10,5г) у тет(20°С, 20 годин) з одержанням зазначеної в загорагідрофурані (400мл) охолоджували до 6°С, після ловку смоли (3,8г). чого додавали розчин 3,4-дигідро-1Н-ізохіноліну Наступні сполуки, зв'язані з полімером, одер(10,0г). Одержану суміш перемішували при 10°С жували аналогічним способом: протягом 30 хвилин, фільтрували і концентрували 4-хлор-3-(піперидин-4-іл)-1Н-індол, в умовах вакууму. Залишок піддавали стандартній 4-фтор-3-(піперидин-4-іл)-1Н-індол, водній обробці, після чого очищали флеш5-хлор-3-(піперидин-4-іл)-1Н-індол, хроматографією на силікагелі (елюент: етилаце5-фтор-3-(піперидин-4-іл)-1Н-індол, тат/гептан, 1:1) з одержанням продукту у вигляді 6-хлор-3-(піперидин-4-іл)-1Н-індол. безбарвної олії (10г). Одержання 3-[4-(7-хлор-1Н-індол-3Наступні сполуки одержували аналогічним іл)піперидин-1-іл]пропіонової кислоти. зв'язаної з способом: полімером 3-бром-1-(3,4-дигідро-1Н-ізохінолін-225мл колбу з круглим дном завантажували 7іл)пропан-1-он хлор-3-(піперидин-4-іл)-1Н-індолом, зв'язаним з з 3,4-дигідро-1Н-ізохіноліну та 3полімером (1,0г, 0,98ммоль), триетиламіном бромпропаноїлхлориду (80,2мл), трет-бутил-3-бромпропіонатом і сухим 4-хлор-1-(3,4-дигідро-1Н-ізохінолін-2-іл)бутанацетонітрилом (5мл). Суміш перемішували при 1-он 80°С протягом 3 годин. Після охолодження до кімз 3,4-дигідро-1Н-ізохіноліну та 4натної температури смолу відфільтровували та хлорбутаноїлхлориду промивали сухим ацетонітрилом (3x10мл) і сухим 4-хлор-1-(3,4-дигідро-2Н-хінолін-1-іл)бутан-1дихлорометаном (3 10мл). Смолу обробляли проон тягом 20 хвилин 8мл 1:1 суміші дихлорометану та з 3,4-дигідро-2Н-хіноліну та 4трифтороцтової кислоти, що містить анізол (2% хлорбутаноїлхлориду мас./мас.) і метіонін (0,2% мас./мас.) (попередженОдержання проміжних сполук на твердій осноня: виділення діоксиду вуглецю). Смолу відфільтві ровували та промивали сухим дихлорометаном Одержання 4(10мл), 1:1 сумішшю дихлорометан:триетиламін нітрофенілоксикарбонілоксиетилполістиролу (3x10мл) і сухим дихлорометаном (3x10мл). Смолу 2л колбу з круглим дном завантажували гідровисушували в умовах вакууму (20°С, 20 годин) з ксиетилполістиролом (62,9г, 83ммоль, продається одержанням зазначеної в заголовку смоли (1,0г). компанією Rapp Polymere, кат. № НА 140000), NНаступні сполуки, зв'язані з полімером, одерметилморфоліном (20мл, 183ммоль) і сухим дихжували аналогічним способом: лорометаном (900мл). Суспензію охолоджували 3-[4-(4-хлор-1Н-індол-3-іл)піперидин-1на льодяній бані та протягом 5 хвилин додавали 4іл]пропіонова кислота, нітрофенілхлорформіат, розчинений у сухому дих3-[4-(4-фтор-1Н-індол-3-іл)піперидин-1лорометані (400мл). Суміш перемішували при кіміл]пропіонова кислота, натній температурі протягом 16 годин. Смолу від3-[4-(5-фтор-1Н-індол-3-іл)піперидин-1фільтровували та промивали сухим іл]пропіонова кислота, дихлорометаном (5 200мл). Смолу висушували в 3-[4-(6-хлор-1Н-індол-3-іл)піперидин-1умовах вакууму (20°С, 72 години) з одержанням іл]пропіонова кислота, зазначеної в заголовку смоли (79,6г). 4-[4-(4-хлор-1Н-індол-3-іл)піперидин-1Одержання 7-хлор-3-(піперидин-4-іл)-1Ніл]масляна кислота, індолу, зв'язаного з полімером 4-[4-(4-фтор-1Н-індол-3-іл)піперидин-1100мл колбу з круглим дном завантажували 4іл]масляна кислота, нітрофенілоксикарбонілоксиетил-полістиролом 4-[4-(5-хлор-1Н-індол-3-іл)піперидин-1(4,0г, 4,3ммоль), 7-хлор-3-(1-третіл]масляна кислота, бутоксикарбонілпіперидин-4-іл)-1Н-індолом (2,7г, 4-[4-(5-фтор-1Н-індол-3-іл)піперидин-18,1ммоль), діізопропілетиламіном (3,5мл, іл]масляна кислота, 20,2ммоль), 4-диметиламінопіридином (0,5г, 4-[4-(7-хлор-1Н-індол-3-іл)піперидин-14ммоль) і сухим диметилформамідом (50мл). Суіл]масляна кислота, міш перемішували при 90°С протягом 72 годин. 5-[4-(4-хлор-1Н-індол-3-іл)піперидин-1Після охолодження до кімнатної температури смоіл]пентанова кислота, лу відфільтровували та промивали сухим димети5-[4-(5-фтор-1Н-індол-3-іл)піперидин-1лформамідом (3 25мл), сухим ацетонітрилом іл]пентанова кислота, (3 25мл) і сухим дихлорометаном (3 25мл). Смо5-[4-(7-хлор-1Н-індол-3-іл)піперидин-1лу переносили в 250мл скляний циліндр із фритою іл]пентанова кислота, та потрійним перехідником на дні. На смолу потім 6-[4-(4-фтор-1Н-індол-3-іл)піперидин-1діяли протягом 20 хвилин 60мл 1:1 суміші дихлоіл]гексанова кислота, рометану та трифтороцтової кислоти, що містить 6-[4-(4-хлор-1Н-індол-3-іл)піперидин-1анізол (2% мас./мас.) і метіонін (0,2% мас/мас), з іл]гексанова кислота, 21 74830 22 6-[4-(5-фтор-1Н-індол-3-іл)піперидин-1ЯМР (ДМСО-d6): 2,00-2,20 (м, 6Н); 2,60 (т, 2Н); 2,90 іл]гексанова кислота, (т, 2Н); 2,95-3,10 (м, 3Н); 3,10-3,20 (м, 2Н); 3,55 (д, 6-[4-(6-хлор-1Н-індол-3-іл)піперидин-12Н); 3,95 (т, 2Н); 6,90 (т, 1Н); 7,05 (т, 1Н); 7,15-7,30 іл]гексанова кислота, (м, 4Н); 7,30-7,40 (м, 1Н); 7,50 (д, 1Н); 10,55 6-[4-(7-хлор-1Н-індол-3-іл)піперидин-1(шир.с, 1Н); 11,05 (с, 1Н), MC m/z: 406 (МН+). іл]гексанова кислота. Наступні сполуки одержували аналогічним Одержання сполук за цим винаходом способом: Приклад 1 2b, гідрохлорид 5-фтор-3-{1-[5-(2-оксо-3,41а, гідрохлорид 5-фтор-3-{1-[2-(2-оксо-3,4дигідро-2Н-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}дигідро-2Н-хінолін-1-іл)етил]піперидин-4-іл}-1Н1Н-індолу індолу з 5-фтор-3-(піперидин-4-іл)-1Н-індолу та 1-(5Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу бромпентан-1-іл)-3,4-дигідрохінолін-2(1Н)-ону. Т. (0,3г), 1-(2-хлоретил)-3,4-дигідрохінолін-2(1Н)-ону пл. 199-200°С. 1H ЯМР (ДМСО-d6): 1,30-1,40 (м, (0,41г) і триетиламіну (0,75г) у диметилформаміді 2Н); 1,55-1,60 (м, 2Н); 1,70-1,80 (м, 2Н); 2,05-2,15 (5мл) і бутаноні (10мл) кип'ятили зі зворотним хо(м, 4Н); 2,55 (т, 2Η); 2,85 (т, 2Η); 2,95-3,10 (м, 5Н); лодильником протягом 6 годин. Суміш концентру3,55 (д, 2Н); 3,90 (т, 2Н); 6,90 (т, 1Н); 7,00 (т, 1Н); вали в умовах вакууму, а залишок очищали флеш7,15 (д, 1Н); 7,20-7,30 (м, 3Н); 7,30-7,35 (м, 1Н); хроматографією на силікагелі (елюент: етилаце7,50 (д, 1Н); 12,20 (шир.с, 1Н); 11,05 (с, 1Н), MC тат/етанол/триетиламін, 90:10:5) з одержанням m/z: 434 (МН+). сирого продукту, який виділяли з ацетону у формі 2с, гідрохлорид 5-хлор-3-{1-[3-(2-оксо-3,4гідрохлоридної солі у вигляді кристалічної сполуки дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}білого кольору (0,04г). 1H ЯМР (ДМСО-d6): 2,001Н-індолу 2,25 (м, 4Н); 2,60 (т, 2Η); 2,90 (т, 2Н); 2,95-3,10 (м, з 5-хлор-3-(піперидин-4-іл)-1Н-індолу та 1-(31Н); 3,10-3,30 (м, 4Н); 3,70 (д, 2Н); 4,35 (т, 2Η); бромпропан-1-іл)-3,4-дигідрохінолін-2(1Н)-ону. Т. 6,90 (т, 1Η); 7,05 (т, 1Н); 7,15-7,40 (м, 5Н); 7,50 (д, пл. 142-146°С. 1H ЯМР (ДМСО-d6): 1,95-2,15 (м, 1Н); 10,95 (шир.с, 1Н); 11,05 (с, 1Н), MC m/z: 392 6Н); 2,60 (т, 2Н); 2,90 (т, 2Н); 2,95-3,15 (3Н); 3,15(МН+), 174. 3,20 (м, 2Н); 3,55 (д, 2Н); 3,95 (т, 2Η); 7,00-7,10 (м, Наступні сполуки одержували аналогічним 2Н); 7,20-7,30 (м, 4Н); 7,35 (д, 1Н); 7,75 (с, 1Н), способом: 11,30 (шир.с, 1Н); 11,15 (с, 1Н), MC m/z: 422 (МН+), Ib, оксалат 5-фтор-3-{1-[3-(1-оксо-3,4-дигідро188. 1Н-хінолін-2-іл)пропан-1-іл]піперидин-4-іл}-1Н2d, гідрохлорид 5-хлор-3-{1-[4-(2-оксо-3,4індолу дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}з 5-фтор-3-(піперидин-4-іл)-1Н-індолу та 1-(31Н-індолу бромпропан-1-іл)-3,4-дигідроізохінолін-1(2Н)ону. з 5-хлор-3-(піперидин-4-іл)-1Н-індолу та 1-(41 H ЯМР (ДМСО-d6): 1,90-2,15 (м, 6Н); 2,95-3,15 (м, бромбутан-1-іл)-3,4-дигідрохінолін-2(1Н)-ону.Т.пл. 7Н); 3,55-3,60 (м, 6Н); 6,90 (т, 1Н); 7,20 (с, 1Н); 7,30 229-231°С. 1H ЯМР (ДМСО-d6): 1,55-1,65 (м, 2Н); (д, 1Н); 7,30-7,40 (м, 4Н); 7,45-7,50 (м, 1Н); 7,90 (д, 1,70-1,80 (м, 2Н); 2,00-2,15 (м, 4Н); 2,55 (т, 2Н); 1Н); 11,05 (с, 1Н), MC m/z: 406 (МН+), 188. 2,85 (т, 2Н); 2,95-3,15 (м, 5Н); 2,55 (д, 2Н); 3,95 (т, 1с, гідрохлорид 5-фтор-3-{1-[4-(1-оксо-3,42Н); 7,00 (т, 1Н); 7,05 (д, 1Н); 7,15 (д, 1Н); 7,20-7,30 дигідро-1Н-хінолін-2-іл)бутан-1-іл]піперидин-4-іл)(м, 3Н); 7,40 (д, 1Н); 7,75 (с, 1Н); 10,05 (шир.с, 1Н); 1Н-індолу 11,10 (с, 1Н), MC m/z: 436 (МН+). з 5-фтор-3-(піперидин-4-іл)-1Η-індолу та 2-(42е, гідрохлорид 5-хлор-3-{1-[5-(2-оксо-3,4бромбутан-1-іл)-3,4-дигідроізохінолін-1(2Н)ону. 1H дигідро-2Η-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}ЯМР (ДМСО-d6): 1,55-1,70 (м, 2Н); 1,70-1,85 (м, 1H-індолу 2Н); 2,05 (д, 2Н); 2,10-2,25 (м, 2Н); 2,90-3,15 (7Н); з 5-хлор-3-(піперидин-4-іл)-1Н-індолу та 1-(53,40-3,65 (м, 6Н); 6,90 (т, 1H); 7,20 (с, 1Н); 7,30 (д, бромпентан-1-іл)-3,4-дигідрохінолін-2(1Н)-ону. Т. 1Н); 7,30-7,40 (м, 2Н); 7,40-7,55 (м, 2Н); 7,90 (д, пл. 206-209°С. 1H ЯМР (ДМСО-d6): 1,30-1,40 (м, 1Н); 10,75 (шир.с, 1Н); 11,05 (с, 1Н), MC m/z: 420 2Н); 1,55-1,65 (м, 2Н); 1,70-1,80 (м, 2Н); 2,00-2,15 (МН+). (м, 4Н); 2,55 (т, 2Η); 2,85 (т, 2Η); 2,95-3,10 (м, 4Н); Приклад 2 3,10-3,25 (м, 1Н); 3,55 (д, 2Н); 3,90 (т, 2Н); 7,00 (т, 2а, гідрохлорид 5-фтор-3-{1-[3-(2-оксо-3.41Н); 7,05 (д, 1Н); 7,15 (д, 1Н); 7,20-7,30 (м, 3Н); дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}7,40 (д, 1Н); 7,75 (с, 1Н); 11,20 (шир.с, 1Н); 11,15 1Н-індолу (с. 1Н), MCm/z: 450 (МН+), 299. Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу 2f, гідрохлорид 7-хлор-3-{1-[4-(2-оксо-3,4(5,0г), 1-(3-бромпропан-1-іл)-3,4-дигідрохіноліндигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}2(1Н)-ону (7,7г) і карбонату калію (7,0г) у димети1Н-індолу лформаміді (40мл) нагрівали до 100°С протягом з 7-хлор-3-(піперидин-4-іл)-1Н-індолу та 1-(42,5 годин. Суміш охолоджували, фільтрували та бромбутан-1-іл)-3,4-дигідрохінолін-2(1Н)-ону. Т. концентрували в умовах вакууму. Залишок очищапл. 253-254°С. 1H ЯМР (ДМСО-d6): 1,55-1,65 (м, ли флеш-хроматографією на силікагелі (елюент: 2Н); 1,75-1,85 (м, 2Н); 2,05-2,25 (м, 4Н); 2,55 (т, етилацетат, потім етилацетат/етанол, 90:10) з 2Н); 2,90 (т, 2Н); 2,95-3,15 (м, 5Н); 3,55 (д, 2Н); одержанням продукту у вигляді олії оранжевого 3,95 (т, 2Η); 6,95-7,05 (м, 2Н); 7,15-7,30 (м, 5Н); кольору (9,1г). Зазначену в заголовку сполуку (1,8г 7,70 (д, 1Н); 10,60 (шир.с, 1Н); 11,30 (с, 1Н), MC вільної основи) виділяли у формі гідрохлоридної m/z: 436 (МН+), 289. солі з тетрагідрофурану у вигляді кристалічної 2g, гідрохлорид 5-фтор-3-{1-[4-(3-оксо-3,4сполуки білого кольору (1,5г). Т. пл. 210-212°С. 1H дигідро-2Н-1,4-бензоксазин-4-іл) бутан-1 23 74830 24 іл]піперидин-4-іл}-1Н-індолу 1,35 (т, 2Н); 1,55 (т, 2Н); 1,75 (т, 2Н); 2,55 (т, 2Н); з 5-фтор-3-(піперидин-4-іл)-1Н-індолу та 4-(42,75 (с, 2Н); 2,85 (т, 2Н); 3,10 (т, 2Н); 3,35 (с, 2Н); бромбутан-1-іл)-3,4-дигідро-2Н-1,4-бензоксазин3,80 (с, 2Н); 3,90 (т, 2Н); 6,10 (с, 1Н); 6,95-7,05 (м, 3(4Н)-ону. Т. пл. 83-92°С. 1H ЯМР (ДМСО-d6): 1,602Н); 7,15 (д, 1H); 7,20-7,30 (м, 2Н); 7,40-7,45 (м, 1,70 (м, 2Н); 1,75-1,85 (м, 2Н); 2,00-2,20 (м, 4Н); 1Н); 7,55-7,60 (м, 2Н); 11,50 (с, 1Н), MC m/z: 432 2,95-3,15 (м, 5Н); 3,55 (д, 2Н); 3,95 (т, 2Н); 4,65 (с, (МН+), 245. 2Н); 6,90 (т, 1Н); 7,00-7,05 (м, 2Н); 7,05-7,15 (м, Приклад 4 1Н); 7,20 (с, 1Н); 7,25 (д, 1H); 7,30-7,40 (м, 1Н); 4, гідрохлорид 5-фтор-3-{1-[4-(2-оксо-3,47,50(д, 1Н); 10,45 (шир.с, 1Н); 11,05 (с, 1Н), MC дигідро-2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}m/z: 422 (МН+), 273. 1Н-індолу 2h, гідрохлорид 5-хлор-3-{1-[4-(3-оксо-3,4Суміш 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Ндигідро-2Н-1,4-бензоксазин-4-іл)бутан-1хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4іл]піперидин-4-іл}-1Н-індолу іл}-1Η-індолу (3,5г), етанолу (100мл), оцтової кисз 5-хлор-3-(піперидин-4-іл)-1Н-індолу та 4-(4лоти (100мл) і оксиду платини (0,4г) струшували бромбутан-1-іл)-3,4-дигідро-2Н-1,4-бензоксазинпри 3атм. протягом 16 годин. Суміш фільтрували, 3(4Н)-ону. Т. пл. 222-224°С. 1H ЯМР (ДМСО-d6): випарювали в умовах вакууму приблизно до 1,60-1,70 (м, 2Н); 1,75-1,85 (м, 2Н); 2,05-2,15 (м, 100мл, потім виливали на лід і додавали водний 4Н); 3,00-3,15 (м, 5Н); 3,55 (д, 2Н); 3,95 (т, 2Η); розчин аміаку до лужного pH. Водну фазу екстра4,65 (с, 2Н); 7,00-7,10 (м, 4Н); 7,20 (с, 1Н); 7,25 (д, гували етилацетатом і об'єднані органічні фази 1Н); 7,40 (д, 1Н); 7,75 (с, 1Н); 10,30 (шир.с, 1Н); промивали соляним розчином, висушували 11,15 (с, 1Н), MC m/z: 438 (МН+), 291, 204. (MgSO4) і концентрували в умовах вакууму. ЗалиПриклад 3 шок очищали флеш-хроматографією на силікагелі 3а, оксалат 5-фтор-3-{1-[3-(2-оксо-3,4-дигідро(елюент: етилацетат/триетиламін, 100:4) з одер2Н-хінолін-1-іл)пропан-1-іл]-3,6-дигідро-2Нжанням сирого продукту (2,0г). Зазначену в загопіридин-4-іл}-1Η-індолу ловку сполуку виділяли з етилацетату у формі Суміш 5-фтор-3-(3,6-дигідро-2Н-піридин-4-іл)гідрохлоридної солі у вигляді кристалічної сполуки 1Η-індолу (3,0г) і карбонату калію (6,2г) у бутаноні білого кольору (2,0г). Т. пл. 212-213°С. 1H ЯМР (250мл) нагрівали до температури кипіння зі зво(ДМСО-d6): 1,55-1,65 (м, 2Н); 1,75-1,85 (м, 2Н); ротним холодильником, після чого додавали 1-(32,00-2,20 (м, 4Н); 2,55 (т, 2Н); 2,85 (т, 2Н); 2,95бромпропан-1-іл)-3,4-дигідрохінолін-2(1Н)-он (5,0г) 3,15 (м, 5Н); 3,55 (д, 2Н); 3,95 (т, 2Н); 6,90 (т, 1Н); у бутаноні (50мл). Одержану суміш кип'ятили зі 7,00 (т, 1Н); 7,15-7,30 (м, 4Н); 7,30-7,40 (м, 1Н); зворотним холодильником протягом 10 годин, фі7,50 (д, 1H); 10,55 (шир.с, 1H); 11,05 (с, 1Н), MC льтрували та концентрували в умовах вакууму m/z: 420 (МН+), 273, 202. (7,7г). Залишок очищали флеш-хроматографією на Приклад 5 силікагелі (елюент: етилацетат/триетиламін, 5а, оксалат 5-фтор-1-метил-3-{1-[3-(2-оксо-3,4100:5) з одержанням сирого продукту, який крисдигідро-2H-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}талізували із суміші тетрагідрофуран/етилацетат. 1Н-індолу Зазначену в заголовку сполуку виділяли із ацетоСуспензію гідриду натрію (0,5г, 60% у мінерану/тетрагідрофурану у формі оксалатної солі у льній олії) і диметилформаміду (60мл) витримувавигляді кристалічної сполуки жовтуватого кольору ли при 22-24°С, після чого додавали розчин 5(1,7г). Т. пл. 203-206°С. 1H ЯМР (ДМСО-d6): 1,95фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін-12,05 (м, 2Н); 2,55 (т, 2Η); 2,75 (с, 2Н); 2,85 (т, 2Η); іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу (4,9г) у 3,15 (т, 2Η); 3,35 (с, 2Н); 3,80 (с, 2Н); 3,95 (т, 2Η); диметилформаміді (50мл). Одержану суміш пере6,05 (с, 1Н); 6,95-7,05 (м, 2Н); 7,15-7,30 (м, 3Н); мішували при кімнатній температурі протягом 25 7,35-7,45 (м, 1Н); 7,50-7,60 (м, 2Н); 11,50 (с, 1Н), хвилин, після чого додавали розчин метилйодиду MC m/z: 404 (МН+), 218. (2,0г) у диметилформаміді (15мл) при температурі Наступні сполуки одержували аналогічним 22-27°С. Одержану суміш перемішували при 22°С способом: протягом 1 години та виливали на лід. Водну фазу 3b, гідрохлорид 5-фтор-3-{1-[4-(2-оксо-3.4екстрагували етилацетатом і об'єднані органічні дигідро-2Н-хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Нфази промивали соляним розчином, висушували піридин-4-іл}-1H-індолу (MgSO4) і концентрували в умовах вакууму. Сирий з 5-фтор-3-(3,6-дигідро-2Н-піридин-4-іл)-1Нпродукт очищали флеш-хроматографією на силііндолу та 1-(4-бромбутан-1-іл)-3,4-дигідрохінолінкагелі (елюент: етилацетат/гептан/триетиламін, 2(1Н)-ону. Т. пл. 124-125°С. 1H ЯМР (ДМСО-d6): 50:50:5) з одержанням продукту у вигляді олії ора1,55-1,65 (м, 2Н); 1,80 (к, 2Н); 2,55 (т, 2Н); 2,75 (д, нжевого кольору (2,4г). Зазначену в заголовку 1Н); 2,85-2,95 (м, 3Н); 3,15-3,30 (м, 3Н); 3,55-3,65 сполуку виділяли з ацетону у формі оксалатної (м, 1H); 3,75 (д, 1Н); 3,90-4,00 (м, 3Н); 6,10 (с, 1Н); солі у вигляді кристалічної сполуки білого кольору 6,95-7,05 (м, 2Н); 7,15 (д, 1Н); 7,20-7,30 (м, 2Н); (0,6г). Т. пл. 188-189°С. 1H ЯМР (ДМСО-d6): 1,857,40-7,45 (м, 1Н); 7,55-7,65 (м, 2Н); 10,70 (шир.с, 2,05 (м, 4Н); 2,10 (д, 2Н); 2,55 (т, 2Н); 2,90 (т, 2Н); 1Н); 11,50 (с, 1Н), MC m/z: 418 (МН+), 231. 2,95-3,05 (м, 3Н); 3,10 (т, 2Н); 3,50 (д, 2Н); 3,75 (с, 3с, оксалат 5-фтор-3-{1-[5-(2-оксо-3,4-дигідро3Н); 3,95 (т, 2Н); 6,95-7,05 (м, 2Н); 7,15-7,30 (м, 2Н-хінолін-1-іл)пентан-1-іл]-3,6-дигідро-2Н4Н); 7,35-7,45 (м, 2Н), MC m/z: 420 (МН+), 188. піридин-4-іл}-1Н-індолу Наступні сполуки одержували аналогічним з 5-фтор-3-(3,6-дигідро-2Н-піридин-4-іл)-1Нспособом: індолу та 1-(5-бромпентан-1-іл)-3,4-дигідрохінолін5b, гідрохлорид 5-фтор-1-метил-3-{1-[4-(22(1Н)-ону. Т. пл. 205-207°С. 1H ЯМР (ДМСО-d6): оксо-3,4-дигідро-2Н-хінолін-1-іл) бутан-1 25 74830 26 іл]піперидин-4-іл}-1Н-індолу індолу з 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолінз 5-хлор-3-(піперидин-4-іл)-1Η-індолу та 41-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу та метилхлор-1-(3,4-дигідро-2Н-хінолін-1-іл)бутан-1-ону. Т. йодиду. Т. пл. 177-179°С. 1H ЯМР (ДМСО-d6): 1,55пл. 158-162°С. 1H ЯМР (ДМСО-d6): 1,85-1,95 (м, 1,65 (м, 2Н); 1,75-1,85 (м, 2Н); 2,00-2,15 (м, 4Н); 2Н); 1,95-2,20 (м, 6Н); 2,60-2,75 (м, 4Н); 2,95-3,15 2,55 (т, 2Н); 2,90 (т, 2Н); 2,95-3,15 (м, 5Н); 3,55 (д, (м, 5Н); 3,55 (д, 2Н); 3,70 (т, 2Н); 7,05-7,25 (м, 6Н); 2Н); 3,75 (с, 3Н); 3,95 (т, 2Н); 6,95-7,05 (м, 2Н); 7,15 7,40 (д, 1Н); 7,75 (с, 1H); 10,45 (шир.с, 1Н); 11,15(с, (д, 1Н); 7,20-7,30 (м, 3Н); 7,35-7,45 (м, 1Н); 7,55 (д, 1Н), MC m/z: 436 (МН+), 303. 1Н); 11,40 (шир.с, 1Н), MC m/z: 434 (МН+). Приклад 7 5с, оксалат 1-(бутан-1-іл)-5-фтор-3-{1-[4-(27, 5-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2оксо-3,4-дигідро-2Н-хінолін-1-іл)бутан-1-іл]-3,6іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індол дигідро-2Н-піридин-4-іл}-1Н-індолу Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу з 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін(3,0г), бутанону (200мл), тетрагідрофурану 1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н(200мл), метанолу (30мл), йодиду калію (11,4г) і індолу та бутилброміду. Т. пл. 152-154°С. 1H ЯМР триетиламіну (7,6мл) нагрівали до температури (ДМСО-d6): 0,90 (т, 3Н); 1,20-1,30 (м, 2Н); 1,55-1,65 кипіння зі зворотним холодильником, після чого (м, 2Н); 1,65-1,80 (м, 4Н); 2,55 (т, 2Н); 2,75 (с, 2Н); додавали розчин 4-хлор-1-(3,4-дигідро-1Н2,85 (т, 2Н); 3,10 (т, 2Н); 3,35 (с, 2Н); 3,80 (с, 2Н); ізохінолін-2-іл)бутан-1-ону (14,6г) у бутаноні 3,95 (т, 2Н); 4,15 (т, 2Н); 6,10 (с, 1H); 6,95-7,05 (м, (50мл). Суміш кип'ятили зі зворотним холодильни2Н); 7,15 (д, 1Н); 7,20-7,30 (м, 2Н); 7,50-7,55 (м, 1); ком протягом 2 годин, фільтрували в гарячому 7,55-7,70 (м, 2Н), MC m/z: 474 (МН+), 231. вигляді та концентрували в умовах вакууму. ЗаПриклад 6 лишок очищали флеш-хроматографією на силіка6а, оксалат 5-фтор-3-{1-[3-(3,4-дигідро-1Нгелі (елюент:етилацетат/етанол/триетиламін, ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}100:5:5) з одержанням сирого продукту. Зазначену 1Н-індолу в заголовку сполуку виділяли з етилацетату у фоСуміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу рмі вільної основи у вигляді кристалічної сполуки (3,0г), бутанону (200мл), тетрагідрофурану білого кольору (0,9г). Т. пл. 146-148°С. 1H ЯМР (100мл), метанолу (50мл) і триетиламіну (2,4мл) (ДМСО-d6): 1,55-1,70 (м, 2Н); 1,70-1,80 (м, 2Н); нагрівали до температури кипіння зі зворотним 1,85-1,95 (м, 2Н); 2,00 (κ, 2Η); 2,30 (κ, 2Η); 2,35холодильником, після чого додавали розчин 32,45 (м, 2Н); 2,60-2,70 (м, 1H); 2,75 (т, 0,8Н); 2,80хлор-1-(3,4-дигідро-1Н-ізохінолін-2-іл)пропан-1-ону 3,00 (м, 3,2Н); 3,65 (т, 2Η); 4,60 (с, 1,2Н); 4,70 (с, (3,5г) у бутаноні (60мл). Суміш кип'ятили зі зворот0,8Н); 6,85-6,95 (м, 1Н); 7,10-7,20 (м, 5Н); 7,25 (д, ним холодильником протягом 30 годин, після чого 1Н); 7,30-7,35 (м, 1Н); 10,85 (с, 1Н), MC m/z: 420 додавали додаткову кількість 3-хлор-1-(3,4(МН+), 202. дигідро-1Н-ізохінолін-2-іл)пропан-1-ону (2,0г) і триПриклад 8 етиламіну (1,6мл) у тетрагідрофурані (50мл). Оде8, 5-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2ржану суміш кип'ятили зі зворотним холодильниіл)-4-оксобутан-1-іл]птеридин-4-іл}-1Н-індол ком протягом ще 12 годин. Суміш охолоджували, Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу фільтрували та концентрували в умовах вакууму. (3,0г), бутанону (200мл) і триетиламіну (8,9мл) Залишок очищали флеш-хроматографією на силінагрівали до температури кипіння зі зворотним кагелі (елюент: етилацетат/етанол/триетиламін, холодильником, після чого додавали розчин 4100:4:4) з одержанням сирого продукту. Зазначену хлор-1-(3,4-дигідро-1Н-ізохінолін-2-іл)бутан-1-ону в заголовку сполуку виділяли з ацетону у формі (15,2г) у бутаноні (80мл). Суміш кип'ятили зі зворооксалатної солі у вигляді кристалічної сполуки бітним холодильником протягом 6 годин. Одержану лого кольору (0,75г). Т. пл. 206-209°С. 1H ЯМР суміш фільтрували та концентрували в умовах (ДМСО-d6): 1,95 (к, 2Н); 2,05-2,15 (м, 2Н); 2,80 (т, вакууму. Залишок очищали флеш-хроматографією 0,8Н); 2,90 (т, 1,2Н); 2,90-3,10 (м, 5Н); 3,30 (т, 2Н); на силікагелі (елю3,55 (д, 2Н); 3,70 (т, 2Н); 4,65 (с, 1,20Н); 4,70 (с, ент:етилацетат/етанол/триетиламін, 100:4:4) з 0,8Н); 6,85-6,95 (м, 1Н); 7,15-7,25 (м, 5Н); 7,30-7,40 одержанням сирого продукту. Зазначену в заголо(м, 1Н); 7,40 (д, 1H); 11,05 (с, 1H), MC m/z: 406 вку сполуку виділяли з ацетону у формі вільної (МН+), 231. основи у вигляді кристалічної сполуки білого коНаступні сполуки одержували аналогічним льору (0,6г). Т. пл. 172-175°С. 1H ЯМР (ДМСО-d6): способом: 1,55-1,65 (м, 2Н); 1,65-1,75 (м, 2Н); 1,90 (с, 2Н); 6b, гідрохлорид 7-хлор-3-{1-[3-(3,4-дигідро-1Н2,00 (к, 2Н); 2,30 (к, 2Н); 2,40 (к, 2Н); 2,65-2,80 (м, ізохінолін-2-іл)-3-оксопропан-1-іл]піперидин-4-іл}1,8Н); 2,80-3,00 (м, 3,2Н); 3,70 (т, 2Н); 4,60 (с, 1Н-індолу 1,2Н);4,70 (с, 0,8Н); 7,05 (д, 1H); 7,10-7,25 (м, 5Н); з 7-хлор-3-(піперидин-4-іл)-1Н-індолу та 37,35 (д, 1Н); 7,55 (с, 1Н); 11,00 (с, 1H), MC m/z: 436 бром-1-(3,4-дигідро-1Н-ізохінолін-2-іл)пропан-1(МН+), 202. ону. 1H ЯМР (ДМСО-d6): 2,05-2,25 (м, 4Н); 2,80 (т, Приклад 9 0,8Н); 2,95 (т, 1,2Н); 3,00-3,20 (м, 5H); 3,30-3,45 (м, 9а, дигідрохлорид 5-фтор-3-{1-[3-(3,4-дигідро2Η); 3,55-3,65 (м, 2Н); 3,65-3,75 (м, 2Н); 4,65 (с, 2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н1,2Н); 4,75 (с, 0,8Н); 7,00 (т, 1Н); 7,15-7,25 (м, 6Н); індолу 7,70 (д, 1Н); 10,70 (шир.с, 1Н); 11,30 (с, 1Н), MC Суспензію алюмогідриду літію (0,94г) у тетраm/z: 422 (МН+), 247. гідрофурані (40мл) перемішували при 5°С, після 6с, гідрохлорид 5-хлор-3-{1-[4-(3,4-дигідро-2Нчого додавали концентровану сірчану кислоту хінолін-1-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Η(1,2г) у тетрагідрофурані (20мл). Суміш перемішу 27 74830 28 вали при 7°С протягом 60 хвилин, після чого дода9f, дигідрохлорид 5-хлор-3-{1-[5-(3,4-дигідровали 5-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолін2Н-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}-1Н1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індол (2,0г) у індолу тетрагідрофурані (60мл). Одержану суміш переміз 5-хлор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хіноліншували при 5°С протягом 60 хвилин, після чого 1-іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу. Т. пл. 1 обробляли стандартним образом. Залишок очи101-106°С. H ЯМР (ДМСО-d6): 1,30-1,45 (м, 2Н); щали флеш-хроматографією на силікагелі (елю1,65 (с,2Н); 1,70-1,85 (м, 2Н); 1,95 (с, 2Н); 2,00-2,25 ент: етилацетат) з одержанням сирого продукту у (м, 4Н); 2,75 (с, 2Н); 2,95-3,25 (м, 5Н); 3,35 (с, 4Н); вигляді безбарвної олії. Зазначену в заголовку 3,55 (д, 2Н); 6,80 (шир.с, 1Н); 6,90-7,15 (м, 4Н); сполуку виділяли з тетрагідрофурану у формі дигі7,20 (с, 1Н); 7,35 (д, 1Н); 7,75 (с, 1Н); 10,70 (шир.с, дрохлоридної солі у вигляді кристалічної сполуки 1Н); 11,20 (с, 1Н), MC m/z: 436 (МН+), 303. білого кольору (1,0г). Т. пл. 230-236°С. 1H ЯМР 9g, дигідрохлорид 7-хлор-3-{1-[4-(3,4-дигідро(ДМСО-d6): 1,95 (т, 2Н); 2,00-2,30 (м, 4Н); 2,75 (т, 2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н2Н); 2,95-3,20 (м, 5Н); 3,30 (т, 2Η); 3,40 (т, 2Η); 3,55 індолу (д, 2Н); 6,20 (шир.с, 1Н); 6,70 (шир.с, 1Н); 6,95 (м, з 7-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін2Н); 7,00 (д, 1Н); 7,10 (т, 1Η); 7,20 (с, 1Н); 7,30-7,40 1-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу.Т. пл. (м, 1Н); 7,50 (д, 1Н); 10,95 (шир.с, 1Н); 11,05 (с, 214-219°С. 1H ЯМР (ДМСО-d6): 1,65 (с,2Н); 1,801Н), MC m/z: 392 (МН+), 259. 1,90 (м, 2Н); 1,95 (с, 2Н); 2,00-2,15 (м, 2Н); 2,15Наступні сполуки одержували аналогічним 2,30 (м, 2Н); 2,70 (с, 2Н); 2,95-3,15 (м, 5Н); 3,35 (с, способом: 4Н); 3,55 (д, 2Н); 6,70 (шир.с, 1Н); 6,85 (шир.с, 1Н); 9b, дигідрохлорид 5-фтор-3-{1-[4-(3,4-дигідро6,95-7,05 (м, 2Н); 7,10 (с, 1H); 7,15-7,25 (м, 2Н); 2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н7,70 (д, 1Н); 10,80 (шир.с, 1Н); 11,30 (с, 1H), MC індолу m/z: 422 (МН+), 289, 188. з 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін9h, дигідрохлорид 5-фтор-1-метил-3-{1-[3-(3,41-іл)бутан-1-іл]піперидин-4-іл}-1Н-індолу. Т. пл. дигідро-2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}207-212°С. 1H ЯМР (ДМСО-d6): 1,65 (с, 2Н); 1,801H-індолу 1,90 (м, 2Н); 1,95 (с, 2Н); 2,05 (д, 2Н); 2,20 (к, 2Н); з 5-фтор-1-метил-3-{1-[3-(2-оксо-3,4-дигідро2,65-2,80 (м, 2Н); 2,95-3,25 (м, 4Н); 3,15-3,25 (м, 2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Н1Н); 3,35 (с, 4Н); 3,55 (д, 2Н); 4,65 (шир.с); 5,55індолу. Т. пл. 202-206°С. 1H ЯМР (ДМСО-d6): 1,856,95 (м, 3Н); 7,00 (с, 1H); 7,10 (с, 1Н); 7,20 (с, 1Н); 1,95 (м, 2Н); 2,00-2,10 (м, 4Н); 2,10-2,25 (м, 2Н); 7,30-7,40 (м, 1Н); 7,55 (д, 1H); 11,75 (шир.с, 1Н); 2,65-2,75 (м, 2Н); 2,95-3,15 (м, 5Н); 3,25-3,35 (м, 11,05 (с, 1H), MC m/z: 406 (МН+), 274. 2Н); 3,35-3,40 (м, 2Н); 3,55 (д, 2Н); 3,75 (с, 3Н); 9с, дигідрохлорид 5-фтор-3-{1-[5-(3,4-дигідро6,65 (шир.с, 1Н); 6,80 (шир.с, 1Н); 6,90-7,10 (м, 3Н); 2Н-хінолін-1-іл)пентан-1-іл]піперидин-4-іл}-1H7,20 (с, 1Н); 7,35-7,45 (м, 1Н); 7,55 (д, 1Н); 10,90 індолу (шир.с, 1), MC m/z: 406 (MH+), 273. з 5-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін9і, оксалат 5-фтор-1-метил-3-{1-[4-(3,4-дигідро1-іл)пентан-1-іл]піперидин-4-іл}-1Н-індолу. Т. пл. 2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1H155-158°С. 1H ЯМР (ДМСО-d6): 1,30-145 (м, 2Н); індолу 1,65 (с,2Н); 1,75-1,80 (м, 2Н); 1,95 (с, 2Н); 2,20 (к, з 5-фтор-1-метил-3-{1-[4-(2-оксо-3,4-дигідро2Н); 2,75 (с, 2Н); 2,95-3,10 (м, 5Н); 3,35 (с, 4Н); 3,55 2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н(д, 2Н); 5,05 (шир.с); 6,70-7,15 (м, 4Н); 6,90 (т, 1Н); індолу. Т. пл. 123-125°С. 1H ЯМР (ДМСО-d6): 1,507,20 (с, 1H); 7,30-7,40 (м, 1H); 7,50 (д, 1Н); 10,75 1,60 (м, 2Н); 1,65-1,75 (м, 2Н); 1,80-1,90 (м, 2Н); (шир.с, 1H); 11,05 (с, 1H), MC m/z: 420 (MH+), 287. 1,90-2,00 (м, 2Н); 2,10 (д, 2Н); 2,60-2,70 (м, 2Н); 9d, дигідрохлорид 5-хлор-3-{1-[3-(3,4-дигідро2,95-3,10 (м, 5Н); 3,20-3,30 (м, 4Н); 3,50 (д, 2Н); 2Н-хінолін-1-іл)пропан-1-іл]піперидин-4-іл}-1Η3,75 (с, 3Н); 6,45 (т, 1Н); 6,60 (д, 1Н); 6,85 (д, 1Н); індолу 6,95-7,05 (м, 2Н); 7,20 (с, 1Н); 7,40-7,45 (м, 2Н), MC з 5-хлор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолінm/z: 420 (МН+), 287. 1-іл)пропан-1-іл]піперидин-4-іл}-1Н-індолу. Т. пл. 9j, дигідрохлорид 5-фтор-3-{1-[4-(3,4-дигідро201-204°С. 1H ЯМР (ДМСО-d6): 1,95 (т, 2Н); 2,002Н-1,4-бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}2,25 (м, 6Н); 2,75 (т, 2Н); 3,00-3,20 (м, 5Н); 3,30 (т, 1Н-індолу 2Н); 3,40 (т, 2Н); 3,55 (д, 2Н); 6,40 (шир.с); 6,65 (с, з 5-фтор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,41H); 6,85 (с, 1Н); 6,95 (д, 1Н); 7,00-7,10 (м, 2Н); бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Н7,20 (с, 1Н); 7,40 (д, 1Н); 7,75 (с, 1Н); 10,85 (шир.с, індолу. Т. пл. 179-186°С. 1H ЯМР (ДМСО-d6): 1,551Н); 11,20 (с, 1Н), MC m/z: 408 (МН+), 275. 1,65 (м, 2Н); 1,75-1,90 (м, 2Н); 2,00-2,10 (м, 2Н); 9е, дигідрохлорид 5-хлор-3-{1-[4-(3,4-дигідро2,15-2,25 (м, 2Н); 2,95-3,25 (м, 5Н); 3,25-3,40 (м, 2Н-хінолін-1-іл)бутан-1-іл]піперидин-4-іл}-1Н4Н); 3,55 (д, 2Н); 4,15-4,25 (м, 2Н); 6,55 (т, 1Н); індолу 6,65 (д, 1Н); 6,70-6,80 (м, 2Н); 6,90 (т, 1Η); 7,20 (с, з 5-хлор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолін1Н); 7,30-7,40 (м, 1Н);7,55(д, 1Н); 10,80 (шир.с, 1-іл)бутан-1-іл]піперидин-4-іл}-1H-індолу. Т. пл. 1Н); 11,05 (с, 1Н), MC m/z: 408 (МН+),273, 190. 1 140-145°С. H ЯМР(ДМСО-d6): 1,65 (с,2Н); 1,809k, дигідрохлорид 5-хлор-3-{1-[4-(3,4-дигідро1,90 (м, 2Н); 1,95 (с, 2Н); 2,00-2,25 (м, 4Н); 2,75 (с, 2Н-1,4-бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}2Н); 2,95-3,25 (м, 5Н); 3,35 (с, 4Н); 3,55 (д, 2Н); 1Н-індолу 6,75 (шир.с, 1Н); 6,90 (шир.с, 1Н); 7,00 (с, 1Н); з 5-хлор-3-{1-[4-(3-оксо-3,4-дигідро-2Н-1,47,05-7,15 (м, 2Н); 7,20 (с, 1Н); 7,40 (д, 1Н); 7,80 (с, бензоксазин-4-іл)бутан-1-іл]піперидин-4-іл}-1Н1Н); 10,70 (шир.с, 1H); 11,20 (с, 1H), MC m/z: 422 індолу. Т. пл. 186-190°С. 1H ЯМР (ДМСО-d6): 1,55(МН+), 289, 188. 1,65 (м, 2Н); 1,70-1,85 (м, 2Н); 2,00-2,20 (м, 4Н); 29 74830 30 2,95-3,25 (м, 5Н); 3,25-3,40 (м, 4Н); 3,55 (д, 2Н); кондиційовану іонообмінну колонку (500мг SCX4,15-4,20 (м, 2Н); 6,55 (т, 1H); 6,65 (д, 1Н); 6,70колонка, продається компанією Analytical 6,80 (м, 2Н); 7,05 (д, 1H); 7,20 (с, 1Н); 7,40 (д, Instruments, № партії 1210-2040), промивали аце1Н);7,75(с, 1Н); 10,50 (шир.с, 1Н); 11,15 (с, 1Н), MC тонітрилом (1мл) і метанолом (1мл). Продукт m/z: 424 (МН+), 289, 190. елюювали 4Μ розчином аміаку в метанолі. Після 9l, дигідрохлорид 5-фтор-3-{1-[3-(3,4-дигідровипарювання летких розчинників сирий продукт 2Н-хінолін-1-іл)пропан-1-іл]-3,6-дигідро-2Ночищали за допомогою препаративної ВЕРХ хропіридин-4-іл}-1Н-індолу матографії з оберненою фазою. Одержаний розз 5-фтор-3-{1-[3-(2-оксо-3,4-дигідро-2Н-хінолінчин потім завантажували в попередньо кондиційо1-іл)пропан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Нвану іонообмінну колонку, промивали індолу. Т. пл. 220-223°С. 1H ЯМР (ДМСО-d6): 1,85ацетонітрилом (1мл) і метанолом (1мл). Продукт 2,00 (м, 2Н); 2,05-2,10 (м, 2Н); 2,70-2,80 (м, 4Н); елюювали 4Μ розчином аміаку в метанолі. Після 2,90-3,00 (м, 1Н); 3,15-3,30 (м, 2Н); 3,30-3,35 (м, випарювання летких розчинників одержували за2Н); 3,40 (т, 2Н); 3,55-3,65 (м, 1Н); 3,70-3,80 (м, значену в заголовку сполуку у вигляді олії жовтого 1Н); 4,00 (д, 1Н); 6,10 (с, 1H); 6,70 (шир.с, 1Н); 6,90 кольору (5мг, 12мкмоль). РХ/МС (m/z) 406 (МН+), (шир.с, 1Н); 6,95-7,05 (м, 2Н); 7,05-7,10 (м, 1Н); RT=3,61, чистота: 66%. 7,40-7,45 (м, 1H); 7,55-7,65 (м, 2Н); 11,10 (шир.с, Наступні сполуки одержували аналогічним 1Н); 11,60 (с, 1Н), MC m/z: 390 (МН+), 203, 146. способом (10b-10m) або з використанням 3,49m, дигідрохлорид 5-фтор-3-{1-[4-(3,4-дигідродигідро-2Н-хіноліну (10n-10z): 2Н-хінолін-1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин10b, 4-фтор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін4-іл}-1H-індолу 2-іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індол з 5-фтор-3-{1-[4-(2-оксо-3,4-дигідро-2Н-хінолінРХ/МС (m/z) 420 (МН+), RT=3,69, чистота: 1-іл)бутан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н93%. індолу. Т. пл. 198-200°С. 1H ЯМР (ДМСО-d6): 1,6010с, 4-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін1,75 (м, 2Н); 1,80-1,90 (м, 2Н); 1,95 (с, 2Н); 2,702-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індол 2,80 (м, 4Н); 2,85-3,00 (м, 1H); 3,15-3,30 (м, 4Н); РХ/МС (m/z) 448 (МН+), RT=3,81, чистота: 3,30-3,40 (м, 2H); 3,55-3,65 (м, 1Η); 3,70-3,80 (м, 97%. 1Н); 3,95 (д, 1Н); 6,10 (с, 1Н); 6,80 (шир.с, 1Н); 10d, 4-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-26,90-7,20 (м, 3Н); 7,00 (т, 1Η); 7,40-7,45 (м, 1Н); іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індол 7,55-7,65 (м, 2Н); 10,95 (шир.с, 1Н); 11,55 (с, 1Н), РХ/МС (m/z) 436 (МН+), RT=3,86, чистота: MC m/z: 404 (МН+), 271, 217. 97%. 9n, дигідрохлорид 5-фтор-3-{1-[5-(3,4-дигідро10е, 4-хлор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін-22Н-хінолін-1-іл)пентан-1-іл]-3,6-дигідро-2Ніл)-5-оксопентан-1-іл]піперидин-4-іл}-1Н-індол піридин-4-іл}-1H-індолу РХ/МС (m/z) 450 (МН+), RT=3,87, чистота: з 5-фтор-3-{1-[5-(2-оксо-3,4-дигідро-2Н-хінолін81%. 1-іл)пентан-1-іл]-3,6-дигідро-2Н-піридин-4-іл}-1Н10f, 4-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолін-2індолу. Т. пл. 167-169°С. 1H ЯМР (ДМСО-d6): 1,30іл)-6-оксогексан-1-іл]піперидин-4-іл}-1H-індол 1,45 (м, 2Н); 1,70 (с, 2Н); 1,75-1,90 (м, 2Н); 2,00 (с, РХ/МС (m/z) 464 (МН+), RT=3,97, чистота: 2Н); 2,70-2,85 (м, 3Н); 2,85-3,00 (м, 1Н); 3,05-3,20 86%. (м, 2Н); 3,20-3,30 (м, 1H); 3,35 (с, 2Н); 3,55-3,65 (м, 10g, 5-фтор-3-{1-[5-(3,4-дигідро-1Н-ізохінолін1Н); 3,70-3,80 (м, 1Н); 3,95 (д, 1Н); 6,10 (с, 1Н); 2-іл)-5-оксопентан-1-іл]піперидин-4-іл}-1H-індол 6,80-7,25 (м, 4Н); 7,00 (т, 1Н); 7,40-7,45 (м, 1Н); РХ/МС (m/z) 434 (МН+), RT=3,67, чистота: 7,55-7,65 (м, 2Н); 11,00 (с, шир.с, 1Н); 11,60 (с, 1Н), 93%. MC m/z: 418 (МН+), 231, 188. 10h, 5-фтор-3-{1-[6-(3,4-дигідро-1Н-ізохінолінПриклад 10 2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1H-індол 10а, 4-фтор-3-{1-[3-(3,4-дигідро-1Н-ізохінолінРХ/МС (m/z) 448 (МН+), RT=3,79, чистота: 2-іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індол 89%. 3-[1-(4-фтор-1Н-індол-3-іл)піперидин-110i, 6-хлор-3-{1-[3-(3,4-дигідро-1Н-ізохінолін-2іл)пропіонову кислоту, зв'язану з полімером (0,1г, іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індол 0,08ммоль), і сухий дихлорометан (1мл) переміРХ/МС (m/z) 422 (МН+), RT=3,80, чистота: шували в хімічній пробірці. Суміш охолоджували 85%. до 0°С й обробляли протягом 2 годин 2Μ розчи10j. 6-хлор-3-{1-[6-(3,4-дигідро-1H-ізохінолін-2ном тіонілхлориду (0,4мл, 0,8ммоль) у дихлоромеіл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індол тані. Смолу відфільтровували та промивали сухим РХ/МС (m/z) 464 (МН+), RT=3,98, чистота: 87%. дихлорометаном (3 1мл), ресуспендували в дих10k, 7-хлор-3-{1-[4-(3,4-дигідро-1Н-ізохінолін-2лорометані (1мл) та обробляли при кімнатній теміл)-4-оксо6утан-1-іл]піперидин-4-іл}-1Н-індол пературі протягом 3 годин 3,4-дигідро-1НРХ/МС (m/z) 436 (МН+), RT=3,85, чистота: ізохіноліном (0,05г, 0,4ммоль). Смолу відфільтро98%. вували та промивали дихлорометаном (3 1мл), 10l, 7-хлор-З- {1-[5- (3.4-дигідро-і Н-ізохінолін1:1 сумішшю дихлорометан:триетиламін (3 1мл) і 2-іл) -5-оксопентан-1-іл]піперидин-4-іл}-1Н-індол сухим дихлорометаном (3 1мл). Смолу обробляли РХ/МС (m/z) 450 (МН+), RT=3,85, чистота: протягом 1 години 1мл суміші метоксиду натрію 96%. (2мл, 5N розчин метоксиду натрію в метанолі), 10m, 7-хлор-3-{1-[6-(3,4-дигідро-1Н-ізохінолінметанолу (50мл) і тетрагідрофурану (50мл). Після 2-іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індол фільтрування смолу промивали метанолом (1мл). PX/MC (m/z) 464 (МН+), RT=3,96, чистота: Об'єднані фільтрати завантажували в попередньо 31 74830 32 97%. протягом 2 годин і розчинник видаляли в умовах 10n, 4-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1вакууму. Залишок розчиняли в етилацетаті й оргаіл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індол нічну фазу промивали холодним 2N водним розPX/MC (m/z) 406 (МН+), RT=3,67, чистота: чином гідрохлориду і соляним розчином. Органічну 82%. фазу висушували (MgSO4), фільтрували та конце10ο, 4-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1нтрували в умовах вакууму (6,4г). Залишок (1,5г) і іл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індол 3,4-дигідро-1Н-ізохінолін (0,63г) розчиняли в суміPX/MC (m/z) 420 (МН+), RT=3,78, чистота: ші ацетонітрилу (25мл) і диметилформаміду 84%. (10мл) й одержану суміш охолоджували (5°С), а 10р, 4-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1потім додавали 1,3-дициклогексилкарбодіімід іл)-3-оксопропан-1-іл]піперидин-4-іл}-1H-індол (1,0г). Суміш перемішували при кімнатній темпеPX/MC (m/z) 422 (МН+), RT=3,85, чистота: ратурі протягом 16 годин, фільтрували та вилива97%. ли в соляний розчин. Водну фазу екстрагували 10g, 4-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1етилацетатом та тетрагідрофураном, а об'єднану іл)-4-оксобутан-1-іл]піперидин-4-іл}-1H-індол органічну фазу промивали соляним розчином, PX/MC (m/z) 436 (МН+), RT=3,97, чистота: висушували (MgSO4) і концентрували в умовах 92%. вакууму. Залишок очищали флеш-хроматографією 10r, 5-фтор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1на силікагелі (елюент: етилацетат) з одержанням іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індол твердої речовини білого кольору (1,0г), яку потім PX/MC (m/z) 406 (МН+), RT=3,63, чистота: додавали до суміші алану в тетрагідрофурані 97%. (100мл) при 5-10°С. Алан одержували з алюмогід10s. 5-фтор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1риду літію (0,55г) і концентрованої сірчаної кислоіл)-4-оксобутан-1-іл]піперидин-4-іл}-1Н-індол ти (0,72г). Суміш гасили додаванням води (1мл), PX/MC (m/z) 420 (МН+), RT=3,73, чистота: 15% водного розчину гідроксиду натрію (0,5мл) і 96%. води (2,5мл) і одержану суміш висушували 10t, 5-фтор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1(MgSO4), фільтрували та концентрували в умовах іл)-5-оксопентан-1-іл]піперидин-4-іл}-1H-індол вакууму. Зазначену в заголовку сполуку кристаліPX/MC (m/z) 434 (МН+), RT=3,76, чистота: зували з ацетону у формі діоксалатної солі (0,8г). 97%. Т. пл. 105-111°С. 1H ЯМР (ДМСО-d6): 1,75 (с, 4Н); 10u, 5-фтор-3-{1-[6-(3,4-дигідро-2Н-хінолін-11,85-2,05 (м, 2Н); 2,10 (д, 2Н); 2,90-3,20 (м, 9Н); іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індол 3,25 (т, 2Н); 3,50 (д, 2Н); 4,15 (с, 2Н); 6,85-6,95 (м, PX/MC (m/z) 448 (МН+), RT=3,88, чистота: 1Н); 7,10-7,25 (м, 5Н); 7,30-7,45 (м, 2Н); 11,05 (с, 97%. 1Н), MC m/z: 406 (МН+), 273, 188. 10v, 6-хлор-3-{1-[3-(3,4-дигідро-2Н-хінолін-1Наступну сполуку одержували аналогічним іл)-3-оксопропан-1-іл]піперидин-4-іл}-1Н-індол способом: PX/MC (m/z) 422 (МН+), RT=3,88, чистота: 11b, діоксалат 5-фтор-3-{1-[4-(6,7-диметокси90%. 3,4-дигідро-1H-ізохінолін-2-іл)бутан-1-іл]піперидин10w, 6-хлор-3-{1-[6-(3,4-дигідро-2Н-хінолін-14-іл}-1Н-індолу іл)-6-оксогексан-1-іл]піперидин-4-іл}-1Н-індол з 5-фтор-3-(піперидин-4-іл)-1Н-індолу та 6,7PX/MC (m/z) 464 (МН+), RT=4,09, чистота: диметокси-3,4-дигідро-1Н-ізохіноліну. Т. пл. 9896%. 105°С. 1H ЯМР (ДМСО-d6): 1,75 (с, 4Н); 1,85-2,00 10х, 7-хлор-3-{1-[4-(3,4-дигідро-2Н-хінолін-1(м, 2Н); 2,10 (д, 2Н); 2,90-3,15 (м, 9Н); 3,30 (с, 2Н); іл)-4-оксобутан-1-іл]піперидин-4-іл}-1H-індол 3,50 (д, 2Н); 3,75 (д, 6Н); 4,10 (с, 2Н); 6,75 (с, 1Н); PX/MC (m/z) 436 (МН+), RT=3,91, чистота: 6,80 (с, 1Н); 6,90-6,95 (м, 1Н); 7,20 (с, 1H); 7,3098%. 7,45 (м, 2Н); 11,05 (с, 1Н), MC m/z: 466 (МН+), 273, 10у. 7-хлор-3-{1-[5-(3,4-дигідро-2Н-хінолін-1248. іл)-5-оксопентан-1-іл]піперидин-4-іл}-1H-індол Фармакологічні тестування PX/MC (m/z) 450 (МН+), RT=3,93, чистота: Сполуки цього винаходу випробували за доб96%. ре відомими і відтворними способами. Тести були 10z, 7-хлор-3-{1-[6-(3,4-дигідро-2Η-хінолін-1наступними. іл)-6-оксогексан-1-іл]піперидин-4-іл}-1H-індол Інгібування зв'язування [3H]YM-09151-2 з D4PX/MC (m/z) 464 (МН+), RT=4,05, чистота: дофаміновими рецепторами людини 97%. За допомогою цього методу в умовах in vitro Приклад 11 визначають інгібування лікарськими засобами 11а, діоксалат 5-фтор-3-{1-[4-(3,4-дигідро-1Нзв'язування [3Н]YM-09151-2 (0,06нМ) з мембранізохінолін-2-іл)бутан-1-іл]піперидин-4-іл}-1H-індолу ними клонованих D4,2-дофамінових рецепторів Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу людини, експресованих у СНО-клітинах. Модифі(5,0г), триетиламіну (6,35мл) і тетрагідрофурану кований метод від NEN Life Science Products, Inc., (500мл) охолоджували до 7°С, а потім додавали сертифікат технічних даних РС2533-10/96. суміш бурштинового ангідриду (2,5г) у тетрагідроУ таблиці 1, нижче, представлені резульфурані (50мл). Суміш перемішували при 8-10°С тати тестів: 33 Сполука № 1а 1b 1с 2а 2b 2с 2d 2е 2f 2g 2h Зв'язування з D4 92% 97% 95% 0,58 12 0,69 8,0 12 78% 7,5 10 74830 Сполука № 3а 3b 3с 4 9l 9m 9n 10а 10b 10с 10d Таблиця 1: Дані зв'язування (значення IC50 у нМ або % інгібування зв'язування при 50нМ) (nt. означає "не випробувався") Сполуки за цим винаходом, як було встановлено, сильно інгібують зв'язування тритійованого YM-09151-2 з D4-дофаміновими рецепторами. Сполуки також оцінювали у функціональному тесті, описаному Gazi et al. в Br. J. Pharmcol, 1999,128, 613-620. В цьому тесті було показано, що сполуки є частковими агоністами або антагоністами D4-дофамінових рецепторів. Сполуки за цим винаходом також випробували в наступних тестах: Інгібування зв'язування [3Н]спіперону з D2рецепторами Сполуки за цим винаходом вивчали на предмет спорідненості у відношенні D2-дофамінового рецептора за допомогою визначення їхньої здатності інгібувати зв'язування [3Н]спіперону з D2рецепторами, за способом, описаним Hyttel et al. J. Neurochem. 1985, 44, 1615. Інгібування зв'язування [3Н]спіперону з D3рецепторами За допомогою даного способу визначали in vitro інгібування лікарськими засобами зв'язування [3Н]спіперону (0,3нМ) з мембранами клонованих D3-дофамінових рецепторів людини, експресованих у СНО-клітинах. Спосіб модифікований за MacKenzie et al. Eur. J. Pharm.-Mol. Pharm. Sec. 1994, 266, 79-85. Інгібування захоплення [3Н]серотоніну синаптосомами інтактного головного мозку щура Сполуки випробували на предмет їх інігбуючего ефекту стосовно зворотного захоплення 5-НТ, за допомогою вимірювання їх здатності інгібувати захоплення [3Н]серотоніну синаптосомами інтактного головного мозку щура в умовах in vitro. Даний аналіз виконували, як описано Hyttel у Psychopharmacology 1978, 60, 13. Інгібування зв'язування [3Н]-кетансерину з 5НТ2А-рецепторами Сполуки оцінювали у відношенні їх афінності до 5-НТ2А-рецепторів за допомогою визначення їхньої здатності інгібувати зв'язування [3Н]кетансерину (0,50нМ) з мембранами мозку (кори) щура in vitro. Метод описаний у Sanchez et al. Drug Dev. Res. 1991, 22, 239-250. Ефективність у відношенні 5-НТ2C-рецепторів за результатами флюорометрії Сполуки вивчали на предмет їх ефективності у відношенні клітин СНО, експресуючих 5-НТ2C Зв'язування з D4 0,71 5,0 15 4,8 0,51 17 53 93% 81% 21% 86% 34 Сполука № 10е 10f 10g 10h 10І 10j 10k 10l 10m Зв'язування з D4 25% 17% 65% 50% 94% 70% 95% 82% 69% рецептори, з використанням аналізу за допомогою флюорометричного візуального планшет-ридера (FLIPR). Це дослідження виконували згідно з інструкцією Molecular Devices Inc. для їх FLIPR Calcium Assay Kit і з модифікацією за Porter et al. British Journal of Pharmacology 1999, 128:13. Було встановлено, що ці сполуки мають несуттєву або дуже слабку спорідненість у відношенні D2-дофамінового рецептора. Було встановлено, що багато сполук інгібують зв'язування [3Н]спіперону з D3-дофаміновим рецептором, деякі зі сполук інгібують зворотне захоплення серотоніну, і деякі зі сполук являють собою ліганди 5-НТ2А-рецепторів та/або ліганди 5-НТ2Cрецепторів. Як згадувалося вище, сполуки за цим винаходом добре розчиняються у воді в порівнянні з родинними сполуками, описаними в WO 98/28293. Відповідно, як очікується, дані сполуки будуть мати поліпшену біологічну придатність. Таким чином, сполуки за цим винаходом вважаються придатними для лікування позитивних і негативних симптомів шизофренії, інших психозів, тривожних розладів, таких як генералізований тривожний розлад, панічний розлад і обсесивнокомпульсивний розлад, депресії, побічних ефектів, індукованих звичайними антипсихотичними агентами, мігрені, ADHD, а також для поліпшення сну. Зокрема, сполуки за цим винаходом вважаються придатними для лікування позитивних і негативних симптомів шизофренії без розвитку екстрапірамідних побічних ефектів. Приклади фармацевтичних форм Фармацевтичні препарати за цим винаходом можна одержати за способами, звичайно застосовуваними в цій галузі. Наприклад, таблетки можна одержати, змішуючи активний інгредієнт зі звичайними ад'ювантами та/або розріджувачами, з наступним пресуванням суміші в звичайній таблетувальній машині. Приклади ад'ювантів або розріджувачів включають: кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камеді й подібні речовини. Можна використовувати будь-які інші ад'юванти або добавки, які звичайно застосовують для таких цілей, такі як барвники, ароматизатори, консерванти тощо, за умови, що вони сумісні з активними інгредієнтами. Розчини для ін'єкцій можна одержати, розчиняючи активний інгредієнт і можливідобавки в частині розчинника для ін'єкцій, переважно в сте 35 74830 рильній воді, після чого розчин доводять до необхідного об'єму, стерилізують і вводять у ампули або пляшечки. Можна використовувати будь-які прийнятні добавки, які звичайно застосовуються в цій галузі, такі як засоби для досягнення ізотонічності, консерванти, антиоксиданти тощо. Типові приклади прописів для складів за цим винаходом є наступними. 1) Таблетки, що містять 5,0мг сполуки за цим винаходом в перерахунку на вільну основу: Сполука 5,0мг Лактоза 60мг Кукурудзяний крохмаль 30мг Гідроксипропілцелюлоза 2,4мг Мікрокристалічна целюлоза 19,2мг Натрієва сіль кроскармелози типу А 2,4мг Стеарат магнію 0,84мг 2) Таблетки, що містять 0,5мг сполуки за цим винаходом в перерахунку на вільну основу: Сполука 0,5мг Лактоза 46,9мг Кукурудзяний крохмаль 23,5мг Комп’ютерна верстка Л. Купенко 36 Повідон 1,8мг Мікрокристалічна целюлоза 14,4мг Натрієва сіль кроскармелози типу А 1,8мг Стеарат магнію 0,63мг 3) Сироп, який містить у мілілітрі: Сполука 25мг Сорбіт 500мг Гідроксипропілцелюлоза 15мг Гліцерин 50мг Метилпарабен 1мг Пропілпарабен 0,1мг Етанол 0,005мл Ароматизатор 0,05мг Натрієва сіль сахарину 0,5мг Вода до 1мл 4) Розчин для ін'єкцій, що містить у мілілітрі: Сполука 0,5мг Сорбіт 5,1мг Оцтова кислота 0,05мг Натрієва сіль сахарину 0,5мг Вода до 1мл Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivatives being useful for the treatment of cns disorders, a pharmaceutical composition and a method for the treatment of diseases
Автори англійськоюBang-Andersen Benny, Felding Jakob, Kehler, Jan
Назва патенту російськоюПроизводные индола, которые полезны для лечения расстройств цнс, фармацевтическая композиция и способ лечения заболеваний
Автори російськоюБанг- Андерсен Бенни, Фелдинг Якоб
МПК / Мітки
МПК: A61K 31/538, A61P 25/28, A61P 25/20, C07D 401/14, A61K 31/4709, A61P 25/18, C07D 413/14, A61K 31/4725, A61P 25/24, A61P 25/06, A61P 25/16, A61P 25/22
Мітки: індолу, похідні, композиція, спосіб, лікування, розладів, корисні, захворювань, цнс, фармацевтична
Код посилання
<a href="https://ua.patents.su/18-74830-pokhidni-indolu-shho-korisni-dlya-likuvannya-rozladiv-cns-farmacevtichna-kompoziciya-ta-sposib-likuvannya-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу, що корисні для лікування розладів цнс, фармацевтична композиція та спосіб лікування захворювань</a>
Попередній патент: Спосіб і пристрій для визначення місця пошкодження кабелю у вигляді однофазного замикання жили на оболонку
Наступний патент: Фенілзаміщені похідні 5,6-дигідропірону як пестициди і гербіциди, агент на їх основі та проміжна сполука
Випадковий патент: Спосіб діагностики розвитку атеросклерозу












