Похідні індолу, що корисні для лікування розладів цнс, фармацевтична композиція та спосіб лікування
Номер патенту: 73995
Опубліковано: 17.10.2005
Автори: Фелдінг Якоб, Сміт Гаррік Пол, Андерсен Кім, Банг-Андерсен Бенні
Формула / Реферат
1. Похідні заміщеного індолу формули
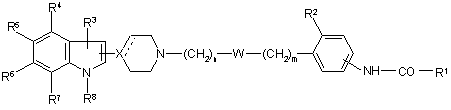 , (1)
, (1)
де R1 являє собою водень або С1-6-алкіл, С2-6-алкеніл, С2-6-алкініл, С3-8-циклоалкіл або С3-8-циклоалкіл-С1-6-алкіл, які можуть бути заміщеними одним або більше замісниками, вибраними з галогену, ціано, нітро, аміно, гідроксигрупи, тіольної групи, С1-6-алкокси, С1-6-алкілтіогрупи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу, або R1 являє собою арил, арил-С1-6-алкіл, гетероарил, гетероарил-С1-6-алкіл, де арильна або гетероарильна групи можуть бути заміщеними одним або більше замісниками, вибраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу, або R1 являє собою -NR'R", де R' і R" є незалежно вибраними з водню і С1-6-алкілу, арилу, арил-С1-6-алкілу, гетероарилу і гетероарил-С1-6-алкілу, які можуть бути заміщеними одним або більше замісниками, вибраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу, або R1 являє собою насичений або частково насичений 5-6-членний цикл, який містить один, два або три гетероатоми, вибрані з О, S і групи N-R9, де R9 являє собою водень або С1-6-алкіл, необов'язково заміщений замісниками, вибраними з галогену, ціано, нітро, аміногрупи, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу;
W являє собою зв'язок або О, S, CO, CS, SO або SО2-групу;
n дорівнює 0-6, m дорівнює 0-6 і n+m дорівнює 0-6; за умови, що, коли W являє собою О або S, тоді ![]() , а коли W являє собою CO, CS, SO або SО2, тоді
, а коли W являє собою CO, CS, SO або SО2, тоді ![]() ;
;
Х являє собою С, СН або N, а пунктирна лінія, що відходить від X, являє собою зв'язок, коли Х являє собою С, і не є зв'язком, коли Х являє собою N або СН;
R2 являє собою С1-6-алкіл;
R3-R7 є вибраними з водню, галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С2-6-алкенілу, С2-6-алкінілу, С3-8-циклоалкілу, С3-8-циклоалкіл-С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу;
R8 являє собою водень, С1-6-алкіл, С2-6-алкеніл, С2-6-алкініл, С3-8-циклоалкіл, С3-8-циклоалкіл-С1-6-алкіл, арил, арил-С1-6-алкіл, ацил, тіоацил, С1-6-алкілсульфоніл, трифторметилсульфоніл або арилсульфоніл, або їх фармацевтично прийнятні кислотно-адитивні солі.
2. Сполука за п. 1, де індол є зв'язаним з Х по 3 положенню індолу.
3. Сполука за пп. 1-2, де W являє собою зв'язок.
4. Сполука за п. 3, де n+m дорівнює 2.
5. Сполука за пп. 1-4, де R2 являє собою метильну групу.
6. Сполука за пп. 1 або 5, де група -NH-CO-R1 є приєднаною до фенільної групи в пара-положенні стосовно положення групи R2.
7. Сполука за пп. 1 або 6, де R1 являє собою С1-6-алкіл, С3-8-циклоалкіл, С3-8-циклоалкіл-С1-6-алкіл, феніл, феніл-С1-6-алкіл, фураніл, тієніл, піридил, піроліл, піримідил, де фенільні групи можуть бути заміщеними одним або більше замісниками, вибраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу; або R1 являє собою -NR'R", де один з R' і R" являє собою водень, а інший з R' і R" є вибраним із С1-6-алкілу, фенілу і феніл-С1-6-алкілу, де фенільні групи можуть бути заміщеними одним або більше замісниками, вибраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, трифторметилу, трифторметилсульфонілу і С1-6-алкілсульфонілу; або R1 являє собою тетрагідропіранільну, морфоліно, тіоморфоліно, піперидино, піперазино або N-(гідроксі-С1-6-алкіл)піперазинільну групу.
8. Сполука за п. 1, яка є вибраною з:
3-(1-{2-[5-(ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[5-(циклобутилметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(3-метоксибензоїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індолу;
3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(півалоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(3-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(3-фенілпропаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[2-метил-5-(3-метил-3-фенілуреїдо)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[5-(3-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-[1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-6-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу;
3-[1-(2-{5-[(циклопентилметаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-6-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(морфолін-4-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-[1-(2-{5-[3-(4-фторфеніл)уреїдо]-2-метилфеніл}етил)піперидин-4-іл]-5-фтор-1Н-індолу;
3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(тетрагідропіран-4-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-(1-{2-[5-(4-хлорбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-(1-{2-[5-(3-циклогексилпропаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу;
3-[1-(2-{5-[(3-фенілпропаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{5-[(2-фенілетаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-[1-(2-{5-[2-(4-фторфеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{5-[(циклобутилметаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-(1-{2-[5-(бензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-(1-{2-[5-(4-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(піридин-4-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(тіофен-2-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(тіофен-3-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(1-[1,2,3]тіадіазол-5-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу;
3-{1-[2-(5-ацетиламіно-2-метилфеніл)етил]-3,6-дигідро-2Н-піридин-4-іл}-5-фтор-1Н-індолу;
3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-5-фтор-1Н-індолу;
3-[1-(2-{5-[(4-фторфенілметаноїл)аміно]-2-метилфеніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-5-фтор-1Н-індолу;
3-{1-[2-(5-ацетиламіно-2-метилфеніл)етил]-3,6-дигідро-2Н-піридин-4-іл}-7-хлор-1Н-індолу;
3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-7-хлор-1Н-індолу і
3-[1-(2-{5-[(4-фторфенілметаноїл)аміно]-2-метилфеніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-7-хлор-1Н-індолу або їх фармацевтично прийнятних солей.
9. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку за будь-яким з пп. 1-8 у терапевтично ефективній кількості разом з одним або більше фармацевтично прийнятними носіями або розріджувачами.
10. Застосування сполуки за будь-яким з пп. 1-8 для виробництва медикаменту, придатного для лікування позитивних і негативних симптомів шизофренії, інших психозів, розладів, пов'язаних із тривожним станом, таких як стан генералізованої тривоги, панічний розлад й обсесивно-компульсивний розлад, депресії, агресії, побічних ефектів, викликаних звичайними антипсихотичними агентами, мігрені, когнітивних розладів, ADHD, а також для поліпшення сну.
11. Спосіб лікування позитивних і негативних симптомів шизофренії, інших психозів, розладів, пов'язаних із тривожним станом, таких як стан генералізованої тривоги, панічний розлад і обсесивно-компульсивний розлад, депресії, агресії, побічних ефектів, викликаних звичайними антипсихотичними агентами, мігрені, когнітивних розладів, ADHD, а також для поліпшення сну, який включає введення терапевтично прийнятної кількості сполуки за будь-яким з пп. 1-8.
Текст
Цей винахід відноситься до нового класу похідних індолу, що мають спорідненість до D4-дофамінового рецептора. Ці сполуки справляють антагоністичний вплив на D4-дофаміновий рецептор і, таким чином, є придатними для лікування певних психіатричних і неврологічних розладів, зокрема, психозів. Деякі з цих сполук виявляють також спорідненість до 5-НТ2A-рецептора та/або 5-НТ2C-рецептора, а деякі з цих сполук є інгібіторами зворотного захоплення серотоніну. У публікації AT 332401 описані сполуки загальної формули де R являє собою водень або алкіл, R1 і R2 являють собою водень або алкіл; p дорівнює 2 або 3, і Χ1 являє собою водень, фтор, хлор або бром. Сполуки, як зазначено, можуть бути використані як нейролептики. Патент не містить будь-яких експериментальних даних. Публікація WO 95/11680 відноситься до широкого класу сполук, що справляють антипсихотичну дію. Одна з груп заявлених сполук має формулу де Χ1 являє собою О, S, NH або NR2, Аlк являє собою алкілен, W1 являє собою СH2, О, S або NH, a R являє собою водень, алкіл, алкокси, гідроксигрупу, карбоксил, галоген, аміно, алкіламіно, діалкіламіно, нітро, алкілтіо, трифторметокси, ціано, ациламіногрупу, три фторацетил, амінокарбоніл, моноалкіламінокарбоніл, діалкіламінокарбоніл тощо. У заявці не надано будь-якого пояснення механізму дії, але сполуки, як зазначено, мають знижену здатність викликати екстрапірамідні побічні ефекти. D4-дофамінові рецептори відносяться до підродини D2-дофамінових рецепторів, які, як вважається, відповідальні за антипсихотичну дію нейролептиків. Побічні ефекти нейролептичних лікарських засобів, які, насамперед, діють через антагонізм стосовно D2г-рецепторів, обумовлені, як відомо, антагонізмом у відношенні D2-рецептора в отріарних (стріатних) ділянках головного мозку. Проте, D4-дофамінові рецептори розташовані, головним чином, не в отріарних, а в інших ділянках мозку, що підтверджує той факт, що селективні антагоністи D4-дофамінових рецепторів будуть вільні від екстрапірамідних побічних ефектів. Це є наочним з антипсихотичної дії клозапіну, який виявляє більш високу спорідненість до D4-, ніж до D2рецепторів, і не викликає екстрапірамідних побічних ефектів [Van ТоI et al. Nature 1991, 350,610; Hadley Medicinal Research Reviews 1996, 16, 507-526 і Sanner Exp. Opin. Ther. Patents 1998, 8, 383-393]. Було показано, що ряд лігандів D4, які, як заявлялося, є селективними антагоністами D 4-рецепторів (L745,879 і U-101958), виявляють антипсихотичну активність [Mansbach et al., Psychopharmacology, 1998, 135, 194-200]. Проте, нещодавно повідомлялося, що ці сполуки у різних дослідженнях визначення ефективності in vitro виявляють себе частковими агоністами D4-рецепторів [Gazi et al. Br. J. Pharmacol. 1998, 124, 889-896 і Gazi et al. Br. J. Pharmacol. 1999, 128, 613-620]. Крім того, було показано, що клозапін, який являє собою ефективний антипсихотичний засіб, є також прихованим антагоністом D4 [Gazi et al. Br. J. Pharmacol. 1999, 128, 613-620]. Таким чином, ліганди D4, що є частковими агоністами або антагоністами D4-рецепторів, можуть мати позитивний ефект у відношенні психозів. Антагоністи дофамінових D4 також можуть бути придатними для лікування порушень пізнавальної здатності [Jentsch et al., Psychopharmacology, 1999, 142, 78-84]. Крім того, опубліковано підтвердження генетичного зв'язку між підтипом "первинної неуважності" дефіциту уваги при гіперактивності (ADHD) та поліморфізмом тандемних дуплікацій у гені, що кодує D4дофаміновий рецептор [McCracken et al. МоI. Psychiatry 2000, 5, 531-536]. Це ясно вказує на наявність зв'язку між D4-дофаміновим рецептором і ADHD, і ліганди, що діють на цей рецептор, можуть бути придатними для лікування цього специфічного розладу. Відомі різноманітні ефекти сполук, які є лігандами різних підтипів рецептора серотоніну. Стосовно 5НТ2А-рецептора, який раніше вказувався як 5-НТ2-рецептор, відомі наступні ефекти, наприклад: антидепресивний ефект і поліпшення якості сну [Meert et al. Drug. De v. Res. 1989, 18, 119], ослаблення негативних симптомів шизофренії та екстрапірамідних побічних ефектів, викликаних застосуванням класичних нейролептиків пацієнтами із шизофренією [Gelders British J. Psychiatry 1989, 155 (suppl. 5), 33]. Крім того, селективні антагоністи 5-НТ2A можуть бути е фективними для профілактики й лікування мігрені [Scrip Report; "Migraine-Current trends in research and treatment"; PJB Publications Ltd.; May 1991] і для лікування стану тривоги [Colpart et al. Psychopharmacology 1985, 86, 303-305 і Perregaard et al. Current Opinion in Therapeutic Patents 1993, 1, 101-128]. Деякі клінічні дослідження розглядають участь підтипу 5-НТ2-рецептора в агресивному поводженні. Більш того, атипічні серотонін-дофамінові антагоністи-нейролептики справляють антагоністичну дію у відношенні 5-НТ2-рецептора на додаток до блокувальних властивостей стосовно дофаміну і, як описано, мають анти-агресивну поведінку [Connor et al. Exp. Opin. Ther. Patents. 1998, 8(4), 350-351]. Нещодавно також накопичилися докази, які обґрунтовують доцільність застосування селективних антагоністів 5-НТ2А в якості препаратів, придатних для лікування позитивних симптомів психозу [Leysen et al. Current Pharmaceutical Design 1997, 3, 367-390 і Carlsson Current Opinion in CPNS Investigational Drugs 2000, 2(1), 22-24]. Сполуки, що є інгібіторами зворотного захоплення 5-НТ, добре відомі як антидепресанти. Ліганди 5-НТ2С, як було встановлено, підсилюють дію інгібіторів зворотного захоплення 5-НТ в експериментах з мікродіалізом і на експериментах з тваринами, а сполуки, що виявляють інгібувальний ефект стосовно зворотного захоплення 5-НТ у поєднанні зі спорідненістю у відношенні 5-НТ2C-рецептора, можуть, отже, бути особливо придатними для лікування депресії й інших розладів, які піддаються лікуванню інгібіторами зворотного захоплення серотоніну (міжнародна заявка PCT/DK00/00671). Отже, ліганди D4-дофамінового рецептора є потенційними лікарськими засобами для лікування шизофренії та інших психозів, а сполуки з комбінованими ефектами у відношенні транспортера 5-НТ можуть мати додаткові переваги у відношенні поліпшеного впливу на депресивні й негативні симптоми у пацієнтів, що страждають на шизофренію. Сполуки з комбінованим впливом на D4-дофаміновий рецептор і 5-НТ2A-рецептор можуть мати додаткові переваги у відношенні поліпшеного впливу на позитивні й негативні симптоми шизофренії й додаткові переваги у відношенні впливу на симптоми депресії та тривоги. Зокрема, сполуки винаходу вважаються придатними для лікування позитивних і негативних симптомів шизофренії без екстрапірамідних побічних ефектів. Метою цього винаходу є одержання сполук, які є частковими агоністами або антагоністами D4дофамінового рецептора, й таких сполук з комбінованою дією на D4-дофаміновий рецептор, 5-НТ2Aрецептор, 5-НТ2C-рецептор та/або 5-НТ-переносника. Відповідно, цей винахід відноситься до нових сполук формули І де R1 являє собою водень або С 1-6-алкіл, С2-6-алкеніл, С3-8-алкініл, С3-8-циклоалкіл або С 3-8-циклоалкілС1-6-алкіл, які можуть бути заміщеними одним або більше замісниками, обраними з галогену, ціано, нітро, аміно, гідроксигрупи, тіольної групи, С1-6-алкокси, С1-6-алкілтіогрупи, трифторметилу, трифторметилсульфонілу і С 1-6-алкілсульфонілу, або R1 являє собою арил, арил-С 1-6-алкіл, гетероарил або гетероарил-С1-6-алкіл, де арильна або гетероарильна групи можуть бути заміщеними одним або більше замісниками, обраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С 1-6-алкілсульфонілу, або R1 являє собою -NR'R", де R' і R" є незалежно обраними з водню і С1-6-алкілу, арилу, арил-С 1-6-алкілу, гетероарилу і гетероарил-С 1-6-алкілу, які можуть бути заміщеними одним або більше замісниками, обраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С 1-6-алкілсульфонілу, або R1 являє собою насичений або частково насичений 5-6-членний цикл, який містить один, два або три гетероатоми, обрані з О або S і групи N-R9, де R9 являє собою водень або С 1-6-алкіл, необов'язково заміщений замісниками, обраними з галогену, ціано, нітро, аміногрупи, С1-6-алкокси, С1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С 1-6-алкілсульфонілу; W являє собою зв'язок або W являє собою О, S, CO, CS, SO або SO2 груп у; n дорівнює 0-6, m дорівнює 0-6 і n+m дорівнює 0-6; за умови, що, коли W являє собою О або S, тоді n³2, а коли W являє собою CO, CS, SO або SO2, тоді n³1; X являє собою С, СН або Ν, а п унктирна лінія, що відходить від X, являє собою зв'язок, коли X являє собою С, і не є зв'язком, коли X являє собою N або СН; R2 являє собою С 1-6-алкіл; R3-R7 є обраними з водню, галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С2-6-алкенілу, С2-6-алкінілу, С38-циклоалкілу, С 3-8-циклоалкіл-С 1-6-алкілу, С 1-6-алкокси, С 1-6-алкілтіогрупи, гідроксигрупи, тіольної групи, трифторметилу, трифторметилсульфонілу і С 1-6-алкілсульфонілу; R8 являє собою водень, С1-6-алкіл, С2-6-алкеніл, С2-6-алкініл, С3-8-циклоалкіл, С3-8-циклоалкіл-С 1-6-алкіл, арил, арил-С1-6-алкіл, ацил, тіоацил, С1-6-алкілсульфоніл, трифторметилсульфоніл або арилсульфоніл, або їх фармацевтично прийнятних кислотно-адитивних солей. В одному з конкретних варіантів здійснення винаходу цей винахід відноситься до сполук, де індол є зв'язаним з X по 3 положенню індолу. В іншому варіанті здійснення винахід відноситься до сполук, у яких W являє собою зв'язок. Зокрема, цей винахід відноситься до сполук, де n+m дорівнює 2. У ще одному варіанті здійснення цей винахід відноситься до сполук , де R2 являє собою метильну груп у. У ще одному варіанті здійснення цей винахід відноситься до сполук, де група -NH-CO-R1 є приєднаною до фенільної групи в пара-положенні стосовно положення групи R2. Зокрема цей винахід відноситься до сполук, де R1 являє собою С 1-6-алкіл, С3-8-циклоалкіл, С3-8циклоалкіл-С 1-6-алкіл, феніл, феніл-С 1-6-алкіл, фураніл, тієніл, піридил, піроліл, піримідил, де фенільні групи можуть бути заміщеними одним або більше замісниками, обраними з галогену, ціано, нітро, аміногрупи, С16-алкілу, С 1-6-алкокси, С 1-6-алкілтіогрупи, гідроксигрупи, трифторметилу, трифторметилсульфонілу і С 1-6алкілсульфонілу; або R1 являє собою -NR'R", де один із R' і R" є обраним з водню, а інший з R' і R" є обраним із С 1-6-алкілу, фенілу і фенілу-С 1-6-алкілу, де фенільні групи можуть бути заміщеними одним або більше замісниками, обраними з галогену, ціано, нітро, аміногрупи, С1-6-алкілу, С1-6-алкокси, С1-6алкілтіогрупи, гідроксигрупи, трифтормєтилу, три фторметилсульфонілу і С 1-6-алкілсульфонілу; або R1 являє собою тетрагідропіранільну, морфоліно, тіоморфоліно, піперидино, піперазино або N-(гідрокси-С1-6алкіл)піперазиногрупу. У конкретному варіанті здійснення цей винахід відноситься до сполук, обраних із: 3-(1-{2-[5-(ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[5-(циклобутилметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(3-метоксибензоїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індолу; 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(півалоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(3-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(3-фенілпропаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[2-метил-5-(3-метил-3-фенілуреїдо)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[5-(3-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл)-6-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу; 3-[1-(2-{5-[(циклопентилметаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-6-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(морфолін-4-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-[1-(2-{5-[3-(4-фторфеніл)уреїдо]-2-метилфеніл}етил)піперидин-4-іл]-5-фтор-1Н-індолу; 3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(тетрагідропіран-4-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-(1-{2-[5-(4-хлорбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-(1-{2-[5-(3-циклогексилпропаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу; 3-[1-(2-{5-[(3-фенілпропаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{5-[(2-фенілетаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-[1-(2-{5-[2-(4-фторфеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Η-індолу; 3-[1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{5-[(циклобутилметаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-(1-{2-[5-(бензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-(1-{2-[5-(4-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(піридин-4-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(тіофен-2-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(тіофен-3-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(1-[1,2,3]тіадіазол-5-ілметаноїл)аміно]феніл}етил)піперидин-4-іл]-7-хлор-1Н-індолу; 3-{1-[2-(5-ацетиламіно-2-метилфеніл)етил]-3,6-дигідро-2Н-піридин-4-іл}-5-фтор-1Н-індолу; 3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-5-фтор-1Ніндолу; 3-[1-(2-{5-[(4-фторфенілметаноїл)аміно]-2-метилфеніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-5-фтор-1Ніндолу; 3-{1-[2-(5-ацетиламіно-2-метилфеніл)етил]-3,6-дигідро-2Н-піридин-4-іл}-7-хлор-1Н-індолу; 3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-7-хлор-1Ніндолу і 3-[1-(2-{5-[(4-фторфенілметаноїл)аміно]-2-метилфеніл}етил)-3,6-дигідро-2Н-піридин-4-іл]-7-хлор-1Ніндолу або їх фармацевтично прийнятних солей. Сполуки цього винаходу є частковими агоністами або антагоністами D4-дофамінових рецепторів. Багато сполук справляють комбіновану дію на D4-дофаміновий рецептор і 5-НТ2А-рецептор, 5-НТ2С-рецептор і/або інгібувальну дію стосовно зворотного захоплення 5-НТ. Таким чином, сполуки за винаходом вважаються придатними для лікування позитивних і негативних симптомів шизофренії, інших психозів, розладів, пов'язаних із тривожним станом, таких як стан генералізованої тривоги, панічний розлад й обсесивно-компульсивний розлад, депресії, агресії, побічних ефектів, викликаних звичайними антипсихотичними агентами, мігрені, когнітивних розладів, дефіциту уваги, пов'язаного з гіперактивністю (ADHD), а також для поліпшення сну. Зокрема, сполуки цього винаходу вважаються придатними для лікування позитивних і негативних симптомів шизофренії без викликання екстрапірамідних побічних ефектів. Відповідно до іншого аспекту цей винахід відноситься до фармацевтичної композиції, яка містить, принаймні, одну сполуку формули І, як визначено вище, або її фармацевтично прийнятну кислотноадитивну сіль у терапевтично ефективній кількості та у поєднанні з одним або більше фармацевтично прийнятними носіями або розріджувачами. Відповідно до ще одного аспекту цей вина хід відноситься до застосування сполуки формули І, як визначено вище, або її кислотно-адитивної солі для виробництва фармацевтичного препарату для лікування згаданих вище захворювань. Сполуки загальної формули І можуть існувати у виді оптичних ізомерів, і такі оптичні ізомери також включені в обсяг цього винаходу. Термін "С1-6-алкіл" відноситься до розгалуженої або нерозгалуженої алкільної групи, яка має від одного до шести атомів вуглецю включно, такої як метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-2пропіл і 2-метил-1-пропіл. Подібним чином, терміни "С2-6-алкеніл" і "С2-6-алкініл", відповідно, позначають такі групи, що мають від двох до шести атомів вуглецю, що включають один подвійний зв'язок і один потрійний зв'язок, відповідно, такі як етеніл, пропеніл, бутеніл, етиніл, пропініл і бутиніл. Терміни "С1-6-алкокси", "С1-6-алкілтіо", "С1-6-алкілсульфоніл", "С1-6-алкіламіно", "С1-6-алкілкарбоніл" тощо позначають такі групи, у яких алкільна група являє собою С 1-6-алкіл, як визначено вище. Термін "С3-8-циклоалкіл" позначає моноциклічний або біциклічний карбоцикл, який має від трьох до восьми С-атомів, такий як циклопропіл, циклопентил, циклогексил тощо. Галоген означає фтор, хлор, бром або йод. Застосовуваний тут термін "ацил" відноситься до формільної, С1-6-алкілкарбонільної, арилкарбонільної, арил-С 1-6-алкілкарбонільної, С3-8-циклоалкілкарбонільної або С3-8-циклоалкіл-С 1-6-алкілкарбонільної групи, а термін "тіоацил" позначає відповідну ацильну груп у, у якій карбонільна група заміщена тіокарбонільною групою. Термін "арил" відноситься до карбоциклічної ароматичної групи, такої як феніл або нафтил, особливо феніл. Термін "гетероарил" відноситься до 5-членних моноциклічних циклів, таких як 1Н-тетразоліл, 3Н-1,2,3оксатіазоліл, 3Н-1,2,4-оксатіазоліл, 3Н-1,2,5-оксатіазоліл, 1,3,2-оксатіазоліл, 1,3,4-оксатіазоліл, 1,4,2оксатіазоліл, 3Н-1,2,4-діоксазоліл, 1,3,2-діоксазоліл, 1,4,2-діоксазоліл, 3Н-1,2,3-дитіазоліл, 3Н-1,2,4дитіазоліл, 1,3,2-дитіазоліл, 1,4,2-дитіазоліл, 1,2,3-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4оксадіазоліл, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5-тіадіазоліл, 1,3,4-тіадіазоліл, 1Н-1,2,3-триазоліл, 1Н1,2,4-триазоліл, ізоксазоліл, оксазоліл, ізотіазоліл, тіазоліл, 1Н-імідазоліл, 1Н-піразоліл, 1Н-піроліл, фураніл, тієніл, 1Н-пентазол; до 6-членних моноциклічних циклів, таких як 1,2,3-оксатіазиніл, 1,2,4оксатіазиніл, 1,2,5-оксатіазиніл, 4Н-1,3,5-оксатіазиніл, 1,4,2-оксатіазиніл, 1,4,3-оксатіазиніл, 1,2,3діоксазиніл, 1,2,4-діоксазиніл, 4Н-1,3,2-діоксазиніл, 4Н-1,3,5-діоксазиніл, 1,4,2-діоксазиніл, 2Н-1,5,2діоксазиніл, 1,2,3-дитіазиніл, 1,2,4-дитіазиніл, 4Н-1,3,2-дитіазиніл, 4Н-1,3,5-дитіазиніл, 1,4,2-дитіазиніл, 2Н1,5,2-дитіазиніл, 2Н-1,2,3-оксадіазиніл, 2Н-1,2,4-оксадіазиніл, 2Н-1,2,5-оксадіазиніл, 2Н-1,2,6-оксадіазиніл, 2Н-1,3,4-оксадіазиніл, 2Н-1,3,5-оксадіазиніл, 2Н-1,2,3-тіадіазиніл, 2Н-1,2,4-тіадіазиніл, 2Н-1,2,5-тіадіазиніл, 2Н-1,2,6-тіадіазиніл, 2Н-1,3,4-тіадіазиніл, 2Н-1,3,5-тіадіазиніл, 1,2,3-триазиніл, 1,2,4-триазиніл, 1,3,5триазиніл, 2Н-1,2-оксазиніл, 2Н-1,3-оксазиніл, 2Н-1,4-оксазиніл, 2Н-1,2-тіазиніл, 2Н-1,3-тіазиніл, 2Н-1,4тіазиніл, піразиніл, піридазиніл, піримідил, піридил, 2Н-піраніл, 2Н-тіїніл; або до біциклічних циклів, таких як 3Н-1,2,3-бензоксатіазоліл, 1,3,2-бензодіоксазоліл, 3Н-1,2,3-бензодитіазоліл, 1,3,2-бензодитіазоліл, бензофуразаніл, 1,2,3-бензоксадіазоліл, 1,2,3-бензотіадіазоліл, 2,1,3-бензотіадіазоліл, 1Н-бензотриазоліл, 1,2-бензизоксазоліл, 2,1-бензизоксазоліл, бензоксазоліл, 1,2-бензизотіазоліл, 2,1-бензизотіазоліл, бензотіазоліл, 1Н-бензимідазоліл, 1Н-індазоліл, 3Н-1,2-бензоксатіоліл, 1,3-бензоксатіоліл, 3Н-2,1бензоксатіоліл, 3Н-1,2-бензодіоксоліл, 1,3-бензодіоксоліл, 3Н-1,2-бензодитіоліл, 1,3-бензодитіоліл, 1Ніндоліл, 2Н-ізоіндоліл, бензофураніл, ізобензофураніл, 1-бензотієніл, 2-бензотієніл, 1Н-2,1-бензоксазиніл, 1Н-2,3-бензоксазиніл, 2Н-1,2-бензоксазиніл, 2Н-1,3-бензоксазиніл, 2Н-1,4-бензоксазиніл, 2Н-3,1бензоксазиніл, 1Н-2,1-бензотіазиніл, 1Н-2,3-бензотіазиніл, 2Н-1,2-бензотіазиніл, 2Н-1,3-бензотіазиніл, 2Н1,4-бензотіазиніл, 2Н-3,1-бензотіазиніл, цинолініл, фталазиніл, хіназолініл, хіноксалініл, ізохіноліл, хіноліл, 1Н-2-бензо-піраніл, 2Н-1-бензопіраніл, 1Н-2-бензотіопіраніл або 2Н-1-бензотіопіраніл. R1, що означає насичений або частково насичений 5-6-членний цикл, який містить один, два або три гетероатоми, обрані з О, S або групи N-R9, включає групи, у яких R1 являє собою -CRaRb, і групи, у яких R1 являє собою -NRaRb, де Ra і Rb разом утворюють 5-6-членний насичений або частково насичений цикл, який необов'язково містить додаткову групу N-R9 або атом О або S, наприклад, групи, такі як піперидиніл, піперазиніл, N-(гідрокси-С 1-6-алкіл)піперазиніл, морфолініл, тіоморфолініл, піролідиніл, тетрагідропіридил, тетрагідропіраніл, тетрагідрофураніл тощо. Кислотно-адитивними солями сполук за цим винаходом є фармацевтично прийнятні солі, одержані при взаємодії з нетоксичними кислотами. Прикладами таких органічних солей є солі малеїнової, фумарової, бензойної, аскорбінової, бурштинової, ща влевої, біс-метиленсаліцилової, метансульфонової, етандисульфонової, оцтової, пропіонової, винної, саліцилової, лимонної, глюконової, молочної, яблучної, мигдалевої, коричної, цитраконової, аспарагінової, стеаринової, пальмітинової, ітаконової, гліколевої, рамінобензойної, глутамінової, бензолсульфонової та теофіліноцтової кислот, а також утворені з 8галогентеофілінами, наприклад, 8-бромотеофіліном. Прикладами таких неорганічних солей є солі хлористоводневої, бромистоводневої, сірчаної, сульфамінової, фосфорної та азотної кислот. Фармацевтичні композиції цього винаходу або композиції, одержані згідно з цим винаходом, можуть уводитися будь-яким придатним шляхом, наприклад, перорально у виді таблеток, капсул, порошків, сиропів тощо або парентерально у виді розчину для ін'єкцій. Для одержання подібних композицій можуть застосовуватися добре відомі в даній галузі способи, і можуть застосовуватися будь-які фармацевтично прийнятні носії, розріджувачі, наповнювачі й інші добавки, які звичайно застосовуються в даній галузі. Сполуки згідно з винаходом зручно вводити в одиничній дозованій формі, що містить зазначені сполуки в кількості приблизно від 0,01 до 100мг. Сумарна денна доза звичайно складає від приблизно 0,05 до 500мг, і найбільш переважно вона складає приблизно від 0,1 до 50мг активної сполуки за винаходом. Сполуки за винаходом можуть бути одержані наступним чином: 1) алкілуванням піперазину, піперидину або тетрагідропіридину формули II за допомогою алкілувального похідного формули III: де R1-R8, X, W, n, m і пунктирна лінія є такими, як визначено вище, a L являє собою групу, що видаляється, таку як галоген, мезилат або тозилат; 2) відновним алкілуванням аміну формули II реагентом формули IV: де R1-R8, X, W, n, m і пунктирна лінія є такими, як визначено вище, а Е являє собою альдегід або активовану карбонову кислоту; 3) відновленням подвійного зв'язку в те трагідропіридинільному кільці в похідних формули V: де R1-R8, W, n і m є такими, як визначено вище; 4) ацилюванням аміну формули VI: де R1-R8, X, W, n, m і пунктирна лінія є такими, як визначено вище, шляхом використання карбонової кислоти і сполучального реагенту, активованого складного ефіру, хлорангідриду кислоти, ізоціанату, карбамоїлхлориду, або за допомогою двоступінчастої обробки фосгеном з наступним додаванням аміну; 5) відщіпленням зв'язаного з полімером похідного формули VII: де R1-R7, X, W, n і m є такими, як визначено вище, a R'OH являє собою гідроксиетил- або гідроксиметилполістирол, смолу Ванга або аналогічні поліетиленгліколь-полістиролові смоли; після чого сполуку формули І виділяють у виді вільної основи або її фармацевтично прийнятної кислотно-адитивної солі. Алкілування за методом 1) звичайно проводять в інертному органічному розчиннику, такому як відповідним чином киплячий спирт або кетон, переважно в присутності органічної або неорганічної основи (карбонат калію, діізопропілетиламін або триетиламін) при температурі дефлегмації. Альтернативно, алкілування може бути проведено при фіксованій температурі, яка відрізняється від температури кипіння, в одному з вищезазначених розчинників або у диметилформаміді (ДМФА), диметилсульфоксиді (ДМСО) або N-метилпіролідин-2-оні (ΝΜΠ), переважно в присутності основи. Синтез амінів формули II, 3-(піперидин-4іл)-1Н-індолів і 3-(3,6-дигідро-2Н-піридин-4-іл)-1Н-індолів, описаний у літературі (див. публікацію ЕР-А1465398). Алкілувальні похідні формули III одержують нітруванням алкілзаміщених фенілоцтових кислот з наступним відновленням нітрогрупи, наприклад, за допомогою хлориду олова(ІІ), і функціоналізацією одержаної аміногрупи. Карбонову кислоту потім відновлюють до відповідного спирту, наприклад, обробкою бораном, з наступним перетворенням спирту в гр упу, що видаляється, наприклад, обробкою метансульфонілхлоридом або тіонілбромідом. Відновне алкілування за способом 2) проводять за стандартними методами, описаними в літературі. Реакція може бути проведена в дві стадії, наприклад, сполученням амінів формули II з реагентами формули IV за стандартними методами через хлорангідрид карбонової кислоти, активовані складні ефіри або з використанням карбонових кислот у комбінації зі сполучальним реагентом, таким як, наприклад, дициклогексилкарбодіімід, з наступним відновленням одержаного аміду алюмогідридом літію або аланом. Карбонову кислоту формули IV одержують нітруванням алкіл-заміщеної фенілоцтової кислоти з наступним відновленням нітрогрупи, наприклад, за допомогою хлориду олова(ІІ), а потім функціоналізацією одержаної аміногрупи. Реакція також може бути проведена за стандартною методикою в одній судині, наприклад, з використанням відновного амінування амінів формули II і альдегідів формули IV. Альдегіди формули IV одержують відновленням раніше згаданої функціоналізованої (амінофеніл)оцтової кислоти обробкою відновлювальним агентом, таким як боран. Одержаний спирт перетворюють у відповідний альдегід за допомогою стандартних методів окиснювання, наприклад, хлорхроматом піридинію. Відновлення подвійного зв'язку відповідно до способу 3) звичайно проводять шляхом каталітичного гідрування при низькому тиску (менше ніж 3 атмосфери) в апараті Пара або за допомогою відновлювальних агентів, таких як диборан або бромоводневі похідні, які одержані in situ з NaBH4 у трифторооцтовій кислоті, в інертних розчинниках, таких як тетрагідрофуран (ТГФ), діоксан або діетиловий ефір. Ацилювання у відповідності зі способом 4) звичайно проводять за стандартними методами через хлорангідрид карбонової кислоти, активовані складні ефіри або за рахунок використання карбонової кислоти в комбінації зі сполучальними реагентами, такими як дициклогексилкарбодіімід. Коли ацилювання дає похідні сечовини, ацилювальними реагентами є карбамоїлхлориди або ізоціанати, або здійснюється двоступінчаста обробка, яка включає обробку фосгеном з наступним додаванням аміну. Проміжні сполуки формули VI одержують так, як описано в способах 1) і 2). Похідні структури VII одержують за допомогою твердофазного синтезу, описаного нижче. Кінцевий продукт відщеплюють від смоли у відповідності зі способом 5) з використанням розведеного метоксиду натрію в суміші метанол/тетрагідрофуран при температурі навколишнього середовища. Перший будівельний блок VIII, одержаний захистом трет-бутоксикарбонілом сполуки формули II, яку одержують за способами, очевидними для кваліфікованого хіміка [див. також ЕР-А1-465398], звичайно приєднують до смоли (наприклад, етил-4-нітрофенілкарбонат, зв'язаний з полістиролом) з використанням основи, наприклад, N,N-диметиламінопіридину і N,N-діізопропілетиламіну, при підвищеній температурі (наприклад, 50-100°С) в апротонному розчиннику (наприклад, у ДМФА або ДМСО). Після зняття захисту зі сполуки IX за допомогою трифторооцтової кислоти вводять другий диверсифікувальний будівельний блок алкілуванням сполуки X, у результаті чого одержують сполуку XI. Алкілувальний реагент одержують нітруванням алкілзаміщеної фенілоцтової кислоти за стандартними методиками нітрування, з наступним відновленням карбонової кислоти, наприклад, обробкою бораном у тетрагідрофурані, і, нарешті, перетворенням одержаного спирту в груп у, що видаляється, наприклад, обробкою метансульфонілхлоридом у дихлорометані і триетиламіні. Алкілування проводять при підвищеній температурі (50-100°С) в апротонному розчиннику, такому як ДМФА, ацетоні або ацетонітрилі, що дає смолу XI. Після відновлення нітрогрупи, наприклад, обробкою хлоридом олова(ІІ) у ДМФА, третій диверсифікувальний будівельний блок уводять за допомогою стандартної методики ацилювання, наприклад, додаванням хлорангідриду кислоти, ізоціанату або карбамоїлхлориду і основи при низькій температурі в ДМФА, ди хлорометані або ацетонітрилі. де R"=C(O)O(CH 2)2(PS), PS=смола Ванга, R1, R7, X, W, n і m є такими, як визначено вище. Температури плавлення були визначені на приладі Buchi SMP-20 і не корегувалися. Аналітичні дані РХМС одержані на приладі РЕ Sciex АРІ 150ЕХ, обладнаним джерелом іонного розпилення і РХ системою Shimadzu LC-8A/SLC-10A. Умови РХ (колонка С18 4,6´30мм із розміром часток 3,5мкм) являли собою елюювання з лінійним градієнтом сумішшю вода/ацетонітрил/трифторооцтова кислота (градієнт від 90:10:0,05 до 10:90:0,03) протягом 4 хвилин при 2мл/хв. Чистота визначалася інтеграцією УФ сліду (254нм). Час затримки Rt виражали в хвилинах. Мас-спектр одержують методом почергового сканування з одержанням інформації про молекулярні маси. Молекулярний іон, МН+, одержують при низькій напрузі на діафрагмі (5-20В), а фрагментацію здійснюють при високій напрузі на діафрагмі (100-200В). Препаративне РХ-МС-розподілення проводили на тому ж приладі. Умови РХ (колонка С18 20´50мм із розміром часток 5мкм) являли собою елюювання з лінійним градієнтом сумішшю вода/ацетонітрил/трифторооцтова кислота (градієнт від 80:20:0,05 до 5:95:0,03) протягом 7 хвилин при 22,7мл/хв. Збір фракцій проводили за допомогою МС-детектування розгалуженого потоку. Спектри 1H ЯМР записані при 500,13МГц на приладі Bruker Avance DRX500 або при 250,13МГц на приладі Bruker AC 250. У якості розчинників використовували дейтеровані хлороформ (99,8% D) або диметилсульфоксид (99,9% D). Як внутрішній стандарт використовують ТМС. Величини хімічних зсувів виражали в м.ч. (млн -1). Для позначення різних ЯМР сигналів використовували наступні абревіатури: с синглет, д - дублет, т - триплет, кв - квартет, квін - квінтет, г - гептет, дд - подвійний дублет, дт - подвійний триплет, дкв - дублет квартетів, тт - триплет триплетів, м - мультиплет. ЯМР сигналами, що відповідають кислотним протонам, звичайно зневажали. Вміст води в кристалічних сполуках визначали титруванням за Карлом Фішером. Для хроматографії на колонках використовували силікагель типу Kiesegel 60, 40-60меш за ASTM. Для іонообмінної хроматографії використовували SCX-колонки, 1г Varian Mega Bond ElutÒ , Chrompack номер за каталогом 220776. Перед використанням SCX-колонки попередньо кондиціювали 10% розчином оцтової кислоти в метанолі (3мл). Приклади Одержання проміжних сполук А. Ацилювальний реагент (2-Метил-5-нітрофеніл)оцтова кислота У круглодонну колбу об'ємом 1л завантажують концентровану сірчану кислоту (500мл) і охолоджують до -12°С (етиленгліколь - сухий лід). Протягом 10 хвилин додають (2-метилфеніл)оцтову кислоту (35,4г, 0,24моль), розчинену в дихлорометані (120мл), і потім суміш протягом 2 годин обробляють по краплях попередньо охолодженим (етиленгліколь-сухой лід) розчином концентрованої сірчаної (100мл) і 100% азотної (10мл) кислот. Потім реакційну суміш перемішують протягом однієї години при -12°С і виливають на лід. Водну фазу екстрагують етилацетатом (3´1л). Об'єднані органічні фази промивають соляним розчином (2´1л) і водою (2´1л), висушують (Na2SО4) і концентрують у вакуумі, одержуючи 38,1г неочищеної суміші (38г). Спектр 1H ЯМР показує, що продукт являє собою суміш зазначеної сполуки і (2-метил-3нітрофеніл)оцтової кислоти при співвідношенні 70:30, і зазначену в заголовку сполуку очи щають розтиранням з діетиловим ефіром. В. Алкілувальний реагент 2-(2-Метансульфонілоксиетил)-1-метил-4-нітробензол У круглодонну колбу об'ємом 500мл завантажують (2-метил-5-нітрофеніл)оцтову кислоту (15г, 77ммоль) і сухий ТГФ (300мл). Суміш охолоджують водою з льодом і протягом 1 години по краплях обробляють комплексом боран-тетрагідрофуран (90мл, 1Μ розчин у ТГФ, 90ммоль). Реакційну суміш перемішують протягом однієї години при кімнатній температурі й потім виливають на лід. Водну фазу екстрагують етилацетатом (3´600мл). Об'єднані органічні фази промивають соляним розчином (2´1л) і водою (2´1л), висушують (Na2SО4) і концентрують у вакуумі. Залишок розчиняють у дихлорометані (200мл) і триетиламіні (10,8мл, 78ммоль). Суміш охолоджують водою з льодом і протягом 20 хвилин по краплях додають суміш метансульфонілхлориду (6,05мл, 78ммоль), розчиненої в дихлорометані (100мл). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/гептан, 2:3), одержуючи зазначену в заголовку сполуку (7,8г). 1H ЯМР (CDCІ3): 2,45 (с, 3Н); 2,96 (с, 3Н); 3,15 (т, 2Н); 4,45 (т, 2Н); 7,33 (д, 1Н); 7,98-8,11 (м, 2Н). 2-(2-Бромоетил)-1-метил-4-нітробензол Суміш 2-(2-метансульфонілоксиетил)-1-метил-4-нітробензолу (4,0г) і броміду літію (6,6г) в ацетоні (250мл) кип'ятять зі зворотним холодильником протягом 3,5 годин. Одержану суміш о холоджують і фільтрують. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/гептан, 1:2), одержуючи зазначену в заголовку сполуку (3,7 г). 1H ЯМР (ДМСО-d6): 2,45 (с, 3Н); 3,25 (т, 2Η); 3,80 (т, 2Η); 7,50 (д, 1Н); 8,05 (дд, 1Н); 8,15 (д, 1Н). Одержання проміжних сполук на твердій основі Одержання 4-нітрофенілоксикарбонілоксиетилполістиролу У круглодонну колбу ємністю 2л завантажують гідроксиетилполістирол (62,9г, 83ммоль, комерційний продукт фірми Rapp Polymere, номер за каталогом НА 140000), N-метилморфолін (20мл, 183ммоль) і сухий дихлорометан (900мл). Суспензію охолоджують на льодяній бані, потім додають протягом 5 хвилин 4нітрофенілхлороформіат, розчинений у сухому ди хлорометані (400мл). Суміш перемішують при кімнатній температурі протягом 16 годин. Смолу відфільтровують і промивають сухим дихлорометаном (5´200мл). Смолу висушують у вакуумі (20°С, 72 години), одержуючи зазначену в заголовку смолу (79,6г). Одержання зв'язаного з полімером 3-{1-[2-(5-аміно-2-метилфеніл)етил]-піперидин-4-іл}-5-фтор-1Ніндолу У круглодонну колбу ємністю 100мл завантажують 4-нітрофенілоксикарбонілоксиетилполістирол (6,6г, 7,1ммоль), 5-фтор-3-(1-трет-бутоксикарбонілпіперидин-4-іл)-1Η-індол (2,7г, 8,1ммоль), діізопропілетиламін (6,2мл, 35,6ммоль), 4-диметиламінопіридин (0,87г, 7,1ммоль) і сухий диметилформамід (85мл). Суміш перемішують при 90°С протягом 20 годин. Після охолодження до кімнатної температури смолу відфільтровують і промивають сухим диметилформамідом (3´25мл), сухим ацетонітрилом (3´25мл) і сухим дихлорометаном (3´25мл). Смолу переносять у скляний циліндр ємністю 250мл із фритою та потрійним перехідником на дні. Смолу обробляють протягом 20 хвилин 80мл суміші дихлорометану і трифторооцтової кислоти (1:1), що містить анізол (2% мас./мас.) і метіонін (0,2% мас./мас.), з використанням азоту для перемішування смоли (попередження: виділення діоксиду вуглецю). Смолу відфільтровують і промивають сухим дихлорометаном (25мл), сумішшю дихлорометан:триетиламін, 1:1 (3´25мл) і сухим дихлорометаном (3´25мл). Смолу переносять у круглодонну колбу об'ємом 250мл. Додають ацетонітрил (70мл), діізопропілетиламін (5,2мл, 30ммоль) і 2-(2-метансульфонілоксиетил)-1-метил-4-нітробензол (3,67г, 14ммоль). Реакційну суміш нагрівають при 70°С протягом 18 годин. Після охолодження до кімнатної температури смолу відфільтровують і промивають сухим ацетонітрилом (3´25мл) і сухим дихлорометаном (3´25мл). Смолу переносять у круглодонну колбу ємністю 250мл і обробляють дигідратом хлориду олова(ІІ) (60мл 0,5Μ розчин в ДМФ). Реакційну суміш перемішують протягом 18 годин при кімнатній температурі. Смолу відфільтровують і промивають сухим диметилформамідом (3´25мл), сухим ацетонітрилом (3´25мл) і сухим дихлорометаном (3´25мл). Смолу висушують у вакуумі (20°С, 20 годин), одержуючи зазначену в заголовку смолу (6,3г). За аналогічною методикою одержують наступні зв'язані з полімером сполуки: 3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-5-хлор-1Н-індол 3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-6-хлор-1Н-індол 3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-7-хлор-1Н-індол Одержання сполук цього винаходу Приклад 1 1а. Фумарат 3-(1-{2-[5-(ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індолу Суміш (2-метил-5-нітрофеніл)оцтової кислоти (47г) і тіонілхлориду (62мл) у дихлорометані (400мл) кип'ятять зі зворотним холодильником протягом 5 годин і концентрують у вакуумі. Невелику кількість залишку (5г) розчиняють у те трагідрофурані (100мл) і протягом 10 хвилин при 0°С по краплях додають до суміші 6-хлор-3-(3,6-дигідро-2Н-піридин-4-іл)-1Η-індолу (6,0г) і триетиламіну (5мл) у тетрагідрофурані (250мл). Суміш концентрують у вакуумі, додають 2N водний розчин гідроксиду натрію (400мл) і етилацетат (400мл), у результаті випадає осад 6-хлор-3-{1-[2-(2-метил-5-нітрофеніл)-1-оксоетил]-3,6-дигідро-2Нпіридин-4-іл}-1Η-індолу, який відфільтровують (3,7г). Органічні фази відокремлюють, промивають соляним розчином, висушують (Na2SО4), фільтрують і концентрують у вакуумі. Залишок очищають флешхроматографією на силікагелі (елюент:етилацетат/гептан, 2:1), одержуючи ще одну порцію 6-хлор-3-{1-[2 (2-метил-5-нітрофеніл)-1-оксоетил]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу (2,2г). Суміш 6-хлор-3-{1-[2-(2метил-5-нітрофеніл)-1-оксоетил]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індолу (5,3г) у тетрагідрофурані (100мл) і дигідрату хлориду олова(ІІ) (14,5г) у етанолі (150мл) кип'ятять зі зворотним холодильником протягом 2 годин, об'єм розчинників зменшують у вакуумі приблизно до 100мл. Додають водний розчин аміаку й органічну фазу видаляють у вакуумі. Водну фазу екстрагують етилацетатом, об'єднані органічні фази промивають соляним розчином, висушують (Na2SО4), фільтрують і концентрують у вакуумі, одержуючи 6хлор-3-{1-[2-(5-аміно-2-метилфеніл)-1-оксоетил]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індол (5,1г). Цю сполуку розчиняють у тетрагідрофурані (200мл) і протягом 15 хвилин при 10°С по краплях додають до суспензії алюмогідриду літію (1,5г) у тетрагідрофурані (100мл). Одержану суміш перемішують при кімнатній температурі протягом 16 годин і піддають стандартній процедурі обробки, одержуючи сирий 6-хлор-3-{1-[2(5-аміно-2-метилфеніл)етил]-3,6-дигідро-2Н-піридин-4-іл}-1Н-індол (7,5г, містить тетрагідрофуран). Сиру сполуку (4,0г) розчиняють в оцтовій кислоті (100мл), після чого додають оксид платини (400мг), одержану суміш струшують в атмосфері водню під тиском в 3 атмосфери протягом 6 годин при кімнатній температурі. Суміш фільтрують, додають воду (400мл), потім додають водний розчин гідроксиду амонію до лужного значення рН. Водну фазу екстрагують етилацетатом, об'єднані органічні фази промивають соляним розчином, висушують (Na2SО4), фільтрують і концентрують у вакуумі, одержуючи 6-хлор-3-{1-[2-(5-аміно-2метилфеніл)етил]піперидин-4-іл}-1Н-індол (2,4г). Сполуку розчиняють у тетрагідрофурані (200мл) і триетиламіні (1мл) і суміш охолоджують до 0°С, після чого додають по краплях ацетилхлорид (0,5мл) у дихлорометані (30мл). Одержану суміш перемішують при кімнатній температурі протягом 2 годин, фільтрують і концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/етанол/триетиламін, 80:20:4), одержуючи неочищену зазначену в заголовку сполуку, яку виділяють з етанолу у виді солі фумаровой кислоти (0,7г). Т. пл. 164-166°С. 1H ЯМР (ДМСО-d6): 1,85-2,10 (м, 4Н); 2,25 (с, 3Н); 2,65-3,00 (м, 7Н); 3,30-3,45 (м, 2Н); 6,60 (с, 3Н (фумарат)); 7,00 (дд, 1Н); 7,10 (д, 1Н); 7,20 (д, 1Н); 7,30-7,45 (м, 3Н); 7,65 (д, 1Н); 9,85(c, 1H); 11,05 (с, 1H). MS m/z: 410 (MH+), 259, 247, 176. Приклад 2 2a, Оксалат 3-(1-{2-[5-(циклобутилметаноїламіно)-2-метилфеніл]етил}-піперидин-4-іл)-5-фтор-1Н-індолу Суміш 5-фтор-3-(піперидин-4-іл)-1Н-індолу (2,7г) у диметилформаміді (75мл), 2-(2-бромоетил)-1-метил4-нітробензолу (3,7г) у бутаноні (200мл) і триетиламіну (9,3мл) кип'ятять зі зворотним холодильником протягом 20 годин, одержану суміш концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/триетиламін, 100:4), одержуючи 5-фтор-3-{1-[2-(2-метил-5нітрофеніл)етил]піперидин-4-іл}-1Н-індол (3,6г), який далі розчиняють в оцтовій кислоті (25мл), потім додають етанол (75мл) і оксид платини (50мг). Одержану суміш струшують при тиску водню в 3 атмосфери протягом 3 годин при кімнатній температурі. Об'єм суміші зменшують у вакуумі (до 50мл), виливають у суміш лід/вода з наступним додаванням водного аміаку до лужного значення рН. Водну фазу екстрагують сумішшю етилацетат/тетрагідрофуран і об'єднані органічні фази промивають соляним розчином, висушують (MgSO4), фільтрують і концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/етанол/триетиламін, 100:4:4), одержуючи 3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-5-фтор-1Н-індол (1,0г), який потім розчиняють у тетрагідрофурані (45мл) і триетиламіні (1,3мл) при 5°С, після чого додають циклобутанкарбонілхлорид (0,3г) у тетрагідрофурані (15мл). Одержану суміш перемішують при 5°С протягом 1 години, фільтрують і концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/етанол/триетиламін, 100:4:4), одержуючи неочищений продукт, який виділяють з етилацетату у виді оксалату, білої кристалічної речовини (0,7г). Т. пл. 116-125°С. 1H ЯМР (ДМСО-d6): 1,75-1,85 (м, 1Н); 1,85-2,05 (м, 3Н); 2,05-2,25 (м, 6Н); 2,30 (с, 3Н); 2,903,25 (м, 8Н); 3,65 (д, 2Н); 6,85-6,95 (м, 1Н); 7,10 (д, 1Н); 7,25 (с, 1Н); 7,30-7,40 (м, 2Н); 7,40 (д, 1Н); 7,55 (с, 1Н); 9,65 (с, 1Н); 11,00 (с, 1Н). MS m/z: 434 (МН+). 3а, 3-(1-{2-[5-(Ацетиламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індолу Зв'язаний з полімером 3-[1-(2-{5-аміно-2-метилфеніл}етил)піперидин-4-іл]-5-фтор-1Н-індол (100мг, 100мкмоль), триетиламін (90мкл) і диметиламінопіридин (0,50мл 0,2Μ розчину в сухому ацетонітрилі) змішують у пробірці. Суміш охолоджують до 0°С і обробляють ацетилхлоридом (0,50мл 1Μ розчину в сухому ацетонітрилі). Реакційну суміш залишають при 0°С на 2 години. Смолу відфільтровують і промивають сухим ацетонітрилом (3´1мл). Смолу обробляють протягом 1 години 1мл суміші метилату натрію (2мл, 5N розчину метилату натрію в метанолі), метанолу (50мл) і тетрагідрофурану (50мл). Після фільтрування смолу промивають метанолом (1мл). Об'єднані фільтрати завантажують у попередньо підготовлену іонообмінну колонку (SCX-колонка 500мг, поставляється фірмою Analytical Instruments, номер 1210-2040), промивають ацетонітрилом (1мл) і метанолом (1мл). Продукт елюють 4Μ розчином аміаку в метанолі. Після випарювання летких розчинників одержують зазначену в заголовку сполук у у вигляді жовтої олії (6мг, 15мкмоль). РХ-МС (m/z): 394 (МН+), RT=1,98, чистота 88%. Аналогічним способом одержують наступні сполуки. При одержанні сечовин замість хлорангідриду використовують відповідний карбамоїлхлорид. Сполуки очищають ВЕРХ з оберненою фазою, якщо за допомогою УФ (254нм) виявляється чистота менш ніж 70% від очікуваної маси. Одержаний розчин потім поміщають у попередньо підготовлену іонообмінну колонку, промиту ацетонітрилом (1мл) і метанолом (1мл). Продукт елюють 4Μ розчином аміаку в метанолі, розчин концентрують у вакуумі, одержуючи кінцевий продукт. 3b, 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індол: РХ-МС (m/z): 478 (МН+), RT=2,45, чистота: 74%. 3с, 3-(1-{2-[2-метил-5-(3-метоксибензоїламіно)феніл]етил}піперидин-4-іл)-5-хлор-1Н-індол: РХ-МС (m/z): 502 (МН+), RT=2,51, чистота: 86%. 3d, 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 420 (МН+), RT=2,16, чистота: 97%. 3е, 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 462 (МН+), RT=2,33, чистота: 91%. 3f, 3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 422 (МН+), RT=2,20, чистота: 93%. 3g, 3-(1-{2-[2-метил-5-(півалоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 436 (МН+), RT=2,33, чистота: 95%. 3h, 3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 450 (МН+), RT=2,48, чистота: 95%. 3і, 3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 474 (МН+), RT=4,02, чистота: 95%. 3j, 3-(1-{2-[5-(3-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 486 (МН+), RT=2,41, чистота: 91%. 3k, 3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 457 (МН+), RT=1,90, чистота: 80%. 3I, 3-(1-{2-[2-метил-5-(3-фенілпропаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 484 (МН+), RT=2,47, чистота: 96%. 3m, 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 470 (МН+), RT=2,47, чистота: 90%. 3n, 3-(1-{2-[2-метил-5-(3-метил-3-фенілуреїдо)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 501 (МН+), RT=2,51, чистота: 87%. 3о, 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1H-індол: РХ-МС (m/z): 436 (МН+), RT=2,30, чистота: 96%. 3р, 3-(1-{2-[2-метил-5-(тіофен-2-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 478 (МН+), RT=2,44, чистота: 93%. 3q, 3-(1-{2-[5-(ізобутаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 438 (МН+), RT=2,33, чистота: 96%. 3r, 3-(1-{2-[5-(3-метрксибеюоїлдміно)-2-метилфеніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 502 (МН+), RT=2,51, чистота: 93%. 3s, 3-(1-{2-[2-метил-5-(піридин-3-ілметаноїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 473 (МН+), RT=2,03, чистота: 88%. 3t, 3-[1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл}етил)піперидин-4-іл]-6-хлор-1Н-індол: РХМС (m/z): 516 (МН+), RT=2,52, чистота: 94%. 3u, 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-6-хлор-1Н-індол: РХ-МС (m/z): 486 (МН+), RT=2,58, чистота: 93%. 3v, 3-[1-(2-{5-[(циклопентилметаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-6-хлор-1Н-індол: РХ-МС (m/z): 465 (МН+), RT=2,49, чистота: 95%. 3х, 3-(1-{2-[2-метил-5-(морфолін-4-ілметаноїламіно)феніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 465 (МН+), RT=3,27, чистота: 91%. 3у, 3-[1-(2-{5-[3-(4-фторфеніл)уреїдо]-2-метилфеніл}етил)піперидин-4-іл]-5-фтор-1Н-індол: РХ-МС (m/z): 504 (МН+), RT=2,52, чистота: 92%. 3z, 3-(1-{2-[5-(гексаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індол: РХ-МС (m/z): 466 (МН+), RT=2,55, чистота: 88%. 3аа, 3-(1-{2-[2-метил-5-(тетрагідропіран-4-ілметаноїламіно)феніл]етил}-піперидин-4-іл)-5-фтор-1Н-індол: РХ-МС (m/z): 464 (МН+), RT=2,05, чистота: 96%. 3аb. 3-(1-{2-[5-(4-хлорбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індол: РХ-МС (m/z): 506 (МН+), RT=2,62, чистота: 87%. 3ac, 3-(1-{2-[5-(3-циклогексилпропаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-5-фтор-1Н-індол: РХМС (m/z): 490 (МН+), RT=2,76,чистота: 95%. 3ad, 3-[1-(2-{5-[(3-фенілпропаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Н-індол: РХ-МС (m/z): 500 (МН+), RT=2,56, чистота: 91%. 3ае, 3-[1-(2-{5-[(2-фенілетаноїл)аміно]-2-метилфеніл}етил)піперидин-4-іл]-7-хлор-1Η-індол: РХ-МС (m/z): 486 (МН+), RT=2,48, чистота: 92%. 3af, 3-(1-{2-[2-метил-5-(4-метилбензоїламіно)феніл]етил}піперидин-4-іл)-7-хлор-1Н-індол: РХ-МС (m/z): 486 (МН+), RT=2,54, чистота: 89%. 3ag, 3-(1-{2-[5-(циклопропілметаноїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Η-індол: РХ-МС (m/z): 436 (МН+), RT=2,26, чистота: 93%. Приклад 4 4а. 3-[1-(2-{5-[2-(4-Фторфеніл)етаноїламіно]-2-метилфеніл} етил )піперидин-4-іл]-7-хлор-1Н-індол Суміш (2-метил-5-нітрофеніл)оцтової кислоти (2,5г) і 1,1'-карбонілдіімідазолу (2,1г) у диметилформаміді (50мл) перемішують при кімнатній температурі 15 хвилин і потім додають розчин 7-хлор-3-(піперидин-4-іл)1Н-індолу (3,0г) у диметилформаміді (50мл). Одержану суміш перемішують при кімнатній температурі протягом 1 години і виливають у суміш лід/вода. Сполуки відфільтровують і розчиняють у тетрагідрофурані. Органічну фазу промивають соляним розчином, висушують (MgSO4), фільтрують і концентрують у вакуумі, одержуючи 7-хлор-3-{1-[2-(2-метил-5-нітрофеніл)-1-оксоетил]піперидин-4-іл}-1Н-індол (4,7г). Суміш 7-хлор3-{1-[2-(2-метил-5-нітрофеніл)-1-оксоетил]піперидин-4-іл}-1Н-індолу (16,6г) і етанолу (500мл) кип'ятять зі зворотним холодильником і потім до суміші протягом 30 хвилин додають концентровану НСl (22мл) і порошок заліза (11,3г). Одержану суміш кип'ятять зі зворотним холодильником ще 90 хвилин, фільтрують гарячою і концентрують у вакуумі. Залишок розчиняють у тетрагідрофурані й органічну фазу промивають соляним розчином, висушують (MgSO4), фільтр ують і концентрують у вакуумі, одержуючи 7-хлор-3-{1-[2-(5аміно-2-метилфеніл)-1-оксоетил]піперидин-4-іл}-1Н-індол (14,3г). Суспензію алюмогідриду літію (6,4г) у тетрагідрофурані (250мл) охолоджують (5°С) і потім додають суміш 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)1-оксоетил]піперидин-4-іл}-1Н-індолу (16,0г) у тетрагідрофурані (250мл). Одержану суміш кип'ятять зі зворотним холодильником 90 хвилин, охолоджують до 5°С і реакцію зупиняють додаванням води. Суміш висушують (MgSO 4), перемішують протягом 10 хвилин, фільтрують і концентрують у вакуумі, одержуючи 7хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індол (12,4г). Розчин 7-хлор-3-{1-[2-(5-аміно-2метилфеніл)етил]піперидин-4-іл}-1Н-індолу (1,0г) і N-етилдіізопропіламіну (0,7г) у тетрагідрофурані (25мл) охолоджують (5°С) і потім додають розчин (4-фторофеніл)ацетилхлориду в тетрагідрофурані (25мл). Одержану суміш перемішують при кімнатній температурі протягом 1 години й потім виливають у соляний розчин. Водну фазу екстрагують тетрагідрофураном і об'єднані органічні фази висушують (MgSO4), фільтр ують і концентрують у вакуумі. Залишок очищають флеш-хроматографією на силікагелі (елюент: етилацетат/гептан/триетиламін, 70:30:5), одержуючи продукт (0,81г). РХ-МС (m/z): 504 (МН+), RT=2,45, чистота: 62%. За аналогічною методикою одержують наступні сполуки: 4b, 3-[1-(2-{5-[2-(4-метоксифеніл)етаноїламіно]-2-метилфеніл)етил)піперидин-4-іл]-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і (4метоксифеніл)ацетилхлориду. РХ-МС (m/z): 516 (МН+), RT=2,35, чисто та: 61%. 4с, 3-[1-(2-{5-[(циклобутилметаноїл)аміно]-2-метилфеніл)етил)піперидин-4-іл]-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і циклобутанкарбонілхлориду. РХ-МС (m/z): 450 (МН+), RT=2,19, чистота: 62%. 4d, 3-(1-{2-[5-(бензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Η-індолу і бензоїлхлориду. РХ-МС (m/z): 472 (МН+), RT=2,47, чистота: 94%. 4е, 3-(1-{2-[5-(4-фторбензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і 4-фторбензоїлхлориду. РХ-МС (m/z): 490 (МН+), RT=2,40, чистота: 74%. 4f, 3-(1-{2-[5-(4-метоксибензоїламіно)-2-метилфеніл]етил}піперидин-4-іл)-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і 4-метоксибензоїлхлориду. РХМС (m/z): 502 (МН+), RT=2,39, чистота: 85%. 4g, 3-[1-(2-{2-метил-5-[(піридин-3-ілметаноїл)аміно]феніл)етил)піперидин-4-іл]-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і нікотиноїлхлориду. РХ-МС (m/z): 473 (МН+), RT=1,85, чистота: 75%. 4h, 3-[1-(2-{2-метил-5-[(піридин-4-ілметаноїл)аміно]феніл}етил)піперидин-4-іл)-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Η-індолу і ізонікотиноїлхлориду. РХ-МС (m/z): 473 (МН+), RT=1,84, чистота: 80%. 4і, 3-[1-(2-{2-метил-5-[(тіофен-2-ілметаноїл)аміно]феніл)етил)піперидин-4-іл]-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і тіофен-2-карбонілхлориду. РХМС (m/z): 478 (МН+), RT=2,34, чистота: 95%. 4j, 3-[1-(2-{2-метил-5-[(тіофен-3-ілметаноїл)аміно]феніл)етил)піперидин-4-іл]-7-хлор-1Η-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Н-індолу і тіофен-3-карбонілхлориду. РХМС (m/z): 478 (МН+), RT=2,31, чистота: 77%. 4k, 3-[1-(2-{2-метил-5-[(1-[1,2,3]тіадіазол-5-ілметаноїл)аміно]феніл)етил)-піперидин-4-іл]-7-хлор-1Н-індол з 7-хлор-3-{1-[2-(5-аміно-2-метилфеніл)етил]піперидин-4-іл}-1Η-індолу і [1,2,3]тіадіазол-5карбонілхлориду. РХ-МС (m/z): 480 (МН+), RT=2,24, чисто та: 69%. Фармакологічні тестування Сполуки цього винаходу випробовували за добре відомими і відтворними способами. Тести були наступними. Інгібування зв'язування [3H]YM-09151-2 з D4-дофаміновими рецепторами людини За допомогою цього методу в умовах in vitro визначають інгібування лікарськими засобами зв'язування [3H]YM-09151-2 (0,06нМ) з мембранами клонованих D4.2-до фамінових рецепторів людини, експресованих у СНО-клітинах. Модифікований метод від NEN Life Science Products, Inc., сертифікат те хнічних даних РС2533-10/96. Результати представлені нижче в таблиці. Таблиця Дані зв'язування (% інгібування зв'язування при 50нМ) Сполука 3а 3b 3с 3d 3е 3f 3g 3h 3j 3k 3l 3m 3n 3о 3р а % інгібування 83 86 68 89 89 96 86 83 90 91 74 81 76 99 92 Сполука 3q 3r 3s 3t 3u 3v 3x 3y 3z 3aa 3ab 3ac 3ad 3ae 3af % інгібування 97 88 92 75 86 95 90 83 91 96 79 97 83 89 90 Сполука 3ag 4a 4b 4c 4d 4e 4f 4g 4h 4i 4j 4k % інгібування 95 23а 16а 5а 48 44 48 6а 73 85 48 67 Значення ІС 50. Сполуки за цим винаходом, як було встановлено, сильно інгібують зв'язування міченого тритієм YM09151-2 з D4-дофаміновими рецепторами. Сполуки також оцінювали у функціональному тесті, описаному Gazi et al. в Br. J. Pharmcol, 1999, 128, 613-629. В цьому тесті було показано, що сполуки є частковими агоністами або антагоністами D4дофамінових рецепторів. Сполуки за цим винаходом також випробовували в наступних теста х. Інгібування зв'язування [3Н]спіперону з D2-рецепторами Сполуки за цим винаходом вивчали на предмет спорідненості у відношенні D2-дофамінового рецептора за допомогою визначення їхньої здатності інгібувати зв'язування [3Н]спіперону з D2-рецепторами за способом, описаним Hyttel et al. J. Neurochem. 1985, 44, 1615. Інгібування захоплення [3Н]серотоніну синаптосомами інтактного головного мозку щура Сполуки випробували на предмет їх інігбуючего ефекту стосовно зворотного захоплення 5-НТ за допомогою вимірювання їхньої здатності інгібувати захоплення [3Н]серотоніну синаптосомами інтактного головного мозку щура в умовах in vitro. Даний аналіз виконували, як описано Hyttel у Psychopharmacology 1978, 60, 13. Інгібування зв'язування [3Н]кетансерину з 5-НТ2А-рецепторами Сполуки оцінювали у відношенні їх афінності до 5-НТ2A-рецепторів за допомогою визначення їхньої здатності інгібувати зв'язування [3Н]кетансерину (0,50нМ) з мембранами мозку (кора) щура in vitro. Метод описаний у Sanchez et al. Drug Dev. Res. 1991, 22, 239-250. Ефективність у відношенні 5-НТ2C-рецепторів за результатами флюорометрії Сполуки вивчали на предмет їх ефективності у відношенні клітин СНО, експресуючих 5-НТ 2Cрецептори, з використанням аналізу за допомогою флюорометричного візуального планшет-ридера (FLIPR). Це дослідження виконували згідно з інструкцією Molecular Devices Inc. для їхнього набору FLIPR Calcium Assay Kit і з модифікацією за Porter et al. British Journal of Pharmacology 1999, 128, 13. Було встановлено, що ці сполуки мають несуттєву або дуже слабку спорідненість у відношенні D 2дофамінового рецептора. Багато сполук, як також встановлено, мають спорідненість до 5-НТ2А-рецепторів і інгібувальну активність стосовно зворотного захоплення серотоніну. Таким чином, сполуки за цим винаходом вважаються придатними для лікування позитивних і негативних симптомів шизофренії, інших психозів, розладів, пов'язаних із тривожним станом, таких як генералізований тривожний розлад, панічний розлад і обсесивно-компульсивний розлад, депресії, побічних ефектів, викликаних звичайними антипсихотичними агентами, мігрені, а також для поліпшення сну. Зокрема, сполуки за цим винаходом вважаються придатними для лікування позитивних і негативних симптомів шизофренії без викликання екстрапірамідних побічних ефектів. Приклади фармацевтичних форм Фармацевтичні препарати за цим винаходом можна одержати за способами, звичайно застосовуваними в цій галузі. Наприклад, таблетки можна одержати, змішуючи активний інгредієнт зі звичайними ад'ювантами та/або розріджувачами, з наступним пресуванням суміші в звичайній таблетувальній машині. Приклади ад'ювантів або розріджувачів включають: кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камеді й подібні речовини. Можна використовувати будь-які інші ад'юванти або добавки, які звичайно застосовують для таких цілей, такі як барвники, ароматизатори, консерванти тощо, за умови, що вони сумісні з активними інгредієнтами. Розчини для ін'єкцій можна одержати, розчиняючи активний інгредієнт і можливі добавки в частині розчинника для ін'єкцій, переважно в стерильній воді, після чого розчин доводять до необхідного об'єму, стерилізують і вводять у ампули або пляшечки. Можна використовувати будь-які прийнятні добавки, які звичайно застосовуються в цій галузі, такі як засоби для досягнення ізотонічності, консерванти, антиоксиданти тощо. Типові приклади прописів для складів за цим винаходом є наступними. 1) Таблетки, що містять 5,0мг сполуки за цим винаходом в розрахунку на вільну основу: Сполука 5,0мг Лактоза 60мг Кукур удзяний крохмаль 30мг Гідроксипропілцелюлоза 2,4мг Мікрокристалічна целюлоза 19,2мг Натрієва сіль кроскармелози типу А 2,4мг Стеарат магнію 0,84мг 2) Таблетки, що містять 0,5мг сполуки за цим винаходом в розрахунку на вільну основу: Сполука 0,5мг Лактоза 46,9мг Кукур удзяний крохмаль 23,5мг Повідон 1,8мг Мікрокристалічна целюлоза 14,4мг Натрієва сіль кроскармелози типу А 1,8мг Стеарат магнію 0,63мг 3) Сироп, що містить на мілілітр: Сполука 25мг Сорбіт 500мг Гідроксипропілцелюлоза 15мг Гліцерин 50мг Метилпарабен 1мг Пропілпарабен 0,1мг Етанол 0,005мл Ароматизатор 0,05мг Натрієва сіль сахарину 0,5мг Вода до 1мл 4) Розчин для ін'єкцій, що містить на мілілітр: Сполука 0,5мг Сорбіт 5,1мг Оцтова кислота 0,05мг Натрієва сіль сахарину 0,5мг Вода до 1мл
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivatives being useful for the treatment of cns disorders,, a pharmaceutical composition and a method for treatment
Автори англійськоюFelding Jakob, Bang-Andersen Benny, SMITH GARRICK
Назва патенту російськоюПроизводные индола, которые полезны для лечения расстройств цнс, фармацевтическая композиция и способ лечения
Автори російськоюФелдинг Якоб, Банг- Андерсен Бенни, Смит Гаррик Пол
МПК / Мітки
МПК: C07D 409/14, A61P 25/18, C07D 401/14, A61K 31/4545, A61P 25/28, A61P 25/22, A61K 31/454, A61P 25/06, A61P 43/00, C07D 405/14, A61P 25/20, A61K 31/5377, C07D 417/14, A61P 25/24, C07D 401/04
Мітки: фармацевтична, похідні, розладів, композиція, корисні, лікування, індолу, спосіб, цнс
Код посилання
<a href="https://ua.patents.su/13-73995-pokhidni-indolu-shho-korisni-dlya-likuvannya-rozladiv-cns-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу, що корисні для лікування розладів цнс, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Пристрій для запобігання витіканню шлаку при випуску металевого розплаву
Наступний патент: Пружинна клема рейкового скріплення
Випадковий патент: Акустооптичний матеріал для іч-діапазону












