Антипаразитичні похідні артемізину (ендопероксиди)
Номер патенту: 75325
Опубліковано: 17.04.2006
Автори: Хейнс Річард Кінгстон, Чан Хо-Вай, Цанг Хінг-Во, Чунг Ман-Кі, Лам Вай-Лун
Формула / Реферат
1. Сполука загальної формули (І)
,(I)
в якій
Y означає групу –NR1R2; де
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють повністю насичену 6-членну гетероциклічну групу, що може бути заміщена одним або більшою кількістю замісників з ряду, що включає атоми галогенів, С1-4 алкіл, С1-4 галоалкіл, С1-6 алкоксикарбоніл, феніл, галофеніл, С1-4 алкілфеніл, С1-4 галоалкілфеніл, С1-4 алкоксифеніл, бензил, піридил і піримідиніл.
2. Сполука згідно з п. 1, в якій Y означає морфолініл, тіоморфолініл, морфолінсульфоніл, фенілпіперазиніл, фторфенілпіперазиніл, хлорфенілпіперазиніл, метилфенілпіперазиніл, трифторметилфенілпіперазиніл, метоксифенілпіперазиніл, бензилпіперазиніл, піридилпіперазиніл і піримідинілпіперазиніл.
3. Сполука згідно з п. 1, що являє собою 10 -(4’-(S,S-діоксотіо)морфолін-1’-іл)-10-дезоксо-10-дигідроартемізин.
4. Спосіб одержання сполуки загальної формули (І) згідно з п.1, який відрізняється тим, що сполуку загальної формули (II)
,(II)
де Q означає атом водню або триметилсилільну групу,
піддають взаємодії з відповідним галогенуючим агентом, з наступною взаємодією одержаної таким чином сполуки з аміном загальної формули HN1R2R2, де R1 і R2 мають вказані в п.1 значення.
5. Спосіб згідно з п. 4, який відрізняється тим, що використовують сполуку загальної формули (II), де Q означає триметилсилільну групу, яку піддають взаємодії з бромтриметилсиланом.
6. Фармацевтична композиція з антипаразитарною активністю, що містить носій і, як активний інгредієнт, сполуку загальної формули (І) згідно з будь-яким з пп. 1-3.
Текст
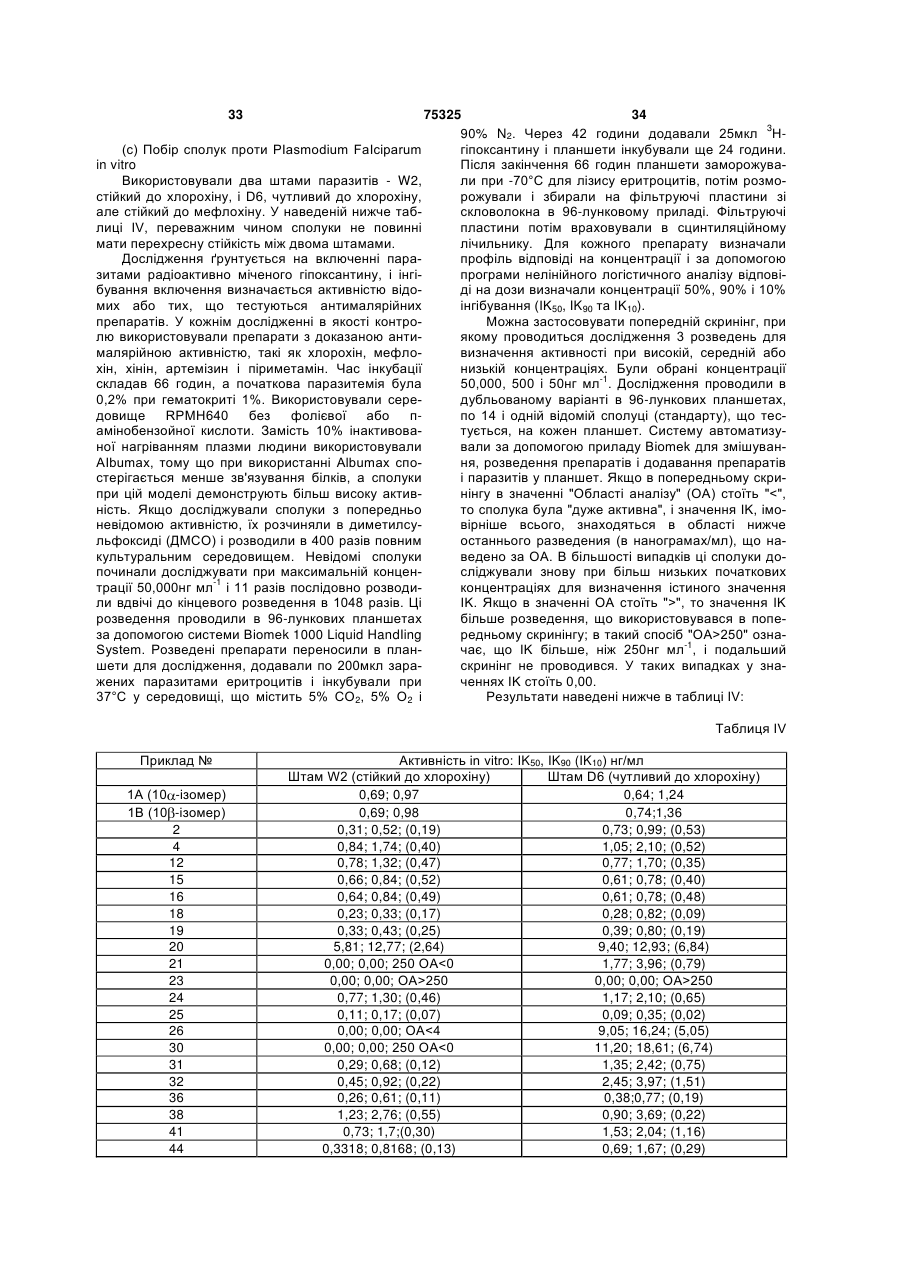
1. Сполука загальної формули (І) (19) 1 3 75325 Даний Корисна модель стосується використання визначених С-10-заміщених похідних артемізину в лікуванні і/або профілактиці захворювань, що викликаються паразитичною інфекцією, та визначення нових С-10-заміщених похідних артемізину, способів їх одержання і фармацевтичної композиції, що містить ці С-10-заміщені похідні. На теперішній час малярія є найбільш важливим у світі паразитичним захворюванням людини. Приблизно 270 мільйонів чоловік в усьому світі інфіковані малярією, причому щороку вмирає близько 2 мільйонів. Завдяки здатності паразитів формувати складний механізм виживання шляхом експресії різних антигенів на поверхні інфікованих еритроцитів вони одержують можливість уникнути руйнівної дії імунної відповіді хазяїна на ці антигени. Крім того, збільшення рівня захворювання малярією пояснюється поширенням стійких до хлору штамів Ptasmodium falciparum і інших штамів, стійких до ряду ліків. В області здоров'я тварин паразитичні захворювання є основною проблемою, особливо захворювання, функціонально зв'язані з малярією. Наприклад, неоспороз це термін, що використовується для опису захворювань, що викликаються у тварин паразитами виду Neospora, особливо Neospora caninum. Інфекції, що викликаються Neospora, зустрічаються у собак, великої рогатої худоби, овець, коз і коней. Кінцевий хазяїн для видів Neospora, включаючи Neospora caninum, невідомий, і, крім того, повний цикл розвитку паразита не ясний. Однак, були виявлені безстатеві фази репродукції, відомі як шизогонія, і наявність стадії одноклітинних тахізоїтів/брадізоїтів. Тахізоїти - це інфекційні одноклітинні паразитичні фази розміром близько 3-7 15мм, що утворюються після внутрішньоклітинної репродуктивно обумовленої ендодіогенії. Репродукція через стадію тахізоїтів відбувається переважно в таких органелах, як нервові й м'язові клітини. Патологічні симптоми, що розвиваються після інфекції, асоційовані в основному в цих тканинах. Приблизно через п'ять або шість тижнів після інфікування собаки природним шляхом, симптоми захворювання включають гіперчутливість, що викликається запаленням нервових клітин, і тенденцію, що підвищується, до надмірного витягування задніх ніг. Спостерігаються очевидні гістопатологічні поразки нервової системи, особливо в 4 мозку і спинному мозку. Великі негнійні запалення, гліозні нарости і периваскулярні інфільтрації переважають у моноядерних клітках (макрофагах, лімфоцитах, клітках плазми), але також частково спостерігаються й в еозинофілах і нейтрофілах. У мускульній системі спостерігаються макроскопічно помітні некрози і дегенеративні зміни. Не враховуючи більш-менш розвинутої атрофії, спостерігаються довгі бліді подовжні смуги. У Каліфорнії й Австралії інфекції, що викликаються Neospora caninum, є основною причиною викиднів у великої рогатої худоби. Симптоми захворювань у худоби подібні із симптомами в собак. Спостерігаються атаксія, ослаблення рефлексів у суглобах, також можуть спостерігатися парези задніх ніг або часткові парези всіх чотирьох ніг. Гістологічна картина; подібна до картини, що спостерігається в собак; в основному спостерігаються негнійні менінгіти й мієліти. Дані з активності in vivo речовин, що підходять для боротьби з неоспорозом, зустрічаються рідко, тому, що ще мають бути розроблені адекватні in vivo тест-системи. Сульфадіазин (що призначається з питною водою) є ефективний при лікуванні експериментально заражених мишей тільки за умови профілактичного лікування, тобто якщо лікування було почато до зараження. У випадку собак лікування сульфадіазином і кліндаміцином є успішним тільки, якщо його розпочинають раніше, тобто з появою перших клінічних симптомів як результату запалення нервових клітин. Кокцидіоїдоз, інфекція тонкої кишки, відносно рідко діагностується в людини, у якої вона викликається tsospora belli. Однак, людина є кінцевим хазяїном для, принаймні, двох, що утворюють кісти, кокцидіоїдальних видів (Sarcocystis suihominis і S. Bovihominis). Уживання сирої або неправильно приготовленої свинини або яловичини, що містить такі кісти, може привести до сильної діареї, причина якої рідко діагностується правильно. Coccidia (тип Apicomptexa, підзагін Eimeriina) є однією з найбільш успішних груп паразитичних найпростіших, що захопили фактично кожен клас вищих організмів. Практичне значення для людини мають 60-100 видів, що паразитують на домашніх тваринах і в деяких випадках можуть викликати значні втрати, особливо це стосується домашнього птаха, хоча стосується також ягнят, телят, поросят, кроликів і інших тварин (дивися таблицю А). Таблиця А Збудники кишкових кокцидіоїдозів у домашніх тварин Тварина 1 курча (Gallus gallus) індичка (Meleargidis gallopavo) гусак (Anser anser) качка (Anas platyhynehus) голуб (Columba livia) Кількість видів Eimeria і/або isospora *) 2 7 7 6 3 2 Найбільш патогенні і/або ті, що часто зустрічаються види (Е=Eimeria, l=lsospora) 3 Ε. Tenella, Ε. Necatrix, E. Maxima, Ε. Acervulina Ε. Meleagrimitis, Ε. Adenoides Ε. Anseris, Ε. Truncata, Ε. Nocens, Ε. Kotlani Tyzzeria perniciosa, Ε. Anatis Ε. Columbarum, Ε. Labbeanea 5 1 75325 2 кролик (Oryctolagus cuniculis) 11 (12) вівця (Ovis arius) коза (Capra hircus) велика рогата худоба (Bos taurus) свиня (Sus scofra) собака (Canis familiaris) 11 (16) 12 (15) 12 (15) 7 (14) 5 кішка (Felis catus) 2+6 6 Продовження таблиці А 3 Ε. Intestinalis, Ε. Ftavescens, Ε. Stiedai, Ε. Magna, Ε. Perforans Ε. Ovinoidalis, Ε. Ashasa, Ε. Ovina Ε. Ninakohlyakimovae, Ε. Arloingi Ε. zuernii, Ε. bovis, E. aubumensis I. suis, Ε. debliecki, Ε. scabra l. canis, l. (Cystisospora) burrowsi I. felis, l. rivolta в якості кінцевих хазяїв: Sarcocystis bovifelis, S. ovifelis, S. fusiformis, S. muris, S.cuniculi, Toxoplasma gondii *) згідно з Peiterdy (1974), Εckert et аl. (1995), Levineand ivens (1970) iMehlhom (1988). Більшість патогенних видів є строго специфічні по відношенню до хазяїна. Вони характеризуються складним життєвим циклом із двома безстатевими фазами репродукції (шизогонія або мерогонія, і спорогонія) і фазою полового розвитку (гаметогонія). Через велику важливість кокцидіоїдозів існує ряд оглядів, наприклад, [Davies et аl. (1963), Hammond and Long (1973); Long (1982 1990) і Pellerdy (1974)]. Економічно вагомі види іноді значно розрізняються по їх чутливості до активних інгредієнтів. Чутливість різних стадій розвитку до медичних агентів також дуже сильно варіює. Що стосується застосування ліків, профілактика є основним підходом стосовно домашнього птаха, в якого симптоми не виявляються до стадії підвищеної захворюваності, а терапія є основним способом по відношенню до ссавців (McDougald 1982). На теперішній час для такого лікування і профілактики серед інших ліків використовують поліефірні антибіотики й сульфаміди. Однак з'явилися стійкі до дії ліків штами Еіmеrіа, і стійкість до ліків являє тепер серйозну проблему. Таким чином, терміново потрібні нові ліки. У зв'язку з численністю патогенних організмів і хазяїв не існує "ідеальної моделі" для ідентифікації і тестування антикокцидіальних агентів. Наприклад, більшість із речовин, що застосовувалися для запобігання кокцидіоїдоза в домашнього птаха, є недостатньо ефективні або зовсім неефективні проти кокцидіоїдозів у ссавців [Habercorn and Mundt, 1989; Habercom 1996]. Опубліковано багато робіт і збірників інструкцій з тестування на тваринах активних речовин для боротьби з кокцидіоїдозом, для імунізації і т.д. Одним з особливо важливих і змістовних є огляд сучасних способів, опублікований Eckert et аl. (1995a). Сполука артемізин, також відома як хінгаосу (1), являє собою тетрациклічний 1,2,4-триоксан, що зустрічається в Artemisia annua. Для лікування малярії використовували артемізин і його похідні дигідроартемізин (2), артемефір (3) і артесунат натрію (4). Різними групами було запропоновано кілька способів, що пояснюють дію артемізину і його похідних у лікуванні малярії [Posner et аl., J. Am. Chem. Soc. 1996, 118, 3537; Posner et аl., J. Am. Chem. Soc. 1995, 117, 5885; Posneretal., J. Med. Chem. 1995, 38, 2273]. Однак, незалежно від способу дії всім поточним похідним властива низька біодоступність при пероральному застосуванні і низька стабільність [Meshnick et al., Parasitology Today 1996, 12, 79], особливо це стосується ефірів "першого покоління" і складних ефірів, артемефіру й артесунату натрію, які одержують з дигідроартемізину. Великі хімічні дослідження артемізину і похідних виявили, що причиною нестабільності є легке розмикання кільця триоксанової частини в самому артемізині або в метаболіті, загальному для всіх похідних, що використовуються на теперішній час, артемефірі, артеефірі й артесунаті, а саме в дигідроартемізині. Розмикання кільця приводить до утворення вільного гідропероксиду, що піддається відновленню. Видалення цієї групи обумовлює порушення активності препарату, а продукти відновлення перетворюються в дезоксометаболіти. Для того щоб розмикання кільця було менш легким, атом кисню в положенні С-10 можна або видалити з утворенням 10дезоксидигідроартемізину, або замінити на інші групи, і цей спосіб забезпечив базу для так званих сполук "другого покоління", що взагалі є похідними 10-дезоксиартемізину. Крім того, були одержані похідні артемізину з різними замісниками в положенні С-9. Також відомі похідні артемізину, в яких атом кисню в положенні С-10 заміщений на аміногрупу. Наприклад, Yang et аl. [Biorg. Med. Chem. Lett., 1995, 5, 1791-1794] синтезували десять нових похідних артемізину, в яких атом кисню в положенні С-10 заміщений на групу-NHAr, де Аr являє феніл-, 3-хлорфеніл, 4-хлорфеніл, 3-бромфеніл-, 4бромфеніл-, 4-йодфеніл-, 4-метилфеніл-, 4метоксифеніл-, 3-карбоксифенілабо 4 7 75325 8 карбоксифеніл- групу. Ці речовини тестували на in СН2- група або подібний sp3-гібридизований центр vivo активність проти штаму К173 Plasmodium між атомом вуглецю, що утворює частину подвійberghei, і було виявлено, що вони активні. ного або потрійного С-С зв'язку й атомом азоту, з Хоча поточні похідні артемізину є вдалі, існуяким зв'язана група. ють проблеми, зв'язані зі стабільністю, біодоступПеревагу мають алкенільні й алкінільні групи, ністю і потенційною нейротоксичністю. Також існує що включають пропеніл, бутеніл, пропініл і бутипотреба в похідних артемізину, що будуть мати ніл. Якщо алкільна частина утворює частину іншої широкий спектр дії проти різних паразитів. групи, наприклад, алкільну частину аралкільної На теперішній час виявлено, що визначені Сгрупи, краще, щоб вона містила до 6, найкраще 10-заміщені похідні артемізину ефективні в лікудо 4 атомів вуглецю. Кращими алкільними фрагванні захворювань, що викликаються інфікуванням ментами є метил і етил. паразитом. Такі сполуки особливо ефективні при Арильна група може бути будь-якою ароматилікуванні захворювань, що викликаються інфікучною вуглеводневою групою і може містити від 6 ванням паразитом роду Plasmodium, Neospora або до 24, переважним чином від 6 до 18, найкраще Eimeria, особливо PІasmodium faІciparum, від 6 до 14 атомів вуглецю. Перевагу мають ариNeospora caninum і Eimeria tenella, що викликають льні групи, що включають феніл-, нафтиніл-, анмалярію, неоспороз і кокцидіоїдоз відповідно. Датрил-, фенантрил- і пірил- групи, краще феніл- або ний Корисна модель надає сполуки загальної фонафтил-, найкраще - феніл - групу. Якщо арильна рмули l група утворює частину іншої групи, наприклад арильну частину аралкільної групи, краще, щоб це була феніл-, нафтил-, антрил-, фенантрил- або пірил-, найкраще феніл- або нафтил-, найкращим чином - фенільна група. Аралкільна група може бути будь-якою алкільною групою, заміщеною арильною групою. Переважним чином аралкільна група містить від 7 до 30, краще від 7 до 24, найкращим чином - від 7 до 18 атомів вуглецю, краще, щоб це були бензил-, нафтилметил-, антрилметил-, фенантрилметил- і пірилметильні групи. Перевагу має бензильна груабо їхні солі, па. де Циклоалкільна група може бути будь-якою наΥ означає атом галогену, необов'язково замісиченою циклічною вуглеводневою групою, вона щену циклоалкіл-, арил-, С-зв'язану гетероарилможе містити від 3 до 12, переважним чином від 3 або гетероциклоалкіл- групу або групу -NR1R2; де до 8, найкращим чином - від 3 до 6 атомів вугле1 R означає атом водню або необов'язково заміщецю. Перевагу мають циклопропіл-, циклопентил- і ну алкіл-, алкеніл- або алкініл- групу; R2 означає циклогексильні групи. необов'язково заміщену алкіл-, алкеніл-, алкініл-, Гетероарильна група може бути будь-якою циклоалкіл-, арил- або аралкіл- групу; ароматичною моноциклічною або поліциклічною або кільцевою системою, що містить, принаймні, один R1 і R2 разом з атомом азоту, до якого вони гетероатом. Переважним чином гетероарильна приєднані, утворюють необов'язково заміщену група є 5-18-членною, краще 5-14-членною і найгетероциклічну групу або аміногрупу, одержану з кращим чином - 5-10-членною ароматичною кільнеобов'язково заміщеного ефіру амінокислоти; цевою системою, що містить, принаймні, один гедля використання в лікуванні і/або профілактероатом, обраний з ряду, що включає атоми тиці захворювань, що викликаються інфікуванням кисню, сірки й азоту. Перевагу мають гетероарипаразитом відмінним від роду PIasmodium. льні групи, що включають піридил-, пірилій-, тіопіПридатні солі включають солі приєднання кисрилій-, піроліл-, фурил-, тієніл-, індолініл-, ізоіндолот, що можуть бути одержані взаємодією відповілініл-, індолізініл-, імідазоліл-, піридоніл-, дної сполуки формули I із придатною кислотою, піримідиніл-, піразиніл-, оксазоліл-, тіазоліл-, пуритакою як органічна або мінеральна кислота. Переніл-, хінолініл-, ізохінолініл-, хіноксалініл-, піридавагу мають солі, одержані взаємодією з мінеральзиніл-, бензофураніл-, бензоксазоліл- і акридиніною кислотою, особливо солі, що утворюються льні групи. Таким чином, С-зв'язана гетероарильна взаємодією з хлористоводневою або бромистовогрупа - це гетероарильна група, що відповідає видневою кислотою. Сполуки формули I, де Υ - група щенаведеному опису, що зв'язана з тетрацикліч1 2 1 2 -NR R , де R і R відповідають визначенню вище, ним 1,2,4- триоксановим фрагментом сполуки заособливо підходять для утворення таких солей. гальної формули I через атом вуглецю в Будь-яка алкільна, алкенільна або алкінільна гетероароматичній кільцевій системі. група, якщо не визначено інакше, може бути лінійГетероциклічна група може бути будь-якою ною або розгалуженою і може містити до 12, перемоноциклічною або поліциклічною кільцевою сисважним чином до 6, а найкраще - до 4 атомів вугтемою, що містить, принаймні, один гетероатом, лецю. Перевагу мають такі алкільні групи як вона може бути ненасиченою або частково або метил, етил, пропіл і бутил. Краще, щоб будь-яка цілком насиченою. Термін "гетероциклічна", таким алкенільна або алкінільна група не була алк-1чином, включає як гетероарильні групи, описані еніл-або алк-1-інільною групою, іншими словами, вище, так і неароматичні гетероциклічні групи. краще, щоб була принаймні одна метиленова Переважним чином необхідно, щоб гетероциклічна 9 75325 10 група була 3-18-членною, краще 3-14-членною, рильну групу або 5-10-членну гетероцикліл-С1найкращим чином - 5-10-членною, кільцева систе6алкільну групу, причому кожна група може бути ма повинна містити, принаймні, один гетероатом, необов'язково заміщена одним або більш замісниобраний з ряду, що включає кисень, сірку й азот. ками з групи, що містить галогенові атоми, гідрокПеревагу мають гетероциклічні групи, що включасил-, С1-4алкіл-, С2-4алкеніл-, С1-4галоалкіл, С1-4 ють специфічні гетероарильні групи, вказані вище, алкокси-, аміно-, С1-4алкіламіно-, ди(С1-4 ала також піраніл-, піперидиніл-, піролідиніл-, діоксакіл)аміно-, карбоксил-, С6-10арил, 5-10-членну гетеніл-, піперазиніл-, морфолініл-, тіоморфолініл-, роциклічну і С1-4алкіл- або феніл-заміщені 5-10морфолінізосульфоніл-, тетрагідроізохінолініл- і членні гетероциклічні групи. Зокрема, Υ може явтетрагідрофуранільні групи. ляти собою С6-18арильну групу, необов'язково заГетероциклілалкільна група може бути будьміщену одним або більш замісниками з групи, що якою алкільною групою, заміщеною гетероциклічмістить галогенові атоми, гідроксил-, С1-4алкіл-, ною групою. Краще, щоб гетероциклічна частина С2-4 алкеніл-, С1-4галоалкіл-, С1-4алкокси-, С1-4 габула 3-18-членною, найкраще 3-14-членною, найлоалкокси-, аміно-, С1-4алкіламіно-, ди(С1-4 алкращим чином - 5-10-членною, щоб гетероциклічна кіл)аміно- і карбоксильні групи. Краще, щоб Υ явгрупа відповідала вищенаведеному опису, а алкіляв собою феніл-, нафтил-, антрил- або льна частина являла С1-6 алкільну, переважним фенантрил- групу, причому кожна група необов'язчином С1-4алкільну, краще - метильну групу. ково заміщена одним або більш замісниками з групи, що містить галогенові атоми і гідроксил-, Амінокислота може бути будь-якою метил-, вініл-, С1-4алкокси- і карбоксильні групи. амінокислотою, такою як гліцин, аланін, валін, У підгрупі сполук, якій надається перевага, Υ лейцин, ізолейцин, серин, треонін, цистеїн, цистин, являє собою феніл-, фторфеніл-, хлорфеніл-, метіонін, аспарагінова кислота, глутамінова кислобромфеніл-, триметилфеніл-, вінілфеніл-, метокта, аспарагін, глутамін, лізин, гідроксилізин, аргісифеніл-, диметоксифеніл-, триметоксифеніл-, нін, гістидин, фенілаланін, тирозин, триптофан, карбоксилфеніл-, нафтил-, гідроксинафтил-, метопролін, гідроксипролін або фенілгліцин, показана в ксинафтил-, антрил-або фенантрильну групу. L- або D-конфігурації. Ефір амінокислоти може Особлива перевага надається сполукам, в яких Υбути будь-яким ефіром такої кислоти, причому феніл або триметоксифеніл. перевагу мають алкілові ефіри, особливо С1-4 алкіУ наступному аспекті, якому надається перелові ефіри. вага, Υ може являти собою групу -NR1R2, де R1 У випадку необов'язкового заміщення групаатом водню або С1-6алкільна група, а R2 - С1-6 алзамісник може бути будь-якою із груп, що викорискіл-, С3-8циклоалкіл-, С6-10арил- або С7-16аралкілтовуються звичайно в розробці і/або модифікації 1 2 група, або R і R разом з атомом азоту, до якого фармацевтичних сполук із метою зміни їхньої вони приєднані, являють 5-10-членну гетероцикліструктури/активності, стабільності, біодоступності чну групу або аміногрупу, що утворилася з С1-6 або інших властивостей. Специфічні приклади алкілового ефіру амінокислоти, причому кожна таких замісників включають, наприклад, галогенові група необов'язково заміщена одним або більш атоми, нітро-, ціано-, гідроксил-, циклоалкіл-, алкілзамісниками з групи, що містить галогенові атоми, , алкеніл-, галоалкіл-, алкокси-, галоалкокси-, аміС1-4алкіл-, С1-4галоалкіл-, С1-6алкоксикарбоніл-, но-, алкіламіно-, діалкіламіно-, форміл-, алкоксифеніл-, галофеніл-, С1-4алкілфеніл-, С1-4 галоалкікарбоніл-, карбоксил-, алканоіл-, алкілтіо-, алкіллфеніл-, С1-4алкоксифеніл-, бензил-, піридил- і сульфініл-, алкілсульфоніл-, алкілсульфонато-, піримидинільну групи. Зокрема, Υ може являти арилсульфініл-, арилсульфоніл-, арилсульфонатособою групу -NR1R2, де R1 - атом водню або С1-4 , карбамоїл-, алкіламідо-, арил-, аралкіл-, необоалкільна група, a R2 - С1-4алкіл-, С3-6циклоалкіл-, в'язково заміщений арил-, гетероциклічні й алкілфеніл- або бензил-група, або R1 і R2 разом з атоабо арил- заміщені гетероциклічні групи. У випадмом азоту, до якого вони приєднані, являють 6-10ку, якщо замісник являє собою або містить алкільчленну гетероциклічну групу або аміногрупу, що ну або алкенільну групу, що заміщує, вона може утворилася із С1-4алкілового ефіру амінокислоти, бути лінійною або розгалуженою і може містити до причому кожна група необов'язково заміщена од12, переважним чином до 6, краще - до 4 атомів ним або більш замісниками з групи, що містить вуглецю. Циклоалкільна група може містити від 3 галогенові атоми, С1-4галоалкіл-, С1-4 алкоксикардо 8, переважним чином від 3 до 6 атомів вуглецю. боніл-, феніл-, галофеніл-, С1-4 алкілфеніл-, С1-4 Арильна група або фрагмент може містити від 6 до галоалкілфеніл-, С1-4алкоксифеніл-, бензил-, піри10 атомів вуглецю, причому перевагу мають фенідил- і піримидинільну групи. льні групи. Гетероциклічна група або фрагмент У підгрупі цих сполук, якій надається перевага, може бути 5-10-членною кільцевою системою, що Υ являє собою пропіламіно-, циклопентиламіно-, описана вище. Атом галогену може бути атомом циклогексиламіно-, феніламіно-, фторфеніламіно-, фтору, хлору, брому або йоду, і будь-яка група, що хлорфеніламіно-, бромфеніламіно-, йодфеніламімістить галофрагмент, така як галоалкільна група, но-, метоксикарбонілфеніламіно-, біфеніламіно-, може таким чином містити будь-який один або бензиламіно-, фторбензиламіно-, більш цих галогенових атомів. біс(трифторметил)бензиламіно-, фенілетиламіно-, В іншому аспекті, краще, коли Υ являє собою фенілметоксикарбонілметиламіно-, діетиламіно-, атом галогену, зокрема, атом або фтору брому, і морфолініл-, тіоморфолініл-, морфоліносульфоособливо атом фтору. ніл-, індолініл-, тетрагідроізохінолініл-, фенілпіпеВ іншому аспекті, якому надається перевага, Υ разиніл-, фторфенілпіперазиніл-, хлорфенілпіпеможе являти собою С3-8циклоалкільну групу, С6разиніл-, метилфенілпіперазиніл-, 18арильну групу, 5-10-членну С-зв'язану гетероа 11 75325 12 трифторметилфенілпіперазиніл-, метоксифенілпіГалогенувальні агенти для одержання сполук перазиніл-, бензилпіперазиніл-, піридилпіперазизагальної формули I, в яких Υ - атом галогену, ніл- і піримідинілпіперазинільну групу. Перевагу включають діетиламіносульфотрифторид, хлортмають сполуки, в яких Υ - пропіламіно-, феніламіриметилсилан, бромтриметилсилан і йодтриметино-, бромфеніламіно-, йодфеніламіно-, біфенілалсилан. Зокрема, сполуки загальної формули I, в міно-, бензиламінояких Υ - атом хлору, брому або йоду, можуть бути ,біс(трифторметил)бензиламіно-, фенілетиламіно-, одержані взаємодією сполуки загальної формули феніл-метоксикарбонілметиламіно- або морфоліII, де Q-триметилсилільна група, з придатним хлонільна група. рувальним, бромувальним або йодувальним агенПереважним чином, паразит являє собою ортом відповідно, наприклад, хлортриметилсиланом, ганізм роду Neospora або роду Eimeria. бромтриметилсиланом або йодтриметилсиланом Даний Корисна модель описує також викорисвідповідно. Цю реакцію зручно проводити в присутання сполуки загальної формули I, що відповідає тності розчинника. Придатні розчинники включавищенаведеним визначенням, для виробництва ють галогеновані вуглеводні, особливо хлоровані ліків для лікування і/або профілактики захворювуглеводні, такі як дихлорметан. Реакцію перевавань, що викликаються інфікуванням паразитом жним чином проводять при температурі від -30°С відмінним від роду Piasmodium. Переважним чидо +10°С, краще від -5°С до +5°С, причому найном паразит являє собою організм роду Neospora краще при 0°С. або роду Eimeria. Сполуки загальної формули I, де Υ - атом Визначені сполуки загальної формули I є нофтору, зручно одержувати взаємодією сполуки вими, і Корисна модель далі описує сполуку загазагальної формули II, де Q - атом водню, з придальної формули I, що відповідає вищенаведеним тним фторуючим агентом, таким як діетиламіносувизначенням, за умови, що якщо Υ являє собою льфотрифторид. Цю реакцію зручно проводити в групу -NR1R2 і R2 являють собою феніл-, 3присутності розчинника, причому придатні розчинхлорфеніл-, 4-хлорфеніл-, 3-бромфеніл-, 4ники включають галогеновані вуглеводні, особлибромфеніл-, 4-йодфеніл-, 4-метилфеніл-, 4во хлоровані вуглеводні, такі як дихлорметан. Реаметоксифеніл-, 3-карбоксифенілабо 4кцію переважним чином проводять при карбоксифенільну групу, то R1 - необов'язково затемпературі від -5°С до кімнатної, тобто від -5°С міщена алкільна група. до 30°С. Реакцію також можна проводити в атмоТакож слід враховувати те, що сполуки загасфері інертного газу, наприклад, азоту. льної формули I можуть існувати у вигляді різних Реактиви Грін'яра, що придатні для одержання геометричних і оптичних ізомерів. Таким чином, сполук загальної формули I, в яких Υ - необов'язданий Корисна модель включає як індивідуальні ково заміщена циклоалкіл-, арил-, С-зв'язана гетеізомери, так і суміші ізомерів. роарил- або гетероциклоалкільна група, включаДаний Корисна модель описує також спосіб ють сполуки загальної формули YMgX, де X - атом одержання нової сполуки загальної формули I, що хлору, брому або йоду. Однак найкраще, щоб X описана на абзац вище, який включає взаємодію являв атом брому. Взаємодію сполуки загальної сполуки загальної формули II формули I, де Υ - атом галогену, переважним чином брому, з реактивом Грін'яра зручно проводити в присутності розчинника. Придатні розчинники включають ефіри, такі як діетиловий ефір. Реакцію переважним чином проводять в атмосфері інертного газу, наприклад, азоту, при температурі від 5°С до +5°С, причому найкраще при 0°С. При застосуванні цього способу виходить один чистий ізомер кінцевого продукту. Взаємодію аміну з сполукою загальної формули I, де Υ - атом галогену, переважним чином брому, для утворення сполуки загальної формули I, де Q - атом водню або триметилсилільна груде Υ - група -NR1R2, де R1 і R2 відповідають вищепа, з придатним галогенувальним агентом з утвонаведеним визначенням, зручно проводити в приренням сполуки загальної формули I, в якій Υ сутності розчинника. Придатні розчинники вклюатом галогену; і при необхідності взаємодію одерчають галогеновані вуглеводні, переважним чином жаної таким чином сполуки загальної формули I з хлоровані вуглеводні, такі як дихлорметан, і ефіри, реактивом Грін'яра загальної формули YMgX, де Υ такі як тетрагідрофуран. Реакцію переважним чи- необов'язково заміщена циклоалкіл-, арил-, Сном проводять при температурі від -5°С до +5°С, зв'язана гетероарил або гетероциклоалкільна групричому найкраще при 0°С. па, а X - атом галогену, з утворенням сполуки заУ випадку, коли сполука загальної формули I, гальної формули I, в якій Υ - необов'язково заміде Υ - атом брому, буде далі введений до взаємощена циклоалкіл-, арил-, С-зв'язана гетероарил дії з реактивом Грін'яра або аміном для одержання або гетероциклоалкільна група; або з аміном загасполуки загальної формули I, де Υ - необов'язково 1 2 1 2 льної формули HNR R , де R і R відповідають заміщена циклоалкіл-, арил-, С-зв'язана гетероавищенаведеним визначенням, з утворенням спорил- або гетероциклоалкільна група або група 1 2 луки загальної формули I, в якій Υ - NR R -група, NR1R2, де R1 і R2 відповідають вищенаведеним 1 2 де R і R відповідають вищенаведеним визначенвизначенням, краще, щоб сполука загальної форням. мули I, де Y - атом брому, була одержана in situ 13 75325 14 взаємодією сполуки загальної формули II, де Q ступну частину реакції переважним чином провотриметилсилільна група, з бромтриметилсиланом. дять в атмосфері інертного газу, наприклад, азоту. Сполуку загальної формули II, де Q - триметиЦю частину реакції краще проводити при темпералсилільна група, можна одержати взаємодією дитурі від -60°С до 20°С, найкраще від -55°С до гідроартемізину, тобто сполуки загальної формули 30°С, найкращим чином від -40°С до -50°С. II, де Q - атом водню, з хлортриметилсиланом у Сполуки загальної формули I, де Υ - необов'яприсутності основи, такої як піридин або триетизково заміщена арил- або С-зв'язана гетероарильламін. Реакцію переважним чином проводять при на група, можна також одержати взаємодією 10кімнатній температурі, тобто від 15°С до 35°С, ациклоартемізину, сполуки, в якій ациклокси-група найкраще від 20°С до 30°С. має вигляд А(С=О)-О-, де А - необов'язково заміДигідроартемізин, тобто сполука загальної щена алкіл-, циклоалкіл-, арил-, аралкіл-, гетероформули II, де Q - атом водню, є відомою сполуциклічна або поліциклічна група, з сполукою загакою і може бути одержана відомими способами. льної формули Υ-Η, де Υ відповідає Сполуки загальної формули I, де Υ - необов'явищенаведеним визначенням, у присутності призково заміщена циклоалкіл-, арил-, С-зв'язана гедатної кислоти Льюіса. Придатні кислоти Льюіса тероарил- або гетероциклоалкільна група, можна включають трифтордіетилефірат бору, хлорид також одержати взаємодією 9,10олова (IV), трифторметансульфонат міді (II) і триангідроартемізину з сполукою загальної формули фторметансульфонову кислоту. Переважним чиΥ-Η, де Υ відповідає вищенаведеному визначенном кислотою Льюіса є трифтордіетилефірат бору. ню, в присутності придатної кислоти Льюіса. При У випадку, якщо А - необов'язково заміщена застосуванні цього способу в кінцевому продукті алкільна група, то, якщо не визначено інакше, воодержують суміш ізомерів. на може бути лінійною або розгалуженою і може Придатні кислоти Льюіса включають трифтормістити до 12, переважним чином до 6, найкраще діефірат бору і трифторметансульфонову кислоту. до 4 атомів вуглецю. Перевагу мають метил-, Реакцію зручно проводити в присутності розчинниетил-, пропіл- і бутильна групи. ка. Придатні розчинники включають галогеновані У випадку, якщо А - необов'язково заміщена вуглеводні, перевага надається хлорованим вугарильна група, вона може бути будь-якою аромалеводням, наприклад, дихлорметану. Реакцію петичною вуглеводневою групою і може містити від 6 реважним чином проводять в атмосфері інертного до 24, переважним чином від 6 до 18, краще від 6 газу, наприклад, азоту, при кімнатній температурі, до 16 і найкращим чином від 6 до 14 атомів вуглетобто від 15°С до 35°С, найкраще від 20°С до цю. Переважним чином арильні групи включають 30°С. феніл-, нафтил-, антрил, фенантрил і пірил- групи, 9,10-ангідроартемізин зручно одержувати взаособливо феніл-, нафтил- і антрил- групи. Якщо ємодією дигідроартемізину з трифтороцтовим анарильний фрагмент утворює частина іншої групи, гідридом. Реакцію зручно проводити в присутності наприклад, арильний фрагмент аралкільної групи, розчинника, переважним чином галогенованого краще, щоб він являв собою феніл-, нафтил-, анвуглеводню, найкраще хлорованого вуглеводню, трил-, фенантрил- або пірил-, найкраще фенілтакого як дихлорметан. Краще, щоб реакція проабо нафтил-, а найкращим чином фенільний фраводилася в присутності основи, наприклад, піригмент. дину, або його похідного, наприклад, диметиламіУ випадку, якщо А - необов'язково заміщена нопіридину. Реакцію переважним чином проводять аралкільна група, вона може бути будь-якою алків атмосфері інертного газу, наприклад, азоту, при льною групою, заміщеною арильною групою. Петемпературі від -5°С до +5°С, найкраще при 0°С, реважним чином аралкільна група містить від 7 до потім реакційну суміш слід залишити для нагріван30, краще від 7 до 24, найкраще від 7 до 18, а найня до кімнатної температури, тобто 15°С-35°С, кращим чином від 7 до 10 атомів вуглецю, причому краще 20°С-30°С. кращими аралкіл ьними групами є бензил-, нафтил Сполуки загальної формули I, в яких Υ - неметил-, антрилметил-, фенантрилметил- і пірилобов'язково заміщена арил- або С-зв'язана гетеметильна групи, найкраще бензильна група. роарильна група, можна також одержати взаємоУ випадку, якщо А - необов'язково заміщена дією 10-трихлорацетімідоїл-10-дезоксоартемізину циклоалкільна група, вона може бути будь-якою із сполукою загальної формули Υ-Η, де Υ відповінасиченою або частково ненасиченою циклічною дає вищенаведеному визначенню, в присутності вуглеводневою групою і може містити від 3 до 12, придатної кислоти Льюіса, такої як трифтордіетипереважним чином від 3 до 8 і найкраще від 3 до 6 лефірат бору. Краще, щоб 10-трихлорацетімідоїлатомів вуглецю. Кращими циклоалкільними група10-дезоксоартемізин був одержаний in situ взаєми є циклопропіл-, циклопентил- і циклогексильна модією сполуки загальної формули II, де Q - атом групи. У випадку, якщо А - необов'язково заміщена водню, з трихлорацетонітрилом у присутності приполіциклічна група, вона може бути будь-якою надатної основи, такої як 1, 8-діазабіцикло, 8сиченою або частково ненасиченою вуглеводнедіазабіцикло[5.4.0]ундекан. Краще, щоб реакція вою групою, що містить більш однієї кільцевої сисодержання 10-трихлорацетімідоїл-10теми. Такі кільцеві системи можуть бути "злитими", дезоксоартемізину проводилася при кімнатній тетобто кільця, які прилягають, мають два загальних мпературі, тобто від 15°С до 35°С, найкраще від атоми вуглецю, що прилягають, або "місточкови20°С до 30°С. Реакцію зручно проводити в присутми", тобто кільця характеризуються, принаймні, ності розчинника. Придатні розчинники включають двома загальними атомами вуглецю ("кінцями місгалогеновані вуглеводні, переважним чином хлотка") і, принаймні, трьома ациклічними ланцюгами ровані вуглеводні, наприклад, дихлорметан. На("містками"), що з'єднують загальні вуглецеві ато 15 75325 16 ми, або "спіро" з'єднаннями, тобто кільця, що приКорисна модель описує також фармацевтичну лягають, зв'язані одним загальним атомом вуглекомпозицію, що включає носій і нову сполуку загацю. Враховується також варіант, коли поліциклічна льної формули I, що відповідає вищенаведеним група може містити більш одного типу цих кільцевизначенням, як діючий агент. вих систем. Перевага надається поліциклічним Фармацевтично прийнятний носій може бути групам, що містять від 4 до 30, краще від 4 до 26 і будь-яким матеріалом, що сприяє введенню діюнайкраще від 6 до 18 атомів вуглецю. Найбільша чого агенту. Носій може бути твердим або рідким, перевага надається біцикличним, трициклічним і включаючи матеріали, газоподібні за нормальних тетрациклічним групам. Перевага надається біциумов, але стиснуті до утворення рідини, може заклічним групам, що містять від 4 до 14, переважстосовуватися будь-який носій, який звичайно виним чином від 6 до 10 вуглецевих атомів. Перевакористовують для створення фармацевтичних га надається трициклічним групам, що містять від композицій. Відповідно до даного корисної моделі 5 до 20, переважним чином від 6 до 14 атомів вугперевагу мають фармацевтичні композиції, що лецю, причому найбільша перевага надається містять діючу речовину в кількості від 0,5 до 95% антрахіноновим групам. Перевага надається тетмаси. рациклічним групам, що містять від 6 до 26, переСполуки загальної формули ί можуть входити важним чином від 6 до 18 атомів вуглецю. до складу таблеток, капсул, супозиторіїв або розНеобов'язкові замісники групи А можуть бути чинів. Ці склади можна одержати відомими способудь-якими з описаних вище, придатних до даного бами при використанні придатних твердих носіїв, випадку. наприклад, лактози, крохмалю або тальку, або Реакцію зручно проводити в присутності розрідких носіїв, наприклад, води, жирових масел або чинника. Придатні розчинники включають галогерідких парафинів. Iнші можливі носії включають новані вуглеводні, особливо хлоровані вуглеводні, матеріали, що одержуються з тваринних або ростакі як дихлорметан. Реакцію переважним чином линних протеїнів, наприклад, желатини, декстрини проводять в атмосфері інертного газу, наприклад, й сою, протеїни з насінин пшениці і PsyIIium; смоазоту. Перевагу має температура реакції, що знали, такі як акацієва, гуарова, агар і ксантан; поліходиться в діапазоні від -60°С до -20°С, краще від сахариди; альгінати; карбоксиметилцелюлози; -55°С до -30°С, найкращим чином від -40°С до карагенани; декстрани; пектини; синтетичні полі50°С. мери, такі як полівінилпіролідон; поліпептидСполуки загальної формули I, в яких Υ - заміні/білкові або полісахаридні комплекси, такі як щена арильна група, де принаймні один із заміскомплекси желатин - акація; цукри, такі як манітол, ників - гідроксильна група, можна одержати також декстроза, галактоза і трегалоза; циклічні цукри, перегрупуванням відповідного C-10 ефірного похітакі як циклодекстрин; неорганічні солі, такі як фодного артемізину таким чином, що атом кисню сфат натрію, хлорид натрію і силікати алюмінію; і ефірного зв'язку стає атомом кисню гідроксильної амінокислоти, що містять від 2 до 12 атомів вуглегрупи в заміщеній арильній групі необхідного процю, такі як гліцин, L-аланін, L-аспарагінова кислодукту. Таке перегрупування може досягатися взата, L-глутамінова кислота, L-гідроксипролін, Lємодією відповідного С-10 ефірного похідного арізолейцин, L-лейцин і L-фенілаланін. темізину з кислотою Льюіса, такою як У композицію можуть бути також включені дотрифтордіефірат бору. Реакцію зручно проводити поміжні компоненти, такі як дезінтегратори, солюв присутності розчинника, такого як дихлорметан, білізатори, консерванти, антиоксиданти, поверхпри температурі від -5°С до +5°С, переважним нево-активні речовини, речовини, що підвищують чином при 0°С. в'язкість, барвники, коригенти органолептичних Визначені сполуки загальної формули I можна властивостей, pH модифікатори, підсолоджуючі одержати також перетворенням іншої сполуки заабо маскуючи смак агенти. Придатні барвники гальної формули I. Наприклад, 10-(4-вінілфеніл)включають червоний, чорний і жовтий оксиди залідигідроартемізин можна перевести в 10-(4за і FD & С барвники, такі як FD & С синій №2 і FD карбоксифеніл)дигідроартемізин взаємодією з & С червоний №40, що доступні від EIIis & Everard. агентом, що окислює, таким як перманганат калію. Придатні коригенти органолептичних властивосТакож сполуки загальної формули I, що містять тей включають м'ятний, малиновий, лакричний, гетероциклічний фрагмент, що містить принаймні апельсиновий, лимонний, грейпфрутовий, карамеодин атом сірки в кільцевій системі, можуть бути льний, ванільний, вишневий і виноградний коригеокислені до сполук загальної формули I, в яких нти органолептичних властивостей і їх комбінації. єдиний або кожен атом сірки перетворений у суПридатні pH модифікатори включають лимонну льфініл- або сульфоніл- групу, взаємодією з прикислоту, винну кислоту, фосфорну кислоту, соляну датним агентом, що окислює. Придатні агенти, що кислоту і малеїнову кислоту. Придатні подсолодуокислюють, включають N-оксид 4-метилморфоліну вачі включають аспартам, ацесульфам К і таума(NMO), перутенат тетрапропіламонію (ТРАР) і їхтин. Придатні маскуючі смак агенти включають ньої суміші. Реакцію зручно проводити в присутногідрокарбонат натрію, іон-обмінні смоли, сполуки, сті розчинника, причому придатні розчинники що включають циклодекстрин, адсорбати або міквключають галогеновані вуглеводні, особливо роінкапсульовані активні добавки. хлоровані вуглеводні, такі як дихлорметан. РеакДля лікування або профілактики кокцидіоїдозів цію переважним чином проводять при кімнатній і захворювань, зв'язаних з паразитами, наприклад, температурі, тобто від 15°С до 35°С, краще від у птахівництві, особливо в курчат, качок, гусей і 20°С до 30°С. Реакцію можна проводити також в індичок, слід змішати від 0,1 до 100чнм (частин на атмосфері інертного газу, наприклад, азоту. мільйон), переважно від 0,5 до 100чнм активної 17 75325 18 речовини з придатним їстівним матеріалом, наMgSO4. Відразу після випарювання розчинника приклад, з комбікормом. При бажанні можна збізалишок двічі очищали флеш-хроматографією на льшити кількість діючої речовини, особливо якщо колонці (10% етилацетат/гексан), з наступною певона добре переноситься реципієнтом. Діючу ререкристалізацією з гексану (289мг, 50,5%); 1Н ЯМР човину можна давати також з питною водою. (300МГц, CDCl3): м,ч, 0,97 (d, J6-Me, 6=6,1Гц, 3Η, 6При лікуванні однієї тварини, наприклад при СН3), 1,00 (d, J9-Me, 9=7,4Гц, 3Η, 9-СН3), 1,13-1,47 лікуванні кокцидіоїдоза або токсоплазмози в ссав(m, 3Η), 1,44(s, 3Н, 3-СН3), 1,47-1,72 (m, 4Η), 1,82ців, для одержання кращого результату признача1,96 (m, 2Η), 2,05 (ddd, J=14,6Гц, J=4,9Гц, J=3,0Гц, ють щодня від 0,5 до 100мг діючої речовини/кг 1Η), 2,39 (td, J=13,5Гц, J=4,0Гц, 1Η), 2,64 (dm, J9, ваги. Однак іноді потрібно відступити від згаданих F=36,1Гц, 1Η, Η-9), 5,60 (dd, J10-F=54,4Гц, J10, 19 дозувань у залежності від ваги експериментальної F 9=2,4Гц, 1Η, Η-10), 5,56 (d, J=1,83Гц, 1Η, Н=12); тварини, способу введення, виду тварини і н індиЯМР (282МГц, CDCl3): (м.ч.) = -136,43 (dd, JF, відуальної реакції на речовину або склад або час і 10=54,1Гц, JF, 9=36,0Гц); MC (CI, NH3): m/z (%) = 304 інтервал введення ліків. У деяких випадках може [M++NH4+] (18), 286 [M+], 284 [304 - HF] (100), 267 бути достатньо використати кількість, меншу за(64), 256 (28), 239 (16), 221 (12), 163 (8), 52 (28). значеного мінімуму, тоді як в інших випадках можПриклад 2 на перевищити максимальну дозу. У випадку заОдержання 10 -феніл-10-дезоксо-10-дигідростосування більшої дози слід розділити її на артемізину (10 -(феніл)-дигідроаотемізину) (Фордекілька менших. мула I: Υ=феніл) Корисна модель включає також нову сполуку (а) Одержання 10загальної формули І, визначену вище, що засто(триметилсилокси)дигідроаотемізину (Формула II: совується для лікування і/або профілактики захвоQ=-Si(CH3)3) рювання, що викликається інфікуванням паразиСпосіб 1 том роду PІasmodium і використання нової сполуки До розчину дигідроартемізину (1,51м, загальної формули І, визначеної вище, у виробни5,32ммоль) у піридині (20мл) при 0°С в атмосфері цтві ліків для лікування і/або профілактики захвоазоту додавали по краплях хлортриметилсилан рювання, що викликається інфікуванням парази(5,20мл, ммоль). Суміш перемішували при кімнаттом роду PІasmodium. У цьому аспекті перевага ній температурі ще 1 годину і вливали в суміш вонадається сполукам, що включають сполуки загади й льоду. Розчин екстрагували діетиловим ефільної формули І, в яких Υ - атом фтору, Υ - феніл-, ром (3 15мл), сушили (MgSO4) і концентрували у диметоксифеніл- або триметоксифенільна група вакуумі. Залишок очищали флеш-хроматографією або Υ - пропіламіно-, фторфеніламіно-, біфеніла(SiO2; 5% етилацетат/гексани) з виходом 10 міно-, бензиламіно-, фенілетиламіно-, фенілмето(триметилсилокси)дигідроартемізину у вигляді ксикарбонілметиламіно- або діетиламінова група. твердої білої речовини (1,47м, 78%). Н 5,49 (1H, s, Корисна модель також описує спосіб лікування Н-12), 5,19 (1Н, d, J=3,05Гц, Н-10), 2,52-2,62 (1Н, захворювання, що викликається інфікуванням паm, Н-9), 2,39 (1Н, ddd, J=17,5, 13,4, 4,01Гц), 2,04 разитом відмінним від роду PІasmodium, що вклю(1Н, ddd, J=14,5, 4,84, 3,05Гц), 1,20-1,97 (9H, m), чає призначення хазяїну, який потребує лікування, 1,45 (3Н, s, H-14), 0,97 (3Н, d, J=6,24Гц, Н-16), 0,87 терапевтично ефективної кількості сполуки зага(3Н, d, J=7,29Гц, Н-15), 0,17 (9Н, s, (CH3)3Si). льної формули І, що відповідає першому вищенаСпосіб 2 веденому визначенню. Переважним чином, параОдержання 10 зитами є організми роду Neosoora або роду (триметилсилокси)дигідроартемізину) (Формула ІI: Eimeria. Також описується спосіб лікування захвоQ=-Si(CH3)3) рювання, що викликається інфікуванням паразиДо розчину дигідроартемізину (1,51г, том роду PІasmodium, що включає призначення 5,32ммоль) у дихлорметані (40мл) при 0°С в атмохазяїну, який потребує лікування, терапевтично сфері азоту додавали по краплях триетиламін ефективної кількості нової сполуки загальної фор(0,94мл, 6,65ммоль) і хлортриметилсилан (0,84мл, мули ), визначеної вище. 6,65ммоль). Реакційну суміш перемішували при Корисна модель ілюструється наступними кімнатній температурі протягом ще 1 години і потім прикладами. вливали в суміш води і льоду. Водяний шар екстПриклад 1 рагували дихлорметаном (2 20мл). Органічні шаОдержання 10 -фтор-10-дезоксо-10-дигідоори об'єднували, сушили (MgSO4) і концентрували у аотемізину (10 -фтор-10вакуумі. Залишок очищали флеш-хроматографією дезоксодигідооаотемізину) (Формула І: Υ=F) (SiO2; 5% етилацетат/гексани) з виходом 10 Розчин дигідроартемізину (1,136м, 4ммоль) у (триметилсилокси)дигідроартемізину у вигляді дихлорметані (24мл) охолоджували до 0°С в атмобілої твердої речовини (1,48г, 78%). H 5,32 (1Н, s, сфері азоту і додавали до нього діетиламіносульН-12), 4,76 (1Н, d, J=9,00Гц, Н-10), 2,25-2,45 (2H,m, фотрифторид (DAST) (0,6мл, 4,8ммоль). Реакційну Н-8, Н-9), 2,01 (1Н, m, Н-4), 1,89 (1Н, m, Н-5), 1,18суміш залишали для нагрівання до кімнатної тем1,79 (8Н, m, Н-2а, H-2b, H-3а, Н-3b, Н-6а, Н-6b, Нператури і потім перемішували в атмосфері азоту 7а, Н-7b), 1,31 (3Н, s, 1-СН3), 0,95 (3Н, d, J=5,83Гц, протягом 24 годин. Жовтий розчин знову охоло9-СН3), 0,86 (3Н, d, J=7,14Гц, 5-СН3), 0,20 (9Н, s, джували до 0°С, додавали до нього розчин Me3Si) м.ч. Na2СО3 (5%, 20мл) і перемішували реакційну су(b) Одержання 10-бром-10-дезоксо-10міш протягом 2 годин при кімнатній температурі. дигідроартемізину (10-бромартемізину) (Формула Потім розділяли дві фази й органічний шар промиl: Υ=Вr) вали 1М НСl, 5% NaНСО і водою і сушили над 3 19 75325 20 До розчину 10 78%). Н 5,32 (1Н, s, Н-12), 4,76 (1Н, d, J 9,00Гц, Н(триметилсилокси)дигідроартемізину (372мг, 10), 2,25-2,45 (2Н, m, Н-8, Н-9), 2,01 (1Н, m, Н-4), 1,04ммоль), одержаного як описано вище в (а) 1,89 (1Н, m, Н-5), 1,18-1,79 (8Н, m, Н-2а, Н-2b, НСпособі 2, у дихлорметані (5мл) при 0°С додали 3а, Н-3b, Н-6а, Н-6b, Н-7а, Н-7b), 1,31 (3Н, s, 1по краплях бромтриметилсилан (140мкл, СН3), 0,95 (3Н, d, J 5,88Гц, 9-СН3), 0,86 (3Н, d, J 1,06ммоль). Реакційну суміш перемішували при 7,14Гц, 5-СН3), 0,20 (9Н, s, Me3Si) м.ч. 0°С ще протягом 30 хвилин з одержанням 10(b) Одержання 10 -(4'-фторбензиламіно)-10бромартемізину in situ. дезоксо-10-дигідроартемізину (10 -(4'(c) Одержання 10 -феніл-10-дезоксо-10фторбензиламіно)дигідроартемізину) (Формула І: дигідроартемізину (10 -(феніл)дигідроаотемізину) Υ=-NR1R2; R1=Η, R2=4-F-бензил) (Формула l: Υ=феніл) До розчину 10 Розчин, одержаний у (b), концентрували у ва(триметилсилокси)дигідроартемізину (214мг, куумі. Залишок розчинили в діетиловому ефірі 0,600ммоль), одержаного як описано вище в (а), у (5мл). До цього розчину додавали фенілмагнійбдихлорметані (5мл) при 0°С додали по краплях ромід (1,40мл, 2,38ммоль, 1,7М) при 0°С в атмосбромтриметилсилан (80мкл, 0,600ммоль). Реакфері азоту. Реакційну суміш перемішували при ційну суміш перемішували при 0°С ще протягом 30 0°С і потім залишали на ніч для досягнення кімнахвилин і потім через канюлю внесли в розчин 4тної температури. Розчин потім обробляли насифторбензиламіну (140мкл, 1,20ммоль) у тетрагідченим розчином хлориду амонію, сушили (MgSO4) рофурані (5мл) при 0°С. Реакційну суміш переміі концентрували у вакуумі. Залишок очищали шували при 0°С і потім залишали на ніч для досягфлеш-хроматографією (SiO2; 8% етилаценення кімнатної температури. Суспензію тат/гексани) з одержанням 10 -феніл-10-дезоксопромивали насиченим розчином NaНСО3, сушили (MgSO4) і концентрували у вакуумі. Залишок очи10-дигідроартемізину (10 щали флеш-хроматографією (SiO2; 15% етилаце(феніл)дигідроартемізину) (159мг, 45%) у вигляді тат/гексани) з виходом 10 -(4'білої твердої речовини. Після перекристалізації із суміші ефір/гексан одержували безбарвний крисфторбензиламіно)дигідроартемізину (76,9мг, 33%) і 9,10-ангідро-10-дезоксо-артемізину (9,10тал прямокутної форми. Т. пл. 122°С; [ ]D20 - 36,0° ангідродегідроартемізину) (84,7мг, 53%) у вигляді (с 0,47/СНСI3); max (плівка) 2938, 2874, 1494, 1452, твердих білих речовин. Т. пл. 45,2-46,3°С; [ ]D20 1376, 1208, 1112, 1076, 1058, 1038, 1010, 954, 944, 18,2° (с 0,055 СНСI3); Н 7,32-7,37 (2Н, m, Аr-Н), 904, 882, 852, 820, 740, 700; H 7,19-7,34 (5Н, m, 6,95-7,02 (2Н, m, Аr-Н), 5,29 (1Н, s, Н-12), 4,10 (1Н, Аr-Н), 5,75 (1Н, d, J=6,70Гц, Н-10), 5,60 (1Н, s, Hd, J=13,8Гц, Η-1'), 4,08 (1Н, d, J=9,76Гц, H-10), 3,91 12), 2,71-2,84(1Н, m, Н-9), 2,31-2,42 (1Н, m), 1,65(1Н, d, J=13,8Гц, Н-1'), 2,33-2,42 (2Н, m), 1,85-2,07 2,12 (5Н, m), 1,28-1,60 (5Н, m), 1,41 (3Н, s, H-14), (3Н, m), 1,65-1,77 (2Н, m), 1,03-1,75 (5Н,m), 1,46 1,01 (1Н, d, J=5,77Гц, Н-16), 0,54 (1Н, d, J=7,68Гц, (3Н, s, Н-14), 0,96 (3Н, d, J=6,02Гц, Н-16), 0,93 (3Н, Н-15); c 141,03, 127,67, 126,24, 126,09, 102,22, d, J=7,19Гц, Н-15); c 136,42 (d, J=3,10Гц), 129,30 90,82, 81,10, 72,99, 51,46, 43,45, 37,46, 36,64, (d, J=7,97Гц), 114,75 (d, J=21,1Гц), 103,90, 91,35, 34,16, 32,08, 25,68, 24,88, 24,71, 19,85, 13,62; m/z 85,47, 80,60, 51,66, 47,50, 45,82, 37,23, 36,26, (Cl, CH4) 345 (M++1,14%), 327 (14), 299 (100); Дані аналізу, обчисл. для С21Н28О4: С, 73,26; Н, 8,14; 34,03, 32,72, 26,03, 24,61, 21,70, 20,15, 14,06; F знайдені С, 73,58; Н, 8,32. 118; m/z (CI, CH4) 392 (M++1, 90%), 374 (54), 346 Дослідження відмінностей ядерного ефекту (100), 328 (20), 267 (16), 209 (16), 165 (26), 109 Оверхаузера: енергія дублетного сигналу Н-10 при (18). Дані аналізу, обчисл. для C22H30NO4F: С, 67,50; Н, 7,72; N, 3,58; знайдені: С, 67,51;Н, 7,77; 5,75 дає 10% збільшення мультиплетного сигнаN, 3,49. лу Н-9 при 2,75; це вказує на те, що стереохімічПриклад 4 но Н-10 і Н-9 знаходяться в син-положенні по відОдержання 10-(2',4'-диметоксифеніл)-10ношенню один до одного. дезоксо-10-дигідроартемізину (10-(2',4'Приклад 3 диметоксифеніл)дигідооартемізину) (Формула I: Одержання 10 -(4'-Фторбензиламіно)-10Υ=2,4-диметоксифеніл) дезоксо-10-дигідроартемізину (10 -(4'(а) Одержання 9,10-ангідро-10фторбензиламіно)дигідроартемізину) (Формула l: дезоксоартемізину (9,10-ангідроартемізину) Υ=-NR1R2; R1=Η, R2=4-F-бензил) До розчину дигідроартемізину (500мг, (a) Одержання 10 1,86ммоль) у дихлорметані (28мл) при 0°С в атмо(триметилсилокси)дигідроартемізину (Формула II: сфері азоту додали 4-(N,N-диметиламіно)піридин Q=-Si(CH3)3) (37мг) і трифтороцтовий ангідрид (0,79мл, До розчину дигідроартемізину (1,51г, 5,58ммоль). Реакційну суміш залишили для досяг5,32ммоль) у дихлорметані (40мл) при 0°С в атмонення кімнатної температури і перемішували просфері азоту додавали по краплях триетиламін тягом ночі. Потім розчин концентрували у вакуумі. (0,94мл, 6,65ммоль). Суміш перемішували при Залишок очищали флеш-хроматографією (SiO2; кімнатній температурі ще 1 годину і вливали в суефір:гексан від 0,5:9,5 до 1,5:8,5) з виходом 9,10міш води й льоду. Водяний розчин екстрагували ангідро-10-дезоксоартемізину (9,10дихлорметаном (2 20мл), сушили (MgSO4) і конангідроартемізину) (180мг, 25%) у вигляді твердої центрували у вакуумі. Залишок очищали флешбілої речовини. Т. пл. 100°С; [ ]D20,5 + 155,74° (с хроматографією (SiO2; 5% етилацетат/гексани) з 0,0101 в СНСІ3); max (плівка): 2948, 2922, 2862, виходом 10 -(триметилсилокси)дигідро2850, 1684, 1432, 1372, 1334, 1198, 1178, 1158, артемізину у вигляді твердої білої речовини (1,48г, 21 75325 22 1142, 1114, 1078, 1028, 1016, 992, 954, 944, 904, гідрокарбонату натрію (2 5мл), сушили (MgSO4) і 880, 828, 812; Н : 6,18 (1Н, s, Н-10), 5,54 (1Н, s, Нконцентрували у вакуумі. Залишок очищали флеш12), 2,40 (1Н, ddd, J=17,1, 13,2, 4,14Гц, Н-9), 2,00хроматографією (SiO2; 10% етилацетат/гексани) з 2,09 (2H,m), 1,88-1,95 (1H,m), 1,07-1,73 (8H,m), виходом 10 -(2'-гідрокси-1'1,58(3H, d, J=1,37Гц, H-16), 1,42 (3Н, s, Н-14), 0,98 нафтил)дигідроартемізину у вигляді твердої білої + (3Н, d, J=5,98Гц, Н-15); m/z (Εl): 380 (М ); Дані речовини (72,7мг). Н 8,91 (1Н, s, ОН), 7,28-7,91 аналізу, обчисл. для С15Н22О4: С, 67,67; Н, 8,27; (6Н, m, Аr-Н), 5,57 (1Н, s, Н-12), 3,11-3,19 (1Н, m), знайдені: С, 67,63; Н, 8,51. 1,28-2,55 (11Н, m), 1,51 (3Н, s, Н-14), 1,04 (3Н, d, (b) Одержання 10-(2',4'-диметоксифеніл)-10J=5,96Гц, Н-16), 0,63 (3Н, d, J=7,23Гц, Н-16). дезоксо-10-дигідроартемізину (10-(2',4'Приклад 6 диметоксифеніл)дигідроартемізину) (Формула l: Одержання 10 -(4'-тіоморфоліно-1'-іл)-10Υ=2,4-диметоксифеніл) дезоксо-10-дигідроартемізину (10 До розчину 9,10-ангідро-10-дезоксоартемізину (тіоморфоліно)дигідроартемізину) (Формула l: (9,10-ангідроартемізину) (191мг, 0,71ммоль), одеΥ=тіоморфоліно) ржаного як описано вище в (а), і 1,3У результаті реакції броміду, одержаного з диметоксибензолу (130мкл, 1,00ммоль) у дихлор10 -(триметилсилокси)дигідроартемізину (356мг, метані (10мл) при кімнатній температурі в атмос1,00ммоль) як описано вище в Прикладі 3 (b), з фері азоту додали трифтордіетилефірат бору (2 тіоморфоліном (300мкл, 3,00ммоль), після флешкраплі). Розчин перемішували ще протягом 1 гохроматографії (8% етилацетат/гексани) одержали дини і потім обробили 20% розчином соляної кис10 -(тіоморфоліно)дигідроартемізин (243мг, 66%) лоти (5мл). Суміш екстрагували діетиловим ефіу вигляді твердої білої речовини. Т. пл. 147,0ром (3 20мл), ефірні екстракти сушили (MgSO4) і 147,6°С; [ ]D20 + 17° (c 0,021/CHCl3); max (плівка) концентрували у вакуумі. Залишок очищали флеш2924, 2872, 1454, 1418, 1376, 1326, 1278, 1226, хроматографією (SiO2; 15% етилацетат/гексани) з 1198, 1184,1154, 1130, 1100, 1056, 1038, 1018, 988, виходом 10-(2',4'-диметоксифеніл)-10-дезоксо-10940, 926, 880, 850, 828, 756; H 5,23 (1Н, s, Н-12), дигідроартемізину (10-(2',4'3,93 (1Н, d, J=10,21Гц, Н-10), 3,20-3,28 (2Н, m), диметоксифеніл)дигідроартемізину) (89,5, 44%) у 2,85-2,93 (2Н, m), 2,53-2,68 (5Н, m), 2,25-2,36 (1Н, вигляді твердої білої речовини. Н 7,56 (1Н, шс, m), 1,93-2,01 (1Н, m), 1,78-1,86 (1Н, m), 1,63-1,70 J=8,4Гц, Ar-Η), 6,40-6,58 (2H, m, Ar-H), 5,43 (1H,s, (2Н, m), 1,14-1,52 (5Н, m), 1,36 (3H, s, Н-14), 0,90Н-12), 5,42 (1Н, s, Н-12'), 5,16 (1Н, d, J=10,8Гц, Н1,04 (1Н, m), 0,91 (3Н, d, J=6,14Гц, Н-16), 0,76 (3Н, 10), 4,96 (1H, d, J=10,3Гц, Н-10'), 3,82, 3,78 (ОМе), d, J=7,18Гц, Н-15); с: 103,70, 92,28, 91,42, 80,11, 2,37-2,48 (2Н, m), 1,05-2,07 (10Н, m), 1,63 (3H,s, Н51,54, 50,39, 45,66, 37,19, 36,14, 34,12, 28,15, 14), 1,34 (3H,s, Н-14'), 1,00 (3H, d, J=6,22Гц, Н-16'), 25,84, 24,59, 21,44, 20,15, 13,41; m/z (СI, NН3) 370 0,90-0,93 (3Н, m, Н-15 і Н-16), 0,59 (3Н, d, (М++1, 100), 324 (70), 310 (10); Дані аналізу, об+ J=7,22Гц, Н-15'); m/z (Сl, NH3) 422 (M+NH4 , 26%), числ. для C19H31NO4S: С, 61,76; Н, 8,46; N, 3,79%; 406 (84), 405 (М++1, 54), 389 (80), 359 (100), 330 знайдені: С, 62,04; Н, 8,39; N, 3,65. (30), 317 (40), 300 (14). Дані аналізу, обчисл. для Приклад 7 С23Н32О6: С, 68,29; Н, 7,97%; знайдені: С, 68,34; Н, Одержання 10 -(4'-(S,S-діксотіоморфолін-1'8,09. іл)-10-дезоксо-10-дигідроартемізину (10 -(4'Приклад 5 морфоліносульфоніл)дигідроартемізину) (ФормуОдержання 10 -(2'-гідрокси-1'ла I: Υ=4'-(5,5-діоксотіоморфолін-1'-іл) (4нафтил)дигідроартемізину (Формула l: Υ=2-ΟΗ морфоліносульфоніл) нафтил) До розчину 10 -(4'-тіоморфоліно)-10-дезоксо(а) Одержання 10 -(2'-нафтокси)10-дигідроартемізину (10 дигідроартемізину (тіоморфоліно)дигідроартемізину) (386мг, До розчину дигідроартемізину (568мг, 1,05ммоль), одержаного як описано вище в Прик2,00ммоль) і 2-нафтолу (288мг, 2,00ммоль) у тетладі 6, у дихлорметані (10мл) при кімнатній темперагідрофурані (10мл) додали трифенілфосфін ратурі в атмосфері азоту додали ΝΜΟ (369мг, (524мг, 4,00ммоль) і діетилазодикарбоксилат 3,15ммоль), молекулярне сито у вигляді порошку (330мкл, 2,00ммоль) при 0°С в атмосфері азоту. (525мг, 4Å) і ТРАР (18,5мг, кат.). Реакційну суміш Реакційну суміш перемішували при кімнатній темперемішували при кімнатній температурі протягом пературі протягом ночі. Потім жовтий розчин конночі, після чого фільтрували через шар SiO2 і зацентрували у вакуумі і залишок очищали флешлишок промивали етилацетатом (3 15мл). Фільтхроматографією (SiO2; 5% етилацетат/гексани) з рат концентрували у вакуумі. Потім залишок очивиходом 10 -(2'-нафтилокси)дигідроартемізину щали флеш-хроматографією (SiO2; 35% (185мг, 23%) у вигляді твердої білої речовини. етилацетат/гексани) з виходом 10 -(4'-(5,5(b) Одержання10 -(2'-гідрокси-1'діоксотіоморфолін-1'-іл)-10-дезоксо-10нафтил)дигідроартемізину дигідроартемізину (10 -(4'До розчину 10 -(2'морфоліносульфоніл)дигідроартемізину) у вигляді нафтокси)дигідроартемізину (232мг, 0,564ммоль), твердої білої речовини (421мг, 100%). Т. пл. 152,3одержаного як описано вище в (а), у дихлорметані 152,7°С; [ ]D20 + 13° (с 0,035/СНСІ3); max (плівка) (10мл) додали трифтордіефірат бору (220мкл) при 2928, 2872, 1454, 1378, 1308, 1270, 1228, 1198, 0°С. Реакційну суміш залишили для досягнення 1124, 1040, 1018, 976, 940, 878, 846, 826, 752, 704, кімнатної температури і перемішували протягом 666; Н : 5,27 (1Н, s, Н-12), 4,21 (1Н, d, J=10,30Гц, ще 30 хвилин. Розчин промивали 10% розчином Н-10), 3,18-3,46 (8Н, m), 2,54-2,62 (1H, m), 2,28 23 75325 24 2,36 (1Н, m), 1,20-2,02 (9H, m), 1,35 (3H, s, H-14), ату) 0,92-1,06 (1H, m), 0,93 (3H, d, J=5,99Гц, H-15), 0,78 До розчину дигідроартемізину (568мг, 2,00ммоль) і бензойної кислоти (244мг, 2,00ммоль) (3H, J=7,13Гц, Н-16); c: 174,20, 104,09, 91,92, у тетрагідрофурані при 0°С в атмосфері азоту до90,84, 90,04, 51,74, 51,27, 46,88, 45,46, 37,29, дали трифенілфосфін (524мг, 2,00ммоль) і діети36,02, 34,04, 28,91, 25,76, 24,66, 21,45, 20,10, + лазодикарбоксилат (мл). Реакційну суміш залиши13,31; m/z (Cl, NH3) 402 (M +1, 100), 373 (30), 356 ли нагріватися до кімнатної температури і (64), 342 (16), 356 (20); Дані аналізу, обчисл. для перемішували протягом ночі. Розчин концентруваC19H31NO5S : С, 56,84; Η, 7,78; Ν, 3,49; знайдені: С, ли у вакуумі. Після флеш-хроматографії (SiO2; 56,83; Η, 7,82; Ν, 3,37. Приклад 8 10% етилацетат/гексани) одержали 10 дигідроартемізинілбензоат у вигляді твердої білої Одержання 10 -(4'-бензилпіперазин-1'-іл)-10речовини (419мг, 53%). Т. пл. 151,4-53,0°С; [ ]D20 + дезоксо-10-дигідроартемізину (10 -(4'морфоліносульфоніл)дигідроартемізину) (Форму119° (с 0,19/СНСl3); mах (плівка) 2942, 2872, 1724, ла l: Υ=4'-бензил-1'-піперазиніл) 1452, 1378, 1268, 1176, 1114, 1064, 1024, 976, 902, У результаті взаємодії броміду, одержаного з 858, 832, 754, 712; Н 7,43-8,03 (5Н, m, Аr-Н, 6,52 10 -(триметилсилокси)-дигідроартемізину (356мг, (1Н, d, J=3,43Гц, Н-10), 5,58 (1Н, s, Н-12), 2,91-3,01 1,00ммоль) як описано вище в Прикладі 3 (b), з 1(1Н, m, Н-9), 2,42 (1Н, ddd, J=17,4, 13,3, 3,91Гц), бензилпіперазином (212,1мкл, 1,22ммоль), після 1,33-2,10 (10Н, m), 1,45 (3H,s, Н-14), 1,02 (3Н, d, флеш-хроматографії (40% етилацетат/гексан) J=6,11Гц, Н-15), 0,98 (3Н, d, J=7,35Гц, Н-14); c: одержали 10 -(4'-бензилпіперазин-1'-іл)-10165,31, 133,03, 129,96, 129,48, 128,39, 104,30, дезоксо-10-дигідроартемізин (144,3мг, 40%) у ви95,29, 88,66, 88,63, 80,42, 52,27, 43,84, 37,44, гляді твердої білої речовини. Т. пл. 105-106°С; 36,10, 34,43, 29,98, 25,78, 24,50, 24,25, 20,14, 12,50; m/z (El): 388 (M+). [ ]D20 + 10,3° (с, 0,909 СНCI3); max (плівка) 2954, 2920, 2860, 2802, 1494, 1454,1376, 1344, 1294, (b) Одержання 10 -(2'-фурил)-10-дезоксо-101270, 1204, 1132, 1114, 1062, 1042, 1016, 986, 942, дигідооартемізину (Формула l: Υ=2-фурил) 924, 880, 852, 824, 738, 694см-1; 1Н ЯМР (300МГц, Розчин 10 -бензоілокси-10-дигідроартемізину CDCl3) Н 7,43-7,30 (5Н, m, Аr-Н), 5,35 (1Н, s, Н-12), (193мг, 0,50ммоль) у дихлорметані (5мл) при -45°С 4,10 (1Н, d, J=10,2Гц, Н-10), 3,62 (1Н, d, J=13,1Гц, послідовно обробили фураном (542мкл, 7,5ммоль) Н бензилу), 3,55 (1Н, d, J=13,1Гц, Η бензилу), 3,11і трифтордіетилефіратом бору (123мкл, 1,0ммоль). 3,06(2Н, m), 2,80-2,70 (2Н, m), 2,70-2,30 (7Н, m), Одержану суміш перемішували при -45°С протя2,15-2,02 (1Н, m), 2,02-1,85 (1Н, m), 1,85-1,70 гом 1 години. Суміш обробляли насиченим розчи(2Н,m), 1,70-1,20 (9Н, m), 1,20-1,00 (4Н, m), 0,88 ном NaНСО3 і екстрагували дихлорметаном (3Н, d, J=7,2Гц, 6-меmил) м.ч.; 13С ЯМР (76МГц, (3 10мл). Екстракти висушували (MgSO4) і конценCDCl3) c 138,3, 129,13, 128,1, 126,9, 103,8, 91,6, трували у вакуумі. Залишок очищали флеш90,4, 80,3, 63,1, 53,5, 51,7, 45,9, 37,4, 36,3, 34,3, хроматографією (SiO2; 15% етилацетат/гексани) з 28,5, 26,0, 24,8, 21,6, 20,3, 13,4 м.д.; MC (Сl, СН4) виходом заголовної сполуки (53,7мг, 32%) у вигляm/е 443 (М++1, 10). Дані аналізу, обчисл. для ді безбарвного масла. Т. пл. 96-97°С; 1Н ЯМР C26H38N2O4: С, 70,56, Н, 8,65, N, 6,33; знайдені: С, (300МГц, CDCl3) Н 7,38 (1Н, m, Н-5'), 6,34-6,30 70,24, Н, 8,67, N, 6,28. (2Н, m, Н-3' і Н-4'), 5,38 (1Н, s, Н-12), 4,46 (1Н, d, Приклад 9 J=10,9Гц, Н-10), 2,84 (1Н, m), 2,60-2,20 (2Н, m), Одержання 10 -(2'-фурил)-10-дезоксо-102,20-1,20 (9Н, m), 1,20-0,80 (6Н, m), 0,62 дигідроартемізину (Формула l: Υ=2'-фурил) (3H,d,J=7,2Гц, 6-меmил) м.ч.; 13С ЯМР (76МГц, Спосіб 1: CDCl3) c 153,2, 142,0, 110,0, 108,3, 104,2, 92,2, До розчину дигідроартемізину (284мг, 80,4, 76,6, 71,1, 52,0, 45,7, 37,4, 36,3, 34,1, 31,5, 1,0ммоль) у дихлорметані (10мл) при 20°С додали 26,1, 24,7, 21,3, 20,3, 13,7 м.ч.; MC (Сl, СН4) m/e трихлорацетонітрил (2,0мл, 20,0ммоль) і одну кра335 (М++1,43). плю 1,8-діазабіцикло[5.4.0]ундекану. Реакційну Приклад 10 суміш перемішували при 20°С протягом 2 годин, Одержання 10 -(пірол-2'-іл)-10-дезоксо-10після чого концентрували у вакуумі при 20°С. Полигідооартемізину (Формула l: Υ=2-піроліл) тім залишок піднімали в дихлорметані (10мл) при Розчин 10 -бензоілокси-10-дезоксоартемізину 0°С і охолоджували до -40°С. Розчин послідовно (700,8мг, 1,80ммоль), одержаного як описано в обробляли фураном (1,09мл, 15,0ммоль) і триПрикладі 9, Способі 2(а), у дихлорметані (30мл) фтордіетилефіратом бору (123мкл, 1,0ммоль), і при -50°С послідовно обробили піролом (624мкл, одержану суміш перемішували при -40°С протягом 9,00ммоль) і трифтордіетилефіратом бору ще 30 хвилин. Реакційну суміш обробляли насиче(332мкл, 2,70ммоль) і потім перемішували при ним розчином NaНСО3 і екстрагували дихлорме50°С протягом 1 години. Реакційну суміш обробтаном (2 10мл). Екстракти сушили (MgSO4) і конляли насиченим розчином NaНСО3 і екстрагували центрували в вакуумі. Залишок очищали флешдихлорметаном (3 10мл). Екстракти сушили хроматографіею (SiO2; 15% етилацетат/гексани) з (MgSO4) і концентрували у вакуумі. Залишок очивиходом заголовної сполуки (11,0мг, 3.3%) у вищали флеш-хроматографією (SiO2; 30% діетилогляді безбарвного масла. Аналітичний зразок одевий ефір/гексани) з виходом заголовної сполуки ржували перекристалізацією з гексанів. (486,6мг, 81%) у вигляді безбарвного масла. [ ]D20 Спосіб 2: + 198,7° (с 0,105 СНСІ3); max (плівка) 2924, 2854, (a) Одержання 10 -бензоілокси-101460, 1376, 1066, 1024, 722см-1; 1Н ЯМР (300МГц, дигідооаотемізину (10 -дигідроаотемізиніл бензоCDCl3) Н 8,80 (1Н, шс s, NH), 6,71 (1Н, m, H-5'), 25 75325 6,04 (2Н, m, Н-3' і Н-4'), 5,39 (1Н, s, Н-12), 4,47 (1Н, d, J=10,8Гц), 2,58 (1Н, m), 2,50-2,10(2Н, m), 2,101,95 (1Н, m), 1,93 (1Н, m), 1,80-1,68 (2Н, m), 1,681,15 (7Н, m), 1,15-0,80 (4Н, m), 0,93 (3Н, d, J=7,1Гц, 6-меmил) м.ч.; 13С ЯМР (76МГц, CDCl3) c 129,9, 117,6,107,2, 106,7,104,1, 91,9, 80,5, 71,9, 60,2, 51,8, 45,7, 37,2, 36,2, 34,0, 32,9, 25,9, 24,6, 21,2, 20,1, 14,0, 13,9 м.ч.; MC (Cl, бутан) m/e 334 (М++1, 100). Дані аналізу, обчисл. для C19H27NO4: С, 68,44, Н, 8,16, N, 4,20; знайдені: С, 68,77, Н, 8,56, N, 3,85. Приклад 11 Одержання 10 -(4'-бензил-4'-метилпіперазин1'-іл)-10-дезоксо-10-дигідроартемізин йодиду (Формула l: Υ=4'-бензил-4'-метилпіперазин-1'-lл) До розчину 10 -(4'-бензилпіперазин-1'-іл)-10дезоксо-10-дигідроартемізину (272мг, 0,62ммоль), одержаного як описано вище в Прикладі 8, у суміші дихлорметану (1,8мл) і діетилового ефіру (5,4мл) в атмосфері азоту при 0°С додали по краплях йодметан (36,7мкл, 0,59ммоль). Суміш струснули і залишили нагріватися до 20°С протягом ночі. Збирали осад, промивали його діетиловим ефіром (2 5мл) і сушили у високому вакуумі. Далі його очищали перекристалізацією із суміші метанол/діетиловий ефір з утворенням плоских прямокутних кристалів (87мг, 24%). Т. пл. 159-161°С; [ ]D20 + 18,4° (с 0,436 CHCl3); max (плівка): 3448, 2928, 2196, 1457, 1378, 1210, 1133, 1099, 1041, 982, 918, 880, 852, 828, 766, 732, 642см-1; 1Н ЯМР (300МГц, CDCl3) Н 8,00-7,60 (2Н, d, J=6,2Гц, Н-2' і Н-6'), 7,60-7,35 (3Н, m, Аr-Н), 5,32 (1Н, s, Н-12), 5,25-5,05 (2Н, m, бензил-Н), 4,13 (1Н, d, J=10,2Гц, Н-10), 3,95-3,55 (4Н, m), 3,55-2,90 (9Н, m), 2,652,20 (2Н, m), 2,20-1,15 (14Н, m), 1,15-0,87 (4Н, m), 0,80 (3Н, d, J=6,9Гц, 6-метил) м.ч.; 13С ЯМР (76МГц, CDCl3) с 133,4, 130,6,129,1, 126,5, 104,0, 91,5, 90,1, 80,1, 67,4, 59,5, 59,3, 51,5, 45,5, 37,2, 36,1, 34,0, 28,4, 25,9, 24,5, 21,5, 20,1, 13,3 м.ч. Приклади з 12 по 61 За допомогою процесів, аналогічних описаним в Прикладах з 1 по 11, були одержані подальші сполуки згідно з корисною моделю, як докладно зазначено нижче в Таблиці l. У цій таблиці сполуки ідентифікуються з посиланням на формулу l. 26 27 75325 28 29 75325 30 Приклад 62 Антипаразитична активність сполук, заявлених у винаході, досліджувалася за допомогою наступних тестів. Скорочення, що використані в прикладах: СО2 = діоксид вуглецю DMCO (ДМСО) = диметилсульфоксид ED = лінія дермальних клітин коня EDTA (ЕДТУ) = етилендіамінтетраоцтова кис 31 75325 32 лота Таблиця ІІ FCS = ембріональна теляча сироватка RPMl = середовище для росту клітинних кульДоза (г/мл) Приклад № тур 10-5 10-6 10-7 10-8 rpm (об/хв) = оберти в хвилину 2 1 1 0 VERO = лінія клітин нирки африканської зеле15 Т/1 1 1 0 ної мавпи 18 2 1 0 (а) Добір сполук проти клітинних культур 19 Τ 0 Neospora Caninum in vitro 20 Т/1 1 1 0 Скринінг проводили в 96-лункових планшетах 21 2 0 (Fatcon 3872). Моношар клітин хазяїна (VERO або 23 Т/2 0 ED) поміщали на планшет для клітинних культур. 24 1 0 Неінфіковані моношари культивували в двох фла25 Т/1 1 1 0 конах для культур клітин (площа поверхні культури 30 1 0 50см3). Клітинний шар відокремлювали за допомо31 2 1 0 гою трипсин-EDTA (5мл, Gibco 45300-019) при 32 2 0 37°С у культуральному СO2-інкубаторі. Після закінчення 10 хвилин більшість клітин відшаровуваАртемізин 0 лася. Клітини за допомогою 5-мл піпетки переносили в 50-мл пробірку для центрифугування, що (b) Добір сполук проти клітинних культур містила близько 1мл підігрітої ембріональної теляEimeria Tenella in vitro чої сироватки. Після центрифугування протягом 5 Клітини з нирок 19-денних курчат культивувахвилин при 1500об/хв (Varifuge 3.0, Heraeus) видали як моношари в 96-лункових планшетах (Fatcon ляли рідину, а осад клітин ресуспендували в сере3872) у середовищі гідролізату лактальбуміну довищі RPMi (100мл, 95% RPMi 1640, 2% FCS, 1% Hanks, 5% ембріональної телячої сироватки, 1% L-глутаміну, 1% гідрокарбонату натрію, 1% пеніциглутаміну і 1% замінних амінокислот. Після двох ліну/стрептоміцину). Суспензію клітин піпетували в днів інкубування при 42°С і 5% СО2 культури інфішість 96-лункових планшетів по 150мкл у лунку. кували спорозоїтами, виділеними з Eimeria tenella, Планшети поміщали в інкубатор при 37°С і 5% СO2 у кількості близько 30,00 на лунку. Сполуки, що на 24 години. Потім клітини інфікували тахізоїтами тестувалися, розчиняли в ДМСО і розводили кульNeospora Caninum у концентрації 48,000 тахізоїтів туральним середовищем до максимальної кінцевої на лунку. Потім інкубували при 37°С і 5% СO2 проконцентрації 10мкг мл-1 із кроком розведення 1:10. тягом 24 годин. На 5 день після інфекції культури оцінювали під Сполуки, що досліджувалися (0,5-1,5мг) навімікроскопом при 100-кратному збільшенні і визнашували в 1,5-мл пробірки Еппендорф і розчиняли чали стан клітин хазяїна і кількість неушкоджених в 1мл диметилсульфоксиду, що відповідало розшизонтів і вільних мерозоїтів. Ефективність оцінюведенню приблизно 1 10-3г мл-1. Середовище, що вали в такий спосіб: використовували для подальшого розведення, Оцінка Ефект, що спостерігається складалося з 87% RPMІ 1640, 10% FCS, 1% L3 = висока активність відсутність неушкоджеглутаміну, 1% гідрокарбонату натрію. 1% пеніциліних паразитів у лунці ну/стрептоміцину. У першому скринінгу використо2 = активність 1-6 паразитів на лунку вували концентрації 10-5, 10-6 і 10-7г мл-1. Розведені 1 = низька активність до 1 неушкодженого шипрепарати переносили в планшети з культурами зонту в полі зору клітин в обсязі 150мкл на лунку після 24-годинного 0 = відсутність активності >1 неушкодженого інкубування з Neospora Caninum. Для першого шизонту в полі зору ряду використовували необроблене середовище; Τ = цитотоксичність клітини хазяїна загинули цей ряд містив інфіковані і неінфіковані клітини в Результати наведені нижче в Таблиці lll: якості контролю. Планшет інкубували при 37°С і 5% СО2 протягом 5 днів. Оцінку за допомогою мікТаблиця lll роскопа проводили через 4 дні після обробки і через 5 днів після інфекції при збільшенні 25 10 в Доза (г/мл) Приклад № інвертованому мікроскопі відповідно до наступної 10-5 10-6 10-7 10-8 схеми оцінки. 2 2 2 1 0 Оцінка Ефект, що спостерігається 15 2 2 1 0 0 = відсутність ефекту моношар цілком зруй18 Τ Τ 1 0 нований 19 Τ Τ 1 0 1 = слабкий ефект моношар зруйнований час20 T Τ/2 0 тково, можна спостерігати скупчення паразитів 21 Τ/2 0 2 = повний ефект неушкоджений моношар, не 23 Τ Τ/2 0 спостерігається тахізоїтів 24 2 1 0 Τ = цитотоксичність клітини загинули, лізовані 25 2 1 1 0 Результати наведені нижче в Таблиці ІІ: 30 Τ 2 0 31 Τ 1 0 32 τ 2 0 Артемізин 2 1 0 33 75325 34 90% N2. Через 42 години додавали 25мкл 3Н(с) Побір сполук проти PIasmodium FaIciparum гіпоксантину і планшети інкубували ще 24 години. in vitro Після закінчення 66 годин планшети заморожуваВикористовували два штами паразитів - W2, ли при -70°С для лізису еритроцитів, потім розмостійкий до хлорохіну, і D6, чутливий до хлорохіну, рожували і збирали на фільтруючі пластини зі але стійкий до мефлохіну. У наведеній нижче табскловолокна в 96-лунковому приладі. Фільтруючі лиці IV, переважним чином сполуки не повинні пластини потім враховували в сцинтиляційному мати перехресну стійкість між двома штамами. лічильнику. Для кожного препарату визначали Дослідження ґрунтується на включенні парапрофіль відповіді на концентрації і за допомогою зитами радіоактивно міченого гіпоксантину, і інгіпрограми нелінійного логістичного аналізу відповібування включення визначається активністю відоді на дози визначали концентрації 50%, 90% і 10% мих або тих, що тестуються антималярійних інгібування (IK50, IK90 та IK10). препаратів. У кожнім дослідженні в якості контроМожна застосовувати попередній скринінг, при лю використовували препарати з доказаною антиякому проводиться дослідження 3 розведень для малярійною активністю, такі як хлорохін, мефловизначення активності при високій, середній або хін, хінін, артемізин і піриметамін. Час інкубації низькій концентраціях. Були обрані концентрації складав 66 годин, а початкова паразитемія була 50,000, 500 і 50нг мл-1. Дослідження проводили в 0,2% при гематокриті 1%. Використовували середубльованому варіанті в 96-лункових планшетах, довище RPMH640 без фолієвої або ппо 14 і одній відомій сполуці (стандарту), що тесамінобензойної кислоти. Замість 10% інактивоватується, на кожен планшет. Систему автоматизуної нагріванням плазми людини використовували вали за допомогою приладу Biomek для змішуванAIbumax, тому що при використанні Albumax споня, розведення препаратів і додавання препаратів стерігається менше зв'язування білків, а сполуки і паразитів у планшет. Якщо в попередньому скрипри цій моделі демонструють більш високу активнінгу в значенні "Області аналізу" (ОА) стоїть "", то значення IK розведення проводили в 96-лункових планшетах більше розведення, що використовувався в попеза допомогою системи Biomek 1000 Liquid HandIing редньому скринінгу; в такий спосіб "ОА>250" ознаSystem. Розведені препарати переносили в планчає, що IK більше, ніж 250нг мл-1, і подальший шети для дослідження, додавали по 200мкл зараскринінг не проводився. У таких випадках у знажених паразитами еритроцитів і інкубували при ченнях IK стоїть 0,00. 37°С у середовищі, що містить 5% СО2, 5% О2 і Результати наведені нижче в таблиці IV: Таблиця IV Приклад № 1А (10 -ізомер) 1Β (10 -ізомер) 2 4 12 15 16 18 19 20 21 23 24 25 26 30 31 32 36 38 41 44 Активність in vitro: IK50, IK90 (IK10) нг/мл Штам W2 (стійкий до хлорохіну) Штам D6 (чутливий до хлорохіну) 0,69; 0,97 0,64; 1,24 0,69; 0,98 0,74;1,36 0,31; 0,52; (0,19) 0,73; 0,99; (0,53) 0,84; 1,74; (0,40) 1,05; 2,10; (0,52) 0,78; 1,32; (0,47) 0,77; 1,70; (0,35) 0,66; 0,84; (0,52) 0,61; 0,78; (0,40) 0,64; 0,84; (0,49) 0,61; 0,78; (0,48) 0,23; 0,33; (0,17) 0,28; 0,82; (0,09) 0,33; 0,43; (0,25) 0,39; 0,80; (0,19) 5,81; 12,77; (2,64) 9,40; 12,93; (6,84) 0,00; 0,00; 250 ОА250 0,00; 0,00; ОА>250 0,77; 1,30; (0,46) 1,17; 2,10; (0,65) 0,11; 0,17; (0,07) 0,09; 0,35; (0,02) 0,00; 0,00; ОА
ДивитисяДодаткова інформація
Назва патенту англійськоюAntiparasitic derivatives of artemisin (endoperoxides)
Назва патенту російськоюАнтипаразитические производные артемизина (эндопероксиды)
МПК / Мітки
МПК: C07D 221/00, A61P 33/00, A61K 31/335, C07D 493/18, A61K 31/35
Мітки: антипаразитичні, артемізину, ендопероксиди, похідні
Код посилання
<a href="https://ua.patents.su/18-75325-antiparazitichni-pokhidni-artemizinu-endoperoksidi.html" target="_blank" rel="follow" title="База патентів України">Антипаразитичні похідні артемізину (ендопероксиди)</a>
Попередній патент: Безперервний спосіб та пристрій для сушіння гарячих водних суспензій простих ефірів целюлози
Наступний патент: Порошкоподібне водорозчинне похідне целюлози і спосіб його одержання
Випадковий патент: Пристрій для розрізання листового паперового матеріалу