Стереоселективний синтез аналогів вітаміну д
Формула / Реферат
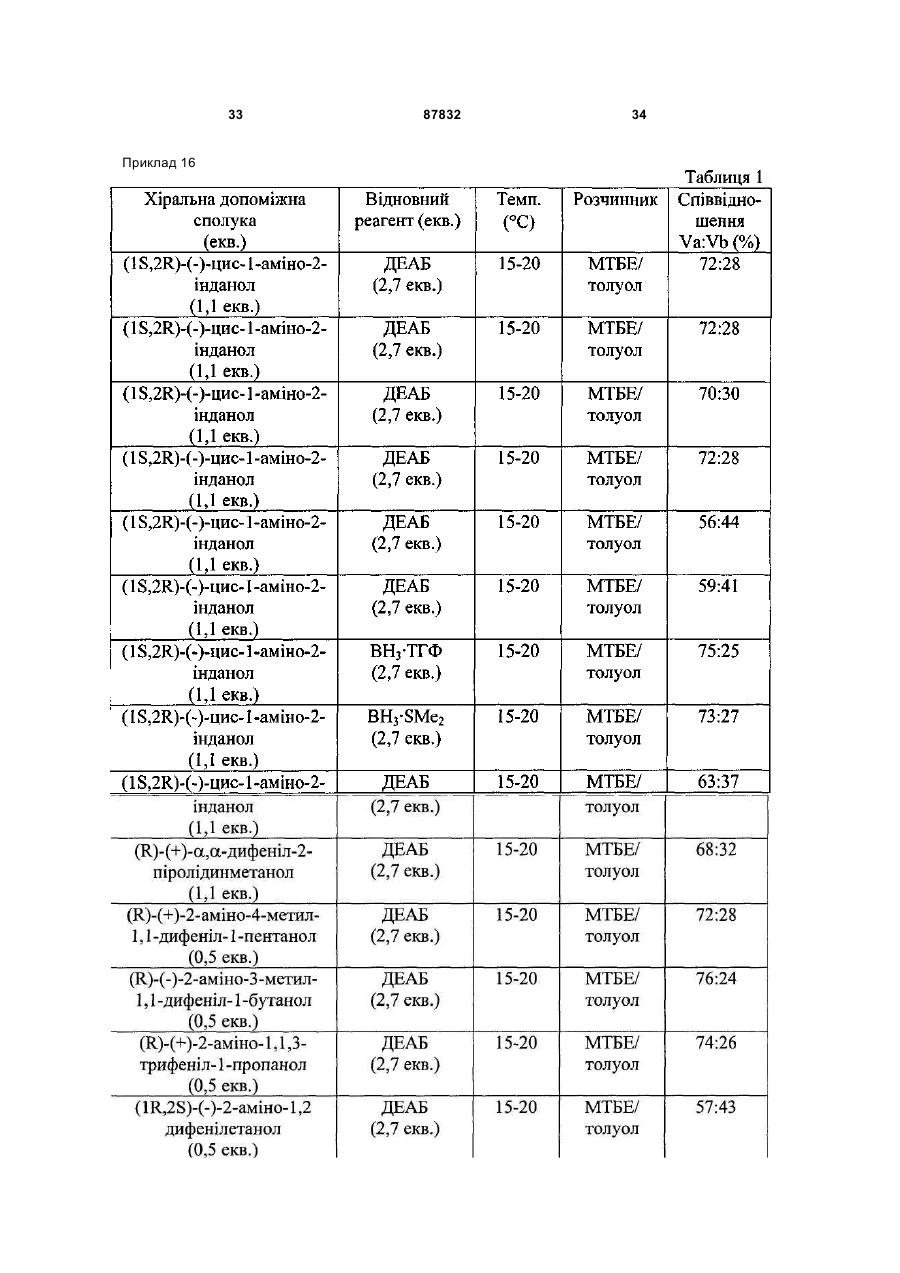
1. Спосіб відновлення сполуки загальної структури III

в якій X являє собою або водень, або OR2,
і в якій R1 і R2 можуть бути однаковими або різними і являють собою або водень, або гідроксизахисну групу,
в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини з отриманням суміші сполук загальної структури IVa і IVb, яка збагачена IVa,
при цьому X, R1 і R2 визначені вище.
2. Спосіб отримання кальципотріолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола-5,7,10(19),22-тетраєн-1![]() -3
-3![]() -24-тріол} або моногідрату кальципотріолу, в якому здійснюють наступні стадії:
-24-тріол} або моногідрату кальципотріолу, в якому здійснюють наступні стадії:
(а) відновлення сполуки загальної структури III

в якій X являє собою OR2,
і в якій R1 і R2 можуть бути однаковими або різними і являють собою або водень, або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини з отриманням суміші сполук загальної структури IVa і IVb, яка збагачена IVa,

при цьому X, R1 і R2 визначені вище;
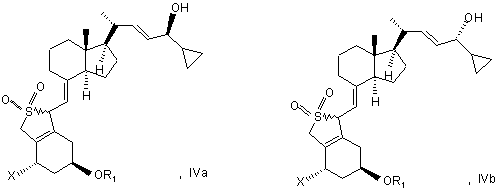
(b) взаємодії суміші сполук загальної структури IVa і IVb, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va,
при цьому X, R1 i R2 визначені вище;
(c) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені вище;
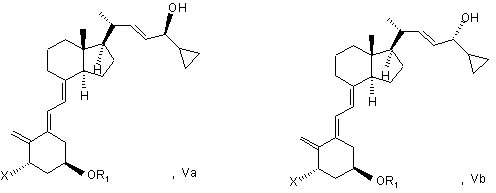
(d) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa
при цьому X, R1 і R2 визначені вище; і
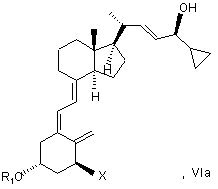
(e) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи (груп) R1 і/або R2 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу.
3. Спосіб отримання кальципотріолу або моногідрату кальципотріолу, в якому здійснюють стадії (а)-(b) за п. 2 і який додатково включає наступні стадії:
(f) ізомеризації суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені в п. 2, в суміш сполук загальної структури VIa і VIb, яка збагачена VIa,

при цьому X, R1 і R2 визначені вище;
(g) виділення сполуки загальної структури VIa з суміші сполук загальної структури VIa і VIb, яка збагачена VIa, при цьому X, R1 і R2 визначені вище;
(h) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи (груп) R1 і/або R2 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу.
4. Спосіб отримання кальципотріолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола-5,7,10(19),22-тетраєн-1![]() -3
-3![]() -24-тріол} або моногідрату кальципотріолу, в якому здійснюють наступні стадії:
-24-тріол} або моногідрату кальципотріолу, в якому здійснюють наступні стадії:
(j) відновлення сполуки загальної структури III

в якій X являє собою водень,
і в якій R1 являє собою водень або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини, отримуючи суміш сполук загальної структури IVa або IVb, яка збагачена IVa,

при цьому X і R1 визначені вище;
(k) взаємодії суміші сполук загальної структури IVa і IVb, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va,

при цьому X і R1 визначені вище;
(1) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X і R1 визначені вище;
(m) гідроксилювання сполуки загальної структури Va відповідним гідроксилюючим агентом, при цьому X і R1 визначені вище, з отриманням сполуки загальної структури Va, в якій X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначено вище;
(о) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa

при цьому X, R1 і R2 визначені вище; і
(р) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу.
5. Спосіб отримання кальципотріолу або моногідрату кальципотріолу, в якому здійснюють стадії (j)-(1) п. 4 і який додатково включає наступні стадії:
(q) захист С-24 гідроксигрупи сполуки загальної структури Va

в якій X являє собою водень, і в якій R1 являє собою водень або гідроксизахисну групу, з гідроксизахисною групою;
(r) гідроксилювання С-24 гідроксизахищеної сполуки загальної структури Va відповідним гідроксилюючим агентом, при цьому X і R1 визначені вище, з отриманням С-24 гідроксизахищеної сполуки загальної структури Va, в якій X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначений вище;
(s) видалення С-24 гідроксизахисної групи сполуки загальної структури Va;
(t) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa

при цьому X, R1 і R2 визначені вище;
(u) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури VІa з отриманням кальципотріолу або моногідрату кальципотріолу.
6. Спосіб за будь-яким з пп. 1-5, в якому стадію відновлення здійснюють в присутності хіральної допоміжної сполуки.
7. Спосіб за будь-яким з пп. 1-6, в якому відновний агент являє собою боранове похідне.
8. Спосіб за будь-яким з пп. 1-6, в якому відновний агент являє собою N,N-діетиланілінборан, борантетрагідрофуран або борандиметилсульфід.
9. Спосіб за будь-яким з пп. 1-8, в якому хіральна допоміжна сполука являє собою хіральний 1,2-аміноспирт.
10. Спосіб за будь-яким з пп. 1-8, в якому хіральна допоміжна сполука являє собою хіральне цис-1-аміно-2-інданолпохідне.
11. Спосіб за будь-яким з пп. 1-8, в якому хіральна допоміжна сполука являє собою (1S,2R)-(-)-цис-1-aміно-2-інданол.
12. Спосіб за будь-яким з пп. 1-11, в якому інертний розчинник являє собою толуол, трет.-бутилметиловий ефір, тетрагідрофуран або їх суміші.
13. Спосіб за будь-яким з пп. 1-12, в якому суміш сполук загальної структури IVa і IVb, отримана відновленням сполуки загальної структури III, має молярне співвідношення IVa:IVb, яке становить щонайменше 56:44.
14. Спосіб за будь-яким з пп. 1-13, в якому стадію відновлення проводять при температурі від 10 °С до 20 °С.
15. Спосіб отримання сполуки загальної структури III

в якій X являє собою або водень, або OR2,
і в якій R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу,
в якому здійснюють реакцію сполуки загальної структури VII або VIII

при цьому R1 і R2 визначені вище,
з діоксидом сірки.
16. Спосіб за будь-яким з пп. 1-15, в якому сполука загальної структури III являє собою епімер загальної структури ІІІа

17. Спосіб за будь-яким з пп. 1-15, в якому сполука загальної структури III являє собою епімер загальної структури Шb

18. Спосіб взаємодії суміші сполук загальної структури IVa і IVb

в якій X являє собою водень або OR2,
при цьому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va,

при цьому X, R1 і R2 визначені вище.
19. Спосіб за будь-яким з пп. 1-3, 15 або 18, в якому X являє собою OR2.
20. Спосіб за будь-яким з пп. 1-19, в якому R1 і/або R2 являють собою алкілсиліл.
21. Спосіб за п. 20, в якому R1 і/або R2 являють собою трет.-бутилдиметилсиліл.
22. Спосіб отримання кальципотріолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола-5,7,10(19),22-тетраєн-1![]() -3
-3![]() -24-тріол} або моногідрату кальципотріолу, який включає спосіб за будь-яким з пп. 1-21.
-24-тріол} або моногідрату кальципотріолу, який включає спосіб за будь-яким з пп. 1-21.
23. Сполука загальної структури ІІІа або ІІІb або їх суміші
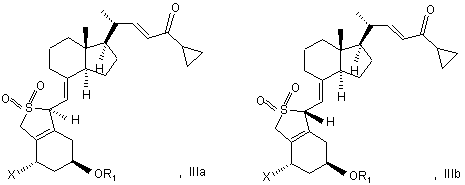
в якій X являє собою водень або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являти собою водень або гідроксизахисну групу.
24. Сполуки загальної структури IVaa, IVab, IVba, IVbb, IVb або їх суміші
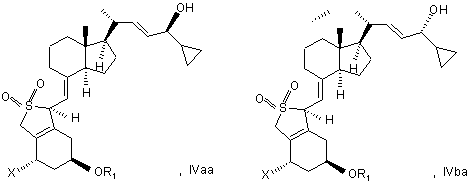
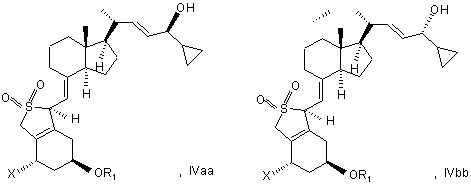
в якій X являє собою або водень, або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являти собою водень або гідроксизахисну групу.
25. Сполука за пп. 23 або 24, в якій X являє собою OR2.
26. Сполука за будь-яким з пп. 23-25, в якій R1 і R2 являють собою алкілсиліл.
27. Сполука за пп. 26, в якій R1 і R2 являють собою трет.-бутилдиметилсиліл.
28. Сполука за будь-яким з пп. 23-25, в якій R1 і R2 являють собою водень.
29. Застосування сполуки за будь-яким з пп. 23-28 як проміжної сполуки для отримання кальципотріолу або моногідрату кальципотріолу.
Текст
1. Спосіб відновлення сполуки загальної структури III , Vb при цьому X, R1 i R2 визначені вище; (c) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені вище; 3 87832 4 (d) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa OH OH OH H O O H H O S H H , VIa X R1O при цьому X, R1 і R2 визначені вище; і (e) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи (груп) R1 і/або R2 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу. 3. Спосіб отримання кальципотріолу або моногідрату кальципотріолу, в якому здійснюють стадії (а)-(b) за п.2 і який додатково включає наступні стадії: (f) ізомеризації суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені в п.2, в суміш сполук загальної структури VIa і VIb, яка збагачена VIa, OH OH H H H H X R1 O , VIa R1 O X , VIb при цьому X, R1 і R2 визначені вище; (g) виділення сполуки загальної структури VIa з суміші сполук загальної структури VIa і VIb, яка збагачена VIa, при цьому X, R1 і R2 визначені вище; (h) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи (груп) R1 і/або R2 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу. 4. Спосіб отримання кальципотріолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола5,7,10(19),22-тетраєн-1 a -3 b -24-тріол} або моногідрату кальципотріолу, в якому здійснюють наступні стадії: (j) відновлення сполуки загальної структури III O H O X O H S , IVa OR1 X O H S OR1 X , IVb при цьому X і R1 визначені вище; (k) взаємодії суміші сполук загальної структури IVa і IVb, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va, OH OH H H H X H , Va OR1 X OR1 , Vb при цьому X і R1 визначені вище; (1) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X і R1 визначені вище; (m) гідроксилювання сполуки загальної структури Va відповідним гідроксилюючим агентом, при цьому X і R1 визначені вище, з отриманням сполуки загальної структури Va, в якій X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначено вище; (о) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa OH H H , VIa X R1O при цьому X, R1 і R2 визначені вище; і (р) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури VIa з отриманням кальципотріолу або моногідрату кальципотріолу. 5. Спосіб отримання кальципотріолу або моногідрату кальципотріолу, в якому здійснюють стадії (j)(1) п.4 і який додатково включає наступні стадії: (q) захист С-24 гідроксигрупи сполуки загальної структури Va OH OR1 , III в якій X являє собою водень, і в якій R1 являє собою водень або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини, отримуючи суміш сполук загальної структури IVa або IVb, яка збагачена IVa, H H X OR1 , Va в якій X являє собою водень, і в якій R1 являє собою водень або гідроксизахисну групу, з гідроксизахисною групою; 5 (r) гідроксилювання С-24 гідроксизахищеної сполуки загальної структури Va відповідним гідроксилюючим агентом, при цьому X і R1 визначені вище, з отриманням С-24 гідроксизахищеної сполуки загальної структури Va, в якій X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначений вище; (s) видалення С-24 гідроксизахисної групи сполуки загальної структури Va; (t) ізомеризації сполуки загальної структури Va в сполуку загальної структури VIa 87832 6 в якій X являє собою або водень, або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, в якому здійснюють реакцію сполуки загальної структури VII або VIII O O H H H H OH X R1O X O , VIa при цьому X, R1 і R2 визначені вище; (u) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури VІa з отриманням кальципотріолу або моногідрату кальципотріолу. 6. Спосіб за будь-яким з пп.1-5, в якому стадію відновлення здійснюють в присутності хіральної допоміжної сполуки. 7. Спосіб за будь-яким з пп.1-6, в якому відновний агент являє собою боранове похідне. 8. Спосіб за будь-яким з пп.1-6, в якому відновний агент являє собою N,N-діетиланілінборан, борантетрагідрофуран або борандиметилсульфід. 9. Спосіб за будь-яким з пп.1-8, в якому хіральна допоміжна сполука являє собою хіральний 1,2аміноспирт. 10. Спосіб за будь-яким з пп.1-8, в якому хіральна допоміжна сполука являє собою хіральне цис-1аміно-2-інданолпохідне. 11. Спосіб за будь-яким з пп.1-8, в якому хіральна допоміжна сполука являє собою (1S,2R)-(-)-цис-1aміно-2-інданол. 12. Спосіб за будь-яким з пп.1-11, в якому інертний розчинник являє собою толуол, трет.бутилметиловий ефір, тетрагідрофуран або їх суміші. 13. Спосіб за будь-яким з пп.1-12, в якому суміш сполук загальної структури IVa і IVb, отримана відновленням сполуки загальної структури III, має молярне співвідношення IVa:IVb, яке становить щонайменше 56:44. 14. Спосіб за будь-яким з пп.1-13, в якому стадію відновлення проводять при температурі від 10°С до 20°С. 15. Спосіб отримання сполуки загальної структури III O H O O S H H IIIa. OR1 X 17. Спосіб за будь-яким з пп.1-15, в якому сполука загальної структури III являє собою епімер загальної структури lllb O H O O S H H IIIb. OR1 X 18. Спосіб взаємодії суміші сполук загальної структури IVa і IVb OH OH H O O H H O S OR1 X , IVa O H S OR1 X H O X OH H H H H H S OR1 , III , IVb в якій X являє собою водень або OR2, при цьому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va, OH O , VIII при цьому R1 і R2 визначені вище, з діоксидом сірки. 16. Спосіб за будь-яким з пп.1-15, в якому сполука загальної структури III являє собою епімер загальної структури ІІІа H R1O , VII OR1 X H X OR1 , Va X OR1 , Vb 7 87832 при цьому X, R1 і R2 визначені вище. 19. Спосіб за будь-яким з пп.1-3, 15 або 18, в якому X являє собою OR2. 20. Спосіб за будь-яким з пп.1-19, в якому R1 і/або R2 являють собою алкілсиліл. 21. Спосіб за п.20, в якому R1 і/або R2 являють собою трет.-бутилдиметилсиліл. 22. Спосіб отримання кальципотріолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола5,7,10(19),22-тетраєн-1 a -3 b -24-тріол} або моногідрату кальципотріолу, який включає спосіб за будь-яким з пп.1-21. 23. Сполука загальної структури ІІІа або ІІІb або їх суміші O O X S O H OR1 , IIIa X O S H H OR1 , IIIb в якій X являє собою водень або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являти собою водень або гідроксизахисну групу. 24. Сполуки загальної структури IVaa, IVab, IVba, IVbb, IVb або їх суміші Даний винахід відноситься до способів отримання кальципотриолу {(5Z,7Е,22Е,24S)-24циклопропіл-9,10-секохола-5,7,10(19),22-тетраєн1a-3b-24-триол} або моногідрату кальципотриолу стереоселективним відновленням. Даний винахід додатково пропонує нові проміжні сполуки і способи синтезу проміжних сполук, придатних для отримання кальципотриолу або моногідрату кальципотриолу. Кальципотриол або кальципотриєн (структура 1) [CAS 112965-21-6] показує високу активність в інгібуванні небажаного розростання епідермальних кератиноцитів [F.A.C.M. Castelijins, M.J. Gerritsen, І.М. J.J. van Еф, van de Kerkhof; Acta Derm. Venereol. 79, 11,1999]. Ефективність кальципотриолу або моногідрату кальципотриолу (II) при лікуванні псоріазу була показана в ряді клінічних випробувань [D.M.Ashcroft et al.; Brit.Med. J. 320, 963-7, 2000] і кальципотриол використовують в декількох комерційних лікарських рецептурах. OH H O O S H H O H OR1 X , IVaa O S H H OR1 X OH O S H H O H OR1 , IVba OH H O X H H OH O H O 8 , IVaa X O S H H OR1 , IVbb в якій X являє собою або водень, або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являти собою водень або гідроксизахисну групу. 25. Сполука за пп.23 або 24, в якій X являє собою OR2. 26. Сполука за будь-яким з пп.23-25, в якій R1 і R2 являють собою алкілсиліл. 27. Сполука за пп.26, в якій R1 і R2 являють собою трет.-бутилдиметилсиліл. 28. Сполука за будь-яким з пп.23-25, в якій R1 і R2 являють собою водень. 29. Застосування сполуки за будь-яким з пп.23-28 як проміжної сполуки для отримання кальципотріолу або моногідрату кальципотріолу. В отриманні кальципотриолу необхідна специфічна стереохімія гідроксильної групи при С-24 для повного прояву біологічної активності. При чинній методології необхідну стереохімію досягають одним з наступних способів: (і) не-діастереоселективним відновленням С24 кетотриєнів з подальшим розділенням діастереомерних сумішей С-24 гідроксилепімерів з допомогою хроматографії (WO 87/00834 & M.J. Calverley; Tetrahedron 43 (20), 4609-19, 1987); (іі) приєднанням енантіомерночистого С-24гідроксилвмісного бокового ланцюга до скелета вітаміну Д (M.J. Calverley, Synlett, 157-59, 1990); (ііі) селективною ферментативною етерифікацією одного з С-24 гідроксилепімерів з подальшим хроматографічним розділенням (WO 03/060094). Не-діастереоселективне відновлення С-24 кетотриєнів з подальшим розділенням епімерної суміші (і) являє собою найбільш широко поширену методику отримання бажаного епімеру. Даний процес відновлення дає головним чином небажаний С-24 епімерний спирт (звичайно приблизно 60% небажаного 24-R епімеру) і у виробничому масштабі важко виділити бажаний S-епімер з такої суміші з допомогою хроматографії. Стереоселективний синтез (іі) являє собою незручний спосіб для масштабного виробництва внаслідок своєї багатостадійної природи і вартості і внаслідок факту використання токсичних проміжних сполук. Спосіб ферментативної етерифікації 9 (ііі) має незручність, крім високої вартості ферментів, що застосовуються, спосіб включає, в залежності від селективності застосовуваних ферментів, 1-2 додаткові реакційні стадії, які додатково збільшують вартість процесу. Стереоселективне відновлення С-24 кетон безпосередньо до бажаних С-24 гідроксилепімерів було, наприклад, описано для похідних холестерину в WO 98/24800 і М. Ishiguro et al., J.C.S. Chem. Comm., 115-117,1981. Стереоселективне відновлення потрійного зв'язку в боковому ланцюзі аналога кальципотриолу з незахищеною триєновою системою, використовуючи S-Alpine Borane, було описано M.J. Calvery et al. в Bioorg. Med. Chem. Lett., 1841-1844 3(9), 1993. Головна технічна проблема використання способів стереоселективного відновлення для синтезу кальципотриолу зумовлена тим, що ненасичена триєнова система відомих до цього часу проміжних сполук для синтезу кальципотриолу хімічно лабільна в присутності кислоти Льюїса, проміжні сполуки легко окислюються, і що вони не сумісні із застосуванням типових умов реакції відновлення. Це приводить до зменшення виходу, забруднення продуктів і трудомістких допоміжних операцій, особливо в крупномасштабному виробництві. Метою даного винаходу є створення альтернативного способу синтезу кальципотриолу, який може подолати одну або більше різних проблем і незручностей, описаних вище. Даний винахід пропонує новий спосіб отримання діастереомерно збагачених С-24 гідроксилепімерів похідних кальципотриолу з використанням нового шляху синтезу, що містить стадію стереоселективного відновлення. Даний винахід додатково пропонує нові хімічно більш стійкі проміжні сполуки, в яких лабільна триєнова система захищена у вигляді аддукту з діоксидом сірки. При отриманні діастереомерно збагачених С-24 гідроксилепімерів похідних кальципотриолу вихід і ефективність подальшого відділення бажаного С-24 Sгідроксилепімеру можуть бути значно поліпшені. Несподівано було знайдено, що сполуки загальної структури III, в якій X являє собою водень або OR2, і в якій R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини утворює суміш сполук загальної структури IVa або IVb, 87832 10 яка збагачена IVa, причому X, R1 і R2 як визначені вище. У першому аспекті, дана сполука відноситься до способу отримання кальципотриолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10-секохола5,7,10(19),22-тетраєн-1a-3b-24-триол} або моногідрату кальципотриолу, що містить наступні стадії: (а) відновлення сполуки загальної структури III, в якій X являє собою OR2, і в якій R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини для утворення суміші сполук загальної структури IVa або IVb, яка збагачена IVa, причому X, R1 і R2 визначені вище; (b) взаємодія суміші сполук загальної структури IVa або IVb, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va, причому X, R1 і R2 як визначені вище; (c) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, причому X, R1 і R2 визначені вище; (d) ізомеризація сполуки загальної структури Va в сполуку загальної структури Vla, в якій X, R1 i R2 визначені вище; і (є) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи R1 і/або R2 сполуки загальної структури Va для отримання кальципотриолу або моногідрату кальципотриолу. У додатковому аспекті, даний винахід відноситься до способу отримання кальципотриолу або моногідрату кальципотриолу, що містить стадії (а) 11 (b), згадані вище, і додатково що містить наступні стадії: (f) ізомеризації суміші сполук загальної структури Va і Vb, причому X, R1 і R2, як визначені в пункті 2, яка збагачена Va до суміші сполук загальної структури VIa і VIb, яка збагачена VIa, причому X, R1 і R2 визначені вище; (g) виділення сполуки загальної структури Vla з суміші сполук загальної структури VIa і VIb, яка збагачена VIa, причому X, R1 і R2 визначені вище; (h) коли R1 і/або R2 не є воднем, видалення гідроксизахисної групи R1 і/або R2 сполуки загальної структури VIa для отримання кальципотриолу або моногідрату кальципотриолу. У ще одному додатковому аспекті, даний винахід відноситься до способу отримання кальципотриолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10секохола-5,7,10(19),22-тетраєн-1a-3b-24-триол} або моногідрату кальципотриолу, що містить наступні стадії: (j) відновлення сполуки загальної структури III, в якій X являє собою водень, і в якій R1 являє собою водень або гідроксизахисну групу, в інертному розчиннику з відновним агентом або з відновним агентом в присутності хіральної допоміжної речовини для утворення суміші сполук загальної структури IVa або IVb, яка збагачена IVa, причому X, R1 і R2 визначені вище; (k) взаємодія суміші сполук загальної структури IVa або IVb, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va, причому X, R1 і R2 визначені вище; (l) виділення сполуки загальної структури Va з суміші сполук загальної структури Va і Vb, яка збагачена Va, причому X, R1 і R2 визначені вище; (m) гідроксилування сполуки загальної структури Va відповідним гідроксилуючим агентом, причому X і R1 визначені вище, з утворенням сполуки загальної структури Va, причому X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначене вище; (про) ізомеризація сполуки загальної структури Va в сполуку загальної структури Vla, причому X, R1 і R2 визначені вище; і (р) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури Vla для отримання кальципотриолу або моногідрату кальципотриолу. У ще одному додатковому аспекті, даний винахід відноситься до способу отримання кальципотриолу або моногідрату кальципотриолу, що 87832 12 містить стадії (j)-(1) пункту 4 і що додатково містить наступні стадії: (q) захист С-24 гідроксигрупи сполуки загальної структури Va, в якій X являє собою водень, і в якій R1 являє собою водень або гідроксизахисну групу, з гідроксизахисною групою; (r) гідроксилування С-24 гідроксизахищеної сполуки загальної структури Va відповідним гідроксилуючим агентом, причому X і R1 визначені вище, для отримання С-24 гідроксизахищеної сполуки загальної структури Va, причому X являє собою OR2 і R2 являє собою водень, і при цьому R1 визначене вище; (s) видалення С-24 гідроксизахисної групи сполуки загальної структури Va; (t) ізомеризація сполуки загальної структури Va в сполуку загальної структури Vla, причому X, R1 і R2 визначені вище; і (u) коли R1 не є воднем, видалення гідроксизахисної групи R1 сполуки загальної структури Vla для отримання кальципотриолу або моногідрату кальципотриолу. У ще одному додатковому аспекті, дана сполука відноситься до способу отримання сполуки загальної структури III, в якій X являє собою або водень або OR2, і причому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, взаємодією сполуки загальної структури VII або VIII, причому R1 і R2 як визначені вище, з діоксидом сірки. У ще одному додатковому аспекті, даний винахід відноситься до способу взаємодії суміші сполук загальної структури IVa і IVb, в якій X являє собою або водень або OR2, і причому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу, яка збагачена IVa, в присутності основи з отриманням суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені вище. У ще одному додатковому аспекті, даний винахід відноситься до способу отримання кальципотриолу {(5Z,7E,22E,24S)-24-циклопропіл-9,10секохола-5,7,10(19),22-тетраєн-1(-3(-24-триол} або моногідрату кальципотриолу, що містить будь-який з способів, описаних вище. У ще одному додатковому аспекті, даний винахід відноситься до сполук загальної структури lllа або lllb, або їх сумішей, 13 в якій X являє собою або водень або OR2, і причому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу. У ще одному додатковому аспекті даний винахід відноситься до сполук загальної структури IVaa, IVab, IVba, IVbb, IVb або їх сумішей, 9 в якій X являє собою або водень або OR2, і причому R1 і R2 можуть бути однаковими або різними і являють собою водень або гідроксизахисну групу. У ще одному додатковому аспекті, даний винахід відноситься до застосування сполук загальної структури lllа, lllb, IVaa, IVab, IVba, IVbb як проміжних сполук у виробництві кальципотриолу або моногідрату кальципотриолу. Визначення Використовуваний тут термін «гідроксизахисна група» означає будь-яку групу, яка утворює похідне, яке стійке до наміченої реакції, в якій згадана гідроксизахисна група може бути селективно видалена реагентами, які не атакують гідроксигрупу, що регенерується. Згадане похідне може бути отримане селективною реакцією гідрокизахисного агента з гідроксигрупою. Силільні похідні, такі як силільні ефіри, що утворюють трет.бутилдиметилсиліл, являють собою приклади гідроксизахисних груп. Силілхлориди, такі як трет.бутилдиметилсилілхлорид (ТБСХ), триметилсилілхлорид, триетилсилілхлорид, дифенілметилсилілхлорид, триізопропілсилілхлорид, і трет.бутилдифенілсилілхлорид являють собою приклади гідроксизахисних агентів. Фтористий водень, такий як водний HF в ацетонітрилі, або тетра-нбутиламонійфторид являють собою приклади реагентів, які можуть видаляти силільні групи. Інші 87832 14 гідроксизахисні групи включають в себе ефір, такий як тетрагідропіраніловий (ТГП) ефір, включаючи в себе алкоксіалкілові ефіри (ацеталі), такий як метоксиметиловий (MOM) ефір, або складний ефір, такий як хлороцтовий ефір, триметилацетат, ацетат або бензоат. Приклади гідроксизахисних груп і способів захисту і видалення, включені в рамки даної заявки (але не обмежені ними) можуть, наприклад, бути знайдені в "Protective Groups in Organic Synthesis" 3rd ed., T.W. Greene & P.G.M. Wuts eds., John Wiley 1999 і в "Protecting Groups", 1st ed., P.J. Kocienski, G. Thieme 2000. Термін «алкіл», що використовується тут, означає лінійну або розгалужену алкільну групу, яка може бути циклічною або ациклічною, що має від одного до двадцяти атомів вуглецю, переважно, від одного до семи атомів вуглецю. Метильна група, етильна група, н-пропільна група, ізопропільна група, пентильна група, гексильна група і трет.-бутилдиметильна група являють собою, не обмежуючись ними, приклади алкільних груп. Використовуваний термін «відновний агент» означає будь-який агент, здатний до відновлення, включаючи в себе енантіоселективне або діастереоселективне відновлення С-24 кетогрупи сполуки загальної структури III, з отриманням сполуки загальної структури IV. В одному варіанті здійснення, відновний агент може відновлювати С-24 кетогрупу сполуки загальної структури III без хіральної допоміжної сполуки з утворенням суміші сполук загальної структури IV, при цьому згадана суміш збагачена бажаним епімером IVa (переважно що утворює 24-S ізомер). В іншому варіанті здійснення, відновний агент може відновлювати С24 кетогрупу сполуки загальної структури III в присутності хіральної допоміжної сполуки з утворенням суміші сполук загальної структури IV, при цьому згадана суміш збагачена бажаним епімером IVa (переважно що утворює 24-S ізомер). Відновний агент може бути хіральним або ахіральним. Приклади відновних агентів включають в себе (але не обмежуються) боранові відновні агенти, гідриди металів, такі як гідрид літію, гідрид алюмінію, борогідрид натрію або АlН3, можливо в присутності солей лантанідів (наприклад, LaCl3, СеВr3, СеСl3) або NaBH3(OAc), Zn(BH4)2 і Et3SiH. Інші відновні агенти включають в себе (але не обмежуються) водень в присутності каталізатора, такого як платина або рутеній, натрій в етанолі, ізопропіловий спирт і ізопропоксид алюмінію, і порошок цинку у воді або в спирті. Використовуваний тут термін «борановий відновний агент» включає в себе боран або будь-яке похідне борану, таке як боранові комплекси з амінами або ефіром. Необмежувальні приклади боранових відновних агентів, наприклад, включають в себе N,N-діетиланілінборан, борантетрагідрофуран, 9-боранбіциклононан (9-ББН) або борандиметилсульфід. Термін «хіральна допоміжна сполука», що використовується тут, означає хіральну сполуку або оптично активний каталізатор, наприклад, сполуку, що містить асиметрично заміщений атом вуглецю або допоміжні хіральні сполуки, або суміші хіральних сполук і/або оптично активних каталізаторів, 15 які будуть поліпшувати вихід сполуки загальної структури IVa по відношенню до її епімерів (збільшення молярного співвідношення IVa:IVb) при відновленні сполуки загальної формули III із згаданим відновним агентом. Згадані хіральні допоміжні сполуки можуть, таким чином, бути будь-якими сполуками, які здатні збільшувати стереоселективність в реакції відновлення сполуки загальної структури III в порівнянні з виходом або стереоселективністю для IVa без присутності або включення хіральної допоміжної сполуки. Необмежувальні приклади хіральних допоміжних сполук включають в себе хіральні 1,2-аміноспирти, такі як хіральні цис-1-аміно-2-інданолпохідні, такі як (1S,2R)-(-)цис-1-аміно-2-інданол або цис-1-аміно-1,2,3,4тетрагідронафталін-2-ол, такі як (1S,2R)-цис-1aміно-1,2,3,4-тетрагідронафталін-2-ол. Інші приклади являють собою бінафтилпохідні, такі як (R)2,2'-біс(дифенілфосфіно)-1,1'-бінафтилрутеній ацетат 2,2'-дигідрокси-1,1'-бінафтилпохідні. Додаткові приклади включають в себе, але не обмежуються ними, (R)-(+)-a,a-дифеніл-2тролідинметанол, (R)-(+)-2-аміно-4-метил-1,1дифеніл-1-пентанол, (R)-(-)-2-аміно-3-метил-1,1дифеніл-1-бутанол, (R)-(+)-2-аміно-1,1,3-трифеніл1-пропанол і (1S, 2R)-(-)-2-аміно-1,2дифенілетанол. Використовуваний тут термін «інертний розчинник» означає будь-який органічний розчинник, сумісний із згаданим відновним агентом в умовах реакції, що застосовуються, або суміші таких розчинників. Вибір такого розчинника буде залежати від специфіки відновного агента, що використовується. Необмежувальні приклади інертних розчинників включають в себе вуглеводні, такі як толуол, і ефір, такий як трет.-бутилметиловий ефір або тетрагідрофуран. Суміш сполук загальної структури IVa і IVb, яка збагачена IVa, означає суміш, що можливо містить інші сполуки або розчинники, з молярним співвідношенням (діастереомерне співвідношення) IVa/IVb, що дорівнює одиниці (50:50) або більше, ніж одиниця, таким чином, що суміш містить щонайменше 50% сполуки загальної структури IVa (із вмістом 50% або менше сполуки загальної структури IVb). Суміш сполук загальної структури Va і Vb, яка збагачена Va, означає суміш, що може містити інші сполуки або розчинники, з молярним співвідношенням (діастереомерне співвідношення) Va/Vb, що дорівнює одиниці (50:50) або більше, ніж одиниця, таким чином, що суміш містить щонайменше 50% сполуки загальної структури Va (із вмістом 50% або менше сполуки загальної структури Vb). Суміш сполук загальної структури Vla і VIb, яка збагачена Vla, означає суміш, що може містити інші сполуки або розчинники, з молярним співвідношенням (діастереомерне співвідношення) VIa/VIb, що дорівнює одиниці (50:50) або більше, ніж одиниця, таким чином, що суміш містить щонайменше 50% сполуки загальної структури Via (із вмістом 50% або менше сполуки загальної структури VIb). Використовуваний тут термін «виділення сполуки» включає в себе очищення і/або ізоляцію 87832 16 сполуки, наприклад щонайменше 90% чистоти, такої як щонайменше 95% чистоти, такої як 97% чистоти, 98% чистоти, 99% чистоти. Термін «виділення сполуки» також включає в себе значення збільшення концентрації сполуки в суміші таких сполук, що можливо містять розчинники, таким чином, що суміш додатково збагачується бажаною або переважною сполукою або ізомером, таким як епімер, після згаданого виділення. Варіанти здійснення У найбільш переважному в даний час варіанті здійснення даного винаходу X являє собою OR2. У переважному в даний час варіанті здійснення даного винаходу R1 і/або R2 являють собою алкілсиліл, такий як трет.-бутилдиметилсиліл, найбільш переважно, коли R1 і R2 однакові. В іншому варіанті здійснення даного винаходу R1 і R2 являють собою водень. У переважному в даний час варіанті здійснення даного винаходу відновний агент являє собою борановий відновний агент, такий як N,Nдіетиланілінборан, борантетрагідрофуран, або борандиметилсульфід. У переважному в даний час варіанті здійснення даного винаходу стадію відновлення проводять з хіральним відновним агентом або в присутності хіральної допоміжної сполуки. У переважному в даний час варіанті здійснення даного винаходу хіральна допоміжна сполука являє собою хіральний 1,2-аміноспирт, такий як хіральне похідне цис-1-аміно-2-інданолу, таке як (1S,2R)-(-)-цис-1-аміно-2-інданол. У переважному в даний час варіанті здійснення даного винаходу стадію відновлення проводять в інтервалі температур від 10 до 20°С, зокрема 1520°С. В іншому варіанті здійснення даного винаходу молярне співвідношення (діастереомерне співвідношення IVa/IVb) суміші сполук загальної структури IVa і IVb, яка збагачена IVa, більше, ніж 55:45, таке як 56:44, таке як 57:43, таке як 59:41, таке як 60:40, таке як 63:37, таке як 65:35, таке як 68:32, таке як 70:30, таке як 72:28, таке як 73:27, таке як 74:26, таке як 75:25, таке як 76:24, таке як 77:23, таке як 78:22, таке як 79:21, таке як 80:20. В іншому варіанті здійснення даного винаходу молярне співвідношення (діастереомерне співвідношення Va/Vb) суміші сполук загальної структури Va і Vb, яка збагачена Va, більше, ніж 55:45, таке як 56:44, таке як 57:43, таке як 59:41, таке як 60:40, таке як 63:37, таке як 65:35, таке як 68:32, таке як 70:30, таке як 72:28, таке як 73:27, таке як 74:26, таке як 75:25, таке як 76:24, таке як 77:23, таке як 78:22, таке як 79:21, таке як 80:20. В іншому варіанті здійснення даного винаходу молярне співвідношення (діастереомерне співвідношення VIa/VIb) суміші сполук загальної структури Vla і VIb, яка збагачена Vla, більше, ніж 55:45, таке як 56:44, таке як 57:43, таке як 59:41, таке як 60:40, таке як 63:37, таке як 65:35, таке як 68:32, таке як 70:30, таке як 72:28, таке як 73:27, таке як 74:26, таке як 75:25, таке як 76:24, таке як 77:23, таке як 78:22, таке як 79:21, таке як 80:20. В одному варіанті здійснення даного винаходу сполука загальної структури Va виділена, напри 17 клад, хроматографічно з суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені вище в (стадії (с)). В іншому варіанті здійснення даного винаходу сполука загальної структури Vla виділена, наприклад, хроматографічно з суміші сполук загальної структури Vla і VIb, яка збагачена Vla, при цьому X, R1 і R2 визначені вище в (стадії (g)). Способи синтезу Сполуки загальної структури III можуть, наприклад, бути синтезовані за допомогою реакції Дільса-Альдера при обробці сполуки загальної структури VII або VIII діоксидом сірки. Використовуваний діоксид сірки може бути рідким, газоподібним або розчиненим у відповідному розчиннику. Відповідні розчинники для реакції ДільсаАльдера являють собою всі розчинники, які сумісні з умовами реакції, такі як алкани, такі як гексан або гептан, вуглеводні, такі як ксилоли, толуол, ефір, такий як діетиловий ефір або метил-трет.бутиловий ефір (МТБЕ), ацетати, такі як етилацетат або 2-пропілацетат, галогеновані розчинники, такі як дихлорметан або суміш згаданих розчинників. У переважному варіанті здійснення розчинник являє собою толуол. В іншому переважному варіанті здійснення розчинник являє собою суміш розчинника, що не змішується з водою, і води, таку як толуол і вода. Реакцію також можна провести в чистому діоксиді сірки без розчинника. Відповідна температура реакції способу знаходиться в інтервалі від -50°С до 60°С, такому як від -30°С до 50°С, такому як від -15°С до 40°С, такому як від 5°С до 30°С, такому як від 0°С до 35°С, такому як від 5°С до 30°С, найчастіше такому як від 10°С до 25°С, такому як від 15°С до 20°С. В одному варіанті здійснення діоксид сірки використовують в надлишку (моль/моль), такому як 5-100 молярний надлишок, такому як 7-30 молярний надлишок, такому як 10-15 молярний надлишок. Будь-який надлишок діоксиду сірки, що не прореагував, може бути видалений з реакційної суміші, наприклад, промиванням з водною основою, такою як водний гідроксид натрію, або відгонкою діоксиду сірки, можливо разом з розчинником, можливо при зниженому тиску. Сполуки загальної структури III звичайно отримують як суміш їх епімерів lllа і lllb. Молярне співвідношення ІІІа/lllb суміші епімерів, отриманих за реакцією Дільса-Альдера буде залежати від груп X, R1 R2 і від умов реакції, що використовуються. Даний винахід включає в себе суміші всіх можливих композицій (молярне співвідношення ІІІа/lllb), таких як 1:99, таких як 2:98, таких як 3:97, таких як 4:96, таких як 5:95, таких як 10:90, таких як 85:15, таких як 80:20, таких як 75:25, таких як 30:70, таких як 35:65, таких як 40:60, таких як 45:55, таких як 50:50, таких як 55:45, таких як 87832 18 60:40, таких як 65:35, таких як 70:30, таких як 75:25, таких як 80:20, таких як 85:10, таких як 90:10, таких як 95:5, таких як 96:4, таких як 97:3, таких як 98:2, таких як 99:1. Загальна формула III включає в себе суміші всіх можливих композицій, як перераховано вище. У варіанті здійснення даного винаходу сполуки lllа і lllb використовують як суміш, як показано в загальній формулі III в подальшій стадії відновлення. Суміш lllа і lllb може, але не обов'язково, бути очищена або виділена хроматографією або кристалізацією. В іншому варіанті здійснення сполуку lllа використовують в подальшій стадії відновлення. У ще одному варіанті здійснення сполуку lllb використовують в подальшій стадії відновлення. Сполука загальної структури VII може, наприклад, бути синтезована згідно з способами розкритими, наприклад, M.J.Calverley, Tetragedron, Vol. 43, №20, рр.4609-4619, 1987 або в WO 87/00834 і в посиланнях, що цитуються там. Наприклад, із сполуки VII, в якій X являє собою OR2 і як R1 так і R2 являють собою являють собою трет.бутилдиметилсиліл, яке описано в даних посиланнях, може бути знятий захист водною гідрофтористою кислотою в ацетонітрилі з отриманням суміші сполук, в яких X являє собою OR2, при цьому або R1 або R2 являють собою водень, або утворюють сполуку, в якій X являє собою OR2, і R1 і R2 обидва являють собою водень. Дана суміш сполук може, наприклад, бути розділена або хроматографією, або кристалізацією, як загалом тут описано. При взаємодії згаданих сполук загальної структури VII, в якій R1 і/або R2 являють собою водень, з відповідним захисним агентом, нові групи R1 і/або R2 можуть бути введені. В залежності від стехіометрії захисного агента, що використовується, і умов реакції може бути отримана суміш незахищених, монозахищених і дизахищених сполук. Будь-яка проміжна сполука в суміші, в якій X являє собою OR2 і або R1 або R2 являє собою водень, може бути потім хроматографічно виділена і може реагувати з відповідним захисним агентом, що відрізняється від першого агента, що використовується, утворюючи сполуки загальної структури VII, в якій X являє собою OR2 і R1 відрізнений від R2. Сполуки загальної структури VII, в якій X являє собою водень і R1 являє собою водень або гідроксизахисну групу можуть, наприклад, бути отримані, починаючи від сполук 7а і/або 7b, описаних M.J. Calverley, Tetrahedron, Vol. 43, №20, p.4610, 1987, подальшими аналогічними процедурами і загальними синтетичними способами, вищеописаним і цитованим вище в посиланнях. Спосіб відновлення по даному винаходу може, наприклад, бути проведений при взаємодії прохірального кетону загальної структури III з хіральним бораном як відновним агентом або з бораном як відновним агентом в присутності хіральної допоміжної сполуки. Спосіб приводить до енантіоселективного/діастереоселективного відновлення прохірального кетону так, що з двох можливих епімерів IVa або IVb утворюється переважно один відповідний епімер. Ступінь енантіоселективності/діастереоселективності буде залежати від від 19 новного агента, що використовується, хіральної допоміжної сполуки і умов реакції. Реакція відновлення сполуки загальної структури III звичайно протікає в температурному інтервалі від -80°С до 70°С, в такому як від -40°С до 60°С, в такому як від -15°С до 50°С, в такому як від -5°С до 40°С, наприклад від 0°С до 5°С або від 5°С до 35°С. В одному варіанті здійснення температурний інтервал складає від 10°С до 30°С, від 15°С до 25°С, від 15°С до 20°С. Оптимум температури буде залежати від специфічних умов реакції і реагентів, що використовуються. В одному варіанті здійснення даного винаходу реакційну суміш негайно охолоджували до 0 -10°С після завершення, щоб уникнути утворення побічних продуктів. Якщо N,N-діетиланілін використовують як відновний агент, то N,N-діетиланілін може легко бути видалений з реакційної суміші екстракцією з водною соляною кислотою. Одномолярний еквівалент по відношенню до основи, що екстрагується 1М соляною кислотою, є переважним. Відновний агент, можливо розчинений або змішаний з інертним розчинником, може бути доданий до сполуки загальної структури III, можливо розчиненої або змішаної з інертним розчинником, наприклад, в інертній атмосфері, такій як азот. Альтернативно, сполука загальної структури III, можливо розчинена або змішана з інертним розчинником, може бути додана до відновного агента, можливо розчиненого або змішаного з інертним розчинником (зворотний порядок). В одному варіанті здійснення даного винаходу, відновний агент використовують в еквімолярній кількості або в молярному надлишку відносно сполуки загальної структури III. У специфічному варіанті здійснення даного винаходу молярне співвідношення відновний агент/сполука загальної структури III становить 1,0-5,0. У переважному в даний час варіанті здійснення даного винаходу молярне співвідношення відновний агент/сполука загальної структури III становить 1,8-3,0, таке як 2,3-3,9, таке як 2,5-2,7. Хіральна допоміжна сполука може реагувати з відновним агентом до відновлення in situ для утворення хірального відновного агента або хіральна допоміжна сполука може, наприклад, служити як хіральний ліганд в комплексі з відновним агентом, тобто, наприклад, утворювати хіральний відновний агент. Даний винахід включає в себе використання таких хіральних відновних агентів або комплексів хіральний лігандвідновний агент, які отримують і виділяють окремо перед використанням для відновлення сполуки загальної структури III. Термін «відновний агент в присутності хіральної допоміжної сполуки» таким чином включає в себе будь-який хіральний відновний агент. Наприклад, хіральна допоміжна сполука може реагувати з борановим відновним агентом до відновлення in situ з утворенням хірального боранового відновного агента або хіральна допоміжна сполука може служити як хіральний ліганд в борановому комплексі. Приклади таких хіральних боранових відновних агентів являють собою хіральні оксаборолідини або оксазаборолідини, такі як хіральні 87832 20 оксазаборолідинові реагенти, отримані з (1R,2S)цис-1-аміно-2-інданолу, (1S,2R)-цис-1-aміно-2інданолу, (S)-пролінолу або В-(3-пінаніл)-9борабіцикло[3.3.2]нонан(аlріnе-boranе) або, наприклад, 5,5-дифеніл-2-метил-3,4-пропано-1,3,2оксазаборолідину, (S)-2-метил-СВSоксазаборолідину, (R)-2-метил-СВSоксазаборолідину. Даний винахід включає в себе тому використання таких хіральних відновних агентів як хіральні боранові відновні агенти, або як комплекси хіральний лігандвідновний агент, такі як хіральний ліганд-боранові комплекси, які отримують і виділяють перед використанням для відновлення сполуки загальної структури III. Інший приклад хірального ліганду в комплексі з відновним агентом являє собою комплекс LiALH4 і 2,2'-дигідрокси-1,1'бінафтилу. Молярне співвідношення відновний агент/хіральна допоміжна сполука знаходиться звичайно в інтервалі 0,1-20,0, такому як 0,4-10, такому як 0,3-5,0, такому як 0,5-4,5, такому як 1,04,0, такому як 1,9-3,1, такому як 2,1-2,9, такому як 2,3-2,7, наприклад 10,8, 5,4,2,6, 2,5 або 1,6. Хіральна допоміжна сполука може бути присутньою в каталітичних кількостях, таких як субстехіометричні або в еквімолярних або в молярному надлишку по відношенню до сполуки загальної структури III або до відновного агента. Наприклад, співвідношення хіральна допоміжна сполука/сполука III може бути 0,25-2,5, таким як 0,5-2,0, таким як 0,8-1,3, таким як 0,9-1,2, таким як 1,0-1,1. Вибір конкретного енантіомеру хіральної допоміжної сполуки буде визначати стереоселективну орієнтацію гідроксигрупи сполуки загальної структури IV відносно С-24. Хіральна допоміжна сполука, яка переважно приводить до Sконфігурації при С-24, є переважною. Реакції, що каталізуються боранами, були, наприклад, розглянуті Deloux and Srebnik [Chem. Rev.93, 763, 1993]. Приклади ефективних каталізаторів, заснованих на хірально модифікованих боранах, можуть, наприклад, бути знайдені в [А.Нігао, J.Chem. Soc. Chem. Commun. 315,1981; E.J. Corey, J. Am. Chem. Soc. 109, 7925, 1987]. Приклади синтезу і/або використання, наприклад, 1,2- і 1,3-аміноспиртів в стереоселективному відновленні з бораном можуть, наприклад, бути знайдені в [E.Didier et al.; Tetrahedron 47, 49414958, 1991; C.H. Senanayake et al., Tetrahedron Letters, 36(42), 7615-18, 1995, EP 0698028, EP 0640089, EP 0305180, WO 93/23408, WO 94/26751]. Синтез і/або використання хіральних цис-1-аміно-2-інданолпохідних в борановому відновленні може, наприклад, бути знайдений в [C.H. Senanayake, Aldrichimica Acta, 31(1), 1-15, 1998; А.К. Ghosh et al., Sinthesis, 937-961, 1998; Y. Hong et al., Tetrahedron Letters, 35(36), 6631-34, 1994; B.Di Simone, Tetrahedron Assimetry, 6(1) 301-06, 1995; Y. Hong et al., Tetrahedron Letters, 36(36), 6631-34, 1994; R. Hett et al., Org. Process. Res. Dev., 2, 96-99, 1998; або ЕР 0763005], і в посиланнях, що там цитуються. Способи отримання кальципотриолу, як тут описані, можуть бути модифіковані відносно послідовності реакційних стадій, пропуску однієї або 21 більше реакційних стадій, або введення додаткових стадій очищення або взаємодії на будь-якій стадії послідовності реакцій. Даний винахід включає в себе всі такі модифікації. Спосіб отримання кальципотриолу, як тут описаний, включає в себе додатково всі варіанти, в яких гідроксизахисні групи R1 і/або R2 для сполук або проміжних сполук, де R1 і/або R2 не є воднем, віддаляються на будь-якій стадії реакційної послідовності. Сполуки або проміжні сполуки, в яких R1 і/або R2 являють собою водень, можуть бути захищені захисними агентами на будь-якій стадії реакційної послідовності, включаючи в себе захисні агенти, які утворюють захисні групи, які відрізняються від груп, видалених раніше в реакційній послідовності. Сполуки і проміжні сполуки за даним винаходом можуть містити асиметрично заміщені (хіральні) атоми вуглецю, і подвійні зв'язки вуглецьвуглець, які можуть спричиняти існування ізомерних форм, наприклад, енантіомерів, діастереомерів і геометричних ізомерів. Епімери відомі як діастереомери, які мають протилежну конфігурацію (R або S) тільки у одного з тетраедричних стереоспецифічних центрів в молекулах, що мають безліч стереоспецифічних центрів, такі як аналоги вітаміну Д, на які орієнтований даний винахід. Позначення, наприклад, С-24 як епімерного центра пари енантіомерів має на увазі, що конфігурація в інших стереоспецифічних центрів пари є ідентичною. Даний винахід відноситься до всіх ізомерних форм, таких як епімери, або до чистих форм або до їх сумішей. Вказівка специфічних конформацій або конфігурацій або в формулах або в найменуваннях сполук або проміжних сполук даного винаходу буде показувати, що дана специфічна конформація або конфігурація є переважним варіантом здійснення винаходу. Вказівка специфічної конформації або конфігурації або в формулах або в найменуваннях сполук або проміжних сполук даного винаходу буде вказувати на те, що дана специфічна конформація або конфігурація являє собою переважний варіант здійснення винаходу. Вказівка специфічної конформації або конфігурації або в формулах або в найменуваннях сполук або проміжних сполук даного винаходу буде включати в себе будь-який інший ізомер, відмінний від специфічно вказаного, або в чистому вигляді або в їх суміші, як інший варіант здійснення даного винаходу. Вказівка неспецифічної конформації або конфігурації або в формулах або в найменуваннях сполук або проміжних сполук даного винаходу буде свідчити, що суміш даних специфічних конформацій або конфігурацій являє собою переважний варіант здійснення винаходу. Наприклад, сполука загальної формули III являє собою суміш епімерів загальної формули lllа і lllb. Вказівка неспецифічної конформації або конфігурації або в формулах або в найменуваннях або в нумераціях сполук або проміжних сполук даного винаходу буде включати в себе будь-який специфічний ізомер, хоч не вказаний специфічно в 87832 22 чистому вигляді, наприклад, як інший варіант здійснення даного винаходу. Наприклад, сполука загальної формули IV включає в себе наступні два епімери IVaa і IVab. Позначення сполуки загальної формули III також включає в себе епімери lllа і lllb. Чисті стереоізомерні форми сполук і проміжних сполук по даному винаходу можуть бути отримані застосуванням методик, відомих в даній галузі, таких як хроматографія або кристалізація, або стереоселективним синтезом. Способи розділення, виділення і очищення за даним винаходом включають в себе, але не обмежуються, хроматографію, таку як адсорбційна хроматографія, (включаючи в себе колонкову хроматографію і хроматографію з псевдо-рухомим шаром (ПРШ)), кристалізацію або дистиляцію. Способи розділення, виділення і очищення можуть бути використані послідовно і в комбінаціях. Колонкова хроматографія, придатна для розділення аналогів вітаміну Д за даним винаходом, добре відома фахівцям в даній галузі фармацевтичної хімії. Методика застосовує колонки, заповнені стаціонарною фазою, наприклад, кремнеземом, таким як заздалегідь оброблений кремнезем, на які завантажують зразок для розділення. Зразок потім елююють відповідним елюентом. Елюювання може бути ізократичним або з так званим програмуванням розчинника (градієнтним), коли склад елюенту змінюється регулярно, (наприклад, лінійно) або не регулярно (наприклад, ступінчасто через проміжок часу). Заздалегідь оброблений силікагель добре відомий фахівцям в галузі хроматографії, являє собою відповідну стаціонарну фазу. Елюювання з 5% (об.:об.) етилацетатом в гексані або в гептані з подальшим елююванням чистим етилацетатом являє собою не єдиний приклад програмованого елюювання, яке приводить до бажаного розділення. Інші відповідні елюенти будуть підібрані фахівцями в даній галузі за допомогою розвитку стандартних способів, наприклад, використанням сумішей гептану і етилацетату відповідної полярності. Для стадії хроматографування може бути використана будь-яка комбінація стаціонарної фази (насадки) і елюенту, яка здатна розділити суміш епімерів С-24. Такі комбінації можуть бути легко визначені фахівцем в даній галузі за допомогою типового експерименту. Наприклад, переважна стаціонарна фаза являє собою кремнезем, такий як оброблений кремнезем. Ретро-реакція Дільса-Альдера суміші сполук загальної структури IVa і IVb, яка збагачена IVa, в присутності основи для отримання суміші сполук загальної структури Va і Vb, яка збагачена Va, при цьому X, R1 і R2 визначені вище, може бути прове 23 дена у всіх розчинниках, які сумісні з умовами реакції, таких як алкани, таких як гексан або гептан, у вуглеводнях, таких як ксилоли, толуол, в ефірі, такому як діетиловий ефір або метил-трет.бутиловий ефір (МТБЕ), в ацетатах, таких як етилацетат або 2-пропілацетат, в галогенованих розчинниках, таких як дихлорметан, у воді або в сумішах вказаних розчинників. Способи згаданої ретро-реакції ДільсаАльдера добре відомі фахівцям в галузі синтезу вітаміну Д (дивись, наприклад, M.J.Calverley, Tetrahedron, Vol. 43, №20, pp.4609-4619, 1987 або в WO 87/00834). Переважні розчинники являють собою толуол, трет.-бутилметиловий ефір, воду або їх суміші. Основи, придатні для використання в ретрореакції Дільса-Альдера включають в себе, але не обмежуються ними, NaHCO3, КНСО3, Na2CO3 або К2СО3. В одному варіанті здійснення даного винаходу основа являє собою водний NaHCO3, і/або ретро-реакцію Дільса-Альдера проводять при температурі вище за 60°С, такій як 70°С, такій як від 70°С до 120°С, такій як від 74°С до 79°С, такій як від 72°С до 78°С. В одному варіанті здійснення даного винаходу температурний інтервал екстракцій і фазових розділень після завершення ретро-реакції ДільсаАльдера під час обробки реакційної маси складає, приблизно, 30°С-40°С. Сполуки загальної структури VIII можуть бути отримані ізомеризацією сполук загальної структури VII. Способи ізомеризації сполук загальної формули Va і/або Vb до Vla і/або VIb, або VII до VIII добре відомі фахівцям в галузі синтезу вітаміну Д. Умови реакції можуть, наприклад, бути знайдені в MJ.Calverley, Tetrahedron, Vol. 43, №20, pp.46094619, 1987 або в WO 87/00834 і в посиланнях, що там цитуються. У переважному варіанті здійснення даного винаходу ізомеризація являє собою фотоізомеризацію, наприклад, УФ освітлення в присутності триплетного сенсибілізатора, наприклад, антрацену або 9-ацетилантрацену. Сполуки загальної формули III, IV, V, VI або VII, в яких Х=водень, можуть бути гідроксильовані відповідним гідроксилуючим агентом, наприклад, селенітною проміжною сполукою при алільному гідроксилуванні, в умовах, знайдених Гессе, наприклад, з SeO2 і N-метилморфолін-N-оксидом при кип'ятінні із зворотним холодильником в метанолі і/або дихлорметані (D.R. Andrews et al., J. Org. Chem., 1986, 51, 1637) або як описано в M.J.Calverley, Tetrahedron, Vol. 43, №20, pp.46094619, 1987 або в WO 87/00834, для отримання сполук загальної формули III, IV, V, VI або VII, в якій Х=гідрокси (X=OR2 і R2=водень). Гідроксигрупи початкових матеріалів можуть бути захищені відповідними захисними групами, такими як визначено вище, способами такими, як вищеописані, наприклад, щоб уникнути небажаного окислення згаданих гідроксигруп. Гідрат кальципотриолу може бути отриманий кристалізацією кальципотриолу з водних розчинників так, як, наприклад, в способах, описаних в WO 94/15912. 87832 24 ПРИКЛАДИ Загальні зауваження: Всі хімічні речовини, якщо не відмічено інакше, були отримані з комерційних джерел. Всі температури плавлення є нескоректованими. Для спектри 1 Н ядерного магнітного резонансу (ЯМР) (300МГц) і 13С ЯМР (75,6МГц) значення хімічного зсуву (d) наводяться в м. ч., якщо не вказано інше; для розчинів в дейтерохлороформі відносно внутрішнього тетраметилсілану (d=0,00) або хлороформу (d=7,26) або дейтерохлороформу d=76,81 для 13С ЯМР) як стандарту. Значення мультиплетності, визначено як дублет (д), триплет (т), квартет (кв) або не визначено (м), і положення дається в приблизній середній точці, якщо не наводиться інтервал. Всі органічні розчинники, що використовуються, були технічної марки. Хроматографію проводили на силікагелі можливо з використанням флеш-техніки. Пластини для тонкошарової хроматографії, покриті силікагелем, були випущені Merck KGaA. Переважно, силікагель для хроматографії був випущений Merck KGaA Німеччина: LiChroprep® Si60 (15-25мкм). Етилацетат, дихлорметан, гексан, н-гексан, гептан або відповідні суміші етилацетату, дихлорметану, метанолу і петролейного ефіру (40-60), гексану або гептану як елюентів, якщо не відмічені інші. Всі реакції можна легко провести в інертній атмосфері, такій як атмосфера азоту. Сполуки загальної структури III Приклад 1: III: X=OR2, R1, R2=трет.-бутилдиметилсиліл 1(S),3(R)-біс(трет.-бутилдиметилсиліокси)20(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е), 10(19)-триєн SО2-аддукти 20(R),1(S),3(R)-біс(трет.бутилдиметилсиліокси)-20-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн (приготований за способом, описаним M.J.Calverley, Tetrahedron, Vol. 43 №20, pp.4609-4619, 1987) (20,0г) розчиняли в толуолі (210мл) при 20°С з подальшим додаванням води (40мл) і SO2 (20мл) при перемішуванні. Коли на основі ВЕРХ робився висновок, що реакція закінчилася {Колонка LiChrosorb Si 60 5мкм 250×4мм Merck, потік 2мл/хв., детектування при 270нм & детектування маси, гексан/етилацетат 9:1(об.:об.)}, звичайно після 2-2,5 годин додавали суміш гідроксиду натрію (27,7%, 60мл) і води (80мл) при 10-18°С до рН реакційної суміші, що дорівнює 6. Толуольну фазу відділяли і розчинник видаляли у вакуумі без нагріву (переважно, нижче за 30°С) з отриманням двох епімерних SО2аддуктів lllа і lllb у вигляді твердої суміші, що містить в основному lllа, як показано з допомогою ТШХ. Два епімерних SО2-аддукти lllа і lllb можуть бути розділені з допомогою хроматографії. Кристалічний lllа може бути до того ж отриманий розтиранням в порошок твердої суміші з метанолом. 1 Н ЯМР (CDCl3) IIIa/X=OR2, R1, R2=трет.бутилдиметилсиліл = 6,73 (дд, 1Н), 6,14 (д, 1H), 4,69 (д, 1H), 4,62 (д, 1H), 4,35 (с, 1H), 4,17 (м, 1H), 3,92 (д, 1H), 3,58 (д, 1Н), 2,61 (м/1Н), 2,29 (м, 1Н), 2,2-1,2 (м, 16Н), 1,11 (д, 3Н), 1,05 (м, 2Н), 0,90 (м, 25 2Н), 0,87 (с, 9Н), 0,85 (с, 9Н), 0,68 (с, 3Н), 0,06 (с, 3Н), 0,05 (с, 3Н), 0,04 (с, 3Н), 0,02 (с, 3Н) Отримання 1: VII: X=OR2, R2=вoдeнь 1(S),3(R)-біc(трет.-бутилдиметилсиліокси)2(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн 20(R),1(S),3(R)-бic(трет.бутилдиметилсилioкси)-20-(3'-циклопротл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн, отриманий за способом, описаним M.J.Calverley, Tetrahedron, Vol. 43 №20, pp.4609-4619, 1987) (20,0г) розчиняли в ацетонітрилі. Додавали водну фтористоводневу кислоту (40%) і суміш перемішували при кімнатній температурі протягом 1 години. Проходження реакції можна легко контролювати з допомогою ТШХ, використовуючи етилацетат як елюент. Етилацетат додавали до реакційної суміші і суміш промивали водним розчином гідрокарбонату натрію. Органічну фазу сушили з допомогою MgSO4 і суміш концентрували. Утворені кристали (білі голки) відфільтровували, промивали етилацетатом і сушили у вакуумі, отримуючи сполуку VII, вказану в заголовку (X=OR2, R1, R2=вoдeнь). 1 Н ЯМР (CDCl3) VII/X=OR2, R1, R2=водень=6,77 (дд, 1Н), 6,57 (д, 1Н), 6,15 (д, 1H), 5,88 (дд, 1Н), 5,13 (дд, 1Н), 4,98 (с, 1H), 4,50 (м, 1H), 4,23 (м, 1Н), 2,86 (м, 2Н), 2,29 (м, 2Н), 2,14-1,20 (м, 16Н), 1,14 (д, 3Н), 1,08 (м, 2Н), 0,89 (м, 2Н), 0,61 (с, 3Н) м.ч. Приклад 2 III: X=OR2, R1, R2=водень 1 1(S),3(R)-дигідрокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн SО2-аддукти. Той же спосіб, як і в Прикладі 1, за винятком того, що вихідним матеріалом був 1(S),3(R)дигідрокси-20(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)еніл)-9,10-секопрегна-5(Е),7(Е),10(19)-триєн з приготування 1. 1 H ЯМР (CDCl3) III/X=OR2, R1, R2 = водень d=6,80 (дд, 1Н), 6,15 (д, 1H), 4,75 (м, 2Н), 4,5-3,9 (м, 4Н), 3,70 (д, 1H), 2,60 (м, 1H), 2,5-0,8 (м, 25Н), 0,68 (с, 3Н) м.ч.; 13 С ЯМР (CDCl3) III/X=OR2, R1, R2 = водень d=201,0, 152,1, 151,0, 133,7, 129,2, 128,3, 108,8, 67,3, 65,1, 63,6, 56,1, 55,9, 55,5, 46,5, 40,1, 39,9, 33,9, 29,8, 27,4, 23,9,22,1, 19,5, 18,9, 12,2, 11,2 м.ч. Отримання 2: VII: X=OR2, вoдeнь = R1 , = тpeт.R2 бутилдиметилсилыл 1(S)-трет.-бутилдиметилсиліл-3(R)-гідрокси20(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн 20(R)1(S)3(R)-біс(трет.бутилдиметилсилілокси)-20-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн був частково позбавлений захисту з використанням тих же умов зняття захисту, як і в Приготуванні 1, з отриманням суміші початкового матеріалу, що не прореагував, двох, частково позбавлених захисту, проміжних продуктів, і сполуки Приготування 1. Очищення хроматографією привело до отримання чистої сполуки, 87832 26 вказаної в заголовку. 1Н ЯМР, як було знайдено, знаходиться у відповідності зі структурою. 1 Н ЯМР (CDCl3) VII/X=OR2, R1=вoдeнь, R2=трет.-бутилдиметилсиліл d=6,75 (дд, 1Н), 6,50 (д, 1Н), 6,14 (д, 1Н), 5,84 (д, 1Н), 5,00 (с, 1Н), 4,92 (с, 1Н), 4,47 (т, 1Н), 4,22 (м, 1Н), 2,85 (дд, 1Н), 2,62 (дд, 1Н), 2,43 (дд, 1Н), 2,29 (м, 1Н), 2,15-1,15 (м, 15Н), 1,11 (д, 3Н), 1,06 (м, 2Н), 0,87 (с, 9Н), 0,86 (м, 2Н), 0,59 (с, 3Н), 0,06 (с, 3Н), 0,04 (с, 3Н) м.ч. Приклад 3: III: X=OR2, вoдeнь = R1 , = тpeт.R2 бyтилдимeтилcилiл 1(S)-тpeт.-бyтилдимeтилcилiл-3(R)-гiдpoкcи20(R)-(3'-циклoпpoпiл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн SO2 аддукти. Той же спосіб як і в Прикладі 1, за винятком того, що вихідним матеріалом був 1(S)-трет.бутилдиметилсиліл-3(R)-гідрокси-20(R)-(3'циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн з Приготування 2. 13 С ЯМР (CDCl3) III/X=OR2, R1=водень, R2=трет.-бутилдиметилсиліл d=200,3, 151,5, 150,4, 132,0, 129,5, 128,0, 108,5, 66,8, 65,5, 63,8, 56,1, 55,9, 55,2, 46,2, 39,8, 33,6, 29,5, 27,2, 25,4, 23,7, 21,8, 19,2, 18,5, 17,7, 11,8, 10,7, -4,7, -5,2 ррм; 1 H ЯМР (CDCl3) IIIb/X=OR2, R1=водень, R2=трет.-бутилдиметилсиліл d=6,75 (дд, 1Н), 6,14 (д, 1Н), 4,80 (д, 1Н), 4,65 (д, 1H), 4,43 (м, 1Н), 4,25 (м, 1Н), 3,92 (д, 1H), 3,63 (дд, 1Н), 2,60 (д, 1Н), 2,51,2 (м, 18Н), 1,12 (д, 3Н), 1,06 (м, 2Н), 0,88 (с, 9Н), 0,87 (м, 2Н), 0,59 (с, 3Н), 0,09 (с, 3Н), 0,07 (с, 3Н) м.ч. Отримання 3: VII: X=OR2, R1=COCMe3, R2=трет.бутилдиметилсиліл 1(S)-трет.-бутилдиметилсиліл-3(R)триметилацетокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн 1(S)-трет.-бутилдиметилсиліл-3(R)-пдрокси20(R)-(3'-циклопротл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн з Приготування 2 може реагувати з хлоридом триметилоцтової кислоти в присутності триетиламіну в дихлорметані. Отриманий сирий продукт можна очистити хроматографічно з отриманням чистої сполуки, вказаної в заголовку. Отримання 4: VII: X=OR2, Ri=COCMe3, R2=водень 1(S)-гідрокси-3(R)-триметилацетокси-20(R)-(3'циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн. 1(S)-трет.-бутилдиметилсиліл-3(R)триметилацетокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн може бути позбавлений захисту, використовуючи той же спосіб зняття захисту, як і в Приготуванні 1. Отриманий сирий продукт можна очистити хроматографічно з отриманням чистої сполуки, вказаної в заголовку. Приклад 4: III: X=OR2, Ri=COCMe3, R2=водень 27 1(S)-гiдpoкcи-3(R)-тpимeтилaцeтoкcи-20(R)-(3'циклoпpoпiл-3'-oкcoпpoп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн SО2 аддукти. Той же спосіб, як і в Прикладі 1, за винятком того, що вихідним матеріалом був 1 (S)-гідрокси3(R)-триметилацетокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн з приготування 4. 13 С ЯМР (CDCl3) IIIa/X=OR2, R1=COCMe3, R2водень d=200,4, 177,6, 151,6, 150,9, 132,8, 129,3, 128,1, 108,8, 66,9, 66,3, 64,6, 55,8, 55,5, 55,3, 46,3, 39,9, 38,5, 36,3, 30,2, 29,6, 27,2, 26,9, 23,7, 21,8, 19,3, 18,6, 11,9, 10,8 м.ч. Приклад 5: III: X=OR2, R1=COCMe3, R2=трет.бутилдиметилсиліл 1(S)-трет.-бутилдиметилсиліл-3(R)триметилацетокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна-5(Е),7(Е),10( 19)-триєн SO2 аддукти Той же спосіб як в Прикладі 1, за винятком того, що вихідним матеріалом був 1(S)-трет.бутилдиметилсиліл-3(R)-триметилацетокси-20(R)(3'-циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн, що отримується, наприклад, з Приготування 3. Отримання 5 VII: X=OR2, R1=COMe, R2=водень 1(S)-гідроксі-3(R)-ацетокси-20(R)-(3'циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн. 1(S),3(R)-дигідрокси-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн (VII: X=OR2, Ri, R2=вoдeнь) з Приготування 1 може реагувати з еквівалентом ацетилхлориду в присутності триетиламіну. Суміш продуктів можна очистити хроматографічно на кремнеземі з отриманням чистої сполуки, вказаної в заголовку. Приклад 6 III: X=OR2, R1=COMe, R2=вoдeнь 1(S)-гідроксі-3(R)-ацетокси-20(R)-(3'циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн SO2 аддукти. Той же спосіб, як в Прикладі 1, за винятком того, що вихідним матеріалом був 1(S)-гідроксі-3(R)ацетокси-20(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)еніл)-9,10-секопрегна-5(Е),7(Е),10(19)-триєн (VII: X=OR2, R1=COMe, R2=водень ), що отримується в Приготуванні 5. 13 С ЯМР (CDCl3) IIIa/X=OR2, R1=COMe, R2=водень d=200,5, 170,3, 151,6, 150,9, 132,8, 129,2, 128,1, 108,3, 66,8, 66,4, 64,6, 55,9, 55,7, 55,3, 46,3, 39,9, 36,4, 30,4, 29,6, 27,2, 23,7, 21,8, 21,0, 19,3, 18,6, 11,9, 10,8. Приклад 7: III: X=OR2, R1=COMe, = трет.R2 бутилдиметилсиліл 1(S)-трет.-бутилдиметилсиліл-3(R)-ацетокси20(R)-(3'-циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн SO2 аддукти. Той же спосіб, як в Прикладі 1, за винятком того, що вихідним матеріалом був 1(S)-трет.бутилдиметилсиліл-3(R)-ацетокси-20(R)-(3' 87832 28 циклопропіл-3'-оксопроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн. 1 Н ЯМР (CDCl3) IIIa/X=OR2, R1=COMe, R2=трет.-бутилдиметилсиліл d=6,75 (дд, 1Н), 6,16 (д, 1Н), 5,20 (м, 1Н), 4,71 (с, 2Н), 4,33 (с, 1H), 3,95 (д, 1Н), 3,60 (д, 1Н), 2,61 (м, 1Н), 2,31 (м, 2Н), 2,151,2 (м, 15Н), 2,03 (с, 3Н), 1,11 (д, 3Н), 1,07 (м, 2Н), 0,89 (м, 2Н), 0,88 (с, 9Н), 0,68 (с, 3Н), 0,08 (с, 3Н), 0,07 (с, 3Н) м.ч. Приклад 8: III: Х=водень, R1=трет.-бутилдиметилсиліл 3(R)-тpeт.-бyтилдимeтилcилiлoкcи-20(R)-(3'циклoпpoпiл-3'-oкcoпpoп-1'(E)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєн SO2 аддукти. Початковий матеріал VII, Х=водень , R1= тpeт.бyтилдимeтилcилiл (отриманий за способом, описаним M.J. Calverley, Tetragedron, Vol. 43, №20, pp.4609-4619, 1987) (38,5г) розчиняли в толуолі (550мл) при 20°С з подальшим додаванням води (105мл) і SO2 (50мл) при перемішуванні. Про закінчення реакції судили по ВЕРХ {Колонка LiChrosorb Si 60 5мкм 250×4мм Merck, потік 2мл/хв., детектування при 270нм & детектування маси, гексан/етилацетат 9:1 (об.:об.)}, звичайно після 2-2,5 годин додавали суміш гідроксиду натрію (27,7%, 150мл) і води (480мл) при 10-18°С до рН реакційної суміші 6. Толуольну фазу відділяли і розчинник видаляли у вакуумі без нагріву (переважно нижче за 30°С) з отриманням двох епімерних SO2 аддуктів lllа і lllb (Х=водень , R1= трет.бутилдиметилсиліл) у вигляді твердої суміші, що містить в основному lllа, як показано з допомогою ТШХ. Два епімерних SO2 аддукти lllа і lllb можуть бути розділені хроматографією. Кристалічний lllа може бути до того ж отриманий розтиранням в порошок твердої суміші з метанолом. 13 С ЯМР (CDCI3) (III: Х =одень, R1=трет.в бутилдиметилсиліл, суміш ізомерів llІа і lllb): 200,3, 151,6, 151,4, 149,8, 149,2, 130,5, 130,1, 128,3, 128,1, 126,6, 126,3, 110,5, 110,0, 67,4, 66,7, 66,6, 66,3, 58,0, 57,9, 55,8, 55,6, 55,3, 55,2, 46,3, 45,5, 39,9, 39,7, 34,4, 34,1, 33,9, 31,4, 30,8, 30,5, 29,6, 29,1, 27,3, 27,1, 26,7, 25,6, 25,1, 24,4, 24,1,23,6,23,2,22,4,21,9,21,9, 19,4, 19,3, 18,6, 18,4, 17,9, 17,9, 13,9, 12,2, 11,9, 10,8, -5,0. Сполуки загальної структури IV Приклад 9: SО2-аддукт 1(S),3(R)-біс(трет.бутилдиметилсилілокси)-20(R)-(3'-циклопропіл3'(S)-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVa: X=OR2, R1, R2=трет.-бутилдиметилсиліл) і SО2-аддукт 1(S),3(R)-біс(трет.бутилдиметилсилілокси)-20(R)-(3'-циклопропіл3(R)'-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVb: X=OR2, R1, R2=тpeт.-бyтилдимeтилcилiл) (1S,2R)-(-)-циc-1-aмiнo-2-iндaнoл (5,0г) змішували з МТБЕ (160мл) в атмосфері азоту при 1525°С з подальшим додаванням N,Nдіетиланілінборану (16мл) при тій же температурі. Суміш перемішували до припинення виділення водню. Суміш SО2-аддуктів 1(S),3(R)-біс(трет.бутилдиметилсиліокси)-20(R)-(3'-циклопропіл-3' 29 оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (III: X=OR2, R1, R2=тpeт.-бyтилдимeтилcилiл), отриманих в Прикладі 1, розчиняли в толуолі (160мл) і в МТБЕ (80мл). Даний розчин по краплях додавали до боранвмісної суміші при 15-25°С. Суміш перемішували протягом 30-60 хвилин після завершення додавання, і потім гасили насиченим водним NaHCO3 (110мл) при 10-15°С. Органічну фазу відділяли і промивали 1М соляною кислотою (100мл) при 0-10°С з подальшим промиванням насиченим водним NaHCO3 (100мл). Органічну фазу, що містить SО2-аддукти 1(S),3(R)-бic(трет.бyтилдимeтилcилioкcи)-20(R)-(3'-циклoпpoпiл3(S)'-гiдpoкcипpoп-1'(E)-eнiл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVa: X=OR2, R1 R2=трет.-бутилдиметилсиліл), і SО2-аддукти 1(S),3(R)-біс(трет.бутилдиметилсиліокси)-20(R)-(3'-циклопропіл3(R)'-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVb: X=OR2, R1 R2=тpeт.-бyтилдимeтилcилiл) в молярному співвідношенні 72-78:22-28 (IVa:IVb), як перевірено ВЕРХ аналізом аліквоти після ретрореакції Дільса-Альдера і аналізу у відповідності зі способом, описаним в прикладі 10. Сполуки IVaa виділяли хроматографією на кремнеземі. 13 С ЯМР (CDCl3) IVa/X=OR2, R1 R2=трет.бутилдиметилсиліл d=150,6, 137,6, 132,3, 129,3, 128,8, 109,0, 76,9, 67,3, 65,8, 64,5, 56,2, 56,1, 55,9, 46,0, 40,5, 40,0, 39,6, 34,1, 29,6, 27,4, 25,6, 25,5, 23,8, 21,8, 20,3, 17,8, 17,7, 17,4, 11,8, 2,8, 1,7, -4,7, -5,0/ -5,0, -5,2 Приклад 10 SО2-аддукти 3(R)-трет.-бутилдиметилсиліокси-20(R)-(3'-циклопропіл-3'(S)гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVa: Х=водень, R1=трет.-бутилдиметилсиліл) і SО2-аддукти 3(R)-трет.-бутилдиметилсиліокси-20(R)-(3'-циклопропіл-3'(R)гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVb: Х=водень, R1=трет.-бутилдиметилсиліл), (1S,2R)-(-)-цис-1-аміно-2-інланол (1,22г, 1,08екв.) змішували з МТБЕ (36мл) в атмосфері азоту при 15-25°С з подальшим додаванням N,Nдіетиланілінборану (3,6мл, 2,7екв.) при тій же температурі. Суміш перемішували до припинення виділення водню. Суміш SО2-аддуктів 3(R)-біс-(трет.бутил-диметилсиліокси)-20(R)-(3'-циклопропіл-3'оксопроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (III: Х=водень , R1= тpeт.-бyтилдимeтилcилiл), отриману в Прикладі 8 (4,32г), розчиняли в суміші МТБЕ (18мл) і толуолу (36мл) при кімнатній температурі і потім по краплях додавали до боранвмісної суміші при 15-25°С протягом 15хв. Суміш перемішували протягом 60 хвилин після завершення додавання і потім гасили насиченим водним NaHCO3 (25мл). Органічну фазу відділяли і промивали 1М соляною кислотою (25мл) при 0-10°С з подальшим промиванням насиченим водним NaHCO3 (25мл) при 10-20°С. Органічна фаза містила SО2-аддукти 3(R)-біс(трет. 87832 30 бутилдиметилсиліокси)-20(R)-(3'-циклопропіл3(S)'-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєну (IVa: Х=водень, R1=трет.-бутилдиметилсиліл) і SО2-аддукти 3(R)-трет.-бутилметилсиліокси-20(R)(3'-циклопропіл-3(R)'-гідроксипроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)-триєну (IVb: Х=водень , R1= трет.-бутилдиметилсиліл). Сполуки загальної структури V Приклад 11: 1(S),3(R)-біс(трет.-бутилдиметилсилілокси)20(R)-(3'-циклопропіл-3(S)'-гідроксипроп-1'(Е)еніл)-9,10-секопрегна-5(Е),7(Е),10(19)триєн (Va: X=OR2, R1, R2=трет.-бутилдиметилсиліл) і 1(S),3(R)-біс(трет.-бутил-диметилсилілокси)20(R)-(3'-циклопропіл-3(R)'-гідроксипроп-1'(Е)еніл)-9,10-секопрегна-5(Е),7(Е),10(19)триєн (Vb: X=OR2, R1, R2=трет.-бутилдиметилсиліл) Органічну фазу з Прикладу 9, що містить SО2аддукти IVa (X=OR2, R1, R2=тpeт.бyтилдимeтилcилiл) і Vb (X=OR2, R1, R2=тpeт.бyтилдимeтилcилiл) енергійно перемішували з насиченим водним розчином NaHCO3 (110мл) (температура бані, приблизно, 90°С), де відганявся МТБЕ. Ретро-реакцію Дільса-Альдера можна було легко контролювати за допомогою ВЕРХ {Колонка LiChrosorb Si 60 250×4мм Merck, витрата 1мл/хв., детектування при 270нм, гексан/етилацетат 9:1,5(об.:об.)}. Після завершення (звичайно 2-2,5 години) реакційну суміш охолоджували до 30-40°С і органічну фазу відділяли, промивали насиченим водним розчином NaНСО3 (110мл) і водою (100мл). Розчинник видаляли у вакуумі і отримане масло (29г) розчиняли в гексані (200мл). Органічну суміш охолоджували до, приблизно, -15°С, фільтрували через короткий шар кремнезему, і залишок промивали гексаном (приблизно, 100мл). Гексанову фазу промивали сумішшю метанол і вода (1:2) і органічний розчинник видаляли у вакуумі. Масло, що залишилося, що містить суміш 1(S),3(R)біс(трет.-бутилдиметилсилілокси)-20(R)-(3'циклопротл-3(S)'-гідроксипроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)триєну (Va: X=OR2, R1, R2=трет.-бутилдиметилсиліл) і 1(S),3(R)-біc(трет.-бутил-диметилсилілокси)-20(R)(3'-циклопропіл-3(R)'-гідроксипроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)триєну (Vb: X=OR2, R1 R2=трет.-бутилдиметилсиліл) в молярному співвідношенні в інтервалі 72-78:22-28 (Va:Vb), як перевірено за допомогою ВЕРХ {Колонка LiChrosorb Si 60 5мкм 250×4мм Merck, витрата 1мл/хв., детектування при 270нм, н-гептан/2пропанол 100:0,25 (об.:об.): час утримування Va, приблизно, 14,3хв., Vb: 11,9хв.; або гексан/етилацетат 90:15 (об.:об.): час утримування Va, приблизно, 7,6хв., Vb: 6,4хв.}, очищали хроматографією, як описано раніше M.J. Calverley, Tetrahedron, Vol. 43, №20, pp.4609-4619, 1987 або WO 87/00834, отримуючи 10,9г (98,9% чистота ВЕРХ) Va/X=OR2, R1, R2=трет.-бутилдиметилсиліл після перекристалізації з суміші гексану і метанолу і невеликої кількості триетиламіну (при повільному випаровуванні гексану з подальшим охолоджуванням до -15°С) у повній відповідності до даних, опи 31 саних M.J. Calverley, Tetrahedron, Vol. 43, №20, pp.4617, 1987 для сполуки 22. 13 С ЯМР (CDCl3) Va/X=OR2, R1, R2=трет.бутилдиметилсиліл d=153,4, 142,9, 137,9, 135,2, 128,7, 121,5, 116,3, 106,4, 77,1, 70,0, 67,0, 56,2, 55,8, 45,7, 43,7, 40,2, 39,8, 36,3, 28,7, 27,5, 25,6, 25,6, 23,3, 22,0, 20,3, 18,0, 17,9, 17,4, 12,1, 2,9, 1,6, -5,0, -5,0, -5,1; Vb/X=OR2, R1, R2=трет.-бутилдиметилсиліл d=153,5, 142,9, 137,6, 135,3, 128,7, 121,5, 116,3, 106,4, 76,8, 70,0, 67,0, 56,2, 56,0, 45,7, 43,8, 40,2, 39,7, 36,4, 28,7, 27,6, 25,7, 25,6, 23,3, 22,0, 20,3, 18,0, 17,9, 17,3, 12,1, 2,8, 1,6, -5,0, -5,1, -5,1 м.ч. Приклад 12 3(R)-трет.-бутилдиметилсилілокси-20(R)-(3'циклопропіл-3(S)'-гідроксипроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)триєн (Va: Х=водень, R1=тpeт.-бyтилдимeтилcилiл) і 3(R)-трет.-бутилдиметилсилілокси-20(R)-(3'циклопропіл-3(S)'-гідроксипроп-1'(Е)-еніл)-9,10секопрегна-5(Е),7(Е),10(19)триєн (Vb: Х=водень, R1=трет.-бутилдиметилсиліл) Органічний розчин з Прикладу 10, що містить SО2-аддукти IVa в(Х = одень , = трет.R1 бутилдиметилсиліл) і IVb (Х=водень , R1= трет.бутилдиметилсиліл), енергійно перемішували з насиченим водним розчином NaHCO3 (25мл) (температура бані, приблизно, 90°С), при цьому відганявся МТБЕ. Ретро-реакцію Дільса-Альдера можна було легко контролювати за допомогою ВЕРХ {Колонка LiChrosorb Si 60 250×4мм Merck, витрата 1мл/хв., детектування при 270нм, гексан/етилацетат 9:1,5 (об.:об.)}. Після завершення (приблизно, 2 години) реакційну суміш охолоджували до 15-25°С і органічну фазу відділяли, промивали водою (25мл), вміст в суміші Va:Vb (Х=водень , R1=трет .-бутилдиметилсиліл) в молярному співвідношенні (75:25), як перевірено ВЕРХ {Колонка LiChrosorb Si 60 5мкм 250×4мм Merck, витрата 1мл/хв., детектування при 270нм, гексан/етилацетат 90:15(об.:об.): час утримування Vb, приблизно, 6,1хв., час утримування Va, приблизно, 7,4хв. 1 Н ЯМР (CDCl3) Va/X=водень, R1=трет.бутилдиметилсиліл d=6,45 (д, 1H), 5,84 (д, 1Н), 5,46 (м, 2Н), 4,92 (с, 1H), 4,63 (с, 1Н), 3,84 (м, 1H), 3,42 (м, 1H), 2,85 (д, 1H), 2,64 (д, 1Н), 2,45 (м, 1H), 2,32-1,18 (м, 17Н), 1,04 (д, 3Н), 0,98 (м, 1h), 0,87 (с, 9Н), 0,56 (с, 3Н), 0,51 (м, 2Н), 0,32 (м, 1H), 0,22 (м, 1Н), 0,05 (с, 3Н), 0,04 (с, 3Н); Vb/X=водень, = трет.-бутилдиметилсиліл R1 d=6,45 (д, 1Н), 5,83 (д, 1Н), 5,47 (м, 2Н), 4,90 (с, 1Н), 4,62 (с, 1H), 3,83 (м, 1Н), 3,45 (м, 1Н), 2,83 (д, 1H), 2,62 (д, 1H), 2,44 (м, 1Н), 2,24 (м, 1Н), 2,181,17 (м, 16Н), 1,03 (д, 3Н), 0,96 (м, 1H), 0,86 (с, 9Н), 87832 32 0,55 (с, 3Н), 0,50 (м, 2Н), 0,30 (м, 1H), 0,20 (м, 1H), 0,05 (с, 3Н), 0,04 (с, 3Н). Сполуки загальної структури VI Приклад 13 1(S),3(R)-біс(трет.-бутил-диметилсилілокси)20(R)-(3'-циклопропіл-3(S)'-гідроксипроп-1'(Е)еніл)-9,10-секопрегна-5(Z),7(Е),10(19)триєн (X=OR2, Vla: R1 R2= трет.-бутилдиметилсиліл) 1(S),3(R)-біс(трет.-бутил-диметилсилілокси)20(R)-(3'-циклопропіл-3(S)'-гідроксипроп-1'(Е)еніл)-9,10-секопрегна-5(Z),7(Е),10(19)триєн (X=OR2, Vla: R1 R2=тpeт.-бyтилдимeтилcилiл), отриманий в Прикладі 11, фотоізомеризували в толуолі з використанням ультрафіолетової лампи високого тиску, як описано раніше M.J. Calverley, Tetrahedron, Vol. 43, №20, pp.4609-4619, 1987 або WO 87/00834, за винятком того, що 9ацетилантрацен використовували замість антранцену, отримуючи 1(S),3(R)-бic(тpeт.бyтилдимeтилcилiлoкcи)-20(R)-(3'-циклопропіл3(S)'-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Z),7(Е),10(19)триєн (Vla X=OR2, R1, R2=трет.-бутилдиметилсиліл) після хроматографії у повній відповідності до даних, описаних M.J. Calverley в Tetrahedron, Vol. 43, №20, pp. 4618, 1987 для сполуки 28. Кальципотриол Приклад 14 1(S),3(R)-дигідрокси-20(R)-(3'-циклопропіл3(S)'-гідроксипроп-1'(Е)-еніл)-9,10-секопрегна5(Z),7(Е),10(19)-триєн 1(S),3(R)-бic(тpeт.-бyтилдимeтилcилiлoкcи)20(R)-(3'-циклопропіл-3(S)'-гідроксипроп-1'(Е)еніл)-9,10-секопрегна-5(Z),7(Е),10(19)триєн (Vla X=OR2, R1 R2=тpeт.-бyтилдимeтилcилiл), отриманий в Прикладі 13, був позбавлений захисту, використовуючи тетрабутилфторид амонію в тетрагідрофурані, з подальшим хроматографуванням, як описано раніше M.J. Calverley, Tetrahedron, Vol. 43, №20, pp.4609-4619, 1987 або WO 87/00834. Кристалізація з суміші етилацетат/гексан, що містить декілька крапель діетиламіну, привела до отримання кальципотриолу у повній відповідності до даних, описаних M.J. Calverley в Tetrahedron, Vol. 43, №20, pp.4618, 1987 для сполуки 4. Моногідрат кальципотриолу Приклад 15 Кальципотриол, отриманий в прикладі 14, кристалізували з суміші етилацетат/вода, як описано в WO 94/15912, отримуючи моногідрат кальципотриолу у повній відповідності до характеристичних даних, описаних в даному патенті. Діастереоселективне відновлення в різних умовах відновлення 33 Приклад 16 87832 34 35 87832 Таблиця 1: Діастереоселективне відновлення сполук загальної структури III, де X=OR2 і R1 і R2=трет.бутилдиметилсиліл (суміш 1S),3(R)-біс(трет.бутилдиметилсиліокси)-20(R)-3'-циклопропіл-3'оксопроп-1'(E)-еніл)-9,10-секопрегна5(Е),7(Е),10(19)-триєн SО2-аддуктів з Прикладу 1 з подальшою процедурою, аналогічною Прикладу 9, з подальшою хелеотропною екструзією діоксиду Комп’ютерна верстка Н. Лиcенко 36 сірки, з подальшою процедурою, аналогічною Прикладу 11, приводить до утворення сполук загальної структури Va: X=OR2, R1, R2=тpeт.бyтилдимeтилcилiл при різних умовах (екв.=молярні еквіваленти відносно III; МТБЕ рет .-бутилметиловий ефір; ДЕАБ=N,Nт = діетиланілінборан). Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStereoselective synthesis of vitamin d analogues
Автори англійськоюSabroe Thomas Peter, Calverley Martin John
Назва патенту російськоюСтереоселективный синтез аналогов витамина д
Автори російськоюСабро Томас Петер, Келверли Мартин Джон
МПК / Мітки
МПК: C07C 401/00, C07D 333/72
Мітки: вітаміну, стереоселективний, аналогів, синтез
Код посилання
<a href="https://ua.patents.su/18-87832-stereoselektivnijj-sintez-analogiv-vitaminu-d.html" target="_blank" rel="follow" title="База патентів України">Стереоселективний синтез аналогів вітаміну д</a>
Попередній патент: Подвійний пальник для газових плит, який належить до типу, що має кілька концентричних вінців полум’я
Наступний патент: Композиція та спосіб одержання кетону
Випадковий патент: Аплікатор для тіла з догляду за шкірою спини