Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності
Номер патенту: 92009
Опубліковано: 27.09.2010
Автори: Карстенс Віллем Фредерік Йоган, Тіммерс Корнеліс Маріус
Формула / Реферат
1. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну формули 1
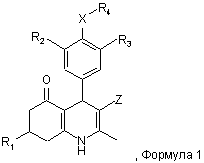
в якій
R1 - (1-6С)алкіл, (2-6С)алкеніл або (2-6С)алкініл;
R2 - галоген;
R3 - SO2NR5R6 або (1-4С)алкокси, як варіант, заміщений одним або більше атомами флуору;
X - О або NR7;
R4 - R8-(2-8C)алкіл, R8-(3-8C)алкеніл, R8-(3-8C)алкініл або R8-(2-4C)aлкoкcі(2-4C)aлкiл;
Z - CN або NO2;
R5 і R6 є незалежно Н або (1-4С)алкілом;
або R5 разом з R6 і N, до якого вони приєднані, утворюють 3-8-членне насичене кільце, яке, як варіант, має додаткові гетероатоми, вибрані з О і S;
R8 - OH, (1-4С)алкокси, NH2; NR9C(O)R11, NR9SO2R11 або C(O)NR9R10;
R7 і R9 є незалежно Н або (1-4С)алкілом;
R10 - (1-4С)алкіл, (1-4С)алкоксі(1-4С)алкіл, або феніл(1-4С)алкіл або (2-5С)гетероарил(1-4С)алкіл, обидва, як варіант, заміщені на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з ОН, NH2, галогену, NO2, CF3, CN, (1-4С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно;
R11 - (1-4С)алкіл, (2-4С)алкеніл, (2-4С)алкініл, (1-4С)алкоксі(1-4С)алкіл, (3-6С)циклоалкіл, (1-4С)алкокси, (ді)(1-4С)алкіламіно або феніл або (2-5С)гетероарил, обидва, як варіант, заміщені на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з ОН, NH2, галогену, NO2, CF3, CN, (1-4С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно;
або її фармацевтично прийнятна сіль.
2. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 1, яка відрізняється тим, що X є О.
3. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 1 або 2, яка відрізняється тим, що R1 є (1-6С)алкілом.
4. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-3, яка відрізняється тим, що R2 є Сl, Вr або І.
5. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-4, яка відрізняється тим, що Z є CN.
6. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-5, яка відрізняється тим, що R3 є SO2NR5R6.
7. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-6, яка відрізняється тим, що призначена для застосування у терапії.
8. Фармацевтична композиція, яка містить похідну 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-6 і фармацевтично прийнятні допоміжні речовини.
9. Застосування похідної 2-метил-4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-6 або її фармацевтично прийнятних солі або сольвату у виготовленні медикаменту для лікування розладів плодючості.
Текст
1. Похідна 2-метил-4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну формули 1 R4 X R2 R 2 (19) 1 3 92009 4 зняється тим, що призначена для застосування у 9. Застосування похідної 2-метил-4-феніл-5-оксотерапії. 1,4,5,6,7,8-гексагідрохіноліну за будь-яким пп. 1-6 8. Фармацевтична композиція, яка містить похідну або її фармацевтично прийнятних солі або соль2-метил-4-феніл-5-оксо-1,4,5,6,7,8вату у виготовленні медикаменту для лікування гексагідрохіноліну за будь-яким пп. 1-6 і фармацерозладів плодючості. втично прийнятні допоміжні речовини. Винахід стосується похідних 2-метил-4-феніл5-оксо-1,4,5,6,7,8-гексагідрохіно-5-ліну, фармацевтичних композицій, що містять їх, і застосування зазначених похідних у виготовленні медикаментів для лікування безплідності. Гонадотропіни грають важливу роль у різних функціях тіла, включаючи метаболізм, терморегуляцію і репродуктивний процес. Гонадотропіни діють на певні типи гонадних клітин, ініціюючи цим оварійну і тестикулярну диференціацію і стероїдогенез. Слизовий гонадотропін FSH (гормон стимуляції фолікул), наприклад, грає головну роль у стимуляції розвитку і дозрівання фолікул, a LH (гормон лютеїнізації) викликає овуляцію (Sharp, R.M. Clin Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35:301342,1979). Наразі FSH застосовують у клініці для оваріальної стимуляції, тобто оваріальної гіперстимуляції для запліднення in vitro (TVF) і індукування овуляції у безплідних ановуляторних жінок (Insler, V., Int. J. Fertility 33:85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5:3-13, 1988), а також при чоловічому гіпогадизму і безплідності. Гонадотропін FSH вивільняється з переднього гіпофізу під впливом гормону, що вивільняє гонадотропін і естрогени, і з плаценти під час вагітності. У жінок FSH діє на яєчник, сприяючи розвитку фолікул і є головним гормоном, що регулює секрецію естрогенів. У чоловіків FSH відповідає за цілісність насіннєносних трубочок і діє на клітини Сертолі, сприяючи гаметогенезу. Очищений FSH використовують клінічно для лікування безплідності у жінок і деяких типів порушення сперматогенезу у чоловіків. Гонадотропін, призначений для терапевтичних цілей може бути ізольований з сечі людини, але з низькою чистотою (Morse et al., Amer. J. Reпродукт. Immunol. and Microbiology 17:143, 1988). Вони також можуть бути приготовлені як рекомбінантні гонадотропіни. Рекомбінантний людський FSH є у продажу і використовується для сприяння репродукції (Olijve et al. Моl. Hum. Reprod. 2:371,1996; Devroey et al. Lancet 339:1170, 1992). Дія гормону FSH опосередковується специфічним рецептором плазмової мембрани, який є членом великої родини рецепторів, сполучених з G-протеїнам. Ці рецептори складаються з одиночних поліпептидів з 7 трансмембранними доменами і можуть взаємодіяти з G-протеїнами, викликаючи активацію аденілатциклази. Рецептор FSH є високоспецифічним об'єктом у процесі росту оваріальних фолікул і експресується виключно у яєчнику. Блокування цього рецептора або пригнічення сигналів, що звичайно відбувається після активації опосередкованого FSH рецептора, порушує розвиток фолікули і, отже, овуляцію і плідність. Низькомолекулярні антагоністи FSH можуть бути основою нових контрацептивів, а низькомолекулярні агоністи FSH можуть бути використані у тих же клінічних застосуваннях, як і природний FSH, тобто для лікування безплідності і гіперстимуляції яєчника при заплідненні in vitro. Низькомолекулярні міметики FSH з агоністичними властивостями були описані у заявках WO 2000/08015 і WO 2002/09706. Деякі похідні тетрагідрохіноліну були описані у заявці WO 2003/004028 як модулятори FSH з агоністичними або антагоністичними властивостями. Залишається потреба у низькомолекулярних гормономіметиках, здатних селективно активувати рецептор FSH. Винахід стосується похідних 2-метил-4-феніл5-оксо-1,4,5,6,7,8-гексагідрохіноліну загальної формули І де R1 - (1-6С)алкіл, (2-6С)алкеніл або (26С)алкініл; R2 - галоген; R3 - SO2NR5R6 або (1-4С)алкокси, як варіант, заміщений одним або більше атомами флуору; X - О або NR7; R4 - R8-(2-8C)алкіл, R8-(3-8C)алкеніл, R8-(38C)алкініл або R8-(2-4C)алкокси(2-4C)-алкіл; Z - CN або NO2; R5 і R6 є незалежно Н або (1-4C)алкілом; або 5 R разом з R6 і Ν, до якого вони приєднані, утворюють 3-8-членне насичене кільце, як варіант, з додатковими гетероатомами, вибраними з О і S; R8 - ОН, (1-4С)алкокси, NH2; NR9C(O)R11, 9 NR SO2R11 або C(O)NR9R10; R7 і R9 є незалежно Н або (1-4С)алкілом; R10 - (1-4С)алкіл, (1-4С)алкокси(1-4С)алкіл або феніл(1-4С)алкіл, або (2-5С)гетероарил(14С)алкіл, як варіант, обидва заміщені на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з ОН, NH2, галогену, NO2, CF3, CN, (1-4С)-алкілу, (1-4С) і (ди)(1-4С)алкіламіно; 5 92009 6 R11 - (1-4С)алкіл, (2-4С)алкеніл, (2-4С)алкініл, група має 3-6 атомів карбону і є такою ж, що була (1-4С)алкокси(1-4С)алкіл, (3-6С)-циклоалкіл, (1визначена вище, а алкільна група з 1-4 атомами 4С)алкокси, (ди)(1-4С)алкіламіно або феніл або (2карбону є такою ж, що була визначена вище. 5С)гетероарил, обидва, як варіант, заміщені на Термін (2-5С)гетероарил означає заміщену (гетеро)ароматичному кільці одним або більше або незаміщену ароматичну групу з 2-5 атомами замісниками, вибраними з ОН, NH2, галогену, NO2, карбону і щонайменше з одним гетероатомом, CF3, CN, (1-4С)алкілу, (1-4С)алкокси і (ди)(1вибраним з Ν, Ο і S, наприклад, імідазоліл, тіадіа4С)алкіламіно; золіл, піридиніл, тієніл або фурил. Бажаними гетеабо її фармацевтично прийнятної солі. роарильними групами є тієніл, фурил і піридиніл. Похідні 2-метил-4-феніл-5-оксо-1,4,5,6,7,8(2-5С)гетероарильна група може бути приєднана гексагідрохіноліну згідно з винаходом є потужними через атом карбону або гетероатом. активаторами рецептора FSH і можуть бути викоТермін (2-5С)гетероарил(1-4С)алкіл означає ристані у тих же клінічних застосуваннях, як і пригетероарилалкільну групу, гетероарильна група родний FSH, оскільки вони діють як агоністи, але з якої має 2-5 атомів карбону і є подібною визначетією перевагою, що вони можуть бути приготовленій вище, а алкільна група має 1-4 атомів карбону і ні синтетично, можуть мати іншу стабільність і моподібна визначеній вище. (2-5С)гетероарильна жуть бути введені пацієнту іншим шляхом. група може бути заміщена на (гетеОтже, агоністи рецептора FSH згідно з винаро)ароматичному кільці одним або більше замісходом можуть бути застосовані у лікуванні розланиками, вибраними з ОН, NH2, галогену, NO2, CF3, дів плодючості, наприклад, для контрольованої CN, (1-4С)алкілу, (1-4С)алкокси і (ди)(1оваріальної гіперстимуляції і процедур IVF. 4С)алкіламіно. Термін (1-4С)алкіл означає розгалужену або Термін феніл(1-4С)алкіл означає фенільну нерозгалужену алкільну групу з 1-4 атомами каргрупу, приєднану до алкільної групи з 1-4 атомами бону, а саме, метил, етил, пропіл, ізопропіл, бутил, карбону, визначеної вище. Фенільна група може втор-бутил і трет-бутил. бути заміщена одним або більше замісниками, Термін (1-6С)алкіл означає розгалужену або вибраними з ОН, NH2, галогену, NO2, CF3, CN, (1нерозгалужену алкільну групу з 1-6 атомами кар4С)алкілу, (1-4С)алкокси і (ди)(1-4С)алкіламіно. бону, наприклад, метил, етил, пропіл, ізопропіл, Термін (ди)(1-4С)алкіламіно означає аміногрубутил, ізобутил, трет-бутил, n-пентил і n-гексил. пу, монозаміщену або дизаміщену алкільними груТермін (2-4С)алкіл означає розгалужену або пами, кожна з яких має 1-4 атомів карбону і є подінерозгалужену алкільну групу з 2-4 атомами карбною зазначеній вище. бону. У формулі І R5 разом з R6 і N, до якого вони Термін (2-8С)алкіл означає розгалужену або приєднані, можуть утворювати 3-8-членне кільце, нерозгалужену алкільну групу з 2-8 атомами каряк варіант, з додатковими гетероатомами, вибрабону. ними з О і S. Прикладами такого кільця є піроліТермін (3-8С)алкеніл означає розгалужену або дин-1-іл, піперидин-1-іл, азепін-1-іл, морфолін-4-іл нерозгалужену алкенільну групу з 3-8 атомами і тіоморфолін-4-іл. карбону, наприклад, 2-пропеніл, 2-бутеніл, 3Термін галоген означає флуор, хлор, бром або бутеніл, пентеніл, гексеніл і октеніл. йод; бажаними є хлор, бром або йод. Термін (2-6С)алкеніл означає розгалужену або Термін "фармацевтично прийнятна сіль" ознанерозгалужену алкенільну групу з 2-6 атомами чає солі, які з медичної точки зору є придатними карбону, наприклад, етеніл, n-пропеніл, 2-метил-2для застосування у контакті з тканинами людини і пропеніл, 2-бутеніл, 3-бутеніл, пентеніл і гексеніл. нижчих тварин без проявів токсичності, подразТермін (2-4С)алкеніл означає розгалужену або нень, алергічних реакцій тощо і мають прийнятне нерозгалужену алкенільну груп з 2-4 атомами карвідношення перевага/ризик. Фармацевтично прибону, наприклад, етеніл, 2-пропеніл, 2-метил-2йнятні солі є добре відомими. Вони можуть бути пропеніл, 2-бутеніл і 3-бутеніл. отримані під час кінцевої ізоляції і очищення споТермін (3-8С)алкініл означає розгалужену або луки винаходу або реакцією вільноосновної функнерозгалужену алкінільну групу з 3-8 атомами карції з придатною неорганічною кислотою, наприбону, наприклад, 2-пропініл, 2-бутиніл, 3-бутиніл, клад, гідрохлорною, фосфорною або пентиніл, гексиніл і октиніл. сульфуровою, або з органічною кислотою, наприТермін (2-6С)алкініл означає алкінільну групу з клад, аскорбіновою, лимонною, виннокам'яною, 2-6 атомами карбону, наприклад, ети-ніл, 2молочною, малеїновою, малоновою, фумаровою, пропініл, 2-бутиніл, 3-бутиніл, пентиніл і гексиніл. гліколевою, бурштиновою, пропіоновою, оцтовою, Термін (2-4С)алкініл означає алкінільну групу з метансульфоновою тощо. 2-4 атомами карбону, наприклад, етиініл, 2В одному з аспектів винахід стосується сполупропініл, 2-бутиніл і 3-бутиніл. ки формули І, в якій X=О. Термін (1-4С)алкокси означає алкоксигрупу з Винахід також стосується сполуки формули І, 1-4 атомами карбону, з алкільним компонентом, в якій R1 - (1-6С)алкіл. Зокрема, винахід стосуєть1 1 який був визначений вище. Бажаними є (1ся сполук, в яких R - (1-4С)алкіл. Бажано, коли R 2С)алкоксигрупи. - n-пропіл. Термін (3-6С)циклоалкіл означає циклоалкільІншим аспектом винаходу є сполуки формули ну групу з 3-6 атомами карбону, а саме, циклопроІ, в якій R є СІ, Br або І. піл, циклобутил, циклопентил і циклогексил. В іншому аспекті винахід стосується сполуки Термін (3-6С)циклоалкіл(1-4С)алкіл означає формули І, в якій Ζ є CN. циклоалкілалкільну групу, в якій цикло-алкільна 7 92009 8 Винахід також стосується сполуки загальної В іншому аспекті винахід стосується сполук формули І, в якій R3 є SO2NR5R6. формули І, де ЕК50 в аналізі на зв'язування станоУ ще одному аспекті винахід стосується сповить менше 10-6М (приклад 33). лук, в яких одне або більше конкретних визначень Далі розглядаються способи приготування погруп R1-R11, X і Ζ комбінуються з визначенням похідних 2-метил-4-феніл-5-оксо-1,4,5,6,7,8хідних 2-метил-4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну винаходу. гексагідрохіноліну формули І. Похідні 1,4,5,6,7,8-гексагідрохіноліну І винаходу можуть бути приготовлені реакцією циклогексан-1,3-діонів загальної формули II, енамінів загальної формули III і бензальдегідів загальної формули IV, в якій R1, R2, R3, R4, X і Ζ є такими, що були визначені вище (добре відома трикомпонентна реакція циклоконденсації типу Ганцша). Опис таких реакцій можна знайти у: Bioorg. Med. Chem. Lett. 12 (2002) 1481-1484, J. Chem. Soc, Perkin Trans. 1 (2002) 1141-1156, Synlett (2002) 89-92, Drug Dev. Res. 51 (2000) 233-243, J. Med. Chem. 42 (1999) 10 1422-1427, ibid. 52665271, ibid. 41 (1998) 2643-2650, WO 9408966, Arzneim.-Forsch./Drug Res. 45 (1995) 1054-1056, J. Med. Chem. 34 (1991) 2248-2260, ibid. 17 (1974) 956-65, Chem. Rev. 72 (1972), 1-42. Такі реакції звичайно проводять при підвищеній температурі у протонному розчиннику, наприклад, оцтовій кислоті, (ізо)пропанолі, етанолі, метанолі або їх сумішах. В іншому варіанті сполуки загальної формули I-а, в якій R1, R2, R3, R4 і Ζ є такими, що були визначені вище, а X=О, можна отримати стандартним О-алкілуванням сполуки загальної формули V-a. Звичайно цю реакцію проводять у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, ДМСО, етанолі, ТГФ, 1,4-діоксані або толуолі з відповідними заміщеними алкілгалогенідами формули VI (Hal=СІ, Br, І), у присутності основи, наприклад, тріетиламіну, N;Nдіізопропілетиламіну (DIPEA), карбонату калію, карбонату цезію або гідриду натрію, як варіант, у присутності каталітичної кількості йодиду калію або йодиду тетрабутиламонію, і отримують Оалкіловані похідні формули I-а. В іншому варіанті О-алкіловані сполуки загальної формули I-а можна отримати відомою реакцією Міцунобу з спиртами формули VII, трифенілфосфіном (як варіант, зв'язаним смолою) і діалкіл-азодикарбоксилатом (наприклад, діетил- азодикарбоксилатом) у належному розчиннику, наприклад, 1,4-діоксані, ТГФ або ДХМ при підвищеній або зовнішній температурі. Сполуки загальної формули Θ-b, в якій R1, R2, 3 R , R4 і Ζ є такими, що були визначені вище, а X=NR7, можуть бути отримані N-алкілуванням сполук загальної формули V-b сполуками загальної формули VI, як це було описано для перетворення сполуки V-a у I-а 9 В іншому варіанті сполуки загальної формули І-b можуть бути приготовлені відновлювальним амінуванням відповідних заміщених альдегідів формули VIII, в якій Е-А є заміщеною алкільною групою (наприклад, 3-етокси-пропіональдегідом, (2-метокси-етокси)-ацетальдегідом, 7гідроксипентаналом) з сполуками V-b і відповідним відновлювачем, наприклад, ціаноборогідридом натрію або триацетоксиборогідридом натрію або цинк/оцтовою кислотою. Відновлювальне амінування добре відоме фахівцям. Сполуки загальної формули V-b можуть бути перетворені у відповідні іміни формули V-c реакцією з альдегідами VIII добре відомими методами з подальшим відновленням, наприклад, борогідридом натрію, з отриманням сполук І-b. Крім того, похідні 1,4,5,6,7,8-гексагідрохіноліну І винаходу можуть бути приготовлені з відповідних функціоналізованих похідних 1,4,5,6,7,8гексагідрохіноліну загальної структури IX, в якій R1, R2, R3, X і Ζ є такими, що були визначені вище, a Y є заміщеним алкілом, алкенілом, алкінілом або алкоксиалкільною групою і FG є функціональною групою (наприклад, галогенідом, захищеним гідроксилом, захищеною аміно, азидо, ціано, карбоновою кислотою, естером тощо, яка може бути перетворена у групи R8. 92009 10 Наприклад, сполуки загальної формули I-c можуть бути отримані видаленням захисної групи з сполук загальної формули ІХ-а, в якій PG - придатна захисна група, наприклад, tбутилдиметилсиліл (TBDMS), тетрагідропіраніл (ТГП) або бензоат. Маніпуляції з захисними групами є добре відомими (див. Protective Groups in Organic Synthesis, T.W. Greene, P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999 . Сполуки загальної формули l-d, в якій R1, R2, 3 R , X і Ζ є такими, що були визначені вище, приготовляють з сполук загальної формули ΘΧ-b, де LG відщеплювана група, обробкою водним амонієм у відповідному розчиннику, наприклад, 1,4-діоксані, ацетонітрилі або ТГФ. В іншому варіанті сполуки загальної формули ΘΧ-b можуть бути оброблені азидом натрію у відповідному розчиннику, наприклад, Ν,Ν-ДМФ або ТГФ з отриманням сполук загальної формули ІХ-с, які можуть бути відновлені відомою реакцією Стодінджера, з використанням трифенілфосфіну (як варіант, зв'язаного смолою) у вологому ТГФ, як варіант, у присутності водної НСІ з отриманням сполук загальної формули l-d. 11 92009 12 В окремих випадках сполук IX-d, в яких LG - бромід в алільній позиції, реакція з азидом натрію і потім відновленням Стодінджера дає регіоізомерні продукти загальних формул I-е і l-f, відповідно. Сполуки загальних формул l-g і l-h, в яких R1, R2, R3, R11, X і Ζ є такими, що були визначені вище, можуть бути приготовлені стандартним Nацилування або Ν-сульфонілуванням сполук загальної формули IX-f, які синтезують з похідних ІХ-е і (1-4С)алкіламінів загальної формули H2N-Alk. Звичайно сполуки IX-f реагують у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, етанолі, ТГФ, 1,4-діоксані, толуолі, 1-метилпіролідин-2-оні або піридині з відповідним чином заміщеним ацилгалогенідом (наприклад, R11-C(O)-CI), кислотним ангідридом (R11C(O)-O-C(O)-R11) або сульфонілгалогенідом (наприклад, R11-SO2-CI) у присутності основи, наприклад, тріетиламіну, Ν,Ν-діізопропілетиламіну (DIPEA) або піридину, з отриманням N-ацилованих або N-сульфонілованих похідних формули l-g і l-h, відповідно. В іншому варіанті, N-ациловані сполуки загальної формули l-g можуть бути отримані реакцією похідних IX-f з карбоновими кислотами зага льної формули Rn-COOH у присутності сполучаючого реагента, наприклад, діізопропілкарбодііміду (DIC), (3-диметиламінопропіл)-етилкарбодііміду (EDCI), тетрафлуорборату О-(бензотріазол-1-іл)Ν,Ν,Ν',Ν'-тетраметилуронію (TBTU) або гексафлуорфосфату О-(7-азабензотріазол-1-іл)-Ν,Ν,Ν',Ν'тетраметилуронію (HATU) і третинної амінової основи (наприклад, DIPEA) у розчинник наприклад, Ν,Ν-ДМФ або ДХМ при зовнішній або підвищеній температурі. Похідні карбонової кислоти загальної формули IX-h, які можна отримати сапоніфікацією відповідних алкілових естерів ΘΧ-g, можуть бути конденсовані з амінами загальної структур R9R10NH з використанням сполучаючого реагента, як це було описано для приготування похідних l-g з сполук IXf, і з отриманням сполук формули I-і, в яких R1, R2, R3, R9, R10, X і Ζ є такими, що були визначені вище, а Υ є алкілом, алкенілом, алкінілом або алкоксиал 13 92009 14 кільною групою. В іншому варіанті сполуки загальтолуолі, дає відповідні кислотні хлориди ІХ-і. Поної формули IX-h можуть бути перетворені у віддальша реакція з амінами загальної структури повідні кислотні хлориди ІХ-і відомими методами. R9R10NH, як варіант, у присутності відповідної треОбробка карбонових кислот загальної формули IXтинної амінової основи дає сполуки загальної фоh тіонілхлоридом або оксалілхлоридом і ДМФ у рмули I-і. відповідному розчиннику, наприклад, ДХМ або Сполуки загальної формули l-d можуть бути Nациловані з отриманням сполук загальної форму ли l-j, в якій R1, R2, R3, R11, X і Ζ є такими, що були визначені вище. Ці ацилування можна здійснити згідно з процедурами синтезу описаними для приготування похідних l-g з сполук IX-f. Подібно до реакції N-сульфонілування похідних IX-f для отримання сполук І-h сполуки l-d можуть бути сульфоніловані для отримання сполук lk, в яких R1, R2, R3, R11, X і Ζ є такими, що були визначені вище. Сполуки загальної формули 1-1, в якій R1, R2, R , R4 і Ζ є такими, що були визначені вище, можуть бути відновлювально алкіловані простими альдегідами або кетонами (формальдегідом, ацетальдегідом, пропіопальдегідом, бутиральдегідом, ацетоном або бутан-2-оном) методом, описаним для приготування сполук Θ-b з V-b, з отриманням сполук загальної формули І-m, в яких R1, R2, R3, R4 і Ζ є такими, що були визначені вище. 3 Заміщені циклогексан-1,3-діони загальної формули II є у продажу або можуть бути приготовлені за відомими процедурами. Відповідні приклади 15 92009 16 можна знайти у: J. Med. Chem. 43 (2000) 4678них Х-b методом, описаним для перетворення 4693, Tetrahedron 56 (2000) 4753-4758, J. Med. сполук формули V-b у похідні І-b. Chem. 35 (1992) 3429-3447, ibid. 24 (1981) 10261034, Org. Synt. Coll. Vol. V (1973) 400, Chem. Ber. 88 (1955) 316-327, Justus Liebig Ann. Chem. 570 (1950) 15-31. Сполуки формули ІІІ-а є у продажу, а сполуки ΘΘΘ-b описано у літературі: DrugDev. Res. 51 (2000) 225-232. Бензальдегіди загальної формули IV-a, в якій R2, R3 і R4 є такими, що були визначені вище, а X=О можна приготувати з бензальдегідів загальної формули Х-а методом, описаним для перетворення сполук формули V-a у I-а. Сполуки загальної Похідні 1,4,5,6,7,8-гексагідрохіноліну загальної формули IV-b, в якій R2, R3 і R4 є такими, що були формули V можуть бути приготовлені згаданою визначені вище, а X=N-R7, приготовляють з похідвище реакцією Ганцша циклоконденсації між циклогександіонами II, енамінами III і альдегідами X. Сполуки загальної формули V-d-e, де R2 є Br, можуть бути також отримані ортобромінуванням фенолів або анілінів відомими методами. Так, сполуки формули V-f-g, синтезовані з сполук II і III і альдегідів XI реакцією циклоконденсації (Ганц ша) дають сполуки формули V-d-e після обробки бромом у відповідному розчиннику, наприклад, оцтовій кислоті, етанолі або ДХМ або їх сумішах, як варіант у присутності ацетату натрію. В іншому варіанті, N-бромсукцинімід у Ν,ΝДМФ або ацетонітрилі може бути використаний для здійснення цього перетворення (див., напри клад, J. Chem. Soc. Perkin Trans,2 6 (2000) 11131118, J. Org. Chem. 44 (1979), 4733-4735). Крім того, сполуки загальної формули V-j, в 3 якій R - аміносульфонільна група, а X=О, можуть бути отримані реакцією амінів загальної формули R5R6NH з сполуками загальної формули V-i, як варіант, у присутності третинної амінової основи, наприклад, тріетиламіну або DIPEA. Сполуки V-i отримують хлорсульфонілуванням сполук загаль ної формули V-h, наприклад, хлоросульфонілуванням фенолів (див. Tetrahedron 53 (1997) 41454158, Bioorg. Med. Chem. Lett. 13 (2003) 379-382. Сполуки загальної формули VI, VII і VIII є у продажу, описані у літературі або можуть бути приготовлені. 17 Похідні 1,4,5,6,7,8-гексагідрохіноліну загальної формули IX можуть бути приготовлені реакцією циклоконденсацїї (Ганцша) між циклогександіонами II, енамінами III і альдегідами XII. В іншому варіанті алкілування похідних загальної формули V реагентами XIII-XV (які описані у літературі, є у продажу або можуть бути легко приготовлені) також дає похідні методом, використаним для приготування сполук Θ-a-b з V-a-b, описаного вище. Бензальдегіди загальної формули X і XI є у продажу або можуть бути приготовлені за відомими з літератури процедурами: J. Chem. Soc, Perkin Trans. 2 (2000) 1119-1124, J. Chem. Soc, Chem. Commun. 4 (1993) 419-420, Synth. Commun. 20 (1990) 2659-2666, Chem. Pharm. Bull. 34 (1986) 121-129, Indian J. Chem. Sect. В 20 (1981) 10101013, Monatsh. Chem. 106 (1975) 1191-1201, DE 1070162, J. Org. Chem 23 (1958) 120, Tetrahedron Lett. 25 (1984), 2901-2904, J. Org. Chem. 25 15 (1960), 2053-2055, J. Chem. Soc, Perkin Trans. 2 (1992), 2235-2242. Бензальдегіди загальної формули X-c, в якій R2 - бромід, а X є Ν-Η, може бути отриманий бромінуванням сполук загальної формули XVI за процедурами, описаними для перетворення сполук загальної формули V-g у V-e. Сполуки загальної формули XVI можуть бути отримані відновленням нітрогрупи у сполуках за 92009 18 гальної формули XVII до відповідної аміногрупи. Звичайно сполуки XVII обробляють цинком і оцтовою кислотою у відповідному розчиннику, наприклад, ТГФ або діоксані при температурі між 0°С і температурою флегми. В іншому варіанті цей метод включає обробку залізом, SnCI2 або гідрогеном у присутності перехідного металу як каталізатора, наприклад, паладію або платини на вугіллі, з використанням відомих методів. Бензальдегіди загальної формули X-d, в якій R2, ідентична визначеній вище R3, є аміносульфонільною групою, а X є О, можуть бути отримані хлоросульфонілуванням сполук загальної формули ХІ-с і потім реакцією з амінами загальної формули R5R6NH за процедурами, описаними для синтезу сполук загальної формули V-j з V-h через Vi. Гідроксильна група сполук X-d може бути трифлована відомими методами для отримання сполук XVTfl, які можна піддати нуклеофільному ароматичному заміщенню амонієм і отримати бензальдегіди Х-е. Реакції ароматичного заміщення описані у: J. Med. Chem. 6 (1963) 272-275, Indian J. Chem. Sect. В 18 (1979), 88-90. Крім того, похідні X-d можуть бути перетворені у сполуки формули XIX, в якій PG є Η або, як варіант, захисною групою, наприклад, 4-нітробензилом або 2,5диметоксибензилом, з подальшим відомим переупорякуванням Смайлса з отриманням продуктів загальної формули Х-е після видалення захисту (якщо потрібно). Такі реакції переупорякування описано, наприклад, у J. Org. Chem. 48 (1983) 5140-5143, Tetrahedron Lett. 30 (1989) 931-934, Tetrahedron 53 (1997) 11919-11928, Synth. Commun. 33 (2003) 2725-2736. 19 Бензальдегіди загальної формули XII приготовляють з описаних вище альдегідів формули X алкілуванням сполуками загальної формули XIII або XIV, подібно до приготування альдегідів IV-a-b з Χ-a-b. В іншому варіанті, бензальдегіди формули XII, в якій X=NH, можуть бути приготовлені методами, описаними для перетворення похідних X-d у Х-е, з використанням належним чином заміщених амінів загальної формули H2N-Y-FG у реакції: Сполуки винаходу мають щонайменше два хіральні атоми карбону і можуть існувати як чисті енантіомери або як суміш енантіомерів, або як суміш діастереомерів. Методи отримання чистих енантіомерів добре відомі, наприклад, кристалізацією солей, отриманих з оптично активних кислот і рацемічних сумішей або хроматографією на хіральних колонках. Для розділення діастереомерів можна використати прямо- або зворотнофазні колонки. Сполуки винаходу можуть утворювати гідрати або сольвати. Відомо, що заряджені сполуки утворюють гідратовані версії при ліофілізації водою або утворюють сольватовані версії при концентруванні у розчині з належним органічним розчинником. Сполуки винаходу включають гідрати або сольвати зазначених сполук. Похідні 2-метил-4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну згідно з винаходом знаходять в агоністах рецептора FSH. Добре відомими є методи аналізів in vitro і in vivo для визначення зв'язування рецептора і визначення біологічної активності гонадотропінів. Взагалі експресований рецептор контактує з тестовою сполукою, і після цього виміряють зв'язування або стимуляцію, або пригнічення функціональної реакції. Для вимірювання функціональної реакції ізольовану ДНК, що кодує рецептор FSH, бажано, людського, експресують у придатних клітинах. Такими клітинами можуть бути клітини яєчника китайського хом'яка, хоча придатними можуть бути і інші клітини. Бажаними є клітини ссавців (Jia et al., MoLEndocrin., 5:759-776,1991). Методи конструювання рекомбінантних ліній клітин, що експресують FSH є добре відомими (Sambrook et al., Molecular Cloning: a Laboratory Manual., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, latest edition). Експресування рецептора здійснюють екс-пресуванням ДНК, що кодує бажаний протеїн. Методи спрямованого на сайт мутагенезу, лігування додаткових послідовностей, PCR і конструювання придатних систем експресії є добре відомими. Частина ДНК або повна ДНК, що кодує бажаний протеїн, може бути конструйована синтетично стандартними твердофазними методами, бажано з включенням рестрикційних сайтів 92009 20 для полегшення лігування. У кодуючі послідовності ДНК можуть бути введені контрольні елементи для транскрипції і трансляції включених кодуючих послідовностей. Сучасні системи експресії є сумісними з різноманітними хазяями, включаючи прокаріоти, наприклад, бактерії, і еукаріоти, наприклад, дріжджі, клітини рослин, клітини комах, клітини ссавців і плазунів тощо. Потім клітини, що експресують рецептор, вводять у контакт з тестовою сполукою для спостереження зв'язування або стимуляції, або пригнічення функціональної реакції. В іншому варіанті ізольовані мембрани клітин, які містіть експресований рецептор, можуть бути використані для вимірювання зв'язування сполуки. Для вимірювання зв'язування можуть бути використані радіоактивні або флюоресцентні сполуки. Як еталон може бути використаний людський рекомбінантний FSH. Можуть бути виконані порівняльні аналізи на зв'язування. Інший аналіз включає скринінг сполук-агоністів рецептора FSH через визначення стимуляції рецептора, опосередкованої сАМР. Такий метод включає експресування рецептора на поверхні хазяйської клітини і дію на клітину тестовою сполукою, після чого виміряють кількість сАМР. Рівень сАМР підвищиться стимулюючою дією тестової сполуки на зв'язування рецептора. На додаток до прямого вимірювання, наприклад, рівнів сАМР у цих клітинах можуть бути використані лінії клітин, які на додаток до трансфекції ДНК, що кодує рецептор, трансфектують також другою ДНК, що кодує ген репортера, експресія якого реагує на рівень сАМР. Такі репортерні гени можуть бути адаптованими до сАМР або можуть бути конструйовані таким чином, щоб приєднуватись до нових елементів реакції сАМР. Взагалі експресію репортерного гену можна контролювати будь-яким елементом реакції, який реагує на зміну рівнів сАМР. Придатними репортерними генами є, наприклад, LacZ, лужна фосфатаза, люцифераза світлячка і протеїн зеленої флюоресценції. Принципи такого трансактиваційного аналізу є добре відомими (див., наприклад, Stratowa, C, Himmler, Α., Czernilofsky, Α., (1995) Curr. Opin. Biotechnol. 6:574. Винахід також стосується фармацевтичних композицій, що містять похідну 2-метил-4-феніл-5оксо-1,4,5,6,7,8-гексагідрохіноліну або її фармацевтично прийнятні солі загальної формули І у суміші з фармацевтично прийнятними допоміжними речовинами і, як варіант, з іншими терапевтичними агентами. Допоміжні речовини мають бути "прийнятними", тобто сумісними з іншими інгредієнтами композиції і не шкідливими для реципієнта. Композиції можуть бути придатними для перорального, під'язичного, підшкірного, внутрішньовенного, внутрішньом'язового, носового, локального або ректального введення у формі одиничних доз. Для перорального введення активний інгредієнт може бути у вигляді дискретних одиниць, наприклад, таблеток, капсул, порошків, гранул, розчинів, суспензій тощо. 21 92009 22 Для парентерального введення, фармацевтиго лікування, можна вводити відповідні кількості чна композиція винаходу може мати форму односполук згідно з винаходом. дозових або багатодозових контейнерів, наприІнший аспект винаходу полягає у використанні клад, рідин для ін'єкції у заздалегідь визначеній похідної 2-метил-4-феніл-5-оксо-1,4,5,6,7,8кількості у герметичних флаконах або ампулах і гексагідрохіноліну загальної формули І у виготовможуть також зберігатись у висушеному замороленні медикаменту для лікування безплідності. жуванням стані (ліофілізованими) і потребувати Винахід ілюструється наведеними далі приклише додання стерильного водного носія, наприладами. клад, води, перед використанням. Загальні умови: У суміші з фармацевтично прийнятними допоАбревіатури: міжними речовинами, наприклад, описаними у ДМА = Ν,Ν-диметиланілін, стандартному довіднику (Gennaro, A.R. et al., ДІПЕА= Ν,Ν-діізопропілетиламін, Remington: Science і Practice of Pharmacy (20th ТФК = трифлуороцтова кислота, Edition, Lippincott Williams & Wilkins, 2000, Part 5: HATU = гексафлуорфосфату O-(7Farmaceutical Manufacturing) активний агент може азабензотрiазол-1-iл)-N,N,N',N'-тетраметилуронію бути спресований у тверді дозовані одиниці, наДМФ = Ν,Ν-диметилформамід, приклад, пігулки, таблетки або виготовлені у формі ТГФ = тетрагідрофуран, капсул або супозиторіїв. З фармацевтично прийнEtOAc = етилацетат. ятними рідинами активний агент може мати форму Якщо не зазначено інше, всі кінцеві продукти рідкої композиції, наприклад, препаратів для ін'єкнаведених нижче прикладів ліофілізують з суміції, зокрема, розчинів, суспензій, емульсій або аешей вода/1,4-діоксан, вода/трет-бутанол або ворозолю, наприклад, носового. да/ацетонітрил. Якщо сполуку отримують як сіль Для виготовлення твердих дозованих одиниць ТФК, ТФК додають у належній кількості до розчинвикористовують звичайні добавки, наприклад, наника перед ліофілізацією. повнювачі, барвники, полімерні зв'язуючі тощо. Назви кінцевих продуктів у прикладах сфорВзагалі може бути використана будь-яка фармамовані за допомогою програми Beilstein Autonom цевтично прийнятна добавка, яка не порушує фун(ver. 2,02,304). кцій активних сполук. Відповідні носії, з якими моДля визначення часів утримання використожна вводити активний агент винаходу у твердій вують такі аналітичні методи ЖХВР: композиції, включають лактозу, крохмаль, похідні Метод 1: Колонка: 5 мкм Luna C-18(2) 150x4,6 целюлози тощо або їх суміші у належній кількості. мм; потік 1 мл/хвил.; виявлення: 210 нм; темпераДля парентерального введення можуть бути викотура колонки 40°С; розчинник A: CH3CN/H2O=1/9 ристані водні суспензії, ізотонічні сольові розчини і (об'єм/об'єм); розчинник В: CH3CN; розчинник С: стерильні ін'єкційні розчини, які містять фармацев0,1 Μ водна трифлуороцтова кислота; градієнт: тично прийнятні диспергенти і/або зволожувачі, розчинники А/В/С=75/20/5 до 15/80/5 наприклад, пропіленгліколь або бутиленгліколь. (об'єм/об'єм/об'єм) за 30,00 хвил, потім константа Винахід включає описану вище фармацевтичпротягом ще 10,00 хвил. при А/В/С=15/80/5 ну композицію у комбінації з пакувальним матеріа(об'єм/об'єм/об'єм). лом, відповідним зазначеній композиції, разом з Метод 2: Ідентичний до методу 1, але з іншим інструкціями з використання композиції згідно з градієнтом: розчинники А/В/С=95/0/5 до 15/80/5 описаним вище. (об'єм/об'єм/об'єм) за 20,00 хвил., потім константа Точна доза і режим введення активного інгрепротягом ще 10,00 хвил. при А/В/С=15/80/5 дієнта або фармацевтичної композиції, що містить (об'єм/об'єм/об'єм). його, залежать від конкретної сполуки, способу Діастереомерне відношення (відношення діасвведення і віку і стану пацієнта, якому вводять тереомерів) визначають, якщо основна сепарація даний медикамент. окремих діастереомерів здійснюється належним Взагалі парентеральне введення потребує методом аналітичної ЖХВР. В іншому варіанті, менших доз, ніж інші способи введення, що більше діастереомерне відношення визначають аналізом 1 залежать від поглинання. Відповідні дози для люН ЯМР, ідентифікуючи відповідні діастереомери дини можуть становити 0,05-25 мг на кг маси тіла. згідно з окремими сигналами. Отримані діастереБажана доза може бути реалізована як єдина доза омерні відношення відповідають конфігураціям Сабо декілька субдоз, які вводять з належним інте4 і С-7 ядра 1,4,5,6,7,8-гексагідрохіноліну. рвалом протягом дня, або (у випадку реципієнтівОчищення препаративною ЖХВР: жінок) як дози які мають бути введені з денним Метод А: Колонка = Luna С-18. Градієнт: 0,1% інтервалом протягом менструального циклу. Дози і трифлуороцтова кислота у H2O/CH3CN (9/1, режим введення можуть бути різними для жінок і об'єм/об'єм)/СН3СМ=80/20 до 0/100 (об'єм/об'єм) чоловіків. за 30-45 хвил., залежно від легкості розділення. Отже, сполуки згідно з винаходом можуть бути Виявлення: 210 нм. використані у терапії. Метод В: Колонка = Luna С-18. Градієнт: Ще один аспект винаходу полягає у викорисH2O/CH3CN (9/1, об’єм/об’єм)/СН3СN=80/20 до танні похідної 2-метил-4-феніл-5-оксо-1,4,5,6,7,80/100 (об'єм/об'єм) за 30-45 хвил. Залежно від леггексагідрохіноліну загальної формули І у виготовкості розділення. Виявлення: 210 нм. ленні медикаменту для лікування розладів, що Приклад 1. {4-[2-бром-4-(3-ціано-2-метил-5викликаються порушеннями, опосередкованими оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6рецептором FSH, бажано, для лікування розладів етокси-фенокси]-бут-2-еніл}-амід фуран-2плодючості. Отже, пацієнтам, що потребують такокарбонової кислоти 23 92009 24 (а) 4-(3-бром-5-етокси-4-гідрокси-феніл)-2(діаст. 1) Rt=19,73 хвил. (діаст. 2) (метод 1). Відметил-5-оксо-7-пропіл-1,4,5,6,7,8ношення діастереомерів: 4:1 гексагідрохінолін-3-карбонітрил Приклад 2. N-{4-[2-бром-4-(3-ціано-2-метил-5Суміш 3-бром-5-етокси-4-гідроксиоксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6бензальдегіду (6 г), 3-амінокротонітрил (2,01 г) і 5етокси-фенокси]-бут-2-еніл}-ізобутирамід пропілциклогексан-1,3-діон (3,8 г) в етанолі (20 мл) Розчин продуктів прикладу 1d (200 мг), ДІПЕА перемішують при 80°С 4 год. Реакційну суміш кон(339 мкл) і ізобутирилхлорид (81 мкл) у ДХМ (4 мл) центрують in vacuo і залишок хроматографують на перемішують 17 год. Суміш розріджують ДХМ і силікагелі у гептан/EtOAc=1/1 (об'єм/об'єм) як промивають насич. водн. NaHCO3. Органічний шар елюент. Вихід: 6,3 г. MS-ESI: [Μ+H]+=445/447. сушать (MgSO4), фільтрують і концентрують in (b) 4-[3-бром-4-(4-бром-бут-2-етокси-5-етоксиvacuo. Залишок очищають препаративною ЖХВР феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8(Метод В). Вихід: 82 мг. MS-ESI: гексагідрохінолін-3-карбонітрил [М+Н]+=584,2/586,2; ЖХВР: Rt=19,41 хвил. (метод Суміш 4-(3-бром-5-етокси-4-гідрокси-феніл)-21). Відношення діастереомерів: 4:1 метил-5-оксо-7-пропіл-1,4,5,6,7,8Приклад 3. {4-[2-бром-4-(3-ціано-2-метил-5гексагідрохінолін-3-карбонітрилу (3,04 г), 1,4оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6дибромбутен (11,68 г) і карбонат калію (1,887 г) у етокси-фенокси]-бут-2-еніл}-амід циклопропанкардіоксані (100 мл) перемішують при 80°С 5 год. Субонової кислоти міш вливають у воду і екстрагують ДХМ. ОрганічНазвану сполуку отримують з суміші сполуки ний шар сушать (MgSO4), фільтрують і концентруприкладу 1d (88,8 мг), ДІПЕА (151 мкл) і циклопроють in vacuo. Залишок розчиняють в ацетонітрилі, панкарбонілхлориду (31 мкл) за процедурою прикпромивають петролейним етером і гептаном для ладу 2 і очищають препаративною ЖХВР (Метод видалення більшості надлишку дибромбутену. В). Регіоізомер (приклад 4) може бути ізольований. Ацетонітрильний шар концентрують in vacuo і заВихід: 39 мг. MS-ESI: [М+Н]+=582,2/584,2; ЖХВР: лишок рекристалізують з ДХМ і гептану. Вихід: Rt=18,75 хвил. (діаст. 1) Rt=18,99 хвил. (діаст. 2) 3,02 г. MS-ESI: [М+Н]+=579,2. (метод 1). Відношення діастереомерів: 4:1 (c) Суміш 4-[4-(4-азидо-бут-2-енілокси)-3-бромПриклад 4. {1-[2-бром-4-(3-ціано-2-метил-55-етокси-феніл]-2-метил-5-оксо-7-пропілоксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-61,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу і 4-[4етокси-феноксиметил]-аліл}-амід циклопропанкар(2-азидо-бут-3-енілокси)-3-бром-5-етокси-феніл]-2бонової кислоти метил-5-оксо-7-пропіл-1,4,5,6,7,8Див. приклад 3. Регіоізомер прикладу 3 також гексагідрохінолін-3-карбонітрилу ізолюють препаративною ЖХВР (Метод В). Вихід: + Суміш сполуки, отриманої у прикладі 1b (1,0 г) 18 мг. MS-ESI: [М+Н] =582,2/584,2; ЖХВР: і азид натрію (0,34 г) у ДМФ (50 мл) перемішують 2 Rt=20,05 хвил. (діаст. 1) Rt=20,37 хвил. (діаст. 2) год. Суміш вливають у воду, отриманий осад зби(метод 1). Відношення діастереомерів: 4:1 рають фільтруванням, промивають водою і сушать Приклад 5. N-{4-[2-бром-4-(3-ціано-2-метил-5in vacuo. Вихід: 914 мг, суміш 2 регіоізомерів. MSоксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6ESI: [М+Н]+=540,2/542,2. етокси-фенокси]-бут-2-еніл}-2-метокси-ацетамід (d) Суміш 4-[4-(4-аміно-бут-2-енілокси)-3-бромНазвану сполуку отримують з суміші сполук, 5-етокси-феніл]-2-метил-5-оксо-7-пропілописаної у прикладі 1d (88,8 мг), ДІПЕА (151 мкл) і 1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу і 4-[4метоксиацетилхлориду (31 мкл) за процедурою (2-аміно-бут-3-енілокси)-3-бром-5-етокси-феніл]-2прикладу 2 і очищають препаративною ЖХВР (Меметил-5-оксо-7-пропіл-1,4,5,6,7,8тод В). Вихід: 44,7 мг. MS-ESI: [M+H]+=586,4/588,4; гексагідрохінолін-3-карбонітрилу ЖХВР: Rt=17,26 хвил. (діаст. 1) Rt=17,56 хвил. (діДо розчину сирої суміші регіоізомерних сполук, аст. 2) (метод 1). Відношення діастереомерів: 4:1 отриманих у приклад 1с (0,914 г) у ТГФ/ДХМ (2/1 Приклад 6. Етиловий естер {4-[2-бром-4-(3(об'єм/об'єм), 18 мл) додають воду (2 мл) і зв'язаціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8ний смолою трифенілфосфін (1,13 г, 3,0 ммоль/г). гексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2Суміш перемішують при 40°С 8 год. Смолу відфіеніл}-карбамової кислоти льтровують і промивають ДХМ і метанолом. Об'єНазвану сполуку отримують з суміші сполук, днані органічні шар концентрують in vacuo. Вихід: описаної у прикладі 1d (88,8 мг), ДІПЕА (151 мкл) і 0,8 г, суміш 2 регіоізомерів. MS-ESI: етилхлорформату (33 мкл) за процедурою описа[M+H]+=514,2/516,2. ною у прикладі 2 і очищають препаративною (e) {4-[2-бром-4-(3-ціано-2-метил-5-оксо-7ЖХВР (Метод В), регіоізомер (приклад 7) також пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6-етоксиможе бути ізольований. Вихід: 45,4 мг. MS-ESI: фенокси]-бут-2-еніл}-амід фуран-2-карбонової ки[М+Н]+=586,2/588,2. ЖХВР: Rt=21,21 хвил. (діаст. слоти 1) Rt=21,52 хвил. (діаст. 2) (метод 1). Відношення Розчин продуктів отриманих у прикладі 1d діастереомерів: 4:1 (88,8 мг), ДІПЕА (151 мкл) і 2-фуроїлхлорид (34 Приклад 7. Етиловий естер {1-[2-бром-4-(3мкл) у ДХМ (4 мл) перемішують 17 год. Суміш розціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8ріджують ДХМ і промивають насич. водн. NaHCO3, гексагідрохінолін-4-іл)-6-етокси-феноксиметил]органічний шар сушать (MgSO4), фільтрують і коналіл}-карбамової кислоти центрують in vacuo. Залишок очищають препараДив. приклад 6. Регіоізомер прикладу 6 ізолютивною ЖХВР (Метод В). Вихід: 46,4 мг. MS MSють препаративною ЖХВР (Метод В). Вихід: 20 мг. ESI: [М+Н]+=608,2/610,2; ЖХВР: Rt=19,45 хвил. MS-ESI: [Μ+H]+=586,2/588,2; ЖХВР: Rt=22,96 хвил. 25 92009 26 (діаст. 1) Rt=23,33 хвил. (діаст. 2) (метод 1). Від[M+H]+=586,4/588,4; ЖХВР: Rt=16,39 хвил. (метод ношення діастереомерів: 4:1 1). Відношення діастереомерів: 5:1. Приклад 8. N-{1-[-бром-4-(3-ціано-2-метил-5Приклад 11. Ізопропіл-метил-амід 4-[2-бром-4оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8етокси-феноксиметил]-аліл}-бензамід гексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2Названу сполук отримують з суміші сполуки, енової кислоти описаної у прикладі 1d (88,8 мг), ДІПЕА (151 мкл) і Названу сполуку отримують з сполуки, описабензоїлхлориду (40 мкл) за процедурою прикладу ної у прикладі 10b (100 мг), ДІПЕА (165 мкл), HATU 2 і очищають препаративною ЖХВР (Метод В). (108 мг) і ізопропіл-метил-аміну (29 мкл) за процеВихід: 14,5 мг. MS-ESI: [М+Н]+=618,4/620,4; ЖХВР: дурою описаною у прикладі 10с. Вихід: 65 мг. MSRt=22,97 хвил. (діаст. 1) Rt=23,27 хвил. 5 (діаст. 2) ESI: [М+Н]+=584,4/586,4; ЖХВР: Rt=19,27 хвил. (метод 1). Відношення діастереомерів: 3:1 (діаст. 1) Rt=19,54 хвил. (діаст. 2) (метод 1). ВідПриклад 9. N-{1-[2-бром-4-(3-ціано-2-метил-5ношення діастереомерів: 5:1. оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6Приклад 12. (піридин-2-ілметил)-амід 4-[2етокси-феноксиметил]-аліл}-ацетамід бром-4-(3-ціано-2-метил-5-оксо-7-пропілНазвану сполуку отримують з суміші сполуки, 1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксиописаної у прикладі 1d (88,8 10 мг), ДІПЕА (151 фенокси]-бут-2-енової кислоти мкл) і ацетилхлориду (24 мкл) за процедурою приНазвану сполуку отримують з сполуки, описакладу 2 і очищають препаративною ЖХВР (Метод ної у прикладі 10b (100 мг), ДІПЕА (165 мкл), HATU В). Вихід: 16,7 мг. MS-ESI: [М+Н]+=556,2/568,2; (108 мг) і 2-піколіламіну (29 мкл) за процедурою ЖХВР: Rt=17,13 хвил. (діаст. 1) Rt=17,44 хвил. (діприкладу 10с. Залишок очищають препаративною аст. 2) (метод 1). Відношення діастереомерів: 3:1 ЖХВР (Метод А). Вихід: 63 мг (сіль ТФК). MS-ESI: Приклад 10. (2-метокси-етил)-амід 4-[2-бром[М+Н]+=619,4/621,4; ЖХВР: Rt=25 9,92 хвил. (ме4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8тод 1). Відношення діастереомерів: 5:1. гексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2Приклад 13. N-{4-[2-бром-4-(3-ціано-2-метил-5енової кислоти оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(а) Метиловий естер 4-[-бром-4-('3-ціано-2етокси-фенокси]-бутил}-ізобутирамід метил-5-оксо-7-пропіл-1,4,5,6,7,8(а) 4-[3-бром-4-(4-бром-бутокси)-5-етоксигексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8енової кислоти гексагідрохінолін-3-карбонітрил Суміш сполук, описану у прикладі 1а (1,48 г), Суміш сполук, описану у прикладі 1а (2,23 г), карбонат калію (0,919 г) і метил 4-бромкротонат 1,4-дибромбутан (8,65 г) і карбонат калію (3 г) у (4,759 г) у діоксані (60 мл) перемішують при 80°С в ДМФ (25 мл) перемішують при 60°С 2 год. Суміш атмосфері нітрогену протягом 17 год. Суміш розріохолоджують до кімнатної температури і промиджують ДХМ і промивають водою. Органічний шар вають гептаном для видалення надлишку дибромсушать (MgSO4), фільтрують і концентрують in бутану. Шар ДМФ розріджують водою і отриману vacuo. Залишок хроматографують на силікагелі з суміш екстрагують EtOAc. Органічний шар сушать гептан/EtOAc (від 1/0 до 0/1) як елюентом. Вихід: (MgSO4), фільтрують і концентрують in vacuo. За1,2 г. MS-ESI: [M+H]+=543,2/545,2. лишок хроматографують на силікагелі з геп(b) 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7тан/EtOAc (від 4/1 до 1/2) як елюентом. Вихід: 2,23 пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксиг. MS-ESI: [M+H]+=581,1. фенокси]-бут-2-енова кислота (b) 4-[4-(4-аміно-бутокси)-3-бром-5-етоксиРозчин метилового естеру 4-[2-бром-4-(3феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил гексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2До розчину продукту операції (а) (2 г) у діоксаенової кислоти (1,2 г) у діоксані (100 мл) і 2N гідроні (60 мл) додають конц. водн. NH4OH (40 мл). Суксид натрію (2,2 мл) перемішують 5 днів. Суміш міш перемішують в автоклаві при 80°С протягом вливають у воду і рН доводять до 2 доданням 4N 17 год. і концентрують in vacuo. Вихід: 2,21 г, сіль водної НСІ. Отриману суміш екстрагують EtOAc. HBr. MS-ESI: [M+H]+=516,4/518,4. Органічний шар сушать (MgSO4), фільтрують і (с) N-{4-[2-бром-4-(3-ціано-2-метил-5-оксо-7концентрують in vacuo. Вихід: 1,5 г. MS-ESI: пропіл-1,4,5,6,7,8-гекгагідрохінолін-4-іл)-6-етокси[M+H]+=529,2/531,2. фенокси]-бутил}-ізобутирамід (с) (2-метокси-етил)-амід 4-[2-бром-4-(3-ціаноСуміш продуктів операції (b) (117 мг), тріети2-метил-5-оксо-7-пропіл-1,4,5,6,7,8ламін (81 мкл) і ізобутирилхлорид (24 мкл) у ДХМ гексагідрохінолін-4-іл)-6-етокси-фенокси]-бут-2(3 мл) перемішують 17 год. Суміш розріджують енової кислоти ДХМ і промивають 0.5N водн. НСІ. Органічний шар Суміш 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7сушать (MgSO4), фільтрують і концентрують in пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксиvacuo. Залишок хроматографують на силікагелі з фенокси]-бут-2-енову кислоту (0,1 г), HATU (0,108 гептан/EtOAc (від 1/0 до 0/1) як елюентом. Вихід: + г), ДІПЕА 5 (165 мкл) i 2-метоксиетиламін (25 мкл) 69 мг. MS-ESI: [M+H] =610,4/612,4; ЖХВР: у ДХМ перемішують 2 год. Реакційну суміш розріRt=19,45 хвил. (метод 1). Відношення діастереоджують водою і екстрагують EtOAc. Органічний мерів: 5:1. шар сушать (MgSO4), фільтрують і концентрують in Приклад 14. {4-[2-бром-4-(3-ціано-2-метил-5vacuo. Залишок очищають препаративною ЖХВР оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(Метод В). Вихід: 65,5 мг. MS-ESI: етокси-фенокси]-бутил}-амід етансульфонової кислоти 27 92009 28 Названу сполук отримують з сполуки, описаної Приклад 17. N-{5-[2-бром-4-(3-ціано-2-метил-5у прикладі 13b (150 мг), тріетиламіну (104 мкл) і оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етанесульфонілхлориду (28 мкл) за процедурою етокси-фенокси]-пентил}-2-метокси-ацетамід прикладу 13с. Вихід: 99 мг. MS-ESI: Названу сполуку отримують з сполуки описа[М+Н]+=608,2/610,2; ЖХВР: Rt=19,32 хвил. (діаст. ної у прикладі 16b (147,5 мг), тріетиламіну (108 1) Rt=19,57 хвил. (діаст. 2) (метод 1). Відношення мкл) і метоксиацетилхлориду (28 мкл) за процедудіастереомерів: 4:1. рою прикладу 15с. Вихід: 88,5 мг. MS-ESI: Приклад 15. {3-[2-бром-4-(3-ціано-2-метил-5[М+Н]+=602,4/604,4; ЖХВР: Rt=18,87 хвил. (діаст. оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-61) Rt=19,20 хвил. (діаст. 2) (метод 1). Відношення етокси-фенокси]-пропіл}-амід циклопропан карбодіастереомерів: 5:1. нової кислоти Приклад 18. {4-[2-бром-4-(3-ціано-2-метил-5(а) 4-[3-бром-4-(3-бром-пропокси)-5-етоксиоксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8етокси-фенокси]-бутил}-амід фуран-2-карбонової гексагідрохінолін-3-карбонітрил кислоти Названу сполуку отримують з сполуки, описаНазвану сполуку отримують з сполуки, описаної у прикладі 1а (2 г), 1,3-дибромпропану (3,67 ної у прикладі 13b (117 мг), тріетиламін (81 мкл) і мл) і карбонату калію (2,49 г) за процедурою прик2-фуроїлхлориду (23 мкл) за процедурою приклаладу 13а. Вихід: 2,47 г. MS-ESI: [М+Н]+=567,2. ду 13с. Вихід: 85,7 мг. MS-ESI: [М+Н]+=610,4/612,4; (b) 4-[4-(3-аміно-пропокси)-3-бром-5-етоксиЖХВР: Rt=19,66 хвил. (метод 1). Відношення діасфеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8тереомерів: 5:1. гексагідрохінолін-3-карбонітрил Приклад 19. N-{2-[2-бром-4-(3-ціано-2-метил-5Названу сполуку отримують з продукту операоксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6ції (2,37 г) і конц. водн. NH4OH (40 мл) за процедуетокси-фенокси]-етил}-метансульфонамід рою прикладу 13b. Вихід: 2,45 г 5 (сіль HBr). MS(а) 4-[3-бром-5-етокси-4-(2-гідрокси-етокси)ESI: [M+H]+=502,3/504,3. феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8(с) {3-[2-бром-4-(3-ціано-2-метил-5-оксо-7гексагідро-хінолін-3-карбонітрил пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксиСуміш сполук, описану у прикладі 1а (4 г), карфенокси]-пропіл}-амід циклопропанкарбонової бонат калію (3,73 г) і 2-брометанол (1,274 мл) у кислоти ДМФ (30 мл) перемішують при 60°С 3 год. РеакСуміш продуктів операції (b) (165 мг), тріетиційну суміш розріджують водою і екстрагують двічі ламіну (118 мкл) і циклопропанкарбонілхлориду EtOAc. Об'єднані органічні шари сушать (MgSO4), (31 мкл) у ДХМ (2 мл) перемішують 17 год. Реакфільтрують і концентрують in vacuo. Залишок хроційну суміш розріджують EtOAc і промивають 0,5N матографують на силікагелі з гептан/EtOAc (від 1/1 водн. НСІ. Органічний шар сушать (MgSO4), фільдо 0/1) як елюентом. Вихід: 3,1 г. MS-ESI: трують і концентрують in vacuo. Залишок хромато[M+H]+=489,4/491,4. графують на силікагелі з гептан/EtOAc (від 3/1 до (b) 2-[2-бром-4-(3-ціано-2-метил-5-оксо-70/1) як елюентом. Вихід: 111,2 мг. MS-ESI: пропіл-1,4,5,6,7,8-гексагідро-хінолін~4-іл)-6-етокси[М+Н]+=570,4/572,4; ЖХВР: Rt=18,23 хвил. (метод фенокси]-етиловий естер метансульфонової кис1). Відношення діастереомерів: 5:1. лоти Приклад 16. N-{5-[2-бром-4-(3-ціано-2-метил-5Суміш продуктів операції (2,9 г), тріетиламіну оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(2,46 мл) і метансульфонілхлориду (550 мкл) у етокси-фенокси]-пентил}-ацетамід ДХМ (50 мл) перемішують 17 год. Суміш екстрагу(а) 4-[3-бром-4-(5-хлорпентилокси)-5-етоксиють 0,5N водн. НСІ. Органічний шар сушать феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8(MgSO4), фільтрують і концентрують in vacuo. Загексагідро-хінолін-3-карбонітрил лишок хроматографують на силікагелі з Названу сполуку отримують з сполуки описаДХМ/метанол (від1/0 до 95/5) як елюентом. Вихід: ної у прикладі 1а (2 г), 1,5-дихлорпентану (4,76 мл) 3,38 г. MS-ESI: [M+H]+=567,2/569,2. і карбонату калію (2,49 г) за процедурою прикладу (с) 4-[4-(2-аміно-етокси)-3-бром-5-етокси13а. Вихід: 2,1 г. MS-ESI: [М+Н]+=549,2/551,2. феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8(b) 4-[4-(5-аміно-пентилокси)-3-бром-5-етоксигексаксагідрохінолін-3-карбонітрил феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8Суміш продуктів операції (b) (3,38 г) і конц. гексагідрохінолін-3-карбонітрил водн. NH4OH (60 мл) у діоксані (90 мл) перемішуНазвану сполуку отримують з продукту операють при 80°С в автоклаві протягом 17 год. Суміш ції (2,0 г) і конц. водн. NH4OH (40 мл) за процедуконцентрують in vacuo. Вихід: 3,82 г (сіль рою прикладу 13b. Вихід: 2,1 г (сіль НСІ). MS-ESI: MeSO3H). MS-ESI: [M+H]+=488,2/490,2. + [M+H] =530,3/532,3. (d) N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7(с) N-{5-[2-бром-4-(3-цiано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолн-4-іл)-6-етоксипропiл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифенокси]-етил}-метансульфонамід фенокси]-пентил}-ацетамід Суміш продуктів операції (с) (130,7 мг), тріетиНазвану сполуку отримують з продукту операламіну (93 мкл) і метансульфонілхлориду (21 мкл) ції (b) (147,5 мг), тріетиламіну (108 мкл) і ацетилху ДХМ (3 мл) перемішують 17 год. Суміш розрілориду (22 мкл) за процедурою прикладу 15с. Виджують ДХМ і промивають 0,5N водн. НСІ. Органіхід: 53,6 мг. MS-ESI: [М+Н]+=572,4/574,4; ЖХВР: чний шар сушать (MgSO4), фільтрують і концентRt=17,44 хвил. (діаст. 1) Rt=17,75 хвил. (діаст. 2) рують in vacuo. Залишок очищають (метод 1). Відношення діастереомерів: 5:1. препаративною ЖХВР (Метод В). Вихід: 57,1 мг. 29 92009 30 MS-ESI: [М+Н]+=566,0/568,0; ЖХВР: Rt=12,49 хвил. Названу сполуку отримують, як у прикладі 19d, (метод 1). Відношення діастереомерів: 4:1. з сирої сполуки (солі MeSO3H) описаної у прикладі Приклад 20. {6-[2-бром-4-(3-ціано-2-метил-521с (214 мг) і циклопропанкарбонілхлориду (37 оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6мкл) у присутності тріетиламіну (141 мкл). Залиетокси-фенокси]гексил}-амід пропан-2шок очищають препаративною ЖХВР (Метод В). + сульфонової кислоти Вихід: 165 мг. MS-ESI: [М+Н] =600,4/602,4; ЖХВР: (а) 4-[3-бром-4-(6-бром-гексил)-5-етоксиRt=22,40 хвил. (метод 2). Відношення діастереофеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8мерів: 8:1. гексагідрохінолін-3-карбонітрил Приклад 23. 3-бром-5-(3-ціано-2-метил-5-оксоНазвану сполуку отримують з сполуки описа7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-2-[2-(2ної у прикладі 1а (1 г), 1,6-дибромгексану (2,78 мл) гідрокси-етокси)-етокси]-N,N-диметилі карбонату калію (1,24 г) за процедурою прикладу бензолсульфонамід 13а. Вихід: 0,93 г. MS-ESI: [M+H]+=607,4/609,4. (а) 4-(3-бром-4-гідроксифеніл)-2-метил-5-оксо(b) 4-[4-(6-аміно-гексилокси)-3-бром-5-етокси7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8карбонітрил гексагідрохінолін-3-карбонітрил Реакцію 3-бром-4-гідрокси-бензальдегіду Названу сполуку отримують з продукту опера(13,07 г) з 3-амінокрототіерилом (5,34 г) і 5ції (0,93 г) і конц. водн. NH4OH (20 мл) за процедупропілциклогексан-1,3-діоном (10,02 г) проводять, рою прикладу 13b. Вихід: 1,08 г (сіль HBr). MS-ESI: яку прикладі 1а. Вихід: 20,25 г. MS-ESI: [M+H]+=544,4/546,4. [М+Н]+=401/403. (с) {6-[2-бром-4-(3-ціано-2-метил-5-оксо-7(b) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропілпропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етокси1,4,5,6,7,8-гексагідро-хінолін-4-іл)-2-гідроксифенокси]-гексил}-амід пропан-2-сульфонової кисбензолсульфонілхлорид лоти При -10°С в атмосфері нітрогену сполуку, опиНазвану сполуку отримують з сполуки описасану у прикладі 23а (20,25 г), додають порціями ної в операції (b) (134 мг), тріетиламіну (89 мкл) і протягом 1 год. до CISO3H (47 мл). Після переміізопропілсульфонілхлориду (29 мкл) за процедушування при -10°С протягом 1 год. реакційну сурою прикладу 13с. Вихід: 22,5 мг. MS-ESI: міш залишають нагрітись до кімнатної температу[М+Н]+=650,4/652,4; ЖХВР:Rt=20,20 хвил. (діаст. ри і перемішують ще 17 год. Реакційну суміш 1) Rt=20,55 хвил. (діаст. 2) (метод 1). Відношення вливають у подрібнений лід (800 мл) і екстрагують діастереомерів: 5:1. декілька разів EtOAc. Об'єднані органічні шари Приклад 21. 4-{4-[2-(2-аміно-етокси)-етокси]-3сушать (MgSO4), фільтрують і концентрують in бром-5-етокси-феніл)-2-метил-5-оксо-7-пропілvacuo. Залишок рекристалізують з EtOAc. Вихід: 1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил 23,7 г. MS-ESI: [M+H]+=499,0/501,0. (а) 4-{3-бром-5-етокси-4-[2-(2-гідрокси-етокси)(с) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропілетокси]-феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,81,4,5,6,7,8-гексагідрохінолін-4-іл)-2-гідркси-N,Nгексагідро-хінолін-3-карбонітрил диметил-бензолсульфонамід Алкілування сполуки, описаної у прикладі 1а (5 Диметиламін пропускають бульбашками через г) (2-хлороетокси)-етанолом (1,42 мл) проводять суспензію сполуки, описаної у прикладі 23b (4,1 г) методом, описаним у прикладі 10а. Залишок хроу діоксані (85 мл) протягом 30 хвил. Після переміматографують на силікагелі з гептан/EtOAc як шування протягом 17 год. реакційну суміш розріелюентом. Вихід: 3,03 г. MS-ESI: джують EtOAc і промивають водою. Під час екст[M+H]+=533,2/535,21. рагування названа сполука кристалізується у (b) Етиловий естер метансульфонової кислоти водному шарі і її отримують фільтруванням. Вихід: 2-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл2,19 г. MS-ESI: [М+Н]+=508,2/510,2. 1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етокси(d) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропілфенокси]-етокси} 1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-[2-(2-гідроксиНазвану сполуку отримують, як у прикладі 19b, етокси)-етокси]-N,N-диметил-бензолсульфонамід з сполуки описаної у прикладі 21а (3,0 г) і метанАлкілування сполуки, описаної у прикладі 23с сульфонілхлориду (522 мкл). Вихід: 2,98 г. MS-ESI: (740 мг), 2-(2-хлоретокси)-етанолом (185 мкл) про[М+Н]+=611,4/613,4. водять, як у прикладі 10а. Вихід: 35,6 мг. MS-ESI: (с) 4-{4-[2-(2-аміно-етокси)-етокси]-3-бром-5[Μ+H]+=596/598; ЖХВР: Rt=14,73хвил. (метод 1) етокси-феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8Приклад 24. 4-{3-бром-4-[2-(2-гідрокси-етокси)гексагідрохінолін-3-карбонітрил етокси]-5-ізопропокси-феніл}-2-метил-5-оксо-7Названу сполуку отримують, як у прикладі 19с, пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил з сполуки описаної у (b) (2,98 г). Вихід 3,0 г (сіль (а) 3-бром-5-гідрокси-4-(4-нітро-бензилокси)MeSO3H). Невелику кількість (214 мг) очищають бензальдегід препаративною ЖХВР (Метод А). Вихід: 221,7 мг Суміш 3-бром-4,5-дигідрокси-бензальдегід (2 (сіль ТФК). MS-ESI: [М+Н]+=532,2/534,2; ЖХВР: г), 4-нітробензилбромід (2 г), карбонат літію (680 Rt=15,39 хвил. (метод 2). Відношення діастереомг) і невелику кількість йодиду тетрабутиламонію мерів: 5:1. (прибл. 50 мг) у ДМФ (15 мл) перемішують при Приклад 22. (2-{2-[2-бром-4-(3-ціано-2-метил60°С протягом 4 год. Суміш розріджують EtOAc і 5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)промивають водою. Органічний шар сушать 6-етокси-фенокси]-етокси}-етиламід циклопропан(MgSO4), фільтрують і концентрують in vacuo. Викарбонової кислоти хід: 2,82 г. MS-ESI: [М+Н]+=352,0/354,0. 31 92009 32 (b) 3-бром-5-ізопропокси-4-(4-нітро(с) 4-(3-бром-5-етокси-4-гідрокси-феніл)-2бензилокси)-бензальдегід метил-3-нiтро-7-пропіл-4,6,7,8-тетрагідро-1НСуміш продуктів операції (2,82 г), ізопропілйохінолін-5-он дид (1,6 мл) і карбонат калію (2,21 г) у ДМФ (25 мл) Суміш 1-метил-2-нітро-вініламіну (1 г), 5перемішують при 60°С 4 год. Суміш розріджують пропілциклогексан-1,3-діону (1,61 20 г) і 3-бром-5EtOAc і промивають водою. Органічний шар суетокси-4-гідрокси-бензальдегіду (2,57 г) в етанолі шать (MgSO4), фільтрують і концентрують in (50 мл) перемішують під зворотним холодильниvacuo. Вихід: 1,66 г. MS-ESI: [М+Н]+=394,0/396,0. ком протягом 17 год. Реакційну суміш концентру(с) 4-[3-бром-5-ізопропокси-4-(4-нітроють in vacuo, залишок розчиняють у ДХМ. Осад бензилокси)-феніл]-2-метил-5-оксо-7-пропілзбирають фільтруванням. Тверду речовину хрома1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил тографують на силікагелі з гептан/EtOAc (від 1/0 Суміш продуктів операції b (1,06 г), 3до 0/1) як елюентом. Вихід: 2,8 г. MS-ESI: амінокротонітрил (221 мг) і 5-пропілциклогексан[М+Н]+=465,0/467,0 1,3-діон (415 мг) в етанолі (20 мл) перемішують (d) 4-{3-бром-5-етокси-4-[2-(2-гідрокси-етокси)при 80°С протягом 17 год. Реакційну суміш концеетоксил-феніл]-2-метил-3-нітро-7-пропіл-4,6,7,8нтрують in vacuo і залишок хроматографують на тетрагідро-1Н-хінолін-5-он силікагелі з гептан/EtOAc=1/1 (об'єм/об'єм) як Суміш продуктів (c) (120 мг), 2-(2-хлор-етокси)елюентом. Вихід: 750 мг. MS-ESI: етанол (39 мг) і карбонат калію (110 мг) у ДМФ (1 [M+H]+=594,4/596,4. мл) перемішують при 60° 17 год. Суміш розріджу(d) 4-(3-бром-4-гідрокси-5-ізопропокси-феніл)ють ДХМ і промивають 1N водн. НСІ. Органічний 2-метил-5-оксо-7-пропіл-1,4,5,6,7,8шар сушать (MgSO4), фільтрують і концентрують in гексагідрохінолін-3-карбонітрил vacuo. Залишок очищають препаративною ЖХВР До розчину продукту операції (c) (750 мг) і оц(Метод В). Вихід: 21,7 мг. MS-ESI: тової кислоти (1,5 мл) у ТГФ (50 мл) додають цин[М+Н]+=553,0/555,0; ЖХВР: Rt=16,12 хвил. (діаст. ковий пил (1,5 г) з енергійним перемішуванням. 1) Rt=16,46 хвил. (діаст. 2) (метод 1). Відношення Суміш перемішують 2 год. і потім фільтрують, роздіастереомерів: 4:1. ріджують EtOAc і промивають насич. водн. Приклад 26. 3-бром-5-(3-ціано-2-метил-5-оксоNaHCO3. Органічний шар сушать (MgSO4), фільт7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-iл)-2-(2рують і концентрують in vacuo. Вихід: 720 мг. MSгідрокси-етокси)-N,Ν-диметил-бензолсульфонамід ESI: [M+H]+=457,6/459,6. Суміш сполуки, описаної у прикладі 23с (203 (е) 4-{3-бром-4-[2-(2-гідрокси-етокси)-етокси]-5мг), 2-брометанолу (29,5 5 u,1), карбонату калію ізопропокси-феніл}-2-метил-5-оксо-7-пропіл(187 мг) і йодиду калію (8 мг) у ДМФ (10 мл) перес 1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил мішують при 60 С протягом17 год. Суміш розріСуміш сирої сполуки (d) (100 мг), 2-(2джують EtOAc і промивають водою. Органічний хлороетокси)етанолу (27 мкл), карбонату калію (90 шар сушать (MgSO4), фільтрують і концентрують in мг) і каталітичної кількості йодиду тетрабутиламоvacuo. Залишок очищають препаративною ЖХВР нію у ДМФ (3 мл) перемішують протягом 20 год. (Метод В). Вихід: 17 мг. MS-ESI: Суміш розріджують EtOAc і промивають водою. [М+Н]+=552,2/554,2; ЖХВР: Rt=14,56 хвил. (метод Органічний шар сушать (MgSO4), фільтрують і 1). концентрують in vacuo. Залишок хроматографують Приклад 27. 4-[3-бром-5-етокси-4-(2-гідроксина силікагелі з гептан/EtOAc (від 1/0 до 0/1) як етокси)-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8елюентом. Вихід: 29 мг. MS-ESI: [М+Н]+ гексагідрохінолін-3-карбонітрил 547,2/549,2; ЖXBP: Rt=18,25 хвил. (метод 1). ВідНазвану сполуку отримують з сполуки, описаношення діастереомерів: 3:1 ної у прикладі Іа (350 мг), 2-брометанолу (111 Приклад 25. 4-{3-бром-5-етокси-4-[2-(2мкл), карбонату калію (326 мг) і йодиду калію (8 15 гідрокси-етокси)-етокси]-феніл-2-метил-3-нітро-7мг) за процедурою прикладу 26. Вихід: 272,3 мг. пропіл-1,4,5,6,7,8-тетрагідро-1Н-хінолін-5-он MS-ESI: [М+Н]+=489,2/491,2; ЖХВР: Rt=21,15 хвил. (a) 1-нітропропан-2-он (метод 2). Відношення діастереомерів: 6:1. До охолодженого розчину нітрометану (1,73 Приклад 28. 4-[3-бром-5-етокси-4-(4-гідроксимл) у ТГФ (50 мл) додають гідрид натрію (1,28 г) і бут-2-енілокси)-феніл]-2-метил-5-оксо-7-пропілперемішують 20 хвил. Цю суміш додають до роз1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил чину ацетилімідазолу (2,72 г) у ТГФ (50 мл) і гріють До розчину сполуки, описаної у прикладі Іb під зворотним холодильником 17 год. Осад збира(150 мг) у діоксан (2,5 мл) і води (2,5 мл) додають ють фільтруванням, тверду речовину розчиняють карбонат кальцію (130 мг). Суміш перемішують в у воді і рН доводять до 3. Водний шар екстрагують атмосфері нітрогену при 100°С протягом 4 год., EtOAc тричі. Органічний шар сушать (MgSO4), фіпотім розріджують EtOAc і промивають 1N водн. льтрують і концентрують in vacuo. Вихід: 1,84 г. НСІ. Органічний шар сушать (MgSO4), фільтрують і (b) 1-метил-2-нітро-вініламін концентрують in vacuo. Залишок хроматографують Суміш 1-нітро-пропан-2-ону (1,6 г) і ацетату на силікагелі з гептан/EtOAc (від 1/0 до 0/1) як амонію (1,3 г) у толуол (25 мл) гріють під зворотелюентом. Вихід: 95 мг. MS-ESI: ним холодильником 17 год. Видаляють воду з реа[M+H]+=515,2/517,2; ЖХВР: Rt=16,19 хвил. (метод кційною суміш апаратом Дина-Старка. Реакційну 1). суміш концентрують in vacuo. Залишок хроматогПриклад 29. 3-бром-5-(3-ціано-2-метил-5-оксорафують на силікагелі з гептан/EtOAc (від 1/0 до 7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(20/1) як елюентом. Вихід: 1,07 г. метокси-етокси)-N,N-диметил-бензолсульфонамід 33 92009 34 Суміш сполуки, описаної у прикладі 23с (200 сиру сполуку, яку очищають кристалізацією з діемг), 2-брометил-метилового етеру (39 мкл), карботилетеру. Вихід: 243 мг. нату калію (109 мг) і йодиду калію (20 мг) у ДМФ (5 (е) 4-[3-бром-4-(2-метокси-етиламіно)-5мл) перемішують при 60°С протягом 17 год. Суміш (морфолін-4-сульфоніл)-феніл]-2-метил-5-оксо-7розріджують EtOAc і промивають водою. Органічпропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил ний шар сушать (MgSO4), фільтрують і концентруСуміш продукту операції (d) (61 мг), 3ють in vacuo. Залишок хроматографують на кремамінокротонітрилу (12,3 мг) і 5-пропілциклогексаннеземі з EtOAc як елюентом. Вихід: 46,8 мг. MS1,3-діону (23,1 мг) в етанолі (5 мл) перемішують ESI: [М+Н]+=566,0/568,0; ЖХВР: Rt=19,84 хвил. при 80°С протягом 17 год. Реакційну суміш конце(метод 1). нтрують in vacuo і залишок очищають препаративПриклад 30. 3-бром-5-(3-ціано-2-метил-5-оксоною ЖХВР (Метод В). Вихід: 57 мг. MS-ESI: 7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-[2-(2[М+Н]+=607,3/609,3; ЖХВР: Rt=16,51 хвил. (діаст. 1 метокси-етокси)-етокси]-N,N-диметил) Rt=16,83 хвил. (діаст. 2) (метод 1). Відношення бензолсульфонамід діастереомерів: 9:1. Суміш сполуки, описаної у прикладі 23с (202 Приклад 32. 4-[3-бром-4-(2-метоксимг), 2-(2-метоксиетокси)-етанолу (78 мкл), діетилаетиламіно)-5-(піролідин-1-сульфоніл)-феніл]-2зодикарбоксилату (75 мкл) і зв'язаного смолою метил-5-оксо-7-пропіл-1,4,5,6,7,8трифенілфосфіну (237 мг (1,69 ммоль/г) у ДХМ (3 гексагідрохінолін-3-карбонггрил мл) і ТГФ (0,75 мл) перемішують 17 год. Смолу (a) 3-бром-4-флуор-5-(піролідин-1-сульфоніл)відфільтровують і промивають метанолом. Об'єдбензойна кислота нані органічні шари сушать (MgSO4), фільтрують і До розчину 3-бром-5-хлорсульфоніл-4-флуорконцентрують in vacuo. Залишок очищають препабензойної кислоти (3,0 г) у діоксані/воді (9/1 ративною ЖХВР (Метод В). Вихід: 22,5 мг. MS-ESI: (об'єм/об'єм), 30 мл) додають ДІПЕА (5 мл) і піро[М+Н]+=610,2/612,2; ЖХВР: Rt=19,13 хвил. (метод лідин (1,55 мл). Після перемішування протягом 2 1). год. суміш розріджують EtOAc і промивають 2М Приклад 31. 4-[3-бром-4-(2-метоксиводн. НСІ. Органічний шар сушать (Na2SO4) і конетиламіно)-5-(морфолін-4-сульфоніл)-феніл1-2центрують in vacuo. Вихід: 2,3 г. метил-5-оксо-7-пропіл-1,4,5,6,7,8(b) 3-бром-4-(2-метокси-етиламіно)-5гексагідрохінолін-3-карбонітрил (піролідин-1-сульфоніл)-бензойна кислота (а) 3-бром-5-хлорсульфоніл-4-флуор-бензойна Розчин 3-бром-4-флуор-5-(піролідин-1кислота сульфоніл)-бензойної кислоти (500 мг) у 23-бром-4-флуор-бензойну кислоту (2,0 г) розметокси-етиламіні гріють при 80°С протягом 3 год. чиняють у хлоросульфоновій кислоті (97%, 35 мл) і Суміш розчиняють у 2М водн. NaOH і промивають гріють при 170°С протягом 72 год. Реакційну суміш EtOAc. Водний шар підкислюють 2М НСІ і екстраохолоджують до кімнатної температури і додають гують EtOAc. Органічний шар сушать (Na2SO4) і краплями до льодо-водяної суміші. Екстрагування концентрують in vacuo. Вихід: 543 мг. EtOAc, сушіння (MgSO4) і концентрування in vacuo (с) 3 -бром-4-(2-метокси-етиламіно)-5дають бажану сполуку. Вихід: 2,5 г. (піролідин-1-сульфоніл)-бензальдегід (b) 3-бром-4-флуор-5(морфолін-4-сульфоніл)До розчину продукту, описаного в опер. (c) бензойна кислота (542 мг) у ТГФ додають ВН3-ТГФ 30 (4,0 мл, 1М у До розчину 3-бром-5-хлорсульфоніл-4-флуорТГФ). Після перемішування протягом 2 год. при бензойної кислоти (3,0 г) у діоксан/воді (9/1 кімнатній температурі обробляють водою, екстра(об'єм/об'єм), 30 мл) додають ДІПЕА (5 мл) і моргують (EtOAc) і концентрують in vacuo, отримуючи фолін (1,65 мл). Після 2-годинного перемішування сирий спирт, який розчиняють у ТГФ. Додають суміш розріджують EtOAc і промивають 2М водн. МnО2 (578 мг) і суміш перемішують протягом ночі. НСІ. Органічний шар сушать (Na2SO4) і концентФільтрація через декаліт і концентрування in vacuo рують in vacuo. Вихід: 2,6 г. дають бажану сиру сполуку, яку кристалізацією з (с) 3-бром-4-(2-метокси-етиламіно)-5діетилетеру. Вихід: 294 мг. (морфолін-4-сульфоніл)-бензойна кислота (d) 4-[3-бром-4-(2-метокси-етиламіно)-5Розчин 3-бром-4-флуор-5-(морфолін-4(піролідин-1-сульфоніл)-феніл]-2-метил-5-оксо-7сульфоніл)-бензойної кислоти (500 мг) у 2пропіл-1.4,5,6,7,8-гексагідрохінолін-3-карбонітрил метокси-етиламіні гріють при 80°С протягом 3 год. Суміш продукту операції (c) (59 мг), 3Суміш розчиняють у 2М водн. NaOH і промивають амінокротонітрилу (12,3 мг) і 5-пропілциклогексанEtOAc. Водний шар підкислюють 2М НСІ і екстра1,3-діону (23,1 мг) в етанолі (5 мл) перемішують гують EtOAc. Органічний шар сушать (Na2SO4) і при 80°С протягом 17 год. Реакційну суміш концеконцентрують in vacuo. Вихід: 575 мг. нтрують in vacuo і залишок очищають препаратив(d) 3-бром-4-(2-етокси-етиламіно)-5ною ЖХВР (Метод В). Вихід: 57 мг. MS-ESI: (морфолін-4-сульфоніл)-бензальдегід [Μ+H]+=591,3/593,3; ЖХВР: Rt=18,43 хвил. ВідноДо розчину продукту, описаного в операції (c) шення діастереомерів: 9:1. (571 мг), у ТГФ додають ВН3-ТГФ (4,5 мл, 1М у Приклад 33. Агоністична активність сполук до ТГФ) і перемішують 2 год. при кімнатній темперарецептора FSH людини, експресованого у клітинах турі, обробляють водою, екстрагують (EtOAc) і СНО концентрують in vacuo, отримуючи сирий спирт, Агоністичну активність сполук до рецептора який розчиняють у ТГФ. Додають МnО2 (587 мг) і FSH людини досліджували на клітинах яєчника суміш перемішують протягом ночі. Фільтрація чекитайського хом'яка (СНО), стабільно трансфекторез декаліт і концентрування in vacuo дає бажану ваних людським рецептором FSH і співтрансфек 35 92009 36 тованих реактивним елементом сАМР яка викликає напівмаксимальну (50%) стимуляцію (СРЕ)/промотером, що спрямовує експресію реполюциферази) і ефективність сполуки порівняно з ртерного гену люциферази світлячка. Зв'язування рекомбінантним людським FSH. Для цього викорисполуки до G-сполученого рецептора FSH підвистовували програму XLfit (Excel, version 2,0, built щує сАМР, що у свою чергу викликає підвищену 30, ID Business Solution Limited). транс-активацію репортерного конструкта люциСполуки всіх прикладів мали активність (ЕК50) ферази. Активність люциферази виміряли лічиль10-6М. Деякі сполуки, зокрема, у прикладах 2, 3, 5, ником люмінесценції. Сполуки випробували при 6, 12, 13, 17, 20, 22, 23, 24, 26, 28, 29, 30, 31 і 32 концентраціях від 0,1 нМ 10 мкМ. Цим аналізом показали ЕК50 менше 10-8М. визначали ЕК50 (концентрація тестової сполуки, В описі до патенту на винахід графічні зображення та текст подаються в редакції заявника Комп’ютерна верстка О. Гапоненко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-phenyl-5-0x0-l,4,5,6,7,8-hexahydr0qлin0line derivatives as medicaments for the treatment of infertility
Автори англійськоюKarstens Willem Frederik Johan, Timmers Cornelis Marius
Назва патенту російськоюПроизводные 4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина для лечения бесплодия
Автори російськоюКарстенс Виллем Фредерик Йоган, Тиммерс Корнелис Мариус
МПК / Мітки
МПК: A61K 31/47, C07D 215/20, A61K 31/4709, C07D 401/12
Мітки: 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну, лікування, безплідності, похідні
Код посилання
<a href="https://ua.patents.su/18-92009-pokhidni-4-fenil-5-okso-145678-geksagidrokhinolinu-dlya-likuvannya-bezplidnosti.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності</a>
Попередній патент: 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохінолінпохідні для лікування безплідності
Наступний патент: Пристрій для ін’єкцій (адаптований пристрій) та спосіб його виготовлення
Випадковий патент: Розвантажувальний тракт трубчатої печі, що обертається












