4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохінолінпохідні для лікування безплідності
Номер патенту: 92008
Опубліковано: 27.09.2010
Автори: Карстенс Віллем Фредерік Йоган, ріма Поведа Педро Мануел, Тіммерс Корнеліс Маріус
Формула / Реферат
1. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну формули І
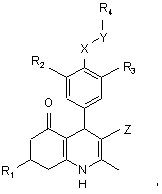
Формула І
де
R1 - (1-6С)алкіл, (2-6С)алкеніл або (2-6С)алкініл;
R2 - галоген, (1-4С)алкокси, флуорований (1-4С)алкокси, (1-4С)алкіл або флуорований (1-4С)алкіл;
або R2 може бути Н, коли R3 є R9,R10-aмiнocyльфoнiл;
R3 - ОН, NO2, CN, флуорований (1-4С)алкокси, (1-4С)алкоксі(2-4С)алкокси, гідроксі(2-4С)алкокси, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (1-4С)алкоксикарбонілокси, (3-4С)алкенілоксикарбонілокси, R7,R8-aміно, R9,R10-aміно, R9,R10-амінокарбоніл, R9,R10-aмiнocyльфoнiл або феніл(1-4С)алкокси, де фенільне кільце, як варіант, заміщено одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкокси, (ді)(1-4С)алкіламіно;
R4 - R11-феніл або R11-(2-5C)гетероарил, де феніл або гетероарил, як варіант, додатково заміщено одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, 20 (1-4С)алкілтіо, (1-4С)алкокси, (2-4С)алкенілу, (2-4С)алкінілу;
R7 - H, (1-4С)алкіл;
R8 - (1-4С)алкілсульфоніл, (1-4С)алкілкарбоніл, (2-4С)алкенілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (1-4С)алкоксі(1-4С)алкілкарбоніл, (3-4С)алкенілоксі(1-4С)алкілкарбоніл, фенілкарбоніл, (2-5С)гетероарилкарбоніл, феніл(1-4С)алкілкарбоніл, (2-5С)гетероарил(1-4С)алкілкарбоніл, де фенільне кільце або гетероароматичне кільце, як варіант, заміщено одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу (1-4С)алкокси, (ді)(1-4С)алкіламіно;
R9 і R10 незалежно вибрано з Н, (1-6С)алкілу, (3-6С)циклоалкілу, (3-6С)циклоалкіл(1-4С)алкілу і (1-4С)алкоксі(2-4С)алкілу; або
R9 і R10 можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше (1-4С)алкільними замісниками;
R11 - H, (1-6С)алкоксикарбоніл, R12,R13-аміно, (1-6С)алкілкарбоніл, (1-6С)алкілсульфоніл, R14-оксо, R14, R15-аміно, R14,R15-амінокарбоніл, R14,R15-aміносульфоніл;
R12 - H, (1-4С)алкіл;
R13 - (1-4С)алкілсульфоніл, (1-4С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ді)(1-4С)алкіламіно(1-4С)алкілкарбоніл, (2-6С)гетероциклоалкіл(1-4С)алкілкарбоніл, (4-6С)гетероциклоалкеніл(1-4С)алкілкарбоніл або (1-4С)алкоксі(1-4С)алкілкарбоніл;
R14 і R15 незалежно вибрано з Н, (1-6С)алкілу, (3-4С)алкенілу, (3-4С)алкінілу, (3-6С)циклоалкілу, (3-6С)циклоалкіл(1-4С)алкілу, гідроксі(2-4С)алкілу, аміно(2-4С)алкілу, (1-4С)алкоксі(2-4С)алкілу, (ді)(1-4С)алкіламіно(2-4С)алкілу, (2-6С)гетероциклоалкіл(2-4С)алкілу, (4-6С)гетероциклоалкеніл(2-4С)алкілу, феніл(1-4С)алкілу і (2-5С)гетероарил(1-4С)алкілу;
X - О або R16-N;
Y - СН2, С(О) або SO2;
Z - CN або NO2;
R16 - Н, (1-4С)алкіл, (1-4С)алкілкарбоніл;
або її фармацевтично прийнятна сіль
2. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 1, яка відрізняється тим, що R1-(1-6C)алкіл.
3. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1, 2, яка відрізняється тим, що R2 - галоген.
4. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-3, яка відрізняється тим, що R3 є R9,R10-аміносульфоніл.
5. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 4, яка відрізняється тим, що R9 і R10 є незалежно (1-6С)алкіл.
6. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за пп. 1-5, яка відрізняється тим, що R4 є R11-феніл або R11-(2-5C)гетероарил, де феніл або гетероарил, як варіант, додатково заміщено одним (1-4С)алкокси.
7. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 6, яка відрізняється тим, що R11 є Н або R12,R13-aміно.
8.Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-7, яка відрізняється тим, що Z є CN.
9. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-8, яка відрізняється тим, що X є О.
10. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-9, яка відрізняється тим, що Y є СН2.
11. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-10, призначена для застосування у терапії.
12. Фармацевтична композиція, яка містить похідну 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-10 і фармацевтично прийнятні допоміжні речовини.
13. Застосування похідної 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі або сольвату у виготовленні медикаменту для лікування розладів плодючості.
Текст
1. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну формули І 2 (19) 1 3 92008 4 R9 і R10 можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше (1-4С)алкільними замісниками; R11 - H, (1-6С)алкоксикарбоніл, R12,R13-аміно, (16С)алкілкарбоніл, (1-6С)алкілсульфоніл, R14-оксо, R14, R15-аміно, R14,R15-амінокарбоніл, R14,R15aміносульфоніл; R12 - H, (1-4С)алкіл; R13 - (1-4С)алкілсульфоніл, (1-4С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ді)(1-4С)алкіламіно(14С)алкілкарбоніл, (2-6С)гетероциклоалкіл(14С)алкілкарбоніл, (4-6С)гетероциклоалкеніл(14С)алкілкарбоніл або (1-4С)алкоксі(14С)алкілкарбоніл; R14 і R15 незалежно вибрано з Н, (1-6С)алкілу, (34С)алкенілу, (3-4С)алкінілу, (3-6С)циклоалкілу, (36С)циклоалкіл(1-4С)алкілу, гідроксі(2-4С)алкілу, аміно(2-4С)алкілу, (1-4С)алкоксі(2-4С)алкілу, (ді)(1-4С)алкіламіно(2-4С)алкілу, (26С)гетероциклоалкіл(2-4С)алкілу, (46С)гетероциклоалкеніл(2-4С)алкілу, феніл(14С)алкілу і (2-5С)гетероарил(1-4С)алкілу; X - О або R16-N; Y - СН2, С(О) або SO2; Z - CN або NO2; R16 - Н, (1-4С)алкіл, (1-4С)алкілкарбоніл; або її фармацевтично прийнятна сіль. 2. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.1, яка відрізняється тим, що R1-(1-6C)алкіл. 3. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1, 2, яка відрізняється тим, що R2 - галоген. 4. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-3, яка відрізняється тим, що R3 є R9,R10-аміносульфоніл. 5. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.4, яка відрізняється тим, що R9 і R10 є незалежно (1-6С)алкіл. 6. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за пп.1-5, яка відрізняється тим, що R4 є R11-феніл або R11-(2-5C)гетероарил, де феніл або гетероарил, як варіант, додатково заміщено одним (1-4С)алкокси. 7. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.6, яка відрізняється тим, що R11 є Н або R12,R13-aміно. 8. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-7, яка відрізняється тим, що Z є CN. 9. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-8, яка відрізняється тим, що X є О. 10. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-9, яка відрізняється тим, що Y є СН2. 11. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-10, призначена для застосування у терапії. 12. Фармацевтична композиція, яка містить похідну 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп.1-10 і фармацевтично прийнятні допоміжні речовини. 13. Застосування похідної 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп.110 або її фармацевтично прийнятної солі або сольвату у виготовленні медикаменту для лікування розладів плодючості. Винахід стосується похідних 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну, фармацевтичних композицій, що містять їх і застосування зазначених похідних у виготовленні медикаментів для лікування розладів плодючості. Гонадотропіни грають важливу роль у різних функціях тіла, включаючи метаболізм, терморегуляцію і репродуктивний процес. Гонадотропіни діють на певні типи гонадних клітин, ініціюючи цим оварійну і тестикулярну диференціацію і стероїдогенез. Слизовий гонадотропін FSH (гормон стимуляції фолікул), наприклад, грає головну роль у стимуляції розвитку і дозрівання фолікул, a LH (гормон лютеїнізації) викликає овуляцію (Sharp, R.M. Clin Endocrinol. 33: 787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35: 301342, 1979). Наразі FSH застосовують у клініці для оваріальної стимуляці, тобто оваріальної гіперстимуляці для запліднення in vitro (TVF) і індукування овуляції у безплідних ановуляторних жінок (Insler, V., Int. J. Fertility 33: 85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5: 3-13, 1988), а також при чоловічому гіпогадизму і безплідності. Гонадотропін FSH вивільняється з переднього гіпофізу під впливом гормону, що вивільняє гонадотропін і естрогени, і з плаценти під час вагітності. У жінок FSH діє на яєчник, сприяючи розвитку фолікул і є головним гормоном, що регулює секрецію естрогенів. У чоловіків FSH відповідає за цілісність насіннєносних трубочок і діє на клітини Сертолі, сприяючи гаметогенезу. Очищений FSH використовують клінічно для лікування безплідності у жінок і деяких типів порушення сперматогенезу у чоловіків. Гонадотропін, призначений для терапевтичних цілей може бути ізольований з сечі людини, але з низькою чистотою (Morse et al, Amer. J. Reproduct. Immunol, and Microbiology 17: 143, 1988). Вони також можуть бути приготовлені як рекомбінантні гонадотропіни. Рекомбінантний людський FSH є у продажу і використовується для сприяння репродукції (Olijve et al. Моl. Hum. Reprod. 2: 371, 1996; Devroeyetal. Lancet 339: 1170, 1992). 5 Дія гормону FSH опосередковується специфічним рецептором плазмової мембрани, який є членом великої родини рецепторів, сполучених з G-протеїнам. Ці рецептори складаються з одиночних поліпептидів з 7 трансмембранними доменами і можуть взаємодіяти з G-протеїнами, викликаючи активацію аденілатциклази. Рецептор FSH є високоспецифічним об'єктом у процесі росту оваріальних фолікул і експресується виключно у яєчнику. Блокування цього рецептора або пригнічення сигналів, що звичайно відбувається після активації опосередкованого FSH рецептора, порушує розвиток фолікули і, отже, овуляцію і плідність. Низькомолекулярні антагоністи FSH можуть бути основою нових контрацептивів, а низькомолекулярні агоністи FSH можуть бути використані у тих же клінічних застосуваннях, як і природний FSH, тобто для лікування безплідності і гіперстимуляції яєчника при заплідненні in vitro. Низькомолекулярні міметики FSH з агоністичними властивостями були описані у заявках WO 2000/08015 і WO 2002/09706. Деякі похідні тетрагідрохіноліну були описані у заявці WO 2003/004028 як модулятори FSH з агоністичними або антагоністичними властивостями. Залишається потреба у низькомолекулярних гормономіметиках, здатних селективно активувати рецептор FSH. Винахід стосується похідних 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну загальної формули І де R1 - (1-6С)алкіл, (2-6С)алкеніл або (26С)алкініл; R2 - галоген, (1-4С)алкокси, флуорований (14С)алкокси, (1-4С)алкіл або флуорований (14С)алкіл; або R2 може бути Н, якщо R3 є R9,R10aмiнocyльфoнiл; R3 - ОН, NO2, CN, флуорований (1-4С)алкокси, (1-4С)алкокси(2-4С)алкокси, гідрокси(24С)алкокси, (1-4С)алкоксикарбоніл, (34С)алкенілоксикарбоніл, (14С)алкоксикарбонілокси, (34С)алкенілоксикарбонілокси, R7,R8-аміно, R9,R10аміно, R9,R10-амінокарбоніл, R9R10-аміносульфоніл або феніл(1-4С)алкокси, де фенільне кільце, як варіант, заміщене одним або більше замісниками, вибраними з гідрокси, аміно, галоген, нітро, трифлуорметил, ціано, (1-4С)алкілу, (2-4С)алкенілу, (24С)алкінілу, (1-4С)алкокси, (ди)(1-4С)алкіламіно; R4 - R11 - феніл або R11-(2-5C)роарил, де феніл або гетероарил, як варіант, додатково заміщено одним або більше замісниками, вибраними з гідро 92008 6 кси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкілтіо, (1-4С)алкокси, (24С)алкенілу, (2-4С)алкінілу; R7-H, (1-4С)алкіл; 8 R (1-4С)алкілсульфоніл, (14С)алкілкарбоніл, (2-4С)алкенілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (34С)алкенілоксикарбоніл, (1-4С)алкокси(14С)алкілкарбоніл, (3-4С)алкенілокси(14С)алкілкарбоніл, фенілкарбоніл, (25С)гетероарил-карбоніл, феніл(14С)алкілкарбоніл, (2-5С)гетероарил(14С)алкілкарбоніл, де фенільне кільце або гетероароматичне кільце, як варіант, заміщено одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу (14С)алкокси, (ди)(1-4С)алкіламіно; R9 і R10 незалежно вибрано з Н, (1-6С)алкілу, (3-6С)циклоалкілу, (3-6С)циклоалкіл(1-4С)алкілу і (1-4С)алкокси(2-4С)алкілу; або R9 і R10 можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше (1-4С)алкільними замісниками; R11 - Н, (1-6С)алкоксикарбоніл, R12,R13-аміно, (1-6С)алкілкарбоніл, (1-6С)алкіл-сульфоніл, R14окси, R14,R15-аміно, R14,R15-амінокарбоніл, R14,R15aмiнocyльфoнiл; R12-H, (1-4С)алкіл; 13 R (1-4С)алкілсульфоніл, (14С)алкілкірбоніл, (3-6С)циклоалкілкарбоніл, (14С)-алкоксикарбоніл, (3-4С)апкенілоксикарбоніл, (ди)(1-4С)алкіламіно-(1-4С)алкілкарбоніл, (26С)гетероциклоалкіл(1-4С)алкілкарбоніл, (46С)гетероцикло-алкеніл(1-4С)алкілкарбоніл або (14С)алкокси(1-4С)алкілкарбоніл; R14 і R15 незалежно вибрано з Н, (1-6С)алкілу, (3-4С)алкенілу, (3-4С)алкінілу, (3-6С)циклоалкілу, (3-6С)циклоалкіл(1-4С)алкілу, гідрокси(24С)алкілу, аміно(2-4С)алкілу, (1-4С)алкокси(24С)алкілу, (ди)(1-4С)алкіламіно(2-4С)алкілу, (26С)гетероциклоалкіл(2-4С)-алкілу, (46С)гетероциклоалкеніл(2-4С)алкілу, феніл(14С)алкілу і (2-5С)гетероарил(1-4С)-апкілу; X - О або R16-N; У-СН2, C(О) або SО2; Ζ - CN або NO2; R16 - Η, (1-4С)алкіл, (1-4С)алкілкарбоніл; або їх фармацевтично прийнятних солей. Похідні 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну згідно з винаходом є потужними активаторам рецептора FSH і можуть мати таке ж клінічне застосування, як і природні FSH, оскільки вони діють як агоністи, але з тією перевагою, що вони можуть бути приготовлені синтетично, можуть мати іншу стабільність і можуть бути введені пацієнту іншим шляхом. Отже, агоністи рецептора FSH згідно з винаходом можуть бути застосовані у лікуванні розладів плодючості, наприклад, для контрольованої оваріальної гіперстимуляці і процедур IVF. Терміни (1-4С)алкіл і (1-6С)алкіл означають розгалужену або нерозгалужену алкільну групу з 1 7 4 і з 1-6 атомами карбону, а саме, метил, етил, пропіл, ізопропіл, бутил, втор-бутил і трет-бутил тощо. Термін (2-4С)алкокси(2-4С)алкіл означає алкоксигрупу, алкіл якої містить 2-4 атоми карбону і приєднаний до алкільної групи з 2-4 атоми карбону. Терміни флуорований (1-4С)алкіл і флуорований (1-4С)алкокси означають розгалужені або нерозгалужені алкільні і алкокси-групи, які мають 1-4 атоми карбону, відповідно, і заміщені щонайменше одним атомом флуору. Терміни (2-4С)алкеніл, (3-4С)алкеніл і (26С)алкеніл означають розгалужені або нерозгалужені алкеніли з 2-4, 3-4 і 2-6 атоми карбону, відповідно, наприклад, етеніл, 2-бутеніл, і n-пентеніл. Термін (2-4С)алкініл означає розгалужені або нерозгалужені алкініли з 2-4 атомами карбону, наприклад, етиніл і пропініл. Термін (3-6С)циклоалкіл означає циклоалкіли 3-6 атомами карбону, а саме, циклопропіл, циклобутил, циклопентил і циклогексил. Термін (3-6С)циклоалкіл(1-4С)алкіл означає (1-4С)алкіл, ідентичний визначеному вище і заміщений (3-6С)циклоалкілалкілом, ідентичним визначеному вище. Термін (2-6С)гетероциклоалкіл означає гетероциклоалкіли з 2-6 атомами карбону, переважно 3-5 атомами карбону, у тому числі щонайменше один гетероатом, вибраний з Ν, Ο і/або S, який може бути приєднаний через гетероатом (якщо можливо) або атом карбону. Бажаними гетероатомами є N або О. Найбільш бажаними є піперидин1-іл, морфолін-4-іл, піролідин-1-іл і піперазин-1-іл. Термін (4-6С)гетероциклоалкеніл означає гетероциклоалкеніл з 4-6 атомами карбону, переважно з 5-6 атомамии карбону, у тому числі щонайменше з одним гетероатомом, вибраним з Ν, Ο і/або S, який може бути приєднаний через гетероатом (якщо можливо) або атом карбону. Бажаними гетероатомами є N або О. Термін (2-5С)гетероарил означає гетероароматичну групу з 2-5 атомами карбону і щонайменше одним гетероатомом, вибраним з Ν, Ο і S, наприклад, імідазоліл, тіадіазоліл, піридиніл, тієніл або фурил. Бажаними гетероарилами є тієніл, фурил і піридиніл. (2-5С)гетероарил може бути приєднаний через атом карбону або гетероатом (якщо можливо). Термін (ди)(1-4С)алкіламіно означає аміногрупу, монозаміщену або дизаміщену алкілами, кожний з яких містить 1-4 атоми карбону і є ідентичним визначеним вище. 92008 8 Термін галоген означає флуор, хлор, бром або йод; бажаними є хлор, бром або йод. Термін фармацевтично прийнятна сіль репрезентує солі, які з медичної точки зору є придатними для застосування у контакті з тканинами людини і нижчих тварин без проявів токсичності, подразнень, алергічних реакцій тощо і мають прийнятне відношення перевага/ризик. Фармацевтично прийнятні солі є добре відомими. Вони можуть бути отримані під час кінцевого ізолювання і очищення сполуки винаходу або реакцією вільноосновної функції з придатною неорганічною кислотою, наприклад, гідрохлорною, фосфорною або сульфуровою, або з органічною кислотою, наприклад, аскорбіновою, лимонною, виннокам'яною, молочною, малеїновою, малоновою, фумаровою, гліколевою, бурштиновою, пропіоновою, оцтовою, метансульфоновою тощо. Кислотна функція може реагувати з органічною або неорганічною основою, наприклад, гідроксид натрію, гідроксид калію або гідроксид літію. Винахід також стосується сполуки формули І, де R1 - (1-6С)алкіл, зокрема, сполуки, в якій R1 - (14С)алкіл. Ще один аспект винаходу стосується сполук формули І, де R2 є галоген, зокрема, R2 є Вr. У ще одному аспекті цього винаходу, R3 у сполуці формули І є R9,R10-aмiнocyльфoнiл, зокрема, R9 і R10 є незалежно (1-6С)алкіл. Ще один аспект винаходу стосується сполук формули І, де R4 є R11-феніл або R11-(25С)гетероарил, феніл або гетероарил, як варіант, додатково заміщений (1-4С)алкокси. Зокрема, винахід стосується сполуки, в якій R11 - Η або R12,R13-аміно. Інший аспект винаходу стосується сполук формули І, де X є О. В одному з аспектів винахід стосується сполук формули І, де У є СН2. Ще один аспект винаходу стосується сполук, в яких Ζ є CN. Ще один аспект винаходу стосується сполуки, в якій одне або більше конкретних визначень груп R1 - R24, X, У і Ζ комбінуються з визначенням похідних 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну формули І. Ще один аспект винаходу стосується сполуки формули І, як в аналізі на зв'язування мають ЕК50 менше 10-8Μ (див приклад 43). Далі розглядаються способи приготування цих сполук. 9 У деяких випадках групи Rx, що містять функціональні групи, можуть потребувати додаткового тимчасового захисту залежно від типу реакції, яку необхідно провести, що добре відомо фахівцям (див. Protective Groups in Organic Synthesis, T.W. Greene, P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999). Похідні 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну формули І, в яких R1, R2, R3, R4, X, У і Ζ є ідентичними визначеним вище, можна 92008 10 отримати декількома способами. Спосіб А починається з належним чином функціоналізованих похідних 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну загальної структури II, де R1, R2, R4, X, У і Ζ є ідентичними визначеним вище, a FG1 є функціональною групою, наприклад, нітро, азидо, (необов'язково захищеною) аміно, (необов'язково захищеним) гідроксилом, карбоновою кислотою, сульфонілхлоридом тощо, як можуть бути перетворені у групи, визначені для R3. 11 Наприклад, N-ацилування або Nсульфонілування сполук загальної формули ІІ-а дає сполуки загальної формули 1-а, де R1, R2, R4, X, У і Ζ є ідентичними визначеним вище, R7 - Η і R8 - ацил або сульфоніл. Звичайно сполуки ІІ-а реагують у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, ДМСО, етанолі, ТГФ, 1,4-діоксані, толуолі, 1-метил-піролідин-2-оні або піридині, з належним чином заміщеним ацилгалогенідом, кислотним ангідридом або сульфонілгалогенідом у присутності основи, наприклад, тріетиламіну, Ν,Ν-діізопропілетиламіну (ДІПЕА) або піридину, з отриманням N-ацилованих або Nсульфонілованих похідних формули 1-а, відповідно. В іншому варіанті N-ациловані сполуки загальної формули l-а можна отримати реакцією похідних ІІ-а з належним чином заміщеними карбоновими кислотами у присутності реагенту сполучення, наприклад, діізопропілкарбодііміду 92008 12 (DIC), (3-диметиламінопропіл)-етил-карбодііміду (EDCI), тетрафлуорборату О-(бензотріазол-1-іл)N,N,N',N'-тетраметилуронію (TBTU) або гексафлуорфосфату 0-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (HATU) і третинної амінної основи наприклад, ДІПЕА) у розчиннику, наприклад, Ν,Ν-ДМФ або ДХМ при зовнішній або підвищеній температурі. Сполуки загальної формули Θ-b, де R1, R2, R4, R8, X, У і Ζ є ідентичними визначеним вище, a R7 (1-4С)алкіл, можна отримати N-алкілуванням похідної 1-а належним чином заміщеної алкілгалогенідами загальної формули R7-Hal. Цю реакцію звичайно проводять у присутності основи, наприклад, карбонату калію, карбонату цезію, гідроксиду натрію або гідриду натрію у придатному розчиннику, наприклад, ДХМ, N.N-ДМФ, етанолі, ДМСО, ТГФ або 1,4-діоксані. 13 92008 14 В іншому варіанті сполуки формули І-b можна отримати добре відомим відновлювальним алкілуванням алкілальдегідами (наприклад, ацетальдегідом, (ізо)бутиральдегідом), ацетоном або бутаноном. Звичайно сполуки загальної формули ІІ-а є обробляють прийнятною карбонільною сполукою і відновлювачем, наприклад, ціаноборогідридом натрію або тріацетоксиборогідридом натрію у придатному розчиннику, наприклад, метанолі, етанолі, ДХМ, Ν,Ν-ДМФ або їх суміш, як варіант, у присутності кислоти, наприклад, оцтової, з отриманням сполук загальної формули ІІ-b. Сполуки загальної формули ІІ-b можуть бути потім Nациловані або N-сульфоніловані з отриманням сполук загальної формули І-b способами, описаними для отримання сполук загальної формули l-а з II-а. Сполуки загальної формули ІІ-b можна також отримати певною послідовністю операцій. Поперше, сполуки формули ІІ-а можуть бути перетворені у похідні 2,4-динітробензол-сульфонаміду ІІ-с N-сульфонілуванням 2,4динітробензолсульфонілхлоридом (DNS-CL). Сульфонамід можна алкілувати з отриманням сполук загальної формули II-d, застосовуючи відомі реакції Міцунобу з належним чином заміщеними первинними або вторинними спиртами формули R7-OH (R7=алкіл), трифенілфосфіном (необов'язково зв'язаним смолою) і діалкілазодикарбоксилатом у прийнятному розчиннику, наприклад, 1,4-діоксані, ТГФ або ДХМ при підвищеній або зовнішній температурі. В іншому варіанті сульфонамід загальної формули ІІ-с може бути алкілований алкіл галогенідами формули R7-Hal (Hal=СІ, Br, І) і придатною основою, наприклад, K2СО3 у розчиннику, наприклад, Ν,Ν-ДМФ, ТГФ або 1,4-діоксані. Розщеплення сульфонамідного зв'язку N-S з первинним аміном, наприклад, пропіламіном, у придатному розчиннику, наприклад, ДХМ, дає сполуки формули ll-b. В іншому варіанті сульфонамідний зв'язок N-S може бути розщеплений меркаптооцтовою кислотою і третинною амінною основою у розчиннику, наприклад, ДХМ. Такі реакції були описані (див., наприклад, Tetrahedron Lett. 38 (1997) 5831-5834, Bioorg.Med. Chem. Lett. 10 (2000) 835-838). Способами, описаними для отримання похідних II-b, отримують сполуки загальної формули І-с, де R1, R2, R4, R9, X, У і Ζ є ідентичними визначеним вище, використовуючи реакцію сполуки ІІ-а з (заміщеними) алкілальдегідами або (циклічними) кетонами (наприклад, пропіональдегідом, циклогексаноном, ацетоном або ацетальдегідом) у відновлювальних умовах, або алкілуванням похідних ІІс R9-OH або R9-Hal з подальшим видаленням DNS-групи. Сполуки І-с можуть бути відновлюва льно алкіловані знову з використанням належним чином заміщених альдегідів або кетонів з введенням R10 і отриманням сполук загальної формули ld, де R1, R2, R4, R9, R10, X, У і Ζ є ідентичними визначеним вище. У деяких випадках відновлювальне алкілування ІІ-а виконують двічі, отримуючи сполуки загальної формули l-d, де R9=R10 (наприклад, при використанні формальдегіду, коли R9=R10=метил). 15 Сполуки загальної формули ІІ-а можна отримати відновленням нітрогрупи у сполуках загальної формули ІІ-е до відповідної аміногрупи. Звичайно сполуки ІІ-е обробляють цинковим пилом і оцтовою кислотою у придатному розчиннику, наприклад, ТГФ або діоксані, при температурах між 0°С і температурою дефлегмації. Інші способи включають обробку залізом, SnCL2 або гідрогеном у присутності перехідного металу як каталізатора, наприклад, паладію або платини на вугіллі, з застосуванням добре відомих способів і реагентів. В іншому варіанті сполуки загальної формули ІІ-а можна отримати розщепленням відомих Nзахисних груп (=PG у формулі ll-f), наприклад, алілоксикарбонільної (АІІос), флуорен-9-ілметоксикарбонільної (Fmoc) або третбутоксикарбонільної (Вос) групи у сполуках загальної формули ll-f з отриманням відповідних похідних ІІ-а. Захисні групи описано, наприклад, у Protective Groups in Organic Synthesis, T.W. Сполуки загальної формули l-f, де R1, R2, R4, X, У і Ζ є ідентичними раніше визначеним, a R є ціано, можна отримати дегідратацією амідів загальної формули l-g трифлуороцтовим ангідридом і придатною основою, наприклад, тріетиламіном або піридином у придатному розчиннику, наприклад, ДХМ, 1,4-діоксані або ТГФ при 0°С або зовнішній температурі. Дегідратація амідів з отриманням арилнітрилів описана, наприклад, у Org. Prep. Proced. Int. 26 (1994) 429-438, Acta Chem. 10 Scand. 53 (1999) 714-720, J. Org. Chem. 57 (1992) 2700-2705. Сполуки формули l-g отримують згідно з синтезом, описаним для похідних 1-е. 92008 16 Greene, P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999. Карбонокислотні похідні загальної формули llh, які можна приготувати сапоніфікацією відповідних алкіл-естерів ll-g, можуть бути конденсовані з амінами загальної структури R9R10NH з застосуванням реагента сполучення, як це було описано для приготування похідних 1-а з ІІ-а, з отриманням сполуки формули 1-е, де R1, R2, R4, R9, R10, 15 X, У і Ζ є ідентичними визначеним вище. В іншому варіанті, сполуки загальної формули ll-h можуть бути перетворені у відповідні кислотні хлориди загальної формули ІІ-І відомими способами, наприклад, обробка карбонових кислот загальної формули ll-h тіонілхлоридом або оксаліл-хлоридом і ДМФ у придатному розчиннику, наприклад, ДХМ або толуолі, дає відповідні хлорангідриди ІІ-і. Подальша реакція з амінами загальної структури R9R10NH, як варіант, у присутності придатної третинної амінної основи дає сполуки загальної формули 1-е. Сполуки загальної формули ll-j, де R1, R2, R4, X, У і Ζ є ідентичними визначеним вище, можуть бути О-алкіловані (заміщеними) алкілгалогенідами Ε-Hal (Е=алкіл, флуорований алкіл, алкоксіалкіл, гідроксіалкіл, (заміщений) фенілалкіл або (заміщений) гетероарилалкіл; Hal=C1, Вг, І) обробкою основою, наприклад, карбонатом калію або карбонатом цезію у придатному розчиннику, наприклад, Ν,Ν-ДМФ, ацетоні, ТГФ, 1,4-діоксані або 1-метилпіролідин-2-оні з отриманням сполуки загальної 17 92008 18 формули l-h, де R1, R2, R4, X, У і Ζ є ідентичними визначеним вище, а Е - алкіл, флуорований алкіл, алкоксіалкіл, гідроксіалкіл, (заміщений) фенілалкіл або (заміщений) гетероарилалкіл. В іншому варіанті для виконання цього перетворення можна застосувати умови Міцунобу, описані для перетворенн похідних ІІ-с у сполуки II-d. Сполуки загальної формули І можна також отримати маніпуляціями з функціональними групами FG2 у сполуках загальної формули III (спосіб В). Наприклад, функціоналізація аміногрупи сполук загальної формули ІІІ-а, як це було описано для перетворення похідних II-а у l-а і І-b, дає сполуки загальної формули l-k, де R1, R2, R3, R12, R13, X, У і Ζ є ідентичними визначеним вище, а А - (заміщений) феніл або (заміщене) гетероарильне кільце. Сполуки загальної формули 1-1, де R1, R2, R3, R14, X, У і Ζ є ідентичними раніше визначеним, R15 - Н, а А - (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати відновлювальним алкілуванням сполук загальної формули ІІІ-а способами, описаними для отримання сполук II-b з ІІ-а або послідовністю 3 операцій, описаною для отримання похідних ΘΘ-b з ІІ-а через ІІ-с і ll-d. Відно влювальне алкілування сполук l-І альдегідами або кетонами у присутності ціаноборогідриду натрію або тріацетоксиборогідриду натрію може давати сполуки загальної формули l-m, де R1, R2, R3, R14, R15, X, У і Ζ є ідентичними визначеним вище, а А (заміщений) феніл або (заміщене) гетероарильне кільце. 19 92008 20 Сполуки загальної формули ІІІ-а можна отримати з сполук загальної формули ІІІ-b або ІІІ-с аналогічно до отримання сполук ІІ-а з ІІ-е або ll-f, відповідно. Похідні аміду l-n, де R1, R2, R3, R14, R15, X, У і Ζ є ідентичними визначеним вище, а А - (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати з карбонової кислоти ІІІ-е, способами, описаними для отримання сполук l-е з ll-h (через хлорангідрид або з застосуванням реагенту сполучення). Подібним чином естери загальної формули І-о, де R1, R2, R3, R14, X, У і Ζ є ідентичними визначеним вище, а А - (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати з похідних ІІІ-е і спиртів загальної формули R14-OH, способами, описаними для перетворення ІІІ-е у відповідні аміди І-n. Сполуки загальної формули ІІІ-е можна отримати з відповідних алкіл-естерів lll-d добре відомим опосередкованим естером розщепленням основою або кислотою. Похідні загальної формули І-р, де R1, R2, R3, 14 R , X, У і Ζ є ідентичними визначеним вище, а А (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати алкілуванням гідроксильної групи у сполуках загальної формули Ill-g алкіл галогенідом загальної формули R14-HaL, в якій Hal може бути Вr, СІ або І. Звичайно таку реакцію проводять в апротонному розчиннику, наприклад, Ν,Ν-ДМФ, 1,4-діоксані або ТГФ у присутності основи, наприклад, гідриду натрію, карбонату калію, карбонату цезію або тріетиламіну при зовнішній або підвищеній температурі. В іншому варіанті перетворення сполук загальної формули Ill-g в арил-етери загальної формули І-р можна проводити алкілуванням в умовах Міцунобу. У такому перетворенні алкілування гідроксигрупи у сполуках формули Ill-g здійснюється спиртами загальної 21 92008 22 формули R14-OH у присутності (зв'язаного смолою) трифенілфосфіну і діетилазодикарбоксилату або їх похідних у придатному апротонному розчиннику, наприклад, ТГФ або ДХМ. Похідні загальної формули Ill-g можна отримати розщепленням гідрокси-захисної групи у сполуках загальної формули Ill-f. Відомими придатними захисними групами є тетрагідропіраніл (ТГП) або трет-бутил-диметилсиліл (TBS). Розщеплення груп ТГП і TBS взагалі проводять обробкою кислотою, наприклад, гідрохлорною, трифлуорметансульфоновою або трифлуороцтовою, у придатному розчиннику, наприклад, ТГФ або метанолі. В іншому варіанті групу TBS можна видаляти, обробляючи флуоридом тетра-n-бутиламонію у ТГФ. Захисні групи описано, наприклад, у Protective Groups in Organic Synthesis, T.W. Greene, P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999. Сполуки загальної формули І можна також отримати маніпулюванням обома функціональними группами FG1 і FG2 у сполуках загальної фор мули IV (спосіб С), згідно з описаними вище перетвореннями сполук загальної формули II і III. Ці дві функціональні групи можуть бути (але не обов'язково) ідентичними. Фахівцю зрозуміло, що порядок модифікування функціональних груп FG1 і FG2 може бути критичним для успішного синтезу. У деяких випадках може виявитись необхідним застосування (ортогональних) захисних груп. Наприклад, динітро-сполуки загальної формули IV-a можуть бути відновлені діаміно-сполуками IV-b способами, описаними для отримання похідних ІІ-а з ІІ-е. Стандартне N-ацилування або Nсульфонілування дає сполуки загальної формули l-q, де R1, R2, R3, X, У і Ζ є ідентичними визначеним вище, А - (заміщений) феніл або (заміщене) гетероарильне кільце, а R13=R8. Для уможливлення незалежних варіацій замісників (наприклад, R8 і R13) функціональні групи у сполуках загальної формули IV мають бути функціоналізовані ортогонально. Наприклад, сполуки загальної формули IV-c можуть бути функціоналізовані способами, описаними для синтезу похідних l-а, І-b, l-е і l-d з сполук ІІ-а з отриманням сполук загальної формули IV-d, де R1, R2, X, У і Ζ є ідентичними визначеним вище, А - (заміщений) феніл або (заміщене) гетероарильне кільце, a G є NR7R8 або NR9R10. Ці сполуки можуть бути перетворені у похідні І-r, де R1, R2, X, У і Ζ є ідентичними визначеним вище, А - (заміщений) феніл або (за7 8 міщене) гетероарильне кільце, G є NR R або 9 10 12 13 14 15 NR R , а K є NR R або NR R . 23 92008 24 Ще одним способом отримання сполук загальної формули І може бути функціоналізація сполук загальної формули V (спосіб D). Сполуки загальної формули V-a, де X=О, можна застосовувати для приготування сполук l-s, в яких R1, R2, R3, R4, У і Ζ є ідентичними визначеним вище, а X=О, Оалкілуванням, О-ацилуванням або Осульфонілуванням у стандартних умовах, добре відомих фахівцям. Схема заміщення (гетеро)арильного кільця у R4 є ідентичними описаній вище. Звичайно сполуки V-a реагують у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, ДМСО, етанолі, ТГФ, 1,4-діоксані, толуолі, 1-метил-піролідин-2-оні або піридині, з належним чином заміщеним (гетеро)ароматичним алкілгалогеном формули IX, ацилхлоридом формули X або сульфонілхлоридом формули XII у присутності основи, наприклад, тріетиламіну, Ν,Ν-діізопропілетиламіну (ДІПЕА), піридину, карбонату калію, карбонату цезію або гідриду натрію, як варіант, у присутності каталітичної кількості йодиду калію або йодиду тетрабутиламоню, з отриманням О-алкілованих, О-ацилованих або О-сульфонілованих похідних формули l-s, відповідно. В іншому варіанті, О-алкіловані сполуки загальної формули l-s, в якій У=СН2, можна отримати, застосовуючи відомі реакції Міцунобу з спиртами формули XIII, трифенілфосфіном (не обов'язково зв'язаним смолою) і діалкілазодикарбоксилатом (наприклад, діетилазодикарбоксилатом) у прийнятному розчиннику, наприклад, 1,4-діоксані, ТГФ або ДХМ при підвищеній або зовнішній температурі. Крім того, О-ациловані сполуки загальної формули l-s, де У=С(О), можна отримати реакцією (гетеро)ароматичної карбонової кислоти формули XI у присутності реагенту сполучення, наприклад, діізопропілкарбодііміду (DIC), (3диметиламінопропіл)-етил-карбодііміду (EDCI), тетрафлуорборату О-(бензотриазол-1-іл)N,N,N',N'-тетраметилуронію (TBTU) або гексафлуорфосфату О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (HATU) і третинної амінної основи (наприклад, ДІПЕА) у розчиннику, наприклад, Ν,Ν-ДМФ або ДХМ, при зовнішній або підвищеній температурі. Сполуки загальної формули l-t можна отримати з сполуки V-b N-алкілуванням, N-ацилуванням або N-сульфонілуванням способами, описаними для синтезу сполук l-s, з реагентами формул ІХХІІІ Крім того, сполуки загальної формули l-t, в якій У=СН2, можна отримати відновлювальним амінуванням (гетеро)ароматичних альдегідів формули XIV сполуками V-b з придатним відновлювачем, наприклад, ціаноборогідридом натрію або тріацетоксиборогідридом натрію. В іншому варіанті сполуки загальної формули V-b можуть бути перетворені у відповідні бензіміни реакцією з (гетеро)ароматичними альдегідами XIV відомими способами з подальшим відновленням, наприклад, борогідридом натрію з отриманням сполуки l-t, в якій У=СН2. 25 92008 26 Сполуки загальної формули l-t, де R1, R2, R3, R4, У і Ζ є ідентичними визначеним вище, а X є ΝΗ, можуть бути N-алкіловані способами, описаними для отримання похідних Θ-b з I-а (якщо У=С(О) або SO2), або способами, описаними для отримання похідних сполуки ΘΘ-b з ІІ-а (якщо У=СН2), з отриманням сполук загальної формули Iu, де R16 - (1-4С)алкіл. Сполуки загальної формули І, де R1, R2, R3, R4, X, У і Ζ є ідентичними визначеним вище, можна також отримати з циклогексан-1,3-діонів загальної формули VI, енамінів загальної формули VII і бензальдегідів загальної формули Vlll-a-b добре документованою трикомпонентною реакцією циклоконденсаціі типу Ганцша (спосіб Е). Опис таких реакцій цикло-конденсації можна знайти у Bioorg. Med. Chem. Lett. 12 (2002) 14811484, J. Chem. Soc, Perkin Транс. 1 (2002) 11411156, Synlett (2002) 89-92, Drug Dev. Res. 51 (2000) 225-232, Drug Dev. Res. 51 (2000) 233-243, J. Med. Chem. 42 (1999) 1422-1427, ibid. 5266-5271, ibid. 41 (1998) 2643-2650, WO 9408966, Arzneim.Forsch/Drug Res. 45 (1995) 1054-1056, J. Med. Chem. 34 (1991) 2248-2260, ibid. 17 (1974) 956-65, Indian J. Chem., Sect В (1994) 526-531, Chem. Rev. 72 (1972), 1-42. Ці реакції звичайно проводять при підвищеній температурі у придатному розчиннику, наприклад, оцтовій кислоті, (ізо)пропанолі, етанолі, метанолі або їх суміші. Сполуки загальної формули l-w, де R2 - Н, R3 є R9,R10-aмiнocyльфoнiл, a R1, R4, X, У і Ζ є ідентичними визначеним вище, можуть бути синтезовані каталітичним гідрогенуванням сполук загальної формули 1-ν, з застосуванням гідрогену і перехід ного металу як каталізатора, наприклад, паладію на вугіллі, у придатному розчиннику, наприклад, етанолі, метанолі, етилацетаті або їх суміші. Подібно до N-алкілувань сполук загальної формули l-t з отриманням l-u, сполуки загальної формули II-k, де R1, R2, R4, У, Ζ є ідентичними визначеним вище, а X=ΝΗ, можуть бути N-алкіловані з отриманням сполук загальної формули ll-1, де R16 - (1-4С)алкільна група. Сполуки загальної формули II можна приготувати з похідних загальних формул XV-a і XV-b способами, описаними для отримання сполук загальних формул l-s і l-t, відповідно, застосовуючи реагенти формул IX-XV. 27 92008 28 Сполуки загальної формули II і III можна також синтезувати реакцією цикло-конденсації типу Ган цша сполук VI і VII з альдегідомами формули XVI або XVII, відповідно. Сполуки загальної формули III можна також приготувати з похідних загальної формули V-a і Vb способами, описаними для отримання сполук загальної формули l-s і l-t, відповідно, застосовуючи реагенти формул XVIII-XXIII. Сполуки загальної формули IV можна отримати з похідних загальних формул XV-a і XV-b способами, описаними для отримання сполук загаль ної формули l-s і l-t, відповідно, застосовуючи реагенти формул XVIII-XXIII. Сполуки загальних формул IV і V-a-b можна також отримати цикло-конденсацією Ганцша, застосовуючи заміщені бензальдегіди загальної формули XXTV або XXV, відповідно. 29 92008 30 Сполуки загальної формул V-c-d, в якяй R2 є Вr, можна також отримати орто-бромуванням фенолів або анілінів. Так, сполуки формули V-e-f, синтезовані з сполук VI і VII і альдегідів реакцією циклоконденсації Ганцша, дають сполуки формул V-c-d після обробки бромом у придатному розчиннику, наприклад, оцтовій кислоті, етанолі або ДХМ, або їх суміші, як варіант, у присутності ацетату натрію. В іншому варіанті для цього перетворення можна застосовувати N-бромсукцинімід у Ν,ΝДМФ або ацетонітрилі (див., наприклад, J. Chem. Soc. Perkin Trans., 2 6 (2000) 1113-1118, J. Org. Chem. 44 (1979), 4733-4735). Крім того, сполуки загальної формули V-i, де R3 є сульфамоїльною групою, а X=О, можна отримати реакцією амінів загальної формули R9R10NH з сполуками загальної формули V-h, як варіант, у присутності третинної амінної основи, наприклад, тріетиламіну або ДІПЕА. Сполуки V-h отримують хлорсульфонілуванням сполук загальної формули V-g. Хлорсульфонілування фенолів описано, наприклад, у Tetrahedron 53 (1997) 4145-4158, Bioorg. Med. Chem. Lett. 13 (2003) 379-382. 31 92008 32 Сполуки загальної формули V можна також отримати з сполук загальної формули XV, селективно модифікуючи FG1. Наприклад, сполуки за1 2 гальних формул XV-c-d, де R , R і Ζ є ідентичними визначеним вище, a FG1 є ΝΗ2, можуть бути селективно N-ациловані або Ν-сульфоніловані в умовах, описаних для отримання сполук 1-а з ІІ-а, з отриманням сполук загальних формул V-j-k, де R1, R2, R8 і Ζ є ідентичними визначеним вище. У літературі описано подібна регіоселективність ацилування або сульфонілування 1,2-діамінобензольних похідних (J. Chem. Soc, Perkin Транс. 1 (1988) 1939-1943, J. Med. Chem. 33 (1990) 2101-2108, J. Med. Chem. 43 (2000) 4084-4097, Bioorg. Med. Chem. 10 (2002) 3997-4004). Наприклад, регіоселективна функціоналізація похідних ортогідроксіаніліну описана у J. Org. Chem. 53 (1988) 4762-4769, JP 2003026630, Pharm. Chem. J. 36 (2002), 410-412. Сполуки загальної формули XV можна також отримати зазначеною вище цикло-конденсацією Ганцша, застосовуючи заміщені бензальдегіди загальної формули XXVII. Крім того, сполуки загальної формули XV, де R2=Вr, можна отримати реакцією Ганцша з альдегідами загальної формули XXVIII і потім орто-бромування отриманих фенолів і анілінів, подібно до отримання сполук формул Vc-d. Заміщені циклогексан-1,3-діони загальної формули VI є у продажу або їх можна отримати за відомими процедурами (див., наприклад,: J. Med. Chem. 43 (2000) 4678-4693, Tetrahedron 56 (2000) 4753-4758, J. Med. Chem. 35 (1992) 3429-3447, ibid. 24 (1981) 1026-1034, Org. Synt. Coll. Vol. V (1973) 400, Chem. Ber. 88 (1955) 316-327, Justus Liebig Ann. Chem. 570 (1950)15-31). Сполуки загальних формул IX - XTV і XVIII XXIII або є у продажу, або описані у літературі і можуть бути легко синтезовані. Бензальдегіди загальної формули VІІІ-а, де R2, 3 R , R4 і У є ідентичними визначеним вище, а X=О, можна легко отримати з бензальдегідів загальної формули XXV-a способами, описаними для перетворенн сполук формули V-a у l-s. Сполуки загальної формули ІІІ-b, де R2, R3, R4 i У є ідентичними визначеним вище, а X=N-R16, отримують з XXV-b способами, описаними для перетворення сполук формули V-b у l-t. Бензальдегіди загальних формул XVH-a-b отримують з альдегідів XXV-a-b реакцією з сполуками XVII - XXIII. Сполука формули VIll-а є у продажу, а сполуку Vl-b описано у літературі (Drug Dev. Res. 51 (2000) 225-232). 33 За такою ж схемою бензальдегіди загальних формул XVI-a-b i XXTV-a-b отримують з сполук загальних формул XXVTI-a-b. Бензальдегіди загальних формул XXV, XXVI, XXVII і XXVIII є у продажу, описані у літературі і можуть бути приготовлені (див., наприклад, J. Chem. Soc, Perkin Trans. 2 (2000) 1119-1124, J. Chem. Soc, 15 Chem. Commun. 4 (1993) 419-420, Synth. Conxmun. 20 (1990) 2659-2666, Chem. Pharm. Bull. 34 (1986) 121-129, Indian J. Chem. Sect. В 20 (1981) 1010-1013, Monatsh. Chem. 106 (1975) 1191-1201, DE 1070162, J. Org. Chem. 23 (1958) 120, Tetrahedron Lett. 25 (1984), 2901-2904, J. Org. Chem. 25 (1960), 2053-2055, J. Chem. Soc, Perkin Trans. 2(1992), 2235-2242. Крім того, бензальдегіди загальних формул 2 XXV-c і XXVII-c, де R є бромід, а Χ ε Ν-Η можна отримати бромуванням сполук загальної формули XXIX, застосовуючи процедури, описані для перетворення сполук загальної формули V-f у V-d. Сполуки загальної формули XXIX легко отримати з сполук загальної формули XXX, застосовуючи способи відновлення, описані для отримання сполук загальної формули ІІ-а з ІІ-е. Сполуки загальної формули XXX є у продажу, описані у літературі і можнуть бути легко отримані. Крім того, заміщені бензальдегіди загальних формул VIII, XVI, XVII, XXIV, XXV, XXVI, XXVII, XXVIII, XXIX, XXX можна отримати з відповідної бензойної кислоти XXXI або бензойних естерів загальної формули XXXII відомим відновленням. Окислення спиртів XXXIII добре відомими способами також дає бензальдегіди. Бензилброміди XXXIV, які можна отримати з відповідних толуольних похідних XXXV бензильним бромуванням, можуть бути перетворені у бензальдегіди відомими способами. Альдегіди можна також отримати видаленням захисту відповідних (циклічних) ацеталів загальної формули XXXVI. 92008 34 Сполуки винаходу мають щонайменше два хіральні атоми карбону і можуть існувати як чисті енантіомери або як суміш енантіомерів, або як суміш діастереомерів. Методи отримання чистих енантіомерів добре відомі, наприклад, кристалізацією солей, отриманих з оптично активних кислот і рацемічних сумішей або хроматографією на хіральних колонках. Для розділення діастереомерів можна використати прямо- або зворотнофазні колонки. Сполуки винаходу можуть утворювати гідрати або сольвати. Відомо, що заряджені сполуки утворюють гідратовані версії при ліофілізації водою або утворюють сольватовані версії при концентруванні у розчині з належним органічним розчинником. Сполуки винаходу включають гідрати або сольвати зазначених сполук. Було виявлено, що похідні 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну згідно з винаходом є агоністами рецептора FSH. Добре відомими є методи аналізів in vitro і in vivo для визначення зв'язування рецептора і визначення біологічної активності гонадотропінів. Взагалі експресований рецептор контактує з тестовою сполукою, і після цього виміряють зв'язування або стимуляцію, або пригнічення функціональної реакції. Для вимірювання функціональної реакції ізольовану ДНК, що кодує рецептор FSH, бажано, людського, експресують у придатних клітинах. Такими клітинами можуть бути клітини яєчника китайського хом'яка, хоча придатними можуть бути і інші клітини. Бажаними є клітини ссавців (Jia et al, MoLEndocrin., 5: 759-776, 1991). 35 Методи конструювання рекомбінантних ліній клітин, що експресують FSH є добре відомими (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, latest edition). Експресування рецептора здійснюють експресуванням ДНК, що кодує бажаний протеїн. Методи спрямованого на сайт мутагенезу, лігування додаткових послідовностей, PCR і конструювання придатних систем експресії є добре відомими. Частина ДНК або повна ДНК, що кодує бажаний протеїн, може бути конструйована синтетично стандартними твердофазними методами, бажано з включенням рестрикційних сайтів для полегшення лігування. У кодуючі послідовності ДНК можуть бути введені контрольні елементи для транскрипції і трансляції включених кодуючих послідовностей. Сучасні системи експресії є сумісними з різноманітними хазяями, включаючи прокаріоти, наприклад, бактерії, і еукаріоти, наприклад, дріжджі, клітини рослин, клітини комах, клітини ссавців і плазунів тощо. Потім клітини, що експресують рецептор, вводять у контакт з тестовою сполукою для спостереження зв'язування або стимуляції, або пригнічення функціональної реакції. В іншому варіанті ізольовані мембрани клітин, які містіть експресований рецептор, можуть бути використані для вимірювання зв'язування сполуки. Для вимірювання зв'язування можуть бути використані радіоактивні або флуоресцентні сполуки. Як еталон може бути використаний лідський рекомбінантний FSH. Можуть бути виконані порівняльні аналізи на зв'язування. Інший аналіз включає скринінг сполук-агоністів рецептора FSH через визначення стимуляції рецептора, опосередкованої сАМР. Такий метод включає експресування рецептора на поверхні хазяйської клітини і дію на клітину тестовою сполукою, після чого виміряють кількість сАМР. Рівень сАМР підвищиться стимулюючою дією тестової сполуки на зв'язування рецептора. На додаток до прямого вимірювання, наприклад, рівнів сАМР у цих клітинах можуть бути використані лінії клітин, які на додаток до трансфекції ДНК, що кодує рецептор, трансфектують також другою ДНК, що кодує ген репортера, експресія якого реагує на рівень сАМР. Такі репортерні гени можуть бути адаптованими до сАМР або можуть бути конструйовані таким чином, щоб приєднуватись до нових елементів реакції сАМР. Взагалі експресію репортерного гену можна контролювати будь-яким елементом реакції, який реагує на зміну рівнів сАМР. Придатними репортерними генами є, наприклад, LacZ, лужна фосфатаза, люцифераза світлячка і протеїн зеленої флюоресценції. Принципи такого трансактиваційного аналізу є добре відомими (див., наприклад, Stratowa, C, Himmler, Α., Czernilofsky, Α., (1995) Curr. Opin. Biotechnol. 6: 574. Винахід також стосується фармацевтичної композиції, що містить похідну 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну або її фармацевтично прийнятні солі загальної формули І у суміші з фармацевтично прийнятними допоміжними речо 92008 36 винами і, як варіант, з іншими терапевтичними агентами. Допоміжні речовини мають бути "прийнятними", тобто сумісними з іншими інгредієнтами композиції і не шкідливими для реципієнта. Композиції можуть бути придатними для перорального, під'язичного, підшкірного, внутрішньовенного, внутрішньом'язового, носового, локального або ректального введення у формі одиничних доз. Для перорального введення активний інгредієнт може бути у вигляді дискретних одиниць, наприклад, таблеток, капсул, порошків, гранул, розчинів, суспензій тощо. Для парентерального введення, фармацевтична композиція винаходу може мати форму однодозових або багатодозових контейнерів, наприклад, рідин для ін'єкції у заздалегідь визначеній кількості у герметичних флаконах або ампулах і можуть також зберігатись у висушеному заморожуванням стані (ліофілізованими) і потребувати лише додання стерильного водного носія, наприклад, води, перед використанням. У суміші з фармацевтично прийнятними допоміжними речовинами, наприклад, описаними у стандартному довіднику (Gennaro, A.R. et al., Remington: Science і Practice of Pharmacy (20th Edition, Lippincott Williams & Wilkins, 2000, Part 5: Farmaceutical Manufacturing) активний агент може бути спресований у тверді дозовані одиниці, наприклад, пігулки, таблетки або виготовлені у формі капсул або супозиторіїв. З фармацевтично прийнятними рідинами активний агент може мати форму рідкої композиції, наприклад, препаратів для ін'єкції, зокрема, розчинів, суспензій, емульсій або аерозолю, наприклад, носового. Для виготовлення твердих дозованих одиниць використовують звичайні добавки, наприклад, наповнювачі, барвники, полімерні зв'язуючі тощо. Взагалі може бути використана будь-яка фармацевтично прийнятна добавка, яка не порушує функцій активних сполук. Відповідні носії, з якими можна вводити активний агент винаходу у твердій композиції, включають лактозу, крохмаль, похідні целюлози тощо або їх суміші у належній кількості. Для парентерального введення можуть бути використані водні суспензії, ізотонічні сольові розчини і стерильні ін'єкційні розчини, які містять фармацевтично прийнятні диспергенти і/або зволожувачі, наприклад, пропіленгліколь або бутиленгліколь. Винахід включає описану вище фармацевтичну композицію у комбінації з пакувальним матеріалом, відповідним зазначеній композиції, разом з інструкціями з використання композиції згідно з описаним вище. Точна доза і режим введення активного інгредієнта або фармацевтичної композиції, що містить його, залежать від конкретної сполуки, способу введення і віку і стану пацієнта, якому вводять даний медикамент. Взагалі парентеральне введення потребує менших доз, ніж інші способи введення, що більше залежать від поглинання. Відповідні дози для людини можуть становити 0,05-25мг на кг маси тіла. Бажана доза може бути реалізована як єдина доза або декілька субдоз, які вводять з належним інте 37 рвалом протягом дня, або (у випадку реципієнтівжінок) як дози які мають бути введені з денним інтервалом протягом менструального циклу. Дози і режим введення можуть бути різними для жінок і чоловіків. Отже, сполуки згідно з винаходом можуть бути використані у терапії. Ще один аспект винаходу полягає у використанні похідної 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну загальної формули І у виготовленні медикаменту для лікування розладів, що викликаються порушеннями, опосередкованими рецептором FSH, бажано, для лікування розладів плодючості. Отже, пацієнтам, що потребують такого лікування, можна вводити відповідні кількості сполуки згідно з винаходом. Інший аспект винаходу полягає у використанні похідної 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну загальної формули І у виготовленні медикаменту для лікуванняі безплідності. Винахід ілюстровано наведеними далі прикладами. Приклади Загальні умови: Абревіатури: ДМА=Ν,Ν-диметиланілін, ДІПЕА=Ν,Ν-діізопропілетиламін, ТФК=трифлуороцтова кислота, HATU=гексафлуорфосфату O-(7азабензотріазол-1-іл)-N,N,N',N'-тетраметилуронію Fmoc=15 9-флуоренілметоксикарбоніл Fmoc-CI=9-флуоренілметоксикарбонілхлорид ДМФ=Ν,Ν-диметилформамід, ТГФ=тетрагідрофуран. Якщо не зазначено інше, всі кінцеві продукти наведених нижче прикладів ліофілізують з сумішей вода/1,4-діоксан, вода/трет-бутанол або вода/ацетонітрил. Якщо сполуку отримують як сіль ТФК, ТФК додають у належній кількості до розчинника перед ліофілізацією. Назви кінцевих продуктів у прикладах сформовані за допомогою програми Beilstein Autonom (ver. 2,02,304). Для визначення часів утримання використовують такі анілітичні методи РХВР: Спосіб 1: Колонка: 5мкм Luna C-18(2) 150 4,6мм; потік 1мл/хвил.; виявлення: 210нм; температура колонки 40°С; розчинник A: CH3CN/H2O=1/9 (об'єм/об'єм); розчинник В: CH3CN; розчинник С: 0,1Μ водна трифлуороцтова кислота; градієнт: розчинники А/В/С=65/30/5 до 10/85/5 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=10/85/5 (об'єм/об'єм/об'єм). Спосіб 2: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=75/20/5 до 15/80/5 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=10/85/5 (об'єм/об'єм/об'єм). Спосіб 3: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=95/0/5 до 15/80/5 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=15/80/5 (об'єм/об'єм/об'єм). 92008 38 Спосіб 4: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=60/40/0 до 0/100/0 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=0/100/0 (об'єм/об'єм/об'єм). Діастереомерне відношення (відношення діастереомерів) визначають, якщо основна сепарація окремих діастереомерів здійснюється належним методом аналітичної РХВР. В іншому варіанті, діастереомерне відношення визначають аналізом 1 Н ЯМР, ідентифікуючи відповідні діастереомери згідно з окремими сигналами. Отримані діастереомерні відношеня відповідають конфігураціям С-4 і С-7 ядра 1,4,5,6,7,8-гексагідрохіноліну. Очищення препаративною РХВР: Спосіб А: колонка Luna С-18, градієнт: 0,1% ТФК у H2OCH3CN (9/1, об'єм/об'єм)/СН3СN=80/20 до 0/100 (об'єм/об'єм) протягом 30-45хвил. залежно від зручності сепарації. Визначення: 210нм. Спосіб В: Колонка:=Luna С-18, градієнт: H2O/CH3CN (9/1, об'єм/об'єм)/СН3СN=80/20 до 0/100 (об'єм/об'єм) протягом 30-45хвил. залежно від зручності сепарації. Визначення: 210нм. Приклад 1. 4-[3-бром-4,5-біс-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (а) 3-бром-4,5-біс-(3-метокси-бензилокси)бензальдегід Суміш 5-бром-3,4-дигідроксибензальдегіду (100мг), 3-метоксибензилброміду (71мкл), карбонату калію (140мг) і йодиду тетрабутиламонію (10 15мг) у 5мл ДМФ перемішували при 60°С протягом 3год. Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 143мг. (b) 4-[3-бром-4,5-біс-(3-метокси-бензилокси)феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш 3-бром-4,5-біс-(3-метокси-бензилокси)бензальдегіду (143мг), 3-амінокротонітрилу (28мг), 5-пропілциклогексан-1,3-діону (52мг) в етанолі (10мл) перемішували при 80°С протягом 17год. Суміш концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/1 2/8 (об'єм/об'єм) як елюенті. Вихід 122мг. MS-ESI: [М+Н]+=657,4/659,4; анал. РХВР Rt=17,18хвил. (діаст. 1) Rt=17,43хвил. (діаст. 2) (спосіб 4). Відношення діастереомерів: 4:1. Приклад 2. 4-[3-бром-4-(3-метоксибензилокси)-5-нітро-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (а) 3-бром-4-гідрокси-5-нітро-бензальдегід 3-бром-4-гідроксибензальдегід (250мг) розчиняли у 5мл оцтової кислоти. Додавали нітритну кислот (52мкл) і суміш перемішували протягом 3год., протягом яких утворюється тверда речовина, яку відфільтровували, промивали водою і сушили у вакуумі. Вихід 249мг. MS-ESI: [М+Н]+=245,8/247,8. (b) 3-бром-4-(3-метокси-бензилокси)-5-нітробензальдегід До розчину 3-бром-4-гідрокси-5-нітробензальдегіду (87,4мг) у сухому ДХМ (7,5мл) додавали 3-піетоксибензиловий спирт (35мкл), три 39 фенілфосфін (103мг) і діетил-азодикарбоксилат (45мкл). Суміш перемішували в атмосфері нітрогену протягом 17год. і потім концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 9/1 1/1 (об'єм/об'єм) як елюенті. Вихід 50мг. (с) 4-[3-бром-4-(3-метокси-бензилокси)-5-нітрофеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш 3-бром-4-(3-метокси-бензилокси)-5нітро-бензальдегіду (50мг), 3-амінокрото-нітрилу (13мг) і 5-пропілциклогексан-1,3-діону (25мг) у 10мл етанолу перемішували при 80°С протягом 17год. Суміш концентрували у вакуумі, залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 8/2 1/1 (об'єм/об'єм) як елюенті. Вихід 50мг. MS-ESI: [М+Н]+=566,2/568,2; анал. РХВР Rt=22,66хвил. (спосіб 1). Відношення діастереомерів: 4:1. Приклад 3. 4-[3-аміно-5-бром-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Сполуку, описану у прикладі 2с (81мг)? розчиняли у ТГФ (10мл) і охолоджували до 0°С. Додавали оцтову кислоту (123мкл), потім цинковий пил (187мг). Після перемішування при кімнатній температурі протягом 1год. суміш розбавляли ДХМ і промивали насич. водн. NaHCO3 і розсолом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 15,3мг (сіль ТФК). + MS-ESI: [М+Н] =536,4/538,4; анал. РХВР: Rt=18,77хвил. (спосіб 1). Відношення діастереомерів: 5:1. Приклад 4. 4-[3-етокси-4-(3-метоксибензилокси)-5-нітро-феніл]-2-метил-5-оксо-7пропіл-1,4, 5,6,7,8-гексагідрохінолін-3-карбонітрил (а) 3-етокси-4-(3-метокси-бензилокси)-5-нітробензальдегід Суміш 5-нітро-3-етокси-4гідроксибензальдегіду (100мг), 3метоксибензилброміду (73мкл), карбонату калію (144мг) і йодиду тетрабутиламонію (10мг) у ДМФ (5мл) перемішували при 60°С протягом 90хвил. Суміш вливали у воду і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 2/1 (об'єм/об'єм) як елюенті. Вихід 43мг. (b) 4-[3-етокси-4-(3-метокси-бензилокси)-5нітро-феніл]-2-метил-5-оксо-7-пропіл-1.4,5,6,7.8гексагідро-хінолін-3-карбонітрил Суміш 3-етокси-4-(3-метокси-бензилокси)-5нітро-бензальдегіду (40мг), 3-амінокрото-нітрилу (10мг) і 5-пропілциклогексан-1,3-діону (19мг) в етанолі (2мл) перемішували при 80°С протягом 17год. Суміш концентрували у вакуумі, залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/1 (об'єм/об'єм) як елюенті. Вихід 50мг. MS-ESI: [М+Н]+=532,4; анал. РХВР: Rt=21,17хвил. (діаст. 1) Rt=21,55хвил. (діаст. 2.) (гетеро 1). Відношення діастереомерів: 4,5:1. 92008 40 Приклад 5. 4-[3-аміно-5-етокси-4-(3-[метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил До розчину сполуки, описаної у прикладі 4b (100мг), і оцтової кислоти (162мкл) у ТГФ (5мл), охолодженого до 0°С, додавали цинковий пил (246мг) з енергійним перемішуванням. Після перемішування протягом 30хвил. суміш фільтрували, потім розбавляли ДХМ і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 85мг (сіль ТФК). MS-ESI: [М+Н]+=502,4; анал. РХВР: Rt=15,28хвил. (діаст. 1) Rt=16,3 8хвил. (діаст. 2) (спосіб 2). Відношення діастереомерів 4:1. Приклад 6. N-[3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-2(3-метокси-бензилокси)-феніл]-бутирамід Суміш сполуки, описаної у прикладі 3 (100мг), бутирилхлориду (21мкл) і Ν,Νдіізопропілетиламіну (162мкл) у ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 52мг. MS-ESI: [М+Н]+=606,2/608,2; анал. РХВР: Rt=21,60хвил. (діаст. 1) Rt=21,99хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 4:1. Приклад 7. Метил-естер [3-бром-5-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8тетрагідрохінолін-4-іл)-2-(3-метокси-бензилокси)феніл]-карбмової кислоти Суміш сполуки, описаної у прикладі 3 (100мг), метилхлорформату (17мкл) і Ν,Νдіізопропілетиламіну (162мкл) у сухому ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 35мг. MS-ESI: + [М+Н] =594,2/596,2; анал. РХВР: Rt=20,33хвил. (діаст. 1) Rt=20,73хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 5:1. Приклад 8. N-[3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-метокси-бензилокси)-феніл]-2-метокси-ацетамід Суміш сполуки, описаної у прикладі 3 (100мг), метокси-ацетилхлориду (24,3мг) і Ν,Νдіізопропілетиламіну (162мкл) у ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 37мг. MS-ESI: [М+Н]+=608,2/610,2; анал. РХВР: Rt=19,99хвил. (діаст. 1) Rt=20,44хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 5:1. Приклад 9. [3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метокси-бензилокси)-феніл]-амід фуран-2карбонової кислоти Суміш сполуки, описаної у прикладі 3 (100мг), 2-фуроїлхлориду (28,9мг) і Ν,Νдіізопропілетиламіну (162мкл) у ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ 41 і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 92мг. MS-ESI: + [М+Н] =630,2/632,2; анал. РХВР: Rt=21,27хвил. (діаст. 1) 5 Rt= 21,75хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 5:1. Приклад 10. N-[3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-метокси-бензилокси)-феніл]-метансульфонамід Суміш сполуки, описаної у прикладі 3 (100мг), метансульфонілхлориду (22мкл) і піридину (46мкл) у ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 55мг. MS-ESI: [М+Н]+=614,2/616,2; анал. РХВР: Rt=18,24хвил. (спосіб 1). Відношення діастереомерів: 6:1. Приклад 11. 2-бром-4-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-нітрофеніл-естер 2-метокси-бензойної кислоти (а) 3-бром-4-гідрокси-5-нітро-бензальдегід До охолодженого розчину 3-бром-4гідроксибензальдегіду (5г) в оцтовій кислоті (50мл) додавали нітритну кислоту (1,17мл). Суміш залишили нагрітись до кімнатної температури. Після перемішування протягом 17год. утворений осад відфільтровували. Тверду речовину промивали водою і сушили у вакуумі. Вихід 3,7г. (b) 4-(3-бром-4-гідрокси-5-нітро-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6.7,8-гексагідрохінолін-3-карбонітрил Суміш 3-бром-4~гідрокси-5-нітробензальдегіду (2г), 3-імінокротонітрилу (667мг) і 5пропілциклогексан-1,3-діону (1,25г) в етанолі (75мл) нагрівали до дефлегмації протягом 17год. Суміш концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 1,8г. MS-ESI: [M+H]+=446,2/448,2. (c) 2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-нітро-фенілестер 2-метокси-бензойної кислоти Суміш 4-(3-бром-4-гідрокси-5-нітро-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу (200мг), Ν,Νдіізопропілетиламіну (390мкл) і 2-метоксибензоїлхлориду (53мкл) у ДХМ (4мл) перемішували протягом 4год. Суміш розбавляли ДХМ і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 90мг. MS-ESI: [М+Н]+=580,2/582,2; анал. РХВР: Rt=24,32хвил. (спосіб 2). Приклад 12. 4-[3-бром-5-ізопропіламіно~4-(3метокси-бензилокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил До суміш сполуки, описаної у прикладі 3 (100мг), оцтової кислоти (114мкл) і ацетону (20мкл) у 2мл ДХМ і 2мл метанолу додавали ціаноборогідрид натрію (25мг) у 1мл етанолу. Після перемішування протягом 17год. суміш розбавляли 92008 42 ДХМ і промивали водою. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 9/1 0/1 (об'єм/об'єм) як елюенті. Вихід 94мг. MS-ESI: [М+Н]+=578,4/580,4; анал. РХВР: Rt=23,34хвил. (діаст. 1) Rt=23,73хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 5:1. Приклад 13. 4-[3-бром-5-диметиламіно-4-(3метокси-бензилокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил До суміші сполуки, описаної у прикладі 3 (100мг), оцтової кислоти (114мкл у 2мл ДХМ) і 2мл метанолу додавали розчин 37% формальдегіду у метанолі (64мкл) і ціаноборогідрид натрію (16мг). Після перемішування протягом 17год. ДХМ видаляли у вакуумі, залишок охолоджували до 0°С, тверду речовину збирали фільтруванням, промивали холодним метанолом і очищали препаративною РХВР (Спосіб В). Вихід 90мг. MS-ESI: [M+H]+=564,4/566,4; анал. РХВР: Rt=16,18хвил. (діаст. 1) Rt= 16,71хвил. (діаст. 2) (спосіб 1). Відношення діастереомерів: 10:1. Приклад 14. [5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-3-етокси2-(3-метокси-бензилокси)-феніл]-амід пропан-1сульфонової кислоти (а) 3-етокси-4-гідрокси-5-нітро-бензальдегід До розчину 3-етокси-4-гідроксибензальдегіду (5г) в оцтовій кислоті (50мл) додавали нітритну кислоту (1,4мл) двома порціями. Утворену суспензію перемішували протягом 17год., тверду речовину збирали фільтруванням, промивали водою і сушили у вакуумі. Вихід 5,07г. (b) 4-(3-етокси-4-гідрокси-5-нітро-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш 3-етокси-4-гідрокси-5-нітробензальдегіду (1,5г), 3-амінокротонітрилу (584мг) і 5-пропілциклогексан-1,3-діону (1,09г) в етанолі (60мл) нагрівали при дефлегмації протягом 17год. Суміш концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 1,3г. MS-ESI: [M+H]+=412,3. (c) 4-[3-етокси-4-(3-метокси-бензилокси)-5нітро-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш 4-(3-етокси-4-гідрокси-5-нітро-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрилу (1,5г), 3метоксибензилброміду (2,56мл), гідроксиду калію (450мг) і хлориду бензилтріетиламонію (415мг) у 60мл ДХМ і 60мл води перемішували протягом 48год. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 7/3 4/6 (об'єм/об'єм) як елюенті. Вихід 1,2г. MS-ESI: [М+Н]+=532,3. (d) 4-[3-аміно-5-етокси-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Розчин 4-[3-етокси-4-(3-метокси-бензилокси)5-нітро-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрилу і оцтової кислоти (1,3мл) у ТГФ (33мл) охолоджували до 0°С. З енергійним перемішуванням додавали порціями цин 43 ковий пил (3,02г), суміш залишили досягти кімнатної температури і потім перемішували протягом 1год. Суміш фільтрували і концентрували у вакуумі. Залишок розчиняли у ДХМ і промивали насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 1,1г. MS-ESI: [Μ+H]+=502,3. (e) [5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-3-етокси-2-(3метокси-бензилокси)-феніл]-амід пропан-1сульфонової кислоти До розчину 4-[3-аміно-5-етокси-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу (220мг) і піридину (106мкл) у ДХМ (5мл) додавали пропан-1-сульфонілхлорид (94мг). Після перемішування протягом 17год. суміш розбавляли ДХМ і екстрагували водою і насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 41мг. MS-ESI: [М+Н]+=608,4; анал. РХВР: Rt=20,50хвил. (спосіб 1). Відношення діастереомерів: 5:1 Приклад 15. N-[3-бром-5-[3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-метокси-бензиламіно)-феніл]метансульфонамід (а) 4-аміно-3-нітро-бензальдегід 4-флуор-3-нітробензальдегід (3г) повільно додавали до 50мл конц. водн. NH4OH. Після перемішування протягом 3год. суміш розбавляли водою і екстрагували ДХМ. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагель у гептан/етилацетат 1/0 0/1 (об'єм/об'єм), як елюенті. Вихід 2,1г. MS-ESI: [M+H]+=167,2. (b) 4-аміно-3-бром-5-нітро-бензальдегід 4-аміно-3-нітро-бензальдегід (2,1г) розчиняли у 25мл ДХМ. Додавали бром (2мл) і оцтову кислоту (1мл) і суміш перемішували протягом 2год. при кімнатній температурі. Суміш розбавляли етилацетатом і промивали водн. NaHSO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 2,5г. MS-ESI: [М+Н]+=245,0/247,0. (с) 4-(4-аміно-3-бром-5-нiтро-феніл)-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Суміш 4-аміно-3-бром-5-нітро-бензальдегіду (665мг), 3-амінокротонітрилу (223мг), 5пропілциклогексан-1,3-діону (418мг) у 50мл етанолу перемішували при 80°С протягом 4год., потім при кімнатній температурі протягом 16год. Реакційну суміш концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 680мг. MS-ESI: [М+Н]+=445,2/447,2. (d) 4-(3,4-діаміно-5-бром-феніл)-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил 4-(4-аміно-3-бром-5-нітро-феніл)-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3 92008 44 карбонітрил (600мг) розчиняли у ТГФ (150мл) і охолоджували до 0°С. Додавали оцтову кислоту (1,3мл) і потім цинковий пил (2г). Утворену суспензію перемішували при 0°С протягом 2год. і потім ще 4год. при кімнатній температурі. Суміш фільтрували і розбавляли насичен водн. NaHCO3, потім екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагель у гептан/етилацетат 3/1 0/1 (об'єм/об'єм) як елюенті. Вихід 316мг. MS-ESI: [M+H]+=415,2/417,2. (е) 9Н-флуорен-9-іл-метил-естер[2-аміно-3бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-феніл]карбамової кислоти 4-(3,4-діаміно-5-бром-феніл)-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (316мг) і Ν,Ν-диметиланілін (195мкл) розчиняли у ДХМ (40мл) і охолоджували до 0°С. Краплями додавали розчин 9-флуоренілметилхлорформату (187мг) у ДХМ (3мл). Після перемішування протягом 2год. реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 381мг. (f) 9Н-флуорен-9-іл-метил-естер [3-бром-5-(3ціано-2-метил-5-оксо-7-пропіл-1.4,5,6,7,8гексагідрохінолін-4-іл)-2-(3-метокси-бензиламіно)феніл]-карбамової кислоти До розчину 9Н-флуорен-9-іл-метил-естеру [2аміно-3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідро-хінолін-4-іл)-феніл]карбамової кислоти у метанолі (5мл) додавали оцтову кислоту (143мкл) і m-анісальдегід (304мкл). Після перемішування протягом 2год. додавали ціаноборогідрид натрію (158мг). Утворену суміш перемішували протягом 3год. і потім гасили водою, екстрагували етилацетатом, органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 145мг. MS-ESI: [М+Н]+=757,6/759,6. (g) 4-[3-аміно-5-бром-4-(3-метоксибензиламіно)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил 9Н-флуорен-9-іл-метил-естер [3-бром-5-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-2-(3-метокси-бензиламіно)феніл]-карбамової кислоти (145мг) розчиняли у 20% піперидину у ДМФ (5мл) і перемішували протягом 1год. Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 70мг. MS-ESI: [М+Н]+=535,4/537,4. (h) N-[3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метокси-бензиламіно)-феніл]-метансульфонамід До розчину 4-[3-аміно-5-бром-4-(3-метоксибензиламіно)-феніл]-2-метил-5-оксо-7-пропіл 45 1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу (70мг) і піридину (40мкл) у 1мл ДХМ додавали порціями метансульфонілхлорид (50мкл) до повного перетворення, яке було підтверджене ТШХ (елюент: гептан/етилацетат 1/1, об'єм/об'єм). Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 18мг (сіль ТФК). MS-ESI: [М+Н]+=613,4/615,4; анал. РХВР: Rt=21,27 25хвил. (спосіб 2). Приклад 16. Метил-естер 3-бром-5-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-2-(3-нітро-бензилокси)бензойної кислоти (a) метил-естер 5-срорміл-2-гідроксибензойної кислоти 5-форміл-2-гідрокси-бензойну кислоту (11,3г) розчиняли у метанолі (35мл) і конц. сульфатній кислоті (3мл). Суміш нагрівали при дефлегмації протягом 40год. Додавали діетилетер і суміш вливали у воду. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок розчиняли у суміші діоксану 5 (80мл) і води (50мл) і обробляли 6Н гідрохлорною кислотою (2,5мл). Через 15хвил. діоксан видаляли у вакуумі, суміш екстрагували етилацетатом, органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 8,23г. MS-ESI: [M+H]+=181,2. (b) метил-естер 3-бром-5-форміл-2-гідроксибензойнох кислоти До розчину метил-естеру 5-форміл-2-гідроксибензойної кислоти (7,93г) в оцтовій кислоті (50мл) і ДХМ (40мл), охолодженого до 0°С, додавали бром (2,49мл). Після перемішування протягом 17год. суміш залишали досягти кімнатної температури. Додавали ацетат натрію (3,61г) і перемішували ще 1год. Суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід + 11,88г. MS-ESI: [М+Н] =259,0/261,0. (c) метил-естер 3-бром-5-форміл-2-(3-нітробензилокси)-бензойної кислоти Суміш метил-естеру 3-бром-5-форміл-2гідрокси-бензойної кислоти (518мг), карбонату калію (613мг), йодиду тетрабутиламонію (68мг) і броміду 3-нітробензилу (525мг) у ДМФ (10мл) нагрівали при 60°С протягом 5год. Суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 851мг. MS-ESI: [М+Н]+=394,0/396,0. (d) метил-естер 3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-нітро-бензилокси)-бензойної кислоти Суміш метил-естеру 3-бром-5-форміл-2-(3нітро-бензилокси)-бензойної кислоти (788 30мг), 3амінокротонітрилу (165мг) і 5-пропілциклогексан1,3-діону (308мг) в етанолі (5мл) нагрівали при 80 С протягом 17год. Суміш концентрували у вакуумі і залишок очищали препаративною РХВР (Спосіб В). Вихід 1,37г. MS-ESI: [М+Н]+=594,4/596,4; анал. РХВР: Rt=24,59хвил. (діаст. 1) Rt=24,89хвил. (діаст. 2) (спосіб 2). 92008 46 Приклад 17. {3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2[(піридин-3-ілметил)-аміно]-феніл}-амід пропан-1сульфонової кислоти (а) [2-аміно-3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-феніліамід пропан-1-сульфонової кислоти Сполуку, описану у прикладі 15d (4г), розчиняли у 250мл ДХМ. Додавали піридин (1,5мл), потім краплями розчин пропансульфонілхлориду (1,03мл) у 50мл ДХМ. Суміш перемішували протягом 17год. і потім промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 5,44г. MS-ESI: [M+H]+=521,4/523,4. (b) {3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-[(піридин-3ілметил)-аміно]-феніл)-амід пропан-1-сульфонової кислоти [2-аміно-3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-феніл]амід пропан-1-сульфонової кислоти (842мг) і оцтову кислоту (950мкл) розчиняли у метанолі (25мл). Додавали 3-піридин-карбоксальдегід (1,52мл) і утворену суміш перемішували протягом 17год. Додавали ціаноборогідрид натрію (1,02г) і перемішували ще 17год. Суміш розбавляли етилацетатом і промивали водною лимонною кислотою і водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід + 237мг (сіль ТФК). MS-ESI: [M+H] =612,4/614,4; анал. РХВР: Rt=8,79хвил. (спосіб 2). Приклад 18. 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метокси-бензилокси)-N-пропіл-бензамід Суміш сполуки, описаної у прикладі 22с (100мг), n-пропіламіну (145мкл), TBTU (75мг) і Ν,Νдіізопропілетиламіну (31мкл) у ДХМ (10мл) перемішували протягом 65год. Суміш розбавляли ДХМ і екстрагували насич. водним NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 41мг. MS-ESI: [М+Н]+=605,4/607,4; анал. РХВР: Rt=26,72хвил. (діаст. 1) Rt=27,01хвил. (діаст. 2) (спосіб 2). Приклад 19. 4-{[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл-6(пропан-1-сульфоніламіно)-феніламіно]-метил}-N(2-метокси-етил)-бензамід (а) 4-{[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан1-сульфоніламіно)-феніламіно]-метил}-бензойна кислота Суміш сполуки, описаної у прикладі 17а (600мг), бензойної кислоти-4-карбоксальдегіду (863мг) і оцтової кислоти (657мкл) у метанолі (5мл) перемішували протягом 1год. Додавали ціаноборогідрид натрію (361мг) і суміш перемішували протягом 17год. Реакційну суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 605мг. MS-ESI: [М+Н]+=655,4/657,4. (b) 4-{[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан 47 1-сульфоніламін)-феніламіно]-метил} N-(2метокси-етил)-бензамід Суміш 4-{[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан1-сульфоніламіно)-феніламіно]-метил}-бензойної кислоти (200мг), TBTU (300мг), Ν,Νдіізопропілетиламіну (536мкл) і 2метоксиетиламіну 30 (134мкл) у ДМФ (2мл) перемішували протягом 2год. при кімнатній температурі. Суміш розбавляли етилацетатом і промивали водним. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі, залишок очищали препаративною РХВР (Спосіб В). Вихід 115мг. MS-ESI: [M+H]+=712,4/714,4; анал. РХВР: Rt=17,99хвил. (спосіб 2). Приклад 20. 4-{[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніламіно]-метил}-N[2-(1Н-імідазол-4-іл)-етил]-бензамід Конденсацію гістаміну (283мг) і сполуки, описаної у прикладі 19а (200мг), у присутності TBTU (300мг) і Ν,Ν-діізопропілетиламіну (536мкл) проводили способом, описаним у прикладі 19b. Вихід 123мг (сіль ТФК). MS-ESI: [M+H]+=748,4/750,4; анал. РХВР: Rt=10,38хвил. (спосіб 2). Приклад 21. 4-[3-бром-4-(3-метоксибензилокси)-5-(морфолін-4-карбоніл)-феніл]-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш сполуки, описаної у прикладі 22с (100мг), морфоліну (50мкл), HATU (100мг) і Ν,Νдіізопропілетиламіну (92мкл) у ДХМ (5мл) перемішували протягом 17год. Суміш розбавляли ДХМ і екстрагували насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі Залишок очищали препаративною РХВР (Спосіб В). Вихід 54мг MS-ESI [М+Н]+=634,4/636,4, анал. РХВР Rt=21,32хвил (спосіб 2). Приклад 22 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метокси-бензилокси)-бензамід (a) метил-естер 3-бром-5-форміл-2-(3-метоксибензилокси)-бензойної кислоти Суміш сполуки, описаної у прикладі 16b (4,62г), 3-метоксибензилброміду (3,03мл), карбонату калію (5,47г) і йодиду тетрабутиламонію (606мг) у ДМФ (90мл) перемішували при 60°С протягом 5год. Суміш вливали у воду i екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували i концентрували у вакуумі. Залишок перекристалізовували з етанолу i діетилетеру (1/1, об'єм/об'єм) Вихід 5,65г. (b) метил-естер 3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-метокси-бензилокси)-бензойної кислоти Суміш метил-естеру 3-бром-5-форміл-2-(3метокси-бензилокси)-бензойної кислоти (3,78г), 3амінокротонітрилу (822мг) i 5-пропілциклогексан1,3-діону (1535мг) в етанолі (25мл) перемішували при 80°С протягом 17год. i суміш концентрували у вакуумі. Вихід 5,9г. (с) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-метоксибензилокси)-бензойна кислота 92008 48 Розчин метил-естеру 3-бром-5-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-2-(3-метокси-бензилокси)бензойної кислоти (5,7г) у діоксані (135мл) i 1Н NaOH (15мл) перемішували протягом 17год. Суміш підкислювали конц оцтовою кислотою i екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували i концентрували у вакуумі. Залишок розчиняли в етанолі i потім концентрували до осадження твердого продукту, який збирали фільтруванням i промивали петролейним етером. Вихід 4,2г. MS-ESI [M+H]+=563,6/565,2. (d) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-метоксибензилокси)-бензамід Суміш 3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метокси-бензилокси)-бензойної кислоти (57мг), хлориду амонію (18мг), HATU (57мг) i Ν,Νднзопропілетиламіну (34мкл) у ДМФ (0,8мл) перемішували протягом 17год. Суміш розбавляли водою i екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 29мг MS-ESI [М+Н]+=564,4/566,4, анал. РХВР R, 19,64хвил. (спосіб 2). Приклад 23 N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-3-метоксибензамід Розчин сполуки, описаної у прикладі 17а (229мг) i Ν,Ν-диметиланіліну (480мг) у ТГФ (4мл) обробляли 75мкл 3-метоксибензоілхлориду. Після перемішування протягом 17год. суміш розбавляли етилацетатом i промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 151мг. MS-ESI: [М+Н]+=655,4/657,4; анал. РХВР: Rt=20,82хвил. (спосіб 2). Приклад 24. N-[3-бром-5-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2(3-метансульфоніламіно-бензилокси)-феніл]метансульфонамід (а) 3-бром-4-гідрокси-5-нітро-бензальдегід До розчину 3-бром-4-гідрокси-бензальдегіду (20г) в оцтовій кислоті (200мл) додавали димлячу нітритну кислоту (4,18мл). Утворену суспензію перемішували протягом 3год., тверду речовину збирали фільтруванням. Додавали ще 420мкл димлячої нітритної кислоти. Через 45хвил. додавали воду і утворений осад збирали фільтруванням. Об'єднані тверді продукти промивали водою і сушили у вакуумі. Вихід 18,26г. MS-ESI: [М+Н]+=245,8/247,8. (b) 4-(3-бром-4-гідрокси-5-нітрофеніл)-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Суміш 3-бром-4-гідрокси-5-нітро-бензальдегіду (18,26г), 3-амінокротонітрилу (6,09г) і 5пропілциклогексан-1,3-діону (11,45г) в етанолі (250мл) перемішували при 80°С протягом 17год. Суміш концентрували у вакуумі, залишок очищали хроматографією на силікагелі у суміші ДХМ як елюенті. Вихід 16,49г. MS-ESI: [M+H]+=446,2/448,2. 49 (с) 4-(3-амiно-5-бром-4-гідрокси-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил До розчину 4-(3-бром-4-гідрокси-5-нітрофеніл)-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрилу (15,8г) і оцтової кислоти (30мл) у ТГФ (300мл), додавали порціями цинковий пил (46г) з енергійним перемішуванням. Через 2год. суміш фільтрували і концентрували до утворення осаду, який збирали фільтруванням і промивали етанолом. Вихід 9,27г. MS-ESI: [M+H]+=416,2/418,2. (d) 4-[3-аміно-5-бром-4-(3-нітро-бензилокси)феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідро-хінолін-3-карбонітрил Суміш 4-(3-аміно-5-бром-4-гідрокси-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрилу (5г), 3нітробензилброміду (2,72г), карбонату калію (3,65г) і йодиду калію (400мг) у ДМФ (100мл) перемішували протягом 65год. при кімнатній температурі. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 1,45г. MS-ESI: [М+Н]+=551,4/553,4. (е) N-[3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-[3-нітробензилокси)-феніл]-метансульфонамід Розчин 4-[3-аміно-5-бром-4-(3-нітробензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилу (1,15г) і тріетиламіну (740мкл) у ДХМ (20мл) обробляли метансульфонілхлоридом (203мкл). Після перемішування протягом 18год. суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Сиру похідну Ν,Ν-біс-метансульфоніланіліну розчиняли у ТГФ (20мл) і обробляли 2N NaOH (3мл). Через 2год. суміш гасили насич. водним NH4CI і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 950мг. MS-ESI: [М+Н]+=629,2/631,2. (f) N-[2-(3-аміно-бензилокси)-3-бром-5-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-феніл]-метансульфонамід Суміш N-[3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-нітробензилокси)-феніл]-метансульфонаміду (950мг) і сульфіду натрію (350мг) в етанолі (12мл) і воді (250мкл) нагрівали при дефлегмації протягом 2год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 709мг. + MS-ESI: [М+Н] =599,2/601,2. (g) N-[3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3метансульфоніламіно-бензилокси)-феніл]метансульфонамід До розчину N-[2-(3-аміно-бензилокси)-3-бром5-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8 92008 50 гексагідрохінолін-4-іл)-феніл]-метансульфонаміду (709мг) і піридину (286мкл) у ДХМ (20мл) додавали метансульфонілхлорид (138мкл). Після перемішування протягом 18год. суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 172мг. MS-ESI: [М+Н]+=677,2/679,2; анал. РХВР: Rt=22,37хвил. (спосіб 3). Приклад 25. 4-[3-бром-5-ціано-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Розчин сполуки, описаної у прикладі 22d (54мг), у ДХМ (1,2мл) охолоджували до 0°С. Додавали тріетиламін (58мкл), потім краплями додавали трифлуороцтовий ангідрид (25мкл). Суміш залишали досягти кімнатної температури і додавали тріетиламін (58мкл) і трифлуороцтовий ангідрид (25мкл). Після перемішування протягом 1год. суміш екстрагували водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 26мг. MS-ESI: [M+H]+=546,2/548,2; анал. РХВР: Rt=24,86хвил. (спосіб 2). Приклад 26. N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-N-(3-метоксибензил)-ацетамід (а) [3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-метоксибензиламіно)-феніл]-амід пропан-1-сульфонової кислоти Конденсацію сполуки, описаної у прикладі 17а (688мг) з m-анісальдегідом (605мкл) у присутності оцтової кислоти (570мкл) і ціаноборогідриду натрію (317мг) у метанолі (6мл) проводили, як описано у прикладі 17b. Вихід 300мг. MS-ESI: [М+Н]+=641,4/643,4. (b) N-[2-бром-4-(3-цiано-2-метил-5-оксо-7пропiл-1,4,5,6,7,8-гексагідрохiнолiн-4-iл)-6-(пропан1-сульфоніламіно)-феніл]-N-(3-метокси-бензил)ацетамід Розчин пропан-1-сульфонової кислоти [3бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-метоксибензиламіно)-феніл]-амід (120мг) у піридині (3мл) обробляли оцтовим ангідридом (153мкл). Після перемішування протягом 17год. суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 27мг. MS-ESI: [М+Н]+=683,2/685,2; анал. РХВР: Rt=21,09хвил. (спосіб 2). Приклад 27. {3-бром-5-[3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2[(3-метокси-бензил)-метил-аміно]-феніл}-амід пропан-1-сульфонової кислоти Суміш сполуки, описаної у прикладі 26а (180мг), 37% формальдегіду у воді (230мкл) і оцтову кислоту (160мкл) у метанолі (5мл) перемішували протягом 2год. Додавали ціаноборогідрид натрію (176мг) і перемішували ще 17год. Суміш розбавляли етилацетатом і промивали водою. 51 Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 17мг. MS-ESI: [M+H]+=675,2/677,2; анал. РХВР: Rt=28,11хвил. (спосіб 2). Приклад 28. пропан-1-сульфонової кислоти [3бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(3-метоксибензиламіно)-феніл]-метил-амід Суміш сполуки, описаної у прикладі 26а (180мг), метилйодиду (19мкл) і карбонату калію (19мг) у ДМФ (1мл) перемішували протягом 65год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 31мг. MSESI: [M+H]+=655,4/657,4; анал. РХВР: Rt=25,00хвил. (спосіб 2). Приклад 29. N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-нікотинамід Суміш сполуки, описаної у прикладі 17а (100мг), TBTU (123мг), нікотинової кислоти (47мг) і Ν,Ν-діізопропілетиламіну (168мкл) у 2мл ДХМ і 2мл ТГФ перемішували протягом 65год. Суміш розбавляли ДХМ і екстрагували водою і насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 74мг (сіль ТФК). MS-ESI: [M+H]+=626,4/628,4; анал. РХВР: Rt=12,03 5хвил. (спосіб 2). Приклад 30. N-(2-{[2-бром-4-(3-ціано-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)6-(пропан-1-сульфонілааміно)-феніламіно]-метил}феніл)-ацетамід (а) [3-бром-5-(3-цiано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(2-нітробензиламіно)-феніл]-амід пропан-1-сульфонової кислоти Конденсацію сполуки, описаної у прикладі 17а (1,05г) з 2-нітробензальдегідом (1,61г) у присутності оцтової кислоти (1,21мл) і ціаноборогідриду натрію (1,34г) у метанолі (25мл) проводили, як описано у прикладі 17b. Вихід 1,21г. MS-ESI: [М+Н]+=676,2/678,2. (b) [2-(2-аміно-бензиламіно)-3-бром-5-(3-ціано2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-феніл]-амід пропан-1сульфонової кислоти [3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(2-нітробензиламіно)-феніл]-амід пропан-1-сульфонової кислоти (1,21г) і оцтову кислоту (1,6мл) розчиняли у ТГФ (150мл). Додавали цинковий пил (2,32г) з енергійним перемішуванням. Через 3год. суміш фільтрували, потім розбавляли етилацетатом і промивали насич. водн. NaHCO3. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 430мг. MS-ESI: [М+Н]+=626,4/628,4. (с) N-(2-{[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан1-сульфоніламіно)-феніламіно]-метил}-феніл)ацетамід 92008 52 Розчин [2-(2-амінобензиламіно)-3-бром-5-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-феніл]-аміду пропан-1сульфонової кислоти (430мг) і Ν,Νдіізопропілетиламіну (120мкл) у 1,2-дихлорпропані (50мл) охолоджували до 0°С і обробляли ацетилхлоридом (49 (мкл) у 1,2-дихлорпропані (15мл). Після перемішування протягом 2год. суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 45мг (сіль ТФК). MS-ESI: [М+Н]+=668,2/670,2; анал. РХВР: Rt=18,91хвил. (спосіб 2). Приклад 31. Метил-естер (2-{[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-(пропан-1сульфоніламіно)-феніламіно]-метил}-феніл)карбамової кислоти До розчину сполуки, описаної у прикладі 30b (100мг), у ДХМ 15 (5мл) додавали Ν,Νдіізопропілетиламін (84мкл) і метилхлорформат (12мкл). Після перемішування протягом 17год. суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 19мг (сіль ТФК). MS-ESI: [М+Н]+=684,2/686,2; анал. РХВР: Rt=17,90 20хвил. (спосіб 2). Приклад 32. N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-3-(2-піперазин1-іл-ацетиламіно)-бензамід (а) N-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан1-сульфоніламіно)-фенілі-3-нітро-бензамід До розчину сполуки, описаної у прикладі 17а (400мг), і Ν,Ν-диметиланіліну (350мкл) у ТГФ (10мл) додавали 3-нітробензоїлхлорид (150мкл). Суміш перемішували протягом 17год., потім вливали у воду і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/3 (об'єм/об'єм) як елюенті. Вихід 412мг. MS-ESI: [М+Н]+=670,2/672,2. (b) 3-аміно-N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-бензамід До розчину N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-3-нітробензаміду (412мг) і оцтової кислоти (520мкл) у ТГФ (10мл), охолодженого до 0°С, додавали цинковий пил (810мг) з енергійним перемішуванням. Після перемішування протягом 4год. суміш фільтрували і концентрували у вакуумі. Залишок розчиняли у ДХМ і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 257мг. MS-ESI: [М+Н]+=640,4/642,4. (с) N-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гекгагідрохінолін-4-іл)-6-(пропан1-сульфоніламіно)-феніл]-3-(2-хлор-ацетиламіно)бензамід 53 До розчину 3-аміно-N-[2-бром-4-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-(пропан-1-сульфоніламіно)-феніл]бензаміду (257мг) у ТГФ (6мл), додавали Ν,Νдіізопропілетиламін (205мкл) і хлорацетилхлорид (50мкл). Суміш перемішували протягом 17год., потім розбавляли ДХМ і екстрагували водою і насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 287мг. MS-ESI: [М+Н]+=716,2/718,2. (d) N-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл-6-(пропан1-сульфоніламіно)-феніл]-3-(2-піперазин-1-ілацетиламіно)-бензамід До розчину N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6(пропан-1-сульфоніламіно)-феніл]-3-(2-хлорацетиламіно)-бензаміду (143мг) у ДХМ (4мл) додавали піперазин (172мг). Суміш перемішували протягом 17год., потім розбавляли ДХМ і екстрагували насич. водн. NaHCO3. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 18мг (сіль ТФК). MS-ESI: [М+Н]+=766,4/768,4; анал. РХВР: Rt=4,87хвил. (спосіб 2). Приклад 33. 4-[3-бром-5-(2-гідрокси-етокси)-4(3-метокси-бензилокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (а) 3-бром-5-гідрокси-4-(3-метоксибензилокси)-бензальдегід Суміш 3-бром-4,5-дигідрокси-бензальдегіду (1г), карбонату літію (314мг), 3метоксибензилхлориду (742мкл) і каталітичної кількості йодиду тетрабутиламонію у ДМФ (5мл) перемішували при 60°С протягом 17год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 1,48г. MS-ESI: [M+H]+=337,2/339,2. (b) 4-[3-бром-5-гідрокси-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш 3-бром-5-гідрокси-4-(3-метоксибензилокси)-бензальдегіду (1,43г), 3амінокротонітрилу (350мг) і 5-пропілциклогексан1,3-діону (654мг) в етанолі (100мл) нагрівали при 80°С протягом 17год. Суміш концентрували у вакуумі і очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як елюенті. Вихід 1,31г. MS-ESI: [М+Н]+=537,2/539,2. (с) 4-[3-бром-5-(2-гідрокси-етокси)-4-(3метокси-бензилокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш 4-[3-бром-5-гідрокси-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (100мг), 2-брометанолу (16 рі), йодиду тетрабутиламонію (5мг) і карбонату калію (50мг) у ДМФ (2мл) перемішували при 70°С протягом 17год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 36мг. MS-ESI: 92008 54 [М+Н]+=581,4/583,4; анал. РХВР: Rt=20,57хвил. (діаст. 1) 5 Rt=20,91хвил. (діаст. 2) (спосіб 2). Приклад 34. 4-[3-бром-4-(3-метоксибензилокси)-5-(2-метокси-етокси)-феніл]-2-метил5-оксо-7-пропіл-14,5,6,7,8-гексагідрохінолін-3карбонітрил Алкілування сполуки, описаної у прикладі 33b (100мг), з 2-метоксиброметаном (22мкп), карбонатом калію (50мг) і йодидом тетрабутиламонію (5мг) у ДМФ (2мл) проводили способом, описаним у прикладі 33с. Вихід 48мг. MS-ESI: [M+H]+=595,2/597,2; анал. РХВР: Rt=24,72хвил. (діаст. 1) Rt=25,08хвил. (діаст. 2) (спосіб 2). Приклад 35. 4-[3-бром-5-гідрокси-4-(3-метоксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил 100мг сполуки, описаної у прикладі 33b, очищали препаративною РХВР (Спосіб В). Вихід 54мг. MS-ESI: [M+H]+=537,4/539,4; анал. РХВР: Rt=21,85хвил. (спосіб 2). Приклад 36. 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-N,Nдіетил-2-(піридин-3-ілметокси)-бензолсульфонамід (а) 3-бром-5-(3-ціано-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-N,N-діетил-2гідрокси-бензолсульфонамід Суміш сполуки, описаної у прикладі 37b (1,5г), і діетиламіну (3,1мл) у діоксані (30мл) перемішували протягом 17год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. + Вихід 1,43г. MS-ESI: [М+Н] =536,2/538,2. (b) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-N,N-діетил-2(піридин-3-ілметокси)-бензолсульфонамід Суміш 3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-N,Nдіетил-2-гідрокси-бензолсульфонаміду (1,43г), 3піколілхлориду (689 nig), карбонату калію (774мг) і йодиду калію (93мг) у ДМФ (40мл) перемішували при 70°С протягом 2год. і потім при кімнатній температурі протягом 17год. Суміш розбавляли етилацетат і екстрагували водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 991мг (сіль ТФК). MS-ESI: [М+Н]+=627,2/629,2; анал. РХВР: Rt=17,36хвил. (спосіб 3). Приклад 37. 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-Nметил-2-(піридин-3-ілметокси)-бензолсульфонамід (а) 4-(3-бром-4-гідрокси-феніл)-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Суміш 3-бром-4-гідрокси-бензальдегіду (13,07г), 5-пропілциклогексан-1,3-діону (10,02г) і 3амінокротонітрилу (5,34г) в етанолі (165мл) перемішували при 80°С протягом 17год. Осад збирали фільтруванням, фільтрат концентрували у вакуумі і потім розтирали з етилацетатом. Тверді продукти об'єднували і сушили у вакуумі. Вихід 20,25г. MSESI: [М+Н]+=401,2/403,2. (b) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-гідроксибензолсульфонілхлорид 55 До 47мл хлорсульфонової кислоти, охолодженої до -10°С у балоні під тиском в атмосфері нітрогену, повільно додавали 4-(3-бром-4-гідроксифеніл)-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (20,25г). Суміш залишили досягти кімнатної температури і після перемішування протягом 17год. вливали у 800мл подрібненого льоду і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок перетирали з етилацетатом, тверді продукти збирали і сушили у вакуумі. Вихід 23,7г. MS-ESI: [M+H]+=499,0/501,0. (c) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-гідрокси-Nметил-бензолсульфонамід Протягом 30хвил. моно-метиламін пропускали бульбашками через розчин 3-бром-5-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохіноліну-4-іл)-2-гідроксибензолсульфонілхлориду (240мг) у діоксані (5мл). Суміш перемішували протягом 17год., потім розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 60мг. MS-ESI: [M+H]+=494,2/494,2. (d) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-N-метил-2(піридин-3-ілметокси)-бензолсульфонамід Суміш 3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2гідрокси-N-метил-бензолсульфонаміду (52мг), 3піколілхлориду, HCL (24мг) і карбонату калію (88мг) у ДМФ (2мл) нагрівали при 70°С протягом 2год., потім при кімнатній температурі протягом 17год. Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 15,5мг (сіль ТФК). MS-ESI: + [М+Н] =585,2/587,2; анал. РХВР: Rt=8,73хвил. (діаст. 1) Rt=9,44хвил. (діаст. 2) (спосіб 2). Відношення діастереомерів: 10:1. Приклад 38. 4-[3-бром-5-гідрокси-4-(піридин-3ілметокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил (а) 3-бром-5-гідрокси-4-(піридин-3-ілметокси)бензальдегід Суміш 3-бром-4,5-дигідрокси-бензальдегіду (1г), 3-піридинкарбінолу (448мкл), діізопропілазодикарбоксилату (DIAD) (908мкл) і трифенілфосфіну на полімері (1,53г, 3ммоль/г) у ТГФ (50мл) перемішували в атмосфері нітрогену протягом 17год. Суміш фільтрували, потім розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 1/0 0/1 (об'єм/об'єм) як + елюенті. Вихід 330мг. MS-ESI: [М+Н] =308,2/310,2. (b) 4-[3-бром-5-гідрокси-4-піридин-3ілметокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш 3-бром-5-гідрокси-4-(піридин-3ілметокси)-бензальдегіду (165мг), 3амінокротонітрилу (44мг) і 5-пропілциклогексан 92008 56 1,3-діону (83мг) в етанолі (25 20мл) перемішували при 80°С протягом 17год. Суміш концентрували у вакуумі і залишок перекристалізовували з ацетонітрилу. Вихід 105мг (сіль ТФК). MS-ESI: + [M+H] =508,4/510,4; анал. РХВР: Rt=7,65хвил. (спосіб 2). Приклад 39. 4-[3-бром-5-флуорметокси-4(піридин-3-ілметокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш сполуки, описаної у прикладі 38b (700мг), бром-флуор-метану (1557мг) і карбонату калію (761мг) у ДМФ (10мл) у балоні під тиском перемішували протягом 20год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі у суміші гептан/етилацетат 2/8 (об'єм/об'єм) як елюенті. Вихід 842мг (сіль ТФК). MS-ESI: [M+H]+=540,2/542,2; анал. РХВР: Rt=5,84хвил. (спосіб 1). Відношення діастереомерів: 7:1. Приклад 40. 4-[3-бром-5-(2,2-дифлуор-етокси)4-(піридин-3-ілметокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил Суміш сполуки, описаної у прикладі 38b (150мг), 2,2-дифлуор-1-брометану (86мг), карбонату калію (82мг) і каталітичної кількості йодиду тетрабутиламонію у ДМФ (5мл) перемішували при 40°С протягом 17год. Суміш розбавляли етилацетатом і промивали водою. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб А). Вихід 113мг (сіль ТФК). MS-ESI: [М+Н]+=572,2/574,2; анал. РХВР: Rt=10,99хвил. (спосіб 2). Приклад 41. 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-N,Nдиметил-2-(тіазол-4-ілметокси)бензолсульфонамід (а) 3-бром-5-(3-цiано-2-метил-5-оксо-7-пропiл1,4,5,6,7,8-гексагідро-хiнолiн-4-iл)-2-гідрокси-N,Nдиметил-бензолсульфонамід Протягом 30хвил. диметиламін бульбашками пропускали через розчин сполуки, описаної у прикладі 37b (4,1г), у діоксані (85мл). Суміш розбавляли водою і ДХМ. У водному шарі утворився осад, який збирали фільтруванням і сушили у вакуумі. Вихід 2,19г. MS-ESI: [М+Н]+=508,2/510,2. (b) 3-бром-5-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідро-хiнолiн-4-iл)-N,N-диметил-2(тіазол-4-ілметокси)-бензолсульфонамід Суміш 3-бром-5-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2гідрокси-N,N-диметил-бензолсульфонаміду (200мг), карбонату калію (109мг), йодиду калію (5мг) і 4-хлорметил-тіазолу. НСІ (71мг) у ДМФ (4,5мл) нагрівали при 60°С протягом 6год. Суміш розбавляли водою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В). Вихід 110мг. MS-ESI: [М+Н]+=605,2/607,2; анал. РХВР: Rt=19,62хвил. (спосіб 2). Приклад 42. 3-бром-5-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-2-(2,5 57 92008 диметил-2Н-піразол-3-ілметокси)-N,N-диметилбензолсульфонамід Суміш сполуки, описаної у прикладі 41а (153мг), карбонату калію (125мг) і 5-хлорметил1,3-диметил-1Н-піразолу (55мг) у ДМФ (1,4мл) нагрівали при 60°С протягом 3год. Суміш розбавляли 1Н гідрохлорною кислотою і екстрагували етилацетатом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (Спосіб В), потім хроматографією на оксиді алюмінію з етилацетатом як елюентом. Вихід 51мг. MS-ESI: [М+Н]+=616,2/618,2; анал. РХВР: Rt=18,40хвил. (спосіб 2). Приклад 43 Агоністична активність сполук до рецептора FSH людини, експресованого у клітинах СНО Агоністичну активність сполук до рецептора FSH людини досліджували на клітинах яєчника китайського хом'яка (СНО), стабільно трансфектованих людським рецептором FSH і співтрансфек Комп’ютерна верстка Т. Чепелева 58 тованих реактивним елементом сАМР (СРЕ)/промотером, що спрямовує експресію репортерного гену люциферази світлячка. Зв'язування сполуки до G-сполученого рецептора FSH підвищує сАМР, що у свою чергу викликає підвищену трансактивацію репортерного конструкта люциферази. Активність люциферази виміряли лічильником люмінесценції. Сполуки випробували при концентраціях від 0,1нМ 10мкм. Цим аналізом визначали ЕК5о (концентрація тестової сполуки, яка викликає напівмаксимальну (50%) стимуляцією люциферази) і ефективність сполуки порівняно з рекомбінантним людським FSH. Для цього використовували програму XLfit (Excel, version 2,0, built 30, ID Business Solution Limited). Сполуки всіх прикладів мали активність (ЕК50) нижче 5 10-6М. Деякі сполуки, зокрема, у прикладах 2,10,17,19, 20, 24, 30-32, 36, 37 і 39-42 показали ЕК50 менше 10-6М. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-phenyl-5-oxo-l,4,5,6,7,8-hexahydroquinoline derivatives as medicaments for the treatment of infertility
Автори англійськоюTimmers Cornelis Marius, Karstens Willem Frederik Johan, Grima Poveda Pedro Manuel
Назва патенту російською4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолинпроизводные для лечения бесплодия
Автори російськоюТиммерс Корнелис Мариус, Карстенс Виллем Фредерик Йоган, Грима Поведа Педро Мануэл
МПК / Мітки
МПК: C07D 215/20, C07D 417/12, C07D 405/12, C07D 401/12, A61K 31/47, A61K 31/4709, A61P 5/24
Мітки: 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохінолінпохідні, безплідності, лікування
Код посилання
<a href="https://ua.patents.su/29-92008-4-fenil-5-okso-145678-geksagidrokhinolinpokhidni-dlya-likuvannya-bezplidnosti.html" target="_blank" rel="follow" title="База патентів України">4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохінолінпохідні для лікування безплідності</a>
Попередній патент: Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності
Наступний патент: Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності
Випадковий патент: Спосіб відновлення юбки поршня












