Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності
Номер патенту: 92007
Опубліковано: 27.09.2010
Автори: ріма Поведа Педро Мануел, Карстенс Віллем Фредерік Йоган, Тіммерс Корнеліс Маріус
Формула / Реферат
1. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну загальної формули
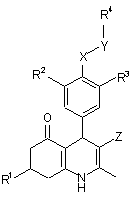 , Формула І
, Формула І
або її фармацевтично придатна сіль,
де
R1 - (1-6С)алкіл, (2-6С)алкеніл або (2-6С)алкініл;
R2, R3 є незалежно галоген, (1-4С)алкіл, (2-4С)алкеніл, (2-4С)алкініл, (1-4С)алкокси, (3-4С)алкенілокси або (3-4С)алкінілокси;
R4 - феніл або (2-5С)гетероарил, заміщені обидва R7 і, як варіант, заміщені на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкокси, (1-4С)алкілтіо і (ді)(1-4С)алкіламіно;
R7 - Н, (1-4С)алкілтіо, (1-4С)алкілсульфоніл, (ді)(1-4С)алкіламіно, R8R9-аміно,R10R11-амінокарбоніл, R12R13-аміно(1-4C)алкілкарбоніламіно, R14R15-аміно-(1-4C)алкіл, R16-окси, R17R18-амінокарбоніл(1-4С)алкокси, R19-оксі(1-4C)алкіл, R19-оксикарбоніл(1-4C)алкіл, R20R21-аміносульфоніл, R20-oкcиcyльфoнiл, аміноімінометил, (ді)(1-4С)алкіламіноімінометил або (2-6С)гетероциклоалкілімінометил, трифлуорметилсульфоніл; R23-оксикарбоніл, R23-карбоніл або R23R24-амінокарбоніл;
R8 - H aбo(1-4C)aлкiл;
R9 - (1-4С)алкілсульфоніл, (1-6С)алкілкарбоніл, (2-6С)алкенілкарбоніл, (2-6С)-алкінілкарбоніл, (3-6С)циклоалкілкарбоніл, (3-6С)циклоалкіл(1-4С)алкілкарбоніл, (1-4С)-алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (3-4С)алкінілоксикарбоніл, (ді)(1-4С)алкіламінокарбоніл, (2-6С)гетероциклоалкілкарбоніл, (5-8С)алкіл, (3-6С)циклоалкіл, (3-6С)-циклоалкіл(1-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, (2-6С)гетероциклоалкіл(2-4С)алкіл або фенілкарбоніл, фенілсульфоніл, феніл(1-4С)-алкоксі(1-4С)алкілкарбоніл, феніл(1-4С)алкіл, (2-5С)гетероарилкарбоніл, (2-5С)гетероарилсульфоніл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкокси або (ді)(1-4С)алкіламіно;
R10 - Н або(1-4С)алкіл;
R11 - гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл або (ді)(1-4С)алкіламіно(2-4С)алкіл; або
R10, R11 у R10R11-амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
R12, R13 є незалежно Н, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)-циклоалкіл, гідроксі(2-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл, (3-6С)циклоалкіл(1-4С)алкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл, аміно(2-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл або феніл(1-4С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або
R12, R13 у R12R13-аміно(1-4C)алкілкарбоніламіно можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
R14, R15 є незалежно Н, (1-6С)алкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл, (3-6С)циклоалкіл-(1-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл, гідроксі(2-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, аміно(2-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (1-6С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ді)(1-4С)алкіламінокарбоніл, (2-6С)гетероциклоалкілкарбоніл або (2-5С)гетероарил(1-4С)алкіл, феніл(1-4С)алкіл, (2-5С)гетероарилкарбоніл, фенілкарбоніл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу або (1-4С)алкокси, (ді)(1-4С)алкіламіно; або
R14, R15 у R14R15-аміно(1-4C)алкілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
R16 - (2-6С)гетероциклоалкіл(1-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, (2-4С)алкоксі(1-4С)алкіл, гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, гідроксикарбоніл(1-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (3-4С)алкінілоксикарбоніл, (ді)(1-4С)алкіламінокарбоніл, (2-6С)гетероциклоалкілкарбоніл або феніл(1-4С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно;
R17, R18 є незалежно Н, (1-6С)алкіл, (3-6С)циклоалкіл(1-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл, гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, (2-6С)гетероциклоалкіл(2-4С)алкіл або феніл(1-4С)алкіл, (2-5С)-гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або
R17, R18 у R17R18-амінокарбоніл(1-4C)алкокси можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
R19 - Н або (1-6С)алкіл;
R20, R21 є незалежно Н, (1-6С)алкіл, (1-6С)алкеніл, (1-6С)алкініл або (1-4С)-алкоксі(1-4С)алкіл; або
R20, R21 у R20R21-aмiнocyльфoнiлi можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
X - О або N-R22;
Y - CH2, C(O) aбo SO2;
Z - CN або NO2;
R22 - H, (1-4С)алкіл;
R23, R24 є незалежно Н, (1-4С)алкіл, (2-4С)алкеніл, (2-4С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл(1-4С)алкіл, (2-6С)гетероциклоалкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (ді)(1-4С)алкіламінокарбоніл(1-4С)алкіл або феніламінокарбоніл(1-4С)алкіл, (2-5С)гетероариламінокарбоніл(1-4С)алкіл, феніл, (2-5С)гетероарил, феніл(1-4С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений при (гетеро)атомі одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або
R23, R24 у R23R24-амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу;
за умови, що сполуки формули І, в яких X є О, R4 є феніл, a R7 вибрано з Н, (1-4С)алкілтіо, (1-4С)алкілсульфонілу, ді(1-4С)алкіламіно, R23-оксикарбонілу, R23-карбонілу і R23R24-амінокарбонілу, і сполуки формули І, в яких X є О, R4 є (2-5С)гетероарил і R7 є Н або (ді)(1-4С)алкіламіно, виключено.
2. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 1, яка відрізняється тим, що R1 є (1-6С)алкіл.
3. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-2, яка відрізняється тим, що R2 є галоген.
4. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-3, яка відрізняється тим, що R3 є (1-4С)алкокси.
5. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-4, яка відрізняється тим, що Z є CN.
6. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-5, яка відрізняється тим, що X є О.
7. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-6, яка відрізняється тим, що Y є СН2.
8. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-7, яка відрізняється тим, що R7 є R8R9-aміно, R10R11-амінокарбоніл, R12R13-аміно(1-4C)алкілкарбоніламіно, R14R15-аміно-(1-4С)алкіл або R17R18-амінокарбоніл(1-4C)алкокси.
9. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-8, яка відрізняється тим, що:
R8 є H;
R9 є (1-4С)алкілсульфоніл, (1-6С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ді)(1-4С)алкіламінокарбоніл, (2-6С)гетероциклоалкілкарбоніл або фенілкарбоніл, феніл(1-4С)алкоксі(1-4С)алкілкарбоніл, (2-5С)гетероарилкарбоніл, (2-5С)гетероарилсульфоніл або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)алкокси;
R10 є H або(1-4С)алкіл;
R11 є гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл або (ді)(1-4С)алкіламіно(2-4С)алкіл; або
R10R11 у R10R11-амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу;
R12, R13 є незалежно Н, (1-6С)алкіл, (3-6С)циклоалкіл, гідроксі(2-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл або (ді)(1-4С)алкіламіно(2-4С)алкіл або феніл(1-4С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або
R12R13 у R12R13-аміно(1-4C)алкілкарбоніламіно можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу або гідроксі(1-4С)алкілу;
R14, R15 є незалежно Н, (1-6С)алкіл, гідроксі(2-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (1-6С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (2-5С)гетероарил(1-4С)алкіл, (2-5С)гетероарилкарбоніл або фенілкарбоніл;
R16 є (2-6С)гетероциклоалкіл(1-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, (2-4С)алкоксі(1-4С)алкіл, гідроксикарбоніл(1-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл або феніл(1-4С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)алкокси;
R17, R18 є незалежно Н, (1-6С)алкіл, (3-6С)циклоалкіл(1-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл або (2-6С)гетероциклоалкіл(2-4С)алкіл, або феніл(1-4С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або
R17R18 у R17R18-амінокарбоніл(1-4C)алкокси можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу або гідроксі(1-4С)алкілу.
10. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 8, яка відрізняється тим, що R7 є R8R9-аміно.
11. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за п. 10, яка відрізняється тим, що R8 є Н і R9 є (1-4С)алкілсульфоніл.
12. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну або її фармацевтично прийнятна сіль, вибрана з групи, яку складають:
N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-3,4,5-триметоксибензамід;
N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-2-[(піридин-4-ілметил)-аміно]-ацетамід;
N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-2-[4-(2-гідроксіетил)-піперазин-1-іл]-ацетамід;
4-{3-бром-4-[3-(3,6-дигідро-2Н-піридин-1-карбоніл)-бензилоксі]-5-етоксифеніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил;
3-[біс-(2-метилоксіетил)-аміно]-N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-пропіонамід;
2-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гeкcaгiдpoxiнoлiн-4-iл)-6-eтoкcифeнoкcимeтил]-фeнoкcи}-N,N-димeтилaцeтaмiд;
4-{3-бром-5-етокси-4-[3-(2-морфолін-4-іл-2-оксоетокси)-бензилокси]-феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил;
{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-амід фуран-2-карбонової кислоти;
N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-акриламід;
{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-амід циклопропанкарбонової кислоти;
метилестер 2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}- карбамінової кислоти;
1-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-3-метилсечовина;
метилестер {3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-піридин-2-іл}-карбамінової кислоти;
4-(3-бром-5-етоксі-4-{3-[(1Н-імідазол-4-ілметил)-аміно]-бензилокси}-феніл)-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил;
N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-метансульфонамід;
алілестер {4-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-карбамінової кислоти;
4-[3-бром-5-етокси-4-(1-метансульфоніл-1Н-пірол-2-ілметокси)-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил;
4-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N-метилбензамідин;
4-{3-бром-5-етокси-4-[(піридин-3-ілметил)-аміно]-феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил;
N-(2-{[2-бром-4-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеніламіно]-метил}-феніл)-метансульфонамід;
4-{3-бром-4-[2-(циклопропілметиламіно)-бензилоксі]-5-етоксифеніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрилабо
N-{2-[2-бром-4-((4R,7S)-3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-4,5-дифлуорфеніл}-метансульфонамід.
13. Похідна 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-12, призначена для застосування у терапії.
14. Фармацевтична композиція, яка містить похідну 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-12 і фармацевтично придатні допоміжні речовини.
15. Застосування похідної 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп. 1-12 або її фармацевтично прийнятних солі або сольвату у виготовленні медикаменту для лікування розладів плодючості.
Текст
1. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну загальної формули 2 (19) 1 3 никами, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (14С)алкокси або (ді)(1-4С)алкіламіно; R10 - Н або(1-4С)алкіл; 11 R - гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (14С)алкоксі(2-4С)алкіл або (ді)(1-4С)алкіламіно(24С)алкіл; або R10, R11 у R10R11-амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, заміщеному одним або більше замісниками, вибраними з (14С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(14С)алкілу; R12, R13 є незалежно Н, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)-циклоалкіл, гідроксі(24С)алкіл, (1-4С)алкоксі(2-4С)алкіл, (36С)циклоалкіл(1-4С)алкіл, (26С)гетероциклоалкіл(1-4С)алкіл, аміно(2-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл або феніл(14С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або R12, R13 у R12R13-аміно(1-4C)алкілкарбоніламіно можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або у (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу; 14 15 R , R є незалежно Н, (1-6С)алкіл, (26С)гетероциклоалкіл(1-4С)алкіл, (3-6С)циклоалкіл(1-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл, гідроксі(24С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, аміно(24С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (16С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (14С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ді)(1-4С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл або (25С)гетероарил(1-4С)алкіл, феніл(1-4С)алкіл, (25С)гетероарилкарбоніл, фенілкарбоніл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу або (1-4С)алкокси, (ді)(1-4С)алкіламіно; або R14, R15 у R14R15-аміно(1-4C)алкілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(14С)алкілу і гідроксі(1-4С)алкілу; R16 - (2-6С)гетероциклоалкіл(1-4С)алкіл, (ді)(14С)алкіламіно(2-4С)алкіл, (2-4С)алкоксі(14С)алкіл, гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, гідроксикарбоніл(1-4С)алкіл, (14С)алкоксикарбоніл(1-4С)алкіл, (14С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (3-4С)алкінілоксикарбоніл, (ді)(14С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл або феніл(14С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, 92007 4 аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (1-4С)алкіламіно; R17, R18 є незалежно Н, (1-6С)алкіл, (36С)циклоалкіл(1-4С)алкіл, (1-4С)алкоксі(24С)алкіл, гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (ді)(1-4С)алкіламіно(2-4С)алкіл, (26С)гетероциклоалкіл(2-4С)алкіл або феніл(14С)алкіл, (2-5С)-гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або R17, R18 у R17R18-амінокарбоніл(1-4C)алкокси можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу; R19 - Н або (1-6С)алкіл; R20, R21 є незалежно Н, (1-6С)алкіл, (1-6С)алкеніл, (1-6С)алкініл або (1-4С)-алкоксі(1-4С)алкіл; або R20, R21 у R20R21R-aмiнocyльфoнiлi можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(14С)алкілу і гідроксі(1-4С)алкілу; X - О або N-R22; Y - CH2, C(O) aбo SO2; Z - CN або NO2; 22 R - H, (1-4С)алкіл; R23, R24 є незалежно Н, (1-4С)алкіл, (2-4С)алкеніл, (2-4С)алкініл, (3-6С)циклоалкіл, (36С)циклоалкіл(1-4С)алкіл, (2-6С)гетероциклоалкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл, (14С)алкоксикарбоніл(1-4С)алкіл, (ді)(14С)алкіламінокарбоніл(1-4С)алкіл або феніламінокарбоніл(1-4С)алкіл, (25С)гетероариламінокарбоніл(1-4С)алкіл, феніл, (25С)гетероарил, феніл(1-4С)алкіл, (25С)гетероарил(1-4С)алкіл, як варіант, заміщений при (гетеро)атомі одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкокси і (ді)(1-4С)алкіламіно; або R23, R24 у R23R24-амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкоксі(1-4С)алкілу і гідроксі(1-4С)алкілу; за умови, що сполуки формули І, в яких X є О, R4 є феніл, a R7 вибрано з Н, (1-4С)алкілтіо, (14С)алкілсульфонілу, ді(1-4С)алкіламіно, R2323 23 24 оксикарбонілу, R -карбонілу і R R амінокарбонілу, і сполуки формули І, в яких X є О, R4 є (2-5С)гетероарил і R7 є Н або (ді)(14С)алкіламіно, виключено. 2. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.1, яка відрізняється тим, що R1 є (1-6С)алкіл. 5 3. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-2, яка відрізняється тим, що R2 є галоген. 4. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-3, яка відрізняється тим, що R3 є (1-4С)алкокси. 5. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-4, яка відрізняється тим, що Z є CN. 6. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-5, яка відрізняється тим, що X є О. 7. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-6, яка відрізняється тим, що Y є СН2. 8. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-7, яка відрізняється тим, що R7 є R8R9-aміно, R10R11амінокарбоніл, R12R13-аміно(111 15 4C)алкілкарбоніламіно, R R -аміно-(1-4С)алкіл або R17R18-амінокарбоніл(1-4C)алкокси. 9. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-8, яка відрізняється тим, що: R8 є H; R9 є (1-4С)алкілсульфоніл, (1-6С)алкілкарбоніл, (36С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (34С)алкенілоксикарбоніл, (ді)(14С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл або фенілкарбоніл, феніл(1-4С)алкоксі(1-4С)алкілкарбоніл, (25С)гетероарилкарбоніл, (25С)гетероарилсульфоніл або (2-5С)гетероарил(14С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)алкокси; R10 є H або(1-4С)алкіл; R11 є гідроксі(2-4С)алкіл, аміно(2-4С)алкіл, (14С)алкоксі(2-4С)алкіл або (ді)(1-4С)алкіламіно(24С)алкіл; або 10 11 10 11 R R у R R -амінокарбонілі можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу; R12, R13 є незалежно Н, (1-6С)алкіл, (36С)циклоалкіл, гідроксі(2-4С)алкіл, (1-4С)алкоксі(24С)алкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл або (ді)(1-4С)алкіламіно(2-4С)алкіл або феніл(14С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або R12R13 у R12R13-аміно(1-4C)алкілкарбоніламіно можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу або гідроксі(1-4С)алкілу; R14, R15 є незалежно Н, (1-6С)алкіл, гідроксі(24С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (16С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (14С)алкоксикарбоніл, (2-5С)гетероарил(1-4С)алкіл, (2-5С)гетероарилкарбоніл або фенілкарбоніл; 92007 6 R16 є (2-6С)гетероциклоалкіл(1-4С)алкіл, (ді)(14С)алкіламіно(2-4С)алкіл, (2-4С)алкоксі(14С)алкіл, гідроксикарбоніл(1-4С)алкіл, (14С)алкоксикарбоніл(1-4С)алкіл або феніл(14С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)алкокси; R17, R18 є незалежно Н, (1-6С)алкіл, (36С)циклоалкіл(1-4С)алкіл, (1-4С)алкоксі(2-4С)алкіл або (2-6С)гетероциклоалкіл(2-4С)алкіл, або феніл(1-4С)алкіл, або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або R17R18 у R17R18-амінокарбоніл(1-4C)алкокси можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу або гідроксі(1-4С)алкілу. 10. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.8, яка відрізняється тим, що R7 є R8R9-аміно. 11. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за п.10, яка відрізняється тим, що R8 є Н і R9 є (1-4С)алкілсульфоніл. 12. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну або її фармацевтично прийнятна сіль, вибрана з групи, яку складають: N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-3,4,5триметоксибензамід; N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-2-[(піридин-4ілметил)-аміно]-ацетамід; N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-2-[4-(2-гідроксіетил)піперазин-1-іл]-ацетамід; 4-{3-бром-4-[3-(3,6-дигідро-2Н-піридин-1-карбоніл)бензилоксі]-5-етоксифеніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил; 3-[біс-(2-метилоксіетил)-аміно]-N-{3-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етоксифеноксиметил]феніл}-пропіонамід; 2-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гeкcaгiдpoxiнoлiн-4-iл)-6eтoкcифeнoкcимeтил]-фeнoкcи}-N,Nдимeтилaцeтaмiд; 4-{3-бром-5-етокси-4-[3-(2-морфолін-4-іл-2оксоетокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-амід фуран-2карбонової кислоти; N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-акриламід; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6 7 92007 8 етоксифеноксиметил]-феніл}-амід циклопропанкарбонової кислоти; метилестер 2-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}- карбамінової кислоти; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-3-метилсечовина; метилестер {3-[2-бром-4-(3-ціано-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-піридин-2-іл}-карбамінової кислоти; 4-(3-бром-5-етоксі-4-{3-[(1Н-імідазол-4-ілметил)аміно]-бензилокси}-феніл)-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил; N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-метансульфонамід; алілестер {4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-феніл}-карбамінової кислоти; 4-[3-бром-5-етокси-4-(1-метансульфоніл-1Н-пірол2-ілметокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил; 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-N-метилбензамідин; 4-{3-бром-5-етокси-4-[(піридин-3-ілметил)-аміно]феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил; N-(2-{[2-бром-4-(3-ціано-2-метил-5-оксо7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеніламіно]-метил}-феніл)метансульфонамід; 4-{3-бром-4-[2-(циклопропілметиламіно)бензилоксі]-5-етоксифеніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил або N-{2-[2-бром-4-((4R,7S)-3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етоксифеноксиметил]-4,5-дифлуорфеніл}метансульфонамід. 13. Похідна 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну за будь-яким з пп.1-12, призначена для застосування у терапії. 14. Фармацевтична композиція, яка містить похідну 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп.1-12 і фармацевтично придатні допоміжні речовини. 15. Застосування похідної 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну за будь-яким з пп.112 або її фармацевтично прийнятних солі або сольвату у виготовленні медикаменту для лікування розладів плодючості. Винахід стосується похідних 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну, фармацевтичної композиції, що містить їх і застосування зазначені похідних у виготовленні медикаментів для лікування безплідності. Гонадотропіни грають важливу роль у різних функціях тіла, включаючи метаболізм, терморегуляцію і репродуктивний процес. Гонадотропіни діють на певні типи гонадних клітин, ініціюючи цим оварійну і тестикулярну диференціацію і стероїдогенез. Слизовий гонадотропін FSH (гормон стимуляції фолікул), наприклад, грає головну роль у стимуляції розвитку і дозрівання фолікул, a LH (гормон лютеїнізації) викликає овуляцію (Sharp, R.M. Clin Endocrinol. 33: 787-807, 1990; Dorrington and Armstrong, Recent Prog. Horm. Res. 35: 301342,1979). Наразі FSH застосовують у клініці для оваріальної стимуляції, тобто оваріальної гіперстимуляції для запліднення in vitro (TVF) і індукування овуляції у безплідних ановуляторних жінок (Insler, V., Int. J. Fertility 33: 85-97, 1988, Navot and Rosenwaks, J. Vitro Fert. Embryo Transfer 5: 3-13, 1988), а також при чоловічому гіпогадизму і безплідності. Гонадотропін FSH вивільняється з переднього гіпофізу під впливом гормону, що вивільняє гонадотропін і естрогени, і з плаценти під час вагітності. У жінок FSH діє на яєчник, сприяючи розвитку фолікул і є головним гормоном, що регулює секрецію естрогенів. У чоловіків FSH відповідає за цілісність насіннєносних трубочок і діє на клітини Сертолі, сприяючи гаметогенезу. Очищений FSH використовують клінічно для лікування безплідності у жінок і деяких типів порушення спе рматогенезу у чоловіків. Гонадотропін, призначений для терапевтичних цілей може бути ізольований з сечі людини, але з низькою чистотою (Morse et al, Amer. J. Reproduct. Immunol, and Microbiology 17: 143, 1988). Вони також можуть бути приготовлені як рекомбінантні гонадотропіни. Рекомбінантний людський FSH є у продажу і використовується для сприяння репродукції (Olijve et al. МоІ. Hum. Reprod. 2: 371,1996; Devroey et al. Lancet 339: 1170, 1992). Дія гормону FSH опосередковується специфічним рецептором плазмової мембрани, який є членом великої родини рецепторів, сполучених з G-протеїнам. Ці рецептори складаються з одиночних поліпептидів з 7 трансмембранними доменами і можуть взаємодіяти з G-протеїнами, викликаючи активацію аденілатциклази. Рецептор FSH є високоспецифічним об'єктом у процесі росту оваріальних фолікул і експресується виключно у яєчнику. Блокування цього рецептора або пригнічення сигналів, що звичайно відбувається після активації опосередкованого FSH рецептора, порушує розвиток фолікули і, отже, овуляцію і плідність. Низькомолекулярні антагоністи FSH можуть бути основою нових контрацептивів, а низькомолекулярні агоністи FSH можуть бути використані у тих же клінічних застосуваннях, як і природний FSH, тобто для лікування безплідності і гіперстимуляції яєчника при заплідненні in vitro. Низькомолекулярні міметики FSH з агоністичними властивостіми були описані у заявках WO 2000/08015 і WO 2002/09706. 9 Деякі похідні тетрагідрохіноліну були описані у заявці WO 2003/004028 як модулятори FSH з агоністичними або антагоністичними властивостями. Залишається потреба у низькомолекулярних гормономіметиках, здатних селективно активувати рецептор FSH. Винахід стосується похідних 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну загальної формули І або їх фармацевтично придатних солей, де R1 - (1-6С)алкіл, (2-6С)алкеніл або (26С)алкініл; R2, R3 є незалежно галоген, (1-4С)алкіл, (24С)алкеніл, (2-4С)алкініл, (1-4С)алкокси, (34С)алкенілокси або (3-4С)алкінілокси; R4 є феніл або (2-5С)гетероарил, заміщені обидва R7 і, як варіант, заміщені на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (14С)алкокси, (1-4С)алкілтіо і (ди)(1-4С)-алкіламіно; R7 - Н, (1-4С)алкілтіо, (1-4С)алкілсульфоніл, (ди)(1-4С)алкіламіно, R8R9-аміно,R10R11амінокарбоніл, R12R13-аміно(114 15 4С)алкілкарбоніламіно, R R -аміно-(1-4C)алкіл, R16-окси, R17R18-амінокарбоніл(1-4С)алкокси, R19окси(1-4C)алкіл, R19-оксикарбоніл(1-4С)алкіл, 20 21 R R -аміносульфоніл, R20-oкcиcyльфoнiл, аміноімінометил, (ди)(1-4С)алкіламіноімінометил або (26С)гетероциклоалкілімінометил, трифлуорметилсульфоніл; R23-оксикарбоніл, R23-карбоніл або R23R24-амінокарбоніл; R8-Набо(1-4С)алкіл; R9 (1-4С)алкілсульфоніл, (16С)алкілкарбоніл, (2-6С)алкенілкарбоніл, (2-6С)алкінілкарбоніл, (3-6С)циклоалкілкарбоніл, (36С)циклоалкіл (1-4С)алкілкарбоніл, (1-4С)алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (34С)алкінілоксикарбоніл, (ди)(14С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл, (5-8С)алкіл, (36С)циклоалкіл, (3-6С)-циклоалкіл(1-4С)алкіл, (ди)(1-4С)алкіламіно(2-4С)алкіл, (2-6С)гетероциклоалкіл(2-4С)алкіл або фенілкарбоніл, фенілсульфоніл, феніл(1-4С)-алкокси(14С)алкілкарбоніл, феніл(1-4С)алкіл, (25С)гетероарилкарбоніл, (25С)гетероарилсульфоніл, (2-5С)гетероарил(14С)алкіл, як варіант, заміщений на (гетеро)ароматичн кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (14С)алкокси або (ди)(1-4С)-алкіламіно; R10 - Н або (1-4С)алкіл; 92007 10 R11 - гідрокси(2-4С)алкіл, аміно(2-4С)алкіл, (14С)алкокси(2-4С)алкіл або (ди)-(1-4С)алкіламіно(2-4С)алкіл; або R10, R11 у R10R11-амінокарбоніл можуть бути з'єднані у (4-6С)гетероциклоалкенільньному кільці або у (2-6С)гетероциклоалкільному кільці, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкокси(1-4С)алкілу і гідрокси(1-4С)алкілу; R12, R13 є незалежно Н, (1-6С)алкіл, (26С)алкеніл, (2-6С)алкініл, (3-6С)-циклоалкіл, гідрокси(2-4С)алкіл, (1-4С)а]кокси(2-4С)алкіл, (36С)циклоалкіл-(1-4С)-алкіл, (2-6С)гетероциклоалкіл(1-4С)алкіл, аміно(2-4С)алкіл, (ди)(1-4С)алкіламіно-(2-4С)алкіл або феніл(14С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (ди)(1-4С)алкіламіно; або R12, R13 у R12R13-аміно(14С)алкілкарбоніламіно можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або у (26С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкокси(1-4С)алкілу і гідрокси-(1-4С)алкілу; R14, R15 є незалежно Н, (1-6С)алкіл, (26С)гетероциклоалкіл(1-4С)алкіл, (3-6С)циклоалкіл-(1-4С)алкіл, (1-4С)алкокси(2-4С)алкіл, гідрокси(2-4С)алкіл, (ди)(1-4С)-алкіламіно(24С)алкіл, аміно(2-4С)алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (1-6С)алкілкарбоніл, (36С)циклоалкілкарбоніл, (1-4С)алкоксикарбоніл, (34С)алкенілоксикарбоніл, (ди)(14С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл або (2-5С)гетероарил(1-4С)алкіл, феніл(1-4С)алкіл, (2-5С)гетероарилкарбоніл, фенілкарбоніл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу або (1-4С)алкокси, (ди)(1-4С)алкіламіно; або R14, R15 у R14R15-аміно(1-4C)алкілi можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками; вибраними з (1-4С)алкілу, (1-4С)алкокси(14С)алкілу і гідрокси(1-4С)алкілу; R16 (2-6С)гетероциклоалкіл(1-4С)алкіл, (ди)(1-4С)алкіламіно(2-4С)алкіл, (2-4С)алкокси-(14С)алкіл, гідрокси(2-4С)алкіл, аміно(2-4С)алкіл, гідроксикарбоніл(1-4С)-алкіл, (1-4С)алкоксикарбоніл(1-4С)алкіл, (14С)алкоксикарбоніл, (3-4С)алкенілокси-карбоніл, (3-4С)-алкінілоксикарбоніл, (ди)(14С)алкіламінокарбоніл, (26С)гетероциклоалкілкарбоніл, або феніл(14С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (1-4С)алкіламіно; 11 R17, R18 є незалежно Н, (1-6С)алкіл, (36С)циклоалкіл(1-4С)алкіл, (1-4С)алкокси(24С)алкіл, гідрокси(2-4С)алкіл, аміно(2-4С)алкіл, (ди)(1-4С)алкіламіно-(2-4С)алкіл, (2-6С)гетероциклоалкіл(2-4С)алкіл або феніл(1-4С)алкіл, (2-5С)-гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (14С)алкілу, (1-4С)алкокси і (ди)(1-4С)алкіламіно; або R17, R18 у R17R18-амінокарбоніл(1-4C)алкокси можуть бути з'єднані у (46С)гетероциклоалкенільному кільці або (26С)гетероциклоалкільньному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкокси(1-4С)алкілу і гідрокси-(1-4С)алкілу; R19 - H aбo (1-6C)алкіл; R20, R21 є незалежно Н, (1-6С)алкіл, (16С)алкеніл, (1-6С)алкініл або (1-4С)-алкокси(1-4С)алкіл; або R20, R21 у R20R21R-aмiнocyльфoнiлi можуть бути з'єднані у (4-6С)гетероциклоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкокси(14С)алкілу і гідрокси-(1-4С)алкілу; X - О або N-R22; Y - CH2,C(О) aбo SО2; Ζ - CN або NO2; 22 R - H, (1-4C)алкіл; R23, R24 є незалежно Н, (1-4С)алкіл, (24С)алкеніл, (2-4С)алкініл, (3-6С)циклоалкіл, (36С)циклоалкіл(1-4С)алкіл, (2-6С)гетероциклоалкіл, (2-6С)гетероциклоалкіл-(1-4С)алкіл, (14С)алкоксикарбоніл(1-4С)алкіл, (ди)(14С)алкіламінокарбоніл(1-4С)-алкіл або феніламінокарбоніл(1-4С)алкіл, (25С)гетероариламінокарбоніл(1-4С)алкіл, феніл, (25С)гетероарил, феніл(1-4С)алкіл, (25С)гетероарил(1-4С)алкіл, як варіант, заміщений при (гетеро)атомі одним або більше замісниками, вибраними з гідрокси, аміно, галогену, нітро, трифлуорметилу, ціано, (1-4С)алкілу, (2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкокси і (ди)(14С)алкіламіно; або R23, R24 у R23R24-амінокарбонілі можуть бути з'єднані у (4-6С)гетероцикпоалкенільному кільці або у (2-6С)гетероциклоалкільному кільці, як варіант, заміщеному одним або більше замісниками, вибраними з (1-4С)алкілу, (1-4С)алкокси(14С)алкілу і гідрокси(1-4С)алкілу; за умови, що сполуки формули І, в яких X є О, R4 є феніл, a R7 вибрано з Н, (1-4С)алкілтіо, (1-4С)алкілсульфонілу, ди(1-4С)алкіламіно, R23-оксикарбонілy, R2323 24 карбонілy і R R -амінокарбонілу, і сполуки формули І, в яких X є О, R4 є (2-5С)гетероарил і R7 є Η або (ди)(1-4С)алкіламіно, виключені. Похідні 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну згідно з винаходом є потужними активаторам рецептора FSH і можуть мати таке ж клінічне застосування, як і природні FSH, оскільки вони діють як агоністи, але з тією перевагою, що вони можуть бути приготовлені синтетично, мо 92007 12 жуть мати іншу стабільність і можуть бути введені пацієнту іншим шляхом. Отже, агоністи рецептора FSH згідно з винаходом можуть бути застосовані у лікуванні розладів плодючості, наприклад, для контрольованої оваріальної гіперстимуляції і процедур IVF. Термін (1-4С)алкіл означає розгалужену або нерозгалужену алкільну групу з 1-4 атомами карбону, а саме, метил, етил, пропіл, ізопропіл, бутил, втор-бутил і трет-бутил. Термін (1-6С)алкіл означає розгалужену або нерозгалужену алкільну групу з 1-6 атомами карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, n-пентил і n-гексил. Бажаними є (1-5С)алкільні групи, більш бажаними - (1-4С)алкільні групи. Термін (5-8С)алкіл означає розгалужені або нерозгалужені алкіли з 5-8 атоми карбону. Термін (2-4С)алкіл означає розгалужену або нерозгалужену алкільну групу з 2-4 атомами карбону. Термін (2-8С)алкіл означає розгалужену або нерозгалужену алкільну групу з 2-8 атомами карбону. Термін (3-8С)алкеніл означає розгалужену або нерозгалужену алкенільну групу з 3-8 атомами карбону, наприклад, 2-пропеніл, 2-бутеніл, 3бутеніл, пентеніл, гексеніл і октеніл. Термін (2-6С)алкеніл означає розгалужену або нерозгалужену алкенільну групу з 2-6 атомами карбону, наприклад, етеніл і n-пентеніл. Термін (2-4С)алкеніл означає розгалужену або нерозгалужену алкенільну груп з 2-4 атомами карбону, наприклад, етеніл, n-пропеніл і 2-бутеніл. Термін (3-6С)циклоалкіл означає циклоалкіли з 3-6 атоми карбону, а саме, циклопропіл, циклобутил, циклопентил і циклогексил. Термін (2-6С)алкініл означає розгалужену або нерозгалужену алкенільну групу з 2-6 атомами карбону, наприклад, етиніл, пропініл і n-пентиніл. Термін (2-4С)алкініл означає розгалужену або нерозгалужену алкенільну групу з 2-4 атомами карбону, наприклад, етиніл і пропініл. Термін (3-6С)циклоалкіл(1-4С)алкіл означає циклоалкілалкіл, циклоалкіл якого має 3-6 атоми карбону і має значення, як і раніше визначене для алкілів з 1-4 атомами карбону. Термін (3-6С)циклоалкіл(1-4С)алкілкарбоніл означає циклоалкільний компонент з 3-6 атомами карбону ідентичний визначеному вище і приєднаний до алкілу, що має 1-4 атоми карбону в алкілкарбонільній групі. Термін (3-6С)циклоалкілкарбоніл означає визначені вище циклоалкіли з 3-6 атомами карбону, приєднані до карбонілу. Термін (2-6С)гетероциклоалкіл означає гетероциклоалкіли, що мають 2-6 атоми карбону, переважно 3-5 атоми карбону, з щонайменше одним гетероатомом, вибраним з N, О і/або S, який може бути приєднаний через гетероатом (якщо можливо) або через атом карбону. Бажаними гетероатомамии є N або О. Найбільш бажаними є піперидин-1-іл, морфолін-4-іл, піролідин-1-іл і піперазин1-іл. 13 Термін (4-6С)гетероциклоалкеніл означає гетероциклоалкеніл з 4-6 атомами карбону, переважно з 3-5 атомами карбону, і з щонайменше одним гетероатомом, вибраним з Ν, Ο і/або S, який може бути приєднаний через гетероатом (якщо можливо) або атом карбону. Бажані гетероатоми - N або О. Термін (2-6С)гетероциклоалкіл(1-4С)алкіл означає гетероциклоалкілалкіл, гетероциклоалкіл якого має 2-6 атомів карбону, переважно 3-5 атомів карбону, з визначеним вище значенням і алкільну групу з визначеним вище значенням з 1-4 атомами карбону. Термін (2-6С)гетероциклоалкіл(2-4С)алкіл означає гетероциклоалкілалкіл, гетероциклоалкіл якого має 2-6 атомів карбону, переважно 3-5 атомів карбону, з визначеним вище значенням, і алкіли з визначеним вище значенням з 2-4 атомами карбону. Термін (2-6С)гетероциклоалкілкарбоніл означає гетероциклоалкілкарбоніл, гетероциклоалкіл якого має 2-6 атоми карбону, переважно 3-5 атоми карбону, з визначеним вище значенням. Термін (2-5С)гетероарил означає заміщену або незаміщену ароматичну групу, що має 2-5 атоми карбону і щонайменше один гетероатом, вибраний з Ν, Ο і S, наприклад, імідазоліл, тіадіазоліл, піридиніл, тієніл або фурил. Бажаними гетероарильними групами є тієніл, фурил і піридиніл. (2-5С)гетероарил може бути приєднаний через атом карбону або гетероатом (якщо можливо). Термін (2-5С)гетероарил(1-4С)алкіл означає гетероарилалкіл, гетероарильна група якого містить 2-5 атоми карбону, з визначеними вище значенням і преференціями, і алкіл з 1-4 атомами карбону, з визначеним вище значенням. Термін (2-5С)гетероариламінокарбоніл(14С)алкіл означає гетероариламінокарбоніл, гетероарил якого містить 2-5 атомів карбону з визначеними вище значенням і преференціями і який приєднано до алкілу, що має 1-4 атомів карбону і визначене вище значення. Термін (2-5С)гетероарилкарбоніл означає гетероарилкарбоніл, гетероарил якого містить 2-5 атомів карбону, з визначеними вище значенням і преференціями. Термін (2-5С)гетероарилсульфоніл означає гетероарилсульфоніл, гетероарил якого містить 25 атомів карбону, з визначеними вище значенням і преференціями. Термін (1-6С)алкілкарбоніл означає алкілкарбоніл, алкіл якого містить 1-6 атомів карбону, з визначеним вище значенням. Термін (2-6С)алкенілкарбоніл означає алкенілкарбоніл, алкеніл якого містить 2-6 атомів карбону, з визначеним вище значенням. Термін (2-6С)алкінілкарбоніл означає алкінілкарбоніл, алкіл якого містить 2-6 атомів карбону, з визначеним вище значенням. Термін (1-4С)алкілсульфоніл означає алкілсульфоніл, алкіл якого містить 1-4 атомів карбону, з визначеним вище значенням. Термін (1-4С)алкілтіо означає алкілтіогрупу з 1-4 атомами карбону і з алкільною частиною з визначеним вище значенням. 92007 14 Термін (1-4С)алкокси означає алкоксигрупу з 1-4 атомами карбону, де алкіл має визначене вище значення. Бажаними є (1-2С)алкоксигрупи. Термін (3-4С)алкенілокси означає алкенілоксигрупу з 3-4 атомами карбону, де алкеніл має визначене вище значення. Термін (3-4С)алкінілокси означає алкінілоксигрупу з 3-4 атомами карбону, де алкініл має визначене вище значення. Термін (1-4С)алкоксикарбоніл означає алкоксикарбоніл, алкоксигрупа якого має 1-4 атомів карбону, з визначеним вище значенням. Бажаними є (1-2С)алкоксикарбоніли. Термін (3-4С)алкенілоксикарбоніл означає алкенілоксикарбоніл, алкеніл якого має 3-4 атомів карбону. Термін (3-4С)алкінілоксикарбоніл означає алкінілоксикарбоніл, алкініл якого має 3-4 атомів карбону. Термін (1-4С)алкокси(1-4С)алкіл означає алкоксигрупу, алкіл якої має 1-4 атоми карбону і приєднаний до алкілів, що мають 1-4 атомів карбону. Термін (1-4С)алкокси(2-4С)алкіл означає алкоксигрупу, алкіл якої має 1-4 атоми карбону, і приєднаний до алкілів з 2-4 атомами карбону. Термін (1-4С)алкоксикарбоніл(1-4С)алкіл означає алкоксикарбонілалкіл, алкіли якого мають 1-4 атомів карбону, з визначеним вище значенням. Термін феніл(1-4С)алкіл означає феніл, приєднаний до алкілів з 1-4 атомами карбону, з визначеним вище значенням. Термін феніл(1-4С)алкокси(1-4С)алкілкарбоніл означає фенілалкокси-частину, алкіл якого має 1-4 атоми карбону, приєднані до алкілу алкіл карбонілу, причому алкільна група також має 1-4 атоми карбону. Термін феніламінокарбоніл(1-4С)алкіл означає феніламінокарбоніл, приєднаний до алкілів, що мають 1-4 атоми карбону, з визначеним вище значенням. Термін гідрокси(2-4С)алкіл означає гідроксіалкіли з 2-4 атомами карбону, причому алкіли мають визначене вище значення. Термін гідроксикарбоніл(1-4С)алкіл означає гідроксикарбонілалкіл, алкіл якого містить 1-4 атоми карбону, з визначеним вище значенням. Термін (ди)(1-4С)алкіламіно означає аміногрупу, монозаміщену або дизаміщену алкілами, кожний з яких має 1-4 атоми карбону і має визначене вище значення. Термін (ди)(1-4С)алкіламінокарбоніл означає (ди)алкіламінокарбоніл, (ди)-алкілдаміногрупа якого має є визначене вище значення. Термін (ди)(1-4С)алкіламінокарбоніл(14С)алкіл означає (ди)алкіламінокарбоніл-алкіл, алкіли якого містять 1-4 атоми карбону, з визначеним вище значенням. Термін амінокарбоніл(1-4С)алкокси означає амінокарбонілалкоксигрупу, алкіл якої має 1-4 атомів карбону, з визначеним вище значенням. Термін (ди)(1-4С)алкіламіно(2-4С)алкіл означає (ди)алкіламіногрупу з 1-4 атомами карбону, приєднану через аміногрупу до алкілів з визначеним вище значенням, що мають 2-4 атомів карбону. 15 Термін аміно(1-4С)алкілкарбоніламіно означає аміноалкілкарбоніламіногрупу, алкіл якої має 1-4 атомів карбону, з визначеним вище значенням. Термін аміно(2-4С)алкіл означає аміноалкіли з 2-4 атомами карбону, причому алкіли мають визначене вище значення. Термін (ди)(1-4С)алкіламіноімінометил означає аліламіноімінометил, аміногрупа якого є монозаміщеною або дизаміщеною алкілами, що мають 1-4 атоми карбону, з визначеним вище значенням. Термін (2-6С)гетероциклоалкілімінометил означає гетероциклоалкілімінометил, гетероциклоалкіл якого визначений вище. Термін галоген означає флуор, хлор, бром або йод; бажаними є хлор, бром або йод. Термін фармацевтично прийнятна сіль репрезентує солі, які з медичної точки зору є придатними для застосування у контакті з тканинами людини і нижчих тварин без проявів токсичності, подразнень, алергічних реакцій тощо і мають прийнятне відношення перевага/ризик. Фармацевтично прийнятні солі є добре відомими. Вони можуть бути отримані під час кінцевого ізолювання і очищення сполуки винаходу або реакцією вільноосновної функції з придатною неорганічною кислотою, наприклад, гідрохлорною, фосфорною або сульфуровою, або з органічною кислотою, наприклад, аскорбіновою, лимонною, виннокам'яною, молочною, малеїновою, малоновою, фумаровою, гліколевою, бурштиновою, пропіоновою, оцтовою, метансульфоновою тощо. Кислотна функція може реагувати з органічною або неорганічною основою, наприклад, гідроксид натрію, гідроксид калію або гідроксид літію. Винахід також стосується сполуки формули І, де R1 - (1-6С)алкіл. Зокрема, винахід стосується сполуки, в якій R1 - (1-4С)алкіл. Ще одним аспектом винаходу є сполуки формули І, де R2, R3 є галоген і/або (1-4С)алкокси. У ще одному аспекті винахід стосується сполуки формули І, в якій Υ є СН2. Ще одним аспектом винаходу є сполука, в якій Ζ є CN. У ще одному аспекті винахід стосується сполуки, в якій X=О. Винахід також стосується сполуки загальної формули І, де R7 - R8R9-аміно, R10R11амінокарбоніл, R12R13-аміно(114 15 4C)алкілкарбоніламіно, R R -аміно (1-4С)алкіл або R17R18-амінокарбоніл(1 -4С)алкокси. У ще одному аспекті винахід стосується сполуки, де R8-H, R9 (1-4С)алкілсульфоніл, (16С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (14С)-алкоксикарбоніл, (3-4С)алкенілоксикарбоніл, (ди)(1-4С)алкіламінокарбоніл, (2-6С)гетероциклоалкілкарбоніл або фенілкарбоніл, феніл(1-4С)алкокси(1-4С)алкілкарбоніл, (25С)гетероарилкарбоніл, (25С)гетероарилсульфоніл або (2-5С)гетероарил(14С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)алкокси; R10 - H або (1-4С)алкіл; 92007 16 R11 - гідрокси(2-4С)алкіл, аміно(2-4С)алкіл, (14С)алкокси(2-4С)алкіл або (ди)(1-4С)-алкіламіно(24С)алкіл; або R10 і R11 разом з N, до якого вони приєднані, утворюють (4-6С)гетероциклоалкенільне кільце або (2-6С)гетероциклоалкільне кільце, як варіант, заміщене одним або більше замісниками, вибраними з (1-4С)алкілу; R12, R13 є незалежно Н, (1-6С)алкіл, (3(5С)циклоалкіл, гідрокси(2-4С)алкіл, (14С)алкокси-(2-4С)алкіл, (2-6С)гетероциклоалкіл(14С)алкіл або (ди)(1-4С)-алкіламіно(2-4С)алкіл або феніл(1-4С)алкіл, (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або R12 і R13 разом з N, до якого вони приєднані, утворюють (4-6С)гетероциклоалкенільне кільце або (2-6С)гетероциклоалкільне кільце, обидва, як варіант, заміщені одним або більше замісниками, вибраними з (1-4С)алкілу або гідрокси(1-4С)алкілу; R14, R15 є незалежно Н, (1-6С)алкіл, гідрокси(24С)алкіл, (1-4С)алкоксикарбоніл-(1-4С)алкіл, (16С)алкілкарбоніл, (3-6С)циклоалкілкарбоніл, (14С)алкоксикарбоніл або (2-5С)гетероарил(14С)алкіл або (2-5С)гетероарилкарбоніл, фенілкарбоніл; R16 (2-6С)гетероциклоалкіл(1-4С)алкіл, (ди)(1-4С)алкіламіно(2-4С)алкіл, (2-4С)-алкокси(14С)алкіл, гідроксикарбоніл(1-4С)алкіл, (14С)алкоксикарбоніл(1-4С)алкіл; або феніл (14С)алкіл або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену або (1-4С)-алкокси; R17, R18 є незалежно Н, (1-6С)алкіл, (36С)циклоалкіл(1-4С)алкіл, (1-4С)алкокси-(24С)алкіл, (2-6С)гетероциклоалкіл(2-4С)алкіл; або феніл(1-4С)алкіл або (2-5С)гетероарил(1-4С)алкіл, як варіант, заміщений на (гетеро)ароматичному кільці одним або більше замісниками, вибраними з галогену; або R17 і R18 разом з Ν, до якого вони приєднані, утворюють (4-6С)гетероциклоалкенільне кільце або (2-6С)гетероциклоалкільне кільце, як варіант, заміщене одним або більше замісниками, вибраними з (1-4С)алкілу або гідрокси(1-4С)алкілу. Винахід також стосується сполуки формули І, де R7 є R8R9-аміно. Ще один аспект винаходу стосується сполуки, в якій R8 - Η і R9 - (1-4С)алкілсульфоніл. Ще один аспект винаходу стосується сполуки, в якій одне або більше конкретних визначень груп R1 - R24, Χ, Υ і Ζ комбінуються з визначенням похідних 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну формули І. Винахід також стосується сполук, вибраних з групи, яку складають N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-3,4,5-триметокси-бензамід; N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-2-[(піридин-4-ілметил)аміно]-ацетамід; 17 N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-2-[4-(2-гідроксиетил)піперазин-1-іл]-ацетамід; 4-{3-бром-4-[3-(3,6-дипдро-2Н-піридин-1карбоніл)-бензилокси]-5-етокси-феніл}-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил; 3-[біс-(2-метилоксиетил)-аміно]-N-{3-[2-бром-4(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідро-хінолін-4-іл)-6-етокси-феноксиметил]феніл}-пропіонамід; 2-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6-етоксифеноксиметил]-фенокси}-N,N-диметил-ацетамід; 4-{3-бром-5-етокси-4-[3-(2-морфолін-4-іл-2оксо-етокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-амід фуран-2-карбонової кислоти; N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-акриламід; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етооксифеноксиметил]-феніл}-амід циклопропанкарбонової кислоти; метил-естер 2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-карбамової кислоти; {2-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-3-метил-мочевина метил-естер {3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-піридин-2-іл}-карбамовової кислоти; 4-(3-бром-5-етокси-4-{3-[(1Н-імідазол-4ілметил)-аміно]-бензилокси}-феніл)-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил; N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-метансульфонамід; 92007 18 аліл-естер{4-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-карбамової кислоти; 4-[3-бром-5-етокси-4-(1-метансульфоніл-1Нпірол-2-ілметокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил; 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6-етоксифеноксиметил]-N-метил-бензамідин; 4-{3-бром-5-етокси-4-[(піридин-3-ілметил)аміно]-феніл}-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил; N-(2-{[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеніламіно]-метил}-феніл)-метансульфонамід; 4-{3-бром-4-[2-(циклопропілметил-аміно)бензилокси]-5-етокси-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил; або N-{2-[2-бром-4-((4R,7S)-3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-4,5-дифлуор-феніл}метансульфонамід Далі розглядаються способи приготування похідних 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну згідно з винаходом. Похідні 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну І винаходу можна приготувати з належним чином функціоналізованих похідних 1,4дигідропіридину загальної структури II, в якій R1, R2, R3, Χ, Υ і Ζ є ідентичними визначеним вище, а А є феніл або гетероарильне кільце. 19 92007 20 R9 - ацил або сульфоніл Наприклад, ацилування або сульфонілування сполук загальної формули ΘΘ-b дає сполуки загаль1 2 3 ної формули I-а, де R , R , R , Χ,Υ і Ζ є ідентични8 ми визначеним вище, R є Н, R9 є ацил або сульфоніл і А є (заміщений) феніл або (заміщений) гетероарильне кільце. Звичайно сполуки ΘΘ-b реагують у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, ДМСО, етанолі, ТГФ, 1,4-діоксані, толуолі, 1-метил-піролідин-2-оні або піридині, з належним чином заміщеними ацилгалогенідом, кислотним ангідридом або сульфонілгалогенідом у присутності основи, наприклад, триетиламіну, Ν,Ν-діізопропілетиламіну (ДІПЕА) або піридину, з отриманням N-ацилованих або Νсульфонілованих похідних формули I-а, відповідно. В іншому варіанті, N-ациловані сполуки загальної формули I-а можна отримати реакцією (гетеро)ароматичної карбонової кислот у присутності реагенту сполучення, наприклад, діізопропілкарбодііміду (DIC), (3-диметиламінопропіл)-етилкарбодііміду (EDCI), тетрафлуорбораті О(бензотриазол-1-іл)-N,N,N',N'-тетраметилуронiю (TBTU) або гексафлуорфосфату O-(7азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію (HATU) і третинної амінової основи (наприклад, ДІПЕА) у розчиннику, наприклад, Ν,Ν-ДМФ або ДХМ при зовнішній або підвищеній температурі. Сполуки загальної формули Θ-b, де R1, R2, R3, Χ, Υ і Ζ є подібними раніше визначеним, R9 є (заміщений) алкіл і А є (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати відновлювальним алкілуванням аміногрупи належним чином заміщеними альдегідами загальної формули Е-С(О)Н (Е - алкіл, циклоалкіл, циклоалкілалкіл, (ди)алкіламіноалкіл, гетероциклоалкілалкіл, (гетеро)арил, (гетеро)арилалкіл) і придатний відновлювач, наприклад, ціаноборогідрид натрію або тріацетоксиборогідрид натрію. Належним чином заміщені кетони також можна застосовувати у цій процедурі. В іншому варіанті сполуки загальної формули ll-b можуть бути перетворені у відповідний (гетеро)арилімін ІІ-с реакцією з належним чином заміщеним альдегідом загальної формули ЕС(О)Н (див. вище) способами, відомими фахівцям, з подальшим відновленням відновлювачем, наприклад, борогідридом натрію з отриманням сполуки загальної формули Θ-b. У цьому випадку можна застосовувати також належним чином заміщені кетони. 21 92007 22 В іншому варіанті, сполуки загальної формули ΘΘ-b можуть бути перетворені у похідні 2,4динітробензолсульфонаміду ll-d сульфонілуванням 2,4-динітробензол-сульфоніл-хлоридом. Сульфонамід може бути алкілований до сполуки загальної формули II-е з застосуванням відомої реакції Міцунобу з належним чином заміщеним первинним або вторинним спиртом формули R9OH (R9 - алкіл, циклоалкіл, циклоалкілалкіл, (ди)алкіламіноалкіл, гетероциклоалкілалкіл або (гетеро)арилалкіл), трифенілфосфін (не обов'язково зв'язаний смолою) і діалкілазодикарбоксилатом у прийнятному розчиннику, наприклад, 1,4діоксані, ТГФ або ДХМ, при підвищеній або зовнішній температурі. В іншому варіанті сульфонамщ може бути алкілований з застосуванням алкілгалогенідів формули R9-Hal (Hal - СІ, Вr, І) і придатної основи, наприклад, K2СО3, у розчиннику, наприклад, Ν,Ν-ДМФ, ТГФ або 1,4-діоксані. Розщеплення сульфонамідного зв'язку N-S первинним амі ном, наприклад, пропіламіном, у придатному розчиннику, наприклад, ДХМ дає сполуки формули Θb. В іншому варіанті сульфонамідний зв'язок N-S може бути розщеплений меркаптооцтовою кислотою і третинною амінною основою у розчиннику, наприклад, ДХМ (див. Tetrahedron Lett. 38 (1997) 5831-5834, Bioorg. Med. Chem. Lett. 10 (2000) 835838). Сполуки загальної формули І-с, де R1, R2, R3, 9 8 R , X, Y і Ζ є ідентичними визначеним вище, R є (1-4С)алкіл і А є (заміщений) (гетеро)арил, можуть бути отримані з сполуки l-а, Θ-b або ll-f. Алкілування сполуки I-а R8-Hal (Hal=СІ, Вr, І) або R8-OH способами, описаними для алкілування сполуки ll-d дає потрібні Ν,Ν-дизаміщені анілінові похідні I-c. Крім того, алкілування сполуки формули Θ-b способами описаними для відновлювального алкілування сполуки формули II-b також дає Ν,Νдизаміщені анілінові похідні I-c. Сполуки загальної формули E-f, отримані способами, описаними для синтезу сполуки формули І-b, можуть бути ациловані, сульфоніловані або відновлювально алкіловані, як це описано для приготування I-а і І-b, відповідно, з отриманням сполуки загальної формули I-c. Нітрогрупа у сполуках загальної формули ІІ-а може бути відновлена до відповідної аміногрупи з отриманням сполуки загальної формули II-b. Звичайно, сполуки ІІ-а обробляють цинком і оцтовою кислотою у придатному розчиннику, наприклад, ТГФ або діоксані, при температурах від 0°С до 23 92007 24 температури дефлегмації. Альтернативні способи включають обробку залізом, SnCL2 або гідрогеном у присутності перехідного металу-каталізатора, наприклад, паладію або платини на вугіллі, з застосуванням способів і реагентів, добре відомих фахівцям. В іншому варіанті сполуки загальної формули ІІ-b можна отримати розщепленням відомої N-захисної групи, наприклад, алілоксикар бонілу (АІІос), флуорен-9-іл-метоксикарбонілу (Fmoc) або трет-бутоксикарбонільної (Вос) групи, на сполуки загальної формули ll-g з отриманням відповідних похідних ll-b. Маніпуляції з захисними групами можна знайти у Protective Groups in Organic Synthesis, T.W. Greene і P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999. Карбоно-кислотні похідні загальної формули ІІі, придатні для сапоніфікації відповідних алкілестерів ll-h, можуть бути конденсовані з амінами загальної структури R10R11NH, з застосуванням реагента сполучення, як це описано для отримання похідних І-а з сполуки формули l-d, де R1, R2, R3, R10, R11, Χ, Υ і Ζ є ідентичними визначеним вище, а А -(заміщений) феніл або (заміщене) гетероарильне кільце. Подібний спосіб сполучення був описаний для отримання похідних l-а. В іншому варіанті сполуки загальної формули ІІ-і можуть бути перетворені у відповідні хлорангідриди ll-j відомими способами. Обробка карбонової кислоти загальної формули ІІ-і тіонілхлоридом або оксалілхлоридом і ДМФ у придатному розчиннику, наприклад, ДХМ або толуолі, дає відповідні хлорангідриди ll-j. Подальша реакція з амінами загальної структури R10R11NH, як варіант, у присутності придатної третинної амінної основи дає сполуки загальної формули l-d. 25 92007 26 Сполуки загальної формули I-е, де R1, R2, R3, R12, R13, Χ, Υ і Ζ є подібними визначеним, а А (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати ацилуванням сполуки загальної формули ΘΘ-b прийнятними ацилгалогенідами з отриманням сполуки ll-k, і потім стандартним заміщенням хлориду або броміду амінами загальної формули R12R13NH. Крім того, сполуки загальної формули I-е з двокарбоновою прокладкою між карбонілом і групою NR12R13 можна отримати ацилуванням сполуки загальної формули ll-b α,β-ненасиченими ацилхлоридами з отриманням сполуки загальної формули ll-l, і потім відомою реакцією Майкла додання з належним чином заміщених амінів загальної формули R12R13NH. Сполуки загальної формули l-f, де R1, R2, R3, R14, R15, Χ, Υ і Ζ є ідентичними визначеним вище, а А - (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримувати алкілуванням амінів загальної формули R14R15NH галогенідами загальної формули ll-m, у присутності третинної основи, наприклад, Ν,Ν-діізопропілетиламіну або триетиламіну у прийнятному розчиннику, наприклад, Ν,Ν-ДМФ, ТГФ або ДХМ. Похідні загальної формули l-g, де R1, R2, R3, R16, Χ, Υ і Ζ є ідентичними визначеним вище, а А (заміщений) феніл або (заміщене) гетероарильне кільце, можна отримати алкілуванням гідроксильної групи у сполуках загальної формули ІІ-о алкіл галогенідом загальної формули R16-Hal, в якій Hal може бути Вr, СІ або І. Звичайно такі реакції проводять в апротонному розчиннику, наприклад, Ν,Ν-ДМФ, 1,4-діоксані або ТГФ у присутності осно 27 92007 28 ви, наприклад, гідриду натрію, карбонату калію, карбонату цезію або тріетиламіну при зовнішній або підвищеній температурі. В іншому варіанті перетворення сполук загальної формули ІІ-о в арильні етери загальної формули l-g можна проводити в умовах алкілування типу Міцунобу. У такому перетворенні алкілування гідроксильної групи у сполуках формули ІІ-о здійснюється спиртами загальної формули R16-OH у присутності (зв'язаного смолою) трифенілфосфіну і діетилазодикарбоксилату або їх похідних у придатному апротонному розчиннику, наприклад, ТГФ або ДХМ. Похідні загальної формули ІІ-о можна отримати розщепленням гідрокси-захисної групи у сполуках загальної формули ІІ-n. Придатними захисними групами є тетрагідропіранільні (ТГП) або третбутил-диметилсилільні (TBS) захисні групи. Розщеплення цих групи взагалі проводять обробкою кислотою, наприклад, гідрохлорною, трифлуорметансульфоновою або трифлуороцтовою у придатному розчиннику, наприклад, ТГФ або метанолі. В іншому варіанті групу TBS можна видаляти обробкою флуоридом тетра-п-бутиламонію у ТГФ. Відповідні дані про захисні групи можна знайти у Priotective Groups in Organic Syntesis, T.W. Greene і P.G.M. Wuts, John Wiley & sons, Inc., New York, 1999. Сполуки винаходу загальної формули І- h можна отримати конденсацією похідних ll-q з амінами загальної формули R17R18NH у присутності засобу сполучення і третинної амінної основи, як описано, наприклад, для отримання of похідні загальної формули l-d. Потрібні похідні формули l-q можна отримати за двостадійним протоколом синтезу з сполук загальної формули ІІ-о алкілуванням фенольної частин прийнятним галогенованим алкілестером до отримання похідніих формули ІІ-р, і потім добре відомим кислотним або основним розщепленням естерної функції. Похідні загальної формули I-і можна отримати з нітрилів загальної формули II-r добре відомим амідиновим синтезом Піннера. Ця процедура включає селективне перетворення нітрильної функції на (гетеро)арильному кільці похідних II-r в імідати ll-s обробкою належною кислотою, наприклад, гідрохлорною, з використанням придатного спирту, як розчинника, як варіант, у присутності співрозчинників, наприклад, 1,4-діоксану або діетилетеру, при зовнішній або підвищеній температурі. Реакція з відповідним ациклічним або циклічним аміном дає амідинові похідні I-і. Амідинові форми є добре відомими (див. J. Med. Chem. 42 (1999) 5415-5425, Bioorg. Med. Chem. Lett. 13 (2003) 697-700, J. Org. Chem. 62 5 (1997), 84498454. 29 Сполуки загальної формули ІІІ-а, де X є О, можна використати для приготування сполуки l-j, де R1, R2, R3, R4, Υ і Ζ є ідентичними визначеним вище, а X є О, О-алкілуванням, О-ацилуванням або О-сульфонілуванням, у стандартних умовах, добре відомих фахівцям. Схема заміщення (гетеро)арильного кільця у R4 визначена раніше. Звичайно сполуки ІІІ-а реагують у розчиннику, наприклад, ДХМ, Ν,Ν-ДМФ, ДМСО, етанолі, ТГФ, 1,4діоксані, толуолі, 1-метил-піролідин-2-оні або піридині з належним чином заміщеним (гетеро)ароматичним алкілгалогенідом формули IV, ацилхлоридом формули V або сульфонілхлоридом формули VII у присутності основи, наприклад, тріетиламіну, Ν,Ν-діізопропілетиламіну (ДІПЕА), карбонату калію, карбонату цезію або гідриду натрію, як варіант, у присутності каталітичної кількості йодиду калію або йодиду тетрабутиламонію, з отриманням О-алкілованих, О-ацилованих або Осульфонілованих похідних формули l-j, відповідно. В іншому варіанті О-алкіловані сполуки загальної формули l-j, в яких Υ є СН2, можуть бути отримані відомою реакцією Міцунобу з спиртів формули VIII, трифенілфосфіну (не обов'язково зв'язаного смолою) і діалкілазодикарбоксилату (наприклад, діетилазодикарбоксилату) у прийнят 92007 30 ному розчиннику, наприклад, 1,4-діоксані, ТГФ або ДХМ при підвищеній або зовнішній температурі. Крім того, О-ациловані сполуки загальної формули l-j, де Υ є С(О), можуть бути отримані реакцією (гетеро)ароматичної карбонової кислоти формули VI у присутності реагенту сполучення, наприклад, діізопропілкарбодііміду (DIC), (3диметиламінопропіл)-етил-карбодііміду (EDCI), тетрафлуорборату O-(бензотриазол-1-іл)-N,N,N',Nтетраметилуронію (TBTU) або гексафлуорфосфат О-(7-азабензотриазол-1-іл)-N,N,N',Nтетраметилуронію, і третинної амінної основи (наприклад, ДІПЕА) у розчиннику, наприклад, Ν,ΝДМФ або ДХМ при зовнішній або підвищеній температурі. Сполуки загальної формули l-k можна отримати з сполуки ІІІ-b N-алкілуванням, N-ацилуванням або N-сульфонілуванням способами, описаними для синтезу сполук l-j, застосовуючи реагенти формули IV-X. Крім того, сполуки загальної формули l-k, в яких Υ є СН2, можна отримати відновлювальним амінуванням (гетеро)ароматичних альдегідів формули IX сполукою ІІІ-Ь і придатним відновлювачем, наприклад, ціаноборогідридом натрію або тріацетоксиборогідридом натрію. 31 В іншому варіанті сполуки загальної формули ІІІ-b можуть бути перетворені у відповідний бензімін реакцією з (гетеро)ароматичними альдегідами IX відомими способами з подальшим відновленням відновлювачем, наприклад, борогідридом натрію, з отриманням сполуки l-k, в якій Υ=СН2. Сполуки загальної формули l-k, де R1, R2, R3, 4 R і Ζ є ідентичними визначеним вище, а X є ΝΗ, можуть бути N-алкіловані способами, описаними для приготування похідних Θ-b, з отриманням сполук загальної формули I-1, де R22 - (1-4С)алкільна група. Сполуки загальної формули І, де R1, R2, R3, R4, Χ, Υ і Ζ є подібними раніше визначеним, можна також отримувати з циклогексан-1,3-діонів загальної формули XVI, енамінів загальної формули XVII і бензальдегідів загальної формули XVIII-a-b добре відомою трикомпонентною реакцією циклоконденсації типу Ганцша. Опис таких реакцій цикло-конденсації можна знайти у Bioorg. Med. 5 Chem. Lett. 12 (2002) 14811484, J. Chem. Soc, Perldn Транс. 1 (2002) 11411156, Synlett (2002) 89-92, Drug Dev. Res. 51 (2000) 92007 32 Сполуки загальної формули II можна також отримати з похідних загальної формули ІІІ-а і ІІІ-b, застосовуючи способи, описані для отримання сполук загальної формули l-j і l-k, і реагенти формули X-XV. Подібно до N-алкілування сполуки загальної формули l-k з отриманням 1-1, сполуки загальної формули ll-t, де R1, R2, R3 і Ζ є ідентичними визначеним вище, а А - (заміщений) феніл або (заміщений) гетероарил, можуть бути N-алкіловані з отриманням сполук загальної формули ll-u, де R22 - (14С)алкільна група. 225-232, Drug Dev. Res. 51 (2000) 233-243, J. Med. Chem. 42 (1999) 1422-1427, ibid. 5266-5271, ibid. 41 (1998) 2643-2650, WO 9408966, Arzneim.Forsch/Drug Res. 45 (1995) 1054-1056, J. Med. Chem. (1991) 2248-2260, ibid. 17 (1974) 956-65, Іnдіаn J. Chem., Sect В (1994) 526-531, Chem. Rev. 72 (1972), 1-42. Ці реакції звичайно проводять при підвищеній температурі у придатних розчинниках, наприклад, оцтовій кислоті, (ізо)пропанолі, етанолі, метанолі або їх суміші. 33 Сполуки загальної формули II і ІІІ-а-b також отримують вищезгаданою цикло-конденсацією Ганцша, застосовуючи заміщені бензальдегіди загальної формули XIX або XX, відповідно. Сполуки загальної формули Ill-c-d, в яких R2 є Вr, можна також отримати ортобромуванням фенолів або анілінів, добре відомим фахівцям. Так, сполуки формули III-e-f дають сполуки формули Ill Сполуки загальної формули Ill-e-f отримують вищезгаданою реакцією Ганцша, застосовуючи бензальдегіди загальної формули ХХІ-а-b. Сполуки загальної формули IV-XV є у продажу або описані у літературі, або можуть бути легко синтезовані. Заміщені циклогексан-1,3-діони загальної формули XVI є у продажу або можуть бути приготовлені за відомими процедурами (див. J. Med. Chem. 43 (2000) 4678-4693, Tetrahedron 56 (2000) 47534758, J. Med. Chem. 35 (1992) 3429-3447, ibid. 24 (1981) 1026-1034, Org. Synt. Coll. Vol. V (1973) 400, Chem. Ber. 88 (1955) 316-327, Justus Liebig Ann. Chem. 570 (1950) 15-31). 92007 34 c-d після обробки бромом у придатному розчиннику, наприклад, оцтовій кислоті, етанолі або ДХМ або їх суміші, як варіант, у присутності ацетату натрію. В іншому для цього перетворені варіанті можна використати N-бромсукцинімід у Ν,Ν-ДМФ або ацетонітрилі (див., наприклад, J. Chem. Soc. Perkin Trans, 2 6 (2000) 1113-1118, J. Org. Chem. 44 (1979), 4733-4735. Сполука формули XVII-a є у продажу, а сполуку XVII-b можна отримати відомими способами (див., наприклад, Drug Dev. Res. 51 (2000) 225232). Бензальдегіди загальної формули XVI11-а, де R2, R3, R4 і Υ є ідентичними визначеним вище, а X=О, легко отримують з бензальдегідів загальної формули ХХ-а, застосовуючи способи, описані для перетворення сполуки формули ІІІ-а у l-j. Сполуки загальної формули XVIII-b отримують з ΧΧ-b, застосовуючи способи, як описані для перетворення сполуки формули ІІІ-b у l-k. 35 92007 36 Бензальдегіди загальної формули ХХ-а і ΧΧ-b є у продажу або можуть бути отримані згідно з відомими процедурами (J. Chem. Soc, Perkin Trans. 2 (2000) 1119-1124, J. Chem. Soc, Chem. Commun. 4 (1993) 419-420, Synth. Commun. 20 (1990) 2659-2666, Chem. Pharm. ВulІ. 34 (1986) 121-129, Indian J. Chem. Sect. В 20 (1981) 10101013, Monats. Chem. 106 (1975) 1191-1201, DE 1070162, J. Org. Chem. 23 (1958) 120, Tetrahedron Lett. 25 (1984), 2901-2904, J. Org. Chem. 25 (1960), 2053-2055, J. Chem. Soc, Perkin Транс. 2 (1992), 2235-2242. Крім того, бензальдегіди загальної формули ХХ-с, де R2 є бромідом, а X є N-H, можна отримати бромуванням сполук загальної формули XXI, застосовуючи процедури, описані для перетворення сполук загальної формули Ill-f у Ill-d. Сполуки загальної формули XXI легко отримують з сполук загальної формули XXII, застосовуючи відновлення, описане для отримання сполук загальної формули ΘΘ-b з ІІ-а. Сполуки загальної формули XXII є у продажу, описані у літературі або можуть бути легко синтезовані. Похідні загальної формули ХІХ-а-b можна отримати з сполук ХХ-а-b реакцією з сполуками XXV, описаною для отримання похідних XVM-a-b. Сполуки винаходу мають щонайменше два хіральні атоми карбону і можуть існувати як чисті енантіомери або як суміш енантіомерів, або як суміш діастереомерів. Методи отримання чистих енантіомерів добре відомі, наприклад, кристалізацією солей, отриманих з оптично активних кислот і рацемічних сумішей або хроматографією на хіральних колонках. Для розділення діастереомерів можна використати прямо- або зворотнофазні колонки. Крім того, енантіомерно чисті похідні гексагідрохіноліну загальної формули XXIII можна отримувати у енантіомерно чистій формі дегідратацією енантіомерно чистих амідів XXIV трифлуороцтовим ангідридом і придатною основою, наприклад, триетиламіном або піридином у придатному розчиннику, наприклад, ДХМ, 1,4-діоксані або ТГФ при 0°С або зовнішній температурі. Дегідратацію амідів з отриманням нітрилів можна знайти, наприклад, у Org. Prep. Proced. Int. 26 (1994) 429-438, Acta Chem. Scand. 53 (1999) 714-720, J. Org. Chem. 57 (1992) 2700-2705. Сполуки загальної формули XXIII можуть бути перетворені (якщо не необхідно) у сполуки загальної формули І описаним вище синтезом. Аміди загальної формули XXIV можна отримати розщепленням хіральної бензильної групи амі дів загальної формули XXV (показано для XXV-a). Цю реакцію можна провести перемішуванням з кислотою, наприклад, трифлуороцтовою, у ДХМ. Сполуки загальної формули XXV отримують цикло-конденсацією Ганцша, описаною вище, з XVI, енаміну XXVI і належним чином заміщеного бензальдегіду. Ця реакція дає суміш 4 стереоізомерів загальних формул XXVa-d, які можна відокремлювати хроматографією, наприклад, колонною флеш-хроматографією на силікагелі і/або РХВР. Енамін XXVI можна отримати відомими способами двома операціями з комерційного (3)-1-(4метокси-феніл)-етиламіну і дикетену або 2,2,6триметил-1,3-діоксин-4-ону. 37 Сполуки винаходу можуть утворювати гідрати або сольвати. Відомо, що заряджені сполуки утворюють гідратовані версії при ліофілізації водою або утворюють сольватовані версії при концентруванні у розчині з належним органічним розчинником. Сполуки винаходу включають гідрати або сольвати зазначених сполук. Було виявлено, що похідні 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну згідно з винаходом є агоністами рецептора FSH. Добре відомими є методи аналізів in vitro і in vivo для визначення зв'язування рецептора і визначення біологічної активності гонадотропінів. Взагалі експресований рецептор контактує з тестовою сполукою, і після цього виміряють зв'язування або стимуляцію, або пригнічення функціональної реакції. Для вимірювання функціональної реакції ізольовану ДНК, що кодує рецептор FSH, бажано, людського, експресують у придатних клітинах. Такими клітинами можуть бути клітини яєчника китайського хом'яка, хоча придатними можуть бути і інші клітини. Бажаними є клітини ссавців (Jia et al, MoLEndocrin., 5: 759-776,1991). Методи конструювання рекомбінантних ліній клітин, що експресують FSH є добре відомими (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, latest edition). Експресування рецептора здійснюють експресуванням ДНК, що кодує бажаний протеїн. Методи спрямованого на сайт мутагенезу, лігування додаткових послідовностей, PCR і конструювання придатних систем експресії є добре відомими. Частина ДНК або повна ДНК, що кодує бажаний протеїн, може бути конструйована синтетично стандартними твердофазними методами, бажано з включенням рестрикційних сайтів для полегшення лігування. У кодуючі послідовності ДНК можуть бути введені контрольні елементи для транскрипції і трансляції включених кодуючих послідовностей. Сучасні системи експресії є сумісними з різноманітними хазяями, включаючи прокаріоти, наприклад, бактерії, і еукаріоти, наприклад, дріжджі, клітини рослин, клітини комах, клітини ссавців і плазунів тощо. Потім клітини, що експресують рецептор, вводять у контакт з тестовою сполукою для спостереження зв'язування або стимуляції, або пригнічення функціональної реакції. В іншому варіанті ізольовані мембрани клітин, які містіть експресований рецептор, можуть бути використані для вимірювання зв'язування сполуки. 92007 38 Для вимірювання зв'язування можуть бути використані радіоактивні або флюоресцентні сполуки. Як еталон може бути використаний людський рекомбінантний FSH. Можуть бути виконані порівняльні аналізи на зв'язування. Інший аналіз включає скринінг сполук-агоністів рецептора FSH через визначення стимуляції рецептора, опосередкованої сАМР. Такий метод включає експресування рецептора на поверхні хазяйської клітини і дію на клітину тестовою сполукою, після чого виміряють кількість сАМР. Рівень сАМР підвищиться стимулюючою дією тестової сполуки на зв'язування рецептора. На додаток до прямого вимірювання, наприклад, рівнів сАМР у цих клітинах можуть бути використані лінії клітин, які на додаток до трансфекції ДНК, що кодує рецептор, трансфектують також другою ДНК, що кодує ген репортера, експресія якого реагує на рівень сАМР. Такі репортерні гени можуть бути адаптованими до сАМР або можуть бути конструйовані таким чином, щоб приєднуватись до нових елементів реакції сАМР. Взагалі експресію репортерного гену можна контролювати будь-яким елементом реакції, який реагує на зміну рівнів сАМР. Придатними репортерними генами є, наприклад, LacZ, лужна фосфатаза, люцифераза світлячка і протеїн зеленої флюоресценції. Принципи такого трансактиваційного аналізу є добре відомими (див., наприклад, Stratowa, C, Himmler, Α., Czemilofsky, Α., (1995) Curr. Opin. Biotechnol. 6: 574. Винахід також стосується фармацевтичної композиції, що містить похідну 4-феніл-5-оксо1,4,5,6,7,8-гексагідрохіноліну або її фармацевтично прийнятні солі загальної формули І у суміші з фармацевтично прийнятними допоміжними речовинами і, як варіант, з іншими терапевтичними агентами. Допоміжні речовини мають бути "прийнятними", тобто сумісними з іншими інгредієнтами композиції і не шкідливими для реципієнта. Композиції можуть бути придатними для перорального, під'язичного, підшкірного, внутрішньовенного, внутрішньом'язового, носового, локального або ректального введення у формі одиничних доз. Для перорального введення активний інгредієнт може бути у вигляді дискретних одиниць, наприклад, таблеток, капсул, порошків, гранул, розчинів, суспензій тощо. Для парентерального введення, фармацевтична композиція винаходу може мати форму одно 39 дозових або багатодозових контейнерів, наприклад, рідин для ін'єкції у заздалегідь визначеній кількості у герметичних флаконах або ампулах і можуть також зберігатись у висушеному заморожуванням стані (ліофілізованими) і потребувати лише додання стерильного водного носія, наприклад, води, перед використанням. У суміші з фармацевтично прийнятними допоміжними речовинами, наприклад, описаними у стандартному довіднику (Gennaro, A.R. et al., Remington: Science і Practice of Pharmacy (20th Edition, Lippincott Williams & Wilkins, 2000, Part 5: Farmaceutical Manufacturing) активний агент може бути спресований у тверді дозовані одиниці, наприклад, пігулки, таблетки або виготовлені у формі капсул або супозиторіїв. З фармацевтично прийнятними рідинами активний агент може мати форму рідкої композиції, наприклад, препаратів для ін'єкції, зокрема, розчинів, суспензій, емульсій або аерозолю, наприклад, носового. Для виготовлення твердих дозованих одиниць використовують звичайні добавки, наприклад, наповнювачі, барвники, полімерні зв'язуючі тощо. Взагалі може бути використана будь-яка фармацевтично прийнятна добавка, яка не порушує функцій активних сполук. Відповідні носії, з якими можна вводити активний агент винаходу у твердій композиції, включають лактозу, крохмаль, похідні целюлози тощо або їх суміші у належній кількості. Для парентерального введення можуть бути використані водні суспензії, ізотонічні сольові розчини і стерильні ін'єкційні розчини, які містять фармацевтично прийнятні диспергенти і/або зволожувачі, наприклад, пропіленгліколь або бутиленгліколь. Винахід включає описану вище фармацевтичну композицію у комбінації з пакувальним матеріалом, відповідним зазначеній композиції, разом з інструкціями з використання композиції згідно з описаним вище. Точна доза і режим введення активного інгредієнта або фармацевтичної композиції, що містить його, залежать від конкретної сполуки, способу введення і віку і стану пацієнта, якому вводять даний медикамент. Взагалі парентеральне введення потребує менших доз, ніж інші способи введення, що більше залежать від поглинання. Відповідні дози для людини можуть становити 0,05-25мг на кг маси тіла. Бажана доза може бути реалізована як єдина доза або декілька субдоз, які вводять з належним інтервалом протягом дня, або (у випадку реципієнтівжінок) як дози які мають бути введені з денним інтервалом протягом менструального циклу. Дози і режим введення можуть бути різними для жінок і чоловіків. Отже, сполуки згідно з винаходом можуть бути використані у терапії. Ще один аспект винаходу полягає у використанні похідної 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну загальної формули І у виготовленні медикаменту для лікування розладів, що викликаються порушеннями, опосередкованими рецептором FSH, бажано, для лікування розладів плодючості. Отже, пацієнтам, що потребують тако 92007 40 го лікування, можна вводити відповідні кількості сполуки згідно з винаходом. Інший аспект винаходу полягає у використанні похідної 4-феніл-5-оксо-1,4,5,6,7,8гексагідрохіноліну загальної формули І у виготовленні медикаменту для лікування безплідності. Винахід ілюстровано наведеними далі прикладами. Загальні умови: Абревіатури: ДМА= Ν,Ν-диметиланілін, ДІПЕА= Ν,Ν-діізопропілетиламін, ТФК= трифлуороцтова кислота, HATU= гексафлуорфосфату О-(7азабензотріазол-1-іл)-N,N,N',N'-тетраметилуронію Fmoc= 15 9-флуоренілметоксикарбоніл Fmoc-CI= 9-флуоренілметоксикарбонілхлорид АІІос= алілоксикарбоніл, ДМФ= Ν,Ν-диметилформамід, ТГФ= тетрагідрофуран. Якщо не зазначено інше, всі кінцеві продукти наведених нижче прикладів ліофілізують з сумішей вода/1,4-діоксан, вода/трет-бутанол або вода/ацетонітрил. Якщо сполуку отримують як сіль ТФК, ТФК додають у належній кількості до розчинника перед ліофілізацією. Назви кінцевих продуктів у прикладах сформовані за допомогою програми Beilstein Autonom (ver. 2,02,304). Для визначення часів утримання використовують такі анілітичні методи РХВР: Спосіб 1: Колонка: 5мкм Luna C-18(2) 150 4,6мм; потік 1мл/хвил.; виявлення: 210нм; температура колонки 40°С; розчинник A: CH3CN/H2O=1/9 (об'єм/об'єм); розчинник В: CH3CN; розчинник С: 0,1Μ водна трифлуороцтова кислота; градієнт: розчинники А/В/С=75/20/5 до 10/85/5 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=10/85/5 (об'єм/об'єм/об'єм). Спосіб 2: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=95/0/5 до 10/80/5 (об'єм/об'єм/об'єм) протягом 20,00хвил., потім константа протягом ще 10,00хвил. при А/В/С =10/80/5 (об'єм/об'єм/об'єм). Спосіб 3: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=35/60/5 до 10/85/5 (об'єм/об'єм/об'єм) протягом 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=10/85/5 (об'єм/об'єм/об'єм). Спосіб 4: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=95/0/5 до 15/80/5 (об'єм/об'єм/об'єм) у 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=15/80/5 (об'єм/об'єм/об'єм). Спосіб 5: Ідентичний способу 1, але з іншим градієнтом: розчинник А/В/С=75/25/0 до 0/100/0 (об'єм/об'єм/об'єм) у 20,00хвил., потім константа протягом ще 10,00хвил. при А/В/С-0/100/0 (об'єм/об'єм/об'єм). Спосіб 6: Ідентичний способу 1, але з іншим градієнтом: розчинники: розчинник А/В/С=60/40/0 до 0/100/0 (об'єм/об'єм/об'єм) у 20,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=0/100/0 (об'єм/об'єм/об'єм). І 41 Спосіб 7: Ідентичний способу 1, але з іншим градієнтом: розчинники: розчинник А/В/С=70/30/3 до 40/60/3 (об'єм/об'єм/об'єм) у 30,00хвил., потім константа протягом ще 10,00хвил. при А/В/С=0/100/3 (об'єм/об'єм/об'єм). І Спосіб 8: Колонка: 3мкм Luna С-18(2) 100 2мм (Phenomenex); потік: 0,25мл/хвил.; визначення: 210нм; температура колонки 40°С; розчинник A: CH3CN/H2O=1/9 (об'єм/об'єм); розчинник В: CH3CN; градієнт: розчинник А/В=65/35 до 10/90 (об'єм/об'єм) протягом 30,00хвил., протягом 2,00хвил.ин до А/В=0/100 (об'єм/об'єм), потім константа протягом ще 8,00хвил. при А/В=0/100 20 (об'єм/об'єм), потім ще 1,00хвил.ина до А/В=65/35 (об'єм/об'єм) і наприкінці константа протягом ще 15,00хвил. при А/В=65/35 (об'єм/об'єм). Спосіб 9: Колонка: Chiralpak AD-H 25 0,46см; визначення хіральності (+/-) і 210нм; Умови: ізократичний гептан/ізопропіловий спирт 80/20 (об'єм/об'єм). Діастереомерне відношення (відношення діастереомерів) визначають, якщо основна сепарація окремих діастереомерів здійснюється належним методом аналітичної РХВР. В іншому варіанті, діастереомерне відношення визначають аналізом 1 Н ЯМР, ідентифікуючи відповідні діастереомери згідно з окремими сигналами. Отримані діастереомерні відношеня відповідають конфігураціям С-4 і С-7 ядра 1,4,5,6,7,8-гексагідрохіноліну. Очищення препаративною РХВР: колонка Luna С-18(2) (5мкм) (150 21,2мм), суміш вода/ацетонітрил, як варіант, у присутності 0,1% водної ТФК, застосовуючи зазначений градієнт: потік 20мл/хвил., визначення: 210нм: Приклад 1. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6етокси-феноксиметил]-феніл}-3,4,5-триметоксибензамід (a) 3-бром-5-етокси-4-(3-нітро-бензилокси)бензальдегід Суміш 3-нітробензилброміду (2г), 3-бром-5етокси-4-гідрокси-бензальдегіду (2,06г), K2СО3 (2,55г) і Bu4NI (186мг) у ДМФ (50мл) перемішували при 60°С протягом 2год. Реакційну суміш розбавляли етилацетатом і промивали водою і розсолом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок перекристалізовували з гептану. Вихід 2,98г. MS-ESI: [М+Н]+=380/382. (b) 4-[4-(3-нітро-бензилокси)-3-бром-5-етоксифеніл]-2-метил-5-оксо-7-пропіл-1,4, 5,6,7,8гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 1а (2г), 3амінокротонітрилу (431мг) і 5-пропілциклогексан1,3-діону (810мг) в етанолі (20мл) перемішували при 80°С протягом 4год. Реакційну суміш концентрували у вакуумі і залишок хроматографували на силікагелі у суміші гептан/етилацетат=1/1 (об'єм/об'єм) як елюенті. Вихід 2,7г. MS-ESI: [М+Н]+=580/582. (с) 4-[4-(3-аміно-бензилокси)-3-бром-5-етоксифеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил SnCI2 (1,62г) додавали до розчину продукту прикладу 1b (500мг) в етанолі (10мл). Після пере 92007 42 мішування протягом 18год. реакційну суміш влили у воду і екстрагували етилацетатом. Органічний шар відокремлювали і промивали 0,5N NaOH і водою, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 440мг. MS-ESI: [М+Н]+=550/552. (d) N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-3,4,5-триметокси-бензамід Суміш продукту прикладу 1с (44мг), 3,4,5триметоксибензоїлхлориду (39мг) і ДІПЕА (70мкл) у ДХМ (10мл) перемішували протягом 18год. Реакційну суміш розбавляли ДХМ і промивали водою і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (0 90% ацетонітрилу). Вихід 39мг. MS-ESI: [M+H]+=744,4/746,4; анал. РХВР: Rt=20,73хвил. (спосіб 1). Приклад 2. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-3,3-диметилбутирамід Ацилування продукту описаного у прикладі 1с (44мг) 3,3-диметил-бутирил-хлоридом (16мг) проводили способом, описаним у прикладі 1d. Вихід 36мг. MS-ESI: [M+H]+=648/650; анал. РХВР: Rt=22,58хвил. (спосіб 1). Приклад 3. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-2-[(піридин-4ілметил)-аміно]-ацетамід (а) 2-бром-N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-ацетамід Бромацетилхлорид (600мкл) у ДХМ (5мл) додавали краплями до розчину продукту прикладу 1с (1,32г) і ДІПЕА (2,1мл) у ДХМ (25мл). Після перемішування протягом 4год. реакційну суміш промивали водою, органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 900мг. MS-ESI: [M+H]+=670/672/674. (b) N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл)-2-[(піридин-4-ілметил)аміно]-ацетамід Суміш продукту прикладу 3 (50мг) і 4піколіламіну (81мг) у ДХМ/ТГФ=4:1 (об'єм/об'єм) (2,5мл) перемішували протягом 18год. Реакційну суміш розбавляли ДХМ і промивали водою і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (0 90% ацетонітрилу, 0,1% ТФК). Вихід 17,9мг (сіль ТФК). MS-ESI: [М+Н]+=698,4/700,4; анал. РХВР: Rt=8,85хвил. (діаст. 1), Rt=9,07хвил. (діаст. 2) (спосіб 2). Приклад 4. N-{3-[2-бром-4-(3-цiано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл]}-2-(циклопентилметил-аміно)-ацетамід Реакцію продукту, описаного у прикладі 3а (50мг), з циклопентил-метил-аміном (74мг) проводили способом, описаним у прикладі 3b. Вихід 53мг (сіль ТФК). MS-ESI: [М+Н]+ 689/691; анал. 43 РХВР: Rt=13,45хвил. (діаст. 1), Rt=13,72хвил. (діаст. 2) (спосіб 2). Приклад 5. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-2-[4-(2-гідроксиетил)-піперазин-1-іл]-ацетамід Реакцію продукту, описаного у прикладі 3а (50мг), з 2-піперазин-1-іл-етанолом (98мг) проводили способом, описаним у прикладі 3b. Вихід 41мг (сіль ТФК). MS-ESI: [M+H]+=720/721; анал. РХВР: Rt=10,40хвил. (діаст. 1) Rt=10,67хвил. (діаст. 2) (спосіб 2). Приклад 6. 3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-N-етил-N-(2-гідрокси-етил)бензамід (a) метил-естер 3-(2-бром-6-етокси-4-формілфеноксиметил)-бензойної кислоти Алкілування 3-бром-5-етокси-4-гідроксибензальдегіду (2г) метил-естером 3-бромметилбензойної кислоти (2,06г) проводили способом, описаним у прикладі 1а. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=7/3 (об'єм/об'єм) як елюенті. Вихід 2,42г. MS-ESI: [M+H]+=393/395. (b) метил-естер 3-[2-бром-4-(3-ціано-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)6-етокси-феноксиметил]-бензойної кислоти Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 6а (2,4г), 3-амінокротонітрилу (504мг) і 5-пропілциклогексан1,3-діону (947мг). Вихід 2,96г. MS-ESI: [M+H]+=593/595. (с) 3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-бензойна кислота Суміш продукту прикладу 6b (2,96г) і 2N NaOH (5мл) у діоксані (100 25мл) перемішували протягом 3 діб. Реакційну суміш вливали у воду, потім додавали 4N HCL до рН2 і екстрагували етилацетатом. Органічний шар промивали розсолом, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 3,0г. MS-ESI: [M+H]+=579/581. (d) 3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N-етил-N-(2-гідрокси-етил)бензамід Суміш продукту прикладу 6с (90мг), 2етиламіно-етанолу (49мкл) і TBTU (82мг) у ДХМ (5мл) перемішували протягом 4год. Реакційну суміш промивали насич. NaHCO3, сушили (MgSO4) і концентрували у вакуумі. Залишок очищали препаративною РХВР (0 90% ацетонітрилу, 0,1% ТФК). Вихід 43мг. MS-ESI: [М+Н]+=650/652; анал. РХВР: Rt=19,96хвил. (діаст. 1), Rt=20,22хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 3:1. Приклад 7. 4-{3-бром-4-[3-(3,6-дигідро-2Нпіридин-1-карбоніл)-бензилокси]-5-етокси-феніл}2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Сполучення сполуки, описаної у прикладі 6с з 1,2,3,6-тетрагідропіридином (47мкл) і TBTU (82мг) проводили способом, описаним у прикладі 6d. Вихід 61мг. MS-ESI: [М+Н]+=644/646; анал. РХВР: 92007 44 Rt=23,48хвил. 10 (діаст. 1), Rt=23,75хвил. (діаст. 2) (спосіб 2) Діаст. відношення: 3:1. Приклад 8. Трет-бутил-естер {3-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил)феноксил-оцтової кислоти (а) 3-бромметил-фенол При 0°С в атмосфері нітрогену карбонтетрабромід (28,05г) додавали протягом 20хвил. до суспензії 3-гідроксибензилового спирту (7г) і трифенілфосфіну (22,18г) у ДХМ (250мл). Після перемішування протягом 1год. при 0°С реакційну суміш концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=2/1 (об'єм/об'єм) як елюенті. Вихід 10г. MS-ESI: [M-H]-=184,8/186,8. (b) 2-(3-бромметил-фенокси)-тетрагідро-піран При 0°С 3,4-дигідро-2Н-піран (9,8мл) і каталітичну кількість піридиніум-р-толуолсульфонату додавали до розчину продукту прикладу 8а (10г) у ДХМ (300мл). Після перемішування протягом 1,5год. при кімнатній температурі реакційну суміш розбавляли ДХМ і промивали насич. NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=4/1 (об'єм/об'єм). Вихід 13,6г. (c) 3-бром-5-етокси-4-[3-(тетрагідро-піран-2ілокси)-бензилокси]-бензальдегід Алкілування 3-етокси-4-гідрокси-5-бромбензальдегіду (11,19г) продуктом прикладу 8b (13,6г) проводили способом, описаним у прикладі 1а. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=3/1 (об'єм/об'єм) як елюенті. Вихід 17,8г. MS-ESI: [М+Н]+=435/437. (d) 4-{3-бром-5-етокси-4-[3-(тетрагідро-піран-2ілокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 8с (5,5г), 3-амінокротонітрилу (1г) і 5-5 пропілциклогексан1,3-діону (1,95г). Вихід 6,4г. MS-ESI: [М+Н]+=635,4/637,4. (е) 4-[3-бром-5-етокси-4-(3-гідроксибензилокси)-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Оксалінову кислот додавали до розчину продукту прикладу 8d (6,4г) у метанолі (135мл) і воді (15мл) до рН2. Після перемішування при 55°С протягом 2год. реакційну суміш концентрували у вакуумі, залишок розчиняли в етилацетаті і промивали водою, насич. NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 5,5г. MSESI: [М+Н]+=551,2/553,2. (f) Трет-бутил-естер (3-[2-бром-4-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]фенокси)-оцтової кислоти Суміш продукту прикладу 8е (100мг), третбутил-бромацетату (105мг) і CsCO3 (355мг) у діоксані (7мл) перемішували при 80°С в атмосфері нітрогену протягом 18год. Реакційну суміш розбавляли етилацетатом і промивали водою, насич. 45 NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (50 100% ацетонітрилу). Вихід 34,5мг. MS+ ESI: [М+Н] =665,4/667,4; анал. РХВР: Rt=10,16хвил. (діаст. 1), 10,55хвил. (діаст. 2) (спосіб 3) Діаст. відношення: 5:1. Приклад 9. N-{3-[2-бром-4-(3-цiано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6етокси-феноксиметил]-феніл}-2-(3-руполідин-1-ілпропіламіно)-ацетамід Реакцію продукту, описаного у прикладі 3 (100мг) з 3-піролідин-1-іл-пропіламіном (191мг) проводили способом, описаним у прикладі 3b. Вихід 32мг (сіль ТФК). MS-ESI: [M+H]+=718,6/720,6; анал. РХВР: Rt=7,24хвил. (спосіб 2). Приклад 10. {3-[бензил-метил-аміно)-N-{3-[2бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-пропіонамід (а) N-{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-акриламід До розчину продукту прикладу 1с (1,5г) у ДХМ додавали ацилоїлхлорид (222мкл) і ДІПЕА (2,38мл). Після перемішування протягом 18год. реакційну суміш промивали водою. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 1,65г. ESIMS: [М+Н]+=604,2/606,2. (b) (3-(бензил-метил-аміно)-N-{3-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]феніл}-пропіонамід Суміш продукту прикладу 10а (150мг) і Nметил-бензиламін (300мг) у ТГФ (2,5мл) перемішували протягом 18год. Реакційну суміш концентрували у вакуумі, залишок розчиняли в етилацетаті і промивали водою. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (10 90% ацетонітрилу, 0,1% ТФК). Вихід 34мг (сіль ТФК). MS-ESI: [M+H]+=725,4/727,4; анал. РХВР: Rt=14,32хвил. (діаст. 1), Rt=14,58хвил. (діаст. 2) (спосіб 2) Приклад 11. 3-[біс-(2-метокси-етил)-аміно]-N{3-[2-бром-4-(3-ціано-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-пропіонамід Названу сполуку отримували способом, описаним у прикладі 10b, з біс-(2-метокси-етил)-аміну (319мг) і продукту прикладу 10а (150мг). Вихід 30мг (сіль ТФК). MS-ESI: [М+Н]+=737,4/739,4; анал. РХВР: Rt=13,24хвил. (спосіб 2). Приклад 12. 4-{3-бром-5-етокси-4-[3-(піридин2-ілметокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 8е (100мг), 2піколілхлорид-гідрохлориду (31,2мг) і CsCO3 (124мг) у ДМФ (7мл) перемішували при 60°С в атмосфері нітрогену протягом 18год. Реакційну суміш розбавляли етилацетатом і промивали водою, насич. NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали пре 92007 46 паративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 19,6мг (сіль ТФК). MS-ESI: [М+Н]+=642,1/644,1; анал. РХВР: Rt=17,24хвил. (спосіб 2). Приклад 13. 4-{3-бром-5-етокси-4-[3-(4-флуорбензилокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 12, з 4-флуор-бензилброміду (23,7мкл) і продукту прикладу 8е (100мг). Залишок очищали препаративною РХВР (50 100% ацетонітрилу). Вихід 58,9мг. MS-ESI: [M+H]+=659,2/661,2; анал. РХВР: Rt=14,38хвил. (діаст. 1), Rt=5 14,90хвил. (діаст. 2) (спосіб 3). Діаст. відношення: 5:1. Приклад 14. 4-{3-бром-4-[3-(2-діетиламіноетокси)-бензилоксил-5-етокси]-феніл}-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Названу сполуку отримували способом, описаним у прикладі 12, з 2-діетиламіноетилхлоридгідрохлориду (32,7мг) і продукту прикладу 8е (100мг). Залишок очищали препаративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 62,9мг (сіль ТФК). MS-ESI: [М+Н]+=650,4/652,4; анал. РХВР: Rt=13,3 5хвил. (діаст. 1), Rt=13,70 (діаст. 2) (спосіб 2). Приклад 15. 2-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-фенокси}-N,N-диметилацетамід Названу сполуку отримували способом, описаним у прикладі 12, з 2-хлор-N,Nдиметилацетаміду (19,6мкл) і продукту прикладу 8е (100мг). Залишок очищали препаративною РХВР (0 100% ацетонітрилу). Вихід 53,8мг. MSESI: [M+H]+=636,4/638,4; анал. РХВР: Rt=20,44хвил. (діаст. 1), Rt=20,77хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 5:1. Приклад 16. 4-{3-бром-5-етокси-4-[3-(2метокси-етокси)-бензилокси]-феніл}-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Суміш продукту прикладу 8е (100мг), 2метоксиетанолу (29мкл), діетилазодикарбоксилату (57мкл) і трифенілфосфінового полімеру, зв'язаного (122мг) у ДХМ (6мл), перемішували в атмосфері нітрогену протягом 54год. Реакційну суміш фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (50 100% ацетонітрилу). Вихід 15мг. MS-ESI: [М+Н]+=609,2/611,2; анал. РХВР: Rt=7,66хвил. (спосіб 3). Приклад 17. 4-{3-бром-5-етокси-4-[3-(2морфолін-4-іл-2-оксо-етокси)-бензилокси]-феніл}2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (a) (3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-iл)-6-етоксифеноксиметил]-фенокси}-оцтова кислота Суміш сполуки прикладу 8f (620мг) у ДХМ (45мл) і трифлуороцтової кислоти (5мл) перемішували протягом 4год. Реакційну суміш розбавляли ДХМ, промивали водою і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтру 47 вали і концентрували у вакуумі. Вихід 553мг. MSESI: [М+Н]+=609,2/611,2. (b) 4-{3-бром-5-етокси-4-[3-(2-морфолін-4-іл-2оксо-етокси)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Сполучення сполуки, описаної у прикладі 17а (79мг) з морфоліном (34мкл) і TBTU (62мг) проводили способом, описаним у прикладі 6d. Вихід 50,5мг. MS-ESI: [M+H]+=678,4/680,4; анал. РХВР: Rt=16,29хвил. (діаст. 1), Rt=16,65 (діаст. 2) (спосіб 1). Діаст. відношення: 5:1. Приклад 18. 2-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-фенокси}-N-тіофен-2ілметил-ацетамід Сполучення сполуки, описаної у прикладі 17а (75мг) з 2-тіофенметиламіном (38мкл) і TBTU (59мг) проводили способом, описаним у прикладі 6d. Залишок очищали препаративною РХВР (40 100% ацетонітрилу). Вихід 45,7мг. MS-ESI: [M+H]+=704,4/706,4; анал. РХВР: Rt=6,96хвил. (спосіб 3). Приклад 19. N-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-2-піролідин-1-ілацетамід (а) 3-бром-5-етокси-4-(2-нітро-бензилокси)бензальдегід Алкілування 3-бром-5-етокси-4гідроксибензальдегіду (5г) 2-нітробензилбромідом (4,85г) проводили способом, описаним у прикладі + 1а. Вихід 7,88г. MS-ESI: [M+H] =380/382. (b) 4-[3-бром-5-етокси-4-(2-нітро-бензилокси)феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 19а (7,88г), 3-амінокротонітрилу (1,7г) і 5пропілциклогексан-1,3-діону (3,2г).Вихід 8,54г. MSESI: [М+Н]+=580,2/582,2. (с) 4-[4-(2-аміно-бензилокси)-3-бром-5-етоксифеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил При 0°С цинковий пил (9,01г) додавали порціями до розчину продукту прикладу 19с (6,9г) і оцтової кислоти (5,9мл) у ТГФ (150мл). Після перемішування при 0°С протягом 1год. при кімнатній температурі протягом 2год. реакційну суміш фільтрували, потім розбавляли ДХМ і промивали насич. NaHCO3 і розсолом. Органічн. шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 3,66г. MS-ESI: [М+Н]+= 550,2/552,2. (d) 2-бром-N-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-ацетамід Реакцію бромацетилхлориду (0,546мл) з продуктом прикладу 19с (1,2г) проводили способом, описаним у прикладі За. Вихід 1,36г. MS-ESI: [М+Н]+=626,2/628,2. (е) N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-2-піролідин-1-іл-ацетамід Суміш продукту прикладу 19d (136мг) і піролідину (181мкл) у ТГФ (5мл) перемішували протягом 92007 48 54год. Реакційну суміш розбавляли етилацетатом і промивали водою, насич. NaHCO3 і розсолом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (10 100% ацетонітрилу, 0,1% ТФК). Вихід 51,8мг (сіль ТФК). MS-ESI: [М+Н]+=661,4/663,4; анал. РХВР: Rt=13,58 (спосіб 2). Приклад 20. N-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-2-[(2-диметиламіноетил)-метил-аміно]-ацетамід Названу сполуку отримували способом, описаним у прикладі 19е, з продукту прикладу 19d (136мг) і N,N,N'-триметил-етан-1,2-діаміну (277мкл). Вихід 41мг (сіль ТФК). MS-ESI: [М+Н]+=690,4/692,4; анал. РХВР: Rt=12,14хвил. (діаст. 1), Rt=12,46 (діаст. 2) (спосіб 2). Діаст. відношення: 7:1 Приклад 21. 4-[3-бром-5-етокси-4-(2метилсульфаніл-піримідин-4-ілметокси)-феніл]-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (a) 5-бром-2-метилсульфаніл-піримідин-4карбонова кислота При 5°С триетиламін (16,9мл) додавали краплями до розчину мукобромної кислотит (10,31г) і 2метил-ізотіомочквини (11,13г) у воді (200мл). Після перемішування при 5°С протягом 3год. реакційну суміш залишили нагріватись (кімнатна температура) і перемішування продовжували ще 54год. Реакційну суміш підкислювали конц. НС (33%). Названий продукт отримували фільтруванням. Вихід 4,1г. MS-ESI: [M+H]+=249/251. (b) 2-метилсульфаніл-піримідин-4-карбонова кислота Продукт прикладу 21а (517мг) у метанолі (25мл) гідрогенували в апараті PARR у присутності KОН (260мг) і 10% Pd на BaSO4 (260мг) протягом 4год. Реакційну суміш фільтрували через декаліт і промивали метанолом (теплим). Фільтрат концентрували до 50% об'єму і потім додавали конц. HCL (33%) до рН1. Осад (KВr) відфільтровували і маточний розчин концентрували у вакуумі. Залишок перекристалізовували з діоксану. Вихід 200мг. MSESI: [М+Н]+=170. (с) 2-метилсульфаніл-піримідин-4-іл)метанол При 0°С оксалілхлорид (295мкл) додавали до розчину ДМФ (91,2мкл) у ДХМ (2мл). Після перемішування при 0°С протягом 1год. реакційну суміш концентрували у вакуумі. Залишок розчиняли в ацетонітрилі (2мл) і ТГФ (3мл), потім порціями додавали продукт приклад 21b (200мг) при 0°С в атмосфері нітрогену. Після перемішування при 0°С протягом 15хвил. реакційну суміш охолоджували (-78°С) і додавали 2М NaBH4 у ДМФ (590мкл). Після перемішування при -20сС протягом 3год. реакційну суміш гасили 2N HCL і концентрували у вакуумі. Залишок розчиняли у воді і розчин доводили до рН11 доданням 2N NaOH і екстрагували ДХМ. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 180мг. MS-ESI: [М+Н]+=156. (d) 3-бром-5-етокси-4-(2-метилсульфанілпіримідин-4-ілметокси)-бензальдегід 49 Суміш продукту прикладу 21с (180мг), 3-бром5-етокси-4-гідрокси-бензальдегіду (289мг), трифенілфосфіну (зв'язаний полімер) (393мг) і діетилазодикарбоксилату (186мкл) у ДХМ (25мл) перемішували протягом 18год. Реакційну суміш відфільтровували і фільтрат концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=3/2 (об'єм/об'єм) як елюенті. Вихід 98мг. MS-ESI: [М+Н]+=383/385. (е) 4-[3-бром-5-етокси-4-(2-метилсульфанілпіримідин-4-ілметокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 22d (49мг), 3-амінокротонітрилу (11мг) і 5пропілциклогексан-1,3-діону (20мг). Залишок очищали препаративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 24мг (сіль ТФК). MS-ESL [М+Н]+=583,2/585,2; анал. РХВР: Rt=25,06хвил. (діаст. 1), Rt=25,51хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 4:1. Приклад 22. {2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-4-іл)-6етокси-феноксиметил]-феніл}-амід фуран-2карбонової кислоти Суміш продукту прикладу 19с (100мг), 2фуроїлхлориду (36мкл) і ДІПЕА (159мкл) у ДХМ (5мл) перемішували протягом 16год. Реакційну суміш розбавляли ДХМ і промивали насич. NaHCO3. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (20 100% ацетонітрилу). Вихід 67мг. MS-ESI: [М+Н]+=644,4/646,4; анал. РХВР: Rt=20,19хвил. (спосіб 1). Приклад 23. N-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-акриламід Реакцію продукту прикладу 19с (100мг) з акрилоїлхлоридом (29мкл) у присутності ДІПЕА (159мкл) проводили способом, описаним у прикладі 22. Вихід 51,1мг. MS-ESI: [М+Н]+=604,4/606,4; анал. РХВР: Rt=19,01хвил. (діаст. 1), Rt=19,42хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 9:1. Приклад 24. {2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-амід циклопропанкарбонової кислоти Реакцію продукту прикладу 19с (100мг) з циклопропанкарбонілхлоридом (33мкл) у присутності ДІПЕА (159мкл) проводили способом, описаним у прикладі 22. Вихід 52,1мг. MS-ESI: [М+Н]+=618,2/620,2; анал. РХВР: Rt=20,30хвил. (діаст. 1), Rt=20,71хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 7:1. Приклад 25. метил-естер {2-[2-бром-4-(3-ціано2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]феніл}-карбамової кислоти Реакцію продукту прикладу 19с (100мг) з метилхлорформатом (28мкл) у присутності ДІПЕА (159мкл) проводили способом, описаним у прикладі 22. Вихід 65,9мг. MS-ESI: [М+Н]+=608,2/610,2; анал. РХВР: Rt=21,37хвил. (діаст. 1), 92007 50 Rt=21,87хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 11:1. Приклад 26. ізобутил-естер {2-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]феніл}-карбамової кислоти Реакцію продукту прикладу 19с (100мг) з ізобутилхлорформатом (47мкл) у присутності ДІПЕА (159мкл) проводили способом, описаним у прикладі 22. Вихід 70мг. MS-ESI: [М+Н]+=650,4/652,4; анал. РХВР: Rt= 26,84хвил. (діаст. ), Rt=27,26хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 7:1. Приклад 27. метил-естер 2-[2-бром-4-(3-ціано2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]фуран-3-карбонової кислоти (a) метил-естер 2-(2-бром-6-етокси-4-формілФеноксиметил)-фуран-3-карбонової кислоти Алкілування 3-бром-5-етокси-4-гідроксибензальдегіду (123мг) метил-естером 2бромметил-фуран-3-карбонової кислоти (109мг) проводили способом, описаним у прикладі 1а. Вихід 191мг. MS-ESI: [M+H]+=383/385. (b) метил-естер 2-[2-бром-4-[3-ціано-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)6-етокси-феноксиметил]-фуран-3-карбоновової кислоти Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 27а (191мг), 3-амінокротонітрилу (41мг) і 5пропілциклогексан-1,3-діону (77мг). Залишок очищали препаративною РХВР (10 90% ацетонітрилу). Вихід 168мг. MS-ESI: [M+H]+=583/585; анал. РХВР: Rt=23,06хвил. (діаст. 1), Rt=23,43хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 4:1. Приклад 28. {2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-амідпропан-1сульфонової кислоти Пропан-1-сульфонілхлорид (31мкл) і піридин (44мкл)додавали до розчину продукту прикладу 19с (100мг) у ДХМ (3мл). Після перемішування протягом 18год. реакційну суміш розбавляли ДХМ і промивали насич. NaHCO3. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (20 100% ацетонітрилу). Вихід 52,7мг. MS-ESI: [М+Н]+=656,4/658,4; анал. РХВР: Rt=22,36хвил. (діаст. 1), Rt=22,72хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 7:1. Приклад 29. 4-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-N-(2-метокси-етил)бензамід (a) метил-естер 4-(2-бром-6-етокси-4-формілфеноксиметил)-бензойної кислоти Алкілування 3бром-5-етокси-4-гідрокси-бензальдегіду (4г) метилестером 4-бромметил-бензойної кислоти (3,73г) проводили способом, описаним у прикладі 1а. Вихід 6,4г. MS-ESI: [М+Н]+=393/395. (b) метил-естер 4-[2-бром-4-(3-ціано-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)6-етокси-феноксиметил]-бензойної кислоти Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 29а 51 (6,4г), 3-амінокротонітрилу (1,34г) і 5пропілциклогексан-1,3-діону (2,51г). Вихід 6,74г. MS-ESI: [M+H]+=593/595. (с) 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-бензойна кислота Суміш продукту прикладу 29Ь (6,5г) і 2N NaOH (11,3мл) у діоксані (400мл) перемішували при 50°С протягом 18год. Реакційну суміш вливали у воду і додавали 4N НС до рН2, потім екстрагували етилацетатом. Органічний шар промивали розсолом, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 6,4г. MS-ESI: [М+Н]+=579/581. (d) 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N-(метокси-етил)-бензамід Сполучення сполуки, описаної у прикладі 29с (100мг) з 2-метокси-етиламіном (44мкл) і TBTU (82мг) проводили способом, описаним у прикладі 6d. Вихід 70мг. MS-ESI: [М+Н]+=636,4/638,4; анал. РХВР: Rt=19,25хвил. (діаст. 1), 19,55хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 4:1 (РХВР). Приклад 30. 4-{3-бром-5-етокси-4-[3(ізобутиламіно-метил)-бензилокси]-феніл}-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (а) 4-(3-бром-5-етокси-4-гідрокси-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 1b, з 3-бром-5-етокси-4-гідроксибензальдегіду (6г), 3-амінокротонітрилу (2,01г) і 5пропілциклогексан-1,3-діону (3,8г). Реакційну суміш охолоджували (0°С) і названу сполуку відфільтровували і промивали етанолом (холодним). Вихід 6,3г. MS-ESI: [M+H]+=445/447. (b) 4-[3-бром-4-(3-бромметил-бензилокси)-5етокси-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 30а (1,96г), α,αдибром-m-ксилолу (9,31г) і K2СО3 (1,22г) у ДМФ (100мл) перемішували при 60°С в атмосфері нітрогену протягом 2год. Реакційну суміш розбавляли етилацетатом і промивали водою, насич. NaHCO3 і розсолом. Органічний шар сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=1/2 (об'єм/об'єм). Вихід 2,52г MSESI: [М+Н]+=627,4/629,4/631,4; анал. РХВР: Rt=17,71хвил. (діаст. 1), 18,07хвил. (діаст. 2) (спосіб 6). Діаст. відношення: 4:1. (с) 4-{3-бром-5-етокси-4-[3-(ізобутиламінометил)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 30b (100мг) і ізобутиламіну (79мкл) в ацетонітрилі (5мл) перемішували протягом 18год. Реакційну суміш концентрували у вакуумі; залишок розчиняли у ДХМ і промивали насич. NaHCO3. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 76мг (сіль ТФК). MS-ESI: [М+Н]+=620,4/622,4; анал. РХВР: Rt=13,56хвил. (діаст. 1), 92007 52 Rt=13,85хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 3:1 Приклад 31. 4-[3-бром-5-етокси-4-(3-{[піридин4-ілметил)-аміно]-метил}-бензилокси)-феніл]-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 30с, з продукту прикладу 30b (100мг) і 4-(амінометил)піридину (81мкл) в ацетонітрилі (5мл). Вихід 41мг (сіль ТФК). MS-ESI: [М+Н]+=30 655,2/657,2; анал. РХВР: Rt=8,08хвил. (спосіб 2). Діаст. відношення: 3:1. Приклад 32. 4-[4-(3-амінометил-бензилокси)-3бром-5-етокси-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил (а) 4-[4-(3-амінометил-бензилокси)-3-бром-5етокси-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 30b (250мг) і NaN3 (78мг) у ДМФ (10мл) перемішували протягом 2год. Реакційну суміш вливали у воду і осад відфільтровували, промивали водою і сушили у вакуумі (50°С). Вихід 197мг. MS-ESI: [М+Н]+=590,4/592,4; анал. РХВР: Rt=23,72хвил. (діаст. 1), Rt=24,12хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 3,5:1. (b) 4-[4-(3-амінометил-бензилокси)-3-бром-5етокси-феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 32а (133мг), трифенілфосфіну (зв'язан.) (150мг) і 10 крапель води у ТГФ/ДХМ=2:1 (об'єм/об'єм) перемішували при 40°С протягом 18год. Реакційну суміш фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 197мг (сіль ТФК). MS-ESI: [М+Н]+=564,2/566,2; анал. РХВР: Rt=10,31хвил. (діаст. 1), Rt=10,58хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 3:1. Приклад 33. 4-[3-бром-5-етокси-4-(3гідроксиметил-бензилокси)-феніл]-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Суміш продукту прикладу 30b (100мг) і СаСО3 (80мг) у діоксан/воді =1/1 (об'єм/об'єм) перемішували при 100°С протягом 18год. Реакційну суміш розбавляли ДХМ і додавали 2N HCL. Органічний шар відокремлювали, промивали насич. NaHCO3, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (20 100% ацетонітрилу). Вихід 44мг. MS-ESI: [М+Н]+=565,2/567,2; анал. РХВР: Rt=15,96хвил. (діаст. 1), Rt=16,33хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 4:1. Приклад 34. 1-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-3-метил-мочевина Суміш сполуки прикладу 19с і 4нітрофенілхлорформату (55мг) у ДХМ (4мл) перемішували протягом 2год. Додавали метиламін (2,7мл, 2М у ТГФ) і перемішували ще Згод. Реакційну суміш розбавляли ДХМ і промивали насич. NaHCO3. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР 53 (20 100% ацетонітрилу). Вихід 54мг. MS-ESI: [М+Н]+=607,2/609,2; анал. РХВР: Rt=15,88хвил. (діаст. 1), Rt=16,1хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 8:1. Приклад 35. {2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-амід піперазин-1карбонової кислоти Названу сполуку отримували способом, описаним у прикладі 34, з продукту прикладу 19с (150мг), 4-нітрофенілхлорформату (55мг) і піперазину (469мг). Залишок очищали препаративною РХВР (0 100% ацетонітрилу, 0,1% ТФК). Вихід 69мг (сіль ТФК). MS-ESI: [М+Н]+=10 662,2/664,2; анал. РХВР: Rt=11,70хвил. (діаст. 1), Rt=12,04хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 5:1. Приклад 36. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-бензил}-3,3-диметилбутирамід Ацилування продукту прикладу 32b (100мг) трет-бутилацетилхлоридом (27мкл) проводили способом, описаним у прикладі 1d. Вихід 33,5мг. MS-ESI: [M+H]+=662,4/664,4; анал. РХВР: Rt=21,26хвил. (діаст. 1), Rt=21,54хвил. (діаст. 2) (спосіб 1). Приклад 37. Етил-естер {3-[2-бром-4-(3-ціано2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]бензил}-карбамової кислоти Реакцію продукту прикладу 32Ь (100мг) з етилхлорформатом (19мкл) у присутності ДІПЕА (93мкл) проводили способом, описаним у прикладі 22. Вихід 37мг. MS-ESI: [M+H]+=636,2/638,2; анал. РХВР: Rt=19,81 25хвил. (діаст. 1), Rt=20,14хвил. (діаст. 2) (спосіб 1). Діаст. відношення: 4,5:1. Приклад 38. Метил-естер {3-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]піридин-2-іл]-карбамової кислоти (а) 4-(2-аміно-піридин-3-ілметокси)-3-бром-5етокси-бензальдегід Реакцію Міцунобу 3-бром-5-етокси-4-гідрокси бензальдегіду (490мг) з (2-аміно-піридин-3-іл)метанолом (250мг) проводили способом, описаним у прикладі 21d. Залишок хроматографували на силікагелі у суміші ДХМ/метанол=99/1 (об'єм/об'єм) як елюенті. Вихід 500мг. MS-ESI: [М+Н]+=351/353. (b) 4-[4-(2-аміно-піридин-3-ілметокси)-3-бром5-етокси-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Названу сполуку отримували способом, описаним у прикладі 1b, з продукту прикладу 38а (500мг), 3-амінокротонітрилу (116мг) і 5пропілциклогексан-1,3-діону (218мг). Вихід 290мг. MS-ESI: [М+Н]+=551/553. (c) Метил-естер{3-[2-бром-4-(3-ціано-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)6-етокси-феноксиметил]-піридин-2-іл)-карбамової кислоти Реакцію продукту прикладу 38b (50мг) з метилхлорформатом (8мкл) у присутності ДІПЕА (47мкл) проводили способом, описаним у прикладі 92007 54 22. Залишок очищали препаративною РХВР (10 90% ацетонітрилу). Вихід 17мг. MS-ESI: [M+H]+=609/611; анал. РХВР: Rt=13,82хвил. (діаст. 1), Rt=14,08хвил. (діаст. 2) (спосіб 5). Діаст. відношення: 7:2 Приклад 39. 4-(3-бром-5-етокси-4-{3-[(1 Німідазол-4-ілметил)-аміно]-бензилокси}-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Суміш продукту прикладу 1с (100мг), 1Німідазол-4-карбальдегіду (21мг), NaCNBH4 (25мг) і оцтової кислоти (114мкл) у метанолі (3мл) перемішували протягом 18год. Реакційну суміш розбавляли етилацетатом, промивали насич. NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (40 100% ацетонітрилу). Вихід 13мг. MS-ESI: [М+Н]+=550,2/552,2; анал. РХВР: Rt=7,27хвил. (спосіб 1). Діаст. відношення: 4:1. Приклад 40. 4-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-N-(2-метокси-етил)бензолсульфонамід (а) 4-бромметил-бензолсульфонілхлорид При 20°С бензоїлпероксид (600мг) додавали до суспензії 4-метил-30 бензолсульфонілхлориду (9,5г) і N-бромсукциніміду (8,9г) у 1,2дихлорпропані (60мл). Реакційну суміш перемішували при 80°С протягом 2год., потім концентрували і названу сполуку отримували, як білу тверду речовину після рекристалізації з гептану. Вихід 2,26г. (b) 4-бромметил-N-(2-метокси-етил)бензолсульфонамід При 20°С триетиламін (61мг) додавали до розчину продукту прикладу 40а (135мг) у діетилетер (2мл). Після 5хвил. додавали 2-метокси-етиламін (37мг). Реакційну суміш перемішували при 20°С протягом 3год. і концентрували у вакуумі. Залишок розчиняли у ДХМ (20мл) і промивали кілька разів насич. NaHCO3. Органічну фазу відокремлювали, сушили (MgSO4) і концентрували у вакуумі. Названий продукт отримували як коричневе масло. Вихід 120мг. MS-ESI: [М+Н]+=308/310. (с) 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N-(2-метокси-етил)бензолсульфонамід При 20°С розчин продукту прикладу 40b (120мг) у ДМФ (3мл) додавали до суспензії продукту 30а (222мг), K2СО3 (200мг) і КІ (10мг) у ДМФ (7мл). Реакційну суміш перемішували при 20°С протягом 16год., вливали у 10мл насич. NaHCO3 і екстрагували етилацетатом. Органічний шар концентрували, розчиняли у ДХМ і промивали водою, сушили (MgSO4) і концентрували у вакуумі. Названий продукт отримували препаративною РХВР (0 90% CH3CN, 0,1% ТФК). Вихід 22мг. MS-ESI: [М+Н]+=672/674; анал. РХВР: Rt=21,31хвил. (спосіб 2). Діаст. відношення: 4:1. Приклад 41. 4-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-N,N-діетилбензолсульфонамід 55 (а) 4-бромметил-N,N-діетилбензолсульфонамід Названу сполуку отримували, як у прикладі 40b, з діетиламіну (37мг) і продукту прикладу 40а (135мг). Вихід 122мг. Rf 25 (гептан/етилацетат (1/1, об'єм/об'єм))=0,45. MS-ESI: [М+Н]+=306/308. (b) 4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N,N-діетил-бензолсульфонамід Названу сполуку отримували, як у прикладі 40 с, з продукту прикладу 41а (122мг) і продукту прикладу 30а (222мг). Вихід 79мг. MS-ESI: [M+H]+=670/672; анал. РХВР: Rt=26,63хвил. (діаст. 1), 26,93хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 4:1. Приклад 42. N-{3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-метансульфонамід Сульфонілування продукту прикладу 1с (100мг) метансульфонілхлоридом(15мкл) проводили способом, описаним у прикладі 28. Вихід 46мг. MS-ESI: [M+H]+=628/630; анал. РХВР: Rt=20,76хвил. (діаст. 1), Rt=21,01хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 4:1. Приклад 43. {3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-амідтіофен-2сульфонової кислоти Сульфонілування продукту прикладу 1с (100мг) із тіофен-2-сульфонілхлорид (36мкл) проводили способом, описаним у прикладі 28. Вихід + 70мг. MS-ESI: [M+H] =696,2/698,2; анал. РХВР: Rt=23,75хвил. (спосіб 2). Діаст. відношення: 4:1. Приклад 44. ізопропіл-естер 4-[2-бром-4-(3ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]бензолсульфонової кислоти (а) ізопропіл-естер толуол-4-сульфонової кислоти При 0°С 4-метил-бензолсульфонілхлорид (3,8г) додавали до розчину 2-пропанолу (6,12мл) у піридині (6,6мл). Реакційну суміш перемішували при 0°С протягом 2год. і потім при 20°С протягом 16год. Реакційну суміш вливали у воду (150мл) і екстрагували ДХМ. Об'єднані органічні фази промивали 3М водною HCL і насич. NaHCO3. Після сушіння (MgSO4) і концентрування у вакуумі названий продукт отримували, як блідожовте масло. Вихід 2,89г. MS-ESl: [M+H]+=215. b) ізопропіл-естер 4-бромметилбензолсульфонової кислоти При 20°С бензоїлпероксид (48мг) додавали до розчину продукту прикладу 44а (956мг) і Nбромсукциніміду (712мг) у дейтерохлороформі (5мл). Реакційну суміш перемішували при 80°С протягом 3год., потім вливали у 20мл насич. NaHCO3 і екстрагують кілька разів ДХМ. Об'єднані органічні шари сушили (MgSO4) і концентрували у вакуумі. Названий продукт отримували як блідожовте масло. Вихід 1,06г. (с) ізопропіл-естер 4-[2-бром-4-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]бензолсульфонової кислоти 92007 56 Названу сполуку отримували, як у прикладі 40с, з продукту прикладу 44b (293мг) і продукту прикладу 30а (400мг). Вихід 38мг. MS-ESI: [М+Н]+=657/659; анал. РХВР: Rt=22,64хвил. (діаст. 1), Rt=22,64хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 10:1. Приклад 45. 3-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-1л)-6етокси-феноксиметил]-N-метилбензолсульфонамід (а) 3-бромметил-бензолсульфонілхлорид Названу сполуку отримували, як у прикладі 40а, з 3-метил-бензолсульфонілхлориду (8,5г), Nбромсукциніміду (8,9г) і бензоїлпероксиду (600мг) у дейтерохлороформі (20мл) як розчиннику. Вихід 3,1г. (b) 3-бромметил-N-метил-бензолсульфонамід Названу сполуку отримували, як у прикладі 40b, з метиламіну (105мг), продукту прикладу 45а (269мг) і продукту прикладу 30а (200мг). Вихід 220мг. MS-ESI: [М-Ме]+=250/252. (с) 3-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-N-метил-бензолсульфонамід Названу сполуку отримували, як у прикладі 40 с, з продукту прикладу 45b (220мг) і продукту прикладу 30а (200мг). Вихід 17мг. MS-ESI: [М+Н]+=628/630; анал. РХВР: Rt=20,7хвил. (діаст. 1), Rt=20,7хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 10:1. Приклад 46. 4-{3-бром-5-етокси-4-[3(морфолін-4-сульфоніл)-бензилокси]-феніл}-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (а) 4-(3-бромметил-бензолсульфоніл)морфолін Названу сполуку отримували, як у прикладі 40b, з морфоліну (137мкл) і продукту прикладу 45а (269мг). Вихід 280мг. (b) 4-{3-бром-5-етокси-4-[3-(морфолін-4сульфоніл)-бензилокси]-феніл}-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Названу сполуку отримували, як у прикладі 40с, з продукту прикладу 46а (280мг) і продукту прикладу 30а (200мг). Вихід 63мг. MS-ESI: [М+Н]+=684/686; анал. РХВР: Rt=22,84хвил. (спосіб 2). Діаст. відношення: 10:1. Приклад 47. 4-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-бензолсульфонова кислота При 20°С розчин КІ (91мг) у воді (0,5мл) додавали до розчину продукту прикладу 44с (37мг) в ацетоні (0,5мл). Реакційну суміш перемішували при 60°С протягом 16год. і вливали у воду (15мл). Після випарювання ацетону реакційну суміш екстрагували декілька разів ДХМ. Органічні фази об'єднували, сушили (MgSO4) і концентрували. Названий продукт отримували препаративною РХВР (0 90% CH3CN, 1% ТФК). Вихід 7мг. MS-ESI: [М+Н]+=617/615; анал. РХВР: Rt=14,31хвил. (діаст. 1), Rt=14,65хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 6:4 (РХВР). Приклад 48. N-{4-[2-бром-4-[3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл}-метансульфонамід 57 (а) 9Н-флуорен-9-ілметил-естер (4гідроксиметил-феніл)-карбамової кислоти Суміш (4-аміно-феніл)-метанолу (500мг), Fmoc-CI (1,2г) і піридину (1мл) у ТГФ (15мл) перемішували протягом 1год. Реакційну суміш розбавляли етилацетатом і промивали водою. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок перекристалізовували з ДХМ. Вихід 470мг. MS-ESI: [M+H]+=346. (b) 9Н-флуорен-9-ілметил-естер (4-хлорметилфеніл)-карбамової кислоти Тіонілхлорид (1,03мл) у ДХМ (5мл) додавали краплями до розчину продукту прикладу 48а (460мг) у ДХМ (10мл). Після перемішування протягом 2год. реакційну суміш концентрували у вакуумі. Вихід 476мг. Rf=0,75 (гептан/етилацетат=1/2 (об'єм/об'єм). (c) 9Н-флуорен-9-ілметилестер {4-[2-бром-4(3-ціано-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]феніл)-карбамової кислоти Суміш продукту прикладу 48Ь (100мг), продукту прикладу 30а (122мг) і K2СО3 (114мг) у ДМФ (5мл) перемішували протягом 4год. Реакційну суміш розбавляли етилацетатом і промивали водою і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 233мг MS-ESI: [M+H]+=772,4/774,4. (d) 4-[4-(4-аміно-бензилокси)-3-бром-5-етоксифеніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Піперидин (335мкл) у ДХМ (5мл) додавали краплями до розчину продукту прикладу 48с (223мг) у ДХМ (5мл). Після перемішування протягом 2год. реакційну суміш концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=1/4 (об'єм/об'єм) як елюенті. Вихід 55мг. MS-ESI: [M+H]+=550,2/552,2. (e) N-{4-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеноксиметил]-феніл}-метансульфонамід Метансульфонілхлорид (8мкл) і піридин (21мкл) додавали до розчину продукту прикладу 48d (50мг) у ДХМ (2мл). Після перемішування протягом 2год. реакційну суміш розбавляли етилацетатом і промивали водою. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок очищали препаративною РХВР (10 100% ацетонітрилу). Вихід 11мг. MS-ESI: [М+Н]+=628/630; анал. РХВР: Rt=19,78хвил. Діаст. відношення: 8:1. Приклад 49. N-{2-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6метокси-феноксиметил]-феніл}-метансульфонамід (а) 4-(3-бром-4-гідрокси-5-метокси-феніл)-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Названу сполуку отримували, як у прикладі 1b, з 3-бром-4-гідрокси-5-метокси-бензальдегіду (3,0г), 3-амінокротонітрилу (1,08г) і 5-пропілциклогексан1,3-діону (1,98г). Вихід 4,8г. MS-ESI: [М+Н]+=431/433. 92007 58 (b) 4-[3-бром-5-метокси-4-(2-нітро-бензилокси)феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил Названу сполуку отримували, як у прикладі 30b, з 1-бромметил-2-нітро-бензолу (200мг) і продукту прикладу 49а (400мг). Вихід 384мг. MS-ESI: [M+H]+=566/568; анал. РХВР: Rt=24,50хвил. (діаст. 1), Rt=24,95хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 10:1. (с) 4-[4-(2-аміно-бензилокси)-3-бром-5метокси-феніл]-2-метил-5-оксо-7-пропіл1,4,5,6,7,8-гексагідро-хінолін-3-карбонітрил Названу сполуку отримували, як у прикладі 19с, з продукту прикладу 49b (300мг). Вихід 289мг. MS-ESI: [М+Н]+=536/538; анал. РХВР: Rt=17,45хвил. (діаст. 1), Rt=17,91хвил. (діаст. 2) (спосіб 2). Діаст. відношення: 10:1. (d) N-{2-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6метокси-феноксиметил]-феніл}-метансульфонамід Названу сполуку отримували, як у прикладі 28, з продукту прикладу 49с (100мг) і метансульфонілхлориду (20мкм). Вихід 61мг. MS-ESI: [М+Н]+=614/616; анал. РХВР: Rt=22,20хвил. (спосіб 2). Діаст. відношення: 15:1. Приклад 50. аліл-естер {4-[2-бром-4-(3-ціано-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-4-іл)-6-етокси-феноксиметил]феніл}-карбамової кислоти (а) аліл-естер (4-гідроксиметил-феніл)карбамової кислоти АІІос-СІ (537г) у ДХМ (5мл) додавали краплями до розчину (4-аміно-феніл)-метанолу (500мг) і піридин (5мл) у ДХМ (5мл). Після перемішування протягом 2год. реакційну суміш розбавляли ДХМ і промивали водою. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Названу сполуку (243мг) отримували перекристалізацією з ДХМ. Маточний розчин хроматографували на силікагелі у суміші гептан/етилацетат =1/1 (об'єм/об'єм) як елюенті і отримали ще 245мг названої сполуки. Вихід 488мг. (b) аліл-естер (4-хлорметил-Феніл)-карбамової кислоти Названу сполуку отримували, як у прикладі 48b, з продукту прикладу 50а (480мг) і тіонілхлориду (1,7мл). Залишок хроматографували на силікагелі у суміші гептан/етилацетаті=1/1 (об'єм/об'єм) як елюенті. Вихід 310мг. (c) аліл-естер (4-[2-бром-4-(3-иіано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феноксиметил]-феніл)-карбамової кислоти Названу сполуку отримували, як у прикладі 48с, з продукту прикладу 50b (300мг) і продукту прикладу 30а (593мг). Вихід 333мг. MS-ESI: [М+Н]+=634,4/636,4; анал. РХВР: Rt=24,99хвил. (спосіб 2).Приклад 51. 4-[3-бром-5-етокси-4-(1метансульфоніл-1Н-пірол-2-ілметокси)-феніл]-2метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (а) 1-метансульфоніл-1Н-пірол-2-карбальдегід Розчин пірол-2-карбоксиальдегіду (500мг) у ТГФ (5мл) додавали до суспензії NaH (252мг, 60% 59 на дисперсія у маслі) у ТГФ (15мл). Після перемішування протягом 15хвил. додавали краплями розчин метансульфонілхлориду (570мкл) у ТГФ (5мл). Після перемішування протягом 1год. додавали воду (25мл) і ТГФ випарювали. Залишок розбавляли ДХМ і промивали водою, насич. NaHCO3 і розсолом. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат =1/1 (об'єм/об'єм) як елюенті. Вихід 265мг. b) (1-метансульфоніл-1 Н-пірол-2-іл)-метанол При 0°С LiBH4 (1,15мл, 2,0М у ТГФ) додавали краплями до розчину продукту прикладу 51а (265мг) у діетилетері (10мл). Після перемішування при 0°С протягом 30хвил. додавали воду (2мл) і оцтову кислоту (2мл, 10% у воді). Водний шар відокремлювали і екстрагували ДХМ. Органічний шар промивали водою і розсолом, відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 205мг. (c) 2-хлорметил-1-метансульфоніл-1Н-пірол При 0°С метансульфонілхлорид (136мкл) додавали краплями до розчину продукту прикладу 51 b (205мг) і ДІПЕА (307мкл) у ДХМ (6мл). Після перемішування протягом 30хвил. реакційну суміш розбавляли ДХМ (30мл) і промивали льодяною водою (30мл), 10% HCL (30мл) і насич. NaHCO3. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і концентрували у вакуумі. Вихід 252мг. (d) 4-[3-бром-5-етокси-4-(1-метансульфоніл1Н-пірол-2-ілметокси)-феніл]-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-3-карбонітрил Алкілування продукту прикладу 30а (539мг) продуктом прикладу 51с (252мг) проводили способом, описаним у прикладі 1а. Залишок очищали препаративною РХВР (40 100% ацетонітрилу). Вихід 363мг. MS-ESI: [М+Н]+=602,4/604,4; анал. РХВР: Rt=15,53хвил. (діаст. 1), Rt=15,99хвил. (діаст. 2) (спосіб 1). Діаст. відношен: 11:1. Приклад 52. N-[2-бром-4-(3-ціано-2-метил-5оксо-7-пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6етокси-феніл]-2-нітро-бензамід (а) 3-етокси-4-нітро-бензальдегід При 20°С йодетан (3,78г) додавали до суспензії K2СО3 (1,09г) і З-гідрокси-4-нітро-бензальдегіду (1,0г) у ДМФ (5мл). Реакційну суміш перемішували при 70°С протягом 18год., вливали у воду і екстрагували етилацетатом. Органічні фази об'єднували, сушили (MgSO4) і концентрували у вакуумі. Названий продукт отримували, як жовту тверду речовину. Вихід 1,17г. MS-ESI:[M+H]+=196. (b) 4-(3-етокси-4-нітро-феніл)-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил Названу сполуку отримували, як у прикладі 1Ь, з продукту прикладу 52а (1,16г), 3амінокротонітрилу (502мг) і 5-пропілциклогексан1,3-діону (920мг). Вихід 1,24г. MS-ESI: [M+H]+=396. (с) 4-(4-аміно-3-етокси-феніл)-2-метил-5-оксо7-пропіл-1,4,5,6,7,8-гексагідрохінолін-3карбонітрил 92007 60 Названу сполуку отримували, як у прикладі 19с, з продукту прикладу 52b (1,2г). Вихід 1,1г. MSESI: [M+H]+=366. (d) 4-(4-аміно-3-бром-5-етокси-феніл)-2-метил5-оксо-7-пропіл-1,4,5,6,7,8-гексагідро-хінолін-3карбонітрил При 0°С розчин брому (56мкл) у ДХМ (5мл) додавали повільно до суміші продукту прикладу 52с (365мг) і ацетату натрію (89мг) в оцтовій кислоті (10мл) і ДХМ (5мл). Реакційну суміш перемішували при 0°С протягом 1год., вливали у воду і потім екстрагували ДХМ. Органічні фази об'єднували, сушили (MgSO4) і концентрували у вакуумі, отримуючи названу сполуку після колонної флешхроматографії (силікагель, гептан/етилацетат (1/4, об'єм/об'єм), Rf=0,55). Вихід 1,17г. MS-ESI: [M+H]+=444/446. (e) N-[2-бром-4-(3-ціано-2-метил-5-оксо-7пропіл-1,4,5,6,7,8-гексагідрохінолін-4-іл)-6-етоксифеніл]-2-нітро-бензамід При 20°С 2-нітро-бензоїлхлорид (125мг) повільно додавали до розчину продукту прикладу 52d (200мг) і Ν,Ν-диметиланіліну (172мкл) у ТГФ (5мл). Реакційну суміш перемішували при 20°С до повного перетворення і потім вливали у насич. NaHCO3 і екстрагували етилацетатом. Органічні фази об'єднували, сушили (MgSO4) і концентрували у вакуумі. Названу сполуку отримували перекристалізацєю з ацетонітрилу. Вихід 37мг. MS-ESI: [М+Н]+=593/595; анал. РХВР: Rt=17,98хвил. (спосіб 2). Приклад 53. 4-[3-бром-5-етокси-4-(1трифлуорметансульфоніл-1Н-пірол-2-ілметокси)феніл]-2-метил-5-оксо-7-пропіл-1,4,5,6,7,8гексагідрохінолін-3-карбонітрил (a) 1-трифлуорметансульсЬоніл- 1Н-пірол-2карбальдегід При -78°С в атмосфері нітрогену трифлуорметансульфоновий ангідрид (3,2мл) додавали краплями до розчину пірол-2-карбоксиальдегіду (1г) і ДІПЕА (3,67мл) у ДХМ (100мл). Після перемішування протягом 5хвил. при -78°С реакційну суміш вливали у насич. NaHCO3 (200мл) і екстрагували ДХМ. Органічний шар відокремлювали, промивали водою, сушили (MgSO4), фільтрували і концентрували у вакуумі. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=2/1 (об'єм/об'єм) як елюенті. Вихід 675мг. (b) (1-трифлуорметансульфоніл-1Н-пірол-2іл)-метанол Названу сполуку отримували, як у прикладі 51b, з продукту прикладу 53а (300мг). Вихід 361мг. (c) 2-хлорметил-1-трифлуорметансульсроніл1Н-пірол Названу сполуку отримували, як у прикладі 51с, з продукту прикладу 53b (361мг). Вихід 391мг. (d) 3-бром-5-етокси-4-(1трифлуорметансульсфоніл-1Н-пірол-2-ілметокси)бензальдегід Алкілування 3-бром-5-етоксибензальдегіду (387мг) продуктом прикладу 53с (391мг) проводили способом, описаним у прикладі 1а. Залишок хроматографували на силікагелі у суміші гептан/етилацетат=3/1 (об'єм/об'єм) як елюенті. Вихід 208мг. MS-ESI: [М+Н]+=456,2/458,2.
ДивитисяДодаткова інформація
Назва патенту англійською4-phenyl-5-oxo-1,4,5,6,7,8-hexahydroquinoline derivatives the treatment of infertility
Автори англійськоюGrima Poveda Pedro Manuel, Karstens Willem Frederik Johan, Timmers Cornelis Marius
Назва патенту російськоюПроизводные 4-фенил-5-оксо-1,4,5,6,7,8-гексагидрохинолина для лечения бесплодности
Автори російськоюГрима Поведа Педро Мануэл, Карстенс Виллем Фредерик Йоган, Тиммерс Корнелис Мариус
МПК / Мітки
МПК: C07D 401/12, C07D 215/20, C07D 405/12, C07D 409/12, A61K 31/4709, C07D 417/12, A61K 31/47, A61P 5/24
Мітки: 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну, лікування, похідні, безплідності
Код посилання
<a href="https://ua.patents.su/36-92007-pokhidni-4-fenil-5-okso-145678-geksagidrokhinolinu-dlya-likuvannya-bezplidnosti.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохіноліну для лікування безплідності</a>
Попередній патент: Спосіб виробництва синтез-газу
Наступний патент: 4-феніл-5-оксо-1,4,5,6,7,8-гексагідрохінолінпохідні для лікування безплідності
Випадковий патент: Спосіб оцінки імунологічного стану слизової оболонки порожнини рота












