Вакцина проти інфекції снlamydia
Номер патенту: 97943
Опубліковано: 10.04.2012
Автори: Пробст Петер, Альдерсон Марк, Барт Бренда, Меттенс Паскаль, Скейкі Ясір А., Маркан Мартін, Нозе Флоренсе Бернадетт, Бхатія Айя, Месонне Жан-Франко Л., Лобет Івз
Формула / Реферат
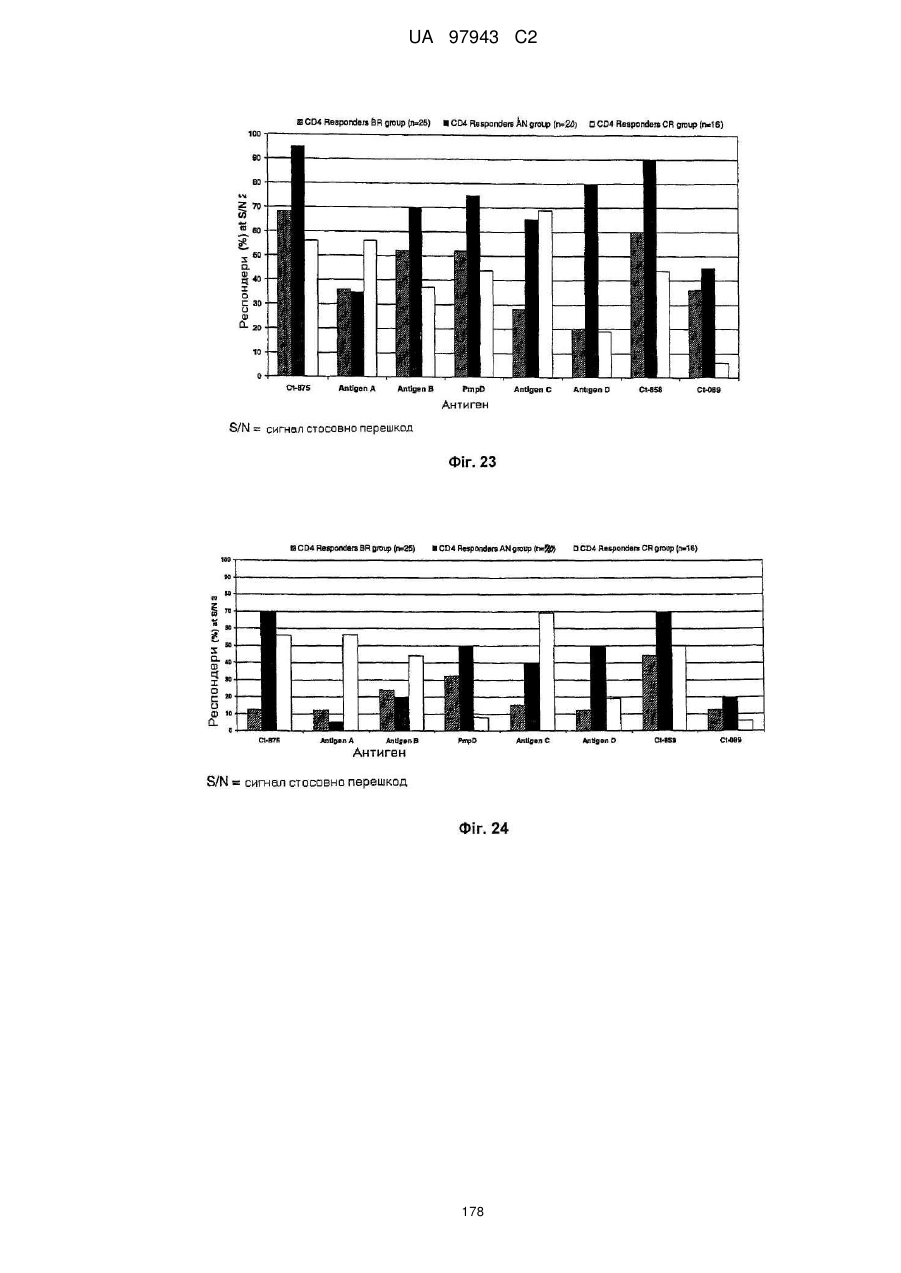
1. Композиція, яка містить комбінацію білка Сhlаmуdіа Сt-858 або його імуногенного фрагмента, або полінуклеотиду чи полінуклеотиду, що їх кодує, та щонайменше одного додаткового білка Сhlаmуdіа або його імуногенного фрагмента, або полінуклеотиду, що їх кодує, вибраного з Swib, Momp, Сt-875, Ct-622, Ct-089, домена-пасажира PmpG (PmpGpd) та домена-пасажира PmpD (PmpDpd).
2. Композиція за п. 1, яка містить білок Сhlаmуdіа Сt-089 або його імуногенний фрагмент, та білок Сhlаmуdіа Сt-858 або його імуногенний фрагмент, або полінуклеотиди, що їх кодують.
3. Композиція за п. 1 або 2, яка містить 2, 3, 4, 5 або 6 білків Сhlаmуdіа або імуногенних фрагментів, чи полінуклеотиди, що їх кодують.
4. Композиція за п. 2 або 3, що крім того містить білок Сhlаmуdіа Сt-875 або його імуногенний фрагмент, або полінуклеотид, що їх кодує.
5. Композиція за будь-яким з пп. 2, 3 або 4, що крім того містить білок Сhlаmуdіа PmpDpd або його імуногенний фрагмент, або полінуклеотид, що їх кодує.
6. Композиція за будь-яким з пп. 1-5, що крім того містить фармацевтично-прийнятний носій.
7. Композиція за будь-яким з пп. 1-6, що крім того містить ад'ювант.
8. Композиція за п. 7, де ад'ювант є преференційним стимулятором реакції Тh1.
9. Композиція за п. 8, де ад'ювант містить 3D-МРL, QS21 або комбінацію 3D-МРL та QS21.
10. Композиція за п. 9, де ад'ювант крім того містить емульсію масло-у-воді
11. Композиція за п. 9, де ад'ювант крім того містить ліпосоми.
12. Композиція за будь-яким з пп. 1-11, де два або більше білків або імуногенних фрагментів зв'язані з утворенням конденсованого білку, або полінуклеотид чи полінуклеотиди, що кодують білок або імуногенні фрагменти, кодує злиття двох або більше білків або імуногенних фрагментів.
13. Композиція, що містить одну з наступних комбінацій поліпептидів Сhlаmуdіа або імуногенних фрагментів, чи полінуклеотидів, що їх кодують:
1. Моmр, РmрDрd, Сt-858, Сt-089, Swіb
11. РmрDрd, Сt-858, Сt-089, Swіb,
2. Моmр, РmрDрd, Сt-858, Сt-622, Сt-089, Swіb
3. Моmр, РmрDрd, Сt-858, РmрGрd, Сt-622, Сt-089
4. Сt-858, Сt-875, Сt-622, Сt-089
5. Сt-858, Сt-875, Сt-089
51. РmрDрd, Сt-858, Сt-875, Сt-089
6. Моmр, РmрD, Сt-858, РmрGрd, Сt-089
1а. Усі п'ять з групи: Моmр, РmрDрd, Сt-858, РmрGрd та Сt-089
11а. Три з групи: РmрDрd, Сt-858, Сt-089, Swіb
2а. П'ять з групи: Моmр, РmрDрd, Сt-858, Сt-622, Сt-089 та Swіb
3а. П'ять з групи: Моmр, РmрDрd, Сt-858, РmрGрd, Сt-622 та Сt-089
4a. Три з групи: Сt-858, Сt-875, Сt-622 та Сt-089
5a. Два з групи: Сt-858, Сt-875 та Сt-089
51a. Три з групи: РmрDрd, Сt-858, Сt-875, Сt-089
6a. Чотири з групи: Моmр, РmрD, Сt-858, РmрGрd та Сt-089,
за умови, що в усіх композиціях 1а-6а представлені білки Сt-089 та Сt-858 або імуногенні похідні, чи полінуклеотиди, що їх кодують.
14. Композиція, що містить одну з наступних комбінацій поліпептидів Сhlаmуdіа або імуногенних фрагментів, чи полінуклеотидів, що їх кодують:
1b. Моmр, РmрDрd, Сt-858, Сt-875, Swіb, Сt-089
1b1. РmрDрd, Сt-858, Сt-875, Swіb, Сt-089
2b. Моmр, РmрDрd, Сt-858, Сt-622, Сt-875, Swіb, Сt-089
3b. Моmр, РmрDрd, Сt-858, РmрGрd, Сt-622, Сt-875, Сt-089
4b. Сt-858, Сt-875
5b. Моmр, Сt-858, Сt-875, Сt-089
5b1. Моmр, Сt-858, Сt-875
6b. Моmр, РmрD, Сt-858, РmрGрd, Сt-875, Сt-089
1с. П'ять з групи: Swіb, Моmр, РmрDрd, Сt-858, РmрGрd та Сt-875
1с1. Три з групи: РmрDрd, Сt-858, Сt-0875, Swіb
2с. П'ять з групи: Моmр, РmрDрd, Сt-858, Сt-622, Сt-875 та Swіb
3с. П'ять з групи: Моmр, РmрDрd, Сt-858, РmрGрd, Сt-622 та Сt-875
4с. Три з групи: Сt-858, Сt-875, Сt-622 та Сt-089
5с1. Три з групи: РmрDрd, Сt-858, Сt-875, Сt-089
6с. Чотири з групи: Моmр, РmрD, Сt-858, РmрGрd та Сt-875,
за умови, що в усіх композиціях 1b-6c представлені білки Сt-875 та Сt-858 або імуногенні похідні, чи полінуклеотиди, що їх кодують.
15. Композиція за будь-яким з пп. 1-14, де Swіb, Моmр, Сt-858, Сt-875, Сt-622, Сt-089, доменом-пасажиром РmрG (РmрGрd) та доменом-пасажиром РmрD (РmрDрd) або їх імуногенними фрагментами чи полінуклеотидами, коли вони представлені у композиції, є:
і. Сt-089 – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 16 (Сt-089 з серовару Е) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
іі. Сt-858 – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 6 (Сt-858 з серовару Е) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
ііі. Сt-875 – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 8 (Сt-858 з серовару Е) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
іv. домен-пасажир РmрD – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 14 (РmрD з серовару LІІ) його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
v. Swіb – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 2 (Swіb з серовару LІІ) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
vі. поліпептид Моmр, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 4 (Моmр з серовару F) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
vіі. Сt-622 – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 10 (Сt-622 з серовару Е) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує;
vііі. домен-пасажир РmрG – поліпептид, що має принаймні 95 % гомології відносно поліпептиду з SЕQ ІD NО: 12 (РmрG з серовару LІІ) або його імуногенного фрагменту, чи полінуклеотиду, що їх кодує.
16. Композиція за будь-яким з пп. 1-15, де усі білки Сhlаmуdіа або їх імуногенні фрагменти, або полінуклеотид чи полінуклеотиди, що їх кодують у композиції, є від Сhlаmуdіа trасhоmаtіs.
17. Застосування композиції за будь-яким з пп. 1-16 як медикаменту.
18. Застосування композиції за будь-яким з пп. 1-16 у виробництві медикаменту для лікування або запобігання Сhlаmуdіа інфекції.
19. Застосування за п. 18, де інфекцією Сhlаmуdіа є Сhlаmуdіа trachomatis.
20. Композиція за будь-яким з пп. 1-16, в якій РmрDрd або РmрGрd присутні як частина повної довжини РmрD або РmрG або їх фрагменти.
21. Застосування за будь-яким з пп. 17-19, де РmрDрd або РmрGрd присутні як частина повної довжини РmрD або РmрG або їх фрагменти.
22. Застосування білка Сhlаmуdіа Сt-858, його імуногенних фрагментів або полінуклеотиду, що їх кодує, та який походить від першого серовару Сhlаmуdіа trасhоmаtіs, у виробництві вакцини для лікування або запобігання інфекції Сhlаmуdіа другим сероваром Сhlаmуdіа trасhоmаtіs.
23. Застосування за п. 22, де вакцина містить два білки, їх імуногенні фрагменти або полінуклеотиди, що їх кодують, вибрані з Сt-089, Сt-858 та Сt-875.
24. Застосування за п. 23, де вакцина містить Сt-089 та Сt-858, їх імуногенні фрагменти або полінуклеотиди, що їх кодують.
25. Застосування за п. 23, де вакцина містить Сt-858 та Сt-875, їх імуногенні фрагменти або полінуклеотиди, що їх кодують.
26. Застосування за будь-яким з пп. 22-25, де вакцина містить Сt-089, Сt-858 та Сt-875, їх імуногенні фрагменти або полінуклеотиди, що їх кодують.
27. Застосування за будь-яким з пп. 22-26, де перший серовар Сhlаmуdіа trасhоmаtіs вибраний з переліку, що складається з сероварів Сhlаmуdіа trасhоmаtіs А, В, Ва, С, D, Dа, Е, F, G, Н, І, Іа, J, Jа, К, L1, L2 та L3.
28. Застосування за будь-яким з пп. 22-27, де серовар Сhlаmуdіа trасhоmаtіs вибрано з очних сероварів Сhlаmуdіа trасhоmаtіs.
29. Застосування за п. 28, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано з очних сероварів Сhlаmуdіа trасhоmаtіs А, В, Ва та С.
30. Застосування за будь-яким з пп. 22-27, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано з очно-статевих сероварів Сhlаmуdіа trасhоmаtіs.
31. Застосування за п. 30, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано з очно-статевих сероварів Сhlаmуdіа trасhоmаtіs D, Dа, Е, F, G, Н, І, Іа, J, Jа та К.
32. Застосування за будь-яким з пп. 22-27, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано з сероварів Сhlаmуdіа trасhоmаtіs LGV.
33. Застосування за п. 32, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано з сероварів LGV Сhlаmуdіа trасhоmаtіs L1, L2 та L3.
34. Застосування за будь-яким з пп. 22-33, де перший серовар Сhlаmуdіа trасhоmаtіs вибрано так, щоб він був сероваром Сhlаmуdіа trасhоmаtіs, що має високий рівень ідентичності послідовностей з більшістю інших сероварів Сhlаmуdіа trасhоmаtіs.
35. Застосування за будь-яким з пп. 22-33, де серовар Сhlаmуdіа trасhоmаtіs вибрано так, щоб він був сероваром Сhlаmуdіа trасhоmаtіs, що має високий рівень ідентичності послідовностей із більшістю звичайних сероварів Сhlаmуdіа trасhоmаtіs.
36. Застосування за будь-яким з пп. 22-35, де перший та другий серовари Сhlаmуdіа trасhоmаtіs є сероварами Сhlаmуdіа trасhоmаtіs, котрі асоційовані з тим же станом хвороби.
37. Застосування за будь-яким з пп. 22-35, де перш та друг серовари Сhlаmуdіа trасhоmаtіs є сероварами Сhlаmуdіа trасhоmаtіs, які асоційовані з різними станами хвороби.
38. Застосування за будь-яким з пп. 22-37, де вакцина містить один або більше додаткових антигенів.
39. Застосування за п. 38, де один або більше додаткових антигенів є антигенами Сhlаmуdіа trасhоmаtіs.
40. Застосування за п. 38 або 39, де один або більше додаткових антигенів вибрані з переліку, що складається з Моmр, Сt-622, РmрGрd та РmрDрd.
41. Застосування за будь-яким з пп. 22-40, де вакцина крім того містить ад'ювант.
42. Застосування за п. 41, де ад'ювант є преференційним стимулятором реакції Тh 1.
43. Застосування за п. 42, де ад'ювант містить 3D-МРL, QS21 або комбінацію 3D-МРL та QS21.
44. Застосування за п. 43, де ад'ювант крім того містить емульсію масло-у-воді.
45. Застосування за п. 43, де ад'ювант крім того містить ліпосоми.
46. Спосіб визначення попередньої інфекції Сhlаmуdіа у особи, який має етапи:
(і) отримання зразка від особи;
(іi) контактування зазначеного зразка від особи з комбінацією білка Сhlаmуdіа Сt-858 або його імуногенного фрагмента, або полінуклеотиду, що їх кодує, та щонайменше одного іншого білка Сhlаmуdіа або його імуногенного фрагмента, або полінуклеотиду, що їх кодує, вибраного з Swib, Momp, Сt-858, Сt-875, Ct-622, Ct-089, домена-пасажира PmpG (PmpGpd) та домена-пасажира PmpD (PmpDpd);
(ііi) визначення реакції зразку.
47. Спосіб за п. 46, де комбінація білків Сhlаmуdіа або їх імуногенних фрагментів, або полінуклеотиду чи полінуклеотидів, що їх кодують, містить два білки, їх імуногенні фрагменти або полінуклеотиди, що їх кодують, які вибрані з наступного переліку: Сt-089, Сt-858 та Сt-875.
48. Спосіб за п. 47, де два вакцинні білки Сhlаmуdіа, їх фрагменти або полінуклеотид, що їх кодує, є Сt-089 та Сt-858.
49. Спосіб за п. 47, де два вакцинні білки Сhlаmуdіа, їх фрагменти або полінуклеотид, що їх кодує, є Сt-875 та Сt-858.
50. Спосіб за п. 48, де комбінація білків Сhlаmуdіа або їх імуногенних фрагментів, або полінуклеотиду чи полінуклеотидів, що їх кодують, включає Сt-089, Сt-858 та Сt-875.
51. Спосіб за будь-яким з пп. 46-50, де зразком є суцільна кров.
52. Спосіб за будь-яким з пп. 46-50, де зразком є очищені клітини.
53. Спосіб за будь-яким з пп. 46-50, де реакцію визначають моніторингом проліферації лімфоцитів.
54. Спосіб за будь-яким з пп. 46-50, де реакцію визначають моніторингом отримання цитокінів.
55. Спосіб за будь-яким з пп. 46-50, де реакцію визначають моніторингом отримання специфічних антитіл.
56. Спосіб за будь-яким з пп. 46-55, де особа є серонегативною.
57. Спосіб за будь-яким з пп. 46-55, де особа є серопозитивною.
Текст
Реферат: Заявлений винахід належить до композиції, яка містить комбінацію білка Сhlаmуdіа Сt-858 або його імуногенного фрагмента, або полінуклеотиду чи полінуклеотиду, що їх кодує, та щонайменше одного додаткового білка Сhlаmуdіа або його імуногенного фрагмента, або полінуклеотиду, що їх кодує, вибраного з Swib, Momp, Сt-875, Ct-622, Ct-089, домена-пасажира PmpG та домена-пасажира PmpD та способів застосування таких білків або полінуклеотидів у лікуванні, попередженні чи діагностиці інфекції Chlamydia. UA 97943 C2 (12) UA 97943 C2 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід загалом стосується лікування або попередження інфекції Chlamydia. Зокрема, винахід стосується композицій поліпептидів, що містять антиген хламідії та його комбінації, та композицій полінуклеотидів, що кодують антиген хламідії та його комбінації, та застосування таких композицій для профілактики або лікування інфекції Chlamydia. Хламідії є внутрішньоклітинними бактеріальними патогенами що відповідальні за широку різноманітність важливих інфекцій людини та тварин. Chlamydia trachomatis переноситься серед людей через соціальний або сексуальний контакт. Існує ряд сероварів Chlamydia trachomatis, та хоча ідентифікація та класифікація сероварів продовжує розвиватися, принаймні про 18 повідомлено на сьогодні. Серовари А - С головним чином асоційовані з трахомою очей, серовари D - К з очно-статевою хворобою, а серовари L1 - L3 з паховим бубоном (LGV) (Brunham, RC et al. J. Nat. Rev. Immunol. 20055:149161). Chlamydia trachomatis є одною з найголовніших причин сексуально передатних хвороб та може викликати тазову запальну хворобу (РID), призводячи до закупорки труб та безплідності. Chlamydia trachomatis може також грати роль у безплідності самців. У 1990р вартість лікування PID у США була оцінена у $4 мільярди. World Health Organisation оцінено, що у 1999 зверх 90 мільйонів нових випадків сексуально передатної Chlamydia trachomatis відбувалося в усьому світі (Global Prevalence та Incidence of Selected Curable Sexually Transmitted Infections, World Health Organisation, Geneva, 2001). Більш того, виразкові сексуально передатні хвороби, як-то інфекція Chlamydia trachomatis, є головним фактором ризику стосовно набуття ВІЛ (Brunham, RC et al. J. Nat. Rev. Immunol. 2005 5:149-161 ; Igietseme, JU et al. Expert Rev. Vaccines 2003 2(1):129-146). Трахома внаслідок очної інфекції Chlamydia trachomatis є головною причиною сліпоти в усьому світі, і як оцінено, вражає 300-500 мільйонів людей (West, SK Prog. Ret. Eye Res. 2004 23:381-401). Сучасне лікування полягає у застосуванні антибіотиків, як-то тетрациклін (щодоби, протягом 4-6 тижнів) або азитроміцин (одиничною дозою). При ефективності у боротьбі з інфекцією, повторна інфекція загалом відбувається внаслідок ендемічної природи інфекції. Повторна інфекці протягом багатьох років викликає рубцювання повік, спотворення нижчого краю повік та потертість шпаринки очей проти роговиці (трихіаз). Стійка травма роговиці є болючою та викликає непрозорість роговиці та сліпоту (Mabey, DCW et al. Lancet 2003 362:223229). Chlamydia pneumonia є головним чинником гострих інфекцій респіраторного тракту у людини та, можна вважати, також грає роль у патогенезі атеросклерозу, а зокрема, коронарної хвороби серця. Особи з високим титром антитіл до хламідійної пневмонії показані як принаймні удвічі сприйнятливіші до коронарної хвороби серця як серонегативні особи. Часто інфекція Chlamydia є безсимптомною та не встановленою клінічним спостереженням, так що суворі та часто необоротні ускладнення можуть бути першими симптомами статевої інфекції. Діти, народжені від матері із статевою інфекцією Chlamydia можуть захворювати пневмонією та Chlamydia trachomatis вважають найголовнішим чинником пневмонії протягом перших 6 місяців життя (de la Maza, LM et al. Curr. Opin. Investig. Drugs 2002 3(7):980-986). Інфекції Chlamydia таким чином являють значну проблему для здоров'я у розвинених країнах та країнах, що розвиваються. Відносно загальнонародного здоров'я та факту що вартість сучасного лікування є надмірною у багатьох країнах, що розвиваються, розробки вакцин для видів Chlamydia є важливою метою для дослідження. Оскільки геномна будова Chlamydia trachomatis є відносно стабільною, а наявність тваринних резервуарів є незначною, навіть вакцини з обмеженою ефективністю можуть мати значний вплив на поширення інфекцій. Таким чином у галузі залишається необхідність у поліпшених вакцинах та pharmaceutical композиції для попередження та лікування інфекції Chlamydia. Також у галузі залишається необхідність у полівалентних вакцинах для попередження та лікування інфекції Chlamydia trachomatis, котрі ефективні проти ряду сероварів. Заявлений винахід задовольняє ці потреби та крім того забезпечує інші пов'язані переваги. Заявлений винахід стосується композиції, що містить антигени бактеріальних патогенів Chlamydia Такі бактеріальні патогени охоплюють Chlamydia trachomatis, Chlamydia psitacci, Chlamydia pneumonia, та Chlamydia muridarum. Антигени хламідії можуть бути похідними від ряду сероварів серед видів Chlamydia. Слід зауважити, що Chlamydia muridarum була раніше відома як штам Chlamydia trachomatis пневмоніту мишей (МоРn), ці назви є ще у звичайному застосуванні, хоча вони стосуються одної бактерії. Для відповідності застосовано тут тільки назву Chlamydia muridarum. Заявлений винахід частково базується на відкритті винахідників, що поліпептиди Chlamydia мають імуногенні та антигенні властивості та можуть давати захист проти інфекції Chlamydia 1 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 при застосуванні як профілактичної вакцини. Деякий рівень перехресної реактивності може бути спостереженим між антигенами відмінних сероварів та різновидів, а тому антигени хламідії передбачувано забезпечуватимуть захисну імунну реакцію проти різновиду або серовару іншого, ніж тій, з котрого було отримано антиген. Більш конкретно, винахідники відкрили, що деякі комбінації поліпептидів Chlamydia дають гарну імунну peaкцію. Деякі комбінації поліпептидів Chlamydia, як показано, забезпечують захист проти інфекції Chlamydia на моделяхмишах. У конкретному втіленні виділені або очищені поліпептиди Chlamydia винаходу можна формувати як фармацевтичні композиції для застосування у попередженні та/або лікуванні інфекції Chlamydia. Імуногенність композиції білку можна посилити уведенням ад'юванту. У конкретному втіленні виділені або очищені поліпептиди Chlamydia застосовують як комбінації індивідуальних антигенів, необов'язково у комбінації з ад'ювантом. Альтернативно, поліпептиди Chlamydia застосовують у формі конденсованого білку, необов'язково у і комбінації з ад'ювантом. У ще одному аспекті винаходу, виділені або очищені полінуклеотиди застосовують для отримання рекомбінантних поліпептидних антигенів in vitro. Альтернативно, полінуклеотиди можна застосовувати як полінуклеотидні вакцини для виклику експресії антигену та наступного індукування імунної реакції проти Chlamydia. У наступному аспекті винаходу деякі комбінації поліпептидів Chlamydia згідно з заявленим винаходом, їх імуногенні фрагменти або полінуклеотиди, що їх кодують, котрі є похідними від першого серовару Chlamydia trachomatis, можна застосовувати для лікування або попередження інфекції Chlamydia від другого серовару Chlamydia trachomatis. Також об'єкт винаходу полягає у застосуванні поліпептидів в аналізах in vitro для визначення опосередкованої гуморальними антитілами або клітинами імунності проти Chlamydia для діагнозу інфекції або контролювання прогресування хвороби. Альтернативно, поліпептиди можна застосовувати як імуногени для створення антитіла проти Chlamydia у тварини. Антитіла можна застосовувати для визначення цільових антигенів in vivo та in vitro. Фіг. 1 показує дані на добу 7 виділення бактерій у мишей Balb/c, що є даними трьох експериментів, у котрих групи з 5 мишей Balb/c імунізували визначеними комбінаціями антигенів у AS01 В. Графік дає дані трьох експериментів, у котрих групи з 5 мишей Balb/c імунізували визначеною комбінацією антигенів в ад'юванті AS01 В. UV ЕВ з серовару Е, що сформовано з AS01 В, є позитивним контролем захисту, а удавано імунізованих AS01 В мишей застосовували як позитивний контроль інфекції. Оброблених 5 прогестероном мишей антигенно стимулювали інтравагінальною дозою 5x10 IFU серовару К. Виділення бактерій визначали узяттям мазків на добу 7 після інфекції та визначенням IFU на клітинах McCoy. Дані від одного послідовного експерименту поєднували. Фіг. 2 показує виділення Chlamydia у LGT та навантаження Chlamydia після антигенного стимулювання сероваром Chlamydia trachomatis К у UGT мишей Balb/c, імунізованих комбінаціями антигенів. Графіки представляють дані з послідовних експериментів, у котрих групи з 8 мишей Balb/c імунізували визначеною комбінацією антигенів в ад'юванті AS01 В. UV ЕВ з серовару Е, що сформовано з AS01 В, є позитивним контролем захисту, а удавано імунізованих AS01 В мишей застосовували як контроль інфекції. Оброблених прогестероном 5 мишей антигенно стимулювали інтравагінальною дозою 5x10 IFU серовару К. Виділення бактерій визначали узяттям мазків на добу 7 після антигенного стимулювання та визначенням IFU на клітинах McCoy. Мишей вбивали через 10 діб після інфекції для визначення навантаження Chlamydia у верхньому статевому тракті гомогенізуванням половини UGT та визначенням IFU на клітинах McCoy. Слід зауважити, що межа визначення бул 10 відносно обох з вищенаведених графіків. Фіг. 3 показує дані стосовно виділення бактерій на добу 7 у мишей С57ВІ/6, імунізованих визначеними комбінаціями антигенів у AS01 В. Графіки представляють дані з послідовних експериментів, у котрих групи з 8 мишей Balb/c імунізували визначеною комбінацією антигенів у AS01 В. UV ЕВ з серовару Е, що сформовано з AS01 В, є позитивним контролем захисту, а удавано імунізованих AS01 В мишей застосовували як контроль інфекції. Оброблених 5 прогестероном мишей антигенно стимулювали інтравагінальною дозою 5x10 IFU серовару К. Виділення бактерій визначали узяттям мазків на добу 7 після антигенного стимулювання та визначенням IFU на клітинах McCoy. Фіг. 4 показує дані стосовно виділення бактерій на добу 7 у мишей Balb/c, імунізованих визначеними комбінаціями антигенів у AS01 В. Графіки представляють поєднані дані з 5 експериментів, у котрих групи з 5-8 мишей Balb/c імунізували визначеною комбінацією антигенів у AS01 В. UV ЕВ з серовару Е, що сформовано з AS01 В, є позитивним контролем захисту, а 2 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 удавано імунізованих AS01 В мишей застосовували як контроль інфекції. Оброблених 5 прогестероном мишей антигенно стимулювали інтравагінальною дозою 5x10 IFU серовару К. Виділення бактерій визначали узяттям мазків на добу 7 після антигенного стимулювання та визначенням IFU на клітинах McCoy. Фіг. 5 показує дані стосовно виділення бактерій на добу 7 у мишей С57ВІ/6, імунізованих визначеними комбінаціями антигенів у AS01 В. Графіки представляють поєднані дані з 3 експериментів, у котрих групи з 5-8 мишей С57ВІ/6 імунізували визначеною комбінацією антигенів у AS01 В. UV ЕВ з серовару Е, що сформовано з AS01 В, є позитивним контролем захисту, а удавано імунізованих AS01 В мишей застосовували як контроль інфекції. Оброблених 5 прогестероном мишей антигенно стимулювали інтравагінальною дозою 5x10 IFU серовару К. Виділення бактерій визначали узяттям мазків на добу 7 після антигенного стимулювання та визначення IFU на клітинах McCoy. Фіг. 6 показує вивірення послідовностей для Ct-089 з серовару Е Chiamydia trachomatis із Ct089 з ряду інших сероварів Chiamydia trachomatis. Фіг. 7а та 7b показують вивірення послідовностей для Ct-858 з серовару Е Chiamydia trachomatis із Ct-858 з ряду інших сероварів Chiamydia trachomatis. Фіг. 8а та 8b показують вивірення послідовностей для Ct-875 з серовару Е Chiamydia trachomatis із Ct-875 з ряду інших сероварів Chiamydia trachomatis. Фіг. 9 показує результати порівняння ідентичності амінокислотних послідовностей Ct-089 з серовару Е Chiamydia trachomatis із Ct-089 з ряду інших сероварів Chiamydia trachomatis. Фіг. 10 показує результати порівняння ідентичності амінокислотних послідовностей Ct-858 з серовару Е Chiamydia trachomatis із Ct-858 з ряду інших сероварів Chiamydia trachomatis. Фіг. 11 показує результати порівняння ідентичності амінокислотних послідовностей Ct-875 з серовару Е Chiamydia trachomatis із Ct-875 з ряду інших сероварів Chiamydia і trachomatis. Фіг. 12 показує вивірення послідовностей для Ct-089 з серовару Е Chiamydia trachomatis з еквівалентними білками з інших сероварів Chiamydia trachomatis та видів Chiamydia. Фіг 13 показує вивірення послідовностей для Ct-858 з серовару Е Chiamydia trachomatis з еквівалентними білками з інших сероварів Chiamydia trachomatis та видів Chiamydia. Фіг. 14 показує вивірення послідовностей для Ct-875 з серовару Е Chiamydia trachomatis з еквівалентними білками з інших сероварів Chiamydia trachomatis та видів Chiamydia. Фіг. 15 показує результати мазків, узятих з імунізованих сероваром Е Chiamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей чотири доби після антигенного стимулювання сероварами Chiamydia trachomatis D, К або J. UV ЕВ у кожному випадку є похідними з того ж сервовару, застосованого для антигенного стимулювання (тобто, J, D та К відповідно). Both UV ЕВ та комбінаці лікування проводять при наявності ад'юванту (тобто, AS01 В). Фіг. 16 показує результати мазків, узятих з імунізованих сероваром Е Chiamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей сім діб після антигенного стимулювання сероварами Chiamydia trachomatis D, К або J. UV ЕВ у кожному випадку є похідними з того ж сервовару, застосованого для антигенного стимулювання (тобто, J, D та К відповідно). Лікування UV ЕВ та комбінацією проводять при наявності ад'юванту (тобто, AS01 В). Фіг. 17 показує колонізацію UGT з імунізованих сероваром Е Chlamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей десять діб після антигенного стимулювання сероварами Chlamydia trachomatis D, К або J. UV ЕВ у кожному випадку є похідними з того ж сервова-ру, застосованого для антигенного стимулювання (тобто, J, D та К відповідно). Лікування UV ЕВ та комбінацією проводять при наявності ад'юванту (тобто, AS01 В). Фіг. 18 показує результати мазків, узятих з імунізованих сероваром Е Chlamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей чотири доби після антигенного стимулювання сероварами Chlamydia trachomatis K або J. UV ЕВ у кожному випадку є похідними з того ж сервовару, застосованого для антигенного стимулювання (тобто, J та К відповідно). Лікування UV ЕВ та комбінацією проводять при наявності ад'юванту (тобто, AS01 В). Фіг. 19 показує результати мазків, узятих з імунізованих сероваром Е Chlamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей сім діб після антигенного стимулювання сероварами Chlamydia trachomatis K або J. UV ЕВ у кожному випадку є похідними з того ж сервовару, застосованого для антигенного стимулювання (тобто, J та К відповідно). Лікування UV ЕВ та комбінацією проводять при наявності ад'юванту (тобто, AS01 В). Фіг. 20 показує колонізацію UGT з імунізованих сероваром Е Chlamydia trachomatis Ct-089, Ct-858 та Ct-875 мишей десять діб після антигенного стимулювання сероварами Chlamydia trachomatis K або J. UV ЕВ у кожному випадку є похідними з того ж сервовару, застосованого для антигенного стимулювання (тобто, J та К відповідно). Лікування UV ЕВ та комбінацією проводять при наявності ад'юванту (тобто, AS01 В). 3 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 21 показує співвідношення респондерів CD4 (для сигналу стосовно відсічки перешкод S/N принаймні 2:1) для стимуляції рядом антигенів для ряду груп серопозитивних осіб. Фіг. 22 показує співвідношення респондерів CD4 (для сигналу стосовно відсічки перешкод принаймні 3:1) для стимуляції рядом антигенів для ряду груп серопозитивних осіб. Фіг. 23 показує співвідношення респондерів CD4 (для сигналу стосовно відсічки перешкод принаймні 2:1) для стимуляції рядом антигенів та його комбінації для ряду груп серопозитивних осіб. Заявлений винахід стосується композицій, що містять комбінації антигенів, корисних для діагнозу, попередження та лікування інфекції Chlamydia, полінуклеотидів, що кодують такі антигени, та способів їх застосування. Антигени заявленого винаходу є поліпептидами антигенів хламідії та їх імуногенними фрагментами. Зокрема, композиції заявленого винаходу можуть містити комбінацію двох або більше білків Chlamydia або їх імуногенних фрагментів. Такі білки можна вибрати зі Swib (також відомий як Ct460), Momp (головний білок зовнішньої мембрани, також відомий як Ct-681), Ct-858, Ct-875, Ct622, Ct-089 (також відомі як CopN), домену-пасажиру PmpG (PmpGpd, також відомий як Ct-871) та домену-пасажиру PmpD (PmpDpd, також відомий як Ct-812). Наприклад, композиція заявленого винаходу може містити Ct-089 та Ct-858 або їх імуногенні фрагменти та необов'язково додаткові антигени, котрі можна вибрати, наприклад, з Momp, Ct-875, Ct-622, PmpGpd та PmpDpd. Y further приклад, композиція заявленого винаходу може містити Ct-875 та Ct-858 або їх імуногенні фрагменти та необов'язково додаткові антигени, котрі можна вибрати, наприклад, з Momp, Ct-622, Ct-089, PmpGpd та PmpDpd. Наприклад, композиція заявленого винаходу може містити одну з наступних комбінацій поліпептидів Chlamydia або їх імуногенних фрагментів: 1. Momp, PmpDpd, Ct-858, Ct-089, Swib 1, PmpDpd, Ct-858, Ct-089, Swib 2. Momp, PmpDpd, Ct-858, Ct-622, Ct-089, Swib 3. Momp, PmpDpd, Ct-858, PmpGpd, Ct-622, Ct-089 4. Ct-858, Ct-875, Ct-622, Ct-089 5. Ct-858, Ct-875, Ct-089 1 5 . PmpDpd, Ct-858, Ct-875, Ct-089 6. Momp, PmpD, Ct-858, PmpGpd, Ct-089 Усі з вищенаведених комбінацій містять Ct-089 та Ct-858. У наступних прикладах композиція заявленого винаходу містить одну з наступних комбінацій, за умови, що усі комбінацій містять Ct-089 та Ct-858: 1 а. Усі п'ять з: Momp, PmpDpd, Ct-858, PmpGpd та Ct-089 1'a. Три поза: PmpDpd, Ct-858, Ct-089, Swib 2a. П'ять поза: Momp, PmpDpd, Ct-858, Ct-622, Ct-089 та Swib 3а. П'ять поза: Momp, PmpDpd, Ct-858, PmpGpd, Ct-622 та Ct-089 4a. Три поза: Ct-858, Ct-875, Ct-622 та Ct-089 5a. Два поза: Ct-858, Ct-875 та Ct-089 5'a. Три поза: PmpDpd, Ct-858, Ct-875, Ct-089 6a. Чотири поза: Momp, PmpD, Ct-858, PmpGpd та Ct-089 або альтернативно 1a". П'ять поза: Swib, Momp, PmpDpd, Ct-858, PmpGpd та Ct-089 Інші зразкові композиції заявленого винаходу можуть містити одну з наступних комбінацій поліпептидів Chlamydia або їх імуногенних фрагментів: 1b. Momp, PmpDpd, Ct-858, Ct-875, Swib, Ct-089 1 1b . PmpDpd, Ct-858, Ct-875, Swib, Ct-089 2b. Momp, PmpDpd, Ct-858, Ct-622, Ct-875, Swib, Ct-089 3b. Momp, PmpDpd, Ct-858, PmpGpd, Ct-622, Ct-875, Ct-089 4b. Ct-858, Ct-875 5b. Momp, Ct-858, Ct-875, Ct-089 1 5b . Momp, Ct-858, Ct-875 6b. Momp, PmpD, Ct-858, PmpGpd, Ct-875, Ct-089 Усі з вищенаведених комбінацій містять Ct-875 та Ct-858. У наступних прикладах, композиція заявленого винаходу містить одну з наступних комбінацій, за умови, що усі комбінації містять Ct-875 та Ct-858: 1с. П'ять поза: Swib, Momp, PmpDpd, Ct-858, PmpGpd та Ct-875 1c'. Три поза: PmpDpd, Ct-858, Ct-0875, Swib 2c. П'ять поза: Momp, PmpDpd, Ct-858, Ct-622, Ct-875 та Swib 3c. П"ять поза: Momp, PmpDpd, Ct-858, PmpGpd, Ct-622 та Ct-875 4c. Три поза: Ct-858, Ct-875, Ct-622 та Ct-089 1 5c . Три поза: PmpDpd, Ct-858, Ct-875, Ct-089 4 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 6c. Чотири поза: Momp, PmpD, Ct-858, PmpGpd та Ct-875 Композиції згідно з винаходом містять два або більше білків Chlamydia або імуногенних фрагментів, наприклад, 3, 4, 5, 6, 7, 8, 9 або 10 білків або імуногенних фрагментів. Для композиції, що містить кожну з вищенаведених комбінацій під номерами 1-6,1 а-6а, 1 b-6b та 1с6с (наприклад, 1 -6 та 1а-6а), комбінація може містити додаткові антигени хламідії, наприклад, один додатковий антиген хламідії, або може містити не більше антигенів хламідії, ніж перерахованих. Наприклад, композиція 1а" може містити тільки п'ять антигенів, котрі є комбінацією перерахованих антигенів хламідії та без інших антигенів, або композиція 1а" може містити комбінацію п'яти перерахованих антигенів хламідії (як-то усі 6 перераховані антигенів, або п'ять з 6 перерахованих антигенів плюс один інший антиген хламідії), та також для композиції 2-6, 2а-6а, 1 b-6b та 1с-6с (наприклад, 2-6 та 2а-6а). Ясно, що у випадку доменів-пасажирів PmpD та PmpG, вони можуть бути у складі більшої частини антигену або полінуклеотиду PmpD або PmpG, наприклад, PmpD або PmpG повної довжини або їх фрагменту, за умови, що фрагмент містить домен-пасажир. Білки або імуногенні фрагменти Momp та Swib можуть бути наприклад, від Chlamydia trachomatis, або вони можуть бути з інших різновидів Chlamydia. Антигени, позначені вище "Ct", можуть бути білками або імуногенними фрагментвми Chlamydia trachomatis, або, коли можливо, вони можуть бути еквівалентними білками від відмінних різновидів Chlamydia (тобто, видів Chlamydia інших, ніж Chlamydia trachomatis). В одному прикладі усі антигени у композиції згідно з винаходом є від Chlamydia trachomatis. Композиції заявленого винаходу можуть альтернативно містити полінуклеотиди, що кодують комбінаці двох або більше білків або імуногенних фрагментів Chlamydia, котрі можна вибрати зі Swib (також відомою як Ct-460), Momp (головний білок зовнішньої мембрани також відомою як Ct-681), Ct-858, Ct-875, Ct-622, Ct-089, домену-пасажиру PmpG (PmpGpd, також відомою як Ct871) та домену-пасажиру PmpD (PmpDpd, також відомою як Ct-812), наприклад, вищезазначених комбінацій антигенів, а саме 1-6, 1а-6а, 1b-6b та 1с-6с (наприклад, 1-6). Композиції полінуклеотидів згідно з винаходом охоплюють ті, котрі кодують комбінації антигенів згідно з винаходом, описані тут (наприклад, Ct-858 та Ct-875). Полінуклеотиди, що кодують відмінні антигени, можуть бути окремими нуклеїновими кислотами, або вони можуть бути разом у одиничній нуклеїновій кислоті чи комбінації окремих та комбінованих нуклеїнових кислот. Далі представлено полінуклеотидні та поліпептидні послідовності для деяких антигенів, котрі можна застосовувати у композиціях винаходу, та котрі перераховані вище. SEQ ID NO:1 є послідовністю кДНК Ct-460, також відомою як Swib від Chlamydia trachomatis, серовар LGVII (серовар LGVII також названо яксеровар LII). SEQ ID NO:2 є послідовністю білку Ct-460, також відомою як Swib від Chlamydia trachomatis, серовар LGVII, цей білок є кодованим SEQ ID NO:1. SEQ ID NO:3 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Momp) від Chlamydia trachomatis, серовар F. SEQ ID NO:4 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Momp) від Chlamydia trachomatis, серовар F, цей білок є кодованим SEQ ID N0:3. SEQ ID NO:5 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар Е. SEQ ID NO:6 є послідовністю білку Ct-858 Chlamydia trachomatis, серовар Е, цей білок є кодованим SEQ ID N0:5. SEQ ID NO:7 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар Е. SEQ ID NO: 8 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар Е, цей білок є кодованим SEQ ID NO: 7. SEQ ID NO: 9 є послідовністю кДНК Ct-622 від Chlamydia trachomatis, серовар Е. SEQ ID NO: 10 є послідовністю білку Ct-622 від Chlamydia trachomatis, серовар Е, цей білок є кодованим SEQ ID NO: 9. SEQ ID NO: 11 є послідовністю кДНК домену-пасажиру PmpG, також відомого як Ct-871 від від Chlamydia trachomatis, серовар LGVII. SEQ ID NO: 12 є послідовністю білку домену-пасажиру PmpG, також відомого як Ct-871 від Chlamydia trachomatis, серовар LGVII, цей білок є кодованим SEQ ID NO: 11. SEQ ID NO: 13 є послідовністю кДНК домену-пасажиру PmpD, також відомого як Ct-812, від Chlamydia trachomatis, серовар LGVII. SEQ ID NO: 14 є послідовністю білку домену-пасажиру PmpD, також відомого як Ct-812, від Chlamydia trachomatis, серовар LGVII, цей білок є кодованим SEQ ID NO: 13. SEQ ID NO: 15 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар Е. SEQ ID NO: 16 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар Е, цей білок є кодованим SEQ ID NO: 15. 5 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 SEQ ID NO: 17 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр) від Chlamydia psitacci. SEQ ID NO: 18 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр) від Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 17. SEQ ID NO: 19 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр) від Chlamydia pneumonia. SEQ ID NO: 20 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр) від Chlamydia pneumonia, цей білок є кодованим SEQ ID NO: 19. SEQ ID NO: 21 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар D. SEQ ID NO: 22 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 21. SEQ ID NO: 23 є послідовністю кДНК Ct-875 від Chlamydia muridarum. SEQ ID NO: 24 є послідовністю білку Ct-875 від Chlamydia muridarum, цей білок є кодованим SEQ ID N0:23. SEQ ID NO: 25 є послідовністю кДНК Ct-875 від Chlamydia psitacci SEQ ID NO: 26 є послідовністю білку Ct-875 від Chlamydia psitacci, цей білок є кодованим SEQ ID NO:25. SEQ ID NO: 27 є послідовністю кДНК PmpG також відомою як Ct-871 від від Chlamydia trachomatis, серовар D. SEQ ID NO: 28 є послідовністю білку PmpG, також відомою як Ct-871 від Chlamydia trachomais, серовар D, цей білок є кодованим SEQ ID NO:27. SEQ ID NO: 29 є послідовністю кДНК PmpG також відомою як Ct-871 від від Chlamydia muridarum. SEQ ID NO: 30 є послідовністю білку PmpG, також відомою як Ct-871 від Chlamydia muridarum, цей білок є кодованим SEQ ID N0:29. SEQ ID NO: 31 є послідовністю кДНК PmpG також відомою як Ct-871 від від Chlamydia psitacci. SEQ ID NO: 32 є послідовністю білку PmpG, також відомою як Ct-871 від Chlamydia psitacci, цей білок є кодованим SEQ ID NO:31. SEQ ID NO: 33 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар D. SEQ ID NO: 34 є послідовністю білку Ct-858 Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 33. SEQ ID NO: 35 є послідовністю кДНК Ct-858 від Chlamydia muridarum. SEQ ID NO: 36 є послідовністю білку Ct-858 Chlamydia muridarum, цей білок є кодованим SEQ ID NO: 35. SEQ ID NO: 37 є послідовністю кДНК Ct-858 від Chlamydia psitacci. SEQ ID NO: 38 є послідовністю білку Ct-858 Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 37. SEQ ID NO: 39 є послідовністю кДНК Ct-858 від Chlamydia pneumonia. SEQ ID NO: 40 є послідовністю білку Ct-858 від Chlamydia pneumonia, цей білок є кодованим SEQ ID NO: 39. SEQ ID NO: 41 є послідовністю кДНК PmpD, також відомою як Ct-812, від Chlamydia trachomatis, серовар D. SEQ ID NO: 42 є послідовністю білку PmpD, також відомою як Ct-812, від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 41. Домен-пасажир охоплює амінокислоти 31 -1203. SEQ ID NO: 43 є послідовністю кДНК PmpD, також відомою як Ct-812, від Chlamydia muridarum. SEQ ID NO: 44 є послідовністю білку PmpD, також відомою як Ct-812, від Chlamydia muridarum, цей білок є кодованим SEQ ID NO: 43. SEQ ID NO: 45 є послідовністю кДНК PmpD, також відомою як Ct-812, від Chlamydia psitacci. SEQ ID NO: 46 є послідовністю білку PmpD, також відомою як Ct-812, від Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 45. SEQ ID NO: 47 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар LGVII. SEQ ID NO: 48 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар LGVII, цей білок є кодованим SEQ ID NO: 47. SEQ ID NO: 49 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар J. 6 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO: 50 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар J, цей білок є кодованим SEQ ID NO: 49. SEQ ID NO: 51 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар Н SEQ ID NO: 52 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар Н, цей білок є кодованим SEQ ID NO: 51. SEQ ID NO: 53 є послідовністю кДНК антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар Е. SEQ ID NO: 54 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар Е, цей білок є кодованим SEQ ID NO: 53. SEQ ID NO: 55 є послідовністю кДНК антигену хламідії, відомого як головний білок і зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар D. SEQ ID NO 56 є послідовністю білку антигену хламідії, відомого як головний білок зовнішньої мембрани (Мотр), також відомою як Ct-681 від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 55. SEQ ID NO: 57 є послідовністю кДНК Ct-622 від Chlamydia trachomatis, серовар D. SEQ ID NO: 58 є послідовністю білку Ct-622 від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 57. SEQ ID NO: 59 є послідовністю кДНК Ct-622 від Chlamydia psitacci. SEQ ID NO: 60 є послідовністю білку Ct-622 від Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 59. SEQ ID NO: 61 є послідовністю кДНК Ct-622 від Chlamydia pneumonia. SEQ ID NO: 62 є послідовністю білку Ct-622 від Chlamydia pneumonia, цей білок є кодованим SEQ ID NO: 61. SEQ ID NO: 63 є послідовністю кДНК Ct-460, також відомою як Swib від Chlamydia trachomatis, серовар D. SEQ ID NO: 64 є послідовністю білку Ct-460, також відомою як Swib від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 63. SEQ ID NO: 65 є послідовністю кДНК Ct-460, також відомою як Swib від Chlamydia muridarum. SEQ ID NO: 66 є послідовністю білку Ct-460, також відомою як Swib від Chlamydia muridarum, цей білок є кодованим SEQ ID NO: 65. SEQ ID NO: 67 є послідовністю кДНК Ct-460, також відомою як Swib від Chlamydia psitacci. SEQ ID NO: 68 є послідовністю білку Ct-460, також відомою як Swib від Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 67. SEQ ID NO: 69 є послідовністю кДНК Ct-460, також відомою як Swib від Chlamydia pneumonia. SEQ ID NO: 70 є послідовністю білку Ct-460, також відомою як Swib від Chlamydia pneumonia, цей білок є кодованим SEQ ID N0:69. SEQ ID NO: 71 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар D. SEQ ID NO: 72 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар D, цей білок є кодованим SEQ ID NO: 71. SEQ ID NО:73 є послідовністю кДНК Ct-089 від Chlamydia muridarum. SEQ ID NO: 74 є послідовністю білку Ct-089 від Chlamydia muridarum, цей білок є кодованим SEQ ID NO: 73. SEQ ID NO: 75 є послідовністю кДНК Ct-089 від Chlamydia psitacci. SEQ ID NO: 76 є послідовністю білку Ct-089 від Chlamydia psitacci, цей білок є кодованим SEQ ID NO: 75. SEQ ID NO: 77 є послідовністю кДНК Ct-089 від Chlamydia pneumonia. SEQ ID NO: 78 є послідовністю білку Ct-089 від Chlamydia pneumonia, цей білок є кодованим SEQ ID NO: 77. SEQ ID NO: 79 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар А. SEQ ID NO: 80 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар А, цей білок є кодованим SEQ ID NO: 79. SEQ ID NO: 81 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар В. SEQ ID NO: 82 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар В, цей білок є кодованим SEQ ID NO: 81. SEQ ID NO: 83 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар G. 7 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO: 84 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар G, цей білок є кодованим SEQ ID NO: 83. SEQ ID NO: 85 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар Н. SEQ ID NO: 86 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар Н, цей білок є кодованим SEQ ID NO: 85. SEQ ID NO: 87 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар І. SEQ ID NO: 88 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар І, цей білок є кодованим SEQ ID NO: 87. SEQ ID NO: 89 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар J. SEQ ID NO: 90 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар J, цей білок є кодованим SEQ ID NO: 89. SEQ ID NO: 91 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар К. SEQ ID NO: 92 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар К, цей білок є кодованим SEQ ID NO: 91. SEQ ID NO: 93 є послідовністю кДНК Ct-089 від Chlamydia trachomatis, серовар L2. SEQ ID NO: 94 є послідовністю білку Ct-089 від Chlamydia trachomatis, серовар L2, цей білок є кодованим SEQ ID NO: 93. SEQ ID NO: 95 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар А. SEQ ID NO: 96 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар А, цей білок є кодованим SEQ ID NO: 95. SEQ ID NO: 97 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар В. SEQ ID NO: 98 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар В, цей білок є кодованим SEQ ID NO: 97. SEQ ID NO: 99 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар G. SEQ ID NO: 100 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар G, цей білок є кодованим SEQ ID NO: 99. SEQ ID NO: 101 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар Н. SEQ ID NO: 102 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар Н, цей білок є кодованим SEQ ID NO: 101. SEQ ID NO: 103 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар І. SEQ ID NO: 104 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар І, цей білок є кодованим SEQ ID NO: 103. SEQ ID NO: 105 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар J. SEQ ID NO: 106 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар J, цей білок є кодованим SEQ ID NO: 105. SEQ ID NO: 107 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар К. SEQ ID NO: 108 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар К, цей білок є кодованим SEQ ID NO: 107. SEQ ID NO: 109 є послідовністю кДНК Ct-858 від Chlamydia trachomatis, серовар L2. SEQ ID NO: 110 є послідовністю білку Ct-858 від Chlamydia trachomatis, серовар L2, цей білок є кодованим SEQ ID NO: 109. SEQ ID NO: 111 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар А. SEQ ID NO: 112 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар А, цей білок є кодованим SEQ ID NO: 111. SEQ ID NO: 113 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар В. SEQ ID NO: 1 14 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар В-ь цей білок є кодованим SEQ ID NO: 113. SEQ ID NO: 115 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар G. SEQ ID NO: 116 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар G, цей білок є кодованим SEQ ID NO: 115. SEQ ID NO: 117 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар Н. SEQ ID NO: 118 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар Н, цей білок є кодованим SEQ ID NO: 117. SEQ ID NO: 119 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар І. SEQ ID NO: 120 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар І, цей білок є кодованим SEQ ID NO: 119. SEQ ID NO: 121 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар J. SEQ ID NO: 122 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар J, цей білок є кодованим SEQ ID NO: 121. SEQ ID NO: 123 є послідовністю кДНК Ct875 від Chlamydia trachomatis, серовар К. 8 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 SEQ ID NO: 124 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар К, цей білок є кодованим SEQ ID NO: 123. SEQ ID NO: 125 є послідовністю кДНК Ct-875 від Chlamydia trachomatis, серовар L2. SEQ ID NO: 126 є послідовністю білку Ct-875 від Chlamydia trachomatis, серовар L2, цей білок є кодованим SEQ ID NO: 125. Деякі з вищенаведених послідовностей та інших споріднених поліпептидів та полінуклеотидів Chlamydia з ряду сероварів відомі та доступні у галузі. Наступні споріднені послідовності можна знайти у патентах США №№ 6,447,779, 6,166,177, 6,565,856, 6,555,115, 6,432,916, та 6,448,234 та вони також розкриті у патентних заявках США №№ 10/197,220, 10/762,058 та 10/872,155, що уведено тут як посилання. Послідовність Ct-089 з серовару D та можливе застосування цього білку як антигену розкрито, наприклад, у WO02/08267 (Corixa Corporation). Послідовність Ct-089 з серовару L2 було розкрито у WO99/28475 (Genset). Роль CopN (також відомий як Ct-089) як гаданий exported регулятор системи секреції білку типу III обговорено Fields, KA та Hackstadt, T Мої. Microbiol. 2000 38(5): 1048-1060. Послідовності Ct-858 та Ct-875 з серовару D доступні з бази даних Swiss-Prot, №№ 084866 та 084883, відповідно. Стосовно наступної інформації дивись Stephens, RS et al. Science 1998 282:754-759. Застосування Ct-858 як антигену розкрито, наприклад, у WO02/08267 (Corixa Corporation). Послідовність Ct-875 з серовару Е (що уводить His-tag) та її застосування як антигену розкрито, наприклад, у США 20040137007. Однак, документ неправильно стосується послідовності 139 як Ct-875, коли тут вона є фактично послідовністю 140. Особи, піддані дії Chlamydia trachomatis, показані як такі, що виявляють деякий ступінь природної імунності стосовно повторної інфекції, принаймні у випадку того ж сервовару (Katz, BP et al. Sex Transm. Dis. 1987 14:160-164), хоча ступінь захисту може залежати від часу після первинної інфекції. Вік також показано як важливий стосовно тривалості інфекції у старіших осіб демонструючи коротшу тривалість інфекції очною Chlamydia trachomatis (Bailey, R et al. Epidemiol. Infect. 1999 123:479- 486), знов підтверджуючи існування адаптивного імунологічного захисту. Підтверджено, що застосування антибіотиків може фактично перешкоджати розвитку природної імунності до Chlamydia trachomatis (Brunham, RC et al. J. Nat. Rev. Immunol. 2005 5:149-161). Головний білок зовнішньої мембрани (Momp) складається приблизно з 60% білку бактеріальної зовнішньої мембрани та є, можна вважати, важливим у визначенні специфічності серотипу. Амінокислотна послідовність містить чотири регіони, котрі незахищені зовні, та у котрих відбувається більшість варіацій послідовності. З приблизно 400 амінокислот у послідовності Momp до 70 амінокислот відрізняються між Momp з відмінних сероварів. Особливо неочікуваною є знахідка, що серовар на основі ідентичності амінокислотних послідовностей не відповідає серовару на основі стан хвороби (тобто, очному, очно-статевому та LGV) (Stothard, DR et al. Infect. Immun. 1998 66(8):3618-3625). Подібно, порівняння ідентичності нуклеотидних послідовностей для гена отрА, котрий кодує Momp, не відповідають станам хвороби (Meijer, A et al. J. Bateriol. 1999 181 (15):4469-4475; Lysen, M etal. J. Clin. Microbiol. 2004 42(4): 1641 -1647). Моноклональні антитіла для Momp ефективні у культурі та у деяких тваринах-моделях, однак, захист може бути обмеженим та є загалом сероварспецифічним. Мишей, імунізованих підшкірно або перорально моноклональним анти-ідіотиповим тілом до антигену екзогліколіпід давали захисну реакцію до серовару С, незважаючи на залишкову чутливість до антигенного стимулювання сероваром К (Whittum-Hudson, JA et al. Nat. Med. 1996 2(10):1116-1121). Один білок розкрито на сьогодні, котрий показує високий рівень гомології послідовності серед відміни серовари, а саме доступний білок-1 класу І (позначено як Сарі , або Ct-529), такі білки мають можливе застосування у розробці вакцин, котрі стимулюють захист проти більше, ніж одного серовару (Fling, SP et al. PNAS 2001 98(3):1160-1165). Однак, на додаток до вимог високих рівнів гомології послідовності між сероварами, білки для застосування у вакцинах повинні також викликати достатню імунну реакцію. Неочікувано, знайдено, що білки Chlamydia trachomatis Ct-089, Ct-858 та Ct-875, зокрема, є дуже антигенними та мають високий ступінь ідентичності послідовностей серед відмінних сероварів Chlamydia trachomatis. Особливо високе збереження у регіоні передбачуваних епітопів. У світлі цієї знахідки, існує можливість розробки вакцин Chlamydia, котрі ефективні проти широкого ряду сероварів Chlamydia trachomatis (тобто, котрі можна застосовувати у перехресному захисті). 9 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з цим аспектом заявленого винаходу запропоновано застосування одного або більше білків Chlamydia, їх імуногенних фрагментів або полінуклеотидів, що їх кодують, вибранихї з переліку, що складається з Ct-089, Ct-858 та Ct-875, та котрі є похідними від першого серовару Chlamydia trachomatis, у виробництві вакцини для лікування або попередження інфекції Chlamydia другим сероваром Chlamydia trachomatis. У наступному аспекті заявленого винаходу запропоновано спосіб лікування або попередження інфекції Chlamydia другим сероваром Chlamydia trachomatis, що полягає у застосуванні вакцини, що містить один або більше білків Chlamydia, їх імуногенних фрагментів або полінуклеотидів, що їх кодують, вибраних з переліку, що складається з Ct-089, Ct-858 та Ct875, котрі є похідними від першого серовару Chlamydia trachomatis. В одному втіленні винаходу перехресно-захисна вакцина містить один білок, йогоімуногенний фрагмент або полінукпеотид, що їх кодує, вибраний з переліку, що складається з Ct-089, Ct-858 та Ct-875. Вакцини, котрі містять тільки один білок, його імуногенний фрагмент або полінуклеотид, що їх кодує, вибраний з переліку, що складається з Ct-089, Ct-858 та Ct-875 повинні відповідно крім того містити принаймні один додатковий хламі-дійний антиген (наприклад, 1 або 2 додаткові антигени). У другому втіленні винаходу перехресно-захисна вакцина містить два білки, їх імуногенні фрагменти або полінуклеотиди, що їх кодують, вибрані з переліку, що складається з Ct-089, Ct858 та Ct-875. Наприклад,: Ct-089 та Ct-858; Ct-089 та Ct-875; або Ct-858 та Ct-875. У третьому втіленні винаходу перехресно-захисна вакцина містить Ct-089, Ct-858 та Ct-875, їх імуногенні фрагменти або полінуклеотиди, що їх кодують. Перший серовар Chlamydia trachomatis може бути як серовар Chlamydia trachomatis. Друг серовар Chlamydia trachomatis може бути як серовар Chlamydia trachomatis, за винятком першого серовару Chlamydia trachomatis. В одному втіленні винаходу перший серовар Chlamydia trachomatis вибрано з переліку, що складається з сероварів Chlamydia trachomatis А, В, Ва, С, D, Da, E, F, G, H, I, la, J, Ja, К , L1 , L2 та L3. У другому втіленні винаходу перший серовар Chlamydia trachomatis вибрано з очних сероварів Chlamydia trachomatis (наприклад, А, В, Ва та С). У ще одному втіленні винаходу перший серовар Chlamydia trachomatis вибрано з очно-статевих сероварів Chlamydia trachomatis (наприклад, D, Da, E, F, G, H, I, la, J, Ja та К). У наступному втіленні винаходу перший серовар Chlamydia trachomatis вибрано з сероварів LGV Chlamydia trachomatis (наприклад, L1 , L2 та L3). В одному втіленні винаходу другий серовар Chlamydia trachomatis вибрано з переліку, що складається з сероварів Chlamydia trachomatis А, В, Ва, С, D, Da, E, F, G, H, I, la, J, Ja, К , L1 , L2 та L3. У другому втіленні винаходу другий серовар Chlamydia trachomatis вибрано з очних сероварів Chlamydia trachomatis (наприклад, А, В, Ва та С). У ще одному втіленні винаходу другий серовар Chlamydia trachomatis вибрано з очно-статевих сероварів Chlamydia trachomatis (наприклад, D, Da, E, F, G, H, I, la, J, Ja та К). У наступному втіленні винаходу другий серовар Chlamydia trachomatis вибрано з сероварів LGV Chlamydia trachomatis (наприклад, L1 , L2 та L3). Для максимізації широти дії способу та застосування заявленого винаходу, може бути бажаним, щоб перший серовар Chlamydia trachomatis було вибрано так, щоб був високий рівень ідентичності послідовностей (наприклад, принаймні 90%, особливо 95%, зокрема 98%, краще 99% ідентичності послідовності) із більшістю інших сероварів Chlamydia trachomatis (наприклад, принаймні 50%, особливо 70%, зокрема 80%, краще 90% інших сероварів Chlamydia trachomatis). Для максимізації практичного застосування способу та застосування заявленого винаходу, може бути бажаним, щоб перший серовар Chlamydia trachomatis було вибрано так, щоб був високий рівень ідентичності послідовностей (наприклад, принаймні 90%, особливо 95%, зокрема 98%, краще 99% ідентичності послідовності) із більшістю (наприклад, принаймні 50%, особливо 70%, зокрема 80%, краще 90%) звичайних сероварів Chlamydia trachomatis (як-то звичайні очні серовари, звичайні очно-статеві серовари, звичайні LGV серовари, або комбінація двох з цих груп сероварів, наприклад, звичайного очного та очно-статевого сероварів). Звичайні очні серовари Chlamydia trachomatis охоплюють А та В. Звичайні очно-статеві серовари Chlamydia trachomatis охоплюють D, E, F та І (Lan, J et al. J. CHn. Microbiol. 1995 33(12):31943197; Singh, Vet al. J. CHn. Microbiol. 2003 41(6):2700-2702). Звичайні серовари LGV Chlamydia trachomatis охоплюють L2. В одному втіленні заявленого винаходу перший серовар Chlamydia trachomatis є се-роваром Chlamydia trachomatis E. У другому втіленні винаходу перший серовар Chlamydia trachomatis є сероваром Chlamydia trachomatis K. В одному втіленні винаходу другий серовар Chlamydia trachomatis вибрано з сероварів Chlamydia trachomatis D, J та К (наприклад, серовару Chlamydia trachomatis K або J). У ще 10 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 одному втіленні винаходу перший серовар Chlamydia trachomatis є сероваром Chlamydia trachomatis E, а другий серовар Chlamydia trachomatis вибрано з сероварів Chlamydia trachomatis D, J та К (наприклад, серовару Chlamydia trachomatis K або J). В одному прикладі заявленого винаходу, коли вакцина містить Ct-089, його імуногенний фрагмент або полінуклеотид, що це кодує, похідні з серовару Е Chlamydia trachomatis, вакцину можна застосовувати у лікуванні або профілактиці інфекцій від сероварів Chlamydia trachomatis А, В, D, G, H, I, J, К або L2; зокрема А, В, D, G, Н, І або К; особливо А або В. У другому приклад заявленого винаходу, коли вакцина містить Ct-858, його імуногенний фрагмент або полінуклеотид, що це кодує, похідні з серовару Е Chlamydia trachomatis, вакцину можна застосовувати у лікуванні або профілактиці інфекцій від сероварів Chlamydia trachomatis А, В, D, G, Н, І, J, K або L2; зокрема J або L2. У наступному прикладі заявленого винаходу, коли вакцина містить Ct-858, його імуногенний фрагмент або полінуклеотид, що це кодує, похідні з серовару Е Chlamydia trachomatis, вакцину можна застосовувати у лікуванні або профілактиці інфекціїї від сероварів Chlamydia trachomatis А, В, D, G, H, I, J, К або L2; зокрема А, В, D, G, Н, І або К. Перший та другий серовари Chlamydia trachomatis можуть бути асоційовані з тим же станом хвороби (наприклад, вони можуть бути очними серовари або очно-статевими серовари), або перший та другий серовари Chlamydia trachomatis можуть бути асоційовані з відмінними станами хвороби (наприклад, перший серовар Chlamydia trachomatis може бути очно-статевим сироваром, а другий серовар Chlamydia trachomatis може бути очним сироваром , або навпаки). У випадку, що вакцина для застосування у заявленому винаході містить більше, ніж один білок, його імуногенний фрагмент або полінуклеотид, що це кодує, вибрані з переліку, що складається з Ct-089, Ct-858 та Ct-875, слід зауважити, що кожний білок, його імуногенний фрагмент або полінуклеотид, що це кодує, може необов'язково бути похідним з відмінного першого серовару Chlamydia trachomatis, котрий може бути вибраним незалежно. Перехресно-захисні вакцини для застосування у заявленому винаході можуть також містити додаткові антигени хламідії (тобто, антигени інші, ніж білки Ct-089, Ct-858 та Ct-875, їх імуногенні фрагменти або полінуклеотиди, що їх кодують), наприклад, 1 , 2, 3, 4 або 5 інших антигенів (вибраних наприклад, з Momp, Ct-622, PmpGpd та PmpDpd). Додаткові антигени у перехресно-захисних вакцинах можуть також містити білки Ct-089, Ct-858 та Ct-875, їх імуногенні фрагменти або полінуклеотиди, що їх кодують, котрі є похідними від другого серовару. У наступному втіленні винаходу поліпептиди та полінуклеотиди Chlamydia, що можна застосовувати згідно з винаходом охоплюють серовари, асоційовані з трахомою, як-то серовари А, В, Ва та С. Таким чином композиції згідно з винаходом можуть застосовувати поліпептиди послідовності, визначені вище, або імуногенні фрагменти цих або полінуклеотидних послідовностіей, що їх кодують, котрі можуть бути наприклад, полінуклеотидними послідовностями, визначеними вище, або їх фрагментами, що кодують імуногенні фрагменти поліпептидів. У конкретних втіленнях: (і) Компоненти Ct-089 та Ct-858 композиції згідно з винаходом можуть бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 16 може бути ) або його імуногенним фрагментом, або поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 6 може бути ) або його імуногенним фрагментом, відповідно, або полінуклеотидами, що кодують це. Альтернативно компоненти Ct-089 та Ct-858 композиції можуть показувати принаймні 95% гомології відносно будь-якого поліпептиду та полінуклеотидної послідовності Ct-089 та Ct-858 від інших сероварів С. trachomatis, котрі описані тут. (іі) Компонент Ct-875 може бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 8 (серовар Е С trachomatis) або його імуногенним фрагментом, або полінуклеотидами, що кодують це. Альтернативно компонент Ct-875 композиції може показувати принаймні 95% гомології відносно будь-якого поліпептиду Ct-875 та полінуклеотидної послідовності від інших сероварів С trachomatis, котрі описані тут. (ііі) Компонент PmpDpd може бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 14 (серовар Lll C trachomatis) або його імуногенним фрагментом, або полінуклеотидами, що кодують це. (iv) Компонент PmpGpd може бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 12 (серовар Lll C trachomatis) або його імуногенним фрагментом, або полінуклеотидами, що кодують це. 11 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 (v) Компонент Мотр може бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 4 (серовар F C trachomatis) або його імуногенним фрагментом, або полінуклеотидами, що кодують це. (vi) Компонент Swib може бути поліпептидом, що має принаймні 95% гомології відносно поліпептиду з SEQ ID NO: 8 (серовар Lll C trachomatis) або його імуногенним фрагментом, або полінуклеотидами, що кодують це. Антигени, описані тут охоплюють поліморфні варіанти та консервативно модифіковані варіації, а також міжштамові та міжвидові гомологи Chlamydia. На додаток, описані тут антигени охоплюють підпослідовності або скорочені послідовності. Описані тут антигени можуть бути у формі конденсованих білків. Конденсовані білки можуть також містити додаткові поліпептиди, необов'язково гетерологічні пептиди від Chlamydia або інших джерел. Ці антигени можуть бути модифікованими, наприклад, додаванням лінкерних пептидних послідовностей, як описано нижче. Ці лінкерні пептиди можуть бути вставленими між одним або більше поліпептидами, котрі комплектують кожний з конденсованих білків. Описані тут антигени можуть також бути у формі хімічнихкон'югатів. Винахід стосується крім того імуногенних композицій та композицій вакцин, що містять композиції антигенів хламідії згідно з винаходом разом з фармацевтично прийнятним носієм та необов'язково імуностимулятором. Композиції заявленого винаходу можуть крім того містити інші компоненти, розроблені для посилення антигенності антигенів або для поліпшення цих антигенів в інших аспектах, наприклад, виділення цих антигени додаванням подовження з гістидинових залишків на одному кінці антигену. Додавання подовження з гісти-динових залишків на одному кінці антигену мож також поліпшувати експресію. Композиції винаходу можуть містити додаткові копії антигенів, додаткові поліпептиди або полінуклео-тиди від Chlamydia sp. Композиції винаходу можуть також містити додаткові гетерологічні поліпептиди або полінуклеотиди не від Chlamydia. Наприклад, композиції винаходу можуть містити поліпептиди або нуклеїнові кислоти, що кодують поліпептиди, де поліпептид посилює експресію антигену, наприклад, NS1, білок вірусу грипу, або їх імуногенну частину (дивись, наприклад, WO99/40188 та WO93/04175). Нуклеїнові кислоти винаходу можна створити на основі кодону, переважного в альтернативних видах, наприклад, людини. Композиції винаходу можуть крім того містити ад'юванти, наприклад, MPL, 3D-MPL, IFA, ENHANZYN (Detox), QS21, CWS, TDM, AGP, CPG, Leif, сапонін, та міметики сапоніну, та їх похідні. Альтернативно або на додаток, композиції винаходу можуть містити BCG або Pvac як ад'ювант. "Конденсований поліпептид" або "конденсований білок" стосується білку, що має принаймні дв поліпептиди Chlamydia (котрі можуть бути такими ж чи відмінними), ковалентно зв'язані, безпосередньо або через амінокислотний лінкер. Поліпептиди, що утворюють конденсований білок, звичайно зв'язані С-кінцем з N-кінцем, хоча вони можуть також бути зв'язані С-кінцем з Скінцем, N-кінцем з N-кінцем, або N-кінцем з С-кінцем. Поліпептиди конденсованого білку можу бути у будь-якому порядку. Цей термін також стосується консервативно модифікованих варіантів, поліморфних варіантів, алелів, мутантів, підпослідо-вностей, міжвидових гомологів, та імуногенних фрагментів антигенів, що складають конденсований білок. Конденсовані білки винаходу можуть також містити додаткові копії антигену компоненту або його імуногенного фрагменту. Полінуклеотидна послідовність, що кодує конденсований білок винаходу гібридизується у суворих умовах принаймні з двома нуклеотидними послідовностями, що кодують поліпептид антигену, вибраний з групи: Ct-681 (Momp) або його імуногенний фрагмент, Ct-871 (PmpG) або його імуногенний фрагмент, Ct-812 (PmpD) або його імуногенний фрагмент, Ct-089 або його імуногенний фрагмент, Ct-858 або його імуногенний фрагмент, Ct-875 або його імуногенний фрагмент, Ct-460 (swib) або його імуногенний фрагмент, та Ct-622 або його імуногенний фрагмент. По-лінуклеотидні послідовності, що кодують індивідуальні антигени конденсованого поліпептиду, тому охоплюють консервативно модифіковані варіанти, поліморфні варіанти, алелі, мутанти, підпослідовності, імуногенні фрагменти, та міжвидові гомологи Ct-681 (Momp), Ct-871 (PmpG), Ct-812 (PmpD), Ct-089, Ct-858, Ct-875, Ct-460 (swib), та Ct-622. Полінуклеотидні послідовності, що кодують індивідуальн поліпептиди конденсованого білку можуть бути у будь-якому порядку. У деяких втіленнях, індивідуальні поліпептиди конденсованого білку є у порядку (N- з С-кінцем) від великого до малого. Великі антигени є приблизно 30 -150 кДа за розміром, проміжні антигени є приблизно 10-30 кДа за розміром, а невеликі антигени є менше, ніж 10 кДа за розміром. Послідовність, що кодує індивідуальний поліпептид може бути невеликою, як наприклад, імуногенн фрагмент, як-то індивідуальний епітоп CTL, що кодує приблизно 8-9 амінокислот, або, наприклад, епітоп HTL або В-клітин Фрагмент може також містити складні епітопи. 12 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Конденсований поліпептид винаходу специфічно зв'язується з антитілами проти принаймні двох поліпептидів антигенів, вибраних з Ct-681 (Momp) або його імуногенного фрагменту, Ct-871 (PmpG) або його імуногенного фрагменту, Ct-812 (PmpD) або його імуногенного фрагменту, Ct089 або його імуногенного фрагменту.ами Ct-858 або його імуногенного фрагменту, Ct-875 або його імуногенного фрагменту, Ct-460 (swib) або його імуногенного фрагменту, та Ct-622 або його імуногенного фрагменту. Антитіла мож бути полі-клональними або моноклональними. Необов'язково, конденсований поліпептид специфічно зв'язується з антитілами проти конденсованого об'єднання антигенів, ці антитіла не зв'язуються з антигенами індивідуально, тобто, коли вони не є частиною конденсованого білку. Конденсовані поліпептиди необов'язково містять додаткові поліпептиди, наприклад, три, чотири, п'ять, шість, або більше поліпептидів, аж до приблизно 25 поліпептидів, необов'язково гетерологічних поліпептидів або повторних гомологічних поліпептидів, конденсованих з принаймні двома антигенами. Додаткові поліпептиди конденсованого білку є необов'язково похідними від Chlamydia, а також інших джерел, як-то інші бактеріальні, вірусні, або безхребетні, хребетні або ссавцеві джерела. Індивідуальн поліпептиди конденсованого білку можуть бути у будь-якому порядку. Як описано тут, конденсований білок може також бути зв'язаним з іншими молекулами, охоплюючи додаткові поліпептиди. Композиції винаходу можуть також містити додаткові поліпептиди, що незв'язані з конденсованими білками винаходу. Ці додатков поліпептиди можуть бути гетерологічними або гомологічними поліпептидами. Термін "конденсований" стосується ковалентного зв'язку між двома поліпептидами у конденсованому білку. Поліпептиди звичайно об'єднані пепти-дним зв'язком, безпосередньо з кожним іншим або через амінокислотний лінкер. Необов'язково, пептиди можуть бути об'єднані через непептидні ковалентні зв'язки, відомі спеціалістам. "FL" стосується повної довжини, тобто, поліпептиду, що є тієї ж довжини як поліпептид дикого типу. Термін "його імуногенний фрагмент" стосується поліпептиду, що містить епітоп, що розпізнається цитотоксичними Т-лімфоцитами, хелперними Т-лімфоцитами або В-клітинами. Способи визначення регіонів епітопів послідовності описані тут. Відповідно, імуногенний фрагмент повинен містити принаймні 30%, відповідно принаймні 50%, особливо принаймні 75% та зокрема принаймні 90% (наприклад, 95% або 98%) амінокислот в еталонній послідовності. Імуногенний фрагмент повинен відповідно містити усі з регіонів епітопів еталонної послідовності. Ад'ювант стосується компонентів у вакцині або терапевтичній композиції, що посилюють специфічну імунну реакцію на антиген (дивись, наприклад, Edeiman, AIDS Res. Hum Retroviruses 8:1409-1411 (1992)). Ад'юванти індукують імунні реакції Th1-типу та Th-2 типу. Тh1-типу цитокіни (наприклад, IFN-γ, IL-2, та IL-12) сприяють індукуванню опосередкованої клітинами імунної реакціі на застосовуваний антиген, а цитокіни Th-2 типу (наприклад, IL-4, IL-5, ІІ-6, IL-10 та TNFβ) сприяють індукуванню гуморальних імунних реакцій. Будь-які різні ад'юванти можна застосовувати у вакцинах цього винаходу для посилення імунної реакції. Деякі ад'юванти містять речовину, розроблену для захисту антигену від швидкого катаболізму, як-то алюміній гідроксид або мінеральне масло, та специфічні або неспецифічні стимуляторм імунних реакцій, як-то ліпід A, Bortadella pertussis або Муcobbactery tuberculosis. Придатні ад'юванти комерційно доступні та охоплюють, наприклад, неповний ад'ювант Фрейнда та повний ад'ювант Фрейнда (Difco Laboratories) та Merck-ад'ювант 65 (Merck та Company, Inc., Rahway, NJ.). Інші придатні ад'юванти охоплюють гель алюміній гідроксиду, біорозкладувані мікросфери, монофосфорил ліпід A, quil A, SBASIc, SBAS2 (Ling et al., 1997, Vaccine 15:1562-1567), SBAS7, АІ(ОН)3 та CpG олігоінуклеотид (WO96/02555). Придатні ад'юванти для застосування у винаході обговорені більш детально нижче. "Нуклеїнова кислота" стосується дезоксирибонуклеотидів або рибонуклеотидів та їх полімерів у одинично- або подвійно-ланцюговій формі. Термін охоплює нуклеїнові кислоти, що містять відомі нуклеотидні аналоги або модифікован залишки каркасу або зв'язки, котрі є синтетичними, природно існуючими, та природно не існуючими, котрі мають подібні властивості стосовно зв'язування, як еталонна нуклеїнова кислота, та котрі метаболізують подібно еталонним нуклеотидам. Приклади таких аналогів охоплюють, без обмеження, фосфоротіоати, фосфорамідати, метилфосфонати, хіральн-метилфосфонати, 2-О-метил рибонуклеотиди, пептид-нуклеїнова кислота (ПНК). Якщо не визначено інше, конкретна послідовність нуклеїнової кислоти також охоплює їх консервативно модифіковані варіанти (наприклад, заміщення вироджених кодонів ) та комплементарні послідовності, а також точно вказану послідовність. Особливо, заміщення вироджених кодонів можна досягти створенням послідовності, у котрій третя позиція одного або 13 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 більше вибраних (або усіх) кодонів є заміщеною змішаними основними та/або дезоксиінозиновими залишками (Batzer et al., Nucleic Acids Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); Rossolini et al., Мої. Cell. Probes 8:91 -98 (1994)). Термін нуклеїнова кислота застосовують почергово з геном, кДНК, мРНК, олігоіну-клеотидом та полінуклеотидом. Терміни "поліпептид," "пептид" та "білок" застосовують почергово і вони стосуються полімеру амінокислотних залишків. Терміни також стосуються полімерів амінокислот, у котрих один або більше амінокислотних залишків є штучними хімічними міметиками відповідної природно існуючої амінокислоти, а також полімерів природно існуючих та природно не існуючих амінокислот. Термін "амінокислота" стосується природно існуючих та синтетичних амінокислот, а також аналогів амінокислот та міметиків амінокислот, що функціонують подібно природно існуючим амінокислотам. Природно існуючі амінокислоти кодовані генетичним кодом, а також пізніше модифіковані, наприклад, гідроксипролін, укарбоксиглутамат та О-фосфосерин. Аналоги амінокислот стосуються сполук, що мають ту ж базову хімічн структуру, як природно існуючі амінокислоти, тобто, а-карбон, що зв'язаний з гідрогеном, кар-боксигрупою, аміногрупою, та Rгрупою, як-то гомосерин, норлейцин, метіонін сульфоксид, метіонін метил сульфоній. Такі аналоги мають модифіковані R-групи (наприклад, норлейцин) або модифікований пептидний каркас, але залишають ту ж базову хімічну структуру, як природно існуючі амінокислоти. Амінокислотні міметики стосуються хімічних сполук, що мають структуру, що є відмінною від загальної хімічної структури амінокислоти, але яка функціонує подібно природно існуючій амінокислоті. Амінокислоти можуть бути позначені тут їх звичайно відомими три-літерними символами або одо-літерними символами за IUPAC-IUB, а також можуть бути позначеними їх звичайними одно-літерними кодами. "Консервативно модифіковані варіанти" стосуються послідовностей амінокислот та нуклеїнових кислот. Відносно окремих послідовностей нуклеїнових кислот, консервативно модифіковані варіанти стосуються тих нуклеїнових кислот, котрі кодують ідентичні або по суті ідентичні амінокислотні послідовності, або де нуклеїнова кислота не кодує амінокислотну послідовність, по суті ідентичної послідовності. Внаслідок виродження генетичного коду, велике число функціонально ідентичних нуклеїнових кислот кодують визначений білок. Наприклад, усі кодони GCA, GCC, GCG та GCU кодують амінокислоту аланін. Таким чином, у кожній позиції, де аланін є визначеним кодоном, кодон мож бути замінен на будь-який з відповідних описаних кодонів без зміни кодованого поліпептиду. Такі варіації нуклеїнових кислот є "мовчазними варіаціями", котр є одним видом консервативно модифікованих варіацій. Кожна послідовність нуклеїнової кислоти тут, котра кодує поліпептид, також описує кожну можливу мовчазну варіацію нуклеїнової кислоти. Спеціалісти розпізнають, що кожний кодон у нуклеїновій кислоті (за винятком AUG, котрий є нормально кодоном тільки для метіоніну, та TGG, котрий є нормально кодоном тільки для триптофану) може бути модифікованим до функціонально ідентичної молекули. Відповідно, кожна мовчазна варіація нуклеїнової кислоти, що кодує поліпептид, є властивою у кожній описаній послідовності. Полінуклеотид винаходу мож містити ряд мовчазних варіацій (наприклад, 1-5, зокрема 1 або 2, а особливо 1 кодон можуть бути заміненими), при порівнянні з еталонною послідовністю. Полінуклеотид винаходу може містити ряд немовчазних консервативних варіацій (наприклад, 15, зокрема 1 або 2, а особливо 1 кодон можуть бути заміненими), при порівнянні з еталонною послідовністю. Спеціалісти повинні знати, що конкретна полі-нуклеотидна послідовність може містити мовчазні та немовчазні консервативні варіації. Як до амінокислотних послідовностей, спеціалісти розпізнають, що індивідуальні заміщення, делеції або вставки у послідовність, нуклеїнової кислоти, пептиду, поліпептиду, або білку, що змінює, додає або усуває одиничну амінокислоту або невеликий процент амінокислот у кодован послідовність є "консервативно модифікованим варіантом" де зміна производять до заміщення амінокислоти хімічно подібною амінокислотою. Таблиці консервативних заміщень, шо дають функціонально подібні амінокислоти, добре відомі у галузі. Такі консервативно модифіковані варіанти є додатковими і не виключають поліморфних варіантів, міжвидових гомологів та алелів винаходу. Поліпептид винаходу може містити ряд консервативних варіацій (наприклад, 1-5, зокрема 1 або 2, та особливо 1 амінокислотний залишок можуть бути заміненими), при порівнянні з еталонною послідовністю. Загалом, такі консервативн заміщення повинні підпадати до одної з групи аміно-кислот, визначених нижче, хоча у деяких випадках інші заміщення можуть бути 14 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 можливими без впливу по суті на імуногенні властивості антигену. Наступні 8 груп містять амінокислоти, що є консервативними заміщеннями одна для одної: 1) Аланін (А), Гліцин (G); 2) Аспарагінова кислота (D), Глутамінова кислота (Е); 3) Аспарагін (N), Глутамін (Q); 4) Аргінін (R), Лізин (К); 5) ізолейцин (І), Лейцин (L), Метіонін (М), Валін (V); 6) Фенілалані Цистеїни (F), Тирозин (Y), Триптофан (W); 7) Серин (S), Треонін (Т); та 8) Цистеїн(С), Метіонін (М) (дивись, наприклад, Creighton, Proteins (1984)). Відповідно аміно-кислотні заміщення обмежені неепітопними регіонами антигену. Варіанти поліпептидних послідовностей також охоплюють ті, де додаткові амінокислоти вставляють порівняно з еталонною послідовністю, наприклад, такі вставки можуть відбуватися у 1 або 2 положеннях (відповідно 1) та мож залучати додавання 50 або менше амінокислот (як-то 20 або менше, зокрема 10 або менше, особливо 5 або менше) у кожному положенні. Відповідно такі вставки не відбуваються у регіоні епітопу, та тому не мають значного впливу на імуногенні властивості антигену. Один приклад вставки охоплює коротке подовження з гістидинових залишків (наприклад, 1-6 залишків) для допомоги експресіх та/або очистки антигену. Інші варіанти поліпептидних послідовностей охоплюють ті, де амінокислоти усунені порівняно з еталонною послідовністю, наприклад, такі делеції можуть відбуватися при 1 або 2 положеннях (відповідно 1) та можуть, наприклад, залучати делецію 50 або менше амінокислот (як-то 20 або менше, зокрема 10 або менше, особливо 5 або менше) у кожному положенні. Відповідно такі вставки не відбуваються у регіоні епітопу, та тому не мають значного впливу на імуногенні властивості антигену. Способи визначення регіонів епітопів антигену описані тут. Термін "гетерологічний" при застосуванні з посиланням на частини нуклеїнової кислоти вказує, що нуклеїнова кислота містить дві або більш підпослідовностей, що не знайдені у тому ж співвідношенні у природі. Наприклад, нуклеїнова кислот є звичайно рекомбі-нантно отриманою, що має дві або більше послідовності від неспоріднених генів, упорядкованих для створення нових функціональних нуклеїнових кислот, наприклад, промотеру з одного джерела та кодувального регіону з ще одного джерела. Подібно, гетерологічний білок вказує, що білок містить дві або більш підпослідовності, що не знайдені у тому ж співвідношенні з кожним іншим у природі (наприклад, конденсованим білком). Вираз "селективно (або специфічно) гібридизується з" стосується зв'язування, дуплексування або гібридизування молекули тільки з конкретною нуклеотидною послідовністю у суворих умовах гібридизації, коли послідовність представлено у складній суміші (наприклад, тотальної клітинної або бібліотечної ДНК або РНК). Вираз "суворі умови гібридизації" стосується умов, у котрих зонд повинен гібридизуватися з його цільовою підпослідовністю, звичайно у складній суміші нуклеїнової кислоти, але не з іншими послідовностями. Суворі умови є залежними від послідовності та повинні бути відмінними у різних випадках. Довші послідовності гібридизуються особливо при вищ температурв. Довідник стосовно гібридизаці нуклеїнових кислот є знайден у Tijssen, Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). Загалом, суворі умови вибрані приблизно на 5-10°С нижче, ніж термічна точка плавлення (Т m) для конкретної послідовності при визначеній іонній силі та рН. Т m є температурою (при визначеній іонній силі, рН та нуклеїновій концентрації), при котрій 50% зондів, комплементарних для цільової гібридизації з цільовою послідовністю при рівновазі (оскільки цільові послідовності представлені у надлишку, при Т m, 50% зондів знаходяться у рівновазі). Суворі умови повинні бути таки, у котрих концентрація солі менше, ніж приблизно 1,0 М іону натрію, звичайно приблизно 0,01 - 1,0 М іону натрію (або іншої солі) при рН 7,0 - 8,3 та температурі принаймні приблизно 30°С для коротких зондів (наприклад, 10-50 нуклеотидів) та принаймні приблизно 60°С для довгих зондів (наприклад, більше, ніж 50 нуклеотидів). Суворих умов можна також досягти додаванням дестабілізувального засобу, як-то фор-маміду. Для селективної або специфічної гібридизації позитивний сигнал є принаймні у два рази більше фонової, необов'язково 10 разів більше фонової гібридизації. Зразкові суворі умови гібридизації мож бути такими: 50% формаміду, 5х SSC, та 1% SDS, інкубування при 42°С, або, 5х SSC, 1% SDS, інкубування при 65°С, з промивкою у 0,2х SSC, та 0,1%SDS при 65°C. Нуклеїнові кислоти, що не гібридизуються у суворих умовах є ще по суті ідентичними, якщо поліпептиди, що вони кодують, умовах є по суті ідентичними. Це відбувається, наприклад, коли копію нуклеїнової кислоти створюють, застосовуючи максимум виродження кодону, дозволеного генетичним кодом. У таких випадках нуклеїнові кислоти звичайно гібридизуються у помірно 15 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 суворих умовах гібридизації. Зразкові "помірно суворі умови гібридизації" охоплюють гібридизацію у буфері з 40% формаміду, 1 М NaCI, 1% SDS при 37°С, та промивку у 1 X SSC при 45°С. Позитивна гібридизація є принаймні удвічі більше фонової. Спеціалісти повинні легко розпізнати, що альтернативні умови гібридизаці та промивки можна застосовувати для забезпечення умов подібної суворості. "Антитіло" стосується поліпептиду, що містить framework регіон від імуноглобулін ген або їх фрагменти, що специфічно зв'язується та розпізнає антиген. Визнай гени імуногло-булінів охоплюють гени константних областей каппа, лямбда, альфа, гамма, дельта, еп-силон та мю, а також міріади генів зміннних областей імуноглобуліну. Легкі ланцюги класифікують як каппа або лямбда. Важкі ланцюги класифікують як гамма, мю, альфа, дельта або епсилон, котрі почергово визначають класи імуноглобулінів, IgG, IgM, IgA, IgD та IgE, відповідно. Зразкова імуноглобулін (антитіла) структурна одиниця містить тетрамер. Кожний тетрамер складається з двох ідентичних пар поліпептидних ланцюгів, кожна пара має один "легкий" (приблизно 25 кДа) та один "важкий" ланцюг (приблизно 50-70 кДа). N-кінець кожного ланцюга визначає змінний регіон з приблизно 100 - 110 або більше амінокислот, головним чином відповідальний за розпізнавання антигену. Терміни змінний легкий ланцюг (VL) та змінний важкий ланцюг (VH) стосуються цих легкого та важкого ланцюгів відповідно. Антитіла існують, наприклад, як інтактні імуноглобуліни або як ряд добре охарактеризованих фрагментів, отриманих розщепленням різними пептидазами. Таким чином, наприклад, пепсин розщеплює антитіло нижче дисульфідних зв'язків у регіоні шарніру для отримання F(ab)' 2, димеру Fab, котрий сам є легким ланцюгом, об'єднаним з VH-CHI дисульфідним зв'язком. F(ab)’2 може бути зменшеним у м'яких умовах для руйнування дису-льфідного зв'язку у регіоні шарніру, перетворюючи F(ab)'2 димер у мономер Fab'. Мономер Fab' є по суті Fab з частиною шарнірного регіону (дивись Fundamental Immunology (Paul ed., 3d ed. 1993). Різні фрагменти антитіл визначені у показниках розщеплення інтактних антитіл, спеціалісту ясно, що такі фрагменти можна синтезувати заново хімічно або застосуванням методології рекомбінантної ДНК. Таким чином, термін антитіло, як застосовано тут, також охоплює фрагменти антитіл, отриманих модифікацією повних антитіл, або антитіл, синтезованих заново, застосовуючи методології рекомбінантної ДНК (наприклад, одиничний ланцюг Fv), або антитіл, ідентифікованих, застосовуючи бібліотеки виявлення фагів (дивись, наприклад, McCafferty et al, Nature 348:552554 (1990)). Для отримання моноклональних або поліклонапьних антитіл можна застосовувати відомі у галузі способи (дивись, наприклад, Kohler & Milstein, Nature 256:495-497 (1975); Kozbor et al., Immunology Today 4: 72 (1983); Cole et al., pp. 77-96 in Monoclonal Antibodies and Cancer Therapy (1985)). Способи отримання одинично-ланцюгових антитіл (патент США 4,946,778) можна пристосувати для отримання антитіла до поліпептидів цього винаходу. Також, трансгенних мишей, або інші організми, як-то інших ссавців, можна застосовувати для експресії гуманізованих антитіл. Альтернативно, спосіб виявлення фагів можна застосовувати для ідентифікації антитіл та гетеромерни фрагментів Fab, що специфічно зв'язуються з вибраними антигенами (дивись, наприклад, McCafferty et al., Nature 348:552-554. (1990); Marks et al., Biotechnology 10:779-783 (1992)). Вираз "специфічно (або селективно) зв'язується" з антитілом або "специфічно (або селективно) імунореактивний із", стосовно білку або пептиду, стосується реакції зв'язування, що є детермінативною стосовно наявності білку у гетерогенній популяції білків та інших біологічних препаратах. Таким чином, у зазначених умовах імуноаналізу, визначені антитіла зв'язуються з конкретним білком принаймні удвічі більше фону та по суті не зв'язуються у значній кількості з іншими білками, представленими у зразку. Специфічне зв'язування з антитілом у таких умовах може потребувати антитіл, що вибрано стосовно їх специфічності до конкретного білку. Наприклад, поліклональні антитіла для конденсованих білків можна вибрати для отримання тільки тих поліклональних антитіл, що є особливо імунореактивними з конденсованим білком, а не з індивідуальними компонентами конденсованих білків. Цієї селекції можна досягти позбавленням від антитіл, що перехресно реагують з індивідуальними антигенами. Різноманітність форматів імуноаналізу можна застосовувати для селекції антитіла, специфічно імунореактивного стосовно конкретного білку. Наприклад, твердо-фазні імуноаналізи ELISA звичайно застосовують для селекції антитіл специфічно імунореакти-вних стосовно білку (дивись, наприклад, Harlow & Lane, Antibodies, A Laboratory Manual (1988), для опису форматів імуноаналізу та умов, що можна застосовувати для визначення специфічної імунореактивності). Звичайно специфічна або селективна реакція повинн бути принаймні удвічі більше фонового сигналу або перешкод, а звичайно більше, ніж 10 -100 разів більше фону. 16 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 Полінуклеотиди можуть містити нативну послідовність (тобто, ендогенну послідовність, що кодує індивідуальний антиген або частину його) або можуть містити варіант такої послідовності. Полінуклеотидні варіанти можуть містити одне або більше заміщень, вставок та/або делецій так, щоб біологічна активність кодованого конденсованого поліпептиду не була зниженою відносно конденсованого поліпептиду, що містить нативні антигени. Варіанти переважно мають принаймні приблизно 70% ідентичності, більш переважно принаймні приблизно 80% ідентичності, а найкраще принаймні приблизно 90% ідентичності до полінуклеотидної послідовності, що кодує нативний поліпептид або частину його. Терміни "ідентичний" або процент "ідентичності," у контексті двох або більше послідовностей нуклеїнових кислот або поліпептидів, стосуються двох або більше послідовностей або підпослідовностей, що є такими ж або мають визначений процент амінокислотних залишків або нуклеотидів, що є таким же (тобто, 70% ідентичності, необов'язково 75%, 80%, 85%, 90%, або 95% (наприклад, 98%) ідентичності у визначеному регіоні), при порівнянні та вирівнюванні для максимуму відповідності у вікні порівняння, або зазначеному регіоні, як визначено, застосовуючи один з наступних алгоритмів порівнянні послідовностей або мануальним вивіренням та візуальною перевіркою. Такі послідовності тоді називають "по суті ідентичними." Це визначення також стосується комплементу тестпослідовності. Необов'язково, ідентичність існує у регіоні, що має принаймні приблизно 25 - 50 амінокислот або нуклеотидів у довжину, або необов'язково у регіоні, що має 75-100 амінокислот або нуклеотидів у довжину. Для порівняння послідовностей, звичайно одна послідовність є еталонною послідовністю, з котрою порівнюють тест-послідовності. При застосуванні порівняння алгоритму послідовностей, тестовану та еталонну послідовності уводять у комп'ютер, координати підпослідовності зазначають, якщо необхідно, та зазначають параметри програми алгоритму послідовності. Параметри за умовчанням програми можна застосовувати, або можуть бути зазначеними альтернативні параметри. Алгоритм порівняння послідовностей тоді розраховують процентом ідентичності послідовності для тест-послідовності відносно еталонної послідовності на основі параметрів програми. "Вікно порівняння", як застосовано тут, охоплює посилання на сегмент будь-якої з ряду сусідніх позицій вибран з групи, що складається з 25 - 500, звичайно приблизно 50 -200, більш звичайно приблизно 100 - 150, у котрій послідовність можна порівнювати з еталонною послідовністю того ж ряду сусідніх позицій після оптимального вирівняння двох послідовностей. Способи вивірення послідовностей для порівняння добре відомі у галузі. Оптимальне вивірення послідовностей для порівняння можна провести, наприклад, алгоритмом локальної гомологіі Smith & Waterman, Adv. Appl. Math. 2:482 (1981), вивіренням алгоритму гомології- Needleman & Wunsch, J. Моl. Biol. 48:443 (1970), способом подібності Pearson & Lipman, Proc. Nat'l. Acad. Scl. USA 85:2444 (1988), комп'ютерною обробкою цих алгоритмів (ГЕП, BESTFIT, FASTA, та TFASTA у Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wl), або мануальним вивіренням та візуальною перевіркою (дивись, наприклад, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)). Одним прикладом корисного алгоритму є PILEUP. PILEUP створює складне вивірення послідовностей з груп зі споріденими послідовностями прогресивними попарними вивіреннями, щоб показувати співвідношення та процент ідентичності послідовностей. Це також показує дерево або древовидну схему, показуючи кластеризовані співвідношення, застосовані для створення вивірення. PILEUP застосуваннє спрощення способу прогресивного вивірення Feng & Doolittle, J. Моl. Evol. 35:351-360 (1987). Застосований спосіб є подібним до способу, описаного Higgins & Sharp, CABIOS 5:151 -153 (1989). Програма може вирівнювати аж до 300 послідовностей, кожна з максимумом довжини 5000 нуклеотидів або амінокислот. Процедура складного вивірення починається з попарного вивірення двох найбільш подібних послідовностей, створюючи кластер двох вирівняних послідовностей. Цей кластер тоді вирівнюють стосовно наступної найбільш спорідненої послідовності або кластеру вирівняних послідовностей. Дві послідовності кластерів вирівнюють простою екстензією попарного вивірення двох індивідуальних послідовностей. Кінцевого вивірення досягають серіями прогресивних попарних вивірень. Програму виконують позначенням конкретних послідовностей та їх координати амінокислот або нуклеотидів для регіонів порівняння послідовностей та позначенням параметрів програми, застосовуючи PILEUP, еталонну послідовність порівнюють з іншими тест-послідовностями для визначення проценту ідентичності послідовностей, застосовуючи наступні параметри: вага відсутнього гепу (3,00), вага довжини відсутнього гепу (0,10), а зважені кінцеві гепи. PILEUP можна отримати з комплектом програмного забезпечення 17 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 аналізу послідовності GCG, наприклад, варіант 7,0 (Devereaux et al, Nuc. Acids Res. 12:387-395 (1984). Ще один приклад алгоритму, що є придатним для визначення проценту ідентичності послідовностей та подібності послідовностей є алгоритми BLAST та BLAST 2,0, котрі описані Altschul et al., Nuc. Acids Res. 25:3389-3402 (1977) та Altschul et al., J. Моl. Biol. 215:403- 410 (1990), відповідно. Програмне забезпечення для проведення аналізів BLAST є доступним з National Center для Biotechnology Information (http://www.ncbi.nlm.nih.gov/). Цей алгоритм містить перше ідентифікування високо-бальної пари послідовністьей (HSP) ідентифікуванням коротких груп символів довжини W у послідовності, котра задовольняє і деякій позитивно-оціненій оцінці порогової величини Т, при вирівненні з групою символів тієї ж довжини у послідовності бази даних. Т позначено як близкість оцінки порогової величини груп символів (Altschul et al., вище). Ці початкові влучення близкості груп символів діють як джерела для початку досліджень для пошуку довших HSP, що їх містять. Влучення груп символів подовжують в обох напрямках вздовж кожної послідовності так, щоб сукупну оцінку вивірення можна було збільшувати. Сукупні бали розраховують, застосовуючи для нуклеотидних послідовностей параметри М (преміальна оцінка для пари звірених залишків; завжди > 0) та N (штраф для невідповідних залишків; завжди < 0). Для амінокислотних послідовностей матрицю підрахунку застосовують для розрахунку сукупної оцінки. Екстензію влучень групи символів у кожному напрямку припиняють, коли: сукупна оцінка вивірення спадає за величиною X від максимуму досяжного значення; сукупна оцінка спадає до 0 або нижче, внаслідок накопичення одного або більше негативних бальних залишків вивірень; або досягнуто кінця будь-якої послідовності. Параметри алгоритм BLAST W, Т, та X визначають чутливість та швидкість вивірення. Програма BLASTN (для нуклео-тидної послідовності) застосовує як дефолти довжину кодової комбінації (W) 11, очікування (Е) або 10, М=5, N=-4 та порівняння of обидва strands. Для амінокислотних послідовностей програма BLASTP застосовує як дефолти довжин кодової комбінації 3, очікування (Е) 10, та матрицю підрахунку BLOSUM62 (дивись Henikoff & Henikoff, Proc. Natl. Acad. ScL USA 89:10915 (1989)) вивірення (В) 50, очікування (Е) 10, M=5, N=-4, та порівняння обох ланцюгів. Алгоритм BLAST також проводить статистичний аналіз подібності між двома послідовностями (дивись, наприклад, Karlin & Altschul, Proc. Natl Acad. Sci. USA 90:5873-5787 (1993)). Одним виміром подібності, запропонованим алгоритмом BLAST є найменша сумарна ймовірність (P(N)), котра забезпечує показник ймовірності, котрим при можливості могло б відбуватися порівняння двох нуклеотидних або амінокислотних послідовностей. Наприклад, нуклеїнову кислоту вважають подібною до еталонної послідовності, якщо найменша сумарна ймовірність у порівнянні тест-нуклеїнової кислоти з еталонною нуклеїновою кислотою є менше, ніж приблизно 0,2, більш переважно менше, ніж приблизно 0,01, а найкраще менше, ніж приблизно 0,001. КОМПОЗИЦІЇ ПОЛІНУКЛЕОТИДІВ Як застосовано тут, терміни "сегмент ДНК" та "полінуклеотид" стосуються молекул ДНК, що виділено із загальної геномної ДНК конкретних видів. Тому, сегмент ДНК, що кодує поліпептид, стосується сегменту ДНК, що містить одну або більше кодувальних послідовностей, є по суті виділеним або очищеним від загальної геномної ДНК видів, з котрих отримано сегмент ДНК. Охоплено термінами "сегмент ДНК" та "полінуклеотид" є сегменти ДНК та менші фрагменти таких сегментів, а також рекомбінантні вектори, охоплюючи, наприклад, плазміди, косміди, плагеміди, фаг, віруси, тощо. Як повинні розуміти спеціалісти, сегменти ДНК цього винаходу можуть містити гено-мні послідовності, екстра-геномні та кодовані плазмідами послідовності та менші створені сегменти генів, що експресують, або їх можна пристосувати для експресії білків, поліпептидів, пептидів тощо. Такі сегменти можна виділяти природно, або модифікувати синтетично. Терміни "виділений," "очищений," або "біологічно чистий" тому стосуються матеріалу, що по суті є або позбавлений компонентів, що звичайно знайдені в його природному стані. Безумовно, це стосується сегменту ДНК, який спочатку виділено, та не виключає інші виділені білки, гени, або кодувальні регіони, пізніше додані до композиції. Чистоту та гомогенність звичайно визначають, застосовуючи електрофорез на поліакриламідному гелі або високоефективну рідинну хроматографію. Білок, що є переважним видом, представленим у препараті, є по суті очищеним. Виділену нуклеїнову кислоту відокремлюють від інших відкритих рамок зчитування, що фланкують ген та кодують інші білки, ніж ген. Як повинен визнати спеціаліст, полінуклеотиди можуть бути одинично-ланцюговими (кодувальними або антисенсовими) або подвійноланцюговими, та можуть бути ДНК (геномною, кДНК або синтетичною) або молекулами РНК. Молекули РНК охоплюють молекули НnРНК, котрі містять інтрони та відповідають молекулі ДНК один до одного, та молекули мРНК, котрі не містять інтронів. Додаткові кодувальні або 18 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 некодувальні послідовності можуть, але без необхідності, бути представленими у полінуклеотиді заявленого винаходу, а полінуклеотид може, але без необхідності, бути зв'язаним з іншими молекулами та/або допоміжними матеріалами. Полінуклеотиди можуть містити нативну послідовність (тобто, ендогенну послідовність, що кодує антиген хламідії або його частину) або може містити варіант або біологічний або антигенний функціональний еквівалент такої послідовності. Полінуклеотид може містити одне або більше заміщень, вставок та/або делецій, як описано нижче, переважно так, щоб імуногенність кодованого поліпептиду не була зниженою відносно нативного пухлинного білку. Дію на імуногенність кодованого поліпептиду можна загалом оцінити як описано тут. Термін "варіанти" також охоплює гомологічні гени ксеногенного походження. У додаткових втіленнях, заявлений винахід стосується виділених полінуклеотидів та поліпептидів, що мають різні довжини сусідніх подовжень послідовностей ідентичних або комплементарних стосовно одної або більше послідовностей, розкритих тут. Наприклад, запропоновано полінуклеотиди згідно з винаходом, що містять принаймні приблизно 15, 20, 30, 40, 50, 75, 100, 150, 200, 300, 400, 500 або 1000 або більш сусідніх нуклеотидів одної або більше послідовностей, розкритих тут, а також усі проміжні довжини. Треба розуміти, що "проміжні довжини", у цьому контексті, означають довжину між значеннями, як-то 16, 17, 18, 19, тощо; 21, 22, 23, тощо; 30, 31, 32, тощо; 50, 51, 52, 53, тощо; 100, 101, 102, 103, тощо; 150, 151, 152, 153, тощо; охоплюючи усе між 200-500; 500-1000, тощо. Полінуклеотиди заявленого винаходу, або їх фрагменти, незважаючи на довжину кодувальної послідовності, можуть бути комбінованими з іншими послідовностями ДНК, як-то промотери, сигнали поліаденілування, додаткові сайти рестрикційного ферменту, складні клонувальні сайти, інші кодувальні сегменти, тощо, так що їх повна довжина може значно варіювати. Тому припускають, що можна застосовувати фрагмент нуклеїнової кислоти майже будь-якої довжини, із загальною довжиною переважно обмеженою простотою препарату та застосуванням у призначеному протоколі рекомбінантної ДНК. Наприклад, ілюстративні сегменти ДНК із загальною довжиною приблизно 10000, приблизно 5000, приблизно 3000, приблизно 2000, приблизно 1000, приблизно 500, приблизно 200, приблизно 100, приблизно 50 пар основ у довжину, тощо, (охоплюючи усі проміжн довжини), як припускають, корисні у багатьох реалізаціях цього винаходу. Більш того, спеціалістам треба розуміти, що у результаті виродження генетичного коду, є багато нуклеотидних послідовностей, що кодують поліпептид, як описано тут. Деякі з цих полінуклеотидів мають мінімальну гомологію стосовно нуклеотидної послідовності будь-якого нативного гена. Однак, полінуклеотиди, що варіюють внаслідок відмінностей у використанні кодону особливо розглянуті у заявленому винаході, наприклад, полінуклеотиди, що оптимізовані для селекції кодонів людини та/або примату. Крім того, алелі генів, що містять запропоновані тут полінуклеотидні послідовності, є у рамках заявленого винаходу. Алелі є ендогенними генами, що замінені у результаті одної або більше мутацій, як-то делеції, вставки та/або заміщення нуклеотидів. Утворені мРНК та білок можуть, але без необхідності, мати замінену структуру або функцію. Алелі можна ідентифікувати, застосовуючи стандартні способи (як-то гібридизація, ампліфікаці та/або порівняння послідовностей бази даних). ІДЕНТИФІКАЦІЯ ПОЛІНУКЛЕОТИДІВ ТА ВИЗНАЧЕННЯ ХАРАКТЕРИСТИК Полінуклеотиди можна ідентифікувати, отримувати та/або обробляти, застосовуючи будь-які різноманітності добре визнаних способів. Наприклад, полінуклеотид можна ідентифікувати, як описано більш детально нижче, скринінгом мікромасиву кДНК. Такі скринінги можна проводити, наприклад, застосовуючи мікромасив Synteni (Palo Alto, CA) згідно з інструкціями виробника (по суті як описано Schena et al., Proc. Natl. Acad. Sci. USA 93:10614-10619 (1996) та Heller et al., Proc. Natl. Acad. Sci. USA 94:2150-2155 (1997)). Альтернативно, полінуклеотиди можна ампліфікувати з кДНК, отриманою з клітин, що експре-сують описані тут білки, як-то клітини С. trachomatis. Такі полінуклеотиди можна ампліфікувати шляхом полімеразної ланцюгової реакції (PCR). Для цього підходу специфічні стосовно послідовності праймери можуть бути розроблені на основі послідовностей запропонованих тут, та можуть бути придбаними або синтезованими. Ампліфіковану частину полінуклеотиду заявленого винаходу можна застосовувати для виділення гена повної довжини з придатної бібліотеки (наприклад, бібліотеки кДНК С. trachomatis), застосовуючи добре відомі способи. Такими способами, бібліотеку (кДНК або геномну) скринують, застосовуючи один або більше полінуклеотидних зондів або прайме-рів, придатних для ампліфікації. Переважно, бібліотеку вибрано за розміром для уведення більших молекул. Випадкові праймовані бібліотеки можуть також бути кращими для ідентифікування 5' та висхідних регіонів генів. Геномні бібліотеки кращі для отримання інтронів та подовження 5' послідовності. 19 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для гібридизації часткову послідовність можна мітити (наприклад, нік-трансляцією або 32 кінцевим-міченням Р), застосовуючи добре відомі способи. Бактеріальну або бакте-ріофагову бібліотеку тоді загалом скринують з гібридизувальними фільтрами, що містять денатуровані бактеріальні колонії (або газони, що містять стерильні плями) з міченим зондом (дивись Sambrook et al., Molecular Cloning: A Laboratory Manual (1989)). Гібридизувальні колонії або плями вибирають та роширюють, а ДНК виділяють для наступного аналізу. кДНК-клони можна аналізувати для визначення величини додаткової послідовності, наприклад, за допомогою PCR, застосовуючи праймер від часткової послідовність та праймер від вектору. Рестрикційні карти та часткові послідовності можна створювати для ідентифікації одного або більше перекритих клонів. Повну послідовність можна тоді визначати, застосовуючи стандартні способи, котрі можуть залучати створення серії делеційних клонів. Утворені перекриті послідовності можна тоді комплектувати в одиничну сусідню послідовність. Молекулу кДНК повної довжини можна створювати лігуванням придатних фрагментів добре відомими способами. Альтернативно, є ряд способів ампліфікації для отримання кодувальної послідовності повної довжини з часткової послідовності кДНК. У таких способах ампліфікацію загалом проводять шляхом PCR. Будь-які комерційно доступні комплекти можна застосовувати для проведення ампліфікації. Праймери можуть бути розробленими, застосовуючи, наприклад, програмне забезпечення, добре відоме у галузі. Праймери мають переважно 22-30 нуклеотидів у довжину і мають вміст GC принаймні 50% та гібридизуються з цільовою послідовністю при температурі приблизно 68°С - 72°С. Ампліфікований регіон можна сек-венсувати як описано вище, та перекриті послідовності комплектувати у сусідню послідовність. Одним таким способом ампліфікації є інверсна PCR (дивись Triglia et al., Nucl. Acids Res. 16:8186 (1988)), котра застосовує рестрикційні ферменти для створення фрагменту у відомому регіоні гена. Фрагмент тоді закільцьовують внутрішньомолекулярним лігуванням та застосовують як темплат для PCR з відмінними праймерами, похідними від відомого регіону. Для альтернативного підходу послідовності, суміжні з частковою послідовністю можна відновлювати ампліфікацією з праймером для лінкерної послідовності та прайме-ром, специфічним стосовно відомого регіону. Ампліфіковані послідовності звичайно піддають другому етапу ампліфікації з тими ж лінкерним праймером та другим праймером, специфічним стосовно відомого регіону. Варіація цієї процедури, котра застосовує два праймери, що ініціюють екстензію у протилежних напрямках від відомої послідовності, описано у WO 96/38591. Ще один такий спосіб відомий як "швидка ампліфікація кінців кДНК" або RACE. Цей спосіб полягає у застосуванні внутрішнього праймеру та зовнішнього праймеру, котрий гібридизується з поліА-регіонм або векторною послідовністю, для ідентифікації послідовності, що 5' та 3' відомої послідовності. Додаткові способи охоплюють захватну PCR (Lagerstrom et al., PCR Methods Applic. 1 :111-19 (1991)) та крокову PCR (Parker et al., Nucl. Acids Res.. 19:3055-60 (1991)). Інші способи, що застосовують ампліфікацію, можна також застосовувати для отримання послідовності кДНК повної довжини. У деяких випадках можливе отримання послідовності кДНК повної довжини аналізом послідовностей забезпечених у базі даних експресованих послідовностей tag (EST), як-то доступних від GenBank. Дослідження для перекритих EST можна загалом проводити, застосовуючи добре відомі програми (наприклад, дослідження NCBI BLAST), і такі EST можна застосовувати для створення сусідньої послідовності повної довжини. Послідовності ДНК повної довжини можуть також бути отриманими аналізом геномних фрагментів. ЕКСПРЕСІЯ ПОЛІНУКЛЕОТИДІ Y КЛІТИНАХ-ХАЗЯЯХ В інших втіленнях винаходу, полінуклеотидні послідовності або їх фрагменти, котрі кодують поліпептиди винаходу, або конденсовані білки або їх функціональні еквіваленти, можна застосовувати у рекомбінантних молекулах ДНК для безпосередньої експресії поліпептиду у прийнятних клітинах-хазяях. Внаслідок уродженого виродження генетичного коду можна отримати інші послідовності ДНК, що кодують по суті ті ж або функціонально еквівалентні амінокислотні послідовності, і ці послідовності можна застосовувати для кло-нування та експресування визначеного поліпептиду. Як повинні розуміти спеціалісти, у деяких випадках може бути переважним отримувати поліпептид-кодувальні нуклеотидні послідовності, що мають природно не існуючі ко-дони. Наприклад, кодони кращі для конкретного прокаріотного або евкаріотного хазяїна можна вибрати до посилення швидкості експресії білку або для отримання рекомбінантно-і го транскрипту РНК, що має бажані властивості, як-то напівперіод, що є довшим, ніж у транскрипту створеного з природно існуючої послідовності. Більш того, полінуклеотидні послідовності заявленого винаходу можна створити, застосовуючи загалом відомі у галузі способи зміни послідовностей, що кодують поліпептиди, для різних причин, охоплюючи але без обмеження, зміни, котрі модифікують клонування, 20 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 процесинг, та/або експресію продукту гена. Наприклад, перестановку ДНК випадковою фрагментацією та повторною збіркою за допомогою PCR фрагментів гена та синтетичних олігоінукпеотидів можна застосовувати для створення нуклеотидних послідовностей. На додаток, можна застосовувати сайт-спрямований мутагенез для вставки нових ре-стрикційних сайтів, зміни характеру глікозилування, зміни зверхності кодону, утворення сплайсових варіантів, або уведення мутацій, тощо. У ще одному втіленні винаходу природні, модифіковані або рекомбінантні послідовності нуклеїнових кислот можна лігувати до гетерологічної послідовності для кодування конденсованого білку. Наприклад, для скринінгу пептидної бібліотеки стосовно інгібіторів активності поліпептиду може бути корисним кодувати хімерний білок, що можна розпізнати комерційно доступним антитілом. Конденсований білок можна також створити з вмістом сайту розщеплення між поліпептид-кодувальною послідовністю та послідовністю гетеро-логічного білку так, щоб поліпептид можна було розщепити та очистити від гетерологічної частини. Послідовності, що кодують потрібний поліпептид, можна синтезувати, цілком або ча-і стково, хімічними способами, добре відомими у галузі (дивись Caruthers, M. H. et al, Nucl. Acids Res. Symp. Ser. pp. 215-223 (1980), Horn et al, Nucl. Acids Res. Symp. Ser. pp. 225-232 (1980)). Альтернативно, білок можна отримати, застосовуючи хімічні способи синтезу амінокислотної послідовності поліпептиду, або його частини. Наприклад, синтез пептиду можна проводити, застосовуючи різні твердо-фазні способи (Roberge et al., Science 269:202-204 (1995)), а автоматичного синтезу можна досягти, наприклад, застосовуючи пептидний синтезатор АВІ 431 A (Perkin Elmer, Palo Alto, CA). Заново синтезований пептид мож бути по суті очищеним препаративною високоефективноюрідинною хроматографією (наприклад, Creighton, proteins, Structures and Molecular Principles (1983)) або інші способи порівняння, доступні у галузі. Склад синтетичних пептидів можна підтвердити амінокислотним і аналізом або секвенсуванням (наприклад, процедурою розщеплення Едмана). На додаток, амінокислотна послідовність поліпептиду, або її частину, може бути заміненою при безпосередньому синтезі та/або комбінованою, застосовуючи хімічні способи, з послідовностями інших білків, або їх частинами, для отримання варіанту поліпептиду. Для експресії потрібного поліпептиду нуклеотидні послідовності, що кодують поліпептид, або функціональні еквіваленти, можна вставляти у прийнятний вектор експресії, тобто, вектор, що містить необхідні елементи для транскрипції та трансляції вставленої кодувальної послідовності. Способи, що добре відомі спеціалістам, можна застосовувати для створення векторів експресії, що містять послідовності, що кодують потрібний поліпептид, та прийнятні контрольні елементи транскрипції та трансляції. Ці способи охоплюють in vitro способи рекомбінантної ДНК, синтетичні способи, та in vivo генетичну рекомбінацію. Такі способи описані у Sambrook et al., Molecular Cloning, A Laboratory Manual (1989), та Ausubel et al., Current Protocols in Molecular Biology (1989). Різноманітність систем вектор експресії/хазяїн можна застосовувати для уведення та експресії полінуклеотидних послідовностей. Це охоплює, але без обмеження, мікроорганізми, як-то бактерії, трансформовані рекомбінантним бактеріофагом, плазмідні або космід-ні вектори експресії ДНК; дріжджі, трансформовані векторами експресії дріжджів; системи клітин комах, інфікованих векторами експресії вірусів (наприклад, бакуловірусу); системи клітин рослин, трансформованих векторами експресії вірусів (як-то вірус мозаїки кольорової капусти, CaMV; вірус мозаїки тютюну, TMV) або бактеріальними векторами експресії (як-то плазміди Ті або pBR322); або системи клітин тварин. Послідовності, що кодують потрібний поліпептид, можна синтезувати, цілком або частково, хімічними способами, добре відомими у галузі (дивись Caruthers, M. H. et al, Nucl. Acids Res. Symp. Ser. pp. 215-223 (1980), Horn et al, Nucl. Acids Res. Symp. Ser. pp. 225-232 (1980)). Альтернативно, білок можна отримати, застосовуючи хімічні способи синтезу амінокислотної послідовності поліпептиду, або його частини. Наприклад, синтез пептиду можна проводити, застосовуючи різні твердо-фазні способи (Roberge et al., Science 269:202-204 (1995)), а автоматичного синтезу можна досягти, наприклад, застосовуючи пептидний синтезатор АВІ 431 A (Perkin Elmer, Palo Alto, CA). Заново синтезований пептид мож бути по суті очищеним препаративною високоефективноюрідинною хроматографією (наприклад, Creighton, Proteins, Structures and Molecular Principles (1983)) або інші способи порівняння, доступні у галузі. Склад синтетичних пептидів можна підтвердити амінокислотним аналізом або секвенсуванням (наприклад, процедурою розщеплення Едмана). На додаток, амінокислотна послідовність поліпептиду, або її частину, може бути заміненою при безпосередньому синтезі та/або комбінованою, застосовуючи хімічні способи, з послідовностями інших білків, або їх частинами, для отримання варіанту поліпептиду. 21 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 Для експресії потрібного поліпептиду нуклеотидні послідовності, що кодують поліпептид, або функціональні еквіваленти, можна вставляти у прийнятний вектор експресії, тобто, вектор, що містить необхідні елементи для транскрипції та трансляції вставленої кодувальної послідовності. Способи, що добре відомі спеціалістам, можна застосовувати для створення векторів експресії, що містять послідовності, що кодують потрібний поліпептид, та прийнятні контрольні елементи транскрипції та трансляції. Ці способи охоплюють і in vitro способи рекомбінантноі ДНК, синтетичні способи, та in vivo генетичну рекомбінацію. Такі способи описані у Sambrook et al., Molecular Cloning, A Laboratory Manual (1989), та Ausubel et al., Current Protocols in Molecular Biology (1989). Різноманітність систем вектор експресії/хазяїн можна застосовувати для уведення та експресії полінуклеотидних послідовностей. Це охоплює, але без обмеження, мікроорганізми, як-то бактерії, трансформовані рекомбінантним бактеріофагом, плазмідні або космід-ні вектори експресії ДНК; дріжджі, трансформовані векторами експресії дріжджів; системи клітин комах, інфікованих векторами експресії вірусів (наприклад, бакуловірусу); системи клітин рослин, трансформованих векторами експресії вірусів (як-то вірус мозаїки кольорової капусти, CaMV; вірус мозаїки тютюну, TMV) або бактеріальними векторами експресії і (як-то плазміди Ті або pBR322); або системи клітин тварин. "Контрольні елементи" або "регуляторні послідовності", представлені у векторі експресії є не трансльованими регіонами векторних енхансерів, промотерів, 5' та 3' нетранс-льованих регіонів, котрі взаємодіють з білками клітини-хазяїна для транскрипції та трансляції. Такі елементи можуть варіювати за своєю силою та специфічністю. Залежно від векторної системи та хазяїна будь-яке число придатних елементів транскрипції та трансляції, охоплюючи конститутивні та індуковувані промотери, можна застосовувати. Наприклад, при клонуванні у бактеріальних системах можна застосовувати індуковувані промотери, як-то гібридний промотер плагеміди lacZ РBLU ESCRI PT (Stratagene, La Jolla, Calif.) або плазміди PSPORT1 (Gibco BRL, Gaithersburg, MD) тощо. У системах клітин ссавціві промотери з генів ссавців або вірусів ссавців є загалом кращими. Якщо це необхідно для створення лінії клітин, що містять складні копії послідовностей, що кодують поліпептид, вектори на основі SV40 або EBV можуть бути переважно застосованими з прийнятним се-лектовуваним маркером. У бактеріальних системах число векторів експресії можна вибрати залежно від застосування, призначеного для експресованого поліпептиду. Наприклад, коли є необхідними великі кількості, наприклад, для індукування антитіл, можна застосовувати вектори, котрі спрямовують високий рівень експресії конденсованих білків, що легко очищати. Такі вектори охоплюють, але без обмеження, клонування багатофункціональної Е. соїі та вектори експресії, як-то BLUESCRIPT (Stratagene), у котрих послідовність, що кодує потрібний і поліпептид, можна лігувати у вектор у рамці з послідовностями для аміно-термінального Met та наступними 7 залишками β-галактозидази так, щоб отримати гібридний білок; вектори pIN (Van Heeke SSchuster, J. Biol. Chem. 264:5503-5509 (1989)); тощо. Вектори pGEX (Promega, Madison, Wis.) можна також застосовувати для експресії чужинних поліпептидів як конденсованих білків із глутатіон S-трансферазою (GST). Загалом, такі конденсовані білки є рочинними та їх можна легко очищати від лізованих клітин поглинанням глутатіон-агарозними кульками, а потім елюванням при наявності вільного глутатіону. Білки, отримані у таких системах, можуть бути розробленими для уведення сайтів розщеплення гепарину, тромбіну, або протеази фактору ХА так, щоб клонований потрібний поліпептид можна було відділити від частини GST за бажанням. У дріжджах Saccharomyces cerevisiae можна застосовувати ряд векторів, що містять конститутивні або індуковувані промотери, як-то альфа фактор, алкоголь-оксидазу, та PGH. Інші вектори, що містять конститутивні або індуковувані промотери, охоплюють GAP, PGK, GAL та ADH. Для огляду дивись Ausubel et al. (вище), Grant et al., Methods Enzymol. 153:516-544 (1987) та Romas et ai. Yeast 8 423-88 (1992). У випадках де застосовують рослинні вектори експресії, експресією послідовностей, що кодують поліпептиди можна курувати будь-яким з ряду промотерів. Наприклад, вірусні промотери, як-то промотери 35S та 19S CaMV можна застосовувати поодинці або у комбінації з омега-лідерною послідовністю від TMV (Takamatsu, EMBO J. 6:307-311 (1987)). Альтернативно, можна застосовувати рослинні промотери, як-то невеликі субодиниці промотерів RUBISCO або термічний шок (Coruzzi et al., EMBO J. 3:1671 -1680 (1984); Broglie et al., Science 224:838-843 (1984); та Winter et al., Results Probl. Cell Differ. 17:85-105 (1991)). Ці констракти можна уводити у клітини рослин безпосереднім перетворенням ДНК або опосередкованою патогеном трансфекцією. Такі способи описані у ряду загалом доступних оглядів (дивись, наприклад, Hobbs у McGraw Hill Yearbook of Science and Technology pp. 191-196(1992)). 22 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Комахову систему можна також застосовувати для експресії потрібного поліпептиду. Наприклад, в одній такій системі, вірус ядерного поліедрозу Autographa californica (AcNPV) застосовують як вектор для експресії чужинних генів у клітини Spodoptera frugiperda або Trichoplusia larvae. Послідовності, що кодують поліпептид можуть бути клонованими у несуттєвий регіон вірусу, як-то ген полігедрину, та розміщеними під контролем промотеру полігедрину. Успішна вставка поліпептид-кодувальної послідовності повинна робити ген полігедрину неактивним та утворювати рекомбінантний вірус без білкової оболонки. Рекомбінантн віруси можна тоді застосовувати для інфікування, наприклад, клітин S. frugiperda або Trichoplusia larvae, у котрих потрібний поліпептид мож бути експресованим (Engelhard et al., Proc. Natl. Acad. Scl. U.S.A. 91 :3224-3227 (1994)). У клітинах-хазяях ссавців ряд систем експресії на основі вірусів є загалом доступними. Наприклад, у випадках, де застосовують аденовірус як вектор експресії, послідовності, що кодують потрібний поліпептид, можна лігувати у комплекс транскрипції/трансляції аденовірусу, що складається з пізнього промотеру та троїстої лідерної послідовності. Вставку у несуттєвий регіон Е1 або Е3 вірусного геному можна застосовувати для отримання життєздатного вірусу, що є здатним експресувати поліпептид в інфікованих клітинах-хазяях (Logan & Shenk, Proc. Natl. Acad. Sci. U.S.A. 81 :3655-3659 (1984)). На додаток, енхансери транскрипції, як-то ен-хансер вірусу саркоми Роуза (RSV), можна застосовувати для посилення експресії у клітинах-хазяях ссавців. Специфічні сигнали ініціації можна також застосовувати для досягнення більш ефективної трансляції послідовностей, що кодують потрібний поліпептид. Такі сигнали охоплюють кодон ініціації ATG та суміжні послідовності. У випадках, де послідовності, що кодують поліпептид, його кодон ініціації та висхідні послідовності, вставляють у прийнятний вектор експресії, жодні додаткові транскрипцйні або трансляцйні контрольні сигнали не є необхідними. Однак, у випадках, де вставляють тільки кодувальну послідовність або її частину, екзогенні трансляцйні контрольні сигнали, охоплюючи ATG кодон ініціації, слід було б запропонувати. Більш того, кодону ініціації слід було б бути у правильній рамці зчитування для гарантії трансляці цілої вставки. Екзогенні трансляцйні елементи та кодони ініціації можуть бути різного оїпоходження, природного та синтетичного. Ефективність експресії можна посилити уведенням енхансерів, що прийнятні для конкретн системи клітин, котр застосовують, як-то описаних у літературі (Scharf. et al., Results Probl. Ceil Differ. 20:125-162(1994)). На додаток, штам клітини-хазяїна можна вибрати за його здатністю модулювати експресію вставленої послідовності або обробляти експресований білок потрібним чином. Так модифікації поліпептиду охоплюють, але без обмеження, ацетилування, карбоксилу-вання. глікозилування, фосфорилування, ліпідування, та ацилування. Пост-трансляцйний процесинг, котрий розщеплює "препро" форму білку можна також застосовувати для полегшення правильної вставки, згортання та/або функції. Відмінні клітини-хазяї, як-то СНО, HeLa, MDCK, HEK293, та WI38, котрі мають специфічну клітинну біомеханіку та характеристичні механізми для такої посттрансляцйної активності, можна вибрати для гарантії правильної модифікації та процесингу чужинного білку. Для довготермінового отримання ре-комбінантних білків з високим виходом, стабільна експресія є загалом кращою. Наприклад, лінії клітин, що стабільно експресують потрібний полінуклеотид, можна трансформувати, застосовуючи вектори експресії, котрі можуть містити вірусний початок реплікації та/або ендогенні експресійні елементи та селектовуваний маркерний ген на тому ж або на окремом векторі. Після уведення вектору, клітинам можна дати рости протягом 1-2 діб у збагачених середовищах перед їх нанесенням на селективне середовище. Метою селек-товуваного маркеру є надати резистентності до селекції, а його наявність дозволяє ріст та отримання клітин, що успішно експресують уведені послідовності. Резистентні клони стабільно трансформованих клітин можуть бути проліферованими, застосовуючи способи культури тканин, прийнятні для типу клітин. Будь-який ряд систем селекції можна застосовувати для отримання трансформованих ліній клітин. Це охоплює, але без обмеження, гени тимідин-кінази вірусу простого герпесу (Wigler et al., Cell 11 :223-32 (1977)) та аденін-фосфорибозилтрансферази (Lowy et al., Cell 22:817-23 (1990)), котрі можна застосовувати у клітинах tk.sup. або aprt.sup., відповідно. Також, можна застосовувати як базис для селекці резистентність до антиметаболіту, антибіотику або гербіциду; наприклад, dhfr, котрий надає резистентності до метотрек-сату (Wigler et al., Proc. Natl. Acad. ScL U.S.A. 77:3567-70 (1980)); npt, котрий надає резистентності до аміноглікозидів, неоміцину та G-418 (Colbere- Garapin et al., J. Моl. ВіоІ. 150:1-14 (1981)); та als або pat, котрі надають резистентності до хлорсульфурону та фосфінот-рицин ацетилтрансфераз, відповідно (Murry, вище). Додатков селектовувані гени описані, наприклад, trpB, що дозволяє клітинам застосовувати індол замість триптофану, або hisD, що дозволяє клітинами застосовувати гістинол замість гістидину (Hartman & Mulligan, Proc. Natl. Acad. Scl. U.S.A. 85:8047-51 (1988)). 23 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нещодавно, застосування видимих маркерів популяризовало такі маркери, як антоціаніни, βглюкуронідаза та її субстрат GUS, та люци-фераза та її субстрат люциферин, що є широко застосованими не тільки для ідентифікації трансформантів, але також для визначення величини тичасової або стабільної експресії білку, властивої конкретній векторній системі (Rhodes et al., Methods Моl. ВіоІ. 55:121 -131 (1995)). Хоча наявність/відсутність експресії маркерного гену підтверджує, що потрібний ген є також представленим, його наявність та експресію може бути необхідним підтвердити. Наприклад, якщо послідовність, що кодує поліпептид, вставляють у послідовність маркерного гена, рекомбінантн клітини, що містять послідовності, можна ідентифікувати відсутністю функції маркерного гену. Альтернативно, маркерний ген може бути розміщеним у тандемі з поліпептид-кодувальною послідовністю під контролем одиничного промотеру. Експресія маркерного гену у відповідь на індукування або селекцію звичайно вказує експресію тандемного гена також. Альтернативно, клітини-хазяї, що містять та експресують потрібну полінуклеотидну послідовність, можна ідентифікувати різноманітністю процедур, відомих спеціалістам. Ці процедури охоплюють, але без обмеження, гібридизації ДНК-ДНК або ДНК-РНК та способи біоаналізу або імуноаналізу білку, що охоплюють технології на мембрані, у розчині, або на основі мікросхеми для визначення нуклеїнової кислоти або білку. Різноманітність протоколів для визначення та виміру експресії кодованих полінуклеотидом продуктів, застосовуючи поліклональні або моноклональні антитіла специфічними стосовно продукту, відомі у галузі. Приклади охоплюють фермент-зв'язаний імуносорбентний аналіз (ELISA), радіоімуноаналіз (RIA), та сортування флуоресцентно-активованих клітин (FACS). Двосайтовий імуноаналіз на монокпональній основі, застосовуючи монок-лональні антитіла, реактивні стосовно двох невзаємодіючих епітопів на визначеному поліпептиді, може бути кращим для деяких застосувань, але можна також застосовувати аналіз конкурентного зв'язування. Ці та інш аналізи описані, серед іншого, Hampton et al., Serological Methods, Laboratory Manual (1990) та Maddox et al., J. Exp. Med. 158:1211-1216 (1983). Широка різноманітність міток та способів кон'югації відомі спеціалістам та їх на застосовувати у різних аналізах нуклеїнових кислот та амінокислот. Отримання мічених гібридизаційних або PCR-зондів для визначення послідовностей, споріднених з полінуклеотидами полягає в олігоміченні, нік-трансляції, міченні кінців або PCR-ампліфікації, застосовуючи мічений нуклеотид. Альтернативно, послідовності, або будь-які їх частини можна клонувати у вектор для отримання мРНК-зонду. Такі вектори відомі у галузі, комерційно доступні, та їх можна застосовувати для синтезу РНК-зондів in vitro додаванням прийнятної РНК-полімерази, як-то Т7, Т3, або SP6 та мічені нуклеотиди. Ці процедури можна провести, застосовуючи різноманітність комерційно доступних комплектів. Придати репортер-ні молекули або мітки, що можна застосовувати охоплюють радіонукліди, ферменти, флуоресцентні, хемідюмінісцентні або хромогени засоби, а також субстрати, кофактори, інгібітори, магнітні частинки, тощо. Клітини-хазяї, трансформовані полінуклеотидною послідовністю, можна культивувати в умовах, придатних для експресії та отримання білку з культур клітин. Білок, отриманий рекомбінантними клітинами, може бути секретованим або міститися внутрішньоклітинно залежно від послідовності та/або застосованого вектору. Як повинні розуміти спеціалісти, вектори експресії, що містять полінуклеотиди винаходу можуть бути розробленими для уведення сигнальної послідовності, що спрямовують секрецію кодованого поліпептиду прокаріотною або евкаріотною мембраною клітин. Інші реком-бінантні конструкції можна застосовувати до поєдання послідовностей, що кодують потрібний поліпептид, з нуклеотидною послідовністю, що кодує поліпептидний домен, що повинен полегшувати очистку рочинних білків. Такі домени полегшення очистки охоплюють, але без обмеження, метал-хелатувальні пептиди, як-то гістидин-триптофанові модулі, що дозволяють очистку на іммобілізованих металах, домени білку А, що дозволяють очистку на іммобілізованому імуноглобуліні, та домен, застосовуван у системі FLAGS екстензії/афінної очистки (Immunex Corp., Seattle, Wash.). Уведення розщеплюваних лінкерних послідовностей, як-то специфічних для Фактору ХА або ентерокінази (Invitrogen. San Diego, Calif.) між доменом для очисткс та кодованим поліпептидом можна застосовувати для полегшення очистки. Один такий вектор експресії забезпечує експресію конденсованого білку, що містить потрібний поліпептид, та нуклеїнову кислоту, що кодує 6 гістидино-вих залишків, передуючих тіоредоксиновому або ентерокіназному сайту розщеплення. Гістидинові залишки полегшують очистку на ІМІАС (афінна хроматографія на іммобілізованому металевому іоні) як описано Porath et al., Prot. Exp. Purif. 3:263-281 (1992), а ентеро-кіназний сайт розщеплення забезпечує очистку потрібного поліпептиду від конденсованого білку. Обговорення векторів, котрі містять конденсовані білки, запропоновано Kroll et al., DNACell Biol. 12:441 -453 (1993)). 24 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 На додаток до рекомбінантних способів отримання поліпептиди винаходу та їх фрагменти, можна отримати безпосереднім синтезом пептиду, застосовуючи твердо-фазні способи (Merrifield, J. Am. Chem. Soc. 85:2149-2154 (1963)). Синтез білку можна проводити, застосовуючи мануальні способи або автоматично. Автоматизований синтез можна провести, наприклад, застосовуючи пептидний синтезатор Applied Biosystems 431 А (Perkin Elmer). Альтернативно, різні фрагменти можна хімічно синтезувати окремо та комбінувати, застосовуючи хімічні способи отримання молекул повної довжини. СПОСОБИ ПОСТАЧАННЯ IN VIVO ПОЛІНУКЛЕОТИДІВ У додаткових втіленнях, генетичні констракти, що містять композиції полінуклеотидів винаходу уводять у клітини in vivo. Цього можна досягти, застосовуючи будь-які різноманітні або добре відомі підходи, кілька з котрих наведені нижче для ілюстрації. 1. АДЕНОВІРУС Один з кращих способів постачання in vivo одної або більше послідовностей нуклеїнових кислот полягає у застосуванні аденовірусного вектору експресії. "Аденовірусний вектор експресії" призначено для уведення тих констрактів, що містять аденовірусні послідовності, достатні для (а) підтримки упаковки констракту та (b) для експресії полінуклео-тиду, що клоновано у сенсовій або антисенсовій орієнтації. Безумовно, у контексті антисе-нсового констракту експресія не потребує, щоб був синтезованим продукт гена. Вектор експресії містить генетично створену форму аденовірусу. Знання генетичної організації аденовірусу, 36 ко, лінійна, подвійно-ланцюгова ДНК вірусу, дозволяє заміщення великих частин аденовірусуної ДНК чужинними послідовностями аж до 7 ко (Grunhaus & Horwitz, 1992). На відміну до ретровірусу аденовірусна інфекція клітин-хазяїв не призводить до хромосомальної інтеграції внаслідок того, що аденовірусна ДНК може реплікуватися епісомально без можливої генотоксичності. Також, аденовіруси є структурно стабільними та жодного геномного перегрупування не визначено після естенсивної ампліфікації. Аденовірус може інфікувати по суті усі епітеліальні клітини, незважаючи на етап їх клітинного циклу. Досі аденовірусна інфекція, здається, стосується тільки м'яких хвороб, як-то гостра респіраторна хвороба людини. Аденовірус є особливо придатним для застосування як вектору перенесення гена внаслідок середього розміру його геному, легкості поводження, високого титру, широкого вибору цільових клітин та високої інфективності. Обидва кінці вірусного геному містять 100-200 пар основ інвертованих повторів (ITR), котрі є цис елементами, необхідними для реплікації та упаковки вірусної ДНК. Ранні (Е) та пізні (L) регіони геному містять відмінні транскрипційні одиниці, що розділені початком вірусної реплікації ДНК. Е1-регіон (Е1А та Е1 В) кодує білки, відповідальні за регуляцію транскрипції вірусного геному та кількох клітинних генів. Експресія регіону Е2 (Е2А та Е2В) призводить до синтезу білків для вірусної реплікації ДНК. Ці білки залучені у реплікацію ДНК, експресію пізнього гена та відсічку клі-тини-хазяїна (Renan, 1990). Продукти пізніх генів, охоплюючи більшість вірусних капсид-них білки, експресуються тільки після значного процесингу одиничного первинного транс-крипту похідного від головного пізнього промотеру (MLP). MLP, (локалізований при 16,8 м.о.) є особливо ефективним у пізній фазі інфекції, та усі похідн мРНК від цього промотеру мають 5D-троїсту лідерну (TPL) послідовність, котра створює її кращу мРНК для трансляції. У сучасній системі рекомбінантний аденовірус створюють гомологічною рекомбінацією між човниковим вектором та провірусним вектором. Внаслідок можливої рекомбінації і між двома провірусними векторами аденовірус дикого типу можна створювати цим способом. Тому, це є критичним для виділення одиничного клону вірусу з індивідуальної плями та дослідження його геномної структури. Створення та розмноження сучасних аденовірусних векторів, котрі є реплікаціями дефіцитної, залежної від унікальної хелперної лінії клітин, позначеної 293, котру було трансформовано з клітин ембріону нирок людини фрагментами Ad5 ДНК, що конститутивно експресує білки Е1 (Graham et al., 1977). Оскільки регіон Е3 є несуттєвим для аденовірусного геному (Jones & Shenk, 1978), сучасні аденовірусні вектори з допомогою клітин 293, несуть чужинну ДНК у Е1, D3 або обох регіонах (Graham & Prevec, 1991). У природі аденовірус може пакувати приблизно 105% геному дикого типу (Ghosh-Choudhury et al.,1987), забезпечуючи місткість для приблизно 2 ко екстра ДНК. Комбінована із приблизно 5,5 ко ДНК, що є замінними у регіонах Е1 та Е3, максимальна місткість сучасного аденовірусного вектору є у межах 7,5 ко, або приблизно 15% від загальної довжини вектору. Більше, ніж 80% вірусного геному аденовірусу залишається у векторному каркасі та є джерелом породженої вектором цитотоксичності. Також, реплікаційна нестача усуненого Е1 вірусу є неповною. Наприклад, блокування експресії вірусного гена спостерігали із зараз доступними векторами при високій 25 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 різноманітності інфекції (МОl) (Mulligan, 1993). Хелпер-ні лінії клітин можуть бути похідними з клітин людини, як-то клітин ембріону нирок людини, клітини м'язів, гематопоетичних клітини або інш людини ембріон мезенхімальних або епітеліальних клітин. Альтернативно, хелперні клітини можуть бути похідними з клітини видів інших ссавців, що є терплячими стосовно аденовірусу людини. Такі клітини охоплюють, наприклад, клітини Vero або мезенхімальних або епітеліальн клітини іншого ембріону мавпи. Як вказано вище, зараз кращою хелперною лінією клітин є 293. Нещодавно, Racher et al. (1995) розкрили поліпшені способи культивування клітин 293 та розмноження аденовірусу. В одному форматі агрегати природних клітин вирощують інокуляцією індивідуальних клітини в обертові колби з силіційорганічним покриттям на 1 л (Techne, Cambridge, UK), що містять 100-200 мл середовища. Після перемішування при 40 об/хв, життєздатність клітин оцінено з трипан-блакитним. У ще одному форматі мі-кроносії Fibra-Cel (Bibby Sterlin, Stone, UK) (5 г/л) застосовують таким чином. Інокулят клітин, ресуспендований у 5 мл середовища, додають до носія (50 мл) у колб Ерленмейєра 250 мл та залишають з перемішуванням на 1 - 4 години. Середовищ тоді переносять у 50 мл свіжого середовища та струшують. Для отримання вірусів клітинам дають рости до приблизно 80% конфлюєнтності, після чого середовищ заміняють (до 25% кінцевого об'єму) та аденовірус додають при МОl 0,05. Культури залишають на ніч, після чого об'єм збільшують до 100% та струшують протягом ще 72 годин. Інакше у такому разі вимога, щоб аденовірусний вектор був реплікаційно дефектним, або принаймні обумовлено дефектним, природа аденовірусного вектору не є, можна вважати, ключовою ст. успішного здійснення винаходу. Аденовірус може бути будь-яким з 42 відмінних відомих серотипів або підгруп A-F. Аденовірус типу 5 підгрупи С є кращим вихідним матеріалом для отримання обумовленого реплікаційно-дефектного аденовірусного вектору для застосування у заявленому винаході, оскільки аденовірус типу 5 є аденовірусом людини, про котрий відома велика кількість біохімічної та генетичної інформаці, та він в минулому застосований для більшості конструкцій, що застосовують аденовірус як вектор. Як вказано вище, звичайний вектор згідно з заявленим винаходом є реплікаційно дефектним та повинен не мати регіон Е1 аденовірусу. Таким чином, він повинен бути найбільш підхожим для уведення полінуклеотиду, що кодує ген, потрібний у позиції, з котрої Е1-кодувальні послідовності мають бути видаленими. Однак, позиція вставки констракту у послідовності аденовіруси не є критичною для винаходу. Полінуклеотид, що кодує потрібний ген, можна також вставляти замість усуненого регіону Е3 у заміщених Е3 векторах, як описано Karlsson et al. (1986), або у регіон Е4, де хелперна лінія клітин або хелперний вірус комплектує дефект Е4. Аденовірус легко вирощувати та поводитися з ним, і він виявляє широкі межі хазяїв in vitro 9 11 та in vivo. Цю групу вірусів можна отримати з високими титрами, наприклад, 10 -10 плямоутворювальних одиниці на мл, та вони є дуже інфекційними. Цикл життя аденовірусу не потребує інтеграції у геном клітини-хазяїна. Чужинні гени, доставлені аденовірусними векторами, є епісомальними, а тому, мають низьку генотоксичність до клітин-хазяїв. Про жодну побічну дію не повідомлено у дослідженнях вакцинації аденовірусом дикого типу (Couch et al., 1963; Top et al., 1971), демонструючи його безпечність та терапевтичну можливість як вектору перенесення гена in vivo. Аденовірусні вектори застосовані в експресії евкаріотного гена (Levrero et al., 1991 ; GomezFoix et al., 1992) та розробці вакцини (Grunhaus & Horwitz, 1992; Graham & Prevec, 1992). Нещодавно, дослідження тварин підтвердили, що рекомбінантний аденовірус можна було б застосовувати для генної терапії (Stratford-Perricaudet & Perricaudet, 1991 ; Stratford-Perricaudet et al., 1990; Rich et al., 1993). Дослідження застосування рекомбінант-ного аденовірусу до відмінних тканин охоплюють інстиляцію у трахеї (Rosenfeld et al., 1991 ; Rosenfeld et al., 1992), ін'єкцію у м'язи (Ragot et al., 1993), периферійні внутрішньовенн ін'єкції (Herz & Gerard, 1993) та стереотаксичний інокулят у мозок (Le Gal La Salle et al., 1993). 2. РЕТРОВІРУСИ Ретровіруси є групою вірусів з одинично-ланцюгов РНК, охарактеризованих здатністю перетворювати їх РНК у подвійно-ланцюгову ДНК у інфікованих клітинах процесом зворотної транскрипції (Coffin, 1990). Утворена ДНК тоді стабільно інтегрується у клітинні хромосоми як провірус та спрямовує синтез вірусних білків. Інтеграція призводить до збереження вірусної генної послідовності у клітині-реципієнті та її нащадках. Ретровірусний геном містить три гени, gag, рої, та env, що кодують капсидні білки, полімеразний фермент та компоненти оболонки, відповідно. Послідовність, знайдена висхідною від гена gag, містить сигнал для упаковки геному у віріони. Послідовності двох довгих термінальних повторів (LTR) представлені на 5' та 3' кінцях вірусного геному. Вони містять послідовності сильного промотеру та енхансеру та також потрібні для інтеграції у геном клітини-хазяїна (Coffin, 1990). 26 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для створення ретровірусного вектору нуклеїнову кислоту, що кодує один або більше потрібних олігоінуклеотидних або полінуклеотидних послідовностей, вставляють у вірусний геном замість деяких вірусних послідовностей для отримання вірусу, що є репліка-ційнодефектним. Для отримання упаковки віріонів створюють лінію клітин, що містить гени gag, рої, та env але без LTR та компонентів упаковки (Mann et al., 1983). Коли рекомбі-нантну плазміду, що містить кДНК, разом із ретровірусною LTR та послідовностями упаковки уводять у цю лінію клітин (осадженням кальцій фосфату наприклад), послідовність упаковки дозволяє транскрипту РНК рекомбінантної плазміди бути упакованим у вірусні частинки, котрі тоді секретуються у середовища культур (Nicolas & Rubenstein, 1988; Temin, 1986; Mann et al., 1983). Середовища, що містять рекомбінантні ретровіруси, тоді збирають, необов'язково концентрують, та застосовують для перенесення гена. Ретрові-русні вектори здатні інфікувати широкі різноманітності типів клітин. Однак, інтеграція та стабільна експресія потребують типу клітинхазяїв (Paskind et al., 1975). Новий підхід, розробленоий для специфічного націлювання ретровірусних векторів, було нещодавно розвинено на основі хімічної модифікації ретровірусу хімічним додаванням залишків лактози до вірусної оболонки. Ця модифікаці могла б дозволити специфічну інфекцію гепатоцитів через рецептори сіалоглікопротеїну. Відмінний підхід до націлювання рекомбінантних ретровірусів було розроблено, у ньому застосовували біотиніловані антитіла проти ретровірусної білкової оболонки та проти специфічного клітинного рецептору. Антитіла були сполученими через біотинові компоненти застосуванням стрептавідину (Roux et al., 1989)., застосовуючи антитіла проти головних антигенів комплексу гістосумісності класу І та класу II, вони продемонстрували інфекцію різних клітин людини, що несуть ті поверхнаві антигени з екотропічним вірусом in vitro (Roux et al., 1989). 3. АДЕНО-АСОЦІЙОВАНІ ВІРУСИ AAV (Ridgeway, 1988; Hermonat & Muzycska, 1984) є паровірусом, відкритим як забруднення аденовірусних штамів. Він є повсюдним вірусом (антитіла представлені у 85% людей США), що не зв'язано з будь-якою хворобою. Його також класифікують як депендо-вірус, внаслідок залежності його реплікації від наявності хелперного вірусу, як-то аденовірус. П'ять серотипів виділено, з котрих AAV-2 є чудово охарактеризованим. AAV має одинично-ланцюгову лінійну ДНК, що заключеною у капсидні білки VP1, VP2 та VP3 для утворення ікосаедрального віріону діаметром 20 - 24 нм (Muzyczka & McLaughlin, 1988). ДНК AAV має приблизно 4,7 ко у довжину. Вона містить дві відкриті рамки зчитування та є фланкованою двома ITR. Є два головних гени у геномі AAV: rep та cap. Ген гер кодує білки, відповідальні за реплікації вірусу, a cap кодує капсидний білок VP1-3. Кожний ITR утворює шпилькову структуру Т-форми. Ці термінальні повтори тільки основними цис компонентами AAV для хромосомальної інтеграції. Тому AAV може бути застосованим як вектор з усіма вірусними кодувальними послідовностями, видаленими та заміненими касетою генів для постачання. Три вірусні промотери ідентифіковані та названі р5, р19, та р40, згідно з їх позиціями на мапі. Транскрипція р5 та р19 призводить до отримання білків rер, а транскрипція р40 дає капсидні білки (Hermonat & Muzyczka, 1984). Є кілька факторів, що підказали дослідникам досліджувати можливість застосування rAAV як вектору експресії. Одного, що потребує постачання гена для інтеграції у хромосому хазяїна, є неочікувано мало. Необхідно мати 145 по ITR, котрі складають тільки 6% геному AAV. Це залишає місце у векторі для вставки 4,5 ко ДНК. Хоча це перенесення місткості мож запобігати AAV від постачання великих генів, воно є достатньо придатне для постачання антисенсових констрактів заявленого винаходу. AAV є також гарним вибором стосовно постачання векторів внаслідок їх безпечності. Є відносно ускладнений механізм вивільнення: не тільки аденовірусу природного типу, але також генів AAV, потрібних для мобілізації rAAV. Подібно, AAV не є патогенним та не асоційований з будь-якою хворобою. Видалення вірусної кодувальної послідовності міні-5 мізує імунні реакції на експресію вірусного гена, а тому, rAAV не викликає запальної реакції. 4. ІНШІ ВІРУСНІ ВЕКТОРИ ЯК ЄКСПРЕСІЙНІ КОНСТРАКТИ Інші вірусні вектори можна застосовувати як експресійні констракти у заявленому винаході для постачання олігоінуклеотидних або полінуклеотидних послідовностей до клітини-хазяїна. Вектори, похідні від вірусів, як-то вірус коров'ячої віспи (Ridgeway, 1988; Coupar et al., 1988), лентивіруси, поліовіруси та віруси герпесу можна застосовувати. Вони надають кілька принадних можливостей для різних клітин ссавців (Friedmann, 1989; Ridgeway, 1988; Coupar et al., 1988; Horwichetal., 1990). При сучасному розпізнаванні дефектних вірусів гепатиту В нове розуміння отриман-) няе стосовно співвідношення структура-функція відмінних вірусних послідовностей. In vitro 27 UA 97943 C2 5 10 15 20 25 30 35 40 45 50 55 60 дослідження показали, що вірус міг би залишати здатність до хелпер-залежної упаковки та зворотної транскрипції, незважаючи на делеці аж до 80% їх генома (Horwich et al., 1990). Це підтвердило, що великі частини геному могли б бути заміненими чужинним генетичним матеріалом. Гепатотропізм та стійкість (інтеграція) були особливо принадними ) властивостями для спрямованого перенесення гена до печінки. Chang et al. (1991) уводили ген хлорамфеніколацетилтрансферази (CAT) у геном вірусу гепатиту В качки замість полімеразної, поверхневої, та доповерхнавої кодувальних послідовностей. Це було котра-нсфектовано з вірусом дикого типу у лінію клітин гепатоми птиць. Культиваційні середовища, що містять високі титри рекомбінантного вірусу, застосовували для інфікування пе-і рвинних гепатоцитів каченят. Стабільну експресію гена CAT визначали протягом принаймні 24 діб після трансфекції (Chang et al., 1991). Додаткові 'вірусні' вектори охопілюють вірусо-подібн частинки (VLP) та фаги. 5. НЕВІРУСНІ ВЕКТОРИ Для впливу на експресію олігоінуклеотидних або полінуклеотидних послідовностей і заявленого винаходу, експресійний констракт повинен бути доставленим у клітину. Це постачання може завершуватися in vitro у будь-якій з лабораторних процедур для трансформування ліній клітин, in vivo або ex vivo, як у лікуванні деяких станів хвороб. Як описано вище, один кращий механізм для постачання є шляхом вірусної інфекції, де експресійний констракт є інкапсульованим у інфекційній вірусній частинці. Як тільки експресійний констракт доставлено у нуклеїнову кислоту клітини, що кодує потрібні олігоінуклеотидні або полінуклеотидні послідовності, він може бути розташованим та експресованим у відмінних сайтах. У деяких втіленнях нуклеїнова кислота, що кодує констракт, може стабільно інтегруватися у геном клітини. Ця інтеграція може бути у конкретному положенні та орієнтації шляхом гомологічної рекомбінації (заміщення гена) або може бути інтеграціяю у випадкові, неспецифічні положення (приріст гена). У наступних втіленнях, нуклеїнова кислота може бути стабільною у клітині як окремий, епісомальний сегмент ДНК. Такі сегменти нуклеїнових кислот або "епісоми" кодують послідовності, достатні для збереження та реплікації незалежного або синхронізованого з клітинами-хазяями циклу. Як експресійний констракт є доставляється у клітину та де у клітині залишається нуклеїнова кислота залежить від типу застосованого експресійного констракту. У деяких втіленнях винаходу, експресійний констракт, що містить одну або більше олігоінуклеотидних або полінуклеотидних послідовностей може просто складатися з голих рекомбінантн ДНК або плазміди. Перенесення констракту, котрий фізично або хімічно проходить мембрану клітини, можна проводити будь-яким з вищенаведених способів. Це є особливо придатним для перенесення in vitro, але це можна застосовувати для in vivo застосування також. Dubensky et al. (1984) успішно уводили поліомавірус ДНК у формі кальцій фосфату, осадженого у печінку та селезінку дорослих та новонароджен мишей, демонструючи активну вірусну реплікацію та гостру інфекцію. Benvenisty & Reshef (1986) також продемонстрували, що безпосередні інтраперитонеальні ін'єкції осаджених на кальцій фосфаті плазмід призводять до експресії трансфектованих генів. Передбачують, що ДНК, що кодує потрібний ген, може також бути перенесеною таким чином in vivo та експресувати продукт гена. Ще одне втілення винаходу для перенесення голого експресійного констракту ДНК у клітини може залучати бомбардування частинками. Цей спосіб залежить від здатності прискорювати покриті ДНК мікрочастинки до високої швидкості, дозволяючи їм протикати мембрани клітин та входити у клітини на вбиваючи їх (Klein et al., 1987). Кілька пристроїв для прискорення невеликих частинок розроблено. Один такий пристрій залежить від високовольтного розряду для створення електроструму, котрий у свою чергу забезпечує рушійну силу (Yang et al., 1990). Застосовані мікрочастинки мають складатися з біологічно інертних речовини, як-то вольфрамові або золоті кульки. Вибран органи, охоплюючи печінку, шкіру, та м'язи тканин щурів та мишей, мають бути бомбардованими in vivo (Yang et al., 1990; Zelenin et al., 1991). Це може потребувати хірургічного втручання до тканин або клітин, для позбавлення від будь-як проміжної тканин між розпилювачем та цільовим органом, тобто, обробки ex vivo. Знов, ДНК, що кодує конкретний ген, може бути доставленою цим шляхом. ПОЛІПЕПТИДНІ КОМПОЗИЦІЇ Заявлений винахід стосується композицій поліпептидів, як описано тут. Загалом, композиція поліпептидів винаходу повинна бути комбінацією виділених поліпептидів або їх імуногенних фрагментів. Альтернативно, деякі або усі з поліпептидних антигенів у винахідницькій композиції можуть бути у конденсованому білку. Наприклад, у винахідницькій композиції, що містить три антигени: (і) антигени можуть бути запропонован у формі трьох виділених поліпептидів (іі) усі 28
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine against chlamydial infection
Автори англійськоюBarth Brenda, Bhatia Ajay, Alderson Mark, Maisonneuve Jean-Francoios L., Lobet Yves, Nozay Florence Bernadette, Marchand Martine, Mettens, Pascal, Skeiky Yasuir A., Probst Peter
Назва патенту російськоюВакцина против инфекции chlamydia
Автори російськоюБарт Бренда, Бхатия Айя, Альдерсон Марк, Месонне Жан-Франко Л., Лобет Ивз, Нозе Флоренсе Бернадетт, Маркан Мартин, Меттенс Паскаль, Скейки Ясир А., Пробст Петер
МПК / Мітки
МПК: A61K 39/118
Мітки: інфекції, вакцина, снlamydia
Код посилання
<a href="https://ua.patents.su/181-97943-vakcina-proti-infekci-snlamydia.html" target="_blank" rel="follow" title="База патентів України">Вакцина проти інфекції снlamydia</a>
Попередній патент: Тверда фармацевтична композиція, що містить валсартан
Наступний патент: Сполуки для лікування запальних захворювань
Випадковий патент: Тримач пальників шахтної печі