Фармацевтична композиція, що містить парацетамол, та спосіб її виготовлення
Номер патенту: 109544
Опубліковано: 10.09.2015
Автори: Шах Пракашчандра Дж., Пател Мілан Р., Пател Кетан Р.
Формула / Реферат
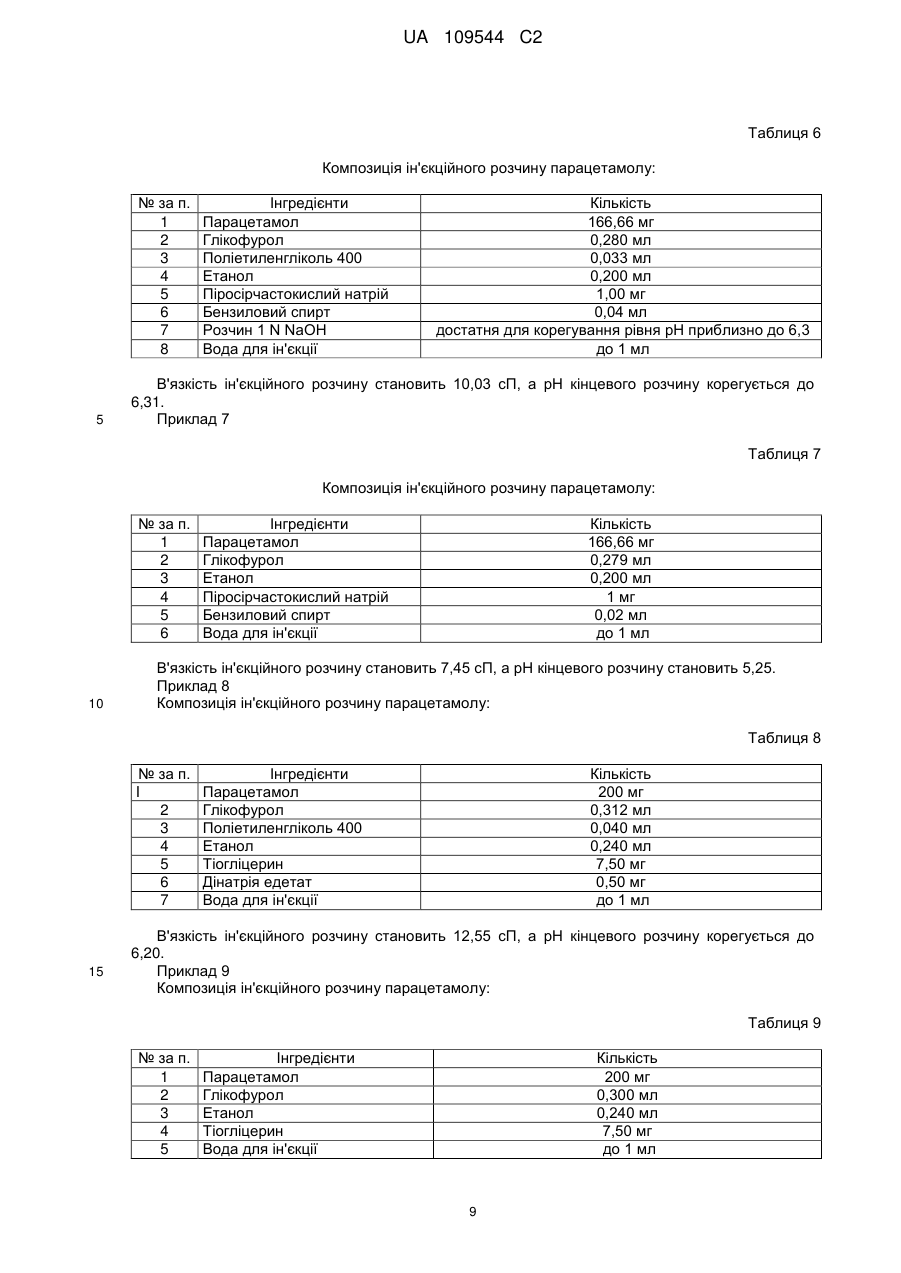
1. Парентеральна композиція з високою концентрацією парацетамолу або його фармацевтично прийнятних солей, що забезпечує повну терапевтичну дозу у 500 мг парацетамолу в 2-3 мл у водній розчинювальній системі, у якій концентрація парацетамолу або його фармацевтично прийнятних солей становить від 166 до 250 мг/мл, а динамічна в'язкість - 7-28 сП при 25 °С.
2. Парентеральна композиція за п 1, у якій розчинювальна система включає глікофурол, етанол і воду.
3. Парентеральна композиція за п. 1, у якій розчинювальна система включає глікофурол, етанол, поліетиленгліколь і воду.
4. Парентеральна композиція за будь-яким з пп. 1-3, динамічна в'язкість якої становить від 16 до 28 сП, краще - від 7 до 22 сП.
5. Парентеральна композиція за будь-яким з пп. 1, 2 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 166 до 200 мг на мл у розчинювальній системі, що включає 25-40 % об. глікофуролу, 20-37 % об. етанолу й воду для доведення загального об'єму розчину до 2-3 мл.
6. Парентеральна композиція за будь-яким з пп. 1-2 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 200 до 250 мг на мл у розчинювальній системі, що включає 25-40 % об. глікофурол, 23-35 % об. етанолу й воду для доведення загального об'єму розчину до 2-3 мл.
7. Парентеральна композиція за будь-яким з пп. 1, 3 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 166 до 200 мг на мл у розчинювальній системі, що включає 25-42 % об. глікофуролу, 10-35 % об. етанолу, 3-19 % об. поліетиленгліколю й воду для доведення загального об'єму розчину до 2-3 мл.
8. Парентеральна композиція за будь-яким з пп. 1, 3 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 200 до 250 мг на мл у розчинювальній системі, що включає 30-40 % об. глікофуролу, 24-35 % об. етанолу, 3-6 % об. поліетиленгліколю й воду для доведення загального об'єму розчину до 2-3 мл.
9. Парентеральна композиція за будь-яким з пп. 1, 3, 4, 7 і 8 у якій поліетиленгліколь являє собою поліетиленгліколь 400/600.
10. Парентеральна композиція за п. 5, динамічна в'язкість якої становить від 7 до 16 сП.
11. Парентеральна композиція за п. 6, динамічна в'язкість якої становить від 16 до 28 сП.
12. Парентеральна композиція за п. 7, динамічна в'язкість якої становить від 9 до 14 сП.
13. Парентеральна композиція за п. 8, динамічна в'язкість якої становить від 14 до 28 сП.
14. Парентеральна композиція за будь-яким з пп. 1-13, яка, за бажанням, включає антиоксиданти, хелатоутворюючі або/і буферні агенти.
15. Парентеральна композиція за будь-яким з 1-14, яка, за бажанням, включає від 2 до 6 % об. бензилового спирту.
16. Спосіб одержання парентеральної композиції з парацетамолом або його фармацевтично прийнятними солями, які мають концентрацію активного інгредієнта в діапазоні приблизно від 166 до 250 мг/мл, у якому:
а) розчинюють необхідну кількість парацетамолу або його фармацевтично прийнятної солі в розчинювальній системі в інертному середовищі;
б) за бажанням, додають антиоксидант, хелатостворюючий агент, бензиловий спирт;
в) за бажанням, корегують рН у межах від 4 до 8;
г) корегують об'єм розчину до заданої величини;
д) фільтрують розчин через 0,22-мікронне фільтраційне середовище;
е) заповнюють розчином ампули/флакони в інертному середовищі;
є) за бажанням, обробляють ампули/флакони в автоклаві;
причому розчинювальна система являє собою глікофурол, етанол і воду або розчинювальна система являє собою глікофурол, етанол, поліетиленгліколь і воду.
17. Спосіб за п. 16, у якому рівень рН розчину на етапі "в" корегують в межах від 4 до 8 за допомогою соляної кислоти, сірчаної кислоти, оцтової кислоти, лимонної кислоти, гідроксиду натрію, гідроксиду калію, гідрокарбонату натрію, гідрокарбонату калію.
18. Спосіб за п. 16, у якому рівень рН розчину на етапі "в" корегують в межах від 4 до 8 за допомогою цитратного буфера, фосфатного буфера тощо.
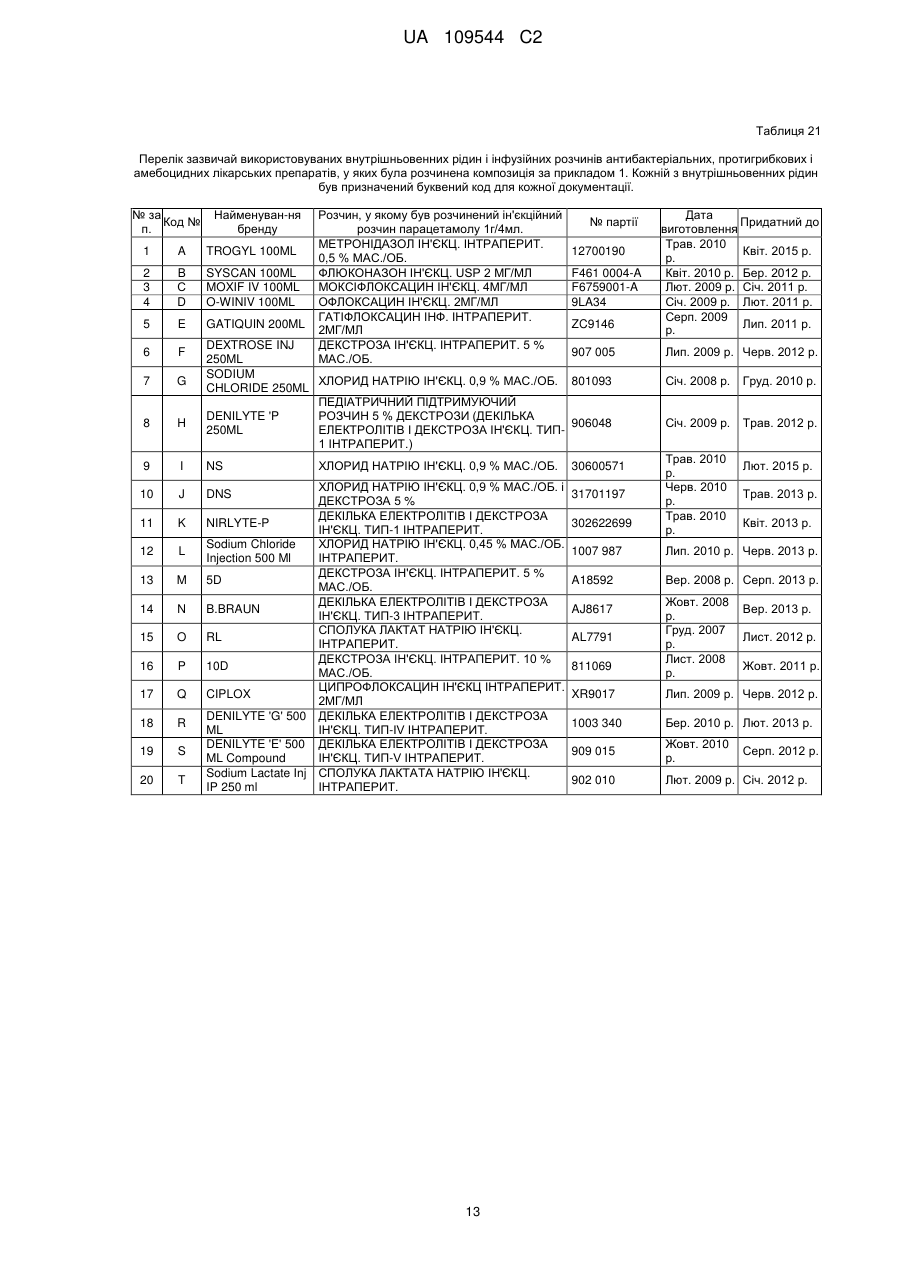
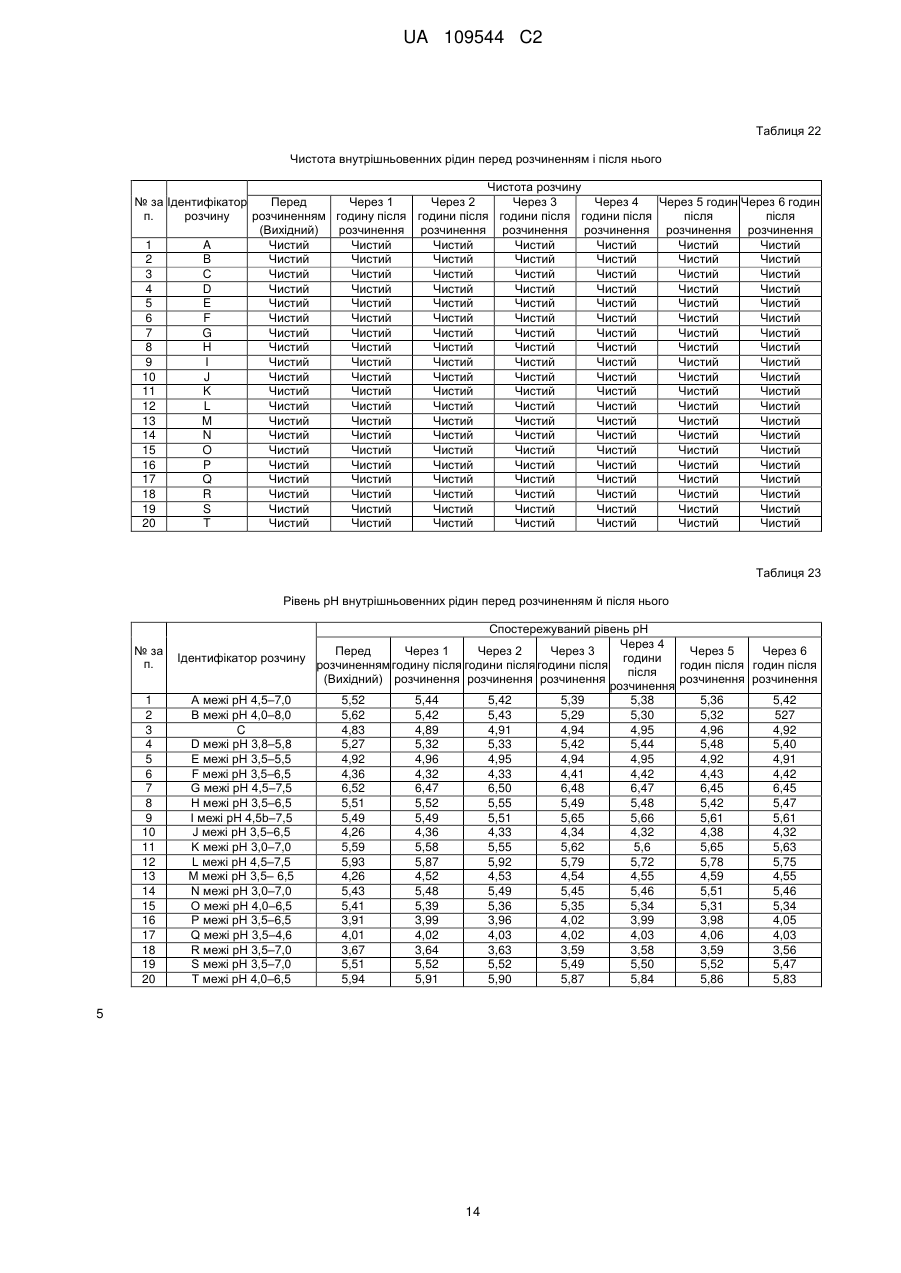
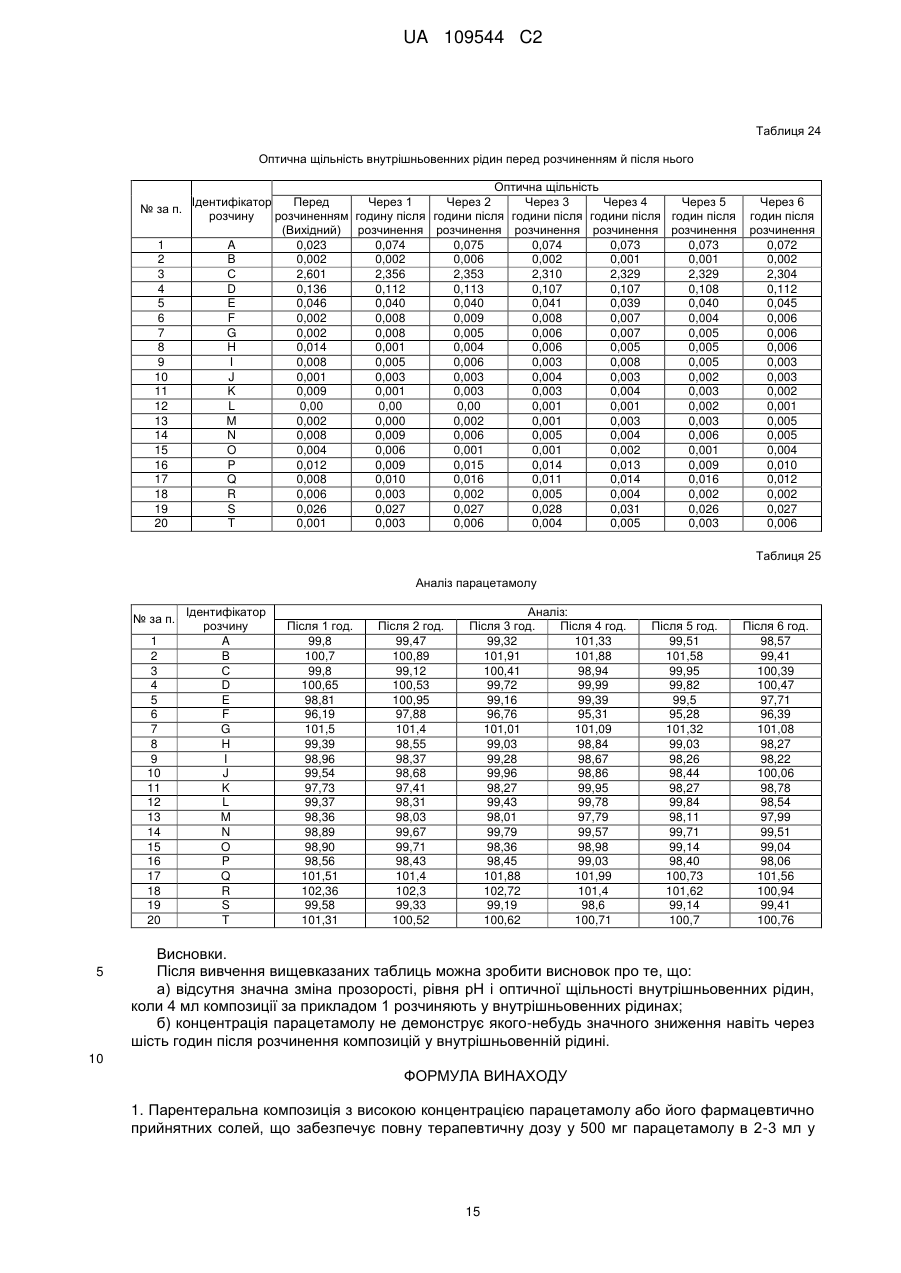
19. Парентеральна композиція за будь-яким з пп. 1-15, яка після розчинення у звичайних внутрішньовенних рідинах, інфузійних розчинах антибактеріальних, протигрибкових і амебоцидних лікарських препаратів і разом з седативними препаратами (ін'єкційним розчином мідазоламу) або наркотичними анальгетиками (ін'єкційним розчином фентанілу цитрату і т. ін.) залишається стійкою, чистою й прозорою протягом принаймні шести годин після розчинення.
20. Парентеральна композиція за будь-яким з пп. 1-15, яка може вводитися внутрішньом'язово, внутрішньовенно або шляхом внутрішньовенної інфузії.
Текст
Реферат: Винахід стосується парентеральної композиції з високою концентрацією парацетамолу або його фармацевтично прийнятних солей, що забезпечує повну терапевтичну дозу у 500 мг парацетамолу в 2-3 мл у водній розчинювальній системі, у якій концентрація парацетамолу або його фармацевтично прийнятних солей становить від 166 до 250 мг/мл, а динамічна в'язкість 7-28 сП при 25 °С, а також способу одержання вказаної композиції. UA 109544 C2 (12) UA 109544 C2 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пов'язана заявка Винахід, описаний в індійській патентній заявці № 630/MUM/2010, поданій 9 вересня 2010 року, є подібним до винаходу, описаного в індійській патентній заявці № 3023/MUM/2009, поданій 30 червня 2010 року, таким чином, що вони складають один винахід. Галузь винаходу Цей винахід стосується парентеральних композицій парацетамолу, що містять терапевтично ефективну дозу парацетамолу, способу їх одержання, включаючи терапевтичне використання зазначених композицій. Опис винаходу Парацетамол (p-ацетіламінофенол) являє собою спільний анальгетичний і жарознижувальний лікарський препарат, який використовується для зняття жару, головних болів і інших незначних болів і неприємних відчуттів. Він є основним інгредієнтом у низці протизастудних і протигрипозних ліків і в багатьох анальгетичних призначеннях. Ці ліки часто використовуються в якості анальгетика й жарознижувального засобу, а також у якості знеболюючого при гострому болі й хронічному болі. Ін'єкції парацетамолу використовуються для лікування гострих гарячкових станів, а також у якості анальгетика для лікування гострого болю, включаючи післяопераційний біль. Фармацевтичні препарати, що містять парацетамол, які призначаються перорально, є загальновідомими. Також добре відомо, що концентровані парентеральні фармацевтичні композиції, що містять парацетамол у розчині, мають деякі переваги перед твердими композиціями, оскільки вони забезпечують швидкий початок фармакологічної дії, на відміну від пероральних композицій, які спочатку повинні розщепитися й розчинитися в шлунковокишковому тракті для того, щоб почалася їхня резорбція. Існують два класи звичайних парентеральних складів з парацетамолом, представлених на ринку. Перший містить 150 мг/мл парацетамолу, представленого в 2 мл розчині. Ця форма дозування забезпечує 300 мг парацетамолу на дозу, яка набагато нижча мінімальної терапевтичної дози в 500 мг. Вони мають високу в'язкість приблизно в 24,80 сП і спричиняють біль при внутрішньом'язовому введенні. Далі, ця форма дозування має додатковий недолік доставляння суб-терапевтичних кількостей. Інша парентеральна формула містить водні розчини парацетамолу з концентрацією в 10 мг/мл, представлені у флаконах 50 мл і 100 мл, що містять відповідно 500 мг і 1000 мг парацетамолу на флакон. Ці форми дозування вводяться тільки шляхом внутрішньовенної інфузії й вочевидь не підходять для внутрішнм'язового введення. Такі форми дозування не підходять для використання в обстановці амбулаторних відділень. Одночасне призначення цих форм дозування з іншими внутрішньовенними рідинами, наприклад, внутрішньовенною інфузією ципрофлоксацину, є незручним. Більше того, виробництво цих форм дозування вимагає додаткової інфраструктури, більшого простору для зберігання й безтарного транспортування, що додається до кінцевої вартості цих продуктів. Таким чином, існує невдоволена потреба в створенні ін'єкційних композицій, що містять парацетамол з високою концентрацією і можуть доставляти терапевтичну дозу (500 мг) в однократній дозі для внутрішньом'язового введення без заподіяння болю пацієнтові. Крім того, існує необхідність у таких формах дозування з високою концентрацією, які можуть бути пристосовані для введення шляхом внутрішньовенної інфузії. Заявка PCT/IN2009/000038 стосується водних стійких фармацевтичних композицій, що містять парацетамол для парентерального введення, причому концентрація парацетамолу в композиції становить 10 мг/1 мл. Ця форма дозування придатна тільки для внутрішньовенної інфузії. В заявці PCT/IB2008/003217 описуються стійкі водні склади, що містять 10 мг/1 мл ацетамінофену, які повинні вводитися винятково шляхом внутрішньовенних інфузій, а також способи їх одержання. Заявка PCT/NL2004/000819 стосується композиції у водному стані для перфузії щонайменше активного інгредієнта, особливо фармакологічного, такого як парацетамол. В заявці PCT/GR2001/000047 описуються стійкі розчини парацетамолу для парентерального застосування, у яких концентрація парацетамолу становить 150 мг/мл. Вони повинні застосовуватися декількома дозами для того, щоб досягти терапевтичного дозування в 500 мг, і отже не є зручними. В заявці PCT/EP1999/005486 описується фармацевтична композиція, яка характеризується тим, що: a) містить i) парацетамол, ii) від 1 до 4 об'ємних частин низькомолекулярного спирту на кожну масову частину парацетамолу і iii) від 1 до 5 об'ємних частин поліетіленгліколю на кожну 1 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 60 масову частину парацетамолу; b) є по суті безводною; і c) утворює прозорий розчин для ін'єкції з 4–10 об'ємними частинами води на кожну масову частину парацетамолу. Описані розчини "є по суті безводними ", що, як описується в зазначеному патенті, розуміється як композиція, що містить менш 0,1 % мас. води. Очікується, що описані розчини мають високу в'язкість. Таким чином, ці розчини необхідно розчиняти водою для того, щоб підготувати розчин для ін'єкції, у якому кожна масова частина парацетамолу має i) від 1 до 4 об'ємних частин низькомолекулярного спирту, ii) від 1 до 5 об'ємних частин поліетіленгліколю і iii) від 4 до 10 об'ємних частин води. У прикладі номер 1 зазначеного патенту описується одержання концентрованого безводного розчину, у якому титр парацетамолу складає приблизно 210 мг на мл. У прикладі 2 описується розчинення цього концентрованого безводного розчину для одержання ін'єкційних розчинів. Відповідно до розрахунків, титр парацетамолу в ін'єкційних розчинах становить приблизно 85,60 мг на мл ін'єкційних розчинів. Заявка PCT/IB2008/003925 стосується стійкого водного розчину парацетамолу, що містить приблизно 10 мг/1 мл, який уводиться винятково за допомогою внутрішньовенної інфузії. Заявка PCT/US2008/083458 стосується композицій, що містять 10 мг/мл парацетамолу для виняткового введення шляхом внутрішньовенної інфузії. Заявка PCT/EP2002/011498 стосується готових до використання високостабільних ін'єкційних розчинів парацетамолу, приготовлених шляхом змішування парацетамолу, води, пропіленгліколю й цитратного буферу, причому концентрація парацетамолу становить до 40 мг/мл для введення винятково шляхом внутрішньовенної інфузії. Заявка PCT/EP2002/002696 стосується водних парентеральних розчинів парацетамолу, які містять від 1 до 17 грамів парацетамолу на літр (тобто від 1 мг на мл до 17 мг на мл), які повинні вводитися винятково шляхом внутрішньовенної інфузії. PCT/EP2000/006871 стосується рідких фармацевтичних композицій, які містять принаймні 10 мг/100 мл парацетамолу в безводному PEG 200. В'язкість в 22 %-ному (мас./об.) розчині парацетамолу, який описаний в прикладі 1, становить 168,4 сП, і, таким чином, він є непридатним для використання як ін'єкційна композиція. В публікації EP2087909 описується готовий до використання ін'єкційний розчин, що має максимальну концентрацію парацетамолу 1 % мас./об. у дистильованій воді й буферній речовині для введення винятково шляхом внутрішньовенної інфузії. В публікації EP0916347 описується ін'єкційний розчин парацетамолу й комбінації парацетамолу з іншими речовинами, такими як гіосцину n-бутилбромід і кодеїну фосфат. Індійська патентна заявка номер 1746/MUM/2008 стосується фармацевтичного складу з парацетамолом, який забезпечує легке введення пацієнтам. У вищевказаному документі заявляється ін'єкційний розчин парацетамолу, що має максимальну концентрацію парацетамолу на рівні 15 % мас./об. з використанням комбінації глікофуролу й води. Однак, ці розчини не забезпечують необхідну терапевтичну дозу в 500 мг у 2–3 мл. Індійська патентна заявка номер 1532/DEL/2008 стосується внутрішньовенного введення парацетамолу, при якому парацетамол розчиняється у воді для ін'єкції в комбінації з пасивними інгредієнтами, такими як буфери, ізотонічні агенти тощо. Однак, вони також не забезпечують необхідну терапевтичну дозу в 500 мг в 2–3 мл. Індійська патентна заявка № 1529/DEL/2008 стосується композицій з парацетамолом і офлоксацином для внутрішньовенного введення з використанням водного носія. Індійська патентна заявка № 1530/DEL/2008 описує композиції парацетамолу й ципрофлоксацину у водному носії для внутрішньовенного введення. Індійська патентна заявка № l531/DEL/2008 описує композицію парацетамолу й диклофенаку натрію у водному носії для внутрішньовенного введення. Індійська патентна заявка № 2708/DEL/2006 стосується водного розчину терапевтично активних речовин; краще парацетамолу, у комплексі з гідроксілпропілбетациклодекстрином (HP-B-CD), інкапсульованих у фізіологічно й фармацевтично прийнятну масловмісну звичайну ліпофільну поверхнево-активну речовину, яка, у свою чергу, розчиняється у водному середовищі, що містить відому гідрофільну поверхнево-активну речовину. Індійська патентна заявка № 3782/DELNP/2005 стосується нового ін'єкційного складу з парацетамолом, який містить водний розчинник, буферну речовину з pKa між 4,5 і 6,5, ізотонічний агент і димер парацетамолу, у якому зазначений димер використовується для стабілізації складу. Індійська патентна заявка № 8070/DELNP/2008 стосується водного розчину парацетамолу для використання шляхом перфузії, який містить принаймні одну речовину, яка може реагувати з фенолатами. 2 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 Парацетамол важко розчиняється у воді и тому в рівні техніки використовувалися різні розчинники, такі як пропіленгліколь, поліетиленгліколь 400, гліцерин формаль, глікофурол, етанол і т.ін., оскільки парацетамол демонструє більш високий рівень розчинності в цих розчинниках у порівнянні з водою. Однак, відсутні аналоги, що описують ін'єкційні композиції парацетамолу з 500 мг парацетамолу в однократній дозі об'ємом приблизно 2 або 3 мл. У єдиному аналогу, а саме в IN1746/MUM/2008, повідомлялося про використання 44 % мас./об. глікофуролу в комбінації з 10 % мас./об. спирту (назва спирту не розкривалася) разом з водою для розчинення 150 мг/мл парацетамолу. У цьому ж аналогу повідомляється про використання 48 % мас./об. глікофуролу в поєднанні з водою для розчинення максимум 150 мг/мл парацетамолу. Завданням фармацевтичної галузі є забезпечення ін'єкційних розчинів, які містять більше, ніж 150 мг/мл парацетамолу, до приблизно 250 мг/мл, таким чином, щоб терапевтична доза в 500 мг/мл могла бути введена у вигляді ін'єкції 2–3 мл розчину. Крім того, незважаючи на такі високі концентрації, ін'єкційні розчини повинні мати в'язкість, що не перевищує 28 сП. До сьогоднішнього дня цього досягти не вдавалося. Короткий опис винаходу Головною метою цього винаходу є створення парентеральних композицій з високою концентрацією парацетамолу, що доставляють повну терапевтичну дозу парацетамолу, способів їх одержання й використання. Ще однієї метою цього винаходу є створення парентеральних композицій з високою концентрацією парацетамолу, що доставляють терапевтичну дозу в 500 мг парацетамолу в 2–3 мл. Іншою метою цього винаходу є створення парентеральних композицій з парацетамолом, що містять парацетамол у кількості приблизно від 166 мг до 250 мг на мл. Крім того, ще однієї метою цього винаходу є одержання парентеральних композицій, що містять парацетамол у кількості від 166 до 250 мг на мл у розчинювальній системі, що містить глікофурол, етанол і воду. Крім того, ще однієї метою винахід є одержання парентеральних композицій, що містять парацетамол у кількості від 166 до 250 мг на мл у розчинювальній системі, що містить глікофурол, етанол, поліетиленгліколь і воду. Ще однієї метою цього винахід є одержання парентеральной фармацевтичної формули з парацетамолу або його фармацевтично прийнятної солі, яка має в'язкість менш 28 сП, що придатна для внутрішнм'язового й внутрішньовенного введення. Вищенаведені й інші цілі цього винаходу досягаються у відповідності з наступними кращими варіантами втілення цього винаходу. Однак, обсяг винаходу не обмежується конкретними втіленнями, які обговорюються нижче. В одному з варіантів втілення цього винаходу створені парентеральні фармацевтичні склади з парацетамолом або його фармацевтично прийнятними солями, у яких концентрація активного інгредієнта в розчинювальній системі становить >150 мг/мл, причому зазначений склад має в'язкість 150 мг/мл в розчинювальній системі з в'язкістю від 7 до 28 сП, краще від 7 до 22 сП. Далі, у способі одержання парентеральних композицій з парацетамолом або його фармацевтично прийнятними солями, які мають концентрацію активного інгредієнта в діапазоні приблизно від 166 до 250 мг/мл: а) розчинюють необхідні кількості парацетамолу або його фармацевтично прийнятної солі в розчинювальній системі в інертному середовищі; б) за бажанням, додають антиоксидант, хелатостворюючий агент, бензиловий спирт, в) за бажанням, коректують pH у межах від 4 до 8; г) коректують об'єм розчину до заданої величини; д) фільтрують розчин через 0,22-мікронне фільтраційне середовище; е) заповнюють розчином ампули/флакони в інертному середовищі; є) за бажанням, обробляють ампули/флакони в автоклаві. Детальний опис винаходу Цей винахід створює парентеральні композиції з високою концентрацією парацетамолу або його фармацевтично прийнятної солі, які містять терапевтичну дозу парацетамолу у невеликому об'ємі ін'єкційних розчинів, які можуть уводитися як внутрішньом'язовим, так і внутрішньовенним методами. 3 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нами була визначена розчинність парацетамолу в різних розчинниках, таких як глікофурол, поліетиленгліколь, етанол і пропіленгліколь. Розчинність парацетамолу в глікофуролі, поліетиленгліколі 400, етанолі, пропіленгліколі й воді становить, відповідно, приблизно 205 мг/мл, 190 мг/мл, 160 мг/мл, 113 мг/мл і 14 мг/мл. Крім того, в'язкість розчину парацетамолу в глікофуролі при концентрації в 205 мг/мл становить приблизно 57 сП, що є неприйнятним для використання в якості ін'єкційних композицій. Як вказувалося в попередніх розділах, рівень техніки не зміг забезпечити ін'єкційні композиції з високою концентрацією парацетамолу (500 мг у розчинах об'ємом 2 або 3 мл) у будь-яких розчинювальних системах. Завдання полягає в тому, щоб приготувати належну розчинювальну систему, щоб створити ін'єкційні композиції, що містять парацетамол у кількості від 166 мг/мл до 250 мг/мл, таким чином, щоб терапевтична доза парацетамолу (500 мг) могла вводитися в 2–3 мл без погіршення в'язкості таких ін'єкційних композицій. Ми несподівано виявили, що розчини парацетамолу з досить високою концентрацією можуть бути приготовлені без значного збільшення в'язкості за допомогою розумно підібраної комбінації розчинників для створення розчинювальних систем із глікофуролу, етанолу й води або розчинювальних систем із глікофуролу, етанолу, поліетіленгліколю й води. Висока концентрація парацетамолу, досягнута в таких композиціях, значно перевищує ті, які раніше отримані в рівні техніки або в ін'єкційних розчинах парацетамолу серійного виробництва. Концентрація парацетамолу, якої вдалося досягти в композиції за цим винаходом, знаходиться в діапазоні приблизно від 166 мг/мл до 250 мг/мл, тим самим забезпечуючи повну терапевтичну дозу парацетамолу як ін'єкційного розчину, який містить 500 мг в 2–3 мл і 1 г в 4 мл або 6 мл відповідно. Композиції цього винаходу можуть уводитися внутрішньом'язово, внутрішньовенно або як внутрішньовенна інфузія після розчинення в одній із зазвичай використовуваних рідин для внутрішньовенного введення (ін'єкційний розчин глюкози 5 % мас./об., ін'єкційний розчин натрію хлориду 0,9 % мас./об., педіатричний підтримуючий розчин з глюкозою 5 % мас./об., ін'єкційний розчин натрію хлориду 0,9 % мас./об. і глюкози 5 % мас./об., ін'єкційний розчин натрію хлориду 0,45 % мас./об., ін'єкційний розчин декількох електролітів і глюкози 10 % мас./об. Тип-3, ін'єкційний розчин сполуки лактату натрію, ін'єкційний розчин глюкози 10 % мас./об., ін'єкційний розчин декількох електролітів і глюкози 10 % мас./об. Тип-IV, ін'єкційний розчин декількох електролітів і глюкози 10 % мас./об. Тип-V, лактат Рінгера і т.д.), а також після розчинення в інфузійних розчинах антибактеріальних, протигрибкових і амебоцидних лікарських препаратів, таких як ципрофлоксацин, офлоксацин, левофлоксацин, празуфлоксацин, гатіфлоксацин, моксіфлоксацин, метронідазол, флюконазол, лінезолід і т.д. Композиції цього винаходу також можуть уводитися спільно як внутрішньовенні інфузії після розчинення необхідної дози у зазвичай застосовуваних внутрішньовенних рідинах разом з седативними препаратами (наприклад, ін'єкційним розчином мідазоламу) або наркотичними анальгетиками (наприклад, ін'єкційним розчином фентанілу цитрату). Композиції за цим винаходом можуть бути представлені в ампулах/флаконах, що містять приблизно від 2 мл до приблизно 3 мл ін'єкційних розчинів або мульти-дозових флаконах, які містять ін'єкційні розчини, що забезпечують декілька однократних доз парацетамолу, які доставляють 500 мг парацетамолу. За бажанням, в композиції вводять належний консервант. Композиції за цим винаходом можуть доставлятися в ампулах/флаконах з однократною дозою, що містить від 500 мг до 2 г парацетамолу для внутрішньовенного введення. Відповідно, для внутрішньовенного введення 4 або 8 мл ін'єкційного розчину з вмістом 250 мг/мл парацетамолу, будуть забезпечувати дозу в 1 грам або 2 грами парацетамолу, відповідно. Подібним чином 6 або 12 мл ін'єкційного розчину з вмістом приблизно 166 мг/мл парацетамолу, описаного в цьому документі, будуть забезпечувати дозу в 1 грам або 2 грама парацетамолу відповідно. Далі, кількість парацетамолу, яке забезпечується ін'єкційними розчинами приблизно в 166 мг/мл, становить приблизно 1 г/6 мл, приблизно 1,5 г/9 мл, приблизно 2 г/12 мл. Точно так само, кількість парацетамолу, яке забезпечується ін'єкційними розчинами з вмістом 250 мг/мл, становить приблизно 1 г/4 мл, приблизно 1,5 г/6 мл, приблизно 2 г/8 мл. Обрані фармацевтичні композиції, описані в цьому документі, можуть уводитися внутрішньом'язово в сідничний, дельтоподібний або внутрішньо-стегновий м'язи з використанням голки 22 або 23 розміру. У одному варіанті втіленні парентеральні композиції за цим винаходом містять парацетамол або його фармацевтично прийнятні солі в концентрації в діапазоні від 166 до 250 мг/мл, розчинені в глікофуролі, етанолі й воді. 4 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті втілення парентеральні композиції за цим винаходом містять парацетамол або його фармацевтично прийнятні солі в концентрації в діапазоні від 166 до 250 мг/мл, розчинені в глікофуролі, поліетиленгліколі, етанолі й воді. Поліетиленгліколь вибирається з поліетіленгліколю 400/600. Відповідно до іншого втілення цього винаходу до композиції, за бажанням, вводять придатний антиоксидант або суміші таких речовин. Придатні антиоксиданти вибираються з тіогліцерину, аскорбінової кислоти, аскорбату натрію, ізоаскорбінової кислоти, метабісульфіту калію, метабісульфіту натрію, пропіонової кислоти, формальдегідсульфоксілату натрію, редукованого глутатіону, тіосечовини, цистеїну, Nацетілцистеїну, метіоніну, сірчанокислого натрію, цитрату натрію і т.д. У ще одному втіленні цього винаходу до композиції, за бажанням, вводять хелатостворюючий агент або суміш таких агентів. Придатні хелатостворюючі агенти, які використовуються тут, включають тринатрію едетат, динатрію едетат, натрію едетат, динатрію кальцію едетат, фумарову кислоту, яблучну кислоту. Ін'єкційні розчини за цим винаходом забезпечують стійкість парацетамолу під час його строку зберігання. Більш того, ін'єкційні композиції, які виготовляються згідно з цим винаходом, являють собою чисті прозорі розчини, і при розчиненні в одній із зазвичай використовуваних рідин для внутрішньовенного введення розчини залишаються чистими й прозорими протягом принаймні шести годин після розчинення, що робить їх безпечними для внутрішньовенного введення. Більш того, композиції за цим винаходом сумісні з інфузійними розчинами антибактеріальних, протигрибкових і амебоцидних лікарських препаратів, таких як, ципрофлоксацин, офлоксацин, левофлоксацин, празуфлоксацин, гатіфлоксацин, моксіфлоксацин, метронідазол, флюконазол, лінезолід і т.д., і такі інфузійні розчини залишаються стійкими, чистими й прозорими протягом принаймні шести годин після розчинення. Більш того, композиції за цим винаходом утворюють чисті прозорі розчини при розчиненні у зазвичай застосовуваних внутрішньовенних рідинах разом з седативними препаратами (ін'єкційним розчином мідазоламу) або наркотичними анальгетиками (ін'єкційним розчином фентанілу цитрату і т.д.) і залишаються стійкими, чистими й прозорими протягом принаймні шести годин після розчинення. Як зазначено в розділі щодо рівня техніки, серійно вироблені ін'єкційні розчини парацетамолу 150 мг/мл демонструють в'язкість приблизно в 25 сП при 25 °C. Єдиний аналог, у якому розчин містив парацетамол у концентрації в діапазоні від 60 мг/мл (6 % мас./об.) до 150 мг/мл (15 % мас./об.), був приготовлений у суміші глікофурол:етанол:вода (в співвідношенні приблизно 44:10:46 або приблизно 4:1:4) або у суміші глікофурол:вода (при співвідношенні 48:52 або приблизно 1:1). В'язкість прикладів, які описуються в аналогу, не була зазначена в описі патенту, і, тому, вони були приготовлені в нашій лабораторії, і в'язкість згідно з прикладами 1 і 2 становила 13,5 сП і 14,8 сП, відповідно. Необхідно відзначити, що концентрація у розчинах, наведена в зазначеному аналогу, становить від 60 мг/мл до 150 мг/мл. Як це ні дивно, але композиції цього винаходу, у яких концентрація парацетамолу становить від 166 до 250 мг на мл, тобто приблизно від 16,6 % до 25 % мас./об. (що значно перевищує будь-яку ін'єкційну композицію у рівні техніки й продукцію серійного виробництва), мають в'язкість в діапазоні від 7 до 28 сП при 25 °C. Далі, необхідно відзначити, що належним чином обрана розчинювальна система в даному винаході забезпечує істотне зниження в'язкості, незважаючи на значно більш високу концентрацію парацетамолу в композиціях за цим винаходом, в порівнянні з в'язкістю розчинів з низькою концентрацією, про які повідомлялося в аналогах. У кращому втіленні композиції за цим винаходом, що мають концентрацію парацетамолу приблизно 250 мг/мл, дають можливість уводити повну терапевтичну дозу в 500 мг парацетамолу в 2 мл ін'єкційного розчину більш низької в'язкості (приблизно 16 сП) у порівнянні з в'язкістю серійно вироблених ін'єкційних розчинів парацетамолу з концентрацією 150 мг/мл, а також композицій, що описуються в рівні техніки. В іншому кращому втіленні композиції за цим винаходом, що мають концентрацію парацетамолу приблизно 166,66 мг/мл, дають можливість уводити повну терапевтичну дозу в 500 мг парацетамолу в 3 мл ін'єкційних розчинів набагато більш низької в'язкості (7,45 сП) у порівнянні із серійно виробленими ін'єкціями парацетамолу 150 мг/мл, а також композиціями, що описані в рівні техніки. Рівень pH композицій знаходиться в діапазоні приблизно від pH 4 до pH 8, краще pH 5 до pH 7, і ще краще від pH 5,5 до pH 7. Відповідно до винаходу, рівень pH композиції за бажанням 5 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 60 корегується до вищевказаних значень за допомогою придатних кислоти/лугу. За бажанням, рівень pH регулюють шляхом додавання буферних композицій для одержання pH у діапазоні від pH 4 до pH 8, краще від pH 5 до pH 7, і ще краще від pH 5,5 до pH 7. Кислоту/луг вибирають із хлористоводневої кислоти, сірчаної кислоти, оцтової кислоти, лимонної кислоти, гідрооксиду натрію, гідрооксиду калію, бікарбонату натрію, бікарбонату калію і т.д. Належні буфери для композицій включають лимоннокислий буфер, фосфатний буфер і таке інше. В одному втіленні композиція цього винаходу містить приблизно від 166 до 200 мг на мл у розчинювальній системі, що включає 25–40 % об. глікофуролу, 20–37 % об. етанолу й воду (у достатній кількості). В іншому втіленні композиція цього винаходу містить приблизно від 200 до 250 мг на мл у розчинювальній системі, що включає 25–40 % об. глікофуролу, 23–35 % об. етанолу й воду (у достатній кількості). У ще одному втіленні композиція цього винаходу містить приблизно від 166 до 200 мг на мл у розчинювальній системі, що включає 25–42 % об. глікофуролу, 10–35 % об. етанолу, 3–19 % об. поліетиленгліколю і воду (у достатній кількості). У ще одному втіленні композиція цього винаходу містить приблизно від 200 до 250 мг на мл у розчинювальній системі, що включає 30–40 % об. глікофуролу, 24–35 % об. етанолу, 3–6 % об. поліетиленгліколю і воду (у достатній кількості). За бажанням в композицію вводять від 2 до 6 % об. бензилового спирту. За бажанням в композицію вводять антиоксиданти й хелатостворюючі агенти. За бажанням в композицію можуть бути введені буфер, кислота / луг. Розчинювальна система, що включає глікофурол, етанол і воду для композиції, яка містить приблизно від 166 мг/мл до 250 мг/мл, має співвідношення глікофурол:етанол:вода від приблизно 2,8:2,0:5,1 (приклад № 7) до приблизно 1:1:1 (приклади 12 і 19). Це різко відрізняється від співвідношення глікофуролу й етанолу, про яке повідомляється в IN1746/MUM/2008, у розмірі 10:1 або розчинювальної системи, що містить тільки глікофурол і воду. В'язкість композицій за цим винаходом, що мають концентрацію парацетамолу в діапазоні приблизно від 166 мг/мл до 200 мг/мл, приготовлених з використанням розчинювальної системи, яка містить глікофурол, етанол і воду, знаходиться в діапазоні приблизно від 7 до приблизно 16 сП. В'язкість композицій за цим винаходом, що мають концентрацію парацетамолу в діапазоні приблизно від 200 мг/мл до 250 мг/мл, приготовлених з використанням розчинювальної системи, яка містить глікофурол, етанол і воду, знаходиться в діапазоні приблизно від 16 до приблизно 28 сП. В'язкість композицій за цим винаходом, що мають концентрацію парацетамолу в діапазоні приблизно від 166 мг/мл до 200 мг/мл, приготовлених з використанням розчинювальної системи, яка містить глікофурол, етанол, пропіленгліколь і воду, знаходиться в діапазоні приблизно від 9 до приблизно 14 сП. В'язкість композицій за цим винаходом, що мають концентрацію парацетамолу в діапазоні приблизно від 200 мг/мл до 250 мг/мл, приготовлених з використанням розчинювальної системи, яка містить глікофурол, етанол, пропіленгліколь і воду, знаходиться в діапазоні приблизно від 14 до приблизно 28 сП. У способі одержання парентеральних композицій з парацетамолу або його фармацевтично прийнятних солей, які мають концентрацію активного інгредієнта в діапазоні приблизно від 166 до 250 мг/мл: а) розчинюють необхідні кількості парацетамолу або його фармацевтично прийнятної солі в розчинювальній системі в інертному середовищі; б) за бажанням, додають антиоксидант, хелатостворюючий агент, бензиловий спирт, в) за бажанням, корегують pH у межах від 4 до 8; г) корегують об'єм розчину до заданої величини; д) фільтрують розчин через 0,22-мікронне фільтраційне середовище; е) заповнюють розчином ампули/флакони в інертному середовищі; є) за бажанням, обробляють ампули/флаконів в автоклаві. Глікофурол додають до необхідної кількості етанолу й частини води для ін'єкції з перемішуванням під потоком інертного газу. До вищевказаного розчину, за бажанням, додають необхідну кількість бензилового спирту та/або поліетіленгліколю 400/600, після чого додають необхідну кількість парацетамолу, поки він повністю не розчиниться. До вищевказаного розчину 6 UA 109544 C2 5 10 15 20 25 додають необхідну кількість антиоксиданту. Далі додають необхідну кількість придатного хелатостворюючого агента й буфера, а також додають воду для ін'єкції, щоб досягти необхідного об'єму. Якщо рівень pH розчину не знаходиться в бажаному діапазоні, то додають придатні кислоту/луг, щоб відкоригувати рівень pH у межах від 4 до 8. Для підтримання рівня pH розчину в межах від 4 до 8 використовують, за бажанням, придатний буфер. Розчин фільтрують через 0,2-мікронний фільтр, і їм заповнюють контейнери для однократної дози або багатократної дози належного об'єму під потоком інертного газу. За бажанням, ін'єкційний розчин стерилізують шляхом автоклавного обробляння, й після цього їм заповнюють контейнери для однократної дози або багатократної дози належного об'єму. В одному із втілень антиоксидант, при його використанні, може додаватися на початку процесу в розчин глікофуролу, етанолу й частини ін'єкційного розчину. В іншому втіленні розчинювальну систем із глікофуролу, етанолу, поліетіленгліколю й частини води для ін'єкції готують при постійному перемішуванні під потоком інертного газу, а поліетиленгліколь не додають ні на будь-якому іншому етапі процесу. У ще одному втіленні готують розчинювальну систему розчину із глікофуролу, етанолу, поліетіленгліколю й частини води для ін'єкції, у якій антиоксидант розчиняють у водній частині ін'єкційного розчину. Послідовність додавання інгредієнтів не обмежується втіленнями, описаними вище, а спеціаліст у цій галузі може досягти різної комбінації композицій, описаних у цьому документі. Наступні приклади, що не мають обмежувального характеру, детально демонструють цей винахід. Однак, вони жодним чином не призначені для обмеження обсягу цього винаходу. Приклади Композиції за цим винаходом готують відповідно до процедури, наведеної вище, і, отже не наданої тут, щоб уникнути повторення. Приклад 1 Таблиця 1 Композиція ін'єкційного розчину парацетамолу № за п. 1 2 3 4 5 6 7 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Розчин 1N NaOH Вода для ін'єкції Кількість 250 мг 0,324 мл 0,050 мл 0,300 мл 7,50 мг достатня для корегування pH приблизно до 6,5 до 1 мл В'язкість ін'єкційного розчину становить 18,59 сП, а pH кінцевого розчину корегується до 6,5. Приклад 2 30 Таблиця 2 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 7 8. Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Натрію моногідрофосфат Лимонна кислота (5 г/100мл) Вода для ін'єкції Кількість 250 мг 0,324 мл 0,050 мл 0,300 мл 7,50 мг 0,50 мг достатня для корегування pH приблизно до 6,2 до 1 мл В'язкість ін'єкційного розчину становить 23,42 сП, а pH кінцевого розчину корегується до 6,25. Приклад 3 35 7 UA 109544 C2 Таблиця 3 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 7 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Розчин 1 N NaОН Вода для ін'єкції Кількість 200 мг 0,312 мл 0,040 мл 0,240 мл 7,50 мг достатня для корегування pH приблизно до 6,2 до 1 мл В'язкість ін'єкційного розчину становить 14,44 сП, а pH кінцевого розчину корегується до 6,20. Приклад 4 5 Таблиця 4 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 7 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Розчин 1 N NaOH Вода для ін'єкції Кількість 220 мг 0,316 мл 0,044 мл 0,264 мл 7,50 мг достатня для корегування pH приблизно до 6,2 до 1 мл В'язкість ін'єкційного розчину становить 18,76 сП, а pH кінцевого розчину корегується до 6,29. Приклад 5 10 Таблиця 5 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 7 8 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Натрій-сульфат Бензиловий спирт Розчин 1 N NaOH Вода для ін'єкції Кількість 166,66 мг 0,280 мл 0,033 мл 0,200 мл 1,5 мг 0,02 мл достатня для корегування рівня pH приблизно до 6 до 1 мл В'язкість ін'єкційного розчину становить 9,02 сП, а pH кінцевого розчину становить 5,82. Приклад 6 8 UA 109544 C2 Таблиця 6 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 7 8 5 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Піросірчастокислий натрій Бензиловий спирт Розчин 1 N NaOH Вода для ін'єкції Кількість 166,66 мг 0,280 мл 0,033 мл 0,200 мл 1,00 мг 0,04 мл достатня для корегування рівня pH приблизно до 6,3 до 1 мл В'язкість ін'єкційного розчину становить 10,03 сП, а pH кінцевого розчину корегується до 6,31. Приклад 7 Таблиця 7 Композиція ін'єкційного розчину парацетамолу: № за п. 1 2 3 4 5 6 10 Інгредієнти Парацетамол Глікофурол Етанол Піросірчастокислий натрій Бензиловий спирт Вода для ін'єкції Кількість 166,66 мг 0,279 мл 0,200 мл 1 мг 0,02 мл до 1 мл В'язкість ін'єкційного розчину становить 7,45 сП, а pH кінцевого розчину становить 5,25. Приклад 8 Композиція ін'єкційного розчину парацетамолу: Таблиця 8 № за п. I 2 3 4 5 6 7 15 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Дінатрія едетат Вода для ін'єкції Кількість 200 мг 0,312 мл 0,040 мл 0,240 мл 7,50 мг 0,50 мг до 1 мл В'язкість ін'єкційного розчину становить 12,55 сП, а pH кінцевого розчину корегується до 6,20. Приклад 9 Композиція ін'єкційного розчину парацетамолу: Таблиця 9 № за п. 1 2 3 4 5 Інгредієнти Парацетамол Глікофурол Етанол Тіогліцерин Вода для ін'єкції Кількість 200 мг 0,300 мл 0,240 мл 7,50 мг до 1 мл 9 UA 109544 C2 В'язкість ін'єкційного розчину становить 13,40 сП, а pH кінцевого розчину становить 5,20. Приклад 10 Композиція ін'єкційного розчину парацетамолу: 5 Таблиця 10 № за п. 1 2 3 4 5 Інгредієнти Парацетамол Глікофурол Етанол Піросірчастокислий натрій Вода для ін'єкції Кількість 200 мг 0,320 мл 0,230 мл 1,0 мг до 1 мл В'язкість ін'єкційного розчину становить 13,90 сП, а pH кінцевого розчину становить 5,40. Приклад 11 Композиція ін'єкційного розчину парацетамолу: 10 Таблиця 11 № за п. 1 2 3 4 5 6 15 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Вода для ін'єкції Кількість 250 мг 0,360 мл 0,060 мл 0,300 мл 7,50 мг до 1 мл В'язкість ін'єкційного розчину становить 26,11 сП, а pH кінцевого розчину корегується до 6,67. Приклад 12 Композиція ін'єкційного розчину парацетамолу: Таблиця 12 № за п. I 2 3 4 5 20 Інгредієнти Парацетамол Глікофурол Етанол Аскорбінова кислота Вода для ін'єкції Кількість 166,66 мг 0,32 мл 0,37 мл 4,0 мг до 1 мл В'язкість ін'єкційного розчину становить 10,79 сП, а pH кінцевого розчину становить 5,79. Приклад 13 Композиція ін'єкційного розчину парацетамолу: Таблиця 13 № за п. 1 2 3 4 5 6 25 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Аскорбінова кислота Вода для ін'єкції Кількість 250 мг 0,316 мл 0,050 мл 0,300 мл 4,0 мг до 1 мл В'язкість ін'єкційного розчину становить 16,02 сП, а pH кінцевого розчину становить 6,54. Приклад 14 Композиція ін'єкційного розчину парацетамолу: 10 UA 109544 C2 Таблиця 14 № за п. 1 2 3 4 5 6 7 5 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Тіогліцерин Бензиловий спирт Вода для ін'єкції Кількість 166,66 мг 0,420 мл 0,034 мл 0,201 мл 7,5 мг 0,020 мл до 1 мл В'язкість ін'єкційного розчину становить 20,62 сП, а pH кінцевого розчину становить 6,30. Приклад 15 Композиція ін'єкційного розчину парацетамолу: Таблиця 15 № за п. 1 2 3 4 5 6 7 10 Інгредієнти Парацетамол Глікофурол Поліетиленгліколь 400 Етанол Бензиловий спирт Тіогліцерин Вода для ін'єкції Кількість 166,6 мг 0,251 мл 0,188 мл 0,201 мл 0,02 мл 7,5 мг до 1 мл В'язкість ін'єкційного розчину становить 21,55 сП, а pH кінцевого розчину становить 6,56. Приклад 16 Композиція ін'єкційного розчину парацетамолу: Таблиця 16 № за п. 1 2 3 4 5 6 7 15 Інгредієнти Парацетамол Глікофурол Етанол Тіогліцерин Бензиловий спирт Поліетиленгліколь 400 Вода для ін'єкції Кількість 166,66 мг 0,403 мл 0,10 мл 7,5 мг 0,02 мл 0,034 мл до 1 мл В'язкість ін'єкційного розчину становить 14,34 сП, а pH кінцевого розчину становить 5,84. Приклад 17 Композиція ін'єкційного розчину парацетамолу: Таблиця 17 № за п. 1 2 3 4 5 6 7 Інгредієнти Парацетамол Глікофурол Етанол Тіогліцерин Бензиловий спирт Поліетиленгліколь 400 Вода для ін'єкції Кількість 166,66 мг 0,422 мл 0,201 мл 7,5 мг 0,10 мл 0,034 мл до 1 мл В'язкість ін'єкційного розчину становить 19,12 сП, а pH кінцевого розчину становить 6,86. Приклад 18 11 UA 109544 C2 Композиція ін'єкційного розчину парацетамолу: Таблиця 18 № за п. 1 2 3 4 5 6 7 5 Інгредієнти Парацетамол Глікофурол Етанол Тіогліцерин Бензиловий спирт Поліетиленгліколь 400 Вода для ін'єкції Кількість 250 мг 0,35 мл 0,30 мл 7,5 мг 0,02 мл 0,05 мл до 1 мл В'язкість ін'єкційного розчину становить 20,92 сП, а pH кінцевого розчину становить 6,79. Приклад 19 Композиція ін'єкційного розчину парацетамолу: Таблиця 19 № за п. 1 2 3 4 5 10 Інгредієнти Парацетамол Глікофурол Етанол Піросірчастокислий натрій Вода для ін'єкції Кількість 250 мг 0,38 мл 0,30 мл 2 мг до 1 мл В'язкість ін'єкційного розчину становить 18,70 сП, а pH кінцевого розчину становить 5,07. Приклад 20 Композиція ін'єкційного розчину парацетамолу: Таблиця 20 № за п. 1 2 3 4 5 15 20 25 Інгредієнти Парацетамол Глікофурол Етанол Піросірчастокислий натрій Вода для ін'єкції Кількість 250 мг 0,375 мл 0,30 мл 2,0 мг до 1 мл В'язкість ін'єкційного розчину становить 18,80 сП, а pH кінцевого розчину становить 6,13. Приклад 21 Склад у Прикладі 1, який описаний вище, був розчинений у внутрішньовенних рідинах, що зазвичай використовуються, і інфузійних розчинах антибактеріальних, протигрибкових і амебоцидних лікарських препаратах, які перелічені в таблиці 21 нижче. Внутрішньовенні рідини, що містять розчинену композицію, були оцінені для того, щоб визначити їхню стійкість для внутрішньовенних інфузій. Були оцінені й проаналізовані наступні параметри кожної їх внутрішньовенних рідин перед розчиненням і після нього з інтервалом у шістдесят хвилин, останній аналіз проводився по закінченню шостої години: (i) Чистота внутрішньовенних рідин (див. результати в таблиці 22) (ii) Рівень pH внутрішньовенних рідин (див. результати в таблиці 23) (iii) Оптична щільність внутрішньовенних рідин (див. результати в таблиці 24) Потім кожна із внутрішньовенних рідин, у якій було розчинено 4 мл композиції (1 грам парацетамолу), була оцінена на предмет вмісту парацетамолу, негайно після цього, з інтервалом у шістдесят хвилин протягом шести годин (результати див. в таблиці 25) 30 12 UA 109544 C2 Таблиця 21 Перелік зазвичай використовуваних внутрішньовенних рідин і інфузійних розчинів антибактеріальних, протигрибкових і амебоцидних лікарських препаратів, у яких була розчинена композиція за прикладом 1. Кожній з внутрішньовенних рідин був призначений буквений код для кожної документації. № за Код № п. Найменуван-ня бренду 1 A TROGYL 100ML 2 3 4 B С D SYSCAN 100ML MOXIF IV 100ML O-WINIV 100ML 5 E GATIQUIN 200ML Розчин, у якому був розчинений ін'єкційний розчин парацетамолу 1г/4мл. МЕТРОНІДАЗОЛ ІН'ЄКЦ. ІНТРАПЕРИТ. 0,5 % МАС./ОБ. ФЛЮКОНАЗОН ІН'ЄКЦ. USP 2 МГ/МЛ МОКСІФЛОКСАЦИН ІН'ЄКЦ. 4МГ/МЛ ОФЛОКСАЦИН ІН'ЄКЦ. 2МГ/МЛ ГАТІФЛОКСАЦИН ІНФ. ІНТРАПЕРИТ. 2МГ/МЛ ДЕКСТРОЗА ІН'ЄКЦ. ІНТРАПЕРИТ. 5 % МАС./ОБ. № партії 12700190 F461 0004-A F6759001-A 9LA34 ZC9146 DEXTROSE INJ 907 005 250ML SODIUM ХЛОРИД НАТРІЮ ІН'ЄКЦ. 0,9 % МАС./ОБ. 801093 CHLORIDE 250ML ПЕДІАТРИЧНИЙ ПІДТРИМУЮЧИЙ DENILYTE 'P РОЗЧИН 5 % ДЕКСТРОЗИ (ДЕКІЛЬКА 906048 250ML ЕЛЕКТРОЛІТІВ І ДЕКСТРОЗА ІН'ЄКЦ. ТИП1 ІНТРАПЕРИТ.) 6 F 7 G 8 H 9 I NS 10 J DNS 11 K 12 L 13 M 14 N 15 O 16 P 17 Q 18 R 19 S 20 T ХЛОРИД НАТРІЮ ІН'ЄКЦ. 0,9 % МАС./ОБ. ХЛОРИД НАТРІЮ ІН'ЄКЦ. 0,9 % МАС./ОБ. і ДЕКСТРОЗА 5 % ДЕКІЛЬКА ЕЛЕКТРОЛІТІВ І ДЕКСТРОЗА NIRLYTE-P ІН'ЄКЦ. ТИП-1 ІНТРАПЕРИТ. Sodium Chloride ХЛОРИД НАТРІЮ ІН'ЄКЦ. 0,45 % МАС./ОБ. Injection 500 Ml ІНТРАПЕРИТ. ДЕКСТРОЗА ІН'ЄКЦ. ІНТРАПЕРИТ. 5 % 5D МАС./ОБ. ДЕКІЛЬКА ЕЛЕКТРОЛІТІВ І ДЕКСТРОЗА B.BRAUN ІН'ЄКЦ. ТИП-3 ІНТРАПЕРИТ. СПОЛУКА ЛАКТАТ НАТРІЮ ІН'ЄКЦ. RL ІНТРАПЕРИТ. ДЕКСТРОЗА ІН'ЄКЦ. ІНТРАПЕРИТ. 10 % 10D МАС./ОБ. ЦИПРОФЛОКСАЦИН ІН'ЄКЦ ІНТРАПЕРИТ. CIPLOX 2МГ/МЛ DENILYTE 'G' 500 ДЕКІЛЬКА ЕЛЕКТРОЛІТІВ І ДЕКСТРОЗА ML ІН'ЄКЦ. ТИП-IV ІНТРАПЕРИТ. DENILYTE 'E' 500 ДЕКІЛЬКА ЕЛЕКТРОЛІТІВ І ДЕКСТРОЗА ML Compound ІН'ЄКЦ. ТИП-V ІНТРАПЕРИТ. Sodium Lactate Inj СПОЛУКА ЛАКТАТА НАТРІЮ ІН'ЄКЦ. IP 250 ml ІНТРАПЕРИТ. 13 30600571 31701197 302622699 Дата Придатний до виготовлення Трав. 2010 Квіт. 2015 р. р. Квіт. 2010 р. Бер. 2012 р. Лют. 2009 р. Січ. 2011 р. Січ. 2009 р. Лют. 2011 р. Серп. 2009 Лип. 2011 р. р. Лип. 2009 р. Черв. 2012 р. Січ. 2008 р. Груд. 2010 р. Січ. 2009 р. Трав. 2012 р. Трав. 2010 р. Черв. 2010 р. Трав. 2010 р. Лют. 2015 р. Трав. 2013 р. Квіт. 2013 р. 1007 987 Лип. 2010 р. Черв. 2013 р. A18592 Вер. 2008 р. Серп. 2013 р. AJ8617 AL7791 811069 Жовт. 2008 р. Груд. 2007 р. Лист. 2008 р. Вер. 2013 р. Лист. 2012 р. Жовт. 2011 р. XR9017 Лип. 2009 р. Черв. 2012 р. 1003 340 Бер. 2010 р. Лют. 2013 р. 909 015 Жовт. 2010 р. 902 010 Лют. 2009 р. Січ. 2012 р. Серп. 2012 р. UA 109544 C2 Таблиця 22 Чистота внутрішньовенних рідин перед розчиненням і після нього Чистота розчину № за Ідентифікатор Перед Через 1 Через 2 Через 3 Через 4 Через 5 годин Через 6 годин п. розчину розчиненням годину після години після години після години після після після (Вихідний) розчинення розчинення розчинення розчинення розчинення розчинення 1 A Чистий Чистий Чистий Чистий Чистий Чистий Чистий 2 B Чистий Чистий Чистий Чистий Чистий Чистий Чистий 3 С Чистий Чистий Чистий Чистий Чистий Чистий Чистий 4 D Чистий Чистий Чистий Чистий Чистий Чистий Чистий 5 E Чистий Чистий Чистий Чистий Чистий Чистий Чистий 6 F Чистий Чистий Чистий Чистий Чистий Чистий Чистий 7 G Чистий Чистий Чистий Чистий Чистий Чистий Чистий 8 H Чистий Чистий Чистий Чистий Чистий Чистий Чистий 9 I Чистий Чистий Чистий Чистий Чистий Чистий Чистий 10 J Чистий Чистий Чистий Чистий Чистий Чистий Чистий 11 K Чистий Чистий Чистий Чистий Чистий Чистий Чистий 12 L Чистий Чистий Чистий Чистий Чистий Чистий Чистий 13 M Чистий Чистий Чистий Чистий Чистий Чистий Чистий 14 N Чистий Чистий Чистий Чистий Чистий Чистий Чистий 15 O Чистий Чистий Чистий Чистий Чистий Чистий Чистий 16 P Чистий Чистий Чистий Чистий Чистий Чистий Чистий 17 Q Чистий Чистий Чистий Чистий Чистий Чистий Чистий 18 R Чистий Чистий Чистий Чистий Чистий Чистий Чистий 19 S Чистий Чистий Чистий Чистий Чистий Чистий Чистий 20 T Чистий Чистий Чистий Чистий Чистий Чистий Чистий Таблиця 23 Рівень pH внутрішньовенних рідин перед розчиненням й після нього № за п. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Спостережуваний рівень pH Через 4 Перед Через 1 Через 2 Через 3 Через 5 Через 6 Ідентифікатор розчину години розчиненням годину після години після години після годин після годин після після (Вихідний) розчинення розчинення розчинення розчинення розчинення розчинення A межі pH 4,5–7,0 5,52 5,44 5,42 5,39 5,38 5,36 5,42 B межі pH 4,0–8,0 5,62 5,42 5,43 5,29 5,30 5,32 527 C 4,83 4,89 4,91 4,94 4,95 4,96 4,92 D межі pH 3,8–5,8 5,27 5,32 5,33 5,42 5,44 5,48 5,40 E межі pH 3,5–5,5 4,92 4,96 4,95 4,94 4,95 4,92 4,91 F межі pH 3,5–6,5 4,36 4,32 4,33 4,41 4,42 4,43 4,42 G межі pH 4,5–7,5 6,52 6,47 6,50 6,48 6,47 6,45 6,45 H межі pH 3,5–6,5 5,51 5,52 5,55 5,49 5,48 5,42 5,47 I межі pH 4,5b–7,5 5,49 5,49 5,51 5,65 5,66 5,61 5,61 J межі pH 3,5–6,5 4,26 4,36 4,33 4,34 4,32 4,38 4,32 K межі pH 3,0–7,0 5,59 5,58 5,55 5,62 5,6 5,65 5,63 L межі pH 4,5–7,5 5,93 5,87 5,92 5,79 5,72 5,78 5,75 M межі pH 3,5– 6,5 4,26 4,52 4,53 4,54 4,55 4,59 4,55 N межі pH 3,0–7,0 5,43 5,48 5,49 5,45 5,46 5,51 5,46 O межі pH 4,0–6,5 5,41 5,39 5,36 5,35 5,34 5,31 5,34 P межі pH 3,5–6,5 3,91 3,99 3,96 4,02 3,99 3,98 4,05 Q межі pH 3,5–4,6 4,01 4,02 4,03 4,02 4,03 4,06 4,03 R межі pH 3,5–7,0 3,67 3,64 3,63 3,59 3,58 3,59 3,56 S межі pH 3,5–7,0 5,51 5,52 5,52 5,49 5,50 5,52 5,47 T межі pH 4,0–6,5 5,94 5,91 5,90 5,87 5,84 5,86 5,83 5 14 UA 109544 C2 Таблиця 24 Оптична щільність внутрішньовенних рідин перед розчиненням й після нього Оптична щільність Ідентифікатор Перед Через 1 Через 2 Через 3 Через 4 Через 5 № за п. розчину розчиненням годину після години після години після години після годин після (Вихідний) розчинення розчинення розчинення розчинення розчинення 1 A 0,023 0,074 0,075 0,074 0,073 0,073 2 B 0,002 0,002 0,006 0,002 0,001 0,001 3 С 2,601 2,356 2,353 2,310 2,329 2,329 4 D 0,136 0,112 0,113 0,107 0,107 0,108 5 E 0,046 0,040 0,040 0,041 0,039 0,040 6 F 0,002 0,008 0,009 0,008 0,007 0,004 7 G 0,002 0,008 0,005 0,006 0,007 0,005 8 H 0,014 0,001 0,004 0,006 0,005 0,005 9 I 0,008 0,005 0,006 0,003 0,008 0,005 10 J 0,001 0,003 0,003 0,004 0,003 0,002 11 K 0,009 0,001 0,003 0,003 0,004 0,003 12 L 0,00 0,00 0,00 0,001 0,001 0,002 13 M 0,002 0,000 0,002 0,001 0,003 0,003 14 N 0,008 0,009 0,006 0,005 0,004 0,006 15 O 0,004 0,006 0,001 0,001 0,002 0,001 16 P 0,012 0,009 0,015 0,014 0,013 0,009 17 Q 0,008 0,010 0,016 0,011 0,014 0,016 18 R 0,006 0,003 0,002 0,005 0,004 0,002 19 S 0,026 0,027 0,027 0,028 0,031 0,026 20 T 0,001 0,003 0,006 0,004 0,005 0,003 Через 6 годин після розчинення 0,072 0,002 2,304 0,112 0,045 0,006 0,006 0,006 0,003 0,003 0,002 0,001 0,005 0,005 0,004 0,010 0,012 0,002 0,027 0,006 Таблиця 25 Аналіз парацетамолу № за п. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 5 Ідентифікатор розчину A B С D E F G H I J K L M N O P Q R S T Після 1 год. 99,8 100,7 99,8 100,65 98,81 96,19 101,5 99,39 98,96 99,54 97,73 99,37 98,36 98,89 98,90 98,56 101,51 102,36 99,58 101,31 Після 2 год. 99,47 100,89 99,12 100,53 100,95 97,88 101,4 98,55 98,37 98,68 97,41 98,31 98,03 99,67 99,71 98,43 101,4 102,3 99,33 100,52 Аналіз: Після 3 год. Після 4 год. 99,32 101,33 101,91 101,88 100,41 98,94 99,72 99,99 99,16 99,39 96,76 95,31 101,01 101,09 99,03 98,84 99,28 98,67 99,96 98,86 98,27 99,95 99,43 99,78 98,01 97,79 99,79 99,57 98,36 98,98 98,45 99,03 101,88 101,99 102,72 101,4 99,19 98,6 100,62 100,71 Після 5 год. 99,51 101,58 99,95 99,82 99,5 95,28 101,32 99,03 98,26 98,44 98,27 99,84 98,11 99,71 99,14 98,40 100,73 101,62 99,14 100,7 Після 6 год. 98,57 99,41 100,39 100,47 97,71 96,39 101,08 98,27 98,22 100,06 98,78 98,54 97,99 99,51 99,04 98,06 101,56 100,94 99,41 100,76 Висновки. Після вивчення вищевказаних таблиць можна зробити висновок про те, що: a) відсутня значна зміна прозорості, рівня pH і оптичної щільності внутрішньовенних рідин, коли 4 мл композиції за прикладом 1 розчиняють у внутрішньовенних рідинах; б) концентрація парацетамолу не демонструє якого-небудь значного зниження навіть через шість годин після розчинення композицій у внутрішньовенній рідині. 10 ФОРМУЛА ВИНАХОДУ 1. Парентеральна композиція з високою концентрацією парацетамолу або його фармацевтично прийнятних солей, що забезпечує повну терапевтичну дозу у 500 мг парацетамолу в 2-3 мл у 15 UA 109544 C2 5 10 15 20 25 30 35 40 45 50 55 водній розчинювальній системі, у якій концентрація парацетамолу або його фармацевтично прийнятних солей становить від 166 до 250 мг/мл, а динамічна в'язкість - 7-28 сП при 25 °С. 2. Парентеральна композиція за п 1, у якій розчинювальна система включає глікофурол, етанол і воду. 3. Парентеральна композиція за п. 1, у якій розчинювальна система включає глікофурол, етанол, поліетиленгліколь і воду. 4. Парентеральна композиція за будь-яким з пп. 1-3, динамічна в'язкість якої становить від 16 до 28 сП, краще - від 7 до 22 сП. 5. Парентеральна композиція за будь-яким з пп. 1, 2 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 166 до 200 мг на мл у розчинювальній системі, що включає 2540 % об. глікофуролу, 20-37 % об. етанолу й воду для доведення загального об'єму розчину до 2-3 мл. 6. Парентеральна композиція за будь-яким з пп. 1-2 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 200 до 250 мг на мл у розчинювальній системі, що включає 2540 % об. глікофурол, 23-35 % об. етанолу й воду для доведення загального об'єму розчину до 23 мл. 7. Парентеральна композиція за будь-яким з пп. 1, 3 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 166 до 200 мг на мл у розчинювальній системі, що включає 2542 % об. глікофуролу, 10-35 % об. етанолу, 3-19 % об. поліетиленгліколю й воду для доведення загального об'єму розчину до 2-3 мл. 8. Парентеральна композиція за будь-яким з пп. 1, 3 і 4, яка містить активний інгредієнт у перерахунку на парацетамол від 200 до 250 мг на мл у розчинювальній системі, що включає 3040 % об. глікофуролу, 24-35 % об. етанолу, 3-6 % об. поліетиленгліколю й воду для доведення загального об'єму розчину до 2-3 мл. 9. Парентеральна композиція за будь-яким з пп. 1, 3, 4, 7 і 8 у якій поліетиленгліколь являє собою поліетиленгліколь 400/600. 10. Парентеральна композиція за п. 5, динамічна в'язкість якої становить від 7 до 16 сП. 11. Парентеральна композиція за п. 6, динамічна в'язкість якої становить від 16 до 28 сП. 12. Парентеральна композиція за п. 7, динамічна в'язкість якої становить від 9 до 14 сП. 13. Парентеральна композиція за п. 8, динамічна в'язкість якої становить від 14 до 28 сП. 14. Парентеральна композиція за будь-яким з пп. 1-13, яка, за бажанням, включає антиоксиданти, хелатоутворюючі або/і буферні агенти. 15. Парентеральна композиція за будь-яким з 1-14, яка, за бажанням, включає від 2 до 6 % об. бензилового спирту. 16. Спосіб одержання парентеральної композиції з парацетамолом або його фармацевтично прийнятними солями, які мають концентрацію активного інгредієнта в діапазоні приблизно від 166 до 250 мг/мл, у якому: а) розчинюють необхідну кількість парацетамолу або його фармацевтично прийнятної солі в розчинювальній системі в інертному середовищі; б) за бажанням, додають антиоксидант, хелатостворюючий агент, бензиловий спирт; в) за бажанням, корегують рН у межах від 4 до 8; г) корегують об'єм розчину до заданої величини; д) фільтрують розчин через 0,22-мікронне фільтраційне середовище; е) заповнюють розчином ампули/флакони в інертному середовищі; є) за бажанням, обробляють ампули/флакони в автоклаві; причому розчинювальна система являє собою глікофурол, етанол і воду або розчинювальна система являє собою глікофурол, етанол, поліетиленгліколь і воду. 17. Спосіб за п. 16, у якому рівень рН розчину на етапі "в" корегують в межах від 4 до 8 за допомогою соляної кислоти, сірчаної кислоти, оцтової кислоти, лимонної кислоти, гідроксиду натрію, гідроксиду калію, гідрокарбонату натрію, гідрокарбонату калію. 18. Спосіб за п. 16, у якому рівень рН розчину на етапі "в" корегують в межах від 4 до 8 за допомогою цитратного буфера, фосфатного буфера тощо. 19. Парентеральна композиція за будь-яким з пп. 1-15, яка після розчинення у звичайних внутрішньовенних рідинах, інфузійних розчинах антибактеріальних, протигрибкових і амебоцидних лікарських препаратів і разом з седативними препаратами (ін'єкційним розчином мідазоламу) або наркотичними анальгетиками (ін'єкційним розчином фентанілу цитрату і т. ін.) залишається стійкою, чистою й прозорою протягом принаймні шести годин після розчинення. 20. Парентеральна композиція за будь-яким з пп. 1-15, яка може вводитися внутрішньом'язово, внутрішньовенно або шляхом внутрішньовенної інфузії. 16 UA 109544 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions comprising paracetamol and process for preparing the same
Автори англійськоюPatel, Ketan, R., Patel, Milan, R., Shah, Prakashchandra, J.
Автори російськоюПател Кетан Р., Пател Милан Р., Шах Пракашчандра Дж.
МПК / Мітки
МПК: A61K 31/167, A61K 9/08, A61K 47/22, A61K 47/10, A61P 29/00
Мітки: композиція, містить, спосіб, виготовлення, парацетамол, фармацевтична
Код посилання
<a href="https://ua.patents.su/19-109544-farmacevtichna-kompoziciya-shho-mistit-paracetamol-ta-sposib-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить парацетамол, та спосіб її виготовлення</a>
Попередній патент: Гетероарилциклогексилтетраазабензо[e]азулени як антагоністи рецептора вазопресину v1a
Наступний патент: Лінія для виготовлення пет-пляшок
Випадковий патент: Заміщені похідні спірохроманону