Гідрофільні, реакційні відносно тіол-групи ціанінові барвники, спосіб їх одержання, їх кон’югати з біомолекулами, спосіб одержання останніх та їх застосування, а також діагностичний набір
Формула / Реферат
1. Індотрикарбоціаніновий барвник формули (І)
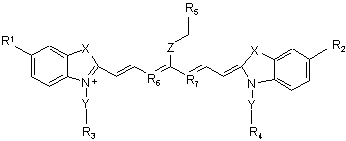 , (І)
, (І)
де Х означає двічі заміщений атом вуглецю, при цьому замісники вибрані з метильної, етильної, пропільної, ізопропільної й/або бутильної груп,
Y означає СН2-СН2 або СН2-СН2-СН2,
Z означає С1-5алкіл, при цьому атоми вуглецю необов'язково заміщені О або S, або є
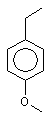 ,
,
R1-R4 незалежно один від одного означають SO3Н або Н, за умови, що принаймні три з R1-R4 означають SO3Н,
R5 означає -CO-NH-R8-R9, -NH-CS-NH-R8-R9 або -NH-CO-R8-R9, у яких R8 вибраний із групи, яка складається з нерозгалуженого С2-13алкілу, у якому С-атоми необов’язково заміщені О або S, і
R9 вибраний із
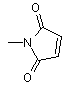 ,
,

або
хлорацетилу, бромацетилу, йодацетилу, хлорацетамідо-, йодацетамідо-, хлоралкілу, бромалкілу та йодалкілу, і у якій R6 й R7 означають СН або С, зв'язані між собою через триметиленову ланку, яка необов’язково може бути заміщена С1-4алкілом, з утворенням необов’язково заміщеного у п-положенні С1-4алкілом шестичленного кільця, або солі й сольвати цієї сполуки.
2. Індотрикарбоціаніновий барвник за п. 1, який відрізняється тим, що
Y означає CH2-CH2,
Z означає С1-5алкіл, при цьому атоми вуглецю необов'язково заміщені О або S,
і в якому R6 й R7 означають СН, і солі й сольвати цієї сполуки.
3. Індотрикарбоціаніновий барвник за п. 1 або 2, який відрізняється тим, що Z означає С1-5алкіл.
4. Індотрикарбоціаніновий барвник за п. 1 або 2, який відрізняється тим, що Z означає

і R6 й R7 кожен означає атоми С, зв’язані між собою через триметиленову ланку з утворенням шестичленного кільця.
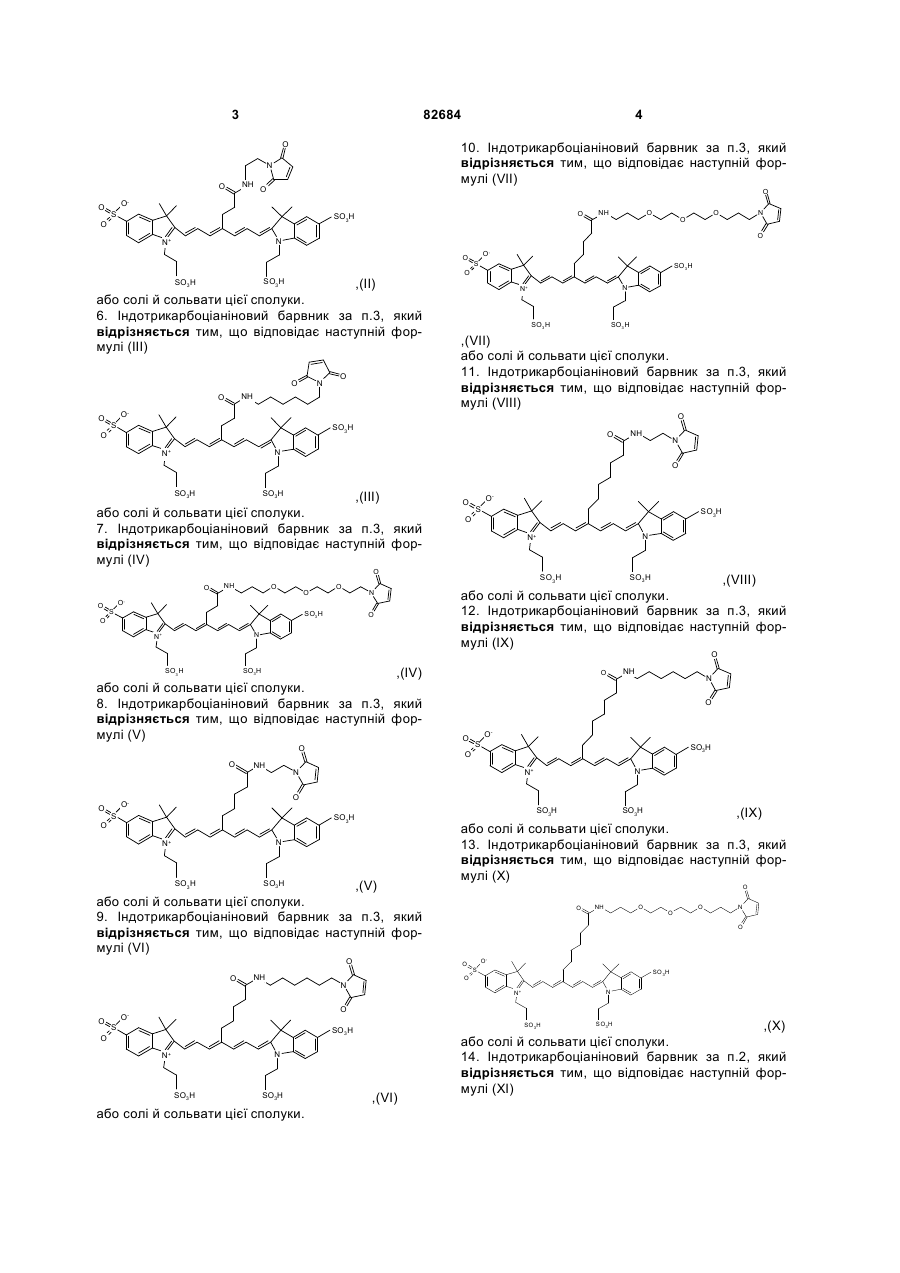
5. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (II)
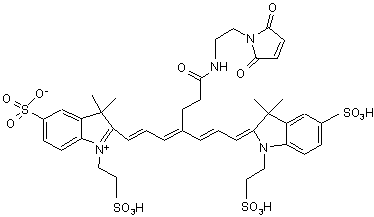 ,(ІІ)
,(ІІ)
або солі й сольвати цієї сполуки.
6. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (III)
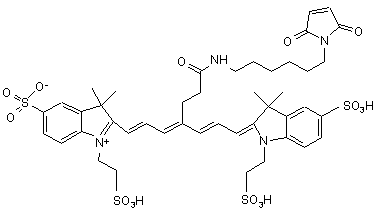 ,(ІІІ)
,(ІІІ)
або солі й сольвати цієї сполуки.
7. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (IV)
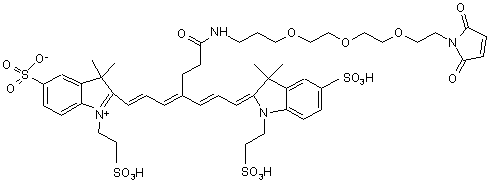 ,(ІV)
,(ІV)
або солі й сольвати цієї сполуки.
8. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (V)
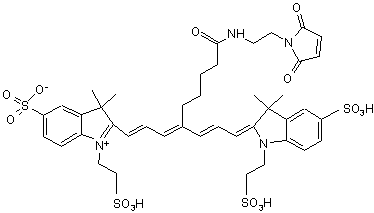 ,(V)
,(V)
або солі й сольвати цієї сполуки.
9. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (VI)
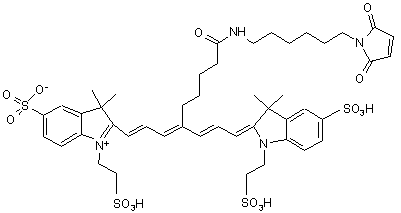 ,(VІ)
,(VІ)
або солі й сольвати цієї сполуки.
10. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (VII)
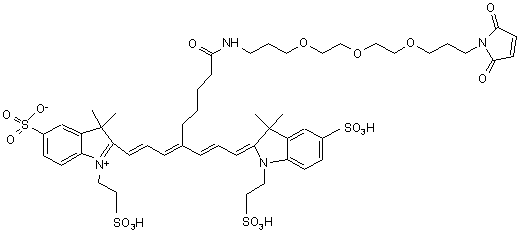 ,(VІІ)
,(VІІ)
або солі й сольвати цієї сполуки.
11. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (VIII)
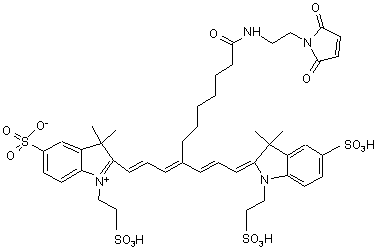 ,(VІІІ)
,(VІІІ)
або солі й сольвати цієї сполуки.
12. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (IX)
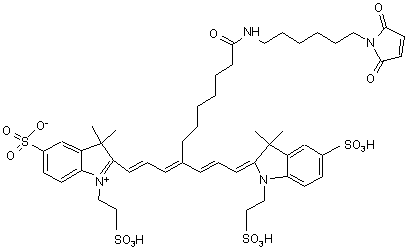 ,(ІХ)
,(ІХ)
або солі й сольвати цієї сполуки.
13. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (X)
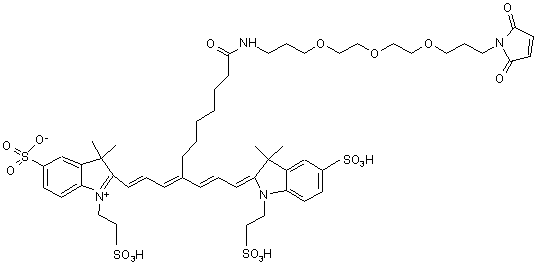 ,(Х)
,(Х)
або солі й сольвати цієї сполуки.
14. Індотрикарбоціаніновий барвник за п. 2, який відрізняється тим, що відповідає наступній формулі (XI)
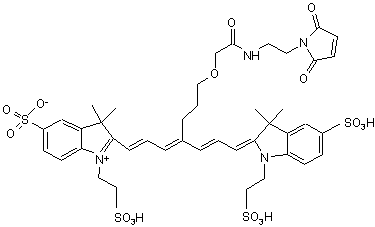 ,(ХІ)
,(ХІ)
або солі й сольвати цієї сполуки.
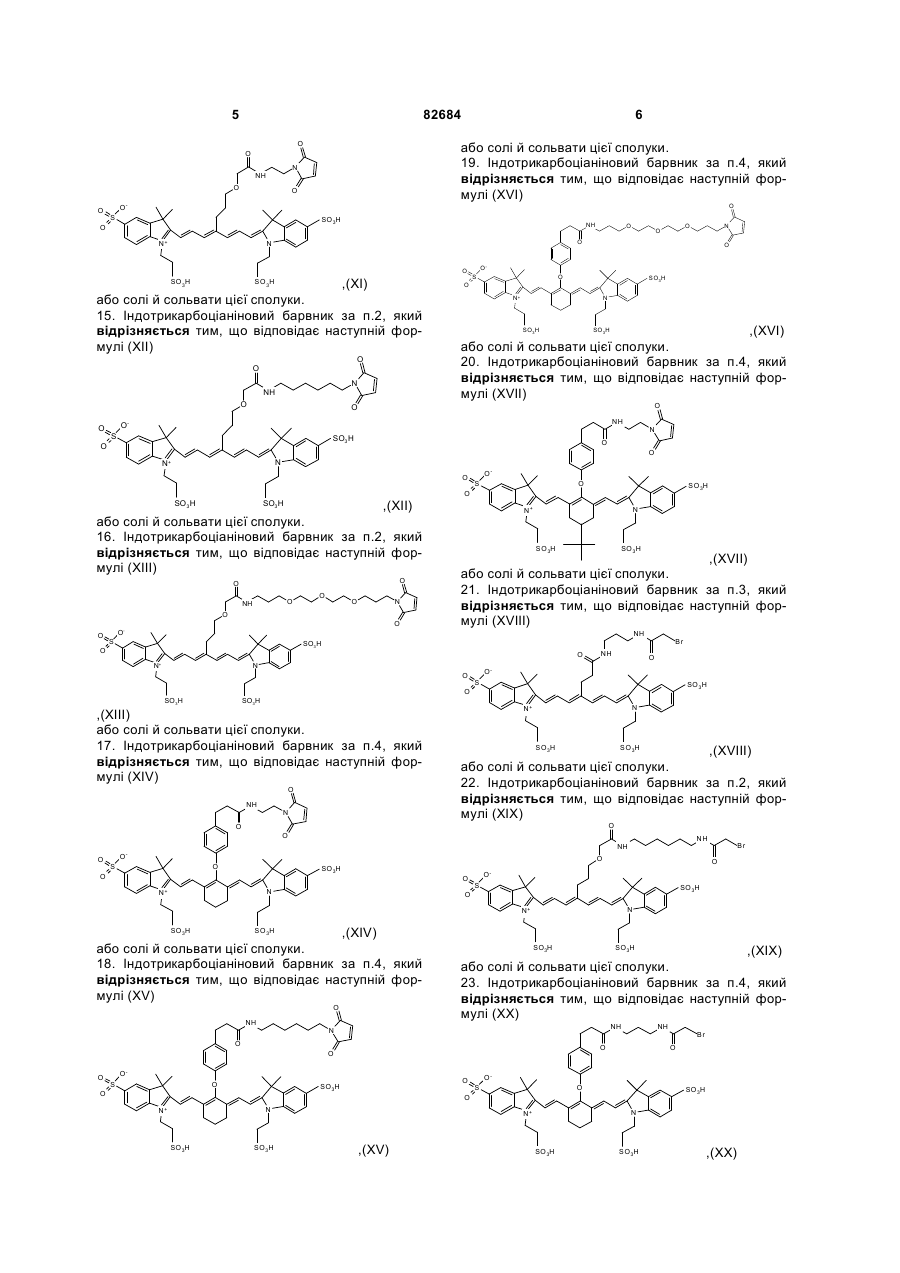
15. Індотрикарбоціаніновий барвник за п. 2, який відрізняється тим, що відповідає наступній формулі (XII)
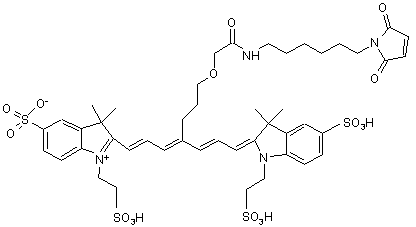 ,(ХІІ)
,(ХІІ)
або солі й сольвати цієї сполуки.
16. Індотрикарбоціаніновий барвник за п. 2, який відрізняється тим, що відповідає наступній формулі (XIII)
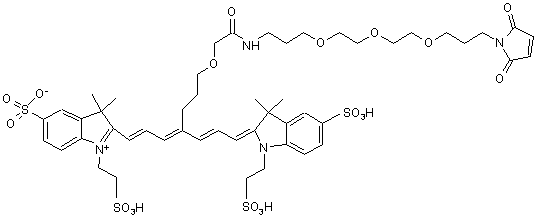 ,(ХІІІ)
,(ХІІІ)
або солі й сольвати цієї сполуки.
17. Індотрикарбоціаніновий барвник за п. 4, який відрізняється тим, що відповідає наступній формулі (XIV)
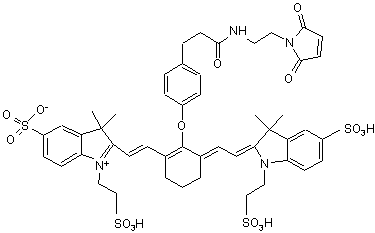 ,(ХІV)
,(ХІV)
або солі й сольвати цієї сполуки.
18. Індотрикарбоціаніновий барвник за п. 4, який відрізняється тим, що відповідає наступній формулі (XV)
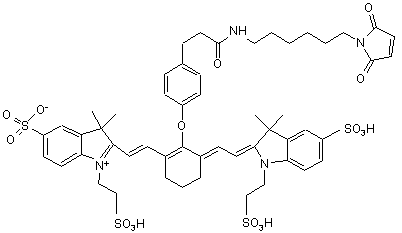 ,(ХV)
,(ХV)
або солі й сольвати цієї сполуки.
19. Індотрикарбоціаніновий барвник за п. 4, який відрізняється тим, що відповідає наступній формулі (XVI)
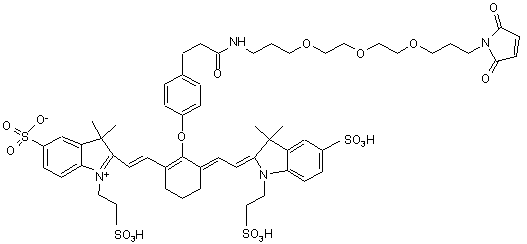 ,(ХVІ)
,(ХVІ)
або солі й сольвати цієї сполуки.
20. Індотрикарбоціаніновий барвник за п. 4, який відрізняється тим, що відповідає наступній формулі (XVII)
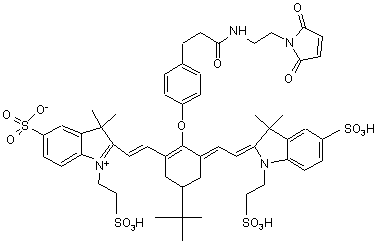 ,(ХVІІ)
,(ХVІІ)
або солі й сольвати цієї сполуки.
21. Індотрикарбоціаніновий барвник за п. 3, який відрізняється тим, що відповідає наступній формулі (XVIII)
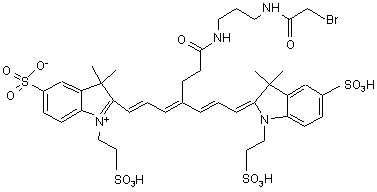 ,(ХVІІІ)
,(ХVІІІ)
або солі й сольвати цієї сполуки.
22. Індотрикарбоціаніновий барвник за п. 2, який відрізняється тим, що відповідає наступній формулі (XIX)
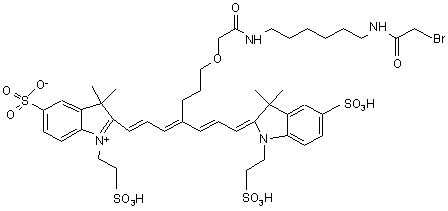 ,(ХІХ)
,(ХІХ)
або солі й сольвати цієї сполуки.
23. Індотрикарбоціаніновий барвник за п. 4, який відрізняється тим, що відповідає наступній формулі (XX)
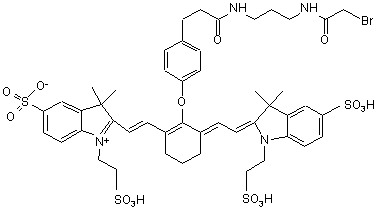 ,(ХХ)
,(ХХ)
або солі й сольвати цієї сполуки.
24. Сполука формули (І)
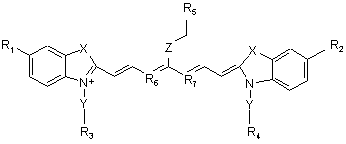 , (І)
, (І)
у якій Х означає двічі заміщений атом вуглецю, при цьому замісники вибрані з метильної, етильної, пропільної, ізопропільної й/або бутильної груп,
Y означає СН2-СН2 або СН2-СН2-СН2,
Z означає С1-5алкіл, при цьому атоми вуглецю необов'язково заміщені О або S, або є оксифенільним фрагментом
 ,
,
R1-R4 незалежно один від одного означають SO3Н або Н, за умови, що принаймні три з R1-R4 означають SO3Н,
R5 означає -COOH, і
R6 й R7 означають СН або С, зв’язані між собою через триметиленову ланку, яка необов'язково може бути заміщена С1-4алкілом, з утворенням необов’язково заміщеного у п-положенні С1-4алкілом шестичленного кільця, або солі й сольвати цієї сполуки.
25. Спосіб одержання індотрикарбоціанінового барвника за будь-яким з пп. 1-16 або 21-23, що має наступну загальну формулу (І)
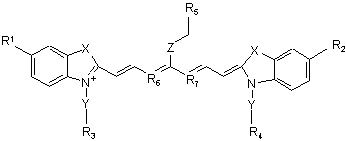 , (І)
, (І)
який відрізняється тим, що включає наступні стадії:
а) одержання індолінінового похідного,
б) одержання одного або більше 4-заміщених піридинів,
в) перетворення одного або більше 4-заміщених піридинів у мезо-заміщені глутакональдегіддіаніліди за допомогою реакції Цинке-Кеніга, і
г) взаємодію сполуки, одержаної на стадії а), зі сполукою, одержаною на стадії в), та
д) введення фрагменту Z-R5 до сполуки, одержаної на стадії г).
26. Спосіб одержання кон'югатів, який відрізняється тим, що включає приєднання індотрикарбоціанінового барвника за будь-яким з пп. 1-23 до біомолекули, яка містить SH-групу.
27. Кон'югат індотрикарбоціанінового барвника з біомолекулою, який відрізняється тим, що отриманий згідно із п. 26.
28. Кон'югат за п. 27, який відрізняється тим, що як біомолекулу включає принаймні одну біомолекулу, вибрану з пептидів, білків, ліпопротеїнів, антитіл або фрагментів антитіл, нуклеїнової кислоти, такої, як, наприклад, оліго- або полінуклеотиди із ДНК або РНК, аптамерів та РНК.
29. Кон'югат згідно із п. 28, який відрізняється тим, що білок вибраний із групи структурних білків або розчинних білків організму.
30. Кон'югат за пп. 28 або 29, який відрізняється тим, що розчинний білок є сироватковим білком, таким, як, наприклад, HSA, BSA, яєчний альбумін, ферментом, як, наприклад, пероксидаза, або антитілом, scFv фрагментом або F(ab).
31. Кон'югат за будь-яким з пп. 27-30, який відрізняється тим, що розчинний білок має спорідненість по відношенню до ED-B-фібронектину.
32. Кон'югат за будь-яким з пп. 27-31, який відрізняється тим, що індотрикарбоціаніновий барвник приєднаний до біомолекули через SH-групу, зокрема через SH-групу до цистеїну.
33. Діагностичний набір, який відрізняється тим, що включає індотрикарбоціаніновий барвник за будь-яким з пп. 1-23 й/або біомолекулу, яка містить SH-групу, разом з додатковими ад'ювантами для здійснення діагностики в умовах in vivo, зокрема пухлин.
34. Застосування кон'югата за будь-яким з пп. 27-31 як флюоресцентного контрастного середовища для in vivo діагностики пухлин.
Текст
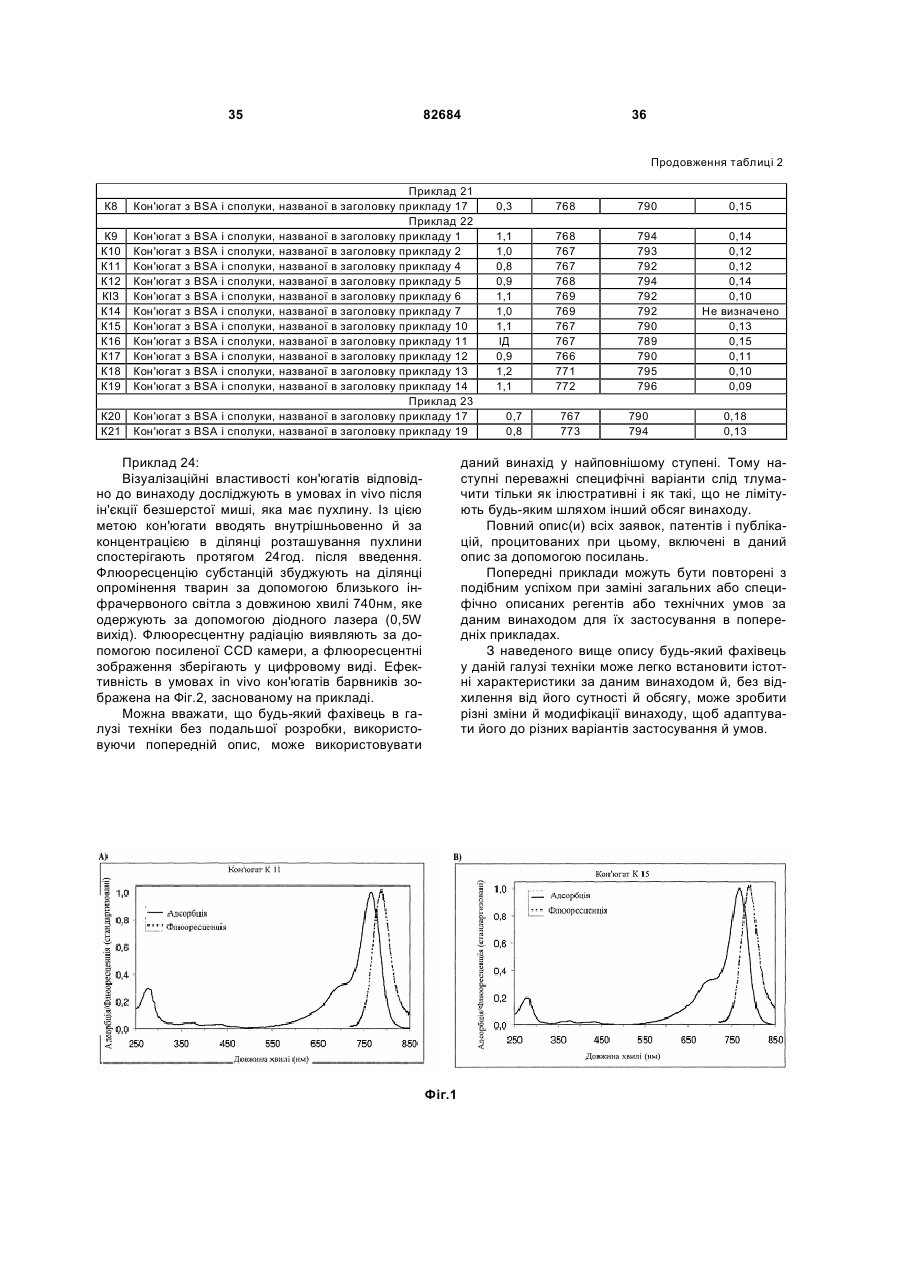
1. Індотрикарбоціаніновий барвник формули (І) 3 82684 10. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (VII) O N NH O O 4 O O OS O SO3H O O N O O O N N+ O або солі й сольвати цієї сполуки. 6. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (III) N O O NH O OS SO3H O ,(ІІ) SO3H SO3H O NH O N N+ SO3H SO3H ,(VІІ) або солі й сольвати цієї сполуки. 11. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (VIII) O S SO3H O O NH N N N+ O SO H SO H ,(ІІІ) або солі й сольвати цієї сполуки. 7. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (IV) 3 3 O O O NH O O O S SO3 H SO3H O N N+ ,(VІІІ) або солі й сольвати цієї сполуки. 12. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (IX) O N N+ OS SO3H SO3H N O O O O SO3 H ,(ІV) SO3H або солі й сольвати цієї сполуки. 8. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (V) O O O NH NH N O O OS SO3H O N N+ N O OS N N+ SO3H SO3H ,(V) або солі й сольвати цієї сполуки. 9. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (VI) O O NH SO H SO H ,(ІХ) або солі й сольвати цієї сполуки. 13. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (X) 3 SO3H O O O 3 O O NH O N O O OS SO 3H O N O O N N+ O OS O N N+ SO3H SO3H або солі й сольвати цієї сполуки. SO H SO H ,(Х) або солі й сольвати цієї сполуки. 14. Індотрикарбоціаніновий барвник за п.2, який відрізняється тим, що відповідає наступній формулі (XI) 3 SO3H ,(VІ) 3 5 82684 або солі й сольвати цієї сполуки. 19. Індотрикарбоціаніновий барвник за п.4, який відрізняється тим, що відповідає наступній формулі (XVI) O O N NH O O 6 O O OS SO3H O NH N N+ ,(ХІ) SO3H O O N NH O O OS O SO3H N N+ ,(ХVІ) або солі й сольвати цієї сполуки. 20. Індотрикарбоціаніновий барвник за п.4, який відрізняється тим, що відповідає наступній формулі (XVII) SO3H SO3H O O NH OS SO3H O N O O N N+ O ,(ХІІ) або солі й сольвати цієї сполуки. 16. Індотрикарбоціаніновий барвник за п.2, який відрізняється тим, що відповідає наступній формулі (XIII) OS O O O O NH O N O O O O SO3H O SO3H SO3H O O O або солі й сольвати цієї сполуки. 15. Індотрикарбоціаніновий барвник за п.2, який відрізняється тим, що відповідає наступній формулі (XII) O N N+ SO3 H SO3H ,(ХVІІ) або солі й сольвати цієї сполуки. 21. Індотрикарбоціаніновий барвник за п.3, який відрізняється тим, що відповідає наступній формулі (XVIII) NH S SO3 H O O N N+ O NH Br O OS SO3 H O SO3H SO3H ,(ХІІІ) або солі й сольвати цієї сполуки. 17. Індотрикарбоціаніновий барвник за п.4, який відрізняється тим, що відповідає наступній формулі (XIV) O NH N N N+ SO H SO H ,(ХVІІІ) або солі й сольвати цієї сполуки. 22. Індотрикарбоціаніновий барвник за п.2, який відрізняється тим, що відповідає наступній формулі (XIX) 3 3 O O O NH NH O OS O O SO3H O O N N+ OS SO3H O SO H SO H ,(ХІV) або солі й сольвати цієї сполуки. 18. Індотрикарбоціаніновий барвник за п.4, який відрізняється тим, що відповідає наступній формулі (XV) 3 N 3 O NH SO H SO H ,(ХІХ) або солі й сольвати цієї сполуки. 23. Індотрикарбоціаніновий барвник за п.4, який відрізняється тим, що відповідає наступній формулі (XX) 3 3 NH N O OO O SO3H O NH O O S N SO3H SO3 H OS O SO3H N N+ ,(ХV) Br O O N+ Br O N+ O N O O O SO3H O SO3H SO3H ,(ХХ) 7 82684 або солі й сольвати цієї сполуки. 24. Сполука формули (І) R5 R1 z Z X N+ R6 X R7 R2 N Y Y R3 R4 , (І) у якій Х означає двічі заміщений атом вуглецю, при цьому замісники вибрані з метильної, етильної, пропільної, ізопропільної й/або бутильної груп, Y означає СН2-СН2 або СН2-СН2-СН2, Z означає С1-5алкіл, при цьому атоми вуглецю необов'язково заміщені О або S, або є оксифенільним фрагментом O , R1-R4 незалежно один від одного означають SO3Н або Н, за умови, що принаймні три з R1-R4 означають SO3Н, R5 означає -COOH, і R6 й R7 означають СН або С, зв’язані між собою через триметиленову ланку, яка необов'язково може бути заміщена С1-4алкілом, з утворенням необов’язково заміщеного у п-положенні С14алкілом шестичленного кільця, або солі й сольвати цієї сполуки. 25. Спосіб одержання індотрикарбоціанінового барвника за будь-яким з пп.1-16 або 21-23, що має наступну загальну формулу (І) R5 R1 z Z X N+ Y R6 X R7 R2 N Y R3 R4 , (І) який відрізняється тим, що включає наступні стадії: а) одержання індолінінового похідного, Даний винахід стосується нових флюоресцентних барвників із класу ціанінових барвників, зокрема індотрикарбоціанінів з абсорбційним і флюоресцентним максимумом у спектральній області від 700 до 900нм, з реакційною групою, специфічною відносно тіол-групи, і трьома, переважно чотирма, сульфонатними групами, збільшення розчинності у воді, а також одержання барвників. Даний винахід стосується також кон'югатів цих барвників з біомолекулами і їх застосування. Останнім часом набуло значення використання світла в медичній діагностиці [див., наприклад, Biomedical Photonics Handbook (Editor: T. Vo-Dinh)], CRC Press). При проведенні експериментальних досліджень розроблена велика кількість різноманітних діагностичних методів для застосування в 8 б) одержання одного або більше 4-заміщених піридинів, в) перетворення одного або більше 4-заміщених піридинів у мезо-заміщені глутакональдегіддіаніліди за допомогою реакції Цинке-Кеніга, і г) взаємодію сполуки, одержаної на стадії а), зі сполукою, одержаною на стадії в), та д) введення фрагменту Z-R5 до сполуки, одержаної на стадії г). 26. Спосіб одержання кон'югатів, який відрізняється тим, що включає приєднання індотрикарбоціанінового барвника за будь-яким з пп.1-23 до біомолекули, яка містить SH-групу. 27. Кон'югат індотрикарбоціанінового барвника з біомолекулою, який відрізняється тим, що отриманий згідно із п.26. 28. Кон'югат за п.27, який відрізняється тим, що як біомолекулу включає принаймні одну біомолекулу, вибрану з пептидів, білків, ліпопротеїнів, антитіл або фрагментів антитіл, нуклеїнової кислоти, такої, як, наприклад, оліго- або полінуклеотиди із ДНК або РНК, аптамерів та РНК. 29. Кон'югат згідно із п.28, який відрізняється тим, що білок вибраний із групи структурних білків або розчинних білків організму. 30. Кон'югат за пп.28 або 29, який відрізняється тим, що розчинний білок є сироватковим білком, таким, як, наприклад, HSA, BSA, яєчний альбумін, ферментом, як, наприклад, пероксидаза, або антитілом, scFv фрагментом або F(ab). 31. Кон'югат за будь-яким з пп.27-30, який відрізняється тим, що розчинний білок має спорідненість по відношенню до ED-B-фібронектину. 32. Кон'югат за будь-яким з пп.27-31, який відрізняється тим, що індотрикарбоціаніновий барвник приєднаний до біомолекули через SH-групу, зокрема через SH-групу до цистеїну. 33. Діагностичний набір, який відрізняється тим, що включає індотрикарбоціаніновий барвник за будь-яким з пп.1-23 й/або біомолекулу, яка містить SH-групу, разом з додатковими ад'ювантами для здійснення діагностики в умовах in vivo, зокрема пухлин. 34. Застосування кон'югата за будь-яким з пп.2731 як флюоресцентного контрастного середовища для in vivo діагностики пухлин. різних медичних галузях, наприклад, ендоскопії, мамографії, хірургії й гінекології. Базовані на застосуванні світла процеси мають високу інструментальну чутливість й уможливлюють молекулярне виявлення й візуалізацію найменших кількостей хромофорів й/або флюорофорів [Weissleder et al. (2001) Molecular Imaging, Radiology 219, 316-333]. Барвники, які вводять у тканини як екзогенні контрастні середовища із метою флюоресцентної діагностики й візуалізації, особливо флюоресцентні барвники з абсорбційним і флюоресцентним максимумом у спектральній області 700-900нм (діагностичне вікно тканин), представляють особливий інтерес для застосування в умовах in vivo. Протони цих довжин хвиль порівняно мало абсорбуються тканинами й можуть тому проникати в 9 тканини на декілька сантиметрів перед тим, як абсорбційний процес (головним чином, за допомогою дії оксигемоглобіну й деоксигемоглобіну) зупинить переміщення світла. Абсорбція може відбуватися, крім того, за допомогою флюоресцентних барвників, які вводяться в тканину, але які випромінюють абсорбовану енергію у вигляді більш довгохвильового флюоресцентного випромінювання. Флюоресцентна радіація може бути виявлена спектрально й уможливлює локалізацію барвників і кореляцію з молекулярними структурами, до яких барвник приєднаний [див. у зв'язку із цим Licha, K. (2002) Contrast Agents for Optical Imaging (Review). B: Topics in Current Chemistry - Contrast Agents II (Editor: W. Krause), Volume 222, Springer Heidelberg, стор. 1-31.]. Щоб досягти діагностично істотної відмінності між хворобливими структурами й здоровими тканинами, введений барвник повинен приводити, до високої, наскільки це можливо, різниці концентрацій між тканинами. Це може бути здійснене, виходячи з фізіологічних властивостей пухлини (кровопостачання, кінетика локалізації, пізнє видалення). Для молекулярного маркірування хворобливоспецифічних структур можуть бути використані кон'югати, які складаються із флюоресцентних барвників з біомолекулами, спорідненими мішеням, такими як, білки, пептиди й антитіла. Після ін'єкції певна частина цих кон'югатів зв'язується з такими структурами молекулярної - мішені, як рецептори або матричні білки, у той час як незв'язана частина виводиться з організму. Таким чином, при здійсненні флюоресцентної діагностики більш висока концентраційна різниця приводить до більшої візуальної контрастності. Флюоресцентні барвники класу ціанінових барвників потрапляють у категорію перспективних представників і були синтезовані з використанням багатьох різних структур. Зокрема, карбоціаніни з індокарбоціаніновими, індодикарбоціаніновими й індотрикарбоціаніновими структурами мають високі коефіцієнти екстинкції й гарні флюоресцентні квантові виходи [Licha, K. (2002) Contrast Agents for Optical Imaging (Review). B: Topics in Current Chemistry -Contrast Agents II (Editor: W. Krause), Volume 222, Springer Heidelberg, стор.1-31, і наведені в них посилання]. [У заявці WO 96/17628] описаний діагностичний процес, проведений в умовах in vivo, за допомогою використання ближнього інфрачервоного випромінювання. У цьому випадку водорозчинні барвники і їх біомолекулярні аддукти зі специфічними фото-фізичними й фармакохімічними властивостями є контрастними середовищами для флюоресцентної і транс-ілюмінаційної діагностики. Синтез ціанінових барвників з індокарбоціаніновими, індодикарбоціаніновими й індотрикарбоціаніновими структурами добре відомий з рівня техніки. Зв'язана із цим відповідна література представлена, наприклад, в: [Bioconjugate Chem. 4, 105-111, 1993; Bioconjugate Chem. 7, 356-62, 1996; Bioconjugate Chem. 8, 751-56, 1997; Cytometry 10, 11-19, 1989 й 11, 418-30, 1990; J. Heterocycl. Chem. 33, 1871-6, 1996; J. Org. Chem. 60, 2391-5, 1995; Dyes and 82684 10 Pigments 17, 19-27, 1991, Dyes and Pigments 21, 227-34, 1993; J. Fluoresc. 3, 153-155, 1993; і Anal. Biochem. 217, 197-204, 1994]. Додаткові методи [описані в патентних публікаціях: US 4 981 977; US 5 688 966; US 5 808 044; WO 97/42976; WO 97/42978; WO 98/22146; WO 98/26077; і ЕР 0 800 831]. Крім того, індотрикарбоціаніни з іншими замісниками синтезовані й приєднані до біомолекул [описані, наприклад, в Photochem. Photobiol. 72, 234, 2000; Bioconjugate Chem. 12, 44, 2001; Nature Biotechnol. 19, 237, 2001; J. Biomed. Optics 6, 122, 2001; J. Med. Chem. 45, 2003, 2002]. Інші приклади можна знайти, зокрема, у публікаціях:[WO 00/61194 ("Short-Chain Peptide Dye Conjugates as Contrast Agents for Optical Diagnostics"), WO 00/71162, WO 01/52746, WO 01/52743 й WO 01/62156]. Однак, відомі індотрикарбоціаніни, які використовували раніше фахівці в галузі техніки, мають недоліки, які погіршують їх ефективне застосування. Низькі флюоресцентні квантові виходи індотрикарбоціанінів завжди виникають після приєднання до біомолекули. Так, Gruber й ін. (Bioconjugate Chemn. 11, 696-704, 2000) відзначають, що для комерційно доступного барвника Су7 втрата флюоресцентної ефективності має місце після приєднання до біомолекули. Becker й ін. (Photochem. Photobiol. 72, 234, 2000) описують кон'югати індотрикарбоціаніну з HAS і трансферином із флюоресцентними квантовими виходами 2,9% або 2,8% і деформованим абсорбційним спектром у фізіологічному середовищі. Крім того, кон'югати барвників мають тенденцію до агрегації. Becker й ін. (Photochem. Photobiol. 72, 234, 2000) для кон'югатів індотрикарбоціаніну з HAS і трансферином й Licha й ін. (Bioconjugate Chem. 12, 44-50, 2001) для рецепторзв'язувальних пептидів описали їх, як такі, що мають деформований абсорбційний спектр у фізіологічному середовищі. Ці деформації вказують на утворення агрегацій і флюоресцентну екстинкцію, які є результатом цього. Подібна проблема існує у випадку неадекватної водної розчинності барвників. Що стосується реакційних груп, завжди існує також проблема неефективного доступу до похідних. Так, Gruber й ін. (Bioconjugate Chemn. 11, 696704, 2000) описують використання Су7біфункціональних HAS-ефірів із двома реакційними групами, які потенційно можуть приводити до утворення поперечних зв'язків між двома біомолекулами. Однак, при наявності двох карбоксильних груп у молекулі синтетичний доступ до похідних утруднений тільки з однією реакційною групою й приводить до побічних продуктів (наприклад, до вмісту порції монореакційних HAS-ефірів Су7 неактивованої й подвійно-активованої молекули Су7). Таким чином, існує постійна потреба в ефективних й легко одержуваних ціанінових барвниках для флюоресцентної діагностики, у яких знижені або зовсім відсутні згадані вище недоліки. Крім того, ці барвники повинні бути в достатній мірі 11 придатними для одержання кон'югатів з біомолекулами. Першим об'єктом за винаходом є індотрикарбоціаніновий барвник загальної формули (І) у якій X означає О, S або С, тобто заміщений у двох місцях, при цьому замісники можуть бути вибрані з метилу, етилу, пропілу, ізопропілу й/або бутилу; Y означає СН2-СН2 або СН2-СН2-СН2; Z означає С15алкіл, при цьому С атоми необов'язково заміщені О або S, або R1-R4, незалежно один від одного означають SO3H або Н, за умови, що, принаймні, три з R1-R4 означають SO3H, R5 означає -CO-NH-R8-R9, -NHCS-NH-R8-R9 або -NH-CO-R8-R9, де R8 вибраний із групи, яка містить нерозгалужений С2-13алкіл, у якому атоми вуглецю необов'язково заміщені О або S, і R9 вибраний з або ацетихлориду, ацетидброміду, ацетилйодиду, хлорацетамідо-групи, йодацетамідо-групи, хлоралкілу, бромалкілу, йодалкілу, піридилдисульфіду й вінілсульфоаміду, і в якій R6 й R7 означають СН або зв'язані з радикалами від С3алкілу до гексильного кільця, яке необов'язково може бути заміщене в п-положенні С1-4алкільним радикалом, і солі й сольвати цієї сполуки. Переважним є індотрикарбоціаніновий барвник за даним винаходом, у якому Y означає СН2СН2; Z означає С1-5алкіл, при цьому атоми вуглецю необов'язково заміщені О або S, і в якому R6 й R7 означають СН, і солі й сольвати цієї сполуки. Найбільш переважним є індотрикарбоціаніновий барвник за даним винаходом, у якому Z означає С1-5алкіл. Ще більш переважним є індотрикарбоціаніновий барвник за даним винаходом, у якому Z означає і R6 й R7 зв'язані з гексильним кільцем через С3-алкіл. Флюоресцентні барвники із класу ціанінових барвників, зокрема індотрикарбоціаніни з абсорб 82684 12 ційним і флюоресцентним максимумом у спектральній області від 700 до 900нм, реакційною групою, специфічною відносно тіол-групи й трьома, переважно чотирма, сульфонатними групами, є, таким чином, об'єктами за даним винаходом. Останні використовуються для збільшення розчинності у воді. Несподівано недавно було знайдено, що індотрикарбоціаніни відповідно до винаходу з вищезгаданою структурою (компактне положення 3-4 сульфонатних груп із сульфонатетильними радикалами) мають високий флюоресцентний квантовий вихід >15%, і що флюоресцентний квантовий вихід після приєднання до біомолекул залишається практично незмінним (максимальна втрата становить близько 10%). Крім того, абсорбційні спектри кон'югатів не виявляють ніякої деформації в ближній інфрачервоній області близько 750нм. Таким чином, отримані барвники з хорошою гідрофільністю, зниженою агрегацією і збільшеним флюоресцентним квантовим виходом у порівнянні зі стандартними індотрикарбоціанінами або Су7 похідними з менше, ніж трьома, сульфонатними групами, зокрема у випадку Су7 й інших відомих структур. Інший цінний аспект в одержанні ціанінових барвників для флюоресцентної діагностики відповідно до винаходу стосується похідних, які мають реакційні функціональні групи, які дають можливість ковалентного зв'язування зі специфічними відносно мішеней біомолекулами. Підходящими похідними є, наприклад, NHS ефіри й ізотіоціанати [Bioconjugate Chem. 4, 105-111, 1993; Bioconjugate Chem. 8, 751-56, 1997], які реагують із аміногрупами в таких сполуках, як, наприклад, іміди малонової кислоти, a-галокетони, або a-галоацетаміди (Bioconjugate Chem. 13, 387-391, 2002; Bioconjugate Chem. 11, 161-166, 2000), які реагують із тіольними групами. Інші біфункціональні лінкери (зв'язувальні проміжні групи) можуть походити із групи, яка містить арилендіізотіоціанати, алкілендіізотіоціанати, біс-Nгідроксисукцинімідилефіри, гексаметилендіізоціанат й ефір N-(умалеїнімідобутирилокси)сукциніміду. [У заявці WO 01/77229] описані ціанінові барвники з комбінацією сульфоарильних груп, алкільних замісників у мезо-положенні метинового ланцюга й, принаймні, однією реакційною групою, яка дає можливість приєднання до біомолекул. Однак, варіанти здійснення стосуються індодикарбоціанінів (поліметиновий ланцюг яких складається з 5 атомів вуглецю) і сполук, які не мають реакційних груп у мезо-положенні. [У заявці WO 00/16810 ("Near-Infrared Fluorescent Contrast Agent and Fluorescence Imaging")] описані індотрикарбоціаніни, наприклад, із замісниками в мезо-положенні С7поліметинового ланцюга. Не зазначено, однак, яким чином можуть бути введені або отримані реакційні групи. Інший аспект даного винаходу стосується індотрикарбоціанінового барвника, у якому R5 означає СООН або NH2. 13 Опубліковані похідні базуються, головним чином, на Су3-, Су5-, Су5,5- і Су7-базисних структурах (комерційно доступні від Amersham Pharmacia Biotech; US 5 268 486; Су3 = індокарбоціанін, Су5 = індодикарбоціанін, Су7 = індотрикарбоціанін). Похідні з реакційною групою відносно тіольної становлять особливий інтерес, тому що уможливлюють безпосереднє зв'язування з біотехнологічними цистеїнами, які займають специфічне положення серед біомолекул. Рівень техніки зараз концентрується головним чином на Су3 і Су5 похідних. Особливо переважні індотрикарбоціанінові барвники відповідно до винаходу вибрані з барвників з формулами від (II) до (XX), які представлені нижче в таблиці 1. Таблиця 1: Переважні барвники відповідно до винаходу 82684 14 15 82684 16 Інший аспект даного винаходу стосується способу одержання індотрикарбоціанінового барвника за даним винаходом. У цьому випадку був знайдений простий доступ через 4-заміщені піридини. Як не дивно, різні 4-заміщені піридини з високими виходами можуть бути перетворені за допомогою реакції Цинке (реакція Zincke-Konig, див. Rompps Chemie Lexikon [Rompps Chemical Dictionary], 10th Edition, стор.5067) у тиезо-заміщений глутакональдегід-діанілід (попередник ціанінового барвника). Крім того, простий й ефективний синтез 4заміщених піридинів, симетричні структури барвників за цим винаході відкривають можливість певної дериватизації з реакційною групою, селективною відносно тіольної групи, у симетричному мезоположенні молекули. Таким чином була проведена подальша дериватизація до сполук з реакційною групою відносно тіольної. Функціональними реакційними групами відносно тіольної є, наприклад, малеїнімідна (малеімід), хлорацетильна, бромацетильна, йодацетильна, хлорацетамідна, бромацетамідна, йодацетамідна, хлоралкільна, бромалкільна, йодалкільна, піридилдисульфідна й вінілсульфонамідна групи. Ще один аспект даного винаходу стосується способу одержання кон'югатів, який включає приєднання індотрикарбоціанінового барвника за даним винаходом до біомолекули. В обсязі цього винаходу під терміном «біомолекула» слід розуміти будь-яку молекулу органічного походження, яка має біологічну активність, зокрема ферментативну активність, або зв'язувальні речовини синтетичного або біологічного походження такі, як наприклад, фармацевтичні агенти, пептиди, білки, рецептори або нуклеїнові кислоти. У свою чергу, переважними біомолекулами є білки, як наприклад, ферменти, пептиди, антитіла й фрагменти антитіл (такі, як наприклад, одиночний ланцюг, Fab, F(ab)2, diabodies і т.п.), ліпопротеїни, нуклеїнові кислоти такі, як наприклад, олігонуклеотиди або полінуклеотиди із ДНК або РНК, аптамери, РНК, і цукри такі, як наприклад, моно-, ди-, три-, оліго- і полісахариди. 17 Синтез і біологічна характеристика кон'югатів ціанінових барвників з біомолекулами такими, як пептиди, антитіла і їх фрагменти й білки для флюоресцентної діагностики пухлин в умовах in vivo описані раніше в багатьох публікаціях. У цьому випадку переважно були використані згадані вище Су3, Су5, Су5,5 і Су 7 [див. у зв'язку із цим, наприклад, Nature Biotechnol. 15, 1271, 1997; Cancer Detect. Prev. 22, 251, 1998; J. Immunol. Meth. 231, 239, 1999; Nature Biotechnol. 17, 375, 1999; Nature Medicine 7, 743, 2001]. Інший аспект даного винаходу зв'язаний з отриманим відповідно до способу за винаходом кон'югатом індотрикарбоціанінового барвника з біомолекулою. Цей кон'югат може бути охарактеризований тим, що він включає біомолекулу, як визначено вище, причому як біомолекула, принаймні, одна біомолекула, вибрана з пептидів, білків, ліпопротеїнів, антитіл або фрагментів антитіл, нуклеїнових кислот таких, як наприклад, олігонуклеотиди або полінуклеотиди ДНК або РНК, аптамерів, РНК, і цукрів таких, як наприклад, моно-, ди-, три-, оліго- і полісахариди, є найбільш переважною. Приєднаний білок може бути охарактеризований тим, що він вибраний із групи структурних білків або розчинних білків організму. Абсолютно переважними є сироваткові білки (наприклад, HSA), антитіла/фрагменти антитіл, як, наприклад, scFv-фрагмент або F(ab), а також пептиди, BSA, яєчний альбумін або отримана з них пероксидаза. Так, з рівня техніки відомі, наприклад, антитіла, які спрямовані проти молекул, які інтенсивно експресують в ангіогенетично активної тканини й тільки на дуже низькому рівні в прилеглій тканині [див. WO 96/01653]. Особливий інтерес представляють антитіла рецепторів факторів судинного росту, рецепторів з ендотеліальними клітинами, з якими зв'язані медіатори запалення, і матричних білків, які особливо експресують при формуванні нових судин. Переважними є інші антитіла й фрагменти антитіл, які протистоять матричному білку EDB-фібронектину і його кон'югатам відповідно до винаходу. EDB-фібронектин, відомий також як онкофетальний фібронектин, є варіантом сплайсингу фібронектину, який формується, зокрема, навколо знову утворених судин у процесі ангіогенезису. Особливо переважними є антитіла L19, Е8, АР38 й АР39 проти EDB-фібронектину [Cancer Res 1999, 59, 347; J Immunol Meth 1999, 231, 239; Protein Expr Purif 2001, 21, 156]. Переважним є кон'югат відповідно до винаходу, який характеризується тим, що індотрикарбоціаніновий барвник приєднаний до біомолекули через SH-групу, зокрема через SH-групу до цистеїну. Необов'язково навіть більш переважно одержуваними з них є такі антитіла і їх фрагменти, які одержують за допомогою рекомбінантної технології так, що на С- або N-кінцях (у межах 1-10 крайніх амінокислот) вони містять цистеїн, який не утворює ніяких внутрішньомолекулярних S-S-містків, і тому може бути використаний для приєднання до барвників відповідно до винаходу. Інший аспект даного винаходу стосується діагностичного комплекту, який включає індотрикарбоціаніновий барвник за даним винаходом й/або 82684 18 кон'югат за даним винаходом. Крім того, набір може містити додаткові ад'юванти для здійснення діагностики, зокрема пухлин, в умовах in vivo. Ці ад'юванти являють собою, наприклад, підходящі буфери, посудини, реагенти для виявлення або інструкції для застосування. Набір переважно містить всі матеріали для внутрішньовенного введення барвників відповідно до винаходу. Спеціальний вміст таких наборів відповідно до винаходу є, наприклад, наступний. Перша посудина містить антитіло (біомолекулу) з вільною SH-групою й стандартними буфером/добавками у вигляді розчину або ліофілізованого матеріалу. Інша посудина містить барвники відповідно до винаходу у вигляді розчину (звичайні добавки) або ліофілізований матеріал у молярному співвідношенні 0,1:1 (10-кратний дефіцит в еквімолярній кількості). Вміст посудини, яка містить барвник, необов'язково змішують з буфером або дистильованою водою, додають до вмісту посудини, яка містить біомолекулу, інкубується протягом 1-10хв, і використовують як ін'єкційний розчин. В іншому варіанті набір являє собою 2-хкамерну систему (наприклад, , шприц), у якій одна камера, яка містить розчин антитіла, фізично відділена перегородкою, яка руйнується, від другої камери, яка містить барвник у вигляді розчину або твердої речовини. Після зламування перегородки відбувається змішування й утворення ін'єкційного розчину. Останній аспект даного винаходу стосується застосування кон'югата відповідно до винаходу як флюоресцентного контрастного середовища для діагностування пухлин в умовах in vivo. Абсорбційний максимум Су7 у зв'язку із цим лежить в області 745нм й є тому особливо підходящим для виявлення флюоресценції в умовах in vivo у більш глибоких шарах тканин (див. вище). Однак, Су7 похідні з реакційними групами, селективними відносно тіольної групи, ще не описані. Крім того, використання кон'югатів з антитілами для виявлення меж поширення пухлини вже описані в [WO 01/23005 (Antibody Dye Conjugates for Binding to Target Structures of Angiogenesis in Order to Intraoperatively Depict Tumor Peripheries)], але без застосування перспективних барвників відповідно до винаходу. Винахід описаний далі в термінах наступних прикладів і фігур, які, однак, не обмежують його. На Фіг.1 представлені стандартизовані абсорбційні й флюоресцентні спектри кон'югата К11 (А) і К15 (Б) (див. таблицю 2) в PBS (фізіологічний розчин з фосфатним буфером). На Фіг.2 показані результати візуалізованих властивостей кон'югатів прикладу 24 відповідно до винаходу: речовина: кон'югат К15, пухлина: F9 тератокарцинома в правому нижньому боці миші, доза: 50нмол/кг маси тіла (дані стосуються барвника), збудження: 740нм (діодний лазер), виявлення: CCD-камера (Hamamatsu) з 802,5+5нм і смугово-пропускним фільтром, 19 час: перед ін'єкцією, 1год., 6год. й 24год. після ін'єкції. Положення пухлини вказане стрілками. Приклади 1-16: Синтез індотрикарбоціанінових барвників з малеімідними групами Приклад 1: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(2-{[2-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)етил]карбамоїл}етил)гепта-2,4,6-триєн1-іліден}-1-(2-сульфонатетил)-2,3-дигідро-1Ніндол-5-сульфонат, внутрішня сіль (формула II) a) 1-(2-Сульфонатетил)-2,3,3-триметил-3Ніндоленін-5-сульфокислота, внутрішня сіль 10г (0,04мл) 2,3,3-триметил-3Н-індоленін-5сульфокислоти (Bioconjugate Chem 1993, 4, 105), 6,8г (0,04мл) хлорангідриду 2хлоретансульфокислоти й 4,2г (0,04мл) триетиламіну перемішують в 200мл ацетонітрилу протягом 6год. Осад відсмоктують і висушують. Вихід 5,0г (35% від теоретичного). Anal. Biochem. 1994,217, 197. б) Трет-бутиловий ефір 3-піридин-4ілпропіонової кислоти 20г (89ммол) трет.-бутил-Р,Рдиметилфосфонацетату в 50мл ТГФ додають по краплях при 0°С до суспензії 3,9 г (98 ммол) гідриду натрію (60%-на в мінеральному маслі) в 250мл ТГФ. Після перемішування протягом 1год. при 0°С, додають по краплях розчин 10г (93ммол) піридинкарбальдегіду в 50мл ТГФ, і перемішують реакційну суміш протягом 1год. при 0°С і протягом 18год. при кімнатній температурі. Тверду речовину, яка випала, видаляють фільтруванням, і розчин концентрують випарюванням. Залишок при нагріванні розчиняють в ізопропанолі, нерозчинну частину відфільтровують, і розчин охолоджують до 0°С для кристалізації. Тверду речовину відфільтровують, перемішують із гексаном, відфільтровують гексан і висушують. Проміжний продукт (15,3г) гідрують в 150мл етанолу з 0,15г 10%-ного паладію на активованому вугіллі протягом 6год. Каталізатор відфільтровують, розчин концентрують випарюванням, і залишок фільтрують на силікагелі (рухома фаза - діетиловий ефір). Одержують 13,0г злегка жовтого масла (вихід 71% від теоретичного). в) 3-[2-(трет.Бутилоксикарбоніл)етил]глутакональдегід-діанілідгідробромід Розчин10г (48ммол) трет-бутилового ефіру 3піридин-4-ілпропіонової кислоти в 150 мл діетилового ефіру перемішують із 8,9г (96ммол) аніліну й 82684 20 потім перемішують при 0°С з розчином 5,4г (48ммол) бромціану в 2мл діетилового ефіру. Після 3год. перемішування при 0°С відфільтровують червону тверду речовину, яка утворилася, промивають ефіром і висушують у вакуумі. Вихід: 20,3г (92% від теоретичного). г) Три натрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(2-карбоксіетил)гепта-2,4,6-триєн-1-іліден}-1-(2сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль Суспензію 1,0г (2,2ммол) 3-[2-(третбутилоксикарбоніл)етил]-глутакональдегід-діанілід гідроброміду (приклад їв) і 1,5г (4,4ммол) 1-(2сульфонатетил)-2,3,3-триметил-3Н-індоленін-5сульфокислоти (приклад 1а) в 20мл ангідриду оцтової кислоти й 5 мл оцтової кислоти змішують із 0,75г (9,1ммол) ацетату натрію й перемішують протягом 1год. при 120°С. Після охолодження перемішують із діетиловим ефіром, тверду речовину, яка випала в осад, відфільтровують, очищають хроматографічно (RP-C18-силікагель, рухома фаза вода/метанол) і ліофілізують (0,5г). Відщеплення захисної групи проводять за допомогою перемішування проміжного продукту в 4 мл дихлорметану/1 мл трифтороцтової кислоти протягом 1год. Після концентрування випарюванням і хроматографічного очищення (RP-C18-силікагель, рухома фаза вода/метанол), одержують 0,45г (23% від теоретичного) блакитного ліофілізату. д) Тринатрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(2-{[2-(2,5-діоксо-2,5-дигідро-1H-пірол-1іл)етил1карбамоїл}етил)гепта-2,4,6-триєн-1іліден}-1-(2-сульфонатетил)-2,3-дигідро-1Н-індол5-сульфонат, внутрішня сіль 0,4г (0,45ммол) сполуки, названої в заголовку прикладу 1г, і 45мг (0,45ммол) триетиламіну розчиняють в 10мл ДМФ, змішують при 0°С з 0,15г (0,45ммол) TBTU і перемішують протягом 10хв. Потім додають розчин 0,17г (0,68ммол) N-(2аміноетил)малеімід-трифторацетату (Int. J. Pept. Protein Res. 1992, 40, 445) і 68мг (0,68ммол) триетиламіну в 0,5мл ДМФ, і перемішують протягом 1год. при кімнатній температурі. Потім додають 10мл діетилового ефіру, тверду речовину відокремлюють центрифугуванням, висушують й очищають за допомогою хроматографії (RP С-18 силікагель, градієнт метанол/вода). Вихід: 0,30 г блакитного ліофілізату (65% від теоретичного). Елементний аналіз: Обчислено: С 47,24; Н 4,26; N 5,51; S 12,61; Na 6,78 Знайдено: С 47,74; Н 4,47; N 5,40; S 11,99; Na 7,02 Приклад 2: Тринатрій 3,3-диметил-2-(7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(2-{[6-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)гексил]карбамоїл}етил)гепта-2,4,6триєн-1-іліден}-1-(2-сульфонатетил)-2,3-дигідро1H-індол-5-сульфонат, внутрішня сіль (формула III) 21 Синтез проводять аналогічно до прикладу 1д з 0,4г (0,45ммол) названої в заголовку прикладу 1г сполуки й 0,21г (0,68ммол) N-(6аміногексил)малеїнмідтрифторацетату (Int. J. Pept. Protein Res. 1992, 40, 445). Вихід: 0,38г блакитного ліофілізату (81% від теоретичного). Елементний аналіз: Обчислено: С 49,25; Н 4,79; N 5,22; S 11,95; Na 6,43 Знайдено: С 48,96; Н 4,92; N 5,32; S 11,88; Na 6,56 Приклад 3: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(2-{[13-(2,5-діоксо-2,5-дигідро-1Hпірол-1-іл)-4,7,10триоксатридецил]карбамоїл}етил)гепта-2,4,6триєн-1-іліден}-1-(2-сульфонатетил)-2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль (формула IV) Синтез проводять аналогічно до прикладу 1д з 0,4г (0,45ммол) названої в заголовку прикладу 1г сполуки й 0,28 г (0,68 ммол) N-(13-aміно-4,7,10триоксатридецил)малеїнімідтрифторацетату (Int. J. Pept. Protein Res., 1992, 40, 445). Вихід: 0,27 г блакитного ліофілізату (51% від теоретичного). Елементний аналіз: Обчислено: С 49,97; Н 5,05; N 4,76; S 10,89; Na 5,86 Знайдено: С 49,22; Н 5,16; N 4,62; S 10,67; Na 5,66 Приклад 4: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-ЗНіндоліум-2-іл]-4-(4-{[2-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-етил1карбамоїл}бутил)гепта-2,4,6триен-1-іліден}-1-(2-сульфонатетил)-2,3-дигідроШ-індол-5-сульфонат, внутрішня сіль (формула V) а) (3-трет.-Бутоксикарбонілпропіл)трифенілфосфоніум бромід 82684 22 50г (0,30мл) 4-броммасляної кислоти по краплях змішують в 400мл ТГФ при -40°С з 187г (0,89мл) ангідриду трифтороцтової кислоти. Після 30хв перемішування при -40°С, додають по краплях 400мл суміші трет.-бутанол/30мл ТГФ протягом 1год. Після 16год. перемішування при кімнатній температурі реакційну суміш переносять в охолоджений льодом розчин карбонату натрію, водну фазу тричі екстрагують діетиловим ефіром, органічну фазу висушують над сульфатом натрію й концентрують випарюванням. Залишок переганяють у вакуумі (температура кипіння 72°С/0,9мбар; вихід: 41г). Для утворення солі фосфонію реакцію проводять, нагріваючи зі зворотним холодильником 41г (0,18мл) проміжного продукту, 44,6г (0,17мл) трифенілфосфіну й 32,5г (0,36мл) бікарбонату натрію в 250мл ацетонітрилу протягом 20год. Реакційну суміш фільтрують, концентрують випарюванням і залишок для кристалізації перемішують із діетиловим ефіром. Вихід: 58,5г (40% від теоретичного, відносно 4броммасляної кислоти) білої твердої речовини. б) трет.-Бутиловий ефір 5-піридин-4ілпентанової кислоти Розчин 14г (28ммол) (3-третбутоксикарбонілпропіл)трифенілфосфоній броміду (приклад 4а) в 100мл безводного ТГФ змішують при -40°С у вакуумі протягом 20хв із 17,5мл (28ммол) бутиллітію (1,6-молярний у гексані) і перемішують протягом 1 год при -40°С. Розчин 2,78г (26ммол) 4-піридинкарбальдегіду в 20мл ТГФ додають по краплях і перемішують протягом 16год. при кімнатній температурі, потім переносять у льодяну воду, водну фазу тричі екстрагують діетиловим ефіром, органічні фази висушують над сульфатом натрію й концентрують випарюванням. Після хроматографічного очищення (силікагель, рухома фаза гексан/етилацетат)), одержують продукт у вигляді E,Z-суміші (4:1 за даними ЯМР; 5,0г). Для гідрування подвійного зв'язку проміжний продукт розчиняють в 200 мл метанолу й перемішують із 100мг РtO2 каталізатора при кімнатній температурі в атмосфері водню. Після фільтрування й концентрування випарюванням одержують жовте масло. Вихід: 4,9г (74% від теоретичного). в) 3-[4-(третБутилоксикарбоніл)бутил]глютакональдегіддіанілід гідробромід Розчин 4,0г (17ммол) трет-бутилового ефіру 5піридин-4-ілпентанової кислоти в 35мл діетилового ефіру змішують із 3,2г (34ммол) аніліну й потім при 0°С з розчином 1,9г (17ммол) бромціану в 8мл діетилового ефіру. Після перемішування протягом 3год. при 0°С червону тверду речовину, яка утворилася, відфільтровують, промивають ефіром і висушують у вакуумі. Вихід: 7,8г (95% від теоретичного). г) Три натрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(4-карбоксибутил)гепта-2,4,6-триєн-1-іліден}-1(2-сульфонатетил)-2,3-дигідро-1H-індол-5сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу 1г з названої в заголовку прикладу 4в сполуки 23 (2,5ммол) і 1-(2-сульфонатетил)-2,3,3-триметил3Н-індоленін-5-сульфонової кислоти (5ммол). Вихід: 0,85г (37% від теоретичного) блакитного ліофілізату. д) Три натрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл14-(4-{[2-(2,5-діоксо-2,5-дигідро-1Н-пірол-1-іл)етил]карбамоїл}бутил)гепта-2,4,6-триєн-1-іліден}1-(2-сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу 1д з 0,4г (0,43ммол) сполуки, названої в заголовку прикладу 4г. Вихід: 0,31г (69% від теоретичного) блакитного ліофілізату. Елементний аналіз: Обчислено: С 48,27; Н 4,53; N 5,36; S 12,27; Na 6,60 Знайдено: С 48,01; Н 4,44; N 5,56; S 12,10; Na 6,81 Приклад 5: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(4-{[6-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-гексил]карбамоїл}бутил)гепта-2,4,6триєн-1-іліден}-1-(2-сульфонатетил)-2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль (формула VI) Синтез проводять аналогічно до прикладу 1д з 0,4г (0,43ммол) сполуки, названої в заголовку прикладу 1г й 0,20г (0,66ммол) N-(6аміногексил)малеіміду трифтороцтової кислоти. Вихід: 0,35г блакитного ліофілізату (74% від теоретичного). Елементний аналіз: Обчислено: С 50,17; Н 5,03; N 5,36; S 11,65; Na 6,26 Знайдено: С 49,83; Н 4,89; N 5,34; S 12,05; Na 6,42 Приклад 6: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(4-{[13-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-4,7,10триоксатридецил]карбамоїл}бутил)гепта-2,4,6триєн-1-іліден)-1-(2-сульфонатетил)-2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль (формула VII) Синтез проводять аналогічно до прикладу 1д з 0,4г (0,43ммол) сполуки, названої в заголовку прикладу 1г, і 0,30г (0,72ммол) N-(13-аміно-4,7,10триоксатридецил)малеімід-трифторацетату. Вихід: 82684 24 0,27г блакитного ліофілізату (52% від теоретичного). Елементний аналіз: Обчислено: С 49,83; Н 5,27; N 4,65; S 10,64; Na 5,72 Знайдено: С 49,45; Н 5,19; N 4,66; S 10,85; Na 5,80 Приклад 7: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(6-{[2-(2,5-діоксо-2,5-дигідро-1Нтрол-1-іл)-етил]карбамоїл}гексил)гепта-2,4,6триєн-1-іліден}-1-(2-сульфонатетил)-2,3-дигідро1H-індол-5-сульфонат, внутрішня сіль (формула VIII) а) (3-трет.Бутоксикарбонілпентил)трифенілфосфоніум бромід Одержання проводять аналогічно до описаного в прикладі 4а, при цьому проміжний продукт трет-бутиловий ефір 3-піридин-4-ілпропіонової кислоти вводять у реакцію у вигляді сирого продукту. Одержують 79г продукту (69% від теоретичного) у вигляді в'язкого безбарвного масла з 50г 6бромгексанової кислоти. б) трет-Бутиловий ефір 7-піридин-4ілгептанової кислоти Одержання проводять аналогічно до описаного в прикладі 4б. трет.-Бутиловий ефір 7-піридин4-ілгептанової кислоти (7,5г, 65% від теоретичного) одержують у вигляді жовтого масла з 25г (48,7ммол) (3-трет.-бутоксикарбонілпентил)трифенілфосфоній броміду (приклад 7а). в) 3-[4-(третБутилоксикарбоніл)гексил]глютакональдегіддіанілід гідробромід Розчин 5,0г (19ммол) трет.-бутилового ефіру 5-піридин-4-ілгептанової кислоти в 30мл діетилового ефіру змішують із 3,6г (38ммол) аніліну й потім при 0°С з розчином 2,1г (19ммол) бромціану в 5мл діетилового ефіру. Після перемішування протягом 2,5год. при 0°С червону тверду речовину, яка утворилася, відфільтровують, промивають ефіром і висушують у вакуумі. Вихід: 8,9г (91% від теоретичного). г) Три натрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(6-карбоксигексил)гепта-2,4,6-триен-1-іліден}-1(2-сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу 1г з названої в заголовку прикладу 4в сполуки (3ммол) і 1-(2-сульфонатетил)-2,3,3-триметил-3Ніндоленін-5-сульфонової кислоти (6ммол). Вихід: 1,5г (54% від теоретичного) блакитного ліофілізату. 25 д) Тринатрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(6-{[2-(2,5-діоксо-2,5-дигідро-1H-пірол-1-іл)етил]карбамоїл}гексил)гепта-2,4,6-триєн-1-іліден}1-(2-сульфонатетил)-2,3-дигідро-1H-індол-5сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу 1д з 0,4г (0,43ммол) названої в заголовку прикладу 4 г сполуки. Вихід: 0,31 г (69% від теоретичного) блакитного ліофілізату. Елементний аналіз: Обчислено: С 49,25; Н 4,79; N 5,22; S 11,95; Na 6,43 Знайдено: С 48,98; Н 4,86; N 5,12; S 11,76; Na 6,77 Приклад 8: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(6-{[6-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-гексил]карбамоїл}гексил)гепта-2,4,6триєн-1-іліден}-1-(2-сульфонатетил)-2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль (формула IX) Синтез проводять аналогічно до прикладу 1д з 0,5г (0,53 ммол) сполуки, названої в заголовку прикладу 7г, і 0,23г (0,75ммол) N-(6аміногексил)малеімід-трифторацетату. Вихід: 0,42г блакитного ліофілізату (70% від теоретичного). Елементний аналіз: Обчислено: С 51,05; Н 5,27; N 4,96; S 11,36; Na 6,11 Знайдено: С 50,74; Н 5,55; N 4,76; S 11,38; Na 6,35 Приклад 9: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(6-{[13-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-4,7,10триоксатридецил]карбамоїл}гексил)гепта-2,4,6триєн-1-іліден)-1-(2-сульфонатетил)-2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль (формула X) Синтез проводять аналогічно до прикладу 1д з 0,5г (0,53ммол) сполуки, названої в заголовку прикладу 1г, і 0,44г (1,06ммол) N-(13-аміно-4,7,10триоксатридецил)малеїнмід-трифторацетату. Вихід: 0,24г блакитного ліофілізату (37% від теоретичного). 82684 26 Елементний аналіз: Обчислено: С 50,64; Н 5,48; N 4,54; S 10,40; Na 5,59 Знайдено: С 50,30; Н 5,56; N 4,34; S 10,15; Na 5,73 Приклад 10: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл1-4-(5-{[2-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-етил]карбамоїл|}-3-оксапентил)гепта2,4,6-триєн-1-іліден}-1-(2-сульфонатетил)-2,3дигідро-1Н-індол-5-сульфонат, внутрішня сіль (формула XI) а) трет.-Бутиловий ефір 3-окса-6-(4піридиніл)гексанової кислоти Розчин 75г (0,4мл) 3(4-піридиніл)-1-пропанолу в 400мл толуолу/50мл ТГФ змішують із 10г сульфату тетрабутиламонію й 350мл 32%-ного розчину гідроксиду натрію. Потім по краплях додають 123г (0,68мл) трет.бутилового ефіру бромоцтової кислоти й перемішують протягом 18год. при кімнатній температурі. Органічну фазу відокремлюють, водну фазу тричі екстрагують діетиловим ефіром. Об'єднані органічні фази промивають розчином NaCl, висушують над сульфатом натрію й концентрують випарюванням. Після хроматографічного очищення (силікагель, рухома фаза: розчин гексан : етилацетат), одержують 56г продукту у вигляді коричнюватого масла (41% від теоретичного). б) 3-[4-Окса-5-(третБутилоксикарбоніл)пентил]глютакональдегіддіанілід гідробромід Розчин 5,0г (20ммол) трет.-бутилового ефіру 3-окса-6-(4-піридиніл)-гексанової кислоти в 60мл діетилового ефіру змішують із 3,7г (40ммол) аніліну й потім при 0°С з розчином 2,2г (20ммол) бромціану в 8мл діетилового ефіру. Після перемішування протягом 1год. при 0°С тверду речовину, яка утворилася, відфільтровують, промивають ефіром і висушують у вакуумі. Вихід: 8,5г (85% від теоретичного) твердої речовини фіолетових кольорів. в) Тринатрій 3,3-диметил-2-(7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(6-карбокси-4-оксагексил)гепта-2,4,6-триєн-1іліден}-1-(2-сульфонатетил)-2,3-дигідро-1Н-індол5-сульфонат, внутрішня сіль Суспензію 3,0г (6ммол) 3-[2-(трет.бутилоксикарбоніл)етил]-глутакональдегід-діанілід гідроброміду (приклад 10б) і 4,2г (12ммол) 1-(2сульфонатетил)-2,3,3-триметил-3Н-індоленін-5сульфонової кислоти (приклад 1а) в 50мл ангідриду оцтової кислоти й 10мл оцтової кислоти змішують із 2,5г (30ммол) ацетату натрію й перемішують протягом 50хв при 120°С. Після охолодження перемішують із діетиловим ефіром, тверду речовину, яка випала в осад, відфільтровують, абсорбційно осаджують в ацетоні й висушують у високому ва 27 куумі. Після хроматографічного очищення (RPC18-силікагель, рухома фаза вода/метанол) видаляють метанол у вакуумі й ліофілізують (0,5г). Після концентрування випарюванням і хроматографічного очищення (RP-C18-силікагель, рухома фаза вода/метанол), відразу одержують названу в заголовку сполуку. Вихід: 2,3г (41% від теоретичного) блакитного ліофілізату. г) Тринатрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2-іл]4-(5-{[2-(2,5-діоксо-2,5-дигідро-1Н-пірол-1-іл)етил]карбамоїл}-3-оксапентил)гепта-2,4,6-триєн-1іліден]-1-(2-сульфонатетил)-2,3-дигідро-1H-індол5-сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу їв з 1,0г (1,1ммол) сполуки, названої в заголовку прикладу 10в. Вихід: 0,85 г блакитного ліофілізату (73% від теоретичного). Елементний аналіз: Обчислено: С 47,54; Η 4,46; Ν 5,28; S 12,09; Na 6,50 Знайдено: С 47, 97; Η 4,65; Ν 5,10; S 12,02; Na 6,68 Приклад 11: Тринатрій 3,3-диметил-2-(7-[3.,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл1-4-(5-{[6-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-гексил]карбамоїл}-3-оксапентил)гепта2,4,6-триєн-1-іліден}-1-(2-сульфонатетил)-2,3дигідро-1Н-індол-5-сульфонат, внутрішня сіль (формула XII) Синтез проводять аналогічно до прикладу 1д з 0,5г (0,55 ммол) сполуки, названої в заголовку прикладу 10в, і 0,23г (0,75ммол) N-(6аміногексил)малеімід-трифторацетату. Вихід: 0,42г блакитного ліофілізату (68% від теоретичного). Елементний аналіз: Обчислено: С 49,46; Η 4,96; Ν 5,01; S 11,48; Na 6,17 Знайдено: С 48,95; Η 5,21; Ν 5,22; S 11,23; Na 6,60 Приклад 12: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонат-1-(2-сульфонатетил)-3Ніндоліум-2-іл]-4-(5-{[13-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-4,7,10-триоксатридецил]карбамоїл}-4оксапентил)гепта-2,4,6-триєн-1-іліден}-1-(2сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль (формула XIII) 82684 28 Синтез проводять аналогічно до прикладу 1д з 0,5г (0,55ммол) сполуки, названої в заголовку прикладу 10в, і 0,46г (1,06ммол) N-(13-аміно-4,7,10триоксатридецил)малеімід-трифторацетату. Вихід: 0,34г блакитного ліофілізату (56% від теоретичного). Елементний аналіз: Обчислено: С 49,17; Н 5,20; N 4,59; S 10,50; Na 5,65 Знайдено: С 49,34; Н 5,32; N 4,45; S 10,28; Na 5,56 Приклад 13: Тринатрій 3,3-диметил-2-[2-(1{[3,3-диметил-5-сульфонат-1-(2-сульфонатетил)3Н-індоліум-2-іл]-вінілен}-2-[4-(2-{[2-(2,5-діоксо-2,5дигідро-1Н-пірол-1-іл)етил]карбамоїл}етил)фенокси]циклогекс-1-ен-3-іліден)етіліден]-1-(2сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль (формула XIV) а) Три натрій 3,3-диметил-2-[2-(1{[3,3-диметил5-сульфонат-1-(2-сульфонатетил)-3Н-індоліум-2іл]вінілен}-2-хлорциклогекс-1-ен-3-іліден)етіліден]1-(2-сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль 5,0г (14,4ммол) 1-(2-сульфонатоетил)-2,3,3триметил-3Н-індоленін-5-сульфокислота (приклад 1а) і 2,6г (7,2ммол) N-[(3-(анілінометилен)-2-хлор1-циклогексен-1-іл)метилєн]анілін гідрохлориду (Aldrich Company) нагрівають зі зворотним холодильником разом з 2,5г (30ммол) безводного ацетату натрію в 100мл метанолу протягом 1год., охолоджують, змішують із 150мл діетилового ефіру й перемішують протягом ночі. Осад відсмоктують, висушують й очищають за допомогою хроматографії (силікагель, градієнт: дихлорметан/метанол). Вихід: 3,8г блакитної твердої речовини (58% від теоретичного). б) Тринатрій 3,3-диметил-2-[2-(1-{[3,3диметил-5-сульфонато-1-(2-сульфонатоетил)-3Ніндоліум-2-іл]-вінілен}-2-[4-(2карбоксіетил)фенокси]циклогекс-1-ен-3іліден)етіліден]-1-(2-сульфонатоетил)2,3-дигідро1Н-індол-5-сульфонат, внутрішня сіль 0,37г (2,2ммол) 3-(4-Гідроксифеніл)пропіонової кислоти в 30мл ДМФ змішують із 0,18г (4,5ммол) гідриду натрію (60%-на мінеральна дисперсія). Після перемішування при кімнатній температурі протягом 30хв суміш охолоджують до 0°С, додають по краплях розчин 2,0г (2,2ммол) названої в заголовку прикладу 12а сполуки в 100мл ДМФ і перемішують протягом 2год при кімнатній температурі. Суміш гасять сухим льодом і розчинник видаляють у вакуумі. Залишок розчиняють у метанолі, перемішують із 200мл ефіру й твердий осад відфільтровують. Проводять хроматографічне очищення (силікагель, градієнт: етилаце 29 тат/метанол). Вихід: 1,9г блакитної твердої речовини (83% від теоретичного). в) Тринатрій 3,3-диметил-2-[2-(1-{[3,3-диметил5-сульфонат-1-(2-сульфонатетил)-ЗН-індоліум-2іл1-вінілен}-2-[4-(2-{[2-(2,5-діоксо-2,5-дигідро-1Hпірол-1-іл)етил1карбамоїл}етил)фенокси]циклогекс-1-ен-3-іліден)етіліден1-1-(2сульфонатетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль 0,1мг (0,10ммол) названої в заголовку прикладу 12б сполуки вводять у реакцію з TBTU й N-(2аміноетил)малеімід-трифторацетатом у присутності триетиламіну й отриманий продукт очищають хроматографічно. Вихід: 93мг блакитного ліофілізату (81% від теоретичного). Елементний аналіз: Обчислено: С 51,21; Н 4,47; N 4,88; S 11,16; Na 6,00 Знайдено: С 51,50; Н 4,55; N 4,95; S 10,93; Na 6,15 Приклад 14: Тринатрій 3,3-диметил-2-[2-(1{[3,3-диметил-5-сульфонат-1-(2-сульфонатетил)3Н-індоліум-2-іл]-вінілен)-2-[4-(2-{[6-(2,5-діоксо-2,5дигідро-1Н-пірол-1-іл)гексил]карбамоїл}етил)фенокси]циклогекс-1-ен-3-іліден)етіліден1-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль (формула XV) Синтез проводять аналогічно до прикладу 1д з 0,7г (0,68ммол) сполуки, названої в заголовку прикладу 14а, і 0,53г (1,22ммол) N-(13-аміно-4,7,10триоксатридецил)малеімід-трифторацетату. Вихід: 0,56г блакитного ліофілізату (68% від теоретичного). Елементний аналіз: Обчислено: С 48,27; Н 4,53; N 5,36; S 12,27; Na 6,60 Знайдено: С 48,01; Н 4,44; N 5,56; S 12,10; Na 6,81 Приклад 15: Тринатрій 3,3-диметил-2-[2-(1{[3,3-диметил -5-сульфонат-1-(2-сульфонатоетил)3Н-індоліум-2-іл]вінілен}-2-[4-(2-{[13-(2,5-діоксо2,5-дигідро-1Н-пірол-1-іл)-4,7,10триоксатридецил]карбамоїл}етил)фенікси]циклогекс-1-ен-3іліден)етіліден]-1-(2-сульфонатоетил)-2,3-дигідро1H-індол-5-сульфонат, внутрішня сіль (формула XVI) 82684 30 Синтез проводять аналогічно до прикладу 1д з 0,7г (0,68ммол) сполуки, названої в заголовку прикладу 14а, і 0,59г (1,36ммол) N-(13-аміно-4,7,10триоксатридецил)малеімід-трифторацетату. Проводять два хроматографічних очищення. Вихід: 0,67г блакитного ліофілізату (75% від теоретичного). Елементний аналіз: Обчислено: С 52,29; Н 5,16; N 4,28; S 9,79; Na 5,27 Знайдено: С 51,88; Н 5,40; N 4,34; S 9,53; Na 5,68 Приклад 16: Тринатрій 3,3-диметил-2-[2-(1{[3,3-диметил-5-сульфонат-1-(2-сульфонатоетил)ЗН-індоліум-2-іл1вінілен}-2-[4-(2-([2-(2,5-діоксо-2,5дигідро-1H-пірол-1-іл)етил]карбамоїл}етил)фенокси]-5-трет.-бутилциклогекс-1-ен-3-іліден)етіліден]-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль (формула XVII) а) N-[(3-(Анілінометилен)-2-хлор-5-трет.-бутил1-циклогексен-1-іл)метилен]анілін гідрохлорид 6,7мл (73,4ммол) оксихлориду фосфору додають по краплях при 0°С до 8мл ДМФ. Потім додають по краплях розчин 5,0г (32,4 ммол) 4-трет.бутилциклогексанону в 30мл дихлорметану, і реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом 3год. Після охолодження до 0°С, повільно по краплях додають 6г (64,8ммол) аніліну в 5,5мл етанолу, суміш переносять в 200г льоду й при перемішуванні додають 5мл конц. хлористовододневої кислоти. Тверду речовину, яка випала в осад, відфільтровують, промивають ефіром і висушують. Вихід: 6,8г (50% від теоретичного) червоної твердої речовини. б) Тринатрій 3,3-диметил-2-[2-(1-{[3,3диметил-5-сульфонат-1-(2-сульфонатоетил)-3Ніндоліум-2-іл]вінілен)-2-хлор-5-трет.-бутилциклогекс-1-ен-3-іліден)етіліден]-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль 5,0г (14,4ммол) 1-(2-сульфонатоетил)-2,3,3триметил-3Н-індоленін-5-сульфокислота (приклад 1а) і 3,0г (7,2ммол) N-[(3-(анілінометилен)-2-хлор5-трет.-бутил-1-циклогексен-1-іл)метилен]анілін гідрохлориду (приклад 16а) нагрівають зі зворотним холодильником разом з 2,5г (30ммол) безводного ацетату натрію в 100мл метанолу протягом 1,5год., охолоджують, змішують із 150мл діетилового ефіру й перемішують протягом ночі. Осад відсмоктують, висушують й очищають за допомогою хроматографії (силікагель, градієнт: дихлорметан/метанол). Вихід: 4,7г блакитної твердої речовини (68% від теоретичного). в) Тринатрій 3,3-диметил-2-[2-(1-{[3,3-диметил5-сульфонат-1-(2-сульфонатоетил)-3Н-індоліум-2іл]вінілен}-2[4-(2-карбоксіетил)фенокси1-5-трет. 31 бутил-циклогекс-1-ен-3-іліден)етіліден]-1-(2сульфонатоетил)-2,3-дигідро-1H-індол-5сульфонат, внутрішня сіль Реакцію проводять із 2,0г (2,1ммол) названої в заголовку прикладу 16б сполуки, як описано в прикладі 13б. Вихід: 1,5г (66% від теоретичного). г) Тринатрій 3,3-диметил-2-[2-(1-{[3,3-диметил5-сульфонат-1-(2-сульфонатоетил)-3Н-індоліум-2іл]вінілен}-2-[4-(2-{[2-(2,5-діоксо-2,5-дигідро-1Нпірол-1-іл)-етил]карбамоїл}етил)фенокси]-5-трет.бутил-циклогекс-1-ен-3-іліден)етіліден]-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль Реакцію проводять із 1,0 г (0,92ммол) названої в заголовку прикладу 16 у сполуки, як описано в прикладі 13в. Очищення хроматографічно проводять двічі, використовуючи RP-C18-силікагель, (рухома фаза ацетонитрил/вода). Вихід: 0,24г (22% від теоретичного). Елементний аналіз: Обчислено: С 52,82; Н 4,93; N 4,65; S 10,64; Na 5,72 Знайдено: С 52,23; Н 5,20; N 4,31; S 10,30; Na 6,15 Приклади 17-19: Синтез індотрикарбоціанінових барвників із бромацетиламідними групами Приклад 17: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонато-1-(2-сульфонатоетил)-3Ніндоліум-2-іл]-4-(5-{[6(бромацетиламіно)гексил]карбамоїл|-4оксапентил)гепта-2,4,6-триєн-1-іліден}-1-(2сульфонатоетил)-2,3-дигідро-1H-індол-5сульфонат, внутрішня сіль (формула XIX) а) Тринатрій 3,3-диметил-2-{7-[,3-диметил-5сульфонато-1-(2-сульфонатоетил)-3Н-індоліум-2іл]-4-(5-{(6-аміногексилгексил)карбамоїл}-4оксапентил)гепта-2,4,6-триєн-1-іліден}-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль Синтез проводять аналогічно до прикладу 1д з 0,5г (0,55ммол) названої в заголовку прикладу 10 у сполуки й 0,15г (0,70ммол) N-boc-гександіаміну (Fluka). Реакційний продукт очищають за допомогою хроматографії (RP CIS-хроматографія, градієнт метанол/вода) і після ліофілізації перемішують при охолодженні льодом у суміші 2мл трифтороцтової кислоти/8мл дихлорметану протягом 15хв. Після центрифугування у вакуумі залишок розчи 82684 32 няють у метанолі, осаджують діетиловим ефіром і виділяють. Вихід: 0,26г блакитної твердої речовини (22% від теоретичного). б) Три натрій 3,3-диметил-2-{7-[3,3-диметил-5сульфонато-1-(2-сульфонатоетил)-3Н-індоліум-2іл]-4-(5-{[6-(бромацетиламіно)гексил]карбамоїл}-4оксапентил)гепта-2,4,6-триєн-1-іліден}-1-(2сульфонатоетил)-2,3-дигідро-1Н-індол-5сульфонат, внутрішня сіль 0,26г (0,23ммол) названої в заголовку прикладу 18а сполуки охолоджують в 5мл ДМФ до -20°С, змішують із 28мг (0,28ммол) триетиламіну й розчином 0,10г (0,46ммол) бромацетилброміду в 0,2мл диметилформаміду. Після перемішування протягом 5год. при максимальній температурі 0°С, осаджують додаванням діетилового ефіру й одержують продукт після переосадження із суміші диметилформамід/діетиловий ефір і висушування. Вихід: 0,23г блакитної твердої речовини (86% від теоретичного). Елементний аналіз: Обчислено: С 45,63; Н 4,87; N 4,84; S 11,07; Na 5,96 Знайдено: С 45,13; Н 4,66; N 4,67; S 10,83; Na не визначали Приклад 18: Тринатрій 3,3-диметил-2-{7-[3,3диметил-5-сульфонато-1-(2-сульфонатоетил)-3Ніндоліум-2-іл]-4-(3-{[3(бромацетиламіно)пропіл]карбамоїл}-етил)гепта2,4,6-триєн-1-іліден}|-1-(2-сульфонатоетил)-2,3дигідро-1Н-індол-5-сульфонат, внутрішня сіль (формула XVIII) Синтез проводять із названої в заголовку прикладу 1г сполуки (0,5г; 0,56ммол) і N-bocпропілендіаміну аналогічно до прикладу 17. Вихід за всіма стадіями: 0,22г (37% від теоретичного). Елементний аналіз: Обчислено: С 43,70; Н 4,33; N 5,23; S 11,96; Na 5,96 5 Знайдено: С 43,21; Н 4,14; N 5,53; S 10,89; Na не визначали Приклад 19: Тринатрій 3,3-диметил-2-[2-(1{[3,3-диметил-5-сульфонато-1-(2сульфонатоетил)-3Н-індоліум-2-іл]вінілен-2-(4-{[3(бромацетиламіно)пропіл]карбамоїл}етил)фенокси]циклогекс-1-ен3-3іліден)етіліден]-1-(2-сульфонатоетил)-2,3дигідро-1Н-індол-5-сульфонат, внутрішня сіль (формула XX) Синтез проводять із названої в заголовку прикладу 13б сполуки (0,5г; 0,49ммол) і N-bocпропілендіаміну аналогічно до прикладу 17. Вихід за всіма стадіями: 0,31г (53% від теоретичного). Елементний аналіз: Обчислено: С 47,88; Н 4,52; N 4,65; S 10,65; Na 5,73 Знайдено: С 48,04; Н 4,43; N 4,69; S 10,72; Na 5,84 Приклади 20-23: Синтез кон'югатів з біомолекулами й фотофізична характеристика кон'югатів 33 82684 Приклад 20: Маркірування BSA (альбумін бичачої сироватки) сполуками, названими в заголовках прикладів 1-16 Загальні інструкції: Розчин 5мг (0,074мкмол) BSA (Sigma Company) в 5мл фосфатного буфера (0,1-молярний Na2HPO4/Na2PO4, pH 6,8) змішують у кожному випадку з 0,74мкмол сполук, названих у заголовках прикладів 1-16 (вихідні розчини для розведення 0,5мг/мл в PBS (фізіологічний розчин з фосфатним буфером), і інкубують протягом 30хв при 25°С. Очищення кон'югатів проводять за допомогою гель-хроматографії (колонка: Sephadex G50, діаметр 1,5cм, Pharmacia, елюент: PBS). Приклад 21: Маркірування BSA сполуками, названими в заголовках прикладів 17-19 Загальні інструкції: Розчин 5мг (0,074мкмол) BSA (від фірми Sigma Company) в 5мл фосфатного буфера (0,1-молярний боратний буфер, рН 8,5) змішують у кожному випадку з 1,10мкмол сполук, названих у заголовках прикладів 17-19 (вихідні розчини для розведення 0,5мг/мл в PBS), і інкубують протягом 5год. при 25°С. Очищення кон'югатів проводять за допомогою гель-хроматографії (колонка: Sephadex G50, діаметр 1,5cм, Pharmacia, елюент: PBS). Приклад 22: Маркірування scFv антитіла АР39 (фрагмент одиночного ланцюга) до ED-Bфібронектину сполуками, названими в заголовках прикладів 1-16. АР39 є scFv із С-кінцевим цистеїном й є присутній у вигляді S-S-димеру з молярною масою близько 56,000г/мл (Сurr. Opin. Drug Discov. Devel. 2002 Mar; 5(2): 204-13). При відновленні дисульфідних містків утворюються два мономери з доступними SH-групами (молярна маса 28 000г/мл). Загальні інструкції: 0,3мл розчину АР39 в PBS (концентрація 0,93мг димеру/мл) змішують із 60мкл розчину трис(карбоксіетил)фосфіну (ТСЕР) в PBS (2,8мг/мл) і інкубують в атмосфері азоту протягом 1 год при 25°С. Надлишок ТСЕР відокремлюють за допомогою гель-фільтрації на NAP5 колонці (елюент: PBS). Кількість отриманого АР39-мономера (ОD280нм=1,4), певне за допомогою фотометрії, становить 230-250мкг (об'єми 0,50,6мл). Розчин змішують із 0,03мкмол сполук, названих у заголовках прикладів 1-16, (вихідні розчини для розведення 0,5мг/мл в PBS), і інкубують протягом 30хв при 25°С. Кон'югат очищають за 34 допомогою гель-хроматографії на NAP-5 колонці (елюент: PBS/10% гліцерин). Імунореактивність розчину кон'югата визначають за допомогою афінної хроматографії (ED-B-фібронектин смола) (J. Immunol. Meth., 1999, 231, 239). Імунореактивність отриманих кон'югатів становить >80% (АР39 перед кон'югацією >95%). Приклад 23: Маркірування scFv антитіла АР39 (фрагмент одиночного ланцюга) до ED-Bфібронектину сполуками, названими в заголовках прикладів 17-19 Загальні інструкції: 0,3мл розчину АР39 в PBS (концентрація 0,93мг димеру/мл) змішують із 60 мкл розчину трис(карбоксіетил)фосфіну (ТСЕР) в PBS (2,8мг/мл) і інкубують в атмосфері азоту протягом 1год. при 25°С. Надлишок ТСЕР відокремлюють за допомогою гель-фільтрації на NAP-5 колонці (елюент: 50ммол боратного буфера, рН 8,5). Кількість отриманого АР39-мономера (OD280нм=1,4) визначене за допомогою фотометрії, становить 230-250мкг (об'єми 0,5-0,6мл). Розчин змішують із 0,06мкмол сполук, названих у заголовках прикладів 1-16, (вихідні розчини для розведення 0,5мг/мл в PBS), і інкубують протягом 4год. при 25°С. Кон'югат очищають за допомогою гельхроматографії на NAP-5 колонці (елюант: PBS/10% гліцерин). Імунореактивність розчину кон'югата визначають за допомогою афінної хроматографії (ED-B-фібронектин смола) (J.Immunol. Meth., 1999, 231, 239). Імунореактивність отриманих кон'югатів становить >75% (АР39 перед кон'югацією >95%). Фотофізична характеристика барвник-В8Акон'югатів прикладів 21 й 22 і кон'югатів барвникscFv антитіло прикладів 23 й 24. Ступінь концентрації (молярне співвідношення барвник/антитіло) визначають фотометрично, ґрунтуючись на коефіцієнті екстинкції 75000л мл-1см-1 у короткохвильовому плечі спектральної лінії (близько 690-710нм); абсорбція антитіла (АР39) визначають із OD280нм=1,4; і/або абсорбція білка (BSA) визначають із OD277нм =0,58. Флюоресцентний квантовий вихід визначають за допомогою SPEX fluorolog (залежна від довжини хвилі чутливість калібрується лампою й детектором) відносно індоціанінового зеленого (Q=0,13 у ДМСО, J.Chem. Eng. Data, 1977, 22, 379, Bioconjugate Chem., 2001, 12, 44). Таблиця 2 Властивості кон’югатів відповідно до винаходу Субстанція (біомолекула/зразок сполуки) Kl К2 КЗ К4 К5 К6 К7 Кон'югат з Кон'югат з Кон'югат з Кон'югат з Кон'югат з Кон'югат з Кон'югат з BSA BSA BSA BSA BSA BSA BSA Приклад 20 і сполуки, названої в заголовку прикладу 2 і сполуки, названої в заголовку прикладу 4 і сполуки, названої в заголовку прикладу 5 і сполуки, названої в заголовку прикладу 10 і сполуки, названої в заголовку прикладу 11 і сполуки, названої в заголовку прикладу 13 і сполуки, названої в заголовку прикладу 16 Ступінь Асорбцій концерн ний мактрації симум(nm) 0,5 0,6 0,7 0,5 0,5 0,4 0,4 766 767 765 766 768 772 772 Флюоресцентний максимум(нм) Флюорес центний квантовийвихід 790 792 790 789 790 793 793 0,13 0,16 0,15 Не визначено 0,14 0,11 Не визначено 35 82684 36 Продовження таблиці 2 К8 К9 К10 К11 К12 КІЗ К14 К15 К16 К17 К18 К19 К20 К21 Приклад 21 Кон'югат з BSA і сполуки, названої в заголовку прикладу 17 Приклад 22 Кон'югат з BSA і сполуки, названої в заголовку прикладу 1 Кон'югат з BSA і сполуки, названої в заголовку прикладу 2 Кон'югат з BSA і сполуки, названої в заголовку прикладу 4 Кон'югат з BSA і сполуки, названої в заголовку прикладу 5 Кон'югат з BSA і сполуки, названої в заголовку прикладу 6 Кон'югат з BSA і сполуки, названої в заголовку прикладу 7 Кон'югат з BSA і сполуки, названої в заголовку прикладу 10 Кон'югат з BSA і сполуки, названої в заголовку прикладу 11 Кон'югат з BSA і сполуки, названої в заголовку прикладу 12 Кон'югат з BSA і сполуки, названої в заголовку прикладу 13 Кон'югат з BSA і сполуки, названої в заголовку прикладу 14 Приклад 23 Кон'югат з BSA і сполуки, названої в заголовку прикладу 17 Кон'югат з BSA і сполуки, названої в заголовку прикладу 19 Приклад 24: Візуалізаційні властивості кон'югатів відповідно до винаходу досліджують в умовах in vivo після ін'єкції безшерстої миші, яка має пухлину. Із цією метою кон'югати вводять внутрішньовенно й за концентрацією в ділянці розташування пухлини спостерігають протягом 24год. після введення. Флюоресценцію субстанцій збуджують на ділянці опромінення тварин за допомогою близького інфрачервоного світла з довжиною хвилі 740нм, яке одержують за допомогою діодного лазера (0,5W вихід). Флюоресцентну радіацію виявляють за допомогою посиленої CCD камери, а флюоресцентні зображення зберігають у цифровому виді. Ефективність в умовах in vivo кон'югатів барвників зображена на Фіг.2, заснованому на прикладі. Можна вважати, що будь-який фахівець в галузі техніки без подальшої розробки, використовуючи попередній опис, може використовувати 0,3 768 790 0,15 1,1 1,0 0,8 0,9 1,1 1,0 1,1 ІД 0,9 1,2 1,1 768 767 767 768 769 769 767 767 766 771 772 794 793 792 794 792 792 790 789 790 795 796 0,14 0,12 0,12 0,14 0,10 Не визначено 0,13 0,15 0,11 0,10 0,09 0,7 0,8 767 773 790 794 0,18 0,13 даний винахід у найповнішому ступені. Тому наступні переважні специфічні варіанти слід тлумачити тільки як ілюстративні і як такі, що не лімітують будь-яким шляхом інший обсяг винаходу. Повний опис(и) всіх заявок, патентів і публікацій, процитованих при цьому, включені в даний опис за допомогою посилань. Попередні приклади можуть бути повторені з подібним успіхом при заміні загальних або специфічно описаних регентів або технічних умов за даним винаходом для їх застосування в попередніх прикладах. З наведеного вище опису будь-який фахівець у даній галузі техніки може легко встановити істотні характеристики за даним винаходом й, без відхилення від його сутності й обсягу, може зробити різні зміни й модифікації винаходу, щоб адаптувати його до різних варіантів застосування й умов. Фіг.1 37 Комп’ютерна верстка Н. Лисенко 82684 Підписне 38 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrophilic, reacting in regard to thiol group cyanine dyes, the process for theirs preparation, conjugates of these dyes with biomolecules, the process for theirs preparation, and diagnostic set
Автори англійськоюLicha Kai, Perlitts Kristin
Назва патенту російськоюГидрофильные, реакционные относительно тиол-группы цианиновые красители, способ их получения, их конъюгаты с биомолекулами, способ получения последних и их применение, а также диагностический набор
Автори російськоюЛиха Кай, Перлитц Кристин
МПК / Мітки
МПК: C07D 403/00, G01N 33/58, C09B 23/00, G01N 33/533
Мітки: набір, застосування, тіол-групи, спосіб, ціанінові, останніх, також, відносної, біомолекулами, кон'югати, одержання, діагностичний, барвники, гідрофільні, реакційні
Код посилання
<a href="https://ua.patents.su/19-82684-gidrofilni-reakcijjni-vidnosno-tiol-grupi-cianinovi-barvniki-sposib-kh-oderzhannya-kh-konyugati-z-biomolekulami-sposib-oderzhannya-ostannikh-ta-kh-zastosuvannya-a-takozh-diagnostic.html" target="_blank" rel="follow" title="База патентів України">Гідрофільні, реакційні відносно тіол-групи ціанінові барвники, спосіб їх одержання, їх кон’югати з біомолекулами, спосіб одержання останніх та їх застосування, а також діагностичний набір</a>
Наступний патент: Стабільна водна композиція наталізумабу та спосіб її отримання
Випадковий патент: Заміщені похідні індазолу, активні як інгібітори кінази