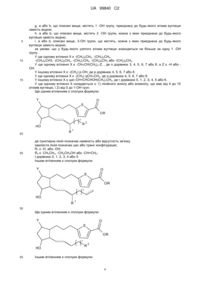
Заміщені циклопентани, що мають простагландинову активність
Формула / Реферат
1. Сполука формули:
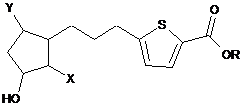 ,
,
де R є Н, або R складається з: 1) С1-6алкілу або фенілу, і 2) від 0 до 2 -ОН-груп;
Y є -Сl, -F, -CN або -CF3; і
X складається з: 1) лінійного алкілу або алкенілу, що має від 4 до 10 атомів вуглецю, і 2) від 0 до 3 -ОН-груп.
2. Сполука за п. 1, де X складається з: 1) лінійного алкілу або алкенілу, що має від 4 до 10 атомів вуглецю, і 2) від 0 до 1 -ОН-груп.
3. Сполука за п. 1 формули:
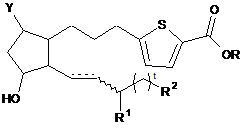 ,
,
де пунктирна лінія позначає наявність або відсутність зв'язку,
хвиляста лінія позначає цис- або транс-конфігурацію;
R1 є -Н або -ОН;
R2 є -СН2СН3, -СН2СН2ОН або -СН=СН2;
t дорівнює 0, 1, 2, 3, 4 або 5.
4. Сполука за п. 3 формули:
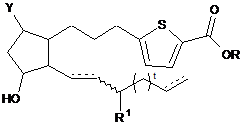 .
.
5. Сполука за п. 3 формули:
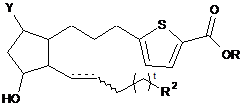 .
.
6. Сполука за п. 3, вибрана з:
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-пентилциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-2-гексил-3-гідроксициклопентил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-2-гептил-3-гідроксициклопентил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-октилциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-нонілциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-(8-гідроксіокт-1-еніл)циклопентил]пропіл}тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-пент-1-енілциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-xлop-2-гeпт-1-eнiл-3-гiдpoкcициклoпeнтил)пропіл]тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-xлop-2-дeк-1-eнiл-3-гiдpoкcициклoпeнтил)пропіл]тіофен-2-карбонової кислоти;
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-(8-гідроксіоктил)циклопентил]пропіл}тіофен-2-карбонової кислоти;
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-(7-гідроксигептил)циклопентил]пропіл}тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідроксі-2-окт-7-енілциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-(7-гідроксигепт-1-еніл)циклопентил]пропіл}тіофен-2-карбонової кислоти;
5-[3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-нон-1-енілциклопентил)пропіл]тіофен-2-карбонової кислоти;
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-((Е)-(R)-3-гідроксіокт-1-еніл)циклопентил]пропіл}тіофен-2-карбонової кислоти і
5-{3-[(1R,2R,3R,5R)-5-хлор-3-гідрокси-2-((E)-(S)-3-гідроксіокт-1-еніл)циклопентил]пропіл}тіофен-2-карбонової кислоти.
7. Сполука за п. 3 формули:
 .
.
8. Спосіб пониження внутрішньоочного тиску, що включає введення сполуки за п. 1 ссавцеві, що потребує такого введення.
9. Застосування сполуки за п. 1 при виробництві лікарського засобу для лікування глаукоми.
10. Офтальмологічно прийнятна рідина, що містить сполуку за п. 1 і офтальмологічно прийнятний ексципієнт.
Текст
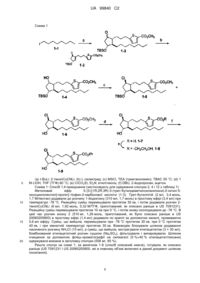
Реферат: У даному документі описані сполуки формули: Y O S OR X HO . Також описані спосіб отримання, лікарські засоби і композиції на основі цих сполук. Y O S OR X HO UA 99840 C2 (12) UA 99840 C2 UA 99840 C2 5 10 15 20 25 30 35 Перехресне посилання Дана заявка на винахід заснована і заявляє пріоритет на підставі попередньої заявки на патент США № 60/986849, поданої 9 листопада 2007 року, і заявки на патент США № 12/265062, поданої 5 листопада 2008 року, які включені в даний документ шляхом посилання. Опис винаходу Очні гіпотензивні агенти застосовують при лікуванні ряду різних очних гіпертензивних станів, таких як постхірургічні і очні гіпертензивні епізоди після лазерної трабекулектомії, глаукоми і як допоміжний засіб до хірургічного втручання. Глаукома є захворюванням ока, що характеризується підвищеним внутрішньоочним тиском. Виходячи з етнології глаукому класифікують як первинну або вторинну. Наприклад, первинна глаукома у дорослих (природжена глаукома) може бути або відкритокутовою, або гострою, або хронічною закритокутовою. Вторинна глаукома походить від вже існуючих очних захворювань, таких як увеїт, внутрішньоочна пухлина або збільшена катаракта. Дійсні причини первинної глаукоми до цих пір невідомі. Підвищений внутрішньоочний тиск виникає через затруднення відтоку внутрішньоочної рідини. При хронічній відкритокутовій глаукомі передня камера ока і її анатомічні структури здаються нормальними, проте, дренаж внутрішньоочної рідини затруднений. При гострій або хронічній відкритокутовій глаукомі передня камера мала, кут фільтрації звужений, а радужка може заважати трабекулярній мережі при вході в канал Шлемма. Розширення зіниці може натискати на корінь радужки спереду проти кута, і може приводити до блокади зіниці, і таким чином, викликати гостру атаку. Очі з вузькими кутами передніх камер схильні до гострих закритокутових атак глаукоми різного ступеня тяжкості. До вторинної глаукоми приводить будь-яке втручання в потік внутрішньоочної рідини із задньої камери в передню камеру і, отже, в канал Шлемма. Запальне захворювання переднього сегменту може перешкоджати виділенню вологи шляхом виникнення повної задньої спайки в бомбірованій радужці, і може закупорювати дренажний канал ексудатом. Іншими звичайними причинами є внутрішньоочні пухлини, збільшені катаракти, закупорка центральної ретинальної вени, травма ока, оперативні процедури і внутрішньоочна кровотеча. Якщо розглядати всі типи разом, глаукома зустрічається приблизно у 2 % всіх людей у віці старше 40 років, і може протікати безсимптомно протягом декількох років до того, як почати прогресувати і привести до швидкої втрати зору. У випадках, коли немає рекомендацій для хірургічного втручання, тоді для лікування глаукоми традиційно застосовують місцеві Радренорецепторні антагоністи. В даний час у продажу є деякі ейкозаноїди і їх похідні для застосування при лікуванні глаукоми. Ейкозаноїди і похідні включають численні біологічно важливі сполуки, такі як простагландини і їх похідні. Простагландини можна описати як похідні простанової кислоти, яка має наступну структурну формулу: 40 45 Відомі різні типи простагландинів, залежно від структури і замінників, присутніх на аліциклічному кільці скелета простаноєвої кислоти. Подальша класифікація заснована на кількості ненасичених зв'язків в бічному ланцюзі, що указується за допомогою числових індексів після родового типу простагландину [наприклад, Е1 (PGE1), простагландин E2 (PGE2)], і на конфігурації замінників в аліциклічному кільці, що указується з допомогою або [наприклад, простагландин F2 (PGF2)]. У даному документі описані сполуки формули: 1 UA 99840 C2 Y O S OR X HO 5 10 15 20 25 30 35 40 45 50 де R є Н, або R складається з: 1) С1-6 алкілу або фенілу, і 2) від 0 до 2 груп -ОН; Y є -СІ, -F, -CN або -CF3; і X складається з: 1) лінійного алкілу або алкенілу, що має від 4 до 10 атомів вуглецю, і 2) від 0 до 3 груп -ОН. Дані сполуки застосовують для пониження внутрішньоочного тиску. Показано, що пониження внутрішньоочного тиску затримує або запобігає проявленню первинної відкритокутової глаукоми, і затримує або запобігає подальшій втраті зору у пацієнтів, страждаючих від первинної відкритокутової глаукоми. Таким чином, дані сполуки також необхідні для лікування глаукоми. Різні типи відповідних лікарських форм і лікарських засобів добре відомі в даній області техніки, і їх можна легко адаптувати для доставки сполук, запропонованих в даному документі. Наприклад, сполуки можна розчинити або суспендувати у водному розчині або емульсії, які утворюють буферний розчин з відповідним значенням рН, і ввести місцево в око ссавця (дивися US 7091231). Для цілей даного опису "лікувати", "лікування" або "процес лікування" відноситься до застосування сполуки, композиції, терапевтично активного агента або ліків при діагнозі, лікуванні, полегшенні, обробці або запобіганні захворюванню або іншому небажаному станові. Якщо не вказано інше, то посилання на сполуки повинне розглядатися широко, включаючи фармацевтично прийнятні солі, проліки, таутомери, альтернативні тверді форми, нековалентні комплекси і їх комбінації хімічного об'єкту зображеної структури або хімічного найменування. Фармацевтично прийнятна сіль є будь-якою сіллю початкової сполуки, яка прийнятна для введення тварині або людині. Термін "фармацевтично прийнятна сіль" також відноситься до будь-якої солі, яка може утворюватися in vivo в результаті введення кислоти або іншої солі, або проліків, які перетворюються на кислоту або сіль. Сіль містить одну або декілька іонних форм сполуки, таких як коньюгірована кислота або основа, пов'язана з одним або більш ніж одним відповідним протиіоном. Солі можуть утворюватися з або включати одну або декілька депротонованих кислотних груп (наприклад, карбонових кислот), одну або декілька протонованих основних груп (наприклад, амінів) або обидві (наприклад, цвітеріони). Проліками є сполуки, які перетворюються на терапевтично активні сполуки після введення. Наприклад, перетворення може відбуватися шляхом гідролізу ефірної групи або якої-небудь іншої біологічно лабільної групи. Приготування проліків добре відоме в даній області техніки. Наприклад, в розділі "Prodrugs and Drug Delivery Systems", ("Проліки і системи доставки ліків") з книги Richard В. Silverman, Organic Chemistry of Drug Design and Drug Action ("Органічна хімія створення ліків і дії ліків") 2d Ed., Elsevier Academic Press: Amsterdam, 2004, p.p. 496-557 запропонована додаткова докладна інформація з даного питання. Зокрема, розглядаються алкілові ефіри, такі як метиловий, етиловий, ізопропіловий і тому подібні. Також розглядаються проліки, що містять полярну групу, таку як гідроксил або морфолін. Приклади таких проліків включають сполуки, що містять угрупування -СО2(СН2)2ОН, і тому подібні. Таутомерами є ізомери, що знаходяться в динамічній рівновазі один з одним. Наприклад, таутомери можуть бути зв'язані за допомогою передачі протона, атома водню або гідрид іона. Якщо стереохімія не позначена ясно і однозначно, передбачається, що структура включає кожен можливий стереоізомер, як в чистому вигляді, так і у вигляді будь-якої можливої суміші. Альтернативними твердими формами є тверді форми, відмінні від тих, які можуть утворюватися в результаті проведення процедур, описаних в даному документі. Наприклад, альтернативні тверді форми можуть бути поліморфами, різними видами аморфних твердих форм, склом і тому подібними. Не ковалентними комплексами є комплекси, які можуть утворюватися між сполукою і одним або декількома додатковими хімічними речовинами, причому такі комплекси не включають ковалентне скріплення між сполукою і додатковими хімічними речовинами. Вони можуть мати, а можуть не мати специфічного співвідношення між сполукою і додатковими хімічними 2 UA 99840 C2 5 10 15 20 речовинами. Приклади можуть включати сольвати, гідрати, комплекси з перенесенням заряду і тому подібні. Алкіл є угрупуванням, що складається з вуглецю і водню і не містить подвійних або потрійних зв'язків. С1-6алкіл є алкілом, що має від 1 до 6 атомів вуглецю. Лінійним алкілом є алкіл, що не має розгалужень або кілець. Алкеніл є функціональною групою, що складається з вуглецю і водню і містить щонайменше один подвійний зв'язок, але що не містить потрійних зв'язків. Лінійний алкеніл є алкеніл, що не має розгалужень або кілець. R є Н, або R складається з: 1) С1-6алкілу або фенілу, і 2) від 0 до 2 -ОН груп. Іншими словами, коли R є Н, тоді сполуки мають структуру, вказану нижче. Альтернативно, R складається з: 1) С1-6 алкілу або фенілу, і 2) від 0 до 2 -ОН угрупувань. Іншими словами, приклади R включають: a. -СН3, -С2Н5, -С3Н7, -С4Н9, -С5Н11, -С6Н13, циклічний-С3Н6, циклічний-С4Н8, циклічний-С5Н10, або циклічний -С6Н12, де "циклічний" позначає присутність кільця; b. -СН2-ОН, -С2Н4-ОН, -С3Н6-ОН, -С4Н8-ОН, -С5Н10-ОН, -С6Н12-ОН, циклічний -С3Н5-ОН, циклічний -С4Н7-ОН, циклічний -С5Н9-ОН, або циклічний -С6Н11ОН, де -ОН може знаходитися в будь-якій позиції у вуглеводневій групі; c. -С2Н3-(ОН)2, -С3Н5-(ОН)2, -С4Н7(ОН)2, -С5Н9-(ОН)2, або С6Н11-(ОН)2, циклічний -С3Н4-(ОН)2, циклічний -С4Н6-(ОН)2, циклічний -С5Н8-(ОН)2 або циклічний -С6Н10-(ВІН)2, де -(OН)2 представляє 2 різних -ОН групи, а кожен -ОН може знаходитися в будь-якій позиції у вуглеводневій групі; або 25 30 35 40 45 d. . Будь-яке перегрупування вуглецю і водню можливе, за умови того, що кожен атом вуглецю має чотири зв'язки (подвійний зв'язок вважається за два зв'язки для кожного вуглецю, створюючого зв'язок, а потрійний зв'язок вважається як 3 зв'язки для кожного вуглецю, створюючого зв'язок), а водень завжди приєднаний тільки до одного атома вуглецю за допомогою одинарного зв'язку. Кожна -ОН приєднана до атома вуглецю, за умови того, що 2 ОН групи не приєднані до одного і того ж атома вуглецю. Таким чином, багато хто з цих груп фактично представляє різноманітність ізомерів. Наприклад, кожен з -С3Н7, -С4Н9, -С5Н11 і -С6Н13 представляє більш ніж один ізомер. Аналогічно, для кожного з присутніх -ОН вводять додатковий номер ізомеру, залежно від того, до якого атома вуглецю даний -ОН приєднаний. Y є -СІ, -F, -CN або -CF3. У одному втіленні Y є -СІ. У іншому втіленні Y є -F. У іншому втіленні Y є -CN. У ще одному втіленні Y є -CF3. X складається з: 1) лінійного алкілу або алкенілу, що має від 4 до 10 атомів вуглецю, і 2) від 0 до 3 -ОН груп. Іншими словами, приклади X включають: e. -(СН2)3СН3, -(СН2)4СН3, -(СН2)5СН3, -(СН2)6СН3, -(СН2)7СН3, -(СН2)8СН3, -(СН2)9СН3; f. лінійні ізомери -С4Н8, -С5Н10, -С6Н12, -С7Н14, -С8Н16, -С8Н18 або -С10Н20, що містять подвійний зв'язок; 3 UA 99840 C2 5 10 15 g. а або b, що описані вище, містять 1 -ОН групу, приєднану до будь-якого атома вуглецю замість водню; h. а або b, що описані вище, містять 2 -ОН групи, кожна з яких приєднана до будь-якого вуглецю замість водню; і. а або b, описані вище, 3-ОН групи, що містять, кожна з яких приєднана до будь-якого вуглецю замість водню; за умови, що у будь-якого узятого атома вуглецю знаходиться не більше за одну 1 -ОН групу. У ще одному втіленні X є -(СН2)3СН3, -(СН2)4СН3, -(СН2)5СН3, -(СН2)6СН3, -(СН2)7СН3, -(СН2)8СН3 або -(СН2)9СН3. У ще одному втіленні X є -CH=CH(CH2)n-Z, , де n дорівнює 3, 4, 5, 6, 7 або 8, a Z є -Н або ОН. У іншому втіленні X є -(СН2) р-ОН, де р дорівнює 4, 5, 6, 7 або 8. У ще одному втіленні X є -(СН2) qCH=CH2, де q дорівнює 4, 5, 6, 7 або 8. У іншому втіленні X є цис-СН=СНСНОН(СН2)rСН3, де r дорівнює 0, 1, 2, З, 4, 5 або 6. У ще одному втіленні X складається з: 1) лінійного алкілу або алкенілу, що має від 4 до 10 атомів вуглецю, і 2) від 0 до 1-ОН груп. Ще одним втіленням є сполуки формули: Y O S OR t R HO R 20 25 2 1 . де пунктирна лінія позначає наявність або відсутність зв'язку хвиляста лінія позначає цис або транс конфігурацію; R1 є -Н, або -ОН; R2 є -СН2СН3, -СН2СН2ОН або -СН=СН2; t дорівнює 0, 1, 2, 3, 4 або 5. Іншим втіленням є сполуки формули: Y O S OR t HO R 1 30 Ще одним втіленням є сполуки формули: Y O S OR t HO 35 R 2 Іншим втіленням є сполуки формули: 4 UA 99840 C2 5 10 15 20 25 30 35 40 45 Далі приведені приклади корисних сполук. 5-[3-((1R,2R,ЗR,5R)-5-хлоро-3-гідрокси-2-пентилциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 1, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-2-гексил-3-гідроксициклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 2, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-2-гептил-3-гідроксициклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 3, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-октилциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 4, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-нонілциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 5, таблиця 1) 5-{3-[(1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-(8-гідроксиокт-1-еніл)-циклопентил]-пропіл}-тіофен2-карбонова кислота (позиція 6, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-пент-1-енілциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 7, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-2-гепт-1-еніл-3-гідроксициклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 8, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-2-дек-1-еніл-3-гідроксициклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 9, таблиця 1) 5-{3-[(1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-(8-гідроксиоктил)-циклопентил]-пропіл}-тіофен-2карбонова кислота (позиція 10, таблиця 1) 5-{3-[(1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-(7-гідроксигептил)-циклопентил]-пропіл}-тіофен-2карбонова кислота (позиція 11, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-окт-7-енілциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 12, таблиця 1) 5-{3-[(1R,2R,3R,5R)-5-хлop-3-гідрокси-2-(7-гідроксигепт-1-еніл)-циклопентил]-пропіл}-тіофен2-карбонова кислота (позиція 13, таблиця 1) 5-[3-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-нон-1-енілциклопентил)-пропіл]-тіофен-2-карбонова кислота (позиція 14, таблиця 1) 5-{3-[(1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-((Е)-(R)-3-гідроксиокт-1-еніл)-циклопентил]-пропіл}тіофен-2-карбонова кислота (позиція 15/16, таблиця 1) 5-{3-[(1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-((Е)-(8)-3-гідроксиокт-1-еніл)-циклопентил]-пропіл}тіофен-2-карбонова кислота (позиція 15/16, таблиця 1) Етил-2-(2-((1R,2R,ЗR,5R)-5-хлор-3-гідрокси-2-октилциклопентил)етилтіо) тіазол-4карбоксилат (6-7, позиція 17, таблиця 1) 5-(3-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-((E)-окт-3-еніл)циклопентил)пропіл)тіофен-2карбонова кислота (7-4, позиція 18, таблиця 1) 5-(3-((1R,2R,ЗR,5R)-5-хлор-2-децил-3-гідроксициклопентил)пропіл)тіофен-2-карбонова кислота (позиція 19, таблиця 1) Наступні приклади направлені тільки на ілюстрацію винаходу, і їх не слід розглядати як такі, що обмежують винахід яким-небудь чином. Приклади Способи синтезу Хоча існує безліч способів одержання розкритих в даному документі сполук, корисні сполуки можуть бути одержані шляхом використання або адаптації наступних ілюстративних способів. 5 UA 99840 C2 Схема 1 5 10 15 20 (a) t-BuLi; 2-тіенілСuСNLі; (b) L-селектрид; (c) MSCI, TEA (триетаноламін); TBAC 55 °C; (d) 1 M LIOH, THF (ТГФ) 60 °C; (e) CICO2Et, Et3N; етилгліколь; (f) DBU, 2-йодопропан, ацетон. Схема 1: Спосіб 1,4-приєднання (застосовують для одержання сполуки 2, 4 і 12 з таблиці 1) Метиловий ефір 5-{3-[(1R,2R,3R)-3-(трет-бутилдиметилсиланілокси)-2-октил-5оксоциклопентил]-пропіл}-тіофен-2-карбонової кислоти (1-3). Трет-бутиллітій (2 мл, 3,4 моль, 1,7 М/пентан) додавали до розчину 1-йодоктану (310 мл, 1,7 моль) в простому ефірі (3,4 мл) при температурі -78 °C. Реакційну суміш перемішували протягом 30 хв, і потім додавали розчин 2тіенілCuCNLi (6 мл, 1,92 моль, 0,32 М/ТГФ, приготований, як описано раніше в US 7091231). Реакційну суміш перемішували протягом 10 хв при 0 °C, і потім знову охолоджували до -78 °C. В цей час розчин енону 2 (510 мг, 1,29 моль, приготований, як було описано раніше в US 20060205800) в простому ефірі (1,4 мл) додавали по краплі за допомогою канюлі, промиваючи 0,6 мл ефіру. Суміш, що вийшла, перемішували при -78 °C протягом 30 хв, при 0 °C протягом 40 хв, і при кімнатній температурі протягом 30 хв. Взаємодію блокували шляхом додавання насиченого розчину NH4CI (15 мл), а суміш, що вийшла, екстрагували етилацетатом (3 × 30 мл). Комбінований етилацетатний розчин сушили (Na2SO4), фільтрували і випаровували. Шляхом очищення за допомогою флеш-хроматографії на силікагелі (0 %>40 % етилацетат/гексани) одержували вказане в заголовку сполуки (558 мг, 85 %). Решта сполук на схемі 1, за винятком 1-8 (спосіб описаний нижче), готували, як описано раніше (US 7091231 і US 20060205800, які в повному об'ємі включені в даний документ шляхом посилання). 6 UA 99840 C2 5 2-Гідроксиетиловий ефір 5-[3-((1R,2R,3R,5R)-5-хлop-3-гідрокси-2-октилциклопентил)-пропіл]тіофен-2-карбонової кислоти (1-8). Розчин етилхлорформіату в СН2СІ2 (0,5 мл розчину 8 мкл/мл, 0,04 моль) додавали до 1-7 (14 мг, 0,035 моль). Додавали триетиламін (40 мкл, 0,29 моль), а через 1 год. додавали етилгліколь (100 мкл, 1,79 моль). Реакційну суміш залишали перемішуватися протягом 3 днів, і потім додавали 1М НСІ (4 мл). Суміш, що вийшла, екстрагували СН2СІ2 (3 × 20 мл), і комбінований розчин СН2СІ2 промивали розсолом (20 мл), сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення залишку за допомогою флешхроматографії на силікагелі (0 %>15 % метанол/СН2СІ2) одержували вказане в заголовку сполуки (5 мг, 32 %) разом з 1-7 (8 мг, 57 %). 10 Схема 2 (THP - 2,3 дигідропіран) 15 20 25 (а) дигідропіран, РРТ (піридиний пара-толуолсульфонат), СН2СІ2; (b) Рh3Р 120 °C. Схема 2: (Солі фосфонію, використовувані в синтезі Віттіга сполук 6, 10, 11,13). 2-(7-бромогептілокси)-тетрагідропіран (2-2, n = 7). Дігідропіран (1 мл, 11,0 моль) і паратолуолсульфонат піридинію (148 мг, 0,59 моль) додавали до розчину 7-бром-1-гептанола (1,1 г, 5,64 моль) в СН2СІ2 (22 мл). Після перемішування протягом ночі розчин промивали 1М НСІ (20 мл), насиченим розчином NaHCO3 (20 мл) і розсолом (20 мл). Розчин сушили (Na2SO4), фільтрували і упарювали. Залишок очищали за допомогою флеш-хроматографії на силікагелі (0 %>50 % етилацетат/гексані) з одержанням вказаної в заголовку сполуки (1,8 г, >100 %). Бромід трифеніл (7-(тетрагідро-2Н-піран-2-ілокси) гептилу) фосфонію (2-3, n = 7). Суміш 2-2 (1,8 г, 30 % метанол/СН2Сl2) з одержанням вказаної в заголовку сполуки (1,174 г, 2,17 моль, 38 % з 7-бром-1-гептанолу). Схема3 30 7 UA 99840 C2 + 5 10 15 20 25 30 35 (a) RCH2PPh3 X-, KOtBu (терт-бутил), THF (ТГФ); (b) H2, Pd/C; (c) PPT, МЕОН; (d) 1M LIOH, ТГФ 60 °C. Схема 3: Синтез Віттіга (використовуваний для одержання сполук 1, 3, 5, 6, 7, 8, 9, 10, 11, 13, 14, 19 [таблиця 1]). Метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-xлop-2-нон-1-еніл-3-(тетрагідро-піран-2-ілокси)циклопентил]-пропіл}-тіофен-2-карбонової кислоти (3-2, R= (СН2)6СН3). Бромід октилтрифенілфосфонію (454 мг, 1,0 моль, Alfa Aesar) сушили у вакуумі (0,4 мБар) протягом 3 діб. Висушену сіль суспендували в 3 мл ТГФ, і додавали розчин трет-ВuOK (900 мкл, 0,9 моль, 1 М/ТГФ). Червоно-оранжевий розчин, що виходить в результаті, перемішували протягом 45 хв і потім розчин альдегіду 3-1 (111 мг, 0,27 моль, попередня заявка на патент США № 60/947,904, подана 3 липня 2007 року) в 1 мл ТГФ додавали за допомогою канюлі, промивали 1 мл ТГФ. Реакційну суміш залишали перемішуватися протягом 1,5 год. і потім реакції зупиняли шляхом додавання 5 мл насиченого розчину NH4CI. Суміш екстрагували етилацетатом (3 × 20 мл), і об'єднаний органічний розчин сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення за допомогою флеш-хроматографії на силікагелі (0 %>50 % етилацетат/гексани) одержували 101 мг (74 %) вказаної в заголовку сполуки. Метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-хлop-2-гептил-3-(тетрагідро-піран-2-ілокси)циклопентил]-пропіл}-тіофен-2-карбонової кислоти (3-3, R=-(СН2)4(СН3). Pd/C (17 мг, 10 %) додавали до розчину 3-2 (R=(CH2)4CH3) 20 мг, 0,04 моль) в метанолі (2 мл). Реакційну суміш поміщали в 1 атм. Н2 (балон) і через 5 год. фільтрували через целіт і упарювали. Взаємодія була не повною, і таким чином було піддано дії умов реакції (17 мг Pd/C і 2 мл метанолу). Після перемішування протягом ночі суміш фільтрували через целіт і упарювали. Залишок очищали за допомогою флеш-хроматографії на силікагелі (0 %>50 % етилацетат/гексани) з одержанням вказаної в заголовку сполуки (25 мг, >100 %). Метиловий ефір 5-[3-((1R,2R,3R,5R)-5хлop-2-гептил-3-гідрокси-циклопентил)-пропіл]-тіофен2-карбонової кислоти (3-4, R =-(СН2)4СН3). РРТ (піридиний пара-толуолсульфонат) (8 мг, 0,032 моль) додавали до метанольного (1 мл) розчину 3-3 (R =-(СН2)4СНз, 25 мг, 0,051 моль). Розчин перемішували при 40 °C протягом ночі і потім упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (0 %>50 % етилацетат/гексани) одержували вказані в заголовку сполуки (18 мг, 87 %). 5-[3-((1R,2R,3R,5R)-5-хлор-2-гептил-3-гідрокси-циклопентил) -пропіл]-тіофен-2-карбонова кислота (3-5, R=-(CH2)4CH3). Використовували раніше описаний спосіб з LIOH (US 20060205800). Схема 4 8 UA 99840 C2 5 10 15 20 25 30 35 (а) 4-2, NAH, ТГФ; (b) NaBH4, МЕОН; (с) РРТ, МЕОН; окремі діастереоізомери; (d) 1M LIOH, ТГФ 60 °C. Метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-хлop-2-((E)-3-oксо-окт-1-еніл)-3-(тетрагідро-піран-2ілокси)-циклопентил]-пропіл}-тіофен-2-карбонової кислоти (4-3). Розчин фосфонату 4-2 (40 мкл, 0,19 моль) в 2,2 мл ТГФ додавали до охолодженої льодом суміші NAH (9 мг, 0,23 моль, 60 %/масло) в 1,6 мл ТГФ за допомогою канюлі. Суміш залишали нагріватися до кімнатної температури, і через 1 год. повторно охолоджували до 0 °C. У цей момент за допомогою канюлі додавали розчин альдегіду 3-1 (80 мг, 0,19 моль) в 0,6 мл ТГФ, промиваючи 0,6 мл ТГФ. Реакційну суміш залишали нагріватися до кімнатної температури, і після перемішування протягом ночі реакцію зупиняли шляхом додавання 10 мл насиченого розчину NH4CI. Суміш, що виходить в результаті, екстрагували етилацетатом (3 × 25 мл), і об'єднаний розчин етилацетату сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення за допомогою флеш-хроматографії на силікагелі (0 %→100 % етилацетат/гексани) одержували вказану в заголовку сполуку (59 мг, 60 %). Метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-хлop-2-((E)-3-гідрокси-окт-1-еніл)-3-(тетрагідро-піран2-ілокси)-циклопентил]-пропіл}-тіофен-2-карбонової кислоти (4-4). NaBH4 (9,2 мг, 0,24 моль) додавали до розчину кетону 4-3 (59 мг, 0,12 моль) в метанолі (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом 2 год., а потім зупиняли шляхом додавання 5 мл 1 М НСІ. Суміш, що виходить в результаті, екстрагували СН2СІ2, і об'єднаний розчин СН2СІ2 сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення за допомогою флешхроматографії на силікагелі (етилацетат/гексани) одержували вказану в заголовку сполуку (48 мг, 80 %). Метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-хлop-3-гідрокси-2-((E)-(S)-3-гідрокси-окт-1-еніл)циклопентил]-пропіл}-тіофен-2-карбонової кислоти і метиловий ефір 5-{3-[(1R,2R,3R,5R)-5-хлop3-гідрокси-2-((E)-(R)-3-гідрокси-окт-1-еніл)-циклопентил]-пропіл}-тіофен-2-карбонової кислоти (45). Використовували спосіб з РРТ/метанол, описаний для схеми 3. Шляхом очищення неочищеного продукту за допомогою флеш-хроматографії на силікагелі (0 %>100 % етилацетат/гексани) одержували індивідуальні діастереоізомери: (вищий Rf, 17 мг, 41 %) і (менший Rf, 17 мг, 41 %). 5-{3-[(1R,2R,3R,5R)-5-хлop-3-гідрокси-2-((E)-(S)-3-гідрокси-окт-1-еніл)-циклопентил]-пропіл}тіофен-2-карбонова кислота і 5-{3-[(1R,2R,3R,5R)-5-xлop-3-гiдpoкcи-2-((E)-(R)-3-гiдpoкcи-oкт-1eнiл)-циклoпeнтил]-пpoпiл}-тioфeн-2-карбонова кислота (4-6). Індивідуальні діастереоізомери гідролізували до відповідних кислот (61 % для діастереоізомера з вищим Rf і 81 % для діастереоізомера з меншим Rf) з використанням раніше описаного способу з LIOH (US 20060205800). Схема 5 40 45 (а) трет-BuOK, ТГФ; (b) H2, Pd/C, МЕОН; (с) дигідропіран, РРТ, СН2СІ2 (3аR,4R,5R,6аS)-5-(третбутилдиметилсилілокси)-4-(окт-1-еніл)гексагідро-2Нциклопента[b]фуран-2-он (5-2). Бромід н-гептилфосфонію (3,185 г, 7,22 моль) сушили у вакуумі протягом 3 діб, і потім суспендували в безводному ТГФ (22 мл). Додавали трет-бутоксид калію (7,2 мл, 7,2 моль, 1М/ТГФ), і червоно-оранжевий розчин, що виходить в результаті, перемішували протягом 45 хв при кімнатній температурі. Розчин (3аR,4R,5R,6аS)-5-(трет 9 UA 99840 C2 5 10 15 20 25 30 35 бутилдиметилсилілокси)-2-оксогексагідро-2Н-циклопента[b]фуран-4-карбальдегіду (5-1, 502 мг, 1,78 моль, Cayman) в 7 мл ТГФ додавали за допомогою канюлі, промивали 3 мл ТГФ. Через 1,5 год. реакцію зупиняли шляхом додавання насиченого розчину NH 4CI. Суміш, що виходить в результаті, екстрагували етилацетатом (3×), і об'єднаний етилацетатний розчин сушили (Na2SO4) фільтрували і упарювали. Шляхом очищення залишку за допомогою флешхроматографії на силікагелі (система Isco Combiflash) одержували вказане в заголовку сполуки (595 мг, 91 %). (3аR,4R,5R,6аS)-5-гідрокси-4-октилгексагідро-2Н-циклопента[b]фуран-2-он (5-3). Суміш 5-2 (595 мг, 1,62 моль) і 5 % Pd/C (556 мг, 0,17 моль) в метанолі (80 мл) перемішували при тиску 1 атм. Н2 (балон) протягом ночі. Суміш потім фільтрували через целіт, і фільтрат упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (система Isco Combiflash) одержували вказану в заголовку сполуку (396 мг, 96 %). (3аR,4R,5R,6аS)-4-октил-5-(тетрагідро-2Н-піран-2-ілокси)гексагідро-2Н-циклопента[b]фуран2-он (5-4). Дігідропіран (60 мкл, 0,66 моль) і РРТ (11 мг, 0,045 моль) додавали до розчину 5-3 (81 мг, 0,32 моль) в дихлорметані (1,2 мл). Після перемішування протягом ночі реакційну суміш промивали 1М НСІ, насиченим розчином NaНСО 3 і розсолом. Органічний шар сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (система Isco Combiflash) одержували вказану в заголовку сполуку (100 мг, 93 %). Схема 6 (a) LiAIH4, THF 0 °C; (b) MsCI (мезилхлорид), Et3N, CH2CI2; (c) KSAc, ДМФ; (d) PBu3, K2CO3, ЕtOН 40 °C; (e) Bu4NCI, толуол 55 °C; (f) PPT, MEOH 40 °C; (g) 1M LIOH, ТГФ. (1S,2R,3R,4R)-2-(2-гідроксиетил)-3-октил-4-(тетрагідро-2Н-піран-2-ілокси)циклопентанол (61). Розчин LiAIH4 (1,5 мл, 1,5 моль, 1М/ТГФ) додавали при 0 °C до розчину 5-4 (453 мгм, 1,34 моль) в ТГФ (5 мл). Через 3 год. по краплях додавали Н2О (5 мл), а потім дихлорметан і 15 % NaOH (10 мл). Реакційну суміш залишали нагріватися до кімнатної температури і додатково перемішували протягом 30 хв. Суміш, що виходить в результаті, екстрагували дихлорметаном (3х), і об'єднаний дихлорметановий розчин сушили (Na 2SO4), фільтрували і упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (система Isco Combiflash) одержували вказану в заголовку сполуку (447 мг, 97 %). 2-((1R,2R,3R,5S)-5-(метилсульфонілокси)-2-октил-3-(тетрагідро-2Н-піран-2ілокси)циклопентил)етил метансульфонат (6-2). MsCI (0,60 мл, 7,72 моль) додавали до охолодженого на льоду розчину 6-1 (447 мг, 1,31 моль) і Et3N (1,3 мл, 9,33 моль) в дихлорметані (5 мл). Реакційну суміш залишали нагріватися до кімнатної температури, і через 3 год. додавали насичений розчин NaHCО3. Суміш, що виходить в результаті, екстрагували дихлорметаном (3х), і об'єднаний дихлорметановий розчин сушили (Na2SO4 фільтрували і упарювали. Шляхом 10 UA 99840 C2 5 10 15 20 25 30 очищення залишку за допомогою флеш-хроматографії на силікагелі (система Combiflash від Isco) одержували вказану в заголовку сполуку (326 мг, 50 %). S-2-((1R,2R,3R,5S)-5-(метилсульфонілокси)-2-октил-3-(тетрагідро-2Н-піран-2ілокси)циклопентил) етил етантіоат (6-3). KSAc (115 мг, 1,01 моль) додавали до розчину 6-2 (326 мг, 0,65 моль) в 8 мл ДМФ. Реакційну суміш залишали перемішуватися протягом ночі, і потім додавали 20 мл H2O. Суміш, що виходить в результаті, екстрагували етилацетатом (3 × 20 мл), і об'єднаний розчин етилацетату промивали Н2О (3 × 60 мл) і розсолом (50 мл). Розчин потім сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення за допомогою флешхроматографії на силікагелі (система Combiflash від Isco) одержували вказану в заголовку сполуку (183 мг, 58 %). Етил 2-(2-((1R,2R,3R,5S)-5-(метилсульфонілокси)-2-октил-3-(тетрагідро-2Н-піран-2ілокси)циклопентил)етилтіо) тіазолу-4-карбоксилат (6-4). Рbu3 (20 мкл, 0,08 моль), Етил 2бромтіазол-4-карбоксилат (6-5, 119 мг, 0,50 моль) і К2СО3 (107 мг, 0,77 моль) додавали до розчину 6-3 (183 мг, 0,38 моль) в 1,6 мл етанолу. Суміш перемішували при 40 °C протягом ночі, і потім додавали 20 мл Н2О. Суміш, що виходить в результаті, екстрагували етилацетатом (30 мл), і етилацетатний розчин промивали розсолом (20 мл). Розчин потім сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (система Combiflash від Isco) одержували вказану в заголовку сполуку (41 мг, 18 %). Етил 2-(2-((1R,2R,3R,5R)-5-хлор-2-октил-3-(тетрагідро-2Н-піран-2-ілокси)циклопентил) етилтіо) тіазолу-4-карбоксилат (6-6). Суміш 6-4 (41 мг, 0,069 моль) і хлориду тетра-нбутиламонію (200 мг, 0,72 моль) в 1 мл толуолу перемішували при 55 °C протягом ночі. Суміш залишали охолоджуватися до кімнатної температури і фільтрували через целіт, промивали етилацетатом. Фільтрат упарювали, і залишок очищали за допомогою флеш-хроматографії на силікагелі (система Isco Combiflash) з одержанням вказаної в заголовку сполуки (24 мг, 65 %). Етил 2-(2-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-октилциклопентил) етилтіо) тіазолу-4карбоксилат (6-7). Використовували спосіб, аналогічний описаному для сполуки 3-4, починаючи з 24 мг 6-6 і з одержанням (13 мг, 67 %) 6-7. 2-(2-((1R,2R,3R,5R)-5-хлор-3-гідрокси-2-октилциклопентил)етилтіо)тіазол-4-карбонова кислота (6-8). Використовували раніше описаний спосіб з LIOH (US 7091231), починаючи з 13 мг 6-7 і з одержанням 6-8 (13 мг, 100 %). Схема 7 35 40 45 50 (аLіАІН4, ТГФ; (b) Рh3Р, I2, імідазол, СН2СІ2 (Е)-окт-3-ен-1-ол (7-2). LіАІН4 (13,5 мл, 13,5 моль, 1 М/ТГФ) додавали до охолодженого на льоду розчину (Е)-окт-3-енової кислоти (7-1, 1,86 г, 13,1 моль) в ТГФ (48 мл). Реакційну суміш залишали нагріватися до кімнатної температури і через 2 год. охолоджували в крижаній лазні, і поволі додавали 50 мл Н2О. Додавали NaOH (3М, 50 мл) і Н2О (50 мл), і суміш, що виходить в результаті, екстрагували дихлорметаном (3 × 100 мл). Об'єднаний органічний шар промивали розсолом (100 мл) і потім сушили (Na2SO4), фільтрували і упарювали. Шляхом очищення залишку за допомогою флеш-хроматографії на силікагелі (система Isco Combiflash) одержували вказану в заголовку сполуку (1,283 г, 76 %). (Е)-1-йодокт-3-ен (7-3). Суміш Рh3Р (3,205 г, 12,2 моль), імідазолу (1,221 г, 17,9 моль), і I2 (3,024 г, 11,9 моль) в СН2СІ2 (38 мл) перемішували при кімнатній температурі. Через 15 хв розчин 7-2 (1,283 г, 10,0 моль) в СН2СІ2 (4,8 мл) додавали за допомогою канюлі, промиваючи 4 мл СН2СІ2. Через 3 год. суміш фільтрували через основний оксид алюмінію, промиваючи 10 % етилацетат/гексани. Фільтрат упарювали, і залишок очищали за допомогою флешхроматографії на силікагелі (система Isco Combiflash) з одержанням вказаної в заголовку сполуки (2,323 г, 98 %). 11 UA 99840 C2 5 5-(3-((1R,2R,3R,5R)-5-хлop-3-гідрокси-2-((E)-OKT-3-еніл)циклопентил)пропіл)тіофен-2карбонова кислота (7-4). Вказану в заголовку сполуку одержували, як описано для 1-7 на схемі 1. Приклади in vitro У заявці на патент США No. 11/553143, поданою 26 жовтня 2006 року, включеною в даний документ шляхом посилання, описані способи одержання даних in vitro в нижче приведеній Таблиці 1. Таблиця 1 ЕР2 Позиція 1 2 3 Структура Інші рецептори ЕР4 2+ 2+ цАМФ Константа Са Са Константа ЕС50 інгібування ЕС50 ЕС50 інгібування (нМ) Кі (нМ) (нМ) (нМ) Кі (нМ) 1 6 0,7 4 2 3 74 405 67 9099 9380 7508 2+ Са ЕС50 (нМ) НА DP(2084), EP3(1742), ТР(187) НА: EP1, FP, IP 754 EP3(5994), DP(1781), ТР(2986) НА: EP1, FP, P 330 DP(2246), EP1(3391), EP3(6658), FP (10К), ІР (>10К) ТР (10К) 4 0,4 0,5 11 11437 395 ЕР1(18214),Е Р3(9526), DP(6768) НА: FP, IP, TP 5 3 1,5 21 >10K 1225 ЕР3(6661) НА: EP1, DP, FP, IP, ТР НА ЕР1(>10К), DP(1003) НА: EP3, FP, IP, TP НА DP(573), EP3(1158), ТР(249) HA: EP1, FP, IP 6 7 14 37 55 60 10 12 531 303 14784 UA 99840 C2 Продовження таблиці 1 ЕР2 Позиція 8 Структура Інші рецептори ЕР4 2+ 2+ цАМФ Константа Са Са Константа ЕС50 інгібування ЕС50 ЕС50 інгібування (нМ) Кі (нМ) (нМ) (нМ) Кі (нМ) 8 14 112 9100 9 15 18 512 34171 10 10K 0,2 ЕС50 (нМ) 186 EP3(544), DP(337), ТР(230), HA:EP1, FP, IP 695 DP(10544) НА: EP1, EP3, FP, I P, TP >10K DP(7732), EP1(86), EP3(421) Ha: fp, ip, tp 1421 DP(842), EP1(456), EP3(329), IP(9655), ТР(1067)
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted cyclopentanes having prostaglanding activity
Автори англійськоюDonde, Yariv, Nguyen, Jeremiah, H., Burk, Robert, M.
Назва патенту російськоюЗамещенные циклопентаны, которые имеют простагландиновую активность
Автори російськоюДонде Ярив, Нгюен Джеремиа Х., Бурк Роберт М.
МПК / Мітки
МПК: A61P 27/06, C07D 263/34, A61K 31/381, C07D 333/40
Мітки: простагландинову, активність, заміщені, циклопентани, мають
Код посилання
<a href="https://ua.patents.su/19-99840-zamishheni-ciklopentani-shho-mayut-prostaglandinovu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Заміщені циклопентани, що мають простагландинову активність</a>
Попередній патент: Бензодіазепінонові сполуки, застосовні в лікуванні шкірних станів
Наступний патент: Перевага точок доступу при бездротовому зв’язку
Випадковий патент: Прес напівсухого пресування