Бензодіазепінонові сполуки, застосовні в лікуванні шкірних станів
Формула / Реферат
1. Сполука, представлена формулою І:
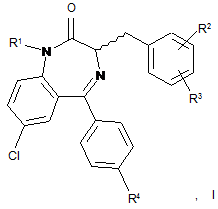
що включає її солі, складні ефіри та проліки, де
R1 являє собою Η або С1-6алкіл;
R2 являє собою Η або С1-6алкіл;
R3 являє собою С1-6алкіл;
R4 являє собою гідроксил або фтор;
стереохімічна конфігурація в стереоцентрі в сполуці, представленій формулою І, являє собою R, S або їхню суміш; і якщо тільки згадана сполука не являє собою
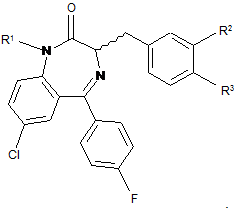
2. Сполука за п. 1, де R4 являє собою фтор.
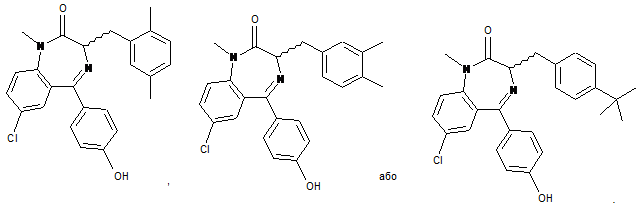
3. Сполука за п. 1, що має структуру:
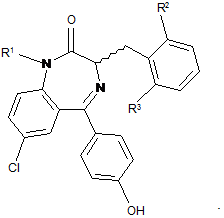
4. Сполука за п. 1, де R4 являє собою гідроксил.
5. Сполука за п. 1, що має структуру:
6. Сполука за п. 1, що має структуру:
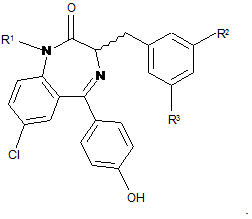
7. Сполука за будь-яким одним з пп. 1-6, де R2 і R3 являють собою С1-3алкіл.
8. Сполука за будь-яким одним з пп. 1-6, де R2 і R3 являють собою метил.
9. Сполука за будь-яким одним з пп. 1-6, де R2 і R3 являють собою етил.
10. Сполука за будь-яким одним з пп. 1-6, де R2 і R3 являють собою ізопропіл.
11. Сполука за будь-яким одним з пп. 1-6, де R2 являє собою Н, і R3 являє собою ізопропіл.
12. Сполука за п. 5, де R являє собою Η або метил; a R2 і R3 являють собою С1-3алкіл.
13. Сполука за п. 1, де сполука вибрана з групи, що містить:
(Z)-7-хлор-5-(4-гідроксифеніл)-3-(2-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлоp-5-(4-гідроксифеніл)-3-(3-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Ζ)-7-хлор-5-(4-гідроксифеніл)-3-(4-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлор-3-(2,3-диметилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Ζ)-7-хлор-3-(2,4-диметилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,5-димeтилбeнзил)-5-(4-гiдpoкcифeнiл)-1H-бeнзo[e][l,4]дiaзeпiн-2(3Н)-он;
(Z)-7-хлор-3-(2,6-диметилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(3,4-димeтилбeнзил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-диметилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2-етилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3-етилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(4-етилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,3-дieтилбeнзил)-5-(4-гiдpoкcифeнiл)-1H-бeнзo[e][l,4]дiaзeпiн-2(3H)-он;
(Z)-7-xлop-3-(2,4-дieтилбeнзил)-5-(4-гiдpoкcифeнiл)-1H-бeнзo[e][l,4]дiaзeпiн-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діетилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-діетилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-діетилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлор-3-(3,5-діетилбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлор-5-(4-гідроксифеніл)-3-(2-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-гідроксифеніл)-3-(3-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-гідроксифеніл)-3-(4-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діізопропілбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,4-діізопропілбензил)-5-(4-гідроксифеніл)-1H-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,5-діізопропілбензил)-5-(4-гідроксифеніл)-1H-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,6-діізопропілбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(3,4-діізопропілбензил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-xлop-3-(3,5-дiiзoпpoпiлбeнзил)-5-(4-гідроксифеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-xлop-5-(4-гiдpoкcифeнiл)-1-метил-3-(2-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-xлоp-5-(4-гідроксифеніл)-1-метил-3-(3-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-гідроксифеніл)-1-метил-3-(4-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,3-диметилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,4-димeтилбeнзил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлоp-3-(2,5-диметилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-диметилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-диметилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2-етилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(3-етилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(4-етилбензил)-5-(4-гідроксифеніл)-1-метил-1H-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,3-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлоp-3-(2,4-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Ζ)-7-хлор-3-(3,5-діетилбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Ζ)-7-хлор-5-(4-гідроксифеніл)-3-(2-ізопропілбензил)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-гідроксифеніл)-3-(3-ізопропілбензил)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-гідроксифеніл)-3-(4-ізопропілбензил)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-діізопропілбензил)-5-(4-гідроксифеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-5-(4-фторфеніл)-3-(2-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-фторфеніл)-3-(3-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-5-(4-фторфеніл)-3-(4-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,3-диметилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,4-диметилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-диметилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-диметилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-диметилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-диметилбензил)-5-(4-фторфеніл)-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2-eтилбeнзил)-5-(4-фтopфeнiл)-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3-етилбензил)-5-(4-фторфеніл)-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(4-етилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діетилбензил)-5-(4-фторфеніл)-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,4-діетилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діетилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-діетилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(2)-7-хлор-3-(3,4-діетилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-діетилбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-фторфеніл)-3-(2-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-фторфеніл)-3-(3-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-фторфеніл)-3-(4-ізопропілбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,4-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,6-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,5-діізопропілбензил)-5-(4-фторфеніл)-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-5-(4-фторфеніл)-1-метил-3-(2-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-5-(4-фторфеніл)-1-метил-3-(3-метилбензил)-1H-бензо[е][1,4]діазепін-2(3Н)-он; (Ζ)-7-хлор-5-(4-фторфеніл)-1-метил-3-(4-метилбензил)-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Ζ)-7-хлор-3-(2,3-диметилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,4-диметилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-диметилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,6-димeтилбeнзил)-5-(4-фторфеніл)-1-метил-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-диметилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Ζ)-7-хлор-3-(3,5-диметилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2-етилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3-етилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(4-етилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,3-діетилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,4-діетилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,5-діетилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(2,6-діетилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(3,4-діетилбензил)-5-(4-фторфеніл)-1-метил-1H-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-3-(3,5-діетилбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-5-(4-фторфеніл)-3-(2-ізопропілбензил)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-хлор-5-(4-фторфеніл)-3-(3-ізопропілбензил)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-xлop-5-(4-фтopфeнiл)-3-(4-iзoпpoпiлбeнзил)-l-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он; (Z)-7-xлop-3-(2,3-діiзoпpoпiлбeнзил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,4-діізопропілбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(2,5-діізопропілбензил)-5-(4-фторфеніл)-1-метил-1Н-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-xлop-3-(2,6-дiiзoпpoпiлбeнзил)-5-(4-фтopфeнiл)-1-мeтил-1H-бензо[е][1,4]діазепін-2(3Н)-он;
(Z)-7-хлор-3-(3,4-діізопропілбензил)-5-(4-фторфеніл)-1-метил-1H-бензо[е][1,4]діазепін-2(3Н)-он або
(Z)-7-xлop-3-(3,5-діізопропілбензил)-5-(4-фторфеніл)-1-метил-1H-бензо[е][1,4]діазепін-2(3Н)-он або їх фармацевтично прийнятні солі.
14. Сполука за п. 1, де сполука являє собою
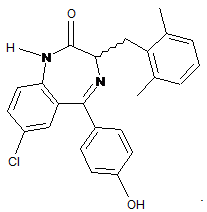
15. Сполука за п. 1, де сполука являє собою
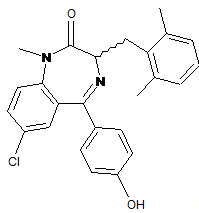 ,
,
або її фармацевтично прийнятна сіль.
16. Сполука за п. 1, де сполука являє собою
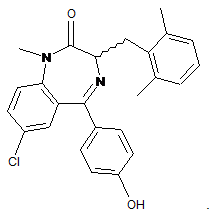
17. Фармацевтична композиція, що містить сполуку за будь-яким одним з пп. 1-16 і фармацевтично прийнятний носій.
18. Фармацевтична композиція за п. 17, яка додатково містить стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор або дьоготь.
19. Фармацевтична композиція за п. 18, де стероїд являє собою триамцинолону ацетонід або бетаметазону дипропіонат; аналог вітаміну D являє собою кальципотриєн; кератолітичний засіб являє собою антралін; топічний ретиноїд являє собою третиноїн або тазаротен; і кальциневриновий інгібітор являє собою такролімус, пімекролімус, аскоміцин або ISA247.
20. Фармацевтична композиція за п. 17, що додатково містить стероїд.
21. Спосіб лікування шкірного стану, при якому вводять терапевтично ефективну кількість сполуки за будь-яким одним з пп. 1-16 суб'єкту, який цього потребує, щоб зменшити інтенсивність симптому стану.
22. Спосіб за п. 21, де шкірний стан пов'язаний з епідермальною гіперплазією.
23. Спосіб за п. 21, де шкірний стан являє собою атопічний дерматит, рожеві вугри або псоріаз.
24. Спосіб за п. 21, де шкірний стан являє собою псоріаз.
25. Спосіб за п. 21, де сполука являє собою сполуку за п. 5 або 6.
26. Спосіб за п. 21, де сполука являє собою сполуку за п. 12.
27. Спосіб за п. 21, де сполука являє собою
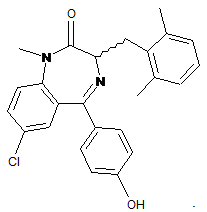
28. Спосіб за п. 27, де шкірний стан являє собою псоріаз.
29. Спосіб лікування епідермальної гіперплазії, при якому вводять терапевтично ефективну кількість сполуки за будь-яким одним з пп. 1-16 суб'єкту, який цього потребує, щоб зменшити інтенсивність симптому епідермальної гіперплазії.
30. Спосіб за п. 29, де сполука являє собою сполуку за п. 5 або 6.
31. Спосіб за п. 29, де сполука являє собою сполуку за п. 12.
32. Спосіб за п. 29, де сполука являє собою
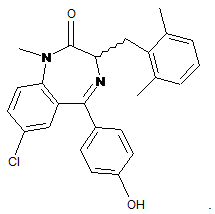
33. Спосіб за будь-яким одним з пп. 21-32, де суб'єкт є людиною.
34. Спосіб за будь-яким одним з пп. 21-32, при якому додатково вводять суб'єкту терапевтичний засіб, вибраний з групи, що включає стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор і дьоготь.
35. Спосіб за п. 34, де стероїд являє собою триамцинолону ацетонід або бетаметазону дипропіонат; аналог вітаміну D являє собою кальципотриєн; кератолітичний засіб являє собою антралін; топічний ретиноїд являє собою третиноїн або тазаротен; і кальциневриновий інгібітор являє собою такролімус, пімекролімус, аскоміцин або ISA247.
36. Спосіб за п. 34, де терапевтичний засіб є стероїдом.
37. Спосіб зменшення проліферації кератиноцитної клітини, при якому піддають згадану клітину впливу сполуки за будь-яким одним з пп. 1-16.
38. Спосіб за п. 37, де сполука являє собою сполуку за п. 5 або 6.
39. Спосіб за п. 37, де сполука являє собою сполуку за п. 12.
40. Спосіб за п. 37, де сполука являє собою
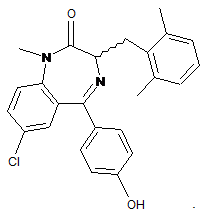
Текст
Реферат: Даний винахід стосується ряду бензодіазепінонових сполук та їх фармацевтичних композицій. Даний винахід також забезпечує способи лікування певних шкірних станів, наприклад атопічний дерматит, рожеві вугри або псоріаз, шляхом введення бензодіазепінону, і способи зменшення проліферації клітин кератиноцитів, піддаючи такі клітини впливу бензодіазепінону. UA 99839 C2 (12) UA 99839 C2 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0001] Дана заявка заявляє перевагу пріоритету попередньої заявки на патент Сполучених Штатів Америки із серійним номером 60/985898, зареєстрованої 6 листопада 2007 р., зміст якої включено в даний документ шляхом посилання. Заява відносно федерально фінансованого дослідження або розробки Даний винахід виконали з державною підтримкою під грант № AI47450, присуджений Департаментом охорони здоров'я США. Держава має певні права на даний винахід. Галузь винаходу [0002] Даний винахід у загальному значенні відноситься до галузі фармацевтичних сполук, застосовних у лікуванні аберантних шкірних станів. Більш конкретно, даний винахід відноситься до бензодіазепінонових сполук і способів їхнього застосування для лікування шкірних станів, пов'язаних з епідермальною гіперплазією, такою як псоріаз. Передумови винаходу [0003] Аберантні шкірні стани турбують мільйони людей в усьому світі. Пацієнти, що страждають від шкірного стану, часто відчувають біль і/або дискомфорт у зв'язку зі станом. Для деяких пацієнтів біль або дискомфорт можуть бути досить важкими. Здатність пацієнтів до сну, виконанню звичайних задач і/або участь у певних спортивних змаганнях можуть бути порушені деякими шкірними станами. Окрім фізичних нездужань шкірні стани можуть мати пагубний вплив на психологічний стан пацієнта. Наприклад, деякі шкірні стани викликають потворні виразки на шкірі пацієнта, що служить причиною того, що деякі пацієнти уникають соціальної взаємодії та/або стають емоційно депресивними. Рожеві вугри являють собою один такий стан, що може мати психологічні впливи, тому що вони часто викликають почервоніння обличчя та появу непривабливих, акне-подібних вугрів. [0004] Однією характеристикою численних шкірних станів є епідермальна гіперплазія. Епідермальна гіперплазія являє собою аномальне збільшення кількості нормальних клітин у нормальній структурі в епідермальній тканині. Дослідження показало, що надмірний ріст клітин кератиноцитів, як правило, зв'язаний з епідермальною гіперплазією. Постулювали, що епідермальна гіперплазія включає комплексне багатоклітинне запальне явище. Утім, місцеве лікування повністю транс-ретиноєвою кислотою (RA) або її попередником, лікування повністю транс-ретинолом (ROL) шкіри також призводить до епідермальної гіперплазії. Див., наприклад, Varani J, et al., (2001) J. Invest. Dermatol, 117: 1335-1341. Типові шкірні стани, пов'язані з епідермальною гіперплазією, включають псоріаз і атопічний дерматит. Див., наприклад, Krueger GC, et al., (1984) J. Am. Acad. Dermatol. 11: 937-947; Fry L. (1988). Brit. J. Dermatol. 119:445-461. [0005] Псоріаз являє собою хронічний, запальний, гіперпроліферативний шкірний стан, що уражає приблизно 2 % загальної популяції. Щороку повідомляють про приблизно 150000 нових випадків псоріазу та про приблизно 400 смертних випадків від псоріазу. Див. Stern, R. S. (1995) Dermatol. Clin. 13:717-722. Типові симптоми псоріазу включають шкірні ураження, почервоніння, запалення або плями шкіри, що стають сухими, червоними, покритими сріблистими лусочками, тріснутими та/або болючими. Додаткові симптоми включають біль у суглобах або тупий біль, хоча ці симптоми типово пов'язані зі псоріатичним артритом. Псоріаз може уражати всі частини шкіри, як правило, він більш видний на шкірі тулуба, голови, ліктів, колін або на нігтях рук, або нігтях ніг. Симптоми псоріазу можуть погіршуватися у відповідь на порізи, опіки, укуси комах або інші шкірні ушкодження. Симптоми псоріазу можуть також бути більш важкими в пацієнтів, що мають недостатню імунну систему, таких як пацієнти, уражені СНІДом або таких, що отримують ракову хіміотерапію. [0006] Існує кілька типів псоріазу. Найбільш загальний тип псоріазу являє собою хронічний бляшковий синдром. Цей тип псоріазу включає періоди ремісії та рецидиву протягом стану. Якщо залишити не вилікуваним, бляшковий псоріаз може розвитися в більш важкий стан, такий як пустульозний псоріаз або еритродермічний псоріаз. При пустульозному псоріазі червоні ділянки на шкірі містять пухирі з гноєм. Еритродермічний псоріаз характеризується великими плямами на шкірі, що є червоними та лущаться. Пацієнти, що страждають від еритродермічного псоріазу, часто скаржаться, що уражені плями на шкірі сверблять і/або болять. Інверсний псоріаз характеризується гладкими, збудженими ділянками шкіри, що типово з'являються на шкірних згинах. Краплеподібний псоріаз виглядає як численні, краплеподібні плями на шкірі та часто пов'язаний зі стрептококовою інфекцією горла. Нігтьовий псоріаз характеризується змінами на нігтях рук і ніг. Ця форма псоріазу часто включає зміну кольору під нігтем або стовщення шкіри під нігтем. [0007] Нинішні способи лікування псоріазу мають ряд недоліків. Наприклад, багато існуючих, топічних протипсоріазних засобів подразнюють шкіру, їх не можна застосовувати тривалий час, і/або вони призводять до агресивного рецидиву псоріазного стану, якщо лікування раптово завершується. Протизапальні засоби, незважаючи на те, що здатні пом'якшити певні симптоми, 1 UA 99839 C2 5 10 15 20 25 30 35 40 не виліковують основне захворювання. Інша нинішня альтернатива лікування, фотохіміотерапія, може призвести до плоскоклітинного та меланомного раку шкіри. [0008] Відповідно, існує необхідність нових композицій і способів, що ефективні в лікуванні шкірних станів, таких як псоріаз. Короткий опис винаходу [0009] Даний винахід забезпечує бензодіазепінонові сполуки, способи лікування різноманітних станів із застосуванням бензодіазепінонових сполук і способи зменшення проліферації кератиноцитної клітини із застосуванням бензодіазепінонових сполук. [0010] В одному аспекті даний винахід забезпечує сполуку, представлену формулою I: , що включає її солі, складні ефіри та проліки, де 1 R являє собою H або C1-6 алкіл; 2 R являє собою H або C1-6 алкіл; 3 R являє собою C1-6 алкіл; 4 R являє собою гідроксил або фтор; стереохімічна конфігурація в стереоцентрі в сполуці, представленій формулою I, являє собою R, S або їхню суміш; і якщо тільки згадана сполука не являє собою або [0011] Сімейство сполук, охоплених формулою I, може бути присутнім у фармацевтичних композиціях, що містять сполуку, описану в даному документі, і фармацевтично прийнятний носій. У певних варіантах здійснення фармацевтична композиція додатково містить стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор або дьоготь. [0012] В іншому аспекті даний винахід забезпечує спосіб лікування шкірного стану. Спосіб включає введення терапевтично ефективної кількості сполуки формули I, описаної в даному документі, суб'єкту, який це потребує, щоб зменшити інтенсивність симптому стану. Різноманітні шкірні стани можна лікувати, зокрема, ті, що пов'язані з епідермальною гіперплазією. У певних варіантах здійснення шкірний стан являє собою атопічний дерматит, рожеві вугри або псоріаз. [0013] В іншому аспекті даний винахід забезпечує спосіб лікування епідермальної гіперплазії. Спосіб включає введення терапевтично ефективної кількості сполуки формули I, описаної у даному документі, суб'єкту, який це потребує, щоб зменшити інтенсивність симптому епідермальної гіперплазії. [0014] У певних варіантах здійснення даний винахід забезпечує комбіновану терапію. Наприклад, у певних варіантах здійснення один з вищевказаних способів додатково включає введення суб'єкту терапевтичного засобу, вибраного з групи, що включає стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор і дьоготь. Різноманітні різні стероїди, циклоспорини, аналоги вітаміну D, кератолітичні засоби, топічні ретиноїди, кальциневринові інгібітори та дьогті прийнятні для даного винаходу. У певних варіантах здійснення стероїд являє собою топічний кортикостероїд. У певних варіантах здійснення топічний кортикостероїд являє собою триамцинолон ацетонід або бетаметазон дипропіонат; аналог вітаміну D являє собою кальципотриєн; кератолітичний засіб являє собою 2 UA 99839 C2 5 10 антралін; топічний ретиноїд являє собою третиноїн або тазаротен; і кальциневриновий інгібітор являє собою такролімус, пімекролімус, аскоміцин або ISA247. [0015] В іншому аспекті даний винахід забезпечує спосіб зменшення проліферації кератиноцитної клітини. Спосіб включає вплив на кератиноцитну клітину сполукою формули I, описаної у даному документі. Докладний опис винаходу [0016] Визначення: Для полегшення розуміння даного винаходу значення наступних виражень визначаються нижче. [0017] Вираз "бензодіазепін" посилається на семичленне неароматичне гетероциклічне кільце, злите з фенільним кільцем, де семичленне кільце має два атоми азоту, як частину гетероциклічного кільця. Два атоми азоту знаходяться в 1 і 4 положеннях, як показано на загальній структурі нижче. N 9 1 2 3 8 7 15 20 25 30 35 40 45 50 55 4 5 6 N [0018] Бензодіазепін може бути заміщеним однією кето групою (типово в 2 положенні) або двома кето групами, по одній в 2 і 5 положеннях. Для цілей даного винаходу бензодіазепінові сполуки охоплюють різноманітні замісники в семичленному неароматичному гетероциклічному кільці. [0019] Вираз "алкіл" є визнаним у даній галузі і включає насичені аліфатичні групи, що включають алкільні групи з нерозгалуженим ланцюгом, алкільні групи з розгалуженим ланцюгом, циклоалкільні групи, алкілом заміщені циклоалкільні групи та циклоалкілом заміщені алкільні групи. Типові приклади включають метил, етил, пропіл, ізопропіл, бутил, ізобутил, вторбутив, трет-бутил, пентил, гексил, циклопропіл, циклобутил, циклопентил, циклогексил і циклопропілметил. [0020] Вираз "гідроксил" означає –OH. Наприклад, пентан, заміщений гідроксильною групою, має формулу CH3(CH2)3CH2OH. [0021] Вираз "фармацевтична композиція" посилається на комбінацію активного засобу з носієм, інертними або активними, що робить композицію особливо придатною для діагностичного або терапевтичного застосування in vivo або ex vivo. [0022] Вираз "фармацевтично прийнятний носій" посилається на будь-який із стандартних фармацевтичних носіїв, таких як фізіологічний розчин із фосфатним буфером, вода, емульсії (наприклад, такі як емульсії олія/вода або вода/олія) і різноманітні типи зволожуючих засобів. Композиції також можуть включати стабілізатори та консерванти. Для прикладів носіїв, стабілізаторів і ад'ювантів (див., наприклад, Martin, Rеmіngtоn's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975]). [0023] Вираз "фармацевтично прийнятна сіль" посилається на будь-яку фармацевтично прийнятну сіль (наприклад, кислу або основну) сполуки даного винаходу, яка при введенні суб'єкту здатна забезпечити сполуку даного винаходу або його активний метаболіт або залишок. Як відомо фахівцю в даній галузі, "солі" сполук даного винаходу можуть бути отримані з неорганічних або органічних кислот і основ. Приклади кислот включають, але не обмежують, хлористоводневу, бромістоводневу, сірчану, азотну, хлорну, фумарову, малеїнову, фосфорну, гліколеву, молочну, саліцилову, бурштинову, толуол-p-сульфонову, винну, оцтову, лимонну, метансульфонову, етансульфонову, мурашину, бензойну, малонову, нафталін-2-сульфонову, бензолсульфонову кислоту та подібні. Інші кислоти, такі як щавлева, у той час як іноді самі по собі не є фармацевтично прийнятними, можуть використовуватися в приготуванні солей, застосовних як проміжні продукти при одержанні сполук даного винаходу та їхніх фармацевтично прийнятних кислотно адитивних солей. Приклади основ включають гідроксиди лужних металів (наприклад, натрію), гідроксиди лужноземельних металів (наприклад, магнію), + аміак і сполуки формули NW 4 , де W являє собою C1-4 алкіл і подібне. Приклади солей включають, але не обмежують, ацетат, адипат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, флюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, лактат, малеат, метансульфонат, 2-нафталінсульфонат, нікотинат, оксалат, пальмоат, пектинат, персульфат, фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, тартрат, тіоцианат, тозилат, ундеканоат і подібне. Інші приклади солей включають аніони сполук даного винаходу, складені з + + + придатним катіоном, таким як Na , NH4 і NW 4 (де W являє собою C1-4 алкільну групу) і подібне. 3 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0024] Для терапевтичного застосування солі сполук даного винаходу розглядають як фармацевтично прийнятні. Однак, солі кислот і основ, що не є фармацевтично прийнятними, можуть також знайти застосування, наприклад, у приготуванні або очищенні фармацевтично прийнятної сполуки. [0025] Слід зазначити, що структура деяких зі сполук даного винаходу включає асиметричні атоми вуглецю. Варто розуміти, що ізомери, які походять від такої асиметрії (наприклад, всі енантіомери та діастереомери), включені в об'єм даного винаходу, якщо не вказано інше. Такі ізомери можна одержати в суттєво чистій формі класичними методами поділу та стереохімічно контрольованим синтезом. Крім того, структури й інші сполуки та частини, обговорювані в даній заявці, також включають усі їхні таутомери. Алкени можуть включати або E- або Z- геометрію, коли це доречно. [0026] Вираз орто, мета та пара є визнаними в даній галузі та посилаються на 1,2-, 1,3- і 1,4дизаміщені бензоли, відповідно. Наприклад, назви 1,2-диметилбензол і орто-диметилбензол є синонімами. [0027] Як правило, відсотковий вміст, зазначений у композиції, є за вагою, якщо не зазначене інше. Більш того, якщо перемінна не супроводжується визначенням, то діє попереднє визначення перемінної. [0028] Вираз "гіперплазія" посилається на форму клітинної проліферації, що стосується збільшення кількості клітин у тканині або органі без суттєвої зміни в структурі або функції. Патологічно гіперплазія включає проліферацію клітин, що не регулюється звичайним обмеженням нормального клітинного росту. Гіперплазія може проявлятися в гіперплазованих клітинах або ракових клітинах, що включають пухлинні клітини, неопластичні клітини, клітини злоякісного новоутворення та метастатичні клітини. [0029] Вираз "епідермальна гіперплазія" посилається на аномальне розмноження або збільшення числа нормальних клітин у нормальній структурі в епідермальній тканині. Епідермальна гіперплазія є характеристикою численних шкірних станів, що включають, але не обмежуються, псоріаз. [0030] Вираз "кератиноцит" посилається на клітину шкіри ороговілого шару епідермісу. [0031] Вираз "фібробласт" посилається на мезодермального походження резидентні клітини сполучної тканини, що секретують фібрилярний проколаген, фібронектин і колагеназу. [0032] Вираз "EC50" є визнаним у даній галузі та посилається на концентрацію сполуки, при якій спостерігається 50 % його максимального впливу. [0033] Вираз "суб'єкт" посилається на організми, які лікують способами даного винаходу. Такі організми переважно включають ссавців (наприклад, мишоподібних, мавпоподібних, кінських, бичачих, свинячих, псових, котячих і подібних) і найбільше переважно включають людину. [0034] Вираз "ефективна кількість" посилається на кількість сполуки (наприклад, бензодіазепінонової сполуки), достатньої для здійснення корисних або бажаних результатів. Ефективну кількість можна вводити за одне або більше введень, нанесень або дозувань, і вона не обмежується, або не призначена бути обмеженою, конкретним складом або шляхом введення. [0035] Вираз "другий засіб" посилається на терапевтичний засіб крім бензодіазепінонової сполуки відповідно за даним винаходом. У деяких випадках другий засіб являє собою антипроліферативний засіб. [0036] Вираз "сумісне введення" посилається на введення, щонайменш, двох засобів (наприклад, сполука даного винаходу) або терапій суб'єкту. У деяких варіантах здійснення сумісне введення двох або більше засобів/терапій є одночасним. В інших варіантах здійснення перший засіб/терапію вводять до другого засобу/терапії. Фахівцям у даній галузі зрозуміло, що сполуки і/або способи введення різноманітних засобів/терапій, що застосовуються, можуть варіюватися. Фахівець у даній галузі може легко визначити доцільне дозування для сумісного введення. У деяких варіантах здійснення, коли засоби/терапії сумісно вводять, відповідні засоби/терапії вводять при більш низьких дозуваннях, ніж доцільні для їхнього введення окремо. Так, сумісне введення особливе бажано у варіантах здійснення, де сумісне введення засобів/терапій знижує необхідне дозування відомого потенційно небезпечного (наприклад, токсичного) засобу (засобів). [0037] Вираз "комбінована терапія" включає введення бензодіазепінонової сполуки даного винаходу і, щонайменш, другого засобу як частини певного режиму лікування, призначеного для забезпечення доброякісного впливу від сумісної дії цих терапевтичних засобів. Доброякісний вплив комбінації включає, але не обмежує, фармакокінетичну або фармакодинамічну сумісну дію, обумовлену комбінацією терапевтичних засобів. Уведення цих терапевтичних засобів у 4 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 комбінації типово виконують через заданий період часу (зазвичай хвилини, години, дні або тижні залежно від вибраної комбінації). "Комбінаційна терапія" може бути, але звичайно не є, призначеною охоплювати введення двох або більше таких терапевтичних засобів, як частину режимів роздільної монотерапії, що випадково та довільно призводять до комбінацій даного винаходу. "Комбінаційна терапія" призначена охоплювати введення цих терапевтичних засобів по черзі, тобто, де кожен терапевтичний засіб вводять у різний час, а також введення цих терапевтичних засобів або, щонайменш, двох з терапевтичних засобів, головним чином, одночасно. Головним чином одночасне введення можна виконати, наприклад, введенням суб'єкту одиничної капсули, що має фіксоване співвідношення кожного терапевтичного засобу, або багаторазово одиничних капсул для кожного з терапевтичних засобів. Почергове або, головним чином, одночасне введення кожного терапевтичного засобу можна здійснити будьяким придатним способом, включаючи, але не обмежуючи, оральні способи застосування, внутрішньовенні способи застосування, внутрішньом'язові способи застосування та пряме поглинання через тканини слизової оболонки. Терапевтичні засоби можна вводити тим самим способом застосування або різними способами застосування. Наприклад, перший терапевтичний засіб вибраної комбінації можна ввести внутрішньовенною ін'єкцією, у той час як інші терапевтичні засоби комбінації можна ввести орально. Альтернативно, наприклад, всі терапевтичні засоби можна ввести орально або всі терапевтичні засоби можна ввести внутрішньовенною ін'єкцією. Послідовність, у якій терапевтичні засоби вводять, не є вузько критичною. "Комбінаційна терапія" також може включати введення терапевтичних засобів, як описано вище, у додатковій комбінації з іншими біологічно активними компонентами та безмедикаментозними терапіями (наприклад, хірургічна операція або променеве лікування). Якщо комбінаційна терапія додатково включає безмедикаментозне лікування, безмедикаментозне лікування можна проводити в будь-який придатний час доти, доки доброякісний вплив від сумісної дії комбінації терапевтичних засобів і безмедикаментозного лікування не буде досягнуто. Наприклад, у придатних випадках доброякісний вплив все ще досягають, коли безмедикаментозне лікування тимчасово видаляють від введення терапевтичних засобів, можливо на дні або навіть тижні. [0038] Даний винахід забезпечує бензодіазепінонові сполуки та способи застосування таких сполук як терапевтичні засоби для лікування ряду різних станів. Показові композиції та способи даного винаходу описані більш детально в наступних розділах: I. Бензодіазепінонові сполуки; II. Терапевтичне застосування бензодіазепінових сполук; і III. Розгляд фармацевтичних композицій, сполук і показових способів введення препарату та дозування. [0039] Здійснення даного винаходу використовує, якщо інакше не зазначено, загальноприйняті методи органічної хімії, фармакології, молекулярної біології (включаючи рекомбінантні методи), біології клітини, біохімії й імунології, що відомі фахівцю в даній галузі. Такі методи пояснені повністю у літературі, такій як "Comprehensive Organic Synthesis" (B.M. Trost & I. Fleming, eds., 1991-1992); "Molecular cloning: a laboratory manual" Second Edition (Sambrook et al., 1989); "Oligonucleotide synthesis" (M.J. Gait, ed., 1984); "Animal cell culture" (R.I. Freshney, ed., 1987); серії "Methods in enzymology" (Academic Press, Inc.); "Handbook of experimental immunology" (D.M. Weir & C.C. Blackwell, eds.); "Gene transfer vectors for mammalian cells" (J.M. Miller & M.P. Calos, eds., 1987); "Current protocols in molecular biology" (F.M. Ausubel et al., eds., 1987, і періодичні відновлення); "PCR: the polymerase chain reaction" (Mullis et al., eds., 1994) і "Current protocols in immunology" (J.E. Coligan et al., eds., 1991), кожний з яких у даному документі включений посиланням у всій своїй повноті. I. Бензодіазепінонові сполуки [0040] В одному аспекті даний винахід забезпечує сполуку, представлену формулою I: , що включає її солі, складні ефіри та проліки, де 1 R являє собою H або C1-6 алкіл; 5 UA 99839 C2 2 5 R являє собою H або C1-6 алкіл; 3 R являє собою C1-6 алкіл; 4 R являє собою гідроксил або фтор; стереохімічна конфігурація в стереоцентрі в сполуці, представленій формулою I, являє собою R, S або їхню суміш; і якщо тільки згадана сполука не являє собою або [0041] У певних варіантах здійснення R4 являє собою фтор. У певних інших варіантах здійснення сполука має структуру: 10 . [0042] У певних інших варіантах здійснення R4 являє собою гідроксил. У певних інших варіантах здійснення сполука має структуру: [0043] У певних інших варіантах здійснення сполука має структуру: 15 20 2 3 [0044] У певних інших варіантах здійснення R і R являють собою C1-3 алкіл. У певних інших 2 3 2 3 варіантах здійснення R і R являють собою метил. У певних інших варіантах здійснення R і R 2 3 являють собою етил. У певних інших варіантах здійснення R і R являють собою ізопропіл. У 1 певних інших варіантах здійснення R являє собою метил. У певних інших варіантах здійснення 2 3 1 R являє собою H, і R являє собою ізопропіл. У певних інших варіантах здійснення R являє 2 3 собою H або метил; і R і R являють собою C1-3 алкіл. У певних інших варіантах здійснення сполука являє собою: 6 UA 99839 C2 [0045] У певних інших варіантах здійснення сполука являє собою: 5 [0046] У певних варіантах здійснення сполуки є описаними в наступних таблицях. Таблиця 1 7 UA 99839 C2 8 UA 99839 C2 9 UA 99839 C2 Таблиця 2 10 UA 99839 C2 5 [0047] Вищезгадані сполуки можуть бути присутніми у фармацевтичних композиціях, що містять сполуку, описану в даному документі, і фармацевтично прийнятний носій. У певних варіантах здійснення фармацевтична композиція додатково містить другий терапевтичний засіб. У певних варіантах здійснення другий терапевтичний засіб являє собою стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор або дьоготь. Різноманіття різних стероїдів, циклоспоринів, аналогів вітаміну D, кератолітичних засобів, топічних ретиноїдів, кальциневринових інгібіторів і дьогтів прийнятні для даного винаходу. У певних варіантах здійснення стероїд являє собою топічний 11 UA 99839 C2 5 10 15 20 25 30 35 стероїд. Топічні стероїди можуть зменшувати утворення бляшок і мати протизапальні впливи. Топічні стероїди можуть також модифікувати імунну відповідь організму на різні подразники. Топічний стероїд може у певних варіантах здійснення бути топічним кортикостероїдом, таким як триамцинолон ацетонід (Artistocort, Kenalog) (0,1 % крем) або бетаметазон дипроприонат (Diprolene, Dірrоsоnе) (0,05 % крем). У певних варіантах здійснення другий терапевтичний засіб являє собою циклоспорин, такий як циклоспорин A або похідне циклоспорину A. У певних варіантах здійснення другий терапевтичний засіб являє собою вітамін D або аналог вітаміну D. Аналоги вітаміну D іноді застосовують для пацієнтів з ураженнями, резистентними до колишньої терапії, або з ураженнями на обличчі або відкритих ділянках, де стоншення шкіри будуть являти собою косметичні проблеми. У певних варіантах здійснення аналог вітаміну D являє собою кальципотриєн. У певних варіантах здійснення другий терапевтичний засіб являє собою кератолітичний засіб. Кератолітичні засоби можна застосовувати для усунення лущення, згладжування шкіри та для лікування гіперкератозу в суб'єкта. У певних варіантах здійснення кератолітичний засіб являє собою антралін, зокрема антралін 0,1-1 % (Drithocreme, AnthraDerm). [0048] У певних варіантах здійснення другий терапевтичний засіб являє собою ретиноїд, такий як топічний ретиноїд. Топічні ретиноїди можуть знижувати когезійну здатність фолікулярних епітеліальних клітин і стимулювати мітотичні, призводячи до збільшення в обміні фолікулярних епітеліальних клітин. У певних варіантах здійснення топічний ретиноїд являє собою третиноїн або тазаротен. У певних варіантах здійснення топічний ретиноїд являє собою третиноїн у складі, що продається як Ретин-A або Авіта. У певних варіантах здійснення топічний ретиноїд являє собою тазаротен у складі, що продається як Тазорак. [0049] У певних варіантах здійснення другий терапевтичний засіб являє собою кальциневриновий інгібітор, такий як такролімус, пімекролімус, аскоміцин або ISA247. Такролімус, також відомий як FK506, описаний у патентах США №№ 4894366; 4916138 і 4929611; кожний з яких в даний опис включений посиланням. Пімекролімус являє собою макролактам, про який повідомили, що він інгібує продукування прозапальних цитокінів T клітинами та гладкими клітинами. Пімекролімус описаний у патенті США № 5912238, який в даний опис включений посиланням. Аскоміцин являє собою етиловий аналог такролімуса, описаний C.E. Griffiths у Br. J. Dermatol. 2001. Apr;144(4):679-81. ISA247 являє собою циклоспоринове похідне, описане в патентах США №№ 6605593 і 6613739; кожний з яких в даний опис включений посиланням. [0050] У певних варіантах здійснення другий терапевтичний засіб являє собою дьоготь. Дьоготь є недорогим лікуванням, що відпускається без рецепта в шампунях або лосьйонах, і він є, зокрема, застосовним на волосяних ділянках. Одним прикладом дьогтю є дьоготь (DHS Tar, Doctar, Theraplex T) протисвербіжний. У певних варіантах здійснення дьоготь присутній у концентрації 2-10 відсотка за вагою. [0051] Бензодіазепінонові сполуки, описані вище, можна приготувати на основі процедур, зображених на Схемі 1. 12 UA 99839 C2 Схема 1 гліцин В1 (R=метил) B2 (R=р-метоксибензил) E1 (R=метил, Ar1= р-метоксибензил) E2 (R=Ar1= р-метоксибензил) 5 10 15 20 25 30 35 40 [0052] N-алкілювання ізатового ангідриду A можна провести обробкою сполуки A гідридом натрію й алкіл або бензилгалогенідом. Реакцію сполуки A з бензилгалогенідом, таким як рметоксибензилгалогенід, можна виконати для встановлення захисної групи, у той час як реакцію сполуки A з різноманітними алкілгалогенідами, наприклад, метилйодидом або етилйодидом, можна виконувати для встановлення алкільного заміщення в N1-положення бензодіазепінового кільця. Ізатовий ангідрид B можна перетворити в бензодіазепінон C реакцією з гліцином. Див. Indian J. Chem. Sect. B. 1985, 24, 905-907. Цією процедурою забезпечили бензодіазепінони C1 і C2 з хорошим виходом, що були згодом оброблені POCl 3 для забезпечення імідоїлхлоридів D1 або D2. [0053] "Південне" арильне кільце (замісник Ar1) можна встановити сполученням по Сузукі арилборної кислоти відповідно до процедур, описаними Nadin і співробітниками, див. J. Org. Chem. 2003, 68, 2844-2852. Зокрема, сполучення по Сузукі імідохлоридів D1 і D2 з (4метоксифеніл)борною кислотою дало 5-арилбензодіазепінони E1 і E2 у великих кількостях. [0054] "Східне" арильне кільце (замісник Ar2) можна встановити алкілюванням у C3положення бензодіазепінонового кільця. Депротонуванням у C-3 за допомогою сильної основи, такої як трет-бутоксид калію, з наступним додаванням заміщеного бензилгалогеніду забезпечили бензодіазепінон G. Бензилгалогеніди для цієї реакції можна одержати комерційно або приготувати з відповідного бензилового спирту, застосовуючи відомі процедури, такі як обробка бензилового спирту тіонілхлоридом. Різноманітні бензилові спирти комерційно доступні. До того ж, різноманітні бензилові спирти можна приготувати, застосовуючи будь-який один з наступних способів: i) відновлення комерційно доступної карбоксильної кислоти (наприклад, відновлення за допомогою літійалюмінієвого гідриду); ii) перетворення дибромбензилового спирту в діалкіл-бензиловий спирт за допомогою, наприклад, реактиву діалкілцинку в присутності паладієвого каталізатора, такого як PdCl 2(dppf); iii) перетворення дибромбензил ацетату в діалкілбензилацетат з наступним гідролізом; iv) формілування цільової ароматичної сполуки з наступним відновленням; або v) перетворення реакційноздатного складного ефіру хлорбензоату у відповідний складний ефір алкілбензоату, застосовуючи, наприклад, реактив Гринь'яру в присутності залізного каталізатора, такого як Fe(acac)3, з наступним відновленням. [0055] Замісники в "східному" ароматичному кільці можна встановити наступним C3алкілюванням ароматичного кільця. Наприклад, C3-алкілювання з 3-бромбензилбромідом, з наступним Pd-каталізованим приєднанням алкільної групи до ароматичного кільця. [0056] Як проілюстровано вище на Схемі 1, бензодіазепінон G можна також приготувати, застосовуючи стратегію синтезу, що включає C3-алкілування імідохлориду D, з наступною реакцію паладієвого сполучення, для встановлення "південного" ароматичного кільця. Ця стратегія синтезу повинна підлягати широкому різноманіттю субстратів, хоча водні виділення продуктів реакції C3-алкілювання потрібно робити швидко за низької температури, щоб звести до мінімуму будь-який гідроліз імідохлоридної групи. Арильні боронати, застосовані в цій реакції 13 UA 99839 C2 5 10 15 20 25 паладієвого сполучення, можна одержати з комерційних джерел або їх можна легко приготувати. Наприклад, арильний боронат можна приготувати обробкою арильного броміду біс(пінаколато)дибором у присутності паладієвого каталізатора. [0057] У ситуаціях, де захисні групи застосовують у ході синтезу, захисні групи в сполуці G можна видалити, застосовуючи стандартні процедури, відомі в даній галузі. Наприклад, метокси захисну групу в Ar1 можна видалити за допомогою AlCl3, що дасть p-гідроксифенільну групу. Подібним чином, зняття N-захисної p-метоксибензильної групи можна виконати за допомогою амонійнітрату церію (IV) відповідно до літературних процедур. II. Терапевтичне застосування бензодіазепінових сполук [0058] Передбачається, що бензодіазепінонові сполуки формули I забезпечують терапевтичні переваги пацієнтам, що страждають від різноманітних шкірних станів. В одному аспекті даний винахід забезпечує спосіб лікування шкірного стану, при якому вводять терапевтично ефективну кількість сполуки формули I суб'єкту, який це потребує, щоб зменшити інтенсивність симптому стану: , що включає її солі, складні ефіри та проліки, де 1 R являє собою H або C1-6 алкіл; 2 R являє собою H або C1-6 алкіл; 3 R являє собою C1-6 алкіл; 4 R являє собою гідроксил або фтор; стереохімічна конфігурація в стереоцентрі в сполуці, представленій формулою I, являє собою R, S або їх суміш; і якщо тільки згадана сполука не являє собою або 4 [0059] У певних варіантах здійснення R являє собою фтор. У певних інших варіантах здійснення сполука має структуру: . 4 [0060] У певних інших варіантах здійснення R являє собою гідроксил. У певних інших варіантах здійснення сполука має структуру: 14 UA 99839 C2 [0061] У певних інших варіантах здійснення сполука має структуру: 2 5 10 3 [0062] У певних інших варіантах здійснення R і R являють собою C1-3 алкіл. У певних інших 2 3 2 3 варіантах здійснення R і R являють собою метил. У певних інших варіантах здійснення R і R 2 3 являють собою етил. У певних інших варіантах здійснення R і R являють собою ізопропіл. У 1 певних інших варіантах здійснення R являє собою метил. У певних інших варіантах здійснення 2 3 1 R являє собою H, і R являє собою ізопропіл. У певних інших варіантах здійснення R являє 2 3 собою H або метил; і R і R являють собою C1-3 алкіл. У певних інших варіантах здійснення сполука являє собою: [0063] У певних інших варіантах здійснення сполука являє собою: 15 20 [0064] У певних інших варіантах здійснення сполука являє собою одну зі сполук, перелічених у Таблицях 1 або 2. У певних інших варіантах здійснення шкірний стан пов'язаний з епідермальною гіперплазією. У певних інших варіантах здійснення шкірний стан являє собою атопічний дерматит, рожеві вугри або псоріаз. У певних інших варіантах здійснення шкірний стан являє собою псоріаз. Існують різноманітні форми псоріазу, що включають тромбоцитний псоріаз, краплеподібний псоріаз, нігтьовий псоріаз, інверсний псоріаз і псоріаз шкіри голови. Передбачається, що одну або більше з цих форм псоріазу можна вилікувати введенням бензодіазепінону, описаного в даному документі. [0065] В іншому аспекті даний винахід забезпечує спосіб лікування епідермальної гіперплазії, при якому вводять терапевтично ефективну кількість сполуки формули I, описану в 15 UA 99839 C2 даному документі, суб'єкту, який це потребує, щоб зменшити інтенсивність симптому епідермальної гіперплазії. У певних варіантах здійснення сполука має структуру: 5 10 15 , 1 2 3 де R являє собою H або C1-6 алкіл; R являє собою H або C1-6 алкіл; R являє собою C1-6 алкіл; і стереохімічна конфігурація в стереоцентрі в сполуці являє собою R, S або їхню суміш. [0066] У певних інших варіантах здійснення сполука має структуру: , 1 2 3 де R являє собою H або C1-6 алкіл; R являє собою H або C1-6 алкіл; R являє собою C1-6 алкіл; і стереохімічна конфігурація в стереоцентрі в сполуці являє собою R, S або їхню суміш. 2 3 [0067] У певних інших варіантах здійснення R і R являють собою C1-3 алкіл. У певних інших 2 3 2 3 варіантах здійснення R і R являють собою метил. У певних інших варіантах здійснення R і R 2 3 являють собою етил. У певних інших варіантах здійснення R і R являють собою ізопропіл. У 1 певних інших варіантах здійснення R являє собою метил. У певних інших варіантах здійснення 2 3 1 R являє собою H, і R являє собою ізопропіл. У певних інших варіантах здійснення R являє 2 3 собою H або метил; і R і R являють собою C1-3 алкіл. У певних інших варіантах здійснення сполука являє собою: [0068] У певних інших варіантах здійснення сполука являє собою: 20 [0069] У певних інших варіантах здійснення сполука являє собою одну зі сполук, перералічених у Таблицях 1 або 2. [0070] У певних варіантах здійснення суб'єкт є людиною. У певних інших варіантах здійснення спосіб додатково включає введення суб'єкту терапевтичного засобу, вибраного з 16 UA 99839 C2 5 10 15 20 25 групи, що включає стероїд, циклоспорин, вітамін D, аналог вітаміну D, кератолітичний засіб, топічний ретиноїд, кальциневриновий інгібітор і дьоготь. У певних варіантах здійснення стероїд являє собою топічний кортикостероїд. У певних інших варіантах здійснення топічний кортикостероїд являє собою триамцинолон ацетонід або бетаметазон дипропіонат; аналог вітаміну D являє собою кальципотриєн; кератолітичний засіб являє собою антралін; топічний ретиноїд являє собою третиноїн або тазаротен; і кальциневриновий інгібітор являє собою такролімус, пімекролімус, аскоміцин або ISA247. У певних інших варіантах здійснення терапевтичний засіб являє собою стероїд. [0071] В іншому аспекті даний винахід забезпечує спосіб зменшення проліферації кератиноцитної клітини, при якому піддають зазначену клітину впливу сполуки формули I, описаної в даному документі. У певних варіантах здійснення сполука має структуру: , 1 2 3 де R являє собою H або C1-6 алкіл; R являє собою H або C1-6 алкіл; R являє собою C1-6 алкіл; і стереохімічна конфігурація в стереоцентрі в сполуці являє собою R, S або їхню суміш. [0072] У певних інших варіантах здійснення сполука має структуру: , 1 2 3 де R являє собою H або C1-6 алкіл; R являє собою H або C1-6 алкіл; R являє собою C1-6 алкіл; і стереохімічна конфігурація в стереоцентрі в сполуці являє собою R, S або їхню суміш. 2 3 [0073] У певних інших варіантах здійснення R і R являють собою C1-3 алкіл. У певних інших 2 3 2 3 варіантах здійснення R і R являють собою метил. У певних інших варіантах здійснення R і R 2 3 являють собою етил. У певних інших варіантах здійснення R і R являють собою ізопропіл. У 1 певних інших варіантах здійснення R являє собою метил. У певних інших варіантах здійснення 2 3 1 R являє собою H, і R являє собою ізопропіл. У певних інших варіантах здійснення R являє 2 3 собою H або метил; і R і R являють собою C1-3 алкіл. У певних інших варіантах здійснення сполука являє собою: [0074] У певних інших варіантах здійснення сполука являє собою: 17 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 [0075] У певних інших варіантах здійснення сполука являє собою одну зі сполук, перелічених у Таблицях 1 або 2. [0076] У певних інших варіантах здійснення спосіб, описаний у даному документі, додатково включає вплив на згаданого суб'єкта ультрафіолетовим випромінюванням. Показали, що фототерапія допомагає лікувати псоріаз. Існують два основних види фототерапії, фототерапія UVB і PUVA. При фототерапії UVB, або ультрафіолетових променях B, застосовують світло, що має довжину хвилі в діапазоні 290-320 нм. Таку фототерапію часто поєднують з одним або більш місцевим лікуванням, що включає: і) дьоготь, що наносять місцево, з наступним застосуванням UVB; ii) застосування дьогтьової ванни з наступним UVB, а потім антралін, що наносять місцево; або iii) застосування UVB у комбінації з кортикостероїдами, що наносять місцево, кальципотриєном, тазаротеном або просто пом'якшуючими засобами. При PUVA (псорален + ультрафіолетові промені А) застосовують фотосенсибілізуючий засіб метоксален (8-метоксипсоралени) разом з UVA світлом (довжина хвилі в діапазоні 320-400 нм). Вважають, що PUVA заважає синтезу ДНК (метоксален ковалентно зв'язує піримідинові основи в ДНК), знижує клітинну проліферацію та викликає апоптоз шкірних лімфоцитів, що призводить до локальної імуносупресії. III. Розгляд фармацевтичних композицій, сполук і показових способів введення препарату та дозування [0077] Показові варіанти здійснення різноманітних передбачуваних лікарських препаратів і фармацевтичних композицій представлені нижче. А. Приготування лікарських препаратів [0078] Сполуки даного винаходу застосовні при готуванні лікарських препаратів для лікування або вивчення ряду шкірних станів. У певних варіантах здійснення шкірний стан пов'язаний з епідермальною гіперплазією. [0079] До того ж, сполуки є також застосовними для приготування лікарських препаратів для лікування або вивчення інших шкірних станів, де ефективність сполук відома або передбачена. Способи і методи приготування лікарських препаратів зі сполуки даного винаходу добре відомі в даній галузі. Показові фармацевтичні сполуки і способи доставки описані нижче. B. Показові фармацевтичні композиції і сполука [0080] У деяких варіантах здійснення даного винаходу композиції вводять окремо, у той час, як у деяких інших варіантах здійснення композиції переважно присутні у фармацевтичній сполуці, що містить, щонайменш, один активний компонент/засіб, як описано вище, разом із твердою основою або, альтернативно, разом з одним або більше фармацевтично прийнятним носієм і факультативно з іншими терапевтичними засобами. Кожен носій повинний бути "прийнятним" у тому сенсі, що він повинний бути сумісним з іншими компонентами сполуки і не шкідливим для суб'єкта. [0081] Передбачувані сполуки включають такі, що придатні для орального, ректального, назального, місцевого (включаючи трансдермальне, букальне і сублінгвальне), вагінального, парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне й інтрадермальне) та пульмонального введення. У деяких варіантах здійснення сполуки зручно представлені в стандартній лікарській формі та приготовлені будь-яким способом, відомим в галузі фармації. Такі способи включають етап внесення в асоціацію активного компонента з носієм, що складає один або більш додаткових компонентів. Загалом, сполуки готують шляхом рівномірного та тісного внесення в асоціацію (наприклад, змішуванням) активного компонента з рідкими носіями або тонко диспергованими твердими носіями, або і тими, і іншими, і потім, якщо необхідно, формуючи продукт. [0082] Склади даного винаходу, що підходять для орального введення, можуть бути представлені як дискретні одиниці, такі як капсули, крохмальні капсули або таблетки, де кожна переважно містить задану кількість активного компонента; як порошок або гранули; як розчин або суспензія у водній або безводній рідині; або як рідка емульсія типу "олія у воді" або рідка 18 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 60 емульсія типу "вода в олії". В інших варіантах здійснення активний компонент присутній у якості болюса, електуарію або пасти і т.д. [0083] У деяких варіантах здійснення таблетки, що містять, щонайменш, один активний компонент і факультативно один або більше додатковий засіб/носій, роблять пресуванням або формованням відповідних засобів. У деяких варіантах здійснення пресовані таблетки готують пресуванням активного компонента в придатному апараті у вільносипку форму, таку як порошок або гранули, факультативно змішану зі зв'язуючою речовиною (наприклад, повідон, желатин, гідроксипропілметилцелюлоза), змазувальною речовиною, інертним розріджувачем, консервантом, засобом, що викликає дезінтеграцію (наприклад, натрію крохмалю гліколят, поперечно зв'язаний повідон, поперечно зв'язана натрію карбоксиметилцелюлоза), поверхневоактивною або диспергуючою речовиною. Формовані таблетки роблять формованням у придатному апараті суміші порошкоподібної сполуки (наприклад, активний компонент), зволоженої інертним рідким розріджувачем. Таблетки можуть факультативно бути покритими або шорсткуватими та можуть бути сформульовані так, щоб забезпечити повільне або контрольоване вивільнення її активного компонента, з використанням, наприклад, гідроксипропілметилцелюлози в різних пропорціях, щоб забезпечити бажаний профіль вивільнення. Таблетки можуть факультативно бути забезпеченими ентеросолюбільним покриттям, щоб забезпечувати вивільнення в частинах кишечнику, а не в шлунку. [0084] Склади, що підходять для місцевого введення в рот, включають коржі, що містять активний компонент в ароматизованій основі, зазвичай в сахарозі та гуміарабіці або трагаканті; пастилки, що містять активний компонент в інертній основі, такій як желатин і гліцерин або сахароза і гуміарабік; і рідини для полоскання рота, що містять активний компонент у придатному рідкому носії. [0085] Фармацевтичні композиції для місцевого введення відповідно до даного винаходу факультативно сформульовані як мазі, креми, суспензії, лосьйони, порошки, розчини, пасти, гелі, розчини, що розпилюються, аерозолі або олії. В альтернативних варіантах здійснення топічні сполуки включають пластири або пов'язки, такі як бандаж або лейкопластири, просочені активним компонентом (компонентами), і факультативно одну або більш допоміжних речовин або розріджувачів. У деяких варіантах здійснення топічні сполуки включають сполуку (сполуки), що підсилюють абсорбцію або проникнення активного засобу (засобів) через шкіру або інші уражені ділянки. Приклади таких речовин, що сприяють проникненню через шкіру, включають диметилсульфоксид (DMSO) і споріднені аналоги. [0086] За бажанням водна фаза кремової основи включає, наприклад, щонайменш, близько 30 % у ваговому відношенні багатоатомного спирту, тобто, спирту, що має дві або більше гідроксильні групи, такі як пропіленгліколь, бутан-1,3-діол, манітол, сорбітол, гліцерин, поліетиленгліколь і їхні суміші. [0087] У деяких варіантах здійснення емульсії з маслянистою фазою даного винаходу складають з відомих компонентів відомим чином. Така фаза типово містить одиночний емульгатор (інакше відомий як емульгуюча речовина), також бажано в деяких варіантах здійснення для цієї фази додатково містити суміш, щонайменш, одного емульгатора з жиром або олією або і з жиром, і з олією. [0088] Переважно гідрофільний емульгатор включають разом з ліпофильним емульгатором так, щоб він діяв як стабілізатор. У деяких варіантах здійснення також є переважним включення й олії, і жиру. Сумісно емульгатор(емульгатори) з або без стабілізатора(стабілізаторів) утворюють так званий емульсійний віск, а віск разом з олією та/або жиром утворюють так звану емульсійну мазеву основу, що утворює маслянисту дисперсну фазу кремових сполук. [0089] Емульгуючі речовини й емульсійні стабілізатори, що підходять для застосування в складі даного винаходу, включають Tween 60, Span 80, цетостеариловий спирт, міристиловий спирт, гліцерилмоностеарат і лаурилсульфат натрію. [0090] Вибір придатних олій або жирів для сполуки ґрунтується на досягненні бажаних властивостей (наприклад, косметичних властивостей), оскільки розчинність активної сполуки/засобу в більшості олій, ймовірних до застосування у фармацевтичних емульсійних сполуках, дуже низька. Так, креми переважно повинні бути нежирними, що не залишають плям, і продуктами, що змиваються, із придатною консистенцією, щоб уникнути витікання з тюбиків або інших ємностей. Можна застосовувати моно- або двоосновні алкільні складні ефіри з прямим або розгалуженим ланцюгом, такі як діізоадипат, ізоцетилстеарат, пропілeнгліколеві складні діефіри жирних кислот з кокосу, ізопропілміристат, децилолеат, ізопропілпальмітат, бутилстеарат, 2-етилгексилпальмітат або суміш складних ефірів з розгалуженим ланцюгом, відомих як Crodamol CAP, останні три є переважними складними ефірами. Їх можна застосовувати окремо або в комбінації, залежно від необхідних властивостей. Альтернативно, 19 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 60 можна застосовувати ліпіди з високою температурою плавлення, такі як білий м'який парафін і/або вазелінова олія або інші мінеральні олії. [0091] Склади, що придатні для місцевого введення в око, також включають очні краплі, де активний компонент розчинений або суспендований у придатному носії, особливо у водному розчиннику для засобу. [0092] Склади для ректального введення можуть бути представлені як супозиторій із придатною основою, що містить, наприклад, олію какао або саліцилат. [0093] Склади, що підходять для вагінального введення, можуть бути представлені як песарії, креми, гелі, пасти, піни або склади розчину, що розпилюється, які містять додатково до засобу відповідні носії, відомі в даній галузі. [0094] Склади, що підходять для назального введення, де носій є твердим, включають грубі порошки, що мають розмір часток, наприклад, у діапазоні від близько 20 до близько 500 мікронів, що вводять способом, при якому лікарський порошок для вдихання через ніс приймають всередину, тобто, швидким вдиханням (наприклад, примусовим) через носовий хід з ємності порошку, підтримуваної близько до носа. Інші придатні склади, де носій являє собою рідину для введення, включають, але не обмежуються, назальні розчини, що розпилюються, краплі або аерозолі в розпилювачі і включають водні або масляні розчини засобів. [0095] Сполуки, що підходять для парентерального введення, включають водні і безводні ізотонічні стерильні ін'єкційні розчини, що можуть містити антиоксиданти, буферні розчини, бактеріостатичні фактори та розчинені речовини, що роблять склад ізотонічним із кров'ю призначеного реципієнта; і водні, і безводні стерильні суспензії, що можуть включати суспендуючі засоби і загущувачі, і ліпосоми або інші системи мікрочастинок, що призначені для націлювання сполуки на кров'яні компоненти або один або більше органів. У деяких варіантах здійснення сполуки присутні/сформульовані в герметизованих ємностях однократної дози або багаторазової дози, наприклад, ампулах і бульбашках, і можуть зберігатися у висушеному сублімацією (ліофілізованому) стані, що вимагають тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням. Приготовлені для незапланованого прийому ін'єкційні розчини та суспензії можна приготувати зі стерильних порошків, гранул і таблеток способом, описаним раніше. [0096] Переважні сполуки в стандартній лікарській формі є утримуючими добову дозу або однократну, денну субдозу засобу, як вище викладено в даному документі, або їхню цільову фракцію. [0097] Варто мати на увазі, що в доповненні до компонентів, зокрема згаданим вище, склади даного винаходу можуть включати інші засоби, традиційні в даній галузі, що мають відношення до типу обговорюваного складу, наприклад, ті, що підходять для орального введення, можуть включати такі додаткові засоби як підсолоджувачі, загущувачі й ароматизуючі засоби. Також мають на увазі, що засоби, композиції та способи даного винаходу комбінують з іншими придатними композиціями та терапіями. Проте, інші сполуки факультативно включають харчові добавки (придатні підсолоджувачі, ароматизатори, фарбуючі речовини і т.д.), рослинні поживні речовини (наприклад, лляна олія), мінерали (наприклад, Ca, Fe, K і т.д.), вітаміни й інші прийнятні композиції (наприклад, сполучена лінолева кислота), розріджувачі та стабілізатори і т. д. C. Розгляд показових способів введення препарату і дозування [0098] Відомі різноманітні системи доставки та їх можна застосовувати для введення терапевтичних засобів (наприклад, показові сполуки, як описано вище) даного винаходу, наприклад, інкапсуляція в ліпосоми, мікрочастинки, мікрокапсули, опосередкований рецепторами ендоцитоз і подібне. Способи доставки включають, але не обмежуються, внутрішньоартеріальний, внутрішньом'язовий, внутрішньовенний, інтраназальний і оральний способи застосування. У особливих варіантах здійснення може бути бажаним введення фармацевтичних композицій даного винаходу місцево в ділянку, що вимагає лікування; це може бути досягнуто, наприклад, без обмеження, шляхом місцевої інфузії під час операції, або ін'єкцією за допомогою катетеру. [0099] Ідентифіковані засоби можна вводити суб'єктам або індивідуумам схильним або з ризиком розвитку патологічного росту цільових клітин і корельованих станів. Коли засіб вводять суб'єкту, такому як миша, пацюк або людина, засіб можна додавати до фармацевтично прийнятного носія та системно або місцево вводити суб'єкту. Для ідентифікації пацієнтів, яких можна благополучно вилікувати, зразок тканини відокремлюють у пацієнта і клітини досліджують на чутливість до засобу. [00100] У деяких варіантах здійснення введення in vivo здійснюють однією дозою, безупинно або періодично протягом курсу лікування. Способи визначення найбільш ефективних засобів і 20 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 дозування введення добре відомі фахівцю в даній галузі, і їх змінюють у залежності від композиції, застосовуваної для терапії, мети терапії, цільової клітини, що підлягає лікуванню, і суб'єкта, що підлягає лікуванню. Однократні або багаторазові введення виконують з рівнем дози та схемою, вибраними лікуючим лікарем. [00101] Придатне дозування сполук і способів введення засобів без важкості визначається фахівецем у даній галузі. Переважно сполуки вводять від близько 0,01 мг/кг до близько 200 мг/кг, більш переважно від близько 0,1 мг/кг до близько 100 мг/кг, ще більш переважно від близько 0,5 мг/кг до близько 50 мг/кг. Коли сполуки, описані в даному документі, вводять разом з іншим засобом (наприклад, сенсибілізуючі засоби), ефективна кількість може бути менше, ніж коли засіб застосовують окремо. [00102] Фармацевтичні композиції можуть вводитися орально, інтраназально, парентерально або інгаляційною терапією та можуть мати форму таблеток, коржів, гранул, капсул, драже, ампул, супозиторіїв або аерозольну форму. Вони також можуть мати форму суспензій, розчинів і емульсій активного компонента у водних або безводних розріджувачах, сиропах, гранулятах або порошках. Додатково до засобу даного винаходу фармацевтичні композиції можуть також містити інші фармацевтично активні сполуки або кілька сполук даного винаходу. [00103] Конкретніше, засіб даного винаходу, також згаданий в даному документі як активний компонент, можна ввести для терапії будь-яким придатним способом застосування, що включає, але не обмежується, оральний, ректальний, назальний, місцевий (включаючи, але не обмежуючись, трансдермальний, аерозольний, букальний і сублінгвальний), вагінальний, перентеральний (включаючи, але не обмежуючись, підшкірний, внутрішньом'язовий, внутрішньовенний і інтрадермальний) і пульмональний. Також розуміють, що переважний спосіб застосування змінюють у залежності стану та віку реципієнта і хвороби, що підлягає лікуванню. [00104] В ідеалі, засіб потрібно вводити, щоб досягти пікових концентрацій активної сполуки в місцях хвороби. Це можна досягти, наприклад, внутрішньовенною ін'єкцією засобу, факультативно у фізіологічному розчині, або оральним введенням, наприклад, таблеткою, капсулою або сиропом, що містять активний компонент. [00105] Бажані рівні в крові засобу можна підтримувати безупинною інфузією, щоб забезпечити терапевтичну кількість активного компонента в хворій тканини. Припускають, що застосування оперативних комбінацій забезпечує терапевтичні комбінації, що вимагають більш низького загального дозування кожного компонента противірусного засобу, ніж може знадобитися, коли кожна окрема терапевтична сполука або ліки застосовують окремо, тим самим зменшуючи несприятливі ефекти. D. Розгляд показових способів сумісного введення препарату та дозування [00106] Як описане вище, даний винахід включає способи, що стосуються сумісного введення сполук, описаних у даному документі, з одним або більше додатковим активним засобом. Дійсно, це ще один аспект даного винаходу, що забезпечує способи для покращення терапій рівня техніки і/або фармацевтичних композицій спільним введенням сполуки даного винаходу. У процедурах сумісного введення засоби можна вводити одночасно або послідовно. В одному варіанті здійснення сполуки, описані в даному документі, вводять до іншого активного засобу(засобів). Фармацевтичними складами та шляхами введення може бути будь-який, описаний вище. Визначення цільового типу і дозування променевої терапії відомі фахівцю в даній галузі, або їх можна визначити відносно легко. [00107] Сенсибілізуюча функція заявлених сполук також спрямована на рішення проблем, пов'язаних з токсичними впливами відомої клінічної медицини. У випадках, коли відомий засіб токсичний, бажано обмежити дозування, що вводяться у всіх випадках і, зокрема, у тих випадках, коли через стійкість до лікарського засобу перевищують необхідне дозування. Коли заявлені сполуки вводять разом з відомим засобом, вони знижують необхідне дозування, що, у свою чергу, знижує шкідливі впливи. Приклади [00108] Даний винахід, описаний у цілому, буде більш легко зрозуміти завдяки посиланню на наступні приклади, що включили лише для цілей ілюстрації певних аспектів і варіантів здійснення даного винаходу, а не для обмеження даного винаходу. Приклад 1 Типові процедури N-алкілювання ізатових ангідридів 21 UA 99839 C2 Me N O Cl 5 10 15 O O [00109] 6-Хлор-1-метил-1H-бензо[d][1,3]оксазин-2,4-діон (B1). У 3 літровій 3-горлій RBF (круглодонній колбі), оснащеній механічним перемішуванням, додатковою лійкою, термоелементом і введенням N2, суспендували Na (30,4 г) у безводному тетрагідрофурані (THF, 400 мл). Під час перемішування при кімнатній температурі суспензію 5-хлорізотонічного ангідриду в THF (400 мл) додавали порціями протягом 45 хвилин. Реакційну суміш 0 перемішували протягом 50 хвилин (температура реакції підвищилася з 18 до 28 C). До цього 0 додали CH3I (285 г, 125 мл) за 15 хвилин. Суміш потім перемішали при 42 C протягом 16 годин. Через те, що TLC (тонкошарова хроматографія) показала, що деяка вихідна речовина, яка не прореагувала, все ще була присутня в реакційній суміші, додали додаткові 30 мл CH 3I і 0 реакційну суміш перемішували при 42 C протягом додаткових 3 годин. Реакційну суміш остудили (RT (кімнатна температура)) і погасили повільним (40 хвилин) додаванням AcOH (55 мл). Реакційну суміш сконцентрували, що дало 275 г в'язкого сиропоподібного продукту, що 1 застосували без будь-якого додаткового очищення. H NMR (ядерно-магнітний резонанс) (300 МГц, CDCl3) δ 3,35 (s, 3 H), 7,54 (d, 1 H), 7,85 (d, 1 H), 7,90 (s, 1 H). MeO N O O Cl O 20 25 30 35 [00110] 6-Хлор-1-(4-метоксибензил)-1H-бензо[d][1,3]оксазин-2,4-діон (B2). У 3 літровій 3горлій RBF, оснащеній механічним перемішуванням, термоелементом і введенням N 2, суспендували 90 г (0,455 моль) 5-хлорізотонического ангідриду в безводному THF (0,9 л). Під N 2 додали 4-метоксибензилхлорид (75 г, 0,48 моль), за яким слідувало додавання тетрабутиламонію йодиду (84 г, 0,23 моль). Реакційну суміш перемішували протягом 5 хвилин при кімнатній температурі, а потім додавали 20 г (0,5 моль) Na порціями протягом 20 хвилин 0 (температура реакції підвищилася до 29 C завдяки екзотермічному ефекту, і внаслідок цього 0 реакційну суміш помістили у водяну баню, щоб підтримувати температуру нижче 30 C). Реакцію перемішували протягом 16 годин (RT). Наступного дня HPLC (високоефективна рідинна хроматографія) показала близько 26 % 5-хлорізотонічного ангідриду, що не прореагував. 0 Додали додатковий Na (1 г), реакційну суміш нагріли до 32 C і перемішували ще 5 годин. NMR показав, що вся вихідна речовина витратилася. Реакцію погасили повільним додаванням 10 г льодяної оцтової кислоти, за яким слідувало перемішування протягом 30 хвилин. Реакційну суміш профільтрували через броунмілерит, і осад на фільтрі промили THF. Фільтрат сконцентрували, що дало 280 г неочищеного продукту (жовто-коричнева тверда речовина), що 1 використовували без додаткового очищення. H NMR (300 МГц, DMSO-d6) δ 3,8 (s, 3 H), 5,25 (s, 2 H), 6,8 (d, 2 H), 7,2 (m, 3 H), 7,75 (d, 1 H), 7,9 (d, 1 H). Приклад 2 Типові процедури перетворення ізатового ангідриду в бензодіазепіндіон Me N Cl 40 O NH O [00111] 7-Хлор-1-метил-3,4-дигідро-1H-бензо[e][1,4]діазепін-2,5-діон (C1). У 2 літровій RBF, оснащеній механічним перемішуванням, холодильником і введенням N 2, гліцин (38 г, 0,506 моль) додали до сирого B1 (107 м, 0,506 моль), за яким слідувало додавання AcOH (500 мл). 0 Реакційну колбу нагрівали в 130 C масляній бані протягом 7 годин. Розчинник випарили під 0 вакуумом при нагріванні (50-60 C). До в'язкого сиропоподібного неочищеного продукту додали 1 22 UA 99839 C2 5 10 л EtOAc, за яким слідувало повільне додавання водного NaHCO 3 (насиченого), щоб довести pН до ~7. Потім додали 10 мл 2 M NaOH, щоб довести pН до ~9-10. Суміш дала тверду фазу разом з органічним і водним шарами. Тверду фазу відфільтрували, що дало продукт, що містить деяку кількість домішок. Тверду фазу розділили між 400 мл дихлорметану (DCM) і 200 мл NaHCО3, і отриману в результаті завись перемішували протягом 20 хв., потім відфільтрували, щоб видалити нерозчинну домішку. Шар DCM розділили і промили 3 % NaHCO3 і потім соляним розчином (200 мл). Шар DCM висушили (MgSO4), відфільтрували та сконцентрували, що дало 50 г чистого продукту. Шар EtOAc сконцентрували, що дало 67 г твердого продукту з деякою домішкою. Водяний шар екстрагували EtOAc (2 × 400 мл). Комбіновані органічні речовини висушили над Na2SO4, відфільтрували та сконцентрували, що дало додаткові 6,7 г неочищеного продукту. Всього одержали 123,4 г продукту, 50 г з яких були дуже чистими (вихід ~кількісний). 1 H NMR (300 МГц, CDCl3) δ 3,2 (s, 3 H), 3,5 (m, 1 H), 3,8 (m, 1 H), 7,35 (d, 1 H), 7,6 (m, 2 H), 8,8 (t, 1 H). MeO N O NH Cl O 15 20 25 30 [00112] 7-Хор-1-(4-метоксибензил)-3,4-дигідро-1H-бензо[e][1,4]діазепін-2,5-діон (C2). У 2 літровій RBF оснащеній механічним перемішуванням, холодильником і введенням N2, гліцин (34 г, 0,45 моль) додали до B2 (280 г), за яким слідувало додавання AcOH (500 мл). Реакційну колбу 0 нагрівали в 130 C масляній бані протягом 8 годин. Розчинник видалили на роторному випарнику 0 при 50-60 C. До в'язкого сиропоподібного неочищеного продукту додали гептан (1 л) і H 2O (1 л), за яким слідувало додавання NaHCO3, щоб довести pН до ~8-9. Суміш дала тверду фазу разом з органічним і водним шарами. Органічний і водний шари декантували, а тверду фазу суспендували з 500 мл 5 % розчину NaHCO3. Шар NaHCO3 декантували, а липку тверду фазу суспендували в 700 мл етилацетату (EtOAc) і 300 мл дихлорметану (DCM). Суміш перемішували протягом 20 хвилин, відфільтрували та осад на фільтрі промили 1 л DCM. Фільтрат сконцентрували та залишок пропустили через 330 г силікагелевої вставки за допомогою 25/75-75/25 EtOAc/гептан (всього 8 л). Чисті фракції об'єднали, що дало 58 г чистого продукту. Додаткові 13 г ~70 % чистого продукту отримали з менш чистих фракцій. Вихід 1 продукту склав 47 % за два етапи. H NMR (300 МГц, DMSO-d6) δ 3,45 (m, IH), 3,6 (s, 3 H), 3,8 (m, IH), 4.8 (d, IH), 5,3 (d, IH), 6,8 (d, 2 H), 7,1 (d, 2 H), 7,7-7,5 (m, 3 H), 8,9 (t, 1 H). Приклад 3 Типові процедури синтезу імідоїл хлориду Me O N Cl 35 40 N Cl [00113] (E)-5,7-Дихлор-1-метил-1H-бензо[e][1,4]діазепін-2(3H)-он (D1). У 1 літровій 2-горлій RBF, оснащеній механічним перемішуванням, холодильником і введенням N 2, суспендували C1 (42,5 м, 0,189 моль) у 400 мл толуолу. До цього додали N, N-диметиланілін (45,5 г, 0,375 моль), за яким слідувало додавання POCl3 (29 г, 0,189 моль), і реакційну суміш перемішували протягом 0 3 хвилин при кімнатній температурі (RT). Реакційну колбу помістили в 90 C масляну баню, реакційну суміш перемішували/нагрівали протягом 7 годин, а потім при RT протягом 9 годин. Реакцію погасили додаванням 500 мл льодяної води і перемішували протягом 15 хвилин. Органічний шар відокремили та швидко промили холодною 0,5 M HCl (300 мл), холодною водою (300 мл), а потім холодним насиченим NaHCO3 (300 мл). Органічний шар висушили (MgSO 4), відфільтрували та сконцентрували на роторному випарнику, що дало 40 г жовтої твердої фази. 1 Вихід продукту склав 87,5 %. H NMR (300 МГц, DMSO-d6) δ 3,25 (s, 3 H), 3,8-3,9 (s, 1 H, br), 4,34,4 (s, IH, br), 7,4 (d, 1 H), 7,7-7,8 (m, 2 H). 23 UA 99839 C2 MeO O N Cl 5 10 15 20 25 30 35 40 45 50 N Cl [00114] (E)-5,7-Дихлор-1-(4-метоксибензил)-1H-бензо[e][1,4]діазепін-2(3H)-он. У 1 літровій 3горлій RBF, оснащеній магнітною мішалкою, холодильником і введенням N 2, суспендували C2 (45 м, 0,136 моль) у 400 мл толуолу. До цього додали N, N-диметиланілін (33 г, 0,272 моль), за яким слідувало додавання POCl3 (23 г) і реакцію перемішували протягом 3 хвилин (RT). 0 Реакційну колбу помістили в 90 C масляну баню, реакційну суміш нагрівали протягом 5 годин, а потім остудили. Реакцію погасили додаванням 450 мл льодяної води і перемішували протягом 15 хвилин. Органічний шар відокремили і швидко промили холодною водою (2 × 250 мл) і соляним розчином (300 мл). Органічний шар висушили над MgSO 4, відфільтрували та сконцентрували на роторному випарнику, що дало 57 г чорного неочищеного продукту. Неочищений продукт застосували на наступному етапі без додаткового очищення. Вихід продукту склав 87,5 %. Приклад 4 Типові процедури приготування бензилгалогенідів [00115] Бензилгалогеніди можна приготувати з відповідного бензилового спирту за допомогою відомих процедур, таких як обробка бензилового спирту тіонілхлоридом. Ряд бензилових спиртів комерційно доступні. До того ж, ряд бензилових спиртів можна приготувати, застосовуючи наступні способи: i) відновлення комерційно доступної карбоксильної кислоти (наприклад, відновлення за допомогою літійалюміній гідриду); ii) перетворення дибромбензилового спирту в діалкіл-бензиловий спирт за допомогою, наприклад, діалкілцинкового реактиву в присутності паладієвого каталізатора, такого як PdCl2(dppf); iii) перетворення дибромбензилацетату в діалкілбензилацетат, з наступним гідролізом; iv) формулювання відповідної ароматичної сполуки, з наступним відновленням; або v) перетворення реакційноздатного хлорбензоатного складного ефіру у відповідний алкілбензоатний складний ефір за допомогою, наприклад, реактиву Гринь'яру в присутності залізного каталізатора, такого як Fe(acac)3, з наступним відновленням. Частина 1: Типові процедури приготування заміщеного бензилового спирту з дибромтолуолу [00116] 1,3-дибром-2-(бромметил)бензол. Суміш 2,6-дибромтолуолу (22,9 г, 92 ммоль), Nбромсукциніміду (ΝBS) (15 г, 84 ммоль), CCl 4 (250 мл) і бензоїлпероксиду (0,03 еквіваленти) 0 перемішували при 85 C (температура гарячої масляної бані) протягом 16 годин, остудили до RT, відфільтрували, промили водним NaHSO3, висушили (Na2SO4), відфільтрували і випарили, що дало 29,5 г (вихід склав 98 %) названого продукту у вигляді білої твердої фази. Ця тверда фаза містить 10 % вихідного матеріалу, що не прореагував, але її успішно застосували без 1 додаткового очищення. H NMR (300 МГц, CDCl3) δ 4,81 (s, 2 H), 7,01 (t, 1 H), 7,53 (d, 2 H). [00117] 2,6-Дибромбензилацетат. Суміш 1,3-дибром-2-(бромметил)бензолу (27,6 г, 84 ммоль), NaOAc (35,5 г, 5 еквівалентів) і диметилформаміду (DMF) (150 мл) перемішували при 0 100 C (температура гарячої масляної бані) протягом 1,75 години, дозволили охолонути, а потім розділили між гептаном (500 мл) і водою (200 мл). Після видалення органічного шару водний шар екстрагували з гептаном (200 мл). Об'єднані органічні сполуки промили H 2O (2 × 300 мл), висушили (Na2SO4), відфільтрували та випарили, що дало 24,57 г (вихід еквівалента 95 %) названого продукту у виді безкольорової олії. Ця олія містить 13 % вихідного матеріалу, що не 1 прореагував, але його успішно застосували без додаткового очищення. H NMR (300 МГц, CDCl3) δ 2,10 (s, 3 H), 5,41 (s, 2 H), 7,08 (t, 1 H), 7,58 (d, 2 H). [00118] 2,6-Діетилбензилацетат. До охолодженої (баня сухий лід-ацетон) суміші 2,6-дибромбензилацетату (5,05 г, 16,4 ммоль) і PdCl2(dppf) (0,08 еквівалента) у сухому THF (50 мл) додали 1,1 M Et2Zn (60 мл, 66 ммоль, 4 еквіваленти). Суміш, що утворилася, нагріли до RT, 0 перемішували при 45 C (запрограмована температура блоку, ~40 годин) і додали до перемішаної суміші розведеної HCl і гептан/EtOAc. Органічний шар висушили (Na 2SO4), відфільтрували і випарили. Хроматографія (2 %-10 % EtOAc/гептан ступінчатий градієнт) дав 1 2,12 г (вихід склав 63 %) названого продукту разом з 0,20 г 2,6-діетилбензилового спирту. H NMR (300 МГц, CDCl3) δ 1,21 (t, 6 H), 2,07 (s, 3 H), 2,70 (q, 4 H), 5,19 (s, 2 H), 7,09 (d, 2 H), 7,22 (dd, 1 H). Наступну сполуку приготували виконанням відповідних заміщень відповідно до вищезгаданої процедури. 24 UA 99839 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 [00119] 2,6-Диметилбензилацетат. H NMR (300 МГц, CDCl3) δ 2,06 (s, 3 H), 2,39 (s, 6 H), 5,17 (s, 2 H), 7,02 (d, 2 H), 7,12 (dd, 1 H). [00120] (2,6-Діетилфеніл)метанол. Суміш 2,6-діетилбензилацетату (2,11 г, 10,2 ммоль), MeOH (20 мл), H2O (6 мл) і NaOH (1,99 г, 50 ммоль, 5 еквівалентів) перемішували при RT протягом ночі. Після концентрування суміш екстрагували з гептаном (50 мл). Органічний шар 1 висушили (Na2SO4), відфільтрували і випарили, що дало 1,90 г названого продукту. H NMR (300 МГц, CDCl3) δ 1,23 (t, 1 H, OH), 1,24 (t, 6 H), 1,37 (br s, 1 H), 2,79 (q, 4 H), 4,75 (d, 2 H), 7,09 (d, 2 H), 7,21 (dd, 1 H). Наступну сполуку приготували виконанням відповідних заміщень відповідно 1 до вищезгаданої процедури: (2,6-диметилфеніл)метанол. H NMR (300 МГц, CDCl3) δ 1,25 (t, 1 H, OH), 2,41 (s, 6 H), 4,72 (d, 2 H), 7,0-7,15 (m, 3 H). Частина 2: Типова процедура для синтезу алкіл-заміщеного бензоатного складного ефіру з галогензаміщеного бензоатного складного ефіру [00121] Метил 2,4-діетилбензоат. До суміші Fe(acac)3 (0,34 г, 0,96 ммоль), метил-2,40 дихлорбензоату (4,0 г, 19,6 ммоль) і N-метил-2-піролідинону (8 мл) у THF (100 мл) при -20 C під азотом додавали тетрагідрофурановий (THF) розчин (1,0 M) етилмагнійброміду (40,0 мл, 40,0 ммоль) протягом ~5 хвилин. Суміш, що утворилася, перемішували при поступовому нагріванні до температури навколишнього середовища. Перемішування продовжувалося протягом додаткових 17 годин. Реакційну суміш розділили між водою та дихлорметаном. Органічний шар відокремили, промили соляним розчином, висушили (MgSO4) і відкачали помпою насухо при зниженому тиску. Коричневий залишок очистили колонковою хроматографією (SiO2, 20 % EtOAc/гептан), що дало 1,2 г бажаного продукту у виді прозорої олії (вихід склав 32 %), разом з 1 1,1 г метил-4-етилбензоату. H NMR (300 МГц, DMSO-d6) δ 1,15 (t, 3 H), 1,20 (t, 3 H), 2,66 (q, 2 H), 2,92 (q, 2 H), 3,82 (s, 3 H), 7,15 (d, 1 H), 7,23 (s, 1 H), 7,76 (d, 1 H). Частина 3: Типова процедура для синтезу алкіл-заміщеного бензальдегіду з алкілзаміщеного бензолу [00122] 2,5-Діізопропілбензальдегід. У 200 мл одногорлій RBF, оснащеній магнітною мішалкою, розчинили 1,4-діізопропілбензол (4 г, 25 ммоль) у 50 мл хлороформу. До цього розчину додавали SnCl4 (11,5 г, 5,2 мл, 4,5 ммоль) за допомогою шприца протягом 5 хвилин. Реакційну суміш перемішували протягом 5 хвилин, а потім додавали Cl 2CHOMe (2,8 г, 24 ммоль) за допомогою шприца протягом 15 хвилин. Реакційну суміш перемішували протягом 20 годин (RT) і після протікання реакції виконали GC/MS (газова хроматографія/масспектрометрія). Реакцію погасили додаванням 70 мл води та перемішуванням суміші протягом 10 хвилин. Органічний шар відокремили та промили 3 Н HCl (2 × 50 мл). Органічний шар висушили над MgSO4, відфільтрували і сконцентрували, що дало 4 г неочищеного продукту. Його піддали колонковій хроматографії із застосуванням 80 г діоксиду кремнію та від 100 % 1 гептану до 95:5 гептан:EtOAc як рухливої фази, що дало 2,4 г продукту (вихід склав 56 %). H NMR (300 МГц, CDCl3) δ 1,17 (d, 6 H), 1,25 (d, 6 H), 2,9 (септет, 1 H), 4,9 (септет, 1 H), 7,4 (m, 2 H), 7,65 (d, 1 H), 10,35 (s, 1 H). [00123] Наступну сполуку приготували на основі вищезгаданої процедури: 3,41 діетилбензальдегід. H NMR (300 МГц, DMSO-d6) δ 1,21 (m, 6 H), 2,72 (q, 4 H), 7,41 (d, 1 H), 7,71 (d, 1 H), 7,75 (s, 1 H). Частина 4: Типова процедура для синтезу алкіл-заміщеного бензилового спирту з алкілзаміщеного бензальдегіду [00124] (2,5-Діізопропілфеніл)метанол. У 2-горлій RBF, оснащеній магнітною мішалкою і введенням N2, розчинили 2,5-діізопропілбензальдегід (1,7 г, 9 ммоль) у 30 мл EtOH і додавали NaBH4 (0,37 г, 10 ммоль) протягом 20 хвилин (порціями). Після 18 годинного перемішування при RT ~95 % розчинника виділили на роторному випарнику, потім додали 5 мл 0,5 M HCl і продукт екстрагували з 25 мл EtOAc. Органічний шар промили 15 мл H2O і 15 мл соляного розчину, висушили над Na2SO4 відфільтрували та сконцентрували насухо, щоб одержати неочищений продукт. Цей матеріал піддали хроматографії зі застосуванням гептан:EtOAc як рухливої фази, 1 що забезпечило 1,1 г чистого продукту. Вихід склав 65 %. H NMR (300 МГц, CDCl3) δ 1,2-1,3 (d, 12 H), 2,8 (септет, 1 H), 3,2 (септет, 1 H), 5,7 (s, 2 H), 7,1-7,3 (m, 3 H). Частина 5: Типова процедура для синтезу алкіл-заміщеного бензилового спирту з дибромбензилового спирту [00125] (3,5-Діетилфеніл)метанол. До охолодженої (сухий лід) суміші 3,5дибромбензилового спирту (1 г, 3,8 ммоль) і PdCl2(dppf)[0,07 еквіваленти] у сухому THF (10 мл) додали 1,1 M Et2Zn (15 мл, 16 ммоль, 4,4 еквіваленти). Суміш, що утворилася, нагріли до RT, 0 перемішали при 45 C (запрограмована температура блоку, протягом ночі). Щоб призвести реакцію до завершення (зникнення і вихідного матеріалу, і моноалкільованого продукту) додали додаткові 1,1 M Et2Zn (10 мл, 11 ммоль, 2,9 еквіваленти) з безупинним перемішуванням при 25 UA 99839 C2 0 5 10 15 20 25 30 35 40 45 50 55 60 45 C (знову протягом ночі). Після охолодження реакційну суміш потім додали до перемішаної суміші розведеної HCl і гептан/EtOAc (2:1; ~200 мл), органічний шар висушили (Na 2SO4), відфільтрували та випарили. Хроматографія (10 % EtOAc/гептан) дала 0,33 г (вихід склав 53 %) 1 названого продукту. H NMR (300 МГц, CDCl3) δ 1,22 (t, 6 H), 1,65 (br s, 1 H), 2,61 (q, 4 H), 4,66 (s, 2 H), 6,95-7,05 (m, 3 H). [00126] Наступні сполуки приготували виконанням відповідних заміщень відповідно до вищезгаданої процедури. 1 [00127] (2,5-Діетилфеніл)метанол. H NMR (300 МГц, CDCl3) δ 1,22 (t, 6 H), 1,50 (br s, 1 H), 2,61 (q, 2 H), 2,65 (q, 2 H), 4,70 (br s, 1 H), 7,0-7,2 (m, 3 H). 1 [00128] (3,4-Діетилфеніл)метанол. H NMR (300 МГц, DMSO-d6) δ 1,14 (t, 3 H), 1,20 (t, 3 H), 2,62-2,70 (m, 4 H), 4,46 (d, 2 H), 5,03 (t, 1 H), 7,05-7,13 (m, 3 H). Частина 6: Типова процедура для синтезу алкіл-заміщеного бензилового спирту з алкілзаміщеного бензилового складного ефіру [00129] (2,4-Діетилфеніл)метанол. До суспензії літійалюміній гідриду (0,47 г, 11,8 ммоль) у безводному THF (20 мл) при кімнатній температурі під азотом додали розчин метил-2,4діетилбензоату (1,5 г, 7,8 ммоль) у THF (15 мл) з перемішуванням протягом ~5 хвилин. Суміш, що утворилася, перемішували при кімнатній температурі протягом 60 хвилин і потім погасили повільним додаванням етилацетату (доки не припиниться виділення бульбашок). Суміш розділили між етилацетатом і 1Н HCl (водний). Водний шар відокремили й екстрагували з етилацетатом. Органічні шари об'єднали, висушили (MgSO 4) і випарили насухо, що дало 1,3 г 1 бажаного спирту у вигляді прозорої олії (вихід склав 100 %). H NMR (300 МГц, CDCl3) δ 1,13 (t, 3 H), 1,17 (t, 3 H), 2,58 (q, 2 H), 2,61 (q, 2 H), 4,43 (d, 2 H), 5,02 (t, 1 H), 7,05-7,11 (m, 3 H). Частина 7: Типова процедура для синтезу алкіл-заміщеного бензилгалогеніду з алкілзаміщеного бензилового спирту [00130] 2-(Хлорметил)-1,3-діетилбензол. До суміші (2,6-діетилфеніл)метанолу (1,83 г, 11,1 ммоль), толуолу (20 мл) і DMF (6 крапель) додали SOCl2 (2,1 г, 1,6 еквіваленти). Розчин, що утворився, перемішували при RT (1 година). Після випарювання насухо, залишок поглинули в гептані (~50 мл) і промили водою (~5 мл), висушили (Na2SO4), відфільтрували та випарили, що 1 дало 1,97 г (вихід склав 97 %) названого продукту. H NMR (300 МГц, CDCl3) δ 1,28 (t, 6 H), 2,79 (q, 2 H), 4,70 (s, 2 H), 7,09 (d, 2 H), 7,20 (m, 1 H). [00131] Наступні сполуки приготували виконанням відповідних заміщень відповідно до вищезгаданої процедури. 1 [00132] l-(Хлорметил)-2,3-диметилбензол. H NMR (300 МГц, CDCl3) δ 2,29 (s, 3 H), 2,31 (s, 3 H), 4,60 (s, 2 H), 7,0-7,2 (m, 3 H). 1 [00133] 1-(Йодметил)-2,4-диметилбензол. H NMR (300 МГц, CDCl3) δ 2,23 (s, 6 H), 4,35 (s, 2 H), 6,9-7,05 (m, 2 H), 7,1 (d, 1 H). 1 [00134] 1-(Хлорметил)-3,4-диметилбензол. H NMR (300 МГц, CDCl3) δ 2,20 (s, 6 H), 4,67 (s, 2 H), 7,1-7,2 (m, 3 H). 1 [00135] 2-(Хлорметил)-1,3-диметилбензол. H NMR (300 МГц, CDCl3) δ 2,42 (s, 6 H), 4,64 (s, 2 H), 7,02 (d, 2 H), 7,12 (dd, 1 H). 1 [00136] 2-(Йодметил)-1,4-диметилбензол. H NMR (300 МГц, CDCl3) δ 2,22 (s, 3 H), 2,26 (s, 3 H), 4,15 (s, 2 H), 6,9-7 (m, 2 H), 7,16 (d, 1 H). 1 [00137] 1-(Хлорметил)-2-етилбензол. H NMR (300 МГц, CDCl3) δ 1,2-1,3 (t, 3 H), 2,75 (q, 2 H), 4,55 (s, 2 H), 7,1-7,35 (m, 4 H). 1 [00138] 1-(Хлорметил)-2,4-діетилбензол. H NMR (300 МГц, CDCl3) δ 1,27 (m, 6 H), 2,69 (q, 2 H), 2,78 (q, 2 H), 4,66 (s, 2 H), 6,98-7,10 (m, 2 H), 7,26 (m, 1H, містить сигнал хлороформу). 1 [00139] 1-(Хлорметил)-3,4-діетилбензол. H NMR (300 МГц, DMSO-d6) δ 1,21 (t, 3 H), 1,25 (t, 3 H), 2,60 (q, 2 H), 2,64 (q, 2 H), 4,71 (s, 2 H), 7,15-7,40 (m, 3 H). 1 [00140] 1-(Хлорметил)-3,5-діетилбензол. H NMR (300 МГц, CDCl3) δ 1,23 (t, 6 H), 2,63 (q, 4 H), 4,54 (s, 2 H), 7,01 (d, 2 H), 7,05 (d, 1 H). 1 [00141] 2-(Хлорметил)-1,4-діетилбензол. H NMR (300 МГц, CDCl3) δ 1,22 (t, 3 H), 1,26 (t, 3 H), 2,61 (q, 2 H), 2,84 (q, 2 H), 4,60 (s, 2 H), 7,0-7,2 (m, 3 H). 1 [00142] 2-(Бромметил)-1,4-діізопропілбензол. H NMR (300 МГц, CDCl3) δ 1,1-1,2 (d, 6 H), 1,21,3 (d, 6 H), 2,8 (септет, 1 H), 3,25 (септет, 1 H), 4,55 (s, 2 H), 7,1-7,3 (m, 3 H). [00143] 1-(Хлорметил)-4-етилбензол і 1-(хлорметил)-4-ізопропілбензол. Приклад 5 Типові процедури для синтезу бензо[e][1,4]діазепін-2(3H)-онів з імідоїлхлоридів Частина I: Реакція паладієвого сполучення [00144] (Z)-7-хлор-5-(4-метоксифеніл)-1-метил-1H-бензо[e][1,4]діазепін-2(3H)-он (E1). У 1 літровій 3-горлій RBF, оснащеній магнітною мішалкою, холодильником, термоелементом і 26 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 60 введенням N2, розчинили неочищений D1 (30 г, 0,124 моль) у 300 мл етиленгліколю простого диметилового ефіру (DME). До цього додали розчин Na2CO3 (21 г, 0,2 моль у 200 мл H2O), за яким слідувало додавання 4-метоксифеніл борної кислоти (22 г, 0,145 моль) і Pd(PPh 3)4 (1,2 г, 0 8,3 ммоль). Реакційну суміш нагрівали в 85 C масляній бані під N2 протягом 2 годин, а потім остудили до кімнатної температури. До неї додали 200 мл EtOAc і суміш перемішували протягом 5 хвилин. Органічний шар відокремили і промили H 2O (200 мл) і соляним розчином (200 мл). Органічний шар висушили над MgSO 4 і потім концентрували насухо, що дало 53 г неочищеного продукту. Цей матеріал піддали силікагелевій хроматографії зі застосуванням 210 г силікагелю і EtOAc/гептан (від 12:88 до 30:70 до 50:50 до 70:30; всього 8 л рухливої фази). Фракції, що містять чистий продукт, об'єднали і сконцентрували насухо, що дало 42,7 г чистого 1 продукту в приблизно кількісному виході. H NMR (300 МГц, CDCl3) δ 3,38 (s, 3 H), 3,73 (d, 1 H), 3,85 (s, 3 H), 4,75 (d, 1 H), 6,9 (m, 2 H), 7,3 l(m, 2 H), 7,48-7,58 (m, 3 H). [00145] (Z)-7-хлор-1-(4-метоксибензил)-5-(4-метоксифеніл)-1H-бензо[e][1,4]діазепін-2(3H)-он (E2). У 1 літровій 3-горлій RBF, оснащеній магнітною мішалкою, холодильником, термоелементом і введенням N2, розчинили неочищений D2 (54 г) у 360 мл DME. До цього додали розчин Na2CO3 (23 г, 0,15 моль, у 250 мл H2O), за яким слідувало додавання 4метоксифеніл борної кислоти (22,7 г, 0,15 моль) і Pd(PPh3)4 (1,4 г, 1,2 ммоль). Реакційну суміш 0 нагрівали в 85 C масляній бані протягом 2 годин і потім остудили (RT). До неї додали 200 мл EtOAc і суміш перемішували протягом 5 хвилин. Органічний шар відокремили та промили 200 мл H2O і потім соляним розчином. Органічний шар сконцентрували насухо, що дало 68 г неочищеного продукту. Цей матеріал піддали колонковій хроматографії, застосовуючи 550 г силікагелю і 25/75-60/40 EtOAc/гептан. Фракції, що містять чистий продукт об'єднали, що дало 21 г чистого продукту, а інші фракції, що містять невелику кількість домішки, (шляхом TLC) дали 1 ще 20 г продукту. H NMR спектр обох партій виявився ідентичним. Усього одержали 41 г 1 продукту, забезпечуючи продукт із 72 % виходом за два етапи. H NMR (300 МГц, CDCl3) δ 3,7 (s, 3 H), 3,80 (d, 1 H), 3,85 (s, 3 H), 4,57 (d, 1 H), 4,85 (d, IH), 5,57 (d, 1 H), 6,63 (d, 2 H), 6,85-6,95 (m, 4 H), 7,16 (d, IH), 7,3-7,44 (m, 4 H). Частина II: C3-Алкілювання бензо[e][1,4]діазепін-2(3H)-онів [00146] (Z)-7-хлор-5-(4-метоксифеніл)-1-метил-3-(2-метилбензил)-1H-бензо[e][1,4]діазепін2(3H)-он. До перемішаного й охолодженого (баня сухий лід/ацетон) розчину E1 (0,50 г, 1,59 t ммоль) у THF (8 мл) повільно додали 1 M KO Bu (2,4 мл, 2,4 ммоль, 1,5 еквіваленти). Темночервону суміш, що утворилася, перемішували на бані сухий лід/ацетон ~10 хвилин, з наступним повільним додаванням розчину 2-метилбензилброміду (0,46 г, 2,5 ммоль, 1,5 еквіваленти) у 0 THF (2 мл). Після перемішування ще ~35 хвилин при -78 C реакційну суміш погасили водою та розбавили EtOAc. Органічний шар висушили (Na2SO4), відфільтрували та випарили (роторний вакуумний випарник, потім високий вакуум). Хроматографія на силікагелі зі застосуванням 2040 % EtOAc/гептан дала 0,56 г (вихід склав 84 %) названого продукту. Слід зазначити, що при використанні бензилхлоридів як алкілюючих засобів, тетрабутиламоній йодид додали разом з 1 алкілюючим засобом при низькій температурі. H NMR (300 МГц, CDCl3) δ 2,38 (s, 3 H), 3,41 (s, 3 H), 3,5-3,65 (m, 2 H), 3,74 (dd, 1 H), 3,84 (s, 3 H), 6,89 (dt, 2 H), 7,05-7,15 (m, 3 H), 7,25-7,35 (m, 3 H), 7,45-7,5 (m, 3 H). [00147] Наступні сполуки приготували виконанням відповідних заміщень відповідно до вищезгаданих процедур. [00148] (Z)-7-хлор-5-(4-метоксифеніл)-3-(3-бромбензил)-1-метил-1H-бензо[e][1,4]діазепін1 2(3H)-он. H NMR (300 МГц, CDCl3) δ 3,40 (s, 3 H), 3,45-3,55 (m, 2 H), 3,67 (dd, 1 H), 3,86 (s, 3 H), 6,91 (d, 2 H), 7,14 (t, 1 H), 7,25-7,3 (m, 3 H), 7,33 (ddd, 1 H), 7,45-7,55 (m, 4 H). [00149] (Z)-7-хлор-5-(4-метоксифеніл)-3-(3-метилбензил)-1-метил-1H-бензо[e][1,4]діазепін1 2(3H)-он. H NMR (300 МГц, CDCl3) δ 2,31 (s, 3 H), 3,38 (s, 3 H), 3,5-3,6 (m, 2 H), 3,68 (dd, 1 H), 3,82 (s, 3 H), 6,88 (d, 2 H), 6,99 (m, 1 H), 7,1-7,2 (m, 3 H), 7,2-7,3 (m, 3 H+CHCl3), 7,4-7,53 (m, 3 H). [00150] (Z)-7-хлор-3-(2,6-диметилбензил)-5-(4-метоксифеніл)-1-метил-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 2,39 (s, 6 H), 3,40 (dd, 1 H), 3,41 (s, 3 H), 3,72 (dd, 1 H), 3,82 (s, 3 H), 3,87 (dd, 1 H), 6,87 (d, 2 H), 6,98-7,04 (m, 3 H), 7,22 (тонка d, 1 H), 7,28 (d, 1 H), 7,39 (d, 2 H), 7,48 (dd, 1 H). [00151] (Z)-7-хлор-3-(3,5-диметилбензил)-5-(4-метоксифеніл)-1-метил-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 2,28 (s, 6 H), 3,39 (s, 3 H), 3,47 (m, 2 H), 3,65 (m, 1 H), 3,85 (s, 3 H), 6,82 (s, 1 H), 6,89 (m, 2 H), 6,97 (s, 2 H), 7,26 (m, 2 H), 7,47 (m, 3 H). [00152] (Z)-3-(2,6-Діетилбензил)-7-хлор-5-(4-метоксифеніл)-1-метил-1H-бензо[e][1,4]діазепін1 2(3H)-он. H NMR (300 МГц, CDCl3) δ 1,13 (t, 6 H), 2,65-2,8 (m, 2 H), 2,8-2,95 (m, 2 H), 3,43 (s, 3 H), 3,49 (dd, 1 H), 3,68 (dd, 1 H), 3,8-3,95 (m, 4 H, включає синглет для OMe при 3,84), 6,87 (d, 2 H), 7,04(dd, 2 H), 7,13 (dd, 1 H), 7,20 (тонка d, 1 H), 7,28 (d, 1 H), 7,40 (d, 2 H), 7,47 (dd, 1 H). 27 UA 99839 C2 5 10 15 20 25 30 35 40 45 50 55 [00153] (Z)-3-(3,4-Діетилбензил)-7-хлор-5-(4-метоксифеніл)-1-метил-1H-бензо[e][1,4]діазепін1 2(3H)-он. H NMR (300 МГц, DMSO-d6) δ 1,12 (m, 6 H), 2,45-2,75 (m, 4 H; містить DMSO сигнал), 3,3-3,45 (m, 2 H; містить бензилові протони, N-Me і H2O сигнали), 3,69 (m, 1 H), 3,81 (s, 3 H), 6,99 (m, 3 H), 7,09 (m, 1 H), 7,21 (s, 2 H), 7,48 (d, 2 H), 7,62 (d, 1 H), 7,70 (тонка dd, 1 H). [00154] (Z)-3-(3,5-Діетилбензил)-7-хлор-5-(4-метоксифеніл)-1-метил-1H-бензо[e][1,4]діазепін1 2(3H)-он. H NMR (300 МГц, CDCl3) δ 1,21 (t, 6 H), 2,58 (q, 4 H), 3,40 (s, 3 H), 3,52 (d, 2 H), 3,69 (t, 1 H), 3,84 (s, 3 H), 6,85-6,95 (m, 3 H; містить d при 6,90), 7,02 (тонка d, 2 H), 7,2-7,3 (m, 2 H; перекривається з CHCl3 сигналом), 7,47 (dd, 1 H), 7,53 (d, 2 H). [00155] (Z)-3-(4-Ізопропілбензил)-7-хлор-5-(4-метоксифеніл)-1-метил-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 1,23 (d, 6 H), 2,84 (септет, 1 H), 3,39 (s, 3 H), 3,51 (m, 2 H), 3,69 (dd, 1 H), 3,85 (s, IH), 6,89 (m, 2 H), 7,12 (m, 2 H), 7,26 (m, 4 H), 7,447,54 (m, 3 H). [00156] (Z)-3-(2,5-Діізопропілбензил)-7-хлор-5-(4-метоксифеніл)-1-метил-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, DMSO-d6) δ 0,96 (d, 3 H), 1,1 (d, 3 H), 1,14 (d, 3 H), 1,16 (d, 3 H), 2,8 (септет, 1 H), 3,17 (септет, 1 H), 3,35 (s, 3 H), 3,40 (m, 2 H), 3,70 (m, 1 H), 3,80 (s, 3 H), 6,9-7,2 (m, 6 H), 7,45 (d, 2 H), 7,6 (d, 1 H), 7,7 (d, 1 H). [00157] (Z)-3-(3-Бромбензил)-1-(4-метоксибензил)-7-хлор-5-(4-метоксифеніл)-1Hбензо[e][1,4]-діазепін-2(3H)-он. До перемішаного й охолодженого (баня сухий лід/ацетон) t розчину E2 (6,00 г, 14,2 ммоль) у THF (80 мл) повільно додали 1 M KO Bu (21 мл, 21 ммоль, 1,5 еквівалента). Темно-червону суміш, що утворилася, перемішували в бані сухий лід/ацетон ~10 хвилин з наступним повільним додаванням розчину 3-бромбензилброміду (5,10 г, 21,4 ммоль, 0 1,5 еквіваленти) у THF (15 мл). Після перемішування ще ~45 хвилин при -78 C реакційну суміш погасили насиченим соляним розчином і розведеним EtOAc. Органічний шар висушили (Na2SO4), відфільтрували та випарили (роторний вакуумний випарник, потім високий вакуум). Хроматографія на силікагелі зі застосуванням 10-30 % EtOAc/гептан дала 7,08 г (вихід склав 84 %) названого продукту. Слід зазначити, що при використанні бензилхлоридів як алкілюючих засобів, тетрабутиламоній йодид додали разом з алкілюючим засобом при низькій температурі. 1 H NMR (300 МГц, CDCl3) δ 3,57 (d, 2 H), 3,70 (s, 3 H), 3,73 (t, 1 H), 3,83 (s, 3 H), 4,59 (d, 1 H), 5,62 (d, 1 H), 6,61 (d, 2 H), 6,8-6,9 (m, 4 H), 7,2-7,45 (m, 8 H), 7,63 (тонка d, 1 H). [00158] Наступні сполуки приготували виконанням відповідних заміщень відповідно до вищезгаданих процедур. [00159] (Z)-3-(2,6-Диметилбензил)-7-хлор-1-(4-метоксибензил)-5-(4-метоксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 2,41 (s, 6 H), 3,50 (dd, 1 H), 3,70 (s, 3 H), 3,79 (dd, 1 H), 3,84 (s, 3 H), 3,90 (dd, 1 H), 4,58 (d, 1 H), 5,69 (d, 1 H), 6,62 (d, 2 H), 6,83 (d, 2 H), 6,90 (d, 2 H), 6,95-7,03 (m, 3 H), 7,06 (тонка d, 1 H), 7,16 (d, 2 H), 7,32 (d, 1 H), 7,37 (dd, 1 H). [00160] (Z)-3-(3,5-Диметилбензил)-7-хлор-1-(4-метоксибензил)-5-(4-метоксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, DMSO-d5) δ 2,2 (s, 6 H), 3,3 (m, 2 H), 3,6 (s, 3 H), 3,7 (m, 1 H), 3,85 (s, 3 H), 5,8 (d, 1 H), 6,45 (d, l H), 6,65 (d, 2 H), 6,85 (m, 3 H), 6,95 (m, 3 H), 7,1 (s, 1 H), 7,2(d, 2 H), 7,6 (d, 1 H), 7,7 (d, 1 H). [00161] (Z)-3-(3,4-Диметилбензил)-7-хлор-1-(4-метоксибензил)-5-(4-гідроксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, DMSO-d6) δ 2,10 (s, 6 H; 2 метильні групи), 3,39 (m, 2 H, містить бензилові протони і H2O сигнал), 3,68 (s, 3 H), 3,81-3,89 (m, 4 H, містить N-PMBOMe сигнал), 4,99 (d, 1 H), 5,41 (d, 1 H), 6,71 (d, 2 H), 6,88 (d, 2 H), 7,0-7,2 (m, 6 H), 7,31 (d, 2 H), 7,65 (m, 2 H). [00162] (Z)-3-(2,6-Діетилбензил)-7-хлор-1-(4-метоксибензил)-5-(4-метоксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 1,18 (t, 6 H), 2,65-2,95 (m, 4 H), 3,59 (dd, 1 H), 3,70 (s, 3 H), 3,74 (dd, 1 H), 3,83 (s, 3 H), 3,90 (dd, 1 H), 4,58 (d, 1 H), 5,71 (d, 1 H), 6,62 (d, 2 H), 6,82 (d, 2 H), 6,89 (d, 2 H), 7,0-7,1 (m, 3 H), 7,1-7,2 (m, 3 H), 7,32 (d, 1 H), 7,36 (dd, 1 H). [00163] (Z)-3-(3,4-Діетилбензил)-7-хлор-1-(4-метоксибензил)-5-(4-метоксифеніл)-1H-бензо[e][1,4]діазепін-2(3H)-он. [00164] (Z)-3-(3,5-Діетилбензил)-1-(4-метоксибензил)-7-хлор-5-(4-гідроксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR (300 МГц, CDCl3) δ 1,21 (t, 6 H), 2,59 (q, 4 H), 3,5-3,65 (m, 2 H), 3,70 (s, 3 H), 3,76 (dd, 1 H), 3,85 (s, 3 H), 6,61 (d, 2 H), 6,8-6,95 (m, 5 H), 7,04 (тонка d, 2 H), 7,10 (тонка d, 1 H), 7,2-7,28 (m, 2 H; перекривається з CHCl3 сигналом), 7,30 (d, 1 H), 7,37 (dd, 1 H). [00165] (Z)-3-(4-Ізопропілбензил)-7-хлор-1-(4-метоксибензил)-5-(4-гідроксифеніл)-1H1 бензо[e][1,4]діазепін-2(3H)-он. H NMR(300 МГц, DMSO-d6) δ 1,15 (d, 6 H), 2,85 (септет, 1 H), 3,25-3,45 (m, 3 H), 3,65 (s, 3 H), 3,75-3,85 (m, 4 H), 4,80 (d, 1 H), 5,45 (d, 1 H), 6,60 (m, 2 H), 6,85 (m, 2 H), 6,95 (m, 2 H), 7,0-7,3 (m, 6 H), 7,63 (dd, 1 H), 7,74 (d, 1 H). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzodiazepinone compounds useful in the treatment of skin conditions
Автори англійськоюGlick, Gary, D.
Назва патенту російськоюБензодиазепиноновые соединения, применяемые при лечении кожных состояний
Автори російськоюГлик Гери Д.
МПК / Мітки
МПК: C07D 243/18
Мітки: застосовні, лікуванні, шкірних, бензодіазепінонові, сполуки, станів
Код посилання
<a href="https://ua.patents.su/43-99839-benzodiazepinonovi-spoluki-zastosovni-v-likuvanni-shkirnikh-staniv.html" target="_blank" rel="follow" title="База патентів України">Бензодіазепінонові сполуки, застосовні в лікуванні шкірних станів</a>
Попередній патент: Лазерний допплерівський вимірювач швидкості
Наступний патент: Заміщені циклопентани, що мають простагландинову активність
Випадковий патент: Газовий термометр












