Фармацевтична композиція інгібітора протеази вірусу гепатиту c
Формула / Реферат
1. Рідка фармацевтична композиція, яка містить
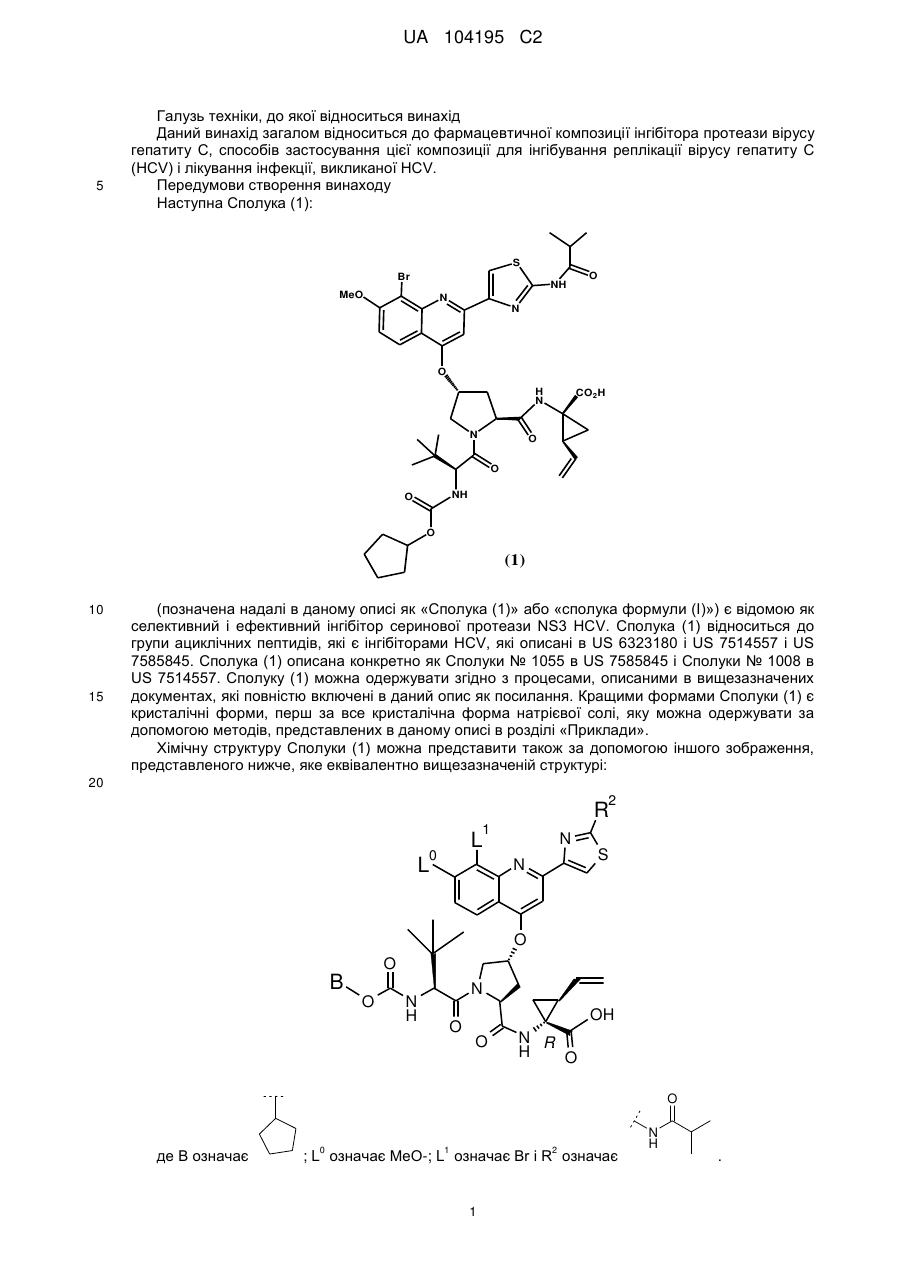
(а) сполуку формули (1):
 (1)
(1)
або її фармацевтично прийнятну сіль;
(б) один або декілька фармацевтично прийнятних ліпідів; і
(в) одну або декілька фармацевтично прийнятних гідрофільних поверхнево-активних речовин.
2. Фармацевтична композиція за п. 1, в якій сполука формули (1) присутня у вигляді натрієвої солі.
3. Фармацевтична композиція за п. 1 або п. 2, в якій сполука формули (1) або її фармацевтично прийнятна сіль присутня в кількості від 1 до 50 мас. %.
4. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятний ліпід присутній в кількості приблизно від 20 до 70 мас. %.
5. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятний ліпід вибраний із групи, яка включає: жирні кислоти, моно-, ди- або тригліцериди з середнім або довгим ланцюгом, ефіри пропіленгліколю і жирних кислот, ефіри сорбіту і жирних кислот, неводорозчинні вітаміни і їх суміші.
6. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятна гідрофільна поверхнево-активна речовина присутня із кількості аж до приблизно 70 мас. %.
7. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятна гідрофільна поверхнево-активна речовина вибрана із групи, яка включає: поліетоксильовані рослинні олії, поліетоксильовані токофероли, поліетоксильовані ефіри сорбіту і жирних кислот, солі жовчних кислот, лецитини і їх суміші.
8. Фармацевтична композиція за одним з попередніх пунктів, яка додатково містить фармацевтично прийнятний гідрофільний розчинник.
9. Фармацевтична композиція за п. 8, в якій фармацевтично прийнятний гідрофільний розчинник вибраний з групи, яка включає: пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, диметилізосорбід, глікофурол, пропіленкарбонат, диметилацетамід, воду і їх суміші.
10. Фармацевтична композиція за п. 8 або п. 9, в якій фармацевтично прийнятний гідрофільний розчинник присутній в кількості аж до 30 мас. %.
11. Фармацевтична композиція за одним з попередніх пунктів, де композиція при розведенні водним розчином з використанням масового співвідношення водного розчину і композиції 100:1 утворює водну дисперсію, абсорбція якої перевищує приблизно 1,0 при довжині хвилі приблизно 400 нм.
12. Фармацевтична композиція за одним з попередніх пунктів, яка містить:
(А)
(а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості приблизно від 5 до 30 мас. %;
(б) фармацевтично прийнятний ліпід в кількості приблизно від 30 до 60 мас. %;
(в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину в кількості приблизно від 20 до 50 мас. %;
(г) необов'язково фармацевтично прийнятний гідрофільний розчинник в кількості приблизно аж до 30 мас. %; або
(Б)
(а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості приблизно від 10 до 20 мас. %;
(б) фармацевтично прийнятний ліпід в кількості приблизно від 40 до 50 мас. %;
(в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину в кількості приблизно від 25 до 35 мас. %;
(г) фармацевтично прийнятний гідрофільний розчинник в кількості приблизно від 5 до 15 мас. %;
або
(В)
(а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості
приблизно від 5 до 30 мас. %;
(б) фармацевтично прийнятний ліпід, вибраний з жирних кислот, моно-, ди- або тригліцеридів з середнім або довгим ланцюгом, ефірів пропіленгліколю і жирних кислот, ефірів сорбіту і жирних кислот, неводорозчинних вітамінів і їх сумішей, в кількості приблизно від 30 до 60 мас. %;
(в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину, вибрану з поліетоксильованих рослинних олій, поліетоксильоваиих токоферолів, поліетоксильованих ефірів сорбіту і жирних кислот, солей жовчних кислот, лецитинів і їх сумішей, в кількості приблизно від 20 до 50 мас. %;
(г) необов'язково фармацевтично прийнятний гідрофільний розчинник, вибраний з пропіленгліколю, поліпропіленгліколю, поліетиленгліколю, гліцерину, етанолу, диметилізосорбіду, глікофуролу, пропіленкарбонату, диметилацетаміду, води і їх сумішей, в кількості приблизно аж до 30 мас. %;
або
(Г)
(а) сполуку формули (1) у вигляді її натрієвої солі в кількості приблизно від 10 до 20 мас. %;
(б) фармацевтично прийнятний ліпід, вибраний з моногліцеридів каприлових і капринових жирних кислот, дигліцеридів каприлових і капринових жирних кислот і їх сумішей, в кількості приблизно від 40 до 50 мас. %;
(в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину, вибрану з токоферилполіетиленглікольсукцинату, поліоксилу 40 гідрогенізованої рицинової олії і поліоксилу 35 рицинової олії і їх сумішей, в кількості приблизно від 25 до 35 мас. %;
(г) фармацевтично прийнятний гідрофільний розчинник, вибраний з пропіленгліколю, поліетиленгліколю, етанолу, води і їх сумішей, в кількості приблизно від 5 до 10 мас. %.
Текст
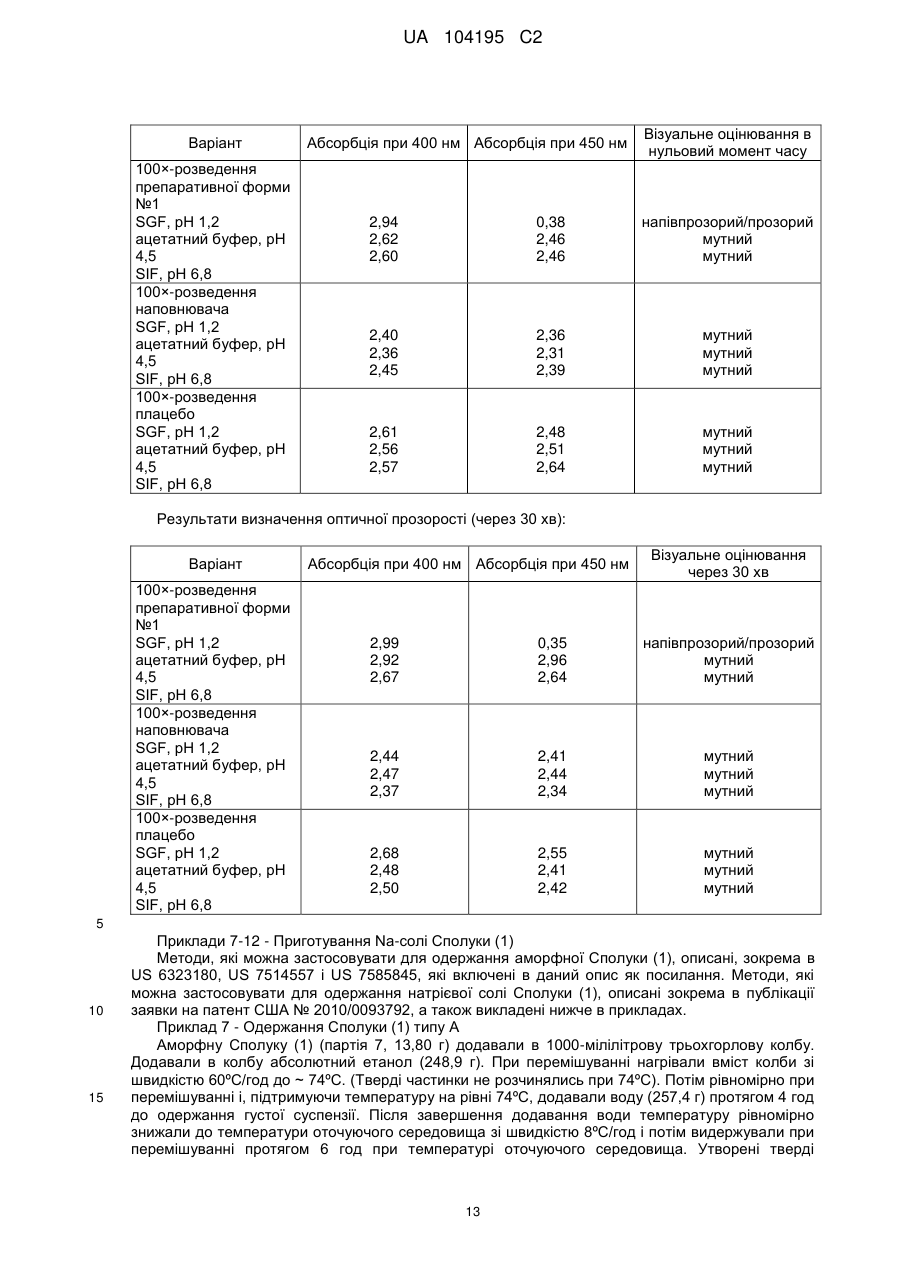
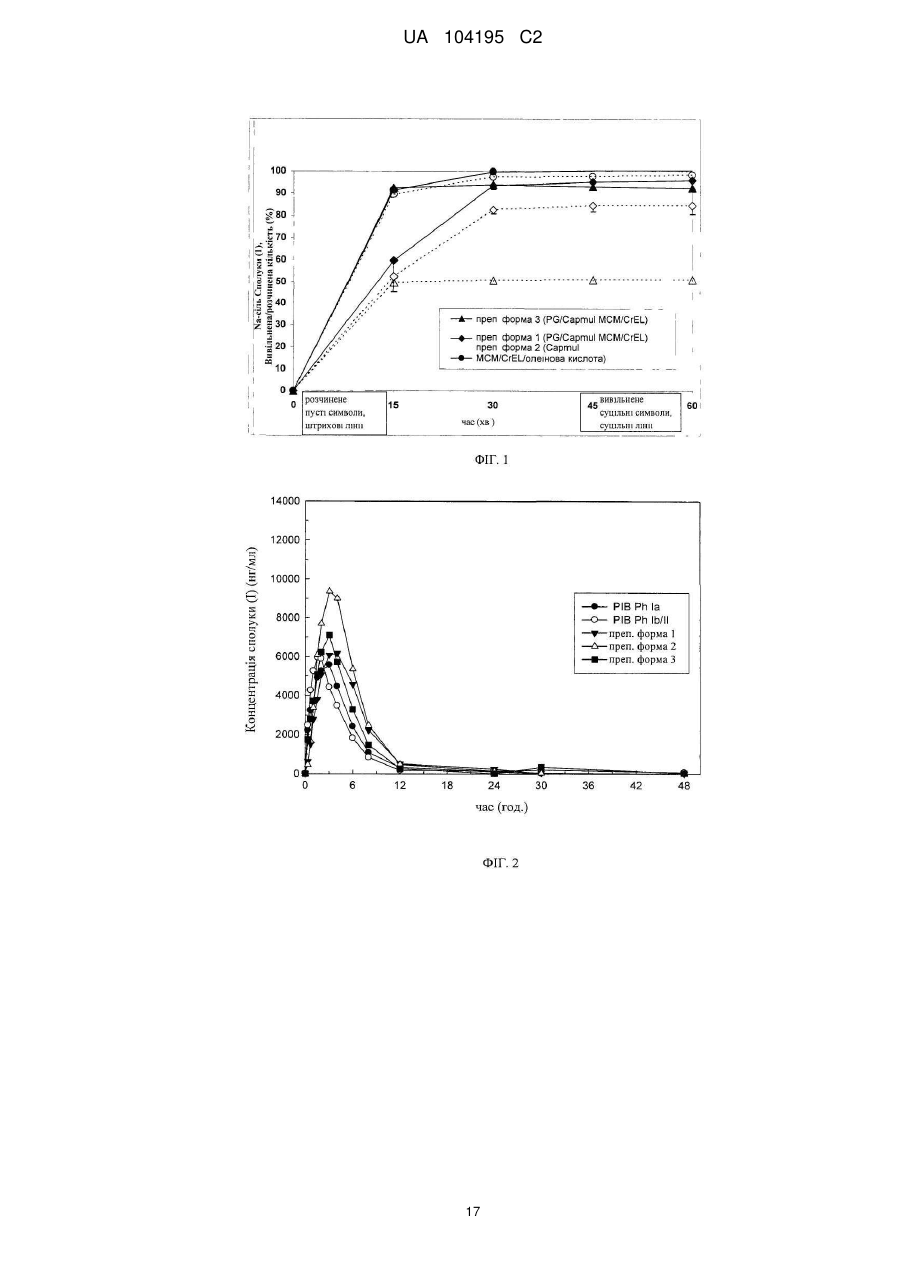
45,565 (55) 57,485 (35) 43,647 (52) 3(2-3) 2 (0,67-2) 3,5 (1,5-24) 3(2-4) 2,5 (1-4) а 40 Д 8,036 (42) Дані являють собою середні значення (%RSD (відносне стандартне відхилення)) за винятком tmax, яке представлено у вигляді медіанного значення (діапазон). В таблицю включені дані, одержані для всіх собак, незалежно від наявності у них блювання. Дані про відповідні середні концентрації Сполуки (1) в плазмі всіх собак (n=6) при використанні п’яти різних препаративних форм Na-солі Сполуки (1), представлені на фіг. 2. 11 UA 104195 C2 Таблиця 2 Узагальнення фармакокінетичних параметрів Сполуки (1) в організмі собак породи Бігль (n=3) а після орального введення Na-солі Сполуки (1) у вигляді п’яти різних препаративних форм ФКпараметри Cmax (нг/мл) AUC0-48 (нг×ч/мл) tmax (ч) Препаративна форма В Г 9,846 (19) 12,744 (15) А 8,315 (35) Б 8,416 (21) Д 9,707 (30) 47,336 (58) 45,623 (35) 65,339 (25) 72,894 (16) 48,214 (11) 3(2-3) 2 (1,5-2) 4(2-6) 3 (2-4) 3 (2-4) а 5 10 15 Дані являють собою середні значення (%RSD) за виключенням t max, яке представлено у вигляді медіанного значення (діапазон). З таблиці виключені всі дані для всіх препаративних форм, одержані для всіх собак, у яких мало місце блювання; 1492, 1912, 1916. Дані про відповідні середні концентрації Сполуки (1) в плазмі трьох собак при використанні п’яти різних препаративних форм Na-солі Сполуки (1) (n=3), представлені на фіг. 3. Приклад 6 - Досліди з визначення оптичної прозорості Оптичну прозорість препаративних форм, запропонованих в даному винаході, оцінювали візуально і визначали кількісно спектроскопічно. Призначені для заповнення препаративні форми одержували згідно з методом, описаним для препаративної форми №1 (приклад 1), а також одержували відповідні препаративні форми наповнювача і плацебо, і кожну з них розводили в 100 разів трьома водними середовищами з різними значеннями рН. Абсорбцію кожного розчину визначали як безпосередньо після приготування, так і через 30 хв при довжині хвилі 400 і 450 нм, використовуючи очищену воду, що відповідає стандарту, одержані результати представлені нижче. Результати свідчать про те, що абсорбція утворених дисперсій становить від 2,36 до 2,99 при 400 нм і від 0,35 до 2,96 при 450 нм. Препаративні форми: Застосовні інгредієнти,% Na-сіль Сполуки (1) Capmul МСМ Cremophor EL альфа-токоферол пропіленгліколь Всього Препаративна форма №1 15,0 46,3 30,8 0,2 7,7 100,0 Наповнювач Плацебо 54,5 36,2 0,2 9,1 100,0 61,3 30,8 0,2 7,7 100 20 25 30 35 Загальна процедура: - додавали зразок препаративної форми в кількості 0,1 г в 20-мілілітровий флакон для сцинтиляційного лічильника; - додавали в флакон 9,9 мл водного середовища; - добре диспергували шляхом перемішування вручну; - одразу здійснювали кількісне оцінювання або видержували протягом 30 хв; - диспергували зразок перед зчитуванням в УФ; - переносили аліквоту в УФ-комірку з довжиною оптичного шляху 1 см; - визначали абсорбцію шляхом одноразового вимірювання або в діапазоні довжин хвиль. Реактиви Водні середовища: змодельований розчин шлункового соку (SGF); ацетатний буфер; розчин, що являє собою модель кишкового соку (SIF). Обладнання: спектрофотометр Cary 50 U V- Vis. Програмне забезпечення: Програмне забезпечення фірми Cary «simple reads». Результати визначення оптичної прозорості (нульовий момент часу): 12 UA 104195 C2 Варіант 100×-розведення препаративної форми №1 SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 100×-розведення наповнювача SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 100×-розведення плацебо SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 Абсорбція при 400 нм Абсорбція при 450 нм Візуальне оцінювання в нульовий момент часу 2,94 2,62 2,60 0,38 2,46 2,46 напівпрозорий/прозорий мутний мутний 2,40 2,36 2,45 2,36 2,31 2,39 мутний мутний мутний 2,61 2,56 2,57 2,48 2,51 2,64 мутний мутний мутний Результати визначення оптичної прозорості (через 30 хв): Варіант 100×-розведення препаративної форми №1 SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 100×-розведення наповнювача SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 100×-розведення плацебо SGF, рН 1,2 ацетатний буфер, рН 4,5 SIF, рН 6,8 Абсорбція при 400 нм Абсорбція при 450 нм Візуальне оцінювання через 30 хв 2,99 2,92 2,67 0,35 2,96 2,64 напівпрозорий/прозорий мутний мутний 2,44 2,47 2,37 2,41 2,44 2,34 мутний мутний мутний 2,68 2,48 2,50 2,55 2,41 2,42 мутний мутний мутний 5 10 15 Приклади 7-12 - Приготування Na-солі Сполуки (1) Методи, які можна застосовувати для одержання аморфної Сполуки (1), описані, зокрема в US 6323180, US 7514557 і US 7585845, які включені в даний опис як посилання. Методи, які можна застосовувати для одержання натрієвої солі Сполуки (1), описані зокрема в публікації заявки на патент США № 2010/0093792, а також викладені нижче в прикладах. Приклад 7 - Одержання Сполуки (1) типу А Аморфну Сполуку (1) (партія 7, 13,80 г) додавали в 1000-мілілітрову трьохгорлову колбу. Додавали в колбу абсолютний етанол (248,9 г). При перемішуванні нагрівали вміст колби зі швидкістю 60ºC/год до ~ 74ºC. (Тверді частинки не розчинялись при 74ºC). Потім рівномірно при перемішуванні і, підтримуючи температуру на рівні 74ºС, додавали воду (257,4 г) протягом 4 год до одержання густої суспензії. Після завершення додавання води температуру рівномірно знижали до температури оточуючого середовища зі швидкістю 8ºС/год і потім видержували при перемішуванні протягом 6 год при температурі оточуючого середовища. Утворені тверді 13 UA 104195 C2 5 10 15 20 25 30 35 40 45 50 55 частинки збирали фільтрацією і промивали 50 мл суміші 1/1 (мас./мас.) EtOH/вода. Вологі тверді частинки сушили протягом 30 хв в воронці з відсмоктуванням, пропускаючи N 2 через осад на фільтрі. (XRPD-аналіз (дифракція рентгенівських променів на порошку) зазначеного зразка продемонстрував, що структура зразка відповідає EtOH-сольвату). Потім тверді частинки сушили при 65-70ºС в вакуумі (P = 25 мм рт. стовпа) і випускали азот протягом 1,5 год. За допомогою XRPD підтверджували, що утворені тверді частинки (12,6 г, скоректований вихід 95,5%) являли собою Сполуку (1) типу А. Приклад 8 - Одержання натрієвої солі Сполуки (1) - Метод 1 2,1 г аморфної натрієвої солі Сполуки (1) і 8,90 г ацетону вносили у флакон і перемішували при температурі оточуючого середовища протягом 3 год. Густу суспензію відфільтровували від маточного розчину і утворені тверді частинки сушили протягом 20 хв в потоку азоту. Збирали 1,51 г кристалічної натрієвої солі Сполуки (1) у вигляді твердих частинок. Приклад 9 - Одержання натрієвої солі Сполуки (1) - Метод 2 15,6 г Сполуки (1) типу А, 175 мл ацетону і 3,6 мл води вносили в 250-мілілітровий реактор і нагрівали до 53ºC до розчинення твердих частинок. В реактор додавали 900 мкл 10,0н.NaOH і в розчин вносили як затравку сполуку типу A. Затравний розчин перемішували при 53ºC протягом 10 хв. Додавали другу порцію (900 мкл) 10,0н. NaOH і систему перемішували при 53ºC протягом 30 хв з одержанням густої суспензії. Густу суспензію охолоджували до 19ºC зі швидкістю охолодження 15ºC/год і видержували протягом ночі при 19ºC. Кінцеву утворену густу суспензію фільтрували і вологі тверді частинки промивали 15 мл ацетону. Тверді частинки сушили протягом 1 год при 52ºC в вакуумі в потоку азоту і потім видержували тверді частинки в лабораторному повітрі протягом 1 год. Збирали 12,1 г кристалічної натрієвої солі Сполуки (1) у вигляді твердих частинок. Приклад 10 – Одержання натрієвої солі Сполуки (1) - Метод 3 25,4 кг аморфної Сполуки (1), 228 л ТГФ і 11,1 кг 10 мас.% NaOH (водний розчин) вносили в реактор. Сполуки перемішували при 25ºC до розчинення всіх твердих частинок. Утворений розчин профільтровували і реактор і фільтр промивали 23 л ТГФ. 180 л розчинника видаляли дистиляцією при атмосферному тиску при 65ºC. Додавали 195 л МІБК (метилізобутилкетон) і 166 л розчинника видаляли шляхом вакуумної дистиляції при ~ 44ºC. В реактор знову додавали 161 л МІБК і 0,41 кг води і вміст нагрівали до 70ºC. Додавали 255 г натрієвої солі Сполуки (1) при 70ºC і додавали протягом 1,5 год 1,42 л води. Після додавання води густу суспензію видержували при 70ºC протягом 45 хв і потім охолоджували до 45ºC протягом 1 год. Утворену густу суспензію фільтрували і промивали 64 л МІБК, що містив ~0,8 мас.% води. Вологий осад на фільтрі сушили при 55ºC з одержанням ~ 25 кг кристалічної натрієвої солі Сполуки (1). Приклад 11 – Одержання натрієвої солі Сполуки (1) - Метод 4 2,00 г аморфної Сполуки (1), 9,96 г ТГФ і 0,11 г води вносили в реактор і перемішували при температурі оточуючого середовища до розчинення твердих частинок. 0,820 мл 21 мас.%-ного розчину NaOEt в етанолі додавали по краплях при перемішуванні з одержанням розчину A. 15,9 г н-BuAc і 160 мкл води вносили в другий реактор і нагрівали до 65ºC (розчин Б). 2,56 г розчину A додавали до розчину Б при 65ºC і в утворену суміш вносили як затравку 40 мг натрієвої солі Сполуки (1). Затравній суміші давали дозріти при 65ºC протягом 45 хв. 2,56 г розчину Б додавали до розчину А з використанням 4 окремих проміжків часу і давали дозріти протягом 45 хв. Після кінцевого додавання і дозрівання густу суспензію охолоджували до 50ºC протягом 1 год і фільтрували. Вологий осад на фільтрі промивали 6 мл н-BuAc, що містив 0,5 мас.% води. Одержані в результаті тверді частинки сушили при 50ºC в вакуумі, використовуючи продувку азотом. Збирали кристалічну натрієву сіль Сполуки (1) у вигляді твердих частинок. Приклад 12 – Одержання натрієвої солі Сполуки (1) - Метод 5 При кімнатній температурі додавали при перемішуванні розчин етоксиду натрію в етанолі (21 мас.%; 306 мл) до розчину Сполуки (1) (745 г) в ТГФ (2000 мл) і воді (76,5 мл). Після перемішування протягом 30 хв суміш фільтрували і фільтр промивали ТГФ (85 мл). Утворений розчин нагрівали до 65ºC і обробляли профільтрованим бутилацетатом (6640 мл, необов’язково попередньо нагрітим до 65ºC) протягом 30 хв. Додавали кристали затравки (0,50 г) і суміш перемішували при 65ºC протягом 2 год, при цьому кристалізація починалася приблизно через 30 хв. Суспензію охолоджували до 50ºC протягом 1 год і перемішували при зазначеній температурі протягом ще 1 год. Зазначену в заголовку сполуку виділяли фільтрацією, промивали профільтрованим бутилацетатом (765 мл, необов’язково попередньо нагрітий до 50ºC) і сушили при 65ºC протягом приблизно 16 год з одержанням кристалічної натрієвої солі Сполуки (1) (~ 725 г). 14 UA 104195 C2 ФОРМУЛА ВИНАХОДУ 5 1. Рідка фармацевтична композиція, яка містить (а) сполуку формули (1): S Br NH N MeO O N O H N CO2H N O O O NH O 10 15 20 25 30 35 (1) або її фармацевтично прийнятну сіль; (б) один або декілька фармацевтично прийнятних ліпідів; і (в) одну або декілька фармацевтично прийнятних гідрофільних поверхнево-активних речовин. 2. Фармацевтична композиція за п. 1, в якій сполука формули (1) присутня у вигляді натрієвої солі. 3. Фармацевтична композиція за п. 1 або п. 2, в якій сполука формули (1) або її фармацевтично прийнятна сіль присутня в кількості від 1 до 50 мас. %. 4. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятний ліпід присутній в кількості приблизно від 20 до 70 мас. %. 5. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятний ліпід вибраний із групи, яка включає: жирні кислоти, моно-, ди- або тригліцериди з середнім або довгим ланцюгом, ефіри пропіленгліколю і жирних кислот, ефіри сорбіту і жирних кислот, неводорозчинні вітаміни і їх суміші. 6. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятна гідрофільна поверхнево-активна речовина присутня із кількості аж до приблизно 70 мас. %. 7. Фармацевтична композиція за одним з попередніх пунктів, в якій фармацевтично прийнятна гідрофільна поверхнево-активна речовина вибрана із групи, яка включає: поліетоксильовані рослинні олії, поліетоксильовані токофероли, поліетоксильовані ефіри сорбіту і жирних кислот, солі жовчних кислот, лецитини і їх суміші. 8. Фармацевтична композиція за одним з попередніх пунктів, яка додатково містить фармацевтично прийнятний гідрофільний розчинник. 9. Фармацевтична композиція за п. 8, в якій фармацевтично прийнятний гідрофільний розчинник вибраний з групи, яка включає: пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, диметилізосорбід, глікофурол, пропіленкарбонат, диметилацетамід, воду і їх суміші. 10. Фармацевтична композиція за п. 8 або п. 9, в якій фармацевтично прийнятний гідрофільний розчинник присутній в кількості аж до 30 мас. %. 11. Фармацевтична композиція за одним з попередніх пунктів, де композиція при розведенні водним розчином з використанням масового співвідношення водного розчину і композиції 100:1 15 UA 104195 C2 5 10 15 20 25 30 35 40 утворює водну дисперсію, абсорбція якої перевищує приблизно 1,0 при довжині хвилі приблизно 400 нм. 12. Фармацевтична композиція за одним з попередніх пунктів, яка містить: (А) (а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості приблизно від 5 до 30 мас. %; (б) фармацевтично прийнятний ліпід в кількості приблизно від 30 до 60 мас. %; (в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину в кількості приблизно від 20 до 50 мас. %; (г) необов'язково фармацевтично прийнятний гідрофільний розчинник в кількості приблизно аж до 30 мас. %; або (Б) (а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості приблизно від 10 до 20 мас. %; (б) фармацевтично прийнятний ліпід в кількості приблизно від 40 до 50 мас. %; (в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину в кількості приблизно від 25 до 35 мас. %; (г) фармацевтично прийнятний гідрофільний розчинник в кількості приблизно від 5 до 15 мас. %; або (В) (а) сполуку формули (1) або її фармацевтично прийнятну сіль в кількості приблизно від 5 до 30 мас. %; (б) фармацевтично прийнятний ліпід, вибраний з жирних кислот, моно-, ди- або тригліцеридів з середнім або довгим ланцюгом, ефірів пропіленгліколю і жирних кислот, ефірів сорбіту і жирних кислот, неводорозчинних вітамінів і їх сумішей, в кількості приблизно від 30 до 60 мас. %; (в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину, вибрану з поліетоксильованих рослинних олій, поліетоксильоваиих токоферолів, поліетоксильованих ефірів сорбіту і жирних кислот, солей жовчних кислот, лецитинів і їх сумішей, в кількості приблизно від 20 до 50 мас. %; (г) необов'язково фармацевтично прийнятний гідрофільний розчинник, вибраний з пропіленгліколю, поліпропіленгліколю, поліетиленгліколю, гліцерину, етанолу, диметилізосорбіду, глікофуролу, пропіленкарбонату, диметилацетаміду, води і їх сумішей, в кількості приблизно аж до 30 мас. %; або (Г) (а) сполуку формули (1) у вигляді її натрієвої солі в кількості приблизно від 10 до 20 мас. %; (б) фармацевтично прийнятний ліпід, вибраний з моногліцеридів каприлових і капринових жирних кислот, дигліцеридів каприлових і капринових жирних кислот і їх сумішей, в кількості приблизно від 40 до 50 мас. %; (в) фармацевтично прийнятну гідрофільну поверхнево-активну речовину, вибрану з токоферилполіетиленглікольсукцинату, поліоксилу 40 гідрогенізованої рицинової олії і поліоксилу 35 рицинової олії і їх сумішей, в кількості приблизно від 25 до 35 мас. %; (г) фармацевтично прийнятний гідрофільний розчинник, вибраний з пропіленгліколю, поліетиленгліколю, етанолу, води і їх сумішей, в кількості приблизно від 5 до 10 мас. %. 16 UA 104195 C2 17 UA 104195 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for a hepatitis c viral protease inhibitor
Автори англійськоюChen, Feng-Jing, Schwabe, Robert J.
Автори російськоюЧень Фен-Цзин, Швабе Роберт Дж.
МПК / Мітки
МПК: A61K 9/107
Мітки: фармацевтична, композиція, протеази, інгібітора, вірусу, гепатиту
Код посилання
<a href="https://ua.patents.su/20-104195-farmacevtichna-kompoziciya-ingibitora-proteazi-virusu-gepatitu-c.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція інгібітора протеази вірусу гепатиту c</a>
Попередній патент: Пристрій для провітрювання виробок і евакуації гірників в аварійній ситуації
Наступний патент: Стопорна гайка
Випадковий патент: Формувач імпульсів типу меандр з настроюванням по заданому пріоритету