Спосіб на основі біомаркерів, призначений для моніторингу лікування
Номер патенту: 107789
Опубліковано: 25.02.2015
Автори: Нішіо Казуто, Накагава Казухіко, Кудо Канає, Арао Токузо
Формула / Реферат
1. Спосіб для моніторингу лікування індивідуума такою сполукою як 3-Z-[l-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінон або його фармацевтично прийнятна сіль, де спосіб полягає у тому, що визначають, чи містить зразок із організму індивідуума біомаркер у кількості, що є індикативною для лікування, причому зазначеним біомаркером є кількість клітин, вибраних з групи, яка складається з VEGFR2+CD45dimpY+-клітин, VEGFR2+pY+-клітин, CD34+CD45dimCD133+CD117-клітин, CD34+CD45dimCD133-CD117+-клітин, CD34+CD45dimCD133+-клітин, CD34+CD45dimCD117+-клітинта CD34+CD45dimCD133+CD117+-клітин.
2. Спосіб за п. 1, у якому сполука являє собою моноетансульфонат 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону.
3. Спосіб за п. 1 або п. 2, у якому біомаркер свідчить про зміну експресії або стану білка або кількості специфічних клітин, що корелює з ризиком виникнення або прогресуванням захворювання або з чутливістю захворювання до даного лікування.
4. Спосіб за п. 1 або п. 2, у якому моніторинг лікування має на увазі будь-який з наступних видів моніторингу: моніторинг рівня відповіді, моніторинг тривалості відповіді, моніторинг швидкості відповіді, моніторинг швидкості стабілізації, моніторинг тривалості стабілізації, моніторинг часу до початку прогресування захворювання, моніторинг тривалості існування без прогресивного розвитку захворювання або моніторинг загальної тривалості існування, зокрема без негативного впливу на тривалість відповіді, але з меншою кількістю й/або меншим рівнем побічних дій, що заподіюють занепокоєння.
5. Спосіб за п. 1 або п. 2, у якому зазначений рівень оцінюють кількісно.
6. Спосіб за п. 1 або п. 2, у якому порівнюють зазначений рівень з референс-значенням.
7. Спосіб за п. 1 або п. 2, у якому зразок являє собою зразок крові.
8. Спосіб за п. 1 або п. 2, у якому біомаркером є кількість VEGFR2+CD45dimpY+-клітин.
9. Спосіб за п. 1 або п. 2, у якому біомаркером є кількість VEGFR2+pY+-клітин.
10. Спосіб за п. 1 або п. 2, у якому біомаркер вибирають з групи, що включає кількість CD34+CD45dimCD133+CD117-клітин, кількість CD34+CD45dimCD133-CD117+-клітин, кількість CD34+CD45dimCD133+-клітин і кількість CD34+CD45dimCD117+-клітин.
11. Спосіб за п. 1 або п. 2, у якому біомаркером є кількість CD34+CD45dimCD133+CD117+-клітин.
12. Спосіб, призначений для визначення того, чи є лікування пацієнта такою сполукою як 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінон або його фармацевтично прийнятна сіль ефективним, що включає наступні елементи: здійснення пацієнтом або лікарем запиту на проведення зазначеного визначення; одержання зразка біологічного матеріалу з організму пацієнта; аналіз зразка за допомогою описаного вище способу моніторингу лікування індивідуума за п. 1 або п. 2; і повідомлення результатів аналізів пацієнтові або лікареві.
13. Діагностичний набір, що містить щонайменше один засіб, призначений для здійснення способу за п. 1 або п. 2, де набір містить: реагент або матеріал, вибраний з антитіл або нуклеїнових кислот, з реагенту або матеріалу для моніторингу експресії набору біомаркерів, яка визначена на рівні мРНК, білка або на рівні клітини, або зразка; необов'язково одну або декілька діючих речовин, призначених для застосування при аналізі клітин зі зразків тканини пацієнта або зразків, узятих із організму пацієнта, і необов'язково інструкції зі застосування, причому зазначеним біомаркером є кількість клітин, вибраних з групи, яка складається з VEGFR2+CD45dimpY+-клітин, VEGFR2+pY+-клітин, CD34+CD45dimCD133+CD117-клітин, CD34+CD45dimCD133-CD117+-клітин, CD34+CD45dimCD133+-клітин, CD34+CD45dimCD117+-клітин та CD34+CD45dimCD133+CD117+-клітин
14. Біомаркер, призначений для використання у способі за п. 1 або п. 2 для моніторингу лікування індивідуума, здійснюваного за допомогою такої сполуки як 3-Z-[1-(4-(N-((4-метил піперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінон або її фармацевтично прийнятна сіль, причому зазначеним біомаркером є кількість клітин, вибраних з групи, яка складається з VEGFR2+CD45dimpY+-клітин, VEGFR2+pY+-клітин, CD34+CD45dimCD133+CD117-клітин, CD34+CD45dimCD133-CD117+-клітин, CD34+CD45dimCD133+-клітин, CD34+CD45dimCD117+-клітин та CD34+CD45dimCD133+CD117+-клітин.
Текст
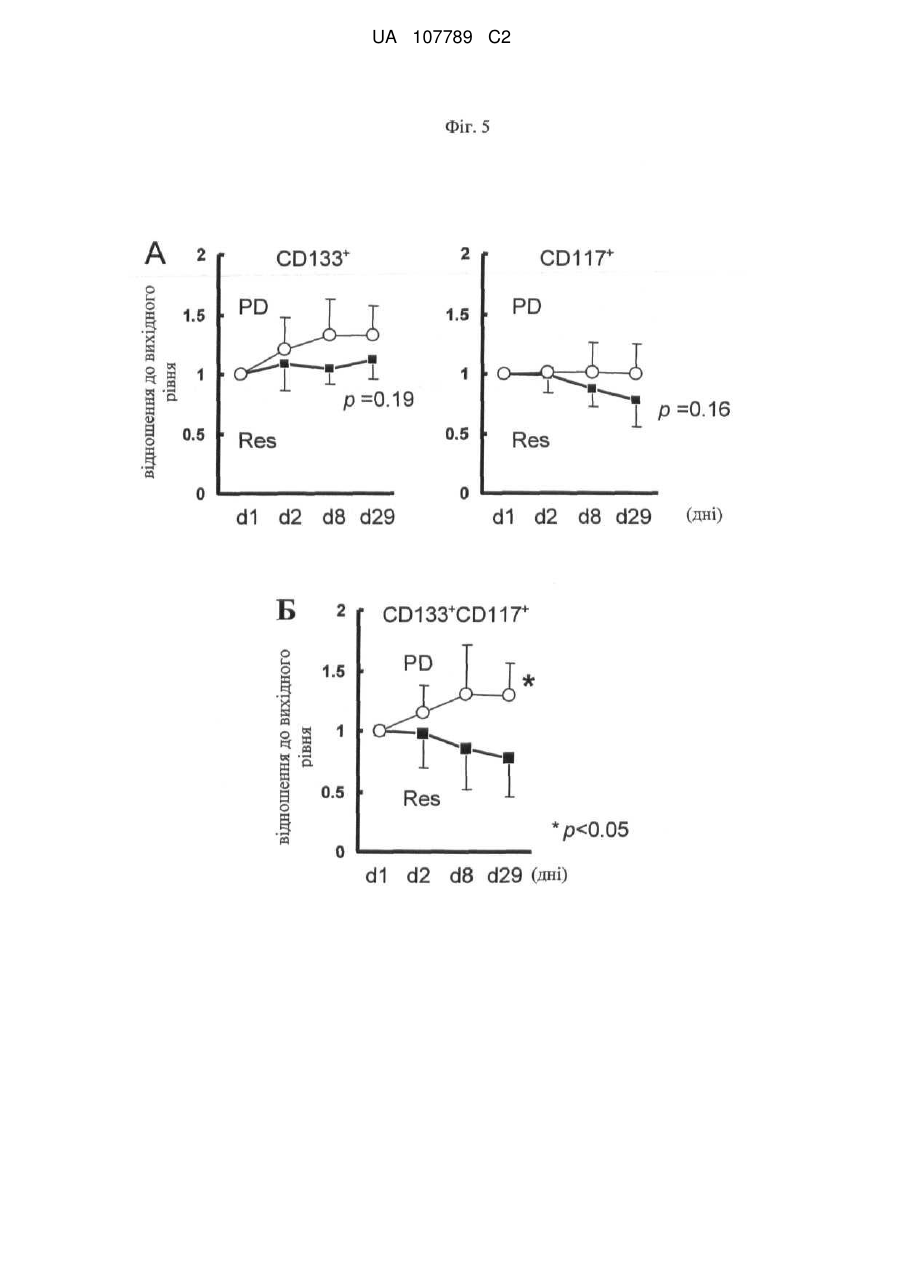
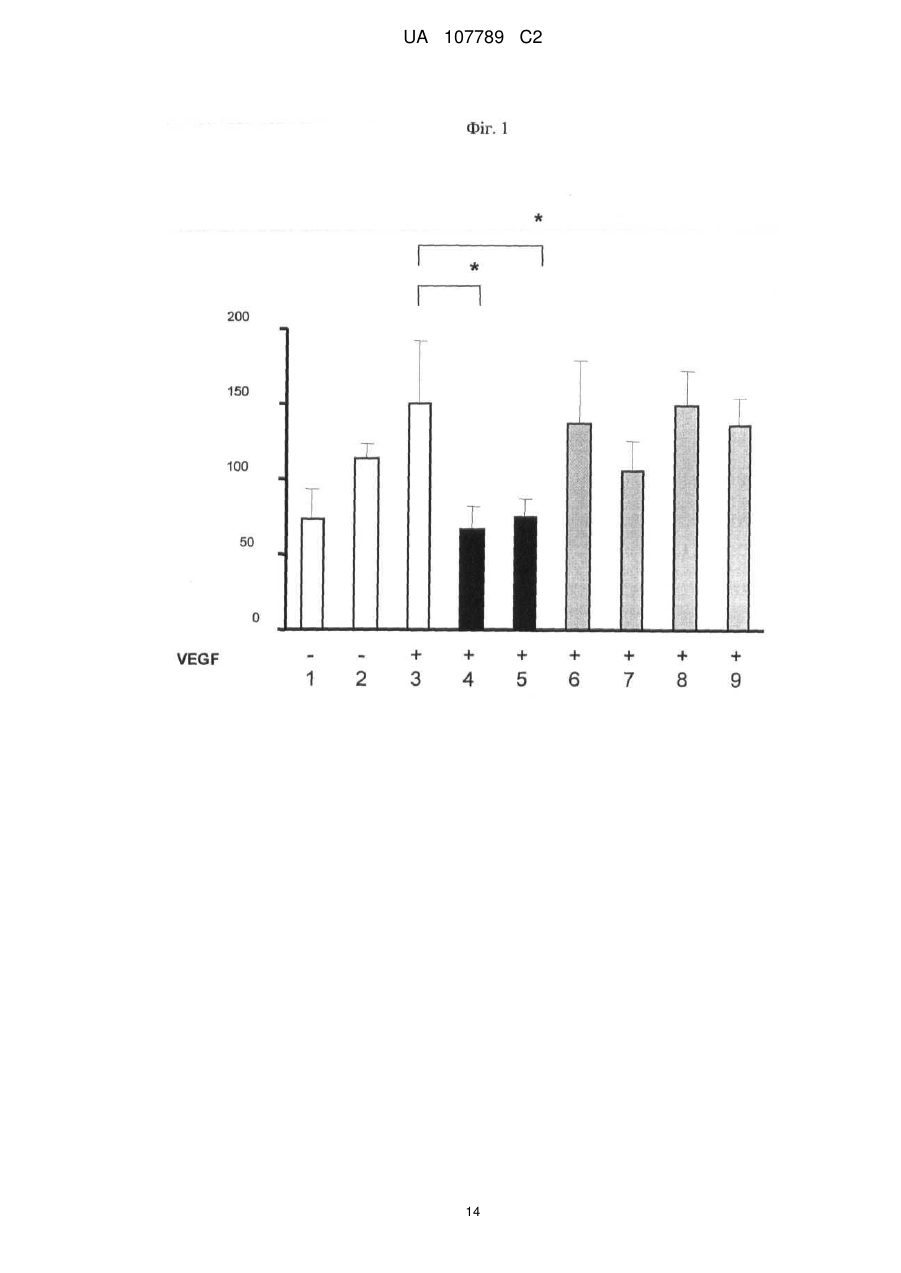
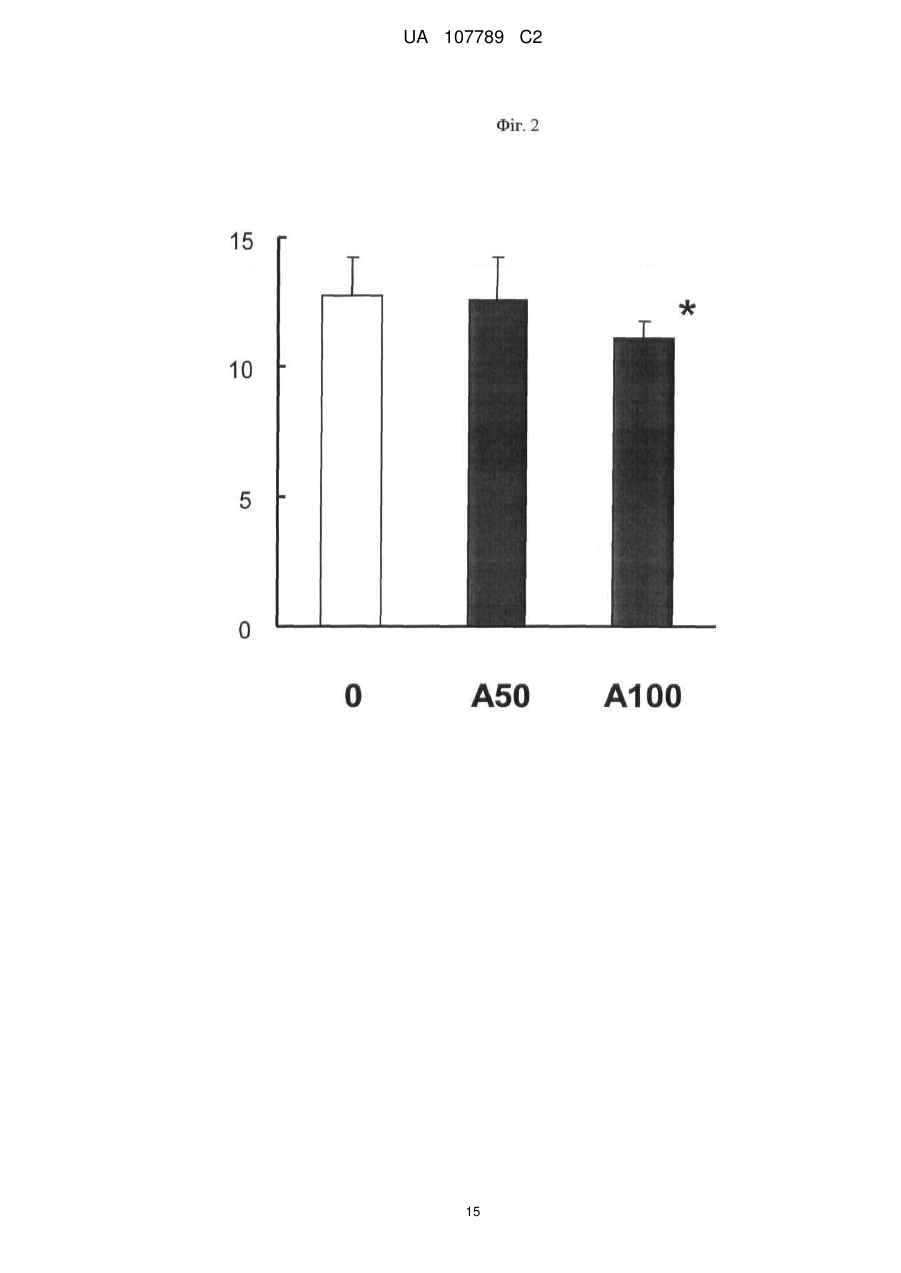
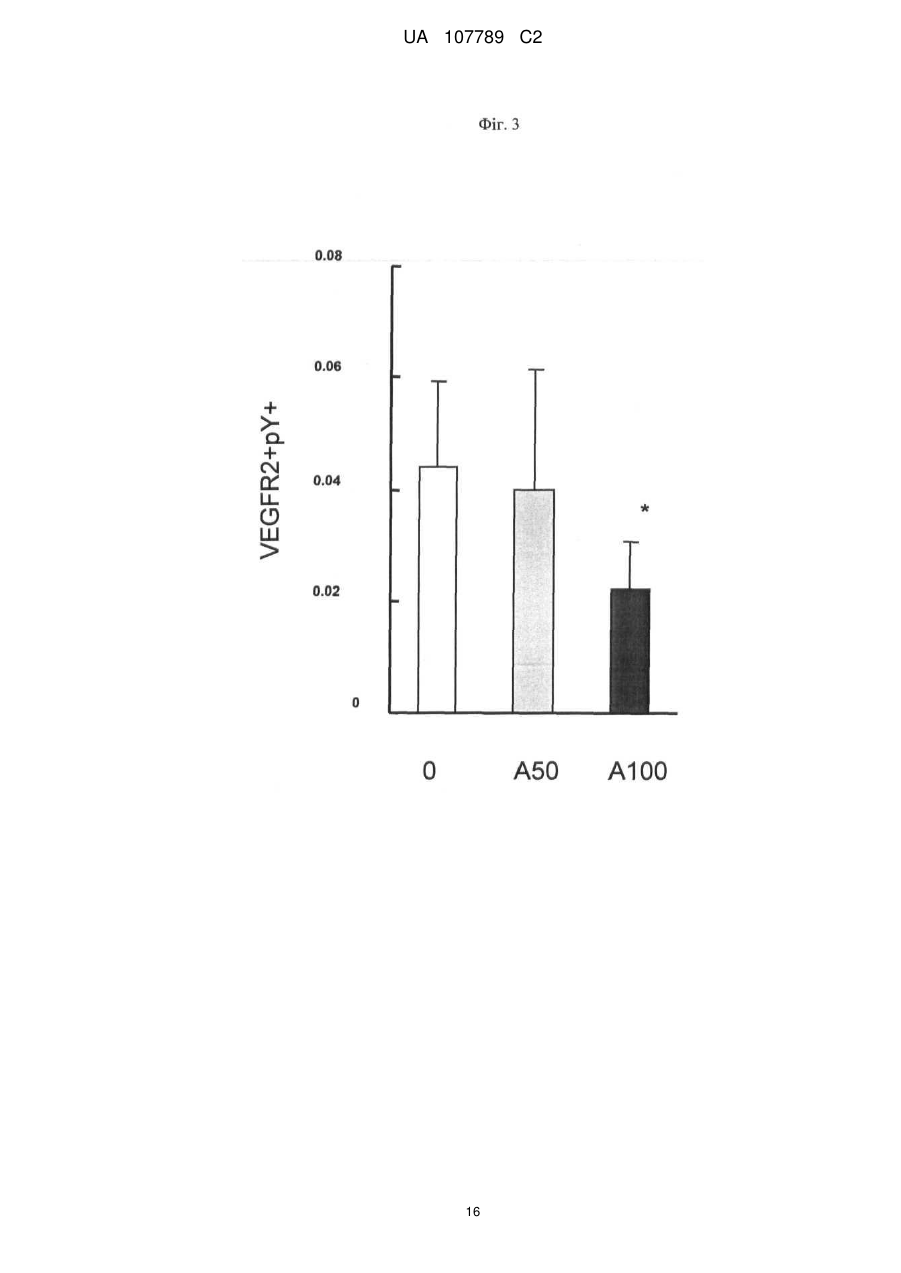
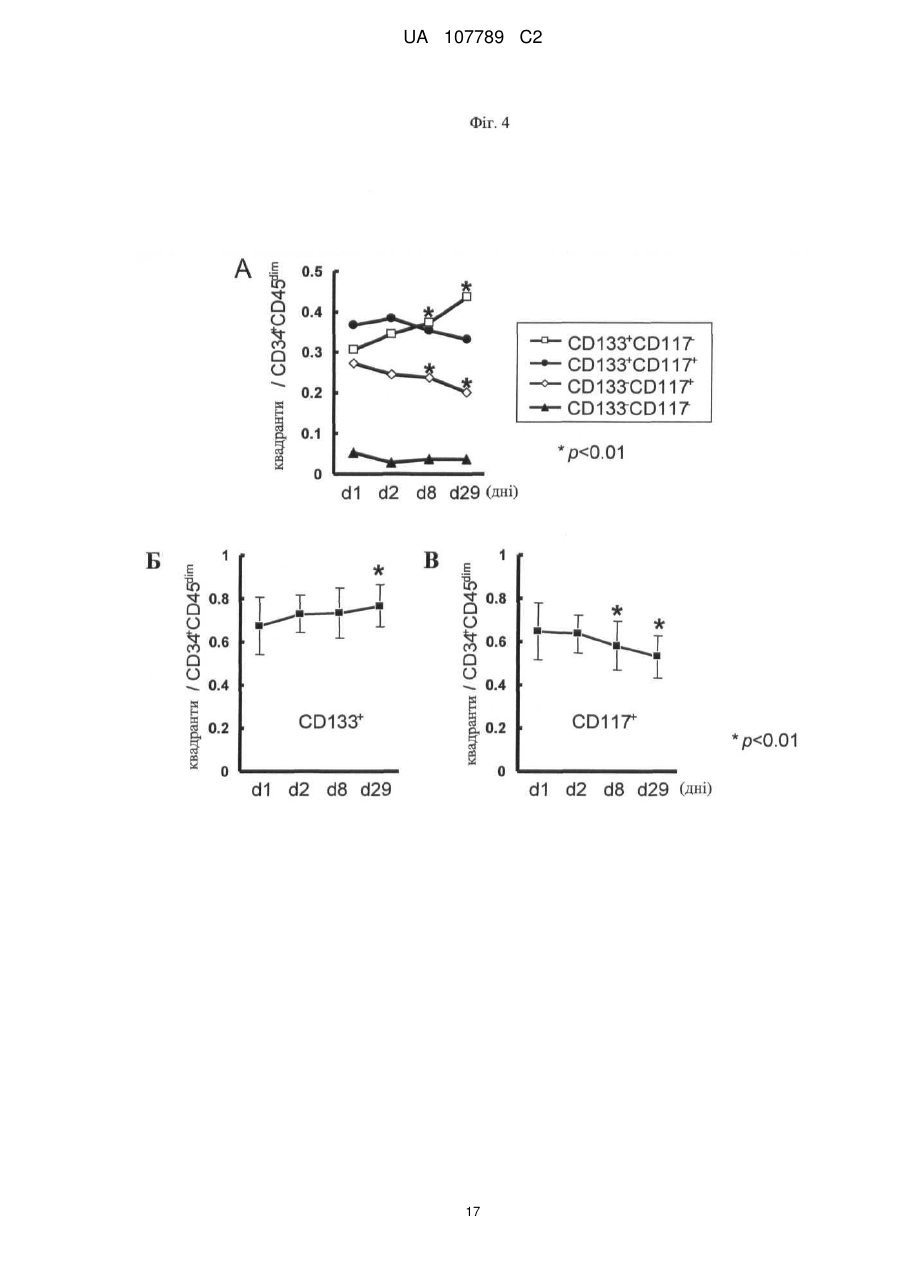
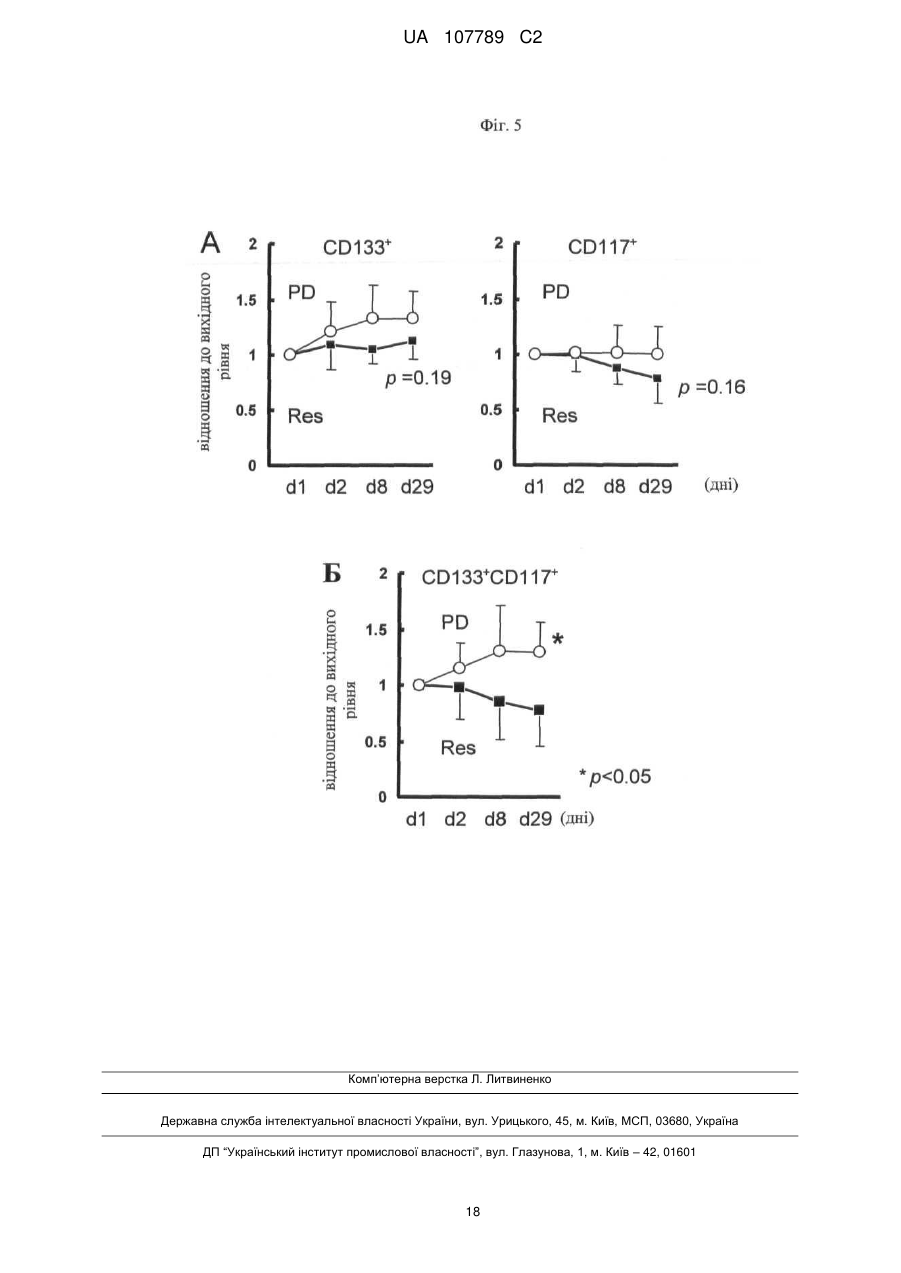
Реферат: Винахід стосується способу моніторингу лікування індивідуума такою сполукою як 3-Z-[1-(4-(N((4-метилтперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6метоксикарбоніл-2-індолінон або його фармацевтично прийнятна сіль, переважно моноетансульфонат, де спосіб полягає у тому, що визначають, чи містить зразок із організму індивідуума біомаркер у кількості, що є індикативною для лікування, причому зазначеним + dim + біомаркером є кількість клітин, вибраних з групи, яка складається з VEGFR2 CD45 pY -клітин, + + + dim + + dim + VEGFR2 pY -клітин, CD34 CD45 CD133 CD117-клітин, CD34 CD45 CD133 CD117 -клітин, + dim + + dim + + dim + + CD34 CD45 CD133 -клітин, CD34 CD45 CD117 -клітин та CD34 CD45 CD133 CD117 клітин. UA 107789 C2 (12) UA 107789 C2 UA 107789 C2 5 10 15 20 Даний винахід належить до галузі медицини й, насамперед, до біомаркерів активності конкретної сполуки й до моніторингу лікування з використанням цієї сполуки. Більше конкретно, даний винахід відноситься до біомаркерів, призначених для моніторингу активності такої сполуки, як 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-Nметиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінон, або її фармацевтично прийнятної солі, і, насамперед у формі моноетансульфонату, при його застосуванні індивідуально або необов'язково у сполученні з іншими фармацевтичними діючими речовинами й/або додатковими методами лікування, такими, наприклад, як променева терапія. Передумови створення винаходу Досягнуті у цей час успіхи у вивченні молекулярних процесів в організмі й розробці технологій вивчення цих процесів привели до вдосконалення методів і систем типування й лікування захворювань. У цей час проводяться дослідження у багатьох галузях з метою створення й/або вдосконалення методів лікування захворювань, а також створення й/або вдосконалення методів або систем моніторингу ефективності лікування. Сполука 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1фенілметилен]-6-метоксикарбоніл-2-індолінон являє собою інноваційну діючу речовину, що має коштовні фармакологічні властивості, насамперед при лікуванні онкологічних захворювань, імунологічних захворювань або патологічних станів, що включають імунологічний компонент, або фіброзних захворювань. Хімічна структура цієї сполуки представлена нижче у вигляді формули A. Формула A O H3C N N N CH3 N H CH3 O O N O 25 30 35 Оснoвна форма цієї сполуки описана у WO 01/27081, форма у вигляді моноетансульфонату описана у WO 2004/013099, а різні інші форми у вигляді солі описані у WO 2007/141283. Застосування зазначеної молекули для лікування імунологічних захворювань або патологічних станів, що включають імунологічний компонент, описане у WO 2004/017948, застосування для лікування онкологічних захворювань описане у WO 2004/096224, і застосування для лікування фіброзних захворювань описане у WO 2006/067165. Форма цієї сполуки у вигляді моноетансульфонату має властивості, які роблять цю форму солі найбільше придатною для створення на її основі лікарського засобу. Хімічна структура моноетансульфонату 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-Nметиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону представлена нижче у вигляді формули A1. Формула A1 O H3C N O N CH3 O N H CH3 N x H3C S O O N O 1 OH UA 107789 C2 5 10 У доклінічних дослідженнях було встановлено, що ця сполука являє собою високо ефективний інгібітор рецепторів судинного ендотеліального фактора росту (VEGFR), що має оральну біодоступність, рецепторів тромбоцитарного фактора росту (PDGFR) і рецепторів фактора росту фібробластів (FGFR), що придушує ріст пухлин за допомогою механізмів інгібування неоваскуляризації пухлин. Установлено також, що ця сполука інгібує передачу сигналів в ендотеліальних і гладком'язових клітинах і перицитах і знижує щільність судин у пухлинах. Крім того, встановлено, що сполука має протипухлинну активність in vivo на всіх вивчених до теперішнього часу моделях при застосуванні у добре переносимих дозах. Нижче у таблиці 1 представлені результати оцінки протипухлинної ефективності in vivo на моделях з використанням ксенотрансплантатів і моделі ізогенних щурячих пухлин. Таблиця 1 Рак колоректальний гліобластома голови і шиї легені (недрібноклітинний) яєчника передміхурової залози (гормонозалежний) ренальний підшлункової залози (мишачий трансгенний) Модель HT-29 HT-29, великі пухлини GS-9L, ізогенні щурячі FaDu NCI-H460 Calu-6 SKOV3 PAC-120 Ефективність T/C 16 %, 100 мг/кг/день, зменшення об'єму пухлини Caki-1 Rip-Tag T/C 13 %, 100 мг/кг/день Вплив на формування пухлини T/C 32 %, 50 мг/кг/день T/C 11 %, 100 мг/кг/день T/C 54 %, 25 мг/кг/день T/C 24 %, 50 мг/кг/день T/C 19 %, 50 мг/кг/день T/C 34 %, 100 мг/кг/день T/C означає зменшення розміру пухлини у % щодо контролю. 15 20 25 30 35 40 Таким чином, цю сполука можна застосовувати для лікування захворювань, які пов'язані з ангіогенезом або проліферацією клітин. Зазначену сполуку можна застосовувати також для лікування фіброзних захворювань, що описано у WO 2006/067165. Незважаючи на велику кількість досліджень, спрямованих на розробку методів діагностування й скринінгу, зберігається необхідність в ефективних методах і системах для моніторингу лікування. Моніторинг не завжди можливий або він вимагає здійснення складних, дорогих і/або тривалих процедур, які часто є незручними для пацієнта, таких як одержання зразків, наприклад, одержання зразків за допомогою біопсії, з організму пацієнта й вивчення цих зразків у лабораторії. Радіологічний аналіз пухлинних клітин можна проводити тільки через декілька тижнів після початку протипухлинної терапії. Так, у WO 2008/127528 представлені методи й процедури для моніторингу відповіді або визначення чутливості пацієнтів, що дозволяють ідентифікувати індивідуальні генетичні профілі, що повинно сприяти лікуванню захворювань і порушень. Згідно з даними, представленим у WO 2008/134526, рак сечового міхура можна виявляти шляхом скринінгу відносно присутності підвищених рівнів ідентифікованих біомаркерів у зразках сечі. У цьому документі описаний також метод діагностування, прогнозування й моніторингу раку сечового міхура, у тому числі як ранньої, так і пізньої стадії раку сечового міхура, шляхом виявлення у зразку сечі, взятому в індивідуума, щонайменше одного біомаркера раку сечового міхура, ідентифікованого при створенні зазначеного винаходу, такого як альфа-lB-глікопротеїн, гаптоглобін, сироватковий трансферин або альфа-1-антитрипсин. Біомаркери можна виявляти й необов'язково кількісно оцінювати за допомогою агента, який виявляє або зв'язується з білком біомаркера, або агента, який виявляє або зв'язується з кодуючими нуклеїновими кислотами, такого як антитіла, що мають специфічну реактивність відносно білка біомаркера або його фрагмента. Таким чином, уже було запропоновано використовувати як індикатор захворювання або його лікувань рівень експресії певних молекул клітинної поверхні. 2 UA 107789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно WO 2005/083123 рівень експресії продукту AC133 у зразку, отриманому з організму індивідуума, тобто кількість білка або його мРНК, є індикативним для захворювання або його лікування. У цьому посиланні зазначено також, що рівень експресії AC133 в організмі онкологічних пацієнтів, що не піддавалися лікуванню, істотно вище у порівнянні зі здоровими індивідуумами. Описано також у прикладах, що рівень експресії AC133 істотно знижувався при лікуванні пацієнтів, що мають різні пухлини, при цьому загальна кількість циркулюючих ендотеліальних клітин залишалася практично такою же у процесі здійснення того ж варіанта лікування. По суті, у зазначеному посиланні продемонстровано також, що кількість циркулюючих ендотеліальних клітин не завжди є індикативною для стану (статусу) індивідуума, хоча загальна кількість продукту експресії AC133 є індикативною для зазначеного статусу. У WO 2004/019864 описане також застосування кількісної ЗТ-ПЛР для виявлення AC133, що служить як маркер, і для діагностування й моніторингу ангіогенезу. Однак до цього часу не описане або не запропоноване застосування ні методу, ні системи, заснованого/заснованої на використанні біомаркерів, для моніторингу лікування індивідуума за допомогою вищевказаного діючої речовини 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону або її фармацевтично прийнятної солі, і насамперед у формі моноетансульфонату, при його застосуванні індивідуально або необов'язково у сполученні з іншими фармацевтичними діючими речовинами й/або додатковими методами лікування, такими, наприклад, як променева терапія. Існуючий рівень техніки не дозволяє також передбачити ні такий метод, ні таку систему. Короткий виклад сутності винаходу Завдання, покладене в основу даного винаходу, полягає у створенні способу або системи на основі біомаркерів для моніторингу лікування індивідуума за допомогою такої сполуки, як 3-Z-[1(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6метоксикарбоніл-2-індолінон або її фармацевтично прийнятної солі, насамперед у формі моноетансульфонату, при його застосуванні індивідуально або необов'язково у сполученні з іншими фармацевтичними діючими речовинами й/або додатковими методами лікування, такими, наприклад, як променева терапія. Таким чином, об'єктом даного винаходу є спосіб або система для моніторингу лікування індивідуума за допомогою 3-Z-[1-(4-(N-((4-метилпіперазин-1-іл)метилкарбоніл)-Nметиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону або її фармацевтично прийнятної солі, насамперед у формі моноетансульфонату, який полягає у тому, що визначають, чи містить зразок із організму зазначеного індивідуума біомаркер у кількості, яка є індикативною для зазначеного лікування. Іншим об'єктом даного винаходу є зазначений/зазначена вище метод або система, у якому/якій біомаркер є індикатором зміни експресії або статусу білка або кількості специфічних клітин, що корелює з ризиком виникнення або прогресування захворювання або з чутливістю захворювання до даного лікування. В іншому варіанті здійснення даного винаходу біомаркер являє собою фармакодинамічний біомаркер. В іншому варіанті здійснення даного винаходу моніторинг лікування має на увазі будь-який з наступних видів моніторингу: моніторинг рівня відповіді, моніторинг тривалості відповіді, моніторинг швидкості відповіді, моніторинг швидкості стабілізації, моніторинг тривалості стабілізації, моніторинг часу до початку прогресування захворювання, моніторинг тривалості існування без прогресивного розвитку захворювання або моніторинг загальної тривалості існування, зокрема без негативного впливу на тривалість відповіді, але з меншою кількістю й/або меншим рівнем побічних дій, що заподіюють занепокоєння. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій рівень оцінюють кількісно. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій здійснюють порівняння зазначеної кількості з референс-значенням. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій здійснюють порівняння зазначеної кількості продукту експресії або специфічних клітин із кількістю продукту експресії або специфічних клітин у зразку, отриманому з організму цього ж індивідуума до початку лікування. В іншому варіанті здійснення винаходу одержують декілька зразків із організму індивідуума у різні моменти часу після початку лікування. Це дозволяє здійснювати моніторинг процесу лікування протягом пролонгованого періоду часу. Це дозволяє, наприклад, визначати, чи залишається кількість біомаркера індикативною для зазначеного захворювання або його лікування. Це, наприклад, можна застосовувати для створення прийнятних схем, доз і типу 3 UA 107789 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування для індивідуального пацієнта. Крім того, це дозволяє визначати, чи є доцільним продовження лікування у цей момент часу. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій зразок одержують у межах місяця після початку лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій зразок одержують у межах тижня після початку лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій зразок одержують у межах двох днів після початку лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій біомаркер містить клітини, що презентують деякі специфічні для клітинної поверхні антигени. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій зразок являє собою зразок крові. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій біомаркером є рівень фосфотирозину в ендотеліальних клітинах. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій біомаркером є кількість VEGFR2 CD45 pY -клітин. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + + якому/якій біомаркером є кількість VEGFR2 pY -клітин. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій біомаркер вибирають з кількості CD34 CD45 CD133 CD 117-клітин, кількості + dim + + dim + CD34 CD45 CD133 CD117 -клітин, кількості CD34 CD45 CD133 клітин і кількості + dim + CD34 CD45 CD117 -клітин. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + + якому/якій біомаркером є кількість CD34 CD45 CD133 CD117 -клітин. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у якому/якій зниження рівнів фосфотирозинув ендотеліальних клітинах, визначене у зразку за допомогою проточної цитометрії, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій зниження кількості VEGFR2 CD45 pY -клітин, визначене за допомогою проточної цитометрії у зразку крові, отриманому з організму індивідуума, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + + якому/якій зниження кількості VEGFR2 pY -клітин, визначене за допомогою проточної цитометрії у зразку крові, отриманому з організму індивідуума, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій підвищення відсотка CD34 CD45 CD133 CD 117 -клітин, установлене після лікування, наприклад у день 29, і у порівнянні з періодом до початку лікування, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій зниження кількості CD34 CD45 CD133 CD117 -клітин, установлене після лікування, наприклад у день 29, і у порівнянні з періодом до початку лікування, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій підвищення кількості CD34 CD45 CD133 CD117 -клітин, установлене після лікування, наприклад у день 29, і у порівнянні з періодом до початку лікування, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій зниження кількості CD34 CD45 CD117 -клітин, установлене після лікування, наприклад у день 8 і день 29, і у порівнянні з періодом до початку лікування, є індикативним для лікування. Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій зниження кількості CD34 CD45 CD133 -клітин, установлене після лікування й у порівнянні з періодом до початку лікування, є індикативним для відповіді (стабілізація захворювання). Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + якому/якій зниження кількості CD34 CD45 CD117 -клітин, установлене після лікування й у порівнянні з періодом до початку лікування, є індикативним для відповіді (стабілізація захворювання). Наступним об'єктом даного винаходу є зазначений/зазначена вище спосіб або система, у + dim + + якому/якій зниження кількості CD34 CD45 CD133 CD117 -клітин, установлене після лікування 4 UA 107789 C2 5 10 15 20 25 30 35 40 45 50 55 60 й у порівнянні з періодом до лікування, є індикативним для відповіді (стабілізація захворювання). Наступним об'єктом даного винаходу є спосіб або система, призначений/ призначена для визначення того, чи буде лікування пацієнта за допомогою 3-Z-[1-(4-(N-((4-метилпіперазин-1іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону або її фармацевтично прийнятної солі, переважно моноетансульфонату, ефективним, що включає наступні елементи: здійснення пацієнтом або лікарем запиту на проведення зазначеного визначення; одержання зразка біологічного матеріалу з організму пацієнта; аналіз зразка за допомогою описаного вище способу або системи для моніторингу лікування індивідуума; і повідомлення результатів аналізів пацієнтові або лікареві. Винахід відноситься також до діагностичного набору, що включає щонайменше один засіб для здійснення способу або системи, запропонованого/запропонованої у винаході. В одному з об'єктів винаходу набір може включати реагенти або матеріали, такі як антитіла або нуклеїнові кислоти, для моніторингу експресії набору біомаркерів, яка визначається на рівні мРНК, білка або на рівні клітини або зразка, і необов'язково одну або декілька діючих речовин, призначених для застосування при аналізі клітин зі зразків тканини пацієнта або зразків з організму пацієнта, і необов'язково інструкції зі застосування. Наступним об'єктом даного винаходу є застосування біомаркера у способі або системі моніторингу лікування індивідуума за допомогою 3-Z-[1-(4-(N-((4-метилпіперазин-1іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону або її фармацевтично прийнятної солі, переважно моноетансульфонату, описаного вище. Опис креслень На кресленнях показано: на фіг. 1 - вплив різних сполук на рівень фосфотирозину у HUVEC-клітинах, оброблених VEGF. На осі абсцис: 1 означає IgG-контроль, не оброблений VEGF і не оброблений діючою речовиною; 2 означає контроль, не оброблений VEGF і не оброблений діючою речовиною; 3 означає контроль, оброблений VEGF, але не оброблений діючою речовиною; 4 означає варіант, оброблений VEGF і оброблений сполукою A1 у концентрації 1 мкМ; 5 означає варіант, оброблений VEGF і оброблений сполукою A1 у концентрації 5 мкМ; 6 означає варіант, оброблений VEGF і оброблений сполукою AG1478 у концентрації 1 мкМ; 7 означає варіант, оброблений VEGF і оброблений сполукою AG1478 у концентрації 5 мкМ; 8 означає варіант, оброблений VEGF і оброблений сполукою 5ФУ у концентрації 1 мМ; 9 означає варіант, оброблений VEGF і оброблений сполукою 5ФУ у концентрації 5 мМ; + dim + на фіг. 2 - рівні фосфотирозину у лейкоцитах лінії VEGFR2 CD45 pY in vivo після обробки сполукою A1. На осі абсцис: 0 означає неопрацьований контроль; A50 означає обробку сполукою А1 у концентрації 50 мг/кг; A100 означає обробку сполукою А1 у концентрації 100 мг/кг; + + на фіг. 3 - вимірювана за допомогою проточної цитометрії кількість VEGFR2 pY -клітин у периферичній крові мишей після обробки сполукою A1. На осі абсцис: 0 означає неопрацьований контроль; A50 означає обробку сполукою А1 у концентрації 50 мг/кг; A100 означає обробку сполукою А1 у концентрації 100 мг/кг; + dim на фіг. 4 - процентний вміст (у квадрантах) CD34 CD45 CD133+/-CD117+/-клітин у цільній крові, зібраній до початку обробки й у день 2, день 8 і день 29 після початку обробки сполукою A1; + dim на фіг. 5 - співвідношення CD34 CD45 CD133+/- CD117+/-клітин у цільній крові, зібраній до початку обробки й у день 2, день 8 і день 29 після початку обробки сполукою A1 у респондерів і нереспондерів. Докладний опис винаходу У контексті даного винаходу біомаркер застосовують як індикатор біологічного стану. Його відмітною ознакою є те, що він піддається об'єктивному вимірюванню та його можна застосовувати як індикатор нормальних біологічних процесів, патогенних процесів або фармакологічних відповідей на терапевтичне втручання. Це задовольняє визначенню, даному дослідницькою групою NIH (Національний інститут охорони здоров'я США) у 1998 р. Більше конкретно, біомаркер є індикатором зміни, що корелює з ризиком виникнення або прогресування захворювання або з чутливістю захворювання до даного лікування. Після валідації запропонованого біомаркера його можна застосовувати для діагностування ризику виникнення захворювання, наявності захворювання в індивідуума або для визначення придатності лікування для захворювання в індивідуума (для вибору лікарської терапії або схеми введення). При оцінці можливих лікарських терапій біомаркер можна застосовувати як замінник природної кінцевої точки, такої як тривалість існування або невідворотність смерті. Якщо 5 UA 107789 C2 5 10 15 20 25 30 35 40 лікування приводить до зміни рівня біомаркера, прямо зв'язаної з поліпшенням здоров'я, то біомаркер служить в якості "сурогатної" кінцевої точки оцінки клінічного сприятливого впливу. Спосіб або система, запропонований/запропонована у винаході, може являти собою, наприклад, спосіб in vitro, у якому стадія вимірювання в індивідуума рівня щонайменше одного біомаркера передбачає одержання біологічного зразка з організму індивідуума й наступне вимірювання рівня біомаркера(ів) у біологічному зразку. Біологічний зразок може являти собою, наприклад, щонайменше один із наступних зразків: зразок сироватки, цільної крові, мононуклеарних клітин периферичної крові, замороженої цільної крові, свіжої плазми, замороженої плазми, сечі, слини, шкіри, волосяного фолікула, кісткового мозку або пухлинної тканини. У контексті даного винаходу найбільший інтерес як маркери специфічних клітинних типів являють молекули кластеру диференціювання (диференційовані антигени лейкоцитів, що виявляються кластером моноклональних антитіл) CD34, CD45, CD133 і CD117. Тому визначення кластеру диференціювання (або диференційованих антигенів, часто скорочено позначуваних як CD) являє собою протокол, який застосовують для ідентифікації й дослідження молекул, що є присутніми на клітинній поверхні лейкоцитів. Номенклатура CD запропонована й затверджена на засіданні 1-ої Міжнародної робочої групи й конференції за st диференційованими антигенами людських лейкоцитів (1 International Workshop and Conference on Human Leukocyte Differentiation Antigens) (HLDA) у Парижі у 1982 р. Ця система призначена для класифікації багатьох моноклональних антитіл (МАт), створених різними лабораторіями в усьому світі, до епітопів на поверхні молекул лейкоцитів (білі кров'яні клітини). Після цього застосування зазначеної системи розширено для багатьох інших клітинних типів, і ідентифіковано більше 320 унікальних кластерів і підкластерів CD. Передбачуваній поверхневій молекулі привласнюють номер CD, якщо встановлено, що два специфічних моноклональних антитіла (МАт) зв'язуються з молекулою. Якщо молекула не досить охарактеризована або відоме тільки одне специфічне для неї МАт, то їй, як правило, привласнюють тимчасовий індикатор "w" (наприклад, "CDw186"). CD-молекули можуть діяти різними шляхами, часто як рецептори або ліганди (молекула, яка активує рецептор), що мають важливе значення для клітини. Вони, як правило, ініціюють сигнальний каскад, змінюючи поводження клітини (передача сигналів у клітині). Деякі білки CD не грають ролі у передачі клітинних сигналів, але мають інші функції, такі як клітинна адгезія. До них відносяться приблизно 250 різних білків. CD-систему часто використовують як клітинні маркери, що дозволяють розрізняти клітини на основі того, які молекули присутні на їх поверхні. У той час як застосування однієї CD-молекули для визначення популяцій не є широко розповсюдженим (хоча є декілька таких прикладів), застосування комбінованих маркерів дозволяє виявляти з дуже високою специфічністю клітинні типи в імунній системі. CD-молекули застосовують для сортування клітин за допомогою різних методів, включаючи проточну цитометрію. Клітинні популяції, як правило, позначають символом «+» або «-» для вказівки того, що певна клітинна фракція експресує CD-молекулу або у ній відсутня CD+ молекула. Наприклад, "CD34 ,CD31 -клітина" означає клітину, що експресує CD34, але не експресує CD31. Зазначена комбінація CD, як правило, відповідає стовбурній клітині на відміну від повністю диференційованої ендотеліальної клітини. Нижче у таблиці 2 представлені CDмаркери деяких гематопоетичних стовбурних клітин і лейкоцитів Таблиця 2 Тип клітини CD-маркери стовбурні клітини CD34+,CD31 всі групи лейкоцитів CD45+ гранулоцит CD45+,CD15+ моноцит CD45+,CD14+ T-лімфоцит CD45+,CD3+ T-клітина-хелпер CD45+,CD3+,CD4+ цитотоксична T-клітина CD45+,CD3+,CD8+ B-лімфоцит CD45+,CD19+ або CD45+,CD20+ тромбоцит CD45+,CD61+ 6 UA 107789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Молекула CD34 кластеру диференціювання являє собою молекулу, що є присутньою на + певних клітинах в організмі людини. Клітини, які експресують CD34 (CD34 -клітина), у нормі присутні у пупковому канатику й кістковому мозку в якості гематопоетичних клітин, ендотеліальних клітин-попередників, ендотеліальних клітин кровоносних судин, але не у лімфатичних судинах (за винятком плевральних лімфатичних судин), у гладких клітинах, у субпопуляції дендритних клітин (які є негативними за фактором XIIIa) в інтерстиціальній тканині й навколо придатків дерми шкіри, а також як клітини деяких пухлин м'яких тканин. CD34 являє собою глікопротеїн клітинної поверхні й функціонує як фактор адгезії типу клітина-клітина. Він може опосередковувати також приєднання стовбурних клітин до позаклітинного матриксу + кісткового мозку або безпосередньо до стромальних клітин. CD34 -клітини можна виділяти зі зразків крові за допомогою імуномагнітних або імунофлуоресцентних методів. Антитіла застосовують для кількісного визначення й очищення гематопоетичних стовбурних клітинпопередників для дослідницьких потреб і для трансплантації кісткового мозку у клінічних + умовах. Таким чином, зазначені клітини можна відсортовувати за ознакою CD34 -експресії. Антиген CD45 кластеру диференціювання являє собою білок, що спочатку позначали як загальний антиген лейкоцитів. Білок, який кодований зазначеним геном, є представником сімейства протеїнтирозинфосфатаз (PTP). Відомо, що PTP являють собою сигнальні молекули, які регулюють різні клітинні процеси, включаючи ріст, диференціювання, мітотичний цикл і онкогенну трансформацію клітин. Зазначена PTP містить позаклітинний домен, один трансмембранний сегмент і два тандемних внутрішньоцитоплазматичних каталітичних домени, і тому належить до PTP рецепторного типу. Цей ген специфічно експресується у гематопоетичних клітинах. Установлено, що зазначена PTP є основним регулятором передачі сигналів T- і B-клітинних рецепторів антигену. Вона функціонує або шляхом безпосередньої взаємодії з компонентами комплексу рецепторів антигену, або шляхом активації кіназ Srcсімейства, необхідних для передачі сигналів рецепторів антигену. Зазначена PTP придушує також JAK-кінази й у результаті функціонує як регулятор передачі сигналів рецепторів цитокінів. Описані чотири отриманих у результаті альтернативного сплайсингу варіанта цього гена, які кодують різні ізоформи. CD45 являє собою трансмембранний білок типу I, який у різних формах присутній на всіх диференційованих гематопоетичних клітинах за винятком еритроцитів і плазматичних клітин і який сприяє активації зазначених клітин (форма костимуляції). Його експресія виявлена при лімфомах, B-клітинному хронічному лімфолейкозі, волосинкоклітинному лейкозі й гострому нелімфоцитарному лейкозі. Молекула CD133 кластеру диференціювання, яку називають також AC133, являє собою глікопротеїн, виявлений у людини й гризунів, який позначають також як промінін-1 (PROM1). Він є основним представником трансмембранних пентаспанових глікопротеїнів (5-спіральних трансмембранних глікопротеїнів, 5-TM), який специфічно локалізується на клітинних виступах. CD133 експресується в гематопоетичних стовбурних клітинах, ендотеліальних клітинахпопередниках, гліобластомах, нейронних й гліальних стовбурних клітинах і деяких інших типах клітин. Молекула CD117 кластеру диференціювання, яку називають також KIT або рецептор C-kit, являє собою цитокіновий рецептор, що експресується на поверхні гематопоетичних стовбурних клітин, а також інших типів клітин. Цей рецептор зв'язується з фактором стовбурних клітин (субстанція, що викликає ріст певних типів клітин). CD117 є важливим маркером клітинної поверхні, який застосовують для ідентифікації певних типів гематопоетичних (кров'яних) клітинпопередників у кістковому мозку. Зокрема, високі рівні експресії CD117 мають місце у гематопоетичних стовбурних клітинах (HSC), мультипотентних попередниках (MPP) і загальних мієлоїдних попередниках (CMP). Для загальних лімфоїдних попередників (CLP) характерні низькі рівні експресії CD117 на поверхні. CD117 ідентифікований також у найбільше ранніх попередниках тимоцитів у тимусі. Крім того, CD117 експресує гладкі клітини, меланоцити у шкірі та інтерстиціальні клітини лінії Cajal у травному тракті. CD117 є також маркером стовбурних клітин у передміхуровій залозі мишей. Як зазначено нижче, і це перебуває відповідно до даного винаходу, клітини, які презентують певні клітинні маркери, можна застосовувати в якості біомаркерів для моніторингу лікування індивідуума за допомогою застосовуваного як діюча речовина 3-Z-[1-(4-(N-((4-метилпіперазин-1іл)метилкарбоніл)-N-метиламіно)аніліно)-1-фенілметилен]-6-метоксикарбоніл-2-індолінону або її фармацевтично прийнятної солі, переважно моноетансульфонату. Зокрема, це включає моніторинг рівня відповіді, тривалості відповіді, швидкості відповіді, швидкості стабілізації, тривалості стабілізації, часу до початку прогресування захворювання, тривалості існування без прогресивного розвитку захворювання або загальної тривалості 7 UA 107789 C2 5 10 15 20 25 30 35 40 45 існування, зокрема без негативного впливу на тривалість відповіді, але з меншою кількістю й/або меншим рівнем побічних дій, що заподіюють занепокоєння. Як відзначалося вище, лікування, запропоноване у даному винаході, згідно з даним описом становить інтерес завдяки антиангіогенній дії й/або дії, що робить вплив на проникність судин. Ангіогенез і/або підвищення проникності судин у цей час виявлені при широкому спектрі хворобливих станів, включаючи рак (такий як лейкоз, саркома Капоші, множинна мієлома і лімфома), діабет, псоріаз, ревматоїдний артрит, гемангіому, гострі й хронічні нефропатії, атерому, артеріальний рестеноз, аутоімунні захворювання, гостре запалення, астму, лімфоедему, ендометріоз, маткова кровотеча, яка пов'язана з дисфункцією, фіброз, цироз і очні хвороби з проліферацією судин сітківки, включаючи вікову дегенерацію жовтої плями. Комбіноване лікування, запропоноване у даному винаході, можна здійснювати згідно з даним описом шляхом одночасного, послідовного або роздільного введення окремих компонентів зазначеного лікування. Комбіноване лікування згідно з даним описом можна застосовувати як єдину терапію або можна застосовувати хірургічне втручання або променеву терапію, або застосовувати додатковий хіміотерапевтичний засіб або агент спрямованої дії при здійсненні комбінованого лікування, запропонованого у винаході. Хірургічне втручання може включати стадію часткової або повної резекції пухлини до, у процесі або після застосування комбінованого лікування, представленого у даному описі. Очікується, що комбіноване лікування, представлене у даному описі, буде особливо придатним у випадку профілактики й лікування таких хвороб, як рак і саркома Капоші. Зокрема, очікується, що комбіноване лікування, запропоноване у винаході, повинно ефективно сповільнювати ріст первинних і рекурентних щільних пухлин, наприклад, ободової кишки, підшлункової залози, головного мозку, сечового міхура, яєчника, молочної залози, передміхурової залози, легенів і шкіри. Очікується, що комбіноване лікування, запропоноване у даному винаході, повинно ефективно сповільнювати ріст пухлин при таких видах раку, як рак легені, включаючи злоякісну плевральну мезотеліому, дрібноклітинний рак легені (SCLC) і недрібноклітинний рак легені (NSCLC), рак голови й шиї, рак стравоходу, рак шлунка, колоректальний рак, шлунково-кишкові стромальні пухлини (GIST), рак підшлункової залози, гепатоклітинний рак, рак молочної залози, нирковоклітинний рак і рак сечових шляхів, рак передміхурової залози, рак яєчника, різні види раку головного мозку, саркому, різні види раку шкіри й гематологічних неоплазій (лейкози, мієлодиплазії, мієломи, лімфоми). Більше конкретно, очікується, що комбіноване лікування, запропоноване у винаході, може інгібувати будь-яку форму раку, асоційованого з VEGF, включаючи лейкоз, множинну мієлому і лімфому, а також, наприклад, інгібувати ріст первинних і рекурентних щільних пухлин, асоційованих з VEGF, насамперед пухлин, ріст і поширення яких у значній мірі залежать від VEGF, включаючи, наприклад, певні пухлини ободової кишки (у тому числі прямої кишки), підшлункової залози, головного мозку, нирки, гепатоклітинний рак, рак сечового міхура, яєчника, молочної залози, передміхурової залози, легені, вульви, шкіри, і насамперед злоякісну плевральну мезотеліому й NSCLC. Більше конкретно очікується, що комбіноване лікування, запропоноване у винаході, повинно ефективно сповільнювати ріст пухлин при злоякісній плевральній мезотеліомі. Більше конкретно очікується, що комбіноване лікування, запропоноване у винаході, повинно ефективно сповільнювати ріст пухлин при недрібноклітинному раку легені (NSCLC). Відповідно до іншого об'єкта даного винаходу, очікується, що лікування повинно інгібувати ріст первинних і рекурентних щільних пухлин, які асоційовані з VEGF, насамперед пухлин, ріст і поширення яких у значній мірі залежать від VEGF. Наведені нижче дослідження призначені для ілюстрації даного винаходу. Застосовувані в описі цих дослідів і у контексті даного опису скорочення пояснені у наведеному нижче списку скорочень. 50 8 UA 107789 C2 Список скорочень АФЦ БСА CEC CEP Cy5.5 EGFR FCM ФІТЦ FSC HepG2 HUVEC PBL ЗФР PD -ФЕ PerCP PY або pY RES SSC TKI VEGFR 5 10 15 20 25 30 35 алофікоціанін бичачий сироватковий альбумін циркулююча ендотеліальна зріла клітина циркулююча ендотеліальна клітина-попередник ціанін 5.5 рецептор епідермального фактора росту проточна цитометрія флуоросцеїнізотіоціанат розсіювач у напрямку поширення клітинна лінія людської гепатоклітинної карциноми ендотеліальні клітини пупкової вени людини лейкоцит периферичної крові забуференний фосфатом фізіологічний розчин прогресуюче захворювання мічений фікоеритрином Білок перидинінхлорофіл фосфотирозин респондер розсіювання у бічному напрямку інгібітор тирозинкінази рецептор 2 судинного ендотеліального фактора росту Доклінічне дослідження Наведені нижче експерименти in vitro і in vivo здійснювали для оцінки протипухлинної активності сполуки A1 у відношенні гепатоклітинної карциноми й для ідентифікації нових фармакодинамічних маркерів у зразках крові, а саме рівнів фосфотирозину в ендотеліальних + dim + + + клітинах, кількості VEGFR2 CD45 pY -клітин і кількості VEGFR2 pY -клітин. Експеримент на HUVEC-клітинах (фіг. 1) HUVEC-клітини обробляли сполукою A1 (1 і 5 мкМ), інгібітором EGFR AG1478 (1 і 5 мкМ) і 5ФУ (5-фторурацил, 1 і 5 мМ) протягом 3 год. і додавали 20 нг/мл VEGF за 5 хв. до збору клітин. Зібрані клітини відмивали двічі ЗФР і центрифугували (300×g, 5 хв.) у 50 мкл буфера для фарбування. Після видалення супернатанту аспірацією клітинний дебрис лізували у 250 мкл розчину для фіксації/підвищення проникності й витримували протягом 20 хв. на льоді. Додавали антитіло PY-100-Alexa 488 та інгібітор фосфатази. Клітини витримували на льоді протягом 30 хв. у темряві та відмивали двічі буфером Perm/Wash™ (буфер для підвищення проникності/відмивання) і лізували знову у 500 мкл буфера для фарбування. Потім клітини оцінювали за допомогою проточної цитометрії (FACS Calibur, фірма BD). Дані одержували, використовуючи програму Cell Quest (фірма BD), і аналізували за допомогою WinMDI 2.9 (вільна програма). Зразки крові мишей для дослідження in vivo (фіг. 2 і 3) Мишей, яким були інокульовані HepG2-клітини, довільно розділяли на три групи залежно від розміру пухлин і обробляли наповнювачем (контроль), сполукою A1 (50 мг/кг, p.o.) або сполукою A1 (100 мг/кг, p.o.) протягом 14 днів. Мишей умертвляли й одержували аспірацією з черевної аорти або серця зразки цільної крові мишей. Кров піддавали гемолізу за допомогою гемолітичного агента при кімнатній температурі протягом 10 хв. Після центрифугування (500×g, 5 хв.) клітини відмивали, використовуючи 1 мл буфера для фарбування. Потім клітини інкубували з 100 мкл буфера для фарбування й 5 мкл антитіла до VEGFR2-ФЕ протягом 15 хв. у темряві. Після цього клітини відмивали та інкубували у 500 мкл розчину для фіксації/ підвищення проникності протягом 20 хв. і двічі відмивали буфером Perm/Wash. Потім додавали суміш антитіл (PY-100, CD45-PerCP-Cy5.5, по 5 мкл кожного) та інгібітора фосфатази та інкубували протягом 30 хв. у темряві. Клітини відмивали й аналізували за допомогою проточної цитометрії (FACS Calibur, фірма BD). Дані одержували, використовуючи програму Cell Quest (фірма BD), і аналізували за допомогою WinMDI 2.9 (вільна програма). Антитіла PY-100 (антитіло до фосфотирозину), кон'юговане з Alexa Fluor 488 (фірма Cell Signaling, № 9414), 9 UA 107789 C2 5 10 15 20 25 30 35 40 45 50 55 60 до VEGFR2-ФЕ (фірма BD pharm, 555308), до CD45-PerCP-Cy5.5 (фірма BD Pham, 340953), застосовуване для контролю ізотипу кон'юговане з Alexa Fluor 488 мишаче IgGκ (фірма BD Pham, 557702) Буфери Буфер фірми BD типу Cytofix/Cytoperm, набір для фіксації /підвищення проникності (каталожний № 554714), 2+ 2+ буфер для фарбування (модифікований за методом Дульбекко ЗФР (без Mg , Ca ), доповнений 1 % інактивованою тепловою обробкою FCS і 0,09 % (мас./об.) азиду натрію, значення pH доведене до 7,4-7,6), 10× буфер для лізису (NH4Cl 82,6 г, NaHCO3 11,9 г, ЕДТК2Na 0,378 г, H2O до 1 л, значення pH доведене до 7,3). Результати У дослідженні in vitro було встановлено, що рівні фосфотирозину у HUVEC-клітинах придушувалися сполукою A1, але не придушувалися AG1478 (EGFR-TKI) і 5ФУ, що продемонстровано на фіг. 1. У дослідженні in vivo було встановлено, що сполука A1 знижувала кількість + dim + VEGFR2 CD45 pY -клітин, що продемонстровано на фіг. 2. Крім того, обробка сполукою А1 + + придушувала VEGFR2 pY -клітини у периферичній крові мишей, що продемонстровано на фіг. 3. Висновок Наявність зниження рівнів фосфотирозину в ендотеліальних клітинах, установлена за допомогою проточної цитометрії, є фармакодинамічним маркером для сполуки А1, що являє собою антиангіогенний інгібітор. + dim + Наявність зниження кількості VEGFR2 CD45 pY -клітин у зразках крові, установлена за допомогою проточної цитометрії, є фармакодинамічним маркером для сполуки А1, що являє собою антиангіогенний інгібітор. + + Наявність зниження кількості VEGFR2 pY -клітин у зразках крові, установлена за допомогою проточної цитометрії, є фармакодинамічним маркером для сполуки А1, що являє собою антиангіогенний інгібітор. Фаза I клінічного дослідження Здійснювали додаткове дослідження, а саме фазу I дослідження, для вивчення протипухлинної активності сполуки A1 за участю пацієнтів із запущеними щільними пухлинами (ST) і для підтвердження того, що CD133- і CD117-позитивні клітини можна застосовувати в якості біомаркерів активності зазначеної діючої речовини. Метод Зразки цільної крові одержували до початку лікування (день 1) і у день 2, день 8 і день 29 + dim після початку лікування. Субпопуляцію CD34 CD45 -клітин периферичної крові з цільної крові додатково ідентифікували за допомогою маркерів клітинної поверхні CD133 і CD117 з використанням проточної цитометрії. Зразок цільної крові (800 мкл) доповнювали 4,5 мл 0,2 % БСА-ЗФР і центрифугували протягом 5 хв. (1500 об/хв.). Після видалення супернатанту аспірацією додавали 4,5 мл 0,2 % БСА-ЗФР і центрифугували. Клітинний дебрис змішували з 50 мкл людського гамма-глобуліну. Додавали антитіла (CD34-ФІТЦ, CD117-ФЕ, CD45-PerCP і CD133-АФЦ) і витримували протягом 45 хв. при 4 °C. Додавали гемолітичний агент (4,5 мл) та інкубували протягом 10 хв. Після центрифугування (1500 об/хв., 5 хв.) супернатант двічі промивали. Потім додавали 0,2 % БСА-ЗФР (4,5 мл) і супернатант видаляли центрифугуванням (1500 об/хв., 5 хв.). Об'єм клітинного дебрису доводили до 800 мкл за допомогою БСА-ЗФР і + dim аналізували проточною цитометрією. Визначали відсоток (квадранти) CD34 CD45 CD133+/CD117+/-клітин. Антитіла CD34-ФІТЦ, фірма BECKMANCOULTER (каталожний № IM1870). CD117-ФЕ, фірма BECKMANCOULTER (каталожний № IM2732). CD45-PerCP, фірма BD Biosciences (каталожний № 347464). CD133-АФЦ, фірма Miltenyi Biotec (каталожний № 130-090-854). Результати Обробка сполукою A1 і CD133CD 117-клітини: Аналіз за допомогою проточної цитометрії дозволив установити, що обробка сполукою A1 істотно підвищувала процентний вміст + dim + CD34 CD45 CD133 CD 117 -клітин (p
ДивитисяДодаткова інформація
Автори російськоюArao, Tokuzo, Kudo, Kanae, Nakagawa, Kazuhiko, Nishio, Kazuto
МПК / Мітки
МПК: G01N 33/574, A61B 5/00, G01N 33/53
Мітки: призначений, лікування, моніторингу, спосіб, основі, біомаркерів
Код посилання
<a href="https://ua.patents.su/20-107789-sposib-na-osnovi-biomarkeriv-priznachenijj-dlya-monitoringu-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб на основі біомаркерів, призначений для моніторингу лікування</a>
Попередній патент: Злитий протеїн m.tuberculosis
Наступний патент: Напівнавісний плуг із удосконаленим пристроєм очищення колеса
Випадковий патент: Радіофармацевтик, спосіб діагностики, визначення відкладень тромбоцитів та комплект для отримання радіофармацевтика