Синтетичний промотор, який індукується патогенами
Формула / Реферат
1. Синтетичний промотор, що індукується патогенами, що містить мінімальний промотор та є придатним для регулювання транскрипції нуклеїнової кислоти, який відрізняється тим, що згаданий мінімальний промотор містить фрагмент послідовності twcccmt, розташований за ділянкою ТАТА та перед однією з точок початку транскрипції, які належать до мінімального промотору, з яких починається транскрипція нуклеїнової кислоти, яка підлягає регулюванню.
2. Синтетичний промотор, який індукується патогенами, за п. 1, який відрізняється тим, що згаданий фрагмент послідовностей повторюється у мінімальному промоторі два або більше разів.
3. Синтетичний промотор, що індукується патогенами, за п. 1 або п. 2, який відрізняється тим, що мінімальний промотор містить нуклеотидну послідовність за однією з Послідовностей № 8-9 або її похідне.
4. Синтетичний промотор, який індукується патогенами, за одним із пп. 1-3, який відрізняється тим, що містить, окрім мінімального промотору, щонайменше один цис-регуляторний елемент із нуклеотидною послідовністю за однією з Послідовностей № 10-15.
5. Рекомбінантний ген із синтетичним промотором, який індукується патогенами, за одним із пп. 1-4.
6. Рослинна клітина із синтетичним промотором, який індукується патогенами, за одним із пп. 1-4, інтегрованим у ДНК рослинної клітини.
7. Трансгенна рослина з рослинною клітиною за п. 6.
8. Посівний матеріал трансгенної рослини за п. 7.
9. Спосіб одержання резистентних до патогенів рослин, який включає введення у рослинну клітину нуклеїнової кислоти, придатної для створення захисту від патогенів, яка регулюється синтетичним промотором, який індукується патогенами, та подальшу регенерацію із цієї рослинної клітини рослини, який відрізняється тим, що синтетичним промотором, який індукується патогенами, є синтетичний промотор, який індукується патогенами, за одним із пп. 1-4.
Текст
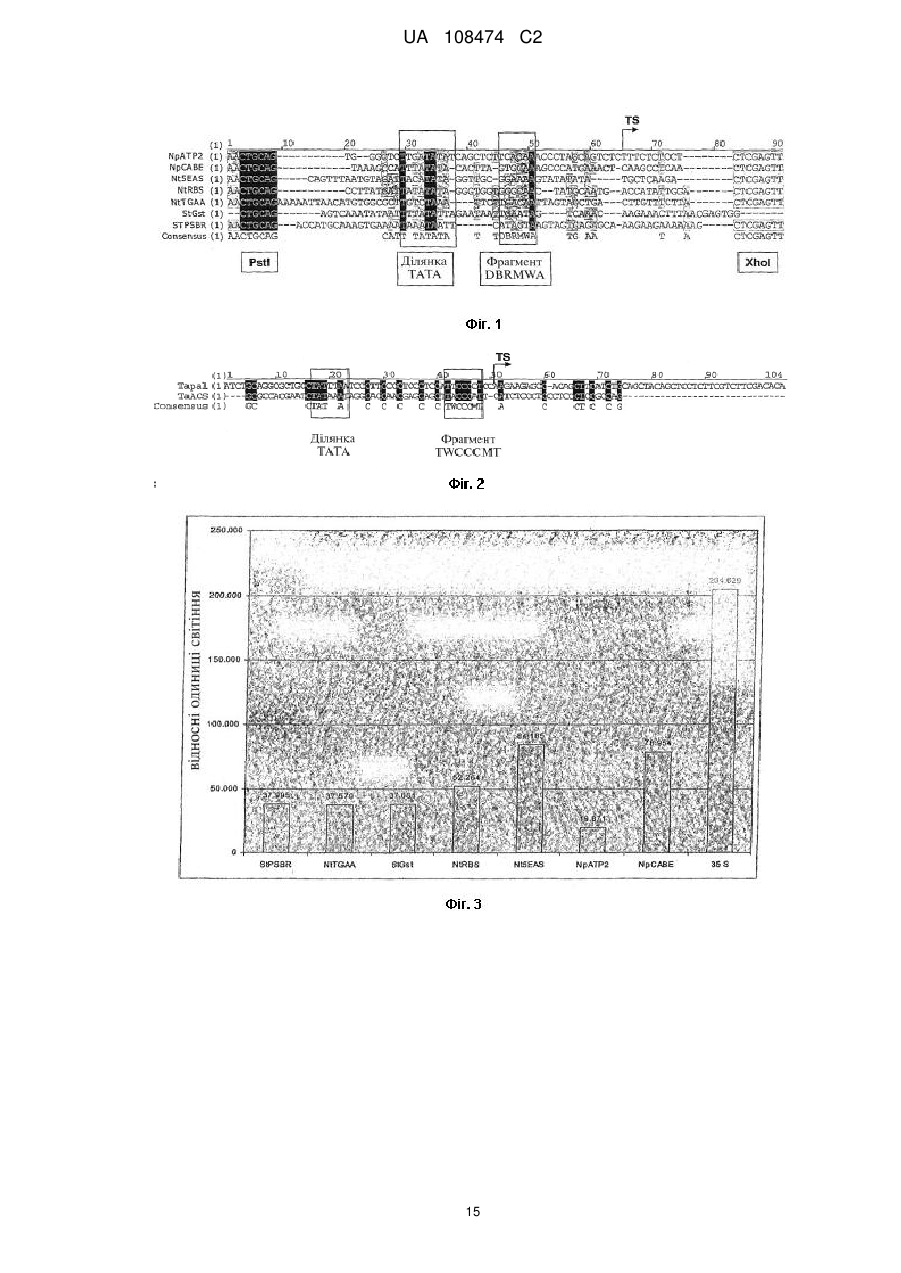
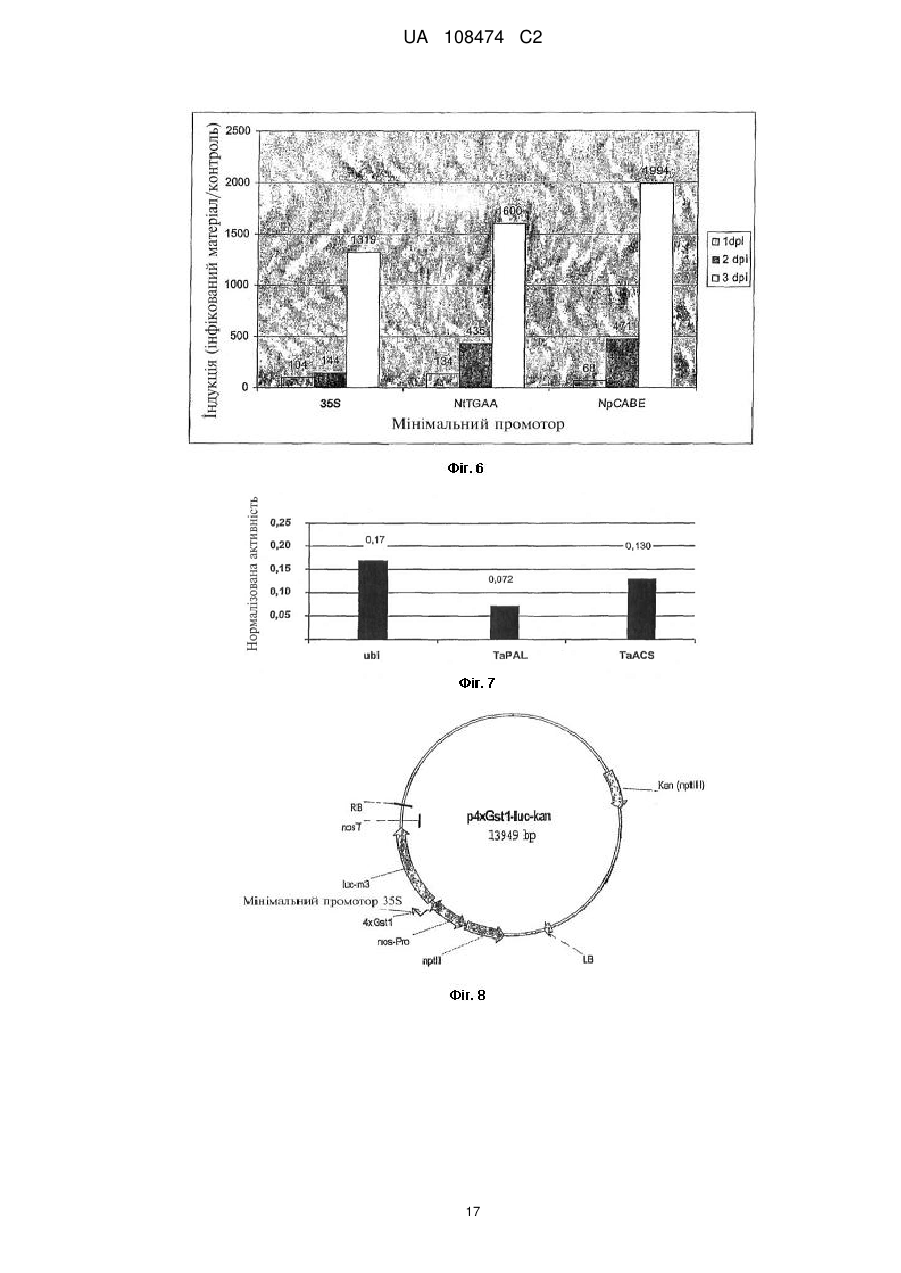
Реферат: Винахід належить до синтетичного промотору, що індукується патогенами та містить мінімальний промотор, який відрізняється тим, що згаданий мінімальний промотор містить UA 108474 C2 (12) UA 108474 C2 фрагмент послідовності twcccmt, розташований за ділянкою ТАТА та перед однією з точок початку транскрипції, які належать до мінімального промотору, з яких починається транскрипція нуклеїнової кислоти, яка підлягає регулюванню. UA 108474 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується придатного для регулювання транскрипції нуклеїнової кислоти синтетичного промотору, який індукується патогенами та містить мінімальний промотор. Крім того, цей винахід стосується трансгенних рослинних клітин та трансгенних рослин. Далі, цей винахід стосується способу одержання рослин, стійких до патогенів. Відомі різноманітні способи одержання рослин, стійких до патогенів, таких як грибки, віруси, бактерії та нематоди. У деяких таких способах використовується гіперчутлива реакція (HR) рослин, при якій на місці безпосереднього контакту патогенного чинника з рослиною утворюються некрози. Внаслідок HR у сусідніх з ураженою ділянкою клітинах відбуваються різноманітні явища та події, які забезпечують захист від патогенів, які перешкоджають подальшому проникненню патогену у рослинну тканину. HR може виникати після експресії гена-ефектора, наприклад, гена авірулентності патогену, та взаємодії з продуктом кореспондуючого гена резистентності (R-гена). При цьому R-ген може бути наявним у рослині або введеним методами генної інженерії у відповідний рослинний геном (Стувер (Stuiver) та ін., 1998; Келлер (Keller) та ін., 1999; Белбахрі (Belbahri) та ін., 2001). Крім того, збудження HR може спричинятися надлишковою експресією або автоактивуванням R-гена (Тао (Тао) та ін., 2000; Танг (Tang) та ін., 1999; Бендахмейн (Bendahmane) та ін., 2002; Гоулз (Howies) та ін., 2005). Внаслідок надлишкової експресії R-гена перевищується граничне значення, яке спричиняє збудження сигнального каскаду, який звичайно збуджується лише у присутності патогену або продукту гена авірулентності цього патогену. Шляхом збудження цього каскаду можна досягти широкої та ефективної резистентності до патогену (Олдройд та Стаскавіч (Oldroyd and Staskawicz), 1998; Тао та ін., 2000; Гоулз та ін., 2005). Автоактивними Rгенами звуться R-гени, модифіковані таким чином, що для збудження сигнального каскаду не є необхідною присутність патогену або продукту гена авірулентності та одночасно для збудження сигнального каскаду є достатньою знижена інтенсивність експресії у порівнянні з немодифікованою формою. Стувер та ін. (1998) показали, що трансформування гена avr-9 з фітопатогенного гриба Cladosporium fulvum, регульованого протомором Gst-1 з картоплі, який індукується патогеном, викликає широку та ефективну резистентність до грибів у рослинах томатів, які несуть кореспондуючий ген Cf9. Резистентності Nicotiana tabacum до овоміцетів Phytophthora parasitica var nicotianae вдалося досягти шляхом трансформування або еліцитору криптогеніну з P.cryptogea, або бактеріального еліцитору рорА з фітопатогенної бактерії Ralstonia solanacearum у N. tabacum. Обидва гени регулюються промотором hsr203J з N. tabacum, який індукується патогенами (Келлер та ін., 1999; Белбахрі та ін., 2001). Система збудження HR вимагає жорсткого регулювання експресії гена-ефектора на місці інфекції. Нерегульована експресія гена-ефектора спричиняє негативний вплив на ріст рослин і, таким чином, на врожайність культурних рослин (Стувер та Кастерс (Custers), 2001). Звичайно, контрольована експресія може забезпечуватися вибором відповідних промоторів, які індукуються патогенами. Такі промотори мають забезпечувати відсутність експресії або дуже низьку експресію в умовах відсутності ураження, але помітне посилення експресії на місці інфекції в разі ураження. Після трансформування двох різних автоактивних форм регульованого природним промотором Fis1, який індукується іржею, гена L6 резистентності до іржі з льону (Linum usitatissimum) у льон, вдалося одержати два фенотипи. До одного з них належали рослини нормальної висоти, які не мали покращеної резистентності до патогенів, а до другого - малорослі рослини із широкою резистентністю до патогенів (Гоулз та ін., 2005). Ці результати показують, що залежно від застосованої форми автоактивного R-гена досягається активність промотору, яка перевищує значення порогу індукування сигнального каскаду, тоді як у рослинах, які не мають помітних фенотипічних відмінностей, індукція промотору Fis1 є недостатньою для досягнення граничного значення. Таким чином, специфічність природного промотору Fis1 є недостатньою длядосягнення широкої та ефективної резистентності до патогенів без негативного впливу на ріст рослин. Природні промотори, які індукуються патогенами, часто виявляють надто неспецифічну активність та активуються численними чинниками; отже, їх застосування для експресії вищезгаданих генів-ефекторів є нераціональним, оскільки збудження HR може відбуватися також в умовах відсутності інфекції. Ця неселективність промоторів спричиняє вплив на ріст рослин і, таким чином, на зниження врожайності культурних рослин. Тому розроблено синтетичні промотори, які містять фрагменти послідовностей (цис-регулювальні елементи), які мають відношення до індукції патогенами, з природних промоторів, які індукуються патогенами. При цьому фрагменти послідовностей, які відповідають іншим збудникам, видалені. Ці цисрегуляторні елементи клонуються перед мінімальним промотором, причому утворюється функціональний промотор, який має підвищену специфічність у порівнянні з природним 1 UA 108474 C2 5 10 15 20 25 30 35 40 45 50 55 промотором, з якого виділено відповідні цис-регуляторні елементи (Раштон (Rushton) та ін., 2002). Як мінімальний промотор для дводольних рослин застосовується ділянка від -46 до +8 гена 35S вірусу мозаїки цвітної капусти. Крім того, відомим є застосування мінімального промотору з природного промотору, з якого клоновано відповідний цис-регуляторний елемент (Перл-Тревер (Perl-Trever) та ін., 2004). Для однодольних рослин описано застосування мінімального промотору з гена Act1 рису (Лю (Lu) та ін., 2000). Хоча описані синтетичні промотори переважають природні промотори, однак вони виявляють певну фонову активність також і при відсутності ураження. Ця фонова активність змінюється від одного виду рослин до іншого. Так, хоча у всіх досліджених до цього часу видах рослин можна виявити можливість індукування патогенами, спостерігається змінність інтенсивності індукування та абсолютної активності промоторів. При надто високій фоновій активності виявляється низька здатність до індукування патогенами, яка визначається як відношення активності промотора в інфікованій тканині до активності промотора в неінфікованій тканині. До цього часу вважалося, що інтенсивність фонової активності синтетичного промотору визначається лише застосовуваними цис-регуляторними елементами. Вони дуже сильно впливають на силу дії промоторів (Раштон та ін., 2002). Вплив мінімальних промоторів до цього часу досліджено мало. За літературними даними, мінімальний промотор лише вкрай незначно впливає на регулювання активності промотора (Сінгх (Singh), 1998). Однак Бхуллар (Bhullar) та ін. (2003) спостерігали помітне зниження промоторної активності промотора 35S в разі заміни мінімального промотору (від -46 до +1) гетерологічними рослинними мінімальними промоторами. Ці зміни автори приписували відмінностям у послідовностях блока ТАТА, в той час як, на їхню думку, ділянки, розташовані з боків блока ТАТА мінімального промотору, не мали відношення до промоторної активності. Задачею цього винаходу є створення синтетичного промотору з низькою фоновою активністю, який індукується патогенами. Згідно із цим винаходом, згадана задача вирішується за допомогою синтетичного промотору, який індукується патогенами, з мінімальним промотором, причому цей мінімальний промотор містить фрагмент послідовностей a) dbrmwa або b) twcccmt, розташований за ділянкою ТАТА та перед однією з точок початку транскрипції, які належать до мінімального промотору, з яких починається транскрипція нуклеїнової кислоти, яка підлягає регулюванню. При цьому фрагмент послідовностей dbrmwa є придатним передусім для дводольних рослин, а фрагмент twcccmt - для однодольних рослин. Символи у фрагментах послідовностей при цьому мають такі значення: d - нуклеотид а або g, або t/u; b - нуклеотид с або g, або t/u; r - нуклеотид g або а; m - нуклеотид а або с; w - нуклеотид а або t/u; а - нуклеотид а; t - нуклеотид t; с - нуклеотид с. В рамках цього винаходу "мінімальний промотор" означає послідовність ДНК промотору, необхідну для здійснення функції промотору. З цією послідовністю ДНК можуть бути зв'язані загальні транскрипційні фактори, наприклад, TFII-D, TFII-A, TFII-B, TFII-E та TFII-F, які утворюють платформу для зв'язування комплексу РНК-полімерази II/TFII-F. Оскільки в цій ділянці починається транскрипція ДНК у мРНК, то точка початку транскрипції (TS) знаходиться у межах мінімального промотору та позначається як позиція +1. Мінімальний промотор перекриває TS та може охоплювати, наприклад, проміжок від позиції -50 до позиції +15. Навколо позиції -30 часто знаходиться так званий блок ТАТА, який, однак, присутній не у всіх промоторах. Блок ТАТА є ділянкою послідовності основ тиміну та аденіну. Блок ТАТА є місцем приєднання протеїну, який зв'язує блок ТАТА (позначається ТВР). Термін "синтетичні промотори" означає промотори, які не зустрічаються у природі, складаються з кількох елементів та містять мінімальний промотор, а також розташований перед мінімальним промотором щонайменше один цис-регуляторний елемент, який є місцем приєднання спеціальних транскрипційних факторів. Синтетичні промотори створюються відповідно до бажаних вимог та індукуються або запускаються різними чинниками. 2 UA 108474 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "похідні" промотору означає скорочені, подовжені або частково ідентичні варіанти цього промотору або його гомологи з однаковими, модифікованими або окремими його властивостями. Термін "гомологія" означає в цьому описі гомологію щонайменше 70 % на площині ДНК, яку можна визначити відомими способами, наприклад, шляхом комп'ютеризованого зіставлення послідовностей (Альтшуль (Altschul) та ін., 1990). Синтетичний промотор за цим винаходом, який індукується патогенами, після перехідної біолістичної трансформації у тканині листя відповідної рослини спричиняє зниження фонової активності у порівнянні з відомими застосовуваними промоторами з мінімальним промотором, наприклад, із мінімальним промотором 35S у дводольних рослинах та мінімальним промотором ubi1 маїсу в однодольних рослинах. Крім того, для синтетичного промотору за цим винаходом, який індукується патогенами, виявлено підвищення швидкості індукування. Синтетичні промотори за цим винаходом, які індукуються патогенами, можуть бути застосовані також для одержання трансгенних рослин, які відрізняються широкою резистентністю до численних патогенів, наприклад, до грибів, овоміцетів, бактерій, вірусів, комах та нематод. Фрагменти послідовностей dbrmwa та twcccmt з точки зору орієнтування розташовані на кодогенному пасмі між блоком ТАТА та точкою початку транскрипції та можуть повторюватися два або більше разів. Послідовності для мінімальних промоторів, яким віддається перевага, позначені у цьому описі як Послідовності № 1-9. Цис-регуляторними елементами для виготовлення синтетичних промоторів, які індукуються патогенами, є передусім такі елементи, присутні у природних синтетичних промоторах, які індукуються патогенами, і відповідають в таких випадках за індукцію патогенами. Їх ідентифікація описана в публікації Раштона та ін. (2002). Цис-регуляторні елементи, яким віддається перевага, для виготовлення синтетичних промоторів, які індукуються патогенами, із застосуванням мінімальних промоторів за цим винаходом описано також у WO 00/29592. Серед вказаних у згаданому документі цисрегуляторних елементів придатним є, у першу чергу, блок D (Послідовність № 10), зокрема, у комбінації 2S/2D (Послідовність № 11), а також елемент Gst1, переважно у комбінації 4Gst1 (Послідовність № 12). До особливо корисних комбінацій цис-елементів належать загальні комбінації блока D (Послідовність № 10) з блоком S або з елементом Gst1. Особливо корисними є, окрім вищезгаданої комбінації 2S/2D (Послідовність № 11), комбінації 2S/4D (Послідовність № 13), 4S/2D (Послідовність № 14) та 2Gst1/2D (Послідовність № 15). Комбінація елементів 2S/4D (Послідовність № 13) з мінімальним промотором за Послідовністю № 2 у трансгенній картоплі після інфікування Phytopthora infestans забезпечувала середнє підвищення активності гена-репортера у 253000 разів у порівнянні з неінфікованим контролем. Клонування елемента 4S/2D (Послідовність № 14) перед мінімальним промотором (Послідовність № 2) дозволило досягти середнього підвищення активності гена-репортера у 2892 рази. З застосуванням елемента 2Gst1/2D (Послідовність № 15) досягнуто середнє підвищення активності гена-репортера у 2967 разів у порівнянні з контролем. Таким чином, застосування промоторів за цим винаходом уможливлює одержання трансгенних рослинних клітин, які можна регенерувати у цілісні рослини з підвищеними характеристиками стійкості до патогенів. Посівний матеріал таких трансгенних рослин вже містить промотори за цим винаходом. Цей винахід не обмежується певними видами рослин. Таким чином, цей винахід стосується також способу одержання резистентних до патогенів рослин, який включає введення у рослинну клітину гена, придатного для створення захисту від патогенів, який регулюється синтетичним промотором, який індукується патогенами, а також подальшу регенерацію з цієї рослинної клітини рослини, який відрізняється тим, що синтетичним промотором, який індукується патогенами, є описаний вище синтетичний промотор, який індукується патогенами. Приклади На Фіг. 1 показано зіставлення послідовностей у мінімальних промоторах (Послідовності № 1-7), яким віддається перевага у випадках дводольних рослин, з фіксованими блоками ТАТА та фрагментами dbrmwa, a також із місцями розриву Pstl та Xhol, які застосовуються для клонування у плазміді pMS231uc+. На Фіг. 2 показано зіставлення послідовностей у мінімальних промоторах (Послідовність № 8 та Послідовність № 9), яким віддається перевага у випадках однодольних рослин, які застосовуються для перехідної трансформації листя пшениці. Окрім блока ТАТА, показано як фіксований фрагмент послідовність twcccmt. 3 UA 108474 C2 5 10 15 20 25 30 35 40 45 50 55 60 Було показано, що мінімальні промотори StGst (Послідовність № 6), NtTGAA (Послідовність № 5), StPSBR (Послідовність № 7), NpCABE (Послідовність № 2), NtRBS (Послідовність № 3), NpATP2 (Послідовність № 1) та Nt5EAS (Послідовність № 4) виявляють помітно знижену активність (10000g протягом 10 хв., змішували 10 мкл надосадової рідини у пробірці люмінометра з 50 мкл субстрату LAR (фірми Promega, Маннгейм) і визначали інтенсивність випромінювання як міру активності люциферази із застосуванням люмінометра (Sirius, фірми Berthold Detection System GmbH, Пфорцгайм). Для порівняння застосовували культивовані in vitro в тих самих умовах рослини, які замість згаданих зооспор обробляли водою. Середнє значення відношення активності люциферази для інфікованих та неінфікованих рослин, одержане для п'яти незалежних проб, характеризує ступінь індукування синтетичного промотору під впливом інфекції. Як видно з Фіг. 7, при застосуванні мінімального промотору 35S максимальне індукування активності люциферази через 72 год. після інфікування посилювалося лише у 10 разів. Навпаки, для всіх нових мінімальних промоторів спостерігалося помітне посилення індукції. Найсильніше індукування через 72 год. після інфікування (коефіцієнт підсилення 395) було досягнуте при застосуванні мінімального промотору StPSBR (Послідовність № 7). Загалом, при застосуванні нових мінімальних промоторів коефіцієнт підсилення індукування у порівнянні з мінімальним промотором 35S через 72 год. після інфікування становив від 3,5 у випадку 4 UA 108474 C2 5 10 15 20 25 30 35 40 45 50 55 мінімального промотора StGst (Послідовність № 6) до 39,5 у випадку мінімального промотору StPSBR (Послідовність № 7). Є цікавим той факт, що між мінімальними промоторами має місце чітка відмінність у кинетиці індукування після інокуляції патогенів. При застосуванні мінімального промотору 35S індукування вимірюється найбільш надійно через 72 год. після інфікування; те саме стосується застосування мінімальних промоторів StPSBR, NtTGAA, StGst, NtRBS та NpATP2. Навпаки, у випадку промоторів NpCABE та Nt5EAS сильне активування можна спостерігати вже через 9 год. після інфікування, і досягнутий рівень індукування залишається приблизно постійним на протязі подальшої тривалості експерименту. Переваги нових мінімальних промоторів були продемонстровані також після їх конденсації з комбінацією цис-елементів 2S/2D. Для цього рослини картоплі були стабільно трансформовані бінарними векторами p2S/2Dluc-kan, p2S/2DNpCABEluc-kan та p2S/2DNtTGAAluc-kan. Ці бінарні вектори були одержані шляхом видалення елемента 4Gstl з вищезазначених бінарних векторів, які включали нові мінімальні промотори та елемент 4xGst1, шляхом ферментації Bcul/Eco1471 та введення елемента 2/2D (Послідовність № 11) як фрагмента Всul/Есо321. Бінарні вектори з новою послідовністю трансформували у штам агробактерій GV3101::pMP90 (Конч та Шелл (Koncz and Schell), 1986) за методикою Ана (An, 1987) та селектували із застосуванням антибіотику катаміцину (50 мг/л). Трансгенні агробактерії застосовували для трансформування картоплі сорту "Baltica" (Дітце (Dietze) та ін., 1995). Трансгенні пагони розмножували та інокулювали в умовах in vitro суспензією зооспор (50000 спор/мл) Phytophthora infestans. Було показано, що зниження фонової активності у порівнянні з випадком застосування мінімального промотору 35S досягається при впливі мінімальних промоторів за цим винаходом також у присутності цис-регуляторного елемента 2S/2D (Послідовність № 11) (Фіг. 5). Одночасно спостерігалося підсилене індукування синтетичних промоторів після інокуляції трансгенної картоплі P. infestans (Фіг. 6). Посилення індукування у пізніший момент часу (3 доби після інфікування, "3 дпі") спостерігається не так чітко, як при застосуванні елемента 4Gst1. Однак через 2 доби після інфікування можна спостерігати помітно сильнішу індукцію при застосуванні нових мінімальних промоторів після ураження патогеном. Таким чином, застосування цих мінімальних промоторів має наслідком покращення кінетики синтетичного промотору, отже, реакція на ураження патогеном збуджується швидше у порівнянні із синтетичними промоторами, які містять мінімальний промотор 35S. На Фіг. 7 зіставлено нормалізовану активність синтетичних промоторів, які індукуються патогенами, які складаються з елемента 2S/2D (Послідовність № 11) та мінімальних промоторів ubi1 (промотор порівняння), TaPAL (Послідовність № 9) та TaACS (Послідовність № 8), після біолістичної трансформації у первинні листи пшениці сорту "Taifun". Видно, що нові мінімальні промотори TaPAL та TaACS у пшениці виявляють знижену фонову активність у порівнянні з мінімальним промотором ubi1. Якщо у присутності мінімального промотору ubi1 нормалізована активність становила 0,17, то при застосуванні мінімального промотору TaPAL це значення зменшувалося до 0,072, а при застосуванні мінімального промотору TaACS - до 0,13. На Фіг. 9 показано плазміду pubiTATARucll, яка включає кДНК з геном люциферази з Renilla reniformis, який є присутнім у наявній на ринку плазміді pRL-Null. Ця кДНК регулюється мінімальним промотором ubi1. Мінімальний промотор ubi1 охоплює ділянку послідовності від 45 до +76 відносно точки початку транскрипції. Для підвищення інтенсивності експресії перший інтрон гена ubi1 у своєму природному оточенні розташований у плазміді до гена-репортера. Ця плазміда використовувалася для клонування цис-регуляторного елемента 2S/2D (Послідовність № 11) з метою одержання синтетичного промотору, який індукується патогенами. Мінімальний промотор ubi1 замінювався новими мінімальними промоторами з метою покращення властивостей синтетичних промоторів. Джерела інформації: An G. (1987). Binary Ті vectors for plant transformation and promoter analysis. Methods Enzymol. 153:292-305. Altschul S.F. et al. (1990), Basic Local Alignment search tool, J. Моl. Biol. 215: 403-410. Becker D. et al. (1992). New plant binary vectors with selectable markers located proximal to the left T-DNA border. Plant Моl Biol. 29:1195-1197. Belbahri L. et al. (2001). A local accumulation of the Ralstonia solanacearum PopA protein in transgenic tobacco renders a compatible plant-pathogen interaction incompatible. Plant J. 28:419430. Bendahmane A. et al. (2002). Constitutive gain-of-function mutants in a nucleotide binding siteleucine rich repeat protein encoded at the Rx locus of potato. Plant J. 32: 195-204. 5 UA 108474 C2 5 10 15 20 25 Bhullar S. (2003). Strategies for the development of functionally equivalent promoters with minimum sequence homology for transgene expression in plants: cis-elements in a novel DNA context versus domain swapping. Plant Physiol. 132: 988-998. Dietze J. et al. (1995). Agrobacterium-mediated transformation of potato (Solanum tuberosum). In: Gene Transfer to Plants XXII (Potrykus I. and Spangenberg G., eds.). Berlin: Springer Verlag, pp. 2429. Howies P. et al. (2005). Autoactive alleles of the flax L6 rust resistance gene induce non-racespecific rust resistance associated with the hypersensitive response. Моl. Plant-Microbe Interact. 18: 570-582. Keller H. et al. (1999). Pathogen-induced elicitin production in transgenic tobacco generates a hypersensitive response and non-specific disease resistance. Plant Cell 11:223-235. Koncz C. and Schell J. (1986). The promoter of TL-DNA gene 5 controls the tissue specific expression of chimeric genes carried by a novel type of Agrobacterium vector. Моl. Gen. Genet., 204: 383-396. Lu H. et al. (2000). Construction of chimeric inducible promoters by elicitors of rice fungal blast pathogen and their expression in transgenic rice. Chinese Science Bulletin 45: 242-246. Oldroyd G.E.D. and Staskawicz B.J. (1998). Genetically engineered broad spectrum disease resistance in tomato. Proc. Natl. Acad. Sci. U. S. A. 95: 10300-10350. Maas C. et al. (1991). The combination of a novel stimulatory element in the first exon of the maize. Shrunken-1 gene with the following introni enhances reporter gene expression up to 1000-fold. Plant Моl Biol. 16: 199-207. Perl-Treves R. et al. (2004). Early induction of the Arabidopsis GSTF8 Promoter by specific strains of the fungal pathogen Rhizactonia solani. Мої. Plant-Microbe Interact. 17: 70-80. Rushton P.J. et al. (2002). Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen-and wound-induced signalling. Plant Cell 14, 749-762. Singh K.B. (1998). Transcriptional regulation in plants: the importance of combinatorial control. Plant Physiol. 118:1111-1120. Stuiver M. H. and Clusters J.H.H.V. (2001). Engineering disease resistance in plants. Nature 411: 865-868. 30 ЛІСТИНГ ПОСЛІДОВНОСТЕЙ KWS SAAT AG Schmidt, Klaus 35 МІНІМАЛЬНИЙ ПРОМОТОР KWS 0111 РСТ 15 40 Patent In version 3.3 45 50 1 69 ДНК Nicotiana plumbaginifolia misc_feature (1)…(8) PstI Erkennungssequenz 55 TATA_signal (19)…(24) 60 misc_feature (32)..(37) dbrmwa 6 UA 108474 C2 5 misc_feature (62)…(69) XhoI Erkennungssequenz 1 10 2 67 ДНК Nicotiana plumbaginifolia 15 misc_feature (1)..(8) PstI Erkennungssequenz 20 TATA_signal (19)..(24) 25 30 misc_feature (31)..(36) dbrmwa misc_feature (60)..(67) XhoI Erkennungssequenz 2 35 3 67 ДНК Nicotiana tabacum 40 Misc_feature (1)..(8) PstI Erkennungssequenz 45 TATA_signal (18)..(25) 50 Misc_feature (33)..(38) dbrmwa 55 Misc_feature 7 UA 108474 C2 (60)..(67) XhoI Erkennungssequenz 3 5 10 4 69 ДНК Nicotiana tabacum 15 misc_feature (1)..(8) PstI Erkennungssequenz TATA_signal (24)..(31) 20 misc_feature (38)..(43) dbrmwa 25 misc_feature (62)..(69) XhoI Erkennungssequenz 30 4 35 40 5 67 ДНК Nicotiana tabacum misc_feature (1)..(8) PstI Erkennungssequenz 50 TATA_signal (19)..(24) misc_feature (31)..(36) dbrmwa 55 misc_feature (60)..(67) XhoI Erkennungssequenz 45 8 UA 108474 C2 5 5 10 15 20 6 67 ДНК Solanum tuberosum misc_feature (1)..(8) PstI Erkennungssequenz TATA_signal (24)..(30) misc_feature (38)..(43) dbrmwa 6 25 7 75 ДНК Solanum tuberosum 30 misc_feature (1)..(8) PstI Erkennungssequenz 35 TATA_signal (26)..(34) 40 misc_feature (36)…(41) dbrmwa 45 misc_feature (68)..(75) XhoI Restriktionsschnittstelle 50 7 8 69 9 UA 108474 C2 ДНК Triticum aestivum 5 10 15 promoter (1)..(69) МІНІМАЛЬНИЙ ПРОМОТОР TATA_signal (13)..(20) misc_feature (38)..(44) twcccmt 8 20 9 149 ДНК Triticum aestivum 25 TATA_signal (17)..(23) 30 misc_feature (42)..(48) twcccmt 35 5'UTR (51)..(149) 9 40 45 50 10 31 ДНК Petroselinum crispum енхансер (1)..(31) BoxD 10 10 UA 108474 C2 5 11 128 ДНК Petroselinum crispum 10 енхансер (1)..(128) синтетичний елемент енхансера, який складається з димеру BoxS та BoxD 15 енхансер (1)..(25) BoxS 20 енхансер (31)..(55) BoxS 25 енхансер (61)..(91) BoxD 30 енхансер (98)..(128) BoxD 11 35 12 118 ДНК Solanum tuberosum 40 енхансер (1)..(118) синтетичний елемент енхансера, який є тетрамером елемента Gst1 45 енхансер (1)..(25) BoxGst1 50 енхансер (32)..(56) BoxGst1 55 енхансер 11 UA 108474 C2 (63)..(87) BoxGst1 5 енхансер (94)..(118) BoxGst1 12 10 15 13 202 ДНК синтетична 20 енхансер (1)..(202) синтетичний елемент енхансера, який складається з димеру BoxS та тетрамеру BoxD 25 енхансер (1)..(25) Box S 30 енхансер (31)..(55) Box S 35 енхансер (61)..(91) Box D 40 енхансер (98)..(128) Box D 45 енхансер (135)..(165) Box D 50 енхансер (172)..(202) Box D 13 12 UA 108474 C2 5 14 188 ДНК синтетична енхансер (1)..(188) 10 енхансер (1)..(25) BoxS 15 енхансер (31)..(55) BoxS 20 енхансер (61)..(85) BoxS 25 енхансер (91)..(115) BoxS 30 енхансер (121)..(151) BoxD 35 енхансер (158)..(188) BoxD 40 14 45 50 55 15 130 ДНК синтетична енхансер (1)..(130) синтетичний елемент енхансера, який складається з димеру Gst1-Box та димеру BoxD 13 UA 108474 C2 енхансер (1)..(25) Box Gstl 5 енхансер (32)..(56) Box Gstl 10 енхансер (63)..(93) Box D 15 енхансер (100)..(130) Box D 20 15 ФОРМУЛА ВИНАХОДУ 25 30 35 40 45 50 1. Синтетичний промотор, що індукується патогенами, що містить мінімальний промотор та є придатним для регулювання транскрипції нуклеїнової кислоти, який відрізняється тим, що згаданий мінімальний промотор містить фрагмент послідовності twcccmt, розташований за ділянкою ТАТА та перед однією з точок початку транскрипції, які належать до мінімального промотору, з яких починається транскрипція нуклеїнової кислоти, яка підлягає регулюванню. 2. Синтетичний промотор, який індукується патогенами, за п. 1, який відрізняється тим, що згаданий фрагмент послідовностей повторюється у мінімальному промоторі два або більше разів. 3. Синтетичний промотор, що індукується патогенами, за п. 1 або п. 2, який відрізняється тим, що мінімальний промотор містить нуклеотидну послідовність за однією з Послідовностей № 8-9 або її похідне. 4. Синтетичний промотор, який індукується патогенами, за одним із пп. 1-3, який відрізняється тим, що містить, окрім мінімального промотору, щонайменше один цис-регуляторний елемент із нуклеотидною послідовністю за однією з Послідовностей № 10-15. 5. Рекомбінантний ген із синтетичним промотором, який індукується патогенами, за одним із пп. 1-4. 6. Рослинна клітина із синтетичним промотором, який індукується патогенами, за одним із пп. 14, інтегрованим у ДНК рослинної клітини. 7. Трансгенна рослина з рослинною клітиною за п. 6. 8. Посівний матеріал трансгенної рослини за п. 7. 9. Спосіб одержання резистентних до патогенів рослин, який включає введення у рослинну клітину нуклеїнової кислоти, придатної для створення захисту від патогенів, яка регулюється синтетичним промотором, який індукується патогенами, та подальшу регенерацію із цієї рослинної клітини рослини, який відрізняється тим, що синтетичним промотором, який індукується патогенами, є синтетичний промотор, який індукується патогенами, за одним із пп. 1-4. 14 UA 108474 C2 15 UA 108474 C2 16 UA 108474 C2 17 UA 108474 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Автори російськоюSchmidt Klaus
МПК / Мітки
МПК: A01H 5/00, C12N 15/82
Мітки: промотор, індукується, патогенами, синтетичний
Код посилання
<a href="https://ua.patents.su/20-108474-sintetichnijj-promotor-yakijj-indukuehtsya-patogenami.html" target="_blank" rel="follow" title="База патентів України">Синтетичний промотор, який індукується патогенами</a>
Попередній патент: Кон’югати, їхнє одержання і застосування в терапії
Наступний патент: Композиція інсуліну тривалої дії
Випадковий патент: Мононитка хірургічна, спосіб виготовлення мононитки хірургічної та сітка хірургічна з застосуванням мононитки хірургічної