Спосіб отримання оптично активних alрha-арілалканових кислот
Номер патенту: 5259
Опубліковано: 28.12.1994
Автори: Фульвіо Іггері, Клаудіо Джардано, Сільвіа Кавіккіолі, Граціано Касталді
Формула / Реферат
Способ получения оптически активных а -арилалкановых кислот общей формулы
где R1 - метил, изопропил;
R2-6-метокси-2-нафтил, 5-бром-6-метокси-2-нафтил, 4-хлорфенил, 4-(2-метилпропил) - фенил, 5-бром-6-окси-2-нафтил, с использованием перегруппировки соответствующих галогенарилалкилкеталей, с последующим кислотным гидролизом, отличающийся тем, что, с целью упрощения процесса, а также повышения его энантиоселективности, вначале оптически активные арилалкилкетали общей формулы
R1 и R2 имеют указанные значения; R3 и R4 - одинаковые или различные и представляют собой ОН или ОNа, или С1-С4-алкокси, или группу NR5R6, где R5 и R6 - метил или этил; С* имеют R- или S-конфигурацию,
подвергают галогенированию по а-положению кетальной группы ахиральным галогенирующим агентом при температуре (-30) - (+40)0С в среде инертного органического растворителя с последующим, в случае необходимости, щелочным гидролизом с получением а-галоидкеталя, существенным образом состоящего из одного или смеси двух энантиомерночистых эпимеров общей формулы (II), где Х-галоид, R1 - R6 и С* имеют указанные значения, после чего проводят перегруппировку при 25-100°С в водородсодержащей среде при рН 4,1 - 6 и после гидролиза получают а-арилалкановую кислоту общей формулы (I) в виде энантиомерной смеси при соотношении энантиомеров, практически равном или выше соотношения эпимеров в исходных а-галоидкеталях.
Приоритет по признакам
06.04.84 стадия галогенирования,
06.08.84 стадия перегруппировки в водно-кислой среде.
Текст
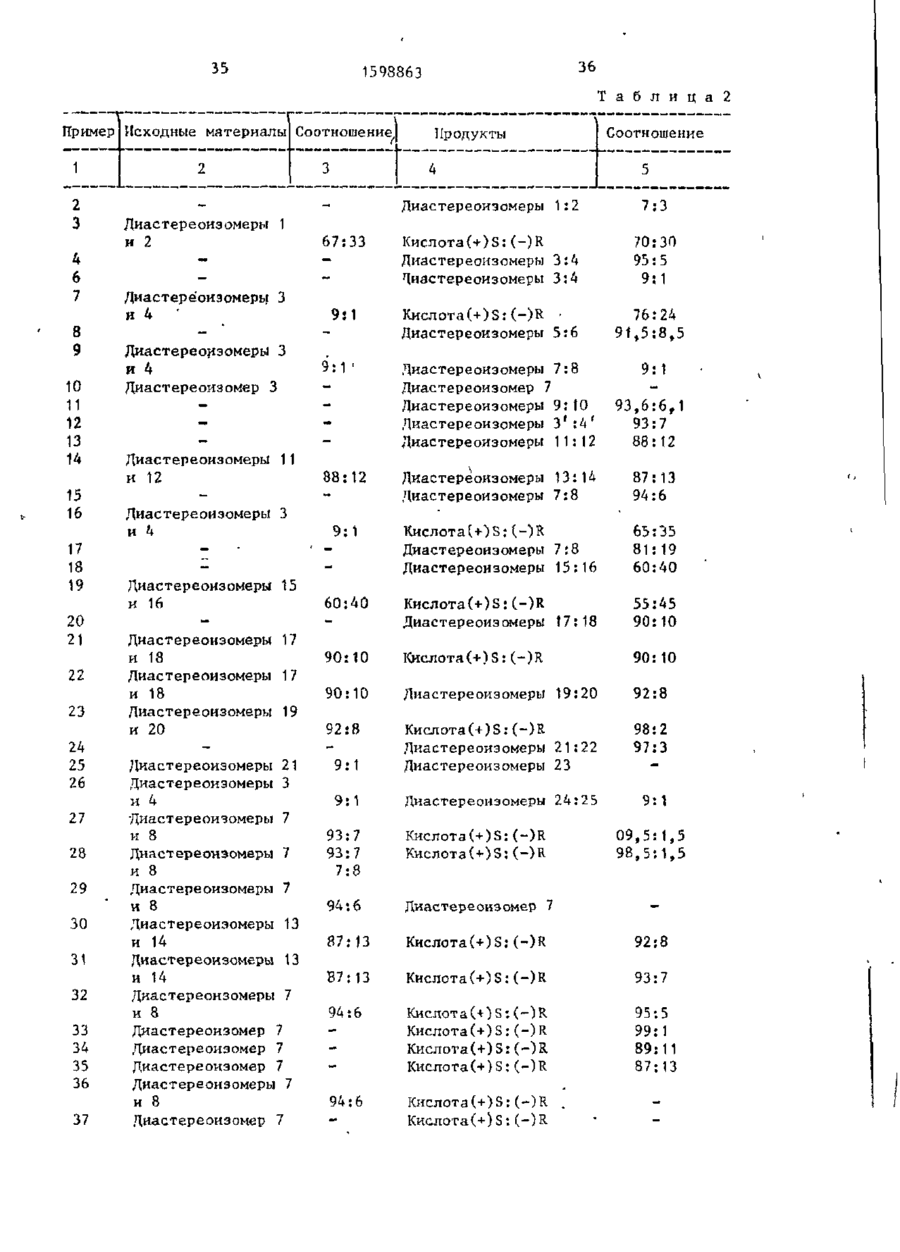
Изобретение относится к карбоновым кислотам, в частности к получению оптически активных о^-арилалкановых кислот ф-лн l^RjCHCOOH, г д е R, метил, иэопропил; - 6-метокси-2~ Изобретение относится к органическому с и н т е з у , а именно к способу получения (/-арилалкановых кислот, проявляющих биологическую активность. Цель изобретения - упрощение п р о цесса и повышение е г о энантиоселскТИБНОСТИ. П р и м е р 1. Получение диметилового эфира 2-этнл-2-(6-метокси-2-нафтил)-1, 3-диоксолан-4(И), "НЮ-дикарбоковой кислоты. 1-(6-Метокси~2-кафтил)пропан-1-он (46,5 г; 0,217 моль), диметиловыи эфир d(+)-винной кислоты (300 г) и нафтил, 5-бром-6-метокси-2-нафтил, 4-хлорфенил, 4-(2-метилпропил)-фенил, 5-бром-6-окси-2-нафтил, проявляющих биологическую активность. Цель - упрощение процесса и повышение его энаитиоселективности. Получение включает галогенирование опти-u ски активных арилалкилкеталей по о/-положению кетальной группы ахиральным галогенирующим агентом при (-30)-(+40)°С в среде инертного органического растворителя с последующим, в случае необходимости, щелочным гидролизом с п о лучением с/-галоидкеталя. Затем проводят перегруппировку при 25-100°С в водородсодержащей среде при рН 4,1 6 и после гидролиза получааот с^-арилалкановую кислоту в виде энантиомерной смеси при соотношении энантиомеров, практически равном или выше со- . отношения эпимеров в исходных о£-галоидкеталях. 2 табл. триметилортоформиат (94,0 г; 0,887 моль) постепенно нагревают до полного растворения, После этого прибавляют метансульфокислоту (1,48 г; 0,0154 моль) и полученный раствор кипятят с обратным холодильником в те чение 2 ч, затем его охлаждают до ком натной температуры и реакционную смесь медленно прибавляют в 10%-ный раствор Na^CO 3 (500 м л ) . Экстрагируют метиленхлоридом и органические экстракты повторно промывают водой. Органическую "фазу сушат над безводным сульфатом натрия и выпаривают раст С 6 1598863 4 3,58 (синглет, ЗН, С Н 3 0 ) ; 3,89 (синворитель при пониженном давпении Осглет, ЗН, С П 3 О ) ; 4,08 (синглет, ЗН таток перекристалличовывают из метаноСНдО); 4,50 (квартет, 1H,J=7,5 Гц, ла (250 м л ) , получая целевой продукт СН-Вг); 4,89 (2Н, АВ-квартет, & \> = (51,68 г; 0,138 моль). =36,3, J=6,3 Гц, СН-СН); 7,1 - 8,0 П р и м е р 2. Получение смеси ди(6Н, мультиплет, ароматический проастереомеров диметилового эфира 2-(1тон) . бромэтил)-2-(6-метокси-2-нафтил)-1,3П р и м е р 3. Получение 2-(6-меЛиоксолан-4(Я), 5(R)-дикарбоновой Ю токси-2-нафтил)пропионовой кислоты. кислоты, Смесь диастереомерных кеталей, К раствору соединения диметилового полученную по примеру 2 ( при соотноэфира 2-этил-2-(6-метокси-2-нафтил)- _ шении 1:2=67:33 нагревают при 125"С 1,3~диоксалан-4(R), 5(R)-дикарбоновой в этиленгликоле в присутствии ацетата кислоты П 7 , 4 г; 0,1 моль) (т.пл. 74 74°С; Ы~} о° =-+33,04 (с=1%, С Ч С 1 э ) ; ИК t5 калия в течение 20 ч„ После обработ(нуйол): 1770, 1740 см-' (колебания ки реакционной смеси получают смесь С=0); ЯМР (СПСІд-ТМС, 200 МГц), < f сложных эфиров, которуют гидролизуют ч./млн.: 0,94 (триплет, ЗН, J=7,5 Гц, в диметоксиэтане и 12%-ной хлористоС Н 3 ) ; 2,08 (квартет, 2Н, J=7,5 Гц, водородной кислоте (24 м л ) , выдержиС Н 2 ) ; 3,46 (синглет, ЗН, С Н Э О ) ; 3,84 20 вая при перемешивании и при 95"С в (синглет, ЗН С Н 3 О ) ; 3,90 (синглет, течение 2,5 ч. Смесь охлаждают до ЗН С Н 3 О ) ; 4,86 (2Н, АВ-квартет, а V = комнатной температуры, выливают в во=10,80, J=6 Гц, СН-СН); 7,1-7,9 (мульду и экстрагируют хлористым метилетиплет, 6Н, ароматический протон) в ном. Объединенные органические экст1,2~дихлорэтане (100 мл) прибавляют 25 ракты промывают насыщенным раствором пербромид-тетра-н-бутиламмония бикарбоната натрия. Водную фазу подN-н-С, Н д 4 В г э (48,2 г; 0,1 моль). кисляют и получают (+)(S)-2-(6-MCTOкси-2-нафтил)пропионовую кислоту Результирующую смесь выдерживают (naproxen с оптической чистотой 4 0 % ) , при 20 С в течение 24 ч и затем медленно при перемешивании прибавляют 30 т.пл. = 151 - 152°С, выход 80%. в 10%-ный раствор Na^COj (200 м л ) . П р и м е р 4. Получение диастеЕго экстрагируют толуолом (2x200 мл) реомерной смеси диметилового эфира и объединенные органические экстрак2-(1-бромэтил)-2-(5-бром-6-метокси-2ты промывают 2%-ным раствором NaHCOj нафтил)-1,3-диоксолан -4 (R) ,5 (R)-ди(ЗхЮО м л ) . Органическую фазу сушат карбоновой кислоты. 35 над сульфатом натрия и растворитель К раствору диметилового эфира 2выпаривают при пониженном давлении. этил-2-(6-метокси-2-нафтил)-1,3-диПолученный сырой продукт (48 г) очиоксолан-4(R),5(R)-дикарбоновой кисщают хроматографически на колонке с силикагелем (элюент гексен: диэтило- 40 лоты (3,74 г;. 0,01 моль) в четыреххлористом углероде (70 мл), поддерживый эфир = 75:25) и получают 13 г ваемому при 0°С в инертной атмосфере, (0,028 моль) целевой смеси диастереопо каплям в течение 1 ч прибавляют меров (выход 2 8 % ) . раствор брома (3,2 г; 0,02 моль) в Соотношение между двумя диастереомерами (1:2), определенное с помощью 45 четыреххлористом^глероде (7 м л ) , *И-ЯМР (200 МГц) равно 7:3. охлажденный до 0 С. Смесь выдерживаю т П Диастереомер 1 (RRS). Р И 0°С в течение 2 ч, после чего Т при интенсивном перемешивании выпиН-ЯМР (CDCb-TMC)
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess of producing optically active alpha-arylalkanoic acids
Назва патенту російськоюСпособ получения оптически активных а-арилалкановых кислот
МПК / Мітки
МПК: C07C 57/00, C07C 51/09, C07D 409/00, C07D 317/26, C07C 53/132, C07D 413/14, C07D 317/32, C07B 57/00, A61K 31/19, C07D 405/00, C07C 53/136, C07C 67/475, C07D 413/12
Мітки: оптично, активних, кислот, отримання, спосіб, alрha-арілалканових
Код посилання
<a href="https://ua.patents.su/20-5259-sposib-otrimannya-optichno-aktivnikh-alrha-arilalkanovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання оптично активних alрha-арілалканових кислот</a>
Попередній патент: Блок емульсіфікатора для емульгірування повітря, пару і молока під час виготовлення міцної кави з молоком та інших подібних напоїв
Наступний патент: Спосіб одержання таблеток
Випадковий патент: Спосіб оцінки ліпідних порушень при запаленнях мигдаликів