Похідні бензимідазолу, їх отримання та терапевтичне застосування
Номер патенту: 72813
Опубліковано: 15.04.2005
Автори: Барт Франсі, Бішон Даніель, Болькеніус Франк, ван Дорсселе Вівіан
Формула / Реферат
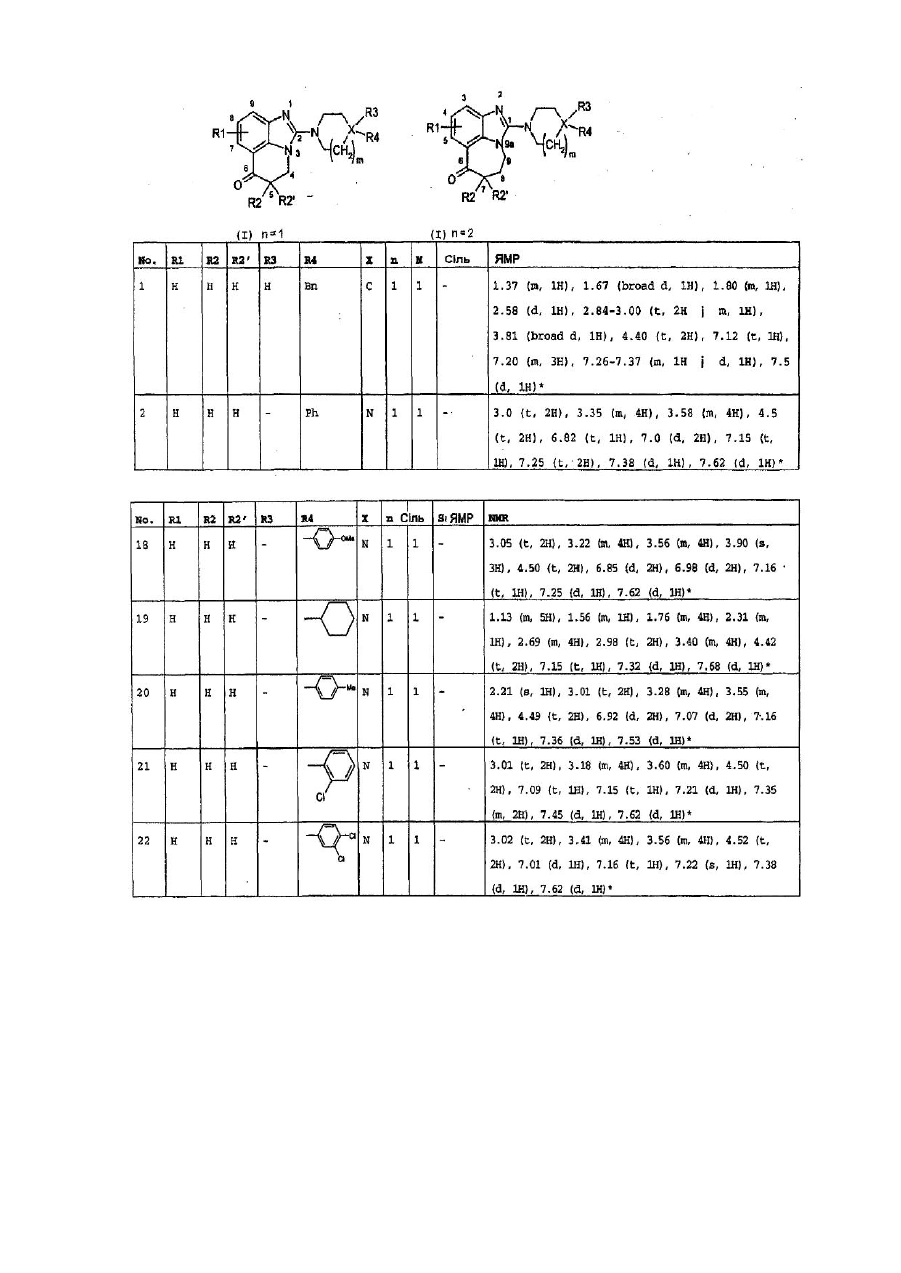
1. Сполуки формули (І):
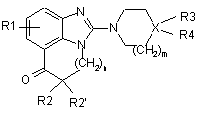 (I),
(I),
у якій:
R1 - атом гідрогену, С1-С4-алкільна група, атом галогену, нітрогрупа або С1-С4-алкоксильна група,
R2 і R2' є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою,
Х - атом нітрогену або карбону,
n = 1 або 2,
m = 1 або 2,
і, коли Х - атом нітрогену:
R3 - атом гідрогену або С1-С4-алкільна група, і тоді сполуки формули (І) включають четвертинний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін,
R4 -атом гідрогену, С1-С6-алкільна група, С3-С7-циклоалкільна група, С3-С7-гетероциклоалкільна група, як варіант, заміщена С1-С4-алкільною групою або групою -COOR, у якій R - С1-С6-алкільна група,
група -(СH2)р-гетероарил, у якій р може мати значення від 0 до 4, а гетероарильна група вибрана серед піридильної, амінопіридильної, піримідинільної, піразинільної, піридазинільної, імідазолільної і тієнільної груп, а зазначена гетероарильна група, як варіант, може бути заміщена С1-С4-алкільною групою,
гетероарилкарбонільна група, причому гетероарильна група вибрана з фурильної, піридильної, піримідильної, піразинільної, піридазинільної і імідазолільної груп,
фенілкарбонільна група, причому фенільна група, як варіант, заміщена атомом галогену,
(С1-С6)-алкілкарбонільна група,
група -(СH2)рCOOR, де р може мати значення від 0 до 4, а R - С1-С6-алкільна група, фенілсульфонільна група, як варіант, заміщена на фенільному ядрі атомом галогену, трифлуорметильною групою, С1-С4-алкільною групою, нітрогрупою або С1-С4-алкоксильною групою, або, у іншому варіанті,
група -(СH2)р-феніл , де р може мати значення від 0 до 4, а фенільна група, як варіант, заміщена однією - трьома групами, вибраними незалежно одна від одної з С1-С4-алкільної, нітро-, аміно-, гідроксильної груп, атома галогену, трифлуорметильної групи, С1-С4-алкоксильної групи, (С1-С4)-алкоксифенільної фупи, С1-С4-алкіламіногрупи, С1-С4-діалкіламіногрупи, групи -NHCHO або групи -NHCOR', де R' - С1-С4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою,
і, коли Х - атом карбону, то:
R3 - атом гідрогену, група -NR5R6, група -N(R5)з+, група -NHCOR7, група -CONHR5, група -COR7, -NHCONH2 група, група -ОН або група -СН2OН,
R4 - атом гідрогену,
-(СH2)р-фенільна група, у якій р може мати значення від 0 до 4, а фенільна група, як варіант, заміщена 1-3 групами, вибраними, незалежно одна від одної, з С1-С4-алкільної групи, нітрогрупи, аміногрупи, атома галогену, трифлуорметильної групи або С1-С4-алкоксильної групи,
-(СH2)р-гетероарильна група, у якій р може мати значення від 0 до 4, а гетероарильна група вибрана з імідазолільної групи, як варіант, заміщеної С1-С4-алкільною групою, піридильної, амінопіридильної, піримідинільної, піразинільної або піридазинільної груп, або, у іншому варіанті,
група -(СH2)tNR7R8, у якій t дорівнює 0 або 1,
за умови, що, коли R4 є групою -NR7R8, то R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH2 і -ОН,
R5 і R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою,
R7 і R8 є, незалежно одна від одної, С1-С4-алкільною або С1-С4-алкоксильною групою, або вони разом утворюють насичене 5-7-членне кільце, яке, як варіант, включає додатковий атом нітрогену, причому це кільце на атомі карбону або нітрогену, включаючи той атом нітрогену, до якого для утворення четвертинного амонію приєднані групи R7 і R8, як варіант, може бути заміщене С1-С4-алкільною групою або групою -COOR", у якій R" - фенільна або (С1-С4)-алкілфенільна група, за винятком двох сполук, у яких R1, R2, R2', R3 є Н, Х - С, n = m = 1, a R4 - 4-імідазолільна або 5-метил-4-імідазолільна група,
у формі енантіомерів або діастереомерів, або сумішей цих різних форм, включаючи рацемічні суміші, а також у формі основ або солей приєднання фармацевтично прийнятних кислот.
2. Сполука формули (I) за п. 1, яка відрізняється тим, що у ній:
R1 - атом гідрогену, С1-С4-алкільна група або С1-С4-алкоксильна група,
R2 - атом гідрогену або С1-С4-алкільна група,
R2’ - атом гідрогену,
X - атом нітрогену,
n дорівнює 1 або 2,
m дорівнює 1 або 2,
R3 - атом гідрогену, і тоді сполуки формули (І) включають четвертинний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін,
R4 - атом гідрогену, С1-С6-алкільна група, С3-С7-циклоалкільна група,
піридильна, піримідинільна або піразинільна група, як варіант, заміщена С1-С4-алкільною групою,
гетероарилкарбонільна група, де гетероарильною групою є фурильна або піридильна група,
фенілкарбонільна група, де фенільна група, як варіант, заміщена атомом галогену,
(С1-С6)алкілкарбонільна група,
група -(СH2)рСООR, у якій р може мати значення від 0 до 4, a R - С1-С6-алкільна група,
фенілсульфонільна група,
фенільна група, заміщена 1-3 групами, вибраними, незалежно одна від одної, з С1-С4-алкільної групи, нітрогрупи, аміногрупи, гідроксильної групи, атома галогену, трифлуорметильної групи, С1-С4-алкоксильної групи, (С1-С4)-алкоксифенільної групи, (С1-С4)-діалкіламіногрупи, групи -NHCHO або групи -NHCOR', у якій R' - С1-С4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою,
-(СH2)р-фенільна група, у якій р може мати значення від 0 до 4,
-(СH2)р -піридильна група, у якій р може мати значення від 0 до 4,
- (СH2)р-тієнільна група, у якій р може мати значення вiд 0 до 4,
(С3-С7)-гетероциклоалкільна група, як варіант, заміщена С1-С4-алкільною групою або групою -COOR, у якій R - С1-С6-алкільна група,
або, у іншому варіанті,
R1 - атом гідрогену,
R2 і R2' є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою,
Х - атом карбону,
n = 1 або 2,
m = 1,
R3 - атом гідрогену, група -NR5R6, група -N(R5)з+, група -NHCOR7, група -CONHR5, група –NHCONH2, група -ОН або група -CH2OH,
R4 - атом гідрогену, бензильна група, фенільна група, як варіант, заміщена 1-3 групами, вибраними, незалежно одна від одної, з С1-С4-алкільної групи, нітрогрупи, аміногрупи, атома галогену, трифлуорметильної групи або С1-С4-алкоксильної групи,
гетероарильна група, вибрана з імідазолільної групи, як варіант, заміщеної С1-С4-алкільною групою, або піридильної групи,
група -NR7R8,
за умови, що, коли R4 - група -NR7R8, то R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH2 і -ОН,
R5 i R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою,
R7 і R8 є, незалежно одна від одної, С1-С4-алкільною або С1-С4-алкоксильною групою, або разом утворюють насичене 5-7-членне кільце, яке, як варіант, включає додатковий атом нітрогену, і на атомі карбону або атомі нітрогену, включаючи той атом нітрогену, до якого приєднані групи R7 і R8 для формування четвертинного амонію, може бути, як варіант, заміщене С1-С4-алкільною групою або групою-COOR", у якій R" - фенільна або (С1-С4)-алкілфенільна група,
за винятком двох сполук, у яких R1, R2, R2', R3 є Н, Х - С, n = m = 1, a R4 - або 4-імідазолільна, або 5-метил-4-імідазолільна група,
у формі енантіомерів або діастереомерів, або сумішей цих різних форм, включаючи рацемічні суміші, а також у формі основ або солей приєднання фармацевтично прийнятних кислот.
3. Сполука формули (І) за п. 1 або п. 2, яка відрізняється тим, що у ній:
R1 - атом гідрогену, метильна або метоксильна група,
R2 - атом гідрогену або метильна група,
R2' - атом гідрогену,
Х - атом нітрогену,
n = 1 або 2,
m = 1 або 2,
R3 - атом гідрогену, і тоді сполуки формули (І) включають четвертинний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін,
R4 - атом гідрогену, С1-С4-алкільна група, С6-С7-циклоалкільна група,
піридильна, піримідинільна або піразинільна група, як варіант, заміщена С1-С4-алкільною групою,
гетероарилкарбонільна група, де гетероарильною групою є фурильна або піридильна група,
фенілкарбонільна група, де фенільна група, як варіант, заміщена атомом галогену,
(С3-С5)-алкілкарбонільна група, група -(СH2)рCOOR, у якій р дорівнює 0 або 1, a R - С1-С4-алкільна група, фенілсульфонільна група, фенільна група, заміщена 1-3 групами, вибраним, незалежно одна від одної, з метильної групи, нітрогрупи, аміногрупи, гідроксильної групи, атома галогену, трифлуорметильної групи, метоксигрупи, (С1-С4)-алкоксифенільної групи, диметиламіногрупи, групи -NHCHO або група -NHCOR', у якій R' - С1-С4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою,
група -(СH2)р-феніл, у якій р дорівнює 1, 2, 3 або 4,
група -(СH2)р-піридил, у якій р дорівнює від 1 до 3,
група -(СH2)р-тієнільна, у якій р дорівнює 2, С6-С7-гетероциклоалкільна група, як варіант, заміщена метильною групою або групою -COOR, у якій R - С1-С4-алкільна група,
або, у і іншому варіанті,
R1 - атом гідрогену,
R2 і R2' є, незалежно одна від одної, атомом гідрогену або метильною групою,
Х - атом карбону,
n = 1 або 2,
m = 1,
R3 - атом гідрогену, група -NR5R6, група -N(СН3)з+, група -NHCOR7, група CONHR5, група –NНСОNН2, група -ОН або група –CH2OH,
R4 - атом гідрогену, бензильна група, фенільна група, як варіант, заміщена 1-3 групами, вибраними незалежно одна від одної з атома галогену і трифлуорметильної групи,
гетероарильна група, а саме, імідазолільна група, як варіант, заміщена метильною або піридильною групою,
група -NR7R8,
за умови, що коли R4 - група -NR7R8, R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH2 і -ОН,
R5 і R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою, R7 і R8 є, незалежно одна від одної, С1-С4-алкільною групою або разом вони утворюють насичене 5-7-членне кільце, яке, як варіант, включає додатковий атом нітрогену, причому це кільце на атомі карбону або на атомі нітрогену, включаючи атом нітрогену, до якого для утворення четвертинного амонію приєднані групи R7 і R8, як варіант, може бути заміщене, метильною групою або групою -COOR", у якій R" - (С1-С4)алкілфенільна група,
за винятком двох сполук, у яких R1, R2, R2', R3 є Н, Х - С, n = m = 1, a R4 - 4-імідазолільна або 5-метил-4-імідазолільна група,
у формі енантіомерів або діастереомерів, або сумішей цих різних форм, включаючи рацемічні суміші, а також у формі основ або солей приєднання фармацевтично прийнятних кислот.
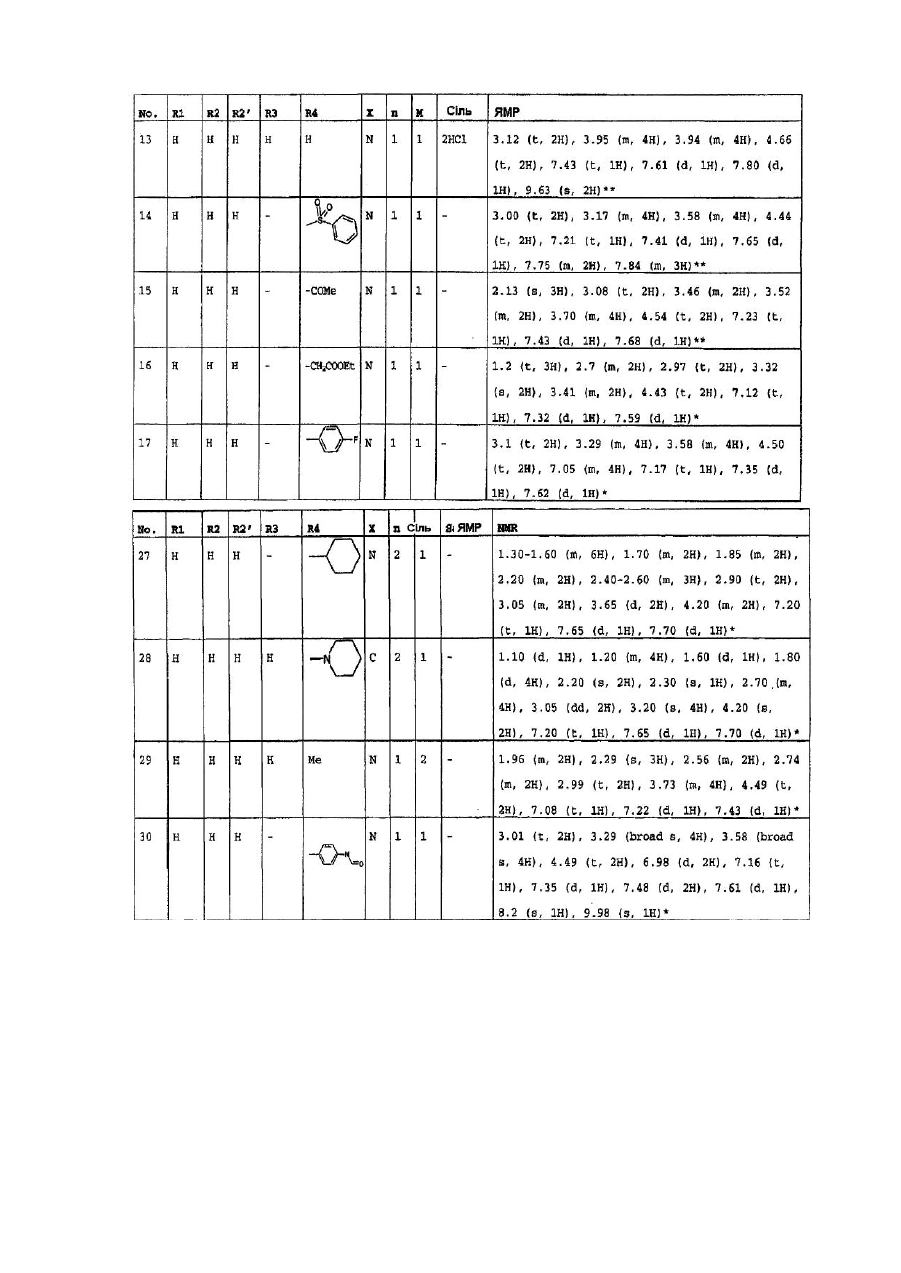
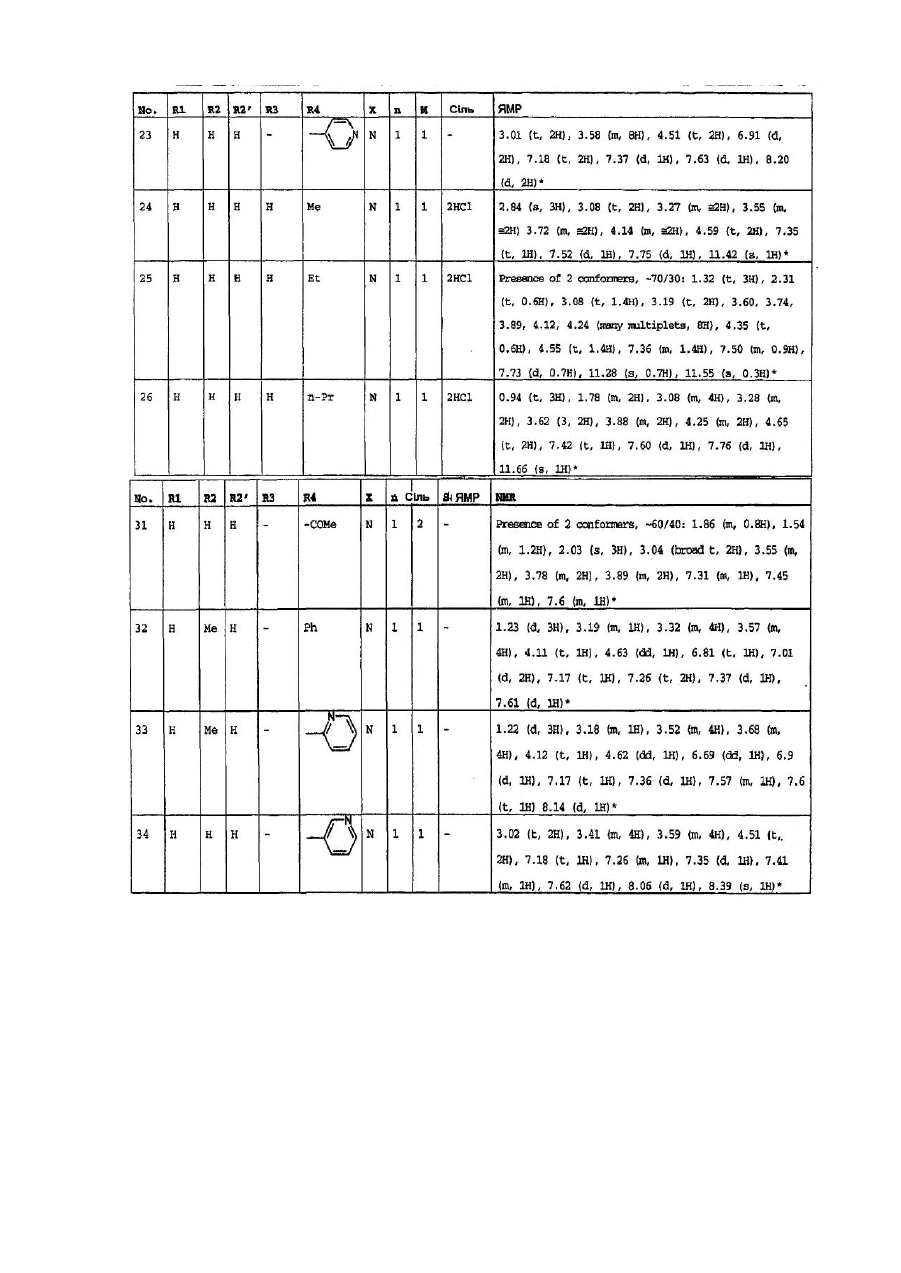
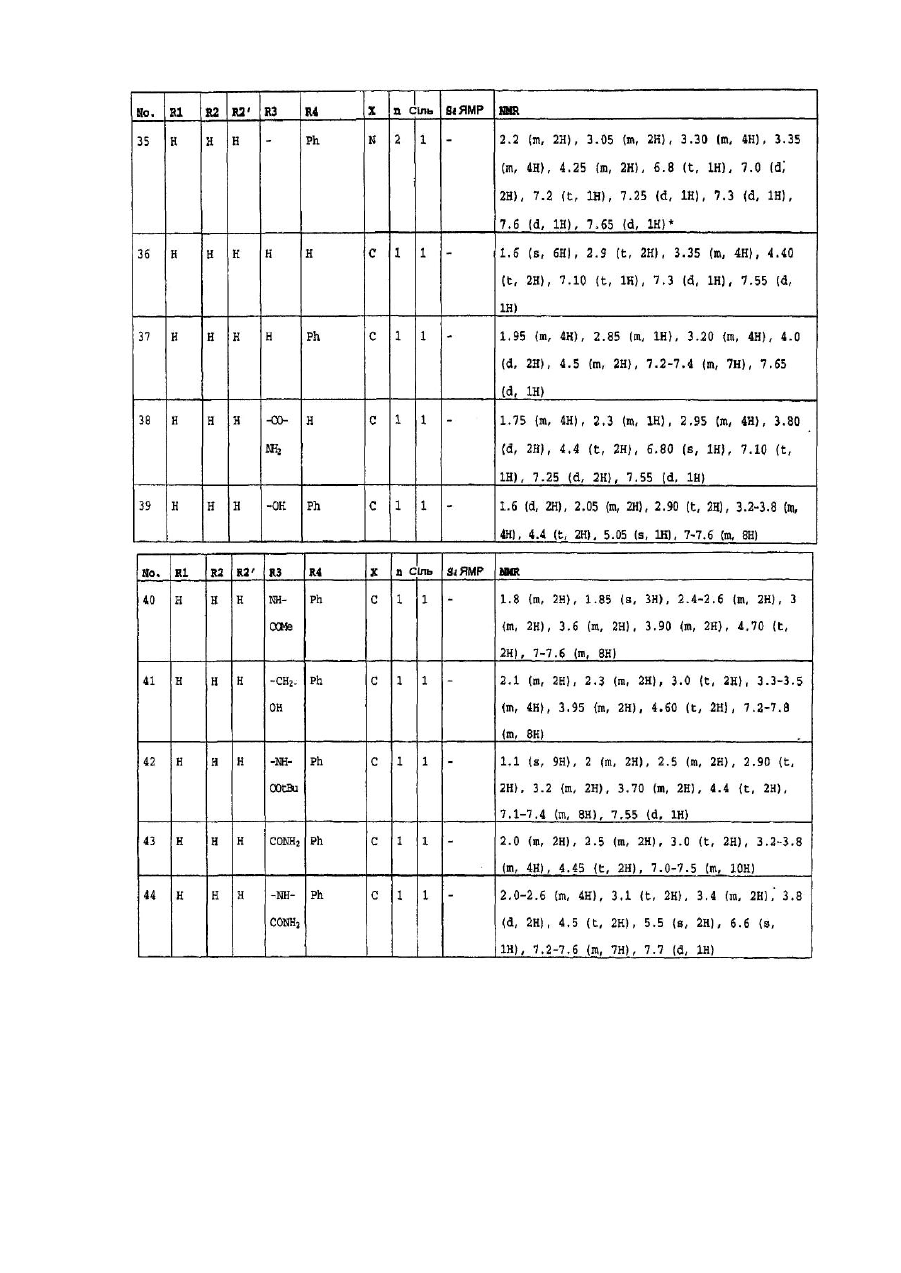
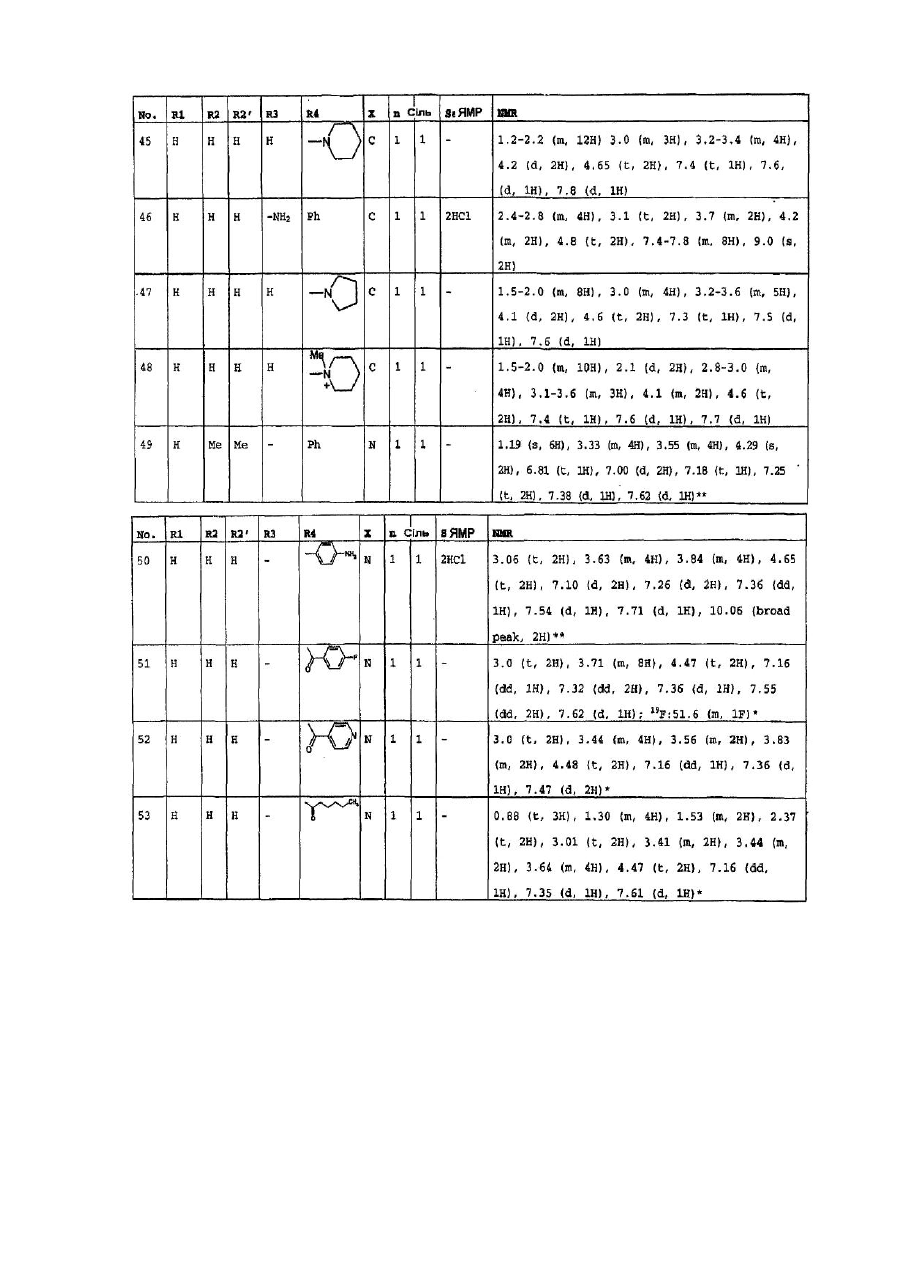
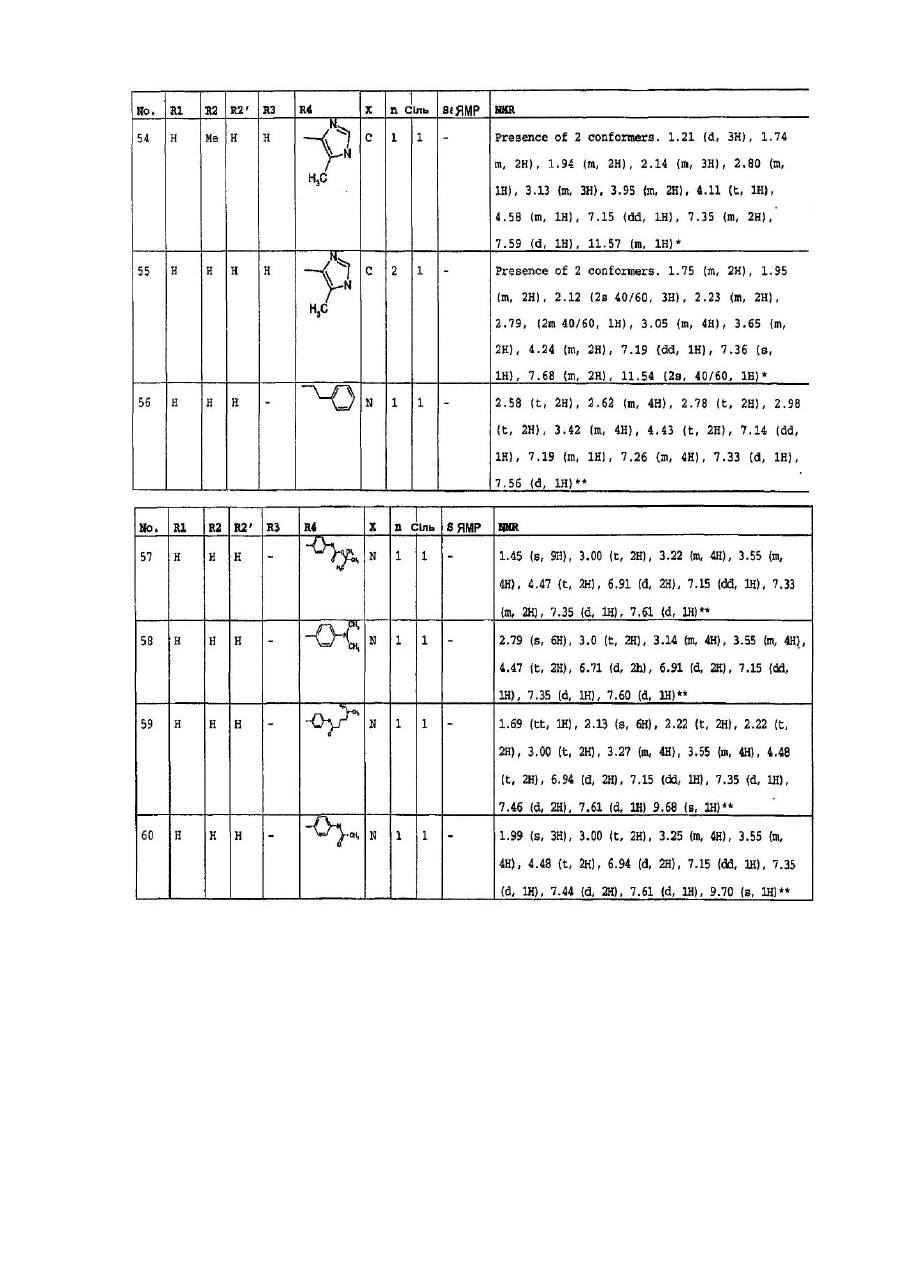
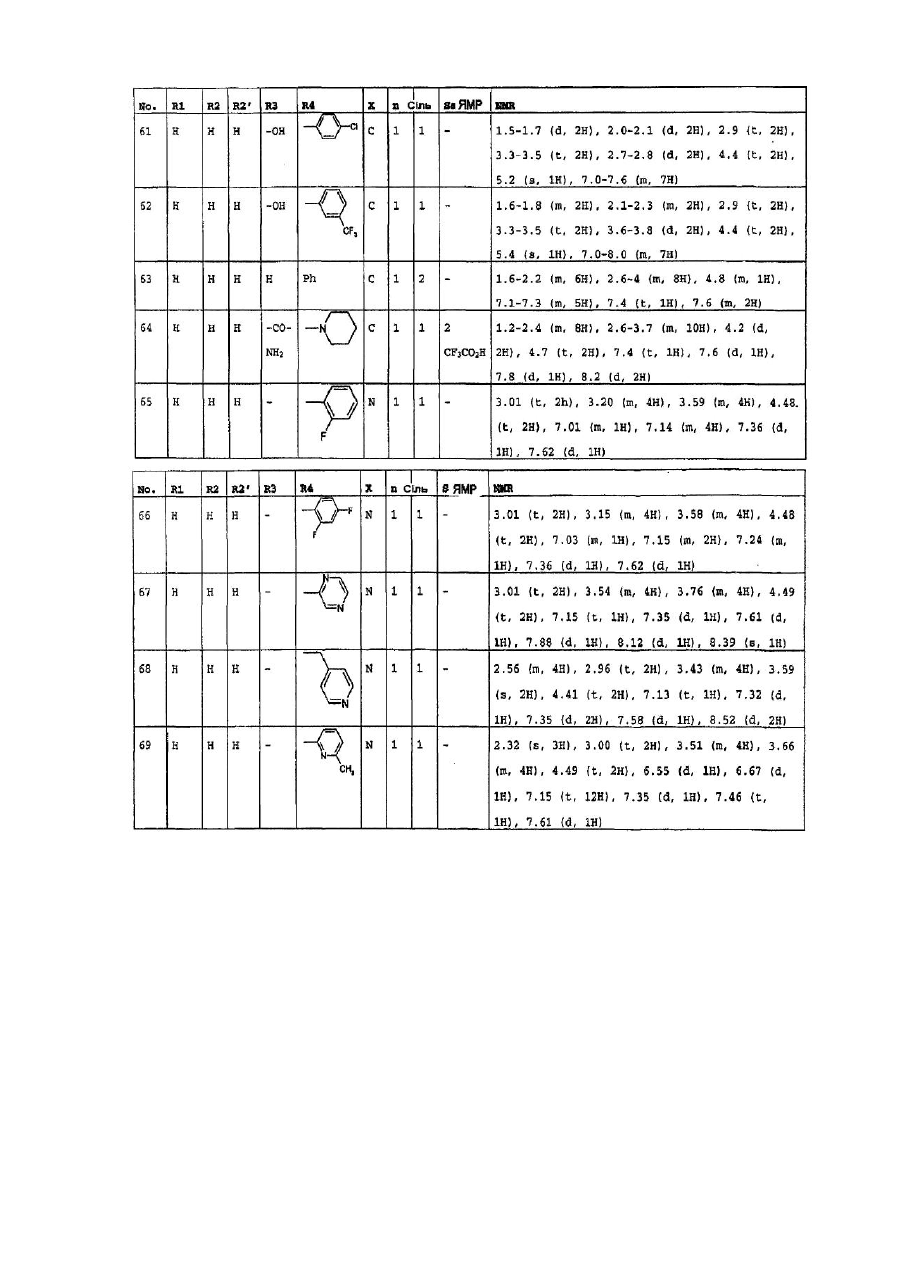
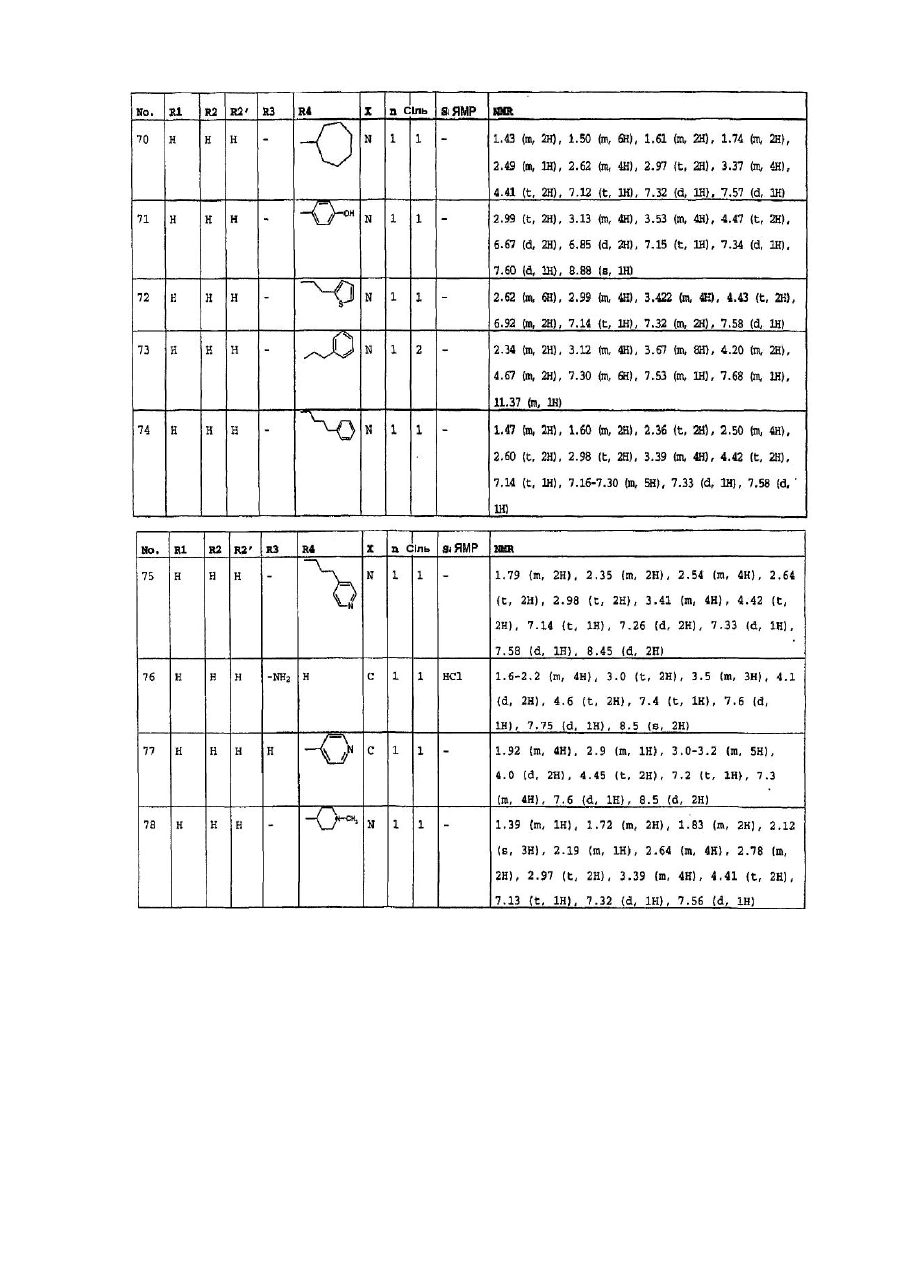
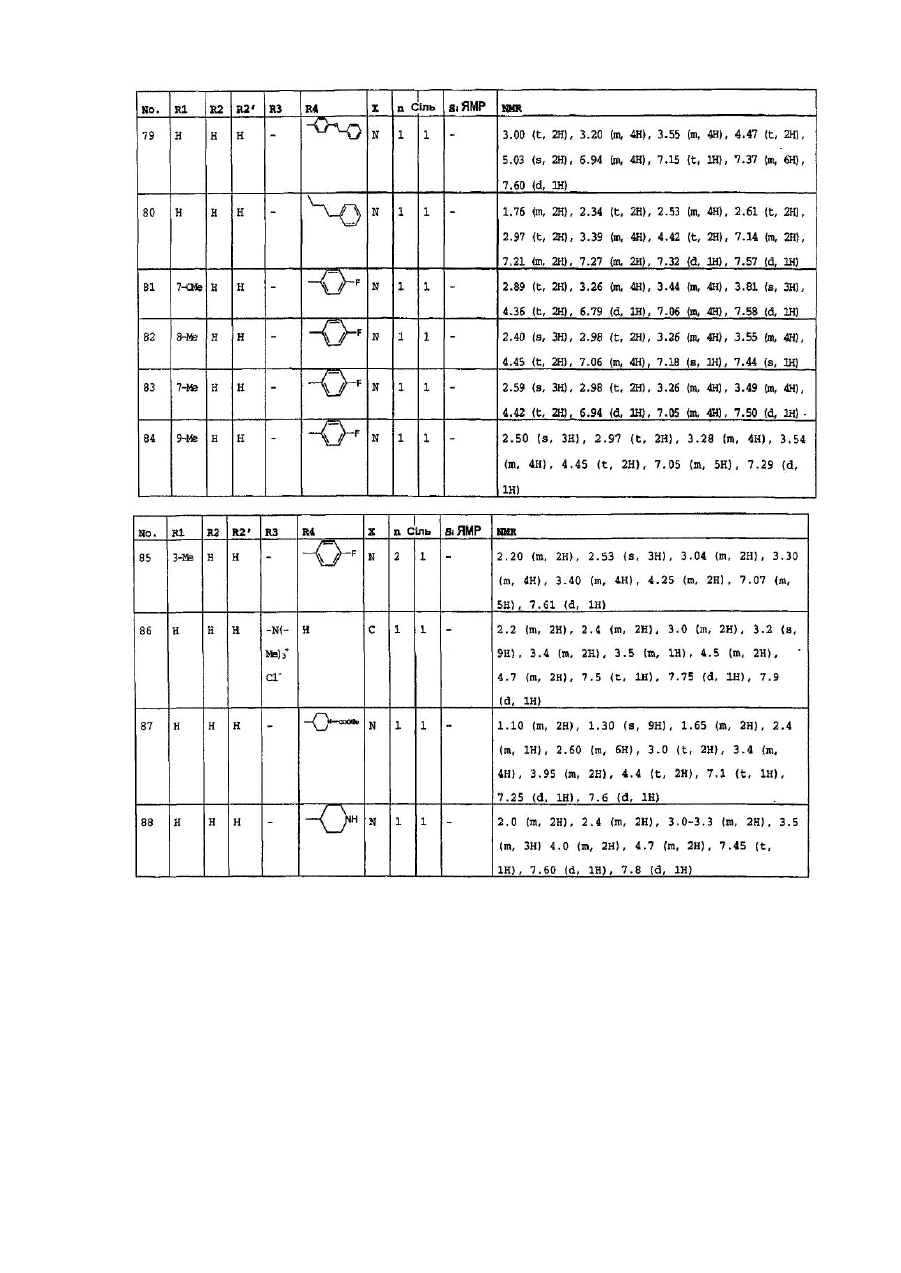
4. Сполуки формули (І) за пп. 1-3, які вибрано з групи, яка складається з:
1-(6-оксо-5,6-дигідро-4H-iмідазо[4,5,1-ij]хінолін-2-іл)-4-піперидинопіперидину,
1-метил-1-[1-(6-оксо-5,6-дигідро-4H-iмідазо[4,5,1-ij]хінолін-2-іл)-4-піперидиніл]-піперидину,
2-[4-(4-диметиламінофеніл)піперазин-1-іл]4,5-дигідроімідазо-[4,5,1-ij]хінолін-6-ону,
2-[4-(4-трет-бутоксикарбоніламінофеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-амінофеніл)піперазин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-ацетамідофеніл)піперазин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-(4-n-пропілпіперазин-1-іл)4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-(4-трет-бутилоксикарбонілпіперазин-1-іл)4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-(піперазин-1-іл)4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-(4-ацетилпіперазин-1-іл)4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-піридил)-піперазин-1-іл)4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-(4-бензилпіперидин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-феніл-4-піперидинкарбоксаміду,
1-(6-оксо-5,6-дигідро-4H-iмідазо[4,5,1-ij]хінолін-2-іл)-4-феніл-4-амінопіперидину,
2-[4-(4-гідроксифеніл)-піперазин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-флуорфеніл)-піперазин-1-іл]4,5-дигідро-9-метилімідазо[4,5,1-ij]хінолін-6-ону,
1-[4-(4-флуорфеніл)-піперазин-1-іл]-3-метил-8,9-дигідро-7H-2,9а-діазабензо[cd]азулен-6-ону,
2-[4-(4-флуорфеніл-)піперазин-1-іл]4,5-дигідро-7-метилімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-флуорфеніл)-піперазин-1-іл]4,5-дигідро-8-метилімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-флуорфеніл)-піперазин-1-іл]4,5-дигідро-7-метоксіімідазо[4,5,1-ij]хінолін-6-ону,
2-[4-(4-метоксифеніл)піперазин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону,
1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4H-4-диметиламінопіперидину,
у формі енантіомерів або діастереомерів, або сумішей цих різних форм, включаючи рацемічні суміші, а також у формі основ або солей приєднання фармацевтично прийнятних кислот.
5. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-4, який відрізняється тим, що похідне формули (II)
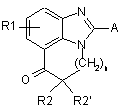 , (II)
, (II)
де R1, R2, R2' і n є ідентичними визначеним у п. 1, а А - відщеплювальна група, вводять в реакцію у присутності аміну формули (III):
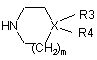 , (III)
, (III)
де X, R3, R4 і m є ідентичними визначеним у п. 1, у розчиннику, яким може бути спирт, етер або гідрокарбон, з одержанням сполуки формули (І) за п. 1, причому реакцію можна проводити у присутності основи, галогенідів лужних металів або паладієвих або нікелевих каталізаторів.
6. Сполуки формули (II) за п. 5, які можуть бути використані як синтетичні інтермедіати.
7. Медичний продукт, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-4.
8. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-4 і один або більше фармацевтично прийнятних наповнювачів.
9. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що її застосовують для приготування медичного продукту, придатного для профілактики або лікування розладів, пов'язаних з ферментом полі(АDР-рибоза)полімеразою.
10. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що її застосовують для приготування медичного продукту, призначеного для профілактики або лікування інфаркту міокарда, серцевої ішемії, серцевої недостатності, атеросклерозу, рестенозу після РТС або операції шунтування, церебральної ішемії і церебрального інфаркту, викликаного ішемією, травмою або тромбоемболією, таких нейродегенеративних захворювань, як хвороба Паркінсона, хвороба Альцгеймера і хорея Хантингтона, гострої ниркової недостатності, зокрема, ішемічного походження або після пересадки нирки, лікування відторгнення після пересадки серця, прискореного атеросклерозу, запалювальних патологій, імунологічних розладів, ревматоїдних хвороб, діабету і панкреатиту, септичного шоку, гострого синдрому порушення дихання, пухлин і метастазів, автоімунних хвороб, СНІДу, гепатиту, псоріазу, васкуліту, виразкового коліту, множинного склерозу і міастенії.
11. Медичний продукт за п. 7, який відрізняється тим, що його використовують для лікування або профілактики розладів, пов'язаних з ферментом полі(АDР-рибоза)полімеразою, який містить сполуку формули (І), у якій R1, R2, R2', R3 є Н, Х - С, n = m = 1 і R4 - 4-імідазолільна або 5-метил-4-імідазолільна група.
Текст
Винахід стосується похідних бензимідазолу, їх приготування і застосування у терапії. Винахід стосується сполук формули (І): (I) де: R1 - атом гідрогену, С1-С4-алкільна група, атом галогену, нітрогрупа або С1-С4-алкоксильна, R2 і R2' є незалежно одна від одної атомом гідрогену або С1-С4-алкільною групою, X - атом нітрогену або атом карбону, n дорівнює 1 або 2, m дорівнює 1 або 2, і, коли X - атом нітрогену, то: R3 - атом гідрогену або С1-С4-алкільна група, і тоді сполуки формули (І) включають четвертинний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін, R4 - атом гідрогену, С1-С6-алкільна група, СЗ-С7-циклоалкільна група, СЗ-С7-гетероциклоалкільна група, як варіант, заміщена С1-С4-алкільною групою або групою -COOR, у якій R - С1-С6-алкільна група, група - (СH2)р-гетероарил, у якій p може мати значення від 0 до 4, а гетероарильна група вибрана серед піридильної, амінопіридильної, піримідинільної, піразинільної, піридизанільної, імідазолільної і тієнільної груп, а зазначена гетероарильна група, як варіант, може бути заміщена С1-С4-алкільною групою, гетероарилкарбонільна група, причому гетероарильна група вибрана серед фурильної, піридильної, піримідильної, піразинільної, пірадизинільної і імідазолільної груп, фенілкарбонільна група, причому фенільна група, як варіант, заміщена атомом галогену, (С1-С6)-алкілкарбонільна група, група -(CH2)рCOOR, де р може мати значення від 0 до 4, a R - С1-С6-алкільна група, фенілсульфонільна група, як варіант, заміщена на фенільному ядрі атомом галогену, трифлуорметильною групою, С1-С4-алкільною групою, нітрогрупою або С1-С4-алкоксильною групою, або, у іншому варіанті, (СH2)р-феніл група, де р може мати значення від 0 до 4, а фенільна група, як варіант, заміщена у ортоі/або мета- і/або парапозиції однією-трьома групами, вибраними незалежно одна від одної серед С1-С4алкільної, нітро-, аміно-, гідроксильної груп, атому галогену, трифлуорметильної групи, С1-С4-алкоксильної групи, (С1-С4)-алкоксифенільної групи, С1-С4-алкіламіногрупи, С1-С4-диапкіламіногрупи, групи -NHCHO або групи -NHCOR1, де R1 - G1-C4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою, і, коли X - атом карбону, то: R3 - атом гідрогену, група -NR5R6, група -N(R5)3+, група -NHCOR7, група -CONHR5, група -COR7, NHCONH2 група, група -ОН або гр упа –СН2ОН, R4- атом гідрогену, -(СH2)р-фенільна група, у якій р може мати значення від 0 до 4, а фенільна група, як варіант, заміщена 1-3 групами, вибраними, незалежно одна від одної, серед С1-С4-алкільної групи, нітрогрупи, аміногрупи, атому галогену, трифлуорметильної групи або С1-С4-апкоксильної групи, -(СH2)р-гетероарильна група, у якій ρ може мати значення від 0 до 4, а гетероарильна група вибрана серед імідазолільної групи, як варіант, заміщеної С1-С4-алкільною групою, піридильної, амінопіридильної, піримідинільної, піразинільної або піридазинільної груп, або, у іншому варіанті, група -(СH2)tNR7R8, у якій t дорівнює 0 або 1, за умови, що, коли R4 є гр упою -NR7R8, то R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH 2 і -ОН, R5 і R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою, R7 і R8 є, незалежно одна від одної, С1-С4-алкільною або С1-С4-алкоксильною групою, або разом утворюють насичене 5-7-членне кільце, яке, як варіант, включає додатковий атом нітрогену для формування, наприклад, 1-піперидильної, 1-піролідинільної або 1-піперазиніпьної групи, причому це кільце на атомі карбону або нітрогену, включаючи той атом гідрогену, до якого для утворення четвертинного амонію приєднані групи R7 і R8, як варіант, може бути заміщене С1-С4-алкільноюгрупоюабо групою-COOR", у якій R" - фенільна або (С1-С4)-алкілфенільна група, за винятком двох сполук, у яких R1, R2, R2', R3 є Н, X - С, n=m=1, a R4 - 4імідазолільна, або 5-метил-4-імідазолільна група. Ці дві сполуки описані у заявці ЕР 646 583 як сполуки 16 і 17 у таблиці і ліганди серотонінергічного рецептора типу 5-НТ3 і 5-НТ4. Сполуки формули (І) можуть включати один або більше асиметричних атомів карбону. Отже, вони можуть існувати у формі енантіомерів або діастереомерів. Ці енантіомери і діастереомери, а також їх суміші входять в об'єм винаходу. Сполуки винаходу можуть бути основами або солями приєднання фармацевтично прийнятних кислот. Такі солі також входять в об'єм винаходу. У цьому документі використані такі терміни: "(Сq-Сr)-алкільна група" - лінійна або розгалужена насичена аліфатична група, яка містить від q до r атомів карбону (q і r - цілі), зокрема, метальна, етильна, пропільна, ізопропільна, n-пропільна, бутильна, іізобутильна, трет-бутильна, n-бутильна, пентильна тощо групи; "атом галогену" означає флуор, хлор, бром або іод; "С3-С7-циклоалкільна група" - циклічноалкільна група, яка містить від 3 до 7 атомів карбону, зокрема, циклопропільна, циклобутильна, циклопентильна, циклогексильна і циклогептильна групи; "С3-С7-гетероциклоалкільна група" – циклічноалкільна група, яка містить від 3 до 7 атомів карбону і один або більше гетероатомів, наприклад, атомів нітрогену, зокрема це може бути піперидинільна група; "(С1-С4)алкоксифеніпьна група" - гр упа формули -О-(СН2)х-феніл, де x може мати значення від 1 до 4. Серед сполук формули (1) згідно з винаходом бажаними є такі, у яких: R1 - атом гідрогену, С1-С4-алкільна група або С1-С4-алкоксильна група, R2 - атом гідрогену або С1-С4-алкільна група, R2' - атом гідрогену, X - атом нітрогену, n дорівнює 1 або 2, m дорівнює 1 або 2, R3 - атом гідрогену, і тоді сполуки формули (І) включають четвертинний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін, R4 - атом гідрогену, С1-С6-алкільна група, С3-С7-циклоалкільна група, піридильна, піримідинільна або піразинільна група, як варіант, заміщена С1-С4-алкільною групою, гетероарилкарбонільна група, де гетероарильною групою є фурильна або піридильна група, фенілкарбонільна група, де фенільна група, як варіант, заміщена атомом галогену, (С1-С6)алкілкарбонільна група, група -(СH2)рCOOR, у якій p can range from 0 to 4, a R - С1-С6-алкільна група, фенілсульфонільна група, фенільна група, заміщена 1-3 групами, вибраними, незалежно одна від одної, серед С1-С4-алкільної групи, нітрогрупи, аміногрупи, гідроксильної групи, атому галогену, трифлуорметильної групи, С1-С4алкоксильної групи, (С1-С4)-алкоксифенільної групи, (С1-С4)-діалкіламіногрупи, групи -NHCHO або групи NHCOR1, у якій R1 - С1-С4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою, -(СH2)р-фенільна група, у якій ρ може мати значення від 0 до 4, -(СH2)р-піридильна група, у якій ρ може мати значення від 0 до 4, -(СH2)р-тієнільна група, у якій ρ може мати значення від 0 до 4, (С3-С7)-гетероциклоалкільна група, як варіант, заміщена С1-С4-алкільною групою або групою -COOR, у якій R - С1-С6-алкільна група, або, у іншому варіанті, бажаними є сполуки, у яких: R1 - атом гідрогену, R2 і R2' є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою, X - атом карбону, n дорівнює 1 або 2, m дорівнює 1, R3 - атом гідрогену, група -NR5R6, група -N(R5)3+, група -NHCOR7, група -CONHR5, група -NHCONH2, група -ОН або гр упа –СН2ОН, R4 - атом гідрогену, бензильна група (а саме, -(СH2)р-фенільна група, у якій р дорівнює 1), фенільна група, як варіант, заміщена 1-3 групами, вибраними, незалежно одна від одної, серед С1-С4алкільною групи, нітрогрупи, аміногрупи, атому галогену, трифлуорметильної групи або С1-С4-алкоксильної групи, гетероарильна група, а саме, імідазолільна група, як варіант, заміщена С1-С4-алкільною групою, або піридильна група, група -NR7R8, за умови, що, коли R4 - група -NR7R8, то R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH 2 і -ОН, R5 і R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою, R7 і R8 є, незалежно одна від одної, С1-С4-алкільною або С1-С4-алкоксильною групою, або разом утворюють насичене 5-7-членне кільце, яке, як варіант, включає додатковий атом нітрогену, і на атомі карбону або атомі нітрогену, включаючи той атом нітрогену, до якого приєднані групи R7 і R8 для формування четвертинного амонію, може бути, як варіант, заміщене С1-С4-алкільною групою або групою -COOR", у якій R"-фенільна або (С1-С4)-алкілфенільна група, за винятком двох сполук, у яких R1, R2, R2', R3 є Н, X - С, n=m=1, a R4 - або 4-імідазолільна, або 5-метил-4-іімідазолільна група. Серед цих бажаних сполук особливо бажаними є сполуки формули (І), у яких: R1 - атом гідрогену, метильна або метоксильна група, R2 - атом гідрогену або метильна група, R2' - атом гідрогену, X - атом нітрогену, n дорівнює 1 або 2, m дорівнює 1 або 2, R3 - атом гідрогену, і тоді сполуки формули (І) включають четвертний амоній, або, у іншому варіанті, R3 відсутня, і тоді сполуки формули (І) включають вторинний або третинний амін, R4 - атом гідрогену, С1-С4-алкільна група, С6-С7-циклоалкільна група, піридильна, піримідильна або піразинільна група, як варіант, заміщена С1-С4-алкільною групою, гетероарилкарбонільна група, де гетероарильною групою є фурильна або піридильна група, фенілкарбонільна група, де фенільна група, як варіант, заміщена атомом галогену, (С3-С5)-алкілкарбонільна група, група -(CH2)PCOOR, у якій р дорівнює 0 або 1, a R - С1-С4-алкільна група, фенілсульфонільна група, фенільна група, заміщена 1-3 групами, вибраним, незалежно одна від одної, серед метальної групи, нітрогрупи, аміногрупи, гідроксильної групи, атомугалогену, трифлуорметильної групи, метоксигрупи, (С1-С4)алкоксифенільної групи, диметиламіногрупи, групи -NHCHO або група -NHCOR1, у якій R1 - С1-С4-алкоксильна або С1-С4-алкільна група, причому ця С1-С4-алкільна група, як варіант, заміщена диметиламіногрупою, -(СН2)р-феніл група, у якій р дорівнює 1, 2, 3 або 4, -(СН2)р-піридил група, у якій р дорівнює від 1 до З, -(СН2)р-тієнільна група, у якій р дорівнює 2, С6-С7-гетероциклоалкільна група, як варіант, заміщена метальною групою або групою -COOR, у якій R С1-С4-алкільна група, або, у і іншому варіанті, найбільш бажаними є ті сполуки формули (І), у яких: R1 - атом гідрогену, R2 і R2' є, незалежно одна від одної, атомом гідрогену або метальною групою, X - атом карбону, n дорівнює 1 або 2, m дорівнює 1, R3 - атом гідрогену, група -NR5R6, група -N(CH3)3+, група -NHCOR7, група -CONHR5, група -NHCONH2, група -ОН або гр упа -СН2ОН, R4- атом гідрогену, бензипьна група, фенільна група, як варіант, заміщена 1-3 групами, вибраними незалежно одна від одної серед атому галогену і три флуорметильної групи, гетероарильна група, а саме, імідазолільна група, як варіант, заміщена метильною або піридильною групою, група -NR7R8, за умови, що коли R4 - група -NR7R8, R3 не є жодною з груп -NR5R6, -NHCOR7, -NHCONH 2 і -ОН, R5 і R6 є, незалежно одна від одної, атомом гідрогену або С1-С4-алкільною групою, R7 і R8 є, незалежно одна від одної, С1-С4-алкільною групою або разом вони утворюють насичене 5-7членне кільце, яке, як варіант, включає додатковий атом нітрогену, причому це кільце на атомі нітрогену, включаючи атом нітрогену, до якого для утворення четвертинного амонію приєднані групи R7 і R8, як варіант, може бути заміщене, метильною групою або групою -COOR", у якій R" - (С1-С4)алкілфенільна група, за винятком двох сполук, у яких R1, R2, R2', R3 є Н, X - С, n=m=1, a R4 - 4-імідазолільна або 5-метил-4іімідазолільна група. Далі термін "відщеплювальна група" означає групу, яка може бути легко відщеплена від молекули гетеролітичним розщепленням зв'язку з втратою електронної пари. Така група може бути легко заміщена іншою через реакцію заміщення. Такими відщеплювальними групами є, наприклад, галогени або така активована гідроксильна група, як мезильна, тозильна, трифлатна, ацетильна тощо. Приклади відщеплювальних груп і опис їх приготування можна знайти у "Ad vances in Organic Chemistry", J.March 3rd Edition, Wily Interscience, pp.310-316. Для приготування сполук формули (І) згідно з винаходом може бути застосована процедура синтезу за Схемою 1. Згідно з цією процедурою, похідні формули (II), у якій R1, R2, R2' і n є ідентичні визначеним вище, а А є відщеплювальною групою, бажано, галогеном, вводять в реакцію у присутності аміну формули (III), де X, R3, R4 і m ідентичні визначеним вище, у розчиннику, яким може бути спирт, наприклад, ізоаміловий, етер, наприклад, ТГФ або ТГМЕ (тріетиленглікольмонометиловий етер) або гідрокарбон, наприклад, толуол, при температурі між кімнатною і точкою кипіння розчинника, для одержання сполуки формули (І). Реакцію можна проводити у присутності основи, наприклад, 2,6-диметиллютидину або трет-бутоксид натрію, у присутності галогенідів лужних металів, наприклад, флуориду калію, або у присутності паладієвих або нікелевих каталізаторів, як це описано, [наприклад, у заявці ЕР 646 583 або у J.Med. Chem. (1986), 29, 1178-1183, Tetrahedron Letters (1997), 32, 5607-5610, Tetrahedron Letters (1999), 55, 12829-12842 і Tetrahedron Letters (1999), 40, 6875-6879]. Коли сполука формули (І) включає вільне первинну або вторинну амінову функцію, її можна також отримати реакцією похідної формули (II) з аміном формули (III), де зазначена амінова функція захищена звичайною амінозахисною групою, наприклад, трет-бутилкарбаматом (BOG). Одержану у такий спосіб сполуку формули (І), що містить захищену амінову функцію, обробляють згідно з одним з відомих способів і одержують бажану сполуку (І), яка містить вільну амінову функцію. Приклади амінозахисних груп і методів зняття захисту можна знайти, зокрема, у роботі T.W. Greene, P.G.M. Wuts, "Protecti ve Groups in Organic Synthesis (захисні групи у органічному синтезі)", J. Wil y, Ed., 1991. Схема 1 Сполуки формули (II) можна приготувати згідно з Схемою 2 в робочих умовах, відомих фахівцям, зокрема, реакцією сполука формули (IV), у якій R1, R2, n і R2' ідентичні визначеним вище, з галогенуючим агентом, наприклад, фосфорилхлоридом Схема 2 Сполуки формули (IV) можна приготувати за процедурою Схеми 2. Згідно з одним з варіантів процедури, дііамін формули (V), у якій R1, R2, R2' ідентичні визначеним вище вводять в реакцію з похідною фосгену, наприклад, карбоніл діімадазолом (GDI). У іншому варіанті похідну формули (VI), у якій R1 ідентична визначеній вище, алкілюють алкілюючим агентом формули (VIII, де R - С1-С4-алкіл), у якій R2 ідентична визначеній вище, і одержують продукти (VII), у яких n=1 і R2' - Н, або агентом формули (IX, R - С1-С4-алкіл), де Υ - відщеплювальна група, у якій R2 і R2' ідентичні визначеним вище, з одержанням продуктів формули (VII), у якій n=2. Сполуки (VII), отримані у такий спосіб, перетворюють у карбонові кислоти (VII, R - Η) або у похідні кислоти, наприклад, кислотні хлориди (VII, R - С1) з подальшим циклізуванням в умовах, відомих фа хівцям, і безпосереднім отриманням інтермедіатів формули (II). Це рішення є подібним описаному у заявці JP 55111406 або у Tetrahedron Letters (1995), 36,1387-1390. У іншому варіанті, сполуки формули (II), де R2 і R2' не є атомом гідрогену, можна приготувати з відповідних сполук (II), у яких R2' - атом гідрогену, алкілюванням реагентом типу R2'Z, де Ζ - відщеплювальн група, бажано, іод. Цю реакцію можна проводити у такому розчиннику, як ДМФ, етер або ТГФ у присутності основи, методами, відомими фахівцям. Сполуки формул (III), (V), (VI), (VIII) і (IX) можна придбати комерційно або приготувати у спосіб, відомий фа хівцям. Об'єктом винаходу є також нові синтетичні інтермедіати формули (II). Наведені далі приклади ілюструють винахід. Номери сполук, наведених як приклади, відповідають номерам у наведеній нижче таблиці, яка дає хімічні структури сполук відповідно до їх номерів. Приклад 1. Приготування інтермедіатів формули (II) 1.1. Приготування 2-хлор-4,5-дигідро-імідазо[4,5,1-ij]хінолін-6-ону (А - С1, R1 - Н, R2 і R2' є H, n=1) Цю сполуку отримують з сполуки 4Н-імідазо[4,5,1-ij] хінолін-2,6-(1Н,5Н)діону (IV), описаного у патенті Японії JP 55111406. 10г сполуки (IV) витримують під зворотним холодильником з 38,6мл фосфорного оксихлориду і 6,3г хлориду амонію протягом 1,5год. у 250мл тригорлій колбі з зворотним конденсатором. Реакційну суміш о холоджують, вливають у лід і додають 20%-й водний розчин амонію з енергійним перемішуванням до досягнення рН9. Суміш екстрагують (2´250мл) етилацетатом, сушать над сульфатом магнію, фільтрують і випарюють. Одержані 9,81г твердої речовини використовують без подальшого очищення у наступній операції. 1Н ЯМР (200МГц, δ 1/млн) ДМСО D6: 7,8 (d, 1H), 7,5 (d, 1H), 7,3 (t, 1H), 4,5 (t, 2H), 3,0 (t, 2H). 1.2 Приготування 1-хлор-8,9-дигідро-7Н-2,9а-діазабензо[сd]азулен-6-ону (А - С1, R1 - Н, R2 і R2' є Η, n=2) 1.2.1. Натрійгідрид етил-3-(2-хлорбензімідазол-1-іл)бутират у вигляді 60%-ї дисперсії у маслі (2,88г, 72ммоль) вносять у атмосфері нітрогену в 1-літрову тригорлу колбу з магнітним перемішувачем, додатковю трубкою і конденсатором. Гідрид натрію промивають двічі пентаном, додають невелику кількість ДМФ і потім розчин етил-4-бромбутирату (14,78г, 72ммоль) у безводному ДМФ (200мл). Після 1-годинного перемішування при кімнатній температурі до суміші додають 2-хлор-1Н-бензімідазол (10,0г, 65,5ммоль), розчинений у безводному ДМФ (200мл). Реакційну суміш гріють при 65°С протягом 8год. і витримують протягом ночі при кімнатній температурі. Після випарювання ДМФ залишок вносять у етилацетат і органічну фазу промивають насиченим хлоридом натрію, сушать над сульфатом магнію, фільтрують і концентрують. Флеш-хроматографія сирого продукту (22г) на силікагелі (750г) з градієнтним елююванням 10%-30%-м етилацетатом у петролейному етері дає бажану сполуку у формі жовтого масла (16,58г, 95%). 1Н ЯМР (300МГц, δ 1/млн) CDCI3: 1,25 (t, 3Н), 2,15 (quint., 2H), 2,40 (t, 2H), 4,15 (quartet, 2H), 4,25, (t, 2Н), 7,20-7,40 (m, 2Н), 7,70 (dd, 1H). 1.2.2. 3-(2-хлор-1-бензімідазоліл)бутоксид літію Етиловий естер (16,58г, 62,2ммоль), розчинений у ТГФ (180мл), вносять у 1-літрову одногорлу колбу з закругленим дном з магнітним перемішуванням і додають водний розчин гідроксиду літію (1,49г, 24ммоль, 100мл дистильованої води). Суміш залишають на ніч при кімнатній температурі, ТГФ і воду випарюють і залишок вносять у етиловий етер (2л) і перемішують 2год. Одержаний білий осад фільтрують, промивають етиловим етером і сушать під вентиляторним вакуумним насосом над фосфорним пентоксидом, одержуючи бажану сполуку у формі білих кристалів (14г, 92%). Цю сполуку без очищення використовують у наступній операції. 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6+εD20: 1,85 (m, 2Н), 1,95 (m, 2Н), 4,20 (t, 2Н), 7,25 (m, 2Н), 7,55 (d, 1Н), 7,60 (d, 1Н). LC-MS: МН+ - 239 (кислота). 1.2.3.1 -хлор-8,9-дигідро-7Н-2,9а-діазабензо[cd]-азулен-6-он Сіль літію (11,95г, 49,7ммоль) у атмосфері аргону вносять у 2-літрову тригорлу колбу з магнітним перемішувачем, конденсатором і додатковою трубкою для введення, додають 1,2-дихлоретан, дистильований над фосфорним пентоксидом (1л). Додають оксалілхлорид (8,55мл, 102ммоль) з перемішуванням і реакційну суміш гріють 15хвил. при приблизно 40°С. До одержаного проміжного кислотного хлориду додають хлорид алюмінію (19,54г, 154,5ммоль) і суміш витримують під зворотним холодильником 3год. Суміш охолоджують, вливають у льодосоляну суміш і екстрагують 1,2-ди хлоретаном, органічну фазу промивають насиченим розчином хлориду натрію, сушать над сульфатом магнію і фільтрують. Розчинник випарюють і флешхроматографують сирий продукт (10,6г) на силікагелі, з елюентом 20% етилацетату у ДХМ, одержуючи бажаний продукт у формі білих кристалів (7,06г, 65%). 1Н ЯМР (300МГц, δ 1/млн) CDCI3: 2,40 (quint., 2Н) , 3,15 (t, 2H), 4,40, (t, 2H), 7,35 (t, 1H), 7,95 (d, 1H), 8,05 (d, 1H). LC-MS: MH+ =221. 1.3. Приготування 2-хлор-5-метил-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону (А - С1, R1 - Н, R2 - CH3, R2' - H, n=1) 1.3.1. Ме тил-1-метил-3-(2-хлор-1-бензімідазоліл)пропіонат 2-хлор-1Н-бензімідазол (15,25г, 100ммоль) розчиняють у хлороформі (100мл) і у атмосфері нітрогену вносять у 1-літрову тригорлу колбу з магнітним перемішувачем, додатковою трубкою і конденсатором. Додають Triton В (47мл, 110ммоль) і метилметакрилат (107мл, 1моль). Реакційну суміш витримують під зворотним холодильником протягом 2год. і після охолодження хлороформ випарюють. Залишок вносять у етилацетат і органічну фазу промивають тричі водою і 1 раз насиченим розчином хлориду натрію. Сирий продукт (10,6г) флеш-хроматографують на силікагелі (1кг) з градієнтним елююванням 30%-70%-м етилацетатом у петролейному етері і одержують бажаний продукт у формі білих кристалів (10,1г, 40%). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 1,15, (d, 3Н), 3,05 (m, 1Н), 3,50 (s, 3Н), 4,25 (dd, 1Н), 4,50 (dd, 1Н), 7,25 (m, 2Н), 7,60 (m, 2Н). 1.3.2.1-метил-3-(2-хлор-1-бензімідазоліл)-пропіонат літію Цю сполуку одержують, як у приготуванні 1.2, обробляючи метил-1-метил-3-(2-хлор-1бензімідазоліл)пропіонат гідроксидом літію. 1Н Я МР (300МГц, δ 1/млн) ДМСО D6+εD20: 1,35 (d, ЗН), 2,60 (m, 1H), 4,10 (dd, 1H), 4,40 (dd, 1H), 7,25 (m, 2H), 7,55 (d, 1H), 7,60 (d, 1H). LC-MS: MH+ =239 (кислота). 1.3.3. 2-хлор-5-метил-4,5-дигідроімідазо[4,5,1-ij]-хінолін-6-он Цю сполуку одержують, як сполуку у приготуванні 1.2, обробляючи її охалілхлоридом для одержання проміжного кислотного хлориду і потім хлоридом алюмінію. 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 1,40 (d, 3Н), 3,20 (m, 1H), 4,10 (dd, 1H), 4,65 (dd, 1H), 7,45 (t, 1Н), 7,70 (d, 1H), 7,85 (d, 1H). LC-MS: MH+ =221. 1.4. Приготування 2-хлор-4,5-дигідро-9-метилімідазо[4,5,1-і]]хінолін-6-ону (А - С1,. R1 - 9-СН3, R2 і R2' є Н, n=1) 1.4.1.2-гідрокси-4-метилбензімідазол 2,3-діамінотолуол (5г, 41ммоль), 1,1-карбонілдіімідазол (7,3г, 45ммоль) і 50мл безводного ДМФ вносять у атфосфері аргону у 250-мілілітрову двогорлу колбу, з магнітним перемішуванням. Суміш гріють при 90-95°С 4год., розчинник дистилюють під вакуумом, залишок вносять у воду (250мл) і екстрагують етилацетатом (3´250мл). Нерозчинний продукт, утворений під час екстрагування, відокремлюють (4,8г) і об'єднану органічну фазу промивають насиченим розчином NaCI, сушать над MgSO4 , фільтр ують і концентрують, одержуючи 1,2г бажаного продукта (6г, кількісно). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,27 (s, 3Н), 6,72 (m, 2Н), 6,82 (m, 1Н). 1.4.2. 2-хлор-4-метилбензімідазол 2-гідрокси-4-метилбензімідазол (5,92г, 40ммоль) і 40мл фосфорилхлориду вносять у 250-мілілітрову двогорлу колбу у атфосфері аргону, з магнітним перемішуванням. Суміш витримують під зворотним холодильником 20год. і фосфорилхлорид випарюють під вакуумом. Тверду речовину вносять у воду (250мл), нейтралізують до рН=8 28%-м водним амонієм і водну фазу екстрагують етилацетатом (3´250мл). Після звичайної обробки одержують бажаний продукт (93%, 6,23г). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,47 (s, 3Н), 7,01 (d, 1H), 7,11 (t, 1H), 7,32 (d, 1H). 1.4.3. Ме тил-1-метил-3-(2-хлор-4-метил-1-бензімідазоліл)пропіонат Цю сполуку одержують, яку Прикладі 1.3.1 (7,85г, 94%). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,48 (s, 3Н), 2,86 (t, 2H), 3,56 (s, 3Н), 4,49 (t, 2H), 7,06 (d, 1H), 7,19 (t, 1H), 7,44 (d,1H). 1.4.4.1-метил-3-(2-хлор-4-метил-1-бензімідазоліл)пропіонат літію Цю сполуку готують, як у Прикладі 1.3.2 (6,94г, 94%). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,3 (dd, 2H), 2,48 (s, 3H), 4,32 (dd, 2H), 7,01 (d, 1H), 7,15 (t, 1H), 7,41 (d, 1H) (кислота). 1.4.5. 2-хлор-4,5-дигідро-9-метилімідазо[4,5,1-ij]хінолін-6-он Цю сполуку готують, як у Прикладі 1.3.3. (4,72г, 76%). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,58 (s, 3H), 3,05 (t, 2H), 4,53 (t, 2H), 7,19, (d, 1H), 7,52 (d, 1H). Приклад 2. 1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-іj]хінолін-2-іл)-4-піперидино-піперидин (R1, R2, R2', R3 є Н, R4 - 1-піперидил, X - С, n=m=1) (сполука 45) 400мг хлорної похідної формули (II) (п.1.1), 5мл ДМФ, 70мг флуориду калію, 0,2мл 2,6-лютидину і 500мг 4піперидинопіперидину разом вводять в реакцію протягом 2год. при 140°С. Після випарювання розчинника залишок хроматографують на силікагелі (елюент: ДХМ +8% метанолу). 375мг продукта одержують у формі білуватої твердої речовини. 1Н ЯМР (200МГц, δ 1/млн) ДМСО D6: 1,2-2,2 (m, 12Н) 3,0 (m, 3Н), 3,2-3,4 (m, 4Н), 4,2 (d, 2H), 4,65 (t, 2H), 7,4 (t, 1H), 7,6, (d, 1H), 7,8 (d, 1H). Приклад 3. Хлориді-Метил-1-[1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-піперидиніл]піперидину (R1, R2, R2', R3 є Н, R4 - N-метил-1-піперидил, X - С, n=1, m=1) (сполука 48) 3.1.4-(N-піперидино)-Вос-піперидин 3,98г 4-оксо-N-Boc піперидину, 1,7г піперидину і 7,1г Ті (IV) ізопропоксиду змішують у тригорлій колбі з закругленим дном під нітрогеном, і суміш залишають перемішуватись на 1год. при кімнатній температурі. Додають 20мл абсолютного етанолу і 850мг NaBH3CN. Суміш залишають реагувати протягом 17год. при кімнатній температурі, додають 5мл води і суміш перемішують 5хвил. і фільтрують через ватманівський папір. Рожевий розчин випарюють, залишок вносять у 100мл етилацетату, розчин сушать над сульфатом магнію і випарюють. Залишок хроматографують на 100г кремнезему і елююють ацетоном, одержуючи 2,2г масла, яке кристалізується. Спектр ЯМР відповідає очікуваній структурі, і продукт використовують без подальшого очищення у наступній операції. 3.2. N-Вос-4-(N-метилпіперидиніум)піперидинхлорид Сполуку п.2.2 перемішують з 5мл СН3І 17год. у темряві і випарюють. Одержані білі кристали (3,10г) використовують без подальшого очищення у наступній операції. 3.3. Хлорид 4-(N-метилпіперидиніум)піперидину Одержані вище кристали суспендують у 20мл ДХМ і додають 5мл насиченого розчину гідрохлориду у етері. Гумоподібний осад розчиняють у 20мл метанолу, випарюють до сухості і вносять у 5мл метанолу. Цей розчин охолоджують до 0°C, додають 1,35мл метоксиду натрію (30% у метанолі) і суміш перемішують 15хвил., фільтрують і випарюють вакуумним насосом. Одержаний амін використовують без подальшого очищення у наступній операції. 3.4. Хлорид 1-Ме тил-1-[1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-піперидил]піперидину. 400мг 2-хлор-4,5-дигідро-6Н-імідазо[4,5,1-ірнолін-6-онуу5мл ДМФ, 70мг флуориду калію, 0,2мл 2,6лютидину і 1,6г 4-(N-метилпіперидиніум)піперидинхлориду вносять у тригорлу колбу під аргоном і залишають перемішува тись на 5год. при 140°С. Суміш випарюють вакуумним насосом і залишок хроматографують з 70г Silic H (Merck) (елюент: ДХМ з 10% метанолу і 0,5% триетиламіну), одержуючи 50мг чистого продукту. Спектр ЯМР відповідає бажаній структурі. Приклад 4. 2-[4-(4-диметиламінофеніл)піперидин-1-іл]4,5-дигідроімідазо[4,5,1-ij]хінолін-6-он (R1, R2, R2' є Н, R3 є -, R4 - парадиметиламінофеніл, X - Ν, n=m=1) (сполука 58) 4.1.1-(трет-бутоксикарбоніл)-4-(4-диметиламінофеніл)піперазин 1-бром-4-N,N-диметиланілін (0,85г, 4,25ммоль), ацетат паладію (0,039г, 0,17ммоль), 2,2'біс(диіфенілфосфін)-1,1'-бінафтил (BINAP) (0,17г, 0,25ммоль) і tBuOK (0,67г, 5,95ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, у атмосфері нітрогену, з магнітним перемішуванням. Колбу очищують 3 рази нітрогеном, додають толуол (25мл) і N-трет-бутоксикарбонілпіперазин (0,95г, 5,1ммоль) і реакційну суміш витримують під зворотним холодильником 20год. Після охолодження до кімнатної" температури додають етилацетат і органічну фазу промивають двічі водою. Після висушування органічної фази над сульфатом натрію, фільтрування і концентрування залишок (1,38г) хроматографують на силікагелі з градієнтним елююванням ДХМ/етилацетатом (від 9:1 до 1:1), одержуючи бажану сполуку (50%, 0,67г). 1Н ЯМР (300МГц, δ 1/млн) CDCI3:1,47 (s, 9Н), 2,99 (m, 4H), 3,57 (m, 4H), 6,72 (d, 2Н), 6,89 (d, 2H). 4.2. N-1-(4-диметиламінофеніл)піперазин Продукт Прикладу 1.1 (0,67г, 2,2ммоль) розчиняють у трифлуороцтовій кислоті (20мл) і піддають магнітному перемішуванню протягом 2,5год. при кімнатній температурі. Після випарювання трифлуороцтової кислоти залишок вносять у насичений розчин карбонату натрію і водну фазу екстрагують двічі етилацетатом. Об'єднані органічні фази промивають до нейтральності насиченим розчином хлориду натрію, сушать над сульфатом натрію і концентрують. Хроматографування залишку на силікагелі (ДХМ/метанол/NН4ОН (95:5:0,1)) дає бажаний продукт (69%, 0,31г, Rf: 0,1). 4.3. 2-[4-(4-диметиламінофеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-іj]хінолін-6-он Хлорний інтермедіат (п.1,1) (0,2г, 0,969ммоль), 1мл триетиленглікольмонометилового етеру (ТГМЕ), лютидин (0,125мл, 1,07ммоль), флуорид цезію (0,148г, 0,969ммоль) і розчин похідної Прикладу 1.2 (0,219г, 1,07ммоль) у ТГМЕ (1мл) вносять у колбу з закругленим дном з конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С протягом 1,5год. і після охолодження додають воду. С уміш екстрагують двічі етилацетатом, органічні фази промивають двічі водою, суша ть над сульфатом натрію, фільтрують і концентрують. Залишок (0,38г) хроматографують на силікагелі (з етилацетатом), одержане масло (0,246г) вносять у невелику кількість ДХМ і кристалізують доданням етеру. Тверду речовину, що відповідає бажаній сполуці, (0,208г, 57%) фільтрують. LC-MS: МН+ =376. 1Н ЯМР (360МГц, δ 1/млн) ДМСО D6: 2,79 (з, 6Н), 3,0 (t, 2Н), 3,14 (т, 4Н), 3,55 (m, 4Н), 4,47 (t, 2H), 6,71 (d, 2H), 6,91 (d, 2H), 7,15 (dd, 1H), 7,35 (d, 1H),7,60(d, 1H). Приклад 5. 2-[4-(4-трет-бутоксикарбоніламінофеніл)піперазин-1-іл]-4,5-дигідроі-мідазо[4,5,1-ij]хінолін-6-он (R1, R2, R2' є Н, R3 є -, X - N, R4 - 4-трет-бутилоксикарбоніл-амінофеніл, n=m=1) (сполука 57) 5.1. 1-[2-(триметилсиліл)етилкарбоніл]-4-(4-нітрофеніл )піперазин Розчин 1-(4-нітрофеніл )піперазину (10г, 48,31ммоль) і 2-(триметилсиліл)етил-р-нітрофенілкарбонату (14,4г, 50,73ммоль) у ТГФ (220мл) витримують під зворотним холодильником 3год. з магнітним перемішуванням і потім перемішують 20год. при кімнатній температурі. Реакційну суміш концентрують, залишок вносять у ДХМ і органічну фазу промивають 4 рази 1N гідрохлоридом натрію і двічі водою. Органічну фазу суша ть над сульфатом натрію, фільтрують і концентрують; масляний залишок використовують без подальшого очищення у наступній операції (12г, 71%). 1Н ЯМР (300МГц, δ 1/млн) CDCI3: 0,04 (s, 9Н), 1,02 (m, 2Н), 3,43 (m, 4Н), 3,65 (m, 4Н), 4,22 (m, 2Н), 6,82 (d, 2Н), 8,13 (d, 2Н). 5.2. 1-[2-(триметилсиліл)етилкарбоніл]-4-(4-амінофеніл)піперазин Суміш нітропохідної, одержаної вище, (12г, 34,2ммоль) і 4-5 лопаточок нікелю Рейні у 300мл етанолу витримують у атмосфері гідрогену, при атмосферному тиску, протягом 18год., з енергійним магнітним перемішуванням. Після фільтрування і концентрування залишок використовують без подальшого очищення у наступній операці; одержаний продукт (вихід 50% згідно з ЯМР і LC-MS) важко очистити. 1Н ЯМР (300МГц, δ 1/млн) CDCI3: 0,04 (s, 9Н), 1,03 (m, 2H), 2,96 (m, 4H), 3,59 (m, 4H), 4,18 (m, 2H), ароматичні протони не можна призначити внаслідок наявності забруднень. 5.3. 1-[2-(триметилсиліл)етилкарбоніл]-4-(4-трет-бутоксикарбоніламінофеніл)-піперазин Сиру реакційну суміш з попередньої операції (оцінка - 31ммоль) і ди-трет-бутилдикарбонат (7,5г, 34,1ммоль) у ТГФ (50мл) вносять у колбу з закругленим дном з конденсатором і витримують під зворотним холодильником 44год. ТГФ випарюють, залишок вносять у суміш вода/етилацетат і органічну фазу промивають двічі водою. Органічну фазу сушать над сульфатом натрію і концентрують, залишок хроматографують на силікагелі (з дихлорметан/етилацетатом (1:1). Нечистий продукт використовують без подальшого очищення у наступній операції. LC-MS: MH+ =422. Щойно одержаний інтермедіат (3г, приблизно 7,12ммоль) і флуорид тетрабутиламонію (3,37г, 10,68ммоль) у ТГФ (60мл) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш витримують під зворотним холодильником 2год., концентрують і залишок вносять у воду з етилацетатом. Органічну фазу промивають двічі водою і насиченим розчином хлориду натрію, сушать над сульфатом натрію і концентрують. Бажану сполуку (0,99г, 50% у 3 операціях) одержують хроматографією на силікагелі з елюентом ДХМ/метанол/NН4ОН (90:10:0,1). 1Н ЯМР (300МГц, δ 1/млн) CDCI3: 1,50 (s, 9H), 3,04 (m, 8H), 6,60 (s, 1H), 6,87 (d, 2H), 7,23 (d, 2H). 5.5. 2-[4-(4-трет-бутоксикарбоніламінофеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-іj]хінолін-6-он Хлорний інтермедіат п.1.1 (0,7г, 3,39ммоль), ТГМЕ (7мл), лютидин (0,43мл, 3,73ммоль), флуорид цезію (0,514г, 3,39ммоль) і 1-(4-трет-бутоксикарбоніламінофеніл)-піперазин (1,03г, 3,73ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С протягом 2год., після охолодження додають воду і екстрагують двічі етилацетатом. Органічні фази промивають двічі водою, суша ть над сульфатом натрію, фільтрують і концентрують. Хроматографія залишку на силікагелі (елюент ДХМ/е тилацетат з градієнтом від 75:25 до 1:1) дає бажану сполуку, яку кристалізують у суміші ДХМ/етер, одержуючи тверду речовину (1,1г, 73%). LC-MS: MH+ =448. 1Н Я МР (500МГц, δ 1/млн) ДМСО D6: 1,45 (s, 9H), 3,00 (t, 2H), 3,22 (m, 4Н), 3,55 (m, 4Н), 4,47 (t, 2Н), 6,91 (d, 2Н), 7,15 (dd, 1Н), 7,33 (m, 2Н), 7,35 (d, 1H), 7,61 (d, 1H). Приклад 6. Дигідрохлорид 2-[4-(4-амінофеніл)піперазин-1-іл]-4,5-дигідроімідазо-[4,5,1-ij]хінолін-6-ону (R1, R2, R2 є Н, R3 є -, R4 - пара-амінофеніл , X - Ν, n=m=1) (сполука 50) Розчин газоподібного гідрохлориду у етанолі додають до сполуки Прикладу 5 (0,22г, 0,497ммоль) і реакційну суміш перемішують при кімнатній температур 2год. С уміш концентрують і після перетирання з етером одержують бажану сполуку у формі твердої речовини (0,155г, 80%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 3,06 (t, 2H), 3,63 (m,4Н), 3,84 (m, 4H), 4,65 (t, 2H), 7,10 (d, 2H), 7,26 (d, 2H), 7,36 (dd, 1H), 7,54 (d, 1H), 7,71 (d, 1H), 10,06 (широкий пік, 2Н). Приклад 7. 2-[4-(4-ацетамідофеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-он (R1, R2, R2' є Н, R3 є -, R4 - пара-ацетамідофеніл , X - Ν, n=m=1) (сполука 60) Сполуку Прикладу 6 (0,20г, 0,48ммоль) і триетиламін (80мкл, 0,572ммоль) додають до розчину оцтової кислоти (27мкл, 0,468ммоль) і карбонілдіімідазолу (0,152г, 0,936ммоль) у ДМФ (4мл). Реакційну суміш піддають магнітному перемішуванню при 70°С протягом 20год. Після випарювання ДМФ під вакуумом залишок вносять у воду, перетирають і тверду речовину відфільтровують. Промивання твердої речовини мінімальною кількістю ДХМ і етеру дає бажану сполуку (0,12г, 64%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 1,99 (s, 3Н), 3,00 (t, 2H), 3,25 (m, 4H), 3,55 (m, 4H), 4,48 (t, 2H), 6,94 (d, 2H), 7,15 (dd, 1Н), 7,35 (d, 1H), 7,44 (d, 2H), 7,61 (d, 1H), 9,70 (s, 1H). Приклад 8. Дигідрохлорид 2-(4-n-пропілпіперазин-1-іл)-4,5-дигідроімідазо[4,5,1-ij]-хінолін-6-ону (R1, R2, R2', R4 є Н, X - N, R3 - n-пропіл, n=m=1) (сполука 26) Інтермедіат формули (II) (п.1.1) (0,2г, 0,969ммоль), 1мл три-етиленглікольмонометилового етеру (ТГМЕ), лютидин (0,37мл, 3,30ммоль), флуорид цезію (0,148г, 0,969ммоль) і розчин N-пропілпіперазиндигідроброміду (0,296г, 1,18ммоль) у ТГМЕ (1мл) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С протягом 2год. 15хвил., після охолодження додають насичений розчин карбонату натрію і хлориду натрію і суміш екстрагують двічі етилацетатом. Органічні фази промивають двічі насиченим розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують. Залишок хроматографують на силікагелі з елюентом ДХМ/метанол/МН 4ОН (95:5:0,5) і одержану дигідрохлоридну сіль масла (0,203г) синтезують розчиненням у невеликій кількості ДХМ і доданням насиченого розчину газоподібного гідрохлориду у безводному етері. Тверду речовину, що відповідає бажаному продукту (0,23г), відфільтровують. LC-MS: MH+ =299. 1Н ЯМР (360 МГц, δ 1/млн) ДМСО D6: 0,94 (t, 3Н), 1,78 (m, 2Н), 3,08 (m, 4Н), 3,28 (m, 2Н), 3,62 (3,2Н), 3,88 (m, 2Н), 4,25 (m, 2Н), 4,65 (t, 2Н), 7,42 (t, 1Н), 7,60 (d, 1Н), 7,76 (d, 1 Η), 11,66 (s,1H). Приклад 9. 2-(4-трет-бутилоксикарбонілпіперазин-1-іл)-4,5-дигідроімідазо[4,5,1-ij]-хінолін-6-он (R1, R2, R2' є Н, R3 є -, X - N, R4 - трет-б утилоксикарбоніл, n=m=1) (сполука 12) Інтермедіат п.1.1 (0,25г, 1,2ммоль), ТГМЕ (1,5мл), лютидин (0,155мл, 1,33ммоль), флуорид цезію (0,184г, 1,21ммоль) і розчин трет-бутил-1-піперазинкарбоксилату (0,237г, 1,28ммоль) у ТГМЕ (1,5мл) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 120°С протягом 3год., після охолодження додають воду і цю суміш екстрагують двічі етилацетатом. Органічні фази промивають двічі водою, сушать над сульфатом натрію, фільтрують і концентрують. Залишок хроматорграфують на силікагелі з елюентом ДХМ/е тилацетат (1:1) і одержують бажану сполуку у формі твердої речовини (0,315г, 73%). LC-MS: MH+ =357. 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 1,51 (s, 9H), 3,07 (t, 2H), 3,46 (m, 4Н), 3,58 (m, 4Н), 4,52 (t, 2H), 7,23 (t, 1H), 7,43 (d, 1H), 7,68 (d, 1H). Приклад 10. Дигідрохлорид 2-(піперазин-1-іл)-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону (R1, R2, R2', R3, R4 є Н, X - Ν, n=m=1) (сполука 13) Насичений розчин газоподібного гідрохлориду у безводному етері додають до сполуки Прикладу 9 (0,1г, 0,28ммоль), заздалегідь розчиненій у мінімальній кількості метанолу, і суміш піддають магнітному перемішуванню при кімнатній температурі протягом ночі. Суміш концентрують і залишок кристалізують у суміші метанол/ДХМ, одержуючи бажану сполуку у формі твердої речовини (0,07г). LC-MS: MH+ =257.1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 3,12 (t, 2Н), 3,95 (m, 4Н), 3,94 (m, 4Н), 4,66 (t, 2H), 7,43 (t, 1H), 7,61 (d, 1H), 7,80(d, 1H), 9,63(s,2H). Приклад 11. Дигідрохлорид 2-(4-ацетилпіперазин-1-іл)-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону (R1, R2, R2' є Н, R3 є -, R4 - СОСН3, X - Ν, n=m=1) (сполука 15) Сполуку Прикладу 10 (0,085г, 0,26 ммоль) і триетиламін (75мкл, 0,52ммоль) додають до розчину оцтової кислоти (20мкл, 0,349ммоль), гідроксибензотриазолу (0,055г, 0,349ммоль) і діізопропілазодикарбоксилату (55мкл, 0,349ммоль) у ДХМ (5мл). Реакційну суміш піддають магнітному перемішуванню при кімнатній температурі протягом ночі і розбавляють етилацетатом і 1N розчином гідрохлоридної кислоти. Сирий продукт одержують звичайним кислотно-основним екстрагуванням і промиванням водою з подальшим висушуванням органічних фаз над сульфатом натрію і випарюванням. Хроматографія на силікагелі з елюентом ДХМ/етанол (95:5) дає бажану сполуку (0,04г). LC-MS: MH+ =299. 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,13 (s, 3Н), 3,08 (t, 2Н), 3,46 (m, 2Н), 3,52 (m, 2Н), 3,70 (m, 4Н), 4,54 (t, 2H), 7,23 (t, 1H), 7,43 (d, 1H), 7,68 (d, 1H). Приклад 12. Дигідрохлорид 2-[4-(4-піридил)піперазин-1-іл)-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону (R1, R2, R2' є Н, R3 є -, R4 - 4-піридил, X - Ν, n=m=1) (сполука 23) Інтермедіат п.1.1 (0,2г, 0,969ммоль), ТГМЕ (1мл), лютидин (125мкл, 0,969ммоль), флуорид цезію (0,148г, 0,969ммоль) і розчин 1-(4-піридил)піперазину (0,238г, 1,02ммоль) у ТГМЕ (1мл) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С протягом 1год. 50хвил., після охолодження додають розчин карбонату натрію і твердого хлориду натрію і суміш екстрагують двічі етилацетатом. Органічні фази промивають двічі насиченим розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують. Залишок хроматографують на силікагелі з елюентом ДХМ/метанол/МН4ОН (95:5:0,5) і одержують бажану сполуку у формі твердої речовини (0,071г). LCMS: MH+ =334.1Н ЯМР (360МГц, δ 1/млн) ДМСО D6: 3,01 (t, 2H), 3,58 (m, 8H), 4,51 (t, 2H), 6,91 (d, 2H), 7,18 (t, 2H), 7,37 (d, 1Н), 7,63 (d, 1H), 8,20 (d,2H). Приклад 13. Дигідрохлорид 2-(4-бензилпіперидин-1-іл)-4,5-дигідроімідазо[4,5,іj]-інолін-6-ону (R1, R2, R2', R3 є Н, R4 - бензил, X - С, n=m=1) (сполука 1) Інтермедіат п.1.1 (0,206г, 1ммоль), розчинений у безводному толуолі (8мл), трет-бутоксид калію (0,157мг, 1,4ммоль), 2,2'-біс(дифенілфосфін)-1,1'-бінафтил (0,04г, 0,06ммоль), ацетат паладію (II) (0,009г, 0,04ммоль) і розчин N-бензилпіперазину (0,21г, 1,2ммоль) у толуолі (2мл) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням у атмосфері нітрогену. Реакційну суміш гріють при 85°С протягом ночі, охолоджують, розбавляють етилацетатом і промивають водою (тричі) і насиченим розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують. Залишок хроматографують (0,24г, ДХМ/е тилацетат (8:2)) і одержують бажаний продукт (0,075г). LC-MS: МН+ =346.1Н Я МР (360МГц, δ 1/млн) ДМСО D6: 1,37 (m, 1Н), 1,67 (broad d, 1H), 1,80 (m, 1H), 2,58 (d, 1H), 2,84-3,00 (t, 2H і m, 1H), 3,81 (broad d, 1H), 4,40 (t, 2H), 7,12 (t, 1H), 7,20 (m, 3H), 7,26-7,37 (m, 1H і d, 1H), 7,5 (d, 1H). Приклад 14. 1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-феніл-4-піперидинкарбоксамід(R1, R2, R2' - Η, R3 є CONH2, R4 - феніл, X - С, n=m=1) (сполука 43) 14.1. Сполука формули (III): 4-феніл-піперидин-4-карбоксамід Цю сполуку отримують синтезом, описаним у літературі (Bioorg. Med. Chem. Lett. 7(19), 1997, 2531-2536). 14.2. 1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-феніл-4-піперидин-карбоксамід 300мг сполуки (II) (п.1.1), 5мл ДМФ, 70мг флуориду калію, 0,2мл 2,6-лютидину і 510мг сполуки (IV), описаної вище, вносять у 50-мілілітрову тригорлу колбу під нітрогеном. Суміш перемішують 4год. при 140°С і випарюють від високим вакуумом. Залишок хроматографують на силікагелі (70-200мкм) з сумішшю 2% метанолу у ДХМ. Одержаний продукт рекристалізують з мінімальної кількості гарячого ацетону і одержують 270мг білих кристалів. Спектр ЯМР відповідає бажаному продукту: 1Н ЯМР (200МГц, δ 1/млн) ДМСО D6: 2,0 (m, 2Н), 2,5 (m,2Н), 3,0 (t, 2Н), 3,2-3,8 (m, 4Н), 4,45 (t, 2H), 7,0-7,5 (m, 10Н). Приклад 15. Дигідрохлорид 1-(6-оксо-5,6-дигідро-4Н-імідазо[4,5,1-ij]хінолін-2-іл)-4-феніл-4-амінопіперидину (R1, R2, R2' є Н, R3 - NH 2, R4 - феніл, X - С, n=m=1) (сполука 46) 4мл концентрованого водного розчину гідрохлоридної кислоти додають до сполуки 42 з таблиці (0,53г, 1,21ммоль), приготовленої, як це було описано вище і заздалегідь розчиненої у 5мл метанолу, і піддають магнітному перемішуванню при кімнатній температурі протягом 30хвил. Суміш концентрують під вакуумом, залишок вносять у абсолютний етанол і випарюють до сухості, одержуючи бажану сполуку у формі твердої речовини (0,45г). 1Н ЯМР (200МГц, δ 1/млн) ДМСО D6: 2,4-2,8 (m, 4Н), 3,1 (t, 2Н), 3,7 (m, 2Н), 4,2 (m, 2Н), 4,8 (t, 2Н), 7,4-7,8 (m, 8Н), 9,0 (s, 2H). Приклад 16. 2-[4-(4-гідроксифеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-іj]хінолін-6-он (R1, R2, R2' є Н, R3 є -, X - N, R4 - 4-гідроксифеніл, n=m=1) (сполука 71) 16.1. Етиленекеталь 2-хлор-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону Розчин інтермедіату п.1.1 (0,6г, 2,9ммоль) у 1,2-дихлоретані (10мл), етиленгліколь (0,216г, 3,49ммоль), ртолуолсульфонову кислоту (0,01г) і триметилортоформат (0,372г, 3,49ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням і додають 13мл 1,2-дихлоретану. Суміш витримують під зворотним холодильником 24год., додають таку ж кількість реагентів (етиленгліколь, ртолуолсульфонова кислота і триметилортоформат) і суміш гріють ще 8год. Після випарювання розчинника залишок вносять у етилацетат, промивають розбавленим розчином карбонату натрію і водою, органічну фазу сушать і випарюють до сухості. Залишок хроматографують на силікагелі з градієнтним елююванням (чистой ДХМ - ДХМ/етилацетат (96:4) і одержують бажану сполуку (0,54г, 74%). МН+ =251. 16.2. Приготування етиленкеталю 2-[4-(4-бензилоксифеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1ij]хінолін-6-ону Інтермедіат п.16.1 (0,54г, 2,16ммоль), ТГМЕ (3мл), лютидин (277мкп, 2,38ммоль), флуорид цезію (0,328г, 2,16ммоль) і 1-(4-бензилоксифеніл)піперазин (0,725г, 2,38ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 100°С 3год., додають лютидин (300мкл, 2,57ммоль) і гріють при 120°С 8год. Суміш о холоджують, додають воду і екстрагують двічі етилацетатом. Органічні фази промивають двічі водою, сушать над сульфатом натрію, фільтрують і концентрують. Залишок двічі очищують хроматографією на силікагелі з градієнтним елююванням (ДХМ/е тилацетат з градієнтом від 90:10 до 40:60 і ДХМ/етилацетат з градієнтом від 0:100 до 95:5).і одержують бажану сполуку забруднену приблизно на 50% кетоном, утвореним гідролізом кетальної функції (0,365г). LCMS: МН+ =483, МН+ =439. 16.3. Приготування етиленкеталю 2-[4-(4-гідроксифеніл)-піперазин-1-іл]-4,5-дигідро-імідазо[4,5,1-ij]хінолін6-ону Суміш сполуки Прикладу 16.2 (0,365г), етанолу (60мл), ДХМ (приблизно 0,5мл) і 10% паладію на вугіллі (0,04г) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням у атмосфері гідрогену протягом 17год. при кімнатній температурі. Після фільтрування і випарювання розчинника залишок хроматографують на силікагелі (градієнт від ДХМ до ДХМ/метанол (94:6)) і одержують бажаний продукт (0,132г). 1Н ЯМР (300МГц, δ 1/млн) ДМСО D6: 2,2 (t, 2H), 3,13 (m, 4H), 3,46 (m, 3H), 4,08-4,20 (m, 4Н), 4,21 (t, 2Н), 6,68 (dd, 2Н), 6,86 (dd, 2Н), 7,04 (m, 2Н), 7,32 (m, 1Н), 8,91 (s, 1H). 16.4. Приготування 2-[4-(4-гідроксифеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-ij]хінолін-6-ону 2-[4-(4-гідроксифеніл)піперазин-1-іл]-4,5-дигідроімідазо[4,5,1-іj]хінолін-6-он (0,055г, 0,14ммоль) розчиняють у 11мл ТГФ і додають 3,6мл водного 5%-го розчину гідрохлоридної кислоти. Суміш піддають магнітному перемішуванню 16год. при кімнатній температурі і 2год. при 50°С. Після розбавлення водою суміш підлужують бікарбонатом натрію, екстрагують двічі етилацетатом і органічні фази сушать над сульфа том натрію. Після звичайної обробки залишок очищують хроматографією на силікагелі (градієнт - від ДХМ до ДХМ/метанол (94:6)) і одержують бажаний продукт (0,027г, 55%). 1Н Я МР (500МГц, δ 1/млн) ДМСО D6; 2,99 (t, 2H), 3,13 (m,4Н), 3,53 (m, 4H) , 4,47 (t, 2H), 6,67 (d, 2H), 6,85 (d, 2Н), 7,15 (t, 1H), 7,34 (d, 1H), 7,60 (d, 1H), 8,88 (s, 1H). Приклад 17. 2-[4-(4-флуор феніл)піперазин-1-іл]-4,5-дигідро-9-метилімідазо[4,5,1-ij]-хінолін-6-он (R1 - 9СН3, R2, R2' є Н, R3 є -, X - N, R4 - 4-флуорфеніл, n=m=1) (сполука 84) Інтермедіат п.1.4 (0,2г, 0,907ммоль), ТГМЕ (2мл), лютидин (0,116мл, 0,998ммоль), флуорид цезію (0,138г, 0,907ммоль) і 4-флуорфенілпіперазин (0,180г, 0,998ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С 3год. і після охолодження додають воду і екстрагують двічі етилацетатом. Органічні фази промивають двічі водою, сушать над сульфатом натрію, фільтрують і концентрують . Залишок хроматографують на силікагелі (градієнт - від чистого ДХМ до ДХМ/метанол (98:2)) і одержують бажану сполуку у формі твердої речовини (0,206г, 62%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,50 (s, 3H), 2,97 (t, 2Н), 3,28 (m, 4Н), 3,54 (m, 4Н), 4,45 (t, 2Н), 7,05 (m, 5Н), 7,29 (d, 1H). Приклад 18. 1-[4-(4-флуорфеніл)піперазин-1-іл]-3-метил-8,9-дигідро-7Н-2,9а-діазабензо[сd]азулен-6-он (R1 - 3-СН3, R2, R2' є Н, R3 є -, X - N, R4 - 4-флуорфеніл, n=2, m=1) (сполука 85) 1-хлор-3-метил-8,9-дигідро-7Н-2,9а-діазабензо[сd]азулен-6-он (0,2г, 0,852ммоль), ТГМЕ (2мл), лютидин (0,109мл, 0,937ммоль), флуорид цезію (0,130г, 0,852ммоль) і 4-флуорфенілпіперазин (0,169г, 0,937ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С 3,5год. і після охолодження додають воду і екстрагують двічі етилацетатом. Залишок хроматографують на силікагелі (градієнт - від чистого ДХМ до ДХМ/метанол (60:40)) і одержують бажану сполуку у формі твердої речовини (0,137г, 42%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,20 (m, 2Н), 2,53 (s, 3Н), 3,04 (m, 2Н), 3,30 (m, 4Н), 3,40 (m, 4Н), 4,25 (m, 2Н), 7,07 (m, 5Н), 7,61 (d,1H). Приклад 19. 2-[4-(4-флуор феніл)піперазин-1-іл]-4,5-дигідро-7-метилімідазо[4,5,1-ij]-хінолін-6-он (R1 - 7СН3, R2, R2' - Н, R3 є -, X - N, R4 - 4-флуорфеніл, n=m=1) (сполука 83) 2-хлор-4,5-дигідро-7-метилімідазо[4,5,1-ij]хінолін-6-он (0,245г, 1,1ммоль), ТГМЕ (2,5мл), лютидин (0,161мл, 1,21ммоль), флуорид цезію (0,167г, 1,1ммоль) і 4-флуорфенілпіперазин (0,219г, 1,1ммоль) вносять у колбу з закругленим дном, обладнану конденсатором, з магнітним перемішуванням. Реакційну суміш гріють при 140°С 2,5год. і після охолодження додають воду і екстрагують двічі етилацетатом. Залишок хроматографують на силікагелі (градієнт - від чистого ДХМ до ДХМ/метанол (60:40)) і одержують бажану сполуку у формі твердої речовини (0,26г, 65%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,59 (s, 3Н), 2,98 (t, 2Н), 3,26 (m, 4Н), 3,49 (m, 4Н), 4,42 (t, 2Н), 6,94 (d, 1Н), 7,05 (m, 4Н), 7,50 (d,1H). Приклад 20. 2-[4-(4-флуор феніл)піперазин-1-іл]-4,5-дигідро-8-метилімідазо[4,5,1-ij]-хінолін-6-он (R1 - 8СН3, R2, R2' є Н, R3 є -, X - N, R4 - 4-флуорфеніл, n=m=1) (сполука 82) Цю сполуку готують, яку Прикладі 19, з 1/2 суміші 2-хлор-4,5-дигідро-8-метилімідазо-[4,5,1-ij]хінолін-6-ону і 2-хлор-4,5-дигідро-7-метилімідазо[4,5,1-ij]хінолін-6-ону. Після хроматографування на силікагелі дві послідовні кристалізації дають бажаний ізомер, забруднений лише 4% іншого ізомеру (0,053г, вихід хорошого ізомеру 48%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,40 (в, 3Н), 2,98 (t, 2Н), 3,26 (m, 4Н), 3,55 (m, 4Н), 4,45 (t, 2Н), 7,06 (m, 4Н), 7,18 (s, 1H), 7,44 (s, 1H). Приклад 21. 2-[4-(4-флуорфеніл)піперазин-1-іл]-4,5-дигідро-7-метоксиімідазо[4,5,1-ij]-хінолін-6-он (R1 - 7ОСН3, R2, R2' є Н, R3 є -, X - N, R4 - 4-флуорфеніл, n=m=1) (сполука 81) Цю сполуку готують, як у Прикладі 19, з 2-хлорпіперазин-1-іл-4,5-дигідро-7-метоксиімідазо[4,5,1-ij]хінолін6-ону (29%). 1Н ЯМР (500МГц, δ 1/млн) ДМСО D6: 2,89 (t, 2Н), 3,26 (m, 4Н), 3,44 (m, 4Н), 3,81 (s, 3Н), 4,36 (t, 2Н), 6,79 (d, 1Н), 7,06 (m, 4Н), 7,58 (d, 1Н). Наведена далі таблиця ілюструє хімічні структури і фізичні властивості сполук винаходу загальної формули (І). Залежно від того, чи n=1 або 2 у цій формулі дві сполуки формули (І) мають різні нумерації атомів на бензімідазольному ядрі. У цій таблиці: НСІ - гідрохлорид, CF3CO2H - три флуорацетатна сіль, а "-" репрезентує сполуку у вільній формі, Me, Et, n-Pr і tBu репрезентують, відповідно, метильну, етильну, n-пропільну і трет-бутильну гр упи, Вn і Ph репрезентують, відповідно, бензильну і фенільну групи, Якщо не вказано інше, ЯМР відповідає протонним ЯМР і вимірювання проводили у d6-ДМСО. * і ** означають вимірювання, відповідно, при 360МГц і при 500МГц. Якщо такі позначення відсутні, це означає вимірювання при 200МГц. Таблиця Сполуки винаходу були піддані фармакологічним тестам для визначення інгібуючої дії на PARP або полі(АDР-рибоза)полімеразу. Сполуки винаходу були піддані таким випробуванням: Дія сполуки на ферментативну активність PARP Рекомбінантну людську PARP-1 (hPARP-1) продукують клітини Sf9, використовуючи бакуловірусну систему експресії (Giner et al., Gene (1992), 114, 279-283). Фермент у частково чистій формі був одержаний з клітинного екстракту після осадження 70%-м сульфатом амонію. Одержаний розчин hPARP-1 був здатний генерувати 0,5-0,7нмоль нікотинаміду з NAD+ в стандартних умовах тесту, описаних нижче. Сполуки, що підлягали тестуванню, були розчинені в інкубаційному середовищі, яке містило 50мM Tris-HCI, 10мМ МgСІ2, 20мкМ ацетату цинку, 1,5мМ дитіотреїтолу, 0,2мкг гістону і 0,1мкг олігонук-леотиду (GGAATTCC) на 100мкл, у присутності частково очищеної hPARP-1, буферованої до рН8. Ферментативну реакцію ініціювали доданням NAD+ (0,2мМ) і вели спостереження при кімнатній температурі протягом 20хвил. Реакцію припиняли доданням НСЮ4 (1,2М) при 4°С. Після центрифугування надосадову рідину аналізували ВЕРХ (колонка Shandon Ultrabase C8). Ізократичне елюювання здійснювали з використанням фосфатного буфера (0,1М) (рН4,5), що містив 6% ацетонітрилу, який вводили з швидкістю 1,25мл/хвил. протягом 6хвил. Утворений нікотинамід виявляли вимірюванням поглинання ултрафіолету (265нм) елюатом з квантуванням відносно піку, зумовленого зовнішнім стандартним нікотинамідом (2нмоль). Залишкову активність hPARP-1 виміряли у присутності сполуки виназоду різних концентрацій і порівнювали з відповідними даними одержаними за її відсутності. Всі вимірювання проводили щонайменше двічі і значення ІС 50 обчислювали з використанням сигмоїдної залежності дії від дози. Цей тест показав, що найактивніші сполуки мали мали ІС 50 у межах 5-500 нМ. Крім того, сполуки винаходу діяли на PARP-2, причому найактивніші до цього ферменту сполуки також мали ІС 50 У межах 5-500нМ. Отже, було виявлено, що сполуки винаходу є селективними інгібіторами PARP, зокрема PARP-1 і PARP-2. Таким чином, сполуки згідно з винаходом можуть бути використані для приготування медичних продуктів, зокрема, інгібіторів PARP. Такі продукти можуть знайти застосування у терапії, зокрема, для профілактики або лікування інфаркту міокарду, серцевої ішемії, серцевої недостатності, атеросклерозу, рестенозу після РТС або операції шунтування, церебральної ішемії і церебрального інфаркту, викликаного ішемією, травмою або тромбоемболією, таких нейродегенеративних захворювань, як хвороба Паркінсона, хвороба Альцгеймера і хорея Хантингтона, гострої ниркової недостатності, зокрема, ішемічного походження або після пересадки нирки, лікування відторгнення після пересадки серця, прискореного атеросклерозу, запалювальних патологій, імунологічних розладів, ревматоїдних хвороб, діабету і панкреатиту, септичного шоку, гострого синдрому порушення дихання, пухлин і метастазів, аутоімунних хвороб, СНІДу, гепатиту, псоріазу, васкуліту, виразкового коліту, множинного склерозу і міастенії. Отже, сполуки формули (І) згідно з винаходом можуть бути використані для приготування медичних продуктів, придатних для лікування і профілактики розладів, пов'язаних з ферментом PARP. Іншим об’єктом винаходу є використання сполуки формули (І), у якій R1, R2, R2', R3 є Н, X - С, n=m=1 і R4 - 4-імідазолільна або 5-метил-4-імідазолільна група, для приготування медичного продукту, придатного для лікування і профілактики розладів, пов'язаних з ферментом PARP. Винахід стосується також фармацевтичних композицій, у склад яких як активний агент входить сполука винаходу. Ці фармацевтичні композиції містять ефективну дозу сполуки винаходу і один або більше фармацевтично придатних наповнювачів. Зазначені заповнювачі вибирають відповідно до бажаної фармацевтичної форми і способу введення. У фармацевтичних композиціях згідно з винаходом для перорального, під'язичного, підшкірного, внутрішньом'язового, внутрішньовенного, локального, внутрішньотрахеального, внутрішньоназального, трансдермального або ректального введення, активний агент формули (І) або, можливо, його сіль або гідрат, можна вводити у формі одиничних доз у суміші з фармацевтично придатними наповнювачами тваринам і людині для профілактики або лікування наведених ви ще розладів або хвороб. Одиничні дозовані форми включають такі форми для перорального введення, як таблетки, капсули, порошки, гранули і розчини або суспензії, і форми для під'язичного, букального, внутрішньотрахеального і внутрішньоназального, підшкірного, внутрішньом'язового, внутрішньовенного і ректального введення. Сполуки згідно з винаходом можна затосовувати у вигляді кремів, мазей або лосьйонів. Щоденна доза активного агента може становити від 0,1 до 1000мг/кг при оральному, парентеральному або ректальному введенні. У деяких випадках можуть виявитись необхідними менші або більші дози і такі дози також входять в об'єм винаходу. Звичайно дозу для кожного пацієнта визначає лікар з урахуванням способу введення, маси і реакції пацієнта. При використанні твердої композиції у формі таблеток активний інгредієнт змішують з фармацевтичним наповнювачем, наприклад, желатином, крохмалем, лактозою, стеаратом магнію, тальком, гуміарабіком тощо. Таблетки можуть бути покриті сахарозою, похідними целюлози або іншими матеріалами. Таблетки можуть бути виго товлені різними способами, наприклад, прямим пресуванням, сухим гранулюванням або гарячим плавленням. Препарати у формі гелевих капсул виготовляють змішуванням активного інгредієнта з розріджувачем і вливанням цієї суміші у м'які або жорсткі капсули. Для парентерального введення можуть бути застосовані водні суспензії, ізотонічні фізіологічні розчини або стерильні розчини для ін'єкцій, які містять фармакологічно сумісні диспергенти і/або змочуючі добавки, наприклад, пропіленгліколь або бутиленгліколь. Ще одним об'єктом винаходу є спосіб лікування наведених вище патологій шляхом введення сполуки винаходу або її фармацевтично прийнятної солі.
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives, preparation thereof and therapeutic application
Автори англійськоюBarth Francis
Назва патенту російськоюПроизводные бензимидазола, их получение и терапевтическое применение
Автори російськоюБарт Франси
МПК / Мітки
МПК: A61P 21/04, A61K 31/4745, C07D 471/06, A61P 17/06, A61P 9/00, A61K 31/497, A61P 25/14, A61P 3/10, A61P 25/28, A61P 13/12, A61P 37/06, C07D 487/06, A61P 9/10, A61K 31/506, A61P 1/16, A61P 7/02, A61P 35/00, A61P 9/04, A61P 25/00, A61P 11/00, A61P 37/00, A61P 35/04, A61P 25/16, A61P 1/04, A61P 1/18, A61P 29/00, A61K 31/55, A61P 9/14, A61P 31/18
Мітки: застосування, отримання, бензимідазолу, терапевтичне, похідні
Код посилання
<a href="https://ua.patents.su/20-72813-pokhidni-benzimidazolu-kh-otrimannya-ta-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні бензимідазолу, їх отримання та терапевтичне застосування</a>