Спосіб одержання 2,4-дисульфоніл-5-циклоамінозаміщених тіазолів
Номер патенту: 85752
Опубліковано: 25.11.2013
Автори: Василенко Олександр Миколайович, Туров Костянтин Володимирович, Броварець Володимир Сергійович, Виноградова Тетяна Костянтинівна, Бабій Сергій Богданович, Зябрєв Володимир Стефанович
Формула / Реферат
Спосіб одержання 2,4-дисульфоніл-5-циклоамінозаміщених тіазолів загальної формули А і їх солей
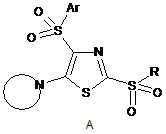
Ar=p-MeC6H4, P-ClC6H4;
R=Me, Et, Pr, Bn, HOCH2CH2, ![]() , cyclo-C6H11, Ph, p-MeC6H4, p-СlС6Н4;
, cyclo-C6H11, Ph, p-MeC6H4, p-СlС6Н4;
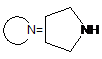 ,
, 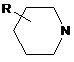 (R=H, 2-Ме, 2-Et, 3-Ме, 4-Ме, 4-Bn, 4-(CH2)4NCH2CH2, 3-EtOCO, 4-NH2CO, 4-HO),
(R=H, 2-Ме, 2-Et, 3-Ме, 4-Ме, 4-Bn, 4-(CH2)4NCH2CH2, 3-EtOCO, 4-NH2CO, 4-HO),
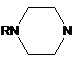 (R=Н, Me, Et, Bn, HOCH2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO,
(R=Н, Me, Et, Bn, HOCH2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO, 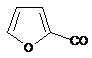 ),
),
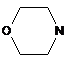 ,
, 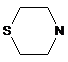 ,
, 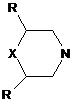 (X=CH2, R=Me; X=O; R=Me, MeO),
(X=CH2, R=Me; X=O; R=Me, MeO), 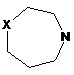 (X=CH2, NH, MeN),
(X=CH2, NH, MeN),
 ,
, 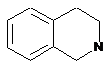 ,
,
що включає різні підходи в залежності від будови замісника R: I®II®III®IV®V®A, якщо R=Me, Et, Pr, Bn; I®II®IV®V®A, якщо R=HOCH2CH2, ![]() , cyclo-C6H11, Ph, р-MeC6H4, р-ClC6H4; I®III®IV®V®A, якщо R=Me:
, cyclo-C6H11, Ph, р-MeC6H4, р-ClC6H4; I®III®IV®V®A, якщо R=Me:
 .
.
Текст
Реферат: Спосіб одержання 2,4-дисульфоніл-5-циклоамінозаміщених тіазолів і їх солей включає різні підходи в залежності від будови замісника. UA 85752 U (12) UA 85752 U UA 85752 U Корисна модель належить до області синтезу органічних речовин та фармацевтичних препаратів. Предметом його є похідні тіазолу загальної формули А і їх солі, які можуть бути використані як протиракові засоби. Ar O S O N N R S S O O A Аr=р-МеС6Н4, р-СlС6H4; 5 R=Me, Et, Pr, Bn, HOCH2CH2, NCH2CH2 , cyclo-C6H11, Ph, p-MeC6H4, p-СlС6Н4; R N NH N= (R=H, 2-Ме, 2-Et, 3-Ме, 4-Ме, 4-Bn, 4-(CH2)4NCH2CH2, 3 , EtOCO, 4-NH2CO, 4-HO), RN N (R=Н, Me, Et, Bn, HOCH2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO, CO O 10 ), R X O N S N X N N , R , (X=CH2, R=Me; X=O; R=Me, MeO), (X=CH2, NH, MeN), O N N O 15 , . Серед органічних речовин, структури яких включають тіазольний цикл з сульфонільною групою в положенні 2, відомі сполуки Б і В як селективні інгібітори ізоформи р110 кінази РІ3, що мають протипухлинні властивості. Сполука Б пригнічує ріст ракових клітин ліній А375 і HeLa [1], а сполука В - ліній NZB5 і NZOV9 [2]. N N NO2 NO2 N N Cl N HCl S Б N Br S O O S Me B , S O O . 20 Про сполуки з 4-сульфонілзаміщеним тіазольним циклом, що виявляють антиракову активність, повідомлень немає. Відсутні також публікації, що містять відомості про будь-які фармакологічні властивості похідних тіазолу з двома сульфонільними групами. 1 UA 85752 U Відомим є метод синтезу двох представників структури А, заснований на циклізації 1-тозил2,2-дихлороетенілізотіоціанату з бензилмеркаптаном або n-тіокрезолом в присутності піридину (схема 1) [3]. Недоліком цього методу є необхідність роботи з меркаптанами, що особливо незручно при введенні в положення 2 тіазольного кільця нижчих алкілсульфонільних груп. 5 Ts Ts C Cl Ts S N RSH, Py N Cl SR S Cl N H2O2 Cl S O(CH2CH2)2NH SO2R Ts N N S O SO2R R=Bn, p-MeC6H4 Схема 1 10 Задача даної корисної моделі - розробити спосіб одержання 2,4-дисульфоніл-5циклоамінозаміщених тіазолів, що придатні для застосування як антиракові препарати. Задача даної корисної моделі вирішується наступним: Спосіб одержання 2,4-дисульфоніл-5-циклоамінозаміщені тіазоли загальної формули А і їх солі Ar O O S N N S S R O O A Аr=р-МеС6Н4, р-СlС6H4; 15 R=Me, Et, Pr, Bn, HOCH2CH2, NCH2CH2 , cyclo-C6H11, Ph, p-MeC6H4, p-СlС6Н4; R N NH N= (R=H, 2-Ме, 2-Et, 3-Ме, 4-Ме, 4-Bn, 4-(CH2)4NCH2CH2, 3-EtOCO, 4 , NH2CO, 4-HO), RN N (R=Н, Me, Et, Bn, HOCH2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO, O CO ), R X O N S , 20 N X N , R (X=CH2, R=Me; X=O; R=Me, MeO), NH, MeN), 2 N (X=CH2, UA 85752 U O N O N , , що включає різні підходи в залежності від будови замісника R: IIIIIIIVVA, якщо NCH2CH2 R=Me, Et, Pr, Bn; IIIIVVA, якщо R=HOCH2CH2, р-ClC6H4; IIIIIVVA, якщо R=Me. , cyclo-C6H11, Ph, р-MeC6H4, 5 ArSO2 Cl Cl N Cl Cl S III RHlg SNa Cl Na2S II RSH ArSO2 Base N S N Cl ArSO2 N C Cl (H2N)2CS I 2 Na2S ArSO2 Cl ArSO2 [O] SR S NH N Cl S V IV SO2R ArSO2 N N S SO2R A 10 15 В основі даної корисної моделі лежить новий спосіб отримання сполук загальної формули А, що включає три підходи, представлених на схемі 2. Для їх реалізації спочатку синтезуються ациклічні реагенти 1-5, ключовими з яких є хлоровмісні 2-азабута-1,3-дієни 4 і вінілізотіоціанати 5. Суть нового методу полягає в циклоконденсації реагентів 4 або 5 з сульфідом натрію в мольному співвідношенні, відповідно, 1:2 або 1:1, що приводить до натрієвих солей 2меркаптотіазолів 6. Останні при дії алкіл- або бензилгалогенідів дають сполуки 7. Ті ж похідні тіазолу 7, які містять в положенні 2 циклогексил- або арилтіогрупи зручніше отримувати безпосередньо із ізотіоціанатів 5. Для окиснення 78 використовується, як правило, надлишок пероксиду водню в оцтовій кислоті, а для нуклеофільного заміщення 8А - два еквіваленти аміну. 3 UA 85752 U O Cl Cl N H Cl ArSO2 Cl ArSO2 H +M Cl Cl 1 ArSO2 Cl Cl Cl Cl 2 Cl ArSO2 Cl N Et3N Cl Cl ArSO2 N (H2N)2CS Cl Cl 3 ArSO2 S 6 N Cl Na2S 5 Base ArSO2 N RHlg SNa S RSH ArSO2 N C Cl 4 2 Na2S Cl PCl5 H N H Cl Cl O Cl [O] SR S NH N Cl S 8 7 SO2R ArSO2 N N S SO2R A Схема 2 5 Тестування сполук A in vitro показало, що деякі з них проявляють виражену антиракову активність з концентраційним параметром GI50 в мікромолярному діапазоні стосовно 60 ліній ракових клітин людини. Корисна модель підтверджується наведеними нижче прикладами. 1. Синтез сполук А 2-(Метилсульфоніл)-5-(піролідин-1-іл)-4-тозилтіазол (А1). Ts N N S Ms 10 15 20 25 30 1.2-(Метилтіо)-4-тозил-5-хлоротіазол (7а). Метод А. До суспензії 151,31 г (0,63 моль) наногідрату сульфіду натрію в 300 мл етанолу додавали порціями 104,11 г (0,30 моль) 3-тозил-1,1,4,4-тетрахлор-2-азабута-1,3-дієн (4а) [4] при охолодженні до 5-10 °С і перемішуванні протягом 1 год. Суміш перемішували ще 3 год., а потім додавали до неї по краплях 20,55 мл (0,33 моль) метилйодиду при 8-10 °C протягом 2,5 год. Реакційну суміш розбавляли 300 мл води, декантували, до смолоподібного залишку додавали 60 мл ізопропанолу і після закінчення кристалізації сполуку 7а відфільтровували; вихід 70 % (66,81 г). Метод Б. До суспензії 47,32 г (197 ммоль) наногідрату сульфіду натрію в 200 мл етанолу додавали порціями 56,74 г (184 ммоль) 1-тозил-2,2-дихлороетенілізотіоціанат (5а) [4] при охолодженні до 5-10 °C і перемішуванні протягом 1 год. Суміш перемішували ще 2 год., а потім додавали до неї по краплях розчин 12,8 мл (202 ммоль) метилйодиду в 20 мл етанолу при 1015 °C протягом 2,5 год. Реакційну суміш розбавляли 300 мл води і сполуку 7а відфільтровували; вихід 99 % (58,06 г). 1 Безбарвні кристали, т. пл. 98 °C (МеОН) [3 (т. пл. 94-95 °C)]. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,41 (с, 3Н), 2,65 (с, 3Н), 7,49 (д, J=8,2 Гц, 2Н), 7,87 (д, J=8,2 Гц, 2Н). 2. 2-(Метилсульфоніл)-4-тозил-5-хлоротіазол (8а). До суспензії 13,97 г (43,7 ммоль) сполуки 7а в 45 мл оцтової кислоти додавали 12 мл 35 %-ного водного розчину пероксиду водню, суміш нагрівали до кипіння 1 год., потім додавали до неї ще 6 мл 35 %-ного водного розчину 4 UA 85752 U 5 10 пероксиду водню, кип'ятили 0,5 год., охолоджували до кімнатної температури і відфільтровували осад сполуки 8а; вихід 89 % (13,70 г). Безбарвні кристали, т. пл. 179 °C 1 (АсОЕt). Спектр ЯМР Н (400 МГц, CDC13), , м. ч.: 2,46 (с, 3Н), 3,33 (с, 3Н), 7,38 (д, J=8,4 Гц, 2Н), 7,96 (д, J=8,4 Гц, 2Н). 3. Суміш 1,58 г (4,5 ммоль) сполуки 8а і 0,83 мл (10 ммоль) піролідину в 30 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився, відфільтровували, промивали водою і отримували 1,28 г (74 %) сполуки А1. З фільтрату розчинник видаляли у вакуумі, залишок промивали ізопропанолом і отримували додатково 0,19 1 г сполуки А1; загальний вихід 85 %. Безбарвні кристали, т. пл. 212 °C розкл. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,01 (т, J=6,5 Гц, 4Н), 2,41 (с, 3Н), 3,24 (с, 3Н), 3,54 (т, J=6,5 Гц, 4Н), 7,43 (д, J=8,1 Гц, 2Н), 7,78 (д, J=8,3 Гц, 2Н). 5-(4-Бензилпіперідин-1-іл)-2-(метилсульфоніл)-4-тозилтіазол (А2). Ts N N Ms S Bn 15 20 Сполуку А2 отримували з 1,06 г (3,0 ммоль) сполуки 8а (див. приклад А1) і 1,16 мл (6,6 ммоль) 4-бензилпіперидину подібно сполуці А1; вихід 95 % (1,39 г). Безбарвні кристали, т. пл. 1 142 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,31-1,47 (м, 2Н), 1,62-1,80 (м, 3Н), 2,41 (с, 3Н), 2,58 (д, J=7,0 Гц, 2Н), 2,99 (т, J=11,3 Гц, 2Н), 3,30 (с, 3Н), 3,64 (д, J=12,0 Гц, 2Н), 7,17-7,24 (м, 3Н), 7,28-7,34 (м, 2Н), 7,44 (д, J=8,0 Гц, 2Н), 7,80 (д, J=8,3 Гц, 2Н). 2-(Метилсульфоніл)-4-тозил-5-(4-фенілпіперазин-1-іл)тіазол (A3). Ts N N Ph 25 30 Ms S N Сполуку A3 отримували з 1,23 г (3,5 ммоль) сполуки 8а (див. приклад А1) і 1,18 мл (7,7 ммоль) 1-фенілпіперазину подібно сполуці А1; вихід 85 % (1,42 г). Кремовий порошок, т. пл. 1 167 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,39 (с, 3Н), 3,29-3,32 (м, 4Н), 3,32 (с, 3Н), 3,43-3,54 (м, 4Н), 6,82 (т, J=7,2 Гц, 1H), 6,99 (д, J=8,5 Гц, 2Н), 7,24 (т, J=7,9 Гц, 2Н), 7,45 (д, J=8,2 Гц, 2Н), 7,84 (д, J=8,2 Гц, 2Н). 5-(3,4-Дигідроізохінолін-2(1H)-іл)-2-(метилсульфоніл)-4-тозилтіазол (А4). Ts N N 35 S Ms Суміш 1,23 г (3,5 ммоль) сполуки 8а (див. приклад А1), 0,48 мл (3,8 ммоль) 1,2,3,4тетрагідроізохіноліну і 0,49 мл (3,5 ммоль) триетиламіну у 8 мл етанолу кип'ятили 1 год., розчин охолоджували до кімнатної температури, осад, що утворився сполуки А4, відфільтровували; 1 вихід 86 % (1,35 г). Безбарвні кристали, т. пл. 143 °C (MeCN). Спектр ЯМР Н (400 МГц, ДМСОd6), , м. ч.: 2,40 (с, 3Н), 3,03 (т, J=5,7 Гц, 2Н), 3,31 (с, 3Н), 3,76 (т, J=5,8 Гц, 2Н), 4,55 (с, 2Н), 7,14-7,19 (м, 1Н), 7,21-7,26 (м, 3Н), 7,44 (д, J=8,1 Гц, 2Н), 7,83(д, J=8,3 Гц, 2Н). 5 UA 85752 U 5-(Піролідин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А5). Ts N N 5 10 15 20 SO2Pr S 1. 2-(Пропілсульфоніл)-4-тозил-5-хлоротіазол (8б). До розчину 47,44 г (198 ммоль) наногідрату сульфіду натрію в 250 мл метанолу додавали порціями 57,94 г (188 ммоль) 1-тозил2,2-дихлороетенілізотіоціанату (5а) [4] при охолодженні до 5-10 °C і перемішуванні протягом 1,5 год. Реакційну суміш перемішували ще 2 год., а потім додавали до неї по краплях розчин 19,08 мл (210 ммоль) пропілброміду в 20 мл метанолу при 10-15 °C протягом 2,5 год. Суміш розбавляли 400 мл води, декантували. Смолоподібний органічний залишок розчиняли в 200 мл оцтової кислоти, розчин нагрівали до 80-100 °C і додавали до нього порціями 110 мл 33 %-ного водного розчину пероксиду водню, підтримуючи екзотермічну реакцію, протягом 1,5 год. Реакційну суміш кип'ятили ще 1 год., потім охолоджували до кімнатної температури і відфільтровували осад сполуки 8б; вихід 59 % (42,14 г). Безбарвні кристали, т. пл. 114 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,92 (т, J=7,4 Гц, 3Н), 1,66 (м 2Н), 2,43 (с, 3Н), 3,503,68 (м, 2Н), 7,52 (д, J=7,9 Гц, 2Н), 7,91 (д, J=8,0 Гц, 2Н). 2. Сполуку А5 отримували з 1,71 г (4,5 ммоль) сполуки 8б і 0,83 мл (10 ммоль) піролідину 1 подібно сполуки А1; вихід 81 % (1,51 г). Безбарвні кристали, т. пл. 153 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,82 (т, J=7,3 Гц, 3Н), 1,33-1,52 (м, 2Н), 1,93-2,09 (м, 4Н), 2,41 (с, 3Н), 13 3,25-3,31 (м, 2Н), 3,48-3,63 (м, 4Н), 7,45 (д, J=8,0 Гц, 2Н), 7,78 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,80, 16,60, 21,54, 26,55, 56,31, 56,70, 127,91, 128,73, 130,17, 139,60, 142,46, 144,47, 159,85. 5-(Піперидин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А6). Ts N N SO2Pr S 25 30 Суміш 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,76 мл (7,7 ммоль) піперидину у 8 мл етанолу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився сполуки А6, відфільтровували; вихід 76 % (1,14 г). Безбарвні кристали, т. пл. 111 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,77 (т, J=7,3 Гц, 3Н), 1,28-1,43 (м, 2Н), 1,51-1,63 (м, 2Н), 1,63-1,77 (м, 4Н), 2,41 (с, 3Н), 3,25-3,32 (м, 2Н), 3,35-3,42 (м, 4Н), 7,45 (д, J=8,0 Гц, 2Н), 7,79 13 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,52, 21,56, 22,97, 25,18, 56,08, 56,90, 128,13, 130,19, 134,26, 138,39, 144,97, 148,31, 164,45. Амід 1-(2-(пропілсульфоніл)-4-тозилтіазол-5-іл)піперидин-4-карбонової кислоти (А7). 35 Ts N O N S SO2Pr H2N 40 Суміш 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5), 0,47 г (3,7 ммоль) аміду піперидин-4карбонової кислоти, 0,72 мл (5,2 ммоль) триетиламіну у 30 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився, відфільтровували, промивали етанолом і отримували 1,02 г (62 %) сполуки А7. З фільтрату розчинник видаляли у 6 UA 85752 U 5 вакуумі, до маслоподібного залишку додавали для кристалізації етанол і відфільтровували додатково 0,22 г сполуки А7; загальний вихід 75 %. Безбарвний порошок, т. пл. 166 °C. Спектр 1 ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J=7,4 Гц, 3Н), 1,29-1,45 (м, 2Н), 1,69-1,92 (м, 4Н), 2,29-2,43 (м, 4Н), 3,14 (т, J=11,3 Гц, 2Н), 3,26-3,30 (м, 2Н), 3,72 (д, J=11,8 Гц, 2Н), 6,87 (с, 1Н), 13 7,36 (с, 1Н), 7,46 (д, J=8,1 Гц, 2Н), 7,80 (д, J=8,1 Гц, 2Н). Спектр ЯМР С (126 МГц, ДMCO-d6), , м. ч.: 12,73, 16,52, 21,56, 28,11, 55,59, 56,07, 128,14, 130,22, 134,53, 138,32, 145,03, 148,06, 148,67, 164,19, 176,06. 5-(Піперазин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А8). Ts N N SO2Pr S HN 10 15 Сполуку A8 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,66 г (7,7 ммоль) піперазину подібно сполуки А6; вихід 68 % (1,02 г). Безбарвні кристали, т. пл. 153 °C. ІЧ -1 1 спектр (KBr), v, см : 3319 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J=7,4 Гц, 3Н), 1,30-1,46 (м, 2Н), 2,41 (с, 3Н), 2,82-2,91 (м, 4Н), 3,29-3,32 (м, 6Н), 7,46 (д, J=8,3 Гц, 2Н), 7,80 13 (д, J=8,3 Гц, 2Н). Спектр ЯМР С (126 МГц, ДMCO-d6), , м. ч.: 12,74, 16,51, 21,57, 45,16, 56,06, 56,69, 128,19, 130,22, 134,59, 138,25, 145,04, 148,90, 164,46. Знайдено, %: N 10,03, S 22,76. C17H23N3O4S3. Обчислено, %: N 9,78, S 22. 5-(4-Метилпіперазин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А9). 20 Ts N N Me 25 SO2Pr S N Сполуку A9 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,91 мл (7,7 ммоль) 1-метилпіперазин подібно сполуці А6; вихід 84 % (1,30 г). Кремові кристали, т. пл. 1 147 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,79 (т, J=7,4 Гц, 3Н), 1,31-1,47 (м, 2Н), 2,25 (с, 3Н), 2,41 (с, 3Н), 3,29-3,31 (м, 6Н), 3,38-3,45 (м, 4Н), 7,46 (д, J=7,9 Гц, 2Н), 7,80 (д, J=8,0 Гц, 13 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,52, 21,57, 45,89, 53,98, 55,36, 56,05, 128,19, 130,24, 135,12, 138,16, 145,11, 149,41, 164,02. 2-(4-(2-(Пропілсульфоніл)-4-тозилтіазол-5-іл)піперазин-1-іл)етанол (А10). 30 Ts N N HO 35 40 N S SO2Pr Сполуку А10 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,94 мл (7,7 ммоль) 2-(піперазин-1-іл)етанолу подібно сполуці А6; вихід 64 % (1,06 г). Безбарвні кристали, т. 1 пл. 90 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J=7,4 Гц, 3Н), 1,31-1,46 (м, 2Н), 2,41 (с, 3Н), 2,45-2,50 (м, 2Н), 2,59-2,67 (м, 4Н), 3,29-3,33 (м, 2Н), 3,38-3,43 (м, 4Н), 3,54 (к, J=5,5 13 Гц, 2Н), 4,48 (т, J=5,3 Гц, 1Н), 7,46 (д, J=8,1 Гц, 2Н), 7,80 (д, J=8,2 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,51, 21,57, 52,53, 55,49, 56,06, 59,02, 60,26, 128,19, 130,24, 135,04, 138,18, 145,1, 149,33, 164,03. 4-(2-(Пропілсульфоніл)-4-тозилтіазол-5-іл)морфолін (A11). 7 UA 85752 U Ts N N 5 SO2Pr S O Сполуку A11 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,67 мл (7,7 ммоль) морфоліну подібно сполуці А6; вихід 86 % (1,30 г). Безбарвні кристали, т. пл. 149 °C. 1 Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,79 (т, J=7,4 Гц, 3Н), 1,33-1,45 (м, 2Н), 2,41 (с, 3Н), 3,32-3,33 (м, 2Н), 3,38-3,43 (м, 4Н), 3,73-3,84 (м, 4Н), 7,46 (д, J=8,0 Гц, 2Н), 7,82 (д, J=8,0 Гц, 2Н). 13 Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,73, 16,53, 21,58, 55,29, 56,02, 65,79, 128,24, 130,28, 135,61, 138,03, 145,21, 150,11, 164,09. 2,6-Диметил-4-(2-(пропілсульфоніл)-4-тозилтіазол-5-іл)морфолін (А12). 10 Ts N Me N SO2Pr S O Me 15 20 Сполуку А12 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,95 мл (7,7 ммоль) 2,6-диметилморфоліну подібно сполуці А6; вихід 88 % (1,41 г). Безбарвні кристали, т. 1 пл. 121 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,80 (т, J=7,4 Гц, 3Н), 1,13 (д, J=6,2 Гц, 6Н), 1,35-1,46 (м, 2Н), 2,41 (с, 3Н), 2,78 (т, J=11,2 Гц, 2Н), 3,63 (д, J=11,3 Гц, 2Н), 3,70-3,86 (м, 13 2Н), 7,47 (д, J=8,0 Гц, 2Н), 7,80 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,55, 18,72, 21,57, 56,05, 59,96, 70,96, 119,40, 128,11, 130,31, 135,02, 138,16, 145,18, 163,51. 2-(Бензилсульфоніл)-5-(4-метилпіперидин-1-іл)-4-тозилтіазол (А13). Ts N N S SO2Bn Me 25 30 35 1. 2-(Бензилтіо)-4-тозил-5-хлоротіазол (7в). Сполуку 7в отримували з 18,49 г (60 ммоль) 1тозил-2,2-дихлороетенілізотіоціанату (5а), 15,13 г (63 ммоль) наногідрату сульфіду натрію і 7,49 мл (63 ммоль) бензилброміду подібно сполуці 7а (див. приклад А1); вихід 91 % (21,72 г). 1 Безбарвні кристали, т. пл. 86 °C (МеОН) [3 (т. пл. 69-70 °C)]. Спектр ЯМР Н (400 МГц, ДМСОd6), , м. ч.: 2,42 (с, 3Н), 4,43 (с, 2Н), 7,19-7,35 (м, 5Н), 7,51 (д, J=1,1 Гц, 2Н), 7,88 (д, J=8,0 Гц, 2Н). 2. 2-(Бензилсульфоніл)-4-тозил-5-хлоротіазол (8в). Сполуку 8в отримували із сполуки 7в як описано в роботі [3]. 3. Сполуку А13 отримували з 1,93 г (4,5 ммоль) сполуки 8в і 1,18 мл (10 ммоль) 4метилпіперидину подібно сполуці А6; вихід 86 % (1,90 г). Безбарвні кристали, т. пл. 142 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,94 (д, J=6,4 Гц, 3Н), 1,21-1,39 (м, 2Н), 1,46-1,61 (м, 1H), 1,67 (д, J=12,4 Гц, 2Н), 2,42 (с, 3Н), 2,97 (т, J=11,3 Гц, 2Н), 3,52 (д, J=11,7 Гц, 2Н), 4,76 (с, 2Н), 6,89 (д, J=7,3 Гц, 2Н), 7,20 (т, J=7,5 Гц, 2Н), 7,31 (т, J=7,3 Гц, 1Н), 7,52 (д, J=8,0 Гц, 2Н), 7,88 (д, J=8,1 Гц, 2Н). 5-(Азепан-1-іл)-2-(бензилсульфоніл)-4-тозилтіазол (А14). 8 UA 85752 U Ts N N 5 SO2Bn S Сполуку А14 отримували з 1,93 г (4,5 ммоль) сполуки 8в (див. приклад А13) і 1,09 мл (9,7 ммоль) азепану подібно сполуці А6; вихід 86 % (1,89 г). Кремові кристали, т. пл. 130 °C 1 (AcOEt/EtOH). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,41-1,57 (м, 4Н), 1,61-1,76 (м, 4Н), 2,42 (с, 3Н), 3,50-3,64 (м, 4Н), 4,69 (с, 2Н), 6,99 (д, J=7,1 Гц, 2Н), 7,27 (т, J=12 Гц, 2Н), 7,34 (т, J=7,2 Гц, 1Н), 7,50 (д, J=8,0 Гц, 2Н), 7,84 (д, J=8,1 Гц, 2Н). 2-((5-(Морфолін-4-іл)-4-тозилтіазол-2-іл)сульфоніл)етанол (А15). Ts N N S O OH SO2 10 15 20 25 30 1. 2-((4-Тозил-5-хлоротіазол-2-іл) тіо) етанол (7г). До суміші 20,03 г (65 ммоль) 1-тозил-2,2дихлороетенілізотіоціанату (5а) [4] і 5,03 мл (72 ммоль) 2-меркаптоетанолу в 50 мл етанолу додавали 10,04 мл (72 ммоль) триетиламін при охолодженні до 10-15 °C і перемішуванні протягом 1 год. Суміш перемішували при кімнатній температурі ще 2 год., розбавляли 100 мл води, осад сполуки 7г відфільтровували; вихід кількісний. Безбарвні кристали, т. пл. 63 °C 1 (МеОН). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,45 с (3Н), 3,25 т (J=6,2 Гц, 2Н), 3,64 т (J=6,2 Гц, 2Н), 4,98 ш. с (1Н), 7,43 д (J=7,8 Гц, 2Н), 7,85 д (J=7,8 Гц, 2Н). 2. 2-((4-Тозил-5-хлоротіазол-2-іл)сульфоніл)етанол (8г). Розчиняли 1,12 г (3,2 ммоль) сполуки 7г і 1,70 г (7,6 ммоль) м-хлоронадбензойної кислоти 77 %-ної чистоти (Aldrich, 273031) в 12 мл хлорооформу. Реакційну суміш витримували при кімнатній температурі 48 год., осад, що утворився, відфільтровували. Фільтрат промивали 10 мл насиченого водного розчину NaHCО 3, органічний шар відокремлювали і видаляли з нього розчинник у вакуумі. До маслоподібного залишку додавали етанол і після закінчення кристалізації відфільтровували сполуку 8г; вихід 1 61 % (0,74 г). Безбарвні кристали, т. пл. 120 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,42 (с, 3Н), 3,76-3,80 (м, 4Н), 5,09 (с, 1Н), 7,51 (д, J=8,2 Гц, 2Н), 7,90 (д, J=8,2 Гц, 2Н). 3. Суміш 0.50 г (1,3 ммоль) сполуки 8г і 0,50 мл (5,7 ммоль) морфоліну в 5 мл етанолу кип'ятили 1 год., розчин охолоджували до кімнатної температури, додавали до нього 2 мл води, осад, що утворився сполуки А15, відфільтровували; вихід 66 % (0,37 г). Безбарвні кристали, т. 1 пл. 109 °C. Спектр ЯМР Н (400 МГц, ДMCO-d6), , м. ч.: 2,45 (с, 3Н), 3,33 (с, 4Н), 3,46 (т, J=6,0 Гц, 2Н), 3,67 (т, J=6,0 Гц, 2Н), 3,77 (с, 4Н), 4,82 (с, 1Н), 7,41 (д, J=8,0 Гц, 2Н), 7,80 (д, J=8,0 Гц, 2Н). 4-(2-((2-(Морфолін-4-іл)етил)сульфоніл)-4-тозилтіазол-5-іл)морфолін (А16). Ts O N N O N SO2 S 35 40 1. 2-((4-Тозил-5-хлоротіазол-2-іл)сульфоніл)етилацетат (8д). До киплячого розчину 20,38 г (58,2 ммоль) сполуки 7г (див. приклад А15) в 150 мл оцтової кислоти додавали по краплях 24 мл 35 %-ного водного розчину пероксиду водню протягом 2 год. Леткі речовини з реакційної суміші видаляли у вакуумі, до залишку додавали етанол і після закінчення кристалізації відфільтровували сполуку 8д; вихід 74 % (18,14 г). Безбарвні кристали, т. пл. 116 °C 9 UA 85752 U (MeCN/EtOH). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,66 с (3Н), 2,43 с (3Н), 4,04 т (J=5,2 Гц, 2Н), 4,32 т (J=5,2 Гц, 2Н), 7,51 д (J=7,8 Гц, 2Н), 7,90 д (J=7,8 Гц, 2Н). 2. Суміш 0,70 г (1,65 ммоль) сполуки 8д і 0,47 мл (5,40 ммоль) морфоліну у 4 мл ТГФ перемішували 72 год., потім додавали до неї 10 мл води і відфільтровували осад сполуки А16; 1 вихід 81 % (0,67 г). Безбарвні кристали, т. пл. 139 °C (ЕtOН). Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,16-2,30 (м, 4Н), 2,41 (с, 3Н), 2,63-2,79 (м, 2Н), 3,27-3,35 (м, 4Н), 3,35-3,42 (м, 4Н), 3,423,51 (м, 2Н), 3,81-3,96 (м, 4Н), 7,31 (д, J=7,6 Гц, 2Н), 7,88 (д, J=7,9 Гц, 2Н). Знайдено, %: С 47,61, Н 5,62, S 19,40. C20H27N3O6S3. Обчислено, %: С 47,89, Н 5,43, S 19,18. 2,6-Диметил-4-(4-тозил-2-(циклогексилсульфоніл)тіазол-5-іл)морфолін (А17). 1 5 10 Ts N Me N O S SO2 Me 15 20 25 30 1. 4-Тозил-5-хлоро-2-(циклогексилтіо)тіазол (7е). До розчину 11,77 г (38,2 ммоль) 1-тозил2,2-дихлороетенілізотіоціанату (5а) [4] і 4,68 мл (38,3 ммоль) циклогексилмеркаптану в 40 мл бензолу додавали розчин 5,35 мл (38,4 ммоль) триетиламіну в 5 мл бензолу при охолодженні до 10-15 °C і перемішуванні протягом 40 хв. Реакційну суміш перемішували при кімнатній температурі ще 1 год., додавали до неї 60 мл води, органічний шар відокремлювали і видаляли з нього розчинник у вакуумі. До маслоподібного залишку додавали етанол і після закінчення кристалізації відфільтровували сполуку 7є; вихід 82 % (12,22 г). Безбарвні кристали, т. пл. 75 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,11-1,48 (м, 5Н), 1,47-1,73 (м, 3Н), 1,79-2,00 (м, 2Н), 2,41 (с, 3Н), 3,45-3,66 (м, 1Н), 7,49 (д, J=7,8 Гц, 2Н), 7,87 (д, J=8,0 Гц, 2Н). 2. 4-Тозил-5-хлоро-2-(циклогексилсульфоніл)тіазол (8е). Сполуку 8е отримували окисненням 12,22 г (31,5 ммоль) сполуки 7е 19 мл 31 %-ним водним розчином пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 90 % (11,93 г). Безбарвні кристали, т. пл. 146 °C. 1 Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,92-1,08 (м, 1Н), 1,13-1,34 (м, 4Н), 1,57 (д, J=13,0 Гц, 1H), 1,71 (д, J=12,7 Гц, 2Н), 1,85-1,97 (м, 2Н), 2,40 (с, 3Н), 3,44-3,59 (м, 1H), 7,50 (д, J=8,0 Гц, 2Н), 7,88 (д, J=8,3 Гц, 2Н). 3. Сполуку А17 отримували з 1,01 г (2,4 ммоль) сполуки 8е і 0,65 мл (5,6 ммоль) 2,6диметилморфоліну подібно сполуці А6; вихід 78 % (0,93 г). Безбарвні кристали, т. пл. 121 °C. 1 Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 0,88-1,15 (м, 4Н), 1,24 (д, J=6,3 Гц, 6Н), 1,64 (д, J=11,4 Гц, 1Н), 1,75 (д, J=10,6 Гц, 2Н), 1,90 (д, J=12,1 Гц, 3Н), 2,43 (с, 3Н), 2,76 (т, J=11,2 Гц, 2Н), 3,06 (т, J=12,0 Гц, 1Н), 3,61 (д, J=12,5 Гц, 2Н), 3,80-4,03 (м, 2Н), 7,32 (д, J=8,5 Гц, 2Н), 7,87 (д, J=8,3 Гц, 2Н). 5-(Азепан-1-іл)-4-тозил-2-(циклогексилсульфоніл)тіазол (А18). 35 Ts N N 40 S SO2 Сполуку А18 отримували з 1,05 г (2,5 ммоль) сполуки 8е (див. приклад А17) і 0,62 мл (5,5 ммоль) азепану подібно сполуці А6; вихід 90 % (1,09 г). Безбарвні кристали, т. пл. 153 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,80-1,19 (м, 5Н), 1,45-1,65 (м, 7Н), 1,71 (д, J=11,3 Гц, 2Н), 1,77-1,92 (м, 4Н), 2,41 (с, 3Н), 3,09 (т, J=11,1 Гц, 1Н), 3,53-3,83 (м, 4Н), 7,44 (д, J=7,6 Гц, 2Н), 7,77 (д, J=12 Гц, 2Н). 5-(Піперидин-1-іл)-2,4-дитозилтіазол (А19). 10 UA 85752 U Ts N N 5 Ts S Сполуку А19 отримували з 1,03 г (2,4 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,52 мл (5,3 ммоль) піперидину подібно сполуці А6; вихід 90 % (1,03 г). Безбарвні кристали, т. пл. 1 151 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 7,66 (д, J=8,0 Гц, 2Н), 7,62 (д, J=8,2 Гц, 2Н), 7,39 (д, J=7,9 Гц, 4Н), 3,35-3,41 (м, 4Н), 2,43 (с, 3Н), 2,41 (с, 3Н), 1,62-1,72 (м, 4Н), 1,50-1,61 (м, 13 2Н). Спектр ЯМР С (126 МГц, ДМCO-d6), , м. ч.: 21,59, 21,63, 22,93, 25,14, 56,87, 128,06, 128,16, 130,10, 130,68, 135,82, 138,30, 144,88, 145,96, 149,08, 164,35. 5-(Піперазин-1-іл)-2,4-дитозилтіазол (А20). 10 Ts N N 15 20 Ts S HN Сполуку А20 отримували з 1,03 г (2,4 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,46 г (5,3 ммоль) піперазину подібно сполуці А6; вихід 72 % (0,83 г). Безбарвні кристали, т. пл. 133 °C. 1 Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,44 (с, 3Н), 2,47 (с, 3Н), 3,03-3,14 (м, 4Н), 3,32-3,43 (м, 13 4Н), 7,24-7,29 (м, 4Н), 7,70 (д, J=8,1 Гц, 2Н), 7,80 (д, J=8,1 Гц, 2Н). Спектр ЯМР С (100 МГц, CDCl3), , м. ч.: 21,45, 21,57, 45,19, 56,60, 127,69, 128,87, 130,71, 131,28, 131,29, 134,25, 137,33, 141,74, 145,16, 148,97, 163,18. Знайдено, %: N 8,43, S 20,04. C 21H23N3O4S3. Обчисленого: N 8,80, S 20,14. (4-(2,4-Дитозилтіазол-5-іл)піперазин-1-іл)(фуран-2-іл)метанон (А21). Ts N N O S N Ts O 25 Сполуку А21 отримували з 0,86 г (2,0 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,76 г (4,2 ммоль) 1-(2-фуро)піперазину подібно сполуці А6; вихід 83 % (0,95 г). Безбарвні кристали, т. пл. 1 93 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,42 (s, 3Н), 2,43 (с, 2Н), 3,39-3,60 (м, 4Н), 3,76-3,99 (м, 4Н), 6,59-6,72 (м, 1H), 7,03-7,12 (м, 1Н), 7,40 (д, J=5,7 Гц, 4Н), 7,68 (д, J=7,9 Гц, 2Н), 7,73 (д, J=7,8 Гц, 2Н), 7,80-7,92 (м, 1Н). 5-(Піперазин-1-іл)-4-тозил-2-((4-хлорофеніл)сульфоніл)тіазол (А22). 30 Cl Ts N N HN SO2 S 11 UA 85752 U 5 10 15 1. 4-Тозил-5-хлоро-2-((4-хлорофеніл)сульфоніл)тіазол (8з). Сполуку 8з отримували окисненням 5,62 г (13,5 ммоль) 4-тозил-5-хлоро-2-((4-хлорофеніл)тіо)тіазолу (7з) [3] 8 мл 32 %ного водного розчину пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 89 % (5,37 г). 1 Безбарвні кристали, т. пл. 142 °C (AcOEt). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,40 (с, 3Н), 7,46 (д, J=8,0 Гц, 2Н), 7,79 (д, J=8,6 Гц, 2Н), 7,82 (д, J=8,2 Гц, 2Н), 8,02 (д, J=8,6 Гц, 2Н). 2. Суміш 0,49 г (1,1 ммоль) сполуки 8з і 0,19 г (2,2 ммоль) піперазину в 10 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, розчинник видаляли у вакуумі, залишок промивали водою, перекристалізовували з етанолу і отримували 0,39 г (71 %) сполуки -1 1 А22. Кремові кристали, т. пл. 186 °C. ІЧ спектр (KBr), v, см : 3277, 3349 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 2,44 (с, 3Н), 2,53-2,54 (м, 7Н), 2,80-2,90 (м, 4Н), 7,36 (д, J=8,1 Гц, 13 2Н), 7,64 (д, J=7,9 Гц, 2Н), 7,65 (д, J=8,5 Гц, 2Н), 7,74 (д, J=8,6 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 21,60, 45,09, 56,71, 128,10, 130,06, 130,40, 134,60, 137,43, 138,15, 140,26, 144,98, 148,33, 164,49. 2-(Метилсульфоніл)-5-(3,5-диметилпіперидин-1-іл)-4-((4-хлорофеніл)сульфоніл)тіазол (А23). SO2 Cl N Me N S Ms Me 20 25 30 35 40 45 50 1. N-(2,2,2-трихлоро-1-((4-хлорофеніл)сульфоніл)етил)формамід (2б). Метод А. Суспензію 325 г (1,54 моль) N-(1,2,2,2-тетрахлороетил)формаміду (1) [5] і 366 г (1,56 моль) дигідрату n-хлоробензолсульфінату натрію [6] в 1300 мл ацетону кип'ятили при перемішуванні 3 год., осад відфільтровували. З фільтрату ацетон видаляли у вакуумі, до маслоподібного залишку додавали 400 мл ізопропанолу і після закінчення кристалізації сполуку 2б відфільтровували; вихід 67 % (361 г). Метод Б. До суспензії 4,64 г (22 ммоль) N-(1,2,2,2-тетрахлороетил)формаміду (1) [5] і 3,89 г (22 ммоль) n-хлоробензолсульфінової кислоти [6] в 35 мл діетилового етеру додавали розчин 3,07 мл (22 ммоль) триетиламіну в 20 мл діетилового етеру при охолодженні до 10-15 °C і перемішуванні протягом 40 хв. Суміш перемішували при кімнатній температурі ще 4 год., додавали до неї 30 мл води, сполуку 2б (1,82 г) відфільтровували. Фільтрат розділяли, з органічного шару розчинник видаляли у вакуумі, до маслоподібного залишку додавали 10 мл етанолу і після закінчення кристалізації відфільтровували основну кількість сполуки 26 (2,30 г); 1 сумарний вихід 53 %. Безбарвні кристали, т. пл. 124 °C (ЕtOН). Спектр ЯМР Н (300 МГц, CDCl3), , м. ч.: 6,01 д (J=11,1 Гц, 1Н), 7,23 ш. с (1H), 7,58 д (J=8,7 Гц, 2Н), 7,92 д (J=8,7 Гц, 2Н), 8,30 с (1Н). 2. (2,2,2-Трихлоро-1-((4-хлорофеніл)сульфоніл)етил)карбонімідоїлдихлорид (3б). Суміш 108,61 г (0,309 моль) сполуки 2б і 128,86 г (0,619 моль) пентахлориду фосфору нагрівали до 120-130 °C 6 год., потім залишали при кімнатній температурі на 48 год. Утворений осад відфільтровували, промивали тетрахлорметаном і отримували 71,72 г (57 %) сполуки 3б. Фільтрат концентрували у вакуумі, осад відфільтровували, промивали тетрахлорметаном і отримували ще 20,49 г сполуки 3б; сумарний вихід 74 %. Безбарвні кристали, т. пл. 115 °C 1 (бензол). Спектр ЯМР Н (400 МГц, CDC13), , м. ч.: 5,45 с (1Н), 7,59 д (J=8,0 Гц, 2Н), 7,89д (J=8,0 Гц, 2Н). 3. 1-((4-Хлорофеніл)сульфоніл)-2,2-дихлороетенілізотіоціанат (5б). До суспензії 30,70 г (76 ммоль) сполуки 3б в 100 мл ацетонітрилу додавали розчин 11,64 мл (84 ммоль) триетиламіну у 10 мл ацетонітрилу при охолодженні до 10-15 °C і перемішуванні протягом 1,5 год., потім додавали 5,77 г (76 ммоль) тіосечовини і суміш кип'ятили при перемішуванні 1 год. Осад відфільтровували, фільтрат охолоджували до 0 °C, осад, що утворився, відфільтровували, промивали охолодженим до 0 °C ацетонітрилом, теплою водою і отримували 10,72 г (43 %) сполуки 5б . Фільтрат концентрували у вакуумі і виділяли додатково 2,94 г сполуки 5б; сумарний -1 вихід 55 %. Блідо-жовті кристали, т. пл. 86 °C (Ме2О). ІЧ спектр (СН2Сl2), v, см : 2011 (NCS). 1 Спектр ЯМР Н (500 МГц, CDCl3), , м. ч.: 7,63 д (J=8,5 Гц, 2Н), 7,94 д (J=8,5 Гц, 2Н). 12 UA 85752 U 5 10 15 4. 2-(Метилтіо)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (7и). Сполуку 7и отримували з 24,48 г (74,5 ммоль) ізотіоціанату 5б, 19,14 г (79,7 ммоль) наногідрату сульфіду натрію і 4,97 мл (79,8 ммоль) метилйодиду подібно сполуці 7а (див. приклад А1, метод Б); вихід 93 % (23,58 г). 1 Світло-коричневий порошок, т. пл. 126 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 2,51 с (3Н), 7,77 д (J=8,5 Гц, 2Н), 8,00 д (J=8,5 Гц, 2Н). 5. 2-(Метилсульфоніл)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (8и). Сполуку 8и отримували окисненням 11,57 г (34 ммоль) сполуки 7и 20 мл 31 %-ного водного розчину пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 88 % (11,14 г). Безбарвні кристали, 1 т. пл. 146 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 3,30 (с, 3Н), 7,75 (д, J=8,3 Гц, 2Н), 8,00 (д, J=8,3 Гц, 2Н). 6. Сполуку А23 отримували з 1,19 г (3,2 ммоль) сполуки 8и і 0,93 мл (7,0 ммоль) 3,5диметилпіперидину подібно сполуці А6; вихід 79 % (1,14 г). Безбарвні кристали, т. пл. 116 °C. 1 Спектр ЯМР Н (400 МГц, ДMCO-d6), , м. ч.: 0,68-0,83 (м, 1H), 0,86 (д, J=6,4 Гц, 6Н), 1,68-1,90 (м, 3Н), 2,65 (т, J=11,7 Гц, 2Н), 3,31 (с, 3Н), 3,58 (д, J=11,7 Гц, 2Н), 7,74 (д, J=8,7 Гц, 2Н), 7,92 (д, J=8,7 Гц, 2Н). 8-(2-(Метилсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол-5-іл)-1,4-діокса-8азаспіро[4.5]декан (А24). SO2 Cl N N S O Ms O 20 25 Сполуку А24 отримували з 1,19 г (3,2 ммоль) сполуки 8и (див. приклад А23) і 0,90 мл (7,0 ммоль) 1,4-діокса-8-азаспіро[4.5]декану подібно сполуці А6; вихід 78 % (1,20 г). Безбарвні 1 кристали, т. пл. 141 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,71-1,90 (м, 2Н), 2,00-2,23 (м, 2Н), 3,34-3,54 (м, 2Н), 3,35 (с, 3Н), 3,65-3,82 (м, 2Н), 3,82-4,07 (м, 4Н), 7,63 (д, J=8,5 Гц, 2Н), 7,90 (д, J=8,5 Гц, 2Н). 5-(3-Метилпіперидин-1-іл)-4-((4-хлорофеніл)сульфоніл)-2-(eтилсульфоніл)тіазол (А25). SO2 Cl N Me N 30 35 40 S SO2Et 1. 5-Хлоро-4-((4-хлорофеніл)сульфоніл)-2-(етилсульфоніл)тіазол (8к). Сполуку 8к отримували з 61,86 г (188 ммоль) ізотіоціанату 5б (див. приклад А23), 47,44 г (198 ммоль) наногідрату сульфіду натрію, 15,67 мл (210 ммоль) етилброміду і 110 мл 33 %-ного водного розчину пероксиду водню подібно сполуці 8б (див. приклад А5); вихід 49 % (35,36 г). Безбарвні 1 кристали, т. пл. 135 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,00 (т, J=7,1 Гц, 3Н), 3,37 (д, J=7,3 Гц, 2Н), 7,76 (д, J=8,4 Гц, 2Н), 8,01 (д, J=8,3 Гц, 2Н). 2. Сполуку А25 отримували з 1,24 г (3,2 ммоль) сполуки 8к і 0,82 мл (7,0 ммоль) 3метилпіперидину подібно сполуці А6; вихід 89 % (1,28 г). Безбарвні кристали, т. пл. 130 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,96 (д, J=6,6 Гц, 3Н), 1,06-1,16 (м, 1Н), 1,18 (т, J=7,4 Гц, 3Н), 1,74-2,08 (м, 4Н), 2,71 (т, J=11,3 Гц, 1Н), 2,95-3,12 (м, 1H), 3,21 (к, J=7,4, 2Н), 3,63 (д, J=11,5 Гц, 1Н), 3,71 (д, J=11,8 Гц, 1Н), 7,50 (д, J=8,7 Гц, 2Н), 7,93(д, J=8,6 Гц, 2Н). 5-(Піперазин-1-іл)-4-((4-хлорофеніл)сульфоніл)-2-(eтилсульфоніл)тіазол (А26). 13 UA 85752 U SO2 Cl N N 5 SO2Et S HN Сполуку А26 отримували з 0,50 г (1,3 ммоль) сполуки 8к і 0,22 г (2,6 ммоль) піперазину подібно сполуці А22; вихід 56 % (0,32 г). Безбарвні кристали, т. пл. 136 °C. ІЧ спектр (KBr), v, см 1 1 : 3207 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,00 (т, J=7,1 Гц, 3Н), 2,53-2,54 (м, 4Н), 2,82-2,91 (м, 4Н), 3,37 (д, J=1,6 Гц, 2Н), 7,73 (д, J=8,5 Гц, 2Н), 7,93 (д, J=8,4 Гц, 2Н). Спектр ЯМР 13 С (126 МГц, ДМСО-d6), , м. ч.: 7,35, 45,16, 49,34, 56,75, 130,01, 130,08, 133,65, 139,48, 139,87, 148,65, 165,02. 1-(2-(Фенілсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол-5-іл)піперидин-4-ол (А27). 10 SO2 Cl N N SO2Ph S HO 15 20 25 30 1. 2-(Фенілтіо)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (7л). До розчину 18,07 г (55 ммоль) ізотіоціанату 5б (див. приклад А23) і 5,65 мл (55 ммоль) тіофенолу в 50 мл бензолу додавали розчин 4,45 мл (55 ммоль) піридину в 5 мл бензолу при охолодженні до 10-15 °C і перемішуванні протягом 30 хв. Реакційну суміш перемішували при кімнатній температурі ще 2 год., додавали до неї 70 мл води, осад відфільтровували, промивали ізопропанолом і отримували 8,78 г сполуки 7л. Фільтрат розділяли, з органічного шару розчинник видаляли у вакуумі, залишок промивали ізопропанолом і отримували 11,89 г сполуки 7л; сумарний вихід 1 93 %. Безбарвні кристали, т. пл. 117 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 7,55 (т, J=6,8 Гц, 2Н), 7,61 (т, J=6,8 Гц, 1H), 7,71 (д, J=7,7 Гц, 2Н), 7,76 (д, J=7,4 Гц, 2Н), 7,97 (д, J=7,4 Гц, 2Н). 2. 2-(Фенілсульфоніл)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (8л). Сполуку 8л отримували окисненням 19,00 г (47,2 ммоль) сполуки 7л 28 мл 31 %-ного водного розчину пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 96 % (19,62 г). Безбарвні кристали, 1 т. пл. 108 °C. Спектр ЯМР H (400 МГц, ДМСО-d6), , м. ч.: 7,67-7,77 (м, 4Н), 7,86 (т, J=7,4 Гц, 1Н), 7,94 (д, J=8,2 Гц, 2Н), 8,01 (д, J=8,1 Гц, 2Н). 3. Сполуку А27 отримували з 1,04 г (2.4 ммоль) сполуки 8л і 0,53 г (5,2 ммоль) 4піперидинолу подібно сполуці А6; вихід 88 % (1,05 г). Безбарвні кристали, т. пл. 174 °C. Спектр 1 ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,46-1,72 (м, 2Н), 1,76-1,98 (м, 2Н), 3,24-3,31 (м, 2Н), 3,513,66 (м, 2Н), 3,65-3,79 (м, 1Н), 4,87 (с, 1Н), 7,55-7,63 (м, 4Н), 7,70-7,77 (м, 5Н). 5-(4-Метилпіперазин-1-іл)-2-(фенілсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол (А28). SO2 Cl N N Me S N SO2Ph 35 Сполуку А28 отримували з 1,04 г (2,4 ммоль) сполуки 8л (див. приклад А27) і 0,59 мл (5,3 ммоль) 1-метилпіперазину подібно сполуці А6; вихід 88 % (1,05 г). Кремовий порошок, т. пл. 1 163 °C. Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,36 (с, 3Н), 2,51-2,73 (м, 4Н), 3,34-3,58 (м, 4Н), 7,36-7,50 (м, 4Н), 7,62 (т, J=7,4 Гц, 1Н), 7,75 (д, J=7,4 Гц, 2Н), 7,80 (д, J=8,4 Гц, 2Н). 14 UA 85752 U 5 10 15 20 25 30 35 40 45 2. Тестування сполук A in vitro Протипухлинні властивості сполук загальної формули А досліджували в Національному інституті раку США (National Cancer Institute, Bethesda, Maryland, USA) на 60 лініях ракових клітин - представників лейкемії (лінії CCRF-CEM, HL-60 (ТВ), К-562, MOLT-4, RPMI-8226, SR), меланоми (лінії LOX IMVI, MALME-3M, М14, MDA-MB-435, SK-MEL-2, SK-MEL-28, SK-MEL-5, UACC-257, UACC-62); раку легенів (лінії А549/АТСС, EKVX, НОР-62, НОР-92, NCI-H226, NCIH23, NCI-H322M, NCI-H460, NCI-H522), товстої кишки (лінії COLO 205, НСС-2998, НСТ-116, НСТ-15, НТ29, КМ12, SW-620), мозку (лінії SF-268, SF-295, SF-539, SNB-19, SNB-75, U251), яєчників (лінії IGROV1, OVCAR-3, OVCAR-4, OVCAR-5, OVCAR-8, NCI/ADR-RES, SK-OV-3), нирок (лінії 786-0, А498, ACHN, САКІ-1, RXF 393, SN12C, ТК-10, UO-31), простати (лінії РС-3, DU-145) і грудей (лінії MCF7, MDA-MB-231/ATCC, HS 578T, ВТ-549, Т- 47D, MDA-MB-468). Ракові клітини вирощували в середовищі RPMI 1640, що містить 5 % ембріональної сироватки великої рогатої худоби і 2 ммоль/л L-глутаміну, в платах для мікротитрування з 96 лунками. Об'єм середовища в кожній лунці становив 100 мкл, а кількість клітин - від 5000 до 40000 в залежності від часу подвоєння конкретної лінії. Після інокуляції плати інкубували при 37 °C 24 год. і частину лунок кожної лінії обробляли трихлорооцтовою кислотою для визначення популяції клітин до моменту додавання досліджуваної сполуки (Tz) як описано нижче. Заздалегідь готували 4 мМ (для однодозового випробування) або 40 мМ (для п'ятидозового випробування) розчин однієї із сполук А в ДМСО, перед випробуванням його розбавляли середовищем, що містить 50 мкг/мл гентаміцину, до концентрації вдвічі більше необхідної. Додавали 100 мкл такого розчину в лунки з клітинами (поряд з контрольним розчином без сполуки) та плати інкубували 48 год. при 37 °C. Випробування закінчували додаванням 50 мкл концентрованого (0,5 г/мл для скоагульованих клітин і 0,8 г/мл для суспендованих) розчину трихлорооцтової кислоти і інкубуванням плат при 4 °C протягом 1 год. Надосадову рідину з лунок видаляли, залишок промивали водою. У кожну лунку додавали 100 мкл розчину сульфородаміну Б концентрацією 4 мг/мл в 1 %ній оцтовій кислоті, плати витримували 10 хвилин при кімнатній температурі. Лунки промивали п'ять разів 1 %-ним розчином оцтової кислоти для видалення незв'язаного барвника і висушували. Для вилучення пов'язаного речовиною клітин барвника в лунки додавали 10 мМ розчину Trizma ® Base (2-аміно-2-(гідроксиметил)-1,3-пропандіол) і визначали величину поглинання екстрактом світла довжиною хвилі 515 нм (Ті). Ступінь пригнічення росту клітин розраховували за формулами: [(Ti-Tz)/(C-Tz)]х100 % при ТіTz [(Ti-Tz)/Tz]х100 % при Ті
ДивитисяДодаткова інформація
Автори англійськоюVasylenko Oleksandr Mykolaiovych, Brovarets Volodymyr Serhiiovych
Автори російськоюВасиленко Александр Николаевич, Броварец Владимир Сергеевич
МПК / Мітки
МПК: C07D 417/04, C07D 277/06, A61P 35/00
Мітки: одержання, спосіб, тіазолів, 2,4-дисульфоніл-5-циклоамінозаміщених
Код посилання
<a href="https://ua.patents.su/20-85752-sposib-oderzhannya-24-disulfonil-5-cikloaminozamishhenikh-tiazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2,4-дисульфоніл-5-циклоамінозаміщених тіазолів</a>
Попередній патент: Спосіб діагностики лактазної недостатності у дітей раннього віку з ротавірусною інфекцією
Наступний патент: Пристрій для перетворення електричної енергії у теплову
Випадковий патент: Спосіб керування термоелектричними параметрами напівпровідника












