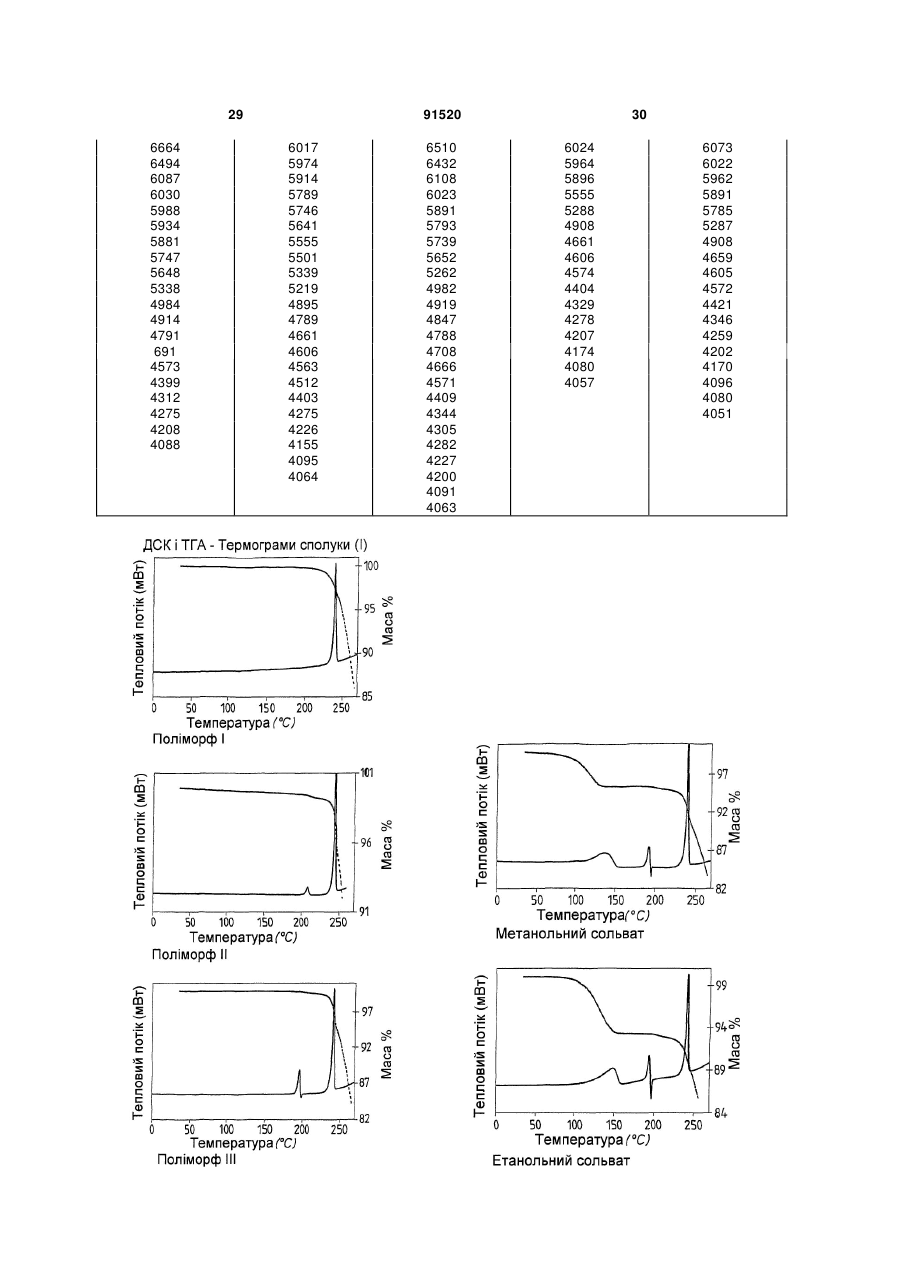
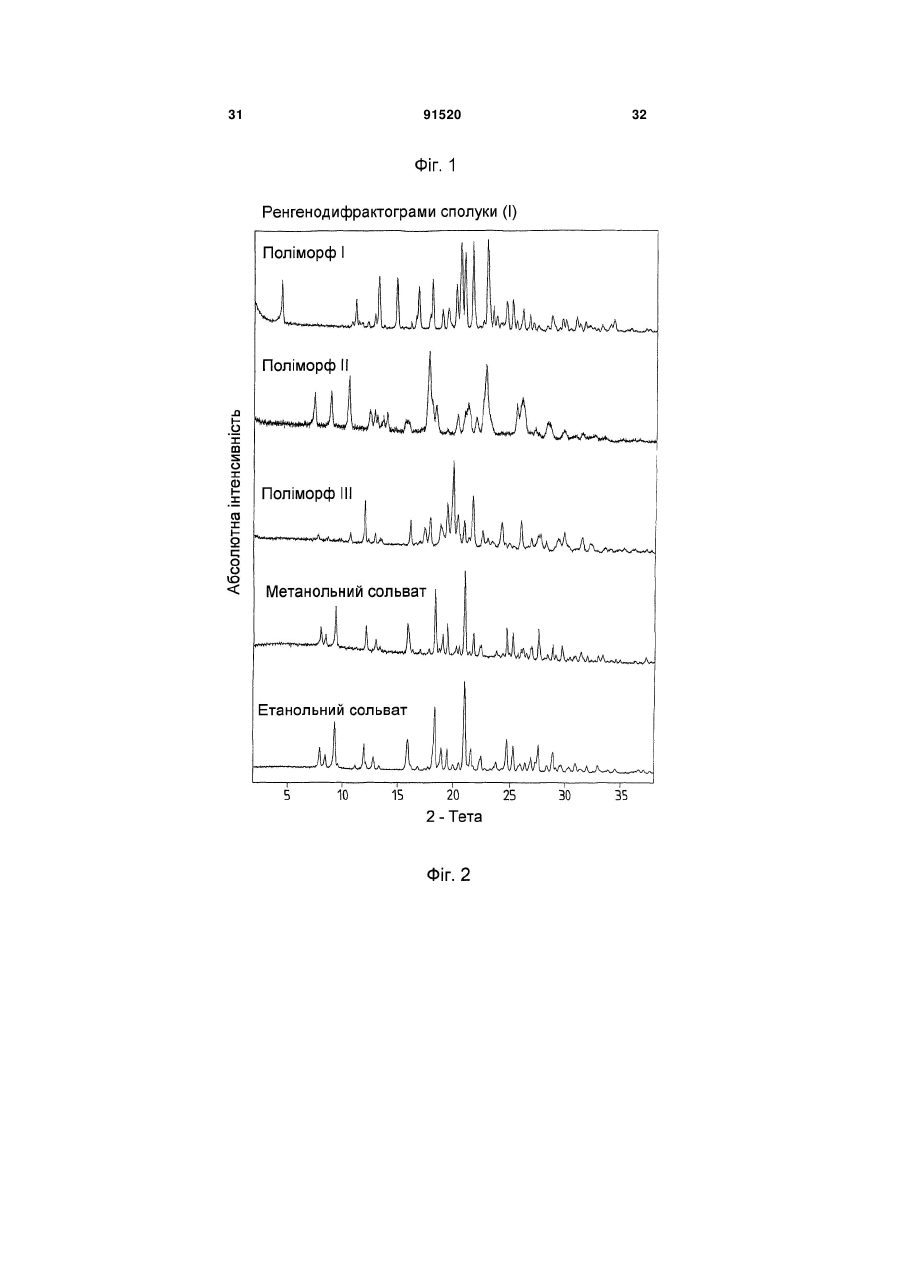
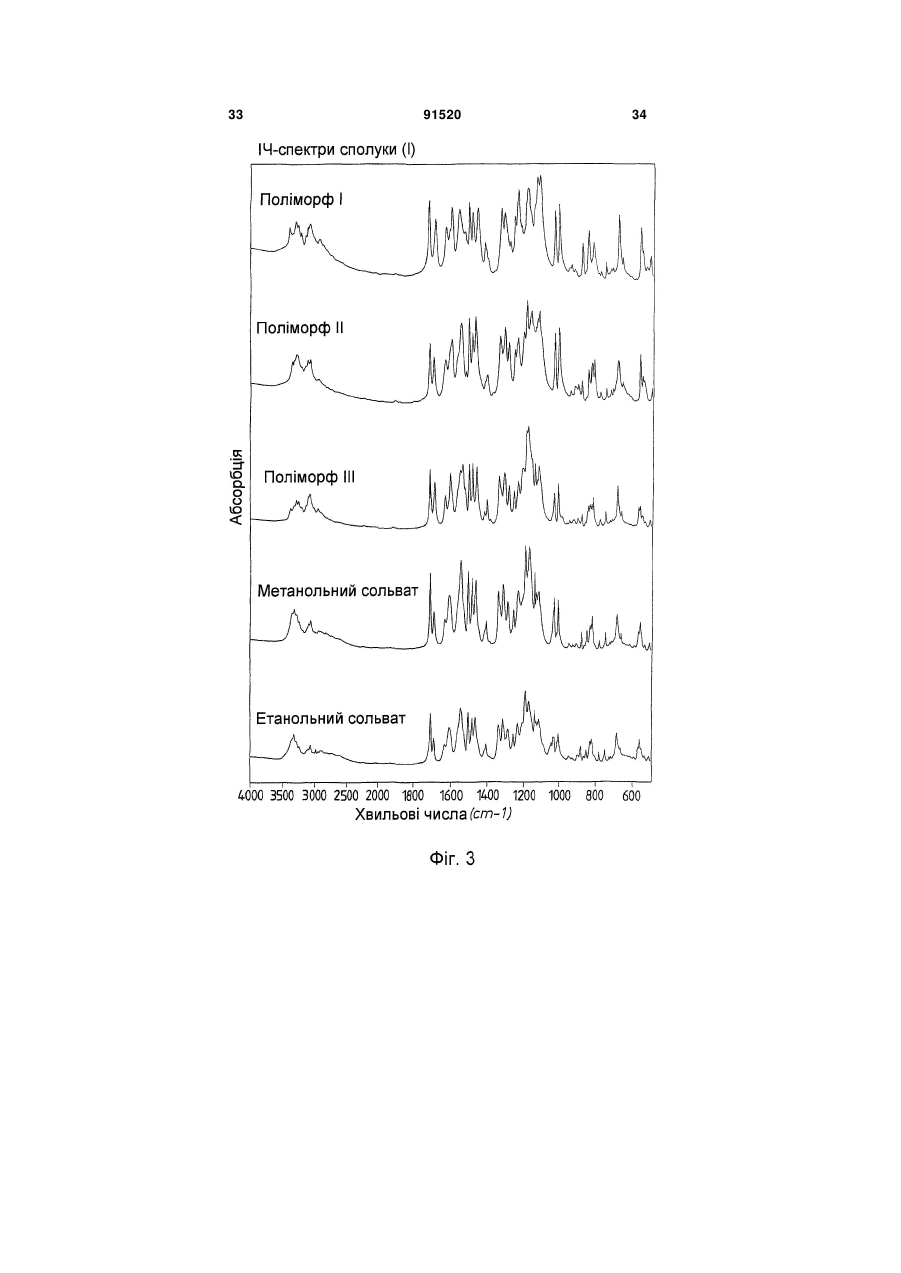
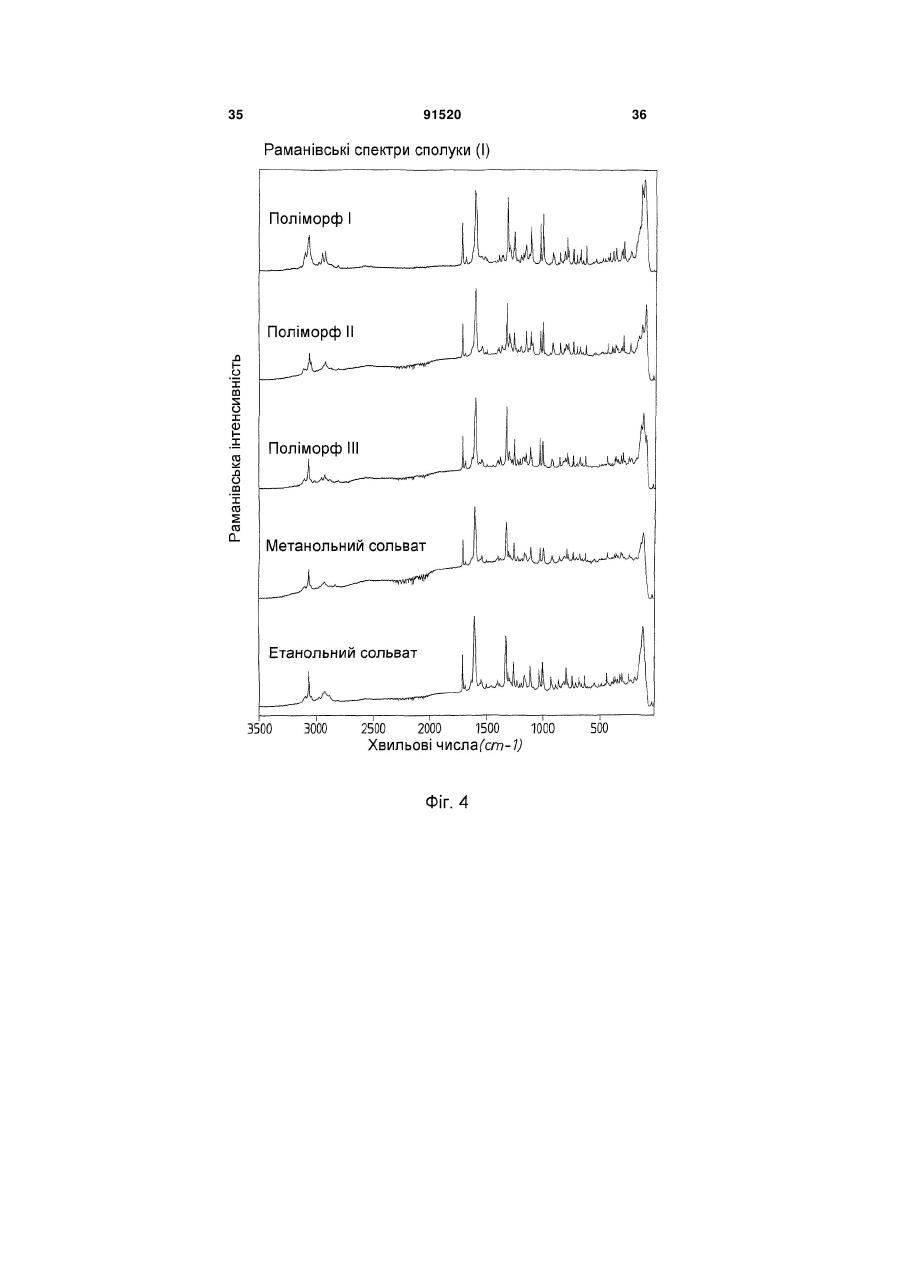
Термодинамічно стабільна форма тозилату
Формула / Реферат
1. Сполука формули (І)
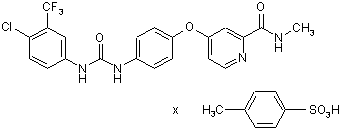 , (І)
, (І)
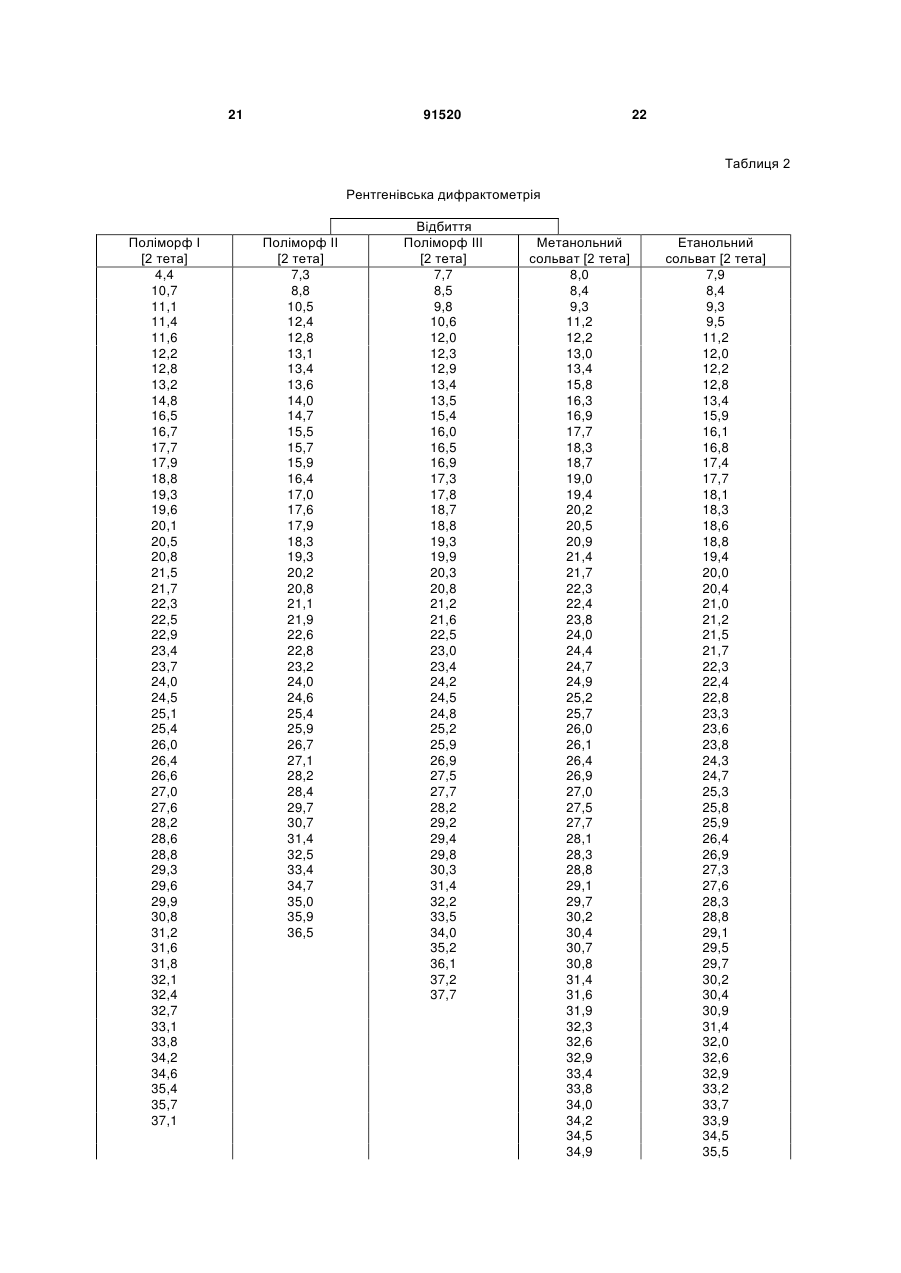
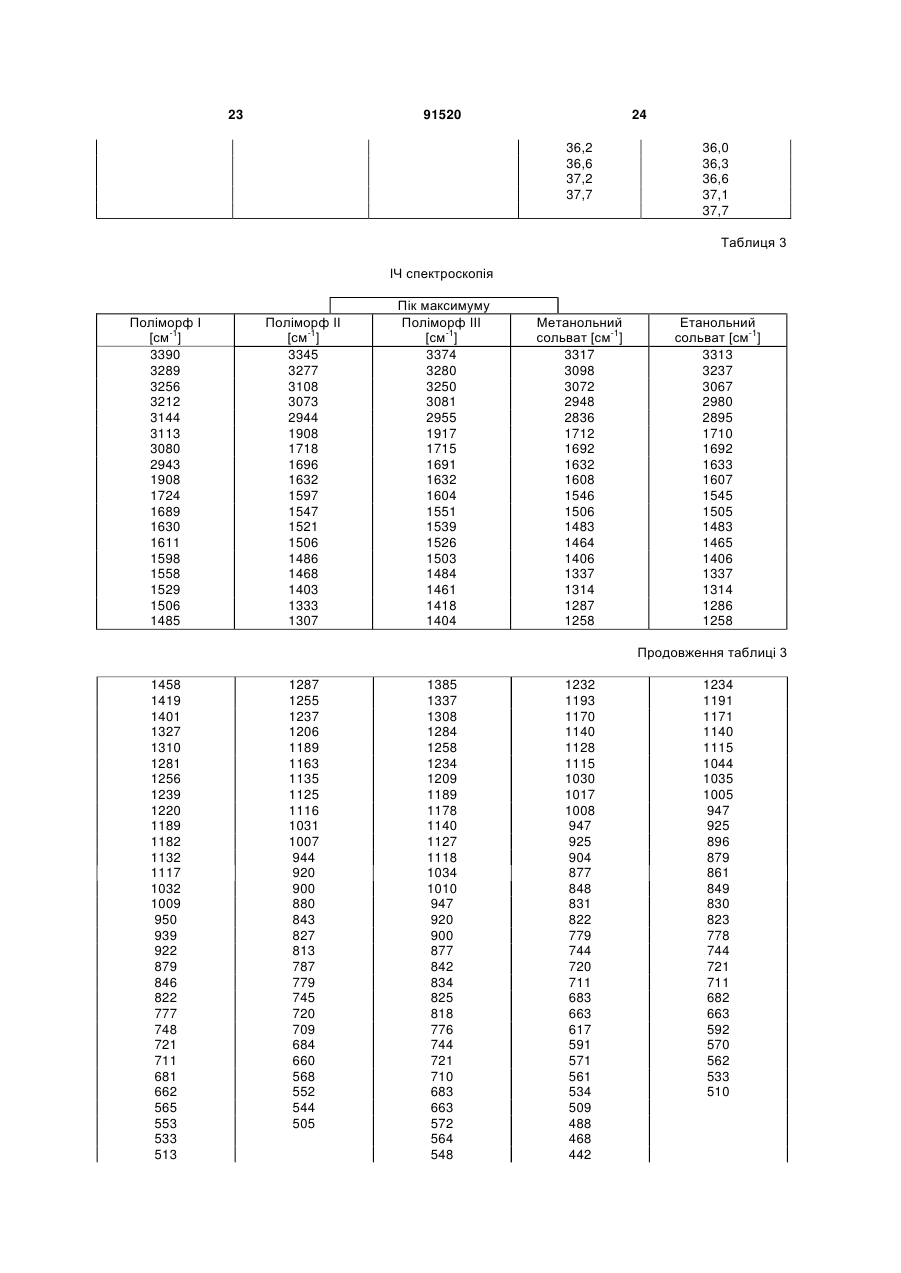
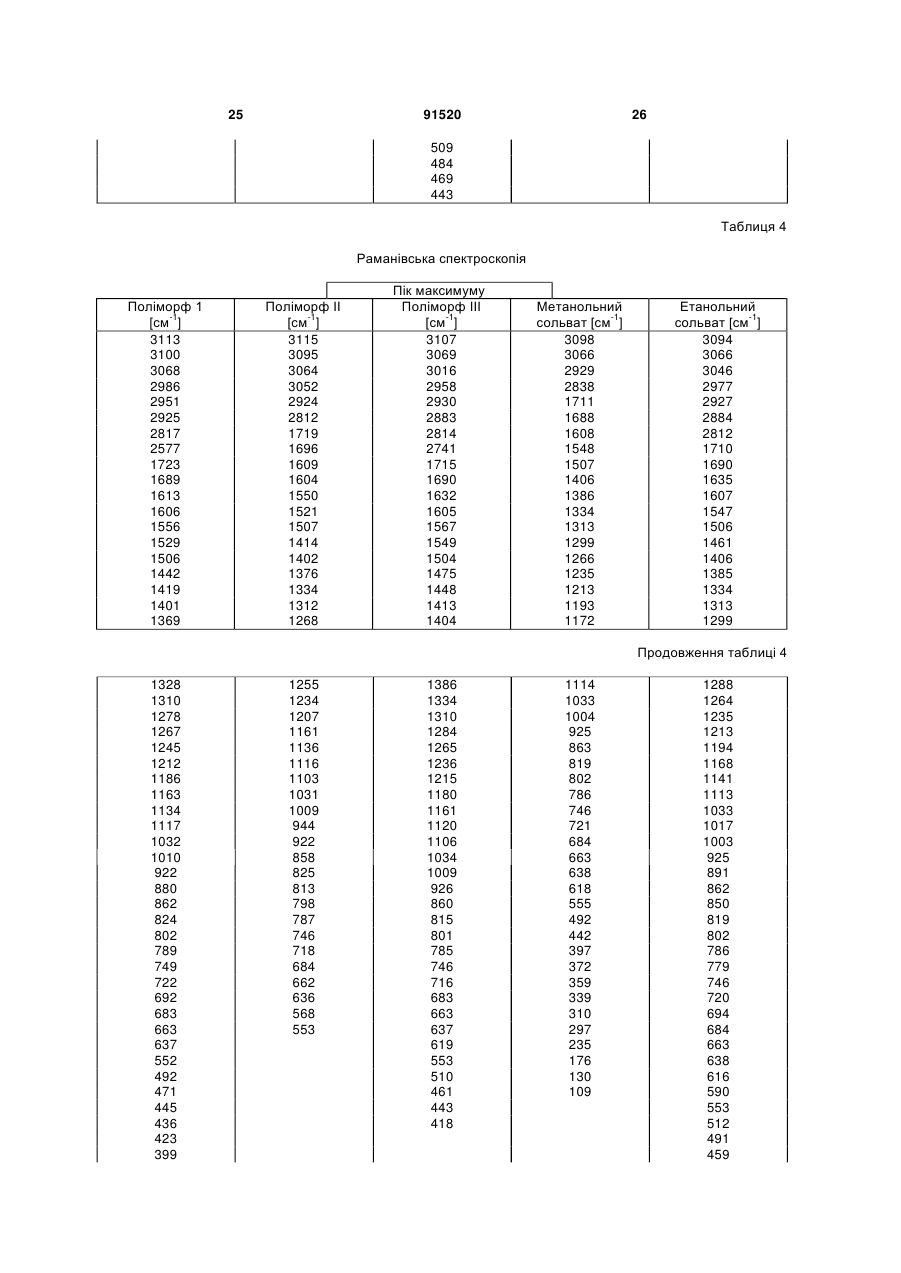
у формі поліморфу І, що показує у рентгенівській дифрактометрії максимум піка кута [2 тета], що дорівнює 14,8; в інфрачервоному спектрі максимум піка, що дорівнює 1724 см-1; в раманівському спектрі максимум піка, що дорівнює 1723 см-1.
2. Сполука формули (І)
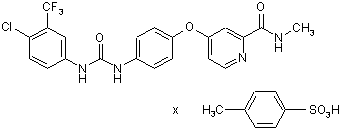 , (І)
, (І)
у формі поліморфу І, що показує у рентгенівській дифрактометрії максимуми піка кута [2 тета], що дорівнюють 4,4 та 20,5.
3. Фармацевтична композиція для лікування розладів, які характеризуються процесами анормального ангіогенезу, гіперпроникності або карциногенного росту клітин, яка містить ефективну кількість сполуки формули (І) у формі поліморфу І згідно з п. 1 та один або більше інертних, нетоксичних, фармацевтично придатних екципієнтів.
4. Фармацевтична композиція для лікування розладів, які характеризуються процесами анормального ангіогенезу, гіперпроникності або карциногенного росту клітин, яка містить ефективну кількість сполуки формули (І) у формі поліморфу І згідно з п. 2 та один або більше інертних, нетоксичних, фармацевтично придатних екципієнтів.
Текст
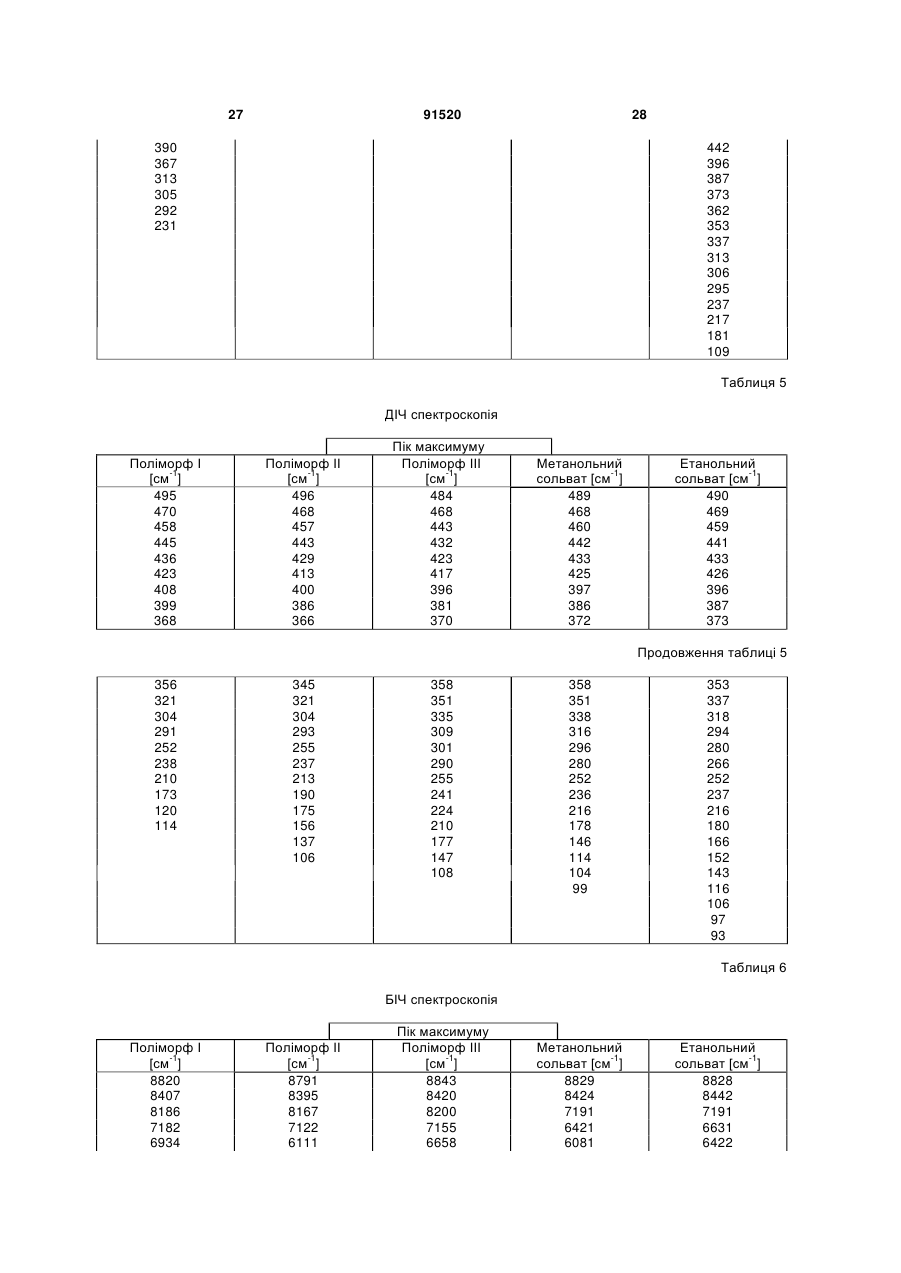
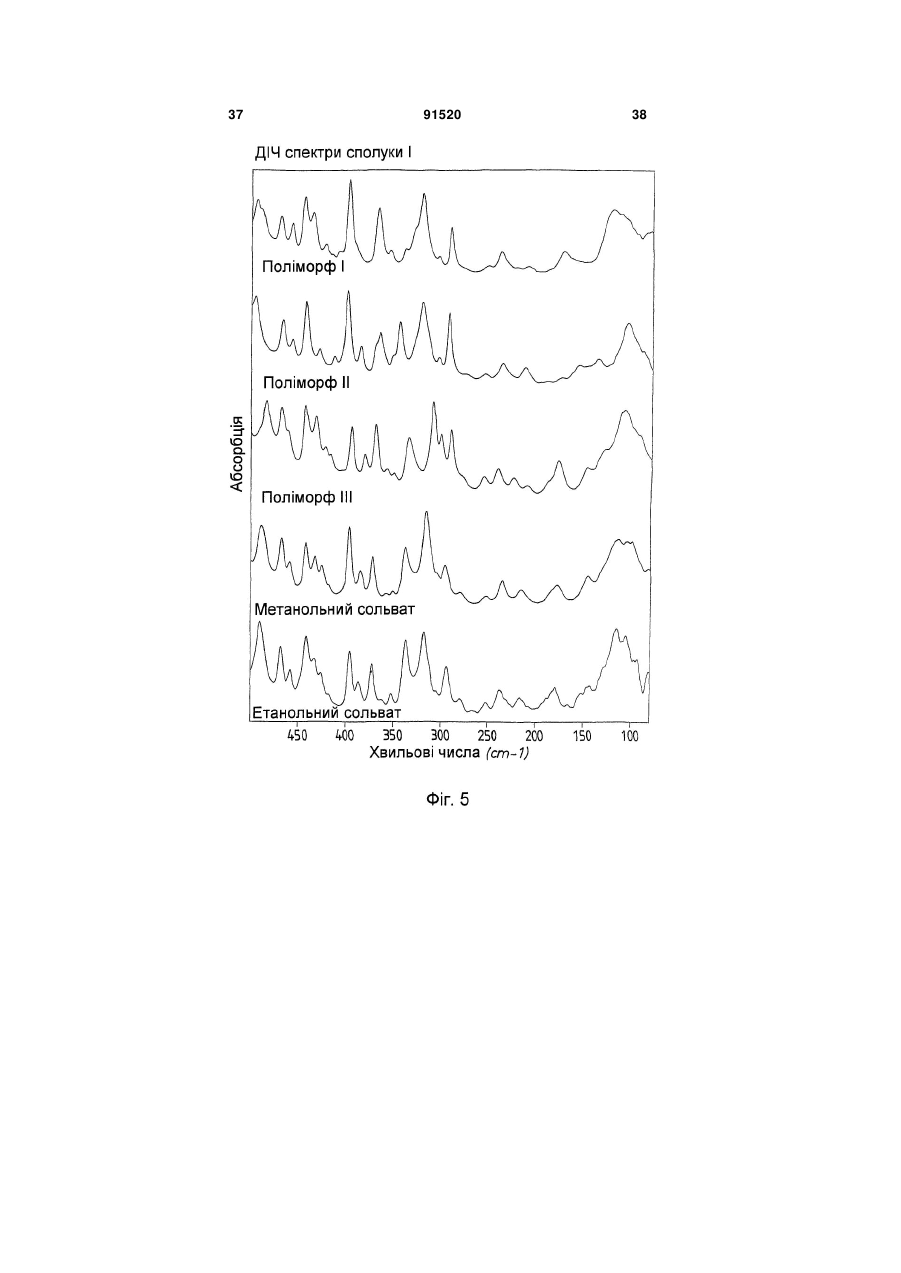
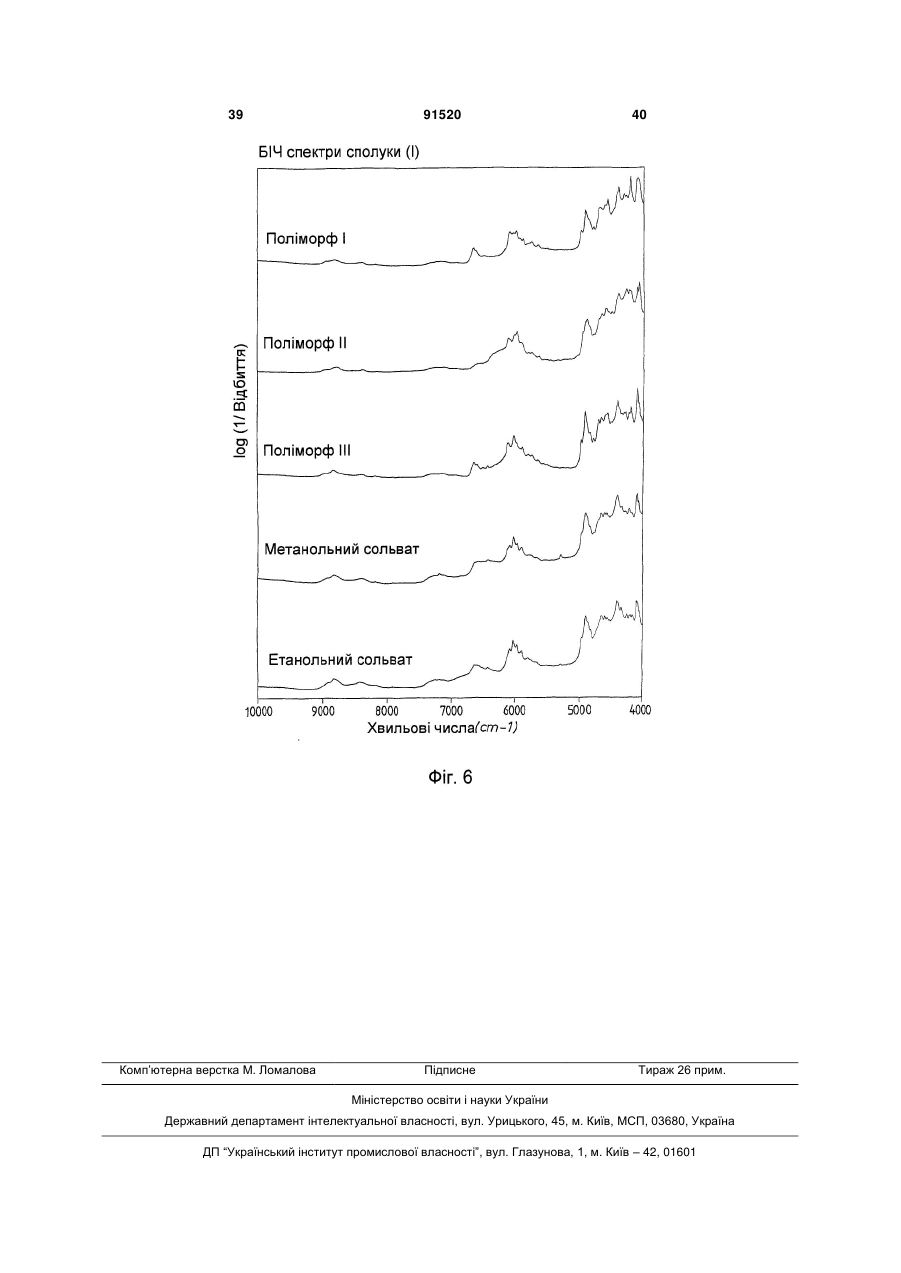
1. Сполука формули (І) (21) a200704751 (22) 20.09.2005 (24) 10.08.2010 (86) PCT/EP2005/010119, 20.09.2005 (31) 04023130.0 (32) 29.09.2004 (33) EP (46) 10.08.2010, Бюл.№ 15, 2010 р. (72) ГРУНЕНБЕРГ АЛЬФОНС, DE, ЛЕНЦ ЯНА, DE CF3 O N x H3C SO3H (13) N H CH3 , (І) мум піка, що дорівнює 1724 см ; в раманівському -1 спектрі максимум піка, що дорівнює 1723 см . 2. Сполука формули (І) CF3 O O O N H N N H x H3C N H CH3 (11) Cl SO3H , (І) у формі поліморфу І, що показує у рентгенівській дифрактометрії максимуми піка кута [2 тета], що дорівнюють 4,4 та 20,5. 3. Фармацевтична композиція для лікування розладів, які характеризуються процесами анормального ангіогенезу, гіперпроникності або карциногенного росту клітин, яка містить ефективну кількість сполуки формули (І) у формі поліморфу І згідно з 91520 -1 у формі поліморфу І, що показує у рентгенівській дифрактометрії максимум піка кута [2 тета], що дорівнює 14,8; в інфрачервоному спектрі макси п. 1 та один або більше інертних, нетоксичних, фармацевтично придатних екципієнтів. 4. Фармацевтична композиція для лікування розладів, які характеризуються процесами анормального ангіогенезу, гіперпроникності або карциногенного росту клітин, яка містить ефективну кількість сполуки формули (І) у формі поліморфу І згідно з п. 2 та один або більше інертних, нетоксичних, фармацевтично придатних екципієнтів. UA N H N H C2 O O (19) Cl 3 Даний винахід стосується нової форми, термодинамічно стабільної при кімнатній томпературі, тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-Nметилпіридин-2-карбоксаміду, способу її одержання, фармацевтичних композицій, що її містять, а також застосування для лікування розладів. Тозилат 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-Nметилпіридин-2-карбоксаміду вказаний у публікаціях WO 03/068228 та WO 03/047579 і відповідає сполуці формули (І): Серед іншого, WO 03/068228 стосується застосування сполуки формули (І) для лікування розладів, в яких важливу роль відіграє ангіогенез, наприклад як для росту пухлин. WO 03/047579 стосується арилсечовин у комбінації з цитотоксичними або цитостатичними сполуками для лікування раку. 4-{4-[({[4-Хлор-3-(трифторметил)феніл]аміно} карбоніл)аміно]фенокси}-N-метилпіридин-2карбоксамід описаний в WO 00/42012 і відповідає сполуці формули (II): Сполуки і їх солі, описані в WO 00/42012, наприклад тозилати, представлені в публікації як інгібітори ферменту RAF-кіназа і можуть застосовуватись для лікування розладів, наприклад раку. Сполуку формули (II) одержують способом, описаним в WO 00/42012. Сполуку формули (І) одержують загальним стандартним способом одержання тозилатів як описано в прикладі 1 ілюстративних прикладів. У цьому способі сполуку формули (І) одержують у формі одного поліморфу кристалу, який далі вказується як поліморф II. Поліморф II характеризується температурою фазового переходу 194°С, характеристичною рентгенодифрактограмою, ІЧ спектром, раманівським спектром, дальнім інфрачервоним (ДІЧ) спектром і ближнім інфрачервоним (БІЧ) спектром (Таб. 1-6, Фіг.1-6). Виявили, що поліморф II є метастабільним. Несподівано виявили два додаткові поліморфи і два сольвати сполуки формули (І). Сполука формули (І) у формі поліморфу І плавиться з розкладом при температурі 223-231°С, сполука фор 91520 4 мули (І) у формі поліморфу III плавиться при 187190°С. Монометанольний сольват сполуки формули (І) містить 4,8% метанолу, моноетанольний сольват сполуки формули (І) - 6,7% етанолу. Поліморф І сполуки формули (І) за винаходом термодинамічно стабільний при кімнатній температурі і стабільний при зберіганні навіть після обробки шляхом суспендування, тож він є особливо придатним для застосування в фармацевтичних рецептурах, наприклад суспензіях або кремах, а також і в інших рецептурах, які одержують шляхом суспендування активного компонента, наприклад водним гранулювання або вологим розмелюванням. Даний винахід стосується сполуки формули (І) у формі поліморфу І. Застосування сполуки формули (І) у формі стабільного поліморфу І за винаходом забезпечує уникнення небажаного перетворення в інший поліморф і пов'язаних з цим змін властивостей сполуки формули (І), наприклад розчинності або біодоступності. Цим забезпечується підвищення безпечності і якості лікарських засобів, що містять сполуку формули (І), а також зменшення ризиків, пов'язаних із вживанням засобу пацієнтом. Поліморф І сполуки формули (І) у порівнянні із поліморфом II, поліморфом III, етанольним і метанольним сольватом, має характеристичну рентгенодифрактограму, ІЧ спектр, дальній інфрачервоний (ДІЧ) спектр і раманівський спектр (Фіг.2-6). Сполука формули (І) у формі поліморфу І плавиться з розкладом при температурі 223-231С і тому її легко відрізнити від поліморфу II (що має температуру фазового переходу 194°С) і поліморфу III (температурою плавлення якого є 187190°С). На відміну від вільних від розчинника форм, у етанольного сольвату сполуки формули (І) і метанольного сольвату сполуки формули (І) спостерігали втрату маси при термогравіметричному аналізі (ТГА), що складала 6,7% і 4,8% відповідно (Фіг.1). Сполука формули (І) у формі поліморфу І за винаходом використовується у фармацевтичних рецептурах у високому ступені чистоти. Для забезпечення стабільності фармацевтична рецептура містить сполуку формули (І) в основному у формі поліморфу І і не містить значних фракцій інших форм, наприклад поліморфу або сольвату сполуки формули (І). Фармацевтична композиція переважно містить більше, ніж 90 вагових відсотків, більш переважно більше, ніж 95 вагових відсотків сполуки формули (І) у формі поліморфу І відносно загальної кількості сполуки формули (І), присутньої у композиції. Спосіб лікування: Даний винахід також стосується застосування сполуки формули (І) у формі поліморфу І для лікування розладів. Перевага надається застосуванню сполуки для лікування розладів, які характеризуються процесами анормального ангіогенезу або гіперпроникності, захворювань кісткового мозку, 5 наприклад лейкемії, або лікування карциноми, наприклад карциноми легень, підшлункової залози, щитовидної залози, нирок або кишечнику, або лікування карциногенного росту клітин. Даний винахід також стосується застосування сполуки формули (І) у формі поліморфу І для одержання фармацевтичної композиції для лікування розладів. Перевага надається застосуванню композиції для лікування розладів, які характеризуються процесами анормального ангіогенезу або гіперпроникності, захворювань кісткового мозку, наприклад лейкемії, або лікування карциноми, наприклад карциноми легень, підшлункової залози, щитоподібної залози, нирок або кишечнику, або лікування карциногенного росту клітин. Сполуку формули (І) у формі поліморфу І за цим винаходом можна застосовувати для лікування, модулювання та/або запобігання захворюванню або стану, опосередкованому одним або більшою кількістю клітинних сигнальних трансдукційних шляхів, в які залучені RAF, VEGFR, PDGFR, р38, та/або flt-3 кінази. Термін "опосередкований" вказує, наприклад, на те, що сигнальна молекула є частиною шляху, абератного або порушеного при захворюванні та/або стані. Не маючи на меті прив'язуватись до будь-якої теорії або механізму дії, виявили, що сполуки за цим винаходом здатні модулювати активність raf, VEGFR, PDGFR, p38, та/або flt-3 кіназ. Однак, способи за цим винаходом не обмежуються певним механізмом або тим, як ці сполуки досягають своєї терапевтичної дії. Під терміном "модулювати" розуміють зміну функціональної активності шляху (або його компонента) у порівнянні із нормальною активністю при відсутності сполуки. Ця дія включає будь-яке якісне вираження або рівень модулювання, включаючи підвищення, агонізування, збільшення, посилення, сприяння, стимулювання, зменшення, блокування, інгібування, скорочення, послаблення, антагонізування і т.д. Під виразом "кіназна активність" розуміють каталітичну активність, при якій фосфат з аденозинтрифосфату (АТФ) переноситься в амінокислотний залишок (напр., серин, треонін або тирозин) в білковому субстраті. Сполука може модулювати кіназну активність, напр., інгібуючи її шляхом безпосереднього конкурування з АФТ за ділянку молекули ("карман"), з якою зв'язується АТФ, шляхом спричинення конформаційної зміни в структурі ферменту, що вплине на його функції (напр., шляхом порушення біологічно активної об'ємної структури), і т.д. Кіназну активність можна визначити стандартними методами дослідження. Набори для проведення кіназних досліджень звичайно включають кіназний фермент, субстрати, буфери і складові вимірювальної системи. Захворювання або стан, "опосередкований" raf, VEGFR, PDGFR, р38, та/або fit-3, передбачає, що один із цих рецепторів є елементом сигнального трансдукційного шляху, який включений у будьякий з елементів фенотипу захворювання (напр., коли порушення у самому рецепторі є однією з "причин" захворювання; коли стимулювання реце 91520 6 птора його лігандом спричинює рухливість, міграцію та/або проліферацію клітин, які складають фенотип захворювання; коли стимулювання рецептора або проліферація викликає рестеноз; а також будь-яку функціональну активність raf, VEGFR, PDGFR, p38, та/або fit-3, яка при неналежному експресуванні обумовлює виникнення симптому захворювання та/або його фенотипу). Термін "лікування" використовується тут у його звичайному значенні, наприклад для позначення догляду за особою з метою боротьби, пом'якшення, зменшення, полегшення, покращення стану і т.д. захворювання або розладу. Захворювання і стани, які можна лікувати, включають будь-які із вказаних вище та нижче, а також наступні: захворювання, пов'язані із raf, включають, напр., порушення проліферації клітин, рак, пухлини і т.д.; захворювання, пов'язані із VEGFR-2, включають, напр., рак, ріст пухлини, запальне захворювання, ревматоїдний артрит, ретинопатію, псоріаз, гломерулонефрит, астму, хронічний бронхіт, атеросклероз, відторгнення трансплантату, стани, що включають ангіогенез, і т.д.; захворювання, пов'язані із VEGFR-3, включають, напр., рак, захворювання рогівки, запалення рогівки, трансплантацію рогівки, лімфатичну гіперплазію, стани. Що включають пімфангіогенез, і т.д.; захворювання, пов'язані із PDGFR-бета, включають, напр., захворювання або стани, що характеризуються проліферацією клітин, продукуванням клітинного матриксу, рухом клітин та/або продукуванням зовнішньоклітинного матриксу. Окремі приклади включають, напр., пухлини, злоякісні утворення, рак, метастазування, хронічну мієлоїдну лейкемію, запалення, ниркові захворювання, діабетичну нефропатію, мезангіальний проліферативний гломерулонефрит, фіброзні стани, атеросклероз, рестеноз, пов'язаний із гіпертензією атеросклероз, атеросклероз венозного шунта, склеродермію, інтерстиціальні легеневі захворювання, синовіальні розлади, артрит, лейкемії, лімфоми і т.д.; захворювання, пов'язані із flt-3, включають, напр., імунні захворювання, захворювання крові, стани, що включають розвиток гематопоетичних клітин (напр., Т-клітин, В-клітин, дендритних клітин, рак, анемію, HTV, синдром набутого імунодефіциту т.д.; захворювання, пов'язані із р38, включають запальні захворювання, муномодуляторні розлади і інші розлади, які пов'язані із анормальним продукуванням цитокіну, особливо TNF-альфа, або анормальною активністю ММР. Ці розлади включають, без обмеження, ревматоїдний артрит, COPD, остеопороз, хворобу Крона і псоріаз. Способи за цим винаходом включають модулювання проліферації клітин пухлини, зключаючи інгібування проліферації клітин. Останнє передбачає те, що ріст та/або диференціювання клітин пухлини зменшується, скорочується, знижується, уповільнюється і т.д. Термін "проліферація" включає будь-який процес, який включений у ріст або 7 поділ клітин, і включає диференціацію і апоптоз. Як обговорювалось вище, raf-кінази відіграють основну роль в активації цитоплазматичного каскаду сигналів, включеного в проліферацію, диференціювання і апоптоз клітин. Наприклад, в результаті досліджень було виявлено, що інгібування c-raf антизмістовими олігонуклеотидами може блокувати проліферацію клітин. Будь-який рівень інгібування можна вважати терапевтичним. Способи за цим винаходом такою включають лікування гіперпроліферативних розладів у ссавців. Гіперпроліферативні розлади включають, без обмеження, солідні пухлини, такі як рак грудей, дихальних шляхів, мозку, статевих органів, травного тракту, сечовивідних шляхів, очей, печінки, шкіри, голови та шиї, щитовидної залози, прищитовидної залози і його віддалених метастаз. Такі розлади також включають лімфоми, саркоми і лейкемію. Пухлина або рак, що лікуються, включають, без обмеження, рак, при якому спостерігають одну або більшу кількість мутацій у raf, ras, VEFGR, PDGFR, p38, та/або flt-3, або також будь-якому апстрім або даунстрім члені сигнального шляху, частинами якого вони є. Як вказано вище, рак можна лікувати сполукою за цим винаходом незалежно від механізму, який його спровокував. Можна лікувати рак будь-яких органів, включаючи, без обмежень, наприклад рак товстої кишки, підшлункової залози, грудей, простати, кісток, печінки, нирок, легень, яєчок, шкіри, шлунку, колоректальний рак, нирковоклітинний рак, гепатоцелюлярний рак, меланому і т.д. Приклади раку грудей включають, без обмежень, інвазивний протоковий рак, інвазивний дольковий рак, протоковий рак in situ і дольковий рак in situ. Приклади раку дихальних шляхів включають, без обмежень, дрібноклітинний і недрібноклітинний рак легень, а також аденому бронхів і плевопульмонарну бластому. Приклади раку мозку включають, без обмежень, гліому ствола головного мозку і гіпоталамусу, мозочкову і мозкову астроцитому, медулобластому, епендимому, а також нейроектодермальну пухлину та пухлину пінеальної області. Види пухлин чоловічих статевих органів включають, без обмежень, рак простати і яєчок. Пухлини жіночих статевих органів включають, без обмежень, рак ендометрію, шийки матки, яєчників, піхви і вульви, а також саркому матки. Види пухлин травного тракту включають, без обмежень, рак анального каналу, товстої кишки, колоректальний рак, рак стравоходу, жовчного міхура, шлунку, підшлункової залози, прямої кишки, тонкої кишки і слинних залоз. Види пухлин сечовивідних шляхів включають, без обмежень, рак сечового міхура, пенісу, нирок, ниркових мисок, сечоводу і уретри. Види раку очей включають, без обмежень, внутрішньоочну меланому і ретинобластому. Приклади раку печінки включають, без обмежень, гепатоцелюлярну карциному (карциному клітин печінки фіброламелярного варіанту або нефіброламелярного варіанту), холангіокарциному 91520 8 (карциному внутрішньопечінкових жовчних протоків) і змішану гепатохолангіокарциному. Види раку шкіри включають, без обмежень, карциному сквамозних клітин, саркому Капоші, злоякісну меланому, рак клітин Меркеля і немеланомний рак шкіри. Види раку голови і шиї включають, без обмежень, рак гортані, гіпофарингеальний, назофарингеальний та/або орофарингеальний рак, а також рак губ та ротової порожнини. Лімфоми включають, без обмежень, лімфому при СНІДі, неходжкінську лімфому, лімфому Тклітин шкіри, хворобу Ходжкіна і лімфому центральної нервової системи. Саркоми включають, без обмежень, саркому м'яких тканин, остеосаркому, злоякісну фіброзну гістіоцитому, лімфосаркому і рабдоміосаркому Види лейкемій включають, без обмежень, гостру або хронічну, гостру мієлоїдну лейкемію, гостру лімфобластну лейкемію, гостру лімфоцитарну лейкемію, хронічну лімфоцитарну лейкемію, хронічну мієлогенну лейкемію, лейкемію волоскових клітин, недиференційовану ГМЛ, промієлоцитарну лейкемію, мієломоноцитарну лейкемію, моноцитарну лейкемію або еритролейкемію, мегокріоцитарну лейкемію і т.д. Окрім інгібування проліферації клітин пухлини, сполуки за цим винаходом можуть також сприяти регресії пухлини, напр., зменшенню розміру пухлини, або рівня ураження раком тіла. Даний винахід також стосується способів модулювання ангіогенезу та/або лімфоангіогенезу у системі, яка містить клітини, що включає введення в систему ефективної кількості описаної тут сполуки. Системою, яка містить клітини, може бути система in vivo, така як пухлина у пацієнта, виділені органи, тканини або клітини, системи досліджень in vitro (САМ, ВСЕ і т.д.), тваринні моделі (напр., in vivo, підшкірні, ракові моделі), носії, хворі на хвороби, які мають ангіогенний та/або лімфоангіогенний компонент, такі як рак) і т.д. Неналежний і ектопічний прояв ангіогенезу (напр., анормальний ангіогенез) може згубно впливати на організм. Цілий ряд патологічних станів пов'язаний із ростом нових кровоносних судин. Такі стани включають, напр., діабетичну ретинопатію, неоваскулярну глаукому, псоріаз, ретролентальну фіброплазію, ангіофіброму, запалення і т.д. Окрім того, збільшення подачі крові в ракову і неопластичну тканину сприяє її росту, що призводить до швидкого збільшення і метастазування пухлини. Окрім того, ріст нових кров'яних та лімфатичних носіїв у пухлині забезпечує шлях виходу для ушкоджених клітин, що сприяє метастазуванню і наступному поширенню раку. Способи за цим винаходом також стосуються лікування та/або профілактики розладів або станів, які пов'язані або виникли внаслідок гіперпроникності судин. Наприклад, VEGF підвищує проникність ендотеліальних клітин. В результаті будь-який стан, внаслідок якого вивільняється VEGF, особливо у рівні, вищому за нормальний, може бути пов'язаним із гіперпроникністю судин і супроводжуючою її згубною дією. В той же час винахід забезпечує 9 лікування або профілактику будь-якого стану або розладу, який пов'язаний або виник внаслідок гіперпроникності судин, незалежно від механізму дії. Розвиток набряку є загрозливим для життя ускладненням різних захворювань центральної нервової системи, включаючи травму голови, пухлини, інсульт, гіпоксію і висотну хворобу. Причиною, що лежить в основі розвитку набряку, є гіперпроникність судин. Сполуки за цим винаходом можна застосовувати для лікування та/або профілактики гіперпроникності судин, таким чином здійснюючи лікування та/або профілактику набряку і пов'язаної з ним згубної дії. Інші стани гіперпроникності (або стани, які обумовлюють виникнення гіперпроникності судин) включають, без обмежень, набряк тканин (напр., легень, нирок, мозку і т.д.), вазогенний набряк головного мозку, хронічне запалення, загоєння ран, ішемію, пухлини, атеросклероз, захворювання периферичних судин, асцит, випоти, ексудати, нефротичний набряк, первинне гломерулярне захворювання, захворювання периферичних артерій, діабетичну ретинопатію, діабетичне захворювання сітківки ока, обструкцію дихальних шляхів, в яких проходить газообмін, при астмі та інших легеневих захворюваннях, серцево-судинний колапс при сепсисі, синдром гострого легеневого ушкодження, гострий респіраторний дистрес-синдром і т.д. Дослідження судинної проникності можна виконати стандартними методиками, напр., описаними у Heiss et al., J. Clin. Invest., 98:1400-1408, 1996; Fischer et al., Am. J. Physiol., 276(4 Pt 1):C812-20, 1999; Fischer et al., Am. J. Physiol. Cell. Physiol., 279:C935-C944, 2000. Сполука формули (І) у формі поліморфу І за цим винаходом також має широкий спектр терапевтичної дії при лікуванні або профілактиці розвитку різних захворювань, таких як запальні стани, коронарний рестеноз, пов'язаний із розвитком пухлин ангіогенез, атеросклероз, аутоімунні захворювання, запалення, деякі захворювання нирок, пов'язані із проліферацією гломерулярних або мезангіальних клітин, а також офтальмологічні захворювання, пов'язані із проліферацією судин сітківки ока, псоріаз, цироз печінки, різні типи діабету, атеросклероз, рестеноз, рестеноз судинного трансплантату, стеноз в стенті, ангіогенез, офтальмологічні захворювання, легеневий фіброз, обілтеруючий бронхоліт, гломерулонефрит, ревматоїдний артрит. Даний винахід також стосується лікування, профілактики, модулювання і т.д. одного або більшої кількості наступних станів у людей та/або інших ссавців: ретинопатії, включно із діабетичною ретинопатією, ішемічної оклюзієї судин сітківки, ретинопатії недоношених і вікової дегенерації жовтої плями; ревматоїдного артриту, псоріазу або бульозних порушень, пов'язаних із утворенням субепідермального пухиря, включаючи бульозний пемфігоїд, поліморфної еритеми або герпетичного дерматиту, ревматичної атаки, резорбції кістки, постклімактеричного остеопорозу, сепсису, грамнегативного сепсису, септичного шоку, ендотокси 91520 10 чного шоку, синдрому токсичного шоку, синдрому системної запальної відповіді, запальних захворювань кишечнику (хвороби Крона і зиразкового коліту), реакції Яріша-Герксхаймера, астми, респіраторного дистрессиндрому у дорослих, гострого фіброзного захворювання легень, саркоїдозу легень, алергічного захворювання органів дихання, силікозу, пневмоконіозу шахтарів, альвеолярного ушкодження, печінкової недостатності, захворювання печінки при гострому запаленні, важкого алкогольного гепатиту, малярії (малярії, викликаної Plasmodium falciparum, і церебральної малярії), інсулін-незалежного діабету (NIDDM), гострої застійної серцевої недостатності, ушкоджень після серцевих захворювань, атеросклерозу, хвороби Альцгеймера, гострого енцефаліту, ушкодження мозку, розсіяного склерозу (демієлінізації і ушкодження олігодендроцитів при розсіяному склерозі), запущеного раку, лімфолейкозу, панкреатиту, погіршення загоєння ран на фоні інфекції, запалення та раку, мієлодисплазійних синдромів, системної червоної вовчанки, біліарного цирозу печінки, некрозу кишечнику, променевого ураження / токсичності після введення моноклональних антитіл, реакції "хазяїна проти трансплантату" (ішемічного і реперфузійного ушкодження і відторгнень алогенного трансплантату нирок, печінки, серця га шкіри), відторгнення алогенного трансплантату легень (облітеруючий бронхіт), або ускладнень після повної заміни стегна, а також інфекційних захворювань, вибраних з туберкульозу, інфекції Helicobacter pylori при пептичній виразці, хвороби Чага внаслідок інфекції Trypanosoma cruzi, дії токсинів, подібних до токсину Шига, внаслідок інфікування Е. соІі, дії ентеротоксину А внаслідок інфікування Staphylococcus, менінгококової інфекції та інфекцій Воrrelia burgdorferi, Treponema pallidum, цитомегаловірусу, вірусу грипу, вірусу енцефаломієліту Тейлера, а також вірусу імунодефіциту людини (ВІЛ), папіломавірусу, бластогліоми, саркоми Капоші, меланоми, раку легень, раку яєчників, раку простати, карциноми сквамозних клітин, астроцитоми, раку голови, раку шиї, раку сечового міхура, раку грудей, колоректального раку, раку щитовидної залози, раку підшлункової залози, раку шлунку, гепатоцелюлярної карциноми, лейкемії, лімфоми, хвороби Ходжкіна, хвороби Баркіта, артриту, ревматоїдного артриту, діабетичної ретинопатії, ангіогенезу, рестенозу, рестенозу в стенті, рестенозу судинного трансплантату, фіброзу легень, цирозу печінки, атеросклерозу, гломерулонефриту, діабетичної нефропатії, синдромів тромботичної мікроангіопатії, відторгнення трансплантату, псоріазу, різних типів діабету, загоєння ран, запалення, а також нейродегенеративних хвороб, гіперімунних розладів, гемангіоми, міокардіального ангіогенезу, коронарної і церебральної сполученої васкуляризації, ішемії, захворювання рогівки, рубеозу, неоваскулярної глаукоми, дегенерації жовтої плями, ретинопатії недоношених, загоєння ран, захворювань, пов'язаних із виразкою, спричиненою Helicobacter pylori, тріщин, ендометріозу, діабетичного стану, хвороби котячих подряпин, гіперплазії щитовидної залози, астми або набряку після опіків, травми, хронічних захво 11 рювань легень, інсульту, поліпів, кіст, синовіту, хронічного і алергічного запалення, синдрому гіперстимуляції яєчників, набряку легень і мозку, келоїду, фіброзу, цирозу, карпального тунельного синдрому, респіраторного дистрессиндрому у дорослих, асциту, офтальмологічних станів, серцево-судинних станів, хвороби Кроу-Фукасе (синдрому POEMS), хвороби Крона, гломерулонефриту, остеоартриту, розсіяного склерозу, відторгнення трансплантату, хвороби Лайма, сепсису, хвороби Хіппеля-Ліндау, пемфігоїду, хвороби Педжета, полікістозу нирок, саркоїдозу, тиреоідіту, синдрому гіперв'язкості, хвороби Ослера-Вебера-Рандю, хронічного оклюзивного захворювання легень, опромінення, гіпоксії, прееклампсії, менометрорапї, ендометріозу, інфекції Herpes simplex, ішемічної ретинопатії, корнеального ангіогенезу, вірусу Herpes Zoster, вірусу імунодефіциту людини, парапоксвірусу, протозойних інфекцій, токсоплазмозу, а також виливів та набряків при пухлинах. Даний винахід також стосується способу запобігання або лікування захворювань, особливо вищевказаних захворювань, із застосуванням ефективної кількості сполуки формули (І) у формі поліморфу І. Комбінація з іншими фармацевтичними агентами: Сполуку формули (І) у формі поліморфу І за цим винаходом можна вводити як окремий фармацевтичний агент або в комбінації із одним або більшою кількістю інших фармацевтичних агентів, якщо така комбінація не викликає жодних неприйнятних побічних ефектів. Це може бути особливо важливим для лікування гіперпроліферативних захворювань, таких як рак. У цьому випадку сполуку за винаходом можна поєднати із відомими цитотоксичними агентами, інгібіторами сигнальної трансдукції, іншими протираковими агентами або протиблювотними засобами, а також їх сумішами і комбінаціями. В одному втіленні сполуку формули (І) у формі поліморфу І за цим винаходом можна поєднати із цитотоксичними протираковими агентами. Приклади таких агентів наведені в одинадцятому виданні каталогу Merck (1996). Ці агенти включають, без обмеження, аспарагіназу, блеоміцин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпазу, циклофосфамід, цитаратін, дакарбазин, дактиноміцин, даунорубіцин, доксорубіцин (адріаміцин), епірубіцин, етопозид, 5-фторурацил, гексаметилмеланін, гідроксисечовину, іфосфамід, ірінотекан, лейковорин, ломустин, мехлоретамін, 6-меркаптопурин, месну, метотреаксат, мітоміцин С, мітоксантрон, преднізолон, преднізон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тіогуанін, топотекан, вінбластин, вінкрістин і віндезин. Інші цитотоксичні лікарські засоби, придатні для застосування із сполуками за винаходом, включають, без обмежень, сполуки, придатність яких для застосування при лікування неопластичних захворювань підтверджена у публікації авторів Goodman і Gilman "The Pharmacological Basis of Therapeutics" (дев'яте видання, 1996, McGraw-Hill). Ці агенти включають, без обмеження, аміноглуте 91520 12 тимід, L-аспараргіназу, азатіоприн, 5-азацитидин, кладрибін, бусульфан, діетилстілбестрол, 2',2'дифтордеоксицитидин, доцетаксел, еритрогідроксиноніладенін, етинілестрадіол, 5фтордеоксиурідин, 5-фтордеоксиурідин монофосфат, флударабінфосфат, флуоксиместерон, флутамід, гідроксипрогестерону капроат, ідарубіцин, інтерферон, медроксипрогестерону ацетат, мегестролу ацетат, мелфалан, мітотан, паклітаксел, пентостатин, N-фосфоноацетил-L-аспартат (PALA), плікаміцин, семустин, теніпозид, тестостеронку пропіонат, тіотепу, триметилмламін, урідин і вінорелбін. В іншому втіленні сполуку формули (І) у формі поліморфу І за цим винаходом можна поєднати із протиблювотними засобами. Протиблювотні засоби, придатні для застосування із сполуками за винаходом, включають, без обмежень, антигістаміни, блокатори Н1-рецептора, антагоністи 5-НТ3, нейролептики, антихолінергічні засоби, антагоністи допаміну, антагоністи серотоніну, глюкокортикоїди або канабіноїди. Ці агенти включають, без обмеження, меклозин, дименгідринат, похідні фенотіазіну (напр. тіетилперазин, трифлупромазин), похідні бензаміду або бензімідазолону (напр. метоклопрамід, бромприд, домперідон), бутирофенони, скопаламін, піридоксин, хлорфеноксамін, гранісетрон, ондансетрон, тропісетрон і дексаметазон. Перевага надається наступним протиблювотним засобам: гранісетрону, ондансетрону, тропісетрону і дексаметазону. Для цілей цього винаходу "комбінація" означає не лише дозовану форму, яка містить всі компоненти (так звані фіксовані комбінації) і комбінаційні упаковки, в яких компоненти знаходяться окремо, а і компоненти, які вводяться одночасно або послідовно як вони використовуються для профілактики або лікування того ж захворювання. Активні компоненти комбінації за винаходом можна сформулювати відомою методикою в стандартні рецептури, які можуть бути і рідкими, і твердими. Прикладами є таблетки, таблетки з покриттям, пігулки, капсули, гранули, аерозолі, сиропи, емульсії, суспензії, розчини. Через те, що комбінація за винаходом добре переноситься, а у деяких випадках є ефективною навіть у низьких дозах, доступний широкий спектр рецептур. Тож, одним із варіантів є формулювання окремих активних компонентів комбінації за цим винаходом окремо один від одного. У цьому випадку немає абсолютної необхідності приймати окремі активні компоненти одночасно; навпаки, послідовне вживання може бути переважним для досягнення оптимальної дії. При такому окремому введенні придатно об'єднувати рецептури окремих активних компонентів, наприклад таблетки або капсули, в придатні первинні упаковки. Кожен із активних компонентів знаходиться в окремому контейнері, яким може бути, наприклад, тюбик, пляшечка або блістерна упаковка. Такі окремі упаковки в загальній первинній упаковці також об'єднуються поняттям набір. Іншими варіантами рецептур, які є придатними і переважними для комбінації за винаходом, є також фіксовані комбінації. Термін "фіксована комбі 13 нація" як він вживається тут означає фармацевтичні форми, в яких дози компонентів присутні у фіксованому співвідношенні. Такі фіксовані комбінації можуть бути, наприклад, у формі пероральних розчинів, але переважними є тверді пероральні фармацевтичні рецептури, наприклад капсули або таблетки. Фармацевтичні композиції: Цей винахід також стосується фармацевтичних композицій, які містять сполуку формули (І) у формі поліморфу І за цим винаходом і способів введення пацієнту, якому це необхідно, фармацевтичної композиції за винаходом. Для цілей цього винаходу пацієнтом є ссавець, включно з людною, якому необхідне лікування певного стану або захворювання. Фармацевтичні композиції за цим винаходом складаються із фармацевтично прийнятного носія і фармацевтично ефективної кількості сполуки формули (І) у формі поліморфу І за цим винаходом. Фармацевтично прийнятним носієм є будьякий носій, який є відносно нетоксичним і безпечним для пацієнта у концентрації, узгодженій із ефективною кількістю активного компонента таким чином, щоб будь-які побічні ефекти, що приписуються носію, негативно не впливають на терапевтичну дію активного компонента. Фармацевтично ефективна кількість сполуки є тою кількістю, яка забезпечує результат або здійснює вплив на той стан, який лікується. Сполуку формули (І) у формі поліморфу І можна вводити зручним шляхом, наприклад перорально, парентерально, пульмонарно, назально, сублінгвально, лінгвально, букально, ректально, місцево, трансдермально, кон'юктивально або у вухо, або у вигляді імплантату або стенту. При введенні такими шляхами, сполуки за винаходом можна вводити у придатних формах введення. Для перорального введення придатними формами введення є ті, які мають призначення відповідно до рівня техніки і доставляють сполуку формули (І) у формі поліморфу І швидким та/або модифікованим способом, наприклад такі як таблетки (таблетки з покриттям або без, наприклад із покриттями, стійкими до шлункового соку або із уповільненим розчиненням, або які нерозчинні, а також які контролюють вивільнення сполуки за винаходом), таблетки, які швидко розкладаються в ротовій порожнині або плівки/пластинки, плівки/ліофілізати, капсули (наприклад тверді або м'які желатинові капсули), покриті цукром таблетки, гранули, пігулки, порошки, суспензії або аерозолі. Парентеральне введення може здійснюватись без стадії абсорбції (наприклад шляхом внутрішньовенного, внутрішносерцевого, внутрішньохребтового або внутршньопоперекового введення), або із стадією абсорбції (наприклад шляхом внутрішньом'язового, підшкірного, внутрішньошкірного, черезшкірного або внутрішньоочеревенним шляхом). Форми введення, придатні для парентерального ведення, включають рецептури для ін'єкцій та вливань у формі суспензій, ліофілізатів або стерильних порошків. 91520 14 Придатними для інших шляхів введення є, наприклад, фармацевтичні форми для інгаляцій (включно із порошковими інгаляторами, небулайзерами), таблетки для лінгвального або букального введення, плівки/платини або капсули, супозиторії, рецептури для вух або очей, вагінальні капсули, водні суспензії (лосьйони, суміші, які необхідно збовтувати), ліофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад пластирі), пасти, присипки, імплантати або стенти. Сполуки за винаходом можна сформулювати у наведені форми для введення. Це можна виконати відомим способом шляхом змішування із інертними, нетоксичними, фармацевтично прийнятними екципієнтами. Такі екципієнти включають носії (наприклад мікрокристалічну целюлозу, лактозу, маніт), розчинники (наприклад рідкі поліетиленгліколі), емульсифікатори і диспергуючі засоби, або зволожуючі агенти (наприклад додецилсульфат натрію, олеат поліоксисорбіту), зв'язуючі агенти (наприклад полівінілпіролідон), синтетичні або природні полімери (наприклад альбумін), стабілізатори (наприклад антиоксиданти, такі як аскорбінова кислота), барвники (наприклад неорганічні пігменти, такі як оксиди заліза) і речовини, що маскують смак та/або запах. Даний винахід також стосується лікарських засобів, які містять принаймні сполуку формули (І) у формі поліморфу І, звичайно разом із одним або більшою кількістю інертних, нетоксичних, фармацевтично придатних екципієнтів, наприклад зв'язуючих агентів, наповнювачів і т.д., а також їх застосування для окреслених вище цілей. Дозування фармацевтичних композицій за цим винаходом: Ґрунтуючись на стандартних лабораторних методиках, відомих для оцінки сполук, корисних для лікування будь-якого із вищевказаних розладів, шляхом стандартних досліджень на токсичність і стандартних фармакологічних досліджень для визначення лікування вказаних вище станів у ссавців, а також шляхом порівняння одержаних таким чином результатів і показників відомих лікарських засобів, які використовуються для лікування цих станів, можна легко визначити ефективну дозу сполук за цим винаходом для лікування кожного бажаного показання. Кількість активного компонента для введення з метою лікування одного із цих станів може варіюватись у широких межах, зважаючи на такі фактори як певна сполука і дозована форма, що застосовується, шлях введення, термін лікування, вік та стать лікованого пацієнта, а також природа та стан лікованого розладу. Загальна кількість активного компонента для введення може варіюватись у межах від приблизно 0,001мг/кг до приблизно 200мг/кг, і переважно від приблизно 0,1мг/кг до приблизно 50мг/кг маси тіла на день. Одинична доза переважно містить від приблизно 5мг до приблизно 4000мг активного компонента, і вона може вводитись один раз або більше разів на день. Денна доза для перорального введення переважно складатиме від 0,1 до 50мг/кг загальної маси тіла. Денна доза для вве 15 дення шляхом ін'єкцій, включно із внутрішньовенними, внутрішньом'язовими, підшкірними і парентеральними ін'єкціями, і при застосуванні методик вливання, переважно складатиме від 0,1 до 10мг/кг загальної маси тіла. Денна доза при ректальному введенні переважно складатиме від 0,1 до 50мг/кг загальної маси тіла. Денна доза при вагінальному введенні переважно складатиме від 0,1 до 50мг/кг загальної маси тіла. Денна доза при місцевому нанесенні переважно складатиме від 0,1 до 10мг/кг, що вводиться один - чотири рази на день. Концентрація при трансдермальному введенні переважно буде такою, що підтримуватиме денну дозу на рівні від 0,1 до 10мг/кг. Денна доза при веденні шляхом інгаляцій переважно складатиме від 0,1 до 10мг/кг загальної маси тіла. Інші дози та кількості можна вибрати стандартним способом. В той же час у деяких випадках може бути бажаним відхилитись від вказаних кількостей з огляду на масу тіла, шлях введення, індивідуальне сприйняття активного компонента, вид препарату і час або інтервал, в якому вводиться засіб. Наприклад, у деяких випадках кількості, менші ніж вищевказані мінімальні кількості, можуть бути достатніми, в той час у деяких випадках необхідний буде вихід за вищу межу. У випадку введення відносно великих кількостей може бути бажаним розділяти такі кількості на декілька окремих доз протягом дня. Спосіб одержання: Винахід також стосується способу одержання сполуки формули (І) у формі поліморфу І шляхом розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано в прикладі 1, в інертному розчиннику при температурі, наприклад, від 50°С до температури кипіння розчинника, переважно від 60 до 80°С, у відсутності кристалів сольвату сполуки формули (І), наприклад у відсутності кристалів метанольного або етанольного сольвату сполуки формули (І), протягом одно дня. Суміш охолоджують до від -30°С до кімнатної температури, переважно до -25°С - 10°С, і кристали виділяють та сушать. Таким чином одержують сполуку формули (І) у формі поліморфу І. Подібно, винахід стосується способу одержання сполуки формули (І) у формі поліморфу І шляхом розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано у прикладі 1, в інертному розчиннику при температурі наприклад від 10°С до температури кипіння розчинника, переважно при кімнатній температурі протягом одного дня. Після цього в суміш вносять кристали сполуки формули (І) у формі поліморфу І, суміш перемішують або струшують, наприклад при кімнатній температурі, від 1 години до 14 днів, переважно від 2 годин до 7 днів. Кристали виділяють та сушать. Таким чином одержують сполуку формули (І) у формі поліморфу І. Подібно, винахід стосується способу одержання сполуки формули (І) у формі поліморфу І, шляхом розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано у прикладі 1, в інертному розчиннику до досягнення бажаного рівня перетворення, переважно до кількісного пе 91520 16 ретворення у поліморф І. Якщо придатно, вносять кристали сполуки формули (І) у формі поліморфу І. Одержані кристали виділяють і, для видалення наявного розчинника, висушують до стабільної ваги при кімнатній температурі або при підвищеній температурі, наприклад 40-80°С. Таким чином одержують сполуку формули (І) у формі поліморфу І. Розчинення сполуки формули (І) у формі поліморфу II в інертному розчиннику означає, що, наприклад, сполуку формули (І) у формі поліморфу II розчинюють повністю (розчин) або частково (суспензія). Суміш можна, наприклад, перемішувати або струшувати. Придатними інертними розчинниками є нижчі спирти, наприклад метанол, етанол, н-пропанол, ізопропанол, н-бутанол, втор-бутанол, ізобутанол, або кетони, такі як ацетон, або алкани, такі як нпентан, циклопентан, н-гексан, циклогексан, або тетрагідрофуран, або ацетонітрил, або толуол, або етилацетат, або суміші вказаних розчинників, або суміші вказаних розчинників з водою. Перевага надається метанолу, етанолу, н-пропанолу, ізопропанолу, ацетону, тетрагідрофурану, ацетонітрилу, толуолу, етилацетату, сумішам вказаних розчинників або сумішам вказаних розчинників з водою. Ізопропанол, етилацетат або їх суміші є найбільш переважними як інертні розчинники. Перевага надається одержанню сполуки формули (І) у формі поліморфу І шляхом розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано у прикладі 1, в метанолі, етанолі, суміші обох розчинників або суміші обох розчинників у воді, переважно суміші 1:1 з водою, струшування або перемішування при температурі від 50°С до температури кипіння розчинника, переважно 60-80°С, у відсутності кристалів сольвату сполуки формули (І), наприклад у відсутності кристалів метанольного сольвату або етанольного сольвату сполуки формули (І), протягом одного дня. Кристали охолоджують до температури від 30°С до кімнатної температури, переважно до -25 10°С, виділяють та сушать. Таким чином одержують сполуку формули (І) у формі поліморфу І. Більш переважно, у якості розчинника використовують ізопропанол, етилацетат або їх суміш. Відповідно, перевага надається одержанню сполуки формули (І) у формі поліморфу І шляхом розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано в прикладі 1, в метанолі, етанолі, суміші обох розчинників або суміші обох розчинників з водою, та струшування або перемішування при температурі від 10°С до температури кипіння розчинника, переважно при кімнатній температурі, до 1 дня. В суміш після цього вносять кристали сполуки формули (І) у формі поліморфу І, її перемішують або струшують, наприклад при кімнатній температурі, від 1 години до 14 днів, переважно від 2 годин до 7 днів. Кристали виділяють та сушать. Таким чином одержують сполуку формули (І) у формі поліморфу І. Більш переважно, у якості розчинника використовують ізопропанол, етилацетат або їх суміш. Відповідно, перевага надається одержанню сполуки формули (І) у формі поліморфу І шляхом 17 розчинення сполуки формули (І) у формі поліморфу II, одержаного як описано у прикладі 1, в інертному розчиннику, окрім метанолу та/або етанолу, переважно в ізопропанолі, ацетоні, тетрагідрофурані, ацетонітрилі, етилацетаті, толуолі, або їх суміші, перемішування або струшування при температурі від 10°С до температури кипіння розчинника, переважно при температурі від кімнатної температури до 90°С, протягом часу до 2 тижнів, переважно від 1 дня до одного тижня. Якщо придатно, суміш охолоджують до кімнатної температури і кристали виділяють та сушать. Таким чином одержують сполуку формули (І) у формі поліморфу І. Більш переважно, у якості розчинника використовують ізопропанол, етилацетат або їх суміш. Сполуку формули (І) можна подібним чином одержати у формі поліморфу І шляхом нагрівання сполуки формули (І) у формі поліморфу II до 195222°С, переважно 195-215°С, наприклад при швидкості нагрівання 10°С-30°С за хвилину, переважно 15°С-25°С за хвилину, з наступним охолодженням до 10°С-30°С, переважно до кімнатної температури, наприклад при швидкості охолодження 1°С-4°С за хвилину, переважно 1°С-3°С за хвилину. Сполуку формули (І) у формі поліморфу III можна одержати шляхом розчинення сполуки формули (І) у формі поліморфу II в інертному розчиннику, наприклад метанолі. Через 1 день - 1 тиждень проводять фільтрацію і продукт висушують і піддають термообробці при 145-160°С протягом часу від 15 хвилин до 1 години. Таким чином одержують сполуку формули (І) у формі поліморфу III. Метанольний сольват сполуки формули (І) можна одержати шляхом розчинення сполуки формули (І) у формі поліморфу II в метанолі. Через 1 тиждень здійснюють фільтрацію, продукт висушують і зберігають в атмосфері метанолу протягом часу від 5 годин до 1 тижня. Таким чином одержують метанольний сольват сполуки формули (І) із вмістом метанолу 4,8ваг. %. Етанольний сольват сполуки формули (І) можна одержати шляхом розчинення сполуки формули (І) у формі поліморфу II в етанолі. Через 1 тиждень проводять фільтрування і продукт висушують. Таким чином одержують етанольний сольват сполуки формули (І) із вмістом етанолу 6,7 вагових відсотків. Звичайно кристалізації проводять при атмосферному тиску. В той же час кристалізації можна проводити при підвищеному тиску або при зниженому тиску (наприклад у межах від 0,5 до 5бар). Показники маси у наступних дослідженнях і прикладах виражені, якщо не вказано інше, у вагових відсотках, частини є ваговими частинами. Співвідношення розчинників, співвідношення розчинення і показники концентрації розчинів рідина/рідина в кожному випадку ґрунтуються на об'ємі. Ілюстративні приклади Термограми одержували із використанням диференціального скануючого калориметра DSC 7 або Pyris-1 і термагравіметричного аналізатора TGA 7 виробництва фірми Перкін-Елмер. Рентгенограми фіксували трансмісійним дифрактомет 91520 18 ром Stoe. ІЧ, ДІЧ, БІЧ спектри і раманівський спектр фіксували за допомогою Фур'єспектрометрів IFS 66v (ІЧ, ДІЧ), IFS 28/N (БІЧ) і RFS 100 (раманівський спектр) виробництва Брукер. Приклад 1: тозилат 4-{4-[(([4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси)-Nметилпіридин-2-карбоксаміду у формі поліморфу II 903г 4-{4-[({[4-хлор-3-(трифторметил)феніл] аміно}карбоніл)аміно]фенокси}-N-метил-піридин-2карбоксаміду, одержаного як описано в WO 00/42012, спочатку завантажували в 2700мл етанолу. 451,7г моногідрату п-толуолсульфонової кислоти розчиняли в 1340г етанолу і додавали по краплях при кімнатній температурі. Суспензію перемішували при кімнатній температурі 1год., потім відфільтровували відсмоктуванням, залишок промивали тричі 830мл етанолу кожного разу. Висушування проводили при 50°С при зниженому тиску із подачею повітря. Одержували 1129,6г вказаної в заголовку сполуки у формі поліморфу II. Приклад 2: Одержання тозилату 4-{4-[({[4хлор-3-(трифторметил)феніл]аміно}карбоніл)аміно]фенокси)-N-метилпіридин-2-карбоксаміду у формі поліморфу І Приклад 2.1 5мг тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II нагрівали до 200°С при швидкості нагрівання 20°С/хв. з наступним охолодженням до кімнатної температури при швидкості охолодження 2°С/хв. Зразок аналізували термоаналітично (ДСК) і він відповідав вказаній в заголовку сполуці у формі поліморфу І. Приклад 2.2 75мг тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II розчиняли в 10мл суміші етанол/вода (1:1) при приблизно 80°С і фільтрували. Суміш розділяли на два зразки, зразок А кристалізували в холодильнику при +8°С, а зразок В - в морозильній камері при -20°С. Після випарування розчинника з сумішей два кристали зразка А і В тестували термоаналітично (ДСК). Обидва зразки відповідали вказані в заголовку сполуці у формі поліморфу І. Приклад 2.3 У кожному випадку 400мг тозилату 4-{4-[({[4хлор-3-(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2карбоксаміду у формі поліморфу II суспендували в а) 8мл метанолу і b) 8мл етанолу, кожну з суспензій перемішували при кімнатній температурі 2 години. В кожну з суспензій додавали 2мг вказаної в заголовку сполуки у формі поліморфу І, після чого їх перемішували при кімнатній температурі 1 тиждень. Після фільтрації тверді залишки двох зразків сушили при кімнатній температурі. Кожен з залишків тестували термоаналітично (ДСК) і кожен відповідав вказаній в заголовку сполуці у формі поліморфу І. 19 91520 Приклад 2.4 200мг тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аmmo]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II суспендували в 5мл суміші етанол/вода (1:1 об./об.) і перемішували при кімнатній температурі 2 години. В суспензію засипали 2мг вказаної в заголовку сполуки у формі поліморфу І, після чого її перемішували при кімнатній температурі 1 тиждень. Після фільтрації твердий залишок сушили при кімнатній температурі. Залишок тестували термоаналітично (ДСК) і він відповідав вказаній в заголовку сполуці у формі поліморфу І. Приклад 2.5 У кожному випадку 50мг тозилату 4-{4-[({[4хлор-3-(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2карбоксаміду у формі поліморфу II змішували у кожному випадку із 2мл а) ізопропанолу, b) ацетону, с) тетрагідрофурану, d) ацетонітрилу, e) етилацетату і f) толуолу, і кожен зразок перемішували при кімнатній температурі 6 днів. У випадку додавання с) тетрагідрофурану і f) толуолу додавали додаткові 1мл відповідного розчинника. Кожну із суспензій фільтрували і відповідні залишки сушили при кімнатній температурі. Кожний із залишків тестували рентгенівською дифрактометрією і кожен відповідав вказаній в заголовку сполуці у формі поліморфу І. Приклад 2.6 200мг тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II суспендували в 4мл толуолу, суспензію перемішували при 80°С один тиждень. Після охолодження до кімнатної температури залишок фільтрували, сушили при кімнатній температурі і тестували рентгенівською дифрактометрією. Вказану в заголовку сполуку одержували у формі поліморфу І. Приклад 3: Одержання тозилату 4-(4-[({[4хлор-3-(трифторметил)феніл]аміно}карбоніл) 20 аміно]фенокси)-N-метилпіридин-2-карбоксаміду у формі поліморфу III 3,5г тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II суспендували в 15мл метанолу і перемішували при кімнатній температурі. Через один тиждень суспензію фільтрували і залишок сушили при кімнатній температурі. Після цього продукт піддавали термообробці при 150°С протягом 30хв. Залишок аналізували рентгенівською дифрактометрією і він відповідав вказаній в заголовку сполуці у формі поліморфу III. Приклад 4: Одержання метанольного сольвату тозилату 4-{4-[({[4-хлор-3-(трифторметил)феніл]аміно)карбоніл)аміно]фенокси)-Nметилпіридин-2-карбоксаміду 3,5г тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II суспендували в 15мл метанолу і перемішували при кімнатній температурі. Через один тиждень суспензію фільтрували і залишок сушили при кімнатній температурі. Після цього продукт зберігали в ексикаторі в атмосфері метанолу протягом одного дня. Залишок аналізували рентгенівською дифрактометрією і він відповідав метанольному сольвату вказаної' в заголовку сполуки із вмістом метанолу 4,8 вагових відсотків. Приклад 5: Одержання етанольного сольвату тозилату 4-(4-[({[4-хлор-3-(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-Nметилпіридин-2-карбоксаміду 3г тозилату 4-{4-[({[4-хлор-3(трифторметил)феніл]аміно}карбоніл)аміно]фенокси}-N-метилпіридин-2-карбоксаміду у формі поліморфу II суспендували в 15мл етанолу і перемішували при кімнатній температурі. Через один тиждень суспензію фільтрували і залишок сушили при кімнатній температурі. Залишок аналізували рентгенівською дифрактометрією і він відповідав етанольному сольвату вказаної в заголовку сполуки із вмістом етанолу 6,7 вагових відсотків. Таблиця 1 Диференційна скануюча калориметрія і термогравіметрія Поліморф І Температура плавлення [°С] Втрата маси [ваг. %] Поліморф II Поліморф II Метанольний сольват Етанольний сольват 223-231* 194** 187-190
ДивитисяДодаткова інформація
Назва патенту англійськоюThermodynamically stable form of tosylate
Автори англійськоюGrunenberg Alfons, Lenz Jana
Назва патенту російськоюТермодинамически стабильная форма тозилата
Автори російськоюГруненберг Альфонс, Ленц Яна
МПК / Мітки
МПК: C07D 213/81, A61P 35/00, A61K 31/44
Мітки: термодинамічно, форма, тозилату, стабільна
Код посилання
<a href="https://ua.patents.su/20-91520-termodinamichno-stabilna-forma-tozilatu.html" target="_blank" rel="follow" title="База патентів України">Термодинамічно стабільна форма тозилату</a>
Попередній патент: Підтримка передачі обслуговування для мереж, що мають різні протоколи встановлення каналу зв’язку
Наступний патент: Композиції, які містять ліпазу, протеазу і амілазу, призначені для лікування недостатності підшлункової залози
Випадковий патент: Побутова газова піч