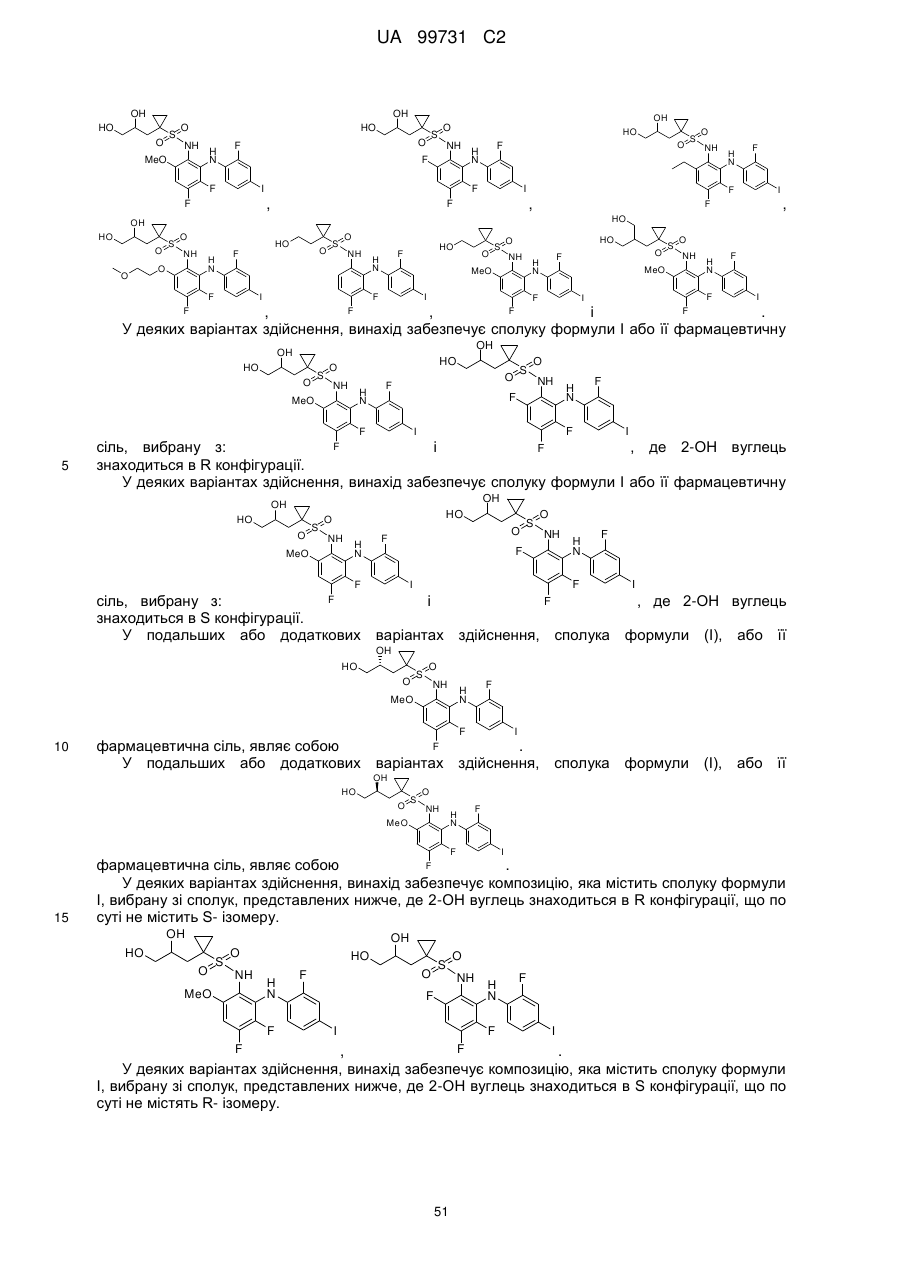
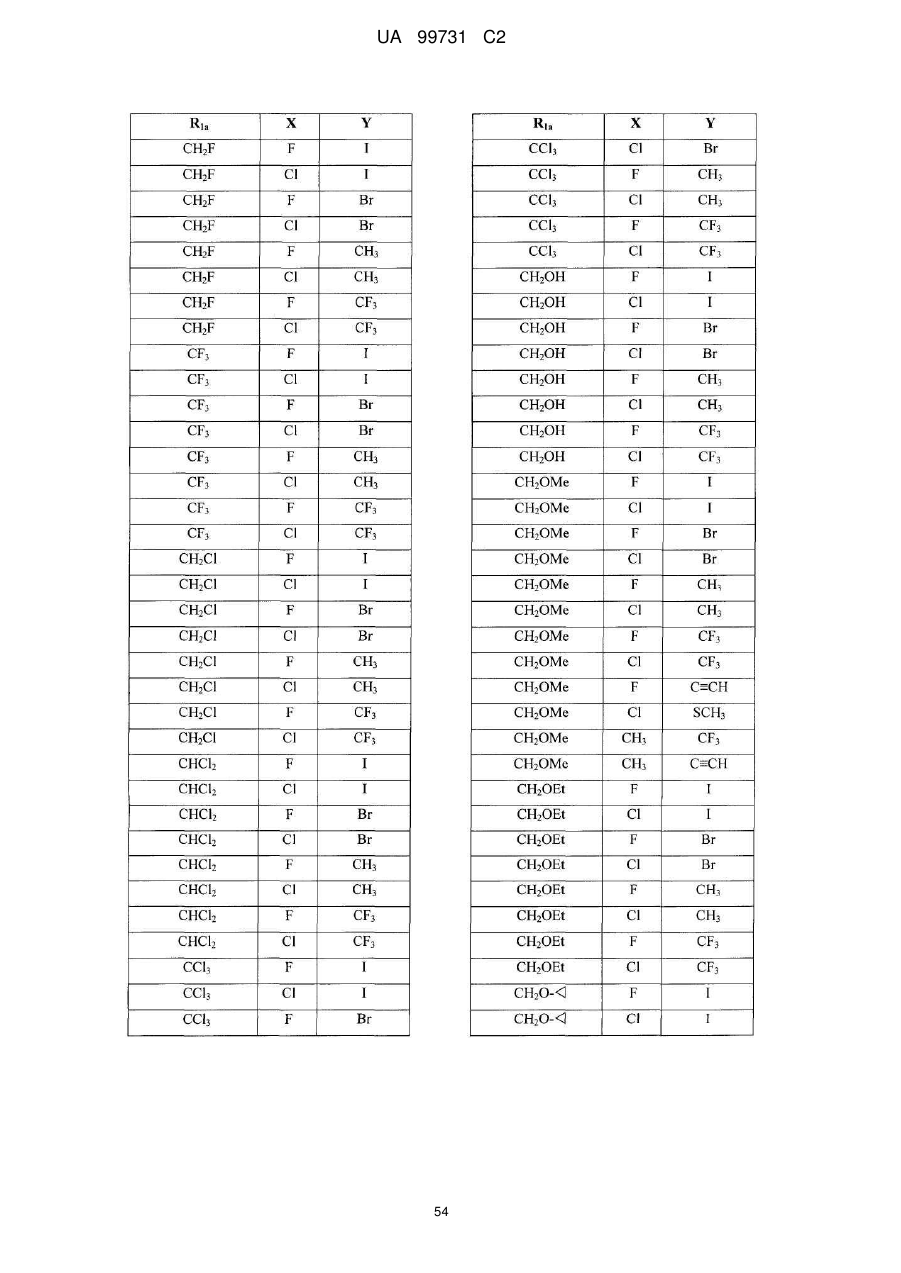
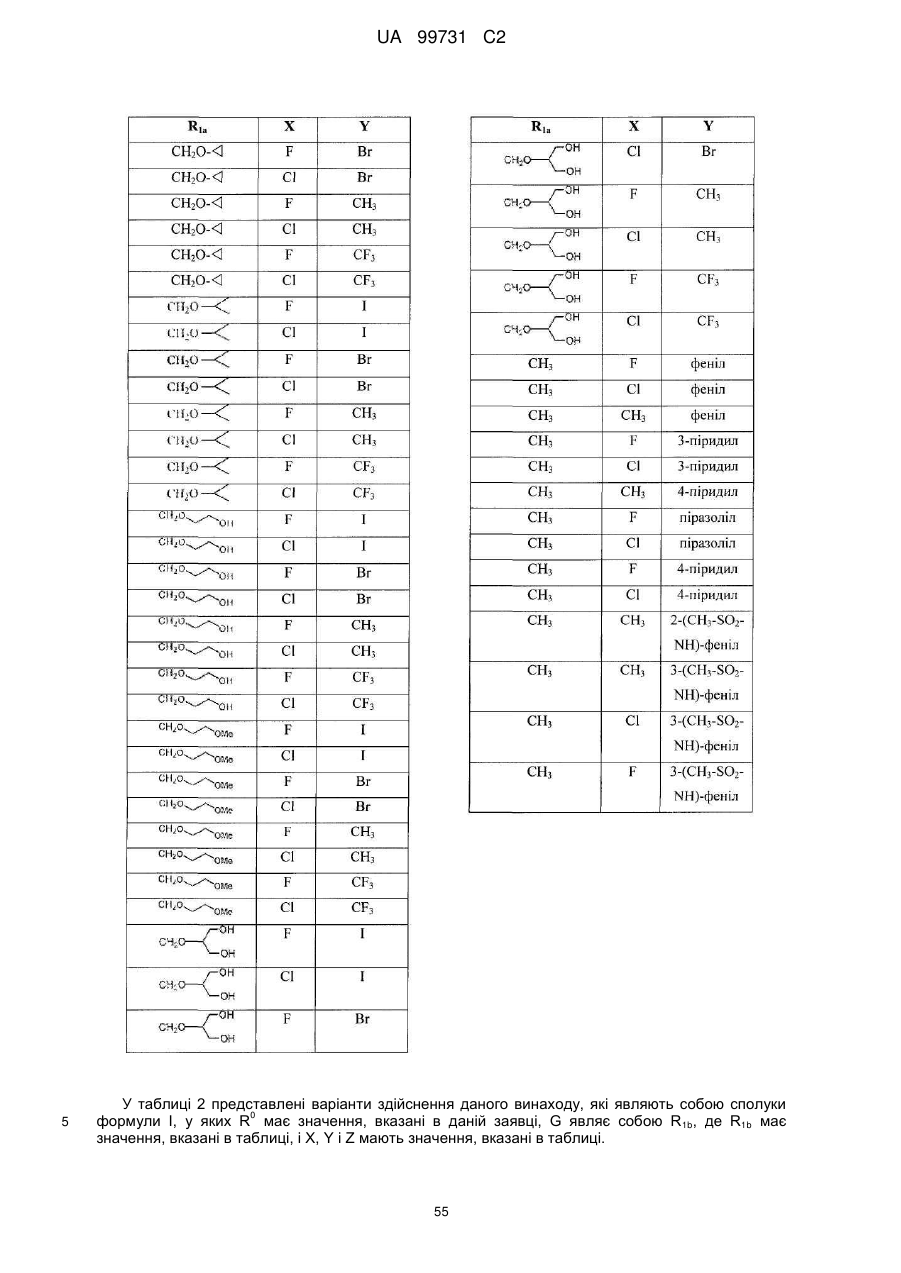
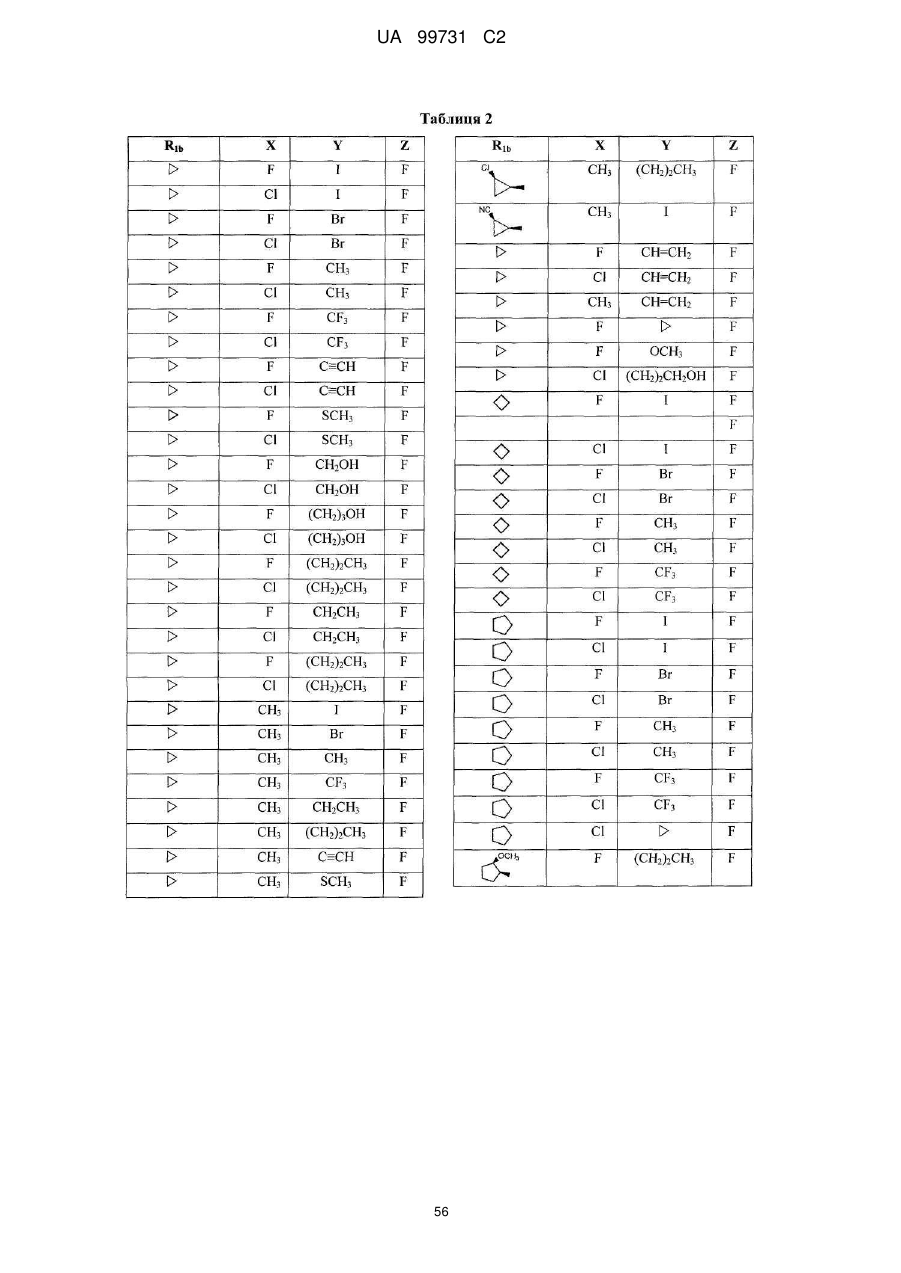
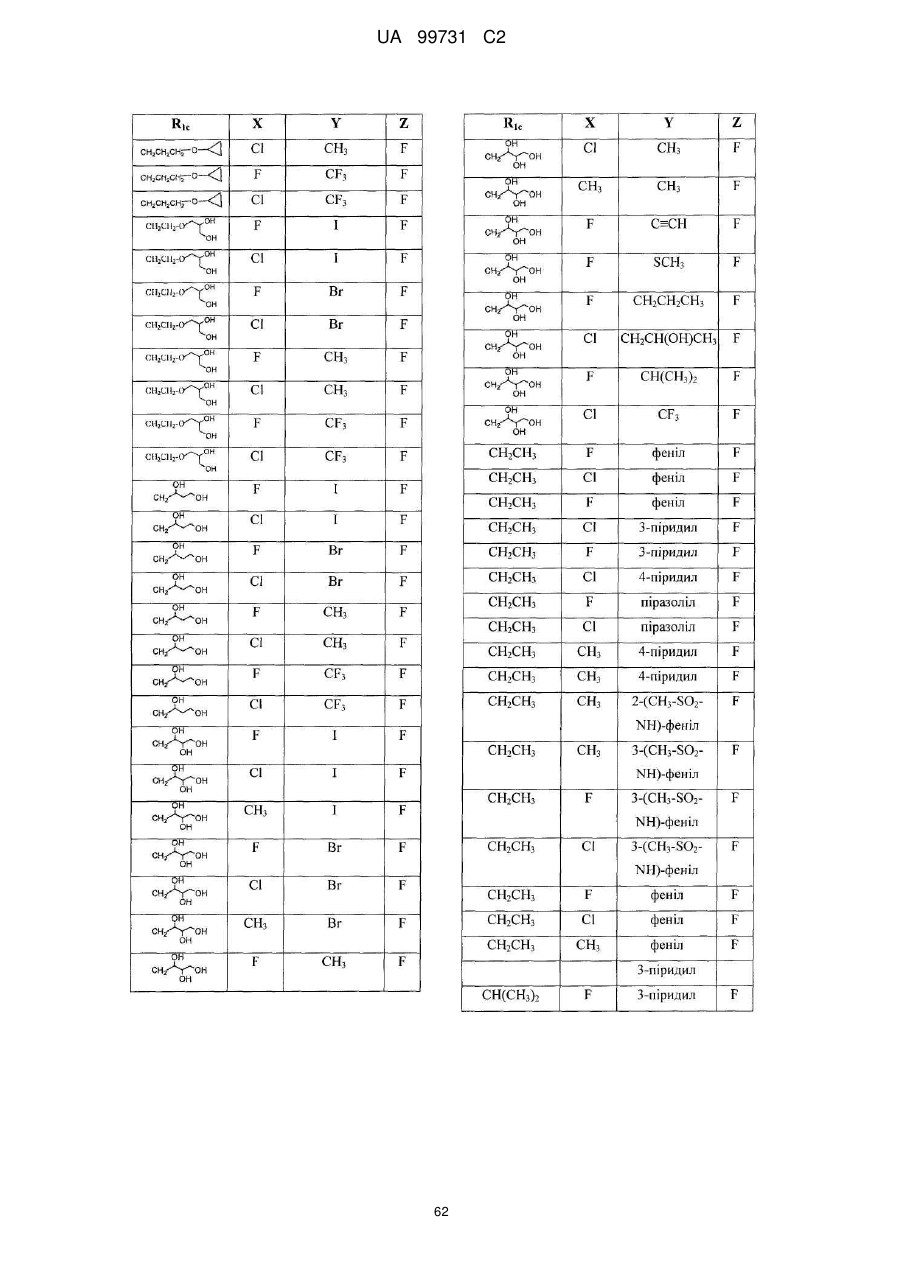
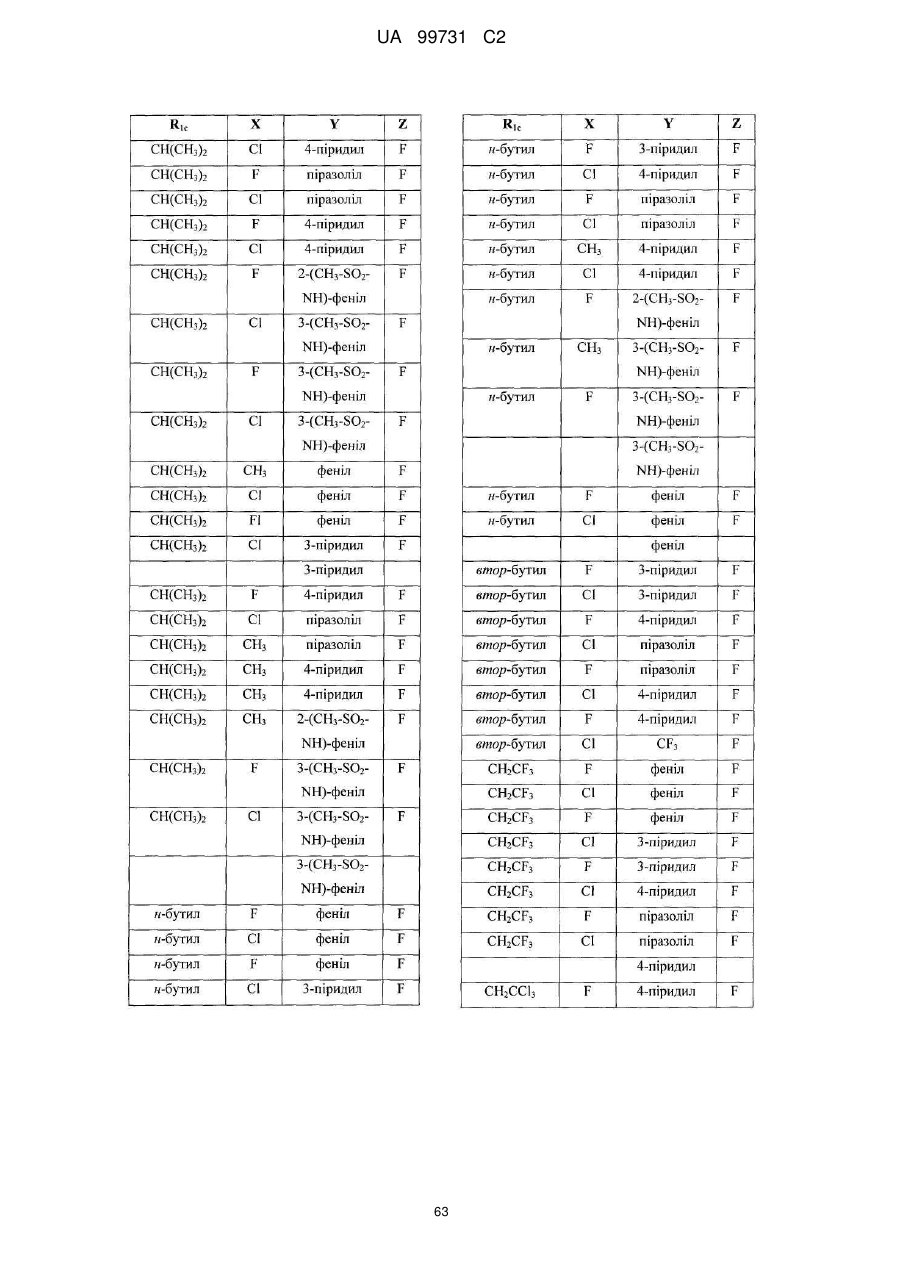
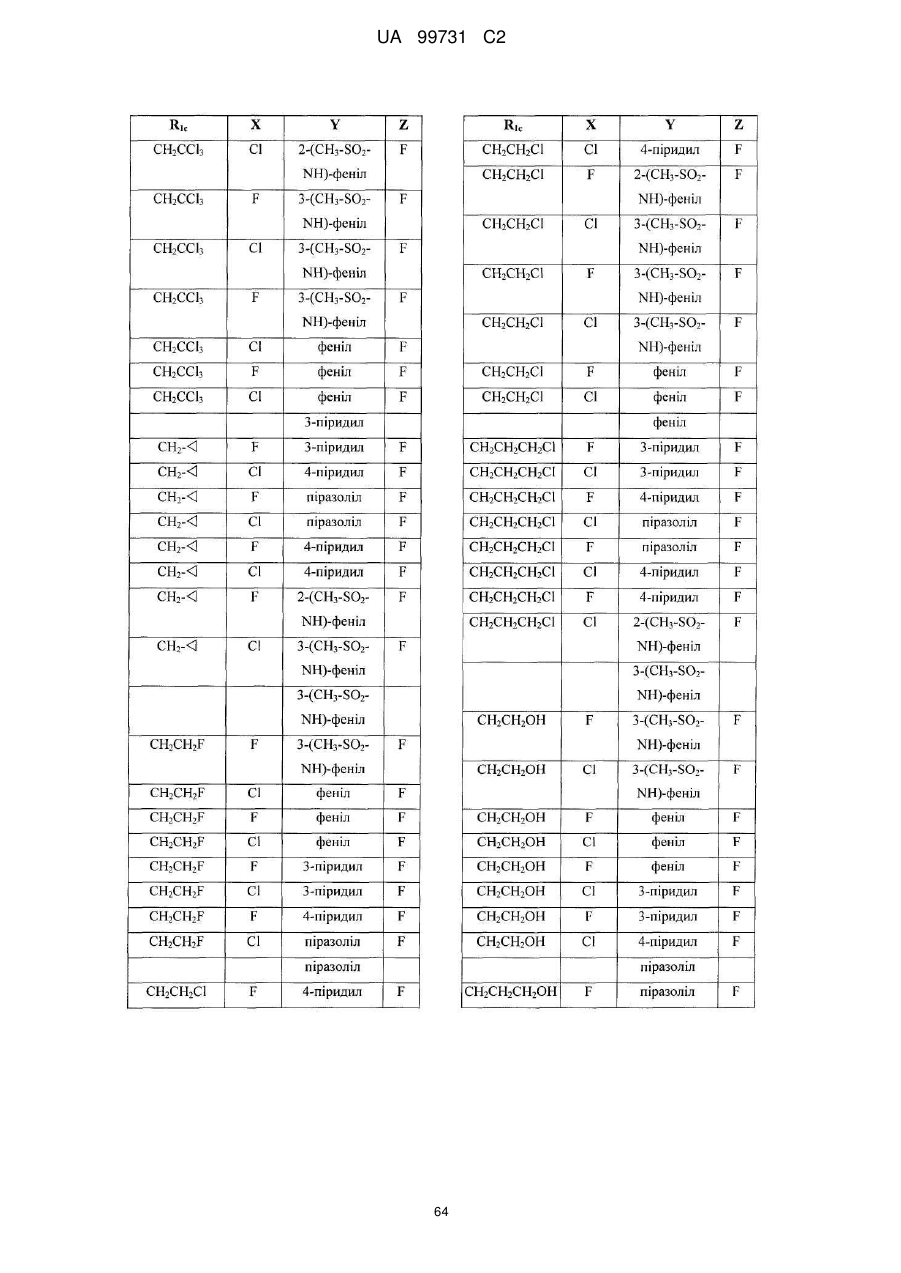
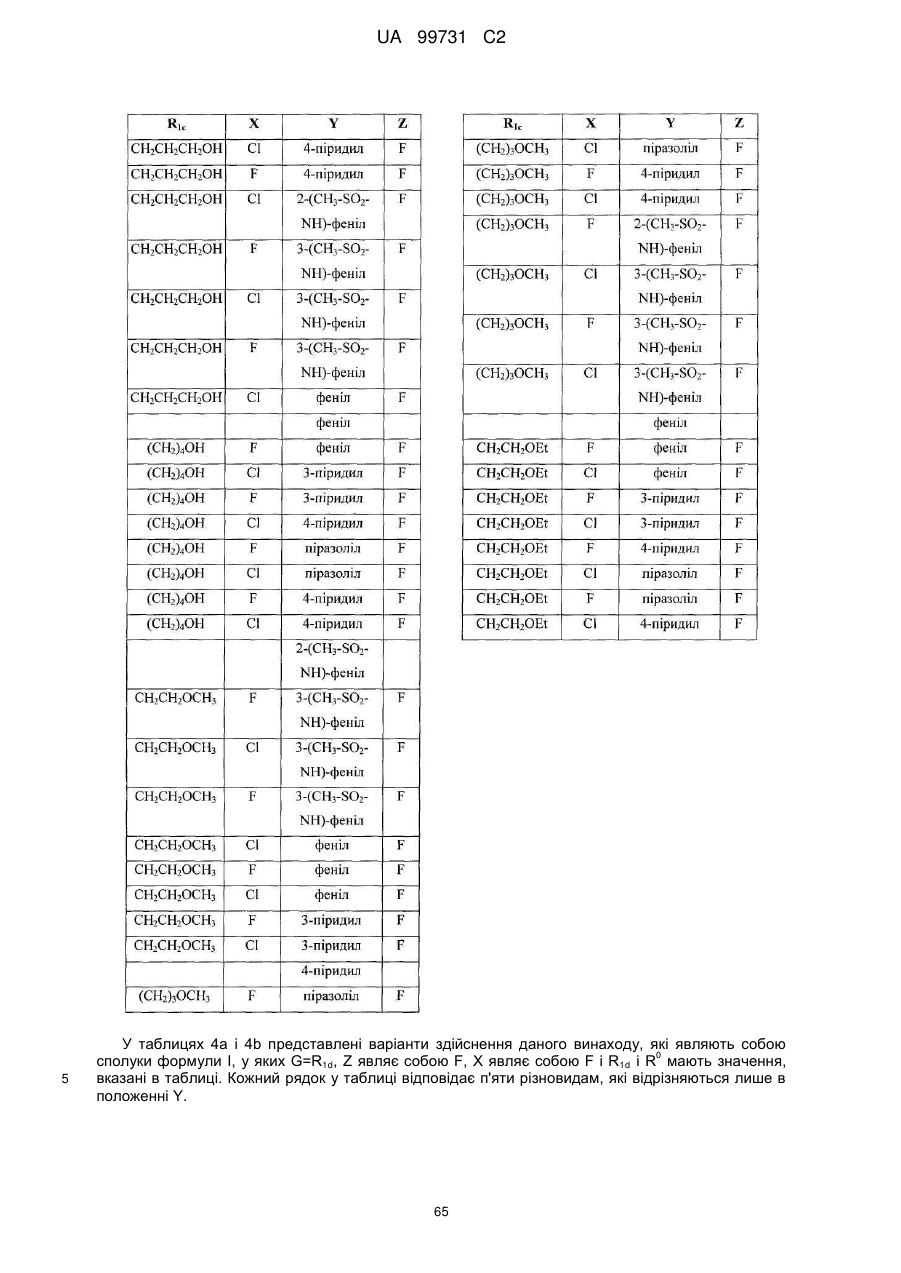
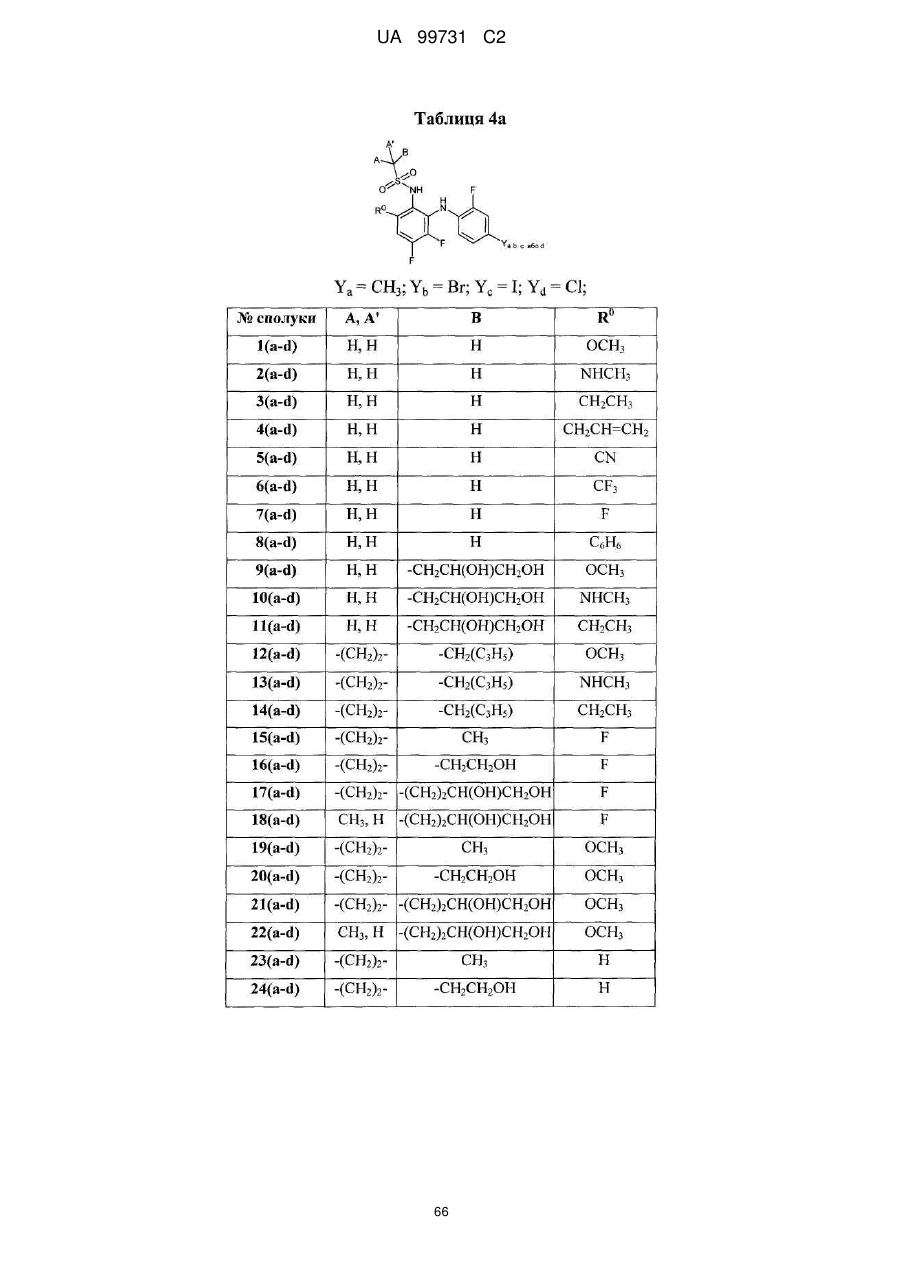
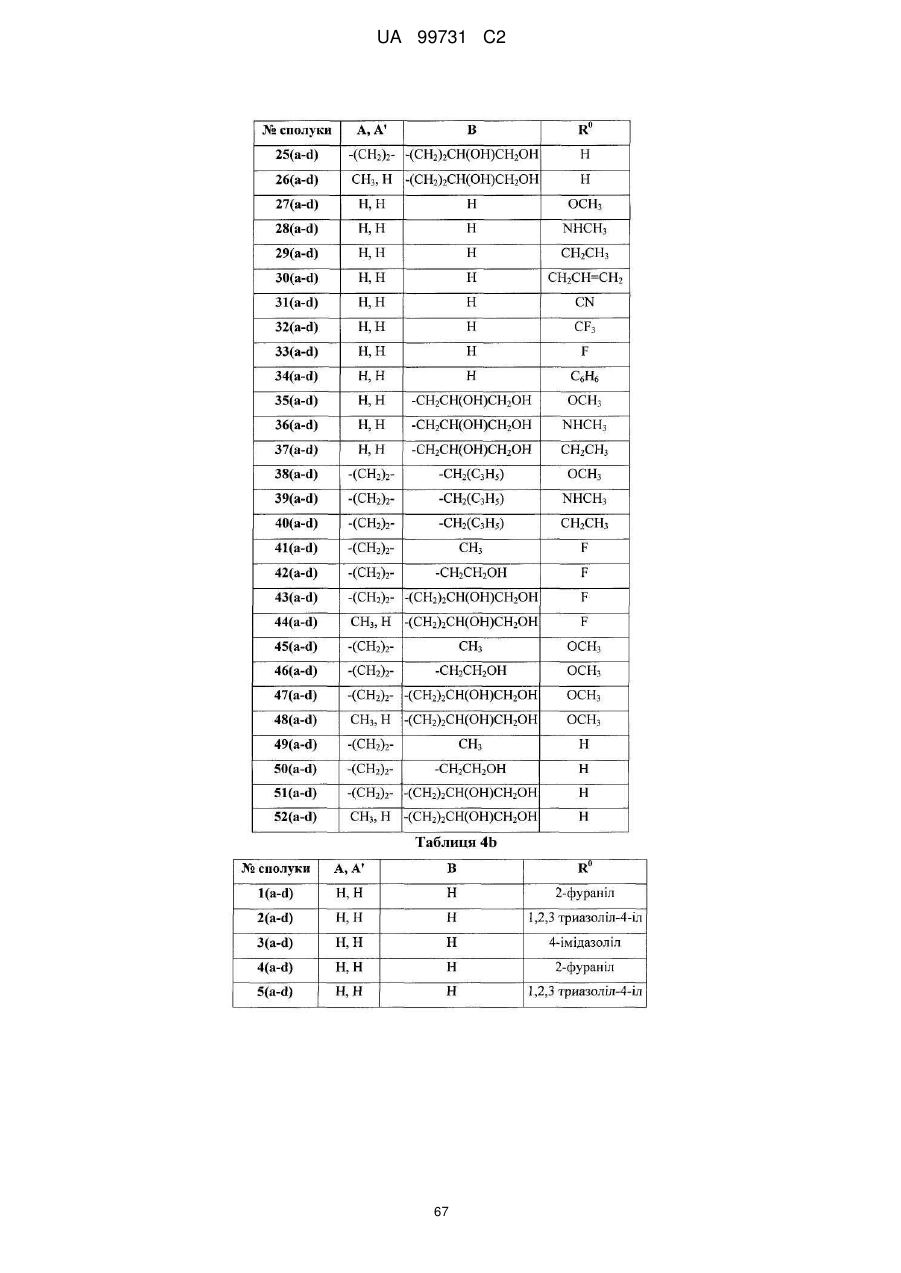
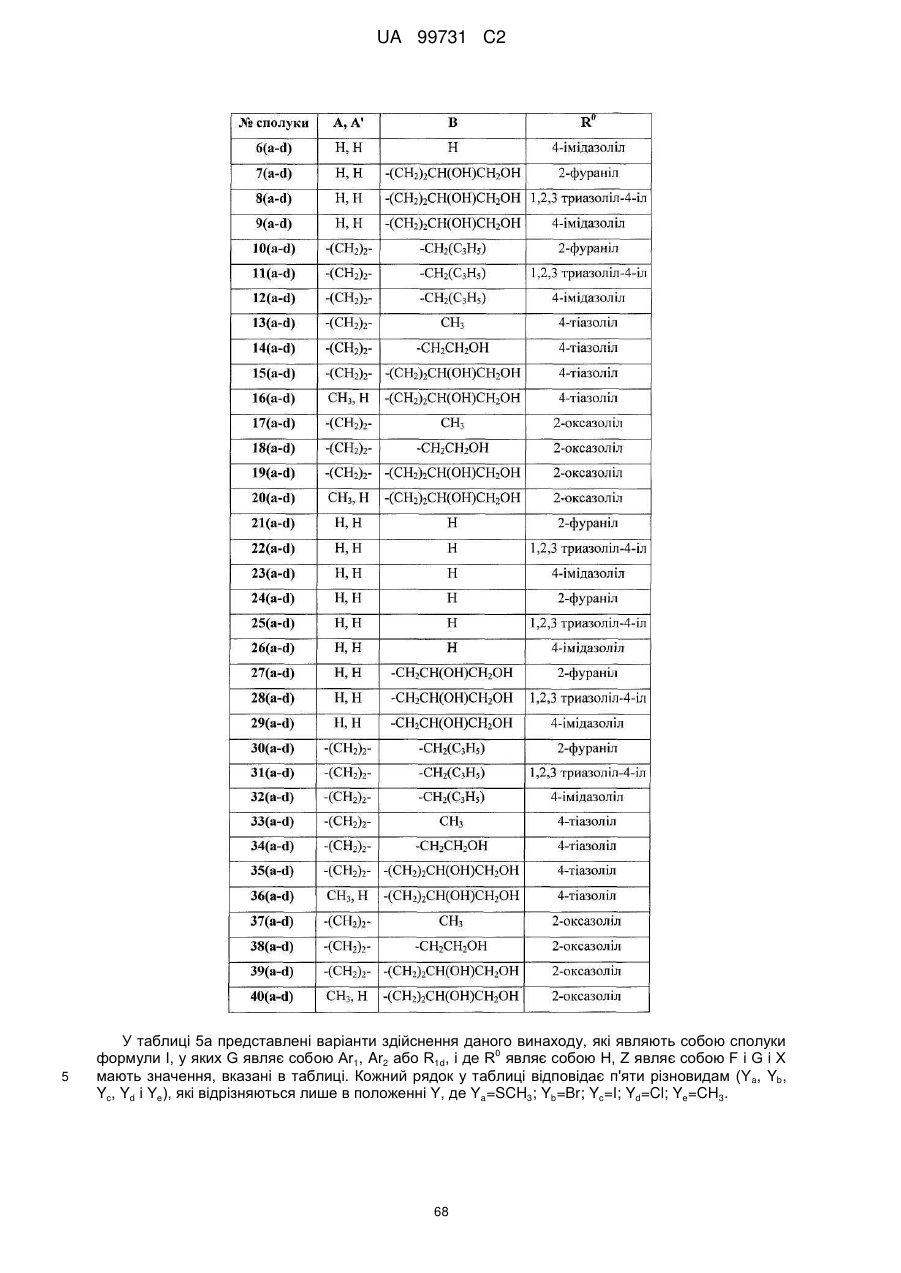
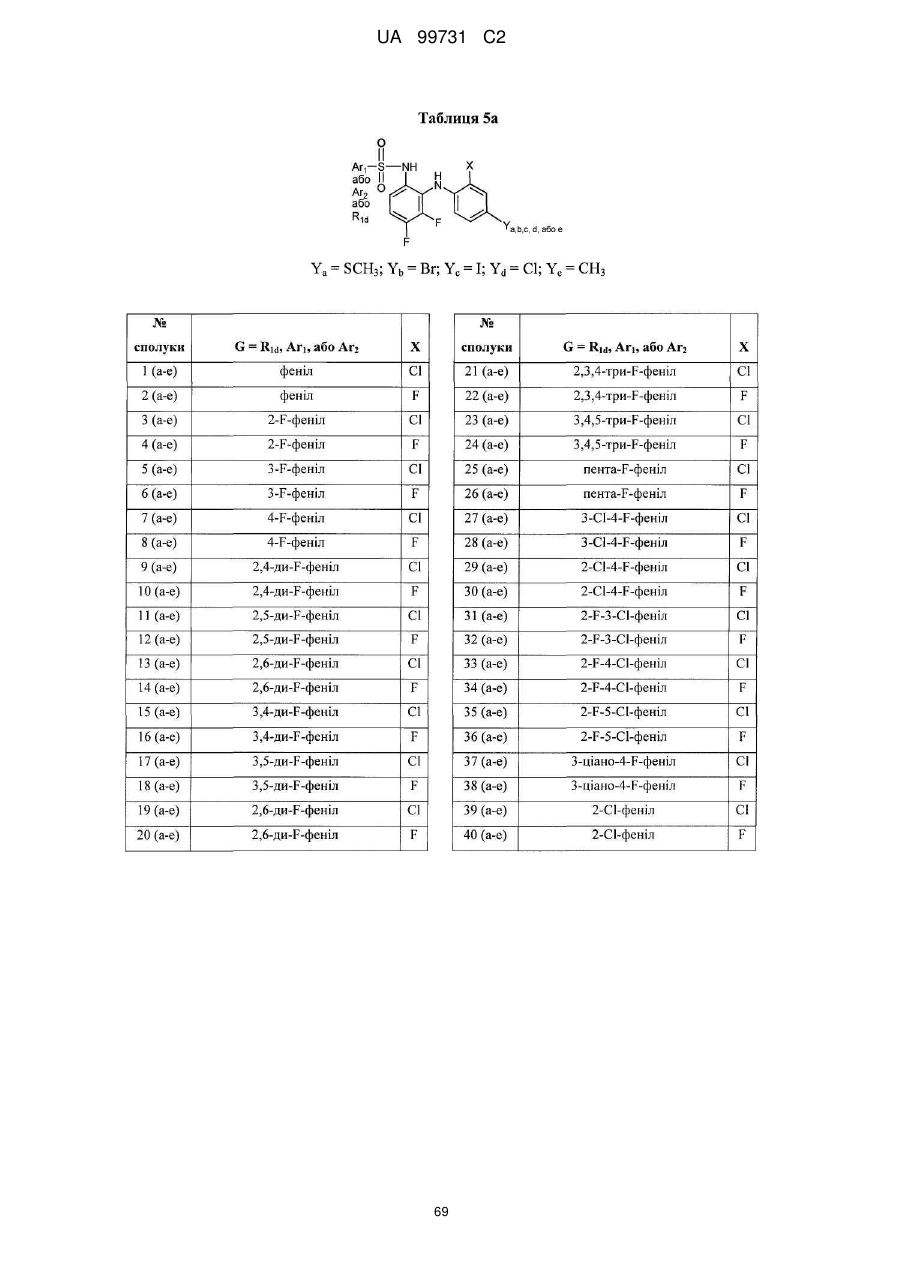
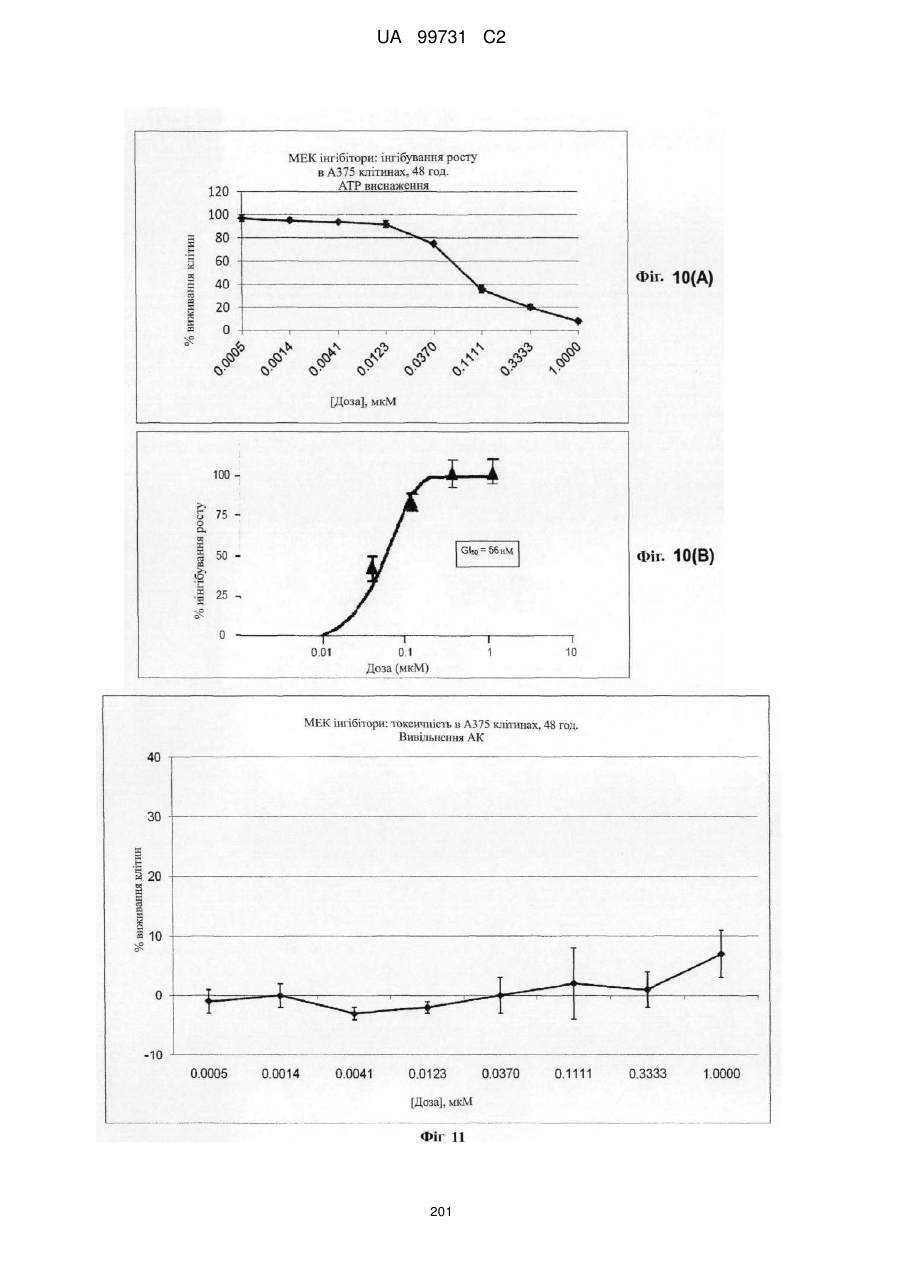
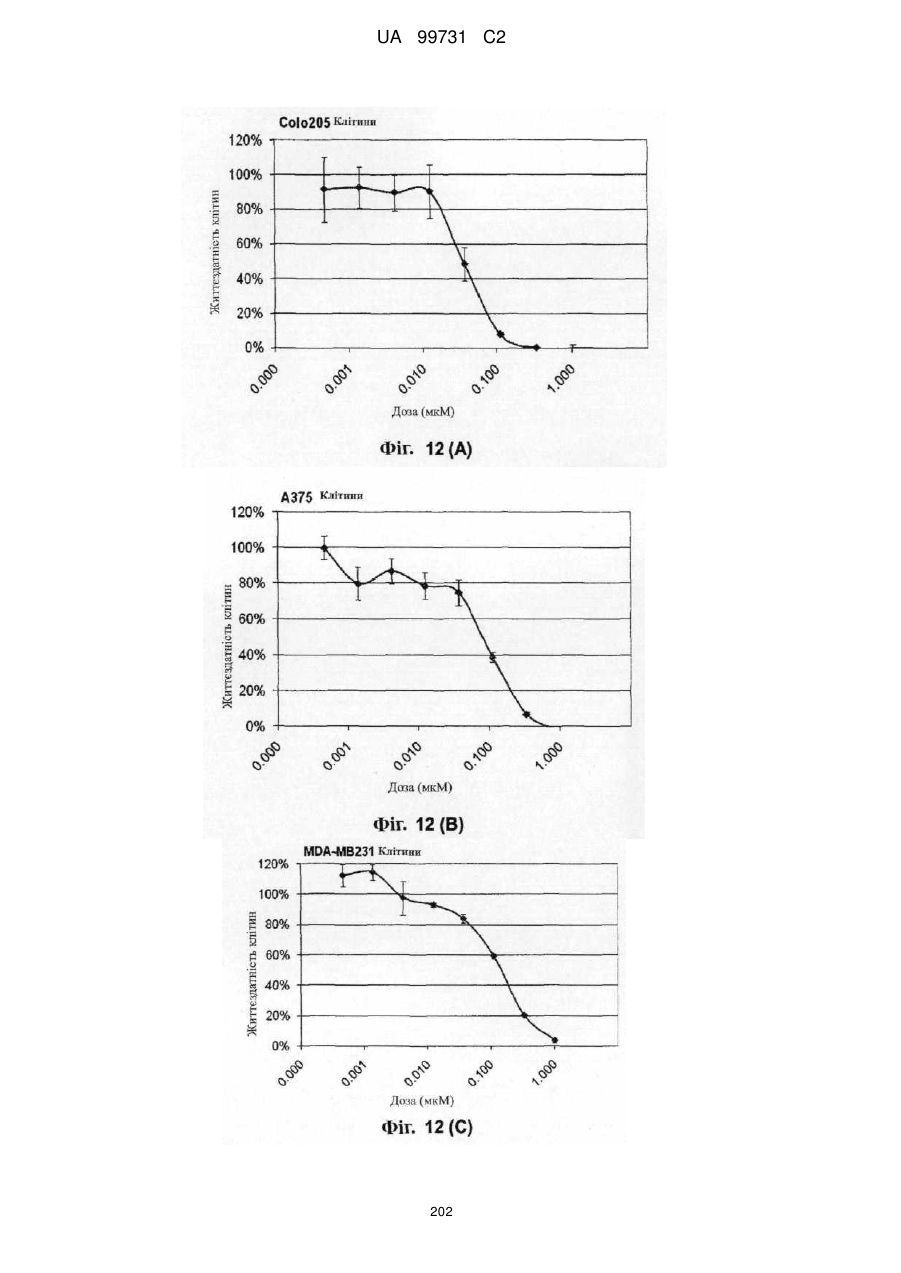
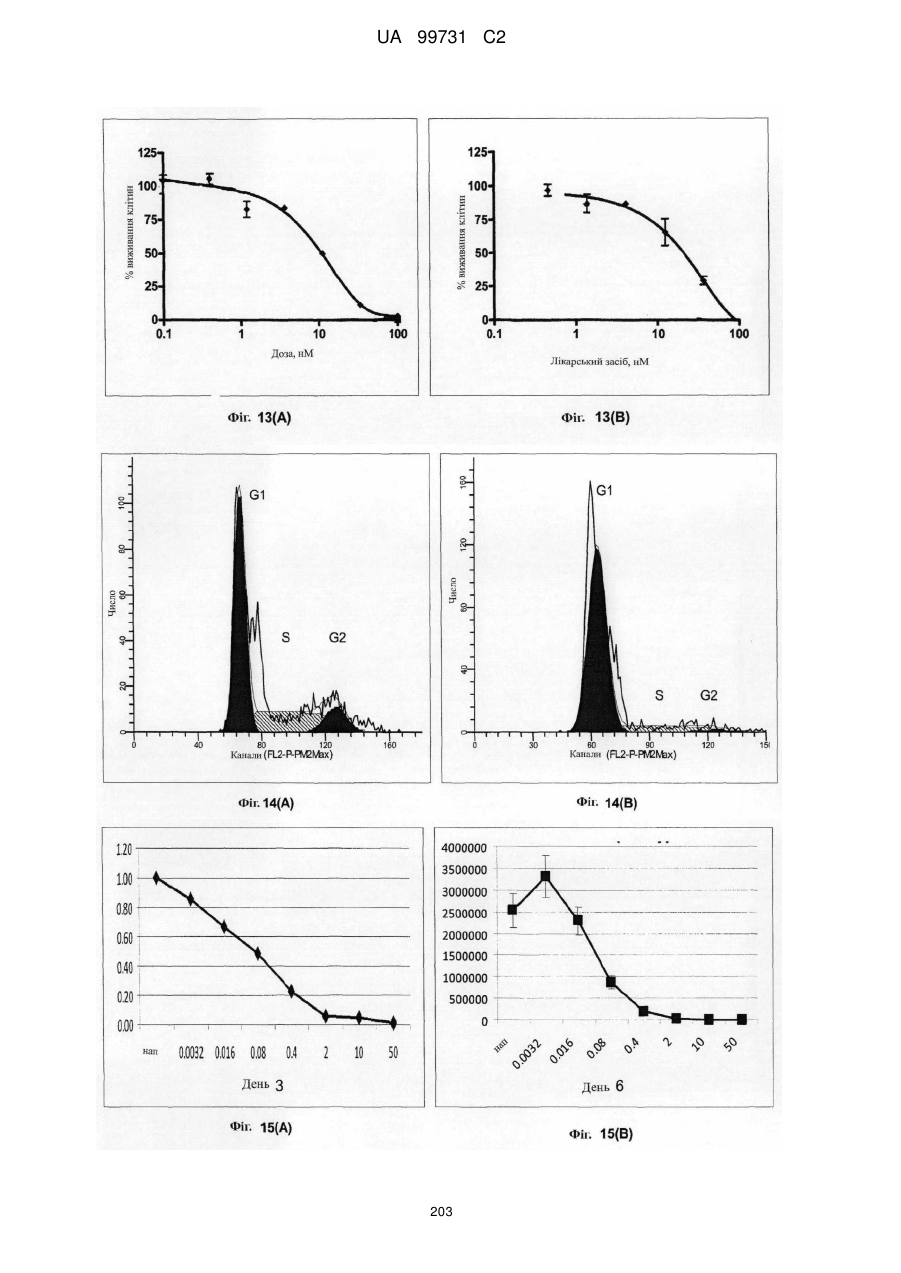
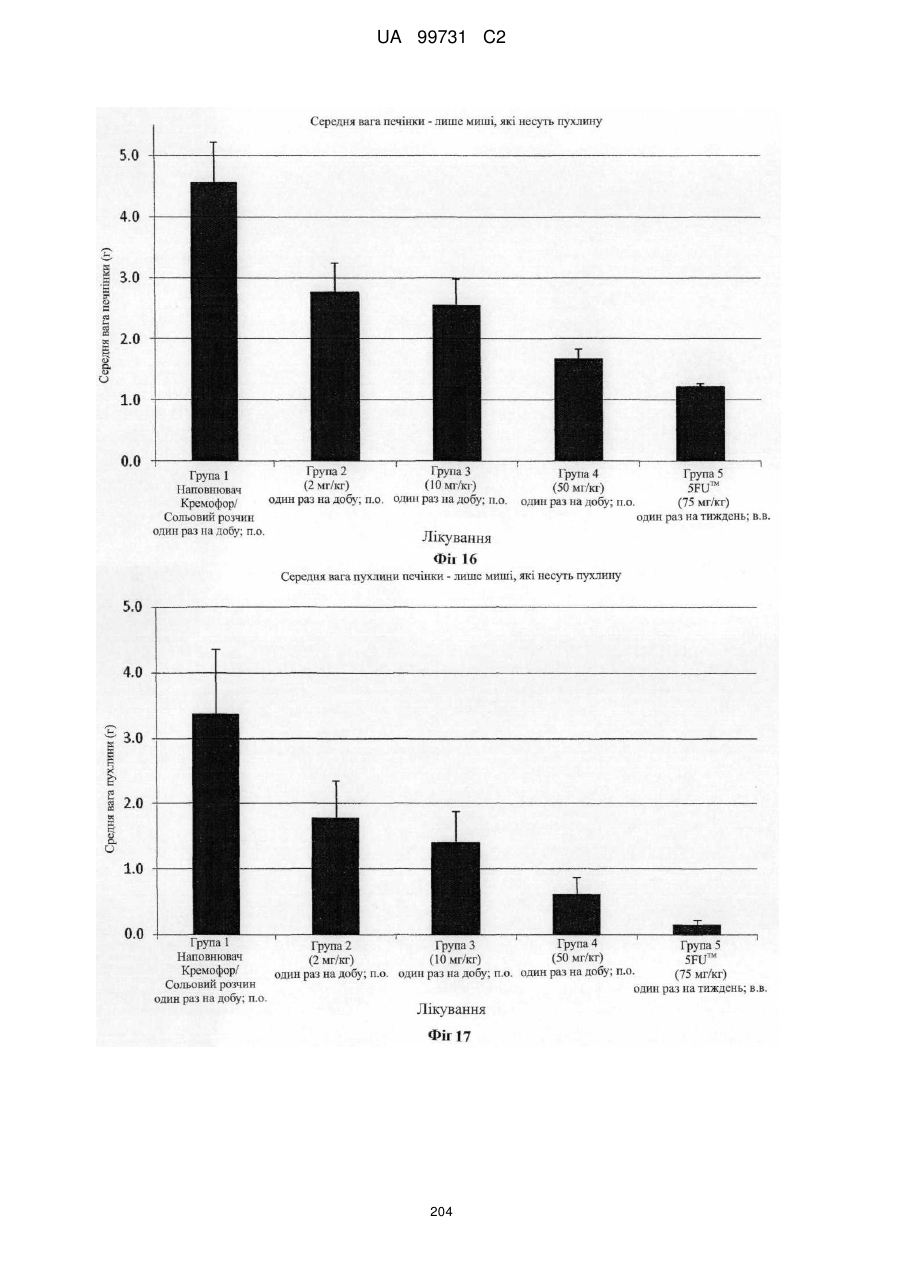
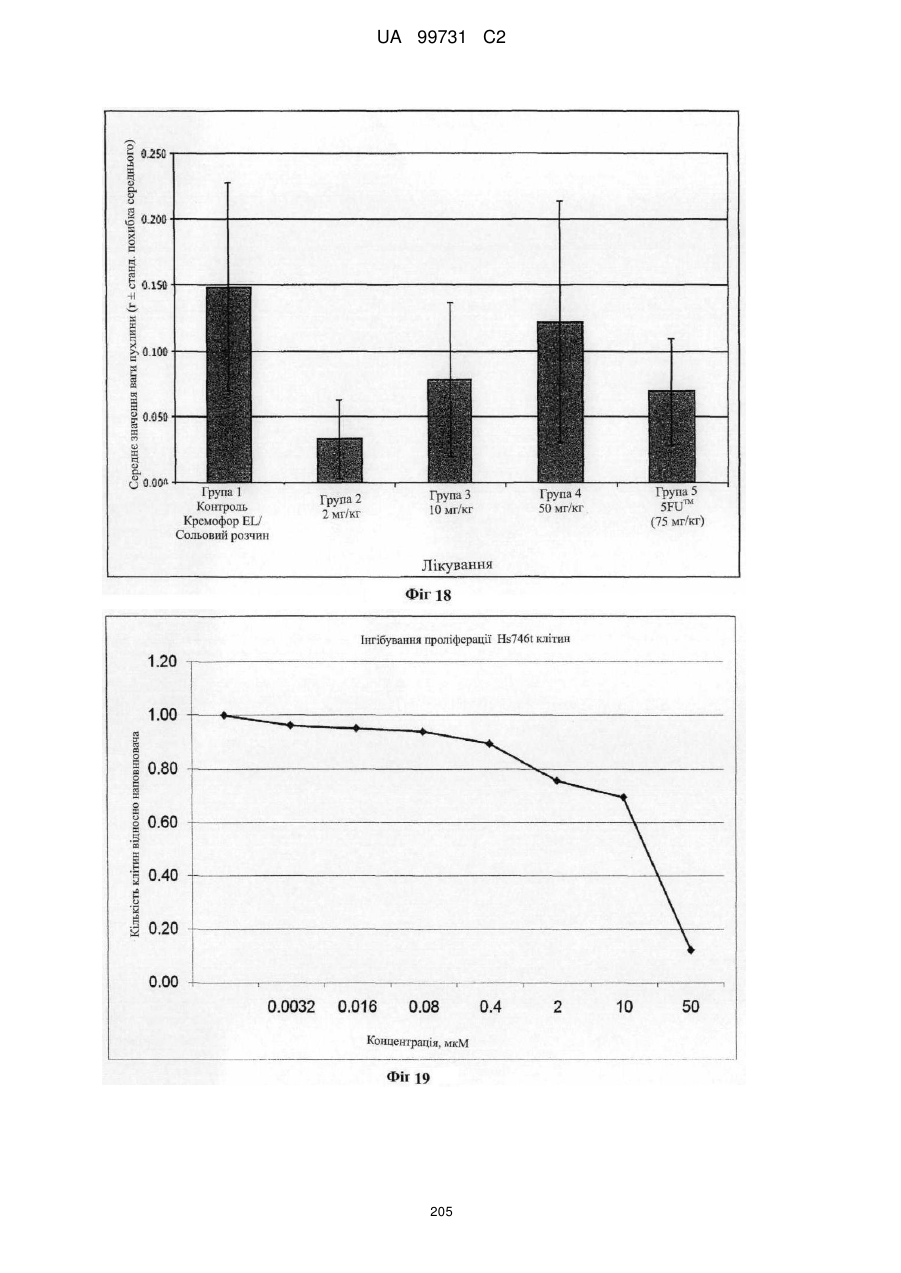
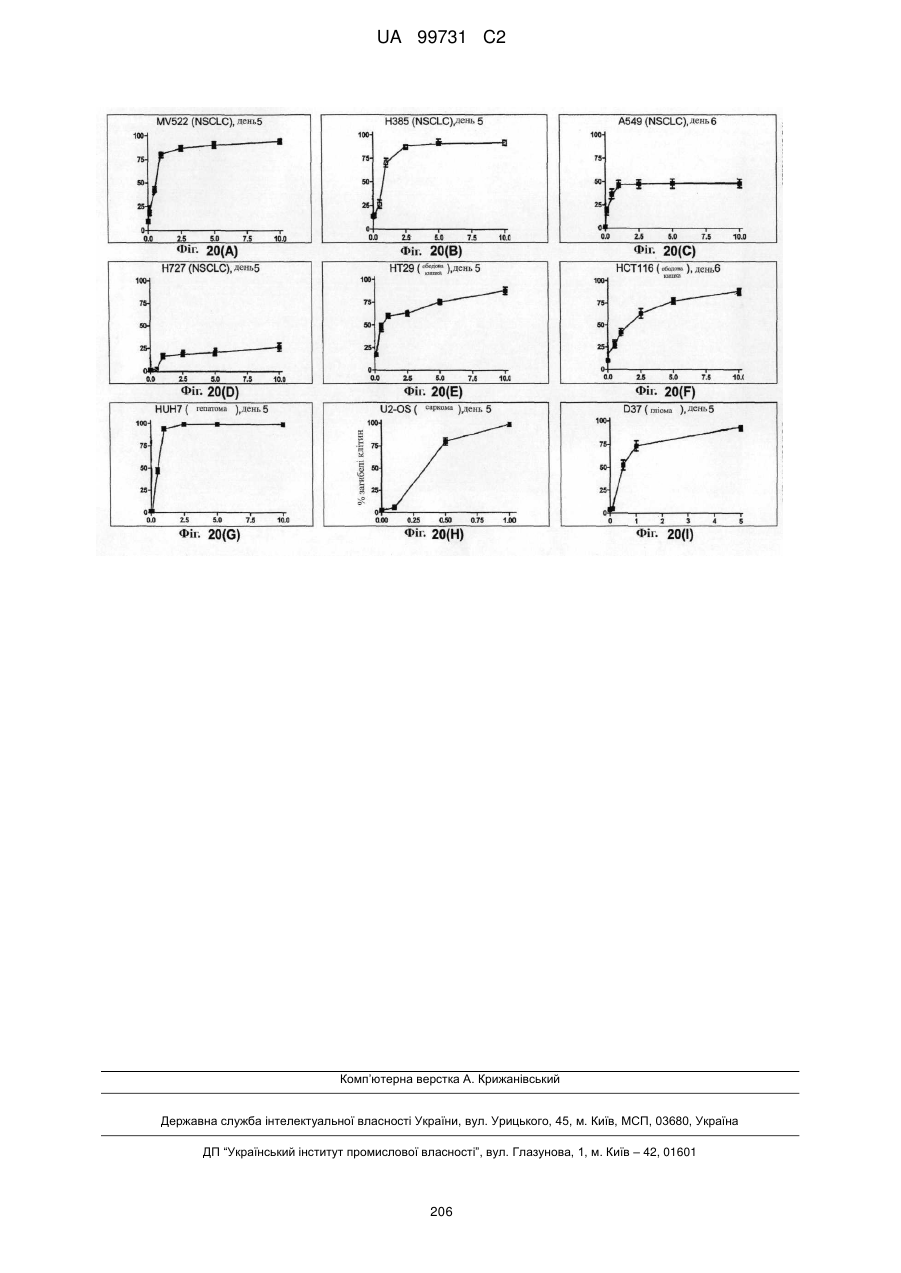
Кристалічні поліморфні форми n-(ариламіно)сульфонамідів як інгібітори мек, композиція (варіанти) та застосування
Номер патенту: 99731
Опубліковано: 25.09.2012
Автори: Роулінгс Колін Едвард, Верньє Жан-Мішель, Жірарде Жан-Люк, Мінер Джеффрі Н., Куорт Баррі, Дімок Стюарт
Формула / Реферат
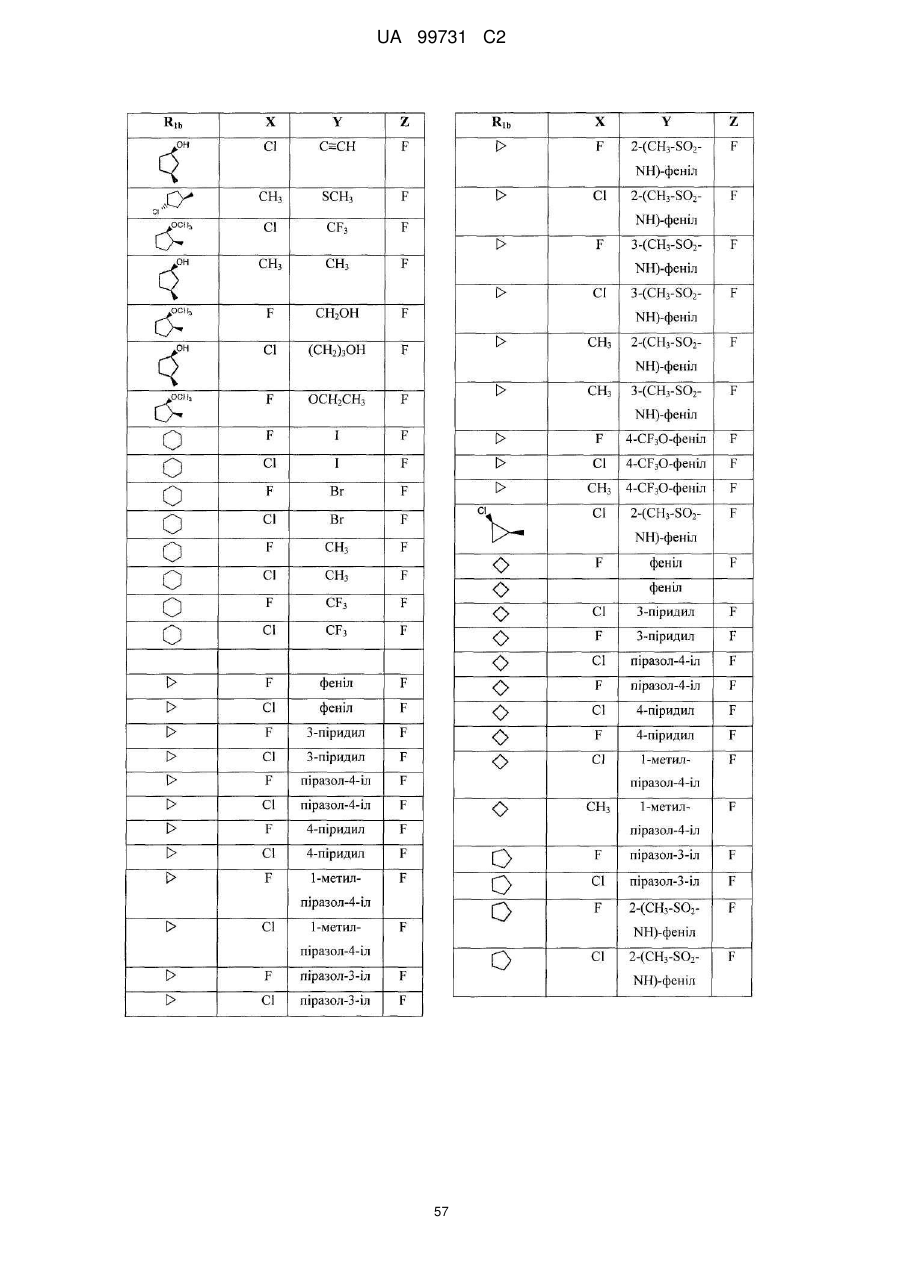
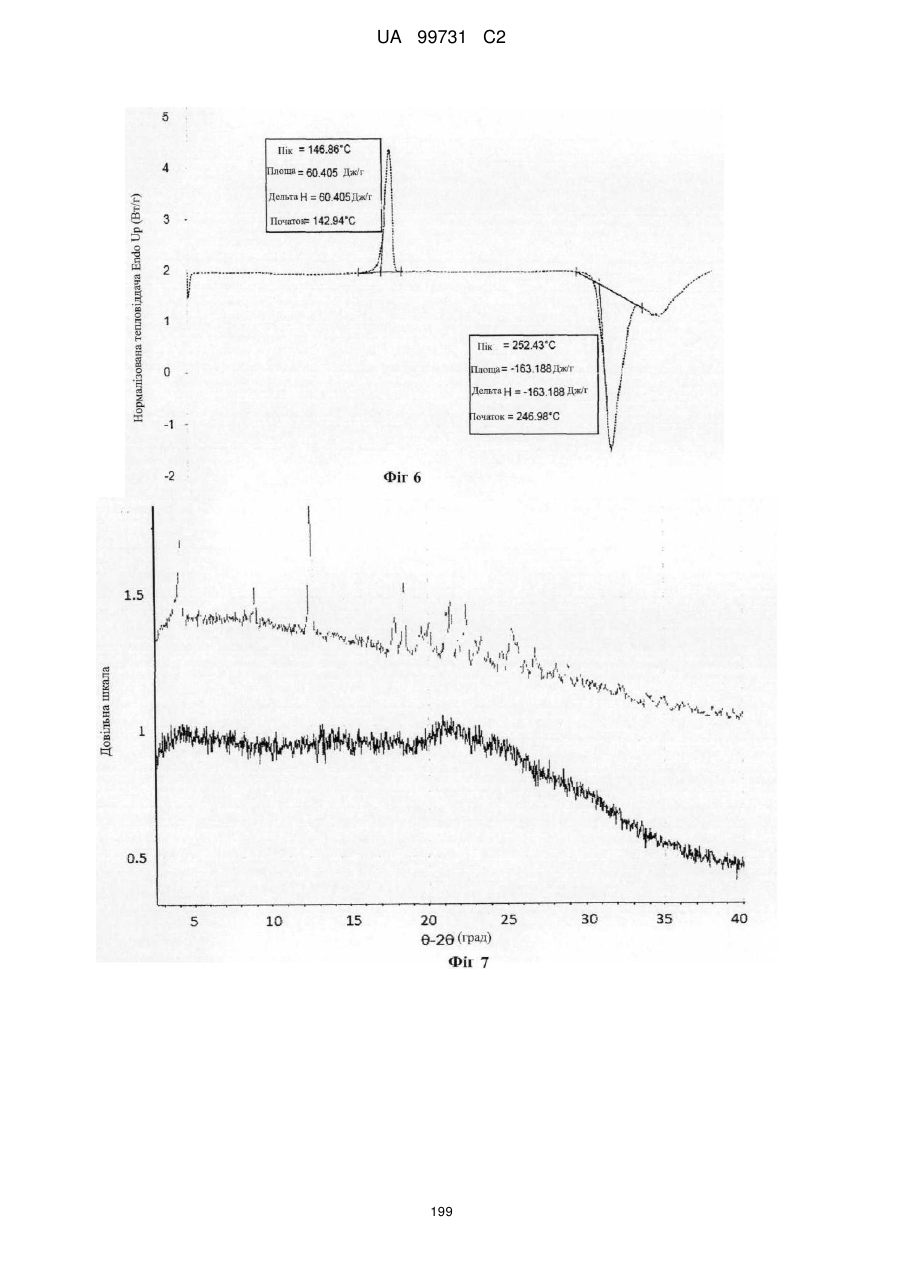
1. Кристалічна поліморфна форма А N-(-)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, що проявляє порошкову рентгенограму, яка містить принаймні 50 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фігурі 5.
2. Кристалічна поліморфна форма А за пунктом 1, де порошкова рентгенограма містить принаймні 70 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фігурі 5.
3. Кристалічна поліморфна форма А за пунктом 1, де порошкова рентгенограма містить принаймні 90 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фігурі 5.
4. Кристалічна поліморфна форма А за пунктом 1, де порошкова рентгенограма по суті ідентична до порошкової рентгенограми, представленій на фігурі 5.
5. Кристалічний поліморф за будь-яким із пунктів 1-4, де кристалічний поліморф має точку плавлення, що проявляється, як визначено за допомогою диференціальної сканувальної калориметрії, приблизно при 143 °С.
6. Кристалічний поліморф за будь-яким із пунктів 1-4, де кристалічний поліморф по суті не містить води.
7. Кристалічний поліморф за будь-яким із пунктів 1-4, де кристалічний поліморф по суті не містить розчинника.
8. Фармацевтична композиція, що містить ефективну кількість кристалічного поліморфу за будь-яким із пунктів 1-4 і принаймні один наповнювач або носій.
9. Кристалічна поліморфна форма А N-(-)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, що проявляє картину диференціальної сканувальної калориметрії, по суті ідентичну до картини диференціальної сканувальної калориметрії, представленої на фігурі 6.
10. Кристалічна поліморфна форма за пунктом 9, де кристалічний поліморф має точку плавлення, що проявляється, як визначено за допомогою диференціальної сканувальної калориметрії, приблизно при 143 °С.
11. Кристалічна поліморфна форма за пунктом 9 або 10, де кристалічний поліморф по суті не містить води.
12. Кристалічна поліморфна форма за будь-яким із пунктів 9-11, де кристалічний поліморф по суті не містить розчинника.
13.Фармацевтична композиція, що містить ефективну кількість кристалічної поліморфної форми за будь-яким із пунктів 9-12 і принаймні один наповнювач або носій.
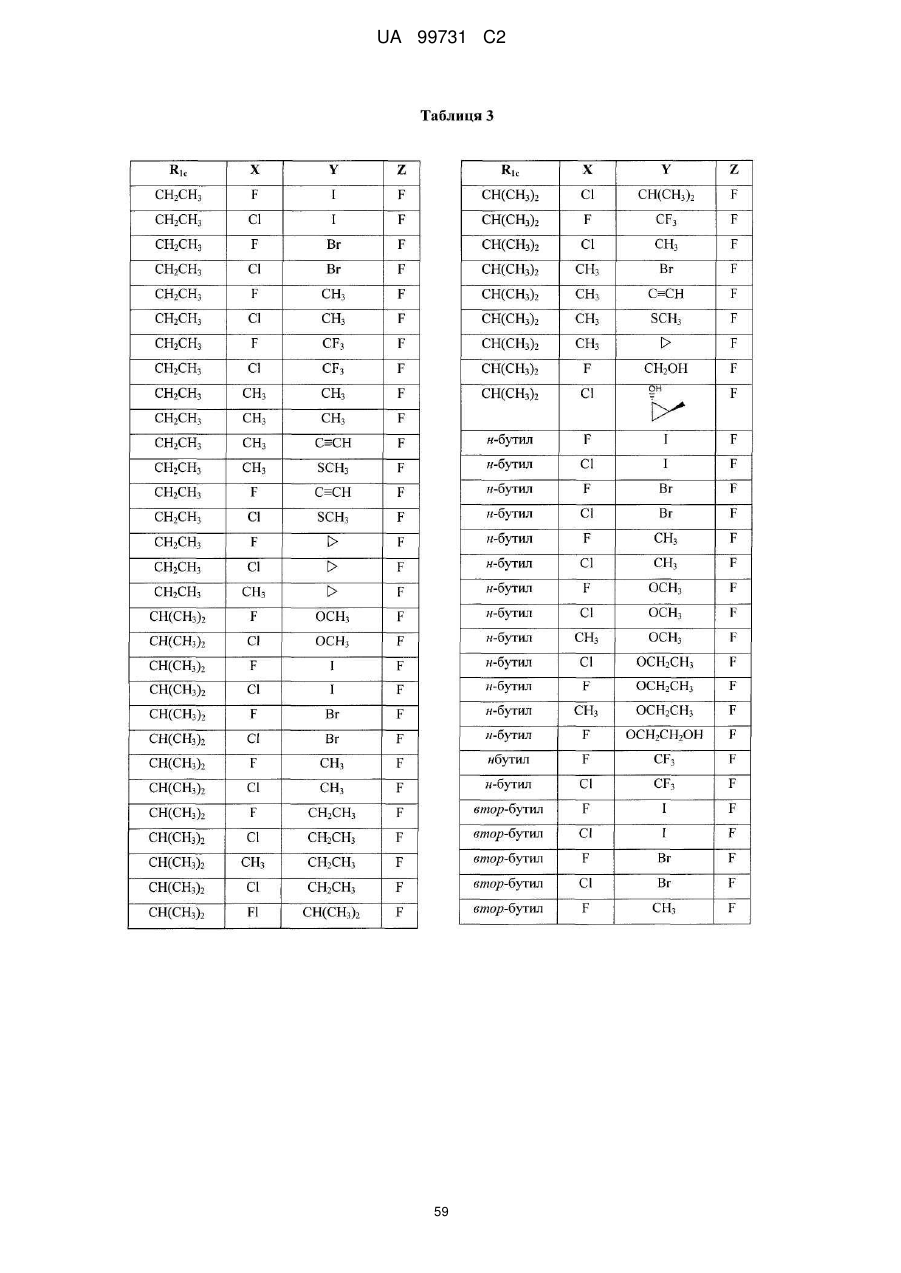
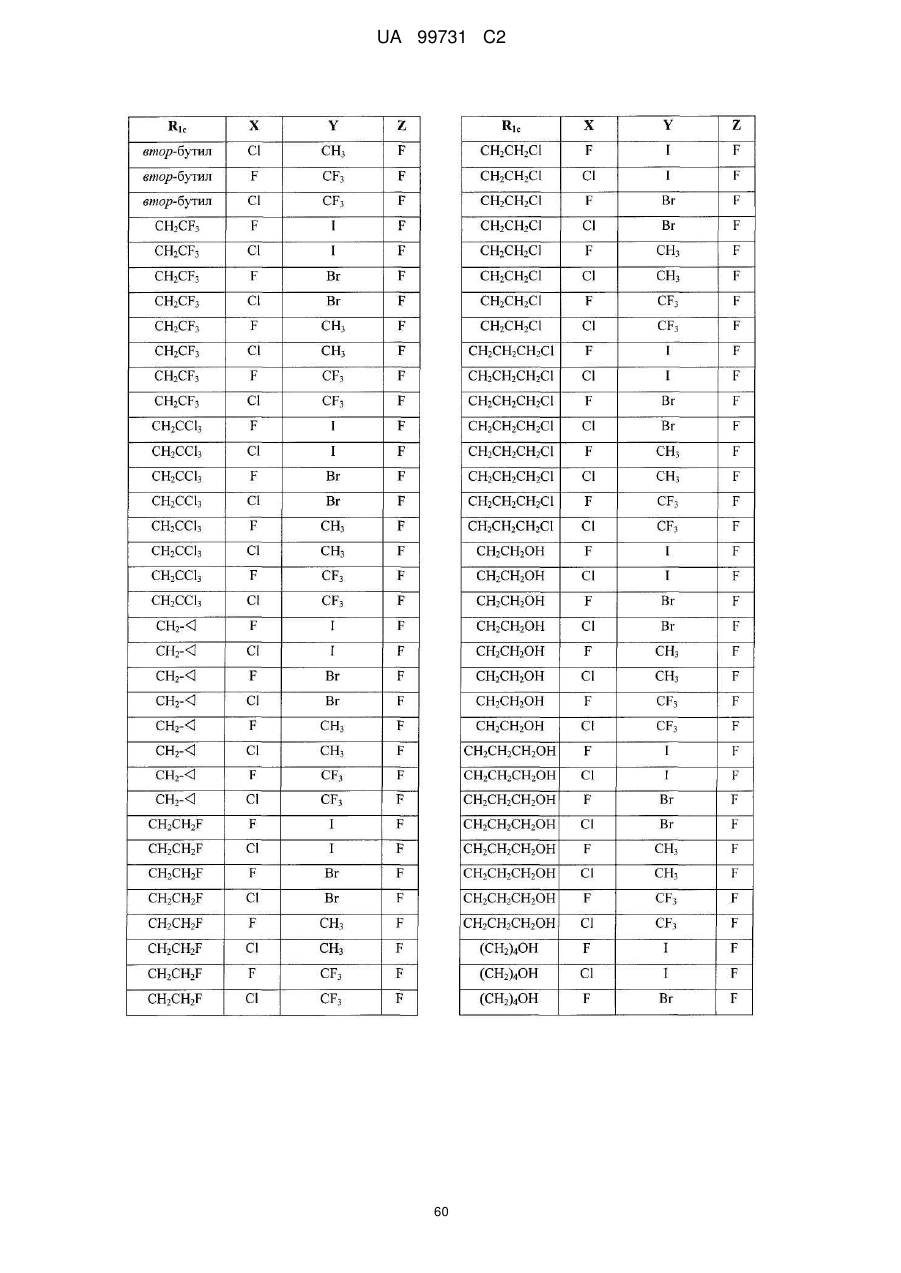
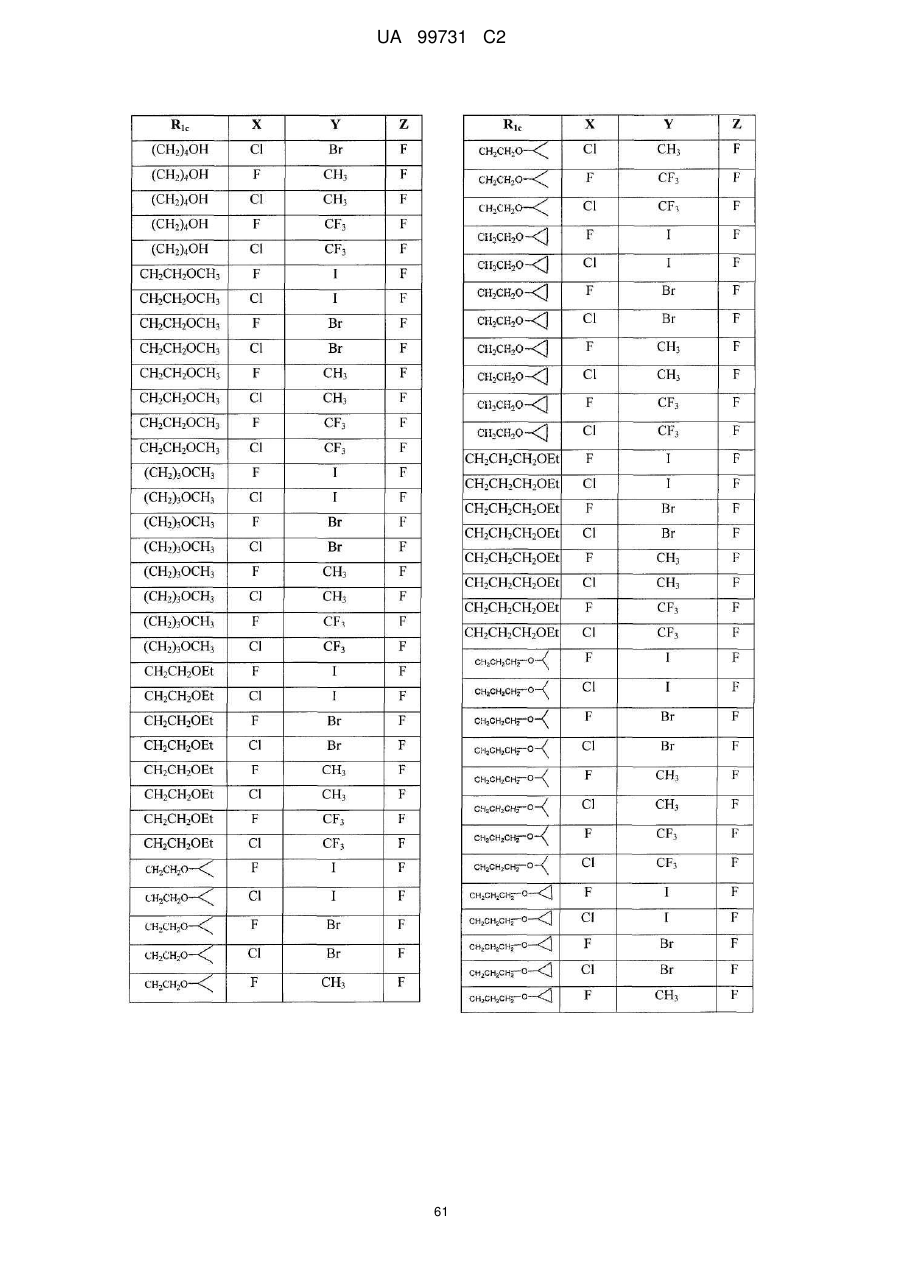
14. Поліморфна форма N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, отримана за допомогою способу, який включає стадію кристалізації аморфного N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду.
15. Поліморфна форма за пунктом 14, де стадія кристалізації включає кристалізацію з суміші етилацетату й гептану.
16. Поліморфна форма за пунктом 15, де суміш етилацетату й гептану міститься у кількісному відношенні від приблизно 1-4 частин етилацетату до приблизно 2-10 частин гептану.
17. Поліморфна форма за пунктом 15, де суміш етилацетату й гептану міститься у кількісному відношенні від приблизно 2 частин етилацетату до приблизно 5 частин гептану.
18. Застосування сполуки або композиції за будь-яким з пунктів 1-17 для приготування лікарського засобу для лікування порушення, опосередкованого МЕК, в індивідуума, що страждає від вказаного порушення.
19. Застосування за пунктом 18, де вказане порушення, опосередковане МЕК, вибирають з групи, яка включає запальні захворювання, інфекції, аутоімунні порушення, удар, ішемію, порушення серцевої діяльності, неврологічні порушення, фіброгенетичні порушення, проліферативні порушення, гіперпроліферативні порушення, пухлини, лейкози, новоутворення, злоякісні новоутворення, карциноми, метаболічні захворювання й злоякісні захворювання.
20. Застосування сполуки або композиції за будь-яким із пунктів 1-17 для приготування лікарського засобу для лікування або профілактики проліферативного захворювання в індивідуума.
21. Застосування за пунктом 20, де вказане проліферативне захворювання являє собою злоякісне новоутворення, псоріаз, рестеноз, захворювання або атеросклероз.
22. Застосування за пунктом 21, де вказане злоякісне новоутворення являє собою рак головного мозку, рак молочної залози, рак легені, рак яєчників, рак підшлункової залози, рак передміхурової залози, рак нирки, рак ободової і прямої кишки, лейкоз, мієлолейкоз, гліобластому, фолікулярну лімфому, гострий лейкоз попередників В-клітин, В-клітинний хронічний лімфолейкоз, рак шлунка, мезотеліому або дрібноклітинний рак легенів.
23.Застосування за будь-яким із пунктів 20, 21 або 22, що додатково включає введення принаймні одного терапевтичного засобу або принаймні однієї додаткової протиракової терапії, такої як променева терапія, лікування за допомогою інгібітора іншого ферменту, що відрізняється від МЕК, хіміотерапія, хірургія, глюкокортикоїд, метотрексат, модифікатори біологічної відповіді або будь-яка їх комбінація.
Текст
Реферат: Даний винахід стосується N-(2-ариламіно)арилсульфонамідних сполук, які є інгібіторами МЕК, включаючи кристалічні поліморфні форми, які проявляють специфічний профіль порошкової рентгенограми та/або специфічний профіль диференціальної сканувальної калориметрії. Даний винахід також стосується фармацевтичних композицій, які містять сполуки, описані в даній заявці, і способів застосування сполук і композицій, описаних у даній заявці, включаючи застосування для лікування та/або запобігання злоякісному новоутворенню, гіперпроліферативним захворюванням і запальним станам. Винахід також стосується способів одержання сполук і композицій, описаних у даній заявці. UA 99731 C2 (12) UA 99731 C2 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 У даній заявці заявляється пріоритет на основі попередньої заявки US № 61/044,886, поданої 14 квітня 2008 р., 61/034,466 поданої 6 березня 2008 р., і 61/034,464, поданої 6 березня 2008 р., кожна з яких у такий спосіб у повному обсязі включена як посилання. Також у даній заявці заявляється пріоритет на основі заявки US сер. № 11/830,733, поданої 30 липня 2007 р., у якій заявляються переваги попередньої заявки US сер. № 60/833,886 поданої 28 липня 2006 р. і міжнародної заявки сер. № PCT/US2006/028326, поданої 21 липня 2006 р. яка частково продовжується, кожна з яких у такий спосіб у повному обсязі включена як посилання. У міжнародній заявці сер. № PCT/US2006/028326 також заявляється пріоритет на основі попередньої заявки US сер. №№ 60/701,814, поданої 21 липня 2005 р.; 60/706,719, поданої 8 серпня 2005 р., і 60/731,633, поданої 28 жовтня 2005 р., кожна з яких у такий спосіб у повному обсязі включена як посилання. Галузь техніки Даний винахід стосується N-(2-ариламіно) арил сульфонамідних сполук, які є інгібіторами MEK, включаючи кристалічні поліморфні форми, які проявляють специфічний профіль порошкової рентгенограми та/або специфічний профіль диференціальної сканувальної калориметрії. Даний винахід також стосується фармацевтичних композицій, які містять сполуки, описані в даній заявці, і способів застосування сполук і композицій, описаних у даній заявці, включаючи застосування для лікування та/або запобігання злоякісного новоутворення, гіперпроліферативних захворювань і запальних станів. Винахід також стосується способів одержання сполук і композицій, описаних у даній заявці. Передумови створення винаходу Онкогени - гени, які беруть участь в утворенні злоякісних новоутворень - звичайно являють собою мутовані форми звичайних нормальних клітинних генів ("прото-онкогени"). Онкогени часто кодують аномальні версії компонентів шляхів передачі сигналів, таких як рецепторні тирозинкінази, серин-треонін-кінази або нижчерозташовані сигнальні молекули. Центральними нижчерозташованими сигнальними молекулами є Ras білки, які заякорінені на внутрішній поверхні цитоплазматичних мембран, і які гідролізують зв'язаний гуанозинтрифосфат (GTP) до гуанозинтрифосфату (GDP). При активації фактором росту рецептори фактора росту ініціюють ланцюг реакцій, які приводять до активації обмінної активності гуанінових нуклеотидів на Ras. Ras по черзі перемикається між активним станом "включеним" зі зв'язаним GTP (далі в даній заявці позначається як "Ras.GTP") і неактивним "виключеним станом зі зв'язаним GDP. Активний "включений" стан, Ras.GTP, зв'язується з і активує білки, які контролюють ріст і диференціацію клітин. Наприклад, в "каскаді мітоген-активованої протеїнкінази (mitogen-activated protein kinase (MAP kinase))," Ras.GTP приводить до активації каскаду серин/треонін кіназ. Однією з декількох груп кіназ, для яких відома необхідність Ras.GTP для їх власної активації, є Raf сімейство. Raf білки активують "MEKl" і "MEK2," скорочення для активованих мітогеном ERK- активуючих кіназ (mitogen-activated ERK-activating kinases) (де ERK являє собою протеїнкіназу, регульовану позаклітинними сигналами, інше позначення для MAPK). MEKl і MEK2 є серин/треонін і тирозинпротеїнкіназами із двоїстою функцією й також відомі як кінази MAP кінази. Таким чином, Ras.GTP активує Raf, що активує MEKl і MEK2, які активують MAP кіназу (MAPK). Вважають, що активація MAP кінази мітогенами є важливою для проліферації, і конститутивна активація цієї кінази достатня для індукції клітинної трансформації. Блокування нижчерозташованого Ras передачі сигналів, як здійснюється за допомогою домінантно-негативного Raf-1 білка, може повністю інгібувати мітогенез, або внаслідок індукції з рецепторів клітинної поверхні або з онкогенних Ras мутантів. Взаємодія Raf і Ras є ключовою регуляторною стадією контролю проліферації клітин. Дотепер не було ідентифіковано інших субстратів MEK, крім MAPK; проте, у недавніх дослідженнях показано, що MEK також може активуватися іншими вищерозташованими сигнальними білками, такими як MEK кіназа або MEKKl і PKC. Активована MAPK переміщається й накопичується в ядрі, де вона може фосфорилувати і активувати транскрипційні фактори, такі як EIk-1 і Sapla, що приводить до посиленої експресії генів, таких як, наприклад, для c-fos. При активації, Raf та інші кінази фосфорилують MEK за двома сусідніми сериновими 218 222 залишками, S і S у випадку MEK1. Ці фосфорилування необхідні для активації MEK як кінази. У свою чергу, MEK фосфорилує MAP кіназу за двома залишками, розділеними єдиною 185 183 амінокислотою: тирозином, Y і треоніном, T . Вважають, що MEK міцно зв'язана з MAP кіназом перед її фосфорилуванням, що дозволяє припустити, що для фосфорилування MAP кінази за допомогою MEK може бути необхідною попередня сильна взаємодія між двома білками. Два фактори - незвичайна специфічність MEK і його необхідність для сильної взаємодії з MAP кіназою перед фосфорилуванням - підтверджує той факт, що MEK-механізм дії може 1 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 істотно відрізнятися від механізмів інших протеїнкіназ, що надають можливість виявлення селективних інгібіторів MEK. Можливо, такі інгібітори будуть діяти через алостеричні механізми, а не за допомогою більш звичайного механізму, який задіює блокування сайту зв'язування ATP. Таким чином, MEKl і MEK2 є обґрунтованими й визнаними мішенями для антипроліферативних терапій, навіть якщо онкогенна мутація не торкається структури або експресії MEK. Див., наприклад, Опубліковані заявки на патент US 2003/0149015 (винахідники Barrett та ін.) і 2004/0029898 (винахідники Boyle та ін.). Описано декілька прикладів l-заміщених-2(п-заміщених-феніламіно)-арильних інгібіторів MEK. У патентах US №№ 6,440,966 і 6,750,217 і відповідній публікації WO 00/42003 описані складні ефіри карбонової й гідроксамової кислоти й N-заміщені амідні похідні складних ефірів сульфонамід-заміщених-2(4-йодфеніламіно)-бензойної кислоти й N-заміщених бензамідів, які діють як MEK інгібітори. Сульфонамід також може бути N-заміщеним. У патенті US 6,545,030 і відповідній публікації WO 00/42029 описані MEK інгібітори, які являють собою l-гетероцикліл-2(4-йодфеніламіно)-бензол, де гетероцикл являє собою п'ятичленне азотвмісне кільце, таке як піразол, триазол, оксазол, ізоксазол, і ізоксазолінон. У більш пізній опублікованій заявці на патент US 2005/004186 описані споріднені сполуки, у яких 4йод замісник патенту US 6,545,030 замінений дуже великим класом компонентів, таких як алкіл, алкокси, ацилокси, алкеніл, карбамоїл, карбамоїлалкіл, карбоксил, карбоксилалкіл, Nацилсульфонамідо, та інші. У патенті US 6,469,004 і відповідної публікації WO 00/42022 описані складні ефіри карбонової й гідроксамової кислот групи гетероцикло-конденсованих феніленових сполук, тобто, бензимідазоли, бензооксазоли, бензотіазоли, бензотіадіазоли, хіназоліни й ін. Гетероцикли являють собою складні ефіри 7-F-6-(4-йод-феніламіно)-5-карбонової кислоти, аміди карбонової кислоти або складні ефіри гідроксамової кислоти. У більш пізніх публікаціях US 2005/0026970 описані подібні сполуки, у яких 4-йод замісник замінений дуже великим класом структур. Споріднені сполуки описані в опублікованих патентних заявках WO 03/077855, WO 03/77914 і US 2005/0554701. Подальші приклади складних ефірів 2-(4-йодфеніламіно)-фенілгідроксамової кислоти, які описані як придатні як MEK інгібітори, можна знайти в WO 2005/028426. В опублікованій патентній заявці WO 02/06213 і відповідній заявці US сер. № 10/333,399 (US 2004/0054172) описані гідрокси-заміщені кислотні ефіри 1-оксамінової кислоти- 2(4галофеніламіно)-3,4-дифторбензолу. У патенті US № 6,891,066 і відповідній публікації WO 03/62191 описані подібні сполуки, у яких 4-гало замісник замінений дуже великим класом структур. Замісниками в 4-ому положенні є метил, етил, етиніл, і 2-гідроксіетил. Специфічні подібні сполуки описані в патенті US № 6,770,778. У патентній заявці WO 04/083167, опублікованій 30 вересня 2004 р. (японською мовою) описано більше двох тисяч - але представлені ЯМР-дані лише для 400-l-(N-заміщених сульфоніл сечовина)-2(2,4-дигалофеніламіно)-3,4-дифторбензолів і передбачається, що вони є придатними як MEK інгібітори. Дані, що вказують на інгібування MEK, представлені лише для підгрупи із дванадцяти сполук. Додатково до вторинного або третинного аміну, ці дванадцять сполук усі містять одну з наступних груп: N, N-двозаміщену сульфоніл сечовину, N-піперазинсульфонамід, N-піперидинсульфонамід або N-піролідинсульфонамід. MEK каскад також залучений у запальні захворювання й порушення. В опублікованій заявці на патент US № 2006/0030610 (винахідники Koch та ін.), опублікованій заявці на патент US № 2006/0140872 (винахідники Furue та ін.). Вони включають як гострі, так і хронічні запальні порушення. Прикладами таких порушень є алергічний контактний дерматит, ревматоїдний артрит, остеоартрит, запальні захворювання кишечнику, хронічне обструктивне захворювання легенів, псоріаз, розсіяний склероз, астма, захворювання й порушення, зв'язані з ускладненнями діабету, і запальні ускладнення сердцевосудинної системи, такі як гострий коронарний синдром. Запальними захворюваннями кишечнику є хвороба Крона й виразковий коліт. MEKl і MEK2 є обґрунтованими й визнаними мішенями для антипроліферативних терапій, навіть якщо онкогенна мутація не торкається структури або експресії MEK. Див., наприклад, опубліковані заявки на патент US 2003/0149015 (винахідники Barrett та ін.) і 2004/0029898 (винахідники Boyle та ін.). Сутність винаходу У даному винаході забезпечуються сполуки формули I, або їх фармацевтично прийнятні солі, сольвати, поліморфи, складні ефіри, таутомери або проліки: 2 UA 99731 C2 G O S O NH R0 H N Z X Y F 5 10 15 20 25 30 35 40 45 50 55 формула I у якій Z являє собою H або F; X являє собою F, Cl, CH3, CH2OH, CH2F, CHF2, або CF3; Y являє собою I, Br, Cl, CF3, C1-C3 алкіл, C2-C3 алкеніл, C2-C3 алкініл, циклопропіл, OMe, OEt, SMe, феніл або Het, де Het являє собою 5-ти - 10-ти членну моно- або біциклічну гетероциклічну групу, де група є насиченою, олефіновою або ароматичною, що містить 1-5 кільцевих гетероатомів, незалежно вибраних з N, 0, і S; де всі вказані фенільні або Het групи необов'язково заміщені F, Cl, Br, I, ацетилом, метилом, CN, NO2, CO2H, C1-C3 алкілом, C1-C3 алкокси, C1-C3 алкіл-C(=O)-, C1-C3 алкіл-C(=S)-, C1-C3 алкоксиC(=S)-, C1-C3 алкіл-C(=O)O-, C1-C3 алкіл-0-(C=O)-, C1-C3 алкіл-C(=O)NH-, C1-C3 алкіл-C(=NH)NH-, C1-C3 алкіл-NH-(C=O)-, ди-C1-C3 алкіл-N-(C=O)-, C1-C3 алкіл-C(=O)N(C1-C3 алкі1)-, C1-C3 алкілS(=O)2NH- або трифторметилом; всі вказані метильні, етильні, C1-C3 алкільні й циклопропільні групи необов'язково заміщені OH; всі вказані метильні групи необов'язково заміщені одним, двома або трьома атомами F; 0 R являє собою H, F, Cl, Br, I, CH3NH-, (CH3)2N-, C1-C6 алкіл, C1-C4 алкокси, C3-C6 циклоалкіл, C2-C6 алкеніл, C2-C6 алкініл, феніл, однозаміщений феніл, O(C1-C4 алкіл), O-C(=O)(C1-C4 алкіл) або C(=O)O(C1-C4 алкіл); де вказані алкільні, алкокси, циклоалкільні, алкенільні, алкінільні й фенільні групи необов'язково заміщені 1-3 замісниками, незалежно вибраними з F, Cl, Br, I, OH, CN, ціанометилу, нітро, фенілу й трифторметилу; вказані C1-C6 алкільні й C1-C4 алкокси групи також необов'язково заміщені OCH3 або OCH2CH3; G являє собою G1, G2, R1a, R1b, R1c, R1d, R1e, Ar1, Ar2 або Ar3; де G1 являє собою C1-C6 алкіл, необов'язково заміщений однією аміно, C1-C3 алкіламіно, або діалкіламіно групою, вказана діалкіламіно група містить дві C 1-C4 алкільні групи, які можуть бути ідентичними або неідентичними; або G1 являє собою C3-C8 діаміно алкільну групу; G2 являє собою 5-ти або 6-ти членне кільце, яке є насиченим, ненасиченим або ароматичним, що містить 1-3 кільцеві гетероатоми, незалежно вибрані з N, 0, і S, необов'язково заміщено 1-3 замісниками, незалежно вибраними з F, Cl, OH, O(C1-C3 алкілу), OCH3, OCH2CH3, CH3C(=O)NH, CH3C(=O)O, CN, CF3, і 5-ти членну ароматичну гетероциклічну групу, яка містить 14 кільцеві гетероатоми, незалежно вибрані з N, O, і S; R1a являє собою метил, необов'язково заміщений 1-3 атомами фтору або 1-3 атомами хлору, або заміщений OH, циклопропокси, або C1-C3 алкокси, де вказана циклопропокси група або C1-C3 алкільні частини вказаних C1-C3 алкокси груп необов'язково заміщені однією гідрокси або метокси групою, і де всі C3- алкільні групи в межах вказаних C1-C4 алкокси необов'язково додатково заміщені другою OH групою; R1b являє собою CH(CH3)-C1-3 алкіл або C3-C6 циклоалкіл, вказані алкільні й циклоалкільні групи необов'язково заміщені 1-3 замісниками, незалежно вибраними з F, Cl, Br, I, OH, OCH 3, і CN; R1c являє собою (CH2)nOmR'; де m являє собою 0 або 1; і де якщо m являє собою 0, то n являє собою 1 або 2; якщо m являє собою 1, то n являє собою 2 або 3; R' являє собою C1-C6 алкіл, необов'язково заміщений 1-3 замісниками, незалежно вибраними з F, Cl, OH, OCH3, OCH2CH3, і C3-C6 циклоалкілу; R1d являє собою C(A)(A')(B)-; де B являє собою H або C1-4 алкіл, необов'язково заміщений однією або двома OH групами; A і A' незалежно являють собою H або C1-4 алкіл, необов'язково заміщений однією або двома OH групами; або A і A', разом з атомом вуглецю, до якого вони приєднані, утворюють 3-х - 6-ти членне насичене кільце; 3 UA 99731 C2 R1e являє собою (CH2)q R2-6 5 10 15 R1e де q являє собою 1 або 2; R2 і R3 кожний незалежно являють собою, H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил або метилсульфоніл; R4 являє собою H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил, метилсульфоніл, нітро, ацетамідо, амідиніл, ціано, карбамоїл, метилкарбамоїл, диметилкарбамоїл, l, 3,4-оксадіазол-2-іл, 5-метил-l, 3,4- оксадіазол, 1,3,4-тіадіазол, 5-метил-l, 3,4-тіадіазол lH-тетразоліл, N-морфоліл карбоніл аміно, N-морфолілсульфоніл і N-піролідинілкарбоніламіно; R5 являє собою H, F, Cl або метил; R6 являє собою H, F, Cl або метил; Ar1 являє собою R2-6 V U 20 25 30 35 Ar1 де U і V являють собою, незалежно, N, CR2 або CR3; R2, R3 і R4 являють собою, незалежно, H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил, ацетамідо, амідиніл, ціано, карбамоїл, метилкарбамоїл, диметилкарбамоїл, l, 3,4-оксадіазол-2-іл, 5-метил-l, 3,4-оксадіазоліл, 1,3,4-тіадіазоліл, 5-метил-l, 3,4-тіадіазоліл, lH-тетразоліл, Nморфолілкарбоніламіно, N-морфолілсульфоніл, N-піролідинілкарбоніламіно, і метилсульфоніл; R5 і R6 являють собою, незалежно, H, F, Cl або метил; Ar2 являє собою V R7-8 U Ar2 де де пунктирна лінія представляє альтернативні формальні розташування для подвійного зв'язку другого кільця; U являє собою -S-, -O- або -N =, і де якщо U являє собою -O- або -S-, то V являє собою -CH=, -CCl= або -N =; якщо U являє собою -N =, то V являє собою -CH=, -CCl=, або -N=; R7 являє собою H або метил; R8 являє собою H, ацетамідо, метил, F або Cl; Ar3 являє собою R7 N U R8 40 Ar3 де U являє собою -NH-, -NCH3- або -O-; R7 і R8 являють собою, незалежно, H, F, Cl, або метил. 4 UA 99731 C2 У деяких варіантах здійснення, винахід забезпечує сполуку формули I, вибрану зі сполук, O S O NH O F H N O S нижче: S O H N F , O NH O NH I H N F F I , F HO H N F , F NH , O S MeO F , O OH F H N S I F HO I F O OH HO NH F H N F I F OH O NH F F представлених O S F F S O O NH H N F I F F , I , F OH HO O OH O S HO NH F H N S O NH H N O O F HO O I F , F F O S O NH F I , F H N F F I , HO HO S O O NH MeO HO F H N O O NH F H N MeO F 5 S I F I F і . У деяких варіантах здійснення, винахід забезпечує сполуку формули I, вибрану з: F OH HO O S OH O NH MeO HO H N F S O O NH F F H N F I F і I , де 2-OH вуглець знаходиться в R конфігурації. У деяких варіантах здійснення, винахід забезпечує сполуку формули I, вибрану з: F F OH OH HO O S O NH MeO HO H N O NH I F H N F і I , де 2-OH вуглець знаходиться в S конфігурації. У деяких варіантах здійснення, винахід забезпечує композицію, яка містить сполуку формули I, вибрану зі сполук, представлених нижче, де 2-OH вуглець знаходиться в R конфігурації, що по суті не містить S- ізомеру. F OH F OH HO O S O NH MeO HO H N F 15 S F F 10 O F O F F I S O NH H N F F F I F , . У деяких варіантах здійснення, винахід забезпечує композицію, яка містить сполуку формули I, вибрану зі сполук, представлених нижче, де 2-OH вуглець знаходиться в S конфігурації, що по суті не містять R- ізомеру. 5 UA 99731 C2 OH OH HO O S HO O NH MeO H N O F S O NH F F H N F F I I F , . У деяких варіантах здійснення, даний винахід забезпечує сполуку формули I, де Y являє собою феніл, піридил, або піразоліл. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де Y являє собою заміщений феніл, піридил, або піразоліл. У ще іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де Y являє собою Br або I. В одному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою 1-піперидил, 2-піперидил, 3-піперидил, або 4-піперидил. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою 1-піперазил або 2-піперазил. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою морфоліл. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою N-метил-2аміноетил. В одному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою N-метил-3-аміно-н-пропіл. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою (CH 3)2N-CH2CH2-NH(CH2)n-, де n являє собою 1, 2, або 3. В іншому субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою (CH 3CH2)2N-CH2CH2-NH-(CH2)n-, де n являє собою 1 або 2. У більш специфічному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою 1-піперидил, 2-піперидил, 3-піперидил, або 4o піперидил; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. В іншому більш специфічному субродовому варіанті здійснення, даний винахід забезпечує сполуку o формули I, де G являє собою 1-піперазил або 2-піперазил; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I В іншому більш специфічному субродовому варіанті o здійснення, даний винахід забезпечує сполуку формули I, де G являє собою морфоліл; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. В іншому більш специфічному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де o G являє собою N-метил-2-аміноетил; Rявляє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. В іншому більш специфічному субродовому варіанті здійснення, даний винахід o забезпечує сполуку формули I, де G являє собою N-метил-3-аміно-н-пропіл; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. В іншому більш специфічному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє o собою (CH3)2N-CH2CH2-NH-(CH2)n-, де n являє собою 1, 2, або 3; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. В іншому більш специфічному субродовому варіанті здійснення, даний винахід забезпечує сполуку формули I, де G являє собою (CH 3CH2)2N-CH2CH2o NH-(CH2)n-, де n являє собою 1 або 2; R являє собою H, галоген, або метокси; X являє собою F; і Y являє собою I. У деяких варіантах здійснення, винахід забезпечує фармацевтичну композицію, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення фармацевтична композиція додатково містить принаймні один фармацевтично прийнятний носій. У деяких варіантах здійснення, винахід забезпечує фармацевтичну композицію, яка містить F 5 10 15 20 25 30 35 40 OH OH HO O F S O NH HO H N F 45 F O MeO I S O NH H N F F I F F сполуку, вибрана з: і , або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, фармацевтична композиція додатково містить принаймні один фармацевтично прийнятний носій. У деяких варіантах здійснення, сполука знаходиться в R конфігурації. У деяких варіантах здійснення, сполука знаходиться в R конфігурації, що по суті не містить S- ізомеру. У деяких варіантах здійснення, сполука знаходиться в S конфігурації. 6 UA 99731 C2 У деяких варіантах здійснення, сполука знаходиться в S конфігурації, що по суті не містить ROH HO O S O NH F H N F F ізомеру. У деяких варіантах здійснення, сполука являє собою: I . У деяких F OH HO O S O NH F H N MeO F 5 I F варіантах здійснення, сполука являє собою: . Винахід також стосується кристалічної поліморфної форми A N-(S)-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду (також у даному винаході позначається як "Сполука A" і "N-(-)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6 OH HO O MeO S O NH H N F 10 15 OH O MeO S O NH H N F 25 I F метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонамід"): , що проявляє специфічну порошкову рентгенограму. У деяких варіантах здійснення, порошкова рентгенограма містить принаймні 50 % піків, представлених на фіг. 5. У деяких варіантах здійснення, порошкова рентгенограма містить принаймні 70 % піків, представлених на фіг. 5. У деяких варіантах здійснення, порошкова рентгенограма містить принаймні 90 % піків, представлених на фіг. 5. У деяких варіантах здійснення, порошкова рентгенограма є по суті ідентичної до порошкової рентгенограми, представленій на фіг. 5. Сполука A характеризується як "S" ізомер шляхом одержання R і S-MTPA складних ефірів на вторинному спирті й порівняння відмінностей хімічного зсуву протону. Див., наприклад, Dale, J.A.; Mosher, H.S., J. Am. Chem. Soc., 1973, 95, 512 і Ohtani та ін., J. Am. Chem. Soc., 1991, 113, 4092. Винахід також стосується N-(R)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-l(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду (також у даному винаході позначається як "Сполука B" і "N-(+)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-l-(2,3HO 20 F F I дигідроксипропіл) циклопропан-1-сульфонамід"): . Сполука B F характеризується як "R" ізомер шляхом одержання R і S-MTPA складних ефірів на вторинному спирті й порівняння відмінностей хімічного зсуву протону. Див., наприклад, Dale, J.A.; Mosher, H.S., J. Am. Chem. Soc., 1973, 95, 512 і Ohtani та ін., J. Am. Chem. Soc., 1991, 113, 4092. Винахід також стосується кристалічної поліморфної форми A N-(S)-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду: OH HO O S O NH MeO H N F F I яка проявляє специфічну картину диференціальної сканувальної калориметрії. У деяких варіантах здійснення, картина диференціальної сканувальної калориметрії є по суті ідентичною до картини диференціальної сканувальної калориметрії, представленої на фіг. 6. F 7 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід також стосується фармацевтичних композицій, які містять ефективну кількість кристалічної поліморфної форми A N-(S)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду й фармацевтично прийнятний носій або наповнювач. У деяких варіантах здійснення, кристалічна поліморфна форма A N-(S)-(3,4-дифтор-2-(2фтор-4-йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду придатна для лікування або запобігання злоякісного новоутворення або запального захворювання. Винахід додатково стосується способів лікування або запобігання злоякісного новоутворення або запального захворювання, які включають введення ефективної кількості кристалічної поліморфної форми A N-(S)-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду суб'єктові, який цього потребує. В інших аспектах, даний винахід стосується фармацевтичних композицій, які містять ефективні кількості сполуки формули I або її фармацевтично прийнятної солі, сольвату, поліморфу, складного ефіру, таутомеру або проліків. У деяких варіантах здійснення, фармацевтичні композиції додатково містять фармацевтично прийнятний носій. Такі композиції можуть містити ад'юванти, ексципієнти, і консерванти, речовини для вповільнення абсорбції, заповнювачі, зв'язувальні речовини, адсорбенти, буфери, речовини, які розпадаються, солюбілізуючі компоненти, інші носії, та інші інертні компоненти. Способи приготування таких композицій добре відомі в даній галузі техніки. В інших аспектах, даний винахід стосується фармацевтичної композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, фармацевтична композиція знаходиться у формі, яка підходить для перорального введення. У подальших або додаткових варіантах здійснення, фармацевтична композиція знаходиться у формі таблетки, капсули, пігулки, порошку, препарату з уповільненим вивільненням, розчину, суспензії, для парентеральної ін'єкції у вигляді стерильного розчину, суспензії або емульсії, для місцевого введення у вигляді мазі або крему або для ректального введення у вигляді супозиторію. У подальших або додаткових варіантах здійснення, фармацевтична композиція знаходиться в дозованих лікарських формах, які підходять для однократного введення точних доз. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,002 до приблизно 6 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,005 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, фармацевтична композиція призначена для введення ссавцеві. У подальших або додаткових варіантах здійснення, ссавцем є людина. У подальших або додаткових варіантах здійснення, фармацевтична композиція додатково містить фармацевтичний носій, ексципієнт та/або ад'ювант. У подальших або додаткових варіантах здійснення, фармацевтична композиція додатково містить принаймні один терапевтичнийзасіб. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й 8 UA 99731 C2 5 10 протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинний засіб вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/антигормональні терапевтичні засоби, і гематопоетичні фактори росту. У подальших або додаткових варіантах здійснення, терапевтичний засіб являє собою таксол, ботрезоміб або обидва засоби. У подальших або додаткових варіантах здійснення, фармацевтична композиція вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, фармацевтична композиція містить фармацевтично прийнятну сіль сполуки формули I. У даному винаході забезпечуються композиції й способи застосування композиції, яка OH OH HO O S HO O NH H N MeO O F F F 15 20 I S O NH H N F F I F F містить сполуку, вибрана з: і . У деяких варіантах здійснення, 2-OH вуглець на сполуці знаходиться в R конфігурації. У деяких варіантах здійснення, 2-OH вуглець на сполуці знаходиться в S конфігурації. У деяких варіантах здійснення, композиція по суті не містить S- ізомеру сполуки. У деяких варіантах здійснення, композиція по суті не містить R- ізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 10 % S- ізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 10 % R- ізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 5 % Sізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 5 % R- ізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 1 % S- ізомеру сполуки. У деяких варіантах здійснення, сполука містить менше, ніж 1 % R- ізомеру сполуки. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 1-100 мг сполуки, HO OH O S O MeO NH F H N F 25 30 I F яка має наступну структуру: . У деяких варіантах здійснення, композиція дозволяє модифікувати вивільнення сполуки. У деяких варіантах здійснення, композиція дозволяє сповільнити вивільнення сполуки. У деяких варіантах здійснення, композиція дозволяє відстрочити вивільнення сполуки. У деяких варіантах здійснення, сполука присутня в кількості приблизно 1-50 мг. У деяких варіантах здійснення, сполука присутня в кількості приблизно 1-10 мг. У деяких варіантах здійснення, сполука присутня в кількості приблизно 10-20 мг. У деяких варіантах здійснення, сполука присутня в кількості приблизно 20-40 мг. У деяких варіантах здійснення, сполука присутня в кількості приблизно 40-50 мг. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять: приблизно 1-50 мг сполуки, HO OH O S O MeO NH H N F 35 40 F I F яка має наступну структуру , де композиція дозволяє модифікувати вивільнення лікарського засобу. У деяких варіантах здійснення, композиція додатково містить мікрокристалічну целюлозу. У деяких варіантах здійснення, композиція додатково містить кроскармелозу натрію. У деяких варіантах здійснення, композиція додатково містить лаурилсульфат натрію. У деяких варіантах здійснення, композиція додатково містить стеарат магнію. 9 UA 99731 C2 Також у даному винаході забезпечуються композиції, що містять приблизно 1 мг сполуки, яка HO OH O S O MeO NH F H N F 5 I F має наступну структуру: . У деяких варіантах здійснення, композиція додатково містить приблизно 222,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 10 мг сполуки, HO OH O S NH O MeO H N F F 10 15 I F яка має наступну структуру . У деяких варіантах здійснення, композиція додатково містить приблизно 213,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 20 мг сполуки, HO OH O S NH O MeO H N F F 20 I F яка має наступну структуру: . У деяких варіантах здійснення, композиція додатково містить приблизно 203,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 40 мг сполуки, HO OH O S O MeO NH H N F F 25 I F яка має наступну структуру . У деяких варіантах здійснення, композиція додатково містить приблизно 183,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять: приблизно 0,4 % за вагою HO OH O S O MeO NH H N F 30 F I F сполуки, яка має наступну структуру , і приблизно 99,6 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач містить мікрокристалічну целюлозу. У деяких 10 UA 99731 C2 5 варіантах здійснення, мікрокристалічна целюлоза становить приблизно 92,6 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить приблизно 5 % за вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 4,2 % за вагою HO OH O S O MeO NH H N F 10 15 F I F сполуки, яка має наступну структуру , і приблизно 95,8 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач містить мікрокристалічну целюлозу. У деяких варіантах здійснення, мікрокристалічна целюлоза становить приблизно 88,8 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить приблизно 5 % за вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять від приблизно 2 % до HO OH O S O MeO NH H N F 20 25 F I F приблизно 10 % за вагою сполуки, яка має наступну структуру , і від приблизно 98 % до приблизно 90 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач додатково містить мікрокристалічну целюлозу. У деяких варіантах здійснення, мікрокристалічна целюлоза становить приблизно 85 % до приблизно 95 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить від приблизно 1 % до приблизно 6 % за вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить від приблизно 0,1 % до приблизно 2 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить від приблизно 0,25 % до приблизно 1,5 % за вагою стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 1 мг сполуки, яка HO OH O S O MeO NH F H N F 30 35 I F має наступну структуру . У деяких варіантах здійснення, композиція додатково міститьприблизно 222,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 10 мг сполуки, HO OH O S O MeO яка має наступну структуру: NH H N F F F I . У деяких варіантах здійснення, композиція 11 UA 99731 C2 5 додатково містить приблизно 213,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 20 мг сполуки, HO OH O S O MeO NH H N F F 10 I F яка має наступну структуру: . У деяких варіантах здійснення, композиція додатково містить приблизно 203,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 40 мг сполуки, HO OH O S O MeO NH H N F F 15 20 I F яка має наступну структуру: . У деяких варіантах здійснення, композиція додатково містить приблизно 183,2 мг мікрокристалічної целюлози. У деяких варіантах здійснення, композиція додатково містить приблизно 12,0 мг кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 2,4 мг стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 0,4 % за вагою OH HO O S O MeO NH H N F F 25 30 I F сполуки, яка має наступну структуру , і приблизно 99,6 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач містить мікрокристалічну целюлозу. У деяких варіантах здійснення, мікрокристалічна целюлоза становить приблизно 92,6 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить приблизно 5 % за вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять приблизно 4,2 % за вагою OH HO O S O MeO NH H N F 35 F I F сполуки, яка має наступну структуру , і приблизно 95,8 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач містить мікрокристалічну целюлозу. У деяких варіантах здійснення, мікрокристалічна целюлоза становить приблизно 88,8 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить приблизно 5 % за 12 UA 99731 C2 5 вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить приблизно 1 % за вагою стеарату магнію. Також у даному винаході забезпечуються композиції й способи лікування злоякісного новоутворення або запалення за допомогою композицій, що містять від приблизно 2 % до HO OH O S O MeO NH H N F 10 15 20 25 30 35 40 45 50 F I F приблизно 10 % за вагою сполуки, яка має наступну структуру , і від приблизно 98 % до приблизно 90 % за вагою фармацевтично прийнятного носія або наповнювача. У деяких варіантах здійснення, фармацевтично прийнятний носій або наповнювач містить мікрокристалічну целюлозу. У деяких варіантах здійснення, мікрокристалічна целюлоза становить від приблизно 85 % до приблизно 95 % за вагою композиції. У деяких варіантах здійснення, композиція додатково містить від приблизно 1 % до приблизно 6 % за вагою кроскармелози натрію. У деяких варіантах здійснення, композиція додатково містить від приблизно 0,1 % до приблизно 2 % за вагою лаурилсульфату натрію. У деяких варіантах здійснення, композиція додатково містить від приблизно 0,25 % до приблизно 1,5 % за вагою стеарату магнію. Також у даному винаході забезпечується кристалічна поліморфна форма A N-(-)-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1сульфонаміду, що проявляє порошкову рентгенограму, яка містить принаймні 50 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фіг. 5, і композиції, що містять цю сполуку… У деяких варіантах здійснення, кристалічна поліморфна форма A, де порошкова рентгенограма містить принаймні 70 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фіг. 5. У деяких варіантах здійснення, порошкова рентгенограма містить принаймні 90 % піків, ідентифікованих на порошковій рентгенограмі, представленій на фіг. 5. У деяких варіантах здійснення, порошкова рентгенограма по суті ідентична до порошкової рентгенограми, представленій на фіг. 5. У деяких варіантах здійснення, кристалічний поліморф має точку плавлення, що проявляється, як визначено за допомогою диференціальної сканувальної калориметрії, приблизно при 143 °C. У деяких варіантах здійснення, кристалічний поліморф по суті не містить води. У деяких варіантах здійснення, кристалічний поліморф по суті не містить розчинника. Також в даному винаході забезпечується кристалічна поліморфна форма A N-(-)-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1сульфонаміду, що проявляє картину диференціальної сканувальної калориметрії по суті ідентичну до картини диференціальної сканувальної калориметрії, представленої на фіг. 6, і композиції, що містять цю сполуку. У деяких варіантах здійснення, кристалічний поліморф має точку плавлення, що проявляється, як визначено за допомогою диференціальної сканувальної калориметрії, приблизно при 143 °C. У деяких варіантах здійснення, кристалічний поліморф за пунктом 67 або 68, де кристалічний поліморф по суті не містить води. У деяких варіантах здійснення, кристалічний поліморф за будь-яким з пунктів 67-69, де кристалічний поліморф по суті не містить розчинника. Також у даному винаході забезпечується поліморфна форма N-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду, яку одержують за допомогою способу, який включає стадію кристалізації аморфного N-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-l-(2,3-дигідроксипропіл) циклопропан-1сульфонаміду, і композиції, що містять цю сполуку. У деяких варіантах здійснення, стадія кристалізації включає кристалізацію із суміші етилацетату й гептану. У деяких варіантах здійснення, суміш етилацетату й гептану містить у кількісному відношенні від приблизно 1-4 частин етилацетату до приблизно 2-10 частин гептану. У деяких варіантах здійснення, суміш етилацетату й гептану містить у кількісному відношенні від приблизно 2 частин етилацетату до приблизно 5 частин гептану. Також у даному винаході забезпечуються способи інгібування MEK ферментів, які включають контактування вказаного MEK ферменту зі сполукою або композицією, описаними в даній заявці, де сполука присутня в кількості, достатній для інгібування вказаного ферменту принаймні на 25 %. У деяких варіантах здійснення, MEK фермент являє собою MEK кіназу. У деяких варіантах здійснення, вказане контактування здійснюють у клітині. 13 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 Також у даному винаході забезпечуються способи лікування порушення, опосередкованого MEK, в особини, що страждає від вказаного порушення, які включають введення вказаному індивідуумові ефективної кількості сполуки або композиції, як описано в даній заявці. У деяких варіантах здійснення, MEK інгібітор вводять у комбінації з додатковою терапією. У деяких варіантах здійснення, додаткова терапія являє собою променеву терапію, лікування за допомогою інгібітора іншої кінази, що відрізняється від MEK, хіміотерапію, хірургію, глюкокортикоїд, метотрексат, модифікатори біологічного відгуку, або будь-яку їх комбінацію. У деяких варіантах здійснення, порушення, опосередковане MEK, вибирають із групи, яка включає запальні захворювання, інфекції, аутоімунні порушення, удар, ішемію, порушення серцевої діяльності, неврологічні порушення, фіброгенетичні порушення, проліферативні порушення, гіперпроліферативні порушення, пухлини, лейкози, новоутворення, злоякісні новоутворення, карциноми, метаболічні захворювання й злоякісні захворювання. У деяких варіантах здійснення, порушення, опосередковане MEK, являє собою гіперпроліферативне захворювання. У деяких варіантах здійснення, порушення, опосередковане MEK, являє собою злоякісне новоутворення, пухлини, лейкози, новоутворення, або карциноми. У деяких варіантах здійснення, порушення, опосередковане MEK, являє собою запальне захворювання. У деяких варіантах здійснення, вказане запальне захворювання являє собою ревматоїдний артрит або розсіяний склероз. Також у даному винаході забезпечуються способи лікування або профілактики проліферативного захворювання в індивідуума, які включають введення вказаному індивідуумові ефективної кількості сполуки або композиції, як описано в даній заявці. У деяких варіантах здійснення, проліферативне захворювання являє собою злоякісне новоутворення, псоріаз, рестеноз, захворювання, або атеросклероз. У деяких варіантах здійснення, проліферативне захворювання являє собою злоякісне новоутворення. У деяких варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку, рак молочної залози, рак легенів, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак нирки, рак ободової і прямої кишки, лейкоз, мієлолейкоз, гліобластому, фолікулярну лімфому, гострий лейкоз попередників В-клітин, В-клітинний хронічний лімфолейкоз, рак шлунка, мезотеліому або дрібноклітинний рак легенів. У деяких варіантах здійснення, спосіб додатково включає введення принаймні одного терапевтичного засобу. У деяких варіантах здійснення, ця стадія включає введення принаймні однієї додаткової терапії злоякісного новоутворення. У деяких варіантах здійснення, додаткова терапія являє собою променеву терапію, лікування за допомогою інгібітора іншої кінази, що відрізняється від MEK, хіміотерапію, хірургію, глюкокортикоїд, метотрексат, модифікатори біологічного відгуку, або будь-яку їх комбінацію. Також у даному винаході забезпечуються способи лікування або профілактики запального захворювання в індивідуума, які включають введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку, як описано в даній заявці. У деяких варіантах здійснення, запальне захворювання являє собою ревматоїдний артрит або розсіяний склероз. Також у даному винаході забезпечуються способи руйнування, інгібування росту або знищення ракових клітин, які включають контактування клітин з кількістю сполуки або композиції, як описано в даній заявці, ефективним для руйнування, інгібування росту або знищення ракових клітин. У деяких варіантах здійснення, ракові клітини включають ракові клітини головного мозку, молочної залози, легенів, яєчника, підшлункової залози, передміхурової залози, нирки, шлунка або ободової і прямої кишки. Також у даному винаході забезпечуються способи інгібування збільшення розміру пухлини, зменшення розміру пухлини, зменшення проліферації пухлини або запобігання проліферації пухлини в індивідуума, які включають введення вказаному індивідуумові ефективної кількості сполуки або композиції, як описано в даній заявці, для інгібування збільшення розміру пухлини, зменшення розміру пухлини, зменшення проліферації пухлини або запобігання проліферації пухлини. У деяких варіантах здійснення, пухлина виникає в головному мозку, молочній залозі, легенях, яєчниках, підшлунковій залозі, передміхуровій залозі, нирках, шлунку, ободовій кишці або прямій кишці. Також у даному винаході забезпечуються способи лікування або запобігання анкілозуючого спондиліту, подагри, тендиніту, бурситу або ішіалгії, які включають введення суб'єктові, який цього потребує, ефективної кількості сполуки формули (I) або її фармацевтичної солі: G O S O NH R0 H N Z 55 X Y ; де: Z являє собою H або F; F 14 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 X являє собою F, Cl, CH3, CH2OH, CH2F, CHF2, або CF3; Y являє собою I, Br, Cl, CF3, C1-C3 алкіл, C2-C3 алкеніл, C2-C3 алкініл, циклопропіл, OMe, OEt, SMe, феніл або Het, де Het являє собою 5-ти - 10-ти членну моно- або біциклічну гетероциклічну групу, де група є насиченою, олефіновою або ароматичною, що містить 1-5 кільцевих гетероатомів, незалежно вибраних з N, 0, і S; де всі вказані фенільні або Het групи необов'язково заміщені F, Cl, Br, I, ацетилом, метилом, CN, NO2, CO2H, C1-C3 алкілом, C1-C3 алкокси, C1-C3 алкіл-C(=O)-, C1-C3 алкіл-C(=S)-, C1-C3 алкоксиC(=S)-, C1-C3 алкіл-C(=O)O-, C1-C3 алкіл-0-(C=O)-, C1-C3 алкіл-C(=O)NH-, C1-C3 алкіл-C(=NH)NH-, C1-C3 алкіл-NH-(C=O)-, ди-C1-C3 алкіл-N-(C=O)-, C1-C3 алкіл-C(=O)N(C1-C3 алкі1)-, C1-C3 алкілS(=O)2NH- або трифторметилом; всі вказані метильні, етильні, C1-C3 алкільні й циклопропільні групи необов'язково заміщені OH; всі вказані метильні групи необов'язково заміщені одним, двома або трьома атомами F; 0 R являє собою H, F, Cl, Br, I, CH3NH-, (CH3)2N-, C1-C6 алкіл, C1-C4 алкокси, C3-C6 циклоалкіл, C2-C6 алкеніл, C2-C6 алкініл, феніл, однозаміщений феніл, O(C1-C4 алкіл), O-C(=O)(C1-C4 алкіл) або C(=O)O(C1-C4 алкіл); де вказані алкільні, алкокси, циклоалкільні, алкенільні, алкінільні й фенільні групи необов'язково заміщені 1-3 замісниками, незалежно вибраними з F, Cl, Br, I, OH, CN, ціанометилу, нітро, фенілу й трифторметилу; вказані C1-C6 алкільні й C1-C4 алкокси групи також необов'язково заміщені OCH3 або OCH2CH3; G являє собою G1, G2, R1a, R1b, R1c, R1d, R1e, Ar1, Ar2 або Ar3; де G1 являє собою C1-C6 алкіл, необов'язково заміщений однією аміно, C1-C3 алкіламіно, або діалкіламіно групою, вказана діалкіламіно група містить дві C 1-C4 алкільні групи, які можуть бути ідентичними або неідентичними; або G1 являє собою C3-C8 діаміно алкільну групу; G2 являє собою 5-ти або 6-ти членне кільце, яке є насиченим, ненасиченим або ароматичним, що містить 1-3 кільцеві гетероатоми, незалежно вибрані з N, 0, і S, необов'язково заміщено 1-3 замісниками, незалежно вибраними з F, Cl, OH, O(C 1-C3 алкіл), OCH3, OCH2CH3, CH3C(=O)NH, CH3C(=O)O, CN, CF3, і 5-ти членну ароматичну гетероциклічну групу, яка містить 14 кільцеві гетероатоми, незалежно вибрані з N, O, і S; R1a являє собою метил, необов'язково заміщений 1-3 атомами фтору або 1-3 атомами хлору, або заміщений OH, циклопропокси, або C1-C3 алкокси, де вказана циклопропокси група або C1-C3 алкільні частини вказаних C1-C3 алкокси груп необов'язково заміщені однією гідрокси або метокси групою, і де всі C3- алкільні групи в межах вказаних C1-C4 алкокси необов'язково додатково заміщені другою OH групою; R1b являє собою CH(CH3)-C1-3 алкіл або C3-C6 циклоалкіл, вказані алкільні й циклоалкільні групи необов'язково заміщені 1-3 замісниками, незалежно вибраними з F, Cl, Br, I, OH, OCH 3, і CN; R1c являє собою (CH2)nOmR'; де m являє собою 0 або 1; і де якщо m являє собою 0, то n являє собою 1 або 2; якщо m являє собою 1, то n являє собою 2 або 3; R' являє собою C1-C6 алкіл, необов'язково заміщений 1-3 замісниками, незалежно вибраними з F, Cl, OH, OCH3, OCH2CH3, і C3-C6 циклоалкілу; R1d являє собою C(A)(A')(B)-; де B являє собою H або C1-4 алкіл, необов'язково заміщений однією або двома OH групами; A і A' незалежно являють собою H або C1-4 алкіл, необов'язково заміщений однією або двома OH групами; або A і A', разом з атомом вуглецю, до якого вони приєднані, утворюють 3-х - 6-ти членне насичене кільце; R1e являє собою (CH2)q R2-6 R1e де q являє собою 1 або 2; 15 UA 99731 C2 5 10 R2 і R3 кожний незалежно являють собою, H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил або метилсульфоніл; R4 являє собою H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил, метилсульфоніл, нітро, ацетамідо, амідиніл, ціано, карбамоїл, метилкарбамоїл, диметилкарбамоїл, l, 3,4-оксадіазол-2-іл, 5-метил-l, 3,4- оксадіазол, 1,3,4-тіадіазол, 5-метил-l, 3,4-тіадіазол lH-тетразоліл, N-морфоліл карбоніл аміно, N-морфолілсульфоніл і N-піролідинілкарбоніламіно; R5 являє собою H, F, Cl або метил; R6 являє собою H, F, Cl або метил; Ar1 являє собою R2-6 V U 15 20 25 30 Ar1 де U і V являють собою, незалежно, N, CR2 або CR3; R2, R3 і R4 являють собою, незалежно, H, F, Cl, Br, CH3, CH2F, CHF2, CF3 OCH3, OCH2F, OCHF2, OCF3, етил, н-пропіл, ізопропіл, циклопропіл, ізобутил, втор-бутил, трет-бутил, ацетамідо, амідиніл, ціано, карбамоїл, метилкарбамоїл, диметилкарбамоїл, l, 3,4-оксадіазол-2-іл, 5-метил-l, 3,4-оксадіазоліл, 1,3,4-тіадіазоліл, 5-метил-l, 3,4-тіадіазоліл, lH-тетразоліл, Nморфолілкарбоніламіно, N-морфолілсульфоніл, N-піролідинілкарбоніламіно, і метилсульфоніл; R5 і R6 являють собою, незалежно, H, F, Cl або метил; Ar2 являє собою V R7-8 U Ar2 де де пунктирна лінія представляє альтернативні формальні розташування для подвійного зв'язку другого кільця; U являє собою -S-, -O- або -N =, і де якщо U являє собою -O- або -S-, то V являє собою -CH=, -CCl= або -N =; якщо U являє собою -N =, то V являє собою -CH=, -CCl=, або -N=; R7 являє собою H або метил; R8 являє собою H, ацетамідо, метил, F або Cl; Ar3 являє собою R7 N U 35 R8 Ar3 де U являє собою -NH-, -NCH3- або -O-; R7 і R8 являють собою, незалежно, H, F, Cl, або метил. У деяких варіантах здійснення, сполуку вибирають із: O S O O NH F H N O NH F F 40 S H N F I , F O F S O NH H N F I , F OH O F S NH I H N F , F O I , F OH HO O S O NH HO H N F F S O F OH O NH MeO I H N F , F 16 HO F O S O NH F I H N F , F F I , UA 99731 C2 OH OH HO O S HO O NH H N S O F HO NH H N O O F O F I , F O F S O NH , HO F O S O NH MeO F I F H N I F F , F H N I F HO HO O S O NH MeO F H N F і I . F У деяких варіантах здійснення, сполуку вибирають із OH OH HO O S HO O NH MeO H N O F S O NH F F H N F F I I F і ; де 2-OH вуглець знаходиться в R конфігурації. У деяких варіантах здійснення, сполуку формули (I), або її фармацевтичну сіль, F OH OH HO O S HO O NH MeO H N F 5 вибирають із F O F S O NH F F H N F I і I ; де 2-OH вуглець знаходиться F OH HO O S O NH MeO H N F в S конфігурації. У деяких варіантах здійснення, сполука являє собою F F I .У OH HO O MeO S O NH H N F 10 15 20 25 F I F деяких варіантах здійснення, сполука являє собою . У даному винаході також забезпечуються способи лікування раку шлунка шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування лейкемічної меланоми, або гепатоми шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування не-дрібноклітинного раку легенів шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку товстої кишки шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку ЦНС шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку яєчника шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку нирки шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку передміхурової залози шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У даному винаході також забезпечуються способи лікування раку молочної залози шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці. У різних варіантах здійснення, ці способи додатково включають введення принаймні одного терапевтичного засобу. У деяких варіантах здійснення, здійснюють принаймні одну додаткову протиракову терапію. У деяких варіантах здійснення, додаткова протиракова терапія являє собою променеву терапію, хіміотерапію, хірургію, або будь-яку їх комбінацію. 17 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Також у даному винаході забезпечуються способи лікування або запобігання псоріазу шляхом введення терапевтично ефективної кількості сполуки або композиції, як описано в даній заявці в місцевій дозованій формі. У різних варіантах здійснення, композиції вводять перорально. У деяких варіантах здійснення, композицію вводять один раз на добу або два рази на добу. У деяких варіантах здійснення, композицію вводять один раз на добу протягом принаймні одного тижня. У деяких варіантах здійснення, при пероральному введенні композиції, T max сполуки досягається в проміжку від 1 години до 3 годин після введення композиції страждаючому суб'єктові. У деяких варіантах здійснення, при введенні суб'єктові, сполука досягає C max у проміжку від приблизно 0,01 мкг/мл до приблизно 1,0 мкг/мл у день 1. У деяких варіантах здійснення, при введенні суб'єктові, сполука досягає Cmax у проміжку від приблизно 0,01 мкг/мл до приблизно 0,8 мкг/мл у день 1. У деяких варіантах здійснення, при введенні суб'єктові, сполука досягає Cmax у проміжку від приблизно 0,03 мкг/мл до приблизно 0,5 мкг/мл у день 1. У деяких варіантах здійснення, сполука має AUC у проміжку від приблизно 0,1 мкг год./мл до приблизно 5,0 мкг год./мл протягом 0-12 годин. У деяких варіантах здійснення, сполука має AUC у проміжку від приблизно 0,1 мкг год./мл до приблизно 4,0 мкг год./мл. У деяких варіантах здійснення, сполука має AUC у проміжку від приблизно 0,5 мкг год./мл до приблизно 3,0 мкг год./мл. У деяких варіантах здійснення, сполука має T max у проміжку від 0,5 до 5,0 годин. У деяких варіантах здійснення, сполука має Tmax у проміжку від 1,0 до 3,0 годин. У деяких варіантах здійснення, сполука має Tmax у проміжку від 1,0 до 2,5 годин. У деяких варіантах здійснення, сполука має концентрацію в плазмі більше, ніж приблизно 0,01 мг/мл через 5 годин після введення разової дози. У деяких варіантах здійснення, сполука має концентрацію в плазмі більше, ніж приблизно 0,01 мг/мл через 10 годин після введення разової дози. У деяких варіантах здійснення, сполука має концентрацію в плазмі більше, ніж приблизно 0,01 мг/мл через 15 годин після введення разової дози. В деяких варіантах здійснення, при введенні групі з 10 суб'єктів, сполука досягає середнього Cmax у проміжку від приблизно 0,01 мкг/мл до приблизно 1,0 мкг/мл у день 1. У деяких варіантах здійснення, при введенні групі з 10 суб'єктів, сполука досягає середнього C max у проміжку від приблизно 0,01 мкг/мл до приблизно 0,8 мкг/мл у день 1. У деяких варіантах здійснення, при введенні групі з 10 суб'єктів, сполука досягає середнього C max у проміжку від приблизно 0,03 мкг/мл до приблизно 0,5 мкг/мл у день 1. У деяких варіантах здійснення, сполука має середнє значення AUC у проміжку від приблизно 0,1 мкг год./мл до приблизно 5,0 мкг год./мл. У деяких варіантах здійснення, сполука має середнє значення AUC у проміжку від приблизно 0,1 мкг год./мл до приблизно 4,0 мкг год./мл. У деяких варіантах здійснення, сполука має середнє значення AUC у проміжку від приблизно 0,5 мкг год./мл до приблизно 3,0 мкг год./мл. У деяких варіантах здійснення, сполука має середнє T max у проміжку від 0,5 до 5,0 годин. У деяких варіантах здійснення, сполука має середнє T max у проміжку від 1,0 до 3,0 годин. У деяких варіантах здійснення, сполука має середнє T max у проміжку від 1,0 до 2,5 годин. Також у даному винаході забезпечуються способи зменшення об'єму пухлини шляхом введення сполук і композицій, як описано в даній заявці. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 5 днів, об'єм пухлини зменшується принаймні приблизно на 25 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 5 днів, об'єм пухлини зменшується принаймні приблизно на 50 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 5 днів, об'єм пухлини зменшується принаймні приблизно на 20-70 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 15 днів, об'єм пухлини зменшується принаймні приблизно на 25 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 15 днів, об'єм пухлини зменшується принаймні приблизно на 50 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 15 днів, об'єм пухлини зменшується принаймні приблизно на 20-70 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 30 днів, об'єм пухлини зменшується принаймні приблизно на 25 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 30 днів, об'єм пухлини зменшується принаймні приблизно на 50 %. У деяких варіантах здійснення, після щоденного введення лікарського засобу протягом 30 днів, об'єм пухлини зменшується принаймні приблизно на 20-70 %. Також у даному винаході забезпечуються способи інгібування росту пухлини шляхом введення сполук і сполук, як описано в даній заявці. У деяких варіантах здійснення, після введення лікарського засобу, ріст пухлини інгібується принаймні приблизно на 20 %. У деяких варіантах здійснення, після введення лікарського засобу, ріст пухлини інгібується принаймні приблизно на 40 %. У деяких варіантах здійснення, після введення лікарського засобу, ріст 18 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 пухлини інгібується принаймні приблизно на 60 %. У деяких варіантах здійснення, після введення лікарського засобу, ріст пухлини інгібується принаймні приблизно на 80 %. У деяких варіантах здійснення, після введення лікарського засобу, ріст пухлини інгібується в проміжку від приблизно 20 % до приблизно 100 %. У деяких варіантах здійснення, після введення лікарського засобу, ріст пухлини в значній мірі інгібований. У деяких варіантах здійснення, композицію вводять два рази на добу. У деяких варіантах здійснення, композицію вводять один раз на добу. У деяких варіантах здійснення, MEK інгібітор не інтерферує із спільним введенням іншого засобу, що пригнічує пухлину. У деяких варіантах здійснення, композиція знаходиться у формі таблетки, капсули, желатинової капсули, каплети, пелети, або гранули. У деяких варіантах здійснення, композиція знаходиться в дозованій формі у вигляді капсули або таблетки, що має загальну вагу від приблизно 50 мг до приблизно 1000 мг. У деяких варіантах здійснення, композиція знаходиться у формі капсули або таблетки, що має загальну вагу, вибрана із групи, яка включає 50 мг, 75 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, і 500 мг. У деяких варіантах здійснення, композиція знаходиться у формі капсули або таблетки, що має загальну вагу від приблизно 240 мг. У деяких варіантах здійснення, композиція додатково містить принаймні один заповнювач, вибраний із групи, яка включає мікрокристалічну целюлозу, силікатовану мікрокристалічну целюлозу, лактозу, стисливий цукор, ксиліт, сорбіт, маніт, желатинований крохмаль, мальтодекстрин, фосфат кальцію, карбонат кальцію, крохмаль і силікат кальцію. У деяких варіантах здійснення, композиція додатково містить принаймні один засіб, що викликає дезінтеграцію, вибраний із групи, яка включає кроскармелозу натрію, крохмальгліколят натрію, кросповідон, метилцелюлозу, альгінову кислоту, альгінат натрію, похідні крохмалю, бетоніт і вігум. У деяких варіантах здійснення, композиція додатково містить принаймні одну змащувальну речовину, вибрану із групи, яка включає стеарат магнію, стеарати металів, тальк, стеарилфумарат натрію й стеаринову кислоту. У деяких варіантах здійснення, композиція додатково містить принаймні один змочувальний засіб або поверхнево-активну речовину, вибрану із групи, яка включає лаурилсульфат натрію, гліцерин, сорбітанолеати, сорбітанстеарати, поліоксіетиленований сорбітанлаурат, пальмітат, стеарат, олеат або гексаолат, поліоксіетиленовий стеариловий спирт і сорбітанмонолаурат. У даній заявці забезпечуються композиції у формі капсули або таблетки й капсула або таблетка вивільняє принаймні 60 відсотків лікарського засобу протягом 30 хвилин, використовуючи Фармакопею US (USP) Апарат II при 50 об. за хвилину з 1 % лаурилсульфатом натрію у воді як середовище розчинення. У деяких варіантах здійснення, композиція знаходиться у формі капсули або таблетки й капсула або таблетка вивільняє близько 60-100 відсотків лікарського засобу протягом 30 хвилин, використовуючи Фармакопею US (USP) Апарат II при 50 об. за хвилину з 1 % лаурилсульфатом натрію у воді як середовище розчинення. У деяких варіантах здійснення, композиція знаходиться у формі капсули або таблетки й капсула або таблетка вивільняє близько 60-90 відсотків лікарського засобу протягом 30 хвилин, використовуючи Фармакопею US (USP) Апарат II при 50 об. за хвилину з 1 % лаурилсульфатом натрію у воді як середовище розчинення. У деяких варіантах здійснення, композиція знаходиться у формі капсули або таблетки й капсула або таблетка вивільняє близько 60-80 відсотків лікарського засобу протягом 30 хвилин, використовуючи Фармакопею US (USP) Апарат II при 50 об. за хвилину з 1 % лаурилсульфатом натрію у воді як середовище розчинення. У даному винаході також забезпечуються партії капсул або таблеток, кожна містить від приблизно 1 до приблизно 50 мг сполуки, як описано в даній заявці, і має приймальне число згідно із USP щодо однорідності сполуки менше, ніж приблизно 15. Способи лікування Винахід стосується способів лікування або запобігання злоякісне новоутворення, які включають введення суб'єктові, який цього потребує, ефективної кількості фармацевтичної композиції, яка містить сполуку формули (I), як описано в даній заявці. У різних варіантах здійснення, сполуки й композиції, корисні в цих способах, являють собою сполуки й композиції, описані сімейством формули (I) або будь-якою підсімейством або видами, приклади яких представлені в даному винаході, що підпадають під обсяг формули (I). Винахід стосується способів лікування або запобігання запального захворювання, які включають введення суб'єктові, який цього потребує, ефективної кількості фармацевтичної композиції, яка містить сполуку формули (I), як описано в даній заявці. У різних варіантах здійснення, сполуки й композиції, корисні в цих способах, являють собою сполуки й композиції, 19 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 описані сімейством формули (I) або будь-якою підсімейством або видами, приклади яких представлені в даному винаході, що підпадають під обсяг формули (I). У деяких варіантах здійснення, винахід стосується способів лікування або запобігання анкілозуючого спондиліту, подагри, тендиніту, бурситу або ішіалгії, які включають введення суб'єктові, який цього потребує, ефективної кількості фармацевтичної композиції, яка містить сполуку формули (I), як описано в даній заявці. У різних варіантах здійснення, сполуки й композиції, корисні в цих способах, являють собою сполуки й композиції, описані сімейством формули (I) або будь-якою підсімейством або видами, приклади яких представлені в даному винаході, що підпадають під обсяг формули (I). У деяких аспектах, даний винахід також стосується способу лікування захворювання в індивідуума, який страждає від вказаного захворювання, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. В інших аспектах, даний винахід стосується способу лікування порушення в ссавця, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, сольвату, поліморфу, складного ефіру, таутомеру або проліків В інших аспектах, даний винахід стосується способу лікування порушення в людини, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, сольвату, поліморфу, складного ефіру, таутомеру або проліків В інших аспектах, даний винахід стосується способу лікування гіперпроліферативного порушення в ссавця, включаючи людину, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, сольвату, поліморфу, складного ефіру, таутомеру або проліків В інших аспектах, даний винахід стосується способу лікування запального захворювання, стану, або порушення в ссавця, включаючи людину, який включає введення вказаному ссавцеві терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, складного ефіру, проліки, сольвату, гідрату або похідного. В інших аспектах, даний винахід стосується способу лікування порушення або стану, яке модулюється MEK каскадом, у ссавця, включаючи людину, який включає введення вказаному ссавцеві кількості сполуки формули I або її фармацевтично прийнятної солі, складного ефіру, проліки, сольвату, гідрату або похідного, ефективного для модуляції вказаного каскаду. Підходяща доза для конкретного пацієнта може бути визначена відповідно до відомих способів фахівцями в даній галузі техніки. Інгібування MEK ферменту В інших аспектах, даний винахід стосується способу інгібування MEK ферменту. У деяких варіантах здійснення, спосіб включає контактування вказаного MEK ферменту з кількістю композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки, достатній для інгібування вказаного ферменту, при якому вказаний фермент інгібується. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 1 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 2 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 3 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 4 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 5 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 10 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 20 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 25 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 30 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 40 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 50 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 60 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 70 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 75 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 80 %. У подальших або додаткових варіантах здійснення фермент інгібований принаймні приблизно на 90 %. У подальших або додаткових варіантах здійснення фермент по суті повністю інгібований. У подальших або додаткових варіантах здійснення MEK 20 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 фермент являє собою MEK кіназу. У подальших або додаткових варіантах здійснення MEK фермент являє собою MEK1. У подальших або додаткових варіантах здійснення MEK фермент являє собою MEK2. У подальших або додаткових варіантах здійснення контактування відбувається в клітині. У подальших або додаткових варіантах здійснення клітина являє собою клітину ссавця. У подальших або додаткових варіантах здійснення клітина ссавця являє собою клітину людини. У подальших або додаткових варіантах здійснення, MEK фермент інгібований за допомогою композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. Порушення, опосередковане MEK В інших аспектах, даний винахід стосується способу лікування порушення, опосередкованого MEK, в особини, що страждає від вказаного порушення, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У деяких варіантах здійснення, фармацевтична композиція знаходиться у формі, яка підходить для перорального введення. У подальших або додаткових варіантах здійснення, фармацевтична композиція знаходиться у формі таблетки, капсули, пігулки, порошку, препаратів з уповільненим вивільненням, розчину, суспензії, для парентеральної ін'єкції у вигляді стерильного розчину, суспензії або емульсії, для місцевого введення у вигляді мазі або крему або для ректального введення у вигляді супозиторію. У подальших або додаткових варіантах здійснення, фармацевтична композиція знаходиться в дозованих лікарських формах, які підходять для однократного введення точних доз. У подальших або додаткових варіантах здійснення, фармацевтична композиція додатково містить фармацевтичний носій, ексципієнт та/або ад'ювант. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, індивідуум, що страждає від порушення, опосередкованого MEK, являє собою ссавця. У подальших або додаткових варіантах здійснення, індивідуум являє собою людину. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинний засіб вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/анти-гормональні терапевтичні засоби, і гематопоетичні 21 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 фактори росту. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із таксолу, ботрезомібу або обох засобів. У деяких варіантах здійснення, порушення, опосередковане MEK, вибирають із групи, яка включає запальні захворювання, інфекції, аутоімунні порушення, удар, ішемію, порушення серцевої діяльності, неврологічні порушення, фіброгенетичні порушення, проліферативні порушення, гіперпроліферативні порушення, не-злоякісні гіперпроліферативні порушення, пухлини, лейкози, новоутворення, злоякісні новоутворення, карциноми, метаболічні захворювання, злоякісне захворювання, судинний рестеноз, псоріаз, атеросклероз, ревматоїдний артрит, остеоартрит, серцеву недостатність, хронічну біль, невропатичний біль, сухість очей, закритокутову глаукому й відкритокутову глаукому. У подальших або додаткових варіантах здійснення, порушення, опосередковане MEK, являє собою запальне захворювання. У подальших або додаткових варіантах здійснення, порушення, опосередковане MEK, являє собою гіперпроліферативне захворювання. У подальших або додаткових варіантах здійснення, порушення, опосередковане MEK, вибирають із групи, яка включає пухлини, лейкози, новоутворення, злоякісні новоутворення, карциноми й злоякісне захворювання. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку, рак молочної залози, рак легенів, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак шлунка, рак нирки, рак ободової і прямої кишки або лейкоз. У подальших або додаткових варіантах здійснення, фіброгенетичне порушення являє собою склеродермію, поліміозит, системний вовчак, ревматоїдний артрит, цироз печінки, келоїдні утворення, інтерстиціальний нефрит або фіброз легенів. У подальших або додаткових варіантах здійснення, вводять ефективну кількість композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. Забезпечувані ефекти В інших аспектах, даний винахід стосується способу забезпечення ефекту в пацієнта, який включає введення ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки, пацієнтові, де ефект вибирають із групи, яка включає інгібування різних злоякісних новоутворень, імунологічних захворювань і запальних захворювань. У деяких варіантах здійснення, ефект являє собою інгібування різних злоякісних новоутворень. У подальших або додаткових варіантах здійснення, ефект являє собою інгібування імунологічних захворювань. У подальших або додаткових варіантах здійснення, ефект являє собою інгібування запальних захворювань. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У деяких варіантах здійснення, композицію вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, індивідуум, що страждає від злоякісного новоутворення, являє 22 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 собою ссавця. У подальших або додаткових варіантах здійснення, індивідуум являє собою людину. У подальших або додаткових варіантах здійснення, вводять ефективну кількість композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. В інших аспектах, даний винахід стосується способу руйнування, інгібування росту або знищення ракової клітини, який включає контактування вказаної клітини з кількістю композиції, ефективним для руйнування, інгібування росту або знищення вказаної ракової клітини, де композиція містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, ракові клітини включають клітини головного мозку, молочної залози, легені, яєчника, підшлункової залози, передміхурової залози, нирки або ободової і прямої кишки. У подальших або додаткових варіантах здійснення, композицію вводять принаймні з одним терапевтичним засобом. У подальших або додаткових варіантах здійснення, терапевтичний засіб являє собою таксол, ботрезоміб або обидва засоби. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинні засоби вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/анти-гормональні терапевтичні засоби, і гематопоетичні фактори росту. У деяких варіантах здійснення, ракові клітини руйнується. У подальших або додаткових варіантах здійснення, руйнується 1 % ракових клітин. У подальших або додаткових варіантах здійснення, 2 руйнується % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 3 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 4 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 5 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 10 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 20 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 25 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 30 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 40 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 50 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 60 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 70 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 75 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 80 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 90 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнується 100 % ракових клітин. У подальших або додаткових варіантах здійснення, руйнуються по суті всі ракові клітини. У різних варіантах здійснення, вищевказане руйнування відбувається протягом одного дня, п'яти днів, десяти днів, одного місяця, двох місяців, шести місяців або одного року. У деяких варіантах здійснення, ракові клітини знищуються. У подальших або додаткових варіантах здійснення, знищується 1 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 2 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 3 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 4 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 5 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 10 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 20 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 25 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 30 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 40 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 50 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 60 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 70 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 75 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 80 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 90 % ракових клітин. У подальших або додаткових варіантах здійснення, знищується 100 % ракових клітин. У подальших або додаткових варіантах здійснення, знищуються по суті всі ракові клітини. У різних варіантах здійснення, вищевказане знищення злоякісних клітин відбувається в одного дня, п'яти днів, десяти днів, одного місяця, двох місяців, шести місяців або одного року. У подальших або додаткових варіантах здійснення, інгібується ріст ракових клітин. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 1 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 2 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин 23 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібується приблизно на 3 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 4 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 5 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 10 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 20 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 25 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 30 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 40 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 50 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 60 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 70 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 75 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 80 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 90 %. У подальших або додаткових варіантах здійснення, ріст ракових клітин інгібується приблизно на 100 %. У різних варіантах здійснення, вищевказане інгібування відбувається протягом одного дня, п'яти днів, десяти днів, одного місяця, двох місяців, шести місяців або одного року. В інших аспектах, даний винахід стосується способу зменшення розміру пухлини, інгібування збільшення розміру пухлини, зменшення проліферації пухлини або запобігання проліферації пухлини в індивідуума, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, розмір пухлини зменшується. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 1 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 2 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 3 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 4 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 5 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 10 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 20 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 25 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 30 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 40 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 50 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 60 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 70 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 75 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 80 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 85 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 90 %. У подальших або додаткових варіантах здійснення, розмір пухлини зменшується принаймні на 95 %. У подальших або додаткових варіантах здійснення, пухлина ліквідується. У деяких варіантах здійснення, розмір пухлини не збільшується. У різних варіантах здійснення, вищевказані впливи на розмір пухлини відбуваються протягом одного дня, п'яти днів, десяти днів, одного місяця, двох місяців, шести місяців або одного року. У деяких варіантах здійснення, проліферація пухлини зменшується. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 1 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 2 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 3 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 4 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 5 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 10 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 20 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 25 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 30 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 40 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 50 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 60 %. У деяких варіантах 24 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснення, проліферація пухлини зменшується принаймні на 70 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 75 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 75 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 80 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 90 %. У деяких варіантах здійснення, проліферація пухлини зменшується принаймні на 95 %. У деяких варіантах здійснення, запобігається проліферації пухлини. У різних варіантах здійснення, вищевказані впливи на проліферацію клітин відбуваються протягом одного дня, п'яти днів, десяти днів, одного місяця, двох місяців, шести місяців або одного року. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинний засіб вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/анти-гормональні терапевтичні засоби, і гематопоетичні фактори росту. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із таксолу, ботрезомібу або обох засобів. У деяких варіантах здійснення, композицію вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, індивідуум, що страждає від злоякісного новоутворення, являє собою ссавця. У подальших або додаткових варіантах здійснення, індивідуум являє собою людину. У подальших або додаткових варіантах здійснення, вводять ефективну кількість композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. Проліферативні захворювання В інших аспектах, даний винахід стосується способу лікування або профілактики проліферативного захворювання в індивідуума, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У деяких варіантах здійснення, проліферативне захворювання являє собою злоякісне новоутворення, псоріаз, рестеноз, аутоімунне захворювання, або атеросклероз. У подальших або додаткових варіантах здійснення, проліферативне захворювання являє собою гіперпроліферативне захворювання. У подальших або додаткових варіантах здійснення, проліферативне захворювання вибирають із групи, яка включає пухлини, лейкози, новоутворення, злоякісні новоутворення, карциноми й злоякісне захворювання. У подальших або додаткових варіантах здійснення, злоякісне новоутворення 25 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 являє собою рак головного мозку, рак молочної залози, рак легенів, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак нирки, рак ободової і прямої кишки, рак шлунка, рак голови й шиї або лейкоз. У подальших або додаткових варіантах здійснення, фіброгенетичне порушення являє собою склеродермію, поліміозит, системний вовчак, ревматоїдний артрит, цироз печінки, келоїдні утворення, інтерстиціальний нефрит або фіброз легенів. У подальших або додаткових варіантах здійснення, рак шлунка, рак головного мозку, рак молочної залози, рак легенів, недрібноклітинний рак легенів, рак яєчника, рак підшлункової залози, рак печінки, рак передміхурової залози, рак нирки, рак ободової і прямої кишки або лейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку або рак кори наднирників. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак молочної залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак яєчника. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак підшлункової залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак передміхурової залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак нирки. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак ободової і прямої кишки. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою мієлолейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою гліобластому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою фолікулярну лімфому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою гострий лейкоз попередників В-клітин. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою Вклітинний хронічний лімфолейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою мезотеліому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою дрібноклітинний рак легенів. У подальших варіантах здійснення, злоякісне новоутворення являє собою рак шлунка. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію, або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинний засіб вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/анти-гормональні терапевтичні засоби, і гематопоетичні фактори росту. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із таксолу, ботрезомібу або обох засобів. У деяких варіантах здійснення, композицію вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових 26 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, індивідуум, що страждає від проліферативного захворювання, являє собою ссавця. У подальших або додаткових варіантах здійснення, індивідуум являє собою людину. У подальших або додаткових варіантах здійснення, вводять ефективну кількість композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. Запальнізахворювання В інших аспектах, даний винахід стосується способу лікування або профілактики запального захворювання в індивідуума, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У подальших або додаткових варіантах здійснення, запальне захворювання вибирають із групи, яка включає хронічні запальні захворювання, ревматоїдний артрит, ревматоїдний артрит, спондилоартропатії, подагричний артрит, остеоартрит, хворобу Стіла, гострий ревматоїдний артрит, ентеропатичний артрит, невропатичний артрит, псоріатичний артрит, гнійний артрит, атеросклероз, системний червоний вовчак, запальні захворювання кишечнику, синдром подразненої товстої кишки, неспецифічний виразковий коліт, рефлюксний езофагіт, хворобу Крона, гастрит, астму, алергії, респіраторний дистрес-синдром, панкреатит, хронічне обструктивне захворювання легенів, фіброз легенів, псоріаз, екзему або склеродермію. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У деяких варіантах здійснення, композицію вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять більше чотирьох разів на добу. У деяких варіантах здійснення, індивідуум, що страждає від запального захворювання, являє собою ссавця. У подальших або додаткових варіантах здійснення, індивідуум являє собою людину. У подальших або додаткових варіантах здійснення, вводять ефективну кількість композиції, яка містить фармацевтично прийнятну сіль сполуки формули I. Злоякісне новоутворення В інших аспектах, даний винахід стосується способу лікування або профілактики злоякісного новоутворення в індивідуума, який включає введення вказаному індивідуумові ефективної кількості композиції, яка містить сполуку формули I або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку, рак молочної залози, рак шлунка, рак легенів, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак нирки, рак ободової і прямої кишки або лейкоз. У подальших або додаткових 27 UA 99731 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення, фіброгенетичне порушення являє собою склеродермію, поліміозит, системний вовчак, ревматоїдний артрит, цироз печінки, келоїдні утворення, інтерстиціальний нефрит або фіброз легенів. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку, рак молочної залози, рак легенів, рак яєчника, рак підшлункової залози, рак передміхурової залози, рак нирки, рак шлунка, рак ободової і прямої кишки або лейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак головного мозку або рак кори наднирників. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак молочної залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак яєчника. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак підшлункової залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак передміхурової залози. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак нирки. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою рак ободової і прямої кишки. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою мієлолейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою гліобластому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою фолікулярну лімфому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою гострий лейкоз попередників В-клітин. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою Вклітинний хронічний лімфолейкоз. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою мезотеліому. У подальших або додаткових варіантах здійснення, злоякісне новоутворення являє собою дрібноклітинний рак легенів. У деяких варіантах здійснення, злоякісне новоутворення являє собою рак шлунка. У деяких варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації з додатковою терапією. У подальших або додаткових варіантах здійснення, додаткова терапія являє собою променеву терапію, хіміотерапію, хірургію, або будь-яку їх комбінацію. У подальших або додаткових варіантах здійснення, композицію, яка містить сполуку формули I, вводять у комбінації принаймні з одним терапевтичним засобом. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із групи, яка включає цитотоксичні засоби, речовини проти ангіогенезу й протипухлинні засоби. У подальших або додаткових варіантах здійснення, протипухлинний засіб вибирають із групи, яка включає алкілувальні засоби, антиметаболіти, епідофілотоксини; протипухлинні ферменти, інгібітори топоізомерази, прокарбазини, мітоксантрони, координаційні комплекси платини, модифікатори біологічного відгуку й інгібітори росту, гормональні/анти-гормональні терапевтичні засоби, і гематопоетичні фактори росту. У подальших або додаткових варіантах здійснення, терапевтичний засіб вибирають із таксолу, ботрезомібу або обох засобів. У деяких варіантах здійснення, композицію вводять перорально, інтрадуоденально, парентерально (включаючи внутрішньовенне, підшкірне, внутрішньом'язове, внутрішньосудинне або шляхом інфузії), місцево або ректально. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I знаходиться в інтервалі від приблизно 0,5 до приблизно 50 мг/кг/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,001 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,01 до приблизно 7 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,02 до приблизно 5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,05 до приблизно 2,5 г/добу. У подальших або додаткових варіантах здійснення кількість сполуки формули I становить від приблизно 0,1 до приблизно 1 г/добу. У подальших або додаткових варіантах здійснення, рівні дозування нижче нижньої межі вищевказаного інтервалу можуть бути більш ніж достатніми. У подальших або додаткових варіантах здійснення, рівні дозування вище верхньої межі вищевказаного інтервалу можуть бути необхідними. У подальших або додаткових варіантах здійснення сполуку формули I вводять в однократній дозі, один раз на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять у багаторазових дозах, більше одного разу за добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять два рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять три рази на добу. У подальших або додаткових варіантах здійснення сполуку формули I вводять чотири рази на добу. У подальших або додаткових варіантах здійснення сполуку 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline polymorphic forms of n-(2-arylamino) aryl sulfonamides as inhibitors of mek, a composition (variants) and use
Автори англійськоюVernier, Jean-Michel, Rowlings, Colin, Edward, Girardet, Jean-Luc, Dimock, Stuart, Quart, Barry, Miner, Jeffrey, N.
Назва патенту російськоюКристаллические полиморфные формы n-(ариламино)сульфонамидов как ингибиторы мэк, композиция (варианты) и применение
Автори російськоюВернье Жан-Мишель, Роулингс Колин Эдвард, Жирарде Жан-Люк, Димок Стюарт, Куорт Барри, Минер Джеффри Н.
МПК / Мітки
МПК: A01N 41/06, A61K 31/18
Мітки: n-(ариламіно)сульфонамідів, композиція, інгібітори, форми, мек, кристалічні, варіанти, застосування, поліморфні
Код посилання
<a href="https://ua.patents.su/208-99731-kristalichni-polimorfni-formi-n-arilaminosulfonamidiv-yak-ingibitori-mek-kompoziciya-varianti-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Кристалічні поліморфні форми n-(ариламіно)сульфонамідів як інгібітори мек, композиція (варіанти) та застосування</a>
Попередній патент: Піна для застосування як прикраси або компонента харчового продукту або напою
Наступний патент: Спосіб збільшення опору потоку газу в шахті (варіанти)
Випадковий патент: Фунгіцидна суміш та засіб, що містять похідну триазолопіримідину та тридеморф, спосіб боротьби з патогенними грибами