Циклічні n,n’-діарилтіосечовини та n,n’-діарилсечовини – антагоністи андрогенових рецепторів, протираковий засіб, спосіб застосування
Номер патенту: 112161
Опубліковано: 10.08.2016
Автори: Іващенко Алєксандр Васільєвіч, Міткін Олєг Дмітрієвіч
Формула / Реферат
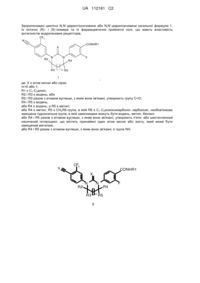
1. Циклічні N,N’-діарилтіосечовини і N,N’-діарилсечовини загальної формули 1 або їх оптичні (R)- і (S)-ізомери, або їх фармацевтично прийнятна сіль, що мають властивість антагоністів андрогенових рецепторів,
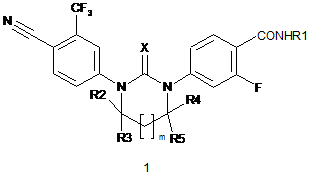 ,
,
де: X є атом кисню або сірки;
m=0 або 1;
R1 є С1-С3алкіл;
R2 і R3 є водень; або
R2 і R3 разом з атомом вуглецю, з яким вони зв'язані, утворюють групу С=О;
R4 і R5 є водень; або
R4 є водень, a R5 є метил; або
R4 є метил, R5 є CH2R6-група, де R6 є С1-С3алкоксикарбонілом, карбоксилом, гідроксильною групою, метоксигрупою або бензилоксигрупою, або
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, утворюють п'яти- або шестичленний насичений гетероцикл, що містить принаймні один атом кисню або азоту, який може бути заміщений метилом, або
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, є групою NH.
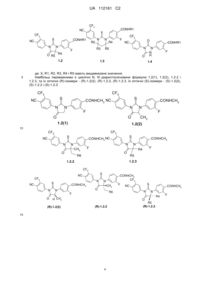
2. Сполука за п. 1 або її оптичні (R)- і (S)-ізомери, або її фармацевтично прийнятна сіль, що вибрана з групи яка включає сполуки формули 1.2, 1.3 та 1.4:
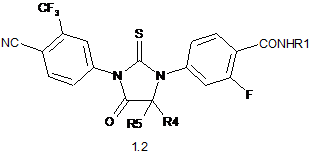 ,
,
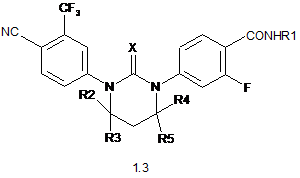 ,
,
 ,
,
де: X, R1, R2, R3, R4 і R5 мають значення, вказані в п. 1.
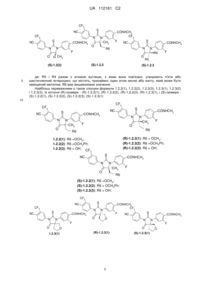
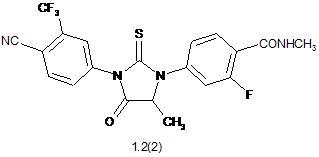
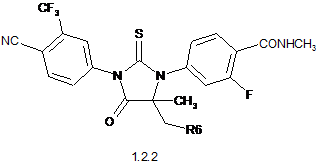
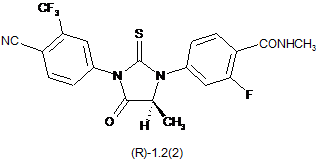
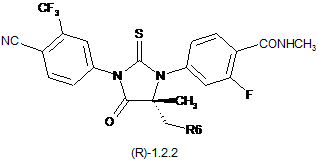
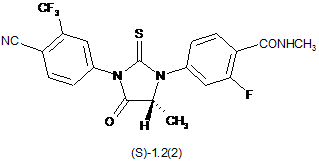
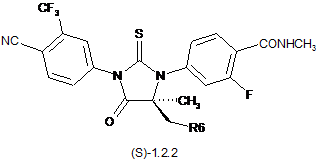
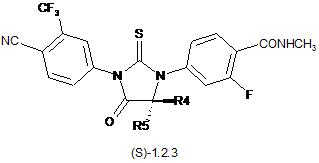
3. Сполука за п. 2, що вибрана з групи, яка включає сполуки формули 1.2(1), 1.2(2), 1.2.2 та 1.2.3, її оптичні (R)-ізомери - (R)-1.2(2), (R)-1.2.2, (R)-1.2.3, і (S)-ізомери - (S)-1.2(2), (S)-1.2.2 і (S)-1.2.3:
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
де: R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, утворюють п'яти- або шестичленний насичений гетероцикл, що містить принаймні один атом кисню або азоту, який може бути заміщений метилом, R6 має значення, вказане в п. 1.
4. Сполука за п. 3, що вибрана з групи, яка включає сполуки формули 1.2.2(1), 1.2.2(2), 1.2.2(3), 1.2.3(1), 1.2.3(2) і 1.2.3(3), її оптичні (R)-ізомери - (R)-1.2.2(l), (R)-1.2.2(2), (R)-1.2.2(3), (R)-1.2.3(1), і (S)-ізомери - (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1),
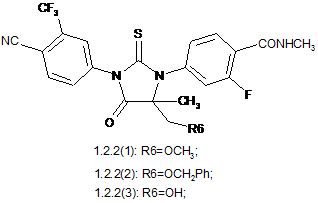
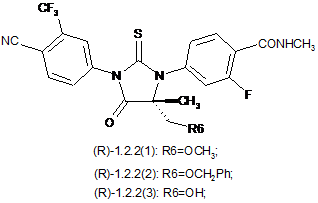
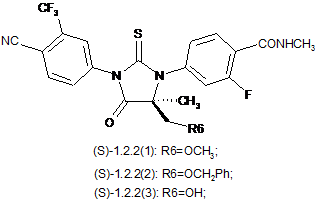
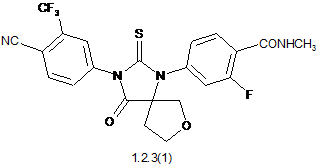
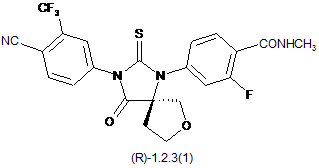
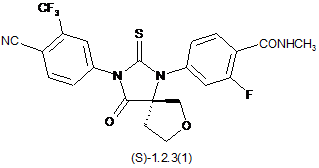
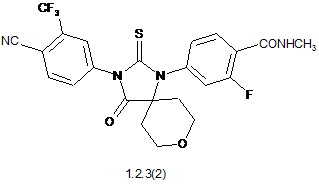
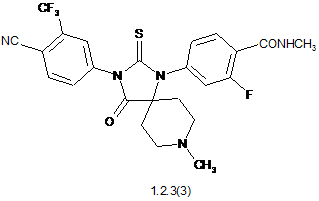
де R6 є гідроксильною групою, метоксигрупою або бензилоксигрупою.
5. Протираковий засіб, що містить принаймні одну сполуку загальної формули 1 за будь яким з пунктів 1-4, що має властивість антагоніста андрогенових рецепторів.
6. Фармацевтична композиція для лікування ракового захворювання, що містить як активний компонент протираковий засіб за п. 6 та інертний наповнювач або розчинник.
7. Фармацевтична композиція за п. 6 у формі таблеток, капсул або ін'єкцій.
8. Фармацевтична композиція за п. 6, що призначена для лікування раку простати.
9. Спосіб лікування ракового захворювання, у тому числі раку простати, у суб’єкта, що цього потребує, шляхом введення протиракового засобу за п. 5 або фармацевтичної композиції за будь-яким з пунктів 6-8.
Текст
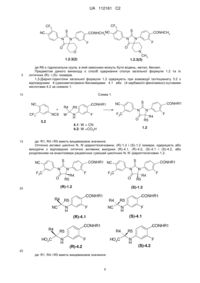
Реферат: Даний винахід стосується нових циклічних N,N'-діарилсечовин та N,N'-діарилтіосечовин антагоністів андрогенових рецепторів, протиракових засобів, фармацевтичної композиції, лікарського засобу та способу лікування раку, в тому числі раку простати. UA 112161 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 112161 C2 Запропоновані циклічні N,N'-діарилтіосечовини або N,N'-діарилсечовини загальної формули 1, їх оптичні (R)- і (S)-ізомери та їх фармацевтично прийнятні солі, що мають властивість антагоністів андрогенових рецепторів, N CF3 CONHR1 X R2 N N R3 m F R4 R5 1 , де: X є атом кисню або сірки; m=0 або 1; R1 є С1-С3алкіл; R2 і R3 є водень; або R2 і R3 разом з атомом вуглецю, з яким вони зв'язані, утворюють групу С=О; R4 і R5 є водень; або R4 є водень, a R5 є метил; або R4 є метил, R5 є CH2R6-група, в якій R6 є С1-С3алкоксикарбоніл, карбоксил, необов'язково заміщена гідроксильна група, в якій замісниками можуть бути водень, метил, бензил; або R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, утворюють п'яти- або шестичленний насичений гетероцикл, що містить принаймні один атом кисню або азоту, який може бути заміщений метилом, або R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, є група NH. N CF3 CONHR1 X N N F R4 R2 m R3 1 R5 UA 112161 C2 5 10 Область техніки Даний винахід відноситься до нових циклічних N, N’-діарилсечовин та N, N’діарилтіосечовин – антагоністів андрогенових рецепторів, протиракового засобу, фармацевтичної композиції, лікарського засобу та способу лікування раку, в тому числі раку простати. Попередній рівень техніки Відомі антагоністи андрогенових рецепторів, що являють собою 1,3-діарил-5,5-диметил-2тіоксо-імідазолідин-4-они I, 5,7-діарил-6-тіоксо-5,7-діаза-спіро[3,4]октан-8-они II та 1,3-діарил-2тіоксо-1,3-діаза-спіро[4,4]нонан-4-они III, що мають протиракову активність [WO2006124118, WO2007127010]. Серед сполук цього класу найбільш ефективним є антагоніст андрогенових рецепторів 4-[5,5-диметил-3-(3-трифторметил-4-ціанофеніл)-4-оксо-2-тіоксо-імідазолідин-1-іл]N-метил-2-фторбензамід MDV3100, що нині знаходиться у III фазі клінічних випробувань, як засіб для лікування раку простати [Drug Data Rep., 2009, 31(6), 609]. S Ar1 S N Ar2 N Ar1 S Ar1 N Ar2 N N N Ar2 Me Me O O I O II III CF3 S NC N CONHCH3 N F OHC 3 15 20 25 30 35 CH3 MDV3100 Пошук високоефективних протиракових лікарських препаратів, що мають підвищену активність і знижену токсичність, як і раніше є одним з основних напрямів створення нових фармакологічних засобів для лікування раку, в тому числі і раку простати. У зв'язку з цим актуальною є розробка нових протиракових субстанцій, фармацевтичних композицій та лікарських препаратів, а також способів їх одержання та застосування. Розкриття винаходу Нижче наведені визначення термінів, які використані в описі цього винаходу. "Азагетероцикл" означає ароматичну або неароматичну, моноциклічну або поліциклічну систему, що містить у циклі принаймні один атом азоту. Азагетероцикл може мати один або більше "замісників циклічної системи". "Активний компонент" (лікарська субстанція, лікарська речовина, drug-substance) означає фізіологічно активну речовину синтетичного або іншого (біотехнологічного, рослинного, тваринного, мікробного та іншого) походження, що має фармакологічну активність і є активним компонентом фармацевтичної композиції, що використовується для виробництва та виготовлення лікарського препарату (засобу). "Алкіл" означає аліфатичну вуглеводневу лінійну або розгалужену групу, з 1-12 атомами вуглецю у ланцюгу. Розгалужена означає, що алкільний ланцюг має один або декілька "нижчих алкільних" замісників. Алкіл може мати один або декілька однакових або різних замісників ("алкільних замісників"), включаючи галоген, алкенілокси, циклоалкіл, арил, гетероарил, гетероцикліл, ароїл, ціано, гідрокси, алкокси, карбокси, алкінілокси, аралкокси, арилокси, арилоксикарбоніл, алкілтіо, гетероарилтіо, аралкілтіо, арилсульфоніл, алкілсульфонілгетероаралкілокси та ін. 1 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Антагоністи" означають ліганди, які зв'язуються з рецепторами певного типу та не викликають активної клітинної відповіді. Антагоністи перешкоджають зв'язуванню агоністів з рецепторами і тим самим блокують передачу специфічного рецепторного сигналу. "Арил" означає ароматичну моноциклічну або поліциклічну систему, що містить від 6 до 14 атомів вуглецю, переважно від 6 до 10 атомів вуглецю. Арил може містити один або більше "замісників циклічної системи", які можуть бути однаковими або різними. Представниками арильних груп є феніл або нафтил, заміщений феніл або заміщений нафтил. Арил може бути анельований з неароматичною циклічною системою або гетероциклом. "Гетероцикліл" означає ароматичну або неароматичну насичену моноциклічну або поліциклічну систему, що містить від 3 до 10 атомів вуглецю, переважно від 5 до 6 атомів вуглецю, в якій один або більше атомів вуглецю заміщені гетероатомом або гетероатомами, такими як азот, сірка або кисень. Приставка "аза", "окса" або "тіа" перед гетероциклілом означає наявність у циклічної системі атома азоту, атома кисню або атома сірки, відповідно. Гетероцикліл може мати один або декілька "замісників циклічної системи", які можуть бути однаковими або різними. Атоми азоту та сірки, що знаходяться в гетероциклілі, можуть бути окисленими до N-оксиду, S-оксиду або S-диоксиду. Представниками гетероциклілів є піперідиніл, пірролідиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, 1,4-диоксан-2-іл, тетрагідрофураніл, тетрагідротіофеніл та ін. "Гідрат" означає стехіометричну або нестехіометричну композицію сполуки або її солі з водою. "Замісник" означає хімічний радикал, що приєднується до скефолда (фрагмента), наприклад, "замісник алкільний", "замісник аміногрупи", "замісник карбамоїльний", "замісник циклічної системи", значення яких визначено в даному розділі. "Лікарський засіб" (препарат) – речовина (або суміш речовин у вигляді фармацевтичної композиції), у вигляді таблеток, пігулок, капсул, ін'єкцій, мазей та інших готових форм, призначена для відновлення, виправлення або зміни фізіологічних функцій людини та тварин, а також для лікування і профілактики хвороб, діагностики, анестезії, контрацепції, косметології та іншого. "Нижчий алкіл" означає лінійний або розгалужений алкіл з 1-4 атомами вуглецю. "Фармацевтична композиція" означає композицію, що містить сполуку загальної формули 1 та, принаймні, один з компонентів, вибраних з групи, що складається з фармацевтично прийнятних та фармакологічно сумісних наповнювачів, розчинників, розріджувачів, носіїв, допоміжних, розподільних та сприймаючих засобів, засобів доставки, таких як консерванти, стабілізатори, наповнювачі, подрібнювачі, зволожувачі, емульгатори, суспендуючі агенти, загусники, підсолоджувачі, віддушки, ароматизатори, антибактеріальні агенти, фунгіциди, лубриканти, регулювальники пролонгованої доставки, вибір і співвідношення яких залежить від природи і способу призначення та дозування. Прикладами суспендуючих агентів є етоксильований ізостеариловий спирт, поліоксиетилен, сорбітол і сорбітовий ефір, мікрокристалічна целюлоза, метагідроксид алюмінію, бентоніт, агар-агар і трагакант, а також суміші цих речовин. Захист від дії мікроорганізмів може бути забезпечений за допомогою різноманітних антибактеріальних та протигрибкових агентів, наприклад, таких як парабени, хлорбутанол, сорбінова кислота та подібні до них сполуки. Композиція може включати також ізотонічні агенти, наприклад, цукри, хлористий натрій та подібні до них. Пролонгована дія композиції може бути забезпечена за допомогою агентів, що уповільнюють абсорбцію активної основи, наприклад, моностеарат алюмінію та желатин. Прикладами відповідних носіїв, розчинників, розріджувачів та засобів доставки є вода, етанол, поліспирти, а також їх суміші, рослинні олії (такі, як оливкова олія) та ін'єкційні органічні естери (такі, як етилолеат). Прикладами наповнювачів є лактоза, молочний цукор, цитрат натрію, карбонат кальцію, фосфат кальцію та подібні до них. Прикладами подрібнювачів і розподільних засобів є крохмаль, алгінова кислота та її солі, силікати. Прикладами лубрикантів є стеарат магнію, лаурилсульфат натрію, тальк, а також поліетиленгліколь з високою молекулярною вагою. Фармацевтична композиція для перорального, сублінгвального, трансдермального, внутрішньом'язового, внутрішньовенного, підшкірного, місцевого або ректального введення активної основи, однієї або в комбінації з іншою активною основою, може бути введена тваринам і людям у стандартній формі введення, у вигляді суміші з традиційними фармацевтичними носіями. Придатні стандартні форми введення включають пероральні форми, такі як таблетки, желатинові капсули, пігулки, порошки, гранули, жувальні гумки та пероральні розчини або суспензії, сублінгвальні та трансбукальні форми введення, аерозолі, імплантати, місцеві, трансдермальні, підшкірні, внутрішньом'язові, внутрішньовенні, інтраназальні або внутрішньоочні форми введення та ректальні форми введення. 2 UA 112161 C2 5 10 15 20 25 30 Фармацевтичні композиції, як правило, одержуть за допомогою стандартних процедур, що передбачають змішання активної сполуки з рідким аботонко подрібненим твердим носієм. "Фармацевтично прийнятна сіль" означає відносно нетоксичні органічні та неорганічні солі кислот та основ, заявлених у цьому винаході. Ці солі можуть бути отримані in situ в процесі синтезу, виділення або очищення сполук або приготовлені спеціально. Зокрема, солі основ можуть бути отримані спеціально, виходячи з очищеної вільної основи заявленої сполуки та відповідної органічної або неорганічної кислоти. Прикладами одержаних таким чином солей є гідрохлорид, гідробромид, сульфати, бісульфат, фосфати, нітрати, ацетати, оксалати, валеріати, олеати, пальмітати, стеарати, лаурати, борати, бензоати, лактати, тозілати, цитрати, малеати, фумарати, сукцінати, тартрати, мезилати, малонати, саліцилати, пропіонати, етансульфонати, бензолсульфонати, сульфамати та до них подібні. (Детальний опис властивостей таких солей дано у Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19.). Солі заявлених кислот також можуть бути спеціально одержані реакцією очищеної кислоти з відповідною основою, при цьому можуть бути синтезовані солі металів та амінів. До металевих відносяться солі натрію, калію, кальцію, барію, цинку, магнію, літію та алюмінію, кращими з яких є солі натрію та калію. Відповідними неорганічними основами, з яких можуть бути одержані солі металів є гідроксид, карбонат, бікарбонат та гідрид натрію, гідроксид та бікарбонат калію, поташ, гідроксид літію, гідроксид кальцію, гідроксид магнію, гідроксид цинку. Як органічні основи, з яких можуть бути одержані солі заявлених кислот, вибрані аміни та амінокислоти, що мають достатню основність, щоб утворити стійку сіль, і придатні для використання в медичних цілях (зокрема, вони повинні мати низьку токсичність). До таких амінів відносяться аміак, метиламін, диметиламін, триметиламін, етиламін, диетиламін, триетиламін, бензиламін, дибензиламін, дициклогексиламін, піперазин, етилпіперидин, трис(гідроксиметил)амінометан та подібні до них. Крім того, для солеутворення можуть бути використані гідроокиси тетраалкіламонія, наприклад, такі як, холін, тетраметиламоній, тетраетиламоній та подібні до них. Як амінокислоти можуть бути використані основні амінокислоти – лізин, орнітин та аргінін. Автори виявили нові циклічні N, N’-діарилтіосечовини та N, N’-діарилсечовини загальної формули 1, їх оптичні (R)- і (S)- ізомери і фармацевтично прийнятні солі, що є антагоністами андрогенових рецепторів, N CF3 CONHR1 X N N F R4 R2 m R3 R5 1 35 40 45 де: Х є атом кисню або сірки; m=0 або 1; R1 є C1-C3алкіл; R2 і R3 є водень; або R2 і R3 разом з атомом вуглецю, з яким вони пов'язані, утворюють групу С = О; R4 і R5 є водень; або R4 є водень, а R5 є метил; або R4 є метил, R5 є СН2R6 група, в якої R6 є С1-С3 алкоксикарбоніл, карбоксил, необов'язково заміщена гідроксильна група, в якої замісники можуть бути водень, метил, бензил; або R4 і R5 разом з атомом вуглецю, з яким вони пов'язані, утворюють п'яти або шестичленний насичений гетероцикл, що містить, принаймні, один атом кисню або азоту, який може бути заміщений метилом, або R4 і R5 разом з атомом вуглецю, з яким вони пов'язані, є група NH. Переважними є N, N’-діарилтіосечовини і N, N’-діарилсечовини, їх оптичні (R)- і (S)- ізомери і фармацевтично прийнятні солі загальної формули 1.2, 1.3 або 1.4. 3 UA 112161 C2 CF3 CONHR1 NC X CF3 S NC N R2 N F N N R3 CONHR1 CF3 R5 F R4 O NC N O R5 R4 5 N N H O 1.2 CONHR1 1.3 F 1.4 де: Х, R1, R2, R3, R4 і R5 мають вищевказане значення. Найбільш переважними є циклічні N, N’-діарилтіосечовини формули 1.2(1), 1.2(2), 1.2.2 і 1.2.3, та їх оптичні (R)-ізомери - (R)-1.2(2), (R)-1.2.2, (R)-1.2.3, їх оптичні (S)-ізомери - (S)-1.2(2), (S)-1.2.2 і (S)-1.2.3 CF3 CF3 S NC S CONHCH3 NC N N N CONHCH3 N F F O O 1.2(1) CH3 1.2(2) 10 CF3 CF3 S NC N S CONHCH3 NC N N N F CH3 O CONHCH3 F R4 O R6 R5 1.2.3 1.2.2 CF3 S NC CF3 N S NC N N CONHCH3 CH3 O N CONHCH3 CF3 R6 F O S NC N CONHCH3 N R4 H CH3 (R)-1.2(2) F O (R)-1.2.2 15 4 R5 (R)-1.2.3 F UA 112161 C2 CF3 S NC CF3 N S NC N CONHCH3 N CH3 O N CONHCH3 CF3 F NC S N R6 CONHCH3 N F O R4 H CH3 O (S)-1.2.2 (S)-1.2(2) 5 F R5 (S)-1.2.3 де: R5 і R4 разом з атомом вуглецю, з яким вони пов'язані, утворюють п'яти або шестичленний гетероцикл, що містить, принаймні, один атом кисню або азоту, який може бути заміщений метилом, R6 має вищевказане значення. Найбільш переважними є також сполуки формули 1.2.2(1), 1.2.2(2), 1.2.2(3), 1.2.3(1), 1.2.3(2) і 1.2.3(3), їх оптичні (R)-ізомери - (R)-1.2.2(1), (R)-1.2.2(2), (R)-1.2.2(3), (R)-1.2.3(1), і (S)-ізомери (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1) 10 CF3 CF3 N CONHCH3 N F CONHCH3 N N CH3 O S NC S NC F CH3 O R6 R6 1.2.2(1): R6 =OCH3; 1.2.2(2): R6 =OCH2Ph; 1.2.2(3): R6 = OH; CF (R)-1.2.2(1): R6 = OCH3; (R)-1.2.2(2): R6 =OCH2Ph; (R)-1.2.2(3): R6 = OH; 3 S NC N CONHCH3 N CH3 O F R6 (S)-1.2.2(1): R6 =OCH3; (S)-1.2.2(2): R6 = OCH2Ph; (S)-1.2.2(3): R6 = OH; CF3 S NC CF3 N S NC N CONHCH3 CF3 N F CONHCH3 O N O F O N CONHCH3 N F O O 1.2.3(1) S NC (R)-1.2.3(1) 5 (S)-1.2.3(1) O UA 112161 C2 CF3 CF3 S NC N S CONHCH3NC N N CONHCH3 N F F O O N O CH3 1.2.3(3) 1.2.3(2) 5 де R6 є гідроксильна група, в якій замісники можуть бути водень, метил, бензил. Предметом даного винаходу є спосіб одержання сполук загальної формули 1.2 та їх оптичних (R)- і (S)- ізомерів. 1,3-Діарил-гідантоїни загальної формули 1.2 одержують при взаємодії ізотіоціанату 3.2 з відповідними 4-(ціанометил)аміно-бензамідами 4.1 або (4-карбамоїл-феніламіно)-оцтовими кислотами 4.2 за схемою 1. Схема 1. 10 NC R4 + NCS CF3 R5 W S NC CONHR1 N N H N F3C F F R4 O 3.2 R5 4.1: W = CN 4.2: W =CO2H 15 CONHR1 1.2 де: R1, R4 і R5 мають вищевказане значення. Оптично активні циклічні N, N’-діарилтіосечовини, (R)-1.2 і (S)-1.2 ізомери, одержують або виходячи з відповідних оптично активних вихідних (R)-4.1, (R)-4.2, (S)-4.1 і (S)-4.2, або розділенням на енантіомери рацемічних сумішей циклічних N, N’-діарилтіосечовин 1.2. S NC S CONHR1 NC N N F3C N R4 O F (S)-1.2 CONHR1 R4 N H F R5 NC R5 N H HO2C F (S)-4.1 (R)-4.1 R4 R5 CONHR1 NC F R4 O (R)-1.2 R4 N F3C R5 20 CONHR1 CONHR1 CONHR1 R4 N H F (R)-4.2 25 де: R1, R4 і R5 мають вищевказане значення. 6 R5 HO2C R5 N H F (S)-4.2 UA 112161 C2 1,3-Діарил-тетрагідропіримідин-2-они загальної формули 1.3.1 одержують при взаємодії відповідних N, N’-діарилсечовин загальної формули 2 з 1,3-дибромпропаном за схемою 2. Схема 2. 5 NC CONHR1 O F3C N H N H NC Br(CH2)3Br K2CO3 F CONHR1 O F3C N N F 2 10 1.3.1 де: R1 має вищевказане значення. Сполуки загальної формули 1.3.2 одержують при взаємодії ізоціанату 3.1 або ізотіоціанату 3.2 з відповідними етил β-аланінатами загальної формули 5 з подальшою циклізацією сечовин, що утворюються, загальної формули 6 за схемою 3, Схема 3. CONHR1 CONHR1 NC X H+ NC + HN NCX CF3 CF3 F CO2Et CO2Et 3.1,3,2 5 F X CF3 N F N O 6(1,2) 1.3.2(1,2) OHNC N N H 6(3) 15 CONHR1 X CF3 20 N N H CONHR1 NC F COOH де: Х і R1 мають вищевказане значення. 1,4-Діарил-[1,2,4]триазолідин-3,5-діони загальної формули 1.4 одержують при взаємодії відповідного гідразина 7 з ізоціанатом 3.1 з подальшою конденсацією семікарбазида 8, що утворюється, з дифосгеном за схемою 4. Схема 4. NC CONHR1 + F H2 NHN 25 7 CF3 NC NCO 3.1 CF3 NH H N O N H 8 O NC F CONHR1 N O CONHR1 N N H 1.4 1 30 F F3C де: R має вищевказане значення. Нові антагоністи андрогенових рецепторів придатні також для вивчення молекулярного механізму інгібування й активації андрогенових рецепторів. Нові циклічні N, N’-діарилтіосечовини і N, N’-діарилсечовини загальної формули 1 є антагоністами андрогенових рецепторів, причому їх активність значно перевищує активність 7 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомих антагоністів андрогенових рецепторів, що опубліковані у міжнародних заявках WO2006124118, WO2007127010, і в Drug Data Rep., 2009, 31(6), 609. Крім того, новий антагоніст 1.2.2(1) більш ніж у три рази менш токсичний, ніж антагоніст MDV3100, оскільки його максимально прийнятна доза (МТD), яка визначена в експериментах на самцях мишей лінії CD1 становить МТD > 100 мг/кг, в той час як MDV3100 має МТD ~ 30 мг/кг. Предметом даного винаходу є новий протираковий засіб, що являє собою, принаймні, одну циклічну N, N’-діарилтіосечовину або N, N’- діарилсечовину загальної формули 1. Предметом даного винаходу є також нова фармацевтична композиція, що містить як активний компонент, принаймні, одну циклічну N, N’-діарилтіосечовину або N, N’діарилсечовину загальної формули 1, її оптично активний ізомер або фармацевтично прийнятну сіль, що має протиракову активність, в ефективній кількості. Найбільш переважною є фармацевтична композиція, яка має активність щодо раку простати, що містить як активний компонент, принаймні, одну циклічну N, N’-діарилтіосечовину або N, N’- діарилсечовину загальної формули 1, її оптично активний ізомер або фармацевтично прийнятну сіль. Фармацевтична композиція може включати фармацевтично прийнятні ексципієнти. Під фармацевтично прийнятними ексципієнтами мають на увазі розріджувачі, допоміжні агенти та/або носії, що застосовуються у сфері фармацевтики. Фармацевтична композиція поряд з циклічною N, N’-діарилтіосечовиною або N, N’- діарилсечовиною загальної формули 1, її оптично активним ізомером або фармацевтично прийнятною сіллю за даним винаходом може включати й інші активні компоненти, у тому числі такі, що мають протиракову активність, за умови, що вони не викликають небажаних побічних ефектів. При необхідності використання фармацевтичної композиції за даним винаходом в клінічній практиці вона може змішуватися з традиційними фармацевтичними носіями. Носії, що використовуються у фармацевтичній композиції за даним винаходом, являють собою носії, які застосовуються у сфері фармацевтики для одержання розповсюджених форм, у тому числі: у пероральних формах використовуються зв'язуючі речовини, змащувальні агенти, дезінтегратори, розчинники, розріджувачі, стабілізатори, суспендуючі агенти, безбарвні агенти, коригенти смаку; у формах для ін'єкцій використовуються антисептичні агенти, солюбілізатори, стабілізатори; у місцевих формах використовуються основи, розріджувачі, змащувальні агенти, антисептичні агенти. Метою даного винаходу також є спосіб одержування фармацевтичних композицій. Поставлена мета досягається змішуванням нового протиракового засобу з інертним наповнювачем та/або розчинником, відмітна особливість якого полягає в тому, що як протираковий засіб використовують, принаймні, одну циклічну N, N’-діарилтіосечовину або N, N’-діарилсечовину загальної формули 1, її оптично активний ізомер або фармацевтично прийнятну сіль. Предметом даного винаходу є лікарський засіб у формі таблеток, капсул або ін'єкцій, поміщених у фармацевтично прийнятну упаковку, що містить у своєму складі новий протираковий засіб або нову фармацевтичну композицію, призначену для лікування раку. Найбільш переважним лікарським засобом, що містить у своєму складі новий протираковий засіб або нову фармацевтичну композицію, є лікарський засіб, призначений для лікування раку простати. Предметом даного винаходу є також терапевтичні коктейлі для лікування ракових захворювань, у тому числі раку простати, що містять як один з компонентів новий лікарський засіб або нову фармацевтичну композицію, що містять у складі як активний компонент, принаймні, одну циклічну N, N’-діарилтіосечовину або N, N’-діарилсечовину загальної формули 1, їх оптично активний ізомер або фармацевтично прийнятну сіль. Терапевтичний коктейль для лікування раку простати, поряд з лікарським засобом за даним винаходом, може містити інші відомі препарати, призначені для лікування ракових захворювань. Відповідно до даного винаходу спосіб лікування ракових захворювань тварин і людей, у тому числі раку простати, полягає у введенні теплокровній тварині або людині нового лікарського засобу, нової фармацевтичної композиції або нового терапевтичного коктейлю. Лікарські засоби можуть вводитися перорально або парентерально (наприклад, внутрішньовенно, підшкірно, внутрішньочеревно або місцево). Клінічне дозування лікарського засобу загальної формули 1 у пацієнтів може коригуватися в залежності від: терапевтичної ефективності і біодоступності активних інгредієнтів в організмі, швидкості їх обміну та виведення з організму, а також залежно від віку, статі та стадії захворювання пацієнта, при цьому добова доза у дорослих звичайно становить 10 500 мг, краще - 50 300 мг. Тому під час приготування з фармацевтичної композиції лікарського засобу за цим винаходом у вигляді 8 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 одиниць дозування необхідно враховувати вищезгадане ефективне дозування, при цьому кожна одиниця дозування препарату повинна містити 10 500 мг лікарського засобу загальної формули 1, краще – 50 300 мг. Відповідно до вказівок лікаря або фармацевта дані препарати можуть прийматися декілька разів протягом певних проміжків часу (переважно – від одного до шести разів). Кращий варіант застосування винаходу Винахід пояснюється кресленнями. Фіг.1. Зміна ваги самців мишей при пероральному введенні сполуки 1.2.2(1). Фіг.2. Зміна ваги самців мишей при пероральному введенні сполуки MDV3100. У прикладах, що наведені нижче, описаний синтез N, N’-діарилтіосечовин і N, N’діарилсечовин та дані їх біологічних випробувань, які ілюструють, але не обмежують, даний винахід. Приклад 1. Синтез N-метил-4-{4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1-іл}-2-фторбензаміду 1.2(1). До розчину 279 мг (1 ммоль) 4-іод-N-метил-2фторбензаміду в 3 мл ДМФА додають 80 мг (1.07 ммоль) гліцину та 207 мг (1.5 ммоль) К 2CO3. Реакційну суміш перемішують у мікрохвильовій печі при 140 °C протягом 18 хв., охолоджують, розріджують 10 мл AcOEt і 10 мл води, нейтралізують HCl до pH 2-3, органічний шар відділяють, водний екстрагують AcOEt (5 × 20 мл). Об'єднані екстракти промивають розсолом, сушать над Na2SO4 і упарюють у вакуумі. Продукт виділяють колонковою хроматографією на SiO 2. Одержують N-(4-метилкарбамоїл-2-фторфеніл)гліцин 4.2(1) (R1=CH3, R4=R5=H, ). Розчин 113 мг (0.5 ммоль) N-(4-метилкарбамоїл-2-фторфеніл)гліцину 4.2(1) і 174 мг (1.0 ммоль) 4ізотіоціанато-2-(трифторметил)бензонітрилу 3.2 в 2 мл ДМФА перемішують при 90 °C протягом 12 год. Реакційну суміш упарюють у вакуумі та методом HPLC виділяють N-метил-4-{4-оксо-2тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-імідазолідин-1-іл}-2-фторбензамід 1.2(1). LCMS + (M+H) 437. Приклад 2. Загальний метод синтезу N-метил-4-{5-метил-4-оксо-2-тіоксо-3-[3(трифторметил)-4-ціанофеніл]імідазолідин-1-іл}-2-фторбензаміду 1.2(2), N-метил-4-{(S)-5метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1-іл}-2-фторбензаміду (S)1.2(2) і N-метил-4-{(R)-5-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1іл}-2-фторбензаміду (R)-1.2(2). До розчину 667 мг (3.9 ммоль) N-метил-2,4-дифторбензаміду в 3 мл ДМСО додають 347 мг (7.8 ммоль) (D, L)-, (D)- або (L)-аланіну та 2.54 г (7.8 ммоль) Cs2CO3. Реакційну суміш перемішують у закритій пробірці при 90 °C протягом 18 год. Охолоджену суміш розріджують ізопропанолом, нейтралізують 1.36 мл (15.6 ммоль) HCl, фільтрують, упарюють в вакуумі та методом HPLC виділяють N-(4-метилкарбамоїл-3-фторфеніл)аланін 4.2(2) (R1=CH3, R4=H, R5=CH3) (S)-N-(4-метилкарбамоїл-3-фторфеніл)аланін (S)-4.2(2) або (R)-N-(4-метилкарбамоїл-3+ 1 фторфеніл)аланін (R)-4.2(2). LCMS (M+H) 241. H ЯМР (ДМСО-d6, 400 МГц): 12.66 (уш. с, 1H), 7.62 (м, 1H), 7.45 (т, J=8.8 Гц, 1H), 6.67 (уш. д, J=7.2 Гц, 1H), 6.42 (дд, J 1=8.4 Гц, J2=2.0 Гц, 1H), 6.29 (дд, J1=14.8 Гц, J2=2.0 Гц, 1H), 4.03 (м, 1H), 2.73 (д, J=4.4 Гц, 3H), 1.37 (д, J=7.2 Гц, 3H). Розчин 110 мг (0.46 ммоль) аміну 4.2(2), (S)-4.2(2) або (R)-4.2(2) і 144 мг (0.55 ммоль) 4ізотіоціанато-2-(трифторметил)-бензонітрилу 3.2 у 2 мл ДМФА перемішують у мікрохвильовій печі при 90 °C протягом 12 год., далі додають ще 50 мг (0.19 ммоль) 4-ізотіоціанато-2(трифторметил)-бензонітрилу 3.2 і перемішування продовжують протягом ще 12 год. Реакційну масу упарюють в вакуумі і методом HPLC виділяють відповідно N-метил-4-{5-метил-4-оксо-2тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1-іл}-2-фторбензамід 1.2(2), або N-метил4-{(S)-5-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1-іл}-2фторбензамід (S)-1.2(2) або N-метил-4-{(R)-5-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4ціанофеніл]імідазолідин-1-іл}-2-фторбензамід (R)-1.2(2). Позірні константи інгібування 1.2(2) (S)-1.2(2) андрогенових рецепторів (Ki) для цих сполук становлять відповідно: Кi = 140.2 nM, Кi = (R)-1.2(2) + 1 106.7 nM і Кi = 73.6 nM. LCMS (M+H) 451. H ЯМР (CDCl3, 400 МГц): 8.28 (т, J=8.6 Гц, 1H), 8.01 (д, J=8.0 Гц, 1H), 7.94 (д, J=1.2 Гц, 1H), 7.81 (дд, J 1=8.0 Гц, J2=1.2 Гц, 1H), 7.48 (дд, J1=12.4 Гц, J2=1.6 Гц, 1H), 7.36 (дд, J1=8.4 Гц, J2=1.6 Гц, 1H), 6.72 (уш. м, 1H), 4.83 (к, J=7.2 Гц, 1H), 3.08 (д, J=4.8 Гц, 3H), 1.60 (д, J=7.2 Гц, 3H). Приклад 3. Синтез N-метил-4-{2-тіо-3-[3-(трифторметил)-4-ціанофеніл]-гідантоїн-1-іл}-2фторбензамідів 1.2.2 і 1.2.3 (загальна методика). Розчин 0.75 ммоль відповідного N-метил-2фтор-4-[(1-ціанометил)аміно]бензаміду 4.1 і 342 мг (1.5 ммоль) 4-ізотіоціанато-2(трифторметил)бензонітрилу 3.2 в 3 мл ДМФА перемішують у мікрохвильовій печі при 110 °C протягом 12 год. Реакційну суміш розчиняють в 30 мл MeOH, додають 7.5 мл 1N HCl і кип'ятять протягом 1.5 год. Розчин упарюють у вакуумі, оброблюють водою, осад відфільтровують, промивають водою і сушать у вакуумі. Продукт виділяють методом HPLC. Одержують: N-метил 9 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-[5-метил-5-(метоксиметил)-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-імідазолідин-11.2.2(1) іл]-2-фторбензамід 1.2.2(1), Кi = 115.9 nM, який поділяють на енантіомери за допомогою рідинної хроматографії високого тиску на Chiralpak HD-H 25 × 1 см (Chiral Technologies Inc., USA). Як елюент використовують суміш 80 % н-гексану, 20 % 2-пропанолу та 0.02 % триетиламіну. Швидкість потоку 4 мл/хв. Одержують оптично чисті ізомери (R)-1.2.2(1) і (S)(R)-1.2.2(1) (S)-1.2.2(1) + 1 1.2.2(1), Кi = 53.3 nM, Кi = 721.5 nM. LCMS (M+H) 495. H ЯМР (CDCl3, 400 МГц): 8.28 (т, J=8.4 Гц, 1H), 7.99 (д, J=8.0 Гц, 1H), 7.92 (с, 1H), 7.80 (д, J=8.0 Гц, 1H), 7.29 (дд, J1=8.8 Гц, J2=1.2 Гц, 1H), 7.21 (дд, J1=11.6 Гц, J2=1.2 Гц, 1H), 6.72 (к, J=4.4 Гц, 1H), 3.71 (д, J=10.0 Гц, 1H), 3.43 (с, 3H), 3.35 (д, J=10.0 Гц, 1H), 3.09 (д, J=4.4 Гц, 3H), 1.52 (с, 3H); N-метил-4-{5-[(бензилокси)метил]-5-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4+ 1 ціанофеніл]імідазолідин-1-іл}-2-фторбензамід 1.2.2(2). LCMS (M+H) 571. H ЯМР (CDCl3, 400 МГц): 8.22 (т, J=8.4 Гц, 1H), 7.96 (д, J=8.0 Гц, 1H), 7.86 (с, 1H), 7.70 (дд, J 1=8.0 Гц, J2=1.2 Гц, 1H), 7.39 (м, 3H), 7.29 (м, 2H), 7.25 (дд, J1=8.4 Гц, J2=1.6 Гц, 1H), 7.18 (дд, J1=8.4 Гц, J2=1.6 Гц, 1H), 6.71 (к, J=4.8 Гц, 1H), 4.59 (м, 2H), 3.79 (д, J=10.2 Гц, 1H), 3.45 (д, J=10.2 Гц, 1H), 3.08 (д, J=4.8 Гц, 3H), 1.51 (с, 3H); етил {4-метил-3-(4-метилкарбамоїл-3-фторфеніл)-5-оксо-2-тіоксо-1-[3-(трифторметил)-4+ ціанофеніл]імідазолідин-4-іл}ацетат 1.2.2(4) (R1=CH3, R4=CH3, R5=CH2COOC2H5). LCMS (M+H) 1 536. H ЯМР (CDCl3, 400 МГц): 8.26 (т, J=8.4 Гц, 1H), 8.01 (д, J=8.0 Гц, 1H), 8.00 (с, 1H), 7.90 (дд, J1=8.0 Гц, J2=1.6 Гц, 1H), 7.18 (дд, J1=8.0 Гц, J2=1.6 Гц, 1H), 7.10 (дд, J1=8.0 Гц, J2=1.6 Гц, 1H), 6.78 (к, J=4.8 Гц, 1H), 4.26 (м, 1H), 3.13 (д, J=18.0 Гц, 1H), 3.09 (д, J=4.8 Гц, 3H), 2.64 (д, J=18.0 Гц, 1H), 1.67 (с, 3H), 1.31 (т, J=7.0 Гц, 3H); N-метил-4-{4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-7-окса-1,3-діазаспіро[4.4]нон1.2.3(1) + 1 1-іл}-2-фторбензамід 1.2.3(1), Кi = 33.9 nM. LCMS (M+H) 493. H ЯМР (CDCl3, 400 МГц): 8.30 (т, J=8.4 Гц, 1H), 8.02 (д, J=8.4 Гц, 1H), 7.98 (д, J=1.6 Гц, 1H), 7.85 (дд, J 1=8.4 Гц, J2=1.6 Гц, 1H), 7.34 (дд, J1=8.4 Гц, J2=1.6 Гц, 1H), 7.25 (дд, J1=11.8 Гц, J2=1.6 Гц, 1H), 6.78 (к, J=4.4 Гц, 1H), 4.43 (д, J=10.0 Гц, 1H), 4.16 (д, J=10.0 Гц, 1H), 3.96 (м, 1H), 3.75 (м, 1H), 3.09 (д, J=4.4 Гц, 3H), 2.74 (м, 1H), 2.48 (м, 1H); N-метил-4-{4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-8-окса-1,3-діазаспіро[4.5]дец+ 1 1-іл}-2-фторбензамід 1.2.3(2). LCMS (M+H) 507. H ЯМР (CDCl3, 400 МГц): 8.32 (т, J=8.4 Гц, 1H), 8.01 (д, J=8.0 Гц, 1H), 7.95 (с, 1H), 7.83 (д, J=8.0 Гц, 1H), 7.20 (д, J=8.4 Гц, 1H), 7.10 (д, J=8.0 Гц, 1H), 6.73 (уш. м, 1H), 4.18 (м, 2H), 3.94 (м, 2H), 3.09 (д, J=4.4 Гц, 3H), 2.07 (м, 4H); N-метил-4-{8-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-1,3,81.2.3(3) + триазаспіро[4.5]дец-1-іл}-2-фторбензамід 1.2.3(3). Кi = 39.2 nM, IC50=170 nМ. LCMS (M+H) 1 520. H ЯМР (ДМСО-d6, 400 МГц): 10.09 (уш. с, 1H), 8.48 (к, J=4.4 Гц, 1H), 8.43 (д, J=8.4 Гц, 1H), 8.29 (с, 1H), 8.11 (д,J=8.4 Гц, 1H), 7.84 (т, J=8.0 Гц, 1H), 7.42 (д, J=10.4 Гц, 1H), 7.30 (д, J=8.0 Гц, 1H), 3.50 (м, 4H), 2.80 (д, J=4.4 Гц, 3H), 2.78 (с, 3H), 2.72 (д, J=14.0 Гц, 1H), 2.16 (м, 2H). Такі солі сполук загальної формули 1.2.3 за даним винаходом, як гідрохлорид, гідробромид, фосфат, нітрат, перхлорат, сульфат, ацетат, можуть бути одержані добре відомими способами. Наприклад, сполуку 1.2.3(3) розчиняли в дихлорметані, до якого додавали насичений розчин HCl у диоксані. Осад N-метил-4-{8-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]1,3,8-триазаспіро[4.5]дец-1-іл}-2-фторбензаміда гідрорхлориду 1.2.3(3)*HCl, що випав, + промивають у диоксані, упарюють і сушать. LCMS (M+H) 520. Приклад 4. Синтез N-метил-4-[5-(гідроксиметил)-5-метил-4-оксо-2-тіоксо-3-[3(трифторметил)-4-ціанофеніл]імідазолідин-1-іл]-2-фторбензаміду 1.2.2(3). До розчину 55 мг (0.11 ммоль) N-метил-4-[5-метил-5-(метоксиметил)-4-оксо-2-тіоксо-3-[3-(трифторметил)-4ціанофеніл]імідазолідин-1-іл]-2-фторбензаміду в 1.5 мл CH2Cl2 під аргоном при -78 °C по краплям додають 53 мкл (0.55 ммоль) BBr3. Реакційну масу перемішують 3 години при -78 ºС і далі ще 3 години при кімнатній температурі. Після закінчення реакції надлишок BBr 3 нейтралізують додаванням 10 мл 5 % розчину карбоната натрію, продукт екстрагують AcOEt, сушать над Na2SO4, упарюють у вакуумі та методом HPLC виділяють N-метил-4-[5(гідроксиметил)-5-метил-4-оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]імідазолідин-1-іл]-21.2.2(3) 1 фторбензамід 1.2.2(3), Кi = 46.3 nM, H ЯМР (ДМСО-d6, 400 МГц): 8.43 (уш. м, 1H), 8.39 (д, J=8.4 Гц, 1H), 8.13 (с, 1H), 7.98 (д, J=8.4 Гц, 1H), 7.78 (т, J=8.0 Гц, 1H), 7.42 (д, J=10.8 Гц, 1H), 7.37 (д, J=8.0 Гц, 1H), 5.93 (т, J=4.4 Гц, 1H), 3.81 (дд, J 1=11.6 Гц, J2=4.4 Гц, 1H), 3.45 (дд, J1=11.6 Гц, J2=5.0 Гц, 1H), 2.79 (д, J=4.0 Гц, 3H), 1.38 (с, 3H). Приклад 5. Синтез {4-метил-3-(4-метилкарбамоїл-3-фторфеніл)-5-оксо-2-тіоксо-1-[3(трифторметил)-4-ціанофеніл]імідазолідин-4-іл}оцтової кислоти 1.2.2(5) (R1=CH3, R4=CH3, R5=CH2COOH). До розчину 46 мг (0.086 ммоль) ефіру 1.2.2(4) та 2 мл спирту додають розчин 7 мг (0.172 ммоль) NaOH у 0. 5 мл води, реакційну масу перемішують 12 год. (LCMS контроль). Розчин упарюють, додають 2 мл ізопропанолу та 15 мкл (0.172 ммоль) HCl, фільтрують і знову 10 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 упарюють у вакуумі. {4-Метил-3-(4-метилкарбамоїл-3-фторфеніл)-5-оксо-2-тіоксо-1-[3(трифторметил)-4-ціанофеніл]імідазолідин-4-іл}оцтову кислоту 1.2.2(5) виділяють методом + 1 HPLC. LCMS (M+H) 469. H ЯМР (ДМСО-d6, 400 МГц): 13.31 (уш. с, 1H), 8.44 (м, 2H), 8.10 (с, 1H), 7.95 (д, J=7.6 Гц, 1H), 7.81 (т, J=8.0 Гц, 1H), 7.25 (д, J=10.8 Гц, 1H), 7.19 (д, J=8.0 Гц, 1H), 3.16 (д, J=17.6 Гц, 1H), 2.79 (д, J=3.6 Гц, 3H), 2.70 (д, J=17.6 Гц, 1H), 1.59 (с, 3H). Приклад 6. Синтез 4-[3-[3-(трифторметил)-4-ціанофеніл]-2-оксо-тетрагідро-піримідин-1(2H)іл]-N-метил-2-фторбензаміду 1.3.1. До розчину 100 мг (0.26 ммоль) 4-[4-ціано-3-(трифторметил)фенілкарбамоїламіно]-N-метил-2-фторбензаміду 2 у 2 мл ДМФА додають 109 мг (0.79 ммоль) K2CO3 і 32 мкл (0.32 ммоль) 1,3-дибромпропану. Суміш перемішують при 90 °C. Через 18 год. додають ще 109 мг K2CO3 і 32 мкл 1,3-дибромпропану і продовжують перемішування при тій же температурі. Додавання повторюють ще 2 рази. Після закінчення реакції суміш упарюють у вакуумі, залишок розчиняють у хлороформі, промивають водою, сушать над Na 2SO4, розчинник відганяють. Продукт виділяють методом колонкової хроматографії на SiO 2 (елюент – AcOEt). + 1 LCMS (M+H) 421. H ЯМР (ДМСО-d6, 400 МГц): 8.17 (уш. м, 1H), 8.13 (д, J=8.4 Гц, 1H), 8.07 (д, J=2.0 Гц, 1H), 7.83 (дд, J1=8.4 Гц, J2=2.0 Гц, 1H), 7.62 (т, J=8.4 Гц, 1H), 7.38 (дд, J 1=12.4 Гц, J2=2.0 Гц, 1H), 7.29 (дд, J1=8.4 Гц, J2=2.0 Гц, 1H), 3.90 (т, J=5.8 Гц, 2H), 3.81 (т, J=5.8 Гц, 2H), 2.77 (д, J=4.8 Гц, 3H), 2.21 (м, 2H). Приклад 7. Синтез N-метил-4-{[3-(трифторметил)-4-ціанофеніл]-2,4діоксотетрагідропіримідин-1(2H)-іл}бензаміду 1.3.2(1), (Х=О, R1=CH3). До розчину 9 г (53.6 ммоль) 4-аміно-N-метил-2-фторбензаміду в 90 мл ДМСО додають 8 г (80 ммоль) етилакрилату та 0.81 г (5.4 ммоль) DBU і перемішують 24 год. при 70 °C (LCMS контроль). Реакційну масу піддають ліофілізації, залишок перекристалізовують з водного спирту. Одержують етил N-[4+ 1 (метилкарбамоїл)-3-фторфеніл]-β-аланінат 5. LCMS (M+H) 269. H ЯМР (ДМСО-d6, 400 МГц) δ 7.57 (уш. с, 1Н), 7.48 (т, J=8.8 Гц, 1Н), 6.47 (уш. с, 1Н), 6.42 (д, J=8.8 Гц, 1Н), 6.33 (д, J=14.8 Гц, 1Н), 4.07 (к, J=7.2 Гц, 2Н), 3.32 (уш. м, 2Н), 2.73 (д, J=4.4 Гц, 3Н), 2.55 (т, J=6.4 Гц, 2Н), 1.18 (т, J=7.2 Гц, 3Н). Розчин 425 мг (1.87 ммоль) 4-ізоціанато-2-(трифторметил)бензонітрилу 3.1 і 500 мг (1.87 ммоль) етил N-[4-(метилкарбамоїл)-3-фторфеніл]-β-аланінату 5 (R1=CH3) в 10 мл CH2Cl2 перемішують 15 ч. Реакційну масу упарюють у вакуумі та продукт виділяють методом колонкової хроматографії на SiO2 (елюент – гексан: AcOEt: Et3N=1:1:0.03). Одержують етил N[4-(метилкарбамоїл)-3-фторфеніл]-N-{[3-(трифторметил)-4-ціанофеніл]-карбамоїл}-β-аланінат + 6(1) (R1=CH3, X=O). LCMS (M+H) 481. До розчину 500 мг (1.04 ммоль) етил N-[4(метилкарбамоїл)-3-фторфеніл]-N-{[3-(трифторметил)-4-ціанофеніл]-карбамоїл}-β-аланінату 6(1) в 5 мл AcOH додають 2.5 мл HCl і перемішують 15 год. Реакційну масу виливають у воду, продукт екстрагують EtOAc. Органічний шар сушать над Na2SO4, упарюють у вакуумі та методом колонкової хроматографії на SiO2 (елюент – гексан: AcOEt=1:1) виділяють N-метил-4{[3-(трифторметил)-4-ціанофеніл]-2,4-діоксо-тетрагідропіримідин-1(2H)-іл}бензамід 1.3.2, (Х=О, 1.3.2(1) + 1 R1=CH3); Кi = 85.6 nM, LCMS (M+H) 435. H ЯМР (ДМСО-d6, 400 МГц) δ 8.29 (д, J=7.6 Гц, 1H), 8.23 (уш. м, 1H), 8.11 (с, 1H), 7.89 (д, J=2.0 Гц, 1H), 7.67 (т, J=8.4 Гц, 1H), 7.39 (д, J=12.4 Гц, 1H), 7.33 (д, J=8.4 Гц, 1H), 4.02 (т, J=6.4 Гц, 2H), 3.03 (т, J=6.4 Гц, 2H), 2.77 (д, J=4.4 Гц, 3H). Приклад 8. Синтез N-метил-4-{[3-(трифторметил)-4-ціанофеніл]-4-оксо-2тіоксотетрагідропіримідин-1(2H)-іл}бензаміду 1.3.2(2), (Х=S, R1=CH 3). Розчин 320 мг (1.51 ммоль) 4-ізотіоціанато-2-(трифторметил)бензонітрилу 3.2 і 404 мг (1.51 ммоль) етил N-[4(метилкарбамоїл)-3-фторфеніл]-β-аланінату 5 (R1=CH3) в 8 мл ДМФА нагрівають у мікрохвильовій печі при 60 °C протягом 8 год. Реакційну масу упарюють у вакуумі і колонковою хроматографією на SiO2 (елюент – гексан: AcOEt=1:2) виділяють етил N-[4-(метилкарбамоїл)-3фторфеніл]-N-{[3-(трифторметил)-4-ціанофеніл]тіокарбамоїл}-β-аланінат 6(2) (R1=CH3, X=S). + LCMS (M+H) 497. До розчину 200 мг (0.4 ммоль) ефіру 6(2) у 1 мл спирту додають розчин 32 мг (0.8 ммоль) NaOH у 0.25 мл води й одержану суміш перемішують при 80 °C протягом 2 год. (LCMS контроль), охолоджують, нейтралізують 69 мкл (0.8 ммоль) HCl, упарюють у вакуумі, залишок екстрагують гарячим ізопропанолом і знов упарюють у вакуумі. Одержують N-[4(метилкарбамоїл)-3-фторфеніл]-N-{[3-(трифторметил)-4-ціанофеніл]тіокарбамоїл}-β-аланін 6(3) + (R1=CH3, X=S). LCMS (M+H) 469. До розчину 114 мг (0.24 ммоль) одержаної кислоти 6(3) у 1.5 мл ДМФА додають 86 мг (0.36 ммоль) TBTU і 110 мг (0.84 ммоль) диізопропілетиламіну. Реакційну суміш перемішують при 45 °C протягом 15 год. Після закінчення реакції (LCMS контроль) розчин виливають у воду та екстрагують EtOAc. Органічний шар сушать над Na 2SO4, упарюють у вакуумі та методом HPLC виділяють N-метил-4-{[3-(трифторметил)-4-ціанофеніл]-41.3.2(2) оксо-2-тіоксотетрагідропіримідин-1(2H)-іл}-2-фторбензамід 1.3.2(2) (R1=CH3, X=S); Кi = 95.2 + 1 nM. LCMS (M+H) 451. H ЯМР (ДМСО-d6, 400 МГц): 8.35 (к, J=4.4 Гц, 1H), 8.27 (д, J=8.0 Гц, 1H), 8.06 (д, J=1.6 Гц, 1H), 7.83 (дд, J1=8.0 Гц, J2=1.6 Гц, 1H), 7.71 (т, J=8.2 Гц, 1H), 7.42 (дд, J1=11.0 Гц, J2=1.8 Гц, 1H), 7.33 (дд, J1=8.2 Гц, J2=1.8 Гц, 1H), 4.13 (т, J=6.8 Гц, 2H), 3.17 (т, J=6.8 Гц, 2H), 11 UA 112161 C2 5 10 15 20 25 30 35 40 45 50 55 60 2.78 (д, J=4.4 Гц, 3H). Приклад 9. Синтез N-метил-2-фтор-4-[4-[3-(трифторметил)-4-ціанофеніл]-3,5-діоксо-1,2,4триазолідин-1-іл]бензаміду 1.4 (R1=CH3). До розчину 1 г (5.95 ммоль) 4-аміно-N-метил-2фторбензаміду в 3.1 мл 5N HCl додають по краплям 2.38 мл 2.5М розчина NaNO 2, підтримуючи температуру суміші 100 мг/кг. При введенні сполуки MDV3100 у дозах 10 і 30 мг/кг загибель мишей не спостерігалася. В групі мишей, що отримували досліджувану речовину в дозі 100 мг/кг, на 3-й день маса тіла почала знижуватися. На 5-й день маса тіла у тварин з цієї групи статистично значно відрізнялася від маси тіла тварин з групи Плацебо (p=0,002, фіг. 2). Загинула одна тварина. Ці дані свідчать про те, що сполука MDV3100 має МТD ~ 30 мг/кг. Приклад 12. Одержання лікарського засобу у формі таблеток. Змішують 1600 мг крохмалю, 1600 мг подрібненої лактози, 400 мг тальку і 1000 мг N-метил-4-[5-метил-5-(метоксиметил)-4оксо-2-тіоксо-3-[3-(трифторметил)-4-ціанофеніл]-імідазолідин-1-іл]-2-фторбензаміду (R)-1.2.2(1). Одержану фармацевтичну композицію спресовують у брусок. Одержаний брусок подрібнюють у гранули і просіюють через сита, збираючи гранули розміром 14-16 меш. Одержані гранули таблетують у відповідну форму таблетки вагою 560 мг кожна. Відповідно до винаходу аналогічним чином одержують лікарські засоби, що містять інші сполуки загальної формули 1. Приклад 13. Одержання лікарського засобу у формі капсул. Ретельно змішують N-метил-4[5-метил-5-метилоксиметил-3-(3-трифторметил-4-ціанофеніл)-4-оксо-2-тіоксо-імідазолідин-1-іл]2-фтор-бензамід (R)-1.2.2(1) з порошком лактози у співвідношенні 2:1. Одержану фармацевтичну композицію упаковують по 300 мг у желатинові капсули придатного розміру. Приклад 14. Одержання лікарського засобу у формі ін'єкційних композицій для внутрішньом'язових, внутрішньочеревних або підшкірних ін'єкцій. Змішують 500 мг N-метил-4-[5метил-5-метилоксиметил-3-(3-трифторметил-4-ціанофеніл)-4-оксо-2-тіоксо-імідазолідин-1-іл]-2фтор-бензамід (R)-1.2.2(1) з 300 мг хлорбутанолу, 2 мл пропіленгліколю та 100 мл ін'єкційної води. Одержаний розчин фільтрують і розміщують по 1 мл в ампули, які запаюють. Промислова придатність Винахід може бути використано в медицині, ветеринарії, біохімії. ФОРМУЛА ВИНАХОДУ 45 1. Циклічні N,N'-діарилтіосечовини і N,N'-діарилсечовини загальної формули 1 або їх оптичні (R)- і (S)-ізомери, або їх фармацевтично прийнятна сіль, що мають властивість антагоністів андрогенових рецепторів, N CF3 CONHR1 X R2 N N R3 m R4 F R5 1 50 , де: X є атом кисню або сірки; 13 UA 112161 C2 5 10 m=0 або 1; R1 є С1-С3алкіл; R2 і R3 є водень; або R2 і R3 разом з атомом вуглецю, з яким вони зв'язані, утворюють групу С=О; R4 і R5 є водень; або R4 є водень, a R5 є метил; або R4 є метил, R5 є CH2R6-група, де R6 є С1-С3алкоксикарбонілом, карбоксилом, гідроксильною групою, метоксигрупою або бензилоксигрупою, або R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, утворюють п'яти- або шестичленний насичений гетероцикл, що містить принаймні один атом кисню або азоту, який може бути заміщений метилом, або R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, є групою NH. 2. Сполука за п. 1 або її оптичні (R)- і (S)-ізомери, або її фармацевтично прийнятна сіль, що вибрана з групи яка включає сполуки формули 1.2, 1.3 та 1.4: CF3 S NC CONHR1 N N F O R4 R5 1.2 15 , CF3 NC CONHR1 X R2 N N R3 R4 F R5 1.3 , CF3 O NC N CONHR1 N N H O F 1.4 20 , де: X, R1, R2, R3, R4 і R5 мають значення, вказані в п. 1. 3. Сполука за п. 2, що вибрана з групи, яка включає сполуки формули 1.2(1), 1.2(2), 1.2.2 та 1.2.3, її оптичні (R)-ізомери - (R)-1.2(2), (R)-1.2.2, (R)-1.2.3, і (S)-ізомери - (S)-1.2(2), (S)-1.2.2 і (S)1.2.3: 14 UA 112161 C2 CF3 S NC N CONHCH3 N F O 1.2(1) , CF3 S NC N CONHCH3 N F O CH3 1.2(2) , CF3 S NC N CONHCH3 N CH3 O F R6 1.2.2 , CF3 S NC N CONHCH3 N R4 O F R5 1.2.3 , CF3 S NC N CONHCH3 N F O 5 H CH3 (R)-1.2(2) , 15 UA 112161 C2 CF3 S NC N CONHCH3 N CH3 O F R6 (R)-1.2.2 , CF3 S NC N CONHCH3 N R4 O F R5 (R)-1.2.3 , CF3 S NC N CONHCH3 N F O CH3 H (S)-1.2(2) , CF3 S NC N CONHCH3 N CH3 O F R6 (S)-1.2.2 , CF3 S NC N CONHCH3 N R4 O 5 10 F R5 (S)-1.2.3 , де: R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, утворюють п'яти- або шестичленний насичений гетероцикл, що містить принаймні один атом кисню або азоту, який може бути заміщений метилом, R6 має значення, вказане в п. 1. 4. Сполука за п. 3, що вибрана з групи, яка включає сполуки формули 1.2.2(1), 1.2.2(2), 1.2.2(3), 1.2.3(1), 1.2.3(2) і 1.2.3(3), її оптичні (R)-ізомери - (R)-1.2.2(1), (R)-1.2.2(2), (R)-1.2.2(3), (R)1.2.3(1), і (S)-ізомери - (S)-1.2.2(1), (S)-1.2.2(2), (S)-1.2.2(3), (S)-1.2.3(1), 16 UA 112161 C2 CF3 S NC N CONHCH3 N CH3 O F R6 1.2.2(1): R6=OCH3; 1.2.2(2): R6=OCH2Ph; 1.2.2(3): R6=OH; CF3 S NC N CONHCH3 N CH3 O F R6 (R)-1.2.2(1): R6=OCH3; (R)-1.2.2(2): R6=OCH2Ph; (R)-1.2.2(3): R6=OH; CF3 S NC N CONHCH3 N CH3 O F R6 (S)-1.2.2(1): R6=OCH3; (S)-1.2.2(2): R6=OCH2Ph; (S)-1.2.2(3): R6=OH; CF3 S NC N CONHCH3 N F O O 1.2.3(1) , 17 UA 112161 C2 CF3 S NC N CONHCH3 N F O O (R)-1.2.3(1) , CF3 S NC N CONHCH3 N F O O (S)-1.2.3(1) , CF3 S NC N CONHCH3 N F O O 1.2.3(2) , CF3 S NC N CONHCH3 N F O N CH3 1.2.3(3) 5 10 , де R6 є гідроксильною групою, метоксигрупою або бензилоксигрупою. 5. Протираковий засіб, що містить принаймні одну сполуку загальної формули 1 за будь-яким з пунктів 1-4, що має властивість антагоніста андрогенових рецепторів. 6. Фармацевтична композиція для лікування ракового захворювання, що містить як активний компонент протираковий засіб за п. 6 та інертний наповнювач або розчинник. 7. Фармацевтична композиція за п. 6 у формі таблеток, капсул або ін'єкцій. 8. Фармацевтична композиція за п. 6, що призначена для лікування раку простати. 9. Спосіб лікування ракового захворювання, у тому числі раку простати, у суб'єкта, що цього потребує, шляхом введення протиракового засобу за п. 5 або фармацевтичної композиції за будь-яким з пунктів 6-8. 18 UA 112161 C2 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
Назва патенту англійськоюЦиклические n ,n '-диарилтиомочевины и n ,n '-диарилмочевины - антагонисты андрогеновых рецепторов, противораковое средство, способ получения и применения
Автори англійськоюMitkin, Oleg Dmitrievich, Ivachtchenko, Alexandre Vasilievich
Автори російськоюМитькин Олег Дмитриевич, Иващенко Александр Васильевич
МПК / Мітки
МПК: C07D 491/107, C07D 239/22, A61K 9/08, A61K 31/4196, A61K 9/48, C07D 471/10, A61K 31/4166, C07D 239/10, A61K 31/4188, C07D 233/86, A61K 31/513, C07D 233/72, A61K 31/527, C07D 249/12, A61K 9/20
Мітки: n,n'-діарилтіосечовини, протираковій, спосіб, андрогенових, антагоністи, застосування, засіб, циклічні, n,n'-діарилсечовини, рецепторів
Код посилання
<a href="https://ua.patents.su/21-112161-ciklichni-nn-diariltiosechovini-ta-nn-diarilsechovini-antagonisti-androgenovikh-receptoriv-protirakovijj-zasib-sposib-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Циклічні n,n’-діарилтіосечовини та n,n’-діарилсечовини – антагоністи андрогенових рецепторів, протираковий засіб, спосіб застосування</a>
Попередній патент: Сполуки піразолу як інгібітори сигма-рецепторів
Наступний патент: Соєві адгезиви та композити, отримані з адгезивів
Випадковий патент: Емульсор