Сполуки піразолу як інгібітори сигма-рецепторів
Номер патенту: 112160
Опубліковано: 10.08.2016
Автори: Діас Фернандес Хосе Луїс, Кааманьо Моуре Ана Марія, Гарсія Лопес Моніка, Торренс Ховер Антоні
Формула / Реферат
1. Сполука загальної формули (І):
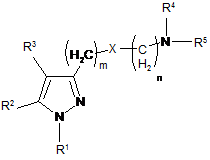 , (I)
, (I)
де
R1 являє собою заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений арил або заміщений або незаміщений циклоалкіл;
R2 являє собою атом водню; F; Сl; Br; I; CF3; OH; SH; CN; заміщений або незаміщений метил; заміщений або незаміщений алкеніл; заміщений або незаміщений алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений, неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або незаміщений, ароматичний або неароматичний гетероциклілалкіл; групу (C=O)-R7; групу (C=O)-O-R8; групу S(O)t-R9 або групу (C=O)-NR10R11;
R3 являє собою атом водню; F; Сl; Br; I; CF3; OH; SH; NH2; CN; заміщений або незаміщений алкіл; заміщений або незаміщений алкеніл; заміщений або незаміщений алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений арил; заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або незаміщений, ароматичний або неароматичний гетероциклілалкіл; групу (C=O)-R7; групу (C=O)-O-R8; групу S(O)t-R9 або групу (C=O)-NR10R11;
R4 і R5 разом з атомом азоту, до якого вони приєднані, утворюють заміщену або незаміщену, ароматичну або неароматичну гетероциклільну групу;
X являє собою атом кисню або групу CH-R12, де R12 вибраний з Н, СН3, SH, OH, NH2, CF3, Cl, F, Br, І і CN;
m вибраний з 1, 2, 3 і 4;
n вибраний з 1, 2, 3 і 4;
t вибраний з 1, 2 і 3;
R7, R8, R9, R10 і R11, однакові або різні, являють собою атом водню; заміщений або незаміщений С1-6алкіл; заміщений або незаміщений С2-6алкеніл; заміщений або незаміщений С1-6алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений арил; заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або незаміщений, ароматичний або неароматичний гетероциклілалкіл;
або її фармацевтично прийнятна сіль, ізомер або сольват;
де заміщення в кожній конкретній заміщеній групі представляє заміщення по одному або більше доступних положеннях однією або більше групами, вибраними з водню, ціано, гідроксилу, нітро, азидо, ацилу, карбоксаміду, алкілу, алкенілу, алкінілу, алкоксигруп, що мають один або більше кисневих зв'язків і від 1 до 12 атомів вуглецю, арилокси, алкілтіо, алкілсульфінілу, алкілсульфонілу, аміноалкілу і карбоциклічного арилу, що містить 6 або більше атомів вуглецю.
2. Сполука за п. 1, де R1 вибраний з 5-10-членної заміщеної або незаміщеної, ароматичної або неароматичної гетероциклільної групи, яка переважно містить N, О або S як член кільця; 5-10-членної заміщеної або незаміщеної арильної групи і 5-10-членної заміщеної або незаміщеної циклоалкільної групи, де заміщення в будь-якій заміщеній групі є таким, як визначено в п. 1.
3. Сполука за п. 2, де R1 вибраний із заміщеного або незаміщеного циклопентилу, заміщеного або незаміщеного циклогексилу, заміщеного або незаміщеного фенілу, заміщеного або незаміщеного нафтилу, заміщеного або незаміщеного тіофену, заміщеного або незаміщеного бензотіофену, заміщеного або незаміщеного бензофурану, заміщеного або незаміщеного піридину і заміщеного або незаміщеного хіноліну, де заміщення в будь-якій заміщеній групі є таким, як визначено в п. 1.
4. Сполука за п. 3, де R1 вибраний з групи, яка складається з: 2-тієнілу, 3-тієнілу, 2,5-дихлор-3-тієнілу, 2,3-дихлор-5-тієнілу, 2,3-дихлор-4-тієнілу, 2-бензотієнілу, 3-бензотієнілу, 4-бензотієнілу, 5-бензотієнілу, 7-бензотієнілу, 2-бензофурілу, 5-бензофурилу, 2-піридилу, 3-піридилу, 4-піридилу, 2-хінолілу, 3-хінолілу, 5-хінолілу, 6-хінолілу, 3,4-дифторфенілу, 3,4-дихлорфенілу, циклопентилу, циклогексилу, 7-гідрокси-2-нафтилу, 6-гідрокси-2-нафтилу, 5-гідрокси-2-нафтилу, 6-фтор-2-нафтилу, 6-метокси-2-нафтилу, 6-бром-2-нафтилу, 6-гідроксиметил-2-нафтилу, 6-фторметил-2-нафтилу, 7-гідрокси-1-нафтилу, 6-гідрокси-1-нафтилу, 5-гідрокси-1-нафтилу, 5-фтор-1-нафтилу, 5-бром-1-нафтилу і 1-нафтилу.
5. Сполука за будь-яким з попередніх пунктів, де R2 вибраний з Н і заміщеного або незаміщеного метилу, R3 вибраний з Н і заміщеної або незаміщеної С1-6алкільної групи, переважно метилу, де заміщення в будь-якій заміщеній групі є таким, як визначено в п. 1.
6. Сполука за п. 5, де R2 являє собою метил і R3 являє собою Н, або R2 і R3 одночасно являють собою Н або метил.
7. Сполука за п. 1, де R4 і R5, взяті разом, утворюють морфолін-4-ільну групу, піперидинову групу, піролідинову групу або піперазин-4-ільну групу.
8. Сполука за будь-яким з попередніх пунктів, де кожен m і n незалежно являє собою 1 або 2.
9. Сполука за будь-яким з попередніх пунктів, вибрана з групи, яка складається з:
4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(2-((5-метил-1-(нафталін-2-іл)-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(3-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)пропіл)морфоліну,
4-(3-(5-метил-1-(нафталін-2-іл)-1H-піразол-3-іл)пропіл)морфоліну,
4-(2-(2-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)етоксі)етил)морфоліну,
4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(3-(1-циклогексил-5-метил-1H-піразол-3-іл)пропіл)морфоліну,
1-(3,4-дихлорфеніл)-5-метил-3-((2-(піролідин-1-іл)етокси)метил)-1H-піразолу,
1-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)піперидину,
1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
(2S,6R)-4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)-2,6-диметилморфоліну,
4-(2-((5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(4-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)бутил)морфоліну,
4-(3-(5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)пропіл)морфоліну,
4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(2-((1-(3,4-дихлорфеніл)-4,5-диметил-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(3-(1-(хінолін-3-іл)-1H-піразол-3-іл)пропіл)морфоліну,
4-(4-(1-(3,4-дихлорфеніл)-1H-піразол-3-іл)бутил)морфоліну,
4-(4-(5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)бутил)морфоліну,
4-(3-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)пропіл)морфоліну,
4-(2-((1-циклопентил-5-метил-1H-піразол-3-іл)метоксі)етил)морфоліну,
гідрохлориду 1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
гідрохлориду (3S,5R)-1-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метоксі)етил)-3,5-диметилпіперазину,
гідрохлориду 4-(2-(2-(1-циклогексил-5-метил-1H-піразол-3-іл)етоксі)етил)морфоліну,
гідрохлориду 4-(2-((1-циклогексил-1H-піразол-3-іл)метоксі)етил)морфоліну,
гідрохлориду 4-(2-((1-циклогексил-4,5-диметил-1H-піразол-3-іл)метоксі)етил)морфоліну,
1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
1-(4-(3-((1-циклогексил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(4-((1-циклогексил-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанону,
1-(4-(4-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанону,
1-(4-(3-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
1-(4-(3-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(4-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанону,
1-(4-(3-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(3-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(3-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанону,
1-(4-(2-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
1-(4-(2-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)етанону,
4-(2-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(2-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метоксі)етил)морфоліну,
4-(3-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)морфоліну,
1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)пропан-1-ону,
1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)-2-метилпропан-1-ону,
1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)пропан-1-ону,
1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)-2-метилпропан-1-ону,
1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)пропан-1-ону,
1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)-2-метилпропан-1-ону,
1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)пропан-1-ону,
1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метоксі)етил)піперазин-1-іл)-2-метилпропан-1-ону
або її фармацевтично прийнятної солі або сольвату.
10. Спосіб отримання сполуки формули (І), як визначено в будь-якому з пп. 1-9, або її солі, ізомеру або сольвату, який включає взаємодію сполуки формули (II):
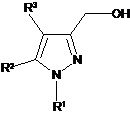 , (II)
, (II)
де R1, R2 і R3 є такими, як визначено в п. 1, зі сполукою формули (III):
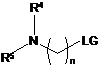 , (III)
, (III)
де R4, R5 і n є такими, як визначено в п. 1, і LG являє собою групу, яка видаляється.
11. Спосіб отримання сполуки формули (І), як визначено в будь-якому з пп. 1-9, або її солі, ізомеру або сольвату, який включає окислення сполуки формули (II), як визначено в п. 10, з отриманням сполуки формули (VII):
 , (VII)
, (VII)
де R1, R2 і R3 є такими, як визначено в п. 1, з подальшою взаємодією сполуки формули (VII) з фосфонієвою сіллю формули (VIII):
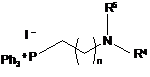 , (VIII)
, (VIII)
де R4, R5 і n є такими, як визначено в п. 1, з отриманням сполуки формули (IX):
 , (IX)
, (IX)
де R1, R2, R3, R4, R5 і n є такими, як визначено в п. 1, і відновлення сполуки формули (IX).
12. Спосіб отримання сполуки формули (І), як визначено в будь-якому з пп. 1-9, або її солі, ізомеру або сольвату, який включає окислення сполуки формули (II), як визначено в п. 10, з отриманням сполуки формули (VII):
 , (VII)
, (VII)
де R1, R2, R3 є такими, як визначено в п. 1, з подальшою взаємодією сполуки формули (VII) з прийнятною фосфонієвою сіллю і подальшим кислотним гідролізом з отриманням сполуки формули (XI):
 , (XI)
, (XI)
де R1, R2, R3 і m є такими, як визначено в п. 1, відновлення сполуки формули (XI) і подальшу взаємодію зі сполукою формули (III):
 , (III)
, (III)
де R4, R5 і n є такими, як визначено в п. 1, і LG являє собою групу, яка видаляється.
13. Спосіб отримання сполуки формули (І), як визначено в будь-якому з пп. 1-9, або її солі, ізомеру або сольвату, який включає взаємодію 3-ацетил-6-метилпіран-2,4-діону з магнієм і подальшу взаємодію зі сполукою формули (V):
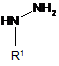 , (V)
, (V)
де R1 є таким, як визначено в п. 1, з отриманням сполуки формули (XV):
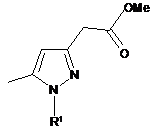 , (XV)
, (XV)
де R1 є таким, як визначено в п. 1, і відновлення сполуки формули (XV) і подальшу взаємодію зі сполукою формули (III):
 , (III)
, (III)
де R4, R5 і n є такими, як визначено в п. 1, і LG являє собою групу, яка видаляється.
14. Спосіб отримання сполуки формули (І), як визначено в будь-якому з пп. 1-9, або її солі, ізомеру або сольвату, який включає окислення сполуки формули (II), як визначено в п. 10, з отриманням сполуки формули (VII):
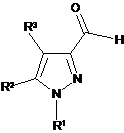 , (VII)
, (VII)
де R1, R2, R3 є такими, як визначено в п. 1, з подальшою взаємодією сполуки формули (VII) з фосфонієвою сіллю формули (XVII):
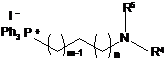 , (XVII)
, (XVII)
де R4, R5, m і n є такими, як визначено в п. 1, з отриманням сполуки формули (XVIII):
 , (XVIII)
, (XVIII)
де R1, R2, R3, R4, R5, m і n є такими, як визначено в п. 1, і відновлення сполуки формули (XVIII).
15. Лікарський засіб, який містить щонайменше одну сполуку формули (І), як визначено в будь-якому з пп. 1-9, або її фармацевтично прийнятну сіль, ізомер або сольват і фармацевтично прийнятний ексципієнт.
16. Застосування сполуки формули (І), як визначено в будь-якому з пп. 1-9, при виробництві лікарського засобу.
17. Застосування за п. 16, де лікарський засіб призначений для лікування і/або профілактики захворювання або стану, опосередкованого сигма-рецептором.
18. Застосування за п. 17, де захворювання включає діарею; ліпопротеїнові порушення; мігрень; ожиріння; підвищені рівні тригліцеридів; хіломікронемію; дисбеталіпопротеїнемію; гіперліпопротеїнемію; гіперліпідемію; змішану гіперліпідемію; гіперхолестеринемію; ліпопротеїнові порушення; гіпертригліцеридемію; спорадичну гіпертригліцеридемію; спадкову гіпертригліцеридемію; артрит; гіпертензію; аритмію; виразки; дефіцит навчання, пам'яті і уваги; когнітивні розлади; нейродегенеративні захворювання; демієлінізуючі захворювання; залежність від наркотиків і хімічних речовин, включаючи кокаїн, амфетамін, етанол і нікотин; пізню дискінезію; ішемічний інсульт; епілепсію; удар; стрес; рак; психотичні стани, зокрема депресію, тривогу або шизофренію; запалення і аутоімунні захворювання.
19. Застосування за п. 17, де захворювання включає болі, переважно невропатичні болі, болі при запаленні або інші больові стани, включаючи алодинію і/або гіпералгезію.
Текст
Реферат: Винахід стосується сполук загальної формули (І): R4 R3 R2 H2 C X n m C H2 N R5 n N N R1 ,I які мають фармакологічну активність стосовно сигма-рецептора, способів отримання таких сполук, які мають їх фармацевтичні композиції, і їх застосування для лікування і або профілактики захворювання, в яке залучений сигма-рецептор. UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, якої стосується винахід Даний винахід стосується сполук, які мають фармакологічну активність стосовно сигма (σ) рецепторів, і, більш конкретно, деяких похідних піразолу, способів отримання таких сполук, фармацевтичних композицій які їх містять, і їх застосування в терапії і для профілактики, зокрема, для лікування або профілактики захворювання або стану, опосередкованого сигма рецепторами. Рівень техніки Пошук нових терапевтичних засобів в останні роки значно допоміг кращому розумінню структури білків і інших біомолекул, пов'язаних з цільовими захворюваннями. Одним важливим класом вказаних білків є сигма (σ) рецептори, рецептори поверхні клітин центральної нервової системи (CNS), які можуть мати відношення до дисфоричних, галюциногенних і серцевих стимулюючих ефектів опіоїдів. При дослідженні біології і функції сигма рецепторів, були представлені докази того, що ліганди сигма-рецепторів можуть бути використані при лікуванні психозів і рухових розладів, таких як дистонія і пізня дискінезія, і рухових порушень, пов'язаних з хореєю Хантінгтона або синдромом Туретта, і при хворобі Паркінсона (Walker, J.M. et al, Pharmacological Reviews, 1990, 42, 355). Повідомляється, що відомий ліганд сигма рецепторів рімказол (rimcazole) клінічно виявляє ефекти при лікуванні психозів (Snyder, S.H., Largent, B.L. J. Neuropsychiatry 1989, 1, 7). Сайти скріплення сигма-рецептору мають переважну афінність стосовно правообертальних ізомерів деяких опіатних бензоморфанів, таких як (+)SKF 10047, (+)циклазосин і (+)пентазоцин, а також деяких нарколептиків, таких як галоперидол. Сигма рецептор має щонайменше два підтипи, які можуть бути розпізнані за стереовибірковими ізомерами цих фармакоактивних препаратів. SKF 10047 має наномолярну афінність стосовно сигма 1 (σ-1) сайту і має мікромолярну афінність стосовно сигма (σ-2) сайту. Галоперидол має подібну афінність стосовно обох підтипів. Ендогенні сигма ліганди не є відомими, хоча передбачають, що прогестерон є одним з них. Можливі сигма-сайтопосередковані ефекти препарату включають модуляцію функції глутаматного рецептору, нейротрансмітерну відповідь, нейропротекцію, поведінку і пізнавальну здатність (Quirion, R. et al. Trends Pharmacol. Sci., 1992, 13:85-86). Більшість досліджень мають на увазі, що сайтами сигма скріплення (рецепторів) є елементи плазмалеми каскаду сигнальної трансдукції. Лікарські засоби, про які повідомлялося, що вони є селективними сигма лігандами, були оцінені як антипсихотичні препарати (Hanner, M. et al. Proc. Natl. Acad. Sci., 1996, 93:8072-8077). Існування сигма рецепторів в ЦНС, ендокринній і імунній системах, передбачає імовірність того, що вони можуть слугувати як зв'язок між трьома системами. З точки зору можливого терапевтичного застосування агоністів або антагоністів сигма рецептору, великі зусилля були направлені на пошук селективних лігандів. Таким чином, в попередньому рівні техніки описані інші ліганди сигма рецепторів. У Міжнародній патентній заявці WO 91/09594 загалом описаний широкий клас лігандів сигма рецепторів, деякі з яких являють собою похідні 4-фенілпіперидину, -тетрагідропіридину або піперазину, які мають необов'язково заміщений арил або гетероарил, алкільний, алкенільний, алкінільний, алкокси або алкоксіалкільний замісник на N-атомі кільця. Терміни арил і гетероарил визначені вказівкою числа таких замісників. У Європейській патентній заявці EP 0414289 A1 загалом описаний широкий клас похідних 1,2,3,4-тетрагідроспіро[нафталін-1,4'-піперидину] і 1,4-дигідроспіро[нафталін-1,4'-піперидину], заміщених біля N-атома піперидину вуглеводневою групою, які мають селективну активність антагоніста сигма рецептору. Термін вуглеводень, як визначено у вказаному патенті, охоплює все можливі прямоланцюжкові, циклічні, гетероциклічні і т. п. групи. Однак конкретно описані тільки сполуки, які мають бензил, фенетил, циклоалкілметил, фурил- або тієнілметил або нижчий алкіл або алкеніл як вуглеводневий замісник біля атома азоту піперидину. Вказано, що сполуки здатні замінювати тритований дитолілгуанідин (DTG) на сигма сайтах з поліпшеною ефективністю, ніж 200 нМ. 1'-бензил-1,2,3,4-тетрагідроспіро[нафталін-1,4'-піперидин] приводиться, зокрема, як переважна сполука. У Європейській патентній заявці EP 0445974 A2 загалом описані відповідні похідні спіро[індан-1,4'-піперидину] і спіро[бензоциклогептен-5,4'-піперидину]. При цьому знову вказано тільки те, що сполуки здатні замінювати тритований дитолілгуанідин (DTG) на сигма сайтах з поліпшеною ефективністю більшою ніж 200 нМ. Європейська патентна заявка EP 0431943 А стосується подальшого дуже широкого класу спіропіперидинових сполук, заміщених на N-атомі піперидину і заявлених як сполуки, які можуть бути використані як антиаритмічні засоби і при послабленій насосній функції серця. У вказаній заявці приведені в прикладах деякі сполуки, більшість з яких містять оксо і/або сульфоніламіно замісник(ки) в спіро циклічній кільцевій системі. Зі сполук, які залишилися, основна частина має 1 UA 112160 C2 5 10 15 20 25 30 35 40 інший полярний замісник, приєднаний до спіроядра, і/або у них є деякий полярний замісник на N-атомі піперидину. Не приводиться яких-небудь припущень або вказівок стосовно впливу сполук на сигма рецептор. У патентній заявці EP 518805 А і в WO 02/102387 описані ліганди сигма рецептору, які мають піперидинову або спіропіперидинову структури. З точки зору хімічної структури сполук, описаних в даній патентній заявці, в попередньому рівні техніки є декілька документів, в яких описані похідні піразолу, які характеризуються тим, що серед інших, вони заміщені аміноалкоксигрупами в різних положеннях піразольної групи. У патенті US 4337263 описані 1-арил-4-арилсульфоніл-3-амінопропокси-1H-піразоли, де аміногрупа може являти собою N-циклічну групу в морфоліновій, піперидиновій або піролідиновій групі. Вони можуть бути використані як гіполіпемічні або гіпохолестеринемічні агенти. У патенті FR 2301250 описані сполуки, подібно описаним вище, такі як 1,4-діарил-3аміноалкоксипіразоли, де аміногрупа містить похідні піролідину, піперидину, гідроксипіперидину, морфоліну або піперазину. Патентна заявка US 2003/0144309 стосується піразолу, де положення 3 піразолів заміщене диметиламіноетоксигрупою і має в положенні 4 піримідинову групу. Вони можуть використовуватися як інгібітори активності JNK3, Lck або Src кінази. У Міжнародній патентній заявці WO 02/092573 описані заміщені похідні піразолу як інгібітори SRC і інших протеїнкіназ. У Міжнародній патентній заявці WO 2004/017961 описані похідні піразолу, де положення 3 заміщене алкоксигрупою, напряму зв'язаною з циклічним амідом, які можуть використовуватися для терапевтичного лікування і/або профілактики стану, пов'язаного зі статевим гормоном у пацієнта. У патенті US 6492529 описані похідні піразолу, які можуть використовуватися при лікуванні запальних захворювань. Вказані сполуки мають в положенні 5 карбамідну групу, приєднану в деяких випадках до морфолінетоксигрупи. Міжнародна патентна заявка WO 04/016592 стосується сполук піразолу для інгібування білкового пренілювання, який містить в положенні 5, серед інших, алкоксигрупу, напряму приєднану до циклічного аміду. Однак ні в одному з вказаних документів не висловлено припущень про дію даних сполук на сигма рецептор. У WO 2006/021462 і WO 2007/098964 описані похідні піразолу як селективні інгібітори сигма рецептору. Вказані сполуки мають в положенні 3 алкоксигрупу. Тому все ще існує потреба в сполуках, які мають фармакологічну активність стосовно сигма рецептору, які є як ефективними, так і виборчими, і які мають хороші «потенційно лікарські» властивості, тобто хороші фармацевтичні властивості, які стосуються введення, розподілу, метаболізму і виведення. Короткий опис даного винаходу Автори даного винаходу несподівано виявили сімейство особливих за структурою похідних піразолу, які є, зокрема, селективними інгібіторами сигма рецептору. Сполуки, представлені піразольною групою, які характеризуються заміщенням в положенні 3 алкільним ланцюгом, який містить амін на її кінці, і, необов'язково, проміжну оксагрупу. Таким чином, в одному аспекті даний винахід стосується сполуки загальної формули (I): , 45 2 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 де 1 R являє собою заміщений або незаміщений ароматичний або неароматичний гетероцикліл; заміщений або незаміщений арил; або заміщений або незаміщений циклоалкіл; 2 3 R і R , однакові або різні, являють собою атом водню; F; Cl; Br; I; CF 3; OH; SH; NH2; CN; заміщений або незаміщений алкіл; заміщений або незаміщений алкеніл; заміщений або незаміщений алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений арил; заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або 7 незаміщений, ароматичний або неароматичний гетероциклілалкіл; групу (С=О)-R ; групу (С=О)8 9 10 11 O-R ; групу S(О)t-R або групу (С=О)-NR R ; 4 5 R і R , однакові або різні, являють собою атом водню; заміщений або незаміщений алкіл; заміщений або незаміщений алкеніл; заміщений або незаміщений алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений арил; заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або незаміщений, ароматичний або 7 8 9 неароматичний гетероциклілалкіл; групу (С=О)-R ; групу (С=О)-O-R ; групу S(О)t-R або групу 10 11 (С=О)-NR R ; або разом з атомом азоту, до якого вони приєднані, утворюють заміщену або незаміщену, ароматичну або неароматичну гетероциклільну групу; 12 12 X являє собою атом кисню або групу CH-R , де R вибраний з Н, CH3, SH, OH, NH2, CF3, Cl, F, Br, I і CN; m вибраний з 1, 2, 3 і 4; n вибраний з 1, 2, 3 і 4; t вибраний з 1, 2 і 3; 7 8 9 10 11 R , R , R , R і R , однакові або різні, являють собою атом водню; заміщений або незаміщений C1-6алкіл; заміщений або незаміщений C2-6алкеніл; заміщений або незаміщений C16алкокси; заміщений або незаміщений циклоалкіл; заміщений або незаміщений арил; заміщений або незаміщений, ароматичний або неароматичний гетероцикліл; заміщений або незаміщений циклоалкілалкіл; заміщений або незаміщений арилалкіл; заміщений або незаміщений, ароматичний або неароматичний гетероциклілалкіл; або її фармацевтично прийнятної солі, ізомеру, проліків або сольвату. У іншому аспекті даний винахід стосується способу отримання сполуки формули (I), як визначений вище, або її солі, ізомеру або сольвату. У іншому аспекті даний винахід стосується лікарського засобу або фармацевтичної композиції, яка містить щонайменше одну сполуку формули (I), як визначено вище, або її фармацевтично прийнятну сіль, ізомер, проліки або сольват і фармацевтично прийнятний ексципієнт. У іншому аспекті даний винахід стосується сполуки формули (I), як визначений вище, для застосування як лікарського засобу, зокрема, для лікування і/або профілактики захворювання або стану, опосередкованого сигма рецептором. У іншому аспекті даний винахід стосується застосування сполуки формули (I), як визначений вище, при виробництві лікарського засобу для лікування і/або профілактики захворювання або стану, опосередкованого сигма рецептором. У іншому аспекті даний винахід стосується способу лікування і/або профілактики захворювання або стану, опосередкованого сигма рецептором, що включає введення суб'єкту, який потребує такого лікування або профілактики, терапевтично ефективної кількості сполуки формули (I), як визначено вище. У одному з варіантів здійснення вказане захворювання або стан, опосередковане сигма рецептором, вибране з групи, яка складається з діареї; ліпопротеїнових розладів; мігрені; ожиріння; підвищених рівнів тригліцеридів; хіломікронемії; дисбеталіпопротеїнемії; гіперліпопротеїнемії; гіперліпідемії; змішаної гіперліпідемії; гіперхолестеринемії; ліпопротеїнових розладів; гіпертригліцеридемії; спорадичної гіпертригліцеридемії; спадкової гіпертригліцеридемії; артриту; гіпертензії; аритмії; виразки; дефіциту навчання, пам'яті і уваги; когнітивних розладів; нейродегенеративних захворювань; демієлінізуючих захворювань; пристрасті до наркотиків і хімічних речовин, включаючи кокаїн, амфетамін, етанол і нікотин; пізньої дискінезії; ішемічного інсульту; епілепсії; удару; стресу; раку; психотичних станів, зокрема, депресії, тривоги або шизофренії; запалення і аутоімунних захворювань. 3 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 У іншому варіанті здійснення вказане захворювання або стан, опосередковане сигма рецептором, вибране з групи, яка складається з болю, переважно невропатичного болю, болю при запаленні або інших больових станів, включаючи алодинію і/або гіпералгезію. У іншому варіанті здійснення сполука формули (I) використовується як фармакологічний інструмент. Дані аспекти і їх переважні варіанти здійснення також додатково визначені в формулі винаходу. Докладний опис винаходу У контексті даного винаходу наступні терміни мають значення, детально описані нижче. «Алкіл» стосується вуглеводневого радикалу з прямим або розгалуженим ланцюгом, який містить 1-12 атомів вуглецю, який не має ненасичені зв'язки, і який приєднаний до залишку молекули одинарним зв'язком, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, н-пентил і т. д. Алкільні радикали необов'язково можуть бути заміщені одним або більше замісниками, такими як арил, галоген, гідрокси, алкокси, карбокси, ціано, карбоніл, ацил, алкоксикарбоніл, аміно, нітро, меркапто, алкілтіо і т. д. Переважні алкільні радикали містять від 1 до 6 атомів вуглецю. Якщо замісником є арил, то це відповідає «арилалкільному» радикалу, такому як бензил або фенетил. Якщо замісником є гетероцикліл, то це відповідає «гетероциклілалкільному» радикалу. Якщо замісником є циклоалкіл, то це відповідає «циклоалкілалкільному» радикалу. «Алкеніл» стосується вуглеводневого радикалу з прямим або розгалуженим ланцюгом, який містить 2-12 атомів вуглецю, який має щонайменше один ненасичений зв'язок, і який приєднаний до залишку молекули одинарним зв'язком. Алкенільні радикали необов'язково можуть бути заміщені одним або більше замісниками, такими як арил, галоген, гідрокси, алкокси, карбокси, ціано, карбоніл, ацил, алкоксикарбоніл, аміно, нітро, меркапто, алкілтіо і т. д. Переважні алкенільні радикали містять від 2 до 6 атомів вуглецю. «Циклоалкіл» стосується стабільного 3-10-членного моноциклічного або біциклічного радикалу, який є насиченим або частково насиченим, і який складається тільки з атомів вуглецю і водню, такого як циклогексил або адамантил. Якщо в описі спеціально не вказане інше, термін «циклоалкіл» має на увазі включення циклоалкільних радикалів, які необов'язково заміщені одним або більше замісниками, такими як алкіл, галоген, гідрокси, аміно, ціано, нітро, алкокси, карбокси, алкоксикарбоніл і т. д. «Арил» стосується радикалів з одним і декількома ароматичними кільцями, включаючи радикали з декількома кільцями, які містять окремі і/або конденсовані арильні групи. Конкретні арильні групи містять від 1 до 3 окремих або конденсованих кілець і від 6 до близько 18 атомів вуглецю кільця, такі як фенільний, нафтильний, інденільний, фенантранільний або антрацільний радикал. Арильний радикал необов'язково може бути заміщений одним або більше замісниками, такими як гідрокси, меркапто, галоген, алкіл, феніл, алкокси, галогеналкіл, нітро, ціано, диалкіламіно, аміноалкіл, ацил, алкоксикарбоніл і т. д. «Гетероцикліл» стосується стабільного 3-15-членного кільцевого радикалу, який складається з атомів вуглецю і від одного до п'яти гетероатомів, вибраних з групи, яка складається з азоту, кисню і сірки, переважно, 4-8-членного кільця з одним або більше гетероатомами, більш переважно, 5- або 6-членного кільця з одним або більше гетероатомами. Кільце може бути ароматичним (тобто, «гетероарил») або неароматичним. Для цілей даного винаходу, гетероцикл може бути моноциклічною, біциклічною або трициклічною кільцевою системою, яка може включати конденсовані кільцеві системи; і атоми азоту, вуглецю або сірки в гетероциклільному радикалі можуть бути необов'язково окислені; атом азоту може бути необов'язково кватернізований; і гетероциклільний радикал може бути частково або повністю заміщеним або ароматичним. Приклади таких гетероциклів включають, але, не обмежуються ними, азепіни, бензимідазол, бензотіазол, фуран, ізотіазол, імідазол, індол, піперидин, піперазин, пурин, хінолін, тіадіазол, тетрагідрофуран, кумарин, морфолін; пірол, піразол, оксазол, ізоксазол, тріазол, імідазол і т. д. «Алкокси» стосується радикалу формули -ORa, де Ra являє собою алкільний радикал, як зазначено вище, який має однин або більше (наприклад, 1, 2, 3 або 4) кисневих зв'язків і від 1 до близько 12 атомів вуглецю або, переважно, від 1 до близько 6 атомів вуглецю, наприклад, метокси, етокси, пропокси і т. д. «Аміно» стосується радикалу формули -NH2, -NHRa або -NRaRb, необов'язково кватернізованого, наприклад, метиламіно, етиламіно, диметиламіно, діетиламіно, пропіламіно і т. д. «Гало», «галоген» або «гал» стосується брому, хлору, йоду або фтору. 4 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вказівки, які є в даному описі на заміщені групи в сполуках за даним винаходом стосуються вказаного фрагмента, який може бути заміщений за одним або більше (наприклад, 1, 2, 3 або 4) доступним положенням однієї або більше відповідними групами, наприклад, галогеном, таким як фтор, хлор, бром і йод; ціано; гідроксилом; нітро; азідо; ацилом, таким як алканоїл, наприклад, C1-6алканоїльною групою, і тому подібне; карбоксамідо; алкільними групами, включаючи такі групи, які містять від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю і, більш переважно, 1-3 атоми вуглецю; алкенільними і алкінільними групами, включаючи групи, які мають один або більше (наприклад, 1, 2, 3 або 4) ненасичених зв'язків і від 2 до близько 12 атомів вуглецю або від 2 до близько 6 атомів вуглецю; алкоксигрупами, які мають один або більше (наприклад, 1, 2, 3 або 4) кисневих зв'язків і від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю; арилокси, таким як фенокси; алкілтіогрупами, включаючи такі групи, які мають один або більше (наприклад, 1, 2, 3 або 4) тіоефірних зв'язків і від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю; алкілсульфінільними групами, включаючи такі групи, які мають один або більше (наприклад, 1, 2, 3 або 4) сульфінільних зв'язків і від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю; алкілсульфонільними групами, включаючи такі групи, які мають один або більше (наприклад, 1, 2, 3 або 4) сульфонільних зв'язків і від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю; аміноалкільними групами, такими як групи, які мають один або більше (наприклад, 1, 2, 3 або 4) атомів N і від 1 до близько 12 атомів вуглецю або від 1 до близько 6 атомів вуглецю; карбоциклічними арилами, які містять 6 або більше атомів вуглецю, зокрема, фенілом або нафтилом, і аралкілом, таким як бензил. Якщо не вказане інше, необов'язково заміщена група може мати замісник в кожному здатному до заміщення положенні групи, і кожен замісник є незалежним один від одного. Термін «сіль» потрібно розуміти як форму активної сполуки, яка використовується згідно з даним винаходом, в якій вказана сполука представлена в іонній формі або є заряджена і пов'язана з протиіоном (катіоном або аніоном) або знаходиться в розчині. Дане визначення включає також четвертинні амонієві солі і комплекси активної молекули з іншими молекулами і іонами, зокрема, комплекси, утворені за допомогою іонних взаємодій. Визначення включає, зокрема, фізіологічно прийнятні солі; даний термін потрібно розуміти як еквівалентний терміну «фармакологічно прийнятні солі». Під терміном «фармацевтично прийнятні солі» в контексті даного винаходу мають на увазі сіль, яка є фізіологічно допустимою (звичайно це означає, що вона нетоксична, зокрема, отримана з протиіоном), при використанні у відповідній формі для лікування, введення або застосування, зокрема, людям і/або ссавцям. Вказані фізіологічно прийнятні солі можуть бути утворені з аніонами або кислотами і в контексті даного винаходу розуміються як солі, утворені щонайменше однією сполукою, яка використовується згідно з даним винаходом - зазвичай протоновані, наприклад, в азоті - такі як катіон, і щонайменше один фізіологічно допустимий аніон, зокрема, коли застосовується на людях і/або ссавцях. У контексті даного винаходу дане визначення, зокрема, включає сіль, утворену фізіологічно допустимою кислотою, тобто солі конкретної активної сполуки з фізіологічно допустимими органічними або неорганічними кислотами - зокрема, при застосуванні на людях і/або ссавцях. Прикладами такого типу солей є такі, які утворені з: хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, метансульфоновою кислотою, мурашиною кислотою, оцтовою кислотою, щавлевою кислотою, янтарною кислотою, яблуневою кислотою, виноградною кислотою, мигдалевою кислотою, фумаровою кислотою, молочною кислотою або лимонною кислотою. Термін «сольват» згідно з даним винаходом потрібно розуміти як такий, що вказує форму активної сполуки згідно з винаходом, в якій вказана сполука зв'язана нековалентним зв'язком з іншою молекулою (звичайно в полярному розчиннику), особливо, включаючи гідрати і алкоголяти, подібно, наприклад, метаноляту. Переважним сольватом є гідрат. Сполуки за даним винаходом можуть бути в кристалічній формі або у вигляді вільних сполук, або у вигляді сольватів і передбачається, що обидві форми входять в об'єм даного винаходу. Способи сольватування, як правило, відомі в даній галузі. Відповідні сольвати являють собою фармацевтично прийнятні сольвати. У конкретному варіанті здійснення сольват являє собою гідрат. Будь-яка сполука, яка є проліками сполуки формули (I), також входить в об'єм даного винаходу. Термін «проліки» використовується в його найбільш широкому значенні і охоплює такі похідні, які in vivo перетворюються в сполуки за даним винаходом. Приклади проліків включають, але, не обмежуючись ними, похідні і метаболіти сполук формули I, які включають біогідролізовані фрагменти, такі як біогідролізовані амідні, біогідролізовані складноефірні, біогідролізовані карбаматні, біогідролізовані карбонатні, біогідролізовані уреїдні і 5 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 60 біогідролізовані фосфатні аналоги. Переважно, проліки сполук з карбоксільними функціональними групами являють собою нижчий алкіловий ефір карбонової кислоти. Ефіри карбонових кислот зручно утворюються шляхом етерифікації груп карбонових кислот, які є на молекулі. Проліки звичайно можуть бути отримані з використанням добре відомих способів, таких як описано в оглядах Burger «Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley), «Design and Applications of Priodrugs» (Н. Bundgaard ed., 1985, Harwood Academic Publishers) and Krogsgaard-Larsen et al. «Textbook of Drug design and Discovery» Taylor & Francis (April 2002). Сполуки за даним винаходом, представлені вищеописаною формулою (I), можуть включати енантіомери, залежно від присутності хіральних центрів, або ізомери, залежно від присутності кратних зв'язків (наприклад, Z, Е). Індивідуальні ізомери, енантіомери або діастереоізомери і їх суміші входять в об'єм даного винаходу. Крім того, сполука, на яку в даному описі посилаються, може існувати у вигляді таутомерів. Зокрема, термін таутомер стосується одного з двох або більше структурних ізомерів сполуки, які існують в рівновазі і легко перетворюються з однієї ізомерної форми в іншу. Загальними таутомерними парами є амін-імін, амід-імідна кислота, кето-енол, лактам-лактим і т. д. Якщо не вказане інше, сполуки за даним винаходом також мають на увазі включення ізотопно-мічених форм, тобто сполуки, які відрізняються тільки присутністю одного або більше ізотопно-збагачених атомів. Наприклад, сполуки, які мають дані структури, за винятком заміни щонайменше одного атома водню дейтерієм або тритієм, або заміни щонайменше одного 13 14 атома вуглецю C- або C-збагаченим атомом вуглецю, або заміни щонайменше одного атома 15 азоту N-збагаченим атомом азоту, входять в об'єм даного винаходу. Сполуки формули (I) або їх солі або сольвати знаходяться, переважно, в фармацевтично прийнятній або по суті чистій формі. Під фармацевтично прийнятною формою мають на увазі, серед інших, таку, яка має фармацевтично прийнятний ступінь чистоти, виключаючи звичайні фармацевтичні добавки, такі як розріджувачі і носії, і, не включаючи речовину, яка розглядається як токсична при звичайних рівнях доз. Ступінь чистоти для лікарської речовини, переважно, складає вище 50%, більш переважно, вище 70%, найбільш переважно, вище 90%. У переважному варіанті здійснення він складає вище 95% сполук формули (I) або її солей, сольватів або проліків. Термін «фармацевтично прийнятні солі, сольвати, проліки» стосується фармацевтично прийнятної солі, складного ефіру, сольвату або іншої сполуки, яка при введенні реципієнту здатна забезпечити (прямо або опосередковано) описану в даному описі сполуку. Однак потрібно розуміти, що нефармацевтично прийнятні солі також входять в об'єм даного винаходу, оскільки такі солі можуть бути використані при отриманні фармацевтично прийнятних солей. Отримання солей, проліків і похідних може бути здійснено способами, відомими в даній галузі. Як використовується в даному описі, терміни «лікувати», «лікування» і «обробка» включають знищення, видалення, реверсію, ослаблення, модифікацію або контроль захворювання або стану, опосередкованого сигма рецептором. Як використовується в даному описі, терміни «запобігання», «який запобігає», «запобіжний», «запобігати» і профілактика стосуються можливості сполуки формули (I) уникнути, мінімізувати або ускладнити початок або розвиток захворювання або стану, опосередкованих сигма рецептором, до їх початку. Термін «фармакологічний інструмент» стосується властивості сполук за даним винаходом, завдяки яким вони являють собою, зокрема, селективні ліганди для сигма рецепторів, з чого витікає, що сполука формули (I), описана в даному винаході, може бути використана як модель для тестування інших сполук як сигма лігандів, за винятком замінених радіоактивних лігандів, а також може бути використана для моделювання фізіологічних дій, пов'язаних з сигма рецепторами. 1 Згідно з одним варіантом здійснення, R в формулі (I) вище вибраний з 5-10-членної заміщеної або незаміщеної, ароматичної або неароматичної гетероциклільної групи, яка, переважно, містить N, О або S як член кільця; 5-10- членної заміщеної або незаміщеної арильної групи; і 5-10-членної заміщеної або незаміщеної циклоалкільної групи. 1 У переважному варіанті здійснення R в формулі (I) вище вибраний із заміщеного або незаміщеного циклопентилу, заміщеного або незаміщеного циклогексилу, заміщеного або незаміщеного фенілу, заміщеного або незаміщеного нафтилу, заміщеного або незаміщеного тіофену, заміщеного або незаміщеного бензотіофену, заміщеного або незаміщеного бензофурану, заміщеного або незаміщеного піридину і заміщеного або незаміщеного хіноліну. 1 У ще більш переважному варіанті здійснення R в формулі (I) вище вибраний з групи, яка складається з: 2-тієнілу, 3-тієнілу, 2,5-дихлор-3-тієнілу, 2,3-дихлор-5-тієнілу, 2,3-дихлор-4 6 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 60 тієнілу, 2-бензотієнілу, 3-бензотієнілу, 4-бензотієнілу, 5-бензотієнілу, 7-бензотієнілу, 2бензофурілу, 5-бензофурілу, 2-піридилу, 3-піридилу, 4-піридилу, 2-хінолілу, 3-хінолілу, 5хінолілу, 6-хінолілу, 3,4-дифторфенілу, 3,4-дихлорфенілу, циклопентилу і циклогексилу. 1 У іншому переважному варіанті здійснення R в формулі (I) вище являє собою α або β нафтил, переважно вибраний з наступних α або β нафтильних груп: 7-гідрокси-2-нафтилу, 6гідрокси-2-нафтилу, 5-гідрокси-2-нафтилу, 6-фтор-2-нафтилу, 6-метокси-2-нафтилу, 6-бром-2нафтилу, 6-гідроксиметил-2-нафтилу, 6-фторметил-2-нафтилу, 7-гідрокси-1-нафтилу, 6гідрокси-1-нафтилу, 5-гідрокси-1-нафтилу, 5-фтор-1-нафтилу, 5-бром-1-нафтилу і 1-нафтилу. 2 3 У іншому варіанті здійснення R і R в формулі (I) незалежно вибрані з Н і заміщеної або незаміщеної C1-6алкільної групи, переважно, метилу. Більш конкретними варіантами здійснення 2 3 2 3 є такі, де R являє собою метил, і R являє собою Н, або R і R одночасно являють собою Н або одночасно метил. 4 5 У переважному варіанті здійснення R і R разом з атомом азоту, до якого вони приєднані, 4 5 утворюють заміщену або незаміщену гетероциклільну групу. Більш переважно, R і R , взяті разом, утворюють морфолін-4-ільну групу, піперидинову групу, піролідинову групу або піперазин-4-ільну групу. Переважними значеннями m і n незалежно є 1 і 2. Далі, X переважно являє собою атом кисню або групу -CH2-. У додаткових переважних варіантах здійснення переважні значення різних замісників, описаних вище, об'єднані. Даний винахід також стосується таких сполучень переважних замісників в формулі (I) вище. Конкретні окремі сполуки за даним винаходом, які підпадають під формулу (I), включають сполуки, перераховані нижче: 4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)морфолін, 4-(2-((5-метил-1-(нафталін-2-іл)-1H-піразол-3-іл)метокси)етил)морфолін, 4-(3-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)пропіл)морфолін, 4-(3-(5-метил-1-(нафталін-2-іл)-1H-піразол-3-іл)пропіл)морфолін, 4-(2-(2-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)етокси)етил)морфолін, 4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)етил)морфолін, 4-(3-(1-циклогексил-5-метил-1H-піразол-3-іл)пропіл)морфолін, 1-(3,4-дихлорфеніл)-5-метил-3-((2-(піролідин-1-іл)етокси)метил)-1H-піразол, 1-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)піперидин, 1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)етанон, (2S,6R)-4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)-2,6диметилморфолін, 4-(2-((5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)метокси)етил)морфолін, 4-(4-(1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)бутил)морфолін, 4-(3-(5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)пропіл)морфолін, 4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)етил)морфолін, 4-(2-((1-(3,4-дихлорфеніл)-4,5-диметил-1H-піразол-3-іл)метокси)етил)морфолін, 4-(3-(1-(хінолін-3-іл)-1H-піразол-3-іл)пропіл)морфолін, 4-(4-(1-(3,4-дихлорфеніл)-1H-піразол-3-іл)бутил)морфолін, 4-(4-(5-метил-1-(хінолін-3-іл)-1H-піразол-3-іл)бутил)морфолін, 4-(3-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)пропіл)морфолін, 4-(2-((1-циклопентил-5-метил-1H-піразол-3-іл)метокси)етил)морфолін, гідрохлорид1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1іл)етанону, гідрохлорид(3S,5R)-1-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)етил)-3,5диметилпіперазину, гідрохлорид4-(2-(2-(1-циклогексил-5-метил-1H-піразол-3-іл)етокси)етил)морфоліну, гідрохлорид4-(2-((1-циклогексил-1H-піразол-3-іл)метокси)етил)морфоліну, гідрохлорид4-(2-((1-циклогексил-4,5-диметил-1H-піразол-3-іл)метокси)етил)морфоліну, 1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)етанон, 1-(4-(3-((1-циклогексил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(4-((1-циклогексил-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанон, 1-(4-(4-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанон, 1-(4-(3-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)етанон, 1-(4-(3-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(4-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)бутил)піперазин-1-іл)етанон, 7 UA 112160 C2 5 10 15 20 25 1-(4-(3-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(3-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(3-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)піперазин-1-іл)етанон, 1-(4-(2-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)етанон, 1-(4-(2-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)етанон, 4-(2-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)морфолін, 4-(2-((1-(3,4-дифторфеніл)-1H-піразол-3-іл)метокси)етил)морфолін, 4-(3-((1-(3,4-дифторфеніл)-5-метил-1H-піразол-3-іл)метокси)пропіл)морфолін, 1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)пропан-1-он, 1-(4-(2-((1-циклогексил-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)-2метилпропан-1-он, 1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)пропан-1-он, 1-(4-(2-((1-циклогексил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)-2-метилпропан-1-он, 1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)пропан-1он, 1-(4-(2-((1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)-2метилпропан-1-он, 1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)пропан-1-он, 1-(4-(2-((1-(3,4-дихлорфеніл)-1H-піразол-3-іл)метокси)етил)піперазин-1-іл)-2-метилпропан-1он, або їх фармацевтично прийнятну сіль, проліки або сольват. У іншому аспекті даний винахід стосується способу отримання сполук загальної формули (I), як описано вище. Сполуки, відповідні переважним варіантам здійснення стосовно загальної формули (Ia), (Ib), (Ic) і (Id) можуть бути отримані таким чином: 8 UA 112160 C2 9 UA 112160 C2 5 10 15 20 25 30 35 Спосіб отримання сполуки формули (Ia) Взаємодія сполуки формули (II) зі сполукою формули (III) в присутності основи і відповідного розчинника; де LG являє собою групу, яка видаляється, яка може бути вибрана з галогену, наприклад, брому або хлориду, або арилсульфонільної групи, наприклад, мезилату, трифлату або тозилату і тому подібне. Дану взаємодію здійснюють у відповідному розчиннику, який є реакційноінертним розчинником, таким як вуглеводні, подібно толуолу; галогеновані вуглеводні, наприклад, дихлорметан, хлороформ; диполярні апротонні розчинники, такі як ацетонітрил, N,N-диметилформамід (ДМФА), N,N-диметилацетамід (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамід (HMPT); простий ефір, такий як тетрагідрофуран (ТГФ), їх суміші з водою і тому подібне. Основа є досить сильною, щоб видалити атом водню з гідроксигрупи, наприклад гідрид лужного або лужноземельного металу, такий як гідрид літію або гідрид натрію, або алкоксид лужного металу, такий як метоксид або етоксид натрію або калію, трет-бутоксид калію або карбонат калію, триетиламін, піридин, йодид натрію, карбонат цезію і т. д. Сполуки формули (III) є комерційно доступними або отримані способами, відомими фахівцям в даній галузі, наприклад, як описано в EP0529973. Проміжні сполуки формули (II) можуть бути отримані, як описано в WO2007079086, шляхом відновлення сполуки формули (IV). Піразолкарбоксилати формули (IV) можуть бути отримані, як описано в WO2007079086, шляхом взаємодії похідного гідразину (V) з 1,3-дикетоном формули (VI) у відповідному розчиннику, такому як оцтова кислота. Гідразини (V) можуть бути комерційно доступними або отримані з відповідних нітро, аміно або галоген заміщених похідних способами, як правило, відомими фахівцям в даній галузі. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090). 1,3-дикетони (VI) можуть бути отримані шляхом конденсації Кляйзена алкілкетону формули CH3COR2 з діетилоксалатом. Спосіб отримання сполуки формули (Ib) Сполуки формули (Ib) можуть бути отримані шляхом відновлення сполуки формули (IX) способами, відомими фахівцям в даній галузі (Paul N. Rylander in «Hydrogenation Methods», Ed. Academic Press, 1990). Сполука формули (IX) може бути отримана шляхом взаємодії сполуки формули (VII) з фосфонієвою сіллю формули (VIII) в присутності основи і відповідного розчинника. Відповідним розчинником буде реакційноінертний розчинник, такий як вуглеводні, подібні толуолу; галогеновані вуглеводні, наприклад, дихлорметан, хлороформ; диполярні апротонні розчинники, такі як N,N-диметилформамід (ДМФА), і тому подібне; простий ефір, такий як 10 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 тетрагідрофуран (ТГФ), і тому подібне; і основа, наприклад, гідрид лужного або лужноземельного металу, такий як або гідрид натрію, або алкоксид лужного металу, такий як метоксид або етоксид натрію або калію, трет-бутоксид калію або карбонат калію, бутилітій, триетиламін, піридин і т. п. (Chem. Rev. 1989, 89, 863-927; Top. Stereochem. 1994, 21, 1). Фосфонієві солі (VIII) отримані способами, відомими фахівцям в даній галузі, з комерційно доступних галогенідів шляхом взаємодії з трифенілфосфіном в присутності відповідного розчинника. (I. Gosney, A. G. Rowley in «Organophosphorous Reagents in Organic Synthesis», Ed. J. I. G. Cadogan, Academic Press, New York, 1979, Chpt 2; J Org. Chem. 1984, 49, 4293-4295 і посилання, які цитуються там ). Сполуки формули (VII) можуть бути отримані шляхом окислення вищеописаних проміжних сполук (II) в присутності відповідного окислювального агента, такого як оксид марганцю (IV), у відповідному розчиннику, такому як галогеновані вуглеводні, наприклад, дихлорметан, хлороформ. (Gabriel Tojo, Marcos Fernandez in «Oxidation of Alcoholes to Aldehydes і Ketones: А Guide to Current Common Practice», Ed. Springer, 2006, Chpt 8). Спосіб отримання сполуки формули (Ic) Згідно з способом А: Взаємодія сполуки формули (XII) зі сполукою формули (III) в присутності основи і відповідного розчинника; де LG являє собою групу, яка видаляється, яка може бути вибрана з галогену, наприклад, брому або хлориду, або арилсульфонільної групи, наприклад, мезилату, трифлату або тозилату і тому подібне. Дану взаємодію здійснюють у відповідному розчиннику, яким буде реакційноінертний розчинник, такий як вуглеводні, подібні толуолу; галогеновані вуглеводні, наприклад, дихлорметан, хлороформ; диполярні апротонні розчинники, такі як ацетонітрил, N,N-диметилформамід (ДМФА), N,N-диметилацетамід (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамід (HMPT); простий ефір, такий як тетрагідрофуран (ТГФ), їх суміші з водою і тому подібне. Основа є досить сильною для видалення водню у гідроксигрупи, наприклад, гідрид лужного або лужноземельного металу, такий як гідрид літію або гідрид натрію, або алкоксид лужного металу, такий як метоксид або етоксид натрію або калію, третбутоксид калію або карбонат калію, триетиламін, піридин, йодид натрію, карбонат цезію і т. д. Сполуки формули (III) є комерційно доступними або отримані способами, відомими фахівцям в даній галузі, наприклад, як описано в EP0529973. Проміжні сполуки формули (XII) можуть бути отримані, як описано в WO2007079086, шляхом відновлення сполуки формули (XI). Сполуки формули (XI) можуть бути отримані шляхом кислотного гідролізу способами, відомими фахівцям в даній галузі. Сполука формули (X) може бути отримана шляхом взаємодії сполуки формули (VII) з фосфонієвою сіллю в присутності основи і відповідного розчинника. Відповідним розчинником буде реакційноінертний розчинник, такий як вуглеводні, подібні толуолу; галогеновані вуглеводні, наприклад, дихлорметан, хлороформ; диполярні апротонні розчинники, такі як N,Nдиметилформамід (ДМФА) і тому подібне; простий ефір, такий як тетрагідрофуран (ТГФ) і тому подібне; і основа, наприклад гідрид лужного або лужноземельного металу, такий як або гідрид натрію, або алкоксид лужного металу, такий як метоксид або етоксид натрію або калію, третбутоксид калію або карбонат калію, бутилітій, триетиламін, піридин і т. д. (Chem. Rev. 1989, 89, 863-927; Top. Stereochem. 1994, 21, 1). Фосфонієві солі отримані способами, відомими фахівцям в даній галузі, з комерційно доступних галогенідів шляхом взаємодії з трифенілфосфіном в присутності відповідного розчинника. (I. Gosney, A. G. Rowley, «Organophosphorous Reagents in Organic Synthesis», Ed. J. I. G. Cadogan, Academic Press, New York, 1979, Chpt 2; J Org. Chem. 1984, 49, 4293-4295 і посилання, які цитуються там ). Сполуки формули (VII) можуть бути отримані шляхом окислення вищеописаних проміжних сполук (II) в присутності відповідного окислювального агента, такого як оксид марганцю, у відповідному розчиннику, такому як галогеновані вуглеводні, наприклад, дихлорметан, хлороформ. (Gabriel Tojo, Marcos Fernandez, «Oxidation of Alcoholes to Aldehydes and Ketones: А Guide to Current Common Practice», Ed. Springer, 2006, Chpt 8). Проміжні сполуки формули (II) можуть бути отримані, як описано в WO2007079086, шляхом відновлення сполуки формули (IV). Піразолкарбоксилати формули (IV) можуть бути отримані, як описано в WO2007079086, шляхом взаємодії похідного гідразину (V) з 1,3-дикетоном формули (VI) у відповідному розчиннику, такому як оцтова кислота. 11 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 Гідразини (V) можуть бути комерційно доступними або отримані з відповідних нітро, аміно або галоген заміщених похідних способами, звичайно відомими фахівцям в даній галузі. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090). 1,3-дикетони (VI) можуть бути отримані шляхом конденсації Кляйзена алкілкетону формули CH3COR2 з діетилоксалатом. Згідно зі способом В: Взаємодія сполуки формули (XVI) зі сполукою формули (III) в присутності основи і відповідного розчинника; де LG являє собою групу, яка видаляється, яка може бути вибрана з галогену, наприклад, брому або хлориду, або арилсульфонільної групи, наприклад, мезилату, трифлату або тозилату і тому подібне. Дану взаємодію здійснюють у відповідному розчиннику, яким буде реакційноінертний розчинник, такий як вуглеводні, подібні толуолу; галогеновані вуглеводні, наприклад, дихлорметан, хлороформ; диполярні апротонні розчинники, такі як ацетонітрил, N,N-диметилформамід (ДМФА), N,N-диметилацетамід (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамід (HMPT); простий ефір, такий як тетрагідрофуран (ТГФ), їх суміші з водою і тому подібне. Основа є досить сильною для видалення водню у гідроксигрупи, наприклад, гідрид лужного або лужноземельного металу, такий як гідрид літію або гідрид натрію, або алкоксид лужного металу, такий як метоксид або етоксид натрію або калію, трет-бутоксид калію або карбонат калію, триетиламін, піридин, йодид натрію, карбонат цезію і т. д. Сполуки формули (III) є комерційно доступними або отримані способами, відомими фахівцям в даній галузі, наприклад, як описано в EP0529973. Проміжні сполуки формули (XVI) можуть бути отримані, як описано в WO2007079086, шляхом відновлення сполуки формули (XV). Піразолкарбоксилати формули (XV) можуть бути отримані, як описано в WO2007079086, шляхом взаємодії похідного гідразину (V) з метил 3,5-діоксогексаноатом формули (XIV) у відповідному розчиннику, такому як MeOH. Гідразини (V) можуть бути комерційно доступними або отримані з відповідного нітро, аміно або галоген заміщеного похідного способами, звичайно відомими фахівцям в даній галузі. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090). Метил 3,5-диоксогексаноат формули (XIV) може бути отриманий шляхом взаємодії комерційно доступної дегідрооцтової кислоти (XIII) з магнієм в MeOH (Tetrahedron Letters 2010, 51, 2741). Спосіб отримання сполуки формули (Id) Спосіб є таким же, як описаний вище для сполук формули (Ib), використовуючи відповідну сполуку (XVII). У процесі здійснення способів, описаних вище, може бути необхідним і/або бажаним захист чутливих груп або реагентів. Введення звичайних захисних груп, а також їх видалення може бути здійснене способами, добре відомими фахівцям в даній галузі. Якщо сполуки загальною формули (I) самі отримані у вигляді суміші стереоізомерів, зокрема, енантіомерів або діастереомерів, вказані суміші можуть бути розділені звичайними способами, відомими фахівцям в даній галузі, наприклад, хроматографічними способами або фракційною кристалізацією з хіральними реагентами. Якщо є хіральні центри, сполуки можуть бути отримані в рацемічній формі, або окремі енантіомери можуть бути отримані або енантіоспецифічним синтезом, або розділенням. Сольвати, переважно гідрати, сполук загальної формули (I), їх відповідні стереоізомери або відповідні солі також можуть бути отримані стандартними способами, відомими фахівцям в даній галузі. Очищення і виділення сполук за винаходом загальної формули (I), їх відповідного стереоізомеру або їх солі, або сольвату, або будь-якої проміжної сполуки, якщо потрібно, може бути здійснено загальновідомими способами, відомими фахівцям в даній галузі, наприклад, хроматографічними способами або перекристалізацією. Було виявлено, що сполуки загальної формули (I), їх стереоізомери, відповідні солі і відповідні сольвати мають високу афінність стосовно сигма рецепторів, тобто вони є селективними лігандами для сигма рецепторів і діють як модулятори, наприклад, антагоністи, зворотні агоністи або агоністи, на ці рецептори. Даний винахід далі стосується лікарських засобів або фармацевтичних композицій, які містять сполуку за даним винаходом або її фармацевтично прийнятну сіль, похідне, проліки або стереоізомери разом з фармацевтично прийнятним ексципієнтом, для введення пацієнту, особливо людині. 12 UA 112160 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін «ексципієнт» стосується компонентів лікарського засобу, іншим ніж активний інгредієнт (визначення, дане Європейським Агентством по лікарських засобах European Medicines Agency - EMA). Вони, переважно, включають «носій, ад’ювант і/або наповнювач». Носії являють собою форму, в яку включені речовини для поліпшення доставки і ефективності лікарських засобів. Носії для лікарських засобів використовуються в системах доставки лікарських засобів, таких як з вивільненням для пролонгування in vivo дії лікарського засобу, який контролюється, зниження метаболізму лікарських засобів і зниження токсичності лікарського засобу. Носії використовуються також в пристроях для підвищення ефективності доставки лікарських засобів до цільових ділянок фармакологічної дії (U.S. National Library of Medicine. National Institutes of Health). Ад’ювантом є речовина, яка додається до продукту лікарського засобу, який впливає на дію активного інгредієнту передбачуваним чином. Наповнювачем є ексципієнт або речовина, переважно, без терапевтичної дії, яка використовується як середовище для надання об'єму при введенні лікарських засобів (Stedman's Medical Spellchecker, © 2006 Lippincott Williams & Wilkins). Такі фармацевтичні носії, ад’юванти або наповнювачі можуть являти собою стерильні рідини, такі як вода і масла, включаючи такі як масла з нафти, тваринні масла, рослинні олії або синтетичні масла, такі як арахісова олія, соєва олія, мінеральне масло, кунжутна олія і тому подібне, ексципієнти, дезінтегранти, зволожувальні агенти або розріджувачі. Відповідні фармацевтичні носії описані в огляді «Remington's Pharmaceutical Sciences» by E.W. Martin. Вибір вказаних ексципієнтів і необхідних для використання кількостей залежать від форми введення фармацевтичної композиції. Лікарський засіб або фармацевтична композиція згідно з даним винаходом можуть бути в будь-якій формі, відповідній для введення людям і/або тваринам, переважно, людям, включаючи немовлят, дітей і дорослих, і можуть бути отримані стандартними способами, відомими фахівцям в даній галузі. Таким чином, препарат згідно з винаходом може бути призначений для зовнішнього або системного застосування, зокрема, для дермального, трансдермального, підшкірного, внутрішньом'язового, внутрішньосуглобового, внутрішньоочеревинного, внутрішньовенного, внутрішньоартеріального, внутрішньоміхурового, внутрішньокісткового, інтракавернозного, легеневого, букального, під’язикового, очного, в скловидне тіло, інтраназального, черезшкірного, ректального, вагінального, перорального, епідурального, інтратекального, внутрішньошлуночкового, внутрішньомозкового, інтрацеребровентрикулярного, інтрацистернального, інтраспінального, періспінального, внутрішньочерепного, доставки через голки або катетери з допомогою або без допомоги насосних пристроїв, або іншими шляхами введення. У переважному варіанті здійснення фармацевтичні композиції представлені в пероральній формі, у вигляді або твердого продукту, або рідкого. Відповідні дозовані форми для перорального введення можуть являти собою таблетки, пілюлі, таблетки у вигляді капсул, гелеві капсули, жувальні гумки, капсули, гранули, краплі, сиропи або розчини, і можуть містити звичайні ексципієнти, відомі в даній галузі техніка, такі як зв'язувальні агенти, наприклад сироп, гуміарабік, желатин, сорбіт, трагакант або полівінілпіролідон; волокна, наприклад лактоза, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; лубриканти для таблетування, наприклад, стеарат магнію; дезінтегранти, наприклад, крохмаль, полівінілпіролідон, натрій крохмаль гліколят або мікрокристалічна целюлоза; або фармацевтично прийнятні зволожувальні агенти, такі як лаурилсульфат натрію. Тверді пероральні композиції можуть бути отримані звичайними способами змішування, наповнення або таблетування. Повторні операції змішування можуть бути використані для розподілу активного агента в композиціях, використовуючи велику кількість наповнювачів. Такі операції є звичайними в даній галузі. Таблетки, наприклад, можуть бути отримані шляхом вологого або сухого гранулювання і необов'язково покриті способами, добре відомими в звичайній фармацевтичній практиці, зокрема, ентеросолюбільним покриттям. Фармацевтичні композиції також можуть бути пристосовані для парентерального введення, такі як стерильні розчини, суспензії або сухі препарати, які відновлюються, аерозолі або спреї у відповідній одиничній дозованій формі. Можуть бути використані відповідні ексципієнти, такі як об’ємотвірний агент, буферні агенти або поверхнево-активні речовини. Композиція за даним винаходом може бути складена у вигляді осаджуваного осаду в розчиненому вигляді або у вигляді пластирів для черезшкірного застосування. Нашкірні аплікації включають мазі, гелі, креми, лосьйони, суспензії або емульсії. Відповідною формою ректального застосування є супозиторії. Вказані композиції отримують з використанням стандартних способів, таких як описано або вказано в Фармакопеях Іспанії і США і текстах подібних посилань. 13 UA 112160 C2 5 10 15 20 25 30 35 40 Згідно з одним варіантом здійснення винаходу, є переважним, щоб сполука формули (I) використовувалася в терапевтично ефективних кількостях. Лікуючий лікар визначить дозування даних терапевтичних агентів, які будуть найбільш відповідними, воно буде змінюватися від виду введення і конкретної вибраної сполуки, і, більш того воно буде змінюватися залежно від пацієнта, який піддається лікуванню, віку пацієнта, типу захворювання або стану, який піддається лікуванню. Коли композиція вводиться перорально, буде потрібна більша кількість активного агента для отримання того ж ефекту в порівнянні з меншою кількістю при парентеральному введенні. Сполуки можуть бути використані таким же чином, як терапевтичні агенти, які порівнюються, і рівень дозування має той же порядок, який звичайно використовується при застосуванні інших терапевтичних агентів. Активні сполуки звичайно вводяться один або більше разів на день, наприклад 1, 2, 3 або 4 разів на день, при звичайних загальних денних дозах в межах від 0,1 до 1000 мг/кг/день. Сполуки і композиції за даним винаходом можуть бути використані з іншими лікарськими засобами, щоб забезпечити комбіновану терапію. Інші лікарські засоби можуть бути частиною однієї і тієї ж композиції, або бути представлені у вигляді окремої композиції для введення в один і той же час або в різний час. Наступні приклади є тільки ілюстрацією деяких варіантів здійснення даного винаходу і не можуть розглядатися як такі, які обмежують його яким-небудь чином. ПРИКЛАДИ Приклад 1 Синтез 4-(2-{[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]метокси}етил)морфоліну 1.1 Синтез етил 1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-карбоксилату Етилацетопіруват (74 мг, 0,468 ммоль) додавали в суспензію вихідної речовини (100 мг, 0,468 ммоль) в AcOH (5 мл), і суміш кип'ятили зі зворотним холодильником протягом 1 години. Потім суміші давали вихолонути до кімнатної температури і розбавляли CH 2Cl2 (10 мл). Органічну фазу промивали H2O (1×10 мл) і водним 10% NaOH (2×10 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок (171 мг) очищали флеш-хроматографією на силікагелю (21% AcOEt/гексан), з отриманням 139 мг бажаного продукту (Rf=0,6 (30% AcOEt/гексан), блідо-жовта тверда речовина, 99%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,62 (д, J=2,4 Гц, 1H, ArH); 7,54 (д, J=8,3 Гц, 1H, ArH); 7,32 (дд, J=2,4 і 8,3 Гц, 1H, ArH); 6,72 (с, 1H, ArH); 4,39 (с, J=6,8 Гц, 2H, CH 2); 2,34 (с, 3H, CH3); 1,39 (т, J=6,8 Гц, 3H, CH3). MS-EI+ m/z: 300,0 (M+1). 1.2 Синтез [1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]метанолу NaBH4 (104 мг, 2,76 ммоль) додавали в суспензію вихідного складного ефіру (551 мг, 1,84 ммоль) в EtOH (12 мл). Суміш кип'ятили зі зворотним холодильником (розчиняється при кип’ятінні) протягом 1 години, і потім додавали ще NaBH4 (104 мг, 2,76 ммоль). Суміш кип'ятили зі зворотним холодильником протягом ще 4 годин і залишали охолоджуватися до кімнатної температури. Суміш виливали в H2O (10 мл), і водний шар екстрагували CH 2Cl2 (2×10 мл). Об'єднані органічні фази промивали водним насиченим NH 4Cl (1×15 мл) і H2O (1×15 мл), 14 UA 112160 C2 5 10 15 20 25 30 35 сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок очищали флешхроматографією на силікагелю (42-60% AcOEt/гексан), з отриманням 354 мг бажаного продукту (Rf=0,5 (10% MeOH/CH2Cl2), жовта тверда речовина, 75%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,82 (д, J=2,5 Гц, 1H, ArH); 7,75 (д, J=8,5 Гц, 1H, ArH); 7,52 (м, 1H, ArH); 6,43 (с, 1H, ArH); 4,91 (с, 2H, CH 2); 2,57 (с, 3H, CH3). 1.3 Синтез 4-(2-йодетил)морфоліну NaI (25,54 г, 170,40 ммоль) додавали в суспензію вихідного хлориду (8,5 г, 56,80 ммоль) в ацетоні (150 мл). Суміш кип'ятили зі зворотним холодильником протягом 17 годин, потім суміші давали охолонути до кімнатної температури і фільтрували, промиваючи CH 2Cl2 (3×100 мл). Фільтрат промивали H2O (3×250 мл), органічну фазу сушили над безводним Na2SO4, фільтрували і концентрували насухо, з отриманням 7,71 г бажаного йодиду (Rf=0,4 (40% AcOEt/гексан), масляниста жовта тверда речовина, 56%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 3,64 (т, J=4,7 Гц, 4H, CH2); 3,14 (т, J=7,6 Гц, 2H, CH2) 2,65 (т, J=7,6 Гц, 2H, CH2) 2,42 (т, J=4,7 Гц, 4H, CH2). 1.4 Синтез 4-(2-{[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]метокси}етил)морфоліну NaH (60% в мінеральному маслі, 25 мг, 0,622 ммоль) додавали до розчину вихідного спирту (80 мг, 0,311 ммоль) в ТГФ (3 мл). Суміш перемішували при кімнатній температурі протягом 10 хв., і додавали вихідний йодид (225 мг, 0,933 ммоль) в ТГФ (2 мл). Суміш кип'ятили зі зворотним холодильником протягом 2 годин, потім суміші давали охолонути до кімнатної температури, і суміш виливали у водний насичений NaHCO3 (8,0 мл). Додавали CH2Cl2 (10 мл) і органічну фазу відділяли. Водну фазу екстрагували CH 2Cl2 (2×8 мл), і об'єднані органічні фази сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок очищали флешхроматографією на силікагелю (3-5,2% MeOH/CH2Cl2), з отриманням 114 мг бажаного продукту (Rf=0,5 (10% MeOH/CH2Cl2), тверда речовина кремового кольору, 99%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,52 (д, J=8,6 Гц, 1H, ArH); 7,32-7,27 (дд, J=2,5 і 8,6 Гц, 1H, ArH); 6,24 (с, 1H, ArH); 4,54 (с, 2H, CH 2); 3,73 (т, J=4,6 Гц, 4H, CH2); 3,65 (т, J=5,8 Гц, 2H, CH2); 2,62 (т, J=5,8 Гц, 2H, CH2); 2,51 (т, J=4,6 Гц, 4H, CH2); 2,35 (с, 3H, CH3). MS-EI+ m/z: 370,3, 372,3 (M+1). Приклад 2 Синтез 4-(2-{[1-(2-нафтил)-5-метил-1H-піразол-3-іл]метокси}етил)морфоліну 2.1 Синтез гідрохлориду 2-нафтилгідразину У суспензію 2-нафтиламіну (800 мг, 5,59 ммоль) у водному 6,0M HCl (6 мл), яка охолоджується на бані H2O-лід, повільно додавали NaNO2 (578 мг, 8,38 ммоль) в H2O (1,2 мл) (2 хв. додавання). Отриманий розчин перемішували на бані H 2O-лід протягом 1 години, і повільно (5 хв. додавання) додавали SnCl2 (3,71 г, 19,56 моль). Отриману суспензію перемішували на 15 UA 112160 C2 5 бані H2O-лід протягом 3,5 годин і потім фільтрували. Тверду речовину промивали послідовно H2O при температурі 0 °C (4×8 мл), H2O при кімнатній температурі (1×8 мл), Et 2O при температурі 0 °C (2×4 мл), сумішшю Et2O/гексан (1:1, 2×4 мл) і гексаном (2×5 мл). Тверду речовину сушили, з отриманням 690 мг бажаного продукту (Rf=0,7 (40% AcOEt/гексан), тверда речовина кремового кольору, 63%-вий вихід). 1 H-ЯМР (ДМСО-d6, 250 МГц, δ): 7,81 (м, 2H, ArH); 7,71 (д, J=7,7 Гц, 1H, ArH); 7,49-7,19 (м, 4H, ArH). MS-EI+ m/z: 159,1 (M-HCl+1). 2.2 Синтез етил 5-метил-1-(2-нафтил)-1H-піразол-3-карбоксилату 10 15 20 25 30 35 40 Етилацетопіруват (544 мг, 3,44 ммоль) додавали в суспензію вихідного гідразину (670 мг, 3,44 ммоль) в AcOH (5 мл). Отриману суспензію кип'ятили зі зворотним холодильником протягом 1 години, потім суміші давали охолонути до кімнатної температури і розбавляли CH2Cl2 (15 мл). Органічну фазу промивали послідовно H 2O (2×20 мл), водним NaOH 10% (1×20 мл) і знов H2O (1×20 мл). Органічну фазу сушили над безводним Na 2SO4, фільтрували і концентрували насухо. Залишок очищали флеш-хроматографією на силікагелю (15-41% AcOEt/гексан), з отриманням 68 мг ізомеру а (Rf=0,8 (20% AcOEt/гексан), тверда речовина помаранчевого кольору, 7%-вий вихід) і 640 мг ізомеру b (Rf=0,6 (20% AcOEt/гексан), тверда речовина помаранчевого кольору, 66%-вий вихід). 1 H-ЯМР ізомер b (CDCl3, 250 МГц, δ): 7,95-7,84 (м, 4H, ArH); 7,60-7,51 (м, 3H, ArH); 6,78 (с, 1H, ArH); 4,43 (с, J=7,1 Гц, 2H, CH2); 2,38 (с, 3H, CH3); 1,40 (т, J=7,1 Гц, 3H, CH3). 1 H-ЯМР ізомер а (CDCl3, 250 МГц, δ): 7,91-7,85 (м, 4H, ArH); 7,53-7,48 (м, 3H, ArH); 6,86 (с, 1H, ArH); 4,22 (с, J=7,1 Гц, 2H, CH2); 2,39 (с, 3H, CH3); 1,20 (т, J=7,1 Гц, 3H, CH3). 2.3 Синтез [5-метил-1-(2-нафтил)-1H-піразол-3-іл]метанолу У суспензію вихідного складного ефіру (640 мг, 2,28 ммоль) в EtOH (15 мл) додавали NaBH4 (129 мг, 3,42 ммоль). Суміш кип'ятили зі зворотним холодильником (розчиняється при кип’ятінні) протягом 1,5 години, і потім додавали ще NaBH4 (640 мг, 2,28 ммоль). Суспензію кип'ятили зі зворотним холодильником додатково 4 години, і додавали ще NaBH4 (640 мг, 2,28 ммоль). Через ще 2,5 години, додавали додаткову кількість NaBH4 (640 мг, 2,28 ммоль) і кип'ятили зі зворотним холодильником додатково 16 годин. Реакційній суміші давали охолонути до кімнатної температури і виливали в H2O (10 мл). Водну фазу екстрагували CH2Cl2 (2×15 мл), і об'єднані органічні фази промивали водним насиченим NH 4Cl (2×30 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок очищали флеш-хроматографією на силікагелю (60-70% AcOEt/гексан), з отриманням 309 мг бажаного продукту (Rf=0,2 (40% AcOEt/гексан), жовта тверда речовина, 57%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,96-7,96 (м, 4H, ArH); 7,61 (д, J=1,9 Гц, 1H, ArH); 7,56 (м, 2H, ArH); 6,25 (с, 1H, ArH); 4,74 (sa, 2H, CH2); 2,39 (с, 3H, CH3). 2.4 Синтез 4-(2-{[1-(2-нафтил)-5-метил-1H-піразол-3-іл]метокси}етил)морфоліну 16 UA 112160 C2 5 10 15 20 25 30 До розчину вихідного спирту (167 мг, 0,70 ммоль) в ТГФ (6 мл) додавали NaH (60%-вий в мінеральному маслі, 56 мг, 1,40 ммоль). Суміш перемішували при кімнатній температурі протягом 5 хв., і додавали вихідний йодид (354 мг, 1,47 ммоль) в ТГФ (2 мл). Реакційну суміш кип'ятили зі зворотним холодильником протягом 2 годин, потім суміші давали охолонути до кімнатної температури і виливали у водний насичений NaHCO 3 (15 мл). Водну фазу екстрагували CH2Cl2 (2×10 мл), і об'єднані органічні фази промивали водним насиченим NaHCO3 (1×20 мл) і H2O (1×10 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок очищали флеш-хроматографією на силікагелю (4% MeOH/CH2Cl2), з отриманням 176 мг бажаного продукту (Rf=0,1 (5% MeOH/CH2Cl2), помаранчеве масло, 71%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,89 (м, 4H, ArH); 7,61-7,50 (м, 3H, ArH); 6,28 (с, 1H, ArH); 4,60 (с, 2H, CH2); 3,74 (т, J=4,7 Гц, 4H, CH2); 3,69 (т, J=5,8 Гц, 2H, CH2); 2,65 (т, J=5,8 Гц, 2H, CH2); 2,53 (м, 4H, CH2); 2,39 (с, 3H, CH3). MS-EI+ m/z: 352,4 (M+1). Приклад 3 Синтез 4-{3-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]пропіл}морфоліну 3.1 Синтез етил 1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-карбоксилату Етилацетопіруват (74 мг, 0,468 ммоль) додавали в суспензію вихідної речовини (100 мг, 0,468 ммоль) в AcOH (5 мл). Отриману суміш кип'ятили зі зворотним холодильником протягом 1 години, потім суміші давали охолонути до кімнатної температури і розбавляли CH 2Cl2 (10 мл). Органічну фазу промивали H2O (1×10 мл) і 10% водним NaOH (2×10 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок (171 мг) очищали флеш-хроматографією на силікагелю (21% AcOEt/гексан), з отриманням 139 мг бажаного продукту (Rf=0,6 (30% AcOEt/гексан), блідо-жовта тверда речовина, 99%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,62 (д, J=2,4 Гц, 1H, ArH); 7,54 (д, J=8,3 Гц, 1H, ArH); 7,32 (дд, J=2,4 і 8,3 Гц, 1H, ArH); 6,72 (с, 1H, ArH); 4,39 (с, J=6,8 Гц, 2H, CH 2); 2,34 (с, 3H, CH3); 1,39 (т, J=6,8 Гц, 3H, CH3). MS-EI+ m/z: 300,0 (M+1). 3.2 Синтез [1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]метанолу 17 UA 112160 C2 5 10 15 20 25 30 35 40 У суспензію вихідного складного ефіру (551 мг, 1,84 ммоль) в EtOH (12 мл) додавали NaBH 4 (104 мг, 2,76 ммоль). Суміш кип'ятили зі зворотним холодильником (розчиняється при кип’ятінні) протягом 1 години, і потім додавали ще NaBH4 (104 мг, 2,76 ммоль). Суміш кип'ятили зі зворотним холодильником протягом ще 4 годин, і потім суміші давали охолонути до кімнатної температури і виливали в H2O (10 мл). Водну фазу екстрагували CH 2Cl2 (2×10 мл), і об'єднані органічні фази промивали водним насиченим NH 4Cl (1×15 мл) і H2O (1×15 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Залишок очищали флешхроматографією на силікагелю (42-60% AcOEt/гексан), з отриманням 354 мг бажаного продукту (Rf=0,5 (10% MeOH/CH2Cl2), жовта тверда речовина, 75%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,82 (д, J=2,5 Гц, 1H, ArH); 7,75 (д, J=8,5 Гц, 1H, ArH); 7,52 (м, 1H, ArH); 6,43 (с, 1H, ArH); 4,91 (с, 2H, CH2); 2,57 (с, 3H, CH3). 3.3 Синтез 1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-карбальдегіду До розчину вихідного спирту (542 мг, 2,11 ммоль) в CH 2Cl2 (30 мл) додавали MnO2 (85%-ва чистота, 2,16 г, 21,10 ммоль). Суміш кип'ятили зі зворотним холодильником протягом 16,5 годин, і потім суміші давали охолонути до кімнатної температури і фільтрували через Целіт, промиваючи CH2Cl2 (3×50 мл) і 5% MeOH/CH2Cl2 (1×40 мл). Фільтрат концентрували насухо і очищали флеш-хроматографією на силікагелю (20% AcOEt/гексан), з отриманням 403 мг бажаного продукту (Rf=0,5 (20% AcOEt/гексан), блідо-жовта тверда речовина, 75%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 9,98 (с, 1H, CHO); 7,65 (д, J=2,5 Гц, 1H, ArH); 7,61 (д, J=8,5 Гц, 1H, ArH); 7,36 (дд, J=2,5 і 8,5 Гц, 1H, ArH); 6,73 (с, 1H, ArH); 2,39 (с, 3H, CH 3). 3.4 Синтез 4-(2-йодетил)морфоліну У суспензію вихідного хлориду (8,5 г, 56,80 ммоль) в ацетоні (150 мл) додавали NaI (25,54 г, 170,40 ммоль). Суміш кип'ятили зі зворотним холодильником протягом 17 годин, потім суміші давали охолонути до кімнатної температури і фільтрували, промиваючи CH 2Cl2 (3×100 мл). Фільтрат промивали H2O (3×250 мл), органічну фазу сушили над безводним Na 2SO4, фільтрували і концентрували насухо, з отриманням 7,71 г бажаного йодиду (Rf=0,4 (40% AcOEt/гексан), масляниста жовта тверда речовина, 56%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 3,64 (т, J=4,7 Гц, 4H, CH2); 3,14 (т, J=7,6 Гц, 2H, CH2) 2,65 (т, J=7,6 Гц, 2H, CH2) 2,42 (т, J=4,7 Гц, 4H, CH2). 3.5 Синтез (4-етилморфолін)(трифеніл)фосфоніййодиду До розчину вихідного йодиду (2,0 г, 8,29 ммоль) в ксилолі (15 мл) додавали PPh 3 (3,26 г, 12,44 ммоль). Суміш кип'ятили зі зворотним холодильником протягом 16 годин, і потім суміші давали охолонути до кімнатної температури. Додавали толуол (8 мл) і суміш перемішували при кімнатній температурі протягом 2 годин. Тверду речовину відфільтровували у вакуумі, промивали Et2O (3×10 мл) і сушили, з отриманням 3,96 г бажаного продукту (Rf=0,1 (10% MeOH/CH2Cl2), біла тверда речовина, 95%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,93-7,83 (м, 15H, ArH); 3,84 (м, 2H, CH2); 3,29 (м, 4H, CH2) 2,59 (м, 2H, CH2) 2,30 (м, 4H, CH2). 18 UA 112160 C2 MS-EI+ m/z: 376,0 (M-1). 3.6 Синтез 4-{3-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]проп-2-еніл}морфоліну t 5 10 15 20 25 30 35 У суспензію фосфінової солі (177 мг, 0,353 ммоль) в ТГФ (3 мл) додавали частину KO Bu (79 мг, 0,703 ммоль). Суміш перемішували при кімнатній температурі протягом близько 1 хв. (суспензія яскраво жовтого кольору), і додавали вихідний альдегід (108 мг, 0,423 ммоль) в ТГФ (3 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години, і потім розбавляли CH2Cl2 (10 мл) і додавали H2O (10 мл). Органічну фазу відділяли і водну фазу екстрагували CH2Cl2 (1×10 мл). Об'єднані органічні фази сушили над безводним Na 2SO4, фільтрували і концентрували насухо. Залишок очищали, здійснюючи три послідовні флешхроматографії на силікагелю (4% MeOH/CH2Cl2, 50% ацетон/гексан і CH2Cl2/MeOH/NH4OH 98:2:1), з отриманням 45 мг бажаного продукту (Rf=0,5 (50% ацетон/гексан), блідо-жовте масло, 36%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ) головний ізомер: 7,62 (д, J=2,5 Гц, 1H, ArH); 7,54 (д, J=8,5 Гц, 1H, ArH); 7,33 (дд, J=2,5 і 8,5 Гц, 1H, ArH); 6,45 (д, J=11,8 Гц, 1H, CH); 6,22 (с, 1H, ArH); 5,84 (м, 1H, CH); 3,74 (м, 4H, CH2); 3,46 (дд, J=1,9 і 6,3 Гц, 2H, CH2); 2,53 (м, 4H, CH2); 2,37 (с, 3H, CH3). MS-EI+ m/z: 352,0, 354,0 (M). 3.7 Синтез 4-{3-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]пропіл}морфоліну До розчину вихідної речовини (123 мг, 0,349 ммоль) в MeOH (4 мл) додавали PtO 2 (4 мг, 0,017 ммоль). Суспензію перемішували при кімнатній температурі в атмосфері H 2 (балон) протягом 2 годин, і потім фільтрували через целіт, промиваючи MeOH (3×5 мл). Фільтрат концентрували насухо і очищали флеш-хроматографією на силікагелю (40% ацетон/гексан), з отриманням 79 мг бажаного продукту (Rf=0,4 (50% ацетон/гексан), блідо-жовте масло, 64%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,50 (д, J=8,8 Гц, 1H, ArH); 7,29 (дд, J=2,5 і 8,8 Гц, 1H, ArH); 6,02 (с, 1H, ArH); 3,72 (м, 4H, CH2); 2,64 (т, J=7,7 Гц, 2H, CH2); 2,44 (м, 6H, CH2); 2,32 (с, 3H, CH3); 1,87 (м, 2H, CH2). MS-EI+ m/z: 351,8, 353,8 (M). Приклад 4 Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-піразол-3-іл]пропіл}морфоліну 4.1 Синтез гідрохлориду 2-нафтилгідразину NaNO2 (578 мг, 8,38 ммоль) в H2O (1,2 мл) повільно додавали (2 хв. додавання) в суспензію 2-нафтилуміну (800 мг, 5,59 ммоль) в 6,0M водному HCl (6 мл), охолодженої на бані H 2O-лід. 19 UA 112160 C2 5 10 15 20 25 30 35 40 Отриманий розчин перемішували на бані H2O-лід протягом 1 години, і повільно додавали (5 хв. додавання) SnCl2 (3,71 г, 19,56 моль). Отриману суспензію перемішували на бані H 2O-лід протягом 3,5 годин і потім фільтрували. Тверду речовину промивали H 2O при температурі 0 °C (4×8 мл), H2O при кімнатній температурі (1×8 мл), Et2O при температурі 0 °C (2×4 мл), сумішшю Et2O/гексан (1:1, 2×4 мл) і гексаном (2×5 мл). Тверду речовину сушили, з отриманням 690 мг бажаного продукту (Rf=0,7 (40% AcOEt/гексан), тверда речовина кремового кольору, 63%-вий вихід). 1 H-ЯМР (ДМСО-d6, 250 МГц, δ): 7,81 (м, 2H, ArH); 7,71 (д, J=7,7 Гц, 1H, ArH); 7,49-7,19 (м, 4H, ArH). MS-EI+ m/z: 159,1 (M-HCl+1). 4.2 Синтез етил 5-метил-1-(2-нафтил)-1H-піразол-3-карбоксилату У суспензію вихідного гідразину (670 мг, 3,44 ммоль) в AcOH (5 мл) додавали етилацетопіруват (544 мг, 3,44 ммоль). Отриману суспензію кип'ятили зі зворотним холодильником протягом 1 години і потім суміші давали охолонути до кімнатної температури і розбавляли CH2Cl2 (15 мл). Органічну фазу промивали H2O (2×20 мл), 10% водним NaOH (1×20 мл) і знов H2O (1×20 мл). Органічну фазу сушили над безводним Na2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали флеш-хроматографією на силікагелю (1541% AcOEt/гексан), з отриманням 68 мг ізомеру а (Rf=0,8 (20% AcOEt/гексан), тверда речовина помаранчевого кольору, 7%-вий вихід) і 640 мг ізомеру b (Rf=0,6 (20% AcOEt/гексан), тверда речовина помаранчевого кольору, 66%-вий вихід). 1 H-ЯМР ізомер b (CDCl3, 250 МГц, δ): 7,95-7,84 (м, 4H, ArH); 7,60-7,51 (м, 3H, ArH); 6,78 (с, 1H, ArH); 4,43 (с, J=7,1 Гц, 2H, CH2); 2,38 (с, 3H, CH3); 1,40 (т, J=7,1 Гц, 3H, CH3). 1 H-ЯМР ізомер а (CDCl3, 250 МГц, δ): 7,91-7,85 (м, 4H, ArH); 7,53-7,48 (м, 3H, ArH); 6,86 (с, 1H, ArH); 4,22 (с, J=7,1 Гц, 2H, CH2); 2,39 (с, 3H, CH3); 1,20 (т, J=7,1 Гц, 3H, CH3). 4.3 Синтез [5-метил-1-(2-нафтил)-1H-піразол-3-іл]метанолу У суспензію вихідного складного ефіру (640 мг, 2,28 ммоль) в EtOH (15 мл) додавали NaBH 4 (129 мг, 3,42 ммоль). Суміш кип'ятили зі зворотним холодильником (розчиняється при кип’ятінні зі зворотним холодильником) протягом 1,5 години, і потім додавали ще NaBH4 (640 мг, 2,28 ммоль). Суміш кип'ятили зі зворотним холодильником протягом ще 4 годин, і додавали додаткову кількість NaBH4 (640 мг, 2,28 ммоль). Через 2,5 години додавали додаткову кількість NaBH4 (640 мг, 2,28 ммоль), і суміш кип'ятили зі зворотним холодильником протягом ще 16 годин. Реакційній суміші давали охолонути до кімнатної температури і виливали в H 2O (10 мл). Водну фазу екстрагували CH2Cl2 (2×15 мл), і об'єднані органічні фази промивали водним насиченим NH4Cl (2×30 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали флеш-хроматографією на силікагелю (60-70% AcOEt/гексан), з отриманням 309 мг бажаного продукту (Rf=0,2 (40% AcOEt/гексан), жовта тверда речовина, 57%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,96-7,96 (м, 4H, ArH); 7,61 (д, J=1,9 Гц, 1H, ArH); 7,56 (м, 2H, ArH); 6,25 (с, 1H, ArH); 4,74 (sa, 2H, CH2); 2,39 (с, 3H, CH3). 20 UA 112160 C2 4.4 Синтез 5-метил-1-(2-нафтил)-1H-піразол-3-карбальдегіду 5 10 15 20 25 30 35 До розчину вихідного спирту (309 мг, 1,29 ммоль) в CH2Cl2 (10 мл) додавали MnO2 (85%-вий для аналізу, 1,33 г, 12,97 ммоль). Суміш кип'ятили зі зворотним холодильником протягом 3 годин, і потім суміші давали охолонути до кімнатної температури і фільтрували через целіт, промиваючи CH2Cl2 (2×15 мл) і сумішшю 10% MeOH/CH2Cl2 (3×15 мл). Фільтрат концентрували насухо і очищали флеш-хроматографією на силікагелю (20% AcOEt/гексан), з отриманням 218 мг бажаного продукту (Rf=0,8 (40% AcOEt/гексан), блідо-жовта тверда речовина, 71%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 10,04 (с, 1H, CHO); 7,94 (м, 4H, ArH); 7,60 (м, 3H, ArH); 6,77 (с, 1H, ArH); 2,43 (с, 3H, CH3). 4.5 Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-піразол-3-іл]проп-2-енил}морфоліну t У суспензію фосфінової солі (154 мг, 0,307 ммоль) в ТГФ (3 мл) додавали частину KO Bu (69 мг, 0,6214 ммоль). Суміш перемішували протягом близько 1 хв. (суспензія яскраво жовтого кольору), і в ТГФ (2 мл) додавали вихідний альдегід (87 мг, 0,368 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 45 хв., і потім додавали водний насичений NH4Cl (10 мл) і екстрагували AcOEt (1×10 мл). Органічну фазу промивали водним насиченим NH4Cl (2×10 мл) і H2O (1×10 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали флеш-хроматографією на силікагелю (3% MeOH/CH2Cl2), з отриманням 27 мг бажаного продукту (Rf=0,2 (5% MeOH/CH 2Cl2), жовте масло, 26%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ) головний ізомер: 7,88 (м, 4H, ArH); 7,62 (дд, J=2,0 і 8,6 Гц, 1H, ArH); 7,55 (м, 2H, ArH); 6,54 (д, J=11,8 Гц, 1H, CH); 6,27 (с, 1H, ArH); 5,84 (м, 1H, CH); 3,80 (м, 4H, CH2); 3,51 (м, 2H, CH2); 2,57 (м, 4H, CH2); 2,42 (с, 3H, CH3). 4.6 Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-піразол-3-іл]пропіл}морфоліну У суспензію Pd/С (10% за масою, 18 мг, 0,017 ммоль) в MeOH (4 мл) додавали вихідну речовину (57 мг, 0,171 ммоль) в MeOH (4 мл). Отриману суспензію перемішували при кімнатній температурі в атмосфері H2 (балон) протягом 2,5 годин і потім фільтрували через целіт, промиваючи MeOH (3×5 мл). Фільтрат концентрували насухо і очищали флеш-хроматографією на силікагелю (3% MeOH/CH2Cl2), з отриманням 46 мг бажаного продукту (Rf=0,15 (5% MeOH/CH2Cl2), жовте масло, 81%-вий вихід). 21 UA 112160 C2 1 5 10 15 20 25 30 35 H-ЯМР (CDCl3, 250 МГц, δ): 7,84-7,94 (м, 4H, ArH); 7,59 (дд, J=2,2 і 8,8 Гц, 1H, ArH); 7,52 (м, 2H, ArH); 6,06 (с, 1H, ArH); 3,74 (м, 4H, CH2); 2,71 (т, J=7,7 Гц, 2H, CH2); 2,49 (м, 6H, CH2); 2,38 (с, 3H, CH3); 1,91 (м, 2H, CH2). MS-EI+ m/z: 335,9 (M+1). Приклад 5 Синтез 4-(2-{2-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]етокси}етил)морфоліну 5.1. Синтез 1-(3,4-дихлорфеніл)-3-[2-метоксивініл]-5-метил-1H-піразолу У суспензію (метоксиметил)трифенілфосфонійхлориду (2,06 г, 6,0 ммоль) в ТГФ (10 мл), охолоджену до -35 °C на бані CO2-ацетон, повільно додавали н-BuLi (2,5M в гексані, 2,4 мл, 6,0 ммоль; 20 хв. додавання). Суміш перемішували, суміші давали охолонути до -10 °C протягом 10 хв., і повільно додавали вихідний альдегід (770 мг, 3,02 ммоль) в ТГФ (5,0 мл). Суміші давали охолонути до кімнатної температури і перемішували протягом 15 годин і виливали у водний насичений NH4Cl (30 мл). Водну фазу екстрагували AcOEt (1×30 мл). Органічні фази промивали водним насиченим NH4Cl (1×30 мл) і H2O (1×20 мл), сушили над безводним Na2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали флеш-хроматографією на Biotage SP1 (0-30% AcOEt/гексан), з отриманням 550 мг бажаного продукту (Rf=0,5 (20% AcOEt/гексан), жовте масло, 64%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,61 (д, J=2,5 Гц, 1H, ArH); 7,50 (д, J=8,5 Гц, 1H, ArH); 7,31 (дд, J=8,5 і 2,5 Гц, 1H, ArH); 7,17 (д, J=13,2 Гц, 0,5 Н, CH); 6,59 (с, 0,5 Н, ArH); 6,22 (д, J=6,9 Гц, 0,5 Н, CH); 6,13 (с, 0,5 Н, ArH); 5,78 (д, J=13,2 Гц, 0,5 Н, CH); 5,45 (д, J=6,9 Гц, 0,5 Н, CH); 3,80 (с, 1,5 Н, CH3); 3,68 (с, 1,5 Н, CH3); 2,35 (с, 1,5 Н, CH3); 2,33 (с, 1,5 Н, CH3). MS-EI+ m/z: 282,6, 285,3 (M+1). 5.2 Синтез [1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]ацетальдегіду До розчину вихідного складного ефіру (400 мг, 1,41 ммоль) в MeOH (4,0 мл) додавали H 2O (1,0 мл) і конц. HCl (2,3 мл). Суміш перемішували при кімнатній температурі протягом 16 годин. Додавали 50% водний NaOH до pH 7-8, і водну фазу екстрагували AcOEt (4×15 мл). Об'єднані органічні фази сушили над безводним Na2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали на Biotage SP1 (0-30% AcOEt/гексан), з отриманням 106 мг бажаного продукту (Rf=0,3 (20% AcOEt/гексан), жовте масло, 28%-вий вихід). 1 H-ЯМР (CDCl3, 250 МГц, δ): 9,76 (т, J=1,9 Гц, 1H, CHO); 7,56 (д, J=2,5 Гц, 1H, ArH); 7,49 (д, J=8,5 Гц, 1H, ArH); 7,27 (дд, J=8,5 і 2,5 Гц, 1H, ArH); 6,11 (с, 1H, ArH); 3,68 (д, J=1,9 Гц, 2H, CH 2); 2,31 (с, 3H, CH3). 5.3 Синтез 2-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]етанолу 22 UA 112160 C2 5 10 15 20 25 До розчину вихідного альдегіду (219 мг, 0,814 ммоль) в ТГФ (5,0 мл), який охолоджується на бані H2O-лід, додавали NaBH4 (92 мг, 2,43 ммоль). Отриманий розчин перемішували на бані H2O-лід протягом 30 хв. і виливали ввідний насичений NH 4Cl (15 мл). Водну фазу екстрагували AcOEt (2×15 мл), і об'єднані органічні фази сушили над безводним Na 2SO4, фільтрували і концентрували насухо. Неочищений продукт очищали на Biotage SP1 (0-60% AcOEt/гексан), з отриманням 110 мг бажаного продукту (Rf=0,3 (40% AcOEt/гексан), біла тверда речовина, 50%вий вихід).) 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,58 (д, J=2,5 Гц, 1H, ArH); 7,52 (д, J=8,5 Гц, 1H, ArH); 7,30 (дд, J=8,5 і 2,5 Гц, 1H, ArH); 6,07 (с, 1H, ArH); 3,91 (м, 2H, CH 2); 2,87 (т, J=5,9 Гц, 2H, CH2); 2,34 (с, 3H, CH3). 5.4 Синтез 4-(2-{2-[1-(3,4-дихлорфеніл)-5-метил-1H-піразол-3-іл]етокси}етил)морфоліну До розчину вихідного спирту (104 мг, 0,383 ммоль) в ТГФ (5 мл) додавали NaH (60% в мінеральному маслі, 30 мг, 0,76 ммоль). Суміш перемішували при кімнатній температурі протягом 10 хв., і додавали 4-(2-хлоретил)морфолін (69 мг, 0,461 ммоль) і NaI (74 мг, 0,493 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом 16 годин, потім суміші давали охолонути до кімнатної температури і виливали в H 2O (10 мл). Водну фазу екстрагували AcOEt (3×15 мл), і об'єднані органічні фази сушили над безводним Na 2SO4, фільтрували і концентрували насухо. Залишок очищали на Biotage SP1 (4-15% MeOH/CH2Cl2), з отриманням 70 мг бажаного продукту (Rf=0,2 (5% MeOH/CH 2Cl2), масло помаранчевого кольору, 48%-вий вихід).) 1 H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,51 (д, J=8,5 Гц, 1H, ArH); 7,29 (дд, J=8,5 і 2,5 Гц, 1H, ArH); 6,09 (с, 1H, ArH); 3,76-3,68 (м, 6H, CH2); 3,62 (т, J=5,8 Гц, 2H, CH2); 2,91 (т, J=7,0 Гц, 2H, CH2); 2,59 (т, J=5,8 Гц, 2H, CH2); 2,49 (м, 4H, CH2); 2,33 (с, 3H, CH3). MS-EI+ m/z: 384,2; 386,0 (M+1). Наступні сполуки за даним винаходом показані у вигляді прикладів в наступній таблиці: Приклад Структура Назва ЯМР H ЯМР (CDCl3) δ м. ч.: 5,98 (с, 1H), 4,47 (с, 2H), 4,00-3,80 (м, 1H), 3,804-(2-((1-циклогексил-5-метил-1H3,67 (м, 4H), 3,61 (т, J=5,8 піразол-3Гц, 2H), 2,60 (т, J=5,8 Гц, іл)метокси)етил)морфолін 2H), 2,54-2,41 (м, 4H), 2,24 (с, 3H), 1,99-1,80 (м, 6H), 1,52-1,15 (м, 4H). 1 H ЯМР (CDCl3) δ м. ч.: 5,76 (с, 1H), 3,95-3,76 (м, 1H), 3,76-3,64 (м, 4H), 2,58 4-(3-(1-циклогексил-5-метил-1H(т, J=7,7 Гц, 2H), 2,49-2,32 піразол-3-іл)пропіл)морфолін (м, 6H), 2,22 (с, 3H), 1,991,64 (м, 9H), 1,49-1,17 (м, 3H). 1 6 7 23 UA 112160 C2 1 8 9 10 11 12 13 H ЯМР (CDCl3) δ м. ч.: 7,60 (д, J=1,8 Гц, 1H), 7,53 (д, J=8,6 Гц, 1H), 7,31 (дд, 1-(3,4-дихлорфеніл)-5-метил-3- J=8,6, 2,4 Гц, 1H), 6,25 (с, ((2-(піролідин-1-іл)етокси)метил)- 1H), 4,55 (с, 2H), 3,64 (т, 1H-піразол J=6,0 Гц, 2H), 2,72 (т, J=6,0 Гц, 2H), 2,56 (с, 4H), 2,35 (с, 3H), 1,90-1,57 (м, 4H). 1 H ЯМР (CDCl3) δ м. ч.: 7,60 (д, J=2,4 Гц, 1H), 7,52 (д, J=8,6 Гц, 1H), 7,31 (дд, 1-(2-((1-(3,4-дихлорфеніл)-5- J=8,6, 2,4 Гц, 1H), 6,25 (с, метил-1H-піразол-31H), 4,53 (с, 2H), 3,64 (т, іл)метокси)етил)піперидин J=6,1 Гц, 2H), 2,58 (т, J=6,1 Гц, 2H), 2,48-2,38 (м, 4H), 2,34 (с, 3H), 1,65-1,50 (м, 4H), 1,50-1,37 (м, 2H). 1 H ЯМР (CDCl3) δ м. ч.: 7,60 (д, J=2,4 Гц, 1H), 7,52 (д, J=8,6 Гц, 1H), 7,30 (дд, 1-(4-(2-((1-(3,4-дихлорфеніл)-5J=8,6, 2,4 Гц, 1H), 6,25 (с, метил-1H-піразол-31H), 4,55 (с, 2H), 3,64 (т, іл)метокси)етил)піперазин-1J=6,1 Гц, 2H), 2,71 (т, іл)етанон J=6,1 Гц, 2H), 2,61-2,49 (м, 4H), 2,34 (с, 3H), 1,84-1,72 (м, 4H), 1,78 (с, 3H). 1 H ЯМР (CDCl3) δ м. ч.: 7,61 (д, J=2,3 Гц, 1H), 7,55 (д, J=8,6 Гц, 1H), 7,33 (д, (2S,6R)-4-(2-((1-(3,4J=8,7 Гц, 1H), 6,20 (с, 1H), дихлорфеніл)-5-метил-1H4,56 (с, 2H), 4,40-4,23 (м, піразол-3-іл)метокси)етил)-2,62H), 4,14-4,00 (м, 2H), диметилморфолін 3,56-3,39 (м, 2H), 3,293,09 (м, 2H), 2,61-2,41 (м, 2H), 2,35 (с, 3H), 1,18 (д, J=5,8 Гц, 6H). 1 H ЯМР (CDCl3) δ м. ч.: 9,07 (д, J=2,5 Гц, 1H), 8,21 (д, J=2,4 Гц, 1H), 8,17 (д, J=8,6 Гц, 1H), 7,88 (д, 4-(2-((5-метил-1-(хінолін-3-іл)-1HJ=8,1 Гц, 1H), 7,85-7,70 (м, піразол-31H), 7,68-7,52 (м, 1H), 6,32 іл)метокси)етил)морфолін (с, 1H), 4,60 (с, 2H), 3,783,65 (м, 6H), 2,64 (т, J=5,8 Гц, 2H), 2,59-2,46 (м, 4H), 2,42 (с, 3H). 1 H ЯМР (CDCl3) δ м. ч.: 7,59 (д, J=2,4 Гц, 1H), 7,51 4-(4-(1-(3,4-дихлорфеніл)-5(д, J=8,6 Гц, 1H), 7,29 (дд, метил-1H-піразол-3J=8,7, 2,5 Гц, 1H), 6,02 (с, іл)бутил)морфолін 1H), 3,89-3,60 (м, 4H), 2,82-2,37 (м, 8H), 2,33 (с, 3H), 1,90-1,39 (м, 4H). 24 UA 112160 C2 1 14 15 16 17 H ЯМР (CDCl3) δ м. ч.: 9,07 (д, J=2,4 Гц, 1H), 8,20 (д, J=2,3 Гц, 1H), 8,16 (д, J=8,6 Гц, 1H), 7,87 (дд, 4-(3-(5-метил-1-(хінолін-3-іл)-1H- J=8,2, 0,9 Гц, 1H), 7,80піразол-3-іл)пропіл)морфолін 7,71 (м, 1H), 7,65-7,56 (м, 1H), 6,11 (с, 1H), 4,00-3,65 (м, 4H), 2,89-2,62 (м, 2H), 2,59-2,46 (м, 6H), 2,41 (с, 3H), 2,03-1,87 (м, 2H). 1 H ЯМР (CDCl3) δ м. ч.: 7,85-7,82 (м, 2H), 7,624-(2-((1-(3,4-дихлорфеніл)-1H- 7,40 (м, 2H), 6,51 (д, J=2,5 піразол-3Гц, 1H), 4,62 (с, 2H), 3,77іл)метокси)етил)морфолін 3,69 (м, 4H), 3,66 (т, J=5,7 Гц, 2H), 2,62 (т, J=5,7 Гц, 2H), 2,55-2,46 (м, 4H). 1 H ЯМР (CDCl3) δ м. ч.: 7,56 (д, J=2,3 Гц, 1H), 7,51 (д, J=8,7 Гц, 1H), 7,28 (дд, 4-(2-((1-(3,4-дихлорфеніл)-4,5- J=6,2, 2,0 Гц, 1H), 4,54 (с, диметил-1H-піразол-32H), 3,82-3,67 (м, 4H), 3,62 іл)метокси)етил)морфолін (т, J=5,2 Гц, 2H), 2,60 (т, J=5,5 Гц, 2H), 2,55-2,43 (м, 4H), 2,24 (с, 3H), 2,05 (с, 3H). 1 H ЯМР (CDCl3) δ м. ч.: 9,31 (д, J=2,6 Гц, 1H), 8,37 (д, J=2,3 Гц, 1H), 8,13 (д, J=8,3 Гц, 1H), 8,00 (д, J=2,5 Гц, 1H), 7,87 (д, 4-(3-(1-(хінолін-3-іл)-1H-піразолJ=7,1 Гц, 1H), 7,77-7,65 (м, 3-іл)пропіл)морфолін 1H), 7,65-7,51 (м, 1H), 6,37 (д, J=2,4 Гц, 1H), 3,85-3,64 (м, 4H), 2,80 (т, J=7,6 Гц, 2H), 2,56-2,40 (м, 6H), 2,06-1,86 (м, 2H). 1 18 4-(4-(1-(3,4-дихлорфеніл)-1Hпіразол-3-іл)бутил)морфолін H ЯМР (CDCl3) δ м. ч.: 7,81 (с, 1H), 7,77 (д, J=2,4 Гц, 1H), 7,54-7,43 (м, 2H), 6,28 (д, J=2,4 Гц, 1H), 3,87-3,60 (м, 4H), 2,72 (т, J=7,4 Гц, 2H), 2,48-2,41 (м, 4H), 2,41-2,34 (м, 2H), 1,76-1,50 (м, 4H). 1 19 H ЯМР (CDCl3) δ м. ч.: 8,90 (д, J=2,5 Гц, 1H), 8,03 (д, J=2,5 Гц, 1H), 7,99 (д, J=8,4 Гц, 1H), 7,70 (д, 4-(4-(5-метил-1-(хінолін-3-іл)-1H- J=8,1 Гц, 1H), 7,66-7,53 (м, піразол-3-іл)бутил)морфолін 1H), 7,51-7,38 (м, 1H), 5,93 (с, 1H), 3,63-3,51 (м, 4H), 2,53 (т, J=7,4 Гц, 2H), 2,36-2,26 (м, 4H), 2,23 (с, 3H), 1,64-1,39 (м, 4H). 25 UA 112160 C2 1 20 H ЯМР (CDCl3) δ м. ч.: 5,99 (с, 1H), 4,44 (с, 2H), 4-(3-((1-циклогексил-5-метил-1H- 3,99-3,81 (м, 1H), 3,76піразол-33,65 (м, 4H), 3,53 (т, J=6,5 іл)метокси)пропіл)морфолін Гц, 2H), 2,51-2,36 (м, 6H), 2,25 (с, 3H), 1,98-1,63 (м, 8H), 1,47-1,18 (м, 2H). 1 21 H ЯМР (CDCl3) δ м. ч.: 5,99 (с, 1H), 4,47 (с, 2H), 3,77-3,67 (м, 4H), 3,60 (т, 4-(2-((1-циклопентил-5-метил-1HJ=5,8 Гц, 2H), 2,59 (т, піразол-3J=5,8 Гц, 2H), 2,54-2,40 (м, іл)метокси)етил)морфолін 4H), 2,25 (с, 3H), 2,10-1,96 (м, 4H), 1,96-1,83 (м, 2H), 1,76-1,55 (м, 2H). 1 22 H ЯМР (ДМСО-d6) δ м. ч.: 6,00 (с, 1H), 4,42 (с, 2H), 4,08-3,96 (м, 1H), 3,871-(4-(2-((1-циклогексил-5-метил3,79 (м, 2H), 3,52-3,35 (м, 1H-піразол-34H), 3,34-3,25 (м, 2H), іл)метокси)етил)піперазин-13,32-2,95 (м, 4H), 2,25 (с, іл)етанон гідрохлорид 3H), 2,04 (с, 3H), 1,88-1,64 (м, 7H), 1,48-1,34 (м, 2H), 1,30-1,14 (м, 1H). 1 23 H ЯМР (ДМСО-d6) δ м. ч.: 5,93 (с, 1H), 4,30 (с, 2H), 4,09-3,91 (м, 1H), 3,58гідрохлорид (3S,5R)-1-(2-((13,43 (м, 2H), 3,23-3,08 (м, циклогексил-5-метил-1H2H), 3,03-2,87 (м, 2H), 2,23 піразол-3-іл)метокси)етил)-3,5(с, 3H), 2,14-1,94 (м, 2H), диметилпіперазину 1,88-1,71 (м, 4H), 1,731,57 (м, 2H), 1,50-1,03 (м, 6H), 1,19 (д, J=5,7 Гц, 6H). 1 24 гідрохлорид 4-(2-(2-(1циклогексил-5-метил-1Hпіразол-3іл)етокси)етил)морфоліну H ЯМР (CDCl3) δ м. ч.: 6,27 (с, 1H), 4,46-3,68 (м, 9H), 3,55-2,84 (м, 8H), 2,40 (с, 3H), 2,51-2,31 (м, 2H), 2,10-1,79 (м, 3H), 1,601,13 (м, 3H). 1 25 гідрохлорид 4-(2-((1циклогексил-1H-піразол-3іл)метокси)етил)морфоліну 26 H ЯМР (CDCl3) δ м. ч.: 7,64 (с, 1H), 6,52 (с, 1H), 4,84 (с, 2H), 4,79-4,61 (м, 2H), 4,37-4,12 (м, 4H), 4,09-3,87 (м, 2H), 3,693,36 (м, 4H), 3,32-3,00 (м, 1H), 2,45-2,22 (м, 2H), 2,05-1,86 (м, 2H), 1,851,63 (м, 3H), 1,63-1,39 (м, 2H), 1,39-1,13 (м, 1H). UA 112160 C2 1 26 гідрохлорид 4-(2-((1циклогексил-4,5-диметил-1Hпіразол-3іл)метокси)етил)морфоліну 27 1-(4-(2-((1-циклогексил-1Hпіразол-3іл)метокси)етил)піперазин-1іл)етанон 28 1-(4-(3-((1-циклогексил-1Hпіразол-3іл)метокси)пропіл)піперазин-1іл)етанон 29 1-(4-(4-((1-циклогексил-1Hпіразол-3іл)метокси)бутил)піперазин-1іл)етанон 30 1-(4-(4-((1-циклогексил-5-метил1H-піразол-3іл)метокси)бутил)піперазин-1іл)етанон 31 1-(4-(3-((1-циклогексил-5-метил1H-піразол-3іл)метокси)пропіл)піперазин-1іл)етанон 27 H ЯМР (CDCl3) δ м. ч.: 4,62 (с, 2H), 4,24 (т, J=12,0 Гц, 2H), 4,15-4,00 (м, 3H), 4,01-3,83 (м, 2H), 3,583,39 (м, 2H), 3,37-3,23 (м, 2H), 3,08 (т, J=10,1 Гц, 2H), 2,23 (с, 3H), 2,15-2,03 (м, 2H), 1,99 (с, 3H), 2,041,79 (м, 4H), 1,77-1,57 (м, 1H), 1,52-1,28 (м, 3H). UA 112160 C2 32 1-(4-(2-((1-(3,4-дихлорфеніл)-1Hпіразол-3іл)метокси)етил)піперазин-1іл)етанон 33 1-(4-(3-((1-(3,4-дихлорфеніл)-1Hпіразол-3іл)метокси)пропіл)піперазин-1іл)етанон 34 1-(4-(4-((1-(3,4-дихлорфеніл)-1Hпіразол-3іл)метокси)бутил)піперазин-1іл)етанон 35 1-(4-(3-((1-(3,4-дихлорфеніл)-5метил-1H-піразол-3іл)метокси)пропіл)піперазин-1іл)етанон 36 1-(4-(3-((1-(3,4-дифторфеніл)-1Hпіразол-3іл)метокси)пропіл)піперазин-1іл)етанон 37 1-(4-(3-((1-(3,4-дифторфеніл)-5метил-1H-піразол-3іл)метокси)пропіл)піперазин-1іл)етанон 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazole compounds as sigma receptor inhibitors
Автори англійськоюGarcia Lopez, Monica, Torrens Jover, Antoni, Diaz Fernandez, Jose Luis, Caamano Moure, Ana Maria
Автори російськоюГарсия Лопес Моника, Торренс Ховер Антони, Диас Фернандес Хосе Луис, Кааманьо Моуре Ана Мария
МПК / Мітки
МПК: C07D 413/12, C07D 413/06, A61K 31/496, C07D 401/12, C07D 413/14, A61K 31/454, A61P 25/00, C07D 403/12, A61K 31/5377, A61K 31/4025
Мітки: інгібітори, піразолу, сполуки, сигма-рецепторів
Код посилання
<a href="https://ua.patents.su/39-112160-spoluki-pirazolu-yak-ingibitori-sigma-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Сполуки піразолу як інгібітори сигма-рецепторів</a>
Попередній патент: Нанодротові каталізатори
Наступний патент: Циклічні n,n’-діарилтіосечовини та n,n’-діарилсечовини – антагоністи андрогенових рецепторів, протираковий засіб, спосіб застосування
Випадковий патент: Пристрій ручного вмикання вакуумних вимикачів












