Піридазинові сполуки і їх застосування
Номер патенту: 96296
Опубліковано: 25.10.2011
Автори: Оліяй Реза, Тсі Уінстон К., Орі Девід А., Дахл Терренце К., Зія Вехід, Бонді Стівен С.
Формула / Реферат
1. Спосіб одержання сполуки формули (1)
 , (1)
, (1)
у якому
(а) проводять реакцію 5-[6-хлорпіридазин-3-ілметил]-2-(2-фторфеніл)-5Н-імідазо[4,5-с]піридину з 2,4-біс(трифторметил)фенілбороновою кислотою в присутності розчинника, що має структуру R1OR2O(R4O)aR3, де кожний з R1, R2, R3 і R4 незалежно один від одного вибраний з С1-С6алкілу та а означає 0 або 1, і
(b) виділяють сполуку (1).
2. Спосіб за п. 1, у якому а означає 0.
3. Спосіб за п. 2, у якому розчинник являє собою диметоксіетан.
4. Спосіб за п. 1, у якому а означає 1.
5. Сполука, що має формулу
 , (1)
, (1)
та її солі та сольвати.
6. Сполука за п. 5, яка знаходиться у формі вільної основи.
7. Сполука за п. 5, яка знаходиться у мікронізованій формі.
8. Сполука за п. 5, яка знаходиться у формі суспензії.
9. Сполука за п. 5, яка знаходиться у водному середовищі.
10. Сполука за п. 5, яка знаходиться у формі розчину.
11. Сполука за п. 10, яка знаходиться у розчині з С4-С22жирною кислотою.
12. Сполука за п. 11, де жирна кислота являє собою олеїнову кислоту або лауринову кислоту.
13. Композиція, що містить сполуку за п. 5 і фармацевтично прийнятний наповнювач.
14. Композиція за п. 13, у якій наповнювач являє собою С4-С22жирну кислоту.
15. Композиція за п. 14, яка являє собою водний розчин і в якій жирна кислота являє собою олеїнову кислоту.
16. Спосіб лікування або профілактики інфекції ВГС, у якій пацієнтові вводять терапевтичну або профілактичну у відношенні до ВГС дозу сполуки за п. 5.
17. Спосіб за п. 16, у якому пацієнт є людиною.
18. Спосіб за п. 17, який додатково включає введення пацієнтові терапевтично ефективної дози іншого агента для лікування або профілактики інфекції ВГС.
19. Спосіб за п. 18, у якому агент являє собою інтерферон.
20. Спосіб за п. 17, у якому терапевтично ефективна доза становить приблизно від 0,5 до 5,0 мг/кг два рази в день.
21. Спосіб за п. 20, у якому доза становить приблизно від 0,7 до 2,2 мг/кг два рази в день.
22. Сполука за п. 5 для застосування як лікарського засобу.
23. Застосування сполуки за п. 5 для виготовлення лікарського засобу для попередження або лікування інфекції ВГС у ссавця.
24. Застосування за п. 23, у якому ссавець є людиною.
25. Спосіб одержання сполуки (1), у якому одержують проміжний продукт (2)
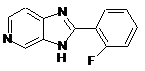 (2)
(2)
зв'язуванням 2,4-біс(трифторметил)фенілборонової кислоти з 3-хлор-6-метилпіридазином з одержанням сполуки (2а)
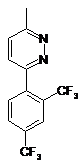 , (2а)
, (2а)
сполуку (2а) обробляють хлоруючим агентом та одержують алкілуючий агент (3)
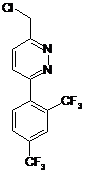 , (3)
, (3)
і використовують алкілуючий агент (3) для алкілування проміжного продукту (2) у лужних умовах з одержанням сполуки (1)
 (1).
(1).
Текст
1. Спосіб одержання сполуки формули (1) 3 96296 21. Спосіб за п. 20, у якому доза становить приблизно від 0,7 до 2,2 мг/кг два рази в день. 22. Сполука за п. 5 для застосування як лікарського засобу. 23. Застосування сполуки за п. 5 для виготовлення лікарського засобу для попередження або лікування інфекції ВГС у ссавця. 24. Застосування за п. 23, у якому ссавець є людиною. 25. Спосіб одержання сполуки (1), у якому одержують проміжний продукт (2) 4 сполуку (2а) обробляють хлоруючим агентом та одержують алкілуючий агент (3) Cl N N CF3 N N N H CF3 F (2) зв'язуванням 2,4біс(трифторметил)фенілборонової кислоти з 3хлор-6-метилпіридазином з одержанням сполуки (2а) , (3) і використовують алкілуючий агент (3) для алкілування проміжного продукту (2) у лужних умовах з одержанням сполуки (1) F F F F F F F N N N N N N N (1). CF3 CF3 , (2а) Вірус гепатиту С являє собою покритий оболонкою, одноланцюговий вірус з позитивною смисловою РНК із сімейства Flaviviridae. ВГС в основному реплікується в гепатоцитах печінки. Циркулюючі частки ВГС зв'язуються з рецепторами на поверхнях гепатоцитів і потім входять у клітини. Перебуваючи в гепатоциті, ВГС використовує внутрішньоклітинний механізм, необхідний для здійснення своєї власної реплікації. Див. статтю Lindenbach В., Nature 436 (7053): 932-8 (2005). Геном ВГС транслюється з утворенням одного білка із приблизно 3011 амінокислот. Потім даний "поліпротеїн" протеолітично процесується вірусними й клітинними протеазами з утворенням трьох структурних (асоційованих з віріоном) і семи неструктурних (NS) білків. ВГС кодує дві протеази, цистеїнуутопротеазу NS2 і серинпротеазу NS3-4A. Потім білки NS рекрутують вірусний геном у комплекс реплікації РНК, що асоційований з реаранжованими цитоплазматичними мембранами. Реплікація РНК відбувається за допомогою вірусної РНК-залежної РНКполімерази NS5B, що утворить проміжну РНК із негативним ланцюгом. Потім РНК із негативним ланцюгом служить матрицею для одержання нових вірусних геномів з позитивним ланцюгом. Геноми, що утворюються, потім можуть транслюватися, далі реплікуватись або упаковуватися в нові вірусні частинки. Нові вірусні частинки, очевидно, відділяються в секреторний шлях і вивільняються на клітинній поверхні. ВГС має високий рівень реплікації при продукуванні приблизно одного трильйона частинок щодня в інфікованого пацієнта. Внаслідок відсутності виправлення помилок за допомогою РНКполімерази ВГС, вірус ВГС має також винятково високу частоту мутацій, - фактора, що може допомогти йому уникнути імунної відповіді хазяїна. Ґрунтуючись на генетичних розходженнях між ізолятами ВГС, вид вірусу гепатиту С класифікують на шість генотипів (1-6) з декількома підтипами в кожному генотипі. Підтипи далі підрозділяють на квазівиди на основі їх генетичної розмаїтості. Перевага й поширення генотипів ВГС варіює в усьому світі. Наприклад, у північноамериканському генотипі переважає генотип 1а за яким ідуть 1b, 2а, 2b і 3а. У європейському генотипі переважає генотип 1b, за яким ідуть 2а, 2b, 2с і 3а. Генотипи 4 і 5 виявляють майже винятково в Африці. Генотип клінічно важливий для визначення потенційної відповіді на лікування на основі інтерферону й необхідної тривалості даного лікування. Генотипи 1 і 4 менш чутливі до лікування на основі інтерферону, ніж інші генотипи (2, 3, 5 і 6). Тривалість стандартного лікування на основі інтерферону для генотипів 1 і 4 становить 48 тижнів, тоді як ліку 5 вання для генотипів 2 і 3 завершують через 24 тижні. За оцінкою Всесвітньої організації охорони здоров'я в усьому світі 170-200 мільйонів чоловік (3 % населення світу) хронічно інфіковані ВГС. Приблизно 75 % даних людей хронічно інфіковані за наявності обумовленої РНК ВГС у плазмі. Дані хронічні носії перебувають у групі ризику розвитку цирозу й/або раку печінки. Відповідно до наступних досліджень протягом 7-16 років, в 7-16 % пацієнтів розвивався цироз, в 0,7-1,3 % розвивалася гепатоцелюларна карцинома й 1,3-3,7 % помирали від захворювання, що зачіпає печінку. Єдиною можливістю лікування, доступною в цей час, є застосування інтерферону -2 (або його пегільованої форми) або у вигляді монотерапії, або в комбінації з рибавірином. Однак уповільнену відповідь спостерігають тільки в приблизно 40 % пацієнтів, і лікування пов'язане із серйозними шкідливими ефектами. Таким чином, існує нагальна потреба в активних і виборчих інгібіторах ВГС. Відповідні описи включають патенти США №№ 4914108, 4988707, 4990518, 5137896, 5208242, 5227384, 5302601, 5374638, 5405964, 5438063, 5486525, 6479508 і опубліковану патентну заявку США № 2003/0108862 А1, канадський патент № 2423800 А1, німецькі патенти №№ 4211474 А1, 4236026, 4309969, 4318813, європейські патенти №№ ЕР 0 138 552 А2, ЕР 0 706 795 А2, ЕР 1 132381 А1, патент Великобританії № 2158440 А, міжнародні публікації №№ WO 00/20416, WO 00/39127, WO 00/40583, WO 03/007945 А1, WO 03/010140 А2, WO 03/010141 А2, WO 93/02080, WO 93/14072, WO 96/11192, WO 96/12703, WO 99/27929, [міжнародні заявки] PCT/US2004/43112, РСТ/ВЕ2003/000117, PCT/US2005/26606, статті Akamatsu, et al. "New Efficient Route for Solid-Phase Synthesis of Benzimidazole Derivatives" Новий ефективний шлях твердофазного синтезу бензімідазолових похідних), 4:475-483, J. Comb. Chem., 2002, Baginski SG et al. Proc. Natl. Acad. Sci. U.S.A. 2000, 5 липня; 97(14):7981-6). Cleve et al., "Derivate desimidazo[4.5-b]- und imidazo[4.5-c]pyridins" (Похідні дезімідазо[4.5-b] і імідазо[4.5-с]піридинів), 747:158-171, Justus Liebigs Annalen Der Chemica, 1971, Kiyama, et al., "Synthesis and Evaluation of Novel Nonpeptide Angiotensin II Receptor Antagonists: Imidazo[4,5-c]pyridine Derivatives with an Aromatic Substituent" (Синтез і оцінка нових непептидних антагоністів рецептора ангіотензину II похідних імідазо[4.5-з]піридинів з ароматичним замісником), 43(3):450-60, Chem Pharm Bull, 1995, Mederski et al., "Synthesis and Structural Assignment of Some N-substituted Imidazopyridine Derivatives" (Синтез і структурна оцінка ряду N-заміщених імідазопіридинових похідних), 48(48): 10549-58, Tetrahedron, 1992, Yutilov et al., 23(l):56-9, KhimikoFaradatsevticheskii Zhurnal, 1989. Крім того див. WO 05/063744. Є необхідність у сполуках, що мають необхідні терапевтичні й/або профілактичні властивості у відношенні ВГС, включаючи високу активність, вибірковість і пероральну біодоступність (що підходить для введення один або два рази в день), низьку токсичність (у тому числі прийнятні показ 96296 6 ники в аналізі петч-кламп hERG (електроретинограми людини), відсутність набряку внаслідок легеневої проникності й відсутність ефекту на QTінтервал, мінімальну або відсутню активацію/формування глутатіонових адуктів, відсутність даних, що підтверджує генотоксичність, низький рівень метаболічного обміну й низький рівень у плазмі, широкий спектр ефективності відносно генотипів ВГС (особливо 1а і 1b, 2, 3 і 4), ефективність відносно мутацій стійкості ВГС (обмежене перекривання профілів стійкості з іншими ненуклеозидними інгібіторами NS5B у клінічних випробуваннях) і сумісність із іншими лікарськими препаратами проти ВГС, такими як інтерферон і рибавірин. Профіль безпеки повинен давати можливість постійного введення дози протягом щонайменше 1 року. Відповідно до досягнення вищевказаних об'єктів, що відповідають даному винаходу, представлена сполука, що має формулу (1) а також її солі й сольвати. [Найменування відповідно до правил номенклатури хімічних сполук] ІЮПАК: 5-({6-[2,4-біс(трифторметил) феніл]піридазин-3-іл}метил)-2-(2-фторфеніл)-5Німідазо[4,5-с]піридин. [Найменування, привласнене службою] CAS: 5Н-імідазо[4,5-с]піридин, 5-[[6[2,4-біс(трифторметил)феніл]піридазин-3іл]метил]-2-(2-фторфеніл). Сполуку (1) використовують у способі лікування або профілактики інфекції ВГС, що включає введення пацієнтові терапевтичної або профілактичної дози сполуки (1). Інший варіант здійснення включає застосування сполуки (1) для виготовлення лікарського засобу для попередження або лікування інфекції ВГС у ссавця (більш докладно у людини). Інший варіант здійснення даного винаходу являє собою спосіб одержання сполуки формули (1) що включає (а) реакцію 5-[6-хлор-піридазин-3ілметил]-2-(2-фтор-феніл)-5Н-імідазо[4,5с]піридину з 2,4-біс(трифторметил)фенілборонової кислотою в присутності розчинника, що має струк 7 1 2 4 3 96296 1 2 3 8 4 туру R OR O(R O)aR , де кожне з R , R , R і R незалежно одне від одного обрані з С1-С6алкілу й а означає 0 або 1 і (b) виділення сполуки (1). В іншому варіанті здійснення для одержання сполуки (1) передбачають спосіб, що включає одержання проміжного продукту (2) зв'язування 2,4біс(трифторметил)фенілборонової кислоти із 3хлор-6-метилпіридазином з одержанням сполуки (2а) обробку сполуки (2а) хлоруючим агентом для одержання алкілуючого агента (3) і використання алкілуючого агента (3) для алкілування проміжного продукту (2) у лужних умовах з одержанням сполуки (1) Алкілуючий агент (3) є новим і є частиною даного винаходу, оскільки являє собою ті ж самі сполуки, що мають метильний замісник, а не хлорметил, або бром, фтор або йод замість хлору. Інший варіант здійснення даного винаходу відноситься до фармацевтичних композицій сполуки формули (1), що включає щонайменше один фармацевтично прийнятний наповнювач. В одному варіанті здійснення сполуки формули (1) готують із органічною кислотою й необов'язково готують у фармацевтичній лікарській формі, такій як капсула. В іншому варіанті здійснення сполуку (1) мікронізують і готують у вигляді суспензії. Сполуки (1) або фармацевтичні композиції, що відповідають даному винаходу, використовують для лікування або профілактики гепатиту С. На Фіг.1 зображена рентгенівська порошкова дифрактограма, отримана для еталонного стандарту кристалічної форми сполуки (1), отриманого способом, представленим у прикладі 1b. На Фіг.2 зображена рентгенівська порошкова дифрактограма, отримана для досліджуваної партії 6 аморфної форми сполуки (1), отриманої способом, представленим у прикладі 1а. Фіг.3 ілюструє DSC (диференціальний скануючий калориметр)-термограму, отриману для еталонного стандарту кристалічної форми сполуки (1), сканування 5C /мін., отриманого способом, представленим у прикладі 1b. Фіг.4 ілюструє DSC-термограму, отриману для досліджуваної партії 6 аморфної форми сполуки (1), сканування 5С/хв., отриманого способом, представленим у прикладі 1 а. Лікарську сполуку, що відповідає даному винаходу, уводять пацієнтові-ссавцеві (включаючи людину) будь-якими засобами, добре відомими в області техніки, тобто перорально, інтраназально, підшкірно, внутрішньом'язово, внутрішньошкірно, внутрішньовенно, внутрішньоартеріально, парентерально або за допомогою катетеризації, у терапевтично ефективній кількості, тобто в кількості, що інгібує ВГС, або в кількості, що інгібує реплікацію ВГС. Вважають, що дана кількість являє собою кількість, що забезпечує рівень у плазмі приблизно 100 нМ, трьохкратний щодо підведеного по білку ЕС90 Звичайно очікують, що це досягається шляхом перорального введення приблизно 0,5 - приблизно 5 мг/кг, як правило, приблизно від 0,7 до 2,2 мг/кг, найбільш часто приблизно 1,2 мг/кг маси тіла людини. Оптимальна доза сполуки, що відповідає даному винаходу, буде залежати від багатьох факторів, відомих фахівцеві, включаючи біодоступність сполуки в заданому препараті, метаболізм і розподіл сполуки в організмі пацієнта, голодний або ситий стан пацієнта, вибір носіїв і наповнюва 9 чів у препараті й інші фактори. Належне дозування, як правило, визначають у передклінічних і клінічних установках, і воно цілком входить у компетенцію звичайного фахівця. Терапевтично ефективну кількість сполуки, що відповідає даному винаходу, необов'язково розділяють на декілька субодиниць/день або вводять один раз у день або з інтервалами, що перевищують один день, залежно від природи інфекції, загального стану пацієнта й складу, у який входить сполука, що відповідає винаходу. Як правило, сполуку вводять два рази на день. Сполуку, що відповідає винаходу, використовують у сполученні з іншими агентами, ефективними відносно інфекцій ВГС. їх необов'язково вводять роздільно в курсі лікування або комбінують із сполукою (1) в одиничній лікарській формі, такій як таблетка, внутрішньовенний розчин або капсула. Дані інші агенти включають, наприклад, інтерферон-а, рибавірин і/або сполуки, що входять в описи ЕР 1162196, WO 03/010141, WO 03/007945, WO 00/204425 і/або WO 03/010140 (і інші подані заявки у своїх сімействах патентів-аналогах). Інші агенти, призначені для введення в курсі лікування сполукою, що відповідає винаходу, включають сполуки, що у цей час проходять клінічні випробування, зокрема, інгібітори протеази ВГС, такі як VX-950 (Vertex Pharmaceuticals), SCH 5030347 (Schering Plough) і BILN-2061 (Boehringer Ingelheim), нуклеозидні інгібітори ВГС, такі як NM283, NM107 (обидва Idenix/Novartis) і R1626 (Hoffmann-LaRoche), а також ненуклеозидні інгібітори ВГС, включаючи ВГС086 і -796 (обидва ViroPharma/Wyeth). Додаткові антивірусні агенти використовують у прийнятих кількостях, хоча, якщо ефективність сполуки, відповідної даному винаходу, і додаткова сполука є адитивними, то кількість кожного активного агента необов'язково пропорційно зменшують, і більшою мірою, якщо агенти діють синергічно. Загалом, однак, агенти використовують у їх звичайних активних кількостях в одиничних комбінованих композиціях. Спільно уведені агенти звичайно одержують у вигляді одиничних композицій, що містять сполуку, яка відповідає даному винаходу, за умови, що вони хімічно сумісні й призначені для введення одним і тим самим шляхом. У протилежному випадку вони необов'язково представлені у формі лікарського набору або упаковки, що включає два агенти в роздільних контейнерах або відділеннях. Сполука, що відповідає даному винаходу, представлена у вигляді вільної основи або у вигляді солі. Солі, як правило, одержують додаванням органічних і/або неорганічних кислот до вільної основи. Приклади включають (1) неорганічні кислоти, такі як гідрогалогенові кислоти, наприклад, соляна й бромводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота й сульфамінові кислоти, або (2) органічні кислоти, такі як оцтова, пропанова, гідроксиоцтова, бензойна, 2гідроксибензойна, 2-оксопропанова, молочна, фумарова, винна, піровиноградна, малеїнова, малонова, яблучна, саліцилова (наприклад, 2 гідроксибензойна), п-аміносаліцилова, ізетіонова, лактобіонова, бурштинова, щавлева й лимонна 96296 10 кислоти; органічні сульфонові кислоти, такі як метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, C 1С6алкілсульфонова, бензолсульфонова птолуолсульфонова й циклогексансульфамінова кислоти. Типовими солями є хлорид, сульфат, бісульфат, мезилат, безилат, езилат, фосфат, оксалат, малеат, сукцинат, цитрат, малонат і/або фумарат. Крім того, в обсяг даного винаходу включені солі сполуки, що відповідає винаходу, утворені з однієї або більше амінокислот, як правило, природних амінокислот, таких як одна з амінокислот, виявлених у білках. Бажано, щоб кислотний противоїон був фізіологічно нешкідливим і нетоксичним або в інших відношеннях фізіологічно прийнятним, якщо солі не використовують у якості проміжного продукту при одержанні з'єднань, коли токсичність несуттєва. Звичайно сполуку (1) будуть уводити у вигляді вільної основи, але підходящі солі включають мезилат (метансульфонова кислота) і НСl. Сполука, що відповідає даному винаходу, включає сольвати, утворені із сполукою, що відповідає даному винаходу, або їх солями, такими як, наприклад, гідрати, алкоголяти й т.п. Фармацевтичну сполуку, що відповідає даному винаходу, необов'язково одержують із прийнятими фармацевтичними носіями й наповнювачами, які будуть вибирати відповідно до прийнятої практики. Таблетки будуть включати наповнювачі, агенти, що ковзають, інертні наповнювачі, зв'язувальні компоненти й т.п. Водні препарати одержують у стерильній формі й, коли вони призначені для доставки шляхом, відмінним від перорального введення, як правило, будуть ізотонічними. Препарати необов'язково включають наповнювачі, такі як наведені в "Handbook of Pharmaceutical Excipients" (Довідник по фармацевтичних наповнювачах) (2005) і включають аскорбінову кислоту й інші антиоксиданти, хелатуючі агенти, такі як EDTA (етилендиамінтетраоцтова кислота), вуглеводи, такі як декстрин, гідроксиалкілцелюлоза, гідроксиалкілметилцелюлоза й/або органічні кислоти, такі як олеїнова кислота або стеаринова кислота. Термін "фармацевтично прийнятний носій", як використовують у даному контексті, означає будьякий матеріал або субстанцію, що входять до складу разом з активним інгредієнтом з метою полегшення його одержання й/або його застосування або поширення в області, яку лікують. Підходящі фармацевтичні носії, призначені для використання в композиціях, що відповідають винаходу, добре відомі компетентним фахівцям в області техніки. Вони включають додаткові компоненти, такі як змочувальні агенти, розпушувачі, зв'язувальні речовини, емульгатори, розчинники, агенти, що ковзають, покриття, антибактеріальні й протигрибкові агенти (наприклад, фенол, сорбінова кислота, хлорбутанол) і ізотонічні агенти (такі як цукри або хлорид натрію), за умови, що вони відповідають фармацевтичній практиці, тобто вони нетоксичні для ссавців. Фармацевтичні композиції, що відповідають даному винаходу, одержують будь-яким відомим способом, наприклад, шляхом гомогенного пере 11 мішування, покриття й/або здрібнювання активних інгредієнтів в одностадійному або багатостадійному способі з використанням обраного матеріалу носія й, при необхідності, інших додаткових агентів, таких як поверхнево-активні агенти. Композиції, що включають сполуку, яка відповідає даному винаходу, виготовлені у вигляді мікросфер (звичайно мають діаметр приблизно 1-10 гм), використовують як препарати з контрольованим або вповільненим вивільненням. В одному необов'язковому препараті сполуку (1) розтирають до одержання тонко здрібненої форми, як правило, до середнього розміру частинок у будь-якій точці, що лежить в інтервалі приблизно 1-20 мікронів. Продукт, що відповідає прикладу 1b, являє собою кристалічні голки й демонструє інтервал розмірів кристала, як правило, приблизно 25-40 мікрон. Його необов'язково мікронізують у струминному млині Jet mill-00 при 2 2 приблизно 60-80 psi (фунт/дюйм , 4320-5760 г/см ) для одержання частинок розміром приблизно 3-4 2 мікрона й площею поверхні приблизно 7-8 м /г. Однак вихідні розміри кристалів будуть варіювати від партії до партії й ступінь мікронізації залежить від вибору. Відповідно мікронізовану сполуку (1) просто визначають як кристалічну або аморфну сполуку (1), що піддана процесу мікронізації, такому як ілюстративний процес, описаний у даному контексті. Ні розмір, ні площа поверхні отриманих у результаті частинок не є важливими. Мікронізовану сполуку (1) суспендують у водному розчині, необов'язково за допомогою суспендуючого агента, емульгаторів і/або поверхнево-активної речовини, як далі описано нижче. Як правило, фармацевтичний препарат являє собою солюбілізовану форму сполуки (1), де сполука (1) розчинена в підходящому розчиннику або солюбілізуючому агенті або їх комбінаціях. Сполуку (1), солюбілізовану в органічному розчиннику, використовують як проміжний продукт для одержання кристалічної сполуки (1), але, як правило, його солюбілізують у фармацевтично прийнятному наповнювачі для лікувального або профілактичного застосування. Підходящі розчини сполуки (1), призначені для фармацевтичних препаратів, включають воду разом з різними органічними кислотами (як правило, С4-С24), звичайно жирними кислотами, такими як капронова, олеїнова, лауринова, пальмітинова й/або міристинова кислота. Жирні кислоти є необов'язково насиченими або ненасиченими або їх сумішами. Крім того, додатково до органічних кислот або замість них використовують поліетиленгліколі (ПЕГ) і/або моно-, ди- або тригліцериди з коротким, середнім або довгим ланцюгом. Пегільовані жирні кислоти з коротким, середнім або довгим ланцюгом також необов'язково використовують у такий же спосіб. Найпоширенішими органічними кислотами є карбонові кислоти, кислотність яких пов'язана з карбоксильною групою -СООН. Сульфонові кислоти, що включають групу OSO3H, є відносно більш сильними кислотами стосовно до даного контексту. Загалом бажано, коли кислота включає ліпофі 96296 12 льний домен. Підходять моно- або дикарбонові кислоти. Підходящі поверхнево-активні агенти необов'язково використовують із кожним із препаратів, що відповідають даному винаходу (будь-який один або більше з наступних агентів, як правило, кожний з них). Дані агенти відомі також як емульгуючі речовини або емульгатори, і їх використовують у фармацевтичних композиціях, що відповідають даному винаходу. Вони є неіоногенними, катіонними й/або аніонними матеріалами, що мають підходящі емульгуючі, диспергуючі й/або змочувальні властивості. Підходящі аніонні поверхневоактивні речовини включають як водорозчинні мила, так і водорозчинні синтетичні поверхневоактивні агенти. Підходящі мила являють собою солі лужних або лужноземельних металів, солі незаміщеного або заміщеного амонію й вищих жирних кислот (С10-С22), наприклад, натрієві або калієві солі олеїнової або стеаринової кислоти або суміші природних жирних кислот, що одержуються з кокосового масла або тваринного жиру. Синтетичні поверхнево-активні речовини включають натрієві або кальцієві солі поліакрилових кислот, жирні сульфонати й сульфати, сульфоновані бензімідазолові похідні й алкіларилсульфонати. Жирні сульфонати або сульфати, як правило, перебувають у формі солей лужних або лужноземельних металів, солей незаміщеного амонію або солей амонію, заміщених алкільним або ацильним радикалом, що має від 8 до 22 атомів вуглецю, наприклад, натрієвої або кальцієвої солі лігносульфонової кислоти або додецилсульфонової кислоти, або суміші сульфатів жирних спиртів, отриманої із природних жирних кислот, солей лужних або лужноземельних металів складних ефірів сірчаної або сульфонової кислот (таких як лаурилсульфат натрію) і сульфонових кислот адуктів жирних спиртів/етиленоксиду. Переважно, коли підходящі сульфоновані бензімідазолові похідні включають 822 атомів вуглецю. Прикладами алкіларилсульфонатів є солі натрію, кальцію або аміноспирту додецилбензолсульфонової кислоти або дибутилнафталінсульфонової кислоти або продукт конденсації нафталін-сульфонової кислоти/формальдегіду. Крім того, підходящими є відповідні фосфати, наприклад солі складного ефіру фосфорної кислоти й продукт приєднання пнонілфенолу до етилен- і/або пропіленоксиду, або фосфоліпіди. Підходящими для даної мети фосфоліпідами є природні (ті, що походять із клітин тварин або рослин) або синтетичні фосфоліпіди типу цефаліну або лецитину, такі як, наприклад, фосфатіділетаноламін, фосфатіділсерин, фосфатіділгліцерин, лізолецитин, кардіоліпін, диоктанілфосфатіділхолін, дипальмітоілфосфатиділхолін і їх суміші. Водні емульсії, що включають дані агенти, входять в обсяг даного винаходу. Придатні неіоногенні поверхнево-активні речовини включають поліетоксильовані й поліпропоксильовані похідні алкілфенолів, жирних спиртів, жирних кислот, аліфатичних амінів або амідів, що містять у молекулі щонайменше 12 атомів вуглецю, алкіларенсульфонатів і диалкілсульфосукци 13 натів, таких як похідні полігліколевого ефіру аліфатичних і циклоаліфатичних спиртів, насичені й ненасичені жирні кислоти й алкілфеноли, причому зазначені похідні включають 3-10 груп гліколевого ефіру й 8-20 атомів вуглецю в алкільній частині алкілфенолу. Крім того, підходящими неіоногенними поверхнево-активними речовинами є водорозчинні адукти поліетиленоксиду з поліпропіленгліколем, етилендиамінполіпропіленгліколь, що включає 1-10 атомів вуглецю в алкільному ланцюзі, причому адукти включають 20-250 груп етиленгліколевого ефіру й/або 10-100 груп пропіленгліколевого ефіру. Дані сполуки, як правило, включають від 1 до 5 структур етиленгліколя/ланку пропіленгліколю. Репрезентативними прикладами неіоногенних поверхневих речовин є нонілфенолполіетоксиетанол, полігліколеві ефіри касторового масла, адукти поліпропілен/поліетиленоксиду, трибутилфеноксиполіетоксиетанол, поліетиленгліколь і октилфеноксиполіетоксиетанол. Складні ефіри жирних кислот і поліетиленсорбіту (такі як поліоксиетиленсорбіт триолеат), гліцерин, сорбіт, сахароза й пентаерітритол також є підходящими неіоногенними поверхнево-активними речовинами. Підходящі катіонні поверхнево-активні речовини включають солі четвертинного амонію, зокрема, галіди, що мають 4 вуглеводневих радикали, необов'язково заміщених гало, фенілом, заміщеним фенілом або гідрокси, наприклад, солі четвертинного амонію, що включають у якості Nзамісника щонайменше один C8-С22алкільний радикал (наприклад, цетил, лаурил, пальмітил, міристил і олеїл) і, у якості подальших замісників, незаміщені або галогеновані нижчі алкільні, бензильні й/або гідрокси-нижчі алкільні радикали. Більше детальний опис поверхнево-активних агентів, що підходять для даної мети, знаходиться в збірнику "McCutcheon's Detergents and Emulsifiers Annual" (Щорічник по детергентах і емульгаторам McCutcheon) (MC Publishing Crop., Ridgewood, New Jersey, 1981), "Tensid-Taschenbucw" (Довідник по поверхнево-активним речовинам), 2 вид. (Hanser Verlag, Vienna, 1981) і "Encyclopaedia of Surfactants" (Енциклопедія поверхнево-активних речовин) (Chemical Publishing Co., New York, 1981). Сполуку, що відповідає даному винаходу, уводять будь-яким шляхом, що відповідає стану, який лікують, таким як пероральний, ректальний, назальний, місцевий (включаючи очний, защічний і під'язичний), вагінальний й парентеральний (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний, внутрішньошкірний, інтратекальний і епідуральний). Кращий шлях введення може варіювати в залежності, наприклад, від стану реципієнта, але, як правило, є пероральним. Препарати сполуки, що відповідає даному винаходу, призначені для перорального введення, як правило, представлені у вигляді окремих одиниць, таких як капсули, крохмальні капсули або таблетки, кожна з яких включає задану кількість активного інгредієнта; у вигляді порошку або гранульованої форми, у вигляді розчину або суспензії у водній рідині або неводній рідині, або у вигляді 96296 14 рідкої емульсії типу масло у воді або рідкій емульсії типу вода в маслі. Сполука, що відповідає даному винаходу, необов'язково представлена у вигляді болюсу, електуарію або пасти. Таблетку одержують пресуванням або формованиям, необов'язково з одним або більше допоміжних інгредієнтів. Пресовані таблетки одержують шляхом пресування в підходящій машині сполуки, що відповідає винаходу, у сипучій формі, такій як порошок або гранули, необов'язково змішаного зі сполучним компонентом, змазуюча речовина, інертний розріджувач, консервант, поверхнево-активний і/або диспергуючий агент. Формовані таблетки, як правило, виготовляють формованиям у придатній машині суміші порошкової сполуки, зволоженим інертним рідким розріджувачем. Таблетки можуть бути необов'язково покритими або мати насічки й можуть бути виготовлені так, щоб забезпечувати в цьому випадку уповільнене або контрольоване вивільнення активного інгредієнта. Препарати необов'язково застосовують у вигляді місцевої мазі або крему, що включають активний інгредієнт(и) у кількості, наприклад, 0,075-20 % мас/мас, (включаючи активний інгредієнт(и) в інтервалі від 0,1 % і 20 % при збільшеннях 0,1 % мас/мас, наприклад, 0,6 % мас/мас, 0,7 % мас/мас, і т.п.), переважно 0,2-15 % мас/мас. І найбільш краще 0,5-10 % мас./мас. При виготовленні у вигляді мазі сполуки використовують із парафінової або мазевої основи, що змішується з водою. Альтернативно сполуку одержують у вигляді крему із кремовою основою типу масло у воді. При необхідності водна фаза кремової основи може включати, наприклад, щонайменше 30 % мас/мас, багатоатомного спирту, тобто спирту, що має дві або більше гідроксильні групи, такі як пропіленгліколь, бутан 1,3-діол, маніт, сорбіт, гліцерин і поліетиленгліколь (включаючи ПЕГ400) і їх суміші. Бажано, коли місцеві препарати можуть включати сполуку, яка підвищує усмоктування або проникнення активного інгредієнта через шкіру або інші уражені області. Приклади даних агентів, що підсилюють проникнення через шкіру, включають диметилсульфоксид і близькі аналоги. Масляна фаза емульсій, що відповідають даному винаходу, складена з відомих інгредієнтів відомим чином. Хоча дана фаза може включати тільки емульгатор (інакше відомий як емульгуючи речовина), бажано, коли вона включає суміш щонайменше один емульгатор з жиром або маслом або з обома, жиром і маслом. Необов'язково гідрофільний емульгатор включають разом з ліпофільним емульгатором, що діє як стабілізатор. Краще також включення як масла, так і жиру. Спільно емульгатор(и) зі стабілізатором(ами) або без них утворять так званий емульгуючий віск, і віск разом з маслом і жиром утворять так звану емульгуючу мазеву основу, що формує масляну дисперсійну фазу кремових препаратів. Вибір підходящих масел або жирів для препарату заснований на досягненні необхідних косметичних властивостей. Так, крем повинен необов'язково бути нежирним, нефарбуючим й здатним до змивання продуктом з підходящою консистенцією, 15 щоб уникнути витікання з тюбиків або інших контейнерів. Можна використовувати одно- або двоосновні складні алкілефіри з нерозгалуженим або розгалуженим ланцюгом, такі як диізоадипат, ізоцетилстеарат, складний пропіленгликолевий диефір кокосових жирних кислот, ізопропілмірістат, децилолеат, ізопропілпальмітат, бутилстеарат, 2етилгексилпальмітат або суміш складних ефірів з розгалуженим ланцюгом, відома як Crodamol CAP, причому три останніх є кращими складними ефірами. Вони можуть бути використані окремо або в комбінації залежно від необхідних властивостей. Альтернативно можна використовувати ліпіди з високою точкою плавлення, такі як білий м'який парафін і/або вазелінове масло або інші мінеральні масла. Препарати, що підходять для місцевого введення в око також включають очні краплі, у яких активний інгредієнт розчинений або суспендований у придатному носії, особливо водному розчиннику для активного інгредієнта. Активний інгредієнт необов'язково присутній у даних препаратах у концентрації 0,5-20 %, краще 0,5-10 %, зокрема, приблизно 1,5 % мас/мас. Препарати, що підходять для місцевого введення в порожнину рота включають коржі, що містять активний інгредієнт в основі зі смаковими добавками, як правило, сахарозою й акацією або трагакантом; пастилки, що містять активний інгредієнт в інертній основі, такий як желатин і гліцерин, або сахароза й акація, і полоскання для порожнини рота, що містять активний інгредієнт у придатному рідкому носії. Препарати для ректального введення можуть перебувати у вигляді супозиторію з придатною основою, що включає, наприклад, масло какао або саліцилат. Препарати, що підходять для назального введення, у яких носій являє собою тверду речовину, включають великий порошок, що має розмір частинок, наприклад, в інтервалі 20-500 мк (включаючи розміри частинок в інтервалі від 20 до 500 мк зі збільшенням 5 мк, наприклад, 30 мк, 35 мк і т.д.), що вводять за допомогою аерозольних або порошкових інгаляторів, численні приклади яких доступні. Підходящі препарати, у яких носій являє собою рідину, призначені для введення як, наприклад, спрей для носа або краплі для носа, включають водні або масляні розчини активного інгредієнта. Препарати, що підходять для вагінального введення, можуть бути представлені у вигляді песаріїв, тампонів, кремів, гелів, паст, пін або препараторів спреїв, що включають на додаток до активного інгредієнта такі носії, як відомі в області техніки як підходящі. Препарати, що підходять для парентерального введення, включають водні й неводні стерильні ін'єкційні розчини, які можуть містити антиоксиданти, буфери, бактеріостатики й розчинені речовини, які роблять препарат ізотонічним із кров'ю перед 96296 16 бачуваного реципієнта, і водні й неводні стерильні суспензії, які можуть включати суспендуючі агенти й згущувачі. Препарати представлені в однодозових або багатодозових контейнерах, наприклад, запечатаних ампулах і флаконах, і можуть зберігатися у висушеному сублімацією (ліофілізованому) стані, що вимагає тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням. Ін'єкційні розчини й суспензії для негайного застосування можна приготувати зі стерильних порошків, гранул і таблеток раніше описаного типу. Сполуку, що відповідає даному винаходу, необов'язково одержують у композиціях з контрольованим вивільненням, у яких вивільнення сполуки контролюється й регулюється, щоб одержати можливість менш частого дозування або поліпшення фармакокінетичного профілю або профілю токсичності сполуки, що відповідає винаходу. Композиції з контрольованим вивільненням одержують відповідно до відомих способів, багато з яких включають одержання активної сполуки з одним або більше полімерних носіїв, таких як поліефір, поліамінокислот, полівінілпіролідон, сополімер етилен-вінілацетату, метилцелюлоза, карбоксиметилцелюлоза й/або протамінсульфат. Швидкість вивільнення лікарського препарату й тривалість дії необов'язково контролюють включенням активного інгредієнта в частки, наприклад, мікрокапсули, полімерної субстанції, такої як гідрогелі, полімолочна кислота, гідроксиметилцелюлоза, поліметилметакрилат і інші вищеописані полімери. Походять також колоїдні системи доставки лікарських препаратів, такі як ліпосоми, мікросфери, мікроемульсії, наночастинки, нанокапсули й т.п. Залежно від шляху введення для фармацевтичної композиції, наприклад, таблеток, можуть вимагатися захисні покриття. Винахід буде повніше зрозумілим з посиланням на наступні приклади, які варто вважати просто ілюстративними, а не обмежуючими обсяг винаходу, як воно заявлено. Приклад 1а Синтез 5-({6-[2,4біс(трифторметил)феніл]пірідазин-3-іл}метил)-2(2- фторфеніл)-5Н-імідазо [4,5-с] піридину. У даному способі виявляють, що диметоксиетан або близькі розчинники, усі з яких мають зага1 2 4 3 1 2 льну формулу R OR O(R O)a , де кожне з R , R , 3 4 R і R незалежно одне від одного обрані з С1С6алкілу й а означає 0 або 1, є більш сприятливими, ніж прийнятий розчинник ДМФ (диметилфор1 2 3 4 мамід). Як правило, кожне з R , R , R і R незалежно одне від одного являють собою С1-С2алкіл і звичайно а означає 0. С1-С6алкіл включає повністю насичені первинні, вторинні або третинні вуглеводневі групи з 1-6 атомами вуглецю, і, таким чином, включають, але без обмеження перерахованим метил, етил, пропіл, бутил і т.п. 17 Сполуки SM ТССА СНСІ3 96296 Мол. маса 128,56 232,41 Кількість 5г 3,62 г 130 мол До розчину комерційно доступного вихідного матеріалу (SM) в СНС3 додають трихлорізоціанурову кислоту (ТССА) при 60C. Потім розчин пе Сполуки S.M. Ядро NaOH(10 %) ДМФ Мол. маса 163 213,2 40 Кількість 5,073 г 6,635 г 1,245 г 320 мол Мол. маса 453,79 500 мкл молі 38,9 15,6 Еквіваленти 1 0,4 ремішують протягом 1,5 годин, прохолоджують і фільтрують через HiFlo-Celite. Фільтрат концертують і сушать у вакуумі. Вихід становить 5,037 р. До розчину ядра (отриманого як описано в літературі) у ДМФ (диметилформаміді) додають NaOH. Потім SM для даної стадії (отриманий на стадії 1) розчиняють у ДМФ (20 мл) і повільно додають до розчину. Реакцію перемішують про Сполуки А DME 2 Н водн. Na2CO3 2, 4-6hcCF фенілборонова кмслота Pd(PPh3)4 18 молі 31,12 31,12 31,12 Еквіваленти 1 1 1 тягом 3 годин, розбавляють водою й екстрагують ЕtOАс. Органічний шар сушать за допомогою Na2SO4- Розчинник видаляють і продукт перекристалізовують з DCM (дихлорметаном). Вихід становить 5,7 р. Моли 0,209 Еквіваленти 1 313 мкл 3 Кількість 95 мг 0,626 3 257,93 80,9 мг 0,313 1,5 1155 12 мг 0,0104 0,05 Сполуку А розчиняють у диметоксиетані (DME). До даного розчину додають 2,4 біс(трифторметил)фенілборонову кислоту й 2 Н водний розчин Nа2СО3. До отриманої в результа 19 96296 20 ті двофазної суміші додають Pd(PPh3)4 і потім реакцію нагрівають при 80C. протягом 72 годин. Реакцію прохолоджують до кімнатної температури й фільтрують через целіт і промивають целіт EtOAc. Фільтрат концентрують у вакуумі. Залишок очищають на 6 г SiO2, використовуючи МеОН/СН2СІ2, щоб елюювати сполуки. Отримана в такий спосіб сполука забруднена PPh3(O). Продукт піддають повторному очищенню на пластині Chromatotron 1 мм із використанням 0-5 % МеОН/СН2Сl2 в 1 % стадіях. Чисті фракції поєднують і концентрують у вакуумі, потім сушать у високому вакуумі протягом 12 годин. Одержують 11,8 мг сполуки (1) вільної основи без домішки PPh3. 1 Дані Н ЯМР-спектроскопії (300 МГц, CD3OD) 6,20 (s, 2) 7,32 (m, 3) 7,52 (m, 1) 7,78 (d, 1) 7,89 (d, 1) 7,95 (s, 2) 8,15 (m, 3) 8,35 (d, 1) 9,12 (s, 1) ЖХ/МС М+Н = 518 Приклад 1b Синтез 5-({6-[2,4біс(трифторметилфеніл1піридазин-3-іл}метил)-2(2-фторфеніл)-5Н-імідазо [4,5-с] піридину Даний приклад спрямований на додатковий спосіб одержання сполуки (1) при використанні наступних схем. Метансульфонову кислоту додають до 2фторбензойної кислоті в реакторі з активною підтримкою охолодження Т 13000-80000) для сполуки (1). Таблиця С Цитотоксичність сполуки (1) у клітинних лініях, що містять реплікон ВГ Сполука 1 2'СМеА Huh-7 lucneob >50 7,26 SL3b >50 3,9 СС50 [мкМ] МН4b >50 16 а HepG2 >50 24,32,1 МТ4 >50 3,51,9 n.d. - не визначено; HSA - людський сироватковий альбумін а Середнє значення СС50 і стандартна помилка, що визначається в щонайменше 4 незалежним експериментам b клітинні лінії, що містять реплікон ВГС Активність сполуки (1) у комбінації з ІФН у відношенні ВГС in vitro Пегільований інтерферон- (ПЕГ-ІФН-) у комбінації з рибавірином представляє сучасний стандарт лікування для ВГС-інфікованих пацієнтів. Дослідження in vitro комбінацій сполуки (1) і IFN- проводять у клітинах з репліконом. Дані аналізують, використовучи матрицю MacSynergy, розроблену Prichard і Shipman. Результати даних досліджень дозволяють припустити адитивну взаємодію між сполукою (1) і ІФН-. Приклад 4 Дані по антивірусній активності, фармакокінетиці й безпеці сполуки (1) на фазі 1 першого випробування на людині на пацієнтах, інфікованих генотипом-1. Рандомізоване випробування двічі сліпим способом з контролем плацебо розробляють із метою оцінки безпеки/переносності, фармакокі нетики й антивірусної активності одноразової (у частині А) і багаторазових (у частині В) доз сполуки (1) (вищеописаний розчин олеїнової кислоти) у пацієнтів із хронічною інфекцією ВГС генотипу 1 (GT-I) без декомпенсованого цирозу. Передбачувані пацієнти мають вік I860 років, не піддавалися лікуванню ВГС і мають загальний хороший стан здоров'я. У закінченій частині А п'ять наступних груп з 6 пацієнтів, що слідують одна за іншою, рандомізують (5:1) для одержання одноразових доз, що підвищуються, сполуки 1 (40, 120, 240, 240-з їжею або 480 мг) або плацебо. У проведеній у цей час частини В рандомізують чотири наступних групи по 12 пацієнтів (10:2), що слідують одна за іншою, для одержання багаторазових зростаючих доз сполуки 1 (40 мг два рази на день, 120 мг два рази на день, 240 мг чотири рази на день, 240 мг два рази на день) або плацебо протягом 8 днів. 35 Тридцять один пацієнт, включений у частину А, мають середній вік 43,6 року, краще чоловічої статі (20/31), білої раси (25/31) і інфіковані або ВГС генотипу-1а (24), або 1b (6). Середнє (інтервал) вихідне вірусне навантаження ВГС стано10 вить 6,6 Log РНК МЕ/мл (5,2-7,3). Одноразові дози сполуки (1) добре переносяться, при цьому не описано ніяких серйозних або обмежуючих лікування шкідливих подій (АЕ). Найпоширенішим АЕ є головний біль. Всі АЕ є м'якими за важкістю за винятком одного випадку головного болю середньої важкості. Відсутні лабораторні патології З або 4, що з'являються при лікуванні. Середній період напівіснування в плазмі сполуки (1) лежить в інтервалі від 10 до 15 годин по всіх групах. Системний вплив зростає приблизно у два рази, коли сполуки (1) уводять із їжею з високим вмістом жиру. Середня концентрація сполуки (1) через 24 години після введення дози 240 мг на голодний шлунок приблизно в 7 разів 96296 36 вища, ніж обумовлене по зв'язуванню білка in vitro значення ЄС50 реплікону ВГС GT-1b. Після впливу одноразової дози максимальний антивірусний ефект спостерігають через 24 години при середньому зниженні, що лежить в інтервалі від 10 0,46 до 1,49 log МЕ/мл РНК ВГС по всіх групах. Індивідуальне зниження рівня РНК ВГС у всіх реципієнтів сполуки (1) лежить в інтервалі від 10 0,19 до 2,54 log МЕ/мл після впливу одноразової дози. Уперше клінічно продемонстрована антивірусна активність сполуки (1). Вплив однієї дози сполуки (1) добре переноситься, демонструє сприятливі властивості РК і високу антивірусну активність. Приклад 5 Активність сполуки (1) у відношенні реплікону ВГС порівнюють із активністю сполуки, що відповідає попередньому рівню техніки (WO 05/063744), сполуки формули (4) Несподівана сполука (1) виявляється приблизно в 330 разів більш активною, ніж сполука формули (4). 37 96296 38 39 96296 40 41 Комп’ютерна верстка А. Крижанівський 96296 Підписне 42 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridazine compounds and use thereof
Автори англійськоюBondy Steven S., Dahl Terrence C., Oare David A., Oliyai, Reza, Tse, Winston, C., Zia, Vahid
Назва патенту російськоюПиридазиновые соединения и их применение
Автори російськоюБонди Стивен С., Дахл Терренце К., Ори Девид А., Олияй Реза, Тси Уинстон К., Зия Вехид
МПК / Мітки
МПК: A61P 31/12, A61K 31/4353, C07D 403/14
Мітки: піридазинові, застосування, сполуки
Код посилання
<a href="https://ua.patents.su/21-96296-piridazinovi-spoluki-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Піридазинові сполуки і їх застосування</a>
Попередній патент: Антивірусні фосфінатні сполуки
Наступний патент: Пристрій для вимірювання рівня наповнення
Випадковий патент: Вибухова суміш












