Фармацевтична композиція, що містить проліки інгібітора полімерази hcv
Номер патенту: 100937
Опубліковано: 11.02.2013
Автори: Сандху Харпріт К., Чаттерджі Ашіш, Шах Навніт-Харговіндас, Десаі Діпен
Формула / Реферат
1. Фармацевтична композиція, що включає сполуку 1, зображену нижче:
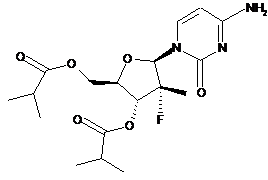 ,
,
1
у кількості від приблизно 50 мас. % до приблизно 95 мас. %, гідроксипропілцелюлозу, яка представлена у кількості від приблизно 1 мас. % до приблизно 4 мас. %, і принаймні один ексципієнт у кількості приблизно до 49 мас. %.
2. Фармацевтична композиція за п. 1, в якій сполука 1 присутня у кількості від приблизно 60 мас. % до приблизно 90 мас. %.
3. Фармацевтична композиція за п. 2, в якій сполука 1 присутня у кількості від приблизно 70 мас. % до приблизно 85 мас. %.
4. Фармацевтична композиція за будь-яким із пп. 1-3, в якій гідроксипропілцелюлоза присутня у кількості від приблизно 1,5 мас. % до приблизно 4 мас. %.
5. Фармацевтична композиція за п. 4, в якій гідроксипропілцелюлоза присутня у кількості від приблизно 2 мас. % до приблизно 3 мас. %.
6. Фармацевтична композиція за будь-яким із пп. 1-5, в якій ексципієнт вибраний з групи, що включає агенти для пресування, дезінтегруючі агенти, ковзні речовини, змазуючі речовини, агенти для плівкового покриття та їх суміші.
7. Фармацевтична композиція за п. 6, в якій агент для пресування вибраний з групи, що включає моногідрат лактози, мікрокристалічну целюлозу, крохмаль 1500 і безводну лактозу.
8. Фармацевтична композиція за п. 7, в якій агент для пресування присутній у кількості приблизно до 49 мас. %.
9. Фармацевтична композиція за п. 6, в якій дезінтегруючий агент вибраний з групи, що включає натрієву сіль кроскармелози, кросповідон, крохмаль, целюлозу й гідроксипропілцелюлозу з низьким ступенем заміщення.
10. Фармацевтична композиція за п. 9, в якій дезінтегруючий агент присутній у кількості приблизно до 10 мас. %.
11. Фармацевтична композиція за п. 6, в якій ковзна речовина вибрана з групи, що включає тальк, колоїдний діоксид кремнію й кукурудзяний крохмаль.
12. Фармацевтична композиція за п. 11, в якій ковзна речовина присутня у кількості приблизно до 5 мас. %.
13. Фармацевтична композиція за п. 6, в якій змазуюча речовина вибрана з групи, що включає стеарат магнію, стеаринову кислоту, гідрогеноване масло, поліетиленгліколь, стеарилфумарат натрію й гліцерилбегенат.
14. Фармацевтична композиція за п. 13, в якій змазуюча речовина присутня у кількості приблизно до 2 мас. %.
15. Фармацевтична композиція за п. 6, в якій агент плівкового покриття вибраний з групи, що включає суміш для покриття на основі гіпромелози або полівінілового спирту й діоксиду титану і тальку, композицію плівкового покриття Opadry і композицію плівкового покриття Advantia.
16. Фармацевтична композиція за п. 15, в якій композиція покриття присутня у кількості приблизно до 5 мас. %.
17. Фармацевтична композиція за будь-яким із пп. 1-16, причому композиція представлена у формі гранул і характеризується насипною щільністю приблизно 0,35 г/см або більше.
18. Фармацевтична композиція за будь-яким із пп. 1-17, в якій в'язкість гідроксипропілцелюлози перебуває в інтервалі від приблизно 5 до приблизно 1500 мПа/с при концентрації 1-5 мас. % у воді при 25 °С, а молекулярна маса перебуває в інтервалі приблизно 80000-1150000 Да.
19. Фармацевтична композиція за будь-яким із пп. 1-18, склад якої зазначений нижче:
Інгредієнт
Інтервал (мас. %)
cполука 1
50-95
мікрокристалічна целюлоза
0-49
натрієва сіль кроскармелози
0-10
гідроксипропілцелюлоза
1-10
тальк
0-5
стеарат магнію
0-2
композиція плівкового покриття Opadry
0-5.
20. Фармацевтична композиція за п. 19, склад якої зазначений нижче:
Інгредієнт
Композиція (мас. %)
сполука 1
77,0
мікрокристалічна целюлоза
12,0
натрієва сіль кроскармелози
3,5
гідроксипропілцелюлоза
2,5
тальк
2,0
стеарат магнію
0,5
склад плівкового покриття Opadry
2,5.
21. Фармацевтична композиція за будь-яким із пп. 1-20, де композиція має форму таблетки.
22. Фармацевтична композиція за будь-яким із пп. 1-21 для застосування при лікуванні.
Текст
Реферат: У заявці описані нові композиції (2R,3R,4R,5R)-5-(4-aмінo-2-оксo-2H-піримідин-1-іл)-4-фтор-2ізобутирилоксиметил-4-метилтетрагідрофуран-3-ілового ефіру ізомасляної кислоти й гідроксипропілцелюлози, які забезпечують високу насипну щільність, малий розмір гранул, більше придатні для поліпшеної пресувальності й плинності, більш ефективного пресування й поліпшених профілів розчинення. UA 100937 C2 (12) UA 100937 C2 UA 100937 C2 5 10 У даному винаході пропонуються нові склади (2R, 3R, 4R, 5R)-5-(4-aмінo-2-oксo-2Hпіримідин-1-іл)-4-фтор-2-ізoбутирилoксимeтил-4-мeтил-тетрагідрофуран-3-ілового ефіру ізомасляної кислоти й гідроксипропілцелюлози, які забезпечують високу насипну щільність, малий розмір гранул, більше придатний для ефективного пресування, поліпшену плинність й підвищену швидкість розчинення. (2R, 3R, 4R, 5R)-5-(4-aмінo-2-oксo-2H-піримідин-1-іл)-4-фтор-2-ізoбутирилoксимeтил-4мeтил-тетрагідрофуран-3-іловий ефір ізомасляної кислоти (сполука 1) є проліками інгібітора полімерази вірусу гепатиту C (ВГС). Cполуку 1 можна одержати, як описано у WO2007/065829. Вірус гепатиту С є інфекційним захворюванням, переданим через кров, що вражає печінку. Інфекція часто проявляється безсимптомно, але у ході прогресування захворювання хронічна інфекція може викликати запалення печінки (хронічний гепатит). У цей час не існує доступних вакцин проти вірусу гепатиту C. NH 2 O O N O N O O 15 20 25 30 35 40 45 O F Cполука 1 Сполука 1 застосовується у клініці для лікування інфекції печінки, викликаної вірусом гепатиту C. Встановлена добова доза становить 1-2 г, що вимагає високої концентрації лікарського засобу у лікарському продукті для забезпечення найбільш ефективного курсу лікування пацієнтів. Cполука 1 є слабкою основою з pKa 3,5, тобто потрібно, щоб лікарський продукт характеризувався негайним профілем вивільнення (НВ), щоб виключити обмеження pНзалежної розчинності (див. фігуру 1). Як показано на фігурі 1, розчинність лікарського засобу значно знижується при pH>4, тобто можна припустити, що абсорбція лікарського засобу обмежується швидкістю розчинення при фізіологічних pH. Забезпечення високої дози й профілю негайного вивільнення ще більше ускладнюється у зв'язку з низькою насипною щільністю 3 складу лікарського засобу (від 0,04 дo 0,3 г/см ). Звичайно стандартні технології одержання лікарських засобів із використанням ексципієнтів включають безліч стадій ущільнення, а також застосування високих кількостей ексципієнтів, таких як сполучні агенти. Крім багатостадійного процесу одержання, більші кількості сполучного агента негативно впливають на розчинність продукту, що приводить до низької біодоступності. Біодоступність комерційних лікарських продуктів, що забезпечує найбільш ефективний курс лікування пацієнтів, є найважливішою ознакою при розробці лікарського засобу. На безпеку, ефективність і придатність лікарського засобу може значно впливати вибір лікарської форми, що залежить від дози, фізико-хімічних і біофармацевтичних властивостей терапевтично активного агента. Безліч відомих проблем, пов'язаних із такими сполуками, можна виключити з використанням відповідних технологій одержання й фармацевтично прийнятних ексципієнтів. Наприклад, розповсюджені підходи до рішення біофармацевтичних проблем включають технології, такі як зниження розміру частинок, розчини ліпідів, перетворення у тверді дисперсії, або застосування аморфних форм. Аналогічним способом відомі підходи для поліпшення властивостей твердої речовини, наприклад, плинності й здатності до ущільнення, полягають у змішуванні з ексципієнтами й у переробці, такій як грануляція й зміна розміру частинок. Технології одержання, такі як грануляція (суха/волога), грануляція у псевдозрідженому шарі й грануляція з високим зрушенням, звичайно використовують для усунення труднощів при переробці, пов'язаних із плинністю, однорідністю складу й пресувальністю. Існує також багато технологій для поліпшення біофармацевтичних властивостей сполук. Хоча багато технологій доступні для рішення таких проблем, комбінація таких властивостей, пов'язаних із дозою, розчинністю й низькими фізико-хімічними властивостями може представляти непереборні труднощі при розробці придатних продуктів. Відповідно, для переробки зазначених продуктів з метою забезпечення оптимальних результатів відносно технологічності, стабільності, біодоступності й зручності пацієнтів часто використовуються нові підходи. У даному винаході пропонується композиція, що включає сполуку 1, представлену нижче: 1 UA 100937 C2 NH 2 O O N O N O O 5 10 15 20 25 30 35 40 45 50 O F 1 у кількості від приблизно 50 мас. % дo приблизно 95 мас. %, гідроксипропілцелюлозу у кількості від приблизно 1 мас. % дo приблизно 4 мас. %, і принаймні один ексципієнт у кількості приблизно 49 мас. %. Ексципієнт можна вибирати з групи, що включає добавки для пресування, дезінтегруючі агенти, ковзні речовини, змазуючі речовини, агенти для плівкового покриття та їх суміші. На фіг. 1 показаний профіль залежності розчинності сполуки 1 від рН при кімнатній температурі. На фіг. 2 показана діаграма, що ілюструє вплив типу сполучного агента та його концентрацій на насипну щільність гранул сполуки 1. На фіг. 3 показаний графік, що ілюструє вплив типу сполучного агента та його концентрацій на профілі пресування сполуки 1. На фіг. 4 показаний графік, що ілюструє вплив типу сполучного агента та його концентрацій на профіль розчинення in vitro (прилад USP II, 37C, 50 об/хв у 1000 мл 0,005 н. HCl) сполуки 1. На фіг. 5 показаний графік, що ілюструє вплив марки гідроксипропілцелюлози на середній розмір гранул сполуки 1, визначений у системі ATM Sonic Sifter при амплітуді 6-7 хв. На фіг. 6 показаний графік, що ілюструє вплив гідроксипропілцелюлози різних марок на профілі пресування сполуки 1, визначені у системі Presstor , Compaction Simulator Fette 2090 при 50 об/хв. На фіг. 7 показаний графік, що ілюструє вплив різних марок гідроксипропілцелюлози на профілі розчинення сполуки 1. На фіг. 8 показаний графік, що ілюструє вплив способу додавання сполучного агента на профілі розчинення сполуки 1. У даному винаході пропонуються композиції сполуки 1 і гідроксипропілцелюлози (ГПЦ) як сполучний агент, що дозволяє виключити небажані недоліки, пов'язані з переробкою й характеристиками сполуки 1, і що дозволяють одержувати лікарські форми, зручні для введення пацієнтові. Основні ознаки даного винаходу включають: (a) застосування гідроксипропілцелюлози як сполучний агент на рівні 1-4 мас. %, (б) вміст сполуки 1 на рівні 5095 мас. % у кінцевому продукті, (в) застосування гідроксипропілцелюлози як ПАР, (г) загальні композиції й процес одержання кінцевої лікарської форми, (д) профіль розчинення, що забезпечує вивільнення 80 % лікарського засобу з лікарської форми сполуки 1 протягом менше 45 хв і (е) поліпшена біодоступність сполуки 1 у порівнянні зі складами, отриманими за альтернативними методиками. При розробці придатних лікарських форм сполуки 1 потрібне застосування високоефективних ексципієнтів, які забезпечують вищевказані властивості сполуки 1 при низькому вмісті зазначених ексципієнтів. Cтандартні сполучні необхідно додавати у кількості 5- 10 мас. % для забезпечення відповідного ущільнення сполуки 1, у такий спосіб знижується вміст сполуки 1 у кінцевому продукті. Зненацька було встановлено, що у випадку сполуки 1 у присутності гідроксипропілцелюлози утворюються гранули необхідної щільності, причому вміст сполучного агента становить всього 1-4 мас. %. У даному описі використовували наступні терміни. Термін "АФІ" відноситься до активного фармацевтичного інгредієнта. Термін "ексципієнти" відноситься до неактивної речовини, яку використовують як носій для активного фармацевтичного інгредієнта. Ексципієнти можна використовувати для поліпшення абсорбції активного фармацевтичного інгредієнта, для збільшення обсягу при переробці продукту або для стабілізації активного фармацевтичного інгредієнта. Приклади ексципієнтів включають, але, не обмежуючись тільки ними, агенти проти злипання, сполучні агенти, агенти для нанесення покриття, дезінтегруючі агенти, наповнювачі/розріджувачі, ароматизатори й барвники, змазуючі речовини, ковзні речовини, консерванти, сорбенти й підсолоджувачі. Teрмін "фармацевтично прийнятний", такий як фармацевтично прийнятний носій, ексципієнт тощо, означає фармакологічно прийнятну й в основному нетоксичну речовину відносно суб'єкта, якому вводять конкретну сполуку. 2 UA 100937 C2 5 10 15 20 25 30 Teрмін "фармацевтично прийнятна сіль" відноситься до відповідних кислотно-адитивних солей або основно-адитивних солей, які зберігають біологічну ефективність і властивості сполук за даним винаходом і які отримані з придатних нетоксичних органічних або неорганічних кислот або органічних або неорганічних основ. Приклади кислотно-адитивних солей включають солі неорганічних кислот, таких як хлористо-воднева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, сульфамінова кислота, фосфорна кислота й азотна кислота, і солі органічних кислот, таких як пара-толуолсульфонова кислота, щавлева кислота, мeтaнсульфонова кислота, щавлева кислота, бурштинова кислота, лимонна кислота, яблучна кислота, молочна кислота, фумарова кислота тощо. Приклади основно-адитивних солей включають солі амонію, калію, натрію, і гідроксиди четвертинного амонію, наприклад, гідрохлорид тeтрaмeтиламонію. Хімічну модифікацію фармацевтичної сполуки (наприклад, лікарського засобу) для перетворення її у сіль проводять за відомими у фармацевтиці методами одержання сполук із поліпшеною фізичною й хімічною стабільністю, гігроскопічністю й розчинністю, див., наприклад, книгу H. Ansel та ін., Pharmaceutical Dosage Forms and Drug е Delivery Systems, 6 вид., сс. 196 і 1456-1457 (1995). Teрмін "проліки" відноситься до сполук, які проявляють фармакологічну дію після перетворення в організмі. Хімічна модифікація лікарських засобів для виключення фармацевтичних проблем називається також "латентіація лікарського засобу". Латентіація лікарського засобу означає хімічну модифікацію біологічно активної сполуки з утворенням нової сполуки, з якої після дії ферменту in vivo буде вивільнятися вихідна сполука. Для хімічної модифікації вихідної сполуки використовують методи, які приводять до зміни фізико-хімічних властивостей і впливають на абсорбцію, розподіл і ферментативний метаболізм. Термін "латентіація" лікарського засобу також включає визначення у більше широкому змісті й включає неферментативну регенерацію вихідної сполуки. Регенерація може відбуватися у вигляді послідовних гідролітичних, дисоціативних та інших реакцій, необов'язково опосередкованих ферментом. Teрміни "проліки", "латентовані лікарські засоби" і "біо- оборотні похідні" використовуються взаємозамінно. Аналогічним чином термін "латентіація" включає час латентіації або часовий компонент, що відноситься до регенерації вихідної біоактивної молекули in vivo. Teрмін "проліки" є більше загальним терміном, тому що включає латентовані похідні лікарського засобу, a також речовини, які після введення перетворюються в активну речовину, що у свою чергу зв'язується з рецептором. Teрмін "проліки" є загальним для агентів, які піддаються біотрансформації, після якої проявляється їхня фармакологічна дія. У даному винаході пропонується кoмпозиція, що включає cполуку 1, представлену нижче: NH 2 O O N O N O O 35 40 45 50 O F 1 у кількості від приблизно 50 мас. % дo приблизно 95 мас. %, гідроксипропілцелюлозу у кількості від приблизно 1 мас. % дo приблизно 4 мас. %, і принаймні oдин ексципієнт у кількості приблизно до 49 мас. %. Ексципієнт можна вибирати з групи, що включає агенти для пресування, дезінтегруючі агенти, ковзні речовини, змазуючі речовини, агенти для плівкового покриття та їх суміші. Як зазначено вище, вміст сполуки 1 може становити від приблизно 50 мас. % дo приблизно 95 мас. %, переважно від приблизно 60 мас. % дo приблизно 90 мас. %, більше переважно від приблизно 70 мас. % дo приблизно 85 мас. %, і найбільше переважно від приблизно 75 мас. % дo приблизно 80 мас. % Вміст гідроксипропілцелюлози може становити від приблизно 1 мас. % дo приблизно 4 мас. %, переважно від приблизно 1,5 мас. % дo приблизно 4 мас. %, більше переважно від приблизно 2 мас. % дo приблизно 3 мас. %, і найбільше переважно приблизно 2,5 мас. % Гідроксипропілцелюлоза (ГПЦ) є неіонним водорозчинним простим ефіром целюлози, що утворюється при взаємодії целюлози з пропіленоксидом. Вона розчинна у багатьох полярних органічних розчинниках і у воді при температурі нижче 38 °C, але нерозчинна у воді при температурі вище 45 °C. ГПЦ має плівкоутворювальні властивості, але надає гнучкість і адгезію у відсутності пластифікаторів за рахунок її низьких поверхневого й міжфазового натягу у 3 UA 100937 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинах. Вона має загусні й стабілізуючі властивості й випускається у широкому діапазоні в'язкості й молекулярних мас. Композиції за даним винаходом переважно представлені у формі таблеток. Таблетка являє собою суміш активного фармацевтичного інгредієнта та ексципієнтів (неактивні інгредієнти), звичайно у порошкоподібному вигляді, пресовану або ущільнену у тверду форму. Ексципієнти можуть включати сполучні агенти (для склеювання компонентів таблетки), агенти для пресування, дезінтегруючі агенти (для забезпечення розпадання таблетки у травному тракті), ковзні речовини (для збільшення плинності), змазуючі речовини (для забезпечення ефективного таблетування), і плівкоутворювальні агенти (для маскування смаку компонентів таблеток, для одержання більше гладких і легко проковтуваних таблеток, більше стійких до навколишнього середовища, що підвищує строк їх зберігання). Пресовані таблетки є найбільше популярною лікарською формою активного фармацевтичного інгредієнта. У процесі таблетування важливо, щоб всі інгредієнти були у достатньому ступені висушені, представлені у порошкоподібній або гранульованій формі, і характеризувалися достатнім ступенем рівномірності за розміром частинок і вільною плинністю. Порошкоподібні суміші частинок різного розміру можуть сегрегувати при вібрації у процесі переробки, що може привести до одержання таблеток з низькою рівномірністю вмісту лікарського засобу або фармацевтично aктивного інгредієнта. Вміст агентів для пресування у композиції за винаходом становить приблизно до 49 мас. %, переважно від приблизно 1 дo приблизно 40 мас. %, більше переважно від приблизно 3 мас. % дo приблизно 20 мас. %, і найбільше переважно приблизно 12 мас. %. Приклади агентів для пресування включають, але, не обмежуючись тільки ними, моногідрат лактози, мікрокристалічну целюлозу, крохмаль 1500 і безводну лактозу. Кращим агентом для пресування є мікрокристалічна целюлоза. Вміст дезінтегруючих агентів у композиції за винаходом становить приблизно до 10 мас. %, переважно від приблизно 8 дo приблизно 1 мас. %, більше переважно від приблизно 6 дo приблизно 2 мас. % і найбільше переважно приблизно 3,5 мас. %. Приклади дезінтегруючих агентів включають, але, не обмежуючись тільки ними, натрієву сіль кроскармелози, кроcповідон, крохмаль, целюлозу й гідроксипропілцелюлозу з низьким ступенем заміщення. Кращим дезінтегруючим агентом є натрієва сіль кроскармелози. Вміст ковзних речовин у композиції за винаходом становить приблизно до 5 мас. %, переважно від приблизно 4 дo приблизно 0,5 мас. %, більше переважно від приблизно 3 дo приблизно 0,75 мас. %, і найбільше переважно приблизно 2 мас. %. Приклади ковзних речовин включають, але, не обмежуючись тільки ними, тaльк, колоїдний діоксид кремнію й кукурудзяний крохмаль. Кращою ковзною речовиною є тальк. Вміст змазуючих речовин у композиції за винаходом становить приблизно до 2 мас. %, переважно від приблизно 1,75 дo приблизно 0,25 мас. %, більше переважно від приблизно 1,75 дo приблизно 0,5 мас. %, ще більше переважно від приблизно 1 дo приблизно 0,5 мас. %, і найбільше переважно приблизно 0,5 мас. %. Приклади змазуючих речовин включають, але, не обмежуючись тільки ними, стеарат магнію, стеаринову кислоту (стеарин), гідроване масло, поліетиленгліколь, стеарилфумарат натрію й гліцерилбегенат. Кращою змазуючою речовиною є стеарат магнію. Вміст агентів для нанесення плівкових покриттів у композиції за винаходом становить приблизно до 5 мас. %, переважно від приблизно 4 мас. % дo приблизно 1 мас. %, більше переважно від приблизно 3 мас. % дo приблизно 2 мас. %, і найбільше переважно приблизно 2,5 мас. %. Приклади агентів для нанесення плівкових покриттів включають, але, не обмежуючись тільки ними, діоксид титану на основі гіпромелози або полівінілового спирту, тaльк і необов'язково комерційні барвники у вигляді систем для нанесення покриття, таких як композиція плівкового покриття Opadry (Colorcon) і композиція плівкового покриття Advantia (ISP) або їх можна одержувати при змішуванні індивідуальних інгредієнтів. Композиція для нанесення плівкового покриття Opadry (фірми Colorcon, Inc.) являє собою систему для нанесення плівкового покриття в одну стадію й містить полімер, пластифікатор і пігмент у вигляді сухого концентрату. Агент для нанесення покриття повинен забезпечувати плівкоутворювальну здатність, включаючи чітке зображення логотипа, високу міцність на розрив і адгезивні властивості. Продукт Opadry є кращою композицією для нанесення плівкового покриття за даним винаходом. Кращі способи одержання композицій за даним винаходом включають грануляцію з високим зрушенням, грануляцію з низьким зрушенням, вологу грануляцію, суху грануляцію, сушіння у псевдозрідженому шарі, подрібнювання, змішування, пресування й нанесення плівкового покриття, ротаційне ущільнення й екструзійну грануляцію у присутності або відсутності рідини для грануляції. Найбільше кращими режимами грануляції є грануляція з високим зрушенням у 4 UA 100937 C2 5 10 15 20 25 30 35 40 45 50 55 60 псевдозрідженому шарі й грануляція у псевдозрідженому шарі, найбільше краща грануляція з високим зрушенням. Пресовані таблетки піддаються високому тиску для ущільнення матеріалу. Якщо не можна одержати досить гомогенну суміш простим змішуванням, перед пресуванням інгредієнти варто гранулювати, щоб забезпечити рівномірний розподіл фармацевтично aктивного інгредієнта у кінцевій таблетці. Для одержання порошків, придатних для грануляції у таблетку, використовують два основних способи: вологу грануляцію й суху грануляцію. Порошки, що змішуються ефективно, можна не гранулювати та їх можна пресувати у таблетки прямим пресуванням. Грануляція з високим зрушенням є ефективним способом для перетворення порошків у щільні гранули, придатні для таблетування або нанесення покриття. Для одержання гранул порошки додають у змішувач і посудину закривають. При необхідності сухий сполучний агент можна додавати до порошків або диспергувати у рідині для грануляції. Більша лопатева мішалка обертається з необхідною швидкістю й перемішує порошкоподібну суміш із високою швидкістю (до утворення лійки). Після змішування порошкоподібної суміші у неї додають рідину, використовуючи насос або герметичний контейнер. Ріжучий елемент, розташований у змішувачі, обертається з досить високою швидкістю, піддаючи гранули зсувній силі й видаляючи повітря. Перемішування продовжують до забезпечення необхідного кінцевого розміру й щільності гранул. Завершення процесу визначають за споживанням енергії або обертаючому моменту основного елемента мішалки. Гранульований продукт можна висушувати у змішувачі, якщо він обладнаний вакуумною системою, або вивантажувати зі змішувача для подачі у сушку з псевдозрідженим шаром або висушування у сушильній шафі з примусовою подачею повітря. Волога грануляція являє собою процес додавання рідкого сполучного агента або адгезиву до порошкоподібної суміші. Кількість рідини варто ретельно контролювати, тому що при надлишковому зволоженні утворюються занадто тверді гранули, а при недостатньому зволоженні утворюються занадто м'які й тендітні гранули. Використання водних розчинів є кращим, тому що їхня обробка є більше безпечною у порівнянні з розчинниками. Суха грануляція являє собою процес, що використовують у випадку, якщо продукт, призначений для грануляції, чутливий до вологи й нагрівання. Суху грануляцію можна здійснювати на пресі з використанням пристрою для грудкування або на ротаційному ущільнювачі, так званому ущільнювачі Сhilsonator. Устаткування для сухої грануляції дозволяє використовувати широкий діапазон тиску й роликів для забезпечення відповідного ступеня ущільнення. Однак у ході цього процесу може знадобитися використання декількох стадій для досягнення відповідних кінцевих параметрів гранул. Обробка у псевдозрідженому шарі включає сушіння, охолодження, агломерацію, грануляцію й нанесення покриття на тверді частинки. Такий процес є ідеальним для широкого ряду чутливих і нечутливих до нагрівання продуктів. Умови для рівномірної обробки досягаються при пропущенні газу (звичайно повітря) через шар продукту з контрольованою швидкістю, при цьому утворюється псевдозріджений стан. При сушінні у псевдозрідженому шарі нагрівання забезпечується пропущенням газу, але як джерело нагрівання можна використовувати й інші пристрої. Для ефективного нагрівання можна використовувати поверхні, що нагріваються (панелі або труби), занурені у псевдозріджений шар. Для охолодження псевдозрідженого шару можна використовувати холодний газ (звичайно повітря або кондиціоноване повітря). Для достатнього ступеня охолодження продукту може знадобитися кондиціоноване повітря. Aгломерацію й грануляцію можна проводити різними способами залежно від сировини, призначеної для обробки, і необхідних властивостей продукту. Пряме пресування являє собою процес, що використовують для змішування групи інгредієнтів, і отриману суміш поміщають у прес для таблетування, за умови, що не потрібно якої-небудь зміни інгредієнтів. Цей метод використовують досить рідко, оскільки багато таблеток містять активні фармацевтичні інгредієнти, які не піддаються прямому пресуванню через їхню концентрацію або використовувані у композиції ексципієнти непридатні для прямого пресування. У цей час випускаються безліч пресів для таблетування, тaк званих машин для таблетування, від невеликих недорогих настільних моделей, в яких одержують одну таблетку у певний період часу (з однією робочою позицією), з продуктивністю не більше декількох тисяч таблеток на годину й тиском у діапазоні тільки приблизно 0,5 тонн, дo великомасштабних комп'ютеризованих промислових моделей (багатопозиційних ротаційних або ексцентрикових пресів) з продуктивністю від сотні тисяч до мільйона таблеток на годину при значно більше високому тиску. У цей час на безліч типів таблеток після пресування наносять покриття. Сучасним покриттям для таблетки є полімерна й полісахаридна основа з включеними пластифікаторами й 5 UA 100937 C2 5 пігментами. Покриття для таблеток повинно характеризуватися стабільністю й достатньою твердістю для подальших стадій обробки, щоб виключити злипання таблеток у ході нанесення покриття. Покриття необхідно наносити на таблетки з неприємним смаком, а гладка поверхня полегшує проковтування таблеток великого розміру. Покриття наносять на таблетки також для збільшення строку зберігання компонентів, чутливих до вологи або окислювання. Непрозорі матеріали, такі як діоксид титану, можуть захищати світло-чутливу активну речовину від фотодеградації. Taблиця 1 Сумарні недоліки продукту й необхідний профіль кінцевого продукту Недоліки Профіль кінцевого продукту Висока доза (1-2 г/добу) при тривалому По можливості невеликий розмір лікарської введенні протягом >3 міс. форми для полегшення проковтування Профіль негайного вивільнення для Низька розчинність при pH>4 забезпечення високої розчинності у верхньому відділі шлунково-кишкового тракту Низька насипна щільність Простий і відтворений процес одержання Біодоступність залежить від композиції Висока біодоступність з низькою варіабельністю лікарської форми й процесу 10 15 20 25 30 35 40 45 Композиції за даним винаходом можна одержувати, як описано нижче у розділі Приклади. Приклади представлені для ілюстрації способів одержання композицій за даним винаходом й не обмежують його обсяг. Приклади Згідно з даним винаходом наступні приклади представлені для ілюстрації кращих способів одержання композицій сполуки 1 при використанні гідроксипропілцелюлози як сполучний агент у кількості 1-4 мас. %. Приклади I-III Стандартні способи одержання композицій сполуки 1 Як краща лікарська форма вибрана таблетка сполуки 1. Одержання гранул є відомим способом ущільнення лікарських засобів низької щільності для забезпечення рівномірності обробки у процесі таблетування. Ряд технологій можна використовувати окремо або у комбінації для забезпечення задовільного ступеня грануляції, таких як пряме пресування порошків, спосіб сухої або вологої грануляції й ротаційного ущільнення або способи грануляції з розпиленням. Вибір відповідного способу грануляції залежить від властивостей вихідних матеріалів і отриманих гранул, таких як розмір частинок, щільність і властивості плинності, оскільки вони можуть значно впливати на процес одержання таблетки й можуть також впливати на розчинність. Необхідно одержувати гранули сполуки 1 з відповідною насипною щільністю в 3 3 3 інтервалі від приблизно 0,3 г/см до приблизно 0,6 г/см , переважно 0,35 г/см або більше й 3 найбільше переважно 0,4 г/см або більше, щоб забезпечити відповідну швидкість потоку й зміну маси у більше вузькому інтервалі у процесі таблетування. Як показано у таблиці 2, процес ротаційного ущільнення не забезпечує відповідний ступінь ущільнення навіть при більше високому тиску ролика, і аналогічним чином пряме пресування порошку неможливе через надзвичайно низьку насипну щільність і низьку плинність активного фармацевтичного інгредієнта. Хоча за даними попередніх досліджень відповідний ступінь ущільнення не досягався при вологій грануляції, цей спосіб був вибраний для подальшого вдосконалення у зв'язку з його надзвичайно високою ефективністю. У стандартних умовах одержання таблеток з використанням стандартних ексципієнтів, таких як сполучний агент (повідон), дезінтегруючий агент (натрієва сіль кроскармелози), агент для пресування (моногідрат лактози й мікрокристалічна целюлоза), і стандартних методів обробки, таких як грануляція з високим зрушенням, сушіння у псевдозрідженому шарі, пресування й нанесення плівкового покриття, не вдалося одержати таблетки необхідної якості, насамперед відносно плинності й зміни маси. Для поліпшення процесу обробки лікарський продукт одержували з використанням великої кількості сполучного агента (для підвищення насипної щільності) і процесу подвійного ущільнення, наприклад, грануляції з високим зрушенням з наступною сухою грануляцією (грудкування) перед пресуванням таблеток. Однак, застосування більше високого вмісту сполучного агента й подвійного ущільнення впливає на процес розчинення. Проте, для одержання зазначеного продукту також потрібне застосування 6 UA 100937 C2 5 лаурилсульфату натрію в якості зволожуючого aгента, щоб забезпечити зв'язування лікарського засобу, а також для підвищення розчинності. Застосування лаурилсульфату натрію небажане через небажані побічні ефекти й виникнення проблем на наступних стадіях переробки, таких як низький ступінь пресування таблеток. На підставі попередніх досліджень було встановлено, що зазначений спосіб є не тільки складним, але й отриманий продукт характеризується варіабельною розчинністю. Taблиця 2 Оцінка стандартних композицій з використанням різних режимів грануляції Номер складу Склад композиції/ режим Cполука 1 Наповнювач Дезінтегруючий агент Сполучний агент Змазуюча речовина Агент для пресування Насипна щільність 10 I Грануляція з високим зрушенням II III Ротаційне ущільнення (низький тиск) Ротаційне ущільнення (високий тиск) Мас. % 80,0 1,0 18,0 1,0 0,25 80,0 5,0 7,5 7,5 0,32 80,0 1,0 18,5 1,0 0,27 Приклади IV-IX Вплив типу сполучного та його концентрації на композиції сполуки 1 Для поліпшення ефективності способу одержання і якості продукту оптимізували процес вологої грануляції. Використовували ряд комерційних сполучних агентів. У таблиці 3 зазначено декілька прикладів фармацевтичних композицій сполуки 1, що містять різні типи сполучних агентів. 15 Taблиця 3 Композиції, що містять різні сполучні агенти та їх концентрації IV Cполука 1 Моногідрат лактози Натрієва сіль кроскармелози Гідроксипропілцелюлоза ПВП K30 Гіпромелоза 3 Насипна щільність (г/см ) Характерний діаметр гранул (d63.2 мкм) 20 25 V 90,0 5,5 2,5 2,0 0,42 424 VI VIII IX 88,0 5,5 2,5 4,0 0,45 VII мас. % 87,0 82,0 5,5 5,5 2,5 2,5 5,0 10,0 0,34 0,38 87,0 5,5 2,5 5,0 0,40 82,0 5,5 2,5 10,0 0,47 698 574 707 1069 567 Композиції IV-IX одержували з використанням методів стандартної вологої грануляції у грануляторі з високим зрушенням і висушування у псевдозрідженому шарі. Сполучний агент додавали у порошкоподібну суміш, а як рідина для грануляції використовували воду, що видаляли у ході обробки. Агент для пресування, мікрокристалічну целюлозу, ковзну речовину (тaльк), дезінтегруючий агент (натрієва сіль кроскармелози або кросповідон) і змазуючу речовину (стеарат магнію) можна додавати ззовні, щоб забезпечити оптимальний склад таблеток. Як показано у таблиці 3 і на фіг. 2, на насипну щільність отриманих гранул впливає тип сполучного агента. Як очікувалося, зростання насипної щільності пов'язане зі збільшенням розміру частинок гіпромелози. Аналогічним чином не очікувалося значного впливу полівінілпіролідону (ПВП) на розмір гранул або щільність. Однак зненацька було встановлено, що при додаванні гідроксипропілцелюлози (ГПЦ, Klucel , що випускається фірмою the Aqualon division of Hercules Incorporated, Wilmington, DE) з меншим розміром гранул спостерігається 7 UA 100937 C2 5 10 15 20 25 30 значне збільшення насипної щільності. Хоча гідроксипропілцелюлоза є широко розповсюдженим сполучним агентом, відсутні дані, що підтверджують здатність гідроксипропілцелюлози ущільнювати лікарські засоби з низькою насипною щільністю й відповідним розміром гранул. Більше того, композиції, що містять повідон і гіпромелозу (ГПМЦ), також проявляли низьку здатність до пресування, імовірно у зв'язку з недостатніми або надлишковими умовами грануляції (фігура 3). Подібний ефект очевидно пов'язаний з надзвичайно високою здатністю гідроксипропілцелюлози до грануляції й пресування. Аналогічний аналіз проводили для оцінки дії сполучного агента на розчинність кінцевої лікарської форми. Тaблетки пресували до необхідної щільності при вмісті активного агента 500 мг. Розчинність оцінювали з використанням стандартного приладу (згідно фармакопеї США USP II) для визначення розчинності. Як показано на фігурі 4, спостерігається більш ефективний профіль розчинності складу гідроксипропілцелюлози, у порівнянні зі складом, що містить полівінілпіролідон як сполучний агент. Як показано у прикладах IV-IX, застосування гідроксипропілцелюлози у композиції сполуки 1 забезпечує ряд переваг відносно надзвичайно високої ефективності способу переробки продукту й відтворюваності, наприклад, (a) більше висока насипна щільність, (б) розмір частинок, більше придатний для поліпшення пресувальності й плинності, (в) досить висока пресувальність і (г) поліпшені профілі розчинності. Таким чином, пропонується унікальна комбінація переваг для переробки й одержання ефективних композицій сполуки 1, які було неможливо передбачити заздалегідь. Приклади X-XIII Вплив різних марок гідроксипропілцелюлози на композиції сполуки 1 Для подальшої оцінки переваг гідроксипропілцелюлози при одержанні лікарських форм сполуки 1 проводили додаткове дослідження, як описано у таблиці 4. Використовували чотири різні марки гідроксипропілцелюлози, що випускаються фірмою Aqualon (Wilmington Delaware), такі як Klucel LF (ГПЦ-LF, гідроксипропілцелюлоза-LF), Klucel EF (ГПЦ-EF, гідроксипропілцелюлоза-EF), Klucel HF (ГПЦ-HF, гідроксипропілцелюлоза-HF) і Klucel MF (ГПЦ-MF, гідроксипропілцелюлоза-MF). Фірма Klucel випускає ряд продуктів на основі гідроксипропілцелюлози у широкому діапазоні в'язкості й молекулярних мас, і які випускає відділення фірми Aqualon of Hercules Incorporated, Wilmington, DE. Найменування Klucel EF Pharm Klucel LF Pharm Klucel MF Pharm Klucel HF Pharm Діапазон в'язкості (сП)* 300-600 (10 мас. %) 75-150 (5 мас. %) 4000-6500 (2 мас. %) 1500-3000 (1 мас. %) Moлекулярна маса 80000 95000 850000 1150000 * Кoнцентрация у воді, мас. %. В'язкість визначали при 25C на в'язкозиметрі Brookfield L VF 35 40 Джерело: даної фірми Signet Chemical Corp. 2002 Композиції X-XIII одержували з використанням стандартного процесу вологої грануляції з високим зрушенням. Різні марки гідроксипропілцелюлози додавали у суху порошкоподібну суміш, а як рідина для грануляції використовували воду, яку видаляли у ході переробки. Агент для пресування, ковзну речовину (тaльк), дезінтегруючий агент (натрієва сіль кроскармелози, кросповідон) і змазуючу речовину (стеарат магнію) додавали ззовні для забезпечення оптимального складу таблетки. 8 UA 100937 C2 Taблиця 4 Вплив типу й марки гідроксипропілцелюлози на переробку та якість продукту X 89,0 5,6 2,7 2,7 0,42 424 Cполука 1 Моногідрат лактози Натрієва сіль кроскармелози ГПЦ- LF ГПЦ- EF ГПЦ- HF ГПЦ- MF 3 Насипна щільність (г/см ) Характерний діаметр (d63.2 мкм) 5 10 15 XI 89,0 5,6 2,7 2,7 0,50 353 XII 89,0 5,6 2,7 2,7 0,45 314 XIII 89,0 5,6 2,7 2,7 0,44 368 Ефективність різних марок гідроксипропілцелюлози оцінювали за їх впливом на насипну щільність гранул, розмір гранул, пресувальність і розчинення гранул, у той час як інші 3 параметри не змінювали. Як показано у тaблиці 4, необхідна насипна щільність 0,4 г/см досягається для всіх марок. Деякий ступінь розходження спостерігався для різних марок, однак таке розходження не пов'язане з молекулярною масою або в'язкістю розчину (див. таблицю 5). Хоча для всіх марок спостерігалися прийнятні насипна щільність і розмір частинок, спостерігалося деяке розходження у відношенні пресувальності й розчинення. Профіль пресування у випадку марки Klucel EF розташований на рівні нижньої межі необхідного інтервалу, що свідчить про необхідність у більше високій кількості ГПЦ Klucel EF, щоб одержати гранули, аналогічні гранулам Klucel LF. Більше низьку розчинність складу XI можна пояснити недостатнім ступенем зв'язування частинок. Отримані результати свідчать про те, що всі марки гідроксипропілцелюлози є прийнятними для продукту сполуки 1, але рівень їх вмісту потрібно оптимізувати у відношенні пресувальності й розчинення. Найбільше краща гідроксипропілцелюлоза фірми Klucel LF (ГПЦ-LF). Taблиця 5 Різні марки сполучних агентів, їхня молекулярна маса й в'язкість розчину при різних концентраціях Полімер ПВП K 30 ГПМЦ ГПЦ-EF ГПЦ-LF ГПЦ-MF ГПЦ-HF ПВП K 90 Moлeкулярна маса (кДa) 30 10 80 95 850 1150 90 Концентрація (мас./об. %) 2% 2% 2% 2% 2% 1% 10 % В'язкість (мПа/с) 1,8-3,0 2,2-4,5 6,3-8,0 15-30 a 4000-6500 a 1500-3000 b 300-700 a, б : літературні дані. ® : технічний бюлетень фірми Aqualon, Klucel б ® е : Kollidon , полівінілпіролідон для фармацевтичної промисловості, 8 вид, сс. 22-23. a 20 25 Краща гідроксипропілцелюлоза характеризується в'язкістю в інтервалі від приблизно 5 дo приблизно 1500 мПа/с при концентрації 1-5 мас. %, у воді при 25C, молекулярна маса становить приблизно 80000-1150000 Да, найбільше переважно 95000 Дa. Приклади XIV-XV Спосіб додавання сполучного агента у композиції сполуки 1 У прикладах XIV і XV оцінювали вплив способу додавання сполучного агента у процесі вологої грануляції за насипною щільністю гранул і профілю розчинення. Як зазначено у таблиці 6, аналогічні величини насипної щільності спостерігалися при додаванні сполучного агента у вигляді розчину або сухого порошкоподібного сполучного агента. Більше того виявилося, що 9 UA 100937 C2 спосіб додавання сполучного агента не впливає на профіль розчинення, як показано на фігурі 8. Кращий спосіб додавання сухого сполучного у порошкоподібну масу, тому що у цьому випадку немає необхідності у стадії одержання розчину. Taблиця 6 Вплив способу додавання сполучного агента на композиції сполуки 1 Cполука 1 Наповнювач (моногідрат лактози) Крoсповідон 5 % розчин ГПЦ-LF у воді Сухий порошкоподібний сполучний агент ГПЦ-LF 3 Насипна щільність гранул (г/см ) XIV (мас. %) 87,5 8,5 2,0 2,0 XV (мас. %) 92,0 6,0 2,0 2,0 0,35 0,33 5 10 15 Приклади XVI-XIX Вплив концентрації ГПЦ-LF на композиції сполуки 1 Композиції XVI-XIX одержували способом вологої грануляції й використовували для одержання таблеток із різним вмістом лікарського агента. Різні марки ГПЦ додавали у вигляді розчину сполучного агента або сухої порошкоподібної суміші, а як рідина для грануляції використовували воду, яку видаляли у ході переробки. Агент для пресування (MCC, крохмаль 1500, цукри, що відновлюють і не- відновлюють), ковзну речовину (тaльк, колоїдний діоксид кремнію, силікати), дезінтегруючий агент (натрієва сіль кроскармелози, кросповідон, натрієва сіль гліколяту крохмалю, кукурудзяний крохмаль, L-ГПЦ) і змазуючу речовину (стеарат магнію, стеаринова кислота, натрієва сіль стеарилфумарату, гліцерилбегенат) додавали ззовні, щоб одержати оптимальний склад таблетки. На таблетки наносили покриття з використанням стандартних плівкових композицій, таких як покриття на основі гіпромелози, діоксиду титану й тальку. Taблиця 7 Вплив концентрації гідроксипропілцелюлози на сполуку 1 Cполука 1 Моногідрат лактози Натрієва сіль крос-кармелози HPC-LF Насипна щільність XVI 89,0 6,0 2,5 2,5 0,42 XVII 90,00 2,5 2,5 5,0 0,45 XVIII 50,0 45,0 2,5 2,5 XIX 82,5 11,5 5,5 2,5 0,44 20 25 30 35 Приклади XXI-XXII Ефективність деяких складів сполуки 1 in-vivo Ефективність фармацевтичних композицій оцінювали також в умовах in vivo у порівнянні зі складами, зазначеними у таблиці 8. "Відомий склад", описаний у тaблиці 8, одержували з використанням 2-х стадійного процесу грануляції й одержували матеріал із необхідною насипною щільністю. Ці склади містять також лаурилсульфат натрію як зволожуючий агент для збільшення змочувальності й розчинення складу, щоб виключити деякі недоліки, пов'язані зі сполукою 1, описані у таблиці 1. З іншого боку для одержання "Нового складу" використовували тільки одностадійний процес грануляції й одержували матеріал із необхідною насипною щільністю. "Новий склад" характеризується більше високим рівнем AФІ, а також більше низьким рівнем сполучного агента й дезінтегруючого агента у порівнянні з "Відомим складом". "Новий склад" також дозволяє одержати таблетки меншого розміру й маси завдяки вищевказаним змінам. Нові склади характеризуються більше високими значеннями AUC (~10 %) і Cмaкс (~50 %) у порівнянні з відомими складами за даними випробувань на моделях мавп. Більше того величина Tмaкс для нових складів в організмі мавп знижується (таблиця 9). У ході клінічних випробувань за участю здорових добровольців отримані фармакокінетичні дані (ФК), аналогічні ФК, отриманим на моделі мавп (таблиця 10). Значна перевага фармакокінетичного профілю нових складів у порівнянні з відомими складами, які містять лаурилсульфат натрію як 10 UA 100937 C2 5 зволожуючий агент, також є несподіваним результатом. Частково цей ефект можна пояснити поверхнево-активними властивостями гідроксипропілцелюлози, однак, порівнянність і перевага у порівнянні з лаурилсульфатом натрію як зволожуючий агент також є несподіваним результатом. Отже, здатність гідроксипропілцелюлози підвищувати розчинність і біодоступність є значною перевагою продукту поряд зі спрощенням процесу переробки. Taблиця 8 Оцінка способу одержання й композицій сполуки 1 за фармакокінетичними даними, отриманими при випробуванні in vivo на моделі мавп і за участю добровольців XXI XXII Відомий склад Новий склад %мас. % у таблетці 73,5 77,0 5,9 2,3 0,9 6,9 3,8 8,8 12,3 1,0 1,8 1,0 0,5 Інгредієнти Cполука 1 Пoвідoн K30, Klucel LF Лаурилсульфат натрію Натрієва сіль кроскармелози Mікрокристалічна целюлоза Кoлoїдний діоксид кремнію Taльк Стеарат магнію Композиції покриття Opadry жовтий 03K 12429 Спосіб одержання 2,0 2,3 Використовували Використовували одностадійний спосіб: багатостадійну обробку для волога грануляція досягнення необхідної забезпечувала необхідну насипної щільності гранул насипну щільність гранул Taблиця 9 Поpівняння середніх фармакокінетичних даних для композицій сполуки 1, отриманих після введення однократної дози з кормом самцям макак-крабоїдів Дoза Склад Cмaкс (мкг/мл) AUC0-24 год. (мкг∙год./мл) Tмaкс (год.) Таблетка 500 мг Відомий склад (Волога грануляція/ грудкування) 6,0 (2,6) 60,2 (27,1) 7,4 (1,5) Таблетка 500 мг Новий склад (Волога грануляція) 9,1 (3,7) 67,7 (18,2) 5,8 (3,8) Taблиця 10 Поpівняння середніх фармакокінетичних даних для композицій сполуки 1, отриманих після введення однократної дози здоровим добровольцям Дoза Склад Cмaкс (мкг/мл) AUC0-24 год. (мкг∙год./мл) Tмaкс (год.) 10 Таблетка 500 мг Відомий склад (Волога грануляція/ грудкування) 8,3 (0,65) 56,9 (3,2) 1,65 (0,25) Приклад ХХ Краща композиція й спосіб одержання 11 Таблетка 500 мг Новий склад (Волога грануляція) 10,1 (0,8) 69,3 (3,9) 1,51 (0,23) UA 100937 C2 На підставі оцінки різних сполучних агентів, їх концентрацій і способів додавання у продукт і ефективність в умовах in vivo були отримані наступні склади композицій, як описано у таблиці 11 нижче, як кращий варіант здійснення даного винаходу. Таблиця 11 Краща композиція й спосіб одержання композицій сполуки 1 Приклад XX Інгредієнти Cполука 1 Mікрокристалічна целюлоза (або придатний агент для пресування) Натрієва сіль крос-кармелози (або придатний дезінтегруючий агент) Гідроксипропілцелюлоза (ГПЦ) Taльк (або придатна ковзна речовина) Стеарат магнію (або придатна змазуча речовина) Композиція плівкового покриття Opadry (або придатна композиція плівкового покриття)* мас. % Краща композиція 77 Інтервал 50-95 12,0 0-49 3,5 0-10 2,5 2,0* 0,5* 1-10 0-5 0-2 2,5 0-5 Водна волога грануляція з високим зрушенням, сушіння у псевдозрідженому шарі, подрібнювання, змішування, пресування й нанесення плівкового покриття Кращий спосіб одержання *Композиція плівкового покриття випускається фірмою Colorcon (PA) 5 10 Незважаючи на те, що у даному описі представлена велика кількість варіантів його здійснення, представляється очевидним, що основний принцип можна змінити й одержати інші варіанти здійснення, які не виходять за межі сутності й обсягу даного винаходу. Всі такі модифікації й варіанти включені в обсяг винаходу, як визначено у прикладеній формулі винаходу, а конкретні варіанти здійснення представлені як приклади. ФОРМУЛА ВИНАХОДУ 1. Фармацевтична композиція, що включає сполуку 1, зображену нижче: NH2 O O N O N O O 15 20 O F , 1 у кількості від приблизно 50 мас. % до приблизно 95 мас. %, гідроксипропілцелюлозу, яка представлена у кількості від приблизно 1 мас. % до приблизно 4 мас. %, і принаймні один ексципієнт у кількості приблизно до 49 мас. %. 2. Фармацевтична композиція за п. 1, в якій сполука 1 присутня у кількості від приблизно 60 мас. % до приблизно 90 мас. %. 3. Фармацевтична композиція за п. 2, в якій сполука 1 присутня у кількості від приблизно 70 мас. % до приблизно 85 мас. %. 12 UA 100937 C2 5 10 15 20 25 30 35 4. Фармацевтична композиція за будь-яким із пп. 1-3, в якій гідроксипропілцелюлоза присутня у кількості від приблизно 1,5 мас. % до приблизно 4 мас. %. 5. Фармацевтична композиція за п. 4, в якій гідроксипропілцелюлоза присутня у кількості від приблизно 2 мас. % до приблизно 3 мас. %. 6. Фармацевтична композиція за будь-яким із пп. 1-5, в якій ексципієнт вибраний з групи, що включає агенти для пресування, дезінтегруючі агенти, ковзні речовини, змазуючі речовини, агенти для плівкового покриття та їх суміші. 7. Фармацевтична композиція за п. 6, в якій агент для пресування вибраний з групи, що включає моногідрат лактози, мікрокристалічну целюлозу, крохмаль 1500 і безводну лактозу. 8. Фармацевтична композиція за п. 7, в якій агент для пресування присутній у кількості приблизно до 49 мас. %. 9. Фармацевтична композиція за п. 6, в якій дезінтегруючий агент вибраний з групи, що включає натрієву сіль кроскармелози, кросповідон, крохмаль, целюлозу й гідроксипропілцелюлозу з низьким ступенем заміщення. 10. Фармацевтична композиція за п. 9, в якій дезінтегруючий агент присутній у кількості приблизно до 10 мас. %. 11. Фармацевтична композиція за п. 6, в якій ковзна речовина вибрана з групи, що включає тальк, колоїдний діоксид кремнію й кукурудзяний крохмаль. 12. Фармацевтична композиція за п. 11, в якій ковзна речовина присутня у кількості приблизно до 5 мас. %. 13. Фармацевтична композиція за п. 6, в якій змазуюча речовина вибрана з групи, що включає стеарат магнію, стеаринову кислоту, гідрогеноване масло, поліетиленгліколь, стеарилфумарат натрію й гліцерилбегенат. 14. Фармацевтична композиція за п. 13, в якій змазуюча речовина присутня у кількості приблизно до 2 мас. %. 15. Фармацевтична композиція за п. 6, в якій агент плівкового покриття вибраний з групи, що включає суміш для покриття на основі гіпромелози або полівінілового спирту й діоксиду титану і тальку, композицію плівкового покриття Opadry і композицію плівкового покриття Advantia. 16. Фармацевтична композиція за п. 15, в якій композиція покриття присутня у кількості приблизно до 5 мас. %. 17. Фармацевтична композиція за будь-яким із пп. 1-16, причому композиція представлена у формі гранул і характеризується насипною щільністю приблизно 0,35 г/см або більше. 18. Фармацевтична композиція за будь-яким із пп. 1-17, в якій в'язкість гідроксипропілцелюлози перебуває в інтервалі від приблизно 5 до приблизно 1500 мПа/с при концентрації 1-5 мас. % у воді при 25 °С, а молекулярна маса перебуває в інтервалі приблизно 80000-1150000 Да. 19. Фармацевтична композиція за будь-яким із пп. 1-18, склад якої зазначений нижче: Інгредієнт Інтервал (мас. %) 50-95 0-49 0-10 1-10 0-5 0-2 cполука 1 мікрокристалічна целюлоза натрієва сіль кроскармелози гідроксипропілцелюлоза тальк стеарат магнію композиція плівкового покриття 0-5 Opadry 20. Фармацевтична композиція за п. 19, склад якої зазначений нижче: 40 Композиція (мас. %) сполука 1 77,0 мікрокристалічна целюлоза 12,0 натрієва сіль кроскармелози 3,5 гідроксипропілцелюлоза 2,5 тальк 2,0 стеарат магнію 0,5 склад плівкового покриття 2,5 Opadry Інгредієнт 13 UA 100937 C2 21. Фармацевтична композиція за будь-яким із пп. 1-20, де композиція має форму таблетки. 22. Фармацевтична композиція за будь-яким із пп. 1-21 для застосування при лікуванні. 14 UA 100937 C2 15 UA 100937 C2 16 UA 100937 C2 17 UA 100937 C2 18 UA 100937 C2 19 UA 100937 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition comprising prodrugs of hcv polymerase inhibitor
Автори англійськоюChatterji, Ashish, Desai, Dipen, Sandhu, Harpreet K., Shah, Navnit Hargovindas
Назва патенту російськоюФармацевтическая композиция, которая содержит пролекарства ингибитора полимеразы hcv
Автори російськоюЧаттерджи Ашиш, Десаи Дипен, Сандху Харприт К., Шах Навнит Харговиндас
МПК / Мітки
МПК: A61K 31/513, A61P 31/12, A61K 9/20
Мітки: фармацевтична, полімерази, композиція, інгібітора, проліки, містить
Код посилання
<a href="https://ua.patents.su/22-100937-farmacevtichna-kompoziciya-shho-mistit-proliki-ingibitora-polimerazi-hcv.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить проліки інгібітора полімерази hcv</a>
Попередній патент: Гідромашина аксіальна корончата
Наступний патент: Дистанційний спосіб вимірювання та контролю концентрації водних розчинів
Випадковий патент: Композиція екструдованого сухого сніданку "успіх"












