Сполуки з аналгезивною дією, спосіб їх отримання, фармакологічна композиція та діагностичний агент на їхній основі
Формула / Реферат
1. Сполука формули (І):
, (I)
де: m дорівнює 0 або 1;
n дорівнює 1 або 2;
R1 вибирають з водню; розгалуженого або нерозгалуженого С1-С6-алкілу;
С3-С8-циклоалкілу;
С4-С8- (алкілциклоалкілу), де алкіл являє собою С1-С2-алкіл і циклоалкіл являє собою С3-С6-циклоалкіл;
бензилу;
;
,
де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів, і де гетероатоми вибирають з О, S і N;
;
та де n = 0 або 1;
С6-С10-арилу або гетероарилу, що має від 5 до 10 атомів, вибраних з будь-якого С, S, N і О, де арил або гетероарил може бути необов'язково і незалежно заміщений 1 чи 2 замісниками, незалежно вибраними з водню, СН3, (СН2)рСF3, галогену, CONR5R4, COOR5, COR5, (СН2)рNR5R4, (СН2)рСH3(CH2)pSOR5R4, (СН2)рSO2R5 і (СН2)рSO2NR5, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, та р дорівнює 0, 1 або 2;
(С1-С2-алкіл)-(С6-С10-арилу) або (С1-С2-алкіл)гетероарилу, причому гетероарильні фрагменти мають від 5 до 10 атомів, вибраних з будь-якого С, S, N і О, і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СH3, CONR5R4, COOR5, COR5, (CH2)qNR5R4, (CH2)qСH3(CH2)qSOR5R4, (CH2)qSO2R5, (CH2)qSO2NR5 і (CH2)qOR4, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, і q дорівнює 0, 1 або 2;
А являє собою
, ,
, та
;
та ,
де R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 R17 і R18, кожен незалежно, такі як визначено вище для R1, і де фенільне кільце кожного замісника А може бути необов'язково і незалежно заміщеним 1 або 2 замісниками Z1 та Z2, які, кожен незалежно, вибирають з водню, СН3, (СН2)rСF3, галогену, CONR2R3, CO2R2, COR2, (СН2)rNR2R3, (СН2)rСH3(CH2)rSOR2, (СН2)rSO2R2 і (СН2)rSO2NR2R3, де R2 і R3, кожен незалежно, такі, як визначено вище для R1, та де r дорівнює 0, 1 або 2; Х являє собою О, S або NR19, де R19 такий, як визначено для R1;
В являє собою заміщений або незаміщений ароматичний, гетероароматичний, гідроароматичний або гетерогідроароматичний фрагмент, що має від 5 до 10 атомів, вибраних з будь-якого С, S, N та О, необов'язково та незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, (СН2)tСF3, галогену, (СН2)tCONR5R4, (СН2)tNR5R4, (СН2)tCOR5, (СН2)tCOOR5, OR5, (СН2)tSOR5, (СН2)tSO2R5 і (СН2)tSO2NR5R4, де R4 і R5, кожен незалежно, такі, як визначено вище для R1, i t дорівнює 0, 1, 2 або 3; а також фармацевтично прийнятні солі сполук формули (І) та їх ізомери, гідрати, ізоформи та проліки.
2. Сполука за п. 1, де R1 вибирають з бензилу;
;
,
де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів і де гетероатоми вибирають з О, S і N; та
;
і де n = 0 або 1;
А вибирають з будь-якого одного з
, ,
та ,
де R6, R7, R8, R9, R16, R17 і R18, кожен незалежно, такі, як визначено вище для R1 і Z1, Z2 та X, кожен незалежно, такі, як визначено вище;
В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, пірилу, фуранілу, хінолінілу, ізохінолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрагідронафтилу, тетрагідрохінілу, тетрагідроізохінолінілу, тетрагідрофуранілу, піролідинілу та індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СН3, СF3, галогену, (СН2)tCONR5R4, -(СН2)tNR5R4, -(СН2)tCOR5, -С(СН2)tСO2R5, -OR5, де t дорівнює 0 або 1, і де R4 і R5 такі, як визначено для R1;
3. Сполука за п. 2, де R1 являє собою (С1-С2-алкіл)феніл і водень;
А являє собою
або ,
де R6, R7, R8, R9, кожен, являють собою етиленову групу, і Z1 і Z2 такі, як визначено вище;
В являє собою феніл або нафталін і
m та n, кожен, дорівнюють 1 або m дорівнює 1 і n дорівнює 0.
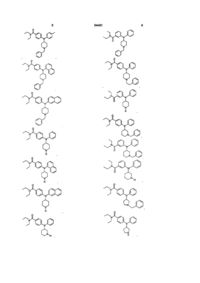
4. Сполука відповідно до формули (І) за п. 1, вибрана з будь-якої однієї з сполук:
; ;
; ;
; ;
; ;
; ;
; ;
; ;
; ;
та .
5. Сполука за будь-яким з попередніх пунктів в формі її гідрохлоридної, бітартратної або трифторацетатної солі.
6. Сполука за будь-яким з попередніх пунктів для використання в терапії.
7. Сполука за п. 6, де терапією є втамування болю.
8. Сполука за п. 6, де терапію спрямовано на шлунково-кишкові порушення.
9. Сполука за п. 6, де терапію спрямовано на спінальні ушкодження.
10. Сполука за п. 6, де терапію спрямовано на порушення симпатичної нервової системи.
11. Сполука загальної формули (І) за п. 1, призначена для одержання лікарського засобу для знеболювання.
12. Сполука загальної формули (І) за п. 1, призначена для одержання лікарського засобу для лікування шлунково-кишкових порушень.
13. Сполука загальної формули (І) за п. 1, призначена для одержання лікарського засобу для лікування хребтових ушкоджень.
14. Сполука за будь-яким з пп. 1-5, яка додатково відрізняється тим, що її мічено ізотопом.
15. Сполука за п. 14 для одержання діагностичного агента.
16. Мічена ізотопом сполука формули (І) за п. 1.
17. Діагностичний агент, який включає сполуку формули (І) за п. 1.
18. Фармацевтична композиція, що включає сполуку формули (І) за п. 1 як активний інгредієнт разом з фармакологічно та фармацевтично прийнятним носієм.
19. Спосіб одержання сполуки формули (І) за п. 1, відповідно до якого
(і) кетон формули (IV):
(IV),
де R1, m та n такі, як визначено в формулі (І) за п. 1, піддають відновному амінуванню заміщеним ариламіном формули (V):
(V),
де W такий, як визначено в формулі (І) за п. 1, необов'язково в присутності розчинника, з одержанням сполуки формули (II):
(II),
де R1, m та n такі, як визначено вище в формулі (І), і W являє собою А або В, як визначено вище в формулі (І).
(ii) R1 і W в формулі (II) необов'язково модифікують після або під час одержання (II) з (IV) і (V);
(iiі) сполуку формули (II), одержану на стадії (і), піддають реакції арилування шляхом взаємодії з арилуючим агентом формули (III):
(III),
де W являє собою А або В, як визначено вище в формулі (І), і Z являє собою підхожий замісник, необов'язково в присутності каталізатора, з одержанням сполуки формули (І) за п. 1, і
(iv) R1 і замісники на А і В необов'язково додатково модифікують.
20. Сполука формули (ІІ):
(II),
де R1, m та n такі, як визначено в формулі (І) за п. 1, і W такий, як визначено для А або В у формулі (І) за п. 1.
21. Сполука формули (II) за п. 20, вибрана з будь-якої з сполук:
; ;
; ;
та .
22. Спосіб знеболювання, відповідно до якого ефективну кількість сполуки формули (І) за п. 1 вводять суб'єкту, який потребує втамування болю.
23. Спосіб лікування шлунково-кишкових порушень, відповідно до якого ефективну кількість сполуки формули (І) за п. 1 вводять суб'єкту, який страждає на зазначене шлунково-кишкове порушення.
24. Спосіб лікування спінальних ушкоджень, відповідно до якого ефективну кількість сполуки формули (І) за п. 1 вводять суб'єкту, який страждає на зазначене спінальне ушкодження.
Текст
1 Сполука формули (І) КОМПОЗИЦІЯ вибраними з водню СНз, (CH 2 ) P CF 3 , галогену, CONR°FT COOR COR 5 , (CH 2 ) P NR 5 R 4 , (CH 2 )pCH3(CH 2 )pSOR 5 R 4 (CH 2 ) P SO 2 R° і (CH 2 ) P SO 2 NR 5 , де R4 і R , кожен незалежно, такі, як визначено вище для R1, та р дорівнює 0, 1 або 2, (Сі-С 2 -алкіл)-(Сб-Сю-арилу) або (Сі-С 2 алкіл)гетероарилу, причому гетероарильні фрагменти мають від 5 до 10 атомів, вибраних з будьякого С, S, N і О, і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СНз, CONR°R 4 COOR(CH 2 ) q CH 3 (CH 2 ) q SOR D R' (CH 2 ) q SO 2 NR і (CH 2 ) q OR , де R і R лежно, такі, як визначено вище для нює 0, 1 або 2, А являє собою (CH 2 ) q NR°R 4 (CH 2 ) q SO 2 R 5 , кожен незаR1, і q дорів О {СН г ) п О (І) де m дорівнює 0 або 1, п дорівнює 1 або 2, R вибирають з водню, розгалуженого або нерозгалуженого Сі-Сє-алкілу, Сз-Св-циклоалкілу, С4-С8- (алкілциклоалкілу), де алкіл являє собою Сі-С2-алкіл і циклоалкіл являє собою Сз-Сєциклоалкіл, бензилу, -|~(СН 2 ) П — СН—СН г де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів, і де гетероатоми вибирають з О, S і N, та де п = 0 або 1, Сб-Сю-арилу або гетероарилу, що має від 5 до 10 атомів, вибраних з будь-якого С, S, N і О, де арил або гетероарил може бути необов'язково і незалежно заміщений 1 чи 2 замісниками, незалежно 00 ^ю 54481 лъ/ t 16 17 д , R7, R8 , RIU, R", RIZ, R'°, R'\ R R R i 1g > I I > I R , кожен незалежно, такі як визначено вище для R1, і де фенільне кільце кожного замісника А може 1 бути необов'язково Z2незалежно заміщеним 1 вибизамісниками Z та і які, кожен незалежно, або 2 галогену, рають з водню, СНз, (CH2)rCF3, COR2, (CH2)rNR2RS, CONR2R3, CO2R (CH2)rSO2R2 і (CH2)rCH3(CH2)rSOR^ 2 3 2 3 (CH2)rSO2NR R де R і R , кожен незалежно, такі, як визначено вище для R , та де г дорівнює 0, 1 або 2, X являє собою О, S або NR19, де R19 такий, як визначено для R1, В являє собою заміщений або незаміщений ароматичний, гетероароматичний, гідроароматичний або гетерогідроароматичнии фрагмент, що має від 5 до 10 атомів, вибраних з будь-якого С, S, N та О, необов'язково та незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СНз, (CH2)tCF3, галогену, (CH2)tCONR5R4, (CH2)tNR5R , 5 5 5 5 (CH2)tCOR5 (CH2)tCOOR OR5, (CH2)tSOR5, 55 5 4 4 5 (CH2)tSO2R і (CH2)tSO2NR R , де R і R кожен незалежно, такі, як визначено вище для R , і t дорівнює 0, 1, 2 або 3, а також фармацевтично прийнятні солі сполук формули (І) та їх ізомери, гідрати, ізоформита проліки 2 Сполука за п 1, де R1 вибирають з бензилу, де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів і де гетероатоми вибирають з О, S і N, та і де п = 0 або 1, А вибирають з будь-якого одного з О R де R6, R7, R8, R9, R16, R17 і R18, кожен незалежно, такі, як визначено вище для R1 і Z1, Z2 та X, кожен незалежно, такі, як визначено вище, В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дипдробензофуранілу, бензотюфенілу, пірилу, фуранілу, хінолінілу, ізохшолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрапдронафтилу, тетрапдрохшілу, тетрапдроізохінолшілу, тетрапдрофуранілу, піролідинілу та індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СНз, CF3, галогену, (CH2)tCONR5R4, (CH^tNRV, -(CH2)tCOR5, -C(CH2)tCO2R5, -OR5, де t дорівнює 0 або 1, і де R4 і R5 такі, як визначено для R1, З Сполука за п 2, де R1 являє собою (Сі-С2алкіл)феніл і водень, А являє собою або де R , R R R , кожен, являють собою етиленову групу, і Z і Z такі, як визначено вище, В являє собою феніл або нафталін і m та п, кожен, дорівнюють 1 або m дорівнює 1 і п дорівнює 0 4 Сполука ВІДПОВІДНО до формули (І) за п 1, вибрана з будь-якої однієї з сполук 0 54481 54481 8 де W такий, як визначено в формулі (І) за п 1, необов'язково в присутності розчинника, з одержанням сполуки формули (II) та 5 Сполука за будь-яким з попередніх пунктів в формі її пдрохлоридної, бітартратної або трифторацетатної солі 6 Сполука за будь-яким з попередніх пунктів для використання в терапії 7 Сполука за п 6, де терапією є втамування болю 8 Сполука за п 6, де терапію спрямовано на шлунково-кишкові порушення 9 Сполука за п 6, де терапію спрямовано на спінальні ушкодження 10 Сполука за п 6, де терапію спрямовано на порушення симпатичної нервової системи 11 Сполука загальної формули (І) за п 1, призначена для одержання лікарського засобу для знеболювання 12 Сполука загальної формули (І) за п 1, призначена для одержання лікарського засобу для лікування шлунково-кишкових порушень 13 Сполука загальної формули (І) за п 1, призначена для одержання лікарського засобу для лікування хребтових ушкоджень 14 Сполука за будь-яким з пп 1-5, яка додатково відрізняється тим, що її мічено ізотопом 15 Сполука за п 14 для одержання діагностичного агента 16 Мічена ізотопом сполука формули (І) за п 1 17 Діагностичний агент, який включає сполуку формули (І) за п 1 18 Фармацевтична композиція, що включає сполуку формули (І) за п 1 як активний інгредієнт разом з фармакологічно та фармацевтично прийнятним носієм 19 Спосіб одержання сполуки формули (І) за п 1, ВІДПОВІДНО до якого (і) кетон формули (IV) 1 де R , m та п такі, як визначено в формулі (І) за п 1, піддають відновному амінуванню заміщеним ариламіном формули (V) W - N H 2 (V), 1 де R , m та п такі, як визначено вище в формулі (І), і W являє собою А або В, як визначено вище в формулі (І) (м) R і W в формулі (II) необов'язково модифікують після або під час одержання (II) з (IV) і (V), (їм) сполуку формули (II), одержану на стадії (і), піддають реакції арилування шляхом взаємодії з арилуючим агентом формули (III) W-Z (ill), де W являє собою А або В, як визначено вище в формулі (І), і Z являє собою підхожий замісник, необов'язково в присутності каталізатора, з одержанням сполуки формули (І) за п 1, і (iv) R1 і замісники на А і В необов'язково додатково модифікують 20 Сполука формули (II) 1 де R , m та п такі, як визначено в формулі (І) за п 1, і W такий, як визначено для А або В у формулі (І)зап 1 21 Сполука формули (II) за п 20, вибрана з будьякої з сполук О 54481 10 22 Спосіб знеболювання, ВІДПОВІДНО ДО ЯКОГО ефективну КІЛЬКІСТЬ сполуки формули (І) за п 1 вводять суб'єкту, який потребує втамування болю 23 Спосіб лікування шлунково-кишкових порушень, ВІДПОВІДНО до якого ефективну КІЛЬКІСТЬ сполуки формули (І) за п 1 вводять суб'єкту, який страждає на зазначене шлунково-кишкове порушення 24 Спосіб лікування спінальних ушкоджень, ВІДПОВІДНО до якого ефективну КІЛЬКІСТЬ сполуки формули (І) за п 1 вводять суб'єкту, який страждає на зазначене спінальне ушкодження Даний винахід стосується нових сполук з азотом в КІЛЬЦІ, способу їх одержання, їх застосування та фармацевтичних композицій, що містять ці нові сполуки Нові сполуки, можна застосовувати в терапії, особливо для лікування болю Засновки здійснення винаходу і відомий рівень техніки 5-Рецептор було ідентифіковано як такий, що відіграє роль в багатьох функціях організму, таких як серцево-судинна та больова системи Ліганди для 5-рецептора можуть, отже, знайти потенційне використання в якості аналгезивних і/або антиппертензивних засобів Було також виявлено, що ліганди для 5-рецептора мають імуномоделюючу активність Нині проведено ідентифікацію принаймні трьох різних популяцій опюїдних рецепторів (|j, 5 та к), і всі три виявляються як в центральній, так і периферійній нервових системах багатьох видів тварин, включаючи людину Аналгезію спостерігали на різних моделях тварин, коли були активовані один чи кілька з цих рецепторів За рідкими винятками, доступні зараз селективні ОПІОІДНІ 5-ліганди є пептидами за природою і не придатні для введення системними шляхами Деякі непептидні 5-антагоністи стали підхожими протягом деякого останнього часу (Для огляду див Takemon and Portoghese, 1992, Ann Rev Pharmacol, Tox, 32 239 - 269) Ці сполуки, наприклад, налтриндол, характеризуються надто слабкою (тобто слабшою в 10 разів) селективністю для зв'язування 5-рецептора порівняно з ц-рецептором та не виявляють аналгезивної активності, факт, який означає потребу в розробці високоселективних непептидних 5-лігандів Таким чином, проблемою, що лежить в основі даного винаходу, було відкриття нових аналгетиків, що мають підвищену аналгезивну дію, а також покращений профіль побічної дії порівняно з сучасними [j-агоністами та потенційну пероральну ефективність Аналгетики, що були ідентифіковані і ВІДОМІ З попереднього рівня техніки, мають багато недоліків, які виявляються втому, що вони мають погану фармакокінетику та не виявляють аналгезивної дії при введенні системними шляхами Окрім, того, було підтверджено документами, що більш прийнятні сполуки, описані у відомому рівні техніки, виявляють також значну судорожну дію при системному введенні Зазначену вище проблему, було розв'язано шляхом розробки нових сполук, що мають кільце піперидину, яке може бути 5-членним, 6-членним або 7-членним азот-вмісним кільцем, як буде описано нижче Опис винаходу Нові сполуки ВІДПОВІДНО ДО ЦЬОГО винаходу визначаються загальною формулою (І) (0 Де m - дорівнює 0 або 1, п - дорівнює 1 або 2, R1 - вибирають з водню, розгалуженого або не роз гал уже ного Сі-Сє-алкілу, Сз-Св-циклоалкілу, С4-С8-(алкілциклоалкілу), де алкіл являє собою d Сг-алкіл і циклоалкіл являє собою Сз-Сєциклоалкіл, бензилу, 11 12 54481 (CH2 ) n де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів, і де гетероатоми вибирають з О, S і N, де п=0 або 1, Сб-Сю-арилу або гетероарилу, що має від 5 до 10 атомів, вибраних з будь-якого атому С, S, N і О, де арил або гетероарил може бути необов'язково і незалежно заміщений 1 чи 2 замісниками, незалежно вибраними з водню, СНз, (CH 2 ) P CF3, галогену, CONR 5 R 4 , COOR 5 , COR 5 , (CH^NRV 5 4 (CH 2 )pCH3(CH 2 )pSOR R , (CH 2 ) P SO 2 R і (CH 2 ) P SO 2 NR 5 , де R4 і R5, кожен незалежно такі, як визначено вище для R1, та р дорівнює 0,1 або 2, (Сі-С 2 -алкіл)-(Сб-Сю-арил) або (Сі-С 2 -алкіл) гетероарил, причому гетероарильні фрагменти мають від 5 до 10 атомів, вибраних з С, S, N і О, і де арил або гетероарил може бути необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з будь-якого замісника водню, СНз, CONR 5 R 4 , COOR 5 , COR 5 , (CH 2 ) q NR 5 R 4 , (CH 2 ) q CH 3 (CH 2 ) q SOR 5 R 4 , (CH 2 ) q SO 2 R 5 , (CH 2 ) q SO 2 NR 5 і (CH 2 ) q OR 4 , де R4 і R5, кожен незалежно, такий, як визначено вище для R1, і q дорівнює 0,1 або 2, А являє собою 1 як визначено вище для R та де г дорівнює 0,1 1Q 1Q або 2, X являє собою О, S або NR , де R такий, як визначено для R1 В являє собою заміщений або незаміщений ароматичний, гетеро ароматичний, гідроароматичний або гетеропдроароматичний фрагмент, що має від 5 до 10 атомів, вибраних з будь-якого атома С, S, N та О, необов'язково та незалежно заміщений 1 або 2 замісниками, незалежно вибраними 5 з водню, СНз, (CH 2 ) t CF 3 , галогену, (CH 2 ) t CONR°R4 R (CH 2 ) t NR 5 R 4 (CH 2 ) t COR 5 , (CH 2 ) t COOR 5 ~"5 OR" (CH 2 ) t SOR 5 , (CH 2 )tSO 2 R 5 і (CH 2 ) t SO 2 NR 5 R z де R4 і R°, кожен незалежно, такі, як визначено вище для R1, 11 дорівнює 0,1, 2 або З До обсягу даного винаходу включені також фармацевтичне прийнятні солі сполук формули (І), а також їх ізомери, гідрати, ізоформи та проліки Більш прийнятні сполуки по винаходу являють собою сполуки формули (І), де R1 вибирають з бензилу сн=СН г де G являє собою гідроароматичну або гетероароматичну групу, що має 5 або 6 атомів і де гетероатоми вибирають з О, S і N, та -4-{он. і де п=0 або 1, А вибирають з будь-якого одного з R « О v - S t о я « де R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R 16 R і R18, кожен незалежно, такі як визначено вище для R1, і де, кільце фенілу кожного замісника А може бути необов'язково і незалежно заміщеним 1 або 2 замісниками Z 1 та Z 2 , які, кожен незалежно, вибирають з водню, СНз, (CH 2 ) r CF3, галогену, 2 3 2 2 (CH 2 ) r NR 2 R S , CONR2R3 CO2R COR z ,2 ,2 (CH ) CH (CH ) SOR , (CH ) SO R z 17 2 r 3 ^ 2 r 2 r 2 (CH 2 ) r SO 2 NR 2 R 3 , де R2 і R3, кожен незалежно, такі, де R6, R7, R8, R9, R16, R17 і R18, кожен незалежно, такі, як визначено вище для R1, і Z1, Z 2 та X, кожен незалежно, такі, як визначено вище, В вибирають з фенілу, нафтилу, індолілу, бензофуранілу, дипдробензофуранілу, бензотюфенілу, пірилу, фуранілу, хінолінілу, ізохшолінілу, циклогексилу, циклогексенілу, циклопентилу, циклопентенілу, інданілу, інденілу, тетрапдронафтилу, тетрапдрохшілу, тетрапдроізохінолшілу, тетрапдрофуранілу, піролідинілу та індазолінілу, кожен з яких необов'язково і незалежно заміщений 1 або 2 замісниками, незалежно вибраними з водню, СНз, CF3, галогену, -(CH2)tCONR5R4, -(CH2)tNR5R4, 54481 14 13 -(CH2)tCOR5, -C(CH2)tCO2R5 та -OR5, де t дорівнює Сполуки винаходу придатні в якості імуномо0 або 1, і де R4 і R5 такі, як визначено вище дуляторів, особливо для аутоімунних хвороб, таких як артрит, для повношарових шкірних шматків, Особливо прийнятні сполуки являють собою органів-трансплантатів і аналогічних хірургічних сполуки формули (І), де потреб, для колагенових хвороб, різних алергій, R1 являє собою (Сі-Сг-алкіл) феніл і водень, для використання в якості протипухлинних засобів А являє собою і антивірусних засобів Сполуки винаходу можна використовувати при О хворобливих станах, де має місце дегенерація або дисфункція опюїдних рецепторів або ОПІОІДНІ рецептори беруть участь в цій парадигмі Вона може включати використання мічених ізотопами варіантів сполук винаходу в діагностичних методиках і в застосуваннях для одержання зображень, таких як позитронна емісійна томографія (ПЕТ) де R , R , R , R , кожен, являють собою етилеСполуки винаходу можна використовувати для нову групу, і Z1 і Z2 такі, як визначено вище, лікування діареї, депресії, нетримання сечі, різних В являє собою феніл або нафталін і психічних хвороб, кашлю, набряку легень, різних m та п, кожен, дорівнюють 1 або m дорівнює 1 шлунково-кишкових порушень, спинального ушкоі п дорівнює - 0 дження і звикання до надмірного вживання лікарЗамісники А і В, ВІДПОВІДНО, можуть бути неських засобів, включаючи лікування від зловжиобов'язково заміщені в будь-якому положенні кільвання алкоголем, нікотином, опюїдами та іншими ця лікарськими засобами, і порушень симпатичної Терміном "галоген" називається хлор, фтор, нервової системи, наприклад, гіпертензії бром і йод Сполуки винаходу можна використовувати в Терміном "арил" називається ароматичне кіякості аналгезивного агента для застосування під льце, що має від 6 до 10 атомів вуглецю, таке як час загальної анестезії та для надання допомоги феніл і нафтил контрольованою анестезією Комбінації агентів з Терміном "гетероарил" називається ароматичрізними властивостями часто використовують для не кільце, в якому один чи кілька з 5 - 10 атомів у досягнення балансу дій, необхідних для підтриКІЛЬЦІ являють собою елементи, ІНШІ ніж вуглець, мання анестезуючого стану (наприклад, амнезії, такі як N, Эта О аналгезії, м'язової релаксації і седативного ефекТерміном "гідроароматичний" називається ту) До цієї комбінації включають анестетики, що структура частково або повністю насиченого аровводяться інгаляцією, снотворні засоби, анксюліматичного кільця, що має 5 - 1 0 атомів вуглецю у тики, нейром'язові блокатори і опюїди КІЛЬЦІ Сполуки даного винаходу в міченій ізотопом Терміном "гетеропдроароматичний" називаформі можна використовувати в якості діагностичється структура частково або повністю насиченого ного засобу ароматичного кільця, в якій один чи кілька з 5 - 10 До обсягу даного винаходу включається також атомів в КІЛЬЦІ є елементами, іншими, ніж вуглець, застосування будь-якої з сполук по наведеній витакими як N, Эта О ще формулі (І) для виготовлення лікарського засоТерміном "ізомери" позначаються сполуки фобу для лікування будь-якого з станів, що обговормули (І), які відрізняються положенням їх функцірюються вище ональної групи і/або орієнтацією Терміном "орієнНаступним аспектом винаходу є спосіб лікутація" називаються стереоізомери, вання суб'єкту, який страждає на будь-який з обгодіастереоізомери, репоізомери та енантюмери ворюваних вище станів, за допомогою якого ефекТерміном "ізоформи" позначаються сполуки тивну КІЛЬКІСТЬ сполуки ВІДПОВІДНО до зазначеної формули (І), які відрізняються їх кристалічною ревище формули (І) вводять пацієнту, який потребує шіткою, такі як кристалічна сполука та аморфні такого лікування сполуки Способи одержання Терміном "проліки" називаються фармакологіСполуки формули (І), як описано вище, можна чно прийнятні ПОХІДНІ, наприклад, складні ефіри і одержати арилуванням аміну формули (II) аміди, так щоб продукт бюперетворення такої похідної, який утворюється, був активним лікарським засобом Посилання на публікацію Goodman and Gilmans, The Pharmacological basis of Therapeutics, 8th ed , McGraw-Hill, Jnt Ed 1992, "Biotransformation of Drugs, p 13 - 15, що описує проліки взагалі, включається тут таким чином Нові сполуки даного винаходу можна використовувати в терапії, особливо для лікування різних хворобливих станів, таких як хронічний біль, гострий біль, раковий біль, біль, викликаний ревматоїде R1, mm такі, як визначено вище в формулі дним артритом, мігрень, вісцеральний біль і так (І), і W являє собою А або В, як визначено вище в далі Цей список, однак, не повинен тлумачитись формулі (І), арилюючим агентом формули (III) як вичерпний 15 W—Z де W являє собою А або В, як визначено вище в формулі (І), і Z являє собою підхожий замісник, тобто реакційноспроможний компонент, підхожий для використання в певному способі, що має бути відомим фахівцю у цій галузі, більш прийнятне, галоген, трифлат (CF3SO3-), мезилат (CH3SO3-), тозилат (СНз(СбН4)ЗОз-), трибутилолово, триацетоксисвинець, діарилвісмут, борат (В(ОН)2), купрат або ІНШІ групи, ВІДОМІ у цій галузі Арилування можна каталізувати металами, більш прийнятне, Си, Ni, Pd або їх ПІДХОЖИМИ солями, комплексами, оксидами або гідроксидами 4-Амінопіперидин наведеної вище формули (II) можна перетворити повністю або частково на його ВІДПОВІДНИЙ аніон обробкою основами, більш прийнятне, триетиламіном, 4-диметиламшопіридином, К2СО3, NaOH, NaH, дмзопропіламідом ЛІТІЮ, трет-бутоксидом натрію чи таке інше, до або під час процесу арилування Реакцію можна проводити в присутності комплексоутворюючих реагентів, більш прийнятне, трифенілфосфшу, трифеніларсину, дибензиліденацетону, 2,2'-біс(дифенілфосфшо)-1,1'бінафтилу, 1,1'-біс(дифенілфосфшо)фероцену, кисню або інших таких сполук, відомих у цій галузі Реакцію можна необов'язково проводити в присутності одного чи кількох розчинників, таких як толуол, дихлорметан, тетрапдрофуран, диметилформамід, діоксан, ацетонітрил чи диметилсульфоксид або в суміші розчинників R1 і замісники на А та В сполук формули (І), як визначено вище, можна модифікувати після або під час одержання (І) з (II) і (III) у способи, ВІДОМІ у цій галузі, наприклад, відновленням, окисленням і алкілуванням Амін формули (II) можна одержати відновним амінуванням кетону формули (IV) (IV) де R1, R2, R3, m та п такі, як визначено вище в формулі (І), заміщеним ариламіном (V) W—NH 2 (V) де W такий, як визначено вище в формулі (II) Відновне амінування можна проводити в одноабо двостадійний спосіб, що включає використання кислоти Бронстедта або Льюіса і відновлювального агента Підхожими кислотами є сірчана кислота, пол фосфорна кислота, 4толуолсульфонова кислота, ізопропоксид титану, трихлорид алюмінію, діетиловий ефірат трифториду бору чи таке інше Підхожими відновлювальними агентами є водень в присутності каталізатора, більш прийнятне, Pd, Pd-C, Pd(OH)2, PtO2, RhC або нікель Ренея, боропдрид натрію, ціаноборопдрид натрію, літіиалюміншпдрид, диборан, дмзобу-тилалюмшійпдрид чи таке інше Реакцію можна 54481 16 проводити в присутності одного чи кількох розчинників, які можуть бути органічними або неорганічними, таких як толуол, дихлорметан, прості ефіри, спирти, оцтова кислота, вода або суміші розчинників 1 R і замісники на W сполуки (II), як визначено вище, можна модифікувати після або під час одержання (І) з (II)' і (III) у способи, ВІДОМІ у цій галузі, наприклад, відновленням, окисленням чи алкілуванням, після або під час одержання (II) з (IV) і (V) Сполуки формули (III), (IV) і (V) можуть бути комерційне доступними, їх можна одержати згідно з літературними методиками або у способи, ВІДОМІ в даній галузі Винахід тепер буде описуватися більш докладно за допомогою наведених далі прикладів, що не повинні ніяким чином розглядатися, як обмеження винаходу Приклади Приклад 1 (і) Одержання 4 -[N-(1-бензил піперидин-4іл)аміно]-І\І, N-діетилбензаміду (сполука 1) (1) ТІ(ОІ-РГ)4 (14,8мл, 50ммоль) додавали до суміші 4-аміно-(г\І,г\І-діетил)бензаміду (4,81г, 25ммоль) і 1-бензил-4-піперидону (6,95мл, 37,5ммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом 2 годин та перемішували при 60°С протягом 15 годин Суміш охолоджували на крижаній бані і додавали ЕЮН (ЮОмл) та гранули NaBH4 (3,5г, 91ммоль) Після перемішування протягом 1 години при 0°С і 20 годин при кімнатній температурі, додавали 1 МІЧЬЦОН (50мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (ЮОмл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, водний шар екстрагували СН2СІ2 (ЮОмл) і об'єднані органічні фази промивали ІЧаНСОз (водний, насичений, ЮОмл) та сушили над К2СО3 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт від РпМе до МЕгСО) та кристалізацією (РпМе), одержуючи названу в заголовку сполуку 1 (7,48г, 82%) у вигляді твердого матеріалу бежевого кольору ІЧ (КВг) 3343, 2939, 1608, 1528, 1459, 1422, 1339, 1285, 1174, 1091, 981, 827, 735см 1 1 НЯМР (СВСІз) 7,32 (д, 4Н), 7,26 (т, 1Н), 7,23 (д, 2Н), 6,54 (д, 2Н), 3,72 (шир с, 1Н), 3,53 (с, 2Н) 3,42 (шир д, 4Н), 3,32 (шир с, 1Н), 2,84 (д, 2Н), 2,15 (т, 2Н), 2,02 (д, 2Н), 1,48 (к, 2Н), 1,17 (т, 6Н) 1 Х ЯМР (CDC13) 171,7, 148,1, 138,3, 129,1, 128,5, 128,2, 127,0, 125,3, 112,2, 63,1, 52,2, 49,8, 17 54481 18 41,5 (шир), 32,4, 13,6 (шир) Аналітичний зразок одержували перекристалізацією з PhMe Аналіз Розраховано для С23Н31М3О С, 75,58, Н, 8,55, N, 11,50 Знайдено С, 75,58, Н, 8,63, N, 11,31 (м) Одержання 4-№-(1-бензял піперид ин-4іл)аміно]І\І,І\І-діетилбензаміду (сполука 2) {3} Суміш 4-[N-(1 -бензил піперид ин-4-іл)амшо]N.N-діетилбензаміду (сполука 1) (0,58г, 1,59ммоль), РпзВі (0,84г, 1,90ммоль) і Си(ОАс)2, (0,43г, 2,38ммоль) в PhMe (25мл) нагрівали при 110°С протягом 15годин Додавали РпзВі (0,84г, 1,90ммоль) і Си(ОАс)г (0,43г, 2,38ммоль) та суміш перемішували при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 6 годин Додавали РпзВі (0,84г, 1,90ммоль) і Си(ОАс)г (0,43г, 2,38ммоль) та суміш перемішували при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 15годин, залишали для охолоджування і гасили IMNH4OH (5мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли ЕЮАс (25мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, темно-синій водний шар екстрагували ЕЮАс (25мл) і об'єднані органічні фази промивали Н2О (50мл) і насиченим сольовим розчином (25мл) та сушили над К2СО3 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від PhMe до Ме2О), одержуючи названу в заголовку сполуку 2 (0,33г, 47%) у вигляді безбарвного масла 1 Н ЯМР (CDCI3) 7,53 (т, 2Н), 7,29-7,18 (м, 8Н), 7,01 (д, 2Н), 6,58 (д, 2Н), 3,85 (т, 1Н), 3,49 (с, 2Н), 3,42 (д, 4Н), 2,95 (д, 2Н), 2,11 (т, 2Н), 1,92 (д, 2Н), 1,51 (к, 2Н), 1,17 (т, 6Н) 13 Н ЯМР (CDCI3) 171,5, 149,0, 143,6, 138,2, 129,5, 129,1, 128,7, 128,2, 128,1, 127,0, 126,7, 125,4, 116,0, 63,1, 55,5, 53,3, 40 (шир), 30,7, 13 (шир) Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в суміші простий ефір/ЕЮН до охолодженого льодом розбавленого простим ефіром НСІ ІЧ (КВг) 3423, 2975, 2934, 2529, 1606, 1458/1285, 1094, 750, 705 см 1 Аналіз Розраховано для С2дНз5МзО*НСГН20 С, 70,21, Н, 7,72, N, 8,47 Знайдено С, 70,02, Н, 7,61, N, 8,35 Приклад 2 (і) Одержання 4-[І\І-(1-бензилпіперидин-4-іл)-4метиланілшо]-г\І,г\І-діетилбензаміду (сполука 3) Суміш 4-[N-(1 -бензил піперид ин-4-іл)амшо]N.N-діетилбензаміду (сполука 1) (0,37г, 1,00ммоль), три-4-толілвісмуту (1,59г, З.ЗОммоль) і Си(ОАс)2 (0,54г, З.ООммоль) в PhMe (20мл) нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 16год Суміш залишали для охолоджування і гасили НгО (2мл) Суміш перемішували протягом 1 годин, розбавляли ЕЮАс (25мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, водний шар екстрагували ЕЮАс (25мл) і об'єднані органічні фази промивали Н2О (50мл) і насиченим сольовим розчином (25мл) та сушили над MgSO4 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від СН2СІ2 до 8% МеОН/СН2СІ2), одержуючи названу в заголовку сполуку 3 (0,09г, 20%) у вигляді безбарвного масла 1 Н ЯМР (CDCI3) 7,30-7,16 (м, 9Н), 6,94 (д, 2Н), 6,52 (д, 2Н), 3,83 (т, 1Н), 3,48 (с, 2Н), 3,42 (д, 4Н), 2,93 (д, 2Н), 2,36 (с, ЗН), 2,07 (т, 2Н), 1,90 (д, 2Н), 1,50 (к, 2Н), 1,16 (т, 6Н) 1 Х ЯМР (CDCI3) 171,6, 149,7, 140,4, 138,2, 136,1, 130,2, 130,2, 129,0, 128,1, 128,0, 126,9, 125,3, 113,8, 63,0, 55,4, 53,3, 41 (шир), 30,5, 21,0, 13 (шир) Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в простому ефірі до охолодженого льодом розбавленого простим ефіром НСІ ІЧ (КВг) 2936, 2528, 1605, 1510, 1457, 1428, 1284, 1094, 952,742, 701 см 1 Аналіз Розраховано для СзоНз7І\ІзО*НСГО 5 Н2О С, 71,91, Н, 7,84, N, 8,39 Знайдено С, 71,75, Н, 7,83, N, 8,32 Приклад З Одержання 4-[N-(1 -бензилпіперидин-4-іл)-1 нафтиламіно]-г\І,г\І-діетилбензаміду (сполука 4) (4) Суміш 4-[N-(1 -бензил піперид ин-4-іл)амшо]N.N-діетилбензаміду (сполука 1) (0,37г, 1,00ммоль), три-1-нафтилвісмуту (0,53г, 19 54481 1,20ммоль) і Cu(OAc)2 (0,27г, 1,50ммоль) в PhMe (20мл) нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 17год Три-1-нафтилвісмут (0,53г, 1,20ммоль) і Си(ОАс)2 (0,27г, 1,50ммоль) додавали при кімнатній температурі Суміш перемішували при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 22год, залишали для охолоджування і гасили 1 МІЧЬЦОН (5мл) Суміш перемішували протягом ЗО хвилин, розбавляли ЕЮАс (25мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, темно-синій водний шар екстрагували ЕЮАс (25мл) і об'єднані органічні фази промивали НгО (50мл) і насиченим сольовим розчином (25мл) і сушили над К2СО3 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від PhMe до Ме2СО), одержуючи названу в заголовку сполуку 4 (0,41г, 83%) у вигляді коричнюватого твердого матеріалу ІЧ (КВг) 2939, 2796, 1619 1511, 1456, 1420, 1346, 1282, 1180, 1099, 783 см 1 1 Н ЯМР (CDCI3) 7,87 (т, 2Н), 7,79 (д, 1Н), 7,51 (т, 1Н), 7,46 (т, 1Н), 7,37 (т, 1Н), 7,31 (д, 1Н), 7,287,19 (м, 5Н), 7,17 (д, 2Н), 6,41 (д, 2Н), 4,08 (т, 1Н), 3,46 (с, 2Н), 3,40 (д, 4Н), 2,89 (д, 2Н), 2,11 (т, 2Н), 2,08 (шир с, 2Н), 1,50 (шир с, 2Н), 1,14 (т, 6Н) 13 С ЯМР (CDCI3) 171,7, 149,8, 138,9, 138,1, 135,0, 133,4, 129,1, 129,0, 128,3, 128,2, 128,1, 128,0, 127,0, 126,4, 126,2, 126,1, 124,6, 124,5, 112,2, 63,0, 56,5,53,3, 40 (шир), 30,4, 13,5 (шир) Аналітичний зразок одержували перекристалізацією з ЕЮН Аналіз Розраховано для С33Н37О С, 80,61, Н, 7,59, N, 8,55 Знайдено С, 80,48, Н, 7,41, N, 8,52 Приклад 4 Одержання 4-[N-(1 -бензил піперид ин-4-іл)-2нафтиламшо]-г\І,г\І-діетилбензаміду (сполука 5) (5) Суміш 4-[N-(1 -бензил піперид ин-4-іл)амшо]N.N-діетилбензаміду (сполука 1) (0,67г, 1,83ммоль), три-2-нафтил вісмуту (0,97г, 2,20ммоль) і Си(ОАс)2 (0,50г, 2,75ммоль) в PhMe (35мл) нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 15год Додавали три-2нафтилвісмут (0,97г, 2,20ммоль) та Си(ОАс)2 (0,50г, 2,75ммоль) і суміш перемішували при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 22 годин Додавали три-2-нафтил вісмут (0,97г, 2,20ммоль) і Си(ОАс)2 (0,50г, 2,75ммоль) Після кип'ятіння ІЗ зворотним холодильником протягом 70 годин суміш залишали для охолоджування і гасили 1 МІЧЬЦОН (1 Омл) Суміш перемішували протягом ЗО хвилин, розбавляли ЕЮАс (35мл) і фільтрували крізь шар целіту® Шари в фільтраті 20 поділяли, темно-синій водний шар екстрагували ЕЮАс (35мл) і об'єднані органічні фази промивали НгО (75мл) та насиченим сольовим розчином (35мл) і сушили над MgSO4 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від PhMe до Ме2СО), одержуючи названу в заголовку сполуку 5 (0,63г, 70%) у вигляді коричневого масла, яке тверділо при стоянні ІЧ (КВг) 2935, 2807, 1614, 1510, 1424, 1284 см і 1 Н ЯМР (CDCI3) 7,83-7,78 (м, 2Н), 7,74 (д, Ш)', 7,48-7,42 (м, ЗН), 7,27-7,21 (м, 7Н), 7,10 (дд, 1Н), 6,66 (д, 2Н), 3,94 (т, 1Н), 3,48 (с, 2Н), 3,43 (шир с, 4Н), 2,94 (д, 2Н), 2,14 (т, 2Н), 1,99 (с, 2Н), 1,57 (м, 2Н), 1,17 (т, 6Н) 13 С ЯМР (СВСІз) 171,4, 148,8, 141,3, 138,1, 134,2, 131,2, 129,2, 129,0, 128,1, 128,0, 127,5, 127,4, 127,2, 126,9, 126,2, 125,4, 125,3, 116,8, 63,0, 55,8, 53,3, 41 (шир ), 30,7, 13,6 (шир ) Аналітичний зразок одержували з МеОН Аналіз Розраховано для C33H37N3O С, 80,61, Н, 7,59, N, 8,55 Знайдено С, 80,35, Н, 7,59, N, 8,46 Приклад 5 Одержання г\І,г\І-діетил-4-(г\І-піперидин-4іланіліно)бензаміду (сполука 6) Розчин 4-[N-(1 -бензил піперид ин-4-іл)анілшо]N.N-діетилбензаміду (сполука 2) (1,21г, 2,74ммоль) в МеОН (25мл)гідрували при 4,219атм (бОпсі) протягом 4 днів в присутності каталітичної КІЛЬКОСТІ Pd(OH)2 на вугіллі Суміш фільтрували крізь шар целіту®, концентрували і залишок очищали хроматографією (градієнт, від СН2СІ2 до СН2СІ2/Ме0Н (9 1) і до CH2CI2/MeOH/NH4OH (водний, концентрований) (80 18 2), одержуючи названу в заголовку сполуку 6 (0,62г, 64%) у вигляді безбарвного масла 1 Н (CDCI3) 7,37 (т, 2Н), 7,25-7,22 (м, ЗН), 7,01 (д, 2Н), 6,61 (д, 2Н), 3,98 (т, 1Н), 3,42 (шир д, 4Н), 3,17 (д, 2Н), 2,78 (т, 2Н), 2,00 (д, 2Н) 1,71 (шир с, 1Н), 1,41 (к, 2Н), 1,18 (т, 6Н) 13 С ЯМР (CDCI3) 171,4, 148,2, 143,1, 129,8, 128,0, 127,9, 127,7, 125,7, 116,9, 53,5, 44,4, 41 (шир), 28,7, 13,5 (шир) Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в простому ефірі до охолодженого льодом розбавленого простим ефіром НСІ ІЧ (КВг) 3426, 3359, 2936, 2722, 1603, 1473, 1281, 1091, 708,503 с м 1 Аналіз Розраховано для С22Н29ІЧзО*НСГН2О С, 65,09, Н, 7,95, N, 10,35 Знайдено С, 65,37, Н, 7,94, N, 10,38 Приклад 6 54481 22 21 Одержання І\І,І\І-діетил-4-[(І\І-піперидин-4-іл]-1Залишок поділяли між СН2СІ2 (Юмл) і 1 MNH4OH (1 Омл) Шари поділяли і органічну фазу промивали нафтиламшо)бензаміду (сполука 7) Н2О (1 Омл) та насиченим сольовим розчином (Юмл) і сушили над К2СОз Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від СН2СІ2 до CH2CI2/MeOH/NH4OH (водний, концентр) (85 13,5 1,5) і верх (LiChroPrep RP-18, елюювання з кількостями, що збільшуються 0,1% ТФО/MeCN в 0,1% ТФО/Н2О), одержуючи названу в заголовку сполуку 8 (30мг) у вигляді трифторацетату ІЧ (нерозбавлений) 3420, 1680, 1600 см 1 1 Н ЯМР (CDCI3, сільТФО) d 1,10 (6Н, М), 1,78 (7) (2Н, м,), 2,10 (2Н, м, CH(CH)CH(N)CH(CH)), 3,00 (2Н, м, CH(CH)NHCH(CH)), 3,35 (6Н, м), 4,15 (1Н, Розчин 4-[N-(1 -бензил піперид ин-4-іл)-1м,), 6,65 (2Н, м), 7,00 (1Н, м), 7,20 (2Н, м), 7,40 (ЗН, нафтиламіно]-г\І,г\І-діетилбензаміду (сполука 4) м), 7,75 (ЗН, м, Аг) (0,22г, 0,45ммоль) в ЕЮН (20мл)гідрували при Приклад 8 4,219атм (бОпсі) протягом 64 годин в присутності Одержання 4-[(І\І-(1-[2-фенілетил]піперидин-4каталітичної КІЛЬКОСТІ Pd(OH)2 на вугіллі Суміш іл)аніліно]-г\І,г\І-діетилбензаміду (сполука 9) фільтрували крізь шар целіту®, концентрували і залишок очищали хроматографією (градієнт, від СН2СІ2 до СН2СІ2/Ме0Н (9 1) до CH2CI2/MeOH/NH4OH (водний, конц) (80 18 2), одержуючи названу в заголовку сполуку 7 (0,12г, 67%) у вигляді безбарвного масла, яке тверділо при стоянні ІЧ (КВг) 2942, 1609, 1512, 1448, 1280 см 1 1 Н ЯМР (CDCI3) 7,86 (т, 2Н), 7,80 (д, 1Н), 7,50 (т, 1Н), 7,45 (т, 1Н), 7,36 (т, 1Н), 7,30 (д, 1Н), 7,18 (д, 2Н), 6,42 (д, 2Н), 4,20 (т, 1Н), 3,40 (шир , д, 4Н), 3,06 (д, 2Н), 2,79-2,63 (м, ЗН), 2,03 (шире, 2Н), 1,39 (шире, 2Н), 1,14 (т, 6Н) 1 Х ЯМР (CDCI3) 171,6, 149,4, 138,7, 134,8, 133,3, 128,7, 128,2, 128,1, 127,9, 126,3, 126,1, 126,0, 124,4, 124,2, 112,1, 56,1, 46,0, 41 (шир), 31,3, 13,4 (шир) Аналіз Розраховано для С2єНзіМзО*1,25Н2О С, 73,64, Н, 7,96, N, 9,91 Знайдено С, 73,77, Н, 7,54, N, 9,96 Приклад 7 Одержання г\І,г\І-діетил-4-[(г\І-піперидин-4-іл]-2нафтиламшо)бензаміду (сполука 8) (І-Хлоретил)хлорформіат (58мкл, 0,53ммоль) додавали до розчину 4-[І\І-(1-бензилпіперидин-4іл)-2-нафтиламіно]-г\І,г\І-діетилбензаміду (сполука 5) (105мг, 0,21ммоль) в дихлоретані (2,5мл) при кімнатній температурі Суміш нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 17 годин і потім залишали для охолоджування до кімнатної температури та концентрували Додавали метанол (2,5мл) і суміш нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 2,5 годин, залишали для охолоджування і концентрували (9) (2-Брометил)бензол (0,18мл, 1,30ммоль) додавали при перемішуванні до охолодженого льодом розчину г\І,г\І-діетил-4-(г\І-піперидин-4іланіліно)бензаміду (сполука 6) (0,21г, 0,59ммоль), EtsN (0,10мл, 0,75ммоль) та каталітичної КІЛЬКОСТІ 4-диметиламшопіридину в СН2СІ2 (5мл) Перемішувану суміш витримували до досягнення кімнатної температури протягом 5 годин, нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 16 годин, залишали для охолоджування до кімнатної температури, розбавляли СН2СІ2 (Юмл) і промивали Н2О (15мл), насиченим сольовим розчином (15мл) й сушили над К2СОз Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від РпМе до РпМе/Ме2СО (1 2)), одержуючи названу в заголовку сполуку 9 (0,11г, 40%) у вигляді безбарвного масла, яке тверділо при стоянні ІЧ (КВг) 2928, 1612, 1504, 1437, 1280, 1980, 754 см ^ 1 Е ЯМР (CDCI3) 7,36 (т, 2Н), 7,30-7,15 (м, 8Н), 7,01 (д, 2Н), 6,61 (д, 2Н), 3,88 (т, 1Н), 3,42 (шир д, 4Н), 3,08 (д, 2Н), 2,76 (м, 2Н), 2,57 (м, 2Н), 2,17 (т, 2Н), 1,97 (д, 2Н), 1,55 (к, 2Н), 1,18 (т, 6Н) 13 С ЯМР (CDCI3) 171,5, 149,0, 143,5, 140,3, 129,6, 128,6, 128,6, 128,4, 128,1, 126,8, 126,1, 125,4, 116,1, 60,6, 55,5, 53,5, 41 (шир), 33,9, 30,7, 13,6 (шир) Аналіз Розраховано для СзоНз7І\ІзО*0,2СзНбО С 78,66, Н, 8,24, N, 8,99 Знайдено С, 78,55, Н, 7,75, N, 8,91 Приклад 9 (і) Одержання 3-[N-(1 -бензил піперид ин-4 23 іл)аміно]-М,І\І-діетилбензаміду (сполука 10) 54481 24 0,98ммоль), РпзВі (1,10г, 2,50ммоль) і Си(ОАс)2 (0,45г, 2,48ммоль) у толуолі (Юмл) нагрівали при 110°С протягом 12 годин Додавали іншу порцію Си(ОАс)г (0,45г) і суміш нагрівали при 110°С протягом додаткових 12 годин та залишали для охолоджування до кімнатної температури Додавали воду (Юмл) і суміш фільтрували крізь целіт® Шари в фільтраті поділяли і органічну фазу промивали водою, насиченим сольовим розчином, сушили над Na2SO4 і концентрували' Хроматографія залишку (ЕЮАс/гептан, 9 1) давала названу в заголовку сполуку 11 (255мг, 59%) у вигляді блідожовтого густого масла (Ю) Ті (ОІ-РГ)4 (0,70МЛ, 2,37ММОЛЬ) додавали до суміші 3-аміно-(І\І,І\І-діетил)бензаміду (150мг, 0,78ммоль) і 1-бензил-4-піперидону (0,18мл, 0,97ммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом бгодин і перемішували при кімнатній температурі протягом 15 годин Суміш охолоджували на крижаній бані і додавали ЕЮН, (5мл) та ЫаВЬЦ (75мг, 1,98ммоль) Після перемішування протягом 1 години при 0°С і 2 днів при кімнатній температурі, додавали 2 МІЧЬЦОН (5мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (Юмл) і фільтрували крізь целіт® Шари в фільтраті поділяли, водний шар екстрагували СН2СІ2 (3x1 Омл) Об'єднані органічні фази промивали 10% НСІ (2x15мл) рН об'єднаних органічних екстрактів встановлювали до 10 за допомогою 2 н NaOH і екстрагували СН2СІ2 (3x1 Омл) Об'єднані органічні екстракти сушили над Na2SO4, фільтрували, концентрували і залишок очищали хроматографією (ЕЮАс гептан EtsN, 9 1 0,1), одержуючи названу в заголовку сполуку 10 (173 мг, 61%) у вигляді блідо-жовтого густого масла ІЧ (нерозбавлений) 3333,1612 с м 1 1 Н ЯМР (CDCI3) 7,40-7,10 (7Н, м), 6,55 (2Н, м), 3,50 (4Н, м), 3,22 (4Н, м), 2,80 (2Н, м), 2,12 (2Н, м), 2,00 (2Н, м), 1,43 (2Н, м), 1,20 (ЗН, м), 1,05 (ЗН, м) 13 С ЯМР (CDCI3) 171,6, 147,1, 138,3, 138,2, 129,1, 129,0, 128,1, 126,9, 114,6, 113,8, 110,6, 63,0, 52,2, 49,8, 43,1, 38,9, 32,4, 14,1, 12,8 Аналіз Розраховано для С2зНзіМзО*НСІ*211Н2О С, 63,07, Н, 8,28, N, 9,59 Знайдено С, 63,19, Н, 7,94, N, 9,25 (м) Одержання 3-[N-(1 -бензил піперидин-4іл)анілше]-г\І,г\І-діетилбензаміду (сполука 11) (11) Суміш 3-[N-(1 -бензил піперидин-4-іл) аміно]N.N-діетилбензаміду (сполука 10) (360мг, ІЧ (нерозбавлений) 3056, ЗОЮ, 2937, 2810, 1629 с м 1 1 Н ЯМР (CDCI3) 7,40-6,60 (14Н, м), 3,80 (1Н, м), 3,43 (4Н, шир с), 3,20 (2Н, шир с), 2,90 (2Н, м), 2,05 (2Н, м), 1,90 (2Н, м), 1,48 (2Н, м), 1,20 (ЗН, шир), 1,00 (ЗН, шир , с) 15 С ЯМР (CDCI3) 171,3 147,3, 144,4, 138,1, 129,3, 129,0, 128,0, 126,9, 126,4, 123,9, 119,7, 117,5, 116/5, 62,9, 55,3, 53,2, 43,0, 39,0, 30,6, 14,0, 12,7 Аналіз Розраховано для С29Нз5МзО*1125НСІ*015Н20 С, 70,15 Н, 7,41, N, 8,47, СІ, 8,94 Знайдено С, 69,69, Н, 7,34, N, 8,25, СІ, 8,96 Приклад 10 Одержання М,г\І-діетил-3-(г\І-піперидин-4іланіліно)бензаміду (сполука 12) (12) Розчин 3-[N-(1 -бензил піперид ин-4-іл)анілшо]N.N-діетилбензаміду (сполука 11) (102мг, 0,23ммоль) в ЕЮН (15мл) гідрували при 2,812атм (40псі) в присутності каталітичної КІЛЬКОСТІ Pd(OH)2 на вугіллі протягом 2 годин Суміш фільтрували крізь целіт® і концентрували Залишок очищали хроматографією (ЕЮДс/гептанОзЫ, 9 1 0,5), одержуючи названу в заголовку сполуку 12 (50мг, 81%) у вигляді блідо-жовтого в'язкого масла ІЧ (сіль НСІ, нерозбавлена) 3421, 1597, 1494см 1 1 Н ЯМР (CDCI3) 7,80-6,50 (9Н, м), 4,00 (1Н, м), 3,21 (2Н, шир с), 3,30 (2Н, м), 3,20 (2Н, шир с), 2,90 (2Н, м), 2,05 (2Н, м), 1,70 (2Н, м), 1,17 (ЗН, шир с), 1,00 (ЗН, шир с) 13 С ЯМР (CDCI3) 171,0, 143,7, 140,7, 138,0, 129,5, 129,2, 128,2, 124,5, 119,7, 117,9, 116,5, 53,2, 43,1, 41,1, 39,0, 28,7, 14,0, 8,9 Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в простому ефірі до охолодженого льодом розбавленого простим ефіром НСІ Аналіз Розраховано для С28НззО*НСГ1,ЗН2О С, 62,30, Н, 8,08, N, 9,91 Знайдено С, 62,40, Н,7,67, N, 9,80 25 54481 Приклад 11 (і) Одержання 4-[N-(1-бензил піперидин-3іл)амшо]-г\І,г\І-діетилбензаміду (сполука 13) (13) ТІ(ОІ-РГ)4 (2,2мл, 7,45ммоль) додавали до суміші 4-амшо-(г\І,г\І-діетил)бензаміду (0,36г, 1,87ммоль) і 1 -бензил-3-піперидону (0,70г, 3,69ммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом 1 години і перемішували при кімнатній температурі протягом 15 годин Суміш охолоджували на крижаній бані і додавали ЕЮН (15мл) та NaBH4 (0,21г, 5,55ммоль) Після перемішування протягом 16 годин при кімнатній температурі, додавали 2 МІЧЬЦОН (15мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (Юмл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, водний шар екстрагували СН2СІ2 (3x15мл) Об'єднані органічні фази промивали 10% НСІ (2х20мл) рН об'єднаних органічних екстрактів встановлювали до 10 за допомогою 2 н NaOH і екстрагували СН2СІ2 (3x1 Омл) Об'єднані органічні екстракти сушили над Na2SO4, фільтрували і концентрували Залишок очищали хроматографією (ЕЮАс/гептан EtsN, 9 1 0,1), одержуючи названу в заголовку сполуку 13 (0,32г, 47%) у вигляді блідо-жовтого густого масла ІЧ (нерозбавлений) 3320, 1736, 1608см 1 1 Н ЯМР (CDCI3) 7,20 (7Н, м), 6,50 (2Н, м), 4,22 (1Н, шир с), 3,60-3,30 (7Н, м), 2,60 (1Н, м), 2,35 (ЗН, м), 1,65 (2Н, м), 1,50 (2Н, м), 1,10 (6Н, м) 13 С ЯМР (CDCI3) 171,7, 147,9, 138,1, 128,7, 128,4 128,1, 126,9, 124,9, 112,1, 63,0, 58,6, 53,5, 48,3, 41 ,4, 28,6,22,3, 13,4 Аналіз Розраховано для С2зНзіМзО*НСІ*211Н2О С, 62,81, Н, 8,30, N, 9,55 Знайдено С, 62,75, Н, 7,94, N, 9,63 (м) Одержання 4-[N-(1 -бензил піперидин-3іл)анілшо]-г\І,г\І-діети-лбензаміду (сполука 14) (14) Суміш 4-[N-(1 -бензил піперид ин-3-іл)амшо]N.N-діетилбензаміду (сполука 13) (0,29мг, 0,79ммоль), РпзВі (0,87г, 1,98ммоль) і Си(ОАс)2 (0,36г, 1,98ммоль) в толуолі (5мл) нагрівали при 26 110°С протягом 12годин і залишали для охолоджування до кімнатної температури Додавали воду (5мл) і суміш фільтрували крізь целіт® Шари в фільтраті поділяли і органічну фазу промивали водою, насиченим сольовим розчином, сушили над Na2SO4 і концентрували Хроматографія залишку (ЕЮАс/гептан, 9 1) давала названу в заго 27 54481 28 ІЧ (нерозбавлений) ЗОЮ, 2930, 1630, 1610см і 1 (16) Ті (Oi-Pr)4 (6,2мл, 21,0ммоль) додавали до суміші 3-аміно-(І\І,І\І-діетил)бензаміду (1,0г, 5,2ммоль) і 1-бензил-З-піперидону (2,0г, Ю.бммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом 2 годин і перемішували при кімнатній температурі протягом 16 годин Суміш охолоджували на крижаній бані і додавали ЕЮН (ЗОмл) і NaBH4 (0,60г, 15,9ммоль) Після перемішування протягом Ібгодин при кімнатній температурі, додавали 2 МІЧЬЦОН (25мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (25мл) і фільтрували крізь шар целіту® Жари в фільтраті поділяли і водний шар екстрагували СН2СІ2 (Зх25мл) Об'єднані органічні фази промивали 10% НСІ (2х25мл) рН об'єднаних водних екстрактів встановлювали до 10 за допомогою 2 н NaOH і екстрагували СН2СІ2 (Зх25мл) Об'єднані органічні екстракти сушили над Na2SO4, фільтрували і концентрували Залишок очищали хроматографією (ЕЮАс/гептан/ЕізІЧ 9 1 0,1), одержуючи названу в заголовку сполуку 16 (1/10г, 58%) у вигляді блідожовтого в'язкого масла ІЧ (нерозбавлений) 3327, 1606, 1440 см 1 1 Н ЯМР (CDCI3) 7,40-7,00 (7Н, м), 6/60-6,40 (2Н, м), 4,20 (1Н, шир с), 3,50 (4Н, м), 3,20 (2Н, шир с), 2,60 (1Н, м), 2,40-2,20 (ЗН, м), 1,70 (2Н, м), 1,50 (2Н, м), 1,20 (ЗН, шир с), 1,00 (ЗН, шир с) 1 Х ЯМР (CDCI3) 171,4, 146,9, 138,1, 137,9, 128,9, 128,6, 127,9, 126,7, 114,1, 113,5, 110,4, 62,8, 58,5, 53,3, 48,3, 42,9, 38,7, 28,6, 22,2, 13,9, 12,6 (м) Одержання 3-[N-(1 -бензил піперид ин-3іл)анілшо]-г\І,І\І-діетилбензаміду (сполука 17) (17) Суміш 3-[N-(1 -бензил піперид ин-3-іл)амшо]N.N-діетилбензаміду (сполука 16) (0,25мг, 0,68ммоль), РпзВі (0,75г, 1,70ммоль) і Си(ОАс)2 (0,31мг, 1,70ммоль) в толуолі (5мл) нагрівали при 110°С протягом 14 годин і залишали для охолоджування до кімнатної температури Додавали воду (5мл) і суміш фільтрували крізь целіт® Шари в фільтраті поділяли і органічну фазу промивали водою і насиченим сольовим розчином, сушили над Na2SO4 і концентрували Хроматографія залишку (ЕЮАс/гептан, 9 1) давала названу в заголовку сполуку 17 (0,16г, 52%) у вигляді блідожовтого в'язкого масла Н ЯМР (CDCI3) 7,40-6,60 (14Н, м), 4,05 (1Н, м), 3,45 (4Н, шир с), 3,18 (2Н, м), 2,75 (1Н, м), 1,90 (1Н, м), 1,80-1,60 (4Н, м), 1,18 (ЗН, шир с), 1,00 (ЗН, шир с) 13 С ЯМР (CDCI3) 171,3, 147,1, 144,5, 138,3, 138,1, 129,3, 129,1, 128,8, 128,1, 126,9, 125,9, 123,7, 119,8, 117,8, 116,9, 63,0, 57,5, 54,4, 53,2, 43,1, 39,0, 29,9, 25,0, 14,1, 12,8 Аналіз Розраховано для С29Нз5О*1,4НСІ*0,5Н2О С, 69,38, Н, 7,46, N, 8,37, СІ, 9 ,91 Знайдено С, 69,11, Н, 7,14, N, 8,08, СІ, 10,12 Приклад 14 Одержання М,г\І-діетил-3-(г\І-піперидин-3іланіліно)бензаміду (сполука 18) (18) Розчин 3-[N-(1 -бензил піперид ин-3-іл)анілшо]N.N-діетилбензаміду (сполука 17) (50мг, 0,11ммоль) в ЕЮН (5мл) гідрували при 2,109атм (ЗОпсі) в присутності каталітичної КІЛЬКОСТІ Pd(OH)2 на вугіллі протягом 6 годин Суміш фільтрували крізь целіт®, концентрували і залишок очищали хроматографією (градієнт, ЕЮАс/гептан/ЕізІЧ від 9 1 0 до 9 1 0,5), одержуючи названу в заголовку сполуку 18 (15мг, 36%) у вигляді блідо-жовтого в'язкого масла 1 Н ЯМР (CDCI3) 7,40-6,60 (9Н, м), 4,40 (1Н, м), 3,60 (2Н, м),), 3,40 (2Н, шир с), 3,15 (ЗН, м), 2,50 (2Н, м), 1,80 (2Н), 1,20 (2Н, м), 1,18 (ЗН, шир с), 0,95 (ЗН, шир с) 1 Х ЯМР (CDCI3) 171,2, 146,9, 144,0, 138,0, 129,4, 126,4, 124,3, 119,7, 117,8, 116,5, 54,1, 45,1, 43,1, 39,0, 30,0, 14,0, 12,7 Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в простому ефірі до охолодженого льодом розбавленого простим ефіром НСІ ІЧ (нерозбавлений) 3412, 1598, 1493 см 1 Аналіз Розраховано для СггНгэС^НСГНгО С, 65,09, Н, 7,95, N, 10,35 Знайдено С, 65,03, Н, 7,80, N, 10,02 Приклад 15 (і) Одержання 4-[N-(1 -бензил піролідин-3іл)аміно]-г\І,г\І-діетилбензаміду (сполука 19) О (19) 29 54481 ТІ(0І-РГ)4 (3,1мл, 10,4ммоль) додавали до суміші 4-аміно-(І\І,І\І-діетил)бензаміду (0,50г, 2,51ммоль) і 1-бензил-З-піролідону (0,85мл, 5,30ммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом 3 годин і перемішували при кімнатній температурі протягом 16 годин Суміш охолоджували на крижаній бані і додавали ЕЮН (ЗОмл) та NaBH4 (0,30г, 8,00ммоль) Після перемішування протягом 16 годин при кімнатній температурі додавали 2MNH4OH (20мл) Суміш перемітували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (20мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, водний шар екстрагували СН2СІ2 (Зх20мл) Об'єднані органічні фази промивали 10% НСІ (2х20мл) рН об'єднаних водних екстрактів встановлювали до 10 за допомогою 2 н NaOH і екстрагували СН2СІ2 (Зх20мл) Об'єднані органічні екстракти сушили над Na2SO4, фільтрували, концентрували і залишок очищали хроматографією (градієнт, ЕЮАС/гептан EtsH, від 9 1 0,5 до 9 01), одержуючи названу в заголовку сполуку 19 (0,40г, 44%) у вигляді блідо-жовтого в'язкого масла ІЧ (нерозбавлений) 3322, 1609, 1527, 1455 см і 1 Н ЯМР (CDCI3) 7,40-7,10 (7Н, м), 6,60-6,40 (2Н, м), 4,20 (1Н, м), 3,95 (1Н, м), 3,55 (2Н, с), 3,35 (4Н, шир с), 2,70 (2Н, м), 2,50-2,35 (2Н, м), 2,25 (1Н, м), 1,60 (1Н, м), 1,15 (6Н, шир т) 13 С ЯМР (CDCI3) 171,4, 148,2, 138,4, 128,5, 128,2, 128,1, 126,7, 126,1, 113,8, 112,1, 60,5, 59,9, 52,5, 51,9, 41 (b), 32,2, 13,3 (м) Одержання 4-[N-(1 -бензил піролідин-3іл)анілшо]-г\І,г\І-діетилбензаміду (сполука 20) п (20) Суміш 4-[N-(1 -бензилпіролідин-3-іл)аміно]-г\І,г\Ідіетилбензаміду (сполука 19) (0,40мг, 1,14ммоль), РгізВі (1,25г, 2,84ммоль) і Си(ОАс)2 (0,52мг, 2,86ммоль) в толуолі (Юмл) нагрівали при 110°С протягом 16 годин і залишали для охолоджування до кімнатної температури Додавали воду (5мл) і суміш фільтрували крізь целіт® Фільтрат промивали водою, сольовим розчином, сушили над Na2SO4 і концентрували Хроматографія залишку (ЕЮАс/МеОН, 95 5) давала названу в заголовку сполуку 20 (0,19г, 40%) у вигляді блідо-жовтого в'язкого масла 1 Н ЯМР (CDCI3) 7,40-7,18 (10Н, м), 7,05 (2Н, м), 6,70 (2Н, м), 4,57 (1Н, м), 3,60 (1Н, шир с), 3,40 (5Н, м), 2,80 (1Н, м), 2,60 (1Н, м), 2,58 (2Н, м), 2,20 (1Н, м), 1,90 (1Н, м), 1,18 (6Н, шир с) 13 С ЯМР (CDCI3) 171,4, 149,3, 145,2, 138,9, 129,4, 128,4, 128,1, 128,0, 127,7, 127,2, 126,7, ЗО 125,0, 117,1, 60,3, 58,3, 57,8, 53,0, 41 (Ь), 29,5, 13,4 Аналітичний зразок одержували у вигляді пдрохлориду доданням розчину вільної основи в простому ефірі до охолодженого льодом розбавленого простим ефіром НСІ ІЧ (нерозбавлений) 3430, 1610, 1457 см 1 Аналіз Розраховано для С28НззО*НСГ1,ЗН2О С, 68,99, Н, 7,24, N, 8,62 Знайдено С, 68,99, Н, 7,57, N, 8,62 Приклад 16 Одержання М,г\І-діетил-3-(г\І-піролідин-3іланіліно)бензаміду (сполука 21) (21) Суміш сполуки 20 (90мг, 0,2105ммоль), NH4O2CH (27мг, 0,4282ммоль) і каталітичної КІЛЬКОСТІ 10% Pd/C в МеОН (5мл) енергійно перемішували при кімнатній температурі протягом ночі Каталізатор вилучали за допомогою целіту і фільтрат концентрували у вакуумі, одержуючи сирий зразок, який очищали шляхом MPLC (СН2СІ2 МеОН (10% ТФО), від 100 0 до 9 1, на силікагелі 60), одержуючи названу в заголовку сполуку 21 (ЗОмг, 42%) у вигляді блідо-жовтого густого масла ІЧ (сіль НСІ, плівка) v 3428 (NH), 1607 (CONEW см 1 Н ЯМР (вільний амін, 400МГц, CDCI3) 5 1,06 (6Н, м, 2хСН2СН3), 1,90 (1Н, м, ArNCHCH(CH)CH2), 2,30 (1Н, м, ArNCHCH(CH)CH2), 2,58 (2Н, м, ArNCHCH2CH2N), 2,95 (1Н, м, NHCH(CH)CH2), 3,23 (1Н, м, NHCH(CH)CH2), 3,40 (4Н, шир с, 2хСН2СН3), 4,70 (1Н, м, ArNCH), 6,68 (2Н, м, Аг), 7,02 (2Н, м, Аг), 7,22 (ЗН, м, Аг), 7,38 (2Н, м, Аг) С ЯМР (вільний амін, 100Гц, CDCI3) d 13,4, 29,7, 41,9, 54,6, 57,9, 59,3, 117,5, 125,5, 127,9, 128,0, 129,7, 144,8, 149,2, 171,2 Елементний аналіз Розраховано для С, 57,66, Н, 7,37, N, 9,61 Знайдено С, 57,86, Н, 7,38, N, 9,03 Приклад 17 (і) Одержання 4-[N-(1 -бензил піперидин-4іл)аміно]-г\І,г\І-діетилбензолсульфонаміду (сполука 22) 31 54481 (22) Ti(0i-Pr)4 (2,10мл, 7,10ммоль) додавали до суміші 4-аміно-(М,І\І-діетил)бензолсульфонаміду (0,81г, 3,55ммоль) і 1-бензил-4-піперидону (0,99мл, 5,32ммоль) при кімнатній температурі Суміш обробляли ультразвуком при 40°С протягом 40 хвилин і перемішували при 60°С протягом 18 годин Темну суміш охолоджували на крижаній бані і додавали ЕЮН (15мл), потім гранули NaBbU (0,5г, 13,2ммоль) Після перемішування протягом 1 години при 0°С і 20год при кімнатній температурі додавали 1 МІЧЬЦОН (5мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли СН2СІ2 (20мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, водний шар екстрагували СН2СІ2 (15мл) і об'єднані органічні фази промивали ЫаНСОз (водний, насичений, 25мл) і сушили над К2СО3 Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт від РпМе до Ме2СО), одержуючи названу в заголовку сполуку 22 (0,91 г, 46%) у вигляді рудувато-коричневого твердого матеріалу ІЧ (КВг) 2942, 1560, 1520, 1321, 1146, 920 см 1 1 Н ЯМР (CDCI3) 7,55 (д, 2Н), 7,34-7,23 (м, 5Н), 6,54 (д, 2Н), 4,08 (д, 1Н), 3,53 (с, 2Н), 3,29 (шир с, 1Н), 3,17 (к, 4Н), 2,85 (д, 2Н), 2,16 (т, 2Н), 2,01 (д, 2Н)/1,51 (к, 2Н), 1,11 (т, 6Н) 13 С ЯМР (CDCI3) 150,2, 138,2, 129,1, 129,0, 128,2, 127,0, 126,8, 63,0, 52,1, 49,6, 41,9, 32,2, 14,1 (м) Одержання 4-[N-(1 -бензил піперидин-4іл)анілшо]-г\І,І\І-діетилбензолсульфонаміду (сполука 23) 32 перемішували при КИПЯТІННІ із зворотним холодильником протягом 24 годин і додавали РпзВі (0,58г, 1,31ммоль) і Си(ОАс)2, (0,30г, 1,64ммоль) Після КИП'ЯТІННЯ ІЗ зворотним холодильником протягом 24 годин суміш залишали для охолоджування і гасили IMNH4OH (5мл) Суміш перемішували при кімнатній температурі протягом ЗО хвилин, розбавляли ЕЮАс (25мл) і фільтрували крізь шар целіту® Шари в фільтраті поділяли, темно-синій водний шар екстрагували ЕЮАс (25мл) і об'єднані органічні фази промивали Н2О (50мл) і насиченим сольовим розчином (25мл) та сушили над К2СОз Суміш фільтрували, концентрували і залишок очищали хроматографією (градієнт, від РпМе до Ме2СО), одержуючи названу в заголовку сполуку 23 (50мг, 10%) у вигляді коричневого масла 1 Н ЯМР (CDCI3) 7,51 (д, 2Н), 7,43 (т, 2Н), 7,35 (т, 1Н), 7,30-7,22 (м, 5Н), 7,07 (д, 2Н), 6,48 (д, 2Н), 3,86 (т, 1Н), 3,48 (с, 2Н), 3,18 (к, 4Н), 2,94 (д, 2Н), 2,11 (т, 2Н), 1,91 (д, 2Н), 1,50 (к, 2Н), 1,11 (т, 6Н) 13 С ЯМР (CDCI3) 151,8, 141,5, 138,1, 131,1, 129,9, 129,1, 128,6, 128,1, 127,5, 127,0, 125,9, 112,7, 63,0, 55,8, 53,1, 42,0, 30,6, 14,2 Очистка ВЕРХ (LiChroPrep RP-18, елюювання зі зростаючим вмістом 0,1% ТФО/MeCN в 1% ТФО/Н2О) давала аналітичний зразок у вигляді білого твердого матеріалу ІЧ (КВг) 3433, 1677, 1586, 1496, 1324, 1196, 1148, 719см 1 Аналіз Розраховано для C28H35N3O2S*1,25CF3COOH С, 59,07, Н, 5,89, N, 6,78 Знайдено С, 59,00, Н, 6,01, N, 7,01 Приклад 18 Одержання г\І,г\І-діетил-4-(г\І-піперидин-4іланіліно)бензолсульфонаміду (сполука 24) (24) (23) Суміш 4-[N-(1 -бензил піперид ин-4-іл)амшо]І\І,г\І-діетилбензолсульфонаміду (сполука 22) (0,44мг, 1,10ммоль), Ph3Bi (0,58г, 1,31ммоль) і Си(ОАс)2 (0,30мг, 1,64ммоль) в РпМе (Юмл) нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 24годин Додавали РпзВі (0,58г, 1,31ммоль) і Си(ОАс)2 (0,30г, 1,64ммоль) Суміш (1-Хлоретил) хлорформіат (Юмкл, 0,1ммоль) додавали до розчину 4-[І\І-(1-бензилпіперидин-4іл)анілшо]-г\І,г\І-діетилбензолсульфонаміду (сполука 23) (19мг, 40 мкмоль) в толуолі (1мл) при кімнатній температурі Суміш нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 16 годин, залишали для охолоджування до кімнатної температури і концентрували Додавали метанол (1мл) і суміш нагрівали при КИП'ЯТІННІ ІЗ зворотним холодильником протягом 4 годин, залишали для охолоджування і концентрували Залишок розподіляли між СН2СІ2 (5мл) і 1MNH4OH (5мл) Шари поділяли і органічну фазу промивали Н2О (5мл) і насиченим сольовим розчином (5мл) та сушили над К2СОз Суміш фільтрували, концентрували і залишок очищали ВЕРХ (LiChroPrep RP-18, елюювання з зростаючим вмістом 0,1% ТФО/MeCN в 0,1% ТФО/Н2О), одержуючи названу в заголовку 33 сполуку 24 (13мг, 84%) у вигляді трифторацетату ІЧ (КВг) 3420, 1658, 1199, 1146, 714 см 1 1 Н ЯМР (CDCI3) 5 7,66-7,63 (м, 4Н), 7,55 (т, 1Н), 7,28 (д, 2Н), 6,76 (д, 2Н), 4,50 (т, 1Н), 3,54 (д, 2Н), 3,35-3,23 (м, 6Н), 2,34 (д, 2Н), 1,73 (к, 2Н), 1,19 (т, 6Н) 13 С ЯМР (СВСІз) 5 153,4, 142,4, 132,8, 131,7, 130,1, 129,7, 128,8, 114,4, 53,6, 45,2, 43,6, 29,2, 14,9 Аналіз Розраховано для C28H35O2SX2CF3COOHXI ,5Н2О С, 46,73, Н, 5,33, N, 6,54 Знайдено С, 46,54, Н, 5,01, N, 6,71 Кращий спосіб втілення винаходу, відомий зараз, має використовувати сполуки прикладу 1, 2, З, 4, 5, 6, 7, 17та18 Фармацевтичні композиції Нові сполуки ВІДПОВІДНО ДО ЦЬОГО винаходу можна вводити перорально, внутрішньом'язово, підшкірне, локально, штраназально, внутрішньочеревне, штраторакально, внутрішньовенне, епідурально, внутрішньооболонково, штрацеребровентрикулярно і шляхом ін'єкції В суглоби Більш прийнятним способом введення є пероральний, внутрішньовенний або внутрішньом'язовий Доза залежатиме від способу введення, тяжкості хвороби, віку і маси пацієнта та інших факторів, які зазвичай розглядаються штатним лікарем лікарні, коли визначення індивідуальної схеми прийому лікарського засобу та рівня дози найкраще підходить конкретному пацієнту Для одержання фармацевтичних композицій з сполук даного винаходу інертні, фармацевтичне прийнятні носи можуть бути або твердими, або рідкими Препарати в твердій формі включають порошки, таблетки, дисперговані гранули, капсули, саше та супозиторії Твердим носієм може бути одна чи кілька речовин, що можуть діяти також як розріджувачі, коригенти, солюбілізатори, змащувальні речовини, суспендувальні агенти, зв'язувальні агенти або агенти, що дезинтегрують таблетки, ним може бути також капсулюючий матеріал В порошках носій являє собою тонкоздрібнений твердий матеріал, що перебуває в суміші з тонкоздрібненим активним компонентом В таблетках активний компонент змішують з носієм, який має необхідні зв'язувальні властивості, в підхожих пропорціях та пресують для одержання потрібної форми і розміру Для одержання композицій в формі супозиторіїв низькоплавкий віск, такий як суміш гліцеридів жирних кислот і какао-масла, спочатку розплавляють та в ньому диспергують активний інгредієнт, наприклад, шляхом перемішування Розплавлену гомогенну суміш потім виливають у форми узвичаєного розміру і залишають для охолоджування та твердіння Підхожими НОСІЯМИ Є карбонат магнію, стеарат магнію, тальк, лактоза, цукор, пектин, декстрин, крохмаль, трагакант, метилцелюлоза, натрійкарбоксиметилцелюлоза, низькоплавкий віск, какаомасло тощо Фармацевтичне прийнятні солі являють собою ацетат, бензолсульфонат, бензоат, бікарбонат, 54481 34 бітартрат, бромід, кальційацетат, камсилат, карбонат, хлорид, цитрат, дипдрохлорид, етилендіамінтетраацетат, едисилат, естолат, езилат, фумарат, глю-каптат, глюконат, глутамат, гліколліларсанілат, гексилрезорцинат, пдрабамш, пдробромід, пдрохлорид, пдроксинафтоат, йодид, ізетюнат, лактат, лактобюнат, малат, малеат, манделат, мезилат, метилбромід, метил нітрат, метилсульфат, мукат, напсилат, нітрат, памоат (ембонат), пантотенат фосфат/дифосфат, полігалактуронат, саліцилат, стеарат, субацетат (основна оцтовокисла сіль), сукцинат, сульфат, танат, тартрат, теоклат, триетюдид, сіль бензатину, хлорпрокашу, холіну, діетаноламшу, етилендіаміну, меглуміну, прокажу, алюмінію, кальцію, ЛІТІЮ, магнію, калію, натрію та цинку Більш прийнятними фармацевтично прийнятними солями є пдрохлориди, трифторацетати і бітартрати Термін композиція включає готову форму активного компонента з капсулюючим матеріалом в якості носія, що забезпечує утворення капсули, в якій активний компонент (з іншими носіями або без них) оточується носієм, який, таким чином, перебуває в асоціації з ним Аналогічним чином включаються саше Як тверді лікарські форми, ПІДХОЖІ ДЛЯ перорального введення, можна використовувати таблетки, порошки, саше та капсули Композиції в рідкій формі включають розчини, суспензії і емульсії Як приклади рідких препаратів, підхожих для парентерального введення, можна зазначити розчини активних сполук в стерильній воді або суміші вода-пропіленгліколь РІДКІ КОМПОЗИЦІЇ можна також виготовляти у розчині водного поліетиленгліколю Водні розчини для перорального введення можна одержати розчиненням активного компонента у воді і доданням підхожих барвників, коригентів, стабілізаторів та загущувачів, якщо необхідно Водні суспензії для перорального використання можна приготувати диспергуванням тонкоздрібненого активного компонента у воді разом з в'язким матеріалом, таким як синтетичні камеді, смоли/ метилцелюлоза, натрійкарбоксиметил целюлоза, та іншими суспендувальними агентами, відомими в галузі фармацевтичних готових препаративних форм Більш прийнятно, фармацевтичні композиції перебувають у вигляді одиничної дози В такій формі композиція поділена на одиничні дози, що містять підхожу КІЛЬКІСТЬ активного компонента Одинична доза може бути упакованим препаратом, причому упаковка містить дискретні КІЛЬКОСТІ препаратів, наприклад, упаковані таблетки, капсули і порошки в пляшечках чи ампулах Одинична дозована форма може також являти собою капсулу, саше чи таблетку або вона може являти собою підхоже число будь-якої з цих упакованих форм Біологічна оцінка А) Модель in vitro Клітинна культура Клітини 293S людини, що експресують клоновані рецептори людини [J, 5 та к і СТІЙКІ ДО неоміцину, вирощували в суспензії при 37°С в атмосфері з 5% СОг У струшуваних колбах, що містять 35 DMEM (модифіковане у спосіб Дульбеко середовище Ігла) без кальцію, 10% ФТС, 5% BCS, 0,1% плюронік F-68T3 600мкг/мл генетицину Препарат мембрани Клітини збирали у вигляді осаду після центрифугування та повторно суспендували в буфері для лізісу (50мМ Трис, рН 1,0, 2,5мМ ЕДТУ з ФМСФ, доданим безпосередньо перед використанням до 0,1 мМ з 0,1 М вихідного розчину в етанолі), інкубували на льоду протягом 15 хвилин, потім гомогенізували з політроном протягом ЗОсек Суспензію центрифугували при 1000g (max) протягом 10 хвилин при 4°С Супернатант зберігали на льоду і осад ресуспендували та центрифугували, як зазначено вище Супернатанти з обох центрифугувань об'єднували і центрифугували при 46000g (max) протягом ЗОхвилин Осад ресуспендували в холодному буфері Трис (50мМ Трис/С1, рН 7,0) і центрифугували знову Кінцевий осад ресуспендували в буфері для мембран (50мМ Трис, 0.32М сахароза, рН 7,0) Аліквоти (1мл) в поліетиленових пробірках заморожували в системі сухий лід/етанол і зберігали при -70°С до використання Концентрації білка визначали модифікованим аналізом Lowry з ДСН Аналіз зв'язування Мембрани розморожували при 37°С, охолоджували на льоду, пропускали 3 рази через голку 25 G і розв-одили в буфері для зв'язування (50мМ Трис, ЗмМ МдСІ2, 1мг/мл АБС (Sigma A-7888), рН 7,4, який зберігали при 4°С після фільтрування крізь фільтр 0,22т і до якого ТІЛЬКИ-НО додали 5мкг/мл апротиншу, ЮмкМ бестатину, ЮмкМ дипротину А без ДТТ) В охолоджені на льоду поліпропіленові пробірки розміром 12х75мм, що містять ЮОмкл підхожого радіоактивного ліганду і Юмкл випробовуваних пептидів при різних концентраціях, додавали аліквоти ЮОмкл Загальне (33) і неспецифічне (НЗ) зв'язування визначали за відсутності і в присутності ЮмкМ налоксона, ВІДПОВІДНО Пробірки струшували вортексом та інкубували при 25°С протягом 60 - 75 хвилин, після цього часу вміст швидко фільтрували у вакуумі і промивали близько 12мл/пробірку охолодженого льодом буферу для промивання (50мМ Трис, рН 7,0, ЗмМ МдСІ2) крізь фільтри GF/B (Ватман), попередньо вимочені протягом, принаймні, 2 годин в 0,1% поліетиленімші Радіоактивність (число розпадів за хвилину), що збереглася на фільтрах, вимірювали бета-лічильником після вимочування фільтрів протягом, принаймні, 12 годин в мінісклянках, що містять 6 - 7мл сцинтиляційної рідини Якщо аналіз проводили в планшетах з 96 глибокими лунками, фільтрування виконували крізь 96 однакових, попередньо вимочених в ПЕІ, фільтрів, які промивали 3x1 мл буфером для промивання і сушили в сушильній шафі при 55°С протягом 2 годин Радіоактивність пластин фільтрів підраховували в TopCount (Packard) після додання 50мкл сцинтиляційної рідини MS-20/лунку Аналіз даних Специфічне зв'язування (СЗ), яке обчислюється як 33-НЗ і СЗ в присутності різних випробовуваних пептидів, виражали як відсоток СЗ від контролю Величини ІС50 і коефіцієнт Хіла (пн) для 54481 36 лігандів у витісненні специфічно зв'язаного радіоактивного ліганду обчислювали з лопстичних діаграм або програм для побудови кривих, таких як Ligand, GraphPad Prism, SigmaPlot або RecepyorFit Величини К, розраховували по рівнянню Cheng-Prussoff Величини середніх значень ± середньоквадратична помилка для ICso/K, і п н приводились для випробовуваних лігандів, принаймні, втрьох кривих витиснення Експерименти з насичення рецепторів Величини К5 радіоактивного ліганду визначали шляхом проведення аналізів зв'язування на клітинних мембранах з підхожими радіоактивними лігандами при концентраціях в діапазоні від 0,2 до 5-кратних концентрацій оціненого К5 (аж до 10кратного, якщо можливі такі КІЛЬКОСТІ потрібного радіоактивного ліганду) Специфічне зв'язування радіоактивного ліганду виражали як пмоль/мг мембранного білка Величини К5 і Втах з окремих експериментів одержували з нелінійної залежності специфічно зв'язаного (В) ліганду від нМ вільного (F) радіоактивного ліганду з окремого експерименту ВІДПОВІДНО до односайтової моделі В) Біологічна модель (модель in vivo) Повний Ад'ювант Фрейнда (FCA) і mechanoallodyma у щурів, індукована манжетою сідничного нерва Тварини Використовували самців щурів Sprague Dawley (Charles River, St-Constant, Canada) вагою 175 200г під час хірургічної операції, їх поділяли на групи потри особини у кожній і приміщували в кімнати, в яких за допомогою термостату підтримували температуру 20°С, при циклі світлол'емрява 12 12 і при вільному доступі до їжі і води Після прибуття тваринам давали акліматизуватись протягом, принаймні, 2 днів перед хірургічною операцією Експерименти були схвалені ВІДПОВІДНИМ Комітетом з медичної етики для дослідження тварин Експериментальна процедура повний Ад'ювант Фрейнда Щурів спочатку анестезували в галотановій камері, після чого їм вводили Юмкл FCA шляхом підшкірної ін'єкції утильну поверхню лівої лапи між другим і третім ЗОВНІШНІМИ пальцями Потім тваринам давали відновитись від анестезії, спостерігаючи за ними в клітках Манжета сідничного нерва Тварин готували згідно з методом, описаним Mosconi and Kruger (1996) Щурів анестезували сумішшю кетамшу/ксилазину (2мл/кг, внутрішньочеревне), клали на правий бік та робили поздовжній розріз по всій тильній стороні лівого стегна М'язи у верхній чверті відсували, розкриваючи сідничний нерв, навколо якого приміщували пластмасову манжету (трубка з ПЕ-60, завдовжки 2мм) Потім рану закривали за допомогою накладення 30 вікрилового і шовкового хірургічних швів у два шари Визначення Mechano-Allodyma у спосіб von frey Випробування проводили між 08 00 і 16 ООгодинами, застосовуючи спосіб, описаний Chaplan et al (1994) Щурів приміщували в клітини з плексигласу на підлогу з дротяної сітки, що за 54481 38 37 безпечувала доступ до лапи, і залишали їх 10 - 15 вання лапи використовували потім наступний, хвилин Випробовуваною ділянкою була середина слабкіший дратівник Для обчислення оптимальнопідошви лівої задньої лапи, при цьому уникали го порогового значення за допомогою цього метоменш чутливих подушечок на лапі Лапи торкались да потрібно 6 ВІДПОВІДНИХ реакцій, що безпосередпо черзі 8 волосками Фон Фрея (Von Frey) з жорстньо наближаються до 50% рівня, і підрахунок цих 6 кістю, що логарифмічне збільшується (0,41, 0,69, відповідей починали, коли мала місце перша зміна 1,20, 2,04, 3,63, 5,50, 8,51 і 15,14 грам, Stoeltmg, у ВІДПОВІДНІЙ реакції, наприклад, коли поріг був 111, USA) Волосок Фон Фрея прикладали знизу вперше перетнутий Утих випадках, коли порогові крізь дротяну підлогу перпендикулярно поверхні значення залишались за межами діапазону дратіподушки лапи із достатнім зусиллям до невеликої вливих стимулів, ВІДПОВІДНО брали значення 15,14 вм'ятини у лапі та тримали приблизно 6 - 8 секунд (нормальна чутливість) або 0,41 (максимально Позитивну реакцію відзначали, якщо лапа була allodymc) Одержаний зразок позитивних і негативрізко відсмикнута Здригання відразу після вилуних відповідей зводили у таблицю, використовуючення волоска також розглядали як позитивну реачи перетворення, Х=відсутність відсмикування, кцію Пересувну здатність розглядали як сумнівну О=відсмикування та 50% порогове значення відВІДПОВІДЬ, і в таких випадках стимулювання повтосмикування інтерполювали з використанням форрювали мули Протокол випробування Тварин випробовували на перший день після операції (група, яка одержувала FCA) і на 7 день після операції (група з манжетою сідничного нерва) 50% порогове значення відсмикування лапи визначали, використовуючи метод вверх-вниз Диксона (Dixon) (1980) Випробування починали з використання волоска 2,04г, середнього у цій серії Стимуляцію використовували завжди послідовно, або у міру збільшення, або зменшення За відсутності відповідної реакції відсмикування лапи на волосок, який використовували спочатку, застосовували більш сильний дратівник, у разі відсмикупорогове значення обробки лікарським порогове значення контролю засобом 50% 5 порогове значенням 0{xf+k5|/10000 де Х^значення останнього волоска Фон Фрея, який використовували (log одиниці), к=табличне значення (з Chaplan et al (1994)) для моделі позитивної/негативної відповідей і 5=середня різниця між стимулами (log одиниці) Тут 5=0,224 Порогові значення Фон Фрея були перетворені у ВІДСОТКОВІ значення максимально можливого ефекту (% ММЕ), згідно з Chaplan et al , 1994 Для розрахування % ММЕ використовували таке рівняння (д)- порогове (д)- порогове Введення випробовуваного засобу Щурам ін'єкували (підшкірне, внутрішньочеревно або вводили перорально) випробовувану сполуку до проведення випробування Фон Фрея, при значення значення allodyma allodyma (g) (g 100 цьому час між введенням випробовуваної сполуки і випробуванням у спосіб фон Фрея змінювалось залежно від природи випробовуваної сполуки 39 структура > дельта 35,05 (n=3) У МИ 3212,60 {пЩ -ЧХ" і 40 54481 3532.27 (n^SJ Каппа 3343.53 n/a 76.35S (n-3) 69.88 fn-4) 4Sfn=2) 132,3 (n*1) 82(n=1J 1711 (n»2) 819(^2) n/a 41 42 54481 71.5В(п«3) ) 2 01 60 3 7.9(=) Ч А 4 . 9 ( = ) 1 0 . 9 ( « ) 1 5 . 2 ( ~) 96 1 n S 2 15 3 n 4 1 84 9 n 3 ^ - ^ v ^ , Ї Й - Х ^ - ч ,і і - ^ * » i > * ^ 4 . J * ^ 1 , S ( « | 29 94 ( = ) 24.4 ( = ) 9 t n3 0DS n 7 42 4 n 5 4 . 2 1 . 3 (л-3) 2 9 . 2 £ в ) 3 7 . 9 ( =J 04 8 3 81 0 пЗ 2 04 2 n 5 6 84.SQ3 {П=ІЗ) • " " S i 2774,509 (n»4) n/a 54481 43 71.435 (n-3) 33,916 (П*3) 0,417 0,919 (n=3) 44 1829,222 (пМ) 3338.108 (л-4) 975.126 (п*4) SS67.721 {n*4} ,759 (n=?) 656.4S3 {П"7) 85,323 (n»5) Підписано до друку 03 04 2003 р 893.220 (n-4) Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюNew compounds with an analgesic action
Назва патенту російськоюНовые соединения с аналгезирующим действием
МПК / Мітки
МПК: A61K 31/63, C07D 207/14, C07D 211/56, C07D 211/58, A61K 31/445, A61K 51/04, A61K 31/4468, A61P 1/00, A61K 31/40, A61K 31/4462, A61P 25/00, A61P 29/00
Мітки: діагностичний, сполуки, композиція, спосіб, основі, аналгезивною, їхній, дією, фармакологічна, агент, отримання
Код посилання
<a href="https://ua.patents.su/22-54481-spoluki-z-analgezivnoyu-diehyu-sposib-kh-otrimannya-farmakologichna-kompoziciya-ta-diagnostichnijj-agent-na-khnijj-osnovi.html" target="_blank" rel="follow" title="База патентів України">Сполуки з аналгезивною дією, спосіб їх отримання, фармакологічна композиція та діагностичний агент на їхній основі</a>
Попередній патент: Аплікатор ляпка
Наступний патент: Спосіб вирощування деревостанів сосни на крупномірний пиловник
Випадковий патент: Спосіб фрагментації каменів у загальній жовчній протоці