Високочисті складні 3,3-дифенілпропіламіномоноефіри
Номер патенту: 81803
Опубліковано: 11.02.2008
Автори: Древс Роланд, Вольфф Ханс-Міхаель, Брайтенбах Армін, Меезе Клаус
Формула / Реферат
1. Фармацевтична композиція, яка містить сполуку загальної формули І
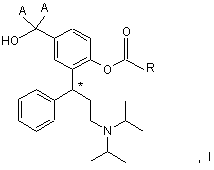
у якій А означає дейтерій або водень, a R являє собою групу, вибрану з C1-C6алкілу, С3-С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-C3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)-конфігурації, (S)-конфігурації або в змішаній конфігурації, яка відрізняється тим, що вона представлена у вигляді вільної основи зі ступенем чистоти вище 97 мас. %.
2. Фармацевтична композиція за п. 1, де у формулі І R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, трет-бутил, ізобутил, пентил і гексил.
3. Фармацевтична композиція за будь-яким з попередніх пунктів, де сполука загальної формули І являє собою 2-[3-(1,1-діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутират.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, де у формулі І позначений символом "*" С-атом знаходиться в (R)-конфігурації.
5. Фармацевтична композиція за будь-яким з попередніх пунктів, де сполука загальної формули І являє собою (R)-2-[3-(1,1-діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутират (фезотеродин).
6. Фармацевтична композиція за будь-яким з попередніх пунктів, у якій фармацевтично прийнятним носієм є полімер.
7. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що в ній сполуки формули І стабілізовані з коефіцієнтом стабілізації, який дорівнює принаймні 2, що розраховується діленням середньомісячного зменшення вмісту сполуки формули І при її зберіганні у вигляді масла при 5 °С при відсутності фармацевтично прийнятного носія на середньомісячне зменшення вмісту відповідної сполуки формули І при її зберіганні при 5 °С в складі зазначеної фармацевтичної композиції.
8. Фармацевтична композиція за будь-яким з пп. 1-7, значення рН якої дорівнює 3,0-6,0.
9. Фармацевтична композиція за будь-яким з попередніх пунктів, призначена для трансдермального або трансмукозного введення в організм.
10. Фармацевтична композиція за будь-яким з попередніх пунктів, яка містить полімерний шар, у якому сполука загальної формули І, зазначена в будь-якому з пп. 1-5, знаходиться в розчиненому або диспергованому вигляді.
11. Фармацевтична композиція за п. 10 з полімерним шаром, який містить контактний клей, що дозволяє фіксувати її на шкірі або на слизовій оболонці пацієнта.
12. Фармацевтична композиція за п. 11, у якій полімерний шар містить контактний клей, який дозволяє фіксувати її на шкірі або на слизовій оболонці пацієнта і який вибраний із групи контактних клеїв на основі силікону, акрилату, SXS, ПІБ або ЕВА.
13. Фармацевтична композиція за будь-яким з попередніх пунктів, яка являє собою трансдермальну терапевтичну систему, у якій діюча речовина введена в клейову матрицю.
14. Фармацевтична композиція за будь-яким з попередніх пунктів, у вигляді дозованої лікарської форми, яка містить принаймні 3 мг сполуки загальної формули І, зазначеної у будь-якому з пп. 1-5.
15. Фармацевтична композиція за п. 14, у якій зазначеною сполукою є (R)-2-[3-(1,1-діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутират (фезотеродин).
16. Набір, який містить фармацевтичну композицію за будь-яким з попередніх пунктів і осушувач.
17. Спосіб одержання сполуки загальної формули І

у якій А означає дейтерій або водень, a R являє собою групу, вибрану з C1-C6алкілу, С3-С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-C3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)-конфігурації, (S)-конфігурації або в змішаній конфігурації, у вигляді вільної основи зі ступенем чистоти принаймні 97 мас. % шляхом вивільнення основи з кристалічної солі, яка має чистоту принаймні 97 мас. %, загальної формули II
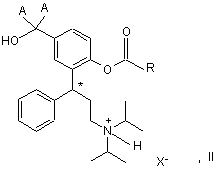
у якій А та R мають зазначені вище значення, а X- означає залишок відповідної фізіологічно сумісної кислоти й у якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)-конфігурації, (S)-конфігурації або в змішаній конфігурації.
18. Спосіб одержання за п. 17, який відрізняється тим, що сполуку формули II піддають у водному розчині взаємодії з відповідним реагентом вивільнення, показник кислотності рКв якого дорівнює 8-11 і який не приводить до осадження сполук формули І.
19. Спосіб за п. 17 або 18, який відрізняється тим, що вільну основу загальної формули І вивільняють із кристалічної солі загальної формули II домішуванням реагенту вивільнення, який вибирають з групи, яка включає
(а) гідрокарбонати лужних металів, лужноземельних металів або амонію,
(б) аміни, поліаміни й основні поліамінокислоти і
(в) основні іоніти.
20. Спосіб за будь-яким з пп. 17-19, який відрізняється тим, що сполуку формули І вивільняють із кристалічної солі формули II домішуванням гідрокарбонату лужного металу, лужноземельного металу або амонію.
21. Спосіб за будь-яким з пп. 17-20, який відрізняється тим, що після вивільнення високочистої основи формули І із кристалічної солі формули II водний розчин екстрагують струшуванням з органічним розчинником і високочисту основу загальної формули І одержують потім шляхом концентрування органічної фази, причому розчинник вибирають із групи, яка включає дихлорметан, етилметилкетон, етилацетат, тpeт-бутилметиловий ефір, діетиловий ефір і толуол.
22. Спосіб за будь-яким з пп. 17-21, який відрізняється тим, що R вибрано з групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутил, пентил і гексил, а позначений символом "*" (зірочкою) С-атом представлений у (R)-конфігурації.
23. Спосіб за будь-яким з пп. 17-22, у якому сполука формули І являє собою (R)-2-[3-(1,1-діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутират.
24. Спосіб за будь-яким з попередніх пунктів, у якому сполука формули II являє собою гідрофумарат (R)-2-[3-(1,1-діізопропіламоній)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутирату.
25. Спосіб одержання фармацевтичної композиції, що містить сполуку, зазначену в будь-якому з пп. 1-15, який відрізняється тим, що зазначену сполуку одержують способом за будь-яким з пп. 17-24 і потім змішують з фармацевтично прийнятним носієм.
26. Застосування фармацевтичної композиції за будь-яким з пп. 1-5 для одержання лікарського засобу.
27. Застосування за п. 26, при якому лікарський засіб призначений для лікування нетримання сечі, гіперактивності детрузора, гіперактивності сечового міхура, полакізурії, ніктурії або імперативного позиву до сечовипускання.
28. Застосування за пп. 26 або 27, при якому лікарський засіб призначений для трансдермального або трансмукозного введення в організм.
29. Застосування за будь-яким з пп. 26-28, при якому лікарський засіб являє собою пластир.
30. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб має
а) полімерний шар, який здатний самоклеїтися, з введеним у нього фезотеродином у вигляді високочистої основи і
б) здатність вивільняти фезотеродин зі швидкістю його проникнення через шкіру людини, що становить від 3 до 15 мг/добу.
31. Гідрокарбонат фезотеродину.
32. Спосіб лікування нетримання сечі, гіперактивності детрузора, гіперактивності сечового міхура, полакізурії, ніктурії або імперативного позиву до сечовипускання, який відрізняється тим, що в організм ссавця вводять композицію за будь-яким з пп. 1-15.
Текст
УКРАЇНА (19) UA (11) 81803 (13) C2 (51) МПК (2006) A61K 9/70 A61K 31/135 A61P 13/00 C07C 213/00 C07C 217/62 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ВИСОКОЧИСТІ СКЛАД НІ 3,3-ДИФ ЕНІЛПРОПІЛАМІНОМОНОЕФІРИ R N , I у якій А означає дейтерій або водень, a R являє собою групу, вибрану з C1-C6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-C3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігураці ї, (S)-конфігураці ї або в змішаній конфігурації, яка відрізняє ться тим, що вона представлена у вигляді вільної основи зі ступенем чистоти ви ще 97 мас. %. 2. Фармацевтична композиція за п. 1, де у форм улі І R вибраний із гр упи , яка включає (13) 81803 O * (11) O HO метил, е ти л, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, трет-бутил, ізобутил, пентил і гексил. 3. Фармаце вти чна композиція за будь-яким з попередні х п унк ті в, де спо лука за га льної фо рм ули І являє собо ю 2-[3-(1 ,1діізопропі ламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират. 4. Фармаце вти чна композиція за будь-яким з попередні х п унк ті в, де у форм улі І позначений символом "*" С-атом знаходиться в (R)конфігурації. 5. Фармаце вти чна композиція за будь-яким з попередні х п унк ті в, де сполука зага льної форм ули І являє собою (R )-2-[3-(1,1діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират (фезотеродин). 6. Фармацевтична композиція за будь -яким з попередні х п ункті в, у якій фармацевтично прийнятним носієм є полімер. 7. Фармаце вти чна композиція за будь -яким з попередні х п унк ті в, яка відрізняє ться тим, що в ній сполуки формули І стабілізовані з коефіцієнтом стабілізації, який до рі вн ює пр инайм ні 2 , що розра хо вується ді ленням сере дньом іся чн о го зменшення вмісту сполуки формули І при її зберіганні у ви гляді масла при 5 °С при відсутності фармацевтично прийнятного носія на середньомісячне зменшення вмісту відп овідно ї сполуки форм ули І при її з бері ганні при 5 ° С в складі зазначеної фармацевтичної композиції. 8. Фармацевтична композиція за будь-яким з пп. 1-7, значення рН якої дорівнює 3,0-6,0. 9. Фармацевтична композиція за будь-яким з попередніх пунктів, призначена для трансдермального або трансмукозного введення в організм. 10. Фарма це вти чна компози ція з а будь-яким з попе редні х п ункті в, яка мі сти ть п оліме рн ий ша р , у я ком у сполука загально ї форм ули І, зазначена в будь -як ом у з пп . 1 -5 , з на хо ди ть ся в розчиненому або диспергованому вигляді. UA (21) a200510471 (22) 03.04.2004 (24) 11.02.2008 (86) PCT/EP2004/003567, 03.04.2004 (31) 103 15 917.7 (32) 08.04.2003 (33) DE (72) БРАЙТЕНБАХ АРМІН, МЕЕЗЕ КЛАУС, ВОЛЬФФ ХАНС-МІХАЕЛЬ , ДРЕВС РОЛАНД (73) ШВАРЦ ФАРМА АГ (56) WO, 01/35957, A1, 2001 WO, 00/12070, A1, 2000 WO, 99/58478, A1, 1999 WO, 94/11337, A1, 1994 (57) 1. Фармацевтична композиція, яка містить сполуку загальної формули І A A C2 2 (19) 1 3 81803 11. Фармацевтична композиція за п. 10 з полімерним шаром, який містить контак тний клей, що дозволя є фіксува ти її на шкірі або на слизо вій о боло нці пацієнта. 12. Фармацевтична композиція за п. 11, у якій полімерний шар містить контактний клей , який дозволя є фіксува ти її на шкірі а бо на слизо вій оболон ці пацієнта і який вибраний із групи контактних клеїв на основі силікону, акрилату, SXS, ПІБ або ЕВА. 13. Фармаце вти чна композиція за будь-яким з попередні х п унк ті в, яка я вля є собою тр ан сде рма льн у те рап е вти чн у систем у, у як ій ді юча ре чо вин а введена в клейову матрицю. 14. Фармаце вти чна композиція за будь-яким з попередні х п унк ті в, у вигляді дозо ван ої лікарської форми , яка мі сти ть прина ймні 3 мг сполуки загальної формули І, зазначеної у будьякому з пп. 1-5. 15. Фармацевтична композиція за п. 14, у якій зазначеною сполукою є (R)-2-[3-(1,1діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират (фезотеродин). 16. Набір, який містить фармацевтичн у композицію за будь-яким з попередніх пунктів і осушувач. 17. Спосіб одержання сполуки загальної формули І A A O HO O R * N , I у якій А означає дейтерій або водень, a R являє собою групу, вибрану з C1-C6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-C3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, у вигляді вільної основи зі ступенем чистоти принаймні 97 мас. % шляхом вивільнення основи з кристалічної солі, яка має чистоту принаймні 97 мас. %, загальної формули II 4 A A O HO R O * + N H , II Xу якій А та R мають зазна чен і ви ще зн ачен ня, а X- озна чає за ли шок відповідної фізіологічно сумісної кислоти й у якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації. 18. Спосіб одержання за п. 17, який відрізняється тим, що сполуку формули II піддають у водному розчині взаємодії з відповідним реагентом вивільнення, показник кислотності рКв якого дорівнює 8-11 і який не приводить до осадження сполук формули І. 19. Сп осі б з а п . 17 або 18 , який від різняє ться тим , що ві льн у о сно ву за га льно ї формули І вивільняють із кристалічно ї солі за гальної формули II домішуванням реагенту вивільнення, який вибирають з групи, яка включає (а) гідрокарбонати лужних металів, лужноземельних металів або амонію, (б) аміни, поліаміни й основні поліамінокислоти і (в) основні іоніти. 20. С посіб за будь-яким з пп . 17 -19 , який від різняє тьс я тим, що сполук у форм ули І виві льняють із кристалі чної солі форм ули II домішуванням гідрокарбона ту лужного металу, лужноземельного металу або амонію. 21. Спосіб за будь-яким з пп. 17-20, який відрізняється тим, що після вивільнення високочистої основи формули І із кристалічної солі формули II во дний розчин екстрагують стр ушуванням з органічним розчинником і високочисту осно ву зага льної формули І одержують потім шля хом концентрування органічної фази, причому розчинник вибирають із групи, яка включає ди хлорметан, етилметилкетон, етилацетат, тpeтбутилметиловий е фір, діетиловий ефір і толуол. 22. Спосіб за будь-яким з пп. 17-21, який відрізняється тим, що R вибрано з групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутил, пентил і гексил, а позначений символом "*" (зіро чкою) С-атом представлений у (R)-конфігурації. 23. Спосіб за будь-яким з пп. 17-22, у якому сполука форм ули І являє собою (R)-2-[3-(1,1діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират. 24. Спосіб за будь-яким з попередніх пункті в, у якому сполука формули II являє собою гідрофумарат (R)-2-[3-(1,1-діізопропіламоній)-1фенілпропіл]-4-(гідроксиметил)фенілізобутирату. 25. Спосіб одержання фармацевтичної композиції, що місти ть сполук у, зазначен у в 5 81803 6 будь-яком у з пп. 1-15, який від різняє ться тим, що зазначе н у сполук у одержують способом за будь-яким з пп. 17-24 і потім змішують з фармацевтично прийнятним носієм. 26. Застосування фармацевтичної композиції за будь-яким з пп. 1-5 для одержання лікарського засобу. 27 . Засто сування з а п . 26 , пр и яком у лікарськи й за сіб приз на чений для лікування нетримання сечі, гіперактивності детр узора, гіперактивності сечового міхура, полакізурії, ніктурії або імперативного позиву до сечовипускання. 28. Застосування за пп. 26 або 27, при якому лікарський засіб призначений для трансдермального або трансмукозного введення в організм. 29. Застосування за будь-яким з пп. 26-28, при якому лікарський засіб являє собою пластир. 30. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб ма є а) по лімерн ий шар , який зда тний самокле їти ся , з введеним у ньо го фезотеродином у вигляді високочистої основи і б) здатність ви вільняти фезо теродин зі швидкістю його проникнення через шкіру людини, що становить від 3 до 15 мг/добу. 31. Гідрокарбонат фезотеродину. 32. Спосіб лікування нетримання сечі, гіперактивності детрузора, гіперактивності сечового міхура , полакізурії, ніктурії або імперативного позиву до се чо вип уска ння , як ий від різняє тьс я тим , що в о р ган ізм сса вця вво дя ть композицію за будь-яким з пп. 1-15. Даний винахід стосується складних 3,3дифенілпропіламіномоноефірів у вигляді високочистих основ, їх одержання та застосування як лікарські засоби, насамперед для трансдермального і трансмукозного введення. За останні 50 років значно зросла частка людей похилого віку в загальній масі населення. У цій групі людей до найбільш розповсюджених захворювань, пов'язаних з віковими змінами організму, відносяться розлади функції сечового міхура. Тому особливого, все більш важливого значення набуває розробка максимально ефективної і м'якої терапії захворювань сечового міхура. При імперативному нетриманні розлад функції сечового міхура обумовлений порушенням функції його м'язів. Причиною такого розладу в багатьох випадках є стимуляція, відповідно гіперактивність мускаринових рецепторів. Тому для терапії гіперактивності сечового міхура і пов'язаних з цим симптомів, таких як підвищений позив до сечовипускання, нетримання, полакізурія або ніктурія, переважно застосовують антимускаринові діючі речовини толтеродин і оксибутинін. Оксибутинін являє собою ефективну антимускаринову діючу речовину, якій, однак, властиві значні побічні дії. При цьому мова насамперед йде про сильно виражену сухість у роті, що у багатьох пацієнтів викликає вкрай неприємні відчуття. Перевага толтеродину на відміну від оксибутиніну полягає приблизно в тому, що він має більш низький набір мускаринових побічних дій. В організмі толтеродин деалкілується переважно під дією ізоферменту 2D6 цитохрому Р450, перетворюючись в головний активний метаболіт 2-[3-(1,1-діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенол, а під дією ізоферменту 3А4 цитохрому Р-450 повільно деалкілується, перетворюючись в неактивний метаболіт. Оскільки толтеродин метаболізується винятково під дією ізоферментів цитохрому Р-450, існує потенційна небезпека взаємодії толтеродину з іншими діючими речовинами, що супроводжується їх розкладанням, наприклад, з варфарином [Colucci, Annals of Pharmacotherapy 33, 1999, с.1173], із протигрибковими засобами, такими як кетоконазол [Brynne, Br. J. Clin. Pharmacol. 48, 1999, с.564], з макролідними антибіотиками або з інгібіторами протеази. Подібна небезпека існує насамперед у так званих "повільних метаболізаторів" (людей з зниженою активністю системи цитохрому Р450) з дефіцитом ізоферменту 2D6, в організмі яких толтеродин метаболізується винятково під дією ізоферменту 3А4 і в плазмі яких толтеродин присутній відповідно в значно більш високій концентрації. [У заявці WO 99/58478] описані нові похідні 3,3-дифенілпропіламінів як мускаринові діючі речовини. Пропоновані в цій публікації похідні 3,3дифенілпропіламіну являють собою проліки 2-[3(1,1-діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенолу, що при проходженні через біологічні мембрани й у плазмі гідролізуються естеразами. Тим самим вдається уникнути залежного від ізоферменту 2D6 механізму розкладання. Тому такі похідні 3,3-дифенілпропіламіну, наприклад, 2-[3-(1,1-діізопропіламіно)-1 фенілпропіл]-4-(гідроксиметил)фенілізобутират (МНН: фезотеродин), на відміну від толтеродину не схильні до накопичення в організмі, у тому числі й в організмі "повільних метаболізаторів", не взаємодіють з індукторами, відповідно інгібіторами цитохрому Р-450 і мають кращий набір властивостей, якими визначається безпека їх застосування з погляду їх потенційної взаємодії з іншими діючими речовинами і їх накопичення в організмі. З урахуванням сказаного вище перевагами описаних [у WO 99/58478] похідних 3,3дифенілпропіламіну, насамперед перевагами фезотеродину, і визначалася необхідність у їх розробці. Саме особливостями шляху метаболізму толтеродину і недоліками оксибутиніну (сухість у 7 81803 роті) пояснюється потреба медицини в лікарському засобі, що не має недоліків обох вищевказаних речовин. Описані [в WO 99/58478] 3,3дифенілпропіламіни одержують взаємодією 2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенолу в лужних умовах з відповідним хлорангідридом кислоти, наприклад, з хлорангідридом ізомасляної кислоти [див. приклад 3аа в WO 99/58478]. Слід, однак, відзначити, що зазначена реакція дозволяє одержувати необхідний основний продукт (В) з виходом, який становить лише від приблизно 90 до максимум приблизно 94%. Продукт звичайно містить від 6 до 10% домішок, якими є вихідна речовина (А), використовуваний ацилювальний агент, а також небажані продукти реакції у вигляді відповідного складного діефіру (С), складного моноефіру (D) 4гідроксигрупи (див. Фіг.1) і продукти, які утворюються в результаті димеризації/полімеризації. Спроби авторів даного винаходу підвищити вибірковість реакції, наприклад, за рахунок варіювання кількості ацилювального агента і/або за рахунок варіювання умов ацилювання (температури, розчинників, концентрацій, послідовності введення домішок і т.д.) не привели до позитивних результатів. Безуспішними виявилися також численні спроби, спрямовані на виділення традиційними методами очищення із утвореної суміші продукту, що міститься в ній у вигляді високочистої основи в кількостях, які задовольняють вимогам фармацевтики. Можливість очищення шляхом кристалізації виключається, оскільки основи загальної формули І, наприклад фезотеродин, що одержані описаним [в ЕР 1077912] способом та являють собою в'язкі масла, дотепер не вдавалося кристалізувати з суміші, що містить їх як продукт. Спроби очищення шляхом перегонки також не дали позитивних результатів. Відомо, однак, що чистота лікарської речовини біля 90-96мас.% є недостатньою для фармацевтичних препаратів. Більш того, бажана для застосування у фармацевтичних препаратах чистота лікарської речовини звичайно повинна перевищувати 97мас.%. Тому проблема одержання 3,3-дифенілпропіл амінів у вигляді високочистих основ залишилася невирішеною. [У заявці WO 01/35957] описані стабільні, кристалічні солі похідних 3,3-дифенілпропіламіну, перевага яких перед аморфними солями полягає в їх більш високій стабільності та чистоті. Подібні солі в принципі придатні для застосування в терапевтичних цілях і можуть призначатися, наприклад, для перорального або парентерального введення в організм. Однак такі солі діючих речовин у багатьох випадках виявляються малопридатними для їх введення в організм деякими шляхами, наприклад, для трансдермального або трансмукозного застосування, оскільки їх іонна форма перешкоджає їх проникненню через шкіру, відповідно через слизову в терапевтично 8 ефективній кількості. Тому при трансдермальному або трансмукозному введенні аміновмісну діючу речовину часто доводиться застосовувати у вигляді основи. Відповідно до винаходу несподівано було встановлено, що одержання вільної основи загальної формули І (приведеної нижче) з чистотою, що перевищує, як правило, 97мас.%, що бажано перевищує 98мас.%, що особливо бажано перевищує 98,5мас.%, що найбільш бажано перевищує 99мас.%, і з гарним виходом, який становить більше 80мол.%, звичайно більше 90мол.%, можливо шляхом її вивільнення з високочистої кристалічної солі за допомогою відповідного реагенту. Об'єктом винаходу відповідно до цього є вільна основа сполуки формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, яка відрізняється тим, що ступінь її чистоти становить більше 97мас.%, краще більше 98мас.%, особливо краще більше 98,5мас.%, найбільш краще більше 99мас.%. В одному з кращих варіантів R вибраний із групи, яка включає метил, етил, ізопропіл, 1пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутил, пентил, гексил, С4-С8циклоалкіл і феніл. В одному з особливо кращих варіантів R означає ізопропіл, і в цьому випадку сполука являє собою 2-[3-(1,1-діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират (фезотеродин у вигляді основи). В іншому варіанті здійснення винаходу сполуки загальної формули І представлені у вигляді рацематів, тобто у вигляді сумішей молекул з (R)- і (S)-конфігураціями. Ще в одному з кращих варіантів позначений символом "*" (зірочкою) С-атом знаходиться в (R)конфігурації, яку мають переважно більше 98мас.% сполуки, особливо переважно більше 99мас.% сполуки, найбільш переважно більше 99,5мас.% сполуки. В одному з найбільш кращих варіантів сполука являє собою (R)-2-[3-(1,1-діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенілізобутират у вигляді високочистої вільної основи (фезотеродин у вигляді основи) з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%. 9 81803 Під поняттям "С1-С6алкіл" згідно з даним винаходом мають на увазі вуглеводневу груп у, яка містить від 1 до 6 С-атомів з прямим або розгалуженим ланцюгом. До кращих С 1С6алкільних гр уп відносяться незаміщені групи з прямим або розгалуженим ланцюгом, вибрані насамперед із групи, яка включає метил, етил, пропіл, ізопропіл, 1-бутил, 2-бутил, ізобутил, тepбутил, пентил і гексил. Під поняттям "С3-С10циклоалкіл" мається на увазі циклічна вуглеводнева група, яка містить від 3 до 10 атомів вуглецю. Під поняттям "високочистий" відповідно до винаходу мається на увазі ступінь чистоти моноефіру загальної формули І, що перевищує принаймні 97мас.%, що бажано перевищує 98мас.%, що особливо бажано перевищує 98,5мас.%, що найбільш бажано перевищує ви ще 99мас.%, тобто на частку діефіру, дигідроксисполук, 4-моноефірів або полімерів припадає відповідно незначна частина. Ступінь чистоти при цьому визначають за допомогою методів, розглянутих нижче у відповідному розділі даного опису. Поняття "вільна основа" відповідно до винаходу означає, що сполука загальної формули І представлена у вигляді солі менше ніж на 10мас.%, переважно менше ніж на 5 або 3мас.%, особливо переважно менше ніж на 1мас.%. Вміст солі при цьому визначають за допомогою методів, розглянути х нижче у відповідному розділі даного опису. Пропоновані у винаході високочисті основи загальної формули І можна одержувати шляхом їх вивільнення з високочистих кристалічних солей загальної формули II у якій А та R мають зазначені вище значення, а X- означає залишок відповідної фізіологічно сумісної кислоти та у якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації. Кислотним залишком X- може при цьому бути насамперед аніон однієї з кислот із групи, яка включає соляну кислоту, бромистоводневу кислоту, фосфорну кислоту, сірчану кислоту, азотну кислоту, оцто ву кислоту, пропіонову кислоту, пальмітинову кислоту, стеаринову кислоту, малеїнову кислоту, фумарову кислоту, щавлеву кислоту, бур штинову кислоту, DL-яблучну кислоту, L-(-)-яблучн у кислоту, D-(+)-яблучну кислоту, DL-винну кислоту, L-(+)-винну кислоту, D(-)-виннуy кислоту, лимонну кислоту, Lаспарагінову кислоту, L-(+)-аскорбінову кислоту, D(+)-глюкоронову кислоту, 2-оксопропіонову кислоту (піровиноградну кислоту), фуран-2-карбонову 10 кислоту (пірослизову кислоту), бензойну кислоту, 4-гідроксибензойну кислоту, саліцилову кислоту, ванілінову кислоту, 4-гідроксикоричну кислоту, галову кислоту, гіпурову кислоту (N-бензоїлгліцин), ацетурову кислоту (N-ацетилгліцин), флоретинову кислоту (3-(4-гідроксифеніл)пропіонову кислоту), фталеву кислоту, метансульфонову кислоту й оротову кислоту, при цьому особливо кращі такі аніони кислот, як гідрофумарат і гідрохлорид. З зазначеної високочистої сполуки загальної формули II відповідні високочисті вільні основи вивільняють шляхом домішування придатних для цих цілей основних реагентів ("реагентів вивільнення"). Як подібні реагенти вивільнення можна назвати, наприклад, лужні сполуки з групи, яка включає - гідроксиди, карбонати та гідрокарбонати лужних, лужноземельних металів і амонію, - аміни, поліаміни й основні поліамінокислоти, що можуть бути представлені як у розчинному вигляді, так і у фіксованому на відповідних носіях вигляді, і - основні іоніти, кращі при цьому слабколужні сполуки з показником кислотності (рКB) 8-11. З числа реагентів вивільнення краще використовува ти ті з них, які перешкоджають осадженню 3,3-дифенілпропіламіномоноефіру у вигляді вільної основи у розчиннику, який використовують. Крім того, слід уникати гідролізу ефірного зв'язку. При взаємодії у водному середовищі, наприклад, сполуки формули II з відповідним гідрокарбонатом спочатку як проміжний продукт утворюється гідрокарбонат 3,3дифенілпропіламіномоноефіру. При екстрагуванні струшуванням з використанням органічного розчинника, наприклад, дихлорметану, відбувається звітрювання СО2, що дозволяє без додаткового очищення одержувати з органічної фази малорозчинний у воді вільний складний 3,3дифенілпропіламіномоноефір у вигляді високочистого масла. Така технологія дозволяє запобігти осадження складного 3,3-дифенілпропіламіномоноефіру безпосередньо після його вивільнення, що в протилежному випадку може привести до зниження чистоти і/або виходу продукту. При цьому вдається також уникнути гідролізу е фірного зв'язку. Гідрокарбонати сполук загальної формули І, насамперед гідрокарбонат фезотеродину, як кращі проміжні продукти також є об'єктом даного винаходу. З ура хуванням цього як реагент вивільнення особливо краще використовувати гідрокарбонат лужного металу, лужноземельного металу або амонію, найбільш кращий з яких гідрокарбонат натрію. Тому в одному з кращих варіантів здійснення способу одержання сполук із пропонованими у винаході характеристиками спочатку сіль формули II розчиняють у воді і змішують з основним реагентом вивільнення, наприклад, з передбаченим для цієї мети гідрокарбонатом. 11 81803 Потім суміш струшують з відповідним розчинником і органічну фазу концентрують до одержання як залишок високочистої основи формули І у вигляді в'язкого масла. Цей варіант здійснення способу більш докладно розглянутий у прикладі 1В. До придатних для очищення вільної основи розчинників відносяться насамперед дихлорметан, трет-бутилметиловий ефір, діетиловий ефір, етилацетат, етилметилкетон і толуол, особливо кращий серед яких дихлорметан. В іншому варіанті здійснення способу одержання сполук із пропонованими у винаході характеристиками спочатку високочисту сіль формули II розчиняють у відповідному розчиннику, після чого пропускають через носій, який містить, наприклад, фіксований на його поверхні іоніт. У цьому випадку високочиста основа загальної формули І міститься в елюаті. Для одержання (R)-2-[3-(1,1-діізопропіламіно)1-фенілпропіл]-4-(гідроксиметил)фенілізобутирату у вигляді високочистої вільної основи особливо бажано використовувати як вихідну сполуку гідрофумарат (R)-2-[3-(1,1-діізопропіламоній)-1фенілпропіл]-4-(гідроксиметил)фенілізобутирату. Об'єктом винаходу відповідно до цього є спосіб одержання високочистої основи загальної формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, який відрізняється тим, що високочисту вільну основу загальної формули І виділяють з чистотою вище 97мас.%, переважно вище 98мас.%, особливо переважно вище 98,5мас.%, найбільш переважно вище 99мас.%, із кристалічної солі загальної формули II у якій А та R мають зазначені вище значення, а Х- означає залишок відповідної фізіологічно сумісної кислоти й у якій позначений символом "*" 12 (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації. Кращим є пропонований у винаході спосіб одержання високочистих основ загальної формули І, у яких позначений символом "*" (зірочкою) Сатом знаходиться в (R)-конфігурації і/або в яких замісник R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тepбутил, ізобутан, пентил і гексил. Особливо бажано пропонований у винаході спосіб призначений для одержання (R)-2-[3-(1,1діізопропіламіно)-1-фетлпротл]-4(гідроксиметил)фенілізобутирату у вигляді високочистої вільної основи, при цьому як вихідну сполуку формули II найбільш доцільно використовува ти гідрофумарат (R)-2-[3-(1,1діізопропіламоній)-1-фенілпропіл]-4(гідроксиметил)фенілізобутирату. Спосіб одержання високочистих солей формули II відомий [з WO 01/35957]. З цією метою спочатку розчин 2-[3-(1,1-діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенолу піддають у лужному розчині взаємодії з хлорангідридом відповідної кислоти, наприклад, із хлорангідридом ізомасляної кислоти. Потім одержану таким шляхом основу з низьким ступенем чистоти змішують при нагріванні з кислотою, наприклад, з фумаровою кислотою. Сіль загальної формули II, яка утворилася, можна викристалізовувати з відповідних розчинників. Одержані кристали знову розчиняють та перекристалізовують. Цей процес при необхідності можна повторювати декілька разів до одержання в результаті сполуки формули II з необхідним ступенем чистоти. З таких солей описаним вище шля хом одержують високочисту основу формули І. Ви хід високочистої вільної основи формули І становить при цьому, як правило, більше 90% від теорії в перерахунку на кількість складного 3,3-дифеніламіномоноефіру формули II, що використовується. У таблиці 1 показане очищення фезотеродину у вигляді основи за допомогою пропонованого у винаході способу. Стадії способуа) 1. Хімічний синтез основи В зі сполуки А 2. Одержання солі Ε з основи В, що одержана на стадії 1 3. Перекристалізація одержаної на стадії 2 солі Ε 4. Високочиста основа В, що виділена з одержаної на стадії 3 солі Ε Примітка: а) сполуки А, В, С, Е: R означає ізопропіл, див. Фіг.1 Пропоновані у винаході високочисті основи загальної формули L одержують у вигляді масла, і вони залишаються стабільними при -20°С. При більш високих температурах, наприклад, при 28°С, пропоновані у винаході вільні основи краще зберігати в присутності осушувачів. Пропонований у винаході спосіб вперше дозволяє ефективно одержувати вільні основи загальної формули І у високочистому вигляді. 13 81803 Пропонований у винаході спосіб допускає можливість його розширення до масштабів промислового одержання високочистих сполук, вперше надаючи можливість одержання фармацевтичних композицій, які містять високочисті основи загальної формули І. Ще одним об'єктом даного винаходу відповідно до цього є фармацевтична композиція, яка містить сполуку загальної формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С6циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, а також принаймні один фармацевтично прийнятний носій, при цьому вільна основа сполуки формули І має чистоту вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%. В одному з кращих варіантів здійснення винаходу пропонована в ньому фармацевтична композиція містить сполуку загальної формули І, у якій R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутан, пентил і гексил, особливо бажано являє собою ізопропіл, а позначений символом "*" (зірочкою) С-атом особливо бажано знаходиться в (R)-конфігурації. В одному з найбільш кращих варіантів здійснення винаходу фармацевтична композиція містить (R)-2-[3-(1,1-діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенілізобутират у вигляді вільної основи (фезотеродин у вигляді вільної основи) з ступенем чистоти принаймні 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%. Оскільки пропоновані у винаході вільні основи сприйнятливі до гідролізу, відповідно до переетерифікації, фармацевтичні композиції, які їх містять, рекомендується зберігати при температурі переважно нижче 25°С, особливо бажано нижче 8°С, у присутності осушувачів. У кращому варіанті пропоновані у винаході вільні основи знаходяться в складі фармацевтичної композиції, що їх містить, в слабкокислому середовищі, тобто при рН3-7, бажано при рН3-6 або 3-5, оскільки стабільність вільних основ у ци х умовах є найбільш високою. З міркувань стабільності бажано далі уникати наявності у фармацевтичних композиціях C1-C8спиртів з коротким ланцюгом, насамперед С1-С4спиртів. 14 Тип лікарської форми, у вигляді якої може бути представлена фармацевтична композиція, залежить насамперед від шляху, який передбачається, її введення в організм, а також від необхідних властивостей конкретної лікарської форми. Відповідно до цього пропонована у винаході фармацевтична композиція може бути представлена, наприклад, у вигляді лікарських форм для перорального застосування, таких як порошки, гранули, таблетки, драже, капсули, розчини або суспензії, у вигляді лікарських форм для парентерального застосування, таких як розчини або суспензії, у вигляді лікарських форм для трансдермального застосування, таких як трансдермальні терапевтичні системи (ТТС), мазі, креми, плівки, примочки, спреї, гелі або піни, або у вигляді лікарських форм для трансмукозного застосування, до яких відносяться лікарські форми для букального або сублінгвального застосування, такі як таблетки з швидким вивільненням діючої речовини, спреї, краплі, лікарські форми у вигляді облаток, мукоадгезивні пігулки або пластири, лікарські форми для назального застосування, такі як примочки, краплі, спреї або мазі, і лікарські форми для пульмонального застосування, такі як аерозолі. Як фармацевтично прийнятні носії у принципі можуть використовуватися допоміжні речовини, відомі спеціалістам в галузі фармацевтичних технологій і описані, [наприклад, у Sucker, Fuchs і Speiser, Pharmazeutische Technologie, в-во Georg Thieme Verlag, Stuttgart], а також в інших оглядових публікаціях, присвячених відповідним лікарським формам. Подібна фармацевтична композиція може бути представлена у вигляді традиційної лікарської форми, однак у залежності від особливих потреб пацієнта може бути також представлена у вигляді лікарської форми з швидким вивільненням діючої речовини або у вигляді ретард-форми (форма з уповільненим вивільненням діючої речовини). Основи загальної формули І, наприклад, фезотеродин, здатні, як несподівано було встановлено, проникати через мембрани. З цієї причини вони особливо придатні для трансдермального або трансмукозного застосування в складі відповідних фармацевтичних композицій. Пропоновані у винаході високочисті основи загальної формули І бажано використовувати в призначених для трансдермального або трансмукозного застосування композиціях з контрольованим вивільненням з них діючої речовини. Особливо кращі при цьому фармацевтичні композиції, які після певної початкової фази затримки забезпечують проникнення діючої речовини, яка вивільнюється з них, через шкіру або слизову оболонку пацієнта з постійною швидкістю впродовж принаймні 24год., переважно принаймні 48год. Для забезпечення такого контрольованого вивільнення діючої речовини фармацевтична композиція бажано містить принаймні один полімерний шар, у якому високочиста основа загальної формули І присутня 15 81803 у диспергованому або розчиненому вигляді. Підбором складу подібного полімерного шару можна впливати на характеристику вивільнення з нього діючої речовини. Так, наприклад, розчинністю діючих речовин у полімерній матриці у вирішальному ступені визначається режим вивільнення тієї або іншої діючої речовини з трансдермальних або трансмукозних терапевтичних систем, а тим самим і швидкість її проникнення через шкіру, відповідно через слизову оболонку. Крім цього до складу полімерного шару можуть входити речовини, які мають властивості контактних (які активуються при короткочасному притисненні) клеїв, які дозволяють прикріплювати і фіксувати фармацевтичну композицію на шкірі або слизовій оболонці пацієнта. Так, наприклад, букальну композицію можна приготовляти у вигляді мукоадгезивної системи, з якої діюча речовина вивільнюється поступово, з уповільненням. Для приклеювання до слизової оболонки використовують полімери, які мають адгезійну здатність, відповідно співполімери, такі, наприклад, як ПВП (полівінілпіролідон), пектини, карбопол, поліакрилати, похідні целюлози, хітозан або поліоксіетилен. Відповідні приклади таких речовин і більш докладну інформацію про них можна знайти, зокрема, [у US 6210699, US 4855142, US 4680323, US 5700478, US 4948580, US 4715369, US 4876092, US 5750136, а також у Woodley, Clin. Pharmacokinet. 40, 2001, с.77, або в Singla, Drug Dev. Ind. Pharm. 26, 2000, с.913]. Подібні полімери, відповідно співполімери можуть виконувати функції клейкої оболонки, наприклад, у таблеток, але разом з тим можуть також, наприклад, у призначеному для букального застосування пластирі, бути компонентом клейкої полімерної матриці, у якій діюча речовина присутня в розчиненому або диспергованому вигляді [Wong, Int. Journ. Pharm. 178, 1999, с.11]. Відповідно до цього, згідно з одним з варіантів здійснення винаходу фармацевтична композиція для трансдермального введення в організм високочистої основи формули І являє собою призначену для букального застосування композицію, насамперед у вигляді букального пластиру принаймні з одним полімерним шаром, у якому високочиста основа загальної формули І присутня у розчиненому або диспергованому вигляді. Такий полімерний шар, який містить високочисту основу переважно має мукоадгезивні властивості. В одному з особливо кращих варіантів здійснення винаходу фармацевтична композиція для трансдермального введення в організм високочистої основи формули І являє собою пластир для трансдермального введення в організм цієї діючої речовини, що називається просто трансдермальним пластиром. Подібні трансдермальні пластири (які часто називають також трансдермальними терапевтичними системами, скорочено "ТТС") можна класифікувати по-різному, однак у більшості випадків їх підрозділяють на три наступні основні групи. 16 До першої групи відносяться ТТС резервуарного типу, у яких діюча речовина присутня в розчині або гелі і надходить до шкіри пацієнта через мембрану, яка регулює швидкість такого її надходження до шкіри. До другої гр упи відносяться ТТС матричного типу, які у свою чергу можна підрозділяти на ТТС ламінатного типу, у яких діюча речовина міститься в шарі (матриці) з неадгезивного полімеру і які для їх прикріплення до шкіри можуть містити інші шари, наприклад, клейовий шар, однак можуть фіксуватися на шкірі й окремими клейкими плівками (лейкопластирами), і на ТТС монолітного типу, у яких діюча речовина міститься в шарі контактного клею (клейовій матриці). Приклад типової структури монолітної ТТС представлений на Фіг.4. Схематично показана на цьому кресленні монолітна ТТС складається з клейової матриці (1), яка містить діючу речовину, з інертного щодо компонентів клейової матриці і непроникного тильного шару (2), який після нанесення ТТС на шкіру розташовується з поверненої від шкіри сторони ТТС, та також шару (3), який видаляється перед нанесенням ТТС на шкіру. До третьої групи ТТС відносяться іонтофоретичні системи, у яких проникнення діючої речовини через шкіру додатково інтенсифікують за рахунок прикладання електричної напруги. До особливо кращих лікарських форм згідно з даним винаходом відносяться ТТС матричного типу, з яких найбільш кращими є монолітні ТТС, у яких діюча речовина міститься у введеному в клейову матрицю вигляді. У наступній частині опису під поняттям "полімерна матриця" або просто "матриця" мається на увазі полімервмісний шар або полімервмісна маса, при цьому в зазначене поняття включене і поняття "клейова матриця". Під поняттям "загальна маса полімерної матриці" відповідно до винаходу мається на увазі маса полімерної матриці, включаючи масу введеної в неї діючої речовини і можливих допоміжних речовин. Як приклади, що не обмежують обсяг винаходу, адгезійних полімерів, відповідно співполімерів, які можуть використовуватися для виготовлення трансдермальних пристроїв (систем) і які можуть містити діючу речовину загальної формули І у розчиненому, частково розчиненому або диспергованому вигляді, можна назвати кремнійорганічні (силіконові) клеї, клеї на основі співполімерів етилену з вінілацетатом (ЕВА-клеї), клеї на основі блокспівполімерів стиролу (SXSклеї), акрилатні клеї, поліуретанові клеї, вінілацетатні клеї, а також адгезійні каучуки, наприклад, поліізобутилен, полібутадієн, неопрен або поліізопрен, так само як і відповідні суміші цих клеїв. Як контактні клеї особливо придатні використовувані в те хнології виготовлення пластирів полімерні клеї силіконового типу, акрилатного типу, SXS- тип у і ЕВА- типу, відомі з рівня техніки. Властивості цих клеїв більш докладно розглянуті нижче. 17 81803 Дозування пропонованих у винаході сполук залежить від віку, ваги і стану пацієнта, а також від методики і часових інтервалів їх введення в організм. Звичайно ефективна добова доза становить від 0,5 до 20мг. При пероральному введенні звичайно призначають принаймні 3мг/добу, наприклад, 3-15мг/добу, переважно 412мг/добу. Звичайна добова доза, наприклад, фезотеродину, для трансдермального або трансмукозного введення дорослому пацієнту може становити принаймні 3 мг, краще від 3 до 15мг, особливо бажано від 4 до 12мг. Виходячи з цього, фармацевтична композиція, призначена для одноразового застосування на добу, повинна містити бажано від 3 до 15мг високочистої основи загальної формули І. Якщо фармацевтична композиція призначена для трансдермального застосування, то з міркувань надійності вона звичайно повинна містити діючу речовину, яка вводиться, у приблизно подвійній кількості. Відповідно до цього типова пропонована у винаході композиція для трансдермального введення в організм високочистої сполуки загальної формули І містить принаймні 6мг діючої речовини, однак у залежності від відповідного дозування і часового інтервалу між окремими введеннями може містити і більше 10, 20, 30, 40 або 50мг високочистої діючої речовини загальної формули І, наприклад, фезотеродину, з розрахунку на одну дозовану лікарську форму. При п'яти- або навіть семиденному інтервалі між введеннями вміст діючої речовини в дозованій лікарській формі може перевищувати 70, 80, 90 і навіть 100мг. Під поняттям "дозована лікарська форма" відповідно до винаходу мається на увазі фармацевтична композиція, яка містить певну кількість діючої речовини і з якої вона при одноразовому введенні в організм пацієнта вивільнюється впродовж заданого проміжку часу в терапевтично ефективній кількості. Тим самим поняття "дозована лікарська форма" включає відповідно до винаходу як таблетки, розраховані на триразовий прийом на добу, так і пластири для тижневого застосування. Відповідно до цього ще одним об'єктом даного винаходу є дозована лікарська форма, яка містить принаймні 3 мг сполуки загальної формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С6циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній 18 конфігурації, а також принаймні один фармацевтично прийнятний носій, при цьому вільна основа сполуки формули І має чистоту вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%. В інших варіантах здійснення винаходу дозована лікарська форма містить принаймні 10, 20, 30, 40, 50, 70, 80, 90 і навіть більше 100мг високочистої діючої речовини загальної формули І. В одному з кращих варіантів здійснення винаходу пропонована в ньому дозована лікарська форма містить сполуку загальної формули І, у якій R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутил, пентил і гексил, особливо бажано являє собою ізопропіл, а позначений символом "*" (зірочкою) С-атом особливо бажано знаходиться в (R)-конфігурації. В одному з найбільш кращих варіантів здійснення винаходу дозована лікарська форма містить (R)-2-[3-(1,1-діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенілізобутират у вигляді вільної основи (фезотеродин у вигляді вільної основи) з ступенем чистоти принаймні 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%. При використанні як фармацевтична композиція трансдермальної лікарської форми щоб уникнути коливань концентрації діючої речовини в плазмі швидкість її проникнення через шкіру пацієнта повинна бути постійною. Тому швидкість проникнення через шкіру діючої речовини, яка міститься в добовій дозі, у сталому режимі при площі ділянки поверхні шкіри, яка покривається такою лікарською формою, яка дорівнює 50см 2, краще дорівнює максимум 40см 2, повинна становити більше 6мкг/см 2/год., краще більше 8мкг/см 2/год, особливо краще більше 10мкг/см 2/год., найбільш бажано більше 12мкг/см 2/год., при цьому швидкість проникнення визначають у досліді in vitro на моделі шкіри людини за методом Tanojo, що описаний в прикладі 3.2. Даний винахід стосується також одержання лікарських засобів. Пропоновані у винаході високочисті основи можуть застосовуватися для одержання відповідного лікарського засобу, призначеного насамперед для лікування нетримання сечі, найбільш переважно для лікування мимовільного сечовипускання, а також для лікування гіперактивності детрузора, гіперактивності сечового міхура, полакізурії, ніктурії або імперативного позиву до сечовипускання. Об'єктом винаходу відповідно до цього є застосування вільної основи загальної формули І 19 81803 у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, при цьому вільна основа сполуки формули І має чистоту вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, для одержання лікарського засобу, призначеного для трансдермального або трансмукозного введення. В одному з кращих варіантів здійснення винаходу для одержання вищевказаного лікарського засобу використовують сполуку загальної формули І, у якій R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1бутил, 2-бутил, тер-бутил, ізобутил, пентил і гексил, особливо бажано являє собою ізопропіл, а позначений символом "*" (зірочкою) С-атом особливо бажано знаходиться в (R)-конфігурації. Високочисті основи формули І можуть використовува тися, наприклад, для одержання призначених для букального застосування лікарських форм, до яких відносяться, зокрема, спреї, мукоадгезивні пігулки або швидкорозчинні облатки і які описані, [наприклад, у WO 02/02085]. З числа інших кращих лікарських форм, для одержання яких використовують основи формули І, можна назвати, наприклад, мазі, креми, примочки, спреї, пасти, плівки або пластири, які містять діючу речовину. При цьому високочисту основу загальної формули І краще використовува ти для одержання призначеного для трансдермального або трансмукозного введення лікарського засобу в ретард-формі і з цією метою її доцільно вводити в адгезійну або неадгезійну полімерну матрицю. Ще одним об'єктом винаходу відповідно до цього є застосування вільної основи загальної формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-С3алкоксигрупою, фтором, хлором, 20 бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, при цьому вільна основа сполуки формули І має чистоту вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, для одержання лікарського засобу, призначеного для трансдермального або трансмукозного введення, яке відрізняється тим, що сполука формули І знаходиться в розчиненому або диспергованому вигляді в полімерному шарі, краще в шарі, який здатний самоклеїтися. В одному з кращих варіантів здійснення винаходу для одержання вищевказаного трансдермального лікарського засобу використовують сполук у загальної формули І, у якій R вибраний із групи, яка включає метил, етил, ізопропіл, 1-пропіл, 1-бутил, 2-бутил, тер-бутил, ізобутил, пентил і гексил, особливо бажано являє собою ізопропіл, а позначений символом "*" (зірочкою) С-атом особливо бажано знаходиться в (R)-конфігурації. Бажано, якщо високочиста сполука загальної формули І представлена у вигляді вільної основи з вмістом зв'язаної солі менше 10мас.%, особливо краще менше 5 або 3мас.%, найбільш краще менше 1мас.%. Відомі [з WO 01/35957] високочисті солі похідних 3,3-дифенілпропіламіну, наприклад, фумарат фезотеродину, не дозволяють досягти при трансдермальному введенні задовільної з терапевтичної точки зору швидкості їх надходження в організм. Домішування до матриці, яка містить діючу речовину, заряджених молекул, таких, наприклад, як силікати або хітозан, так само як і засобів, що інтенсифікують проникнення діючої речовини через шкіру, які називаються активаторами черезшкірного всмоктування, таких як олеїнова кислота або пропіленглікольмонолаурат (ПГМЛ), також не дозволяє досягти задовільної швидкості проникнення діючої речовини через шкіру (таблиця 2). Вивільнення основи з відповідної солі in situ за рахунок домішування силікату кальцію під час приготування клейової матриці, як це описано [в WO 94/07486], також не забезпечує необхідної швидкості проникнення діючої речовини через шкіру людини (таблиця 2), оскільки така хімічна реакція з утворенням вільної основи, як правило, не завершується повністю, внаслідок чого значна частка діючої речовини присутня в матриці в протонованому вигляді. Тому при виготовленні пропонованих у винаході пристроїв сполуку загальної формули І слід додавати в масу, яка утворює полімерну матрицю, вже у вигляді високочистої вільної основи. Партія № Контактний клей Спосіб Вміст діючої Пи 21 81803 переробки 201110801 203020601 201110851 201110861 203020621 201110871 203020631 200020312 201040352,3 201060614 201060435 акрилат акрилат ЕВА силікон силікон SXS силікон+ПВАц6 акрилат акрилат/ОК силікон силікон в розчиннику в розчиннику в розплаві в розплаві в розплаві в розплаві в розплаві в розчиннику розчиннику в розчиннику в розплаві 22 принаймні 3мг, наприклад, від/добу (в сталому мкг/см 2 3 до 15мг, бажано маса речовини (мас.% 12мг або від 6 до 12мг. через 24год.) від 4 до режимі, фезотеродину) використанніЧерез шкіру основі акрилату і При матриці матриць на 2 через шкіру (г/м ) силікону також вдалося досягти in vitro людини порівнянної миші швидкості проникнення фезотеродину 15 100 705 не визнач. (високочиста вільна не визнач.через шкіру ссавця основа) 15 87 332,64 (Фіг.3, таблиця 2). 510 15 84 323,7 Ще 63 одним об'єктом винаходу не визнач. до відповідно 15 495 цього є 100 застосування визнач. основи загальної 15 не вільної 544,89 формули І 15 89 460 383,8 15 15, фумарат 15, фумарат 15, фумарат 15, DiOH 5 83 105 110 60 101 не визнач. 27 84 не визнач. не визнач. 501,09 не визнач. не визнач. 24,2 Примітки: не визнач, означає "не визначали", 1 у якій до матриці додавали фезотеродин у вигляді вільної основи, А означає водень або дейтерій, a R 2 являє собою групу, вибрану порівняльний приклад, при одержанні використовували фумарат фезотеродину, з С1-С6алкілу, С33 С6циклоалкілу і фенілу, кожний з яких може бути порівняльний приклад, при одержанні використовували фумарат фезотеродину з олеїновою кислотою заміщений С1-С3алкоксигрупою, фтором, хлором, (ОК) як активатор черезшкірного всмоктування, 4 бромом, нітрогрупою, аміногрупою, порівняльний приклад, одержання шляхом вивільнення основи йодом,з фумарату в клейовій матриці, in situ 5 гідроксигрупою, дигідроксиметаболіт (2-[3-(1,1порівняльний приклад, при одержанні використовували оксогрупою, меркаптогрупою або дейтерієм, і в діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенол)фезотеродину, якій позначений символом "*" 6 (зірочкою) С-атом може знаходитися в (R)ПВАц означає "полівінілацетат". конфігурації, (S)-конфігурації або в змішаній конфігурації, при цьому вільна основа сполуки формули І має чистоту вище 97мас.%, краще На Фіг.2 показано, що ТТС, у яких (R)вище 98мас.%, особливо краще вище 98,5мас.%, фезотеродин у вигляді високочистої основи найбільш краще вище 99мас.%, введений у кількості 15мас.% у відповідну клейову матрицю SXS- або ЕВА- типу, забезпечують у для одержання лікарського засобу, призначеного для трансдермального введення, дослідах in vitro таку швидкість проникнення діючої яке відрізняється тим, що сполуку формули І речовини через шкіру людини, яка при відповідній вводять у полімерний шар, переважно в площі поверхні, яку покривають, від 5 до 50см 2 полімерний шар, який здатний самоклеїтися, з дозволяє визначити терапевтично необхідну добову дозу, як це представлено нижче в таблиці одержанням лікарського засобу, а сполука, яка вивільнюється з нього загальної формули І 3. надходить в організм ссавця через його шкіру, насамперед в організм людини через її шкіру, 3 Таблиця у добовому дозуванні, що становить від 0,5 до Швидкість проникнення фезотеродину через шкіру людини (мг/добу) у принаймні 3мг/добу, наприклад, 20мг/добу, краще перерахунку на площу ТТС від 3 до 15мг/добу, особливо краще від 4 до 12мг/добу, найбільш30см 2 від 6 до 12мг/добу. 2 краще Площа ТТС 5см 2 10см 2 20см 2 40см 2 50см В одному з кращих варіантів здійснення Контактний клей винаходу 6,5 для одержання 13 вищевказаного ЕВА 1,6 3,2 9,7 16 лікарського7,6 засобу11,4 використовують сполуку SXS 1,9 3,8 15,2 19 загальної формули І, 15 якій R вибраний із25 у групи, силікон/церезин+ ПВАц 2,5 5 10 20 яка акрилат (Durotak 87-4287) 1,7 3,3 включає метил, етил, ізопропіл, 1-пропіл, 16,6 10 13,3 16,7 бутил, 2-бутил, тep-бутил, ізобутил, пентил і гексил, особливо бажано являє собою ізопропіл, а Модель, яка використовувалася в дослідах in позначений символом "*" (зірочкою) С-атом vitro, що запропонована Tanojo [Journ. Control Rel. особливо бажано знаходиться в (R)-конфігурації. 45, 1997, cc. 41-47], виявилася найбільш вдалою В особливо кращих варіантах здійснення моделлю, у якій швидкість проникнення через винаходу лікарський засіб містить як діючу шкіру, яка вимірюється in vitro, в максимальному речовину фезотеродин у ви гляді високочистої ступені співвідноситься з аналогічними основи. показниками швидкості in vivo, отриманими в ході Відповідно до одного з особливо кращих різних клінічних досліджень. Звідси випливає, що варіантів об'єктом винаходу відповідно до цього є застосування пропонованих у винаході ТТС застосування високочистої сполуки загальної дозволяє забезпечити проникнення діючої формули І для одержання лікарського засобу, який речовини через шкіру з швидкістю, необхідною для а) має полімерний шар, який здатний її надходження в організм у терапевтично самоклеїтися та містить фезотеродин у вигляді необхідному добовому дозуванні, що становить високочистої основи, і 23 81803 б) вивільняє фезотеродин у вигляді високочистої основи, забезпечуючи її проникнення через шкіру з швидкістю від 0,5 до 25мг/добу, краще принаймні 3мг/добу, наприклад, від 3 до 15мг/добу, особливо краще від 4 до 12мг/добу. Як показано на Фіг.2, вивільнення діючої речовини з подібних лікарських засобів відбувається після деякої початкової фази затримки практично з постійною швидкістю впродовж принаймні 24год. Відповідно до іншого особливого варіанта винахід відповідно до цього стосується застосування високочистої сполуки загальної формули І, наприклад, фезотеродину, для одержання лікарського засобу, з якого розчин сполуки загальної формули І після початкової фази затримки вивільнюється з постійною швидкістю впродовж принаймні 24год., бажано впродовж 36 або 48год. Під виразом "сталий режим" згідно з даним винаходом мають на увазі швидкість проникнення діючої речовини через шкіру, що встановлюється після завершення початкової фази затримки після первинного накладання пропонованого у винаході пристрою на шкіру. Під виразом "швидкість проникнення в сталому режимі" мається на увазі швидкість проникнення діючої речовини через шкіру, що встановлюється після завершенні початкової фази затримки. Під виразом "постійна швидкість проникнення" згідно з даним винаходом мають на увазі швидкість проникнення в сталому режимі, при якій сполука загальної формули І транспортується через шкіру людини з деякою середньою швидкістю, якій властива певна, внутрішня мінливість CV у часі, що не перевищує 30%, переважно не перевищує 20%, і яка розраховується відповідно до рівняння CV=(sd: х )´100% [розрахунки див. у "Parameters for Compartement-free Pharmacokinetics", під ред. Cawello, в-во Shaker Verlag, Aachen, 1999, с.112]. Добову дозу при цьому вводять в організм із середньою швидкістю проникнення, яка розраховується розподілом добової дози на 24год. (і яка виражається мг/год.), при величині мінливості CV, що дорівнює 30%. Для спеціаліста в даній галузі очевидно, що постійна швидкість проникнення встановлюється тільки після завершенні початкової стадії "припливу" діючої речовини до шкіри (фази затримки) після первинного накладання пристрою на шкіру. Тому при розрахунку постійної швидкості проникнення фазу затримки не враховують. Під виразом "швидкість проникнення через шкіру людини" відповідно до винаходу мається на увазі, якщо не зазначене інше, швидкість, виміряна in vitro на моделі шкіри людини за методом Tanojo, що описаний в прикладі 3.2. До кращих полімерних матриць відносяться полімерні матриці, які здатні самоклеїтися, ЕВАтипу, SXSтипу, силіконового типу або акрилатного типу, властивості й одержання яких більш докладно розглянуті нижче. Силіконові клеї 24 Кращими контактними силіконовими клеями є аміностійкі поліорганосилоксанові клеї, що активуються при короткочасному притисненні (контактні). Контактні силіконові клеї являють собою в більшості випадків полідиметилсилоксани, однак у принципі в таких клеях замість метильних груп можуть бути присутніми також інші органічні залишки, такі, наприклад, як етильні або фенільні групи. Подібні аміностойкі контактні силіконові клеї відрізняються звичайно тим, що вони взагалі не містять вільних силанольних функціональних груп або містять лише невелику їх кількість, оскільки SiOH-групи піддалися алкілуванню. Такі клеї описані [в ЕР 180377]. До особливо кращих клеїв даного типу відносяться конденсати або суміші силіконових смол і поліорганосилоксанів, що описані, [наприклад, у US RE 35474]. Відповідні клеї випускаються, наприклад, фірмою Dow Corning у вигляді так називаних біоАКП-клеїв (АКП означає "активований при короткочасному притисненні"). Особливо придатними при цьому є суміші біо-АКП-клеїв Q74301 і Q7-4201, насамперед у їх співвідношенні в інтервалі від 40:60 до 60:40. Пластирі-матриці на основі силіконового клею переважно виготовляють методами, основаними на застосуванні розчинників. З цією метою на першій стадії з контактних клеїв і діючої речовини приготовляють розчин в органічному розчиннику або в суміші розчинників. На другій стадії розчин розподіляють рівним шаром і ламінують, після чого видаляють розчинник. Такий спосіб описаний, [наприклад, у WO 99/49852]. Альтернативний спосіб, у якому не використовуються органічні розчинники, заснований на застосуванні розплаву клею. При здійсненні цього способу полімер, відповідно контактний клей розплавляють нагріванням до температури в інтервалі від 70 до 200°С, переважно від 90 до 160°С, найбільш переважно від 100 до 150°С, і в гомогенізований розплав матриці вводять діючу речовину. Після нетривалої гомогенізації клейову матрицю, яка містить діючу речовину, знову охолоджують, внаслідок чого діюча речовина піддається термічному навантаженню впродовж звичайно менше 5 хв., а при необхідності впродовж менше 4, 3, 2 і навіть менше 1 хв. У результаті діюча речовина виявляється введеною в отверділий полімерний розплав. Під час цього процесу діюча речовина практично захищена від небажаного впливу зовнішніх факторів (світла, кисню). Перевага цього способу перед способом, що заснований на використанні розчинників, полягає в тому, що високочисті основи загальної формули І не піддаються впливу розчинників, а їх можна відразу ж вводити в розплав клею, де після нетривалої гомогенізації відбувається їх стабілізація в охолоджуваній полімерній матриці. Подібний спосіб, заснований на використанні розплаву, краще проводити в екструдері, наприклад, у дво хчерв'ячному екструдері, як це описано [в WO 99/48493]. 25 81803 Силіконові клеї при зазначених вище температурах їх переробки звичайно мають занадто в'язку консистенцію, тобто їх динамічна в'язкість перевищує 150Па×с. У патентній літературі описані різні методи зниження в'язкості силіконових клеїв за рахунок домішування до них придатних для цієї мети домішок (пластифікаторів) і надання їм таким шляхом здатності до утворення розплаву. Як приклад таких пластифікаторів для силіконів можна назвати гліцеринмонолаурат або лаурилацетат, що описані [в ЕР 835136], воски формули R-C(O)-OR', описані [в ЕР 360467], алкілметилсилоксанові воски, які описані [в ЕР 524775], силоксовані поліефірні воски, які описані [в ЕР 663431], або органічні воски, які описані [в US RE 36754]. Звичайно пластифікатори додають до силіконового клею в кількості від 1 до 30мас.% у перерахунку на загальну масу здатної утворювати розплав клейової суміші. Кращі як пластифікатори органічні воски, які описані [в US RE 36764], наприклад, озокерит, церезин, парафін, канделільний віск, карнаубський віск, бджолиний віск або суміші цих восків, найбільш кращі з яких озокерит і церезин. Попередньо приготовлені, здатні до утворення розплаву контактні силіконові клеї, зокрема суміші таких силіконових клеїв з церезином або озокеритом, можна придбати у фірми Dow Corning, шт. Мічиган. За рахунок домішування до контактного силіконового клею церезину в кількості 10мас.% вдалося, наприклад, знизити динамічну в'язкість одержуваної клейової суміші при температурі обробки 150°С з значення, що перевищує 150Па×с, до значення нижче 50Па×с. Подібну клейову суміш, яка містить контактний силіконовий клей, можна успішно переробляти способом, основаним на використанні розплаву, в інтервалі температур від 70 до 200°С, насамперед від 100 до 150°С. Відповідно до винаходу несподівано було встановлено, що здатні до утворення розплаву контактні силіконові клеї можуть ефективно застосовуватися для трансдермального введення сполук загальної формули І. Ще одним об'єктом винаходу відповідно до цього є пристрій для трансдермального введення в організм сполуки формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою,фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R) 26 конфігурації, (S)-конфігурації або в змішаній конфігурації, який відрізняється тим, що сполука загальної формули І у вигляді вільної основи з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, введена в полімерний шар, який здатний самоклеїтися (клейову матрицю), до складу якого входить аміностійкий силікон. В одному з особливо кращих варіантів здійснення винаходу основу клейової матриці утворює здатна до утворення розплаву суміш з контактного силіконового клею і принаймні одного пластифікатора, наприклад, озокериту. У пропоновану відповідно до винаходу матрицю на основі силікону бажано вводити як діючу речовину фезотеродин у вигляді високочистої вільної основи. Під поняттям "здатність до утворення розплаву" мається на увазі при цьому, що динамічна в'язкість контактного клею при звичайній для заснованого на використанні розплаву способу робочій температурі, наприклад, 160°С, становить максимум 150Па×с, переважно максимум 120Па×с. Ще одним об'єктом винаходу є призначений для трансдермального введення сполуки загальної формули І лікарський засіб, який має клейову матрицю, що містить а) від 50 до 99мас.% клейової суміші з 1) 70-99мас.% аміностійкого силіконового клею і 2) 1-30мас.%, краще 3-15мас.%, прийнятного пластифікатора, краще органічного воску, особливо бажано вибраного з групи, яка включає озокерит, церезин, парафін, канделільний віск, карнаубський віск, бджолиний віск і суміші цих восків, особливо кращі з яких озокерит і церезин, і б) від 1 до 40мас.% сполуки загальної формули І, введеної в неї у ви гляді високочистої вільної основи. Контактні силіконові клеї є комерційно доступними продуктами і випускаються, наприклад, фірмою Dow Corning у вигляді біо-АКПклеїв Q7-4300 або Q7-4200. Здатні до утворення розплаву силіконові клеї зазначеного типу, що складаються із сумішей АКП-клею Q7-4300 з органічними восками, такими як озокерит або церезин, також можна придбати у фірми Dow Corning. На Фіг.3 показані графіки швидкості проникнення діючої речовини через шкіру миші, побудовані на основі даних, отриманих in vitro при застосуванні пластиру, виготовленого на основі силіконового клею, способом основаним на використанні його розплаву, і що містить озокерит, як пластифікатор для клейової матриці, а також введений в її фезотеродин у вигляді високочистої основи. ЕВА-клеї ЕВА-клеї являють собою здатні до утворення розплаву контактні клеї на основі співполімерів етилену з вінілацетатом ("ЕВА-клеї"). Такі ЕВАклеї описані, зокрема, [у патенті US 4144317]. ЕВА-клеї відрізняються гарними властивостями 27 81803 щодо клейкості, простотою одержання і переробки, а також гарно переносяться шкірою. ЕВА-клеї можна придбати, наприклад, у фірми Beardow Adams (13/ВА). Щодо переробки названих клеїв способом, основаним на використанні розплаву, справедливо в принципі все сказане вище у відношенні силіконових клеїв, за винятком того, що до ЕВАклеїв звичайно не потрібно додавати пластифікатори. Ще одним об'єктом винаходу відповідно до цього є пристрій для трансдермального введення в організм сполуки формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з C1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, який відрізняється тим, що сполука загальної формули І у вигляді вільної основи з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, введена в полімерний шар, який здатний самоклеїтися (клейову матрицю), до складу якого входить контактний клей ЕВА- типу. В одному з особливо кращих варіантів здійснення винаходу клейову матрицю на основі ЕВА-клею одержували способом, основаним на використанні розплаву. Як діючу речовину в таку пропоновану у винаході матрицю на основі ЕВАклею краще при цьому вводити фезотеродин у вигляді високочистої вільної основи. На Фіг.2 та 3 показані графіки швидкості проникнення діючої речовини через шкіру людини, відповідно через шкіру миші, побудовані на основі даних, отриманих in vitro при застосуванні пластиру, який виготовлений на основі ЕВА-клею способом, основаним на використанні його розплаву, та який містить введений у клейову матрицю фезотеродин у вигляді високочистої вільної основи. Контактні SXS-клеї Контактні SXS-клеї можна переробляти і способом, основаним на використанні розчинників, і способом, основаним на використанні розплаву. Під поняттям "контактні SXS-клеї" (далі SXS-клеї) відповідно до винаходу мають на увазі клеї на основі блокспівполімерів стиролу, макромолекули яких несуть на кінцях нееластомерні стирольні блоки, а в середній частині - еластомерні блоки. Еластомерні блоки можуть являти собою, 28 наприклад, поліетиленбутилен, поліетиленпропілен, полібутадієн, поліізобутилен або поліізопропен. Відповідні SXS-клеї описані, зокрема, [у патентах US 5559165 і US 5527536], і вони відрізняються гарними властивостями щодо клейкості, простотою одержання і переробки, а також гарно переносяться шкірою. Контактні SXS-клеї є в продажі (наприклад, під назвою Duro Tak 378-3500, продукт фірми National Starch & Chemical) або їх можна одержувати самостійно в черв'ячному розплавлювачі при виготовленні пластирів, які містять діючу речовину. З цією метою, наприклад, відповідні кількості (принаймні зазначених нижче компонентів) блокспівполімеру стиролу (наприклад, типу Kraton GX1657 або Kraton D-1107CU фірми Shell) з аліфатичною і/або ароматичною смолою (наприклад, типу Regalite R1090, Regalite R1010 або Regalite R1100 фірми Keyser Mackay) і маслом (наприклад, типу Ondina 933 або Ondina 941 фірми Shell) подають з окремих дозуючих пристроїв у черв'ячний розплавлювач, де вони змішуються між собою і розплавляються. На останній стадії в одержаний таким шляхом контактний клей у черв'ячний розплавлювачі дозують діючу речовину й одержану масу наносять рівним шаром на плівки. Полімер, смолу й масло звичайно використовують у масовому співвідношенні між ними, що становить, наприклад, 100:120:20 або 100:200:50. Варіюючи це кількісне співвідношення між зазначеними компонентами, властивості SXSклею можна відповідно узгоджувати з необхідними властивостями ТТС (клейкість, мінімальна плинність у холодному стані, тривалість зберігання клейкості, профіль вивільнення діючої речовини і т.д.). Ще одним об'єктом винаходу відповідно до цього є пристрій для трансдермального введення в організм сполуки формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений C1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, який відрізняється тим, що сполука загальної формули І у вигляді вільної основи з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, введена в полімерний шар, який здатний самоклеїтися 29 81803 (клейову матрицю), до складу якого входить контактний клей на основі SXS. В одному з особливо кращих варіантів здійснення винаходу клейову матрицю на основі SXS одержували способом, основаним на використанні розплаву. Як діючу речовину в пропоновану у винаході матрицю на основі SXS краще при цьому вводити фезотеродин у вигляді високочистої вільної основи. На Фіг.2 та 3 показані графіки швидкості проникнення діючої речовини через шкіру людини, відповідно через шкіру миші, побудовані на основі даних, отриманих in vitro при застосуванні пластиру, який виготовлений на основі SXS-клею способом, основаним на використанні його розплаву, і який містить введений у нього фезотеродин у вигляді високочистої вільної основи. Оскільки SXS-клеї виявляють високу тенденцію до окислювання, до клейових матриць на їх основі бажано додавати антиоксиданти. Як приклад придатного для цієї мети антиоксиданту можна назвати Irganox® (продукт фірми СІВА). Акрилатні клеї Поліакрилати одержують радикальною полімеризацією похідних (мет)акрилової кислоти, при цьому як інші мономери можуть використовува тися також інші сполуки, такі, наприклад, як вінілацетат. Під поняттям "поліакрилат" відповідно до винаходу маються на увазі полімери, які містять ланки на основі акрилової кислоти і/або метакрилової кислоти, так само як і їх співполімери і суміші. Шляхом підбору відповідних мономерів, контактним клеям, які одержують з них, можна в принципі надавати особливі властивості, тобто забезпечувати оптимальну здатність розчиняти діючу речовину, необхідну р ухливість діючої речовини в матриці, а також забезпечувати необхідну швидкість її транспортування через шкіру. Слід зазначити, що швидкість транспортування діючої речовини через шкіру істотно обмежена коефіцієнтом її розподілу і її всмоктуванням через шкіру. Клей (контактний клей), який активується при короткочасному притисненні поліакрилатного типу може являти собою гомополімер і/або співполімер принаймні однієї похідної акрилової кислоти і/або метакрилової кислоти у вигляді розчину в органічному розчиннику. Контактний клей поліакрилатного типу може бути таким, що зшивається або таким, що не зшивається. Зшивальний агент зв'язує полімерні ланцюги за допомогою реакційноздатних гр уп. У результаті подібного зшивання може підвищуватися когезія контактного клею. Полімерний контактний клей поліакрилатного типу бажано складається принаймні з мономерів, вибраних із групи, яка включає акрилову кислоту, акриламід, гексилакрилат, 2-етилгексилакрилат, гідроксіетилакрилат, октилакрилат, бутилакрилат, метилакрилат, гліцидилакрилат, метакрилову кислоту, метакриламід, гексилметакрилат, 2етилгексиламідакрилат, октилметакрилат, 30 метилметакрилат, гліцидилметакрилат, вінілацетат, вінілпіролідон і алілакрилат. До числа кращих контактних полімерних клеїв акрилатного типу відносяться контактні клеї, що зшиваються, які одержують полімеризацією мономерів у наступних їх комбінаціях: 2-етилгексилакрилат/Nбутилакрилат/бутилакрилат/акрилова кислота, 2-етилгексилакрилатNбутилакрилат/вінілацетат/акрилова кислота, 2-етилгексилакрилат/вінілацетат/акрилова кислота, 2-етилгексилакрилат/вінілацетат/алілакрилат, 2-етилгексил акрилат/вінілацетат/дивінілбензол/акрилова кислота, 2етилгексилакрилат/вінілацетат/алілметакрилат/акр илова кислота, 2-етилгексил акрилат/вінілацетат/2гідроксіетилакрилат, 2-етилгексил акрилат/вінілацетат/2гідроксіетилметакрилат, 2-етилгексилакрилат/діетиловий ефір фумарової кислоти/акрилова кислота, 2-етилгексилакрилат/діетиловий ефір малеїнової кислоти/2-гідроксіетил акрилат. Як приклад кращих зшивальних агентів можна назвати наступні сполуки: дифенілметан-4діізоціанат, гексаметилендіізоціанат, ацетилацетонат титану, ацетилацетонат алюмінію, ацетилацетонат заліза, ацетилацетонат цинку, ацетилацетонат магнію, ацетилацетонат цирконію, 2-етил-1,3-гександіолтитанат, тетраізооктилтитанат, тетранонілтитанат, поліфункціональні похідні пропіленіміну, ефірні похідні меламіно-формальдегідних смол, уретанові смоли з високим ступенем метилування і іміно-меламінові смоли. Контактні клеї, що не зшиваються, бажано одержувати полімеризацією мономерів у наступних їх комбінаціях: 2-етилгексил акрилат/Nутилакрилат/вінілацетат, 2-етилгексилакрилат/вінілацетат, 2-етилгексил акрилат/N-бутил акрилат/вініл ацетат/алілакрилат, 2-етилгексил акрилат/N-Nбутилакрилат/алшметакрилат, 2-етилгексилакрилат/Nбутилакрилат/вінілацетат/дивінілбензол, 2-етилгексилакрилат/діетиловий ефір фумарової кислоти/алілакрилат, 2-етилгексилакрилат/діетиловий ефір малеїнової кислоти/алілакрилат, 2-етилгексилакрилат/Nбутилакрилат/акриламід/вінілацетат/алілакрилат, 2-етилгексилакрилат/Nбутилакрилат/ізобутилакрилат/вінілацетат/алілакр илат. Крім цього деякі контактні клеї зазначеного вище тип у можна використовувати у вигляді водної дисперсії (контактні клеї дисперсійного типу). Перевага, пов'язана з використанням таких контактних клеїв дисперсійного типу, полягає в 31 81803 тому, що в процесі нанесення з них покриттів і їх сушіння не відбувається випарювання горючих або токсичних розчинників. Контактні клеї дисперсійного типу бажано одержувати полімеризацією мономерів у наступних їх комбінаціях: N-бутилакрилат/ізобутилакрилат/акрилова кислота, 2-етилгексилакрилат/Nбутилакрилат/акрилова кислота, 2-етилгексилакрилат/N-бутилакрилат/2гідроксіетилакриламід, 2-етилгексилакрилат/Nбутилакрилат/вінілацетат/акриламід, 2-етилгексилакрилат/Nбутилакрилат/вінілацетат/2-гідроксіетил акрилат, 2-етилгексилакрилат/Nбутилакрилат/алшакрилат/акрилова кислота, 2-етилгексилакрилат/Nбутилакрилат/вінілацетат/дивінілбензол. Для поліпшення фізичних властивостей контактного клею або для їх узгодження з особливими вимогами придатні для застосування відповідно до винаходу поліакрилати зшивають за допомогою іонів багатовалентних металів. Звичайно іони металів використовують у вигляді хелатних сполук металів, розчинних в органічних розчинниках. Найбільш придатні для застосування як зшивальні агенти ацетилацетонат алюмінію й ацетилацетонат титану. При використанні відповідно до винаходу як контактний клей поліакрилатного контактного клею його здатність розчиняти діючу речовину залежить в основному від типу і кількості вільних функціональних груп, що містяться в такому клею. До числа найбільш кращих для застосування в пропонованому у винаході пристрої контактних клеїв відносяться поліакрилати з полярними групами, насамперед з вільними гідроксигрупами. Як приклад подібних контактних клеїв можна назвати поліакрилати, для одержання яких полярні мономери, такі, наприклад, як гідроксіетилакрилат, гідроксіетилметакрилат, акрилова кислота або метакрилова кислота, використовують у кількості біля 1-10мас.%, особливо бажано в кількості 38мас.%, найбільш бажано в кількості 4-6мас.%. Подібні контактні клеї є у продажі під торговельною назвою Duro-Tak® (фірма National Starch & Chemicals, Гамбург). У пропонованому у винаході пристрої найбільш бажано використовува ти контактні клеї поліакрилатного типу, при одержанні яких мономери гідроксіетилакрилат і/або гідроксіетилметакрилат домішують у процесі полімеризації в кількості 3-8мас.%, особливо краще в кількості 4-6мас.%. Подібний контактний клей можна одержувати відповідно до описаного в US 5498418 загальним способом наступним шляхом. Контактний клей зазначеного типу можна одержувати шляхом радикальної полімеризації. На першій стадії в органічному розчиннику приготовляють суміш з 2140мас.% вінілацетату, 55-70мас.% С2-С8алкілового ефіру акрилової кислоти і 3-10мас.% С2С4гідроксілалкілового ефіру акрилової кислоти 32 (вміст мономерів у суміші повинен становити в цілому 100мас.%). На другій стадії до суміші домішують звичайний зшивальний агент в органічному розчиннику, а також у деяких випадках домішують діючу речовину, якість якої повинна відповідати меті застосування, що передбачається, трансдермального пристрою (пластиру), при необхідності в органічному розчиннику. На завершення на третій стадії одержану суміш особливого співполімеру акрилату з вінілацетатом піддають на додатковому етапі зшиванню при одночасному нагріванні і видаленню органічного розчинника або суміші розчинників, які використовують. Одержана діюча речовина особливим чином шляхом послідовного і додаткового зшивання зазначеного співполімеру акрилату з вінілацетатом "вбудовують" у матеріал контактного клею. В іншому варіанті співполімер акрилату з вінілацетатом можна полімеризувати і зшивати під час відсутності діючої речовини. У цьому випадку діючу речовину додають у процесі переробки співполімеру акрилату з вінілацетатом при виготовленні пластиру. Відносна в'язкість цього співполімеру акрилату з вінілацетатом становить від 3,0 до 4,2 при 20°С. До суміші на додаток до вінілацетату бажано додавати мономери 2-етилгексилакрилат і гідроксіетилакрилат. Для наступного зшивання особливого співполімеру акрилату з вінілацетатом доцільно використовувати е фір титанової кислоти, що складається з полібутилтитанату і/або ацетилацетонату титану, краще в кількості від 0,3 до 3мас.% у перерахунку на масу співполімеру. Процес виготовлення пропонованої у винаході ТТС може включати наступні стадії. Спочатку приготовляють розчин співполімеру, що одержаний радикальною полімеризацією суміші мономерів, яка складається з 21-40мас.% вінілацетату, 55-70мас.% С2-С8алкілового ефіру акрилової кислоти і 1-10мас.% С2С4гідроксіалкілового ефіру акрилової кислоти, з домішуванням у деяких випадках діючої речовини в кількості, яка необхідна для передбаченої мети застосування ТТС, а також звичайного зшивального агента або суміші таких агентів, після чого одержаний розчин наносять на захисну плівку ТТС шаром необхідної товщини й на завершення шляхом нагрівання видаляють розчинник або суміш розчинників, що в остаточному підсумку приводить до додаткового зшивання особливого співполімеру акрилату і вінілацетату. В одному з варіантів здійснення подібного процесу співполімер акрилату з вінілацетатом і в деяких випадках діючу речовину, а також зшивальний агент спочатку розчиняють у розчиннику, що містить 20-40мас.% етанолу або суміші етанолу з метанолом, при певному співвідношенні між твердими компонентами, що складаються на 40-60мас.% із суміші співполімеру акрилату з вінілацетатом, зшивального агента і діючої речовини. В іншому, кращому, варіанті здійснення винаходу діючу речовину додають до дисперсії 33 81803 лише після зшивання акрилату і потім її після гомогенізації наносять на захисну плівку. Особливий, включений у даний опис як посилання приклад одержання подібного контактного клею на основі співполімеру акрилату з вінілацетатом приведений [у патенті US 5498418, починаючи з рядка 61 у стовпчику 2 і закінчуючи рядком 10 у стовпчику 3]. Найбільш кращими для використання відповідно до винаходу контактними клеями є клеї Duro-Tak® 387-2287 і Duro-Tak® 387-4287 (випускається фірмою National Starch & Chemicals, Гамбург). В одному з особливо кращих варіантів здійснення винаходу контактний клей Duro-Tak змішують у придатному для цієї мети розчиннику з необхідною кількістю діючої речовини й одержану таким шляхом гомогенну дисперсію розподіляють рівним шаром необхідної товщини. На завершення при підвищеній температурі (50-70°С) видаляють розчинник або суміш розчинників. Ще одним об'єктом винаходу відповідно до цього є пристрій для трансдермального введення в організм сполуки формули І у якій А означає водень або дейтерій, a R являє собою групу, вибрану з С1-С6алкілу, С3С10циклоалкілу і фенілу, кожний з яких може бути заміщений С1-С3алкоксигрупою, фтором, хлором, бромом, йодом, нітрогрупою, аміногрупою, гідроксигрупою, оксогрупою, меркаптогрупою або дейтерієм, і в якій позначений символом "*" (зірочкою) С-атом може знаходитися в (R)конфігурації, (S)-конфігурації або в змішаній конфігурації, який відрізняється тим, що сполука загальної формули І у вигляді вільної основи з ступенем чистоти вище 97мас.%, краще вище 98мас.%, особливо краще вище 98,5мас.%, найбільш краще вище 99мас.%, введена в полімерний шар, краще в полімерний шар, який здатний самоклеїтися (клейову матрицю), що містить принаймні один полімер акрилатного типу і/або метакрилатного типу. Як діючу речовину в пропоновану у винаході матрицю на основі акрилату бажано вводити фезотеродин у вигляді високочистої вільної основи. На Фіг.3 показаний графік швидкості проникнення діючої речовини через шкіру миші, побудований на основі даних, отриманих in vitro при застосуванні пластиру, який виготовлений на основі акрилатного клею, способом основаним на використанні його розплаву, і який містить введений у нього фезотеродин у вигляді високочистої вільної основи. Допоміжні речовини і домішки Описані вище полімерні матриці, які містять діючу речовину, в пропонованих відповідно до 34 винаходу пристроях можуть містити також інші допоміжні речовини і домішки. Як приклад при цьому можна назвати буфери, гідротропні солюбілізатори, хімічні стабілізатори, антиоксиданти, інші допоміжні речовини для уповільнення вивільнення діючої речовини (ретарданти), а також активатори черезшкірного всмоктування. Активатори черезшкірного всмоктування можна додавати, наприклад, для збільшення проникаючої через шкіру кількості діючої речовини або для зменшення розмірів пристрою і відповідно площі ділянки шкіри, яка покривається ним. Як приклади, що не обмежують обсяг винаходу, найбільш часто використовуваних активаторів черезшкірного всмоктування можна назвати спирти, насамперед спирти з коротким ланцюгом, такі як етанол, жирні спирти, такі як лауриловий спирт, багатоатомні спирти, такі як гліцерин, аміди, наприклад, ароматичні аміди, такі як N,N-діетил-мтолуамід, амінокислоти, азони, масла (олії), такі, зокрема, як ментол або м'ятна олія, жирні кислоти та їх ефіри, такі, наприклад, як олеїнова кислота, лаурилова кислота, ізопропілміристат або гліцеринмонолаурат, макроцикли, такі, наприклад, як циклопентадеканон, фосфоліпіди, такі як лецитин, 2-піролідони, а також сульфоксиди, такі, зокрема, як диметилсульфоксид. Завдяки гарній здатності вільних основ загальної формули І проникати через шкіру в кращих варіантах здійснення винаходу пропонується відмовитися від домішування активаторів черезшкірного всмоктування. Як інші компоненти до клейової матриці можна додавати гідрофільний компонент, такий, наприклад, як гідрофільний полімер. Подібні гідрофільні полімери можуть виконувати функції гідротропних солюбілізаторів, відповідно інгібіторів кристалізації сполук загальної формули І і сприяти рівномірному їх розподілу в клейовій матриці. Гідрофільні полімери, придатні для використання в пропонованій у винаході ТТС, можна вибирати, наприклад, із групи, яка включає полісахариди, заміщені полісахариди, поліетиленоксиди, полівінілацетати, полівінілпіролідони (ПВП), ПВП із відповідними пластифікаторами, поліетиленгліколі, поліпропіленгліколі, поліакрилати, співполімери полівінілпіролідону і (полі)вінілацетату, співполімери етилену і вінілацетату, а також полівінілові спирти з відповідними пластифікаторами, наприклад, гліцерином. До кращих гідрофільних полімерів відносяться ПВП, поліетиленоксиди (ПЕО), полівінілацетати (ПВАц), а також співполімери ПВП із вінілацетатом. Гідрофільні полімери можна додавати до клейового шару, наприклад, у кількості від 0,5 до 40мас.% у перерахунку на його загальну масу. Бажано додавати гідрофільні полімери в кількості від 2 до 25мас.%, особливо краще від 2 до 15мас.% або від 2 до 10мас.%. Для переробки способом, основаним на використанні розплаву, особливо придатні такі гідрофільні полімери, динамічна в'язкість розплаву 35 81803 яких при температурах нижче 170°С становить максимум 150Па×с, краще менше 120Па×с, особливо краще менше 80 Па«с. При занадто низькій динамічній в'язкості гідрофільного полімеру при необхідній температурі його переробки до нього необхідно попередньо додавати відповідний пластифікатор, наприклад, гліцерин. Домішування зазначених вище гідрофільних полімерів може виявитися доцільним насамперед у випадку клейових матриць, що мають дуже високу гідрофобність, наприклад, силіконових, поліізобутиленових або SXS-матриць. Складні 3,3-дифенілпропіламіномоноефіри у вигляді вільних основ проявляють, про що вже згадувалося [в WO 01/35957], тенденцію до зменшення свого вмісту, що обумовлено, наприклад, гідролізом і переетерифікацією. Відповідно до винаходу, однак, несподівано було встановлено, що стабільність складних 3,3дифенілпропіламіномоноефірів можна значно підвищити при їх включенні в матриці з гідрофільними компонентами. Так, наприклад, якщо після 6-місячного зберігання при 5°С вільна основа фезотеродин у вигляді масла розкладається приблизно на 3-4%, то при введенні фезотеродину в матриці, які містять полярні компоненти, його кількість не зменшується зовсім або зменшується в набагато меншому ступені. Як приклад таких матриць, що забезпечують стабілізацію складного моноефіру загальної формули І, можна назвати матриці, які містять поліакрилати, насамперед поліакрилати з полярними групами, ЕВА або суміші силіконових клеїв з гідрофільними полімерами, наприклад, ПВП або ПЕО (таблиця 4). 36 полімерами, такими як ПЕО або ПВП, дозволяє значно підвищити стабілізацію фезотеродину, а саме, незалежно від способу переробки (у розплаві або розчиннику). Один з варіантів здійснення винаходу відноситься відповідно до цього до матриць, відповідно до фармацевтичних композицій або пристроїв, у яких вміст сполуки загальної формули І знижується у вигляді вільної основи значно повільніше в порівнянні з їх зберіганням у вигляді масла в ідентичних умовах у не введеному в полімер стані. До кращих відносяться такі варіанти, у яких при зберіганні при 5°С та/або 25°С забезпечується принаймні 2-, 3-, 7- або 10-кратне підвищення стабілізації складного 3,3дифенілпропіламіномоноефіру в порівнянні з аналогічними показниками при його зберіганні у вільному вигляді. До особливо кращих пропонованих у винаході фармацевтичних композицій, відповідно пристроїв відносяться такі, у яких вільна основа присутня в полімерному шарі, у якому вміст сполуки загальної формули І після 6-місячного зберігання при 4°С знижується менше ніж на 3%, краще менше ніж на 2% або 1%, а після 3-місячного зберігання при 25°С та 60%-вій відносної вологості повітря знижується менше ніж на 10%, краще менше ніж на 5%, особливо краще менше ніж на 3% або 1,5%. Кращими матрицями є такі, які містять від 50 до 95мас.% контактного клею, вибраного з групи, яка включає - акрилатні клеї, а також їх співполімери, насамперед акрилатні клеї з полярними групами, наприклад, з вільними гідроксигрупами, - ЕВА-клеї, - силіконові клеї, які містять від 2 до 25мас.%, переважно від 2 до 10мас.%, гідрофільного полімеру, вибраного насамперед з ПЕО, ПВП і 4 Таблиця ПВАц, - SXS- або зберіганні Стабілізація фезотеродину в різних матрицях при ПІБ-клеї, які містять від 2 до 25мас.%, переважно від 2 до 10мас.%, гідрофільного полімеру, Коефіцієнт стабілізації1 Коефіцієнт стабілізації1 при зберіганні Спосіб переробки Матриця при зберіганні при 5°С при 2 5-°Ссуміші з відн. вологості контактних клеїв і 60%-вій гідрофільних (наприклад, полярних поліакрилатів) і у розплаві гідрофобних ЕВА 7 4,5 контактних клеїв (наприклад, силіконових, SXSсилікон/цер3 у розплаві або ПІБ-клеїв). силікон+2% ПВП 2 2 у розчиннику До найбільш кращих контактних розплаві силікон/цер3+5% ПЕО 3 2,5 у клеїв для одержання пропонованих у винаході матриць розкладання не поліакрилат у розчиннику відносяться 13 поліакрилати, насамперед спостерігається 2 поліакрилати - з полярними групами. Подібні поліізобутилен (ПІБ) у розчиннику матриці не тільки забезпечують винятково SXS 1,1 у розплаві ефективний профіль вивільнення фезотеродину, але і мають високу здатність стабілізувати Примітки: складний 3,3-дифенілпропіламіномоноефір. 1 коефіцієнт стабілізації визначали поділом середньомісячного показує практика, фезотеродину при його Як зменшення вмісту оптимальними для зберіганні у вигляді ви хідного матеріалу (масло) на середньомісячне зменшення вмісту при зберіганні в пацієнтів є ТТС із площею максимум приблизно матрицях, 50см 2. Звичайно ТТС має площу, що дорівнює 2 до кінця періоду вимірювань через 6 місяців, 40см 2, кращі, однак, ТТС із площею від 5 до 35см 2, 3 цер означає церезин. особливо бажано від 10 до 30см 2. Питома маса матриць у ТТС варіюється звичайно в межах від 30 до 300г/см 2, кращі при З наведених у таблиці 4 даних випливає, що цьому матриці з питомою масою від 40 до введення фезотеродину в матриці, які 200г/см 2, насамперед від 40 до 150г/см 2. складаються з ЕВА-клею, поліакрилатного клею або сумішей силіконового клею з гідрофільними 37 81803 Кількість введеної в ту або іншу конкретну матрицю діючої речовини залежить від її ємності та її здатності вивільняти діючу речовину, а також від способу її одержання. Звичайно діючу речовину доцільно вводити в матрицю в кількості від 5 до приблизно 40мас.% у перерахунку на її загальну масу разом з діючою речовиною, при цьому для виготовлення ТТС, розрахованої на застосування впродовж 1-3 доби, максимальну кількість введеної в матрицю діючої речовини краще обмежувати більш низькими значеннями, що знаходяться у межах від 7 до 30мас.%, насамперед від 8 до 20мас.%. При необхідності одержання лікарського засобу, розрахованого на введення в організм сполуки загальної формули І впродовж 7 діб, діючу речовину можна використовувати в ньому в порівняно більш високих концентраціях, що становлять, наприклад, 14-15мас.%. Відповідно до цього питома концентрація діючої речовини в матриці (у мг на см 2 її площі) становить від 0,1 до 12, краще від 0,25 до 7,5, особливо краще від 0,3 до 4, найбільш краще від 0,6 до 2,5. У пристроях, розрахованих на застосування впродовж 7 доби, питома концентрація діючої речовини в матриці бажано повинна становити не менше 2мг/см 2. Ще одним об'єктом винаходу є спосіб профілактики і/або лікування нетримання сечі, гіперактивності детрузора, гіперактивності сечового міхура, полакізурії, ніктурії або імперативного позиву до сечовипускання, який полягає в тому, що в організм ссавця, насамперед людини, що потребує профілактики або лікування зазначених захворювань, вводять сполуку загальної формули І у вигляді вільної основи з пропонованим у винаході ступенем чистоти, зазначеним вище. Нижче винахід більш докладно проілюстрований на прикладах. Приклади 1. Одержання фезотеродину у вигляді високочистої основи А. Одержання фезотеродину у вигляді основи (формула В, див, Фіг.1, R являє собою ізопропіл) До охолодженого до -3°С розчину 59,8г (175,1моль) (R)-2-[3-(діізопропіламіно)-1фенілпропіл]-4-(гідроксиметил)фенолу (формула А, ди в. Фіг.1), розчиненого в 750мл дихлорметану, впродовж приблизно 10хв. по краплях при перемішуванні й охолодженні на льодяній бані додавали розчин 18,6г хлорангідриду ізомасляної кислоти в 250мл дихлорметану. Через приблизно 5хв. в осад випадала біла речовина. До цієї речовини впродовж 5 хв по краплях при перемішуванні й охолодженні на льодяній бані додавали розчин 17,7г триетиламіну в 250мл дихлорметану. Потім суміш послідовно по одному разу промивали 250мл води, 250мл приблизно 5%-вого водного розчину NaHCO3 і 250мл води. Висушений над Na2SO4 дихлорметановий екстракт концентрували на роторному випарнику до постійної маси з одержанням у результаті в'язкоплинного масла блідо-жовтого кольору. Вихід сирого продукту: 63,7г (88,5%). 38 Чистота сполуки формули В за даними РХВРаналізу становила в цьому прикладі 94,1%. Звичайний діапазон чистоти цієї сполуки становить 90,5-94,4%. У досліді з перегонкою у високому вакуумі відбувалося розкладання сполуки формули В з утворенням сполук формул А та С Б. Одержання фумарату фезотеродину (формула Е, Фіг.1, R являє собою ізопропіл, X означає гідрофумарат) Розчин 41,87г (102ммоль) ефіру (R)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілізомасляної кислоти (формула В) у 90мл 2-бутанону змішували при нагріванні з фумаровою кислотою (11,81г, 102ммоль). Після розчинення кислоти повільно додавали при перемішуванні циклогексан (20-30мл) аж до початку помутніння. Безбарвну гомогенну суміш витримували спочатку впродовж 18год. при кімнатній температурі, а потім впродовж декількох годин при 0°С. Безбарвні кристали, що випали в осад, відокремлювали вакуум-фільтрацією, промивали невеликою кількістю суміші циклогексану і 2-бутанону (у співвідношенні 90:10, у об. %) і сушили у вакуумі при 30°С. Вихід: 44,6г (83,1% від теорії) гідрофумарату (формула Е) ефіру (R)-2-(3-діізопропіламіно-1фенілпропіл)-4-гідроксиметилфенілізомасляної кислоти у вигляді безбарвних лусочок. tпл 98,8°C, після другої кристалізації з тієї ж самої суміші розчинників одержали продукт з tпл 103°С. [α]D20=+6,0 (с=1,0, етанол); -19,3 (с=1,0, ацетонітрил). 1 Н-ЯМР (CDCI3): зокрема 6,84част/млн для СН= гідрофумарат-аніона. 13 С-ЯМР (CDCl3): зокрема 135,58част/млн та 170,56част/млн для олефінових і карбонільних атомів вуглецю гідрофумарат-аніона. Чистота одержаної в цьому прикладі сполуки формули Ε (за даними РХВР-аналізу) становила 99,2%. В. Одержання фезотеродину у вигляді високочистої основи (формула В, Фіг.1, R являє собою ізопропіл) 250г (0,474моль) кристалічного фумарату (R)2-[3-(діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)-феніл-2-метилпропаноату (формула Е) додавали при перемішуванні до 1л води і нагрівали до 30°С. Після закінчення приблизно 30 хв утворювався майже прозорий розчин. До цього охолодженого до кімнатної температури розчину впродовж приблизно 10хв. порціями додавали при перемішуванні 96,0г гідрокарбонату натрію. До майже прозорого безбарвного водного розчину гідрокарбонату фезотеродину додавали 1л дихлорметану. Після нетривалого перемішування при кімнатній температурі (інтенсивне утворення СО2) дихлорметанову фазу відокремлювали і послідовно по одному разу промивали 0,2л 5%вого водного розчину гідрокарбонату натрію і 0,2л води. Після фільтрації прозору безбарвну дихлорметанову фазу концентрували на роторному випарнику при температурі бані біля 39 81803 40°С до постійної маси з створенням на завершення вакууму за допомогою мембранного насоса (кінцевий тиск 5мбар). У результаті одержали ефір (R)-2-(3-діізопропіламіно-1фенілпропіл)-4-гідроксиметилфенілізомасляної кислоти (формула В) у вигляді майже безбарвного в'язкого масла. Вихід: 180,6г (92,6%). [α]D20=+5,9 (с=1,0, етанол); -6,7 (с=1,0, ацетонітрил). ЯМР (CDCI3): 19,01, 19,95, 20,59, 21,12, 34,28, 36,89, 41,88, 42,32, 43,90, 48,78, 64,68, 122,57, 125,59, 126,16, 126,86, 127,96, 128,54, 136,88, 138,82, 143,92, 147,90, 175,69 (част/млн). Чистота одержаної в цьому прикладі сполуки становила за даними РХВР-аналізу 99,0%. Звичайний діапазон чистоти цієї сполуки становить 98,7-99,5%. 1 Н- та 13С-ЯМР: Резонансні сигнали для гідрофумарат-аніона знаходилися нижче межі виявлення (порівн. формулу Е). Довгостроково цю сполуку краще зберігати в темному місці в атмосфері аргону при -20°С. Г. Одержання гідрокарбонату (формула Е, Фіг.1, R являє собою ізопропіл. X означає гідрокарбонат) Фезотеродин (107,7мг, ефір (R)-2-(3діізопропіламіно-1-фенілпропіл)-4гідроксиметилфенілізомасляної кислоти, формула В) покривають шаром дистильованої води і перемішують при кімнатній температурі. Після 2денного перемішування реакційна суміш як і раніше залишається двофазовою. У верхній, водній фазі за даними тонкошарової хроматографії (силікагель, система розчинників: петролейний ефір/ацетон/триетиламін у співвідношенні 70:20:10, об.%) відсутній будь-який органічний матеріал (формула В або Е). Через цю двофазову реакційну суміш при кімнатній температурі і при перемішуванні пропускають слабкий потік діоксиду вуглецю. Розчинення нижньої, масляної фази (фезотеродину) у водній фазі повністю, до утворення прозорого розчину завершується після закінчення двох днів. 13 С-ЯМР-спектр гідрокарбонату фезотеродину (δ-показники): 14,11, 15,36, 15,51, 29,32, 31,09, 38,95, 43,31, 52,38, 60,45, 120,04, 124,07, 124,33, 124,83, 126,12, 131,97, 136,55, 139,06, 144,60, 157,46 (НСО3-), 175,75. Отримані значення (значення δ) добре 13 узгоджені з даними С-ЯМР-спектроскопії гідрохлориду фезотеродину, одержаного шляхом розчинення основи в 1-молярній соляній кислоті: 13,26, 15,32, 15,48, 29,29, 31,06, 38,95, 43,34, 52,42, 60,49, 120,10, 124,18, 124,38, 124,85, 126,13, 131,97, 136,50, 139,02, 144,61, 175,94. 2. Одержання матриць ТТС 2.1. Одержання матриці на основі силіконового клею способом, основаним на використанні розплаву 8,5г контактного клею на силіконовій основі, що являє собою суміш контактного силіконового клею Біо-АКП Q7-4300 (фірма Dow Corning, шт. Мічиган) з 5мас.% озокериту (фірма Dow Corning), 40 впродовж приблизно 20хв. нагрівали до 150°С до утворення гомогенного розплаву. Потім додавали 1,5г фезотеродину (високочиста вільна основа) і суміш впродовж наступних 5хв. витримували при 150°С. Далі суміш гомогенізували вручну і наносили на попередньо нагріту плівку (120°С, ширина зазору 250мкм). Для дослідів з вивільнення діючої речовини плівку нарізали на шматочки площею 5см 2. 2.2. Одержання матриці на основі акрилатного клею способом, основаним на використанні розчинника 1,5г фезотеродину у вигляді високочистої основи розчиняли в дихлорметані та додавали до 8,5г розчину клею DuroTak® 387-2287 (в етилацетаті). Суміш, що утворилася, перемішували до одержання гомогенної дисперсії. Потім цю дисперсію наносили рівним шаром на плівку (витягання згідно Еріхсена 100мкм, 6мм/с, сушіння: 30хв. при 50°С). 2.3. Одержання матриці на основі SXS-клею способом, основаним на використанні розплаву 100 частин блокспівполімеру стиролу (тип Kraton D1107CU), 150 частин смоли (тип Regalite R 1090), 20 частин масла (тип Ondina) і 1 частину антиоксиданту (тип Irganox) змішували між собою і розплавляли при високій температурі, що дорівнює 140°С. Потім до розплаву, що взятий порціями по 8,5г, додавали 1,5г фезотеродину (у вигляді високочистої вільної основи) і суміш впродовж наступних 1-5 хв витримували при 140°С. Потім суміш гомогенізували механічним шляхом і наносили на попередньо нагріту плівку (120°С, 250мкм). Для дослідів плівку нарізали на шматочки необхідного розміру. 2.4. Одержання матриці на основі ЕВА-клею способом, основаним на використанні розплаву 8,5г ЕВА-клею нагрівали впродовж приблизно 20хв. до 160°С до утворення гомогенного розплаву. Потім до цього розплаву додавали 1,5г, відповідно 1,65 г фезотеродину у вигляді високочистої основи, після чого суміш гомогенізували вручн у. На завершення суміш наносили на попередньо нагріту (до 120°С) поверхню охолоджувального циліндра типу "ChillRoll". Одержану плівку (для дослідів з дослідження проникнення діючої речовини через шкіру) нарізали на шматочки площею по 5см 2. 3. Досліди з дослідження вивільнення діючої речовини 3.1. Визначення проникнення діючої речовини на моделі шкіри миші Швидкість проникнення діючої речовини через шкіру миші визначали в горизонтальній дифузійній комірці, використовуючи шматочки шкіри товщиною біля 120-150мкм, взяті з черевця і спини тварин. Середовище: фосфа тний буферний розчин (0,066молярний), рН6,2, 32°С. Вивільнення діючої речовини визначали рідинною хроматографією високого розподілу (РХВР). 3.2. Визначення проникнення діючої речовини на моделі шкіри людини (а) Експериментальна частина 41 81803 Проникнення фезотеродину через шкіру людини визначали в основному за методикою, яка описана [в Н. Tanojo та ін. у Journ. Control Rel. 45, 1997, cc.41-47], але використовуючи замість силіконової мембрани діалізну мембрану [Diachema, тип 10.14, фірма Dianorm, Мюнхен, Німеччина, виготовлену з нейтральної целюлози, гранична крупність молекул, які проходять через мембрану, 5000Да, товщина (у сухому стані) 25мкм, попередня обробка відповідно до інструкції виробника]. У дослідах використовували шматочки шкіри людини товщиною біля 250мкм, взяті з абдомінальної ділянки. ТТС із площею поверхні 2,545см 2 накладали на шматочок шкіри такої ж площі, при цьому шкіра прилягала до силіконової мембрани з її поверненої від акцептора сторони (схема 1). Як акцепторну фазу використовували ЗФР (забуферений фосфатом фізіологічний розчин, 0,066-молярний) з рН6,2 і температурою 32±0,5°С. Досліди проводили впродовж 72год. при витраті, яка дорівнює 5мл/год., відбираючи проби кожні 3 год. У моменти взяття проб середовище, у яке вивільнялася діюча речовина, заміняли на свіже середовище з температурою 32±0,5°С і кількість, що вивільнилася, фезотеродину визначали за допомогою РХВР. Швидкість проникнення Q(t) визначали в перерахунку на площу вимірювальної комірки (0,552см 2) за наступною формулою: Q(t) [мкг/см 2]= концентрація фезотеродину ´об'єм акцептора/0,552см 2 (б) Аналіз вивільнення діючої речовини Проникнення діючої речовини через препарати шкіри визначали за допомогою РХВР (колонка Spherizorb 5CN, 25см) за наступних умов: 4об. частин ацетонітрилу/6об. частин Н2О/0,1% об. частин ТФОК, 35°С, 225нм, швидкість потоку 1мл/хв. 4. Визначення чистоти діючої речовини Хімічну чистоту фезотеродину визначали за допомогою РХВР, що заснована на розділенні компонентів на нерухомій оберненій фазі та градієнтному елююванні системою розчинників. Матеріали й уста ткування (як приклад) Ацетонітрил для РХВР, метансульфонова кислота (
ДивитисяДодаткова інформація
Назва патенту англійськоюHighly pure bases of 3,3-diphenyl propylamine monoesters
Автори англійськоюBreitenbach, Armin, Meese, Claus, Wolff, Hans-Michael, Drews, Roland
Назва патенту російськоюВысокочистые сложные 3,3-дифенилпропиламиномоноэфиры
Автори російськоюБрайтенбах Армин, Меезе Клаус, Вольфф Ханс-Михаэль, Древс Роланд
МПК / Мітки
МПК: C07C 217/62, A61K 9/70, A61P 13/00, C07C 213/00, A61K 31/135
Мітки: високочисті, складні, 3,3-дифенілпропіламіномоноефіри
Код посилання
<a href="https://ua.patents.su/22-81803-visokochisti-skladni-33-difenilpropilaminomonoefiri.html" target="_blank" rel="follow" title="База патентів України">Високочисті складні 3,3-дифенілпропіламіномоноефіри</a>
Попередній патент: Шахтна водовідливна установка
Наступний патент: Асинхронний електродвигун
Випадковий патент: Спосіб підготовки зубощелепної системи пацієнта до проведення раціонального протезування при наявності зубощелепних деформацій












