Похідні n-ацил-a-амінокислоти або їх фізіологічно прийнятні солі, прості або складні ефіри, аміди або їх гідрати як фармацевтично активні речовини
Номер патенту: 39849
Опубліковано: 16.07.2001
Автори: Марсел Мюллер, Лео Аліг, Маріанне Хюрцелер, Беат Штейнер, Паул Хадварі, Томас Веллер
Формула / Реферат
1. Производные N-ацил-α-аминокислоты формулы (I):
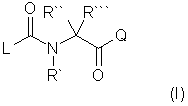
где L - группа формулы
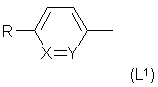
или H2N-(CH2)t- (L2)
где Χ обозначает СН,
Y - СН или N,
R - амидиногруппа,
t - целое число от 2 до 6,
R`-H, Alk, AlkOAlk,
R`` - Η, Alk, AlkNH2, AlkOH, Alk-индолил, AlkCOOH, AlkOCOAlk, Ph, AlkPh, где Ph необязательно имеет один или несколько заместителей, выбранных из группы: ОН, галоген, причем ОН или СООН группы в R`` могут быть переведены в простой или сложный эфир или амид, или
R` вместе с R`` при определенных условиях - пропиленовая или бутиленовая группа, замещенная ОН или AlkPh,
R``` обозначает Alk или Н,
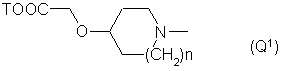
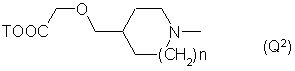
Q - группа формулы
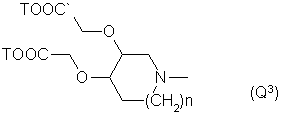
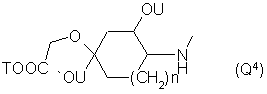
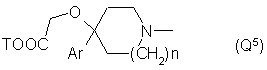
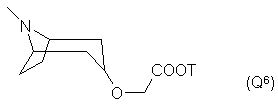
или -NH(CH2)VOCH2COOT, (Q7)
где U, U` - Η, низший алканоил,
Аr – F3AlkPh или, если R` и R`` вместе с N- и С-атомами, с которым они связаны, образуют пирролидиниленовое или пиперидиниленовое кольцо, может быть также группой формулы
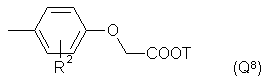
где R2 – Alk, H, OCH2COOAlk,
Alk обозначает низший алкил,
ν - целое число от 2 до 5,
n - целое число от 0 до 1,
Т - Η или низший алкил,
T`-Н,
или их физиологически приемлемые соли, простые или сложные эфиры, амиды или их гидраты в качестве фармацевтически активных веществ.
2. Соединения по п. 1, отличающиеся тем, что L обозначает группу L1, R`, R`` и R``` - водород или имеют значения, указанные в п. 1, причем находящиеся в R`, R`` гидроксильные или карбоксильные группы могут быть этерифицированы до простого или сложного эфира или амидированы, и Т обозначает в группе Q водород или отщепляемый при физиологических условиях низший алкил.
3. Соединения по п. 1 или п. 2, отличающиеся тем, что L обозначает группу L`, R - амидино, Χ обозначает СН, Υ - СН или N и Q - группа Q1, Q2, Q4, Q5 или Q8.
4. Соединения по любому из пп. 1, 2 или 3, отличающиеся тем, что Q обозначает группу Q1, особенно, где n = 1 и Т - водород или метил, и -N(R`)C(R``R```)CO- - один из остатков Gly, Ala, D-Ala, Val, Leu, Sar, Orn, Lys, Phg, 2-метил-Рго, Phe, Туr, 3-йод-Туr, 3,5-дийод-Туr, Ser(Ac), Ser, Asp, Glu, Pro, 4-бензилокси-Рrо, 4-гидрокси-Рrо, 2-пиперидиленкарбонил, NHCH(CH2CH2NH2)CO, Trp, Туr(Ме), Туr(гексил) и O,N(Me)2-Tyr.
5. Соединения по любому из пп. 1, 2 или 3, отличающиесятем, что Q обозначает группу Q2, особенно если n = 1, Т - водород и -N(R`)C(R``R```)CO- -остаток Ala.
6. Соединения по любому из пп. 1, 2 или 3, отличающиеся тем, что Q обозначает группу Q4, особенно такие соединения, где n = 1, Т - водород, U и U`- водород или Ас и -N(R`)C(R``R``` )СО- - остаток А1а.
7. Соединения по любому из пп. 1, 2 или 3, отличающиеся тем, что Q обозначает группу Q5, особенно если n = 1, Т - водород, Аr— α,α,α-трифтор-m-толил и -N(R`)C(R``R```)CO- - остаток А1а.
8. Соединения по любому из пп. 1, 2 или 3, отличающиеся тем, что Q обозначает группу Q8, особенно где R2 - группа -ОСН2СОО(Н или метил), Т -водород или метил и -N(R`)C(R``R```)CO- - остаток Pro.
9. Соединения по п. 1 или п. 3 , отличающиеся тем, что они выбраны из группы:
[[1-[N-(п-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[[1-N-[(5-амидино-2-пиридил)карбонил]-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[[1-[N-(п-амидинобензоил)-3-(4-гидрокси-3-йодoфенил)-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[[1-[3-ацетокси-N-(п-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусная кислота,
[п-[[1-(п-амидинобензоил)-2-пирролидинил]карбонил]фенокси]уксусная кислота,
[[1-[N-[(5-амидино-2-пиридил)карбонил]-L-тирозил]-4-пиперидинил]окси]уксусная кислота и особенно
[[1-[N-(п-амидинобензоил)-L-тирозил]-4-пиперидинил]окси]уксусная кислота.
10. Соединения по п. 1, отличающиеся тем, что Q обозначает группу Q3, где п = 0 и Т - водород, или группу Q6, особенно, где Т - водород.
11. Соединения по п. 1, отличающиеся тем, что Q обозначает группу Q7, особенно, где v = 2, Т - водород или бутил.
12. Соединения по п. 1, отличающиеся тем, что -N(R`)C(R``R```)CO-обозначает остаток N-(метоксиэтил)-Glу.
13. Соединения по п. 1, отличающиеся тем, что они выбраны из группы:
(S)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусная кислота,
сложный этиловый эфир (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусной кислоты,
(S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусная кислота,
1-[N-(4-амидинобензоил)-4`-гексилокси-L-фенилаланил]пиперидин-4-илоксиуксусная кислота.
Текст
39849 Изобретение относится к новым производным N-ацил-a-аминокислоты или их физиологически приемлемым солям, простым или сложным эфирам, амидам или их гидратам в качестве фарма-цевтически активных веществ, которые могут найти применение при лечении или профилактике болезней, вызванных связыванием адгезивных протеинов с тромбоцитами и агрегацией тромбоцитов. Из литературы известны различные производные аминокислот. Из J. Chem. Abstr., 1991 ref. 1750402і известны соединения формулы (II): H2N(NH)CNHC6H4ZCOOH, не содержащие амид-ных групп. Эти кислоты не считаются физиологически активными. Полагают, что соответствующие кислотам (II) амиды (I), которые вместо группы -Z-COOH содержат группу -Z-COOCH2CON(R1,R2), действуют как ингибиторы трипсина и плазмина и таким образом могут находить применение при лечении острого геморратического панкреатита. В отличие от этих соединений заявленные соединения тормозят связывание других протеинов, таких как фибриноген, фибронектин, коллаген, ламинин и фактор Виллибанда, с соответствующими рецепторами и поэтому могут быть использованы при лечении такого, например, заболевания, как тромбоз. Эта, на удивление эффективная, тормозящая активность подтверждается ниже (см. таблицу). Наиболее близкими являются N-ацил-альфа-аминокислоты (патент ЕР № 0381033, кл. С07С311/19), которые отличаются от предлагаемых производных радикалами Q и R', R" (см. ниже структурную формулу 1) и их активность, например, как ингибитора связывания кровяных пластинок, как видно из нижеуказанных сравнительных данных, уступает активности предлагаемых со-единений. Согласно изобретению, предлагаются производные N-ацил-альфа-аминокислоты форму-лы (1): O R " R"' L C N C C Q R' где L - гр уппа формулы: (1) O R (L1 ) (L1) X Y или H2N(CH2)t, (L2) Х - обозначает СН; Y - обозначает СН или N; t - обозначает целое число от 2 до 6; R - амидиногруппа; R' обозначает Н, Alk, AlkOAlk; R" - обозначает Н, Alk, AlkNHz, AlkOH, Аlkиндоил, AlkCOOH, AlkOCOAlk, Ph, AlkPh, где необязательно имеет один или несколько заместителей, вы-бранных из группы ОН, галоген, причем ОН- или СООН-группы в могут быть переведены в простой или сложный эфир или амид или R' обозначает вместе с R" при определенных условиях пропилен- или бутилен-группу, замещенную ОН или AlkPh; R'" - обозначает Alk или Н; Q - обозначает группу формулы (CH2 )n O COO-T N (Q1) (CH2 )n O COO-T N (CH2 )n O (Q2) COO-T N (Q3) O (CH2 )n COO-T' O COO-T N (Q4) O-U O-U' (CH2 )n Ar N (Q5) O O N COO-T COO-T (Q6) или -NH(CH2)VOCH2COOT, 7 ) 39849 где U, U' - Н, низший алкалоид; Аг - FsAlkPh или, если R' к R" вместе с N- и С- атомами, с которыми они связаны, образует пирролидиниленовое или пиперидиниленовое кольцо, может быть также группой формулы: R2 O COO-T (Q8) где R2 - Alk, H, OCH 2COOAlk; везде Alk обозначает низший алкил; v - целое число от 2 до 5; n - целое число от 0 до 1; Т - обозначает Н или низший алкил; Т' - обозначает Н; или их физиологически приемлемые соли или их простые или сложные эфиры, или амиды или их гидраты. Предпочтительными являются соединения 1, где L представляет группу L1, R', R" и R"' обозначают водород или другие указанные выше значения, причем находящиеся в R" гидроксильные или карбоксильные группы могут быть этерифициро-ваны с образованием простого или сложного эфира или амидированы, и Т обозначает в группе Q водород или отщепляемый при физиологических условиях низший алкил; а также соединение 1, где L обозначает группу L1, R обозначает амидо, Х обозначает СН, Y обозначает СН или N, Q обозначает группу Q 1, Q2, Q 4, Q5, или Q8 . Предпочтительными являются также соединения 1, где Q обозначает О1, особенно где n=1 и Т обозначают водород или метил, и -N(R')C(R",R'")CO- обозначают один из остатков Gly, Ala, D-Ala, Val, Leu Sar, Om, Lys, Phg, 2-мeтилA-Pro, Phe, Туг, 3-йод-Туr, 3,5-дийод-Туr, Ser(Ac), Ser, Asp, GIU, Pro, 4бензилокси-Рго, 4-гидрокси-Рго, 2-пиперидиленкарбонил, NHCH(CH 2CH2NH2)CO, Trp, Туr (Me), Туr (гексил) и О, N(Me)2-Tyr; в частности, соединения 1, где Q обозначает группу Q2 , особенно если n=1, Т обозначает водород; и N(R')C(R",R"')CO - является остатком Ala, или соединения 1, где Q обозначает группу Q4, особенно такие соединения, где n=1, Т обозначает водород, U и U' обозначают водород или Ас, и -N(R')C(R",R"')CO - является остатком Ala; либо соединения 1, где Q обозначает группу Q5 , особенно если n=1, Т обозначает водород, Аг обозначает a,a,a-трифтор-m-толил и -N(R')C(R",R"')CO - является остатком Ala; а также соединения 1, где Q обозначает группу Q8, особенно где R2 обозначает группу -ОСН2СОО(Н или метил), Т обозначает водород или метил и N(R')C(R",R"')CO - является остатком Pro. Наиболее предпочтительны соединения 1, выбранные из группы: [[1-[N-(n-амидинобензоил)-L-аланил]-4-пипери-динил]окси] уксусная кислота, [[1-[М-(5-амидино-2-пиридил)карбонил]L-ала-нил]4-пиперидинил]окси]-уксусная кислота, [[1-[N-(n-амидинобензоил)-3-(4гидрокси-3-йод-фенил)-L-аланил]-4-пиперидинил]окси]уксусная кислота, [[1-[3-ацетокси-N-(n-амидинобензоил)L-ала-нин]-4-пиперидинил]окси]-уксусная кислота, [n-[[1-(n-амидинобензоил)-2-пирролидини]кар-бонил]фенокси]уксусная кислота, [[1-[N-(5-амидино-2-пиридил)карбонил]-L-тиро-зил]-4-пиперинил]окси-уксусная кислота и особенно [[1-[N-(n-амидинобензоил)-L-тирозил]-4-пипе-ридинил]окси]уксусная кислота. Другими предпочтительными соединениями формулы 1 являются такие соединения, где Q представляет группу Q3 , особенно где n=1 и Т представляет водород, или группу Q6 , особенно где Т представляет водород, либо соединения 1, где Q представляет группу Q 7, особенно где v=2, Т представляет водород или бутил, а также соединения 1, где -N(R')С(R",R'")СО- является остатком N(метоксиэтил)Glу. В частности, предпочтительны соединения 1, выбранные из группы: (S)-1-[2-(5-амидинопиридин-2-илкарбонил-амино)-3-(4-метоксифенил)пропионил]пиперидин-4илоксиуксусная кислота, сложный этиловый эфир (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусной кислоты, (S)-1-[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксус-ная кислота, [1-[N-(4-амидинобензоил)-4'-гексилокси-L-фе-нилаланил]пиперидин-4-илокси-уксуская кислота. В настоящем описании данного изобретения Me обозначают метил. Ас обозначают ацетил, t-Bu обозначают трет.-бутил, Вое обозначают t- буток-сикарбонил, Z обозначают бензилоксикарбонил, Fmoc обозначают 9-фторенилметоксикарбонил, Val обозначают L-валил, Phe обозначают L-фенилаланил, Ser обозначают L-серил, Gly обозначают глицил, Аlа обозначают L-аланил, Asp обозначают L-аспартил, Leu обозначают L-лейцил, Туr обозначают L-тирозил, Sar обозначает саркозил, Оrn обозначают L-орнитил, Lys обозначают L-лизил, Phg обозначает L-a-фенилглицил, Pro обозначают L-пролил, Clu обозначают Lглутамил, Тrр обозначают L-триптофан. Выражение "низший" обозначают группы с 1-6, предпочтительно с 1-4, С-атомами. Примерами низших алкильных групп является метил, этил, пропил, изопропил, n-, втор- или трет.-бутил и гек-сил. Примерами отщепляемых при физиологических условиях низши х алкильных групп являются первичные и вторичные низшие алкильные группы. Символы R', R" и R"' в остатке a-амино-карбоновой кислоты -N(R')C(R",R"')CO- представ-ляют водород или в a-аминокарбоновых кислотах с открытой цепью или циклических, природных или синтетических обычные N- заместители или боковые цепи. Примерами таких N-заместителей R' и боковых цепей R" и R" являются возможно замещенные через ОН, СООН, NH2 или арил, особенно через фенил, гидроксифенил, гидроксийодфенил или гидроксидийодфенил, низшие алкил. Две замещенные таким образом при необходимости низшие алкильные группы R' и R" вместе с N-или С-атомом, с которым они связаны, могут 39849 образовывать 4- до 6-членное, особенно 5-членное кольцо. Встречающиеся в N-заместителях R' и боковых цепях R" и R'" гидрокси- или карбоксигруппы могут быть этерифицированы с образованием простого или сложного эфира или амидированы, а встречающиеся аминогруппы могут быть проаци-лированы C1-6алканоилом или ароилом. Примерами таких групп простого эфира, сложного эфира или амида являются O-Т0, -СОО-Т0-или -CON(V,V'), где V и V' имеют вышеуказанное значение и Т0 обозначают низший алкил, особенно метил, гексил и трет.-бутил или аралкил, особенно бензил. Примерами a-аминокарбоновых кислот с от-крытыми цепями являются H-GIy-OH, H-AIa-OH, H-Orn-OH и Н-Туr-ОН; Примерами циклических a-аминокарбоновых кислот, т.е. таких, где R' и R" вместе с N или Сатомом, с которым они связаны, образуют кольцо, являются Н-Рго-ОН, Н-Рго(4-ОН)-ОН и 2пиперидинкарбоновой кислотой. Примерами C1-6-алканоилгрупп U и U' являются формил, ацетил и пропионил. Арил обозначают фенил при необходимости с количеством заместителей до 3, как алкил, ОН, низший алкокси, галоген или галонизший алкил, особенно СF3. Аро-ил обозначают соответствующие гр уппы бевзоила. Соединения формулы 1 можно подвергать сольватации, особенно гидратации. Гидратацию можно осуществлять в процессе способа получения или она может происходить постепенно в результате гигроскопических свойств ранее безводного соединения формулы 1. Примерами физиологически приемлемых со-лей соединений формулы 1 являются соли с физиологически переносимыми минеральными ки-слотами, как соляная кислота или фосфорная ки-слота; или с органическими кислотами, как метан-сульфокислота, уксусная кислота трифторуксус-ная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Соединения формулы 1 со свободной карбоксигруппой могут образовывать также соли с физиологически переносимыми основаниями. Примерами таких солей являются соли щелочных металлов, щелочноземельных металлов, аммония и алкиламмония, как соль Na, К, Са или тетраметиламмония. Соединения формулы 1 могут существовать также в форме амфотерных ионов. Соединения формулы 1, которые содержат один или несколько асимметрических атомов С, могут существова ть как энантиомеры, как диастереомеры или как их смеси, например, как рацематы. Вышеуказанные N-ацил a-аминокислоты можно получать по изобретению в результате того, что: а) в соединении формулы O E" E"' L0 C N C C G (II) E' O где L° представляет группу формулы (L01) N C X Y или R01-(CH2)t (L02) 01 в которой А представляет защищенную в случае необходимости амидиногруппу, R представляет защищенную в случае необходимости аминогруппу, Е',Е",Е'" и G имеют такое же значение, как R', R", R'" или Q в формуле 1, причем, если R 01 представляет амино или гуанидино, или если А представляет амидино, по меньшей мере один из Е', Е", Е'" и G содержит по меньшей мере одну группу сложного эфира карбоновой кислоты и/или группу простого эфира и/или защищенную аминогруппу, отщепляют группу простого эфира или защищенную амино-, амидиногруппу или сложного эфира карбоновой кислоты, или б) в нитриле формулы O R" R "' N C C N C C OH (III) X Y R' O переводят цианогруппу в амидиногруппу, или в) амин формулы R'-NHC(R",R'")CO-Q (IV) обрабатывают кислотой формулы L1-СООН или его реакционноспособным производным, и г) в случае необходимости функционально изменяют содержащуюся в соединении формулы 1 реакционоспособную гр уппу, и д) в случае необходимости соединение формулы 1 переводят в физиологически переносимую соль или соль соединения формулы 1 переводят в свободную кислоту или основание. Примерами отцепляемых групп сложного эфира карбоновой кислоты являются бензил-ОСО- и низший алкил-ОСО, как t-Bu-OCO-. Примерами отщепляемых защищенных амино-, ами-диногрупп являются - NHZ, -NH-Boc и –N3; -C(NH)NH-Z, -C(NH)-NH-Boc, C(N-Boc)N(Boc)2 и -C(N-Boc)NB-Boc; -NHC(NH)NHNО2 и NHC(N-Boc)NH-Boc. Примерами отщепляемой группы простого эфира является t-Bu-О-. Группы сложного эфира можно гидролизовать известным образом, например, при помощи основания, как гидроокись щелочного металла, на-пример гидроокись натрия, в растворителе, как метанол или вода; или при помощи кислоты, как соляная кислоты. Сложный бензиловый эфир можно расщеплять 39849 гидрированием в присутствии катализатора на основе благородного металла, как палладий на активном угле (Pd/C) в растворителе, как метанол, этанол, муравьиная кислота или уксусная кислота, при температуре приблизительно до 40°С, предпочтительно при комнатной температуре. При этом одновременно отцепляется содержащаяся в группе А за щитная группа амидино, как Z. Группы сложного эфира, как t-Bu-О-, а также защитные амино или амидиногруппы, как Вое и группы простого эфира, как t-Bu-C-, можно отщеплять при помощи кислоты, такой как муравьиная кислота или трифтор уксусная кислота, при желании в растворителе как дихлорметан, или при по-мощи насыщенной НСl ледяной уксусной кислоты, при температуре до 40°С, предпочтительно при комнатной температуре. Вариант б) можно осуществлять при реакции нитрили III с сероводородом и триэтиламином в пиридине с получением тиоамида, последний ме-тилированием метилйодидом в ацетоне и последующим аммонолизом с ацетатом аммония в ме-таноле переводят в соединение 1. Взаимодействие в) амина (IV) с кислотой L1-СООН или с ее реакционноспособным производным, таким как хлорангидрид кислоты, осуществляют в присутствии основания, как пиколин, в растворителе, как дихлорметан, при температуре до 40°С, предпочтительно при комнатной температуре. Для функциональных превращений реакцион-носпособных групп по варианту способа г) используют отщепление содержащихся в гр уппе Q групп низшего алкоксикарбонила -СОО-Т или -СОО-Т', или C1-6алканоилокси или ароилоксигрупп О-U или О-U', или этерификацию карбоксигруппы в ки-слоте 1, и галогенирование, особенно йодирова-ние содержащийся в боковой цепи R" или R'" арильной группы. Так, содержащиеся в группе Q бутоксикарбо-нил- или метоксикарбонилгруппы можно омылять при помощи кислоты, такого как водный раствор соляной кислоты дли уксусной кислоты, или в ос-новных условиях, например, при помощи водного раствора натрового щёлока в метаноле, ацетокси-группы при помощи карбоната калия в метаноле. Этерификацию карбоксигруппы осуществляет, на-пример, реакцией кислоты с подходящим спиртом в присутствии каталитических количеств H2SO4 . Йодирование арильной группы, особенно гид-роксифенилгруппы в боковой цепи R" или R"', можно осуществлять реакцией соединения 1 с хлорамином Т в присутствии йодида натрия в воде/диметилформамиде. Амин 1, где L представляет группу H2N(CH2)t, можно превратить в соответствующий гуанидин 1, где L обозначает HN=C(NH2)NH(CH2)t, причем амин обрабатывают этансульфонатом 2-8-изотио-мочевины в присутствии основания, такого как Na2CO3 или NaOH при температурах до 40°С. Соединения формул (II) и (III) являются но-выми и как таковые так же представляют предмет настоящего изобретения. Таким образом, предметом данного изобретения являются соединения формулы (II): O E" E"' L0 C N C C G (II) E' O где L° обозначает группу формулы N C X Y и Е', Е", Е'" и G имеют значения R', R", R"', как указано выше, или L° обозначает группу формулы (L01) A X Y или R01-(CH2)t (L02) 01 в которой А обозначает защищенную в случае необходимости амидиногруппу, R обозначает в случае необходимости защищенную аминогруппу, и Е', Е", Е"' и G имеют такое же значение, как R', R", R'" или Q в формуле 1, причем если R01 обозначает амино, или если А обозначает амидино, по меньшей мере, один из Е', Е", Е1" и G содержит, по меньшей мере, одну группу сложного эфира карбоновой кислоты и/или группу простого эфира и/или защищенную аминогруппу. Соединение (II) со значением L0=L01 получают обработкой амина формулы E'-NHC(E",E'")CO-G' (V) где G' обозначают одну из групп Q1-Q8 , в которой группа -СОО-Т и имеющаяся в случае необходимости группа -СОО-Т' являются группами сложного эфира карбоновой кислоты, кислотой формулы COOH (VI) X Y или с ее реакционноспособным производным, на-пример хлорангидридом кислоты. Это превращение можно осуществлять в случае необходимости в присутствии тетра-nбутиламмонийгидрогенсульфата в растворителе, как дихлорметан, и основания, как водный раствор бикарбонат натрия. A 39849 Амин H-Q0, где Q0 представляет одну из аминогрупп Q1-Q7 в которой группа -СОО-Т и имеющаяся в случая необходимости группы -СОО-Т' являются группой сложного эфира карбоновой кислоты можно обрабатывать кислотой формулы O R" R "' C N C C OH N C (VII) X Y R' O до нитрила III. Эту реакцию можно осуществлять в присутствии 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметил-уронийгексафторфосфата (HBTU) и органического основания, как N-метилморфолин, в растворителе, как диметилформамид. Соединение II', где А представляет амидино, можно получать превращением циангруппы в амидиногруппу в соответствующем соединению II нитриле. Последний можно получать сочетанием амина вышеуказанной формулы V с кислотой формулы COOH (VIII) X Y или с ее функциональным производным, на-пример хлорангидридом кислоты. Эту реакцию можно осуществлять в присутствии 2-хлор-4,6-диметокси-1,3,5-триазина (CDMT) и основания, как N-метилморфолин, в растворителе, как дихлорметан. Соединение II, где L0 обозначают группу L02 с защи щенной аминогруппой R01, получают сочетанием амина V с кислотой формулы R01-(CH2)t-COOH, например, в присутствии HBTU и N-метилморфолина. Нитрил III', где Q представляет группу Q8 , можно получать, например, следующим образом. Амин формулы 2 3 R R R' R" N C HN C C O W 1 (ІХ) R"' O 4 5 R R где R' и R" вместе с N и С-атомом образуют цикл, и W1 представляет защитн ую гр уппу, обрабатывают кислотой VIII или с ее функциональным производным, отщепляют защитную гр уппу и превращают полученный фенол с производным бромуксусной кислоты ВrСН2СОО-Т. Реакцию амина (IX) с соотве тствующим кислоте (VIII) хлорангидридом кислоты можно осуществлять в присутствии основания, как триэтиламин, в диметилформамиде. Отщепление защитной группы W1, например бензила, можно осуществлять гидрогенолизом на Pd/C в этаноле, а реакцию вышеуказанного фенола с производным бромуксусной кислоты в диметилформамиде в присутствии карбоната калия. Амины (IV) и (V) можно получать, например, реакцией N-защищенной аминокислоты формулы W2-N(E')C(E",E'")COOH (X) 0 2 с амином H-Q и удалением защитной группы W , например Z или Воc в продукте реакции. Кислоты (VII) можно получать взаимодействием функционального производного кислоты (VIII), например, хлорангидрида кислоты с амином R'-NНС(R",R'")СОО-низший алкил (Х') и отщеплением группы сложного эфира в продукте реакции. Эту реакцию можно осуществлять, например, в дихлорметане в присутствии триэтил-амина. Группу низшего алкила, например, метил, можно удалять водным раствором LiOH в метаноле. Можно превращать также аминокислоту формулы R'-NHC(R",R'")СООH (Х') например, глицин, реакцией непосредственно с соответствующим кислоте (VIII) хлорангидридом в присутствии водного раствора бикарбоната на-трия, в случае необходимости в присутствии тетраметиламмоний-сульфата в ди хлорметане, до кислоты (VII). Амин (IX) можно получать в результате то го, что реагент Гриньяра бромида формулы R 2 R 3 Br O W 4 5 2 (ХІ) R R превращают с соединением формулы R' R" CH3 2 W N C CO N (ХІІ) O CH3 R"' и удаляет защитн ую аминогруппу W2 из продукта реакции. 39849 Используемые выше амины HQ0, где Q0 обозначают одну из аминогрупп Q1-Q7, в которой группа -СООТ и имеющаяся в случае необходимости группа -СОО-Т' являются группами сложного эфира карбоновой кислоты, можно получать, как описано в нижеследующих примерах 1а), 1b), 1с), 2а), 46а), 46b), 47а) и 48а), 48b). Соединения формулы 1, их сольваты и и х со-ли тормозят как связывание фабриногена, фибри-нектина и фактора Виллибранда с фибриноген-ным рецептором кровяных пластинок (глюкопро-теин IIb/IIIa) так и связывание тех же и других ад-гезивных протеинов, как витронектин, коллаген и ламинин, с соответствующими рецепторами на поверхности различных типов клеток. Таким образом, указанные соединения оказывают влияние на взаимодействия клеток-клеток и клеток-матрицы. Они особенно препятствуют образованию тромбоцитов и могут применяться при борьбе или предупреждении таких болезней, как тромбоз, кровоизлияние в мозг, инфаркт миокарда, воспаление и артериосклероз. Далее, эти соединения оказывают воздействие на клетки опухоли, причем они тормозят их метастазирование. Таким образом, их можно применять также в качестве противоопухолевых средств. Далее, они могут ускорять заживление раны. Так как они также препятствуют рассасыванию костной ткани, их можно применять при лечении остеопороза. Торможение связывания фибриногена с фиб-риногенным рецептором глюкопротеином IIb/IIIa можно обнаружить следующим образом: Глюкопротеин IIb/IIIa получают из Тритон-Х-100 экстрактов кровяных пластинок человека и очищают методом лектиафинной хроматографии (Аnаlуtiсаl Biochemistry 151, 1985, 169-177) и методом афинной хроматографии на Arg-Gly-Asp-Ser-колонке (Science 231, 1986, 1559-62). Полученный таким путем протеинрецептор связывают на пластинках с микротитром. Специфическое связывание фибриногена с иммобилизированным рецептором определяют при помощи ELISA-системы ("Enzyme-Linked. Immunasortent assay"). Нижеприведенные lС50-величины соответствуют такой концентрации испытываемого вещества, которая не-обходима, чтобы тормозить на 50% связывание фибриногена с иммобилизированным рецептором. Ниже приведены данные IC50 для соединений, полученных по примерам табл. 1. Эти соединения имеют низкую токсичность, однако LD50 продуктов примеров 3 и 14 составляет 250 и примера 5 500 мг/кг при внутривенном назначении у мыши. Для подтверждения явного превосходства со-единений согласно изобретению по сравнению с соединениями, описанными в европейской заявке, ниже приводятся сравнительные данные для lС50, полученные для обоих соединений формулы 1. Ингибирование агрегации бляшек в человеческой плазме Человеческую плазму, обогащенную тромбоцитами, (h-PRP) получают из антикоагулирован-ной крови с помощью 1/10 объема 90 мМ трина-рий цитрата, и агрегацию тромбоцитов измеряют путем регистрации скорости изменения световой трансмиссии с помощью агрегометра, затем проводилось серийное разбавление с помощью ингибиторов и агрегация осуществлялась с помощью таких антагонистов, как коллаген (COL), аденоо-озинтрифосфит (ADP) или тромбин (THR) при ко-нечной концентрации в человеческой плазме 2,5 мкг/мл, 10 мкМ и 0,2 U/мл соответственно. Значения IC50 для эти х тре х антагонистов приведены в табл. 2 и 3. Концентрация COL, ADP, THR указана в различных единицах, наиболее подходящих для трех антагонистов. Коллаген (COL) является высокомолекулярным белком, ADP молекулой аденозин-5'дифосфата, и THR-ферментом. Сокращение U для THR представляет собой единицу измерения активности фермента. Известный "неодикумарин" или "пелентан" яв-ляется антикоагулянтом и антагонистом витамина К. В противоположность этому следует из описания и приложенной таблицы, заявленные соединения обладают действием, тормозящим как связывание адгезивных протеинов с тромбоцитами, так и агрегацию тромбоцитов, а также на взаимодействие клетка-клетка. (J. Cardiovasc. Surg. - 106, 1993, 834-4 Trombosis and Haemostasis - 70, 1993, 560). Из вышеуказанных источников следует, что ве щество Ro 44-9883, которое соответствует продукту из примера 14, в организмах собаки и морской свинки проявляет тормозящее действие на агрегацию кровяных пластинок и потому может применяться для лечения и профилактики лечения тромбозов. Предметом данного изобретения является также композиция, ингибирующая связывание ад-гезивных протеинов с тромбоцитами и агрегацию тромбоцитов, содержащая активное начало и фармацевтически инертные вспомогательные ве-щества, которая в качестве активного вещества содержит соединение формулы 1 в эффективном количестве. Соединения формулы 1, их сольваты или соли могут быть переработаны как таковые или, при желании, с другими терапевтически активными веществами в галеновую форму. Лекарственные средства, содержащие вышеуказанные соединения, можно применять орально, через кишечник, например, в форме таблеток через рот, таблеток с лаковым покрытием, драже, капсул в твердой и мягкой желатине, растворов, эмульсий или суспензий, или ректально, в форме, например, свечей; или в виде аэрозоля. Но можно применять также парентерально, например, в форме растворов для инъекций или настоек для вливания. Для получения таблеток, таблеток с лаковым покрытием, драже и капсул в твердой желатине можно смешивать активное вещество с фарма-цевтически инертными, неорганическими или органическими наполнителями. В качестве таких наполнителей для таблеток, драже и капсул в твердой желатине можно применять, например, лактозу, кукур узный крахмал или его производные, тальк, стеариновую кислоту или ее соли. Для капсул в мягком желатине в качестве наполнителей применяются, например, растительные 39849 масла, воски, жиры, полутвердые и жидкие многоатомные спирты; однако, в зависимости от свойства активного вещества для капсул с мягкой желатиной возможно отсутствие любых наполнителей. Для получения растворов и сиропов в качестве наполнителей применяются, например, вода, многоатомные спирты, сахароза, инвертный сахар и глюкоза; для растворов для инъекций применяются, например, вода, спирты, многоатомные спирты, глицерин и растительные масла, а для свечей применяются, например, натуральные или отверженные масла, воски, жиры и полужидкие или жидкие многоатомные спирты. Фармацевтические препараты наряду с этим могут содержать еще консерванты, агенты растворения, стабилизаторы, смачиватели, эмульгаторы, подслащивающие вещества, красители, ароматические вещества , соли для изменения осмотического давления, буферные растворы, средства для покрытия или антиокислители. Для борьбы или предупреждения вышеназванных заболеваний дозировка активного вещества может изменяться в широких пределах и, ко-нечно, в любом отдельном случае должна быть приспособлена к индивидуальным условиям. В общем, при оральном назначении следовало бы устанавливать дозу около от 0,1 до 20 мг/кг, предпочтительно около от 0,5 до 4 мг/кг в день для взрослого, причем, указанный верхний предел может быть и выше, если это окажется необходимым. Пример 1 Раствор 2,43 г сложного трет.-бутилового эфира [[1-[М-(n-амидинобензоил)глицил]-4-пипе-ридинил]оксиуксусной кислоты в 15 мл дихлорме-тана/трифторуксусной кислоты 1:1 оставляют на 5 часов при комнатной температуре. После выпаривания растворителей и хроматографии [сили-лированный силикагель (LiChroprep RP-18), метанол/вода-элюент] получают 0,46 г трифторацетата [[1-[N-(nамидинобензоил)глицил]-4пиперидинил]-окси]уксусной кислоты, точка плавления 233-236°С. MS(FAB):363 (М+H)+. Исходное вещество можно получать следующим образом: a) к раствору 50 г 4-гидроксипиперидина в 500 мл дихлорметана добавляют по очереди при 0°С 69,1 мл триэтиламина и 70,2 мл сложного бензилового эфира хлормуравьиной кислоты. По-лученную суспензию перемешивают в течение но-чи при комнатной температуре и затем фильтруют. Получающийся после сгущения фильтрата остаток поглощают в уксусном эфире, промывают водой и 1 н. и соляной кислотой, сушат и сгущают. Получают 73,6 г М-бензилоксикарбонил-4-гидрок-сипиперидина, коэффициент Rf=0,56 (уксусный эфир/метанол 9:1, MS(EI): 235 (М'); b) к раствору 30,1 г N-бензилоксикарбонил-4-гидроксипиперидина в 300 мл толуола добавляют 28 мл сложного трет.-бутилового эфира бромуксусной кислоты и 1,4 г тетра-n-бутиламмонийби-сульфата в 10 мл воды. После этого прикалывают раствор 125 г гидроокиси натрия в 125 мл воды. После перемешивания в течение ночи отделяют органические экстракты, сушат и сгущают. После сушки получают 34,1 г Nбензилоксикарбонил-4[(трет.-бутоксикарбонил)-метокси]-пиперидина, коэффициент Rf=0,76 (уксусный эфир MS(EI):293 (M-C 4H8)+; c) к раствору 30 г продукта б) в 50 мл этанола добавляют 1,5 г Pd/C (10%). Реакционную смесь гидрируют при комнатной температуре. После этого отфильтровывают катализатор, промывают этанолом и сгущают фильтрат. Получают 17,4 г сложного трет.-бутилового эфира 4-пиперидинил-оксиуксусной кислоты, коэффициент Rf=0,14 (ук-сусный эфир/метанол 1:1). MS(E1):215 (М+); d) реакцией 5,8 г (активированного 5,4 г CDMT) Z-глицина с 6,0 г сложного трет.-бутилово--го эфира 4пиперидинилоксиуксусной кислоты и 6,3 мл N-метилморфолина в дихлорметане получают 10 г бензил-[[[4[(N-бутоксикарбонил)меток-си]пиперидинил]карбонил]метил]карбамата MSN(E1):406 (М+); e) гидрогенолизом раствора 10 г продукта d) в 200 мл этанола в присутствии 0,7 г Pd/C (10%) и 1,4 мл уксусной кислоты выделяют после хрома-тографии на силикагеле с уксусным эфиром/метанолом 1:1 4,1 г сложного трет.-бутилово-го эфира 1-[(1-глицил-4-пиперидинил)окси]уксус-ной кислоты, MS(E1):273 (М+Н)+. IR:1746 см-1; f) к смеси 4,1 г продукта е) и 0,03 г тетра-n-бутиламмоний гидросульфата в 210 мл дихлорметана/насыщенного раствора бикарбоната натрия 4:3 добавляют при комнатной температуре 2,95 n-амидинобензоилхлорид-гидрохлорида (полученно-го из n-амидинобензойной кислоты превращением с хлористым тионилом в тетрагидрофуране в присутствии диметилформамида). После перемешивания в течение ночи разбавляют дихлорматаном и водой, устанавливают рН 9-10 добавлением 1Н натрового щелока, отделяют органические экстракты, сушат и сгущают. После суток получают 2,43 г желаемого исходного вещества, MS(FAB):419 (М+Н)+. Пример 2 A) Раствор 1,5 г сложного метилового эфира [[1-[N-(цианбензоил)глицил]-4пиперидинил]окси]ук-сусной кислоты в 215 мл пиридина/триэтиламина 40:3 насыщают сероводородом и оставляют на 24 часа при комнатной температуре. После удаления растворителей поглощают остаток в уксусном эфире и промывают насыщенным раствором хлористого натрия. Органические экстракты сушат и сгущают. После хроматографии остатка на сили-кагеле с уксусным эфиром в сопровождении ук-сусного эфира/метанола выделяют 1,34 г сложного метилового эфира [[1-[N-[n-тиокарбамоил)бен-зоил]глицил]-4пиперидинил]окси]уксусной кислоты, MS (FAB):394 (М+Н)+. B) Взаимодействие 1,25 г продукты с предыдущей стадии с 7,5 мл йодистого метила в 150 мл ацетона при температуре кипения дает после фильтрования и удаления растворителя 1,65 г гидройодида. сложного метилового эфира [[1-[N-[n-[1-(метилтио)формимидоил]бензоил]глицил]-4пиперидинил]окси]уксусной кислоты, MS(FAB):408 (М+H)+. С) Аммонолизом 1,5 г продукта В) в присутствии 0,32 г ацетата аммония в 100 мл метанола при температуре кипения получают 0,76 г гидро-йодида сложного метилового эфира [[1-[N-(n-ами 39849 динобензоил)глицил]-4-пиперидинил]окси]уксус-ной кислоты. Точка плавления 103-105°С. MS (FAB):377 (М+Н)+. Исходный нитрил можно получить следующим образом: a) этерификацией трифторацетата 4-пипери-динилоксиуксусной кислоты (полученного обработкой продукта, примера 1с) трифторуксусной кислотой в дихлорметане) в метаноле в присутствии хлористого тионила получают гидрохлорид сложного метилового эфира 4-пиперидинилокси-уксусной кислоты, MS(EI):1]3 (М)+; b) реакция 1,35 г продукта а) с 1,18 г N-(n-цианбензоил) глицина (полученного превращением глицина с n-цианбензоилхлоридом в насыщенном растворе бикарбоната натрия) в присутствии HBTU и Nметилморфолина в диметилформамиде дают после хроматографии на силикагеле (уксусный эфир/метанол 9:1 до 1:1) 1,66 г желаемого ис-ходного нитрила, MS(EI):359 (М)+. Пример 3 Из 13 г сложного трет.-бутилового эфира [[1-N-(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты обработкой трифторуксусной кислотой в дихлорметане (как описано в примере 1) получают после перекристаллизации из метанола/простого диэтилового эфира 8,9 г три-фторацетата [[1[N-(n-амидинобензоил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 120°С (разложение). MS(FAB):377 (M+H)+. [a] 20D=+24,7°(c=0,7, вода). Исходное вещество можно получать следующим образом: a) реакция 18 г Z-L-аланила с 17,4 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксус-ной кислоты и последующий гидрогенолиз полученного продукта, как в примере 1d) и 1е), дают 15,8 ацетата сложного трет.-бутилового эфира 1-[(1-L-аланил-4-пиперидинил)оксиуксусной кислоты. Точка плавления 93-96°С. [a]20D=+2,0° (с=1,0, метанол); b) сочетание 4,7 г продукта а) с 3,4 г р-амиди-нобензоилхлорид гидрохлорида, как в примере 1f), дают 4,2 г желаемого исходного вещества. MS(E1):433 (М+Н)+. Пример 4 Из 0,3 г сложного трет.-бутилового эфира [[1-[N-[n-р(трет.-бутоксикарбонил)амидинобензоил]-Dаланил]-4-пиперидинил]окси]уксусной кислоты по-лучают по аналогии с Примером 1 0,1 г трифторацетата [[1-[N-(n-амидинобензоил)-D-аланил]-4-пи-перидинил]окси]уксусной кислоты. Точка плавления 115°С (разложение), [a]20D=27,5° (с=0,8, вода). MS(FAB):377 (М+Н)+. Исходное вещество можно получать следующим образом: a) взаимодействием 3 г сложного трет.-бути-лового эфира 4-пиперидинилоксиуксусной кислоты с 2,43 г Z-D-аланила, как описано в приме-ре 1d), получают после хроматографии на силика-гале с уксусным эфиром/гексаном 1:1 3,1 г бензил-[(R)-1-[[4-[(трет.-бутоксикарбонил)метокси]пиперидинил]карбонил]этил]карбамата. MS(E1):420 (M)+; b) гидрогенолизом 3,1 г продукта а), как описано в примере 1е), получают 2,5 г ацетата сложного трет.бутилового эфира 1-[(1-D-аланил-4-пи-перидинил)окси]уксусной кислоты. MS (EI):215 (М+N)-С3Н5NO)); c) взаимодействием 1 г предварительной стадии с 0,66 г n-амидинобензоилхлоридгидрохлори-да в диметилформамиде в присутствии триэтиламина и последущей обработкой ди-трет.-бутил-дикарбонатом получают после хроматографии на силикагеле с дихлорметаном/метанолом 20:1 0,3 г желаемого исходного вещества. MS(FAB):533 (М+Н)+. Пример 5 Гидролизом 1,6 г сложного трет.-бутилового эфира [[1-[N-[(5-амидино-2-пиридил)карбонил]-L-аланил]4-пиперидинил окси уксусной кислоты в насыщенной хлористый водородом ледяной уксусной кислоте получают после хроматографии на силилированном силикагеле RP-18 и перекристаллизации из тетрагидрофурана/уксусного эфира 0,15 г [[1-[N [(5-амидин-2-пиридил)карбонил]L-аланил]-4пиперидинил]окси]уксусной кислоты. Точка плавления: выше 200°С (разложение) MS(FAB):3]8 (M+H)+. Исходное вещество можно получать следующим образом: a) взаимодействием 2,4 г ацетата сложного трет.-бутилового эфира 1-[(1-L-аланил-4-пипери-динил)окси]уксусной кислоты (пример 3а) с 1,0 г 5-циан-2-пиколиновой кислоты по примеру 1d по-лучают 2,43 г сложного трет.-бутилового эфира [[1-[N-[(5-циан-2-пиридил)карбонил]-L-аланил]-4-пиперидинил]окси]уксусной кислоты, MS(FAB):417 (М+Н)+; b) последующая обработка 2,4 г продукта вы-шеуказанной стадии, как описано в примере 2А), 2В), 2С), дают 2 г желаемого исходного вещества. Точка плавления 142-145°С. MS(FAB):434 (M+H)+. Пример 6 Из 1г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-валил]-4-пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 после кристаллизации из уксусного эфира 0,8 г [[1-[N-(n-амидинобензоил)-L-валил]-4-пиперидинил]окси]уксусной кислоты в виде три-фторацетата. Точка плавления 210-211°С MS(FAB):405 (М+Н)+. [a] 20D=+32,6° (с=0,8, вода). Исходное вещество можно получать следующим образом: a) реакцией 2,5 г Z-L-валина с 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксус-ной кислоты, как описано в примере 26), получают 4 г сложного трет.-бутилового эфира [[1-[N-[(бензилокси)карбонил]-L-валил]-4-пиперидинил]-окси]уксусной кислоты. MS (EI):449 (М+Н)+; b) по аналогии с примером 1е), однако без до-бавления уксусной кислоты получают из 1,9 г продукта Примера 6а) 1,4 г сложного трет.-бутило-вого эфира 1-[1-L-валил-4-пиперидинил)-окси]ук-сусной кислоты, MS (EI):315 (М+Н)+; c) по аналогии с примером 1f) получают из 3,3 г продукта примера 6b) и 2,5 г n-амидинобензоилхлорид-гидрохлорида после хроматографии (силикагель; дихлорметан/метанол/уксусная кис-лота 95:4:1) 39849 и кристаллизации из простого диэти-лового эфира 1,1 г желаемого исходного ацетата. Точка плавления 179-182°С. MS (FAB):461 (М+Н)+. Пример 7 Из 1,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-лейцил]-4-пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 после кристаллизации из уксусного эфира/простого диэтилового эфира 1,1 г [[1-[N-(n-амидинобензоил)-L-лейцил]-4-пиперидинил]окси]уксусной кислоты в виде трифторацета-та. Точка плавления 216-218°С. MS(FANB):419 (М+Н)+. [a]20D=+22,5° (с=0,8, вода). Исходный ацетат можно получать следующим образом: a) реакцией 2,6 г Z-L-лейцина с 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиукус-ной кислоты, как описано в примере 1d), получают 4,1 г сложного трет.-бутилового эфира [[1-[-N[(бензилокси)карбонил]-L-лейцил]-4-пиперидинил]-окси]уксусной кислоты. MS(FAB):463 (М+Н)+; b) по аналогии с примером 6b) и 1f) получают из 4,1 г продукта примера 7а) после хроматогра-фии (силикагель; дихлорметан/метанол/уксусная кислота 95:4:1) и кристаллизации из простого ди-этилового эфира 1,5 г желаемого ацетата. Точка плавления 120-129°С (разложение). MS(FAB):475 (M+N)+. Пример 8 Из 1,4 г ацетата сложного трет.-бутилового эфира [[1-[(n-амидино-N-метилбензамидо)ацетил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 после кристаллизации из простого диэтилового эфира 0,9 г [[1-[(n-амидино-N-метилбензамидо)ацетил]-4-пипериди-нил]окси]уксусной кислоты в виде три фторацета-та. Точка плавления 134-135°С. MS (FAB):377 (M+H)+. Исходное вещество можно получать следующим образом: a) взаимодействием 2,0 г Z-саркозин-N-гидр-оксисукцинимидного эфира с 1,3 г сложного трет.бутилового эфира 4-пиперидинилоксиуксусной кислоты в присутствии триэтиламина в тетрагидрофуране получают 2,1 г бензил-[4-[[[(t-бутоксикар-бонил)метокси]пиперидино]карбамоил]метил]ме-тилкарбамата. MS(FAB):421 (М+Н)+; b) по аналогии с примером 6b) и 1f) получают из 4 г продукта примера 8а) после хроматографии (силикагель; дихлорметан/метанол/уксусная кис-лота 93:5:2) и кристаллизации из простого диэти-лового эфира 1,5 г желаемого ацетата. Точка плавления 168-189°С. MS (FAB):432 (М+Н)+. Пример 9 Из 5,4 г сложного трет.-бутилового эфира [[1-[N2-(n-амидинобензоил)-N5-бутоксикарбонил)-L-ор-нитил]4-пиперидинид]окси]уксусной кислоты по-лучают по аналогии с примером 1 4,9 г [[1-[N2-(n-амидинобензоил)-L-орнитил]-4-пиперидинид]окси] уксусной кислоты в виде трифторацетата. MS(FAB):420 (М+Н)+. [a]20D=+4,5° (с=0,8, МеОН). Исходное вещество можно получать следующим образом: a) превращением 6 г сложного трет.-бути-лового эфира 4-пиперидинилоксиуксусной кислоты с 10,2 г N2-Z-N5-Boc-L-opнитинa, как описано в примере 1d), получают после хроматографии на силикагеле с уксусным эфиром/гексаном 1:1 11 г сложного трет.-бутилового эфира [[1-[N2-(бензил-оксикарбонил)-N5(трет.-бутоксикарбонил)-L-орни-тил]-4-пиперидинил]окси]уксусной кислоты. MS(FAB):564 (М+Н)+; b) гидрогенолизом 11 г продукта а), как описано в примере 1е), получают 9 г ацетата сложного трет.бутилового эфира [[1-N5-трет.-бутоксикар-бонил)-L-орнитил]-4-пиперидинил]окси]уксусной кислоты. + MS(FAB):430 (М+Н) ; c) реакцией 9 г продукта б) с 4,4 г n-амидино-бензилхлоридгидрохлорида, как описано в примере 1f), получают 5,7 г желаемого исходного вещества. MS(FAB): 576 (M+N)+. Пример 10 Из 0,54 г сложного трет.-бутилового эфира [[1-[N2-[n-N-(t-бутоксикарбонил)амидинобензоил]-N6-трет.бутоксикарбонил)]-L-лизил]-4-пиперидинил]-окси]уксусной кислоты получают по аналогии с примером 1 0,35 г [[1-[N 2-(n-амидинобензоил)]-L-лизил]-4-пиперидинил]окси]уксусной кислоты в виде трифторацетата. MS(FAB):434 (М+Н)+. [a]=12,4° (с=0,8, вода). Исходное вещество можно получать следующим образом: а) реакцией 2 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 2,8 г N 2-Z-N6Boc-L-лизиина, как описано в примере 1d), получают после хроматографии на силикагеле с уксусным эфиром/гексаном 1:1 2,6 г сложного трет.-бутилового эфира [[1-[N2-(бензилоксикарбо-нил)-N6-(трет.бутоксикарбонил)-L-лизил]-4-пипе-ридинил]окси]уксусной кислоты. MS (FAB):578 (M+H)+; b) гидрогенолизом 2,6 г полученного продукта, как описано в Примере 1е), получают 2 г ацетата сложного трет.-бутилового эфира [[1-[N6-(трет.-бутоксикарбонил)-L-лизил]-4-пиперидинил]окси]ук-сусной кислоты. MS(FAB):444 (M+H)+; c) реакцией 2 г продукта предварительной стадии с 1 г n-амидинобенэоилхлорид-гидрохло-рида, как описано в примере 4с), получают после хроматографии (силикагель; дихлорметан/мета-нол 20:1) 1,95 г желаемого исходного вещества MS (FAB):690 (М+Н)+. Пример 11 Из 0,4 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-фенилглицил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 0,25г [[1-[N-(n-амидинобензоил)-Lфенилглицил]-4-ниперидинил] окси]уксусной кислоты в виде трифторацетата. Точка плавления выше 250°С (уксусный эфир/простой диэтиловый эфир 1:1). MS(FAB): 439 (М+Н)+. [a]20D=+6,5° (с=0,6 МеОН). Исходное вещество можно получать следующим образом: a) взаимодействием 1,85 г сложного трет.-бу-тилового эфира 4-пиперидинилоксиуксусной кислоты с 3,5 г Z-L-фенилглицин-N-гидроксисукцини-мидного эфира, как описано в примере 8а), получают после 39849 хроматографии на силикагеле с пет-ролейным эфиром/простым диэтиловым эфиром 1:1 3,8 г сложного трет.-бутилового эфира [[1-(N-бензилоксикарбонил-L-фенилглицил)-4-пипериди-нил]окси]уксусной кислоты. MS(FAB): 483 (М+В)+; b) гидрогенолизом 4,7 г полученного продукта, как описано в примере 6b), получают 3,2 г сложного трет.-бутилового эфира [[1-(L-фенилглицил)-4-пиперидинил]окси]уксусной кислоты. MS (FAB) 349 (М+Н)+; c) реакцией 3,2 г продукта стадии b) с 2,2 г n-амидинобензоилхлорид-гидрохлорида, как описано в примере 1f), получают после хроматографии (силикагель; дихлорметан/метанол/уксусная кислота 95:5:2) 0,4 г желаемого ацетата. Точка плавления 207-220°С (уксусный эфир, разложение). MS (FAB): 495 (М+Н)+. Пример 12 Из 0,5 г ацетата сложного трет.-бутилового ээфира [[1-[1-(n-амидинобензоил)-2-метил-L-про-лил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 0,14г [[1-[1-(n-ами-динобензоил)-2метил-L-пролил]-4-пиперидинил] окси]уксусной кислоты в виде трифторацетата. Точка плавления 219220°С (ацетонитрил). MS(FAB):417(M+H)+. [a] 20D=+17,1° (с=0,9. МеОН). Исходное вещество можно получать следующим образом: a) реакцией 2-метил-L-пролил-гидробромида с n-цианбензоилхлоридом аналогично примеру 26 получают 1-(n-цианбензоил)-2-метил-L-пролин. MS(EI):213 (М-СООН)+; b) реакцией 1,67 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 0,8 г хлорангидрида кислоты 1-(n-цианбензоил)-2-метил-L-пролина (полученного обработкой продукта предварительной стадии хлористым тиони-лом) получают 0,89 г сложного трет.-бутилового эфира [[1-[1-(nцианбензоил)-2-метил-L-пролил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 180-182°С (уксусный эфир); c) последующей обработкой 0,89 г продукта b), как описано в примере 2А), 2В), 2С), получают после хроматографии (силилированный силика-гель RP-18; вода/метанол 9:1) 0,59 г желаемого ацетата. Точка плавления 191-192°С (уксусный эфир, разложение). MS(FAB):473 (М+Н)+. Пример 13 Из 2,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-3-фенил-L-ала-нил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 1,9 г [[1-[N-(n-ами-динобензоил)-3фенил-L-аланил]-4-пиперидинил]-окси]уксусной кислоты в виде трифторацетата. Точка плавления 234235°С (уксусный эфир). [a]20D=+17,9° (с=1,0, МеОН). MS(EI): 453 (М+Н)+. Исходное вещество можно получать следующим образом: a) реакцией 2,15 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 3,0 г Z-Lфенилаланина, как описано в примере 2b), получают 4,8 г сложного трет.-бутилового эфира [[1-(Nбензилоксикарбонил-3-фенил-L-аланил)-4-пиперидинил]окси]уксусной кислоты. MS (FAB): 497 (М+Н)+; b) гидрогенолизом 4,8 г полученного продукта, как описано в примере 6b), и последующим превращением с 2,0 г n-амидинобензоилхлорид-гид-рохлорида, как описано в примере 1f) получают после хроматографии (силикагель; дихлорметан/ метанол/ уксусная кислота 22:2:1) 2,5 г желаемого ацетата. Точка плавления 176-178°С (диэтиловый простой эфир). MS (FAB): 509 (M+H)+. Пример 14 Из 2,5 г ацетата сложного трет.-бутилового эфира [[1-[N-(n-амидинобензол)-3-(n-трет.-буток-сифенил)L-аланил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 по-сле хроматографии (силилированный силикагель RP-18N вода/метанол-градиент) 1,0 г [[1-[N-(n-амидинобензоил)-L-тирозил]-4пиперидинил]]окси] уксусной кислоты как трифторацетат. Точка плавления 125-130°С (уксусный эфир, разложение). MS(FAB): 469 (М+Н)+. Исходное вещество можно получать следующим образом: а) превращением 2,15 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 3,71 г N-Z-(OtBu)-L-тирозина как описано в примере 2b), получают после хроматографии (си-ликагель, простой диэтиловый эфир/петролейный эфир 1:1) 4,8 г сложного трет.-бутилового эфира [[1-[N(бензилоксикарбонил)-3-[n-(трет.-бутитокси-фенил)]-L-аланил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 96°С (простой диэтило-вый эфир), MS(EI): 417 (M-C 7H7-C4H8)+, [a]20D=+5,4° (с=0,8, СН3ОН); б) гидрогенолизом 4,8 г предварительной стадии как в примере 6b) и последующим превращением с 1,5 г n-амидинобензоилхлорид-гидро-хлорида как в примере 1f) получают после хрома-тографии (силикагель; дихлорметан/метанол/ук-сусная кислота 22:2:1) 2,6 г желаемого ацетата. Точка плавления 170-172°С (простой диэтиловый эфир). MS(FAB): 581 (М+Н)+. Пример 15 Хроматографией выделяют 0,09 г трифтор-ацетата сложного метилового эфира [[1-N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил]окси]ук-сусной кислоты в виде простого продукта, полученного по примеру 14. Точка плавления 189-190°С (уксусный эфир). MS (FAB):483 (M+H)+. Пример 16 Обработкой 0,58 г трифторацетата [[1-N-(n-амидинобензоил)-L-тирозил]-4-пиперидинил]окси] уксусной кислоты (Пример 14) с хлорамином Т в присутствии йодистого натрия в воде/диметилф-ормамиде 8:1 получают после хроматографии (силилированный кизельгель RP-18, вода/ацето-нитрил-элюент) 0,04 г [[1N-(n-амидино-бензоил)-3-(4-гидрокси-3-йодфенил)-L-аланил]-4-пипериди-нил]окси]уксусной кислоты. Точка плавления 230°С (вода, разложение). MS(FAB):595 (М+Н)+. Пример 17 Из описанной в примере 16 реакционной массы выделяют дополнительно 0,09г [[1-Nn-амидинобензоил)-3-(4-гидрокси-3-йодфенил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты. Точка плав-ления 220-221°С (вода, разложение). MS(FAB):720 (М+Н)+. 39849 Пример 18 Из 1,3 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N-(трет.-бутоксикарбонил) амидино]бензоил]-L-аланил]-4-пиперидинил]окси] уксусной кислоты получают обработкой хлористым водородом в ледяной уксусной кислоте после хроматографии (силилированный кизельгель RP-18, метанол/вода-элюент) 0,45 г гидрохлорида [[1-[3-ацетокси-N-(n-амидинобензоил)-L-аланил]-4пиперидинил]окси]уксусной кислоты. [a]20D=+0,9° (с=1,0, МеОН). MS(FAB): 435 (М+Н)+. Исходное вещество получают следующим образом: а) реакцией 7,5 г Z-L-Ser(tBu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилокси-уксусной кислоты и последующим гидрогенолизом полученного продукта, как описано в приме-ре 1d),e), получают 10,6 г ацетата сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-L-аланил)-4пиперидинил]окси]уксусной кислоты. Точка плавления 76-78°С. MS(FAB): 359 (M+H)+; б) реакцией 9,9 г предварительной стадии а) с 5,2 г n-амидинобензоилхлорид-гидрохлоридом в диметилформамиде в присутствии триэтиламина и последующей обработкой ди-трет.-бутил-дикарбонатом получают после хроматографии на силикагеле с дихлорметаном/метанолом 20:1, а затем уксусным эфиром/гексаном 3:1, 4,3 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N-(трет.бутоксикарбонил)амидино]бензоил]-L-аланил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 162165°С. MS(FAB): 605 (М+Н)+. Пример 19 Из 1,0 г сложного трет.-бутилового эфира [[1-[3-трет.-бутокси-N-[n-[N-(трет.-бутоксикарбонил)амидино]бензоил]-L-аланил]-4-пиперидинил]окси] уксусной кислоты (пример 18) получают по аналогии с примером 1 после хроматографии (силили-рованный кизельгель RP-18, вода) 0,58 г трифтор-ацетата [[1[N-(n-амидинобензоил)-L-серил]-4-пиперидинил]окси]уксусной кислоты. [a]20D=+17,6° (с=1,0, вода). MS (FAB): 393 (М+Н)+. Пример 20 Из 5 г сложного трет.-бутилового эфира L-N-(n-амидинобензоил)-3-[[4-[(трет.-бутоксикарбонил) метокси]пиперидинил]карбонил]-b-аланина получают по аналогии с примером 1 после кристаллизации с уксусным эфиром/тетрагидрофураном 2,0 г трифторацетата L-N-(n-амидинобензоил)-3-[[4(карбоксиметокси)пиперидино]карбонил]-Р-ала-нина, точка плавления 145-150°С. MS (FAB): 421 (М+Н)+. Исходное вещество можно получать следующим образом: а) реакцией 11 г Z-L-Asp(0-tBu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 2б), получают 16 г сложного трет.-бутилового эфира L-N(бензилоксиикарбонил)-3-[[4-[(трет.-бутоксикар-бонил)метокси]пиперидино]карбонил]-b-аланина. М8 (FAB): 521 (М+Н)+; b) после гидрогенолиза 17 г предварительной стадии, а), как изложено в примере 6b), выделяют 11 г сложного трет.-бутилового эфира L-3-[[4-[(трет.-бутоксикарбонил)метокси]пиперидино]кар-бонил]-bаланина. MS (FAB): 387 (М+Н)+; c) реакцией 11 г предыдущей стадии с 6,9 г n-амидино-бензоил-гидрохлорида, как изложено в Примере 1f), выделяют после хроматографии (силикагель, дихлорметан/метанол 9:1) 10,2 г желаемого исходного вещества . MS(FAB): 533 (М+Н)+. Пример 21 Из 0,5 г сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-4-трет.-бутокси-L-глутамо-ил]-4пиперидинил]окси]уксусной кислоты получают по аналогии с примером 1 после кристаллизации с уксусным эфиром 0,25 г трифторацетата [[1-[N-(n-амидинобензоил)-L-a-глутамоил]-4-пипери-динил]окси]уксусной кислоты. Точка плавления 105-108°С. [a]=+6,9° (с=0,8, метанол). MS (FAB): 435 (М+Н)+. Исходное вещество можно получать следующим образом: a) реакцией 11 г Z-L-Glu(Ot-Bu)-OH с 7,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты, как описано в примере 1d), получают 15,4 г сложного трет.-бутилового эфира [N-(бензилоксикарбонил)-4-трет.-бутокси-L-глутамоил]-4-пиперидинил]окси]ук-сусной кислоты. MS (FAB): 535 (М+Н)+; b) после гидрогенолиза 15,4 г предварительной стадии, как изложено в примере 6b), получают 7,5 г ацетата сложного трет.-бутилового эфира [[1-4-трет.-бутокси-L-глутамоил]-4-пиперидинил]окси] уксусной кислоты. MS (FAB): 401 (М+Н)+; c) реакцией 7,5 г предварительной стадии с 3,9 г n-амидино-бензоилхлорид-гидрохлорида, как изложено в примере 1f), получают 6,9 г сложного трет.-бутилового эфира [[1-[N-(n-амидинобензо-ил)-4трет.-бутокси-L-глутамоил]-4-пиперидинил] окси]уксусной кислоты. М S (FAB): 547 (М+Н)+. Пример 22 Из 2 г сложного трет.-бутилового эфира [[(R/S)-1-[N-(n-амидинобензоил)-L-аланил]-3-пипе-ридинил]метокси]уксусной кислоты получают по аналогии с примером 1 0,6 г трифторацетата [[(R/S)-1-[N-(nамидинобензоил)-L-аланил]-3-пипе-ридинил]-метокси]уксусной кислоты. Точка плавления 87-90°С (уксусный эфир). MS (FAB): 391 (M+H)+. Исходное вещество можно получать следующим образом: а) из рац-3-(гидроксиметил)пиперидина получают по аналогии с примером 1а) рац-Nбензилоксикарбонил-3-(гидроксиметил)пиперидин. MS (EI): 249 (М)+; b) из продукта а) получают по аналогии с примером 1b) бензил-рац-3-[[(трет.-бутоксикарбонил)метокси]метил]1-пиперидинкарбоксилат. MS(EI): 307 (M-C4H 8)+; c) продукт b) по аналогии с примером 1с) гид-рируют до сложного трет.-бутилового эфира рац-(3пиперидинил-метокси)уксусной кислоты. MS(EI): 172 (M-C 4H 8)+; 39849 d) реакцией продукта с) с Z-L-аланином, как в примере 1d) получают бензил-[(S)-1-[[(R/S)-3-[(трет.бутоксикарбонил)метокси]пиперидино]-кар-бонил]этил]карбамат. MS(EI): 434 (М)+; e) гидрированием продукта d), как в примере 1е), получают ацетат сложного трет.-бутилового эфира [[(R/S)-1-L-аланил-3-пипериди-нил]мет-окси]уксусной кислоты. MS (EI): 285 (M-СН3)+; f) реакцией продукта е) с n-амидинобензоил хлорид-гидрохлоридом, как в примере 1f), получают после хроматографии (силилированный кизельгель RP-18) желаемое исходное вещество. MS(FAB): 447 (М+Н)+. Пример 23 Из 2,7 г сложного трет.-бутилового эфира [[1-[N-(n-амидинобензоил)-L-аланил]-4-(a,a,a-три-фтор-mтолил)-4-пиперидинил]окси]уксусной кис-лоты получают по аналогии с примером 1 0,7 г [[1-[N-(nамидинобензоил)-L-аланил]-4-(a,a,a-три-фтор-m-толил)-4-пиперидинил]окси]уксусной кис-лоты. Точка плавления выше 280°С (вода/мета-нол). MS(FAB): 521 (М+Н)+. Исходное вещество можно получать следующим образом: a) из 4-(3-(трифторметил)фенил)пиперидин-4-ола получают по аналогии с примером 1 а) бензил-4гидрокси-4-(a,a,a-трифтор-m-толил)-1-пипе-ридинкарбоксилат. MS(EI): 379 (M)+; b) из продукта а) получают по аналогии с примером 1b) бензил-4-[(трет.-бутоксикарбонил) метокси]-4(a,a,a-трифтор-m-толил)-1-пиперидин-карбоксилат. MS(FAB): 494 (М+Н)+; c) гидрированием продукта b), как в приме-ре 1е), получают ацетат сложного трет.-бутилового эфира [[4-(a,a,a-трифтор-m-толил)-4-пипериди-нил]окси]уксусной кислоты. MS(EI): 227 (M-C 6H12 O3)+; d) взаимодействием продукта с) с Z-L-алани-ном, какв примере 1 получают бензил-[(S)-1-[[4-[(tбутоксикарбонил)метокси]-4-(a,a,a-трифтор-m-толил)-1-пиперидинил]карбонил]этил]карбамат. MS (FAB): 565 (М+Н)+; e) гидрированием продукта d), как в приме-ре 1е), получают ацетат сложного трет.-бути-лового эфира 1-[[L-аланил-4-(a,a,a-трифтор-m-толил)-4-пиперидинил]окси]уксусной кислоты. MS(EI): 415 (М-СН3)+; f) взаимодействием продукта е) с n-амидино-бензоилхлорид-гидрохлоридом, как в примере 1f), получают желаемое исходное вещество. MS(EI): 577 (М+Н)+. Пример 24 Раствор 150 мг трет.-бутил-[[1-[1-(n-амидино-бензоил)-L-пролил]-4-пиперидинил]окси] ацетата в 10 мл дихлорметана и 10 мл трифторуксусной ки-слоты перемешивают 2 часа при комнатной температуре и выпаривают. Остаток суспендируют в простом эфире и фильтруют на нутче. Получают 141 мг трифторацетата [[1-[1-(n-амидинобензоил)-L-пролил]-4-пиперидинил]окси]уксусной кислоты. Точка плавления 234-236°С. Исходное вещество можно получать следующим образом: a) 4,97 г хлорангидрида цианобензойной ки-слоты, 3,45 г L-пролина и 0,73 г тетраметиламмонийсульфата перемешивают в 300 мл дихлорме-тана и 150 мл 5%-ного раствора бикарбоната на-трия 48 часов. Водную фаз у подкисляют при по-мощи 3 г серной кислоты и экстрагируют уксусным эфиром. Фазу уксусного эфира промывают насыщенным раствором хлористого натрия, сушат и выпаривают. Хроматография остатка на силикаге-ле (RP-18) с водой дают 3,70 г 1-(n-цианобензо-ил)-L-пролина. Точка плавления 80-85°С; b) реакция 250 мг 1-(n-цианобензоил)-L-про-лина с 215 мг сложного трет.-бутилового эфира 4пиперидинилоксиуксусной кислоты дают после хроматографии на силикагеле с уксусным эфиром/метанолом (98:2) 300 мг трет.-бутил-[[1-[1-(n-цианобензоил)-L-пролил]-4-пиперидинил]окси]ацетата. MS:442 (М+Н)+; c) обработка 1 г предварительной стадии, как в примере 2А), 2В), 2С) ведет через трет.-бутил-[[1-[1-(n(тиокарбамоил)бензоил)-L-пролил]-4-пипериди-нил]окси] ацетат, точка плавления 108-110°С, и t-бутил-[[1[1-(n-[(1-метилтио)формимидо-ил]бензо-ил)-L-пролил]-4-пиперидинил]окси]аце-тат точка плавления 132133°С, к 72 мг желаемого ацетата, точка плавления 100°С (разложение). Пример 25 Аналогично примеру 24 получают из 150 мг трет.-бутил-[[1-[(4R)-1-(n-амидинобензоил)-4-бен-зилокси-Lпролил]-4-пиперидинил]оксиацетат-гид-рохлорида после хроматографии на силикагеле (RP-18, вода/тетрагидрофуран 95:5) 72 мг [[1-[(4R)-1-(n-амидинобензоил)-4-бензилокси-L-про-лил]-4пиперидинил]окси]уксусной кислоты. Точка плавления 226-227°С. Исходное вещество можно получать следующим образом: а) в раствор 905 мг сложного метилового эфира (4К)-гидрокси-L-пролина и 828 мг хлористого 4цианобензоила в 50 мл дихлорметана добавляют 1,46 мл триэтиламина. После перемешивания раствор промывают насыщенным раствором хлористого натрия, сушат и выпаривают. Хромато-графия остатка на силикагеле (уксусный эфир/ гексан 5:1) дают 810 мг сложного метилового эфира (4К)-1-[n-цианобензо-ил)4-гидрокси-L-пролина. Точка плавления 101-102°С; b) в раствор 730 мг предварительной стадии и 600 мкл бензилтрихлорацетимидата в 5 мл циклогексана и 5 мл дихлорметана закапывают 40 мкл трифторметансульфокислоты. Полученный осадок фильтруют на нутче и промывают фильтрат при помощи 5%-ного раствора бикарбоната натрия, сушат и выпаривают. Хроматография остатка на силикагеле (уксусный эфир) дают 940 мг сложного метилового эфира (4R)-4-бензилокси-1-(n-циано-бензоил)-L-пролина. MS: 305 (М-59); c) 880 мг предварительной стадии и 1,2 мл 2 н. раствора гидроокиси лития перемешивают в 10 мл метанола. После удаления метанола водный остаток подкисляют при помощи 2,4 мл 1 н. соляной кислоты и экстрагируют уксусным эфиром. Сушка органической фазы и выпаривание дают 470 мг (4R)-4бензилокси-1-(n-цианобензо-ил)-L-пролина. Точка плавления 58-60°С; 39849 d) 450 мг продукта с) обрабатывают в присутствии HBTU с 280 мг сложного трет.-бутилового эфира 4пиперидинилоксиуксусной кислоты. Остаток растворяют в уксусном эфире и промывают фазу уксусного эфира при помощи 5%-ного раствора бикарбоната натрия, 1 н. раствора бисульфата калия и насыщенного раствора хлористого натрия, сушат и выпаривают. После хроматогра-фии остатка на силикагеле (дихлорметан/метанол 98:2) получают 500 мг трет.-бутил-[[1-[(4R)-4-бензилокси-1-(n-цианобензоил)-Lпролил]-4-пипе-ридинил]окси] ацетата. MS: 548 (М+Н)+; e) обработка 400 мг предварительной стадии, как в примере 2А), 2В), 2С), дают 177 мг желаемо-го ацетата. Точка плавления гидройодида 148-150°С. Пример 26 Раствор 1,60 г трет.-бутил-[[1-[(4R)-1-[n-амиди-нобензоил)-4-гидрокси-L-пролил]-4-пиперидинил]-окси] ацетата в 20 мл дихлорметана и 20 мл трифторуксусной кислоты перемешивают 2 часа при комнатной температуре и выпаривают. Остаток растворяют в этаноле и смешивают с простым эфиром. Фильтрование на нутче и сушка осадка дают 1,25 г трифторацетата [[1-[(4R)-1-(n-амиди-нобензоил)-4-гидрокси-L-пролил]4-пипери-динил] окси уксусной кислоты. Точка плавления 220°С (разложение). Исходное вещество можно получать следующим образом: а) реакция 14,78 г (4Р)-1-(бензилокси-карбо-нил)-4-гидрокси-L-пролина с 12,0 г сложного трет.бутилового эфира 4-пиперидинилоксиуксусной ки-слоты дает после хроматографии на силикагеле (уксусный эфир/метанол 95:5) 17,83 г трет.-бутил-[[1-[(4R)-1-(бензилоксикарбонил)-4-гидрокси-L-пролил]-4пиперидинил]окси]ацетата. MS: 463 (M+H)+; b) гидрирование 17,0 г продукта предыдущей стадии в этаноле в присутствии 2,0 г Pd/C (10%) дает после отфильтровывания катализатора и сгущения 11,06 г трет.-бутил-[[1-[(4R)-4-гидрокси-L-пролил]-4пиперидинил]окси] ацетата. MS: 329 (М+Н)+; c) реакция 2,0 г продукта стадии b) с 1,34 г n-амидинобензоилхлорида по примеру 1f) дают 1,95 г желаемого ацетата. Пример 27 Раствор 700 мг трет.-бутил-[[1-[[1-(n-амидино-бензоил)-2-пиперидинил]-карбонил]-4-пипериди-нил]окси] ацетата в 20 мл дихлорметана и 20 мл трифторуксусной кислоты перемешивают 3 часа при комнатной температуре и выпаривают. Остаток растворяют в этаноле и смешивают с простым эфиром. Фильтрование на нутче и сушка осадка и хроматография на силикагеле (RP-18, вода/тет-рагидрофуран 9:1) дают 111 мг [[1-[[1-(n-амидинобензоил)-2-пиперидинил]-карбонил]-4-пи-перидинил]окси]уксусной кислоты. Точка плавления 233-234°С. Исходное вещество получают следующим образом: a) взаимодействием 5,26 г 1-(бензилоксикар-бонил)-2-пиперидинкарбоновой кислоты с 4,30 г сложного трет.-бутилового эфира 4-пиперидинил-оксиуксусной кислоты и хроматографией на сили-кагеле (уксусный эфир/гексан 2:1) получают 7,33 г сложного бензилового эфира 2-[[4-[(трет.-бутокси-карбонил)метокси]пиперидино]карбонил]-1-пипе-ридинкарбоновой кислоты. MS:461 (M+H)+; b) гидрированием 4,6 г продукта а) стадии в этаноле в присутствии 0,4 г Pd/C (10%) получают после отфильтровывания катализатора и сгущения растворителя 3,2 г трет.-бутил-[[1-(2-пипери-динилкарбонил)4-пиперидинил]окси]ацетата. MS: 327 (М+Н)+; c) реакция 3,26 г предварительной стадии с 2,49 г n-амидинобензоилхлорида по примеру 1f) дают 1,56 г желаемого ацетата, точка плавления 93-95°С. Пример 28 Раствор 130 мг трет.-бутил-[[(IRS,2RS,3RS 4RS)-4-[[N-(n-амидинобензоил)-L-аланил]амино]-2,3диацетоксициклогексил]окси]ацетат-гидрохло-рида в 5 мл дихлорметана и 5 мл трифторуксусной кислоты перемешивают 2 часа при комнатной температуре и сгущают. С успендирование остатка в простом эфире и фильтрование на нутче дают 126 мг три фторацетата [[(IRS,2RS,3RS,4RS)-4-[[N-(-амидинобензоил)-Lаланил]амино]-2,3-диацеток-сициклогексил]окси]уксусной кислоты, MS: 507 (М+Н)+. Исходное вещество получают следующим образом: а) раствор 4,64 г цис-4-амино-3-циклогексен-1-ола, 10,2 г N-(бензилоксикарбонилокси) сукцини-мида и 5,7мл триэтиламина в диметилформамиде после перемешивания разбавляют простым эфиром, промывают насыщенных раствором хлористого натрия, сушат и сгущают. Хроматография остатка на силикагеле (уксусный эфир/гексан 2:1) дают 5,62 г бензил-(IRS,4SР)-4-гидрокси-2-цигло-гексен-1карбамата. MS: 156 (М-91)+; b) в условиях фазового перехода (30 мл то-луола, 30 мл 50%-ного раствора гидроокиси на-трия, 100 мг тетрабутиламмонийгидросульфата) 2,1 г предыдущей стадии превращают 1,76 мл сложного трет.бутилового эфира бромуксусной кислоты. После перемешивания органическую фа-зу отделяют, промывают насыщенным раствором хлористого натрия, сушат и сгущают. Хромато-графия остатка на силикагеле (гексан/уксусный эфир 3:1) дают 1,91 г бензил (IRS,4SР)-4-[(трет.-бутоксикарбонил)метокси]-2циклогексен-1-карба-мата MS: 333 (M-28)+; c) раствор 722 мг предыдущей стадии b), 280 мг N-метилморфолин-N-окиси и 26 мг тетра-окиси осмия в 20 мл ацетона и 10 мл воды перемешивают и затем удаляют ацетон при пониженном давлении и экстрагируют водную фазу простым эфиром. Промывка органической фазы насыщенным раствором хлористого натрия, сушка и сгущение дают после хроматографии на силика-геле (уксусный эфир/гексан 2:1) 476мг бензил-(IRS,2SP, 3SP,48Р)-4-[(трет.-бутоксикарбонил)мет-окси]-2,3дигидроксициклогексанкарбамата. MS: 396 (М+Н)+; d) раствор 728 мг продукта предыдущей стадии в 10 м этанола гидрируют в присутствии 100 мг 20%ного Pd/C. Затем отфильтровывают катализатор, выпаривают фильтрат и обрабатывают остаток в 30 мл 39849 тетрагидрофурана в присутствии 697 мг HBTU и 200 мл триэтиламина с 410 мг N-бензилоксикарбонил-Lаланина. Реакционный раствор разбавляют простым эфиром, промывают насыщенным раствором бикарбоната на-трия и насыщенным раствором хлористого натрия и сгущают. Хроматография на силикагеле (уксус-ный эфир/метанол 95:5) дают 521 г бензил-[(S)-1-[[(IRS,2SP,3SP,4SP)-4-[(трет.бутоксикарбонил) метокси]-2,3-дигидроксициклогексил]карбамоил] этил] карбамата. MS: 467 (М+Н)+; e) ацетилирование 800 мг продукта стадии d) в 10 мл уксусного ангидрида и 10 мл пиридина и сгущение реакционного раствора дают после хро-матографии на силикагеле (уксусный эфир/гексан 2:1) 670 мг бензил-[(S)-L-[[(IRS,2SP,3SP,4SP)-4-[(тpeт.-бутоксикарбонил)метокси]-2,3-ацетоксициклогексил]карбамоил]этил]карбамата. MS: 551 (М+Н)+; f) гидрорование 670 мг предыдущей стадии в 10 мл этанола в присутствии 100 мг 10%-ного Pd/C, отфильтровывание катализатора и выпаривание раствора дают после обработки (аналогично Примеру 1f) при помощи 329 мг n-амидино-бензоилхлорида и хроматографии на силикагеле (RP-18, вода/метанол 9:1) 230 мг желаемого исходного вещества. MS: 563 (М+Н)+. Пример 29 220 продукта примера 28 и 300 мг карбоната калия перемешивают в 10 мл метанола при комнатной температуре и затем выпаривают метанол. Хроматография на силикагеле (RP-18, вода/аце-тонитрил 95:5) дают 110 мг [[(IRS,2RS,3RS, 4SP)-4-[[N-(n-амидинобензоил)-L-аланил]амино]-2,3-дигидроксициклогексил]окси]уксусной кислоты. Пример 30 Обработка 1,3 г сложного метилового эфира рац-[n-[[1-(р-цианобензоил)-2-пирролидинил]карбонил]фенокси]уксусной кислоты, как описано в примере 2А), 2В), 2С), дает после хроматографии (силилированный кизельгель RP-18, вода/мета-нол-элюент) и перекристаллизации из этанола 0,45 г ацетата сложного метилового эфира рац-[n-[[1-(р-амидинобензоил)-2-пирролидинил]карбонил] фенокси] уксусной кислоты. Точка плавления 210-211°С. MS(FAB): 410 (М+Н)+. Исходное вещество можно получать следующим образом: a) реакцией реактива Гриньяра из 8,3 г n-бен-зилоксибромбензола и 0,8 г магниевых стружек с 9,34 г ZL-пролин-N-метоксиметиламида в тетра-гидрофуране выделяют после хроматографии (силикагель, простой диэтиловый эфир/петролей-ный эфир 1:1) 4,3 г рац-1-(бензилоксикарбонил)-2-(nбензилоксибензоил)-пирролидина. MS (El): 211 (С14Н11О 2)+, 204 (C 12H14NO2)+; b) гидрированием 3,3 г продукта стадии а), как в примере 6b), и последующей реакцией с 1,32 г nцианбензоилхлорида в диметилформамиде в присутствии триэтиламина получают 2,8 г рац-1-(nцианбензоил)-2-(n-гидроксибензоил)пирролидина. Точка плавления 194-196°С (уксусный эфир). MS(E1): 320 (M)+; c) реакция 2,8 г предыдущей стадии с 1,53 г сложного метилового эфира бромуксусной кислоты в диметилформамиде в присутствии карбоната калия дают после хроматографии (силикагель, дихлорметан/метанол 99:1) 1,3 г желаемого исходного соединения. MS(EI): 392 (М)+. Пример 31 Нагреванием 0,30 г продукта примера 30 в водном растворе уксусной кислоты получают после хроматографии (силилированый кизельгель RP-18, вода/ацетонитрил-элюент) 0,11 г рац-[n-[[1-(nамидинобензоил)-2-пирролидинил]карбонил] фенокси уксусной кислоты. Точка плавления выше 250°С. MS(FAB): 396 (М+Р)+. Пример 32 Обработкой 0,85 г сложного диметилового эфира [[4-[1-(n-цианбензоил)-DL-пролил]-m-фенилен]диокси]уксусной кислоты, как описано в примере 2А), 2В), 2С), получают после хроматогра-фии (силилированый силикагель RP-18, вода/ме-танол-градиент) и кристаллизацию из простого диэтилового эфира 0,09 г ацетата сложного диме-тилового эфира [[4-[1-(n-амндинобензоил)DL-пролил]-m-фенилен]диокси]диуксусной кислоты. Точка плавления 93-95°С. MS(FAB): 438 (М+Н)+. Исходное вещество можно получать следующим образом: a) превращением магниевой соли 4 г сложного метилового эфира-3-гидрокси-феноксиуксусной кислоты с 5,8 г Z-L-пролинала и этерификацией продукта с 3,8 г сложного метилового эфира бром-уксусной кислоты, как описано в примере 30с), по-лучают после хроматографии (силикагель, простой диэтиловый эфир/петролейный эфир 4:1) 7,6 г сложного диметилового эфира [[4-[(RS)-1-бе-нзилоксикарбонил)-DLпирролил]гидроксиметил]-m-фенилен]диокси]-диуксусной кислоты. MS (FAB): 488 (М+Н)+; b) из 5,3 г предварительной стадии получают окислением при помощи 7,5 мл реактива Джонса в простом диэтиловом эфире после хроматографии (силикагель, дихлорметан/метанол 99:1) 2,2 г сложного диметилового эфира [[4-[1-бензилокси-карбонил)-DL-пролил-m-фенилен]диокси]диуксус-ной кислоты. MS(EI): 485 (М)+; c) гидрированием 2,2 г предварительной стадии, как в примере 6b), и последующим превращением с 1,0 г n-цианбензоилхлорида в хлороформе в присутствии триэтиламина получают по-сле хроматографии (силикагель, дихлорметан/ метанол 99:1) 0,85 г желаемого исходного вещества. MS(EI): 480 (M)+. Пример 33 Из 0,09 г продукта примера 32 получают гидролизом с водным раствором натрового щелока в метаноле при 50°С после нейтрализации уксусной кислотой, хроматографии (силилированный ки-зельгель RP-18, вода/ацетондтрил-элюент) и кристаллизации из этанола 0,09 г мононатриевой соли [[4-[1-(nамидинобензоил)-DL-пролил]-m-фени-лен]диокси]диуксусной кислоты. Точка плавления 241-242°С. MS(FAB): 492 (M+Na)+, 470 (М+H)+. Пример 34 39849 Из 0,47 г [[1-[N-(n-амидинобензоил)-L-тиро-зил]-4-пипердинил]окси уксусной кислоты (при-мер 14) получают этерификацией в этаноле в присутствии каталитических количеств концентрированной серной кислоты после хроматографии (LiChroprep RP-18, вода/этанол-элюент) 0,3 г по-лусульфа та сложного этилового эфира [[1-[N-(n-амидинобензоооил)-L-тирозил]-4-пипединил]окси] уксусной кислоты, точка плавления 182-184°С (этанол). MS (ISO=ионное плавление): 497 (М+Н)+. Пример 35 Из 0,48 г сложного трет.-бутилового эфира [[1-[N-[5-(1-трет.-бутоксиформамидо)пентаноил]-3-(n-трет.бутоксифенил)-L-аланил]-4-пиперидинил]ок-си] уксусной кислоты получают по аналогии с примером 1 после кристаллизации из простого диэтилового эфира 0,2 г соли трифторацетата [[1-[N-(5-амиопентаноил)L-тирозил]-4-пипердинил]ок-си]уксусной кислоты, точка плавления 78-88°С (разложение), [а]20D=+11,6° (с=0,7, метанол). MS(FAB): 422 (М+Н)+. Исходное вещество можно получать следующим образом. Реакция 0,7 г сложного трет.-бутиловового эфира [[1-[3-(n-бутоксифенил)-L-аланил]-4-пиперидинил]окси]уксусной кислоты полученного гидро-генолизом продукта примера 14а) с 0,35 N-Boc-5аминопентановой кислоты в присутствии HBTU и N-метил-морфолина (как в примере 2b) дают 0,55 г исходного эфира, [a] 20D=+1,2° (с=0,4, метанол). MS (FAB): 634 (M+H)+. Пример 36 Из 0,6 г [(S)-3-(n-амидинобензамидо)-3-[[4-[(трет.-бутоксикарбонил)метокси]-пиперидине]кар-бонил] пропил]-трет.-бутилкарбамата получают по аналогии с примером 1 после хроматографии (LiChroprep) RP18, вода/метанол-элюент) и перемешивания в тетрагидрофуране 0,26 г соли три-фторацетата [[1-[(S)-2-(nамидинобензамидо)-4-ами-нобутаноил)]-4-пиперилинил]окси]уксусной кислоты. Точка плавления выше 170°С (разложение), [a]20D=5,8° (с=0,5, вода). MS(E1): 406 (М+Н)+. Исходное вещество можно получать следующим образом: a) реакция 1,0 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной кислоты с 2,0 г N 2-Fmoc4 N -Boc-(S)-2,4-диаминомасляной кислоты в присутствии HBTU и основания Хюнига дает, как описано в примере 2b), после хроматографии (си-ликагель, EtOAc/гексан 1:1,5) 2,2 г 3-трет.-бутил-1-(флуорен-9илметил)-(8)-1-[[4-[(трет.-бутоксикар-бонил)метоксипиперидино]карбонил]триметилен-дикарбамата. MS(FAB): 638 (M+H)+; b) взаимодействие 2,3 г продукта а) с пиперидином (20% в диметилформамиде) дает после хроматографии (силикагель, уксусный эфир/мета-нол 4:1) 0,65 г трет.-бутил-[(S)-3-амино-3-[[4-[(трет.бутоксикарбонил)метокси]пиперидино]кар-бонил]-пропил]карбамата. MS(FAB): 416 (М+Н)+; c) взаимодействие 0,65 г продукта b) с 0,38 г n-амидинобензоилхлорид-гидрохлоридом (как в примере 1f) получают 0,6 г исходного карбамата. MS(FAB): 562 (М+Н)+. Пример 37 Из 0,25 г соли ацетата сложного трет.-бути-лового эфира [[1-[N-[(5-амидино-2-пиридил)карбо-нил]-3-(nтрет.-бутоксифенил)-L-аланил]-4-пипери-динил]окси]уксусной кислоты получают (как в примере 1) после хроматографии (LiChroprep RP-18, вода/метанол-градиент) и перемешивания в ук-сусном эфире 0,12 г [[1[N-[(5-амидино-2-пири-дил)карбонил]-L-тирозил]-4-пиперидинил]окси]ук-сусной кислоты, точка плавления 198-200°С (разложение). MS (FAB): 470 (М+Н)+. Исходное вещество можно получать следующим образом: a) превращение 2,5 г сложного трет.-бути-лового эфира [[1-[3-(n-трет.-бутоксифенил)-L-аланил]-4пиперидинил]окси]уксусной кислоты с 0,85 г 5-циан-2-пиколиновой кислоты (как в примере 1d) дает 1,55г сложного трет.-бутилового эфира [[1-[3- (п -трет.-бутоксифенил)-М- [[5-циано -2-пи-ридил]- карбонил]-Ь аланил] -4-пиперидинил]окси] уксусной кислоты. Точка плавления 122-123°С (простой диэтиловый эфир/пет-ролейный эфир 4:1). MS (FAB): 565 (М+Н)+; b) последующая обработка 1,43 г продукта стадии а), как описано в примере 2А), 2В), 2С), да-ет 0,98 г желаемого исходного вещества. Точка плавления 183-186°С. MS (El): 582 (М+Н)+. Пример 38 Превращение 0,7 г сложного этилового эфира (S)-1-[2-(5-цианопиридин-2-илкарбониламино)-3-(4метоксифенил)пропионил]пиперидин-4-илокси-уксусной кислоты, как описано в примере 2А), 2В), 2С), дает после кристаллизации из воды 0,1 г соли ацетата сложного этилового эфира (S)-1-[2-(5-aми-динoпиpидин2-илкapбoнилaминo)-3-(4-метокси-фенил)пропионил]пиперидин-4-илоксиуксусной ки-слоты. Точка плавления 180-181°С (разложение). MS (ISP): 512 (М+Н)+. Исходный нитрил можно получать следующим образом: а) взаимодействие 7 г N-Z-L-тирозин-дигид-рата с 4,5 г сложного этилового эфира 4-пиперидинилоксиуксусной кислоты (полученного обработкой соответствующего сложного трет.-бутило-вого эфира, пример 1с), с трифторуксусной кислотой, с последующей обработкой раствором соляной кислоты в этаноле, как в примере 1d), дают 6,5 г сложного этилового эфира [[1-[N-(бензил-оксикарбонил)-L-тирозил-4пиперидинил]окси]ук-сусной кислоты. Этот продукт обрабатывают в диметформамиде в присутствии карбоната калия йодистым метилом, причем после хроматографии (силикагель, хлористый метилен метанол 99:1) получают 4,2 г сложного этилового эфира (S)-1-[2-бензилоксикарбониламино-3-(4метоксифенил) пропионил]пиперидин-4-илоксиуксусной кислоты, [a]20D=+1,9° (с=0,8, метанол). MS (ISP): 439 (М+Н)+; b) из 4 г продукта а) получают по аналогии с примером 1а) 3,5 г сложного этилового эфира (S)-1-[2амино-3-(4-метоксифенил)пропионил]пипери-дин-4-илоксиуксусной кислоты. MS(EI): 365 (М+Н)+; 39849 с) взаимодействие 1,46 г продукта b) с 0,74 г 5-циан-2-пиколиновой кислоты по примеру 1d) дают после хроматографии на силикагеле (хлористый метилен/метанол 40:1) 0,72 г исходного нитрила. MS(ISP): 495,5 (М+Н)+. Пример 39 Омылением сложного этилового эфира (8)-1-[2-(5-амидинопиридин-2-илкарбониламино)-3-(4метоксифенил)пропионил]пиперидин]-4-илоксиук-сусной кислоты (пример 38) при рН 12 получают после хроматографии (LiChroprep RP-18, во-да/метанол-элюент) и перемешивания в этаноле (8)-1-[2-(5амидинопиридин-2-илкарбониламино)-3-(4-метоксифенил)пропионил]пиперидин]-4-илок-сиуксусную кислоту. Точка плавления выше 250°С. MS(ISP): 484,4 (M+H)+. Пример 40 Взаимодействием 1,2 г сложного этилового эфира (8)-1-[2-амино-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиуксусной кислоты (при-мер 38b) с 0,77 г гидрохлорида хлорангидрида 4амидинобензойной кислоты в 3-пиколине (аналогично примеру 1f) получают после хроматографии (LiChroprep RP-18,вода/этанол-элюент) и перемешивания с уксусным эфиром 0,25 г гидрохлорида сложного этилового эфира (S)-1-[2-(4-амидино-бензамидо)-3-(4-метоксифенил)пропионил]пипе-ридин-4илоксиуксусной кислоты, точка плавления 105-107°С. М (ISP): 511,3 (M+Н)+. Пример 41 Омылением 0,35 г гидрохлорида сложного этилового эфира (S)-1-[2-(4-амидинобензамидо)-3-(4метоксифенил)пропионил]пиперидин-4-илокси-уксусной кислоты (пример 4f) при рН 12 получают после хроматографии (LiChroprep RP-18, вода/ метанол-элюент) и кристаллизации из этанола/ воды 0,05 г (8)-1[2-(4-амидинобензамидо)-3-(4-метоксифенил)пропионил]пиперидин-4-илоксиук-сусной кислоты, точка плавления 191-192°С. MS(ISP): 483,3 (М+Н)+. Пример 42 Из 1,6 г сложного трет.-бутилового эфира [1-[N-(4-амидинобензоил)-триптофанил]пиперидин-4илокси]уксусной кислоты получают по аналогии с примером 1 после хроматографии (LiChroprep RP-18, вода/метанол-элюент) и смешивания с тетра-гидрофураном и ацетонитрилом 0,7 г [1-[N-(4амидинобензоил)-L-триптофил]пиперидин-4-илок-си]уксусной кислоты, точка плавления 210°С (разложение). MS (ISP): 492,2 (М+Н)+. Исходное вещество получают следующим образом: a) взаимодействие 5,1 г сложного трет.-бути-лового эфира 4-пиперидинилоксиуксусной кислоты (пример 1с) с 8,0 г Z-Тrр-ОН в присутствии HBTU и N-металморфонила дает, как описано в примере 2b), после хроматографии (силикагель, хлористый метилен/метанол 20:1) 11,5 г сложного трет.-бутилового эфира [1-(N-бензилокси-карбо-нил-L-триптофил)пиперидин-4-илокси]уксусной кислоты. MS (ISP): 536,0 (М+Н)+; b) раствор 6,6 г продукта а) в метаноле нагревают в присутствии 10%-ного Pd/С и формиата аммония до температуры кипения. После фильтрования и хроматографии (силикагель, хлористый метилен/метанол 9:1) получают 4,3 г сложного трет.-бутилового эфира (1-L-триптофил-пипери-дин-4-илокси)уксусной кислоты. MS (EI): 384 (M-NH 3)+; c) превращением 1,9 г продукта b) с 1,15 г гидрохлорида хлорангидрида бензойной кислоты в пиридине, как описано в примере 1f) получают после хроматографии (силикагель, хлористый метилен/метанол 7:1) 1,6 г исходного эфира. MS (ISP): 548,3 (M+N)+. Пример 43 Раствор 3,2 г сложного трет.-бутилового эфира [1-[N-(4-амидинобензоил)-4'-гексилокси-L-фенилаланил]пиперидин-4-илокси]уксусной кислоты в муравьиной кислоте оставляют на ночь при комнатной температуре. После сгущения, хромато-графии (LiChroprep RP-18, вода/метанол-элюент) и перемешивания с простым диэтиловым эфиром выделяют 0,45 г [1-[N-(4-амидинобензоил)-4'-гек-силоксиL-фенилаланил]пиперидин-4-илокси]ук-сусной кислоты, точка плавления 160°С (разложение), [a]20D=-3,2° (с=0,5, метанол). MS (ISP): 553,2 (M+H)+. Исходный эфир получают следующим об-разом: a) по аналогии с примером 38а) превращение 5,6 г сложного трет.-бутилового эфира [[1-[N-(бензилоксикарбонил)-L-тирозил]-4-пиперидинил]окси] уксусной кислоты с 1-йодгексаном при 80°С дают после хроматографии (силикагель, гексан/уксус-ный эфир 2,5:1) 3,9 г сложного трет.-бутилового эфира [1-(Nбензилоксикарбонил-4'-гексилокси-L-фенилаланил)пиперидин-4-илокси]уксусной кисло-ты. MS (EI): 445 (MZ-NH2)+; b) гидрированием 3,9 г продукта а) в метаноле (аналогично примеру 1с) получают 2,85 г сложного трет.-бутилового эфира [1-(4'-гексилокси-L-фенилаланил)пиперидин-4-илокси]уксусной кисло-ты. MS (EI): 462 (М)+, 445 (M-NH 3)+; с) взаимодействием 0,5 г продукта b) с 0,3 г гидрохлорида хлорангидрида 4-амидинобензой-ной кислоты в пиридине (аналогично примеру 1f) получают после хроматографии (силикагель, хлористый метилен/метанол 5:1) 0,7 г исходного эфира. MS(ISP): 609,4 (М+Н)+. Пример 44 Раствор 0,65 г сложного трет.-бутилового эфира (R,S)-1-[2-(4-аминоиминометил-N-метилбензоиламино)-3-(4-метоксифенил)пропионил]пи-перидин-4-илокси уксусной кислоты в муравьиной кислоте оставляют на ночь при комнатной температуре. После сгущения и хроматографии (LiChroprep RP18, вода/ацетонитрил-элюент) выделяют 0,13 г (R,S)-1-[2-(4-аминоиминометил-N-метилбензоиламино)-3 39849 (4-метоксифенил)пропио-нил]пиперидин-4-илокси уксусной кислоты, точка плавления 181-182°С. MS (ISP): 497,1 (М+Н)+. Исходный эфир получают следующим об-разом: a) сочетанием 1,37 г Z-N-Me-Tyr(Me)-OH (J..A.C.S., 112, 1990, 7663) с 0,86 г сложного трет.-бутилового эфира 4-пиперидинилоксиуксусной ки-слоты (пример 1с), как описано в примере 2b), по-лучают после хроматографии (силикагель, простой диэтиловый эфир/гексан 5:1) 1,6 г сложного трет.-бутилового эфира (R,S)-1-2-(N-бензилокси-карбонил-N-метиламино)-3-(4-метоксифенил)про-пионил пиперидин-4илокси]уксусной кислоты. MS(EI): 541,0 (М+Н)+; b) гидрированием 1,5 г продукта а) в метаноле, как описано в примере 1с), получают 1,05 г масла, которое превращают непосредственно с 0,58 г гидрохлорида хлорангидрида 4-амидино-бензойной кислоты в пиридине, как описано в примере 1f). После хроматографии (силикагель, хлористый метилен/метанол 9:1) получают 0,7 г исходного эфира, точка плавления 109-111°С. MS (ISP): 553,2 (М+Н)+. Пример 45 Этерификацией 0,07 г (R,S)-1-[2-(4-аминоими-нометил-N-метилбензоиламино)-3-(4-метоксифенил)пропионил]пиперидин-4-илокси уксусной ки-слоты в этаноле, как описано в Примере 34, получают после хроматографии (LiChroprep RP-18, во-да/этанол-элюент) и перемешивания с простым диэтиловым эфиром 0,056 г сложного этилового эфира (R,S)-1-[2-(4-аминоиминометил-N-метил-бензоиламино)-3-(4метоксифенил)пропионил]пи-перидин-4-илокси уксусной кислоты, точка плавления 126-128°С. MS (ISP): 525,5 (М+Н)+. Пример 46 К 100 мг сложного трет.-бутилового эфира (S)-цис-1-[2-(4-амидинобензоиламино)пропионил]-4-трет.бутоксикарбонилметокси-пирролидин-3-илоксиуксусной кислоты в 5 мл хлористого метилена добавляют 5 мл трифторуксусной кислоты. После перемешивания при комнатной температуре растворители выпаривают и остаток хромато-графируют на силикагеле RP-18 с водой/тетра-гидрофураном (0-50%). Получают 73 мг (S)-цис-1-[2-(4-амидинобензоиламино)пропионил]-4-карбоксиметокси-пирролидин-3илоксиуксусной кислоты. MS:437 (М+Н)+. Исходный эфир получают следующим об-разом: a) перемешивают в условиях фазового перехода 237 мг цис-N-бензилоксикарбонилпирроли-дин-3,4диола, 1 мл сложного трет.-бутилового эфира бромуксусной кислоты и 100 мл тетрабутиламмонийгидросульфата в 10 мл 50%-ного натрового щелока. Органическую фазу промывают во-дой и выпаривают. Хроматография остатка от вы-паривания на силикагеле с уксусным эфиром/гексаном (1:3) дают 354 мг сложного бензилового эфира цис-3,4-бис-трет.-бутоксикарбонилмет-окси-пирролидин-1карбоновой кислоты. MS: 354 (M-III); b) продукт стадии а) гидрируют 320 мг в 10 мл ЕtOН в присутствии 100 мг 10%-ного Pd/C, через 2 часа отфильтровывают катализатор и остаток в 10 мл тетрагидрофурана перемешивают с 234 мг Nбензилоксикарбонил-L-аланин-К-гидроксисук-цинимидного эфира в присутствии 100 мкл триэти-ламина. Реакционный раствор разбавляют с простым эфиром, органическую фазу промывают 1-молярным раствором KHSO4, суша т и выпаривают. Хроматография остатка с гексаном/уксусным эфиром (1:1) на силикагеле дает 260 мг сложного трет.-бутилового эфира (S)-цис-1-(2-бензилоксикарбониламинопропионил)-4-трет.-бутоксикарбо-нилметокси-пирролидин-3-илоксиуксусной кислоты. MS: 537 (М+Н)+; c) продукт стадии b) гидрируют 250 мг в 10 мл этанола в присутствии 100 мг 10%-ного Pd/C, че-рез 4 часа отфильтровывают катализатор и перемешивают остаток в 10 мл пиридина с 102 мг nамидинобензоилхлорид-гидрохлорида. Выпаривание раствора и хроматография остатка на силикагеле RP18 с водой/тетрагидрофураном (5-30%) дает 143 мг исходного эфира, точка плавления 127°С (d). Пример 47 Раствор 150 мг гидрохлорида сложного этилового эфира (S)-8-[2-(4-амидинобензоилламино)-3-(4-трет.бутоксифенил)пропионил-8-азабицикло [3,2,1]октан-эндо-3-илоксиуксусной кислоты перемешивают в 5 мл CH2Cl2 и 2,5 мл трифторуксусной кислоты при комнатной температуре и выпаривают. Остаток с простым эфиром дает кристаллы, которые отсасывают на нутче и растворяют в 5 мл ЕtOН. К раствор у добавляют 40 мг NaOH, растворенной в 1 мл воды, и перемешивают при комнатной температуре. Реакционный раствор нейтрализуют при помощи 1 н. соляной кислоты и выпаривают. Хроматография остатка с водой/тетра-гидрофураном на силикагеле RP-18 дают 75 мг (8)-8-[2-(4-аминоиминометил-бензоил-амино)3-(4-гидроксифенил)пропионил-8-азаби-цикло[3,2,1]ок-тан-эндо-3-илоксиуксусной кислоты. MS: 495 (M+H)+. Исходное вещество получают следующим образом: a) к раствору 1 г N-бензилоксикарбонилнор-тропина и 20 мг ацетата родия (II) в 3 мл толуола добавляет при 80°С 2 мл сложного этилового эфира диазоуксусной кислоты в 2 мл толуола. Че-рез 3,5 часа раствор выпаривают и остаток хрома-тографируют с гексаном/уксусным эфиром (20-50%) на силикагеле. Получают 555 мг сложного бензилового эфира эндо-З-этоксикарбонилмет-окси-8азабицикло[3,2,1]октан-8-карбоновой кисло-ты. М: 348 (М+Н)+; b) раствор 500 мг продукта стадии а) в 20 мл этанола гидрируют в присутствии 100 мг 10%-ного Pd/C, через 3 часа отфильтровывают катализатор и выпаривают фильтрат. Остаток растворяют в 10 мл тетрагидрофурана и добавляют к раствору 828 мг N-Z-L-Tyr(tBu)-OH, 140 мкл N-метилморфо-лина и 569 мг HBTU в 10 мл тетрагидрофурана, который перемешивали 1 час при 0°С. После пе-ремешивания реакционный раствор выпаривают и остаток хроматографируют с гексаном/уксусным эфиром (1:1) на силикагеле. Получают 650 мг сложного этилового эфира (S)-8-[2-бензилоксикар-бониламино-3-(4-трет.бутоксифенил)пропионил-8-азабицикло[3,2,1]октан-эндо-3-илоксиуксусной кислоты. MS: 567 (М+Н)+; 39849 c) 600 мг продукта предыдущей стадии гидри-руют в 20 мл этанола, в присутствии 100 мг 10%-ного Pd/C, через 16 часов отфильтровывают катализатор и остаток в 10 мл пиридина перемешивают с 262 мг nамидинобензоилхлорид-гидрохло-рида при комнатной температуре. Выпаривание раствора и хроматография остатка на силикагеле RP-18 с водой/тетрагидрофураном (0-50%) дает 198 мг исходного эфира. MS: 579 (М+Н)+. Пример 48 706 мг сложного бутилового эфира (Е)- или (Z)-(S)-[3-[2-[4-(трет.-бутоксикарбонилимино-ди-трет.бутоксидикарбониламинометил)бензамино] пропиониламино]пропокси]уксусной кислоты перемешивают в 1,5 мл хлористого метанола и 1,5 мл трифторуксусной кислоты при 20°С. После выпаривания растворителя в вакууме, отпарки с толуолом и кристаллизации из ацетонитрила по-лучают 407 мг трифторацетата сложного бутилового эфира (S)-[3-[2-[4-(амидино)бензоиламино] пропиониламино]пропокси]-уксусной кислоты (1:1) точка плавления 163-165°С. [a]20D=+19°(с=0,5 в метаноле). Исходное вещество получают следующим образом: a) акрилонитрил, сложный бутиловый эфир гликолевой кислоты и карбонат калия нагревают до 60°С. После обработки уксусным эфиром и во-дой отгоняют сложный бутиловый эфир 2-циан-этоксиуксусной кислотой. Точка плавления 100-120°С, 0,3 мм рт. ст. (трубка с шаровым расширением); b) последний гидрируют в уксусной кислоте на Pd/C и полученный при этом амин обрабатывают с Nбензилоксикарбонил-L-аланином для получения сложного бутилового эфира (S)-[3-(2-бензилоксикарбониламино-пропиониламино]пропокси]уксус-ной кислоты, точка плавления 54-55°С. [a]20D= =-11,0° (с=0,5 в метаноле); c) гидрированием на Pd/C в уксусной кислоте получают из него сложный бутиловый эфир [3-(2аминопропиониламино)пропокси]уксусной кислоты, который обрабатывают с n-[E/Z]-три(трет.-бутоксикарбонил)амидинобензойной кислотой до ис-ходного вещества. MS: 707 (27 М+Н). [a] 20D=+21,4° (с=0,5 в метаноле). Пример 49 416 мг сложного бутилового эфира (S)-[3-[2-[4-(амидино)бензоиламино]пропиониламино]пропок-си]уксусной кислоты перемешивают в 8,3 мл 25%-ной соляной кислоты при 20°С. Раствор выпаривают и остаток отпаривают с водой. Из тетрагид-рофурана получают 211 мг гидрохлорида (S)-[3-[2-[4(амидино)бензоиламино]пропиониламино]проп-окси]-уксусной кислоты в виде гидрата (1:1), точка плавления 89-90°С. [a]20D=+23,4° (с=0,5 в метаноле). Пример 50 1 г сложного трет.-бутилового эфира 1-[N-[4-(трет.-бутоксикарбонилимино-ди-трет.-бутоксикарбониламинометил)-бензоил]-N-(2-метоксиэтил) глицил]пиперидин-4-илоксиуксусной кислоты перемешивают в 3,8 мл хлористого метилена и 3,8 мл трифторуксусной кислоты при 20°С. Смесь растворителей выпаривают, остаток отпаривают с водой, растворяют в этиловом спирте и при по-мощи раствора аммиака в метаноле устанавливают рН 8, после чего выкристаллизовывают 1-[N-[4(аминоиминометил)-бензоил]-N-(2-метоксиэтил) глицил]пиперидин-4-илоксиуксусную кислоту в виде гидрата (2:1). Точка плавления >250°С. MS: 421 (100, М+Н). Исходное вещество можно получать следующим образом: а) сложный трет.-бутиловый эфир N-(2-мет-оксиэтил)глицина взаимодействуют в простом эфире и насыщенном, водном растворе бикарбоната натрия со сложным бензиловым эфиром хлормуравьиной кислоты до сложного трет.-бути-лового эфира N-бензилоксикарбонил-(2-метокси-этил)глицина, MS: 324 (82, М+Н); b) последний расщепляют в хлористом метилене/трифторуксусной кислоте до N-бензилокси-карбонилN-(2-метоксиэтил)глицина, MS: 267 (1, М); c) реакция последнего со сложным трет.-бути-ловым эфиром пиперидин-4-илоксиуксусной ки-слоты приводит к сложному трет.-бутиловому эфиру 1-[N-бензилоксикарбонил-N-(2-метоксиэтил)глицил]пиперидин-4-илоксиуксусной кислоты. MS: 465(100, М+Н); d) каталитическим гидрированием на Pd/C в этаноле получают из него сложный трет.-бутиловый эфир 1-[N-(2-метоксиэтил)глицил]пи-перидин-4-илоксиуксусной кислоты, MS: 331 (100, M+H); e) последний обрабатывают с 4-(трет.-буток-сидикарбонилимино-ди-трет.-бутоксикарбониламинометил)бензойной кислотой до исходного эфира, MS: 777 (70, М+Н). Пример А Соединение формулы 1 можно применять из-вестным образом как активное вещество для по-лучения таблеток состава, приведенного в табл.4. Пример В Соединение формулы 1 можно применять из-вестным образом в виде активного вещества для получения капсул состава, приведенного в табл. 5. 39849 Таблица 1 Пример 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Y (или L) СН СН СН СН N СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН (CH2)4NH2 СН N N N СН СН 42 СН 43 44 45 46 47 48 49 50 СН СН СН СН СН СН СН СН R' Н Н Н Н Н Н Н Me Н Н Н R" Н Н Me Me Me iPr iBu H (CH2)3NH2 (CH2)4NH2 (СН2)3 Н Н Н Н Н Н Н Н Н Н Н CH2 СН2ОН CH2OH CH2(J, OH) CH2(J2, OH) СН2Оас СН2ОН CН2COOН (CH2)2COOH Me Me (СН2)3 СН2СН(ОСН2)СН2 СН2СН(ОН)СН2 (СН2)4 Н Me Н Me (СН2)3 (СН2)3 (СН2)3 (СН2)3 Н CH2OH Н CH2OH Н (CH2)2NH2 Н CH2OH Н CH2OMe Н CH2OMe Н CH2OH Н CH2OH CH2-3Н индолил Н CH2ОНех Me CH2OMe Me CH2OMe Н Me Н CH2OH Н Me Н Me CH2OEt H R'" H H H H H H H H H H H Me H H H H H H H H H H H H H H H H H H H H H H H H H Н H H H Q Q1 (1, H) Q1 (1, Ме) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, Ме) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q2 (1, H) Q5 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, H) 4 Q (1, H, Ас) Q4 (1, H, Н) Q5 (Ме, H) Q5 (Н, H) 8 Q (Ме, ОСH2СООМе) Q8 (Н, ОСH2СООМе) Q1 (1, Et) Q1 (1, H) Q1 (1, H) Q1 (1, H) Q1 (1, Et) Q1 (1, H) Q1 (1, Et) Q1 (1, H) IС50 (мкМ) 0,01 0,26 0,0017 0,14 0,001 0,027 0,033 0,008 0,08 0,017 0,018 7,2 0,001 0,018 0,053 0,002 0,012 0,0017 0,012 0,09 0,16 0,47 0,17 0,026 0,37 0,82 0,008 17,5 100 0,015 0,001 0,19 0,014 0,075 0,89 0,11 0,0003 0,031 0,0008 0,05 0,0007 H Q1 (1, H) 0,007 H H H H H H H H 1 Q (1, H) Q1 (1, H) Q1 (1, Et) Q3 (o, H) Q7 (H) Q7 (3, nBu) Q7 (3, H) Q1 (1, H) 0,0016 0,01 0,35 4,7 0,008 100 2,26 0,017 39849 Таблица 2 Соединения согласно изобретению IC50 (мкМ) ADP COL THR 5 14 16 31 37 39 40 43 0,027 0,026 0,026 0,027 0,024 0,092 0,033 0,021 0,030 0,041 0,041 0,038 0,011 0,010 0,013 0,013 0,015 0,019 0,009 0,011 0,011 0,021 0,016 0,029 Таблица 3 Соединения по европ. заявке IC50 (мкМ) ADP COL THR 2 25 26 48 82 83 0,65 0,33 0,42 0,18 0,15 0,13 0,09 1,00 0,9 1,20 0,18 0,45 0,37 0,051 0,070 0,060 Таблица 4 Вещество Активное вещество Микрокристаллическая целлюлоза Кукур узный крахмал Тальк Гидроксипропилметилцеллюлоза На одну таблетку 200 мг 155 мг 25 мг 25 мг 20 мг 425 мг Таблица 5 Вещество Активное вещество Кукур узный крахмал Молочный сахар Тальк Стеарат магния На одну капсулу 100,0 мг 20,0 мг 95,0 мг 4,5 мг 0,5 мг 220,0 мг
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 207/12, A61P 7/02, C07D 207/16, A61K 31/451, C07C 257/00, C07C 279/18, C07D 207/08, C07D 211/46, C07D 211/22, C07D 211/52, C07D 401/12, C07C 233/76, C07D 211/42, C07D 211/48, C07D 453/00, A61K 31/165, C07D 401/06, A61K 31/155, A61K 31/445, C07D 451/06
Мітки: прості, речовини, аміди, ефіри, солі, похідні, фармацевтично, складні, прийнятні, гідрати, активні, n-ацил-a-амінокислоти, фізіологічно
Код посилання
<a href="https://ua.patents.su/20-39849-pokhidni-n-acil-a-aminokisloti-abo-kh-fiziologichno-prijjnyatni-soli-prosti-abo-skladni-efiri-amidi-abo-kh-gidrati-yak-farmacevtichno-aktivni-rechovini.html" target="_blank" rel="follow" title="База патентів України">Похідні n-ацил-a-амінокислоти або їх фізіологічно прийнятні солі, прості або складні ефіри, аміди або їх гідрати як фармацевтично активні речовини</a>
Попередній патент: Каталізатор для одержання ароматичних сполук
Наступний патент: Спосіб і пристрій для виробництва горючих газів з твердих палив
Випадковий патент: Цілодобовий прицільний комплекс для наведення реактивного снаряда












