Азабіциклоалканові похідні, їх одержання і їх застосування в терапії
Номер патенту: 97833
Опубліковано: 26.03.2012
Автори: Локхед Алістер, Бен Аяд Омар, Словінскі Франк, Сааді Мурад, Ваше Жюльєн, Леклерк Оділь
Формула / Реферат
1. Сполука формули (І):
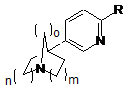 , (I)
, (I)
в якій:
R означає
або атом водню або галогену;
або гідроксил, (С1-С6)алкокси, (С3-С7)циклоалкіл-О- або (С3-С7)циклоалкіл-(С1-С3)алкілен-О-;
або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С1-С6)алкілу, (С3-С7)циклоалкілу, (С3-С7)циклоалкіл-(С1-С3)алкілену, (С1-С6)алкокси, (С3-С7)циклоалкіл-О-, (С3-С7)циклоалкіл-(С1-С3)алкілен-О-, (С1-С6)фторалкілу, (С1-С6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С1-С6)алкіламіногрупи або ді(С1-С6)алкіламінорупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, гетероарил-(С1-С6)алкілену, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3;
n означає 1 або 2;
m означає 1 або 2;
о означає 1 або 2;
у вигляді основи або адитивної солі кислоти, у вигляді гідрату або сольвату;
причому випадок, де n і о =1 і m = 2, виключається;
і причому виключаються наступні сполуки:
4-(6-фторпіридин-3-іл)-1-азабіцикло[2.2.1]гептан;
4-(6-хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептан;
4-(6-бромпіридин-3-іл)-1-азабіцикло[2.2.1]гептан;
4-(піридин-3-іл)-1-азабіцикло[2.2.1]гептан.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що R означає
або атом водню або галогену;
або гідроксил;
або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С1-С6)алкілу, (С1-С6)алкокси, (С1-С6)фторалкілу, (С1-С6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С1-С6)алкіламіногрупи або ді(С1-С6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3;
n означає 1 або 2;
m означає 1 або 2;
о означає 1 або 2;
у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату.
3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що R означає
або атом галогену;
або гідроксил;
або гетероциклоалкільну групу, або арильну групу, або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С1-С6)алкілу, (С1-С6)алкокси, (С1-С6)фторалкілу, (С1-С6)фторалкокси, ді(С1-С6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3;
n означає 1 або 2;
m означає 1 або 2;
о означає 1;
у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату.
4. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що n, m і о означають 1; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату.
5. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що n і m означають 2 і о означає 1; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату.
6. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-5 або адитивну сіль фармацевтично прийнятної кислоти цієї сполуки або її гідрат або сольват.
7. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-5 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше фармацевтично прийнятний ексципієнт.
8. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування і запобігання погіршенням пізнавальних здібностей; розладів уваги; порушень виконавчих функцій, пов'язаних з хворобою Альцгеймера, патологічним або нормальним старінням, хворобою Паркінсона, трисомією 21, психіатричними патологіями, алкогольним синдромом Корсакова, васкулярними деменціями, черепно-мозковими травмами; рухових порушень, які спостерігаються у випадку хвороби Паркінсона або інших неврологічних захворювань або анатомо-гістопатологічних розладів, пов'язаних з вищезгаданими нейродегенеративними захворюваннями; розсіяного склерозу.
9. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування і запобігання порушенням мозкового кровообігу, гіпоксичних церебральних кризів, психіатричних патологій.
10. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для запобігання симптомам, виникаючим внаслідок позбавлення тютюну, алкоголю, різних речовин, які викликають залежність.
11. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування болю.
12. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування ішемії нижніх кінцівок, облітеруючого артеріїту нижніх кінцівок, ішемії серця, інфаркту міокарда, серцевої недостатності, дефіциту загоєння шкіри хворих діабетом пацієнтів, варикозних виразок у випадку венозної недостатності, септичного шоку.
13. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування запальних процесів.
14. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування дерматологічних патологій, астми, виразкового неспецифічного ректоколіту.
Текст
Реферат: Даний винахід стосується сполуки загальної формули (І), в якій R означає або атом водню або галогену; або гідроксил, (С1-С6)алкокси, (С3-С7)циклоалкіл-О- або (С3-С7)циклоалкіл-(С1С3)алкілен-О-; або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С1-С6)алкілу, (С3-С7)циклоалкілу, (С3-С7)циклоалкіл-(С1-С3)алкілену, (С1-С6)алкокси, (С3-С7)циклоалкіл-О-, (С3-С7)циклоалкіл-(С1-С3)алкілен-О-, (С1-С6)фторалкілу, (С1С6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С 1-С6)алкіламіногрупи або ді(С1-С6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, гетероарил-(С1-С6)алкілену, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл може бути необов'язково заміщений С(О)О(СН3)3; n означає 1 або 2; m означає 1 або 2; о означає 1 або 2; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату; способу одержання і застосуванню в терапії. UA 97833 C2 (12) UA 97833 C2 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується азабіциклоалканових похідних, їх одержання і їх застосування в терапії. У Міжнародній патентній публікації WO03/057697A описуються похідні 5-(піридин-3-іл)-1азабіцикло[3.2.1]октану, ліганди нікотинових рецепторів, які придатні при лікуванні або запобіганні порушенням, зв'язаних з дисфункцією нікотинових рецепторів, особливо на рівні центральної нервової системи. Завжди існує необхідність у виявленні і одержанні продуктів, які мають афінність до нікотинових рецепторів. Винахід відповідає цій меті, пропонуючи нові сполуки, які мають афінність до нікотинових рецепторів. Об'єктом даного винаходу є сполуки, які відповідають загальній формулі (І): в якій: R означає або атом водню або галогену; або гідроксил, (С1-C6)алкокси, (С3-С7)циклоалкіл-О- або (С3-С7)циклоалкіл-(С1-С3)алкілен-О-; або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С 1C6)алкілу, (С3-С7)циклоалкілу, (С3-С7)циклоалкіл-(С1-С3)алкілену, (С1-C6)алкокси, (С3С7)циклоалкіл-О-, (С3-С7)циклоалкіл-(С1-C3)алкілен-О-, (С1-C6)фторалкілу, (С1-C6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С 1-C6)алкіламіногрупи або ді(С1C6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-C6)алкілену, гетероарилу, гетероарил(С1-C6)алкілену, арил-О-, -С(О)-(С1-C6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3; n означає 1 або 2; m означає 1 або 2; о означає 1 або 2; причому випадок, де n і о = 1 і m = 2 виключається; і причому виключаються наступні сполуки: -4-(6-фторпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; -4-(6-хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; -4-(6-бромпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; -4-(піридин-3-іл)-1-азабіцикло[2.2.1]гептан. 4-(6-Фторпіридин-3-іл)-1-азабіцикло[2.2.1]гептан, 4-(6-хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептан, 4-(6-бромпіридин-3-іл)-1-азабіцикло[2.2.1]гептан і 4-(піридин-3-іл)-1-азабіцикло[2.2.1]гептан описуються в Міжнародній патентній публікації WO95/03306A як артроподицидні сполуки. Сполуки формули (І) можуть включати один або декілька стереогенних центрів, як, наприклад один або декілька асиметричних атомів вуглецю. Отже, вони можуть існувати в формі енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їх суміші, включно рацемічні суміші, становлять частину винаходу. Сполуки формули (І) також можуть існуватися у вигляді основ або адитивних солей кислот. Такі адитивні солі становлять частину винаходу. Ці солі можуть бути одержані з фармацевтично прийнятними кислотами, однак, солі інших кислот, придатні, наприклад для очищення або виділення сполук формули (І), також становлять частину винаходу. Сполуки формули (І) можуть існувати в формі гідратів або сольватів, а саме, в формі асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також становлять частину винаходу. У рамках даного винаходу: 1 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 60 - під позначенням (Ct-Cz), де t і z можуть приймати значення від 1 до 7, розуміють вуглецевий ланцюг, який може включати від t до z атомів вуглецю, наприклад (С1-C3) означає вуглецевий ланцюг, який може включати від 1 до 3 атомів вуглецю; - під атомом галогену розуміють атом фтору, хлору, брому або іоду; - під алкілом розуміють лінійну або розгалужену насичену аліфатичну групу. Як приклади можна назвати групи: метил, етил, пропіл, ізопропіл, бутил, ізобутил, тре-бутил, пентіл і т.д.; - під алкокси розуміють радикал -О-алкіл, алкільна група якого являє собою таку, як вказана вище; - під алкіленом розуміють лінійну або розгалужену насичену двовалентну алкільну групу, наприклад С1-3-алкілен означає лінійний або розгалужений двовалентний вуглецевий ланцюг з 1-3 атомів вуглецю, наприклад метилен, етилен, 1-метилетилен, пропілен; - під циклоалкілом розуміють циклічну вуглецеву групу. Як приклад можна назвати групи: циклопропіл, циклобутил, циклопентіл, циклогексил, і т.д.; - під фторалкілом розуміють алкіл, один або декілька атомів водню в якому замінені атомом фтору; - під фторалкокси розуміють алкокси, один або декілька атомів водню в якому замінені атомом фтору; - під гетероциклоалкілом розуміють 3-7-членну циклічну групу, яка містить 1-2 гетероатоми, які вибираються з О, S або N; як приклади гетероциклоалкілів можна назвати групи: піролідиніл, піперазиніл, морфолініл; - під арилом розуміють циклічну ароматичну групу, яка включає від 6 до 10 атомів вуглецю. Як приклади арильних груп можна назвати феніл або нафтил; - під гетероарилом розуміють 5-15-членну частково насичену або ароматичну циклічну групу, яка містить від 1 до 4 гетероатомів, які вибираються з О, S або N. Як приклад можна назвати групи: індоліл, фурил, піроліл, тіазоліл, піразоліл, піридиніл, піримідиніл, бензодіоксоліл, бензофурил, бензотієніл, бензоксадіазоліл, бензотріазоліл, хінолініл, ізохінолініл, дибензофурил, дибензотієніл, імідазоліл, триазоліл, тетразоліл, оксазоліл, оксадіазоліл, тіадіазоліл, тієніл, ізоксазоліл, ізотіазоліл. Серед сполук формули (І), об'єктів винаходу, перша підгрупа сполук утворена сполуками, в яких: R означає або атом водню або галогену; або гідроксил; або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С 1C6)алкілу, (С1-C6)алкокси, (С1-C6)фторалкілу, (С1-C6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С1-C6)алкіламіногрупи або ді(С1-C6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-C6)алкілену, гетероарилу, арил-О-, -С(О)-(С1-C6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН 3)3; позначає 1 або 2; m означає 1 або 2; о означає 1 або 2. Серед сполук формули (І), об'єктів винаходу, друга підгрупа сполук утворена сполуками, в яких: R означає або атом галогену, більш конкретно, атом хлору; або гідроксил; або гетероциклоалкіл, більш конкретно, піролдиніл або піперазиніл, або арил, більш конкретно, феніл або нафтил, або гетероарил, більш конкретно, піразоліл, індоліл, піридиніл, бензофурил, хінолініл, бензотієніл, фурил, дибензофурил, піроліл, піримідиніл, бензотриазоліл, дибензотієніл, бензоксадіазоліл, тіазоліл або ізохінолініл; причому ця група, необов'язково може бути заміщена однією або декількома групами, більш конкретно, однією або двома групами, які вибираються з атомів галогенів, більш конкретно, атома фтору, (С 1-C6)алкілу, більш конкретно, мітилу, (С1-C6)алкокси, більш конкретно, метоксигрупи, (С1-C6)фторалкілу, більш конкретно, трифторметилу, (С1-C6)фторалкокси, більш конкретно, трифторметоксигрупи, ді(С 1C6)алкіламіногрупи, більш конкретно, диметиламіногрупи, гетероциклоалкілу, більш конкретно, морфолінілу, піролідинілу або піперазинілу, арилу, більш конкретно, фенілу, арил-(С1C6)алкілену, більш конкретно, бензилу, гетероарилу, більш конкретно, піразолілу, арил-О-, більш конкретно, феноксигрупи, -С(О)-(С1-C6)алкілу, більш конкретно, -С(О)-СН3; причому гетероциклоалкіл необов'язково заміщений С(О)О(СН 3)3; 2 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 60 n означає 1 або 2; m означає 1 або 2; о означає 1. Серед сполук формули (І), об'єктів винаходу, і другої підгрупи, вказаної вище, третя підгрупа сполук утворена сполуками, в яких n і m і о означають 1. Серед сполук формули (І), об'єктів винаходу, і другої підгрупи, вказаної вище, четверта підгрупа сполук утворена сполуками, в яких n і m означають 2, і о означає 1. З сполук формули (І), об'єктів винаходу, можна назвати, зокрема наступні сполуки: 1. 4- [6-(1-метил-1 Н-піразол-4-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 2. 5-[6-(1-метил-1Н-піразол-4-іл)гаридин-3-іл]-1-азабіцикло[3.3.1]нонан 3. 5-[6-(3,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 4. 5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-ол 5. 5-(6-хлорпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 6. 5-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]-1-метил-1Н-індол 7. 5-(1-азабіцикло[3.3.1]нон-5-іл)-2,4'-біпіридин 8. 4-[6-(4-фторфеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 9. 4-[6-(1-бензофур-2-ил)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 10. 5-[6-(1-бензофур-2-ил)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 11. 5-(1-азабіцикло[2.2.1]гепт-4-іл)-2,4'-біпіридин 12. 6-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]хінолін 13. 4-[6-(4-бензилпіперазін-1-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 14. 4-[6-(1-бензотієн-2-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 15. 5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-ол 16. 4-[6-(1,3-бензодіоксол-5-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 17. 4-[6-(3,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 18. 4-{6-[3-(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[2.2.1]гептан 19. 4-[6-(3-фторфеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 20. 5-[6-(3-фторфеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 21. 4-[6-(3-фурил)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 22. 4-(6-дибензо[b,d]фур-4-илпіридин-3-іл)-1-азабіцикло[2.2.1]гептан 23. 3-[5-(1-азабіцикло[2,2.1]гепт-4-іл)піридин-2-іл]хінолін 24. 5-(1-азабіцикло[2.2.1]гепт-4-іл)-2,3'-біпіридин 25. 4-{6-[4-(трифторметокси)феніл]піридин-3-іл}-1-азабіцикло[2.2.1]гептан 26. 5-[6-(1-бензотієн-2-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 27. 4-[6-(4-фтор-2-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 28. 4-[6-(1H-пірол-3-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 29. 4-(6-піролідин-1-ілпіридин-3-іл)-1-азабіцикло[2.2.1]гептан 30. 5-(6-дібензо[b,d]фур-4-илпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 31. 5-[6-(1,3-бензодіоксол-5-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 32. 6-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]хінолін 33. 5-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]-1-метил-1H-індол 34. 5-[6-(1H-пірол-3-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 35. 5-{6-[3-(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 36. 5-[6-(4-фторфеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 37. 4-(6-піримідин-5-ілпіридин-3-іл)-1-азабіцикло[2.2.1]гептан 38. 4-[6-(2,4-диметоксипіримідин-5-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 39. 5-(6-біфеніл-4-ілпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 40. 5-[6-(3-фурил)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 41. 5-(1-азабіцикло[3.3.1]нон-5-іл)-2,3'-біпіридин 42. 5-{6-[4-(трифторметокси)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 43. 5-[6-(4-фтор-2-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 44. 3-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]хінолін 45. 4-(6-біфеніл-4-ілпіридин-3-іл)-1-азабіцикло[2.2.1]гептан 46. 8-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]хінолін 47. 1-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]-1Н-1,2,3-бензотриазол 48. 5-(6-дибензо[b,d]тієн-2-ілпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 49. 5-[6-(4-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 50. 5-[6-(3-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 51. 5-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]-2,1,3-бензоксадіазол 52. 4-[6-(2-морфолін-4-ілпіримідин-5-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 3 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 60 53. 4-[6-(1-метил-1Н-пірол-2-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 54. 4-[6-(3-фтор-5-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 55. 4-[6-(3-фтор-4-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 56. 4-[6-(2-фтор-3-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 57. 5-[6-(3-фтор-4-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 58. 5-[6-(2-фтор-3-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 59. 5-[6-(1-метил-1H-пірол-2-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 60. 5-[6-(2-фурил)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 61. 5-{6-[3-(1Н-піразол-1-іл)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 62. 4-[6-(тіазол-2-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 63. 5-(6-піримідин-5-ілпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 64. 5-[6-(1-нафтил)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 65. 5-[6-(2-морфолін-4-ілпіримідин-5-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 66. 5-[6-(2,4-диметоксипіримідин-5-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 67. 5-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]-2,1,3-бензоксадіазол 68. 5-(6-фенілпіридин-3-іл)-1-азабіцикло[3.3.1]нонан 69. 5-[6-(2,5-диметоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 70. 5-{6-[4-(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 71. 5-(1-азабіцикло[3.3.1]нон-5-іл)-4'-метокси-2,3'-біпіридин 72. 4-[5-(1-азабіцикло[3.3.1]нон-5-щ)піридин-2-іл]ізохінолін 73. 5-{6-[3,5- біс(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 74. 5-[6-(тіазол-2-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 75. 5-[6-(4-феноксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 76. 5-[6-(2-фторфеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 77. 5-(1-азабіцикло[3.3.1]нон-5-іл)-6'-піролідин-1-іл-2,3'-біпіридин 78. тре-бутил-4-[5-(1-азабіцикло[3.3.1]нон-5-іл)-2,3'-біпіридин-6'-іл]піперазін-1-карбоксилат 79. 5-[6-(2-метоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 80. 5-[6-(2,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 81. 5-{6-[3-(трифторметокси)феніл]піридин-3-іл}-1-азабіцикло[3.3.1]нонан 82. 3-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]-N,N-диметиламінофеніл 83. 4-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]ізохінолін 84. 5-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]ізохінолін 85. 4-(6-фенілпіридин-3-іл)-1-азабіцикло[2.2.1]гептан 86. 4-{6-[3.5-біс(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[2.2.1]гептан 87. 5-(1-азабіцикло[2.2.1]гепт-4-іл)-4'-метокси-2,3'-біпіридин 88. тре-бутил-4-[5-(1-азабіцикло[2.2.1]гепт-4-іл)-2,3'-біпіридин-6'-іл]піперазін-1-карбоксилат 89. 5-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]ізохінолін 90. 5-(1-азабіцикло[2.2.1]гепт-4-іл)-6'-фтор-2,3'-бітридин 91. 5-(1-азабіцикло[3.3.1]нон-5-іл)-2'-фтор-2,3'-біпіридин 92. 4-[6-(2-метоксифеніл)піридин-3-іл]-1-азабіцикл о [2.2.1]гептан 93. 4-[6-(2,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 94. 4-[6-(2,5-диметоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 95. 4-[6-(2-фторфеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 96. 4-[6-(4-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 97. 4-[6-(2-нафтил)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 98. 4-[6-(4-феноксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 99. 4-{6-[2-(трифторметил)феніл]піридин-3-іл}-1-азабіцикло[2.2.1]гептан 100. 5-[6-(2-нафтил)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 101. 5-(1-азабіцикло[2.2.1]гепт-4-іл)-2'-фтор-2,3'-біпіридин 102. 5-(1-азабіцикло[3.3.1]нон-5-іл)-6'-фтор-2,3'-біпіридин 103. 4-[6-(3-трифторметоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 104. 5-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]хінолін 105. 5-[6-(2-фторбіфеніл-4-іл)піридин-3-іл]-1-азабіцикло[3.3.1]нонан 106. 1-{3-[5-(1-азабіцикло[3.3.1]нон-5-іл)піридин-2-іл]феніл}етанон 107. 1-{3-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]феніл}етанон 108. 4-(6-(4-метилфеніл)піридин-3-іл)-1-азабіцикло[2.2.1]гептан 109. 4-[6-(2-фторбіфеніл-4-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 110. 5-[5-(1-азабіцикло[2.2.1]гепт-4-іл)піридин-2-іл]хінолін 111. 4-[6-(3-метоксифеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 112. 4-[6-(3,4-дифторфеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан 4 UA 97833 C2 5 10 15 20 25 30 35 40 45 113. 4-[6-(3-піразол-1-ілфеніл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан. У нижченаведеному контексті, під захисною групою розуміють групу, яка дозволяє, з одного боку, захищати реакційно-здатну функціональну групу, таку, як гідроксил або амін, під час синтезу і, з іншого боку, дегенерувати інтактну реакційно-здатну функціональну групу в кінці синтезу. Приклади захисних груп, а також способи захисту і видалення захисту представлені в посібнику Green et al. «Protective Groups in Organic Synthesis», друге видання (John Wiley and Sons, Inc., Нью-Йорк), 1991. У нижченаведеному контексті, під групою, що видаляється розуміють групу, яка може бути легко відщеплена від молекули шляхом розриву гетеролітичного зв'язку з розділенням електронної пари. Ця група також може бути легко замінена іншою групою, наприклад під час реакції заміщення. Такими групами, що видаляються є, наприклад галогени або активована гідроксильна група, така як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат, і т.д. Приклади груп, що видаляються, а також посилання на їх одержання представлені в посібнику J. March «Advances in Organic Chemistry», третє видання, Wiley Interscience, 1985, стор. 310-316. Згідно з винаходом і у випадку, де n і m і о означають 1, сполуки загальної формули (І) можна одержувати способом, представленим на нижченаведеній схемі 1. Сполуку формули (II) вводять у взаємодію з етилбромуцетатом загальної формули (III), в якій R1 означає (С1-C4)алкіл, в присутності основи, такої як діізопропіламід літію, одержуючи сполуку загальної формули (IV). Гідрування нітрильної функціональної групи в атмосфері водню при тиску від 1 до 6 атмосфер в присутності каталізатора, такого як, наприклад нікель Ренея, приводить до сполуки загальної формули (V). Сполуку загальної формули (V) відновлюють за допомогою відновника, такого як, наприклад літійалюмінійгідрид, одержуючи сполуку формули (VI). Сполуку формули (VI) перетворюють в сполуку формули (VII), наприклад в присутності концентрованої бромоводневої кислоти. Сполуку формули (VII) в лужному середовищі вводять у взаємодію з основою, такою як карбонат натрію, одержуючи сполуку формули (VIII). Обробка цієї сполуки, наприклад оксихлоридом фосфору, приводить до сполуки формули (IX). Сполуки загальної формули (І) потім можуть бути одержані із сполуки формули (IX) відповідно до будьяких відомих фахівцеві в даній галузі способів, таких як, наприклад: - за допомогою боронової кислоти формули R-B(OH)2, в якій R має вказане у випадку загальної формули (І) значення, в присутності каталізатора на основі паладію, як, наприклад тетракистрифенілфосфінпаладій; - за допомогою сполуки формули R-H, в якої R має вказане у випадку загальної формули (І) значення, в присутності або відсутності сильної основи, як, наприклад гідрид натрію, в розчиннику, наприклад в диметилформаміді, або без розчинника; - за допомогою сполуки формули R-H, в якій R має вказане у випадку загальної формули (І) значення, в присутності основи, як, наприклад тре-бутилат натрію, каталізатора на основі паладію, як, наприклад ацетат паладію(ll), і лігандау, як, наприклад 2-дициклогексилфосфіно-2'(N,N-диметиламіно)біфеніл; - за допомогою похідної формули R-Sn(CH2)[3CH3)]3, яка містить двовалентне олово, в якій R має вказане у випадку загальної формули (І) значення, в присутності каталізатора на основі паладію, як, наприклад біс(трифенілфосфін)дихлорпаладій; - за допомогою сполуки формули R-H, в якій R має вказане у випадку загальної формули (І) значення, в присутності н-бутилітію, хлориду цинку і каталізатора на основі паладію, як, наприклад тетракистрифенілфосфінпаладій. 5 UA 97833 C2 5 Згідно з винаходом і у випадку, де n і m означають 2 і о означає 1, сполуки загальної формули (І) можна одержувати способом, представленим на нижченаведеній схемі 2. Сполуку формули (II) вводять у взаємодію з етилакрилатом загальної формули (X), в якій R1 означає (С1-С4)алкіл, в присутності основи, такої як тритон В, одержуючи сполуку загальної формули (XI). Сполуку загальної формули (І) одержують потім з проміжних продуктів (XII)-(XVI) згідно з стадіями, аналогічним стадіями, які дозволяють одержувати проміжні продукти (IV)-(IX), як описується вище на схемі 1. 10 6 UA 97833 C2 5 10 15 20 25 30 Сполука формули (II) є доступною при використанні способів, які описуються в літературі, як, наприклад в Міжнародній патентній публікації WO2004/111031. На схемах 1 і 2, початкові сполуки і реагенти, коли спосіб їх одержання не описаний, є комерційно доступними або описуються в літературі або ж можуть бути одержані способами, які там описані, або які відомі фахівцеві в даній галузі. Сполуки загальної формули (І), придатні іншим значенням n, m і о, можуть бути одерлсані шляхом адаптації способів, представлених на схемах 1 і 2, згідно з класичними методами синтезу органічної хімії, фахівцем, який адаптується в даній галузі. Об'єктом даного винаходу, згідно іншого з його аспектів, також є сполуки формул (III)-(XVI). Ці сполуки придатні як проміжні продукти синтезу сполук загальної формули (І). Зокрема об'єктом даного винаходу є проміжний продукт формули (XVI). У нижченаведених прикладах описується одержання деяких сполук згідно з винаходом. Ці приклади не є такими, які обмежують об'єм винаходу і призначені тільки для пояснення даного винаходу. Номери сполук, вказані в дужках в заголовках, відповідають таким, вказаним в першій колонці нижченаведеної таблиці, в якій представлені хімічні структури і фізичні властивості деяких сполук згідно з винаходом. Приклад 1 (сполука № 4) 5-(1-Азабіцикло[3.3.1]нон-5-іл)піридин-2-ол 1.1 Дієтил-4-ціано-4-(6-метоксипіридин-3-іл)гептандіоат У колбу місткістю 250 мл в атмосфері аргону вводять 2,775 г (18,73 моль) (6метоксипіридин-3-іл)ацетонітрилу (WO2004/111031) в 125 мл безводного ацетонітрилу. Додають 0,87 мл (1,87 моль) тритону В (40%-ний розчин в метанолі), реакційну суміш доводять до температури кипіння із зворотним холодильником, потім по краплях додають 20,40 мл (187,30 моль) етилакрилату. Реакційне середовище після цього перемішують при кип'ятінні із зворотним холодильником протягом 48 годин, охолоджують до кімнатної температури і концентрують при зниженому тиску. Таким чином одержаний залишок виливають в насичений водний розчин хлориду амонію, екстрагують два рази дихлорметаном. Органічні фази об'єднують, сушать над сульфатом натрію, відфільтровують і концентрують при зниженому тиску. Одержаний залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1. Одержують 7,981 г продукту у вигляді масла жовтогарячого кольору. 7 UA 97833 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н-ЯМР (CDCІ3; 200 МГц): δ (м.д.): 8,18 (д, 1H); 7,45 (дд, 1Н); 6,71 (д, 1H); 4,00 (кв, 4Н); 3,87 (с, 3Н); 2,55-1,97 (м, 8Н); 1,14 (т, 6Η). 1.2 Етил-3-[3-(6-метоксипіридин-3-іл)-6-оксопіперидин-3-іл]-пропаноат У колбу для гідрування вводять 1,999 г (5,74 моль) дієтил-4-ціано-4-(6-метоксипіридин-3іл)гептандіоату, такого, як одержаний на стадії 1.1, у вигляді розчину в 115 мл етилового спирту, в присутності 50% у воді нікелю Ренея (0,1 екв.). Середовище перемішують при тиску водню близько 5 атмосфер при температурі 60°С протягом 6 годин, потім його фільтрують через діатомову землю, і розчинник видаляють шляхом випаровування при зниженому тиску. Одержаний залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1, з одержанням 1,231 г бажаної сполуки у вигляді воскоподібної речовини жовтого кольору. 1 Н-ЯМР (CDCІ3; 200 МГц): δ (м.д.): 8,13 (д, 1H); 7,55 (дд, 1H); 6,80 (д, 1H); 6,45 (шир.с, 1H); 4,09 (кв, 2Н); 3,96 (с, 3Н); 3,80-3,37 (АВ, 2Н); 2,52-1,88 (м, 8Н); 1,21 (т, 3Н). 1.3 3-[3-(6- Метоксипіридин-3-іл)піперидин-3-іл]пропан-1-ол У колбу ємністю 250 мл при кімнатній температурі вводять 2,321 г (7,58 моль) етил-3-[3-(6метоксипіридин-3-іл)-6-оксопіперидин-3-іл]пропаноату, одержаного на стадії 1.2, у вигляді розчину в 128 мл безводного тетрагідрофурану. Додають порціями 2,876 г (75,8 моль) літійалюмінійгідриду, одержану суміш потім перемішують при кімнатній температурі протягом 3 годин. Цю суміш після цього гідролізують за допомогою насиченого водного розчину сульфату натрію, фільтрують через цілит і концентрують при зниженому тиску. Одержаний залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1, з одержанням 1,80 г бажаної сполуки у вигляді воскоподібної речовини жовтого кольору. 1 Н-ЯМР (CDCІ3; 200 МГц): δ (м.д.): 7,94 (д, 1Н); 7,37 (дд, 1H); 6,57 (д, 1H); 3,78 (с, 3Н); 3,31 (т, 2Н); 3,12-2,70 (АВ, 2Н); 2,65 (т, 2Н); 2,11 (шир.с, 2Н); 2,01-0,97 (м, 8Н). 1.4 Гідробромід (1:1) 5-[3-(3- бромпропіл)піперидин-3-іл]піридин-2-олу У пробірку, що герметично закривається вводять 0,100 г (0,4 моль) 3-[3-(6-метоксипіридин-3іл)піперидин-3-іл]пропан-1-олу, одержаного на стадії 1.3, у вигляді розчину в 5 мл водного розчину бромоводню (48% мас. розчин). Реакційне середовище перемішують при температурі 110°С протягом 12 годин. Потім цей розчин приводять назад до кімнатної температури, концентрують при зниженому тиску. Одержаний залишок два рази розчиняють в метанолі і випаровують при зниженому тиску, розтирають в діетиловому ефірі, одержуючи після фільтрації 0,150 г бажаної сполуки у вигляді порошку каштанового кольору. Температура плавлення: 230°С. 1 Н- ЯМР (D2O; 200 МГц): δ (м.д.): 7,88 (дд, 1H); 7,51 (д, 1H); 6,80 (д, 1H); 3,65-3,27 (АВ, 2Н); 3,31 (т, 2Н); 3,24-2,90 (м, 2Н); 2,32-1,25 (м, 8Н). 1.5 5-(1-Азабіцикло[3.3.1]нон-5-іл)піридин-2-ол (сполука № 4) У колбу ємністю 250 мл вводять 2,17 г (5,71 моль) гідробромиду (1:1) 5-[3-(3бромпропіл)піперидин-3-іл]піридин-2-олу, одержаного на стадії 1.4, у вигляді розчину в 114 мл хлороформу і 40 мл води. Додають 3,94 г (28,54 моль) карбонату натрію, і реакційну суміш перемішують при температурі 80°С протягом 2 годин. Цю суміш потім приводять назад до кімнатної температури, виливають в ділильну воронку і екстрагують два рази хлороформом. Органічні фази об'єднують, сушать над сульфатом натрію, відфільтровують і концентрують при зниженому тиску. Таким чином одержаний залишок розтирають в діетиловому ефірі, одержуючи після фільтрації і висушування 0,813 г бажаної сполуки у вигляді порошку білого кольору. Температура плавлення: 191-192°С. 1 6 Н-ЯМР (d -ДМСО; 200 МГц): δ (м.д.): 7,89 (дд, 1H); 7,41 (д, 1H); 6,65 (д, 1H); 3,70-3,34 (м, 6Н); 2,70-1,83 (м, 8Н). Приклад 2 (сполука № 5) 5-(6-Хлорпіридин-3-іл)-1-азабіцикло[3,3.1]нонан У пробірку, що герметично закривається вводять 1 г (4,59 моль) 5-(1-азабіцикло[3.3.1]нон-5іл)піридин-2-олу, одержаного в прикладі 1, у вигляді розчину в 12,8 мл (137,7 моль) оксихлориду фосфору, і потім перемішують при температурі 140°С протягом 45 хвилин. Реакційну суміш після цього приводять назад до кімнатної температури, виливають на 200 г подрібненого льоду і перемішують протягом 15 хвилин. Потім дуже повільно реакційну суміш доводять до значення рН 10 за допомогою концентрованого розчину гідроксиду натрію. Реакційну суміш після цього екстрагують два рази хлороформом, органічні фази потім об'єднують, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску, одержуючи 461 мг бажаної сполуки у вигляді порошку каштанового кольору. Температура плавлення: 245-246°С. 8 UA 97833 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H- ЯМР (CDCІ3; 200 МГц): δ (м.д.): 8,29 (д, 1Н); 7,55 (дд, 1H); 7,23 (д, 1H); 3,30-3,10 (м, 6Н); 2,42-2,00 (м, 4Н); 1,92-1,63 (м, 4Н). Приклад 3 (сполука № 3) Гідрохлорид (2:1) 5-[6-(3,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло[3.3.1]нонану У колбу ємністю 100 мл вводять 0,055 г (0,23 моль) 5-(6-хлорпіридин-3-іл)-1азабіцикло[3.3.1]нонану, одержаного в прикладі 2, у вигляді розчину в 12 мл суміші 1,2диметоксієтан/вода в співвідношенні 8/4. Потім послідовно в атмосфері аргону вводять 0,106 г (0,58 моль) 3,4-диметоксифенілборонової кислоти, 0,08 г (0,58 моль) карбонату калію і 0,024 г (0,03 моль) дихлорбіс(трифенілфосфін)паладію(П). Суміш нагрівають при температурі 110°С протягом 2 годин, охолоджують до кімнатної температури і виливають в 300 мл насиченого водного розчину карбонату натрію. Водну фазу екстрагують два рази за допомогою 100 мл хлороформу, об'єднані органічні фази сушать над сульфатом натрію і концентрують їх при зниженому тиску. Залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1. Одержану в формі основи сполуку (5-[6-(3,4-диметоксифеніл)піридин-3-іл]-1-азабіцикло [3.3.1]нонан) перетворюють в гідрохлорид шляхом додання двох еквівалентів хлористого водню у вигляді 5-6 н. розчину в ізопропіловому спирті. Після розтирання за допомогою діетилового ефіру одержують 0,035 г очікуваного продукту у вигляді порошку жовтого кольору. Температура плавлення: 235-236°С. 1 6 Н-ЯМР (d -ДМСО) δ (м.д.): 8,57 (з, 1Н); 7,84-7,50 (м, 4Н); 7,01 (д, 1Н); 3,82 (з, 3Н); 3,77 (з, 3Н); 3,30 (шир.с, 2Н); 3,13-2,83 (м, 4Н); 2,31-1,95 (м, 4Н); 1,88-1,61 (м, 2Н); 1,55-1,33 (м, 2Н). Приклад 4 (сполука № 15) 5-(1-Азабіцикло[2.2.1]гепт-4-іл)піридин-2-ол 4.1 Дієтил-3-ціано-3-(6-метоксипіридин-3-іл)пентандіоат У тригорлу колбу ємністю 100 мл в атмосфері аргону і при температурі -78°С вводять 10,12 мл (20,25 моль)діїзопропіламіду літію в 22 мл безводного тетрагідрофурану. Додають 1,00 г (6,75 моль) (6-метоксипіридин-3-іл)ацетонітрилу (WO2004/111031) у вигляді розчину в 5 мл безводного тетрагідрофурану. Реакційну суміш потім обережно доводять до температури 0°С і перемішують при цій температурі протягом однієї години. Після цього реакційну суміш охолоджують до темпрератури -78°С і додають по краплях 2,25 мл (20,25 моль) етилбромуцетату. Одержану суміш потім повільно приводять зворотно до кімнатної температури, потім витримують при перемішуванні протягом 12 годин. Реакційне середовище після цього виливають в насичений водний розчин хлориду амонію, екстрагують два рази діетиловим ефіром. Органічні фази об'єднують, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Одержаний залишок очищують колоночною хроматографією на силікагелі, елююючи сумішшю циклогексану і етилацетату в пропорціях 90/10. Одержують 1,758 г продукту у вигляді масла каштанового кольору. 1 Н- ЯМР (CDCІ3; 200 МГц): δ (м.д.): 8,08 (д, 1H); 7,49 (дд, 1H); 6,55 (д, 1Н); 3,90 (кв, 4Н); 3,72 (з, 3Н); 3,11-2,79 (АВ, 4Н); 0.97 (т, 6Η). 4.2 Етил-[3-(6-метоксипіридин-3-іл)-5-оксопіролідин-3-іл]ацетат У колбу для гідрування вводять 2,990 г (9,33 моль) дієтил-3-ціано-3-(6-метоксипіридин-3іл)пентандіоату, такого, як одержаний на стадії 4.1, у вигляді розчину в 186 мл етилового спирту, в присутності 50% у воді нікелю Ренея (0,1 екв.). Середовище перемішують при тиску водню близько 5 атмосфер при температурі 60°С протягом 6 годин, потім фільтрують через діатомову землю, і розчинник видаляють шляхом випаровування при зниженому тиску. Одержаний залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/1/1, з одержанням 1,5 г бажаної сполуки у вигляді воскоподібної речовини жовтого кольору. 1 Н- ЯМР (CDCІ3; 200 МГц): δ (м.д.): 7,93 (д, 1H); 7,37 (дд, 1Н); 6,66 (д, 1Н); 6,52 (шир.с, 1H); 3,91 (кв, 2Н); 3,85 (з, 3Н); 3,84-3,57 (АВ, 2Н); 2,71 (т, 4Η); 1,04 (т, 3Н). 4.3 2-[3-(6-Метоксипіридин-З-іл)піролідин-3-іл]етанол У колбу ємністю 250 мл вводять при кімнатній температурі 1,50 г (5,39 моль) етил-[3-(6метоксипіридин-3-іл)-5-оксопіролідин-3-іл]ацетату, одержаного на стадії 4.2, у вигляді розчину в 90 мл безводного тетрагідрофурану. Додають порціями 2,046 г (53,90 моль) літійалюмінійгідриду, одержану суміш потім перемішують при кімнатній температурі протягом 3 годин. Цю суміш потім гідролізують за допомогою насиченого водного розчину сульфату натрію, фільтрують через ці лит і концентрують при зниженому тиску. Одержаний залишок очищують колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/1/1, з одержанням 0,41 г бажаної сполуки у вигляді воскоподібної речовини жовтого кольору. 9 UA 97833 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (CDCІ3; 200 МГц): δ (м.д.): 7,95 (д, 1Н); 7,39 (дд, 1H); 6,64 (д, 1H); 3,83 (з, 3Н); 3,602,91 (м, 8Н); 2,09 (т, 2Н); 1,92-1,64 (м, 2Н). 4.4 Гідробромід (1:1) 5-[3-(2-брометил)піролідин-3-іл]піридин-2-олу У пробірку, що герметично закривається вводять 0,32 г (1,44 моль) 2-[3-(6-метоксипіридин-3іл)піролідин-3-іл]етанолу, одержаного на стадії 4.3, у вигляді розчину в 7,2 мл водного розчину бромистого водню (48% мас. розчин). Реакційну суміш перемішують при температурі 160°С протягом 5 годин. Після цього цей розчин приводять назад до кімнатної температури, концентрують при зниженому тиску. Одержаний залишок два рази розчиняють в метанолі і випаровують при зниженому тиску, розтирають в діетиловому ефірі, одержуючи після фільтрації 0,5 г бажаної сполуки у вигляді смолоподібної речовини каштанового кольору. 1 H-ЯМР (D2O; 200 МГц): δ (м.д.): 7,72 (дд, 1H); 7,49 (д, 1H); 6,65 (д, 1H); 3,78-2,90 (м, 6Н); 2,55-2,05 (м, 4Н). 4.5 5-(1-Азабіцикло[2.2.1]гепт-4-іл)піридин-2-ол (сполука № 15) У колбу ємністю 250 мл вводять 1,5 г (4,26 моль) гідробромиду (1:1) 5-[3-(2брометил)піролідин-3-іл]піридин-2-олу, одержаного на стадії 4.4, у вигляді розчину в 85 мл хлороформу і 10 мл води. Додають 2,944 г (21,3 моль) карбонату натрію, і реакційну суміш перемішують при температурі 60°С протягом 3 годин. Цю суміш потім приводять назад до кімнатної температури, виливають в ділильну воронку і екстрагують два рази хлороформом. Органічні фази об'єднують, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Таким чином одержаний залишок розтирають в діетиловому ефірі, одержуючи після фільтрації і висушування 0,265 г бажаної сполуки у вигляді порошку каштанового кольору. Температура плавлення: 170-172°С. 1 6 H-ЯМР (d -ДМСО; 200 МГц): δ (м.д.): 7,48 (дд, 1H); 7,08 (д, 1Н); 6,27 (д, 1Н); 2,94-2,74 (м, 2Н); 2,65-2,42 (м, 2Н); 2,35 (з, 2Н); 1,75-1,50 (м, 2Н); 1,50-1,33 (м, 2Н). Приклад 5 (сполука № 1) Гідрохлорид (2:1) 4-[6-(1-метил-1Н-піразол-4-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептану 5.1 4-(6-Хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептан У пробірку, що герметично закривається вводять 0,37 г (1,94 моль) 5-(1азабіцикло[2.2.1]гепт-4-іл)піридин-2-олу, одержаного в прикладі 4, у вигляді розчину в 5,44 мл (58,35 моль) оксихлориду фосфору, і потім перемішують при температурі 140°С протягом 45 хвилин. Реакційну суміш після цього приводять назад до кімнатної температури, виливають на 200 г подрібненого льоду і перемішують протягом 15 хвилин. Потім середовище дуже повільно доводять до значення рН 10 за допомогою концентрованого розчину гідроксиду натрію. Реакційну суміш потім екстрагують два рази хлороформом, органічні фази об'єднують, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску, одержуючи 370 мг бажаної сполуки у вигляді порошку каштанового кольору. Температура плавлення: 70-72°С. 1 H-ЯМР (ДМСО; 200 МГц): δ (м.д.): 8,36 (д, 1H); 7,80 (дд, 1Н); 7,41 (д, 1H); 3,00-2,79 (м, 2Н); 2,78-2,49 (м, 2H); 2,58 (з, 2Н); 1,82-1,51 (м, 4Н). 5.2 Гідрохлорид (2:1) 4-[6-(1-метил-1H-піразол-4-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептану (сполука № 1) У колбу ємністю 100 мл вводять 0,055 г (0,26 моль) 4-(6-хлорпіридин-3-іл)-1азабіцикло[2.2.1]гептану, одержаного на стадії 5.1, у вигляді розчину в 12 мл суміші 1,2диметоксієтан/вода в співвідношенні 8/4. Потім послідовно в атмосфері аргону вводять 0,137 г (0,66 моль) 1-метил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразолу, 0,091 г (0,66 моль) карбонату калію і 0,028 г (0,04 моль) дихлорбіс(трифенілфосфін)паладію(ll). Суміш нагрівають при температурі 110°С протягом 2 годин, охолоджують її до кімнатної температури і виливають її в 300 мл насиченого водного розчину карбонату натрію. Водну фазу екстрагують два рази за допомогою 100 мл хлороформу, об'єднані органічні фази сушать над сульфатом натрію і концентрують при зниженому тиску. Залишок очищують колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1. Одержану в формі основи сполуку (4-[6-(1-метил-1H-піразол-4-іл)піридин-3-іл]-1азабіцикло[2.2.1]гептан) перетворюють в гідрохлорид шляхом додання двох еквівалентів хлористого водню у вигляді 5-6 н. розчину в ізопропіловому спирті. Після розтирання при використанні діетилового ефіру одержують 0,053 г (62%) очікуваного продукту у вигляді порошку білого кольору. Температура плавлення: 281-283°С 1 6 H-ЯМР (d -ДМСО) δ (м.д.): 8,67 (з, 1H); 8,55 (д, 1H); 8,35 (з, 1H); 8,22 (д, 1H); 8,04 (д, 1H); 3,90 (з, 3Н); 3,60 (з, 2Н); 3,55-3,31 (м, 4Н); 2,31-2,07 (м, 4Н). Приклад 6 (сполука № 13) 10 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 4-[6-(4- Бензилпіперазін-1-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан У атмосфері аргону в колбу ємністю 50 мл, яка містить 0,036 г (0,37 моль) трет-бутилату натрію у вигляді розчину в 5 мл толуолу, попередньо продутих аргоном, вводять 0,055 г (0,32 моль) 1-бензилпіперазину. Потім послідовно додають в атмосфері аргону 0,06 г (0,29 моль) 4(6-хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептану, одержаного на стадії 5.1 прикладу 5, 0,003 г (0,01 моль) ацетату паладію(ІІ) і 0,011 г (0,03 моль) 2-дициклогексилфосфшо-2'-(N,Nдиметиламіно)біфенілу. Суміш нагрівають при температурі 100°С протягом З годин, охолоджують її до кімнатної температури, розбавляють за допомогою 40 мл дихлорметану і виливають в 300 мл насиченого водного розчину карбонату натрію. Водну фазу екстрагують два рази за допомогою 100 мл дихлорметану, об'єднані органічні фази сушать над сульфатом натрію і концентрують при зниженому тиску. Залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 90/10/1. Одержують 0,04 г очікуваного продукту у вигляді порошку бежового кольору. Температура плавлення: 109-111°С. 1 6 Н- ЯМР (d -ДМСО) δ (м.д.): 8,05 (д, 1Н); 7,49 (дд, 1Н); 7,38-7,15 (м, 5Н); 6,73 (д, 1H); 3,50 (з, 2Н); 3,40 (шир.т, 4Н); 3,01-2,79 (м, 2Н); 2,69-2,35 (м, 8Н); 1,78-1,42 (м, 4Н). Приклад 7 (сполука № 29) 4-(6-Піролідин-1-ілпіридин-3-іл)-1-азабіцикло[2.2.1]гептан У пробірку, що герметично закривається, яка містить 0,060 г (0,29 моль) 4-(6-хлорпіридин-3іл)-1-азабіцикло[2.2.1]гептану, одержаного на стадії 5.1 прикладу 5, додають 0,852 г (11,98 моль) піролідину. Суміш нагрівають при температурі 130°С протягом 3 годин, охолоджують її до кімнатної температури, розбавляють за допомогою 40 мл толуолу і концентрують при зниженому тиску. Таким чином одержаний залишок розбавляють за допомогою 50 мл дихлорметану і виливають його в 300 мл насиченого водного розчину карбонату натрію. Водну фазу екстрагують два рази за допомогою 100 мл дихлорметану, об'єднані органічні фази сушать над сульфатом натрію і концентрують при зниженому тиску. Залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 85/15/1,5. Одержують 0,029 г очікуваного продукту у вигляді порошку коричневого кольору. Температура плавлення: 119-121°С. 1 6 H- ЯМР (d -ДМСО) δ (м.д.): 7,99 (д, 1Н); 7,42 (дд, 1H); 6,35 (д, 1Н); 3,43-3,18 (м, 6Н); 2,962,78 (м, 2Н); 2,62-2,44 (м, 2Н); 2,00-1,82 (м, 4Н); 1,75-1,41 (м, 4Н). Приклад 8 (сполука № 62) 4-[6-(Тіазол-2-іл)піридин-3-іл]-1-азабіцикло[2.2.1]гептан У атмосфері аргону в колбу ємністю 50 мл, яка містить 0,055 г (0,26 моль) 4-(6-хлорпіридин3-іл)-1-азабіцикло[2.2.1]гептану, одержаного на стадії 5.1 прикладу 5, у вигляді розчину в 10 мл тетрагідрофурану, послідовно вводять 0,246 г (0,66 моль) 2-трибутилстанілтіазолу і 0,055 г (0,08 моль) хлориду біс(трифенілфосфін)паладію(ll). Суміш кип'ятять з зворотним холодильником протягом 12 годин, охолоджують до кімнатної температури, розбавляють за допомогою 40 мл дихлорметану і виливають в 300 мл насиченого водного розчину хлориду амонію. Водну фазу доводять до значення рН 5 за допомогою 1 н. розчину соляної кислоти. Органічну фазу відділяють, потім водну фазу доводять до значення рН 10 за допомогою порошкоподібного карбонату натрію. Водну фазу екстрагують два рази за допомогою 100 мл дихлорметану, об'єднані органічні фази сушать над сульфатом натрію і концентрують при зниженому тиску. Залишок очищають колоночною хроматографією на силікагелі, елююючи сумішшю хлороформу, метанолу і гідроксиду амонію в пропорціях 95/5/0,5. Одержують 0,038 г очікуваного продукту у вигляді порошку білого кольору. Температура плавлення: 127-129°С. 1 6 Н-ЯМР (d -ДМСО) δ (м.д.): 8,60 (д, 1Н); 8,04 (д, 1H); 7,98-7,82 (м, 2Н); 7,77 (д, 1H); 3,02-2,76 (м, 2Н); 2,70-2,33 (м, 4Н); 1,90-1,51 (м, 4Н). У нижчеприведеній таблиці 1 представлені хімічні структури і фізичні властивості деяких прикладів сполук згідно з винаходом. У колонці «Сіль» цієї таблиці знак «-» означає сполуку в стані основи, «НВr» означає гідробромид і «НСl» означає гідрохлорид. Молярні співвідношення кислота:основа вказуються норуч. «ВОС» означає тре-бутоксикарбоніл. 11 UA 97833 C2 12 UA 97833 C2 13 UA 97833 C2 14 UA 97833 C2 5 10 15 20 Сполуки згідно з винаходом становили об'єкт фармакологічних випробувань, які підкреслили інтерес до них як до активних речовин лікарських засобів. Так, їх досліджували у відношенні їх афінності до нікотинових рецепторів, які містять субодиницю α7, згідно з методами, описаними Mark і Collins в J. Pharmacol. Exp. Ther., 22, 564 (1982), і Mark і інш. в Моl. Pharmacol., 30, 427(1986). Обезголовлюють самців пацюків OFA масою від 150 до 200 г, 1Hвидко витягують весь головний мозок, гомогенізують його за допомогою подрібнювача PolytronTM в 15 об'ємах 0,32 Μ розчину сахарози при температурі 4°С, потім центрифугують при прискоренні 1000 g протягом 10 хвилин. Осад після центрифугування видаляють і супернатант центрифугують при прискоренні 8000 g протягом 20 хвилин при температурі 4°С. Осад після центрифугування рекуперують і гомогенізують за допомогою подрібнювача PolytronTM в 15 об'ємах бідистильованої води при температурі 4°С, потім центрифугують його при прискоренні 8000 g протягом 20 хвилин. Осад після центрифугування видаляють, і супернатант і шар шкіри («лейкоцитна плівка») центрифугують при прискоренні 40000 g протягом 20 хвилин. Осад після центрифугування рекуперують, суспендують в 15 об'ємах бідистильованої води при температурі 4°С і ще раз центрифугують при прискоренні 40000 g протягом 20 хвилин перед його консервацією при температурі -80°С. В день експерименту, тканину повільно розморожують і суспендують в 5 об'ємах буфера. 150 мкл цієї мембранної суспензії попередньо інкубують при температурі 37°С протягом 30 хвилин, в темряві, в присутності або у відсутність сполуки, яка тестується. Потім мембрани 3 інкубують протягом 60 хвилин при температурі 37°С, в темряві, в присутності 50 мкл 1 нМ [ Н]-α 15 UA 97833 C2 5 10 бунгаротоксину в кінцевому об'ємі 250 мкл буфера 20 мМ HEPES, 0,05% поліетиленіміну. Реакцію припиняють шляхом фільтрації через фільтри Whatman GF/CTM, попередньо оброблені протягом 3 годин за допомогою 0,05% поліетиленіміну. Фільтри промивають два рази по 5 мл буфера при температурі 4°С і вимірюють радіоактивність, утриману на кожному фільтрі, за допомогою рідинної сцинтиграфії. Визначають неспецифічне скріплення в присутності кінцевого 1 мкМ α-бунгаротоксину; неспецифічне скріплення становить близько 60% всього скріплення, рекуперуючого на фільтрі. Для кожної концентрації досліджуваної сполуки 3 визначають процент інгібування специфічного скріплення [ Н]-α-бунгаротоксину, потім розраховують СІ50, концентрацію сполуки, яка інгібує 50% специфічного скріплення. СІ50 найбільш афінних сполук згідно з винаходом становить від 0,001 мкМ до 1 мкМ. Експериментальні дані деяких конкретних сполук представлені в нижченаведеній таблиці 2. Таблиця 2 Сполука № 113 16 12 19 15 20 25 30 35 40 45 50 СІ50 α7 (нМ) 4,7 9,1 37,1 13,8 Сполуки згідно з винаходом також досліджували у відношенні їх афінності до нікотинових рецепторів, які містять субодиницю α4β2, згідно з методами, описаними Anderson і Arneric в Eur. J. Pharmacol., 253, 261 (1994), і Hall і інш. в Brain Res., 600, 127 (1993). Обезголовлюють самців пацюків Sprague Dawley масою від 150 до 200 г, швидко витягують весь головний мозок, гомогенізують його в 15 об'ємах 0,32 Μ розчину сахарози при температурі 4°С, потім центрифугують при прискоренні 1000 g протягом 10 хвилин. Осад після центрифугування видаляють, і супернатант центрифугують при прискоренні 20000 g протягом 20 хвилин при температурі 4°С. Осад після центрифугування рекуперують і гомогенізують за допомогою подрібнювана PolytronTM в 15 об'ємах бідистильованої води при температурі 4°С, потім центрифугують при прискоренні 8000 g протягом 20 хвилин. Осад після центрифугування видаляють, і супернатант і шар шкіри (лейкоцитна плівка) центрифугують при прискоренні 40000 g протягом 20 хвилин. Осад після центрифугування рекуперують, суспендують його в 15 об'ємах бідистильованої води і ще раз центрифугують при прискоренні 40000 g перед консервацією при температурі -80°С. В день експерименту тканину повільно розморожують і суспендують в 3 об'ємах буфера. 150 мкл цієї мембранної суспензії інкубують при температурі 4°С протягом 120 хвилин в 3 присутності 100 мкл 1 нМ [ Н]-цитизину в кінцевому об'ємі 500 мкл буфера, в присутності або у відсутність сполуки, яка тестується. Реакцію припиняють шляхом фільтрації через фільтри Whatman GF/BTM, попередньо оброблені за допомогою поліетиленіміну, фільтри промивають два рази по 5 мл буфера при температурі 4°С і вимірюють радіоактивність, утриману на фільтрі, за допомогою рідинної сцинтиграфії. Визначають неспецифічне скріплення в присутності 10 мкМ (-)-нікотину; неспецифічне скріплення становить 75-85% всього скріплення, рекуперуючого на фільтрі. Для кожної концентрації досліджуваної сполуки визначають процент інгібування 3 специфічного скріплення [ Н]-цитизину при дозах 1 мкМ і 10 мкМ. Для найбільш афінних сполук згідно з винаходом розраховують СІ50, концентрацію сполуки, яка інгібує 50% специфічного скріплення. СІ50 найбільш афінних сполук згідно з винаходом становить від 0,001 мкМ до 1 мкМ. Сполуки згідно з винаходом також досліджували у відношенні їх афінності до периферичних нікотинових рецепторів гангліонарного типу згідно з методом, описаним Houghtling і інш. в Моl. Pharmacol., 48, 280 (1995). Розморожують бичачі надниркові залози, консервовані при температурі - 80°С, і гомогенізують їх за допомогою подрібнювана PolytronTM в 20 об'ємах буфера 50 мМ Tris-HCl з рН 7,4 і при температурі 4°С, потім центрифугують при прискоренні 35000 g протягом 10 хвилин. Супернатант видаляють, і осад після центрифугування суспендують в 30 об'ємах буфера 50 мМ Tris-HCl при температурі 4°С і повторно гомогенізують перед повторним центрифугуванням при прискоренні 35000 g протягом 10 хвилин. Останній осад після центрифугування обробляють за допомогою 10 об'ємів буфера Tris-HCl при температурі 4°С. 100 мкл мембрани або 10 мг свіжої тканини інкубують при температурі 24°С протягом 3 годин в присутності 50 мкл кінцевого 0,66 3 нМ [ Н]-епібатидину в кінцевому об'ємі 250 мкл буфера, в присутності або у відсутність сполуки, яка тестується. Реакцію припиняють шляхом розбавлення зразків буфером 50 мкМ Tris-HCl, рН 16 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 7,4, при температурі 4°С, потім фільтрують через фільтри Whatman GF/CTM, попередньо оброблені за допомогою 0,5% поліетиленіміну протягом 3 годин. Фільтри промивають два рази по 5 мл буфера і вимірюють радіоактивність, утриману на фільтрі, за допомогою рідинної сцинтиграфії. Визначають неспецифічне скріплення в присутності кінцевого 2 мМ (-)-нікотину; неспецифічне скріплення становить 30-40% всього скріплення, рекуперуючого на фільтрі. Для кожної концентрації продукту, що досліджується визначають процент інгібування специфічного 3 скріплення [ Н]-епібатидину, потім розраховують СІ50, концентрацію сполуки, яка інгібує 50% специфічного скріплення. СІ50 сполук згідно з винаходом становить від 0,001 мкМ до 1 мкМ. Одержані результати показують, що деякі сполуки згідно з винаходом є селективними лігандами у відношенні субодиниці α7 нікотинового рецептора і що інші - відносно змішаних типів α4β2 і α7. Ці результати наводять на думку про використання сполук у випадку лікування або запобігання порушенням, зв'язаних з дисфункцією нікотинових рецепторів, особливо на рівні центральної нервової системи, однак, також на рівні периферичної системи. Ці порушення включають погіршення пізнавальних здатностей, більш конкретно, погіршення (сприйнятливість, закріплення і повторення), які стосуються пам'яті, однак, також розлади процесів відносно уваги, і порушення виконавчих функцій, зв'язані з хворобою Альцгеймера, патологічним старінням (Age Associated Memory Impairment, AAMI) або нормальним старінням (старече недоумство), хворобою Паркінсона, трисомією 21 (синдром Дауна), психіатричними патологіями, як, зокрема когнітивні порушення, асоційовані з шизофренією (Cognitive Impairment Associated with Schizophrenia, CIAS), порушення, зв'язані з посттравматичним стресом (PostTraumatic Stress Disoder, PTSD), з алкогольним синдромом Корсакова, васкулярними деменціями (multi-infarct dementia, MDI), черепно-мозковими травмами. Сполуки згідно з винаходом також можуть бути придатні у випадку лікування рухових порушень, які спостерігаються при хворобі Паркінсона або інших неврологічних захворюваннях, таких, як хорея Гентінгтона, синдром Туретта, пізня дискінезія і гіперкінезія. Вони також можуть мати нейрозахисну терапевтичну активність по відношенню до анатомогісто-патологічних розладів, зв'язаних з вищезгаданими нейродегенеративними захворюваннями. Вони також можуть бyти придатні для лікування розсіяного склерозу. Сполуки згідно з винаходом також можна призначати для лікувальної або симптоматичної терапії порушень мозкового кровообігу і гіпоксичних церебральних кризів. Вони можуть бути використані у випадку психіатричних патологій: шизофренія (позитивні і/або негативні симптоми), біполярні розлади, депресія, неспокій, напади паніки, PTSD, порушення уваги з гіперактивністю (Attention Deficit Hyperactivity Disorder, ADHD), компульсивні і нав'язливі поведінки. Вони можуть попереджувати симптоми, виникаючі внаслідок позбавлення тютюну, алкоголю, різних речовин, які викликають залежність, таких як кокаїн, ЛСД, індійська конопля, бензодіазепіни. Вони можуть бути придатні у випадку лікування болю різного походження (включно хронічний, невропатичний або запальний біль). Крім того, сполуки згідно з винаходом можуть бути використані для лікування ішемії нижніх кінцівок, облітеруючого артеріїту нижніх кінцівок (PAD: периферичне артеріальне захворювання), ішемії серця (стабільний ішемічний синдром), інфаркту міокарда, серцевої недостатності, дефіциту загоєння шкіри хворих діабетом пацієнтів, варикозних виразок у випадку венозної недостатності, септичного шоку. Сполуки згідно з винаходом також можуть бути використані для лікування запальних процесів різного походження, як, зокрема, які стосуються центральної нервової системи запалення, запалення легенів, зв'язані з алергіями або астмою, пародонтит, саркоїдоз, панкреатит, пошкодження за рахунок реперфузії, ревматоїдний поліартрит. Сполуки згідно з винаходом також можуть бути придатні у випадку лікування дерматологічних патологій, таких, як псоріаз, і у випадку лікування астми. Сполуки згідно з винаходом також можуть бути використані для лікування виразкового неспецифічного ректоколіту. Сполуки згідно з винаходом, отже, можуть бути використані для одержання лікарських засобів, особливо, лікарських засобів, придатних для лікування або запобігання порушенням, зв'язаних з дисфункцією нікотинових рецепторів, зокрема вищезгаданих порушень. 17 UA 97833 C2 5 10 15 20 25 30 35 Таким чином, об'єктом даного винаходу, згідно з іншим з його аспектів, є лікарські засоби, які включають сполуки формули (І) або адитивну сіль даної сполуки з фармацевтично прийнятною кислотою або гідрат або сольват сполуки формули (І). Ці лікарські засоби знаходять своє застосування в терапії, особливо, у випадку лікування або запобігання порушенням, зв'язаних з дисфункцією нікотинових рецепторів, зокрема вищезгаданих порушень. Згідно з іншим з його аспектів, даний винахід стосується фармацевтичних композицій, які включають, як діюча основа, сполуки згідно з винаходом. Ці фармацевтичні композиції містять ефективну дозу щонайменше однієї сполуки згідно з винаходом або фармацевтично прийнятною сіллю, гідрату або сольвату вищезгаданої сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. Вищезгадані ексципієнти вибирають, в залежності від фармацевтичної форми і бажаного способу введення, серед звичайних ексципієнтів, які відомі фахівцеві в даній галузі. У випадку фармацевтичних композицій згідно з даним винаходом, для перорального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, локального, топічного, інтратрахеального, інтраназального, трансдермального або ректального введення, діюча основа вищенаведеної формули (І) або її можлива(ий) сіль, сольват або гідрат можуть бути введені в разовій формі введення, в суміші з класичними фармацевтичними ексципієнтами, тваринам і людям для профілактики або лікування вищезгаданих порушень або захворювань. Придатні разові форми введення включають пероральні форми, такі, як таблетки, м'які і тверді желатинові капсули, порошки, гранули і пероральні розчини або суспензії, сублінгвальні, букальні, інтратрахеальні, внутрішньоочні, інтраназальні форми введення, форми введення шляхом інгаляції, локальні, трансдермальні, підшкірні, внутрішньом'язові або внутрішньовенні форми введення, форми введення ректальним шляхом і імплантати. Для локального застосування можна використати сполуки згідно з винаходом в кремах, гелях, мазях або лосьйонах. Як приклад, разова форма введення сполуки згідно з винаходом в формі таблетки може включати наступні інгредієнти: сполуки згідно з винаходом 50,0 мг маніт 223,75 мг натрійкроскармелозу 6,0 мг кукурудзяний крохмаль 15,0 мг гідроксипропілметилцелюлозу 2,25 мг стеарат магнію 3,0 мг Вищезгадані разові форми дозуються для можливості добового введення від 0,01 мг до 20 мг діючого початку на кг маси тіла, в залежності від галенової форми. Можуть зустрічатися особливі випадки, які відповідають більш високому або більш незначному дозуванню; таке дозування не входить в рамки даного винаходу. Згідно із звичайною практикою, придатне кожному пацієнту дозування визначає лікар в залежності від способу введення, ваги і відповідної реакції вищезгаданого пацієнта. Даний винахід, згідно з іншим з його аспектів, також стосується способу лікування вищезгаданих патологій, які включають введення пацієнту ефективної дози сполуки згідно з винаходом або однієї (одного) з його фармацевтично прийнятних солей або гідратів або сольватів. ФОРМУЛА ВИНАХОДУ 40 1. Сполука формули (І): R o n 45 N N m , (I) в якій: R означає або атом водню або галогену; або гідроксил, (С1-С6)алкокси, (С3-С7)циклоалкіл-О- або (С3-С7)циклоалкіл-(С1-С3)алкілен-О-; або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С 1 18 UA 97833 C2 5 10 15 20 25 30 35 40 45 50 55 С6)алкілу, (С3-С7)циклоалкілу, (С3-С7)циклоалкіл-(С1-С3)алкілену, (С1-С6)алкокси, (С3С7)циклоалкіл-О-, (С3-С7)циклоалкіл-(С1-С3)алкілен-О-, (С1-С6)фторалкілу, (С1-С6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С 1-С6)алкіламіногрупи або ді(С1С6)алкіламінорупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, гетероарил(С1-С6)алкілену, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3; n означає 1 або 2; m означає 1 або 2; о означає 1 або 2; у вигляді основи або адитивної солі кислоти, у вигляді гідрату або сольвату; причому випадок, де n і о =1 і m = 2, виключається; і причому виключаються наступні сполуки: 4-(6-фторпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; 4-(6-хлорпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; 4-(6-бромпіридин-3-іл)-1-азабіцикло[2.2.1]гептан; 4-(піридин-3-іл)-1-азабіцикло[2.2.1]гептан. 2. Сполука формули (І) за п. 1, яка відрізняється тим, що R означає або атом водню або галогену; або гідроксил; або гетероциклоалкільну, арильну або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С 1С6)алкілу, (С1-С6)алкокси, (С1-С6)фторалкілу, (С1-С6)фторалкокси, нітрогрупи, ціаногрупи, гідроксилу, аміногрупи, (С1-С6)алкіламіногрупи або ді(С1-С6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, арил-О-, -С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН3)3; n означає 1 або 2; m означає 1 або 2; о означає 1 або 2; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату. 3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що R означає або атом галогену; або гідроксил; або гетероциклоалкільну групу, або арильну групу, або гетероарильну групу; причому ця група необов'язково може бути заміщена однією або декількома групами, які вибираються з атомів галогенів, (С1-С6)алкілу, (С1-С6)алкокси, (С1-С6)фторалкілу, (С1-С6)фторалкокси, ді(С1С6)алкіламіногрупи, гетероциклоалкілу, арилу, арил-(С1-С6)алкілену, гетероарилу, арил-О-, С(О)-(С1-С6)алкілу, причому гетероциклоалкіл необов'язково заміщений С(О)О(СН 3)3; n означає 1 або 2; m означає 1 або 2; о означає 1; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату. 4. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що n, m і о означають 1; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату. 5. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що n і m означають 2 і о означає 1; у вигляді основи або адитивної солі кислоти, а також у вигляді гідрату або сольвату. 6. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-5 або адитивну сіль фармацевтично прийнятної кислоти цієї сполуки або її гідрат або сольват. 7. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-5 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше фармацевтично прийнятний ексципієнт. 8. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування і запобігання погіршенням пізнавальних здібностей; розладів уваги; порушень виконавчих функцій, пов'язаних з хворобою Альцгеймера, патологічним або нормальним старінням, хворобою Паркінсона, трисомією 21, психіатричними патологіями, алкогольним синдромом Корсакова, васкулярними деменціями, черепно-мозковими травмами; рухових порушень, які спостерігаються у випадку хвороби Паркінсона або інших неврологічних захворювань або анатомо-гістопатологічних розладів, пов'язаних з вищезгаданими нейродегенеративними захворюваннями; розсіяного склерозу. 19 UA 97833 C2 5 10 15 9. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування і запобігання порушенням мозкового кровообігу, гіпоксичних церебральних кризів, психіатричних патологій. 10. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для запобігання симптомам, виникаючим внаслідок позбавлення тютюну, алкоголю, різних речовин, які викликають залежність. 11. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування болю. 12. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування ішемії нижніх кінцівок, облітеруючого артеріїту нижніх кінцівок, ішемії серця, інфаркту міокарда, серцевої недостатності, дефіциту загоєння шкіри хворих діабетом пацієнтів, варикозних виразок у випадку венозної недостатності, септичного шоку. 13. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування запальних процесів. 14. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування дерматологічних патологій, астми, виразкового неспецифічного ректоколіту. Комп’ютерна верстка Т. Чепелева Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюAzabicycloalkane derivatives, preparation thereof and use thereof in therapy
Автори англійськоюBen Ayad, Omar, Leclerc, Odile, Lochead, Alistair, Saady, Mourad, Slowinski, Franck, Vache, Julien
Назва патенту російськоюАзабициклоалкановые производные, их получение и применение в терапии
Автори російськоюБен Аяд Омар, Леклерк Одиль, Локхед Алистер, Саади Мурад, Словински Франк, Ваше Жюльен
МПК / Мітки
МПК: A61P 25/00, A61P 9/00, A61P 29/00, A61K 31/4748, C07D 487/08, C07D 471/08
Мітки: терапії, азабіциклоалканові, одержання, застосування, похідні
Код посилання
<a href="https://ua.patents.su/22-97833-azabicikloalkanovi-pokhidni-kh-oderzhannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Азабіциклоалканові похідні, їх одержання і їх застосування в терапії</a>
Попередній патент: Спосіб керування бурошнековою машиною
Наступний патент: Похідні сульфоніламіду для лікування анормального росту клітин
Випадковий патент: Кутовий багатосектор












