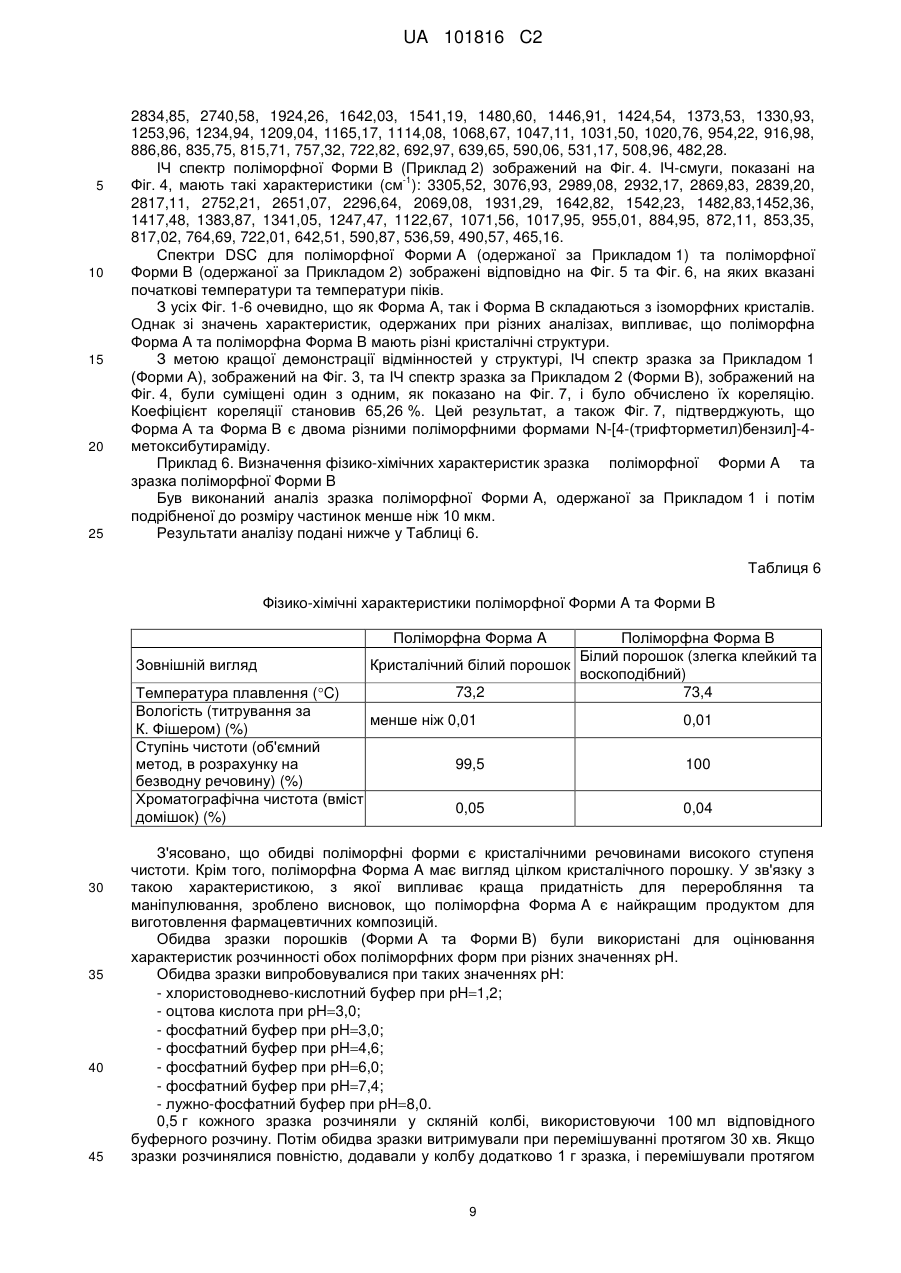
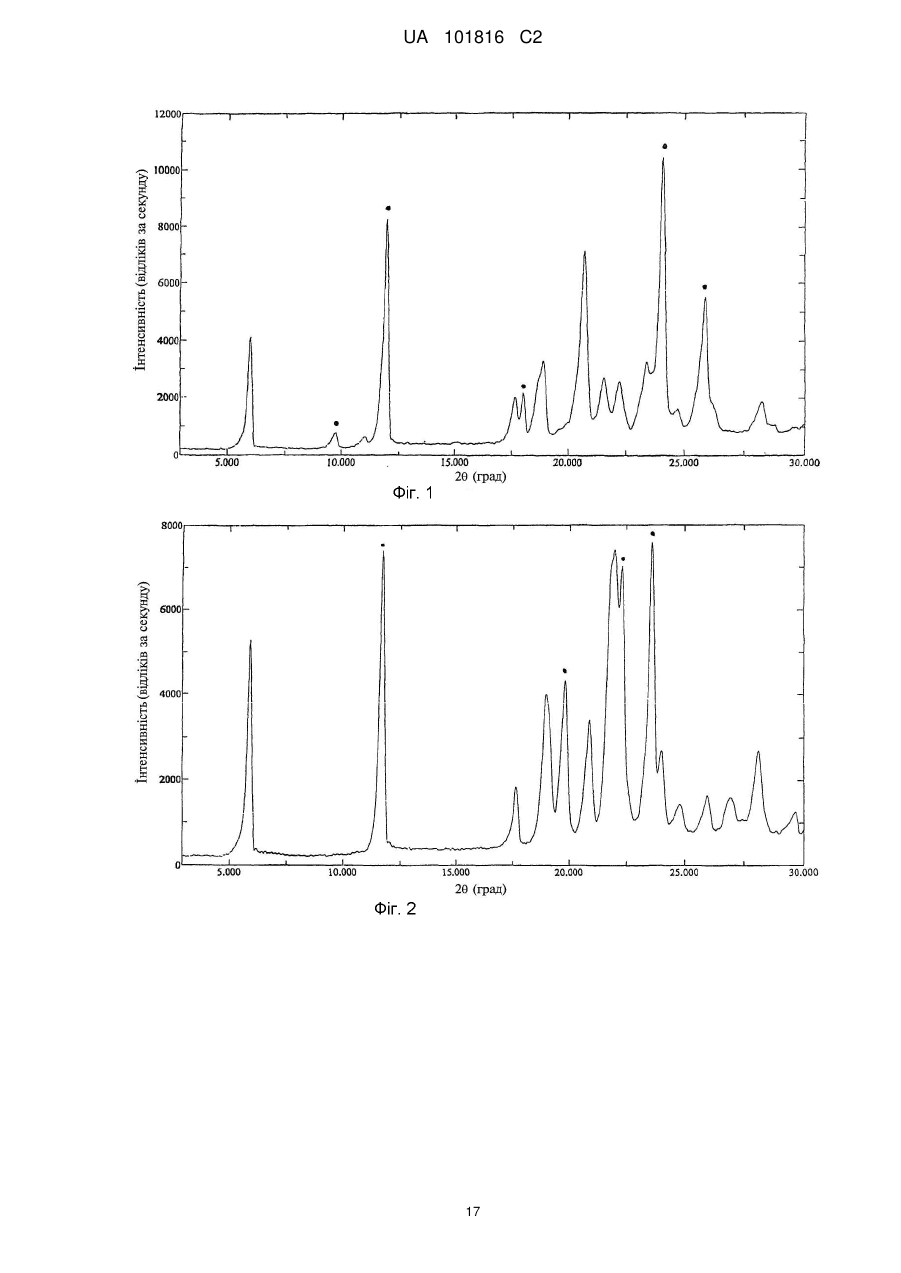
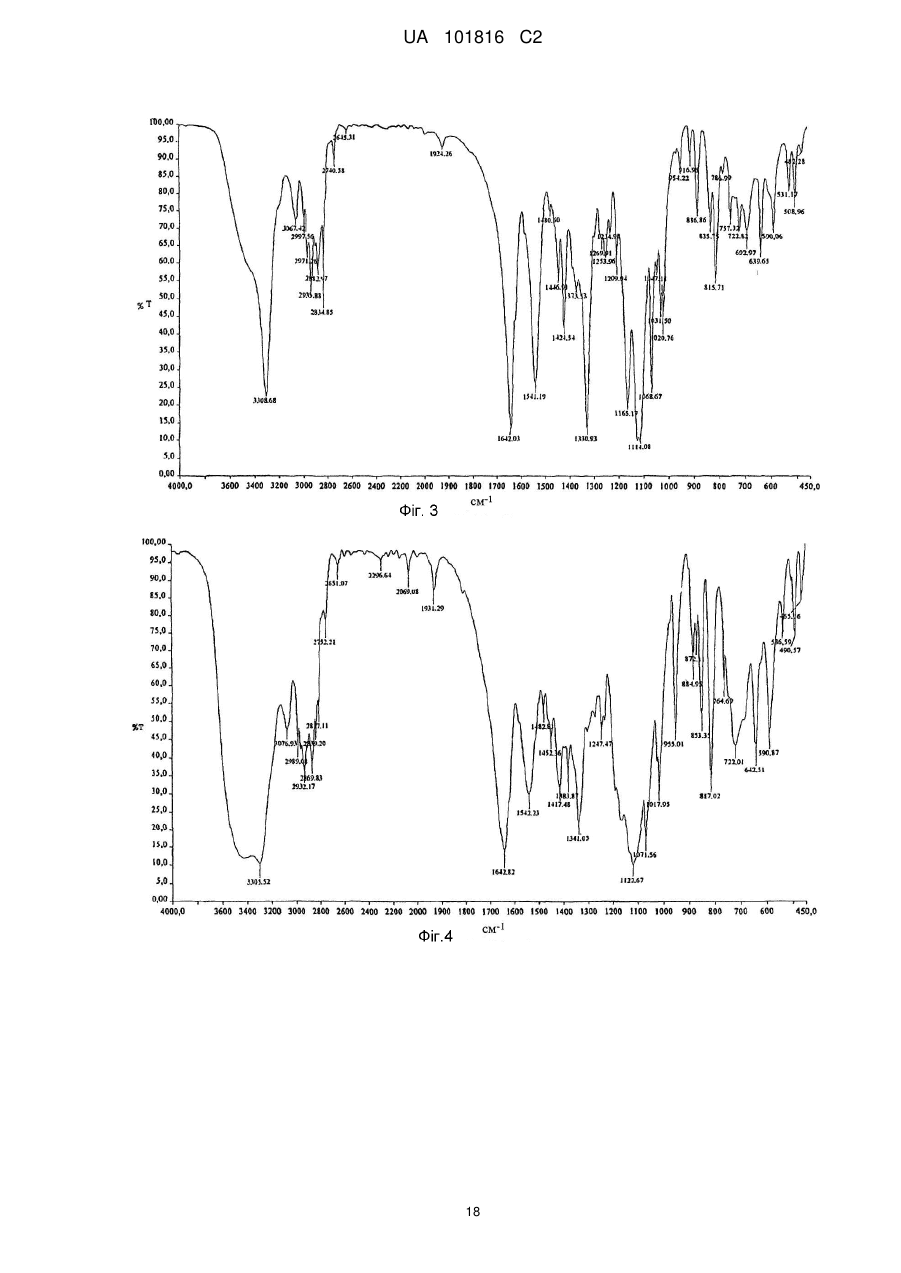
Поліморфні форми n-[4-(трифторметил)бензил]-4-метоксибутираміду
Формула / Реферат
1. Поліморфна Форма А N-[4-(трифторметил)бензил]-4-метоксибутираміду формули
 , (І)
, (І)
порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ)±0,2°:
9,7; 12,0; 18,0; 24,1; 25,9.
2. Поліморфна Форма А за п. 1, порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції ±0,2°:
Пік
2θ
1
6,0
2
9,7
3
11,0
4
12,0
5
17,6
6
18,0
7
18,7
8
18,9
9
19,6
10
20,7
11
21,6
12
22,2
13
23,4
14
24,1
15
24,7
16
25,9
17
26,2
18
28,2
3. Поліморфна Форма А за п. 1 або п. 2, яка має порошкову рентгенодифрактограму, показану на Фіг. 1.
4. Поліморфна Форма В N-[4-(трифторметил)бензил]-4-метоксибутираміду формули (І)
 , (І)
, (І)
порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ)±0,2°:
11,7; 19,8; 22,3; 23,6.
5. Поліморфна Форма В за п. 4, порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції ±0,2°:
Пік
2θ
1
5,9
2
11,7
3
17,6
4
19,0
5
19,8
6
20,9
7
21,9
8
22,3
9
23,6
10
24,0
11
24,8
12
26,0
13
27,0
14
27,4
15
28,1
16
29,6
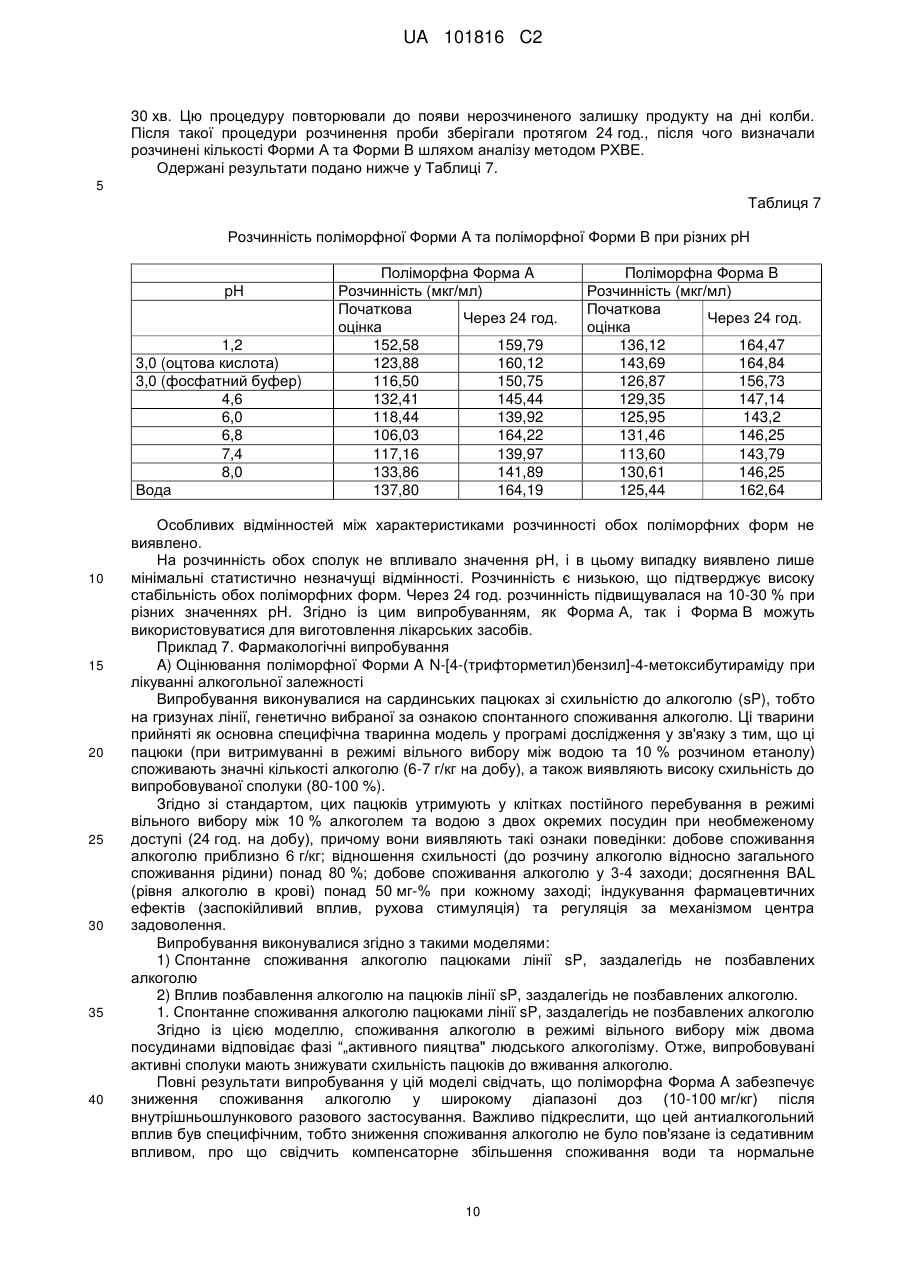
6. Поліморфна Форма В за п. 4 або п. 5, яка має порошкову рентгенодифрактограму, показану на Фіг. 2.
7. Спосіб виготовлення поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3, який включає такі стадії:
і) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду; та
(іі) одержання кристалічної поліморфної Форми А з розчину неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки.
8. Спосіб виготовлення поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6, який включає такі стадії:
і) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду; та
іі) одержання кристалічної поліморфної Форми В з розчину неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки.
9. Спосіб за п. 7 або п. 8, який відрізняється тим, що 4-трифторметилбензиламін одержують шляхом проведення реакції 4-трифторметилбензальдегіду з хлористоводневим гідроксиламіном за поданою нижче схемою:
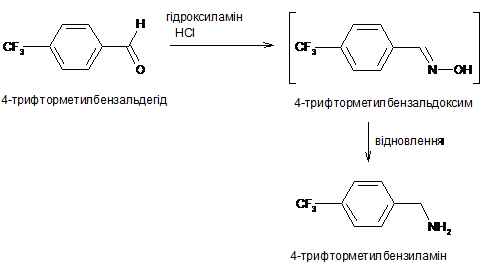 .
.
10. Спосіб за будь-яким із п. 7, п. 8 та п. 9, який відрізняється тим, що каталізатором на стадії (і) є 30 % розчин метилату натрію у метанолі.
11. Спосіб за будь-яким із пп. 7-10, який відрізняється тим, що органічний розчинник вибирають з групи, до якої входять толуол та суміш етилацетату з н-гексаном.
12. Спосіб за п. 11, який відрізняється тим, що органічним розчинником є суміш етилацетату з н-гексаном.
13. Спосіб за п. 12, який відрізняється тим, що співвідношення етилацетат:н-гексан у суміші етилацетату з н-гексаном становить від 1:4 до 1:2, перевага віддається співвідношенню приблизно 1:3.
14. Фармацевтична композиція, яка містить як активну речовину ефективну кількість поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3 та фармацевтично прийнятний носій.
15. Фармацевтична композиція, яка містить як активну речовину ефективну кількість поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6 та фармацевтично прийнятний носій.
16. Фармацевтична композиція за п. 14 або п. 15, яка відрізняється тим, що сполука у поліморфній Формі А або у поліморфній Формі В присутня у кількості від 12,5 % (мас.) до 50 % (мас.).
17. Застосування поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3 для виготовлення лікарського засобу для лікування наркоманії та алкоголізму.
18. Застосування поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6 для виготовлення лікарського засобу для лікування наркоманії та алкоголізму.
19. Застосування за п. 17 або п. 18 для зниження свідомого споживання етилового спирту та/або при лікуванні абстинентного синдрому.
20. Застосування за п. 17 або п. 19, яке відрізняється тим, що поліморфна Форма А N-[4-(трифторметил)бензил]-4-метоксибутираміду застосовується у дозі від 5 мг/кг до 50 мг/кг.
21. Застосування за п. 20, яке відрізняється тим, що поліморфна Форма A N-[4-(трифторметил)бензил]-4-метоксибутираміду застосовується у дозі від 5 мг/кг до 10 мг/кг.
Текст
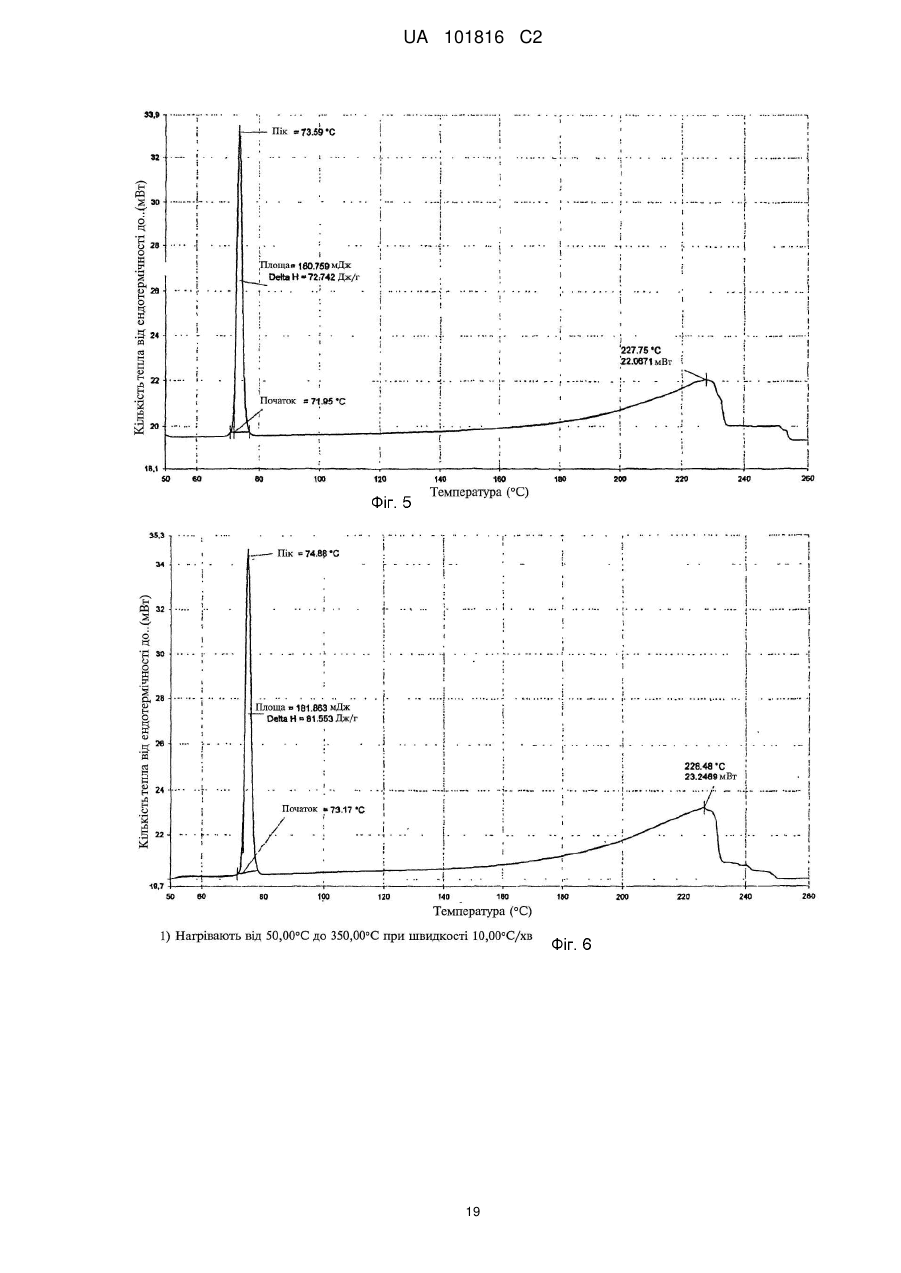
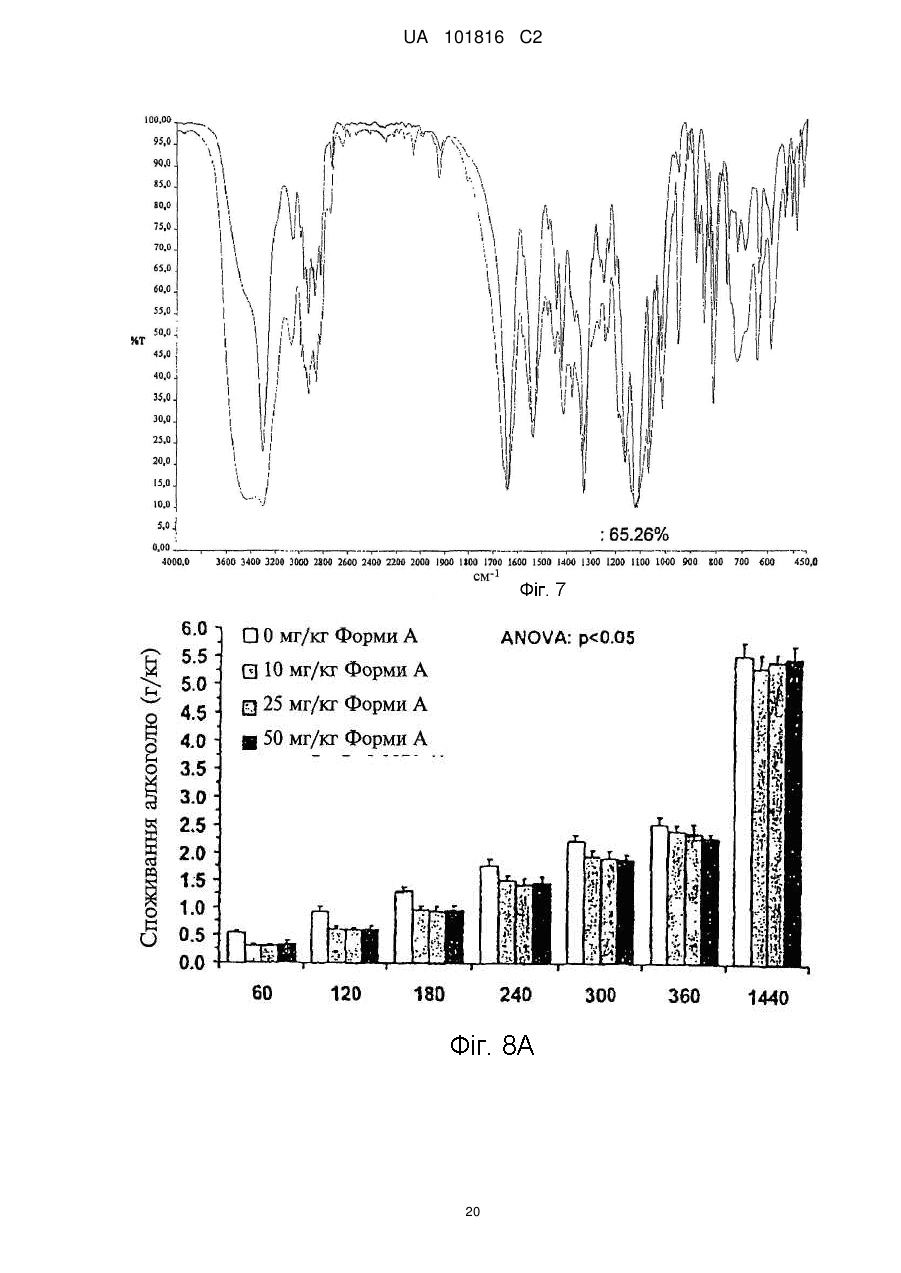
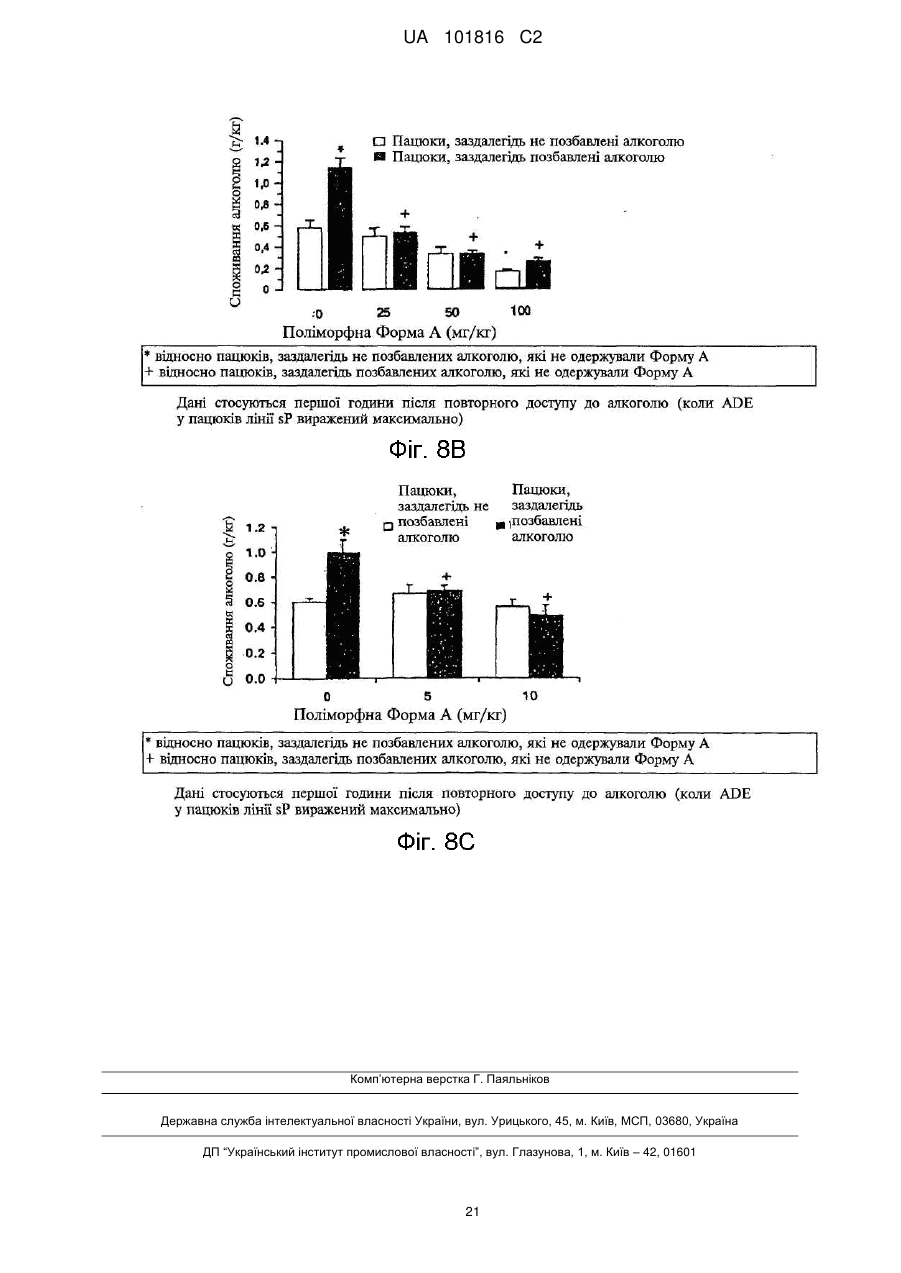
Реферат: Описані кристалічні форми сполуки N-[4-(трифторметил)бензил]-4-метоксибутираміду. Дві поліморфні форми, які мають назви поліморфна Форма А та поліморфна Форма В, можуть застосовуватися при лікуванні наркоманії та алкоголізму та мають дуже високу стабільність. Описані також способи виготовлення цих поліморфних форм. UA 101816 C2 (12) UA 101816 C2 UA 101816 C2 Галузь винаходу Цей винахід стосується двох нових поліморфних форм (модифікацій) сполуки Формули (I) O OCH3 CH2 HN CH2 CH2 CF3 , 5 10 15 20 25 30 35 40 (I) а саме N-[4-(трифторметил)бензил]-4-метоксибутираміду, та їх застосування при лікуванні наркоманії і, зокрема, при лікуванні алкоголізму. Рівень техніки N-[4-(трифторметил)бензил]-4-метоксибутирамід вперше був описаний у Європейському патенті EP 0 932 597 B1 як корисна при лікуванні наркоманії та алкоголізму речовина, що входить до групи амідів. Згідно зі згаданим патентом, N-[4-(трифторметил)бензил]-4-метоксибутирамід, який містить 4-трифторметилбензильну групу, має оптимальні властивості з точки зору нейрофармакологічної активності у порівнянні із солями γ-гідроксимасляної кислоти (GHB), добре відомої як засіб лікування алкоголізму. Зокрема, при визначенні впливу на моторну активність пацюків він виявив кращі характеристики ефективності та тривалості дії у порівнянні з GHB і ще кращі, ніж інші аміди, які містили у структурі різні групи. Отже, у зв'язку з його оптимальною нейрофармакологічною активністю, для застосування N[4-(трифторметил)бензил]-4-метоксибутираміду у фармакології необхідно виготовляти його з високим рівнем чистоти та з високими виходами. Спочатку автори цього винаходу спробували одержати N-[4-(трифторметил)бензил]-4метоксибутирамід за методикою, описаною у згаданому патенті. Конкретно, згідно з EP 0 932 597 B1, вищезгадану сполуку виготовляли за загальною методикою синтезу, описаною на с. 8 патенту, яка передбачає виконання таких стадій A) проведення реакції складного ефіру 4-алкоксимасляної кислоти з відповідним аміном у присутності NH4Cl при температурі 160-170C з одержанням неочищеного продукту, B) хроматографування неочищеного продукту на силікагелі з елююванням сумішшю циклогексану з етилацетатом і, нарешті, C) перекристалізацію із суміші CH2Cl2/Et2O. Однак при реалізації цієї методики автори цього винаходу виявили, що навіть у разі, якщо одержувався бажаний продукт, значення фізико-хімічних показників кожної його партії були різними. Таким чином, виявлено, що загальний спосіб синтезу, описаний у EP 0 932 597 B1, характеризується низькою відтворюваністю, а також, у зв'язку з необхідністю стадії очищення В), є дуже дорогим і тому непридатним для виготовлення N-[4-(трифторметил)бензил]-4метоксибутираміду у промислових масштабах. Суть винаходу Намагаючись розв'язати проблему відтворюваності процесу виготовлення N-[4(трифторметил)бензил]-4-метоксибутираміду, автори цього винаходу несподівано виявили, що згадана сполука може існувати у різних поліморфних формах. Конкретно, у процесі розроблення способів виготовлення та дистиляції, аналізуючи кожного разу одержаний продукт, вони виявили дві нові поліморфні форми N-[4-(трифторметил)бензил]-4-метоксибутираміду, Форму A та Форму B, які мають різні структури кристалічних грат. Таким чином, згідно з одним аспектом цей винахід пропонує поліморфну Форму A N-[4(трифторметил)бензил]-4-метоксибутираміду формули: 45 1 UA 101816 C2 O OCH3 CH2 HN CH2 CH2 CF3 5 10 15 20 25 30 35 40 45 50 , (I) порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ) ±0,2: 9,7; 12,0; 18,0; 24,1; 25,9. Згідно з іншим аспектом, цей винахід пропонує поліморфну Форму B сполуки Формули (I), порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ) ±0,2: 11,7; 19,8; 22,3; 23,6. Крім того, авторами цього винаходу віднайдено спосіб, який уможливлює одержання згаданих двох нових поліморфних Форм А та В завжди відтворюваним та стабільним шляхом з високим рівнем чистоти без необхідності виконання стадії хроматографічного очищення. Таким чином, згідно із ще одним аспектом, цей винахід стосується способу виготовлення поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду, який включає такі стадії: i) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду; та ii) одержання кристалічної поліморфної Форми A з розчину неочищеного N-[4(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. Згідно із ще одним аспектом цей винахід стосується способу виготовлення поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду, який включає такі стадії: i) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду; та ii) одержання кристалічної поліморфної Форми B з розчину неочищеного N-[4(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. Поліморфні Форма A та Форма B N-[4-(трифторметил)бензил]-4-метоксибутираміду є корисними при лікуванні наркоманії та при лікуванні алкоголізму. Більш конкретно, вони є корисними при зменшенні добровільного споживання етилового спирту та при лікуванні синдрому абстиненції. Крім того, вищезгадані поліморфна Форма A та поліморфна Форма B є корисними також при лікуванні криз абстиненції, пов'язаної з наркотиками, які викликають звикання, наприклад, із героїном, кокаїном, морфіном та психотропними наркотиками. Таким чином, цей винахід стосується також поліморфної Форми A N-[4(трифторметил)бензил]-4-метоксибутираміду для застосування як лікарського засобу, а також поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду для застосування як лікарського засобу. За іншим аспектом цей винахід стосується також фармацевтичної композиції, яка містить ефективну кількість поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду як активну речовину та фармацевтично прийнятний носій, а також фармацевтичної композиції, яка містить ефективну кількість поліморфної Форми B N-[4-(трифторметил)бензил]-4метоксибутираміду як активну речовину та фармацевтично прийнятний носій. Опис фігур На Фіг. 1 показано порошкову рентгенодифрактограму N-[4-(трифторметил)бензил]-4метоксибутираміду у кристалічній поліморфній Формі A; на Фіг. 2 показано порошкову рентгенодифрактограму N-[4-(трифторметил)бензил]-4метоксибутираміду у кристалічній поліморфній Формі B; 2 UA 101816 C2 5 10 15 20 25 на Фіг. 3 показано інфрачервоний спектр кристалічної поліморфної Форми A N-[4(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 4 показано інфрачервоний спектр кристалічної поліморфної Форми B N-[4(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 5 показано картину диференціальної сканувальної калориметрії (DSC) поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 6 показано картину диференціальної сканувальної калориметрії (DSC) поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 7 показано кореляцію між ІЧ спектрами поліморфної Форми A та поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 8A показано результати моделювання спонтанного вживання алкоголю на пацюках лінії sP, заздалегідь не позбавлених алкоголю, після введення поліморфної Форми A N-[4(трифторметил)бензил]-4-метоксибутираміду; на Фіг. 8B показано результати моделювання впливу на організм позбавлення алкоголю на пацюках лінії sP, заздалегідь не позбавлених алкоголю, після введення великих доз поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду; і на Фіг. 8C показано результати моделювання впливу на організм позбавлення алкоголю на пацюках лінії sP, заздалегідь не позбавлених алкоголю, після введення малих доз Форми A N[4-(трифторметил)бензил]-4-метоксибутираміду. Детальний опис винаходу Цей винахід стосується нової поліморфної Форми A та нової поліморфної Форми B N-[4(трифторметил)бензил]-4-метоксибутираміду, порошкові рентгенодифрактограми яких включають значущі піки, які відповідають різним кутам дифракції (2θ у кутових градусах ±0,2) а саме 9,7, 12,0, 18,0, 24,1, 25,9 для поліморфної Форми A та 11,7, 19,8, 22,3, 23,6 для поліморфної Форми B. Більш конкретно, поліморфна Форма A дає на порошковій рентгенодифрактограмі, показаній на Фіг. 1, 18 піків, які відповідають кутам дифракції та значенням інтенсивності, поданим нижче у Таблиці 1. Таблиця 1 Піки поліморфної Форми A (2θ у кутових градусах ±0,2) Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 2θ 6,0 9,7 11,0 12,0 17,6 18,0 18,7 18,9 19,6 20,7 21,6 22,2 23,4 24,1 24,7 25,9 26,2 28,2 Інтенсивність (відліків за секунду) 4082 797 640 8297 2032 2173 2658 3293 919 7158 2730 2601 3261 10380 1663 5534 1771 1889 I/I0 40 8 7 80 20 21 26 32 9 69 27 26 32 100 17 54 18 19 30 35 Згідно із цим винаходом поліморфна Форма A N-[4-(трифторметил)бензил]-4метоксибутираміду може бути виготовлена способом, який включає такі стадії: (i) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду; та (ii) одержання кристалічної поліморфної Форми A з розчину неочищеного N-[4 3 UA 101816 C2 5 10 15 20 25 30 35 40 (трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. 4-трифторметилбензиламін для виконання стадії (i) можна одержати за відомими способами синтезу ароматичних амінів. За варіантом, якому віддається перевага, 4трифторметилбензиламін одержують шляхом проведення реакції 4трифторметилбензальдегіду з гідроксиламіном за поданою нижче схемою: Вихід 4-трифторметилбензиламіну за цією схемою може за варіантом, якому віддається перевага, досягати 90 %. Згідно із цим винаходом на стадії (i) 4-трифторметилбензиламін вводять в реакцію з метил4-метоксибутиратом у присутності каталізатора, за варіантом, якому віддається перевага, із 30 % розчином метилату натрію у метанолі; однак можна застосовувати також N, Nдиметиламінопіридин та хлорид амонію. За варіантом, якому віддається перевага, стадію (i) виконують при температурі від 95C до 135C, більша перевага віддається температурі від 110C до 120C. Після закінчення реакції неочищений N-[4-(трифторметил)бензил]-4метоксибутирамід можна виділити звичайними способами, такими як дистиляція з органічними розчинниками. За варіантом, якому віддається перевага, стадія (i) дозволяє одержати вихід неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду приблизно 70 %. Одержаний таким чином неочищений N-[4-(трифторметил)бензил]-4-метоксибутирамід на стадії (ii) кристалізують у поліморфній Формі A шляхом одержання спочатку розчину неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику з подальшим внесенням у згаданий розчин поліморфної Форми A як затравки. Згаданим розчинником може бути будь-який прийнятний органічний розчинник, який сприяє кристалізації поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду. За варіантом, якому віддається перевага, такий органічний розчинник може бути вибраний з групи, до якої входять толуол та суміш етилацетату з н-гексаном. За варіантом, якому віддається більша перевага, розчин неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду виготовляють із застосуванням суміші етилацетату з н-гексаном. При розчиненні неочищеного продукту у суміші етилацетату з н-гексаном за варіантом, якому віддається перевага, співвідношення етилацетат:н-гексан становить від 1:4 до 1:2, за варіантом, якому віддається більша перевага, приблизно 1:3. Розчин неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду в розчиннику за варіантом, якому віддається перевага, одержують шляхом нагрівання його до температури від 35C до 70C, за варіантом, якому віддається більша перевага, – до температури від 40C до 60C перед внесенням поліморфної Форми A як затравки. Осадження поліморфної Форми A за варіантом, якому віддається перевага, виконують при температурі від 0C до 35C, за варіантом, якому віддається більша перевага, – при температурі від 10C до 20C. За варіантом, якому віддається перевага, стадія (ii) дозволяє одержати вихід поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду приблизно 95 %. За іншим варіантом здійснення цього винаходу запропонована поліморфна Форма B N-[4 4 UA 101816 C2 (трифторметил)бензил]-4-метоксибутираміду. Поліморфна Форма B дає на порошковій рентгенодифрактограмі, показаній на Фіг. 2, 16 піків, які відповідають кутам дифракції та значенням інтенсивності, поданим нижче у Таблиці 2. Таблиця 2 Піки поліморфної Форми B (2θ у кутових градусах ±0,2°) Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 2θ 5,9 11,7 17,6 19,0 19,8 20,9 21,9 22,3 23,6 24,0 24,8 26,0 27,0 27,4 28,1 29,6 Інтенсивність (відліків за секунду) 5211 7402 1845 3985 4334 3405 7127 6896 7594 2689 1434 1654 1590 1089 2695 1252 I/I0 69 98 25 53 58 45 94 91 100 36 19 22 21 15 36 17 5 10 15 20 25 30 35 Згідно із цим винаходом поліморфна Форма B N-[4-(трифторметил)бензил]-4метоксибутираміду може бути виготовлена способом, який включає такі стадії: (i) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду; та (ii) одержання кристалічної поліморфної Форми B з розчину неочищеного N-[4(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. Усі аспекти способу, яким віддається перевага, вказані вище стосовно до способу одержання поліморфної Форми A, а саме до одержання бензиламіну на стадії (i), а також усі сприятливі характеристики обох стадій (i) та (ii) залишаються такими самими для способу одержання поліморфної Форми B, і вказуються в описі способу її одержання шляхом посилання. Перевагою цього винаходу є те, що поліморфну Форму A та поліморфну Форму B одержують простим способом, який також виключає застосування хроматографічного методу з метою одержання чистих кристалічних форм і, що є більш важливим, є відтворюваним та забезпечує селективне одержання бажаної кристалічної модифікації у стабільному вигляді. Кристалічні поліморфні Форми A та B можна розрізнити, зокрема, за їхніми порошковими рентгенодифрактограмами, показаними відповідно на Фіг. 1 та Фіг. 2, однак їх можна розрізняти також за їхніми інфрачервоними спектрами, як буде показано нижче в експериментальних розділах. Обидві кристалічні поліморфні Форми A та B є термодинамічно стабільними, і не можуть перетворюватися одна в одну. Було виконано випробування розчинності обох поліморфних форм, і відмінностей між характеристиками розчинності Форми А та Форми В не виявлено. Обидві форми виявили також несподівану фармакологічну активність при лікуванні наркоманії і, зокрема, при лікуванні алкоголізму. Внаслідок наявності таких властивостей кристалічні поліморфні Форма A та Форма B можуть застосовуватися як лікарські засоби. Отже, згідно із цим винаходом запропонована фармацевтична композиція, яка містить або поліморфну Форму A, або поліморфну Форму B, та відповідні фармацевтичні допоміжні речовини. За варіантом, якому віддається перевага, композиція за цим винаходом містить від 12,5 % (мас.) до 50 % (мас.) поліморфної Форми A або поліморфної Форми B. Такі композиції можуть виготовлятися з використанням звичайних розріджувачів або наповнювачів та способів, 5 UA 101816 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомих у фармації. Фармацевтичні композиції, які містять поліморфну Форму A та поліморфну Форму B, можна вводити в організм будь-якими відповідними шляхами, наприклад, пероральним або парентеральним. За варіантом, якому віддається перевага, фармацевтичні композиції для перорального застосування можуть виготовлятися у вигляді твердих лікарських форм, таких як порошки, гранули, таблетки (факультативно шипучі), пресовані або покриті оболонкою пігулки, драже, пастилки, тверді або м'які капсули, або у вигляді рідких лікарських форм, таких як розчини, суспензії або емульсії. Фармацевтичні композиції для парентерального застосування можуть мати форму водних або неводних розчинів, суспензій або емульсій. У складі твердих композицій Форма A або Форма B можуть поєднуватися з будь-якими прийнятними твердими допоміжними речовинами, вибраними, наприклад, із групи, яку складають ковзні засоби, розпушувачі, наповнювачі тощо. У складі рідких композицій Форма A або Форма B можуть бути, наприклад, розчинені у воді, органічних розчинниках або спиртах. За варіантом, якому віддається перевага, поліморфна Форма A та поліморфна Форма B можуть бути використані при лікуванні наркоманії та при лікуванні алкоголізму. Для таких цілей згадані поліморфні форми за варіантом, якому віддається перевага, можна застосовувати у дозах від 5 мг/кг до 50 мг/кг. Навіть незважаючи на те, що обидві поліморфні форми мають аналогічні характеристики та аналогічну активність при застосуванні як лікарські засоби, перевага згідно із цим винаходом віддається поліморфній Формі A N-[4-(трифторметил)бензил]-4-метоксибутираміду. Реально така поліморфна Форма A виявила оптимальні фізичні властивості, такі як стискуваність та густина, результатом яких є краща придатність для обробляння та маніпулювання, що є надзвичайно важливим для розробки рецептури та виробництва готової продукції. Крім того, як показано нижче в експериментальному розділі, поліморфна Форма A несподівано виявила терапевтичний вплив на алкогольну залежність навіть при застосуванні у дуже малих фармакологічних дозах від 5 мг/кг до 10 мг/кг. Форму A було також випробувано на фармакологічну безпечність, токсичність та генотоксичність, при цьому, як показано нижче, було виявлено, що вона є безпечною, має дуже низьку токсичніть та генотоксичність. Нижче винахід буде описаний більш детально шляхом подання необмежувальних прикладів для кращого характеризування як Форми A, так і Форми B та їхніх фізико-хімічних та фармакологічних властивостей. Приклад 1. Одержання поліморфної Форми A N-[4-(трифторметил)бензил]-4метоксибутираміду A) Одержання 4-трифторметилбензиламіну У реактор завантажували 15 кг дистильованої води, 2,50 кг ацетату натрію, 2,30 кг гідрохлориду гідроксиламіну, 4,00 кг метанолу. Додавали при кімнатній температурі 5,0 кг трифторметилбензальдегіду, і перемішували суміш протягом приблизно 30 хв, після чого видаляли 5 кг розчинника шляхом дистиляції у вакуумі. Потім додавали 12,0 кг 80 % оцтової кислоти, після чого додавали частинами 4,5 кг цинку, при цьому уможливлюючи підвищення температури до 60-80C в результаті екзотермічності реакції. Після досягнення вказаної температури її підтримували шляхом охолодження. Після завершення реакції додавали 10,0 кг толуолу та 15,0 кг 30 % розчину аміаку для видалення солей цинку. Одержану таким чином суміш перемішували при 50-60C, після чого нижній водний шар видаляли. Після дистиляції у вакуумі до досягнення половинного об'єму толуольний розчин, який містив 4-трифторметилбензиламін, вивантажували та використовували на наступній стадії (i). За даними потенціометричного титрування одержали 4,00 кг 4-трифторметилбензиламіну. Вихід: 79,5 %. B) Стадія i). Одержання неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду Толуольний розчин, одержаний на етапі A) (4,00 кг 4-трифторметилбензиламіну), завантажували у реактор. Після дистиляції до одержання маслянистого залишку додавали до нього 3,20 кг метил-4-метоксибутирату та 0,40 кг 30 % розчину метилату натрію. Потім розчин нагрівали до 110-120C із дистиляцією під атмосферним тиском із метою повного видалення метанолу (в тому числі метанолу, який вивільнюється при реакції), і підтримували цю температуру протягом щонайменше 2 год. Потім реактор витримували при 110-120C у вакуумі протягом щонайменше 1 год. Після завершення реакції до реакційної суміші додавали 12,0 кг толуолу, 2,0 кг води та 0,40 кг 80 % оцтової кислоти. Після перемішування нижній водний шар відділяли та видаляли. Потім органічну фазу дистилювали у вакуумі, одержуючи маслянистий залишок. До цього залишку додавали 4,00 кг етилацетату та 12,0 кг н-гексану, і одержану суміш 6 UA 101816 C2 5 10 15 20 25 30 35 40 нагрівали до 40-60C, та витримували при цій температурі до повного розчинення. Потім розчин охолоджували до 20-30C, та витримували при цій температурі до утворення значної кількості осаду. Після цього суміш охолоджували 0-10C, і центрифугували, промиваючи сумішшю 0,80 кг етилацетату з 4,00 кг н-гексану. Одержаний вологий продукт використовували на наступній стадії без додаткового оброблення. Одержано приблизно 3,8 кг неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду. Вихід: 60,5 %. C) Стадія (ii). Кристалізація поліморфної Форми A N-[4-(трифторметил)бензил]-4метоксибутираміду У реактор завантажували 3,8 кг неочищеного N-[4-(трифторметил)бензил]-4метоксибутираміду (відповідного вологого продукту), 3,8 кг етилацетату та 11,4 кг н-гексану. Суміш нагрівали до 40-60C, та витримували при цій температурі до повного розчинення, після чого розчин охолоджували до 25-35C. Додавали 0,038 кг поліморфної Форми A N-[4(трифторметил)бензил]-4-метоксибутираміду як затравку. Витримували суміш при 25-35C протягом щонайменше 1 год., потім охолоджували до 10-20C, і знов витримували протягом щонайменше 1 год. Після цього суміш центрифугували, промиваючи заздалегідь підготовленою сумішшю, яка містила 0,76 кг етилацетату та 2,28 кг н-гексану. Одержаний продукт сушили при 40-50C. Одержано приблизно 3,4 кг поліморфної Форми A N-[4-(трифторметил)бензил]-4метоксибутираміду. Вихід: 89,5 %. Приклад 2. Одержання поліморфної Форми B N-[4-(трифторметил)бензил]-4метоксибутираміду За методикою, описаною стосовно до експериментальних етапів A) та B) Прикладу 1, із використанням тих самих кількостей реагентів, було одержано неочищений N-[4(трифторметил)бензил]-4-метоксибутирамід. C) Стадія (ii). Кристалізація поліморфної Форми B N-[4-(трифторметил)бензил]-4метоксибутираміду У лабораторну колбу завантажували 34,0 г N-[4-(трифторметил)бензил]-4метоксибутираміду, 34,0 г етилацетату та 102 г н-гексану. Суміш нагрівали до 40-60C, та витримували при цій температурі до повного розчинення. Потім розчин охолоджували до 2535C, і додавали 0,35 г поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравку. Витримували суміш при 25-35C протягом щонайменше 1 год., потім охолоджували до 10-20C, і знов витримували протягом щонайменше 1 год. Після цього суміш центрифугували, промиваючи заздалегідь підготовленою сумішшю, яка містила 6,8 г етилацетату та 20,4 г н-гексану. Одержаний продукт сушили при 40-50C. Одержано приблизно 31 г поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду. Приклад 3. Аналіз поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду Спочатку був підданий аналізу кристалізований продукт, одержаний за Прикладом 1, з метою підтвердження, що він є N-[4-(трифторметил)бензил]-4-метоксибутирамідом. На пробі продукту за Прикладом 1 було виконано вказані нижче аналізи. - Мас-спектрометричний (MASS) аналіз за методом (+)ESI (іонізації електророзпиленням) із застосуванням приладу Thermo-Finnigam LCQ-Advantage Одержане значення молекулярної маси становило 275, в той час як згідно зі спектром масової фрагментації одержано результати, подані нижче у Таблиці 3. Таблиця 3 Результати аналізу спектра масової фрагментації Інтерпретація [M+H]+ m/z 276 CF3 244 NH +H O 7 + UA 101816 C2 5 Молекулярна маса та спектр масової фрагментації підтвердили структуру N-[4(трифторметил)бензил]-4-метоксибутираміду. 1 - Аналіз методом H-ЯMР у розчинниках CDCl3 та CDCl3+D2O із застосуванням приладу Variant Geminy 200 з робочою частотою 200 МГц ЯМР-спектр підтвердив структуру N-[4-(трифторметил)бензил]-4-метоксибутираміду згідно з поданими нижче результатами. Таблиця 4 1 Спектр H-ЯМР N-[4-(трифторметил)бензил]-4-метоксибутираміду -1 δ (млн ) 1,91 2,33 3,28 3,40 4,46 6,31 7,37 7,56 10 Мультиплетність d-триплет триплет синглет триплет синглет широкий синглет Система AA'BB’ Система AA'BB’ (H) (2) (2) (3) (2) (2) (1) (2) (2) J (Гц) 6,2; 7,3 7,3 6,2 5,9 8,1 8,1 Інтерпретація CH2 CH2 CH3 CH2 CH2 NH H;H H;H - Елементний аналіз Проба дала вказані нижче значення вмісту елементів, які відповідали обчисленим значенням. Таблиця 5 Значення вмісту елементів для C13H16NO2F3 C H N O F Обчислено (%) для C13H16NO2F3 56,72 5,82 5,09 11,64 20,73 Знайдено (%) 56,52 5,87 5,00 11,33 20,48 15 20 25 30 35 Приклад 4: Аналіз поліморфної Форми B N-[4-(трифторметил)бензил]-4-метоксибутираміду 1 Мас-спектрометричний, H-ЯМР та елементний аналізи були повторені на пробі кристалізованого продукту, одержаного за Прикладом 2, із застосуванням тих самих методів та приладів. Усі одержані дані підтвердили, що продукт за Прикладом 2 є N-[4-(трифторметил)бензил]-4метоксибутирамідом. Приклад 5. Визначення поліморфізму N-[4-(трифторметил)бензил]-4-метоксибутираміду На двох пробах кристалізованих продуктів за Прикладом 1 та Прикладом 2 були виконані вказані нижче аналізи: - порошкова рентгенодифрактографія із застосуванням приладу Rigaku Miniflex та випромінювання Cu-α1 та Cu-α2; - аналіз методом диференціальної сканувальної калориметрії (DSC) із застосуванням приладу Perkin-Elmer DSC 6 при швидкості сканування 10C/хв в інтервалі температур 50260C; - аналіз методом інфрачервоної спектроскопії із застосуванням приладу Perkin-Elmer FT-IR Spectrum-one, при цьому пробою, яку піддавали аналізуванню, була суспензія у KBr. Порошкову рентгенодифрактограму проби поліморфної Форми A за Прикладом 1 показано на Фіг. 1, а всі значення 2θ та інтенсивності (відліків за секунду) подані вище у Таблиці 1. Порошкова рентгенодифрактограма проби поліморфної Форми B за Прикладом 2 показана на Ô³ã. 2, а всі значення 2θ та інтенсивності (відліків за секунду) подані вище у Таблиці 2. ІЧ спектр поліморфної Форми A (Приклад 1) зображений на Фіг. 3. ІЧ-смуги, показані на -1 Фіг. 3, мають такі характеристики (см ): 3308,68, 3067,42, 2997,56, 2971,26, 2935,88, 2882,97, 8 UA 101816 C2 5 10 15 20 25 2834,85, 2740,58, 1924,26, 1642,03, 1541,19, 1480,60, 1446,91, 1424,54, 1373,53, 1330,93, 1253,96, 1234,94, 1209,04, 1165,17, 1114,08, 1068,67, 1047,11, 1031,50, 1020,76, 954,22, 916,98, 886,86, 835,75, 815,71, 757,32, 722,82, 692,97, 639,65, 590,06, 531,17, 508,96, 482,28. ІЧ спектр поліморфної Форми B (Приклад 2) зображений на Фіг. 4. ІЧ-смуги, показані на -1 Фіг. 4, мають такі характеристики (см ): 3305,52, 3076,93, 2989,08, 2932,17, 2869,83, 2839,20, 2817,11, 2752,21, 2651,07, 2296,64, 2069,08, 1931,29, 1642,82, 1542,23, 1482,83,1452,36, 1417,48, 1383,87, 1341,05, 1247,47, 1122,67, 1071,56, 1017,95, 955,01, 884,95, 872,11, 853,35, 817,02, 764,69, 722,01, 642,51, 590,87, 536,59, 490,57, 465,16. Спектри DSC для поліморфної Форми A (одержаної за Прикладом 1) та поліморфної Форми B (одержаної за Прикладом 2) зображені відповідно на Фіг. 5 та Фіг. 6, на яких вказані початкові температури та температури піків. З усіх Фіг. 1-6 очевидно, що як Форма A, так і Форма B складаються з ізоморфних кристалів. Однак зі значень характеристик, одержаних при різних аналізах, випливає, що поліморфна Форма A та поліморфна Форма B мають різні кристалічні структури. З метою кращої демонстрації відмінностей у структурі, ІЧ спектр зразка за Прикладом 1 (Форми А), зображений на Фіг. 3, та ІЧ спектр зразка за Прикладом 2 (Форми В), зображений на Фіг. 4, були суміщені один з одним, як показано на Фіг. 7, і було обчислено їх кореляцію. Коефіцієнт кореляції становив 65,26 %. Цей результат, а також Фіг. 7, підтверджують, що Форма А та Форма В є двома різними поліморфними формами N-[4-(трифторметил)бензил]-4метоксибутираміду. Приклад 6. Визначення фізико-хімічних характеристик зразка поліморфної Форми A та зразка поліморфної Форми B Був виконаний аналіз зразка поліморфної Форми A, одержаної за Прикладом 1 і потім подрібненої до розміру частинок менше ніж 10 мкм. Результати аналізу подані нижче у Таблиці 6. Таблиця 6 Фізико-хімічні характеристики поліморфної Форми A та Форми B Поліморфна Форма A Зовнішній вигляд Поліморфна Форма B Білий порошок (злегка клейкий та Кристалічний білий порошок воскоподібний) 73,2 73,4 Температура плавлення (C) Вологість (титрування за менше ніж 0,01 К. Фішером) (%) Ступінь чистоти (об'ємний метод, в розрахунку на 99,5 безводну речовину) (%) Хроматографічна чистота (вміст 0,05 домішок) (%) 30 35 40 45 0,01 100 0,04 З'ясовано, що обидві поліморфні форми є кристалічними речовинами високого ступеня чистоти. Крім того, поліморфна Форма A має вигляд цілком кристалічного порошку. У зв'язку з такою характеристикою, з якої випливає краща придатність для переробляння та маніпулювання, зроблено висновок, що поліморфна Форма A є найкращим продуктом для виготовлення фармацевтичних композицій. Обидва зразки порошків (Форми А та Форми В) були використані для оцінювання характеристик розчинності обох поліморфних форм при різних значеннях рН. Обидва зразки випробовувалися при таких значеннях рН: - хлористоводнево-кислотний буфер при pH1,2; - оцтова кислота при pH3,0; - фосфатний буфер при pH3,0; - фосфатний буфер при pH4,6; - фосфатний буфер при pH6,0; - фосфатний буфер при pH7,4; - лужно-фосфатний буфер при pH8,0. 0,5 г кожного зразка розчиняли у скляній колбі, використовуючи 100 мл відповідного буферного розчину. Потім обидва зразки витримували при перемішуванні протягом 30 хв. Якщо зразки розчинялися повністю, додавали у колбу додатково 1 г зразка, і перемішували протягом 9 UA 101816 C2 30 хв. Цю процедуру повторювали до появи нерозчиненого залишку продукту на дні колби. Після такої процедури розчинення проби зберігали протягом 24 год., після чого визначали розчинені кількості Форми А та Форми В шляхом аналізу методом РХВЕ. Одержані результати подано нижче у Таблиці 7. 5 Таблиця 7 Розчинність поліморфної Форми A та поліморфної Форми B при різних pH pH 1,2 3,0 (оцтова кислота) 3,0 (фосфатний буфер) 4,6 6,0 6,8 7,4 8,0 Вода 10 15 20 25 30 35 40 Поліморфна Форма A Розчинність (мкг/мл) Початкова Через 24 год. оцінка 152,58 159,79 123,88 160,12 116,50 150,75 132,41 145,44 118,44 139,92 106,03 164,22 117,16 139,97 133,86 141,89 137,80 164,19 Поліморфна Форма B Розчинність (мкг/мл) Початкова Через 24 год. оцінка 136,12 164,47 143,69 164,84 126,87 156,73 129,35 147,14 125,95 143,2 131,46 146,25 113,60 143,79 130,61 146,25 125,44 162,64 Особливих відмінностей між характеристиками розчинності обох поліморфних форм не виявлено. На розчинність обох сполук не впливало значення рН, і в цьому випадку виявлено лише мінімальні статистично незначущі відмінності. Розчинність є низькою, що підтверджує високу стабільність обох поліморфних форм. Через 24 год. розчинність підвищувалася на 10-30 % при різних значеннях pH. Згідно із цим випробуванням, як Форма А, так і Форма В можуть використовуватися для виготовлення лікарських засобів. Приклад 7. Фармакологічні випробування A) Оцінювання поліморфної Форми A N-[4-(трифторметил)бензил]-4-метоксибутираміду при лікуванні алкогольної залежності Випробування виконувалися на сардинських пацюках зі схильністю до алкоголю (sP), тобто на гризунах лінії, генетично вибраної за ознакою спонтанного споживання алкоголю. Ці тварини прийняті як основна специфічна тваринна модель у програмі дослідження у зв'язку з тим, що ці пацюки (при витримуванні в режимі вільного вибору між водою та 10 % розчином етанолу) споживають значні кількості алкоголю (6-7 г/кг на добу), а також виявляють високу схильність до випробовуваної сполуки (80-100 %). Згідно зі стандартом, цих пацюків утримують у клітках постійного перебування в режимі вільного вибору між 10 % алкоголем та водою з двох окремих посудин при необмеженому доступі (24 год. на добу), причому вони виявляють такі ознаки поведінки: добове споживання алкоголю приблизно 6 г/кг; відношення схильності (до розчину алкоголю відносно загального споживання рідини) понад 80 %; добове споживання алкоголю у 3-4 заходи; досягнення BAL (рівня алкоголю в крові) понад 50 мг-% при кожному заході; індукування фармацевтичних ефектів (заспокійливий вплив, рухова стимуляція) та регуляція за механізмом центра задоволення. Випробування виконувалися згідно з такими моделями: 1) Спонтанне споживання алкоголю пацюками лінії sP, заздалегідь не позбавлених алкоголю 2) Вплив позбавлення алкоголю на пацюків лінії sP, заздалегідь не позбавлених алкоголю. 1. Спонтанне споживання алкоголю пацюками лінії sP, заздалегідь не позбавлених алкоголю Згідно із цією моделлю, споживання алкоголю в режимі вільного вибору між двома посудинами відповідає фазі “„активного пияцтва" людського алкоголізму. Отже, випробовувані активні сполуки мають знижувати схильність пацюків до вживання алкоголю. Повні результати випробування у цій моделі свідчать, що поліморфна Форма A забезпечує зниження споживання алкоголю у широкому діапазоні доз (10-100 мг/кг) після внутрішньошлункового разового застосування. Важливо підкреслити, що цей антиалкогольний вплив був специфічним, тобто зниження споживання алкоголю не було пов'язане із седативним впливом, про що свідчить компенсаторне збільшення споживання води та нормальне 10 UA 101816 C2 5 10 15 20 25 30 35 40 45 50 55 60 споживання корму пацюками лінії sP (дані не наведено). На Фіг. 8A показано результати окремого експерименту. Конкретно, тваринам вводили дози 10 мг/кг, 20 мг/кг, 25 мг/кг та 50 мг/кг поліморфної Форми A, і оцінювали споживання алкоголю. Несподівано з'ясовано, що малі дози, наприклад, 10 мг/кг, значно знижували споживання алкоголю. 2. Вплив позбавлення алкоголю на пацюків лінії sP, заздалегідь позбавлених алкоголю Для подальшого характеризування антиалкогольної дії поліморфної Форми A, оцінювали дію цієї сполуки на вплив позбавлення алкоголю (Alcohol Deprivation Effect, ADE). ADE являє собою надійно встановлене тимчасове збільшення споживання алкоголю, яке має місце після періоду абстиненції, та модель непереборного неконтрольованого потягу до алкоголю та його вживання, яка характеризує рецидиви алкоголізму у алкоголіків. Згідно із цією моделлю у пацюків лінії sP, які вживали алкоголь, викликали алкогольну абстиненцію шляхом виключення доступу до етанолу протягом двох тижнів. Після закінчення цього періоду тваринам вводили поліморфну Форму A за 30 хв перед вимиканням освітлення, після чого поновлювали доступ до алкоголю. Споживання вимірювали через 1 год. після вимикання освітлення. Результати показано на Фіг. 8B та Фіг. 8C відповідно для великих доз та малих доз кристалічної поліморфної Форми A. Поліморфна Форма A повністю пригнічувала вплив позбавлення алкоголю, демонструючи дуже високу активність в діапазоні доз 5-100 мг/кг. Крім того, навіть малі дози, наприклад, 5 мг/кг, були здатні повністю виключати надмірне споживання алкоголю. Приклад 8. Оцінювання фармакологічної безпечності, токсикологічних характеристик та генотоксичності поліморфної Форми A 1. Фармакологічна безпечність Ймовірні негативні впливи поліморфної Форми A на ЦНС, серцево-судинні, дихальні та імунні функції оцінювалися in vitro та in vivo (на пацюках та собаках) у різних експериментальних моделях. При випробуваннях in vivo досліджувану сполуку завжди застосовували шляхом разового перорального введення у дозах 100 мг/кг, 300 мг/кг та 1000 мг/кг. A) Центральна нервова система (ЦНС) - Тест Ірвіна (Irwin) та температура тіла у пацюків Невроповедінкові впливи поліморфної Форми A досліджували згідно з тестом Ірвіна із застосуванням стандартного спостережувального пристрою, який уможливлює оцінювання діяльності як центральної, так і периферичної нервової системи (наприклад, моторну активність, координацію рухів, соматичну сенсорну або моторну рефлекторні реакції, автономні реакції); температуру тіла вимірювали електронним термометром. При дозі 100 мг/кг досліджувана сполука викликала тимчасовий спад спонтанної рухової активності; при більш високих дозах вплив на рухову активність був сильнішим та тривалішим та був пов'язаний з міорелаксацією та зниженням усвідомлення своїх дій. При дозі 1000 мг/кг пацюки займали положення “„на кінчиках пальців", атаксичне, а згодом лежаче або розпластане положення; усі ці ефекти були оборотними. Доза 100 мг/кг не впливала на температуру тіла, а при більших дозах спостерігалося значне зниження температури тіла, яке тривало до чотирьох годин. - Тривалість сну пацюків під впливом гексобарбіталу Випробування полягає у вимірюванні тривалості викликаного гексобарбіталом сну; речовини седативної або протисонної дії спричиняють відповідно збільшення або зменшення тривалості викликаного гексобарбіталом сну. При застосуванні найменшої дози (100 мг/кг) статистично значущого впливу на час засинання або тривалість сну не виявлено. При помірних дозах спостерігалося незначне зменшення тривалості сну, а при найбільшій дозі – значне зменшення часу засинання та тривалості сну. - Проконвульсивна активність сполуки, виявлена у пацюків У цьому випробуванні досліджувалася можлива проконвульсивна дія поліморфної Форми A при її застосуванні в комбінації з дозою пентилентетразолу, який викликав судоми; попереднє оброблення речовинами, які мають проконвульсивні властивості, спричиняло прискорення початку судом. При всіх застосовуваних дозах поліморфної Форми A статистично значущого проконвульсивної дії не спостерігалося, однак при дозах 100 мг/кг та 300 мг/кг час до появи судом збільшувався, що вказує на можливу протисудомну дію. B) Серцево-судинна система In Vitro - Клітини HERG (ген hERG людини, який кодує калієві канали) Досліджувалася можлива блокувальна дія поліморфної Форми A на залишковий струм Herg, який реєструється у клітинах HEK-293 (людських ембріональних ниркових клітинах), стабільно трансфікованих к-ДНК HERGG-1. Спосіб полягав у вимірюванні залишкового струму HERG шляхом застосування фіксації потенціалу у конфігурації цілої клітини. Відомо, що сполуки, які 11 UA 101816 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібують струм HERG, подовжують потенціал дії міокардіальних волокон та збільшують інтервал QT. Одержані результати свідчать, що поліморфна Форма A не спричиняє статистично 7 6 значущого пригнічення залишкового струму HERG у концентрації 10- M; у концентраціях 10- M 5 та 10- M спостерігалося незначне та незалежне від дози зменшення, і тільки при найвищій 4 випробуваній концентрації 10- M зниження становило приблизно 50 %. Слід підкреслити, що це інгібування ніколи не досягало рівня 70 %, який розглядається як порогове значення, при якому сполуку вважають активною в цьому випробуванні. - Волокна Пуркіньє Можливий негативний вплив поліморфної Форми A на потенціал дії міокардіальних волокон оцінювали на ізольованих собачих волокнах Пуркіньє. Трансмембранний потенціал дії вимірювали із застосуванням внутрішньоклітинного мікроелектрода; цей спосіб рекомендується для виявлення здатності сполуки до індукування подовження інтервалу QT. Поліморфна 7 6 5 Форма A у концентраціях 10- M, 10- M та 10- M не спричиняла статистично значущого впливу на параметри потенціалу дії при нормальних або низьких швидкостях стимуляції; у дуже високій 4 концентрації 10- M спостерігалося значне зниження тривалості потенціалу дії реполяризації. При всіх випробуваних концентраціях не зареєстровано ні ранньої, ні затриманої післядеполяризації. Ці результати свідчать, що, виходячи з кривої електрофізіологічної дії поліморфної Форми A, при її застосуванні не слід очікувати TDP (тріпотіння-мерехтіння шлуночків) або подовження інтервалу QT; поліморфну Форму A можна віднести до лікарських засобів, нездатних викликати TDP або подовжувати інтервал QT у людей. In Vivo - Оцінювання впливу на серцево-судинну систему притомних собак Оцінювався будь-який можливий вплив поліморфної Форми A, введеної пероральним шляхом у дозах 100 мг/кг, 300 мг/кг та 1000 мг/кг, на кров'яний тиск, частоту серцевих скорочень та електрокардіограму притомних собак, рух яких не обмежувався, заздалегідь споряджених телеметричними передавачами. На першому етапі дослідження реєструвалися тільки телеметричні вимірювання; реєстрування цих параметрів починалося щонайменше за 24 год. до введення сполуки і продовжувалося протягом 24 год. після введення доз. На другому етапі собакам вводили тільки найбільшу дозу 1000 мг/кг, і виконувалися додаткові дослідження; такі як реєстрування 6-канальної електрокардіограми (відведення I, II, III, aVL, aVR та aVF), відбирання проб крові та спостереження за тваринами виконувалися перед обробленням та через 3 год. після оброблення. Перший етап. Поліморфна Форма A у дозі 100 мг/кг не викликала змін кров'яного тиску, частоти серцевих скорочень та форми електрокардіограми (зокрема, не виявлено змін у морфології зубця Т). При дозах 300 мг/кг та 1000 мг/кг спостерігалося незначне підвищення артеріального тиску (середнього, систолічного та діастолічного артеріального тиску), незначне зменшення тривалості інтервалів PR та PQ і незначне зменшення тривалості інтервалу QT, скоригованої на частоту серцевих скорочень за методом Сарма (Sarma). Зміни, які спостерігалися при дозі 300 мг/кг, були дуже незначними та ізольованими і, отже, не можуть бути приписані фармакологічній дії поліморфної Форми A, як і зміни тривалості інтервалів PR та PQ, які спостерігалися при дозі 1000 мг/кг, в той час як виявлені збільшення інтервалу QT, скоригованого на частоту серцевих скорочень, були явно пов'язані з впливом поліморфної Форми A, що дозволяє припустити збільшення тривалості шлуночкової реполяризації. При всіх випробуваних дозах не виявлено збурень на електрокардіограмі (відведення II) і, зокрема, змін морфології зубця T. Другий етап. Перед введенням поліморфної Форми A у дозі 1000 мг/кг та через 3 год. після її введення збурень у 6-канальній електрокардіограмі не виявлено. У всіх тварин в період від 0,5 год. до 17 год. після введення дози спостерігалося блювання. Аналіз плазми підтвердив присутність поліморфної Форми A у плазмі через 3 год. після введення. Ці результати свідчать, що поліморфна Форма A, введена перорально в дозах 100 мг/кг, 300 мг/кг та 1000 мг/кг, лише в дозі 1000 мг/кг викликає незначну гіпертензію, пов'язану зі збільшенням тривалості шлуночкової реполяризації. C) Дихальна система - Оцінювання дихальної діяльності притомних пацюків Оцінювався вплив поліморфної Форми A на параметри дихання (інтенсивність дихання, пікові швидкості вдихання та видихання, час вдихання та видихання, показник опору дихальних шляхів, хвилинний об'єм та дихальний об'єм) притомних пацюків після разового перорального введення. Параметри дихання вимірювали методом плетизмографії всього тіла. Поліморфна 12 UA 101816 C2 5 10 15 20 25 30 35 Форма A у дозі 100 мг/кг не впливала на параметри дихання, дози 300 мг/кг та 1000 мг/кг викликали прискорене дихання, повязане з тимчасовим зменшенням дихального об'єму. Статистичних змін пікових швидкостей вдихання та видихання, хвилинного об'єму або показника опору дихальних шляхів не виявлено, що дозволяє припустити, що випробовувана сполука не спричиняє ніякого пригнічення дихання або звужування бронхів. D) Імунна система - Тест на PCF на пацюках Можливий вплив поліморфної Форми A на імунну систему оцінювали, застосовуючи метод визначення бляшкотвірних клітин (Plaque Forming Cells, PCF), у пацюків після перорального введення сполуки пацюкам протягом 28 діб у дозах 150 мг/кг, 250 мг/кг та 500 мг/кг. Метод базується на стимуляції імунної системи антигенним засобом (еритроцитами вівці) та оцінюванні впливу об'єкта дослідження на імунну реакцію. Імунну реакцію оцінювали шляхом вимірювання частки спленоцитів, які продукували антитіла проти антигенного засобу (бляшкотвірних клітин) у присутності комплементу. Одержані при цьому дослідженні результати свідчать, що поліморфна Форма A виявляла незначну та дозонезалежну імунопригнічувальну активність; при випробовуванні менших доз (150 мг/кг та 250 мг/кг) спостерігався порівнянний пограничний ефект, який стає чітко вираженим лише при найбільшій дозі (500 мг/кг). По суті, статистичний аналіз довів значущість дози 150 мг/кг, але не довів значущість дози 250 мг/кг; ці факти можуть вказувати, що ефекти, виявлені при вказаних дозах, можуть бути зумовлені варіабельністю, нормально притаманною цьому випробуванню, оскільки неоднорідність імунної реакції спостерігається часто, і ймовірно, що вона пов'язана з індивідуальними відмінностями в імунній чутливості. Усі вищезгадані дослідження фармакологічної безпечності були виконані у відповідності з правилами GLP та згідно з Керівними принципами щодо безпечності фармакології Міжнародної конференції з гармонізації ICH S7A. 2. Токсикологія та генотоксичність Для підтримки клінічних випробувань досліджуваної сполуки, тобто поліморфної Форми A, були виконані дослідження токсичності на гризунах та негризунах із застосуванням одноразового та багаторазового введення. Дослідження токсичності разових доз були виконані на мишах та пацюках із введенням внутрішньоочеревинним та пероральним шляхами. Дослідження токсичності при повторюваному пероральному застосуванні (28 діб введення з подальшим 14-добовим періодом відновлення) виконували на пацюках та собаках. Для дослідження потенціальної генотоксичності сполуки були виконані тест Еймса (Ames) та тест на мікроядра. У поданій нижче таблиці 8 наведені результати досліджень поліморфної Форми A. Tаблиця 8. Дослідження токсичності та генотоксичності поліморфної Форми A Шлях введення іp** os*** іp os Діапазон доз (мг/кг) 200-1000 2000-4000 200-1000 2000-4000 Пацюк os 50-1550/1200 Собака os 125-1125/900 Тип дослідження Дослідна тварина Гостра токсичність Гостра токсичність Субхронічна токсичність Субхронічна токсичність Тест Еймса Тест мікроядра 40 45 Миша Пацюк Генотоксичність S.typhimurium In vitro 3-500 мкг/мл на Пацюк (клітини os 500-2000 кісткового мозку) Схема Результати Одноразово Одноразово 4 тижні +відновлення 4 тижні +відновлення LD50 ~800 LD50> 4000 LD50 ~800 LD50> 4000 NOEL* 100 NOEL* 125 / Негативний Одноразово Негативний * NOEL: Відсутність ефекту на придатному для спостереження рівні ** ip – внутрішньоочеревинне введення ***os – пероральне введення Генотоксичність оцінювали на пацюках за тестом Еймса та тестом на мікроядрах. - Тест на зворотну мутацію Salmonella Typhimurium (тест Еймса) Мутагенний потенціал поліморфної Форми A визначали in vitro шляхом виконання тесту на зворотну мутацію Salmonella Typhimurium згідно з рекомендаціями ЄС. Випробовувана сполука не викликала генних мутацій як наслідки змін базових пар або зсувів рамок у геномах 13 UA 101816 C2 5 10 15 20 застосовуваних штамів Salmonella typhimurium (TA 1535, TA 1537,TA 98, TA 100 та TA 102) у концентраціях в межах від 50 мкг/мл до 3000 мкг/мл із метаболічною активацією та без неї. Отже, поліморфну Форму A слід розглядати як таку, що не є мутагенною у цьому тесті на зворотну мутацію Salmonella typhimurium. - Тест на мікроядра Кластогенну або веретенну отруйну дію поліморфної Форми A досліджували шляхом виявлення мікроядерних поліхроматичних еритроцитів у кістковому мозку оброблених сполукою пацюків. Дослідження виконували відповідно до рекомендацій ЄС. Спосіб включав пошук присутності фрагмента хромосоми або кількох хромосом, які виникають внаслідок делеції або ефекту отруєння мітотичного волокна у поліхроматофільних еритроцитах кісткового мозку. Кластогенні продукти можуть у момент мітозу спричиняти руйнування хромосоми, а отрути веретена ïîøêîäæóþòü структуру мітотичних веретен. Ацентричний фрагмент хромосоми, який не зазнав нормальної міграції, не утримується у ядрі дочірньої клітини, а з'являється у цитоплазмі. Він відомий під назвою тіла Хауелла-Джоллі (Howell-Jolly) або мікроядра. Це мікроядро можна виявити у поліхроматичних еритроцитах, оскільки основне ядро виштовхується із цих клітин невдовзі після останнього мітозу, а мікроядро залишається в еритроцитах. Самцям та самицям пацюків лінії Sprague Dawley вводили перорально одноразово дози 2000 мг/кг – 1000 мг/кг – 500 мг/кг поліморфної Форми A, і через 24 год. та 48 год. після оброблення у тварин видаляли стегна та витягали клітини кісткового мозку. У всіх випробуваних дозах та у всі моменти дослідження поліморфна Форма A не викликала кластогенної активності. ФОРМУЛА ВИНАХОДУ 25 1. Поліморфна Форма А N-[4-(трифторметил)бензил]-4-метоксибутираміду формули O HN C H2 H2 C C H2 OCH3 CF3 30 , (І) порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ)±0,2°: 9,7; 12,0; 18,0; 24,1; 25,9. 2. Поліморфна Форма А за п. 1, порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції ±0,2°: Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 2θ 6,0 9,7 11,0 12,0 17,6 18,0 18,7 18,9 19,6 20,7 21,6 22,2 23,4 24,1 24,7 25,9 26,2 28,2 14 UA 101816 C2 3. Поліморфна Форма А за п. 1 або п. 2, яка має порошкову рентгенодифрактограму, показану на Фіг. 1. 4. Поліморфна Форма В N-[4-(трифторметил)бензил]-4-метоксибутираміду формули (І) O HN 5 10 20 25 30 C H2 OCH3 CF3 , (І) порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції (2θ)±0,2°: 11,7; 19,8; 22,3; 23,6. 5. Поліморфна Форма В за п. 4, порошкова рентгенодифрактограма якої має піки, що відповідають таким кутам дифракції ±0,2°: Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 15 C H2 H2 C 2θ 5,9 11,7 17,6 19,0 19,8 20,9 21,9 22,3 23,6 24,0 24,8 26,0 27,0 27,4 28,1 29,6 6. Поліморфна Форма В за п. 4 або п. 5, яка має порошкову рентгенодифрактограму, показану на Фіг. 2. 7. Спосіб виготовлення поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3, який включає такі стадії: і) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду; та (іі) одержання кристалічної поліморфної Форми А з розчину неочищеного N-[4(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. 8. Спосіб виготовлення поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6, який включає такі стадії: і) проведення реакції 4-трифторметилбензиламіну з метил-4-метоксибутиратом у присутності каталізатора з одержанням неочищеного N-[4-(трифторметил)бензил]-4-метоксибутираміду; та іі) одержання кристалічної поліморфної Форми В з розчину неочищеного N-[4(трифторметил)бензил]-4-метоксибутираміду в органічному розчиннику шляхом внесення у згаданий розчин поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду як затравки. 9. Спосіб за п. 7 або п. 8, який відрізняється тим, що 4-трифторметилбензиламін одержують шляхом проведення реакції 4-трифторметилбензальдегіду з хлористоводневим гідроксиламіном за поданою нижче схемою: 15 UA 101816 C2 H гідроксиламін HCl CF3 CF3 O 4-трифторметилбензальдегід N OH 4-трифторметилбензальдоксим відновлення CF3 NH2 4-трифторметилбензиламін 5 10 15 20 25 30 . 10. Спосіб за будь-яким із п. 7, п. 8 та п. 9, який відрізняється тим, що каталізатором на стадії (і) є 30 % розчин метилату натрію у метанолі. 11. Спосіб за будь-яким із пп. 7-10, який відрізняється тим, що органічний розчинник вибирають з групи, до якої входять толуол та суміш етилацетату з н-гексаном. 12. Спосіб за п. 11, який відрізняється тим, що органічним розчинником є суміш етилацетату з н-гексаном. 13. Спосіб за п. 12, який відрізняється тим, що співвідношення етилацетат:н-гексан у суміші етилацетату з н-гексаном становить від 1:4 до 1:2, перевага віддається співвідношенню приблизно 1:3. 14. Фармацевтична композиція, яка містить як активну речовину ефективну кількість поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3 та фармацевтично прийнятний носій. 15. Фармацевтична композиція, яка містить як активну речовину ефективну кількість поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6 та фармацевтично прийнятний носій. 16. Фармацевтична композиція за п. 14 або п. 15, яка відрізняється тим, що сполука у поліморфній Формі А або у поліморфній Формі В присутня у кількості від 12,5 % (мас.) до 50 % (мас.). 17. Застосування поліморфної Форми А N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 1-3 для виготовлення лікарського засобу для лікування наркоманії та алкоголізму. 18. Застосування поліморфної Форми В N-[4-(трифторметил)бензил]-4-метоксибутираміду за будь-яким із пп. 4-6 для виготовлення лікарського засобу для лікування наркоманії та алкоголізму. 19. Застосування за п. 17 або п. 18 для зниження свідомого споживання етилового спирту та/або при лікуванні абстинентного синдрому. 20. Застосування за п. 17 або п. 19, яке відрізняється тим, що поліморфна Форма А N-[4(трифторметил)бензил]-4-метоксибутираміду застосовується у дозі від 5 мг/кг до 50 мг/кг. 21. Застосування за п. 20, яке відрізняється тим, що поліморфна Форма A N-[4(трифторметил)бензил]-4-метоксибутираміду застосовується у дозі від 5 мг/кг до 10 мг/кг. 16 UA 101816 C2 17 UA 101816 C2 18 UA 101816 C2 19 UA 101816 C2 20 UA 101816 C2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymorphic forms of n-[4-(trifluoromethyl)benzyl]-4-methoxybutyramide
Автори англійськоюCacciaglia, Roberto, Ferrari, Massimo
Назва патенту російськоюПолиморфные формы n-[4-(трифторметил)бензил]-4-метоксибутирамида
Автори російськоюКаччалья Роберто, Феррари Массимо
МПК / Мітки
МПК: C07C 235/06, A61K 31/165, A61P 25/30
Мітки: n-[4-(трифторметил)бензил]-4-метоксибутираміду, форми, поліморфні
Код посилання
<a href="https://ua.patents.su/23-101816-polimorfni-formi-n-4-triftormetilbenzil-4-metoksibutiramidu.html" target="_blank" rel="follow" title="База патентів України">Поліморфні форми n-[4-(трифторметил)бензил]-4-метоксибутираміду</a>
Попередній патент: Способи і пристрої для керування режимом вимірювань ue у drx-режимі
Наступний патент: Спосіб сироти осушення водосховища
Випадковий патент: Пристрій для визначення дрейфової рухливості неосновних носіїв заряду