Кальцієва сіль периндоприлу або її сольват
Номер патенту: 105167
Опубліковано: 25.04.2014
Автори: Зупет Рок, Бомбек Сергея, Мерславік Маріо, Гойяк Урска, Смрколь Матей
Формула / Реферат
1. Кальцієва сіль периндоприлу або її сольват.
2. Кальцієва сіль за п. 1 у формі солі приєднання органічної або неорганічної кислоти.
3. Кальцієва сіль за п. 2, в якій органічна або неорганічна кислота вибрана з групи, що складається з НСl, НВr, НІ, малеїнової кислоти і фумарової кислоти.
4. Кальцієва сіль периндоприлу гідрохлориду.
5. Кальцієва сіль периндоприлу або її сольват за будь-яким з пп. 1-4 для застосування як лікарського засобу, особливо для лікування серцево-судинних захворювань.
6. Фармацевтична композиція, що містить кальцієву сіль периндоприлу або її сольват за будь-яким з пп. 1-4.
7. Фармацевтична композиція за п. 6, яка може бути одержана способом, що включає грануляцію суміші допоміжних речовин з розчином, що містить периндоприл або його сіль, а також неорганічну сіль кальцію, зокрема хлорид кальцію.
8. Фармацевтична композиція за п. 7, в якій розчин включає воду або суміш води і етанолу як розчинник.
9. Спосіб одержання фармацевтичної композиції, що містить кальцієву сіль периндоприлу або її сольват за п. 6, в якому суміш наповнювачів гранулюють з розчином, що містить периндоприл або його солі та неорганічні солі кальцію, зокрема хлорид кальцію.
10. Спосіб за п. 9, в якому розчин включає воду або суміш води і етанолу як розчинник.
Текст
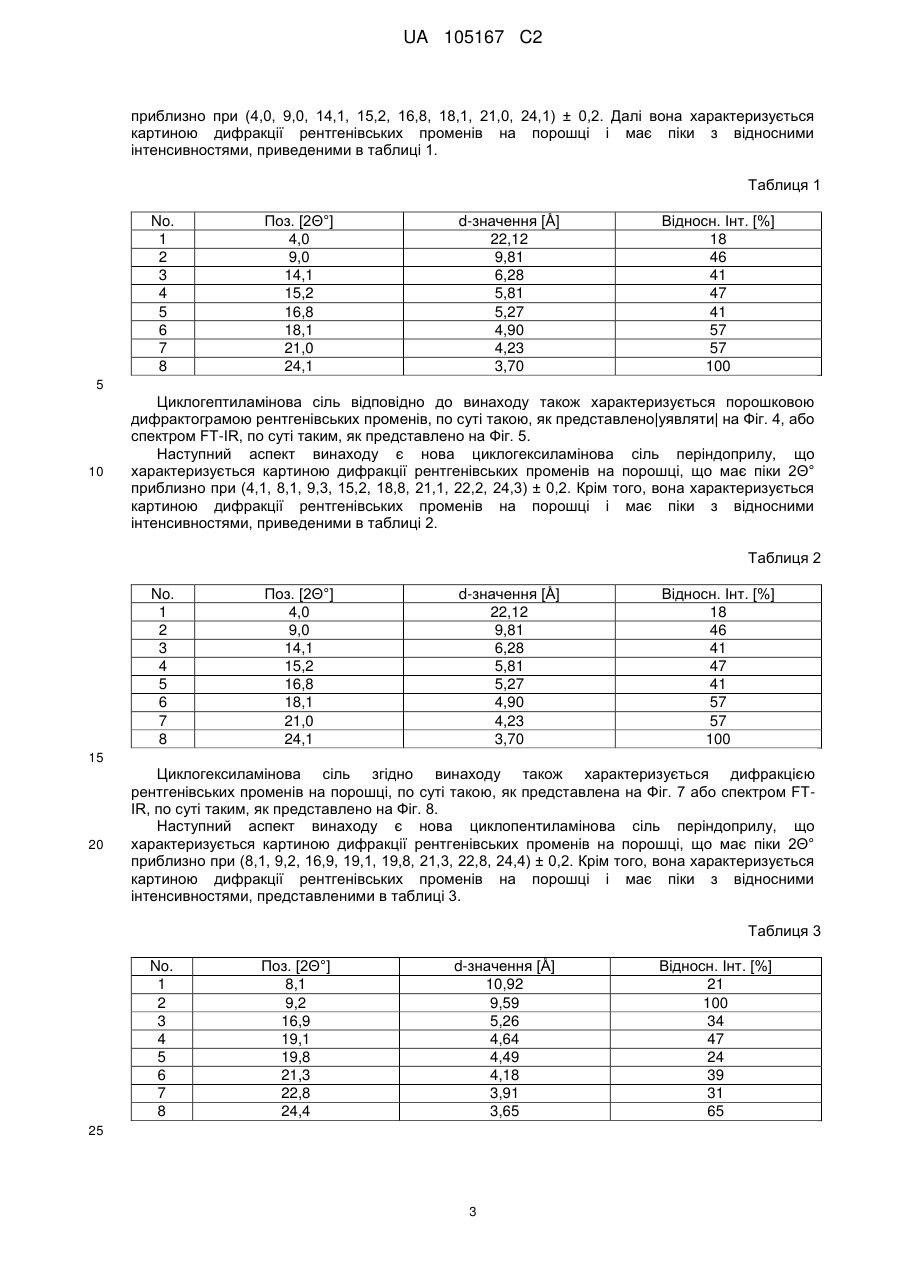
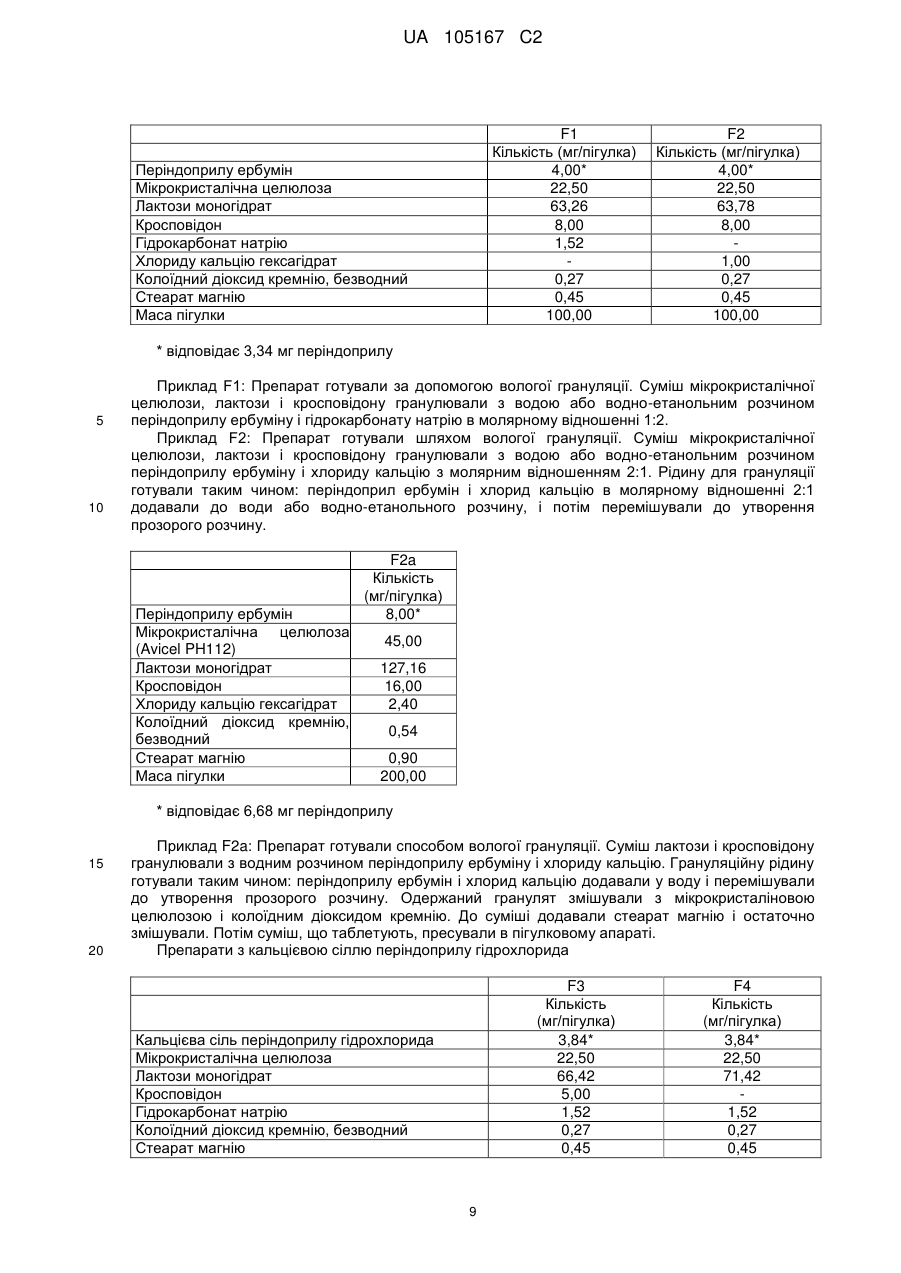
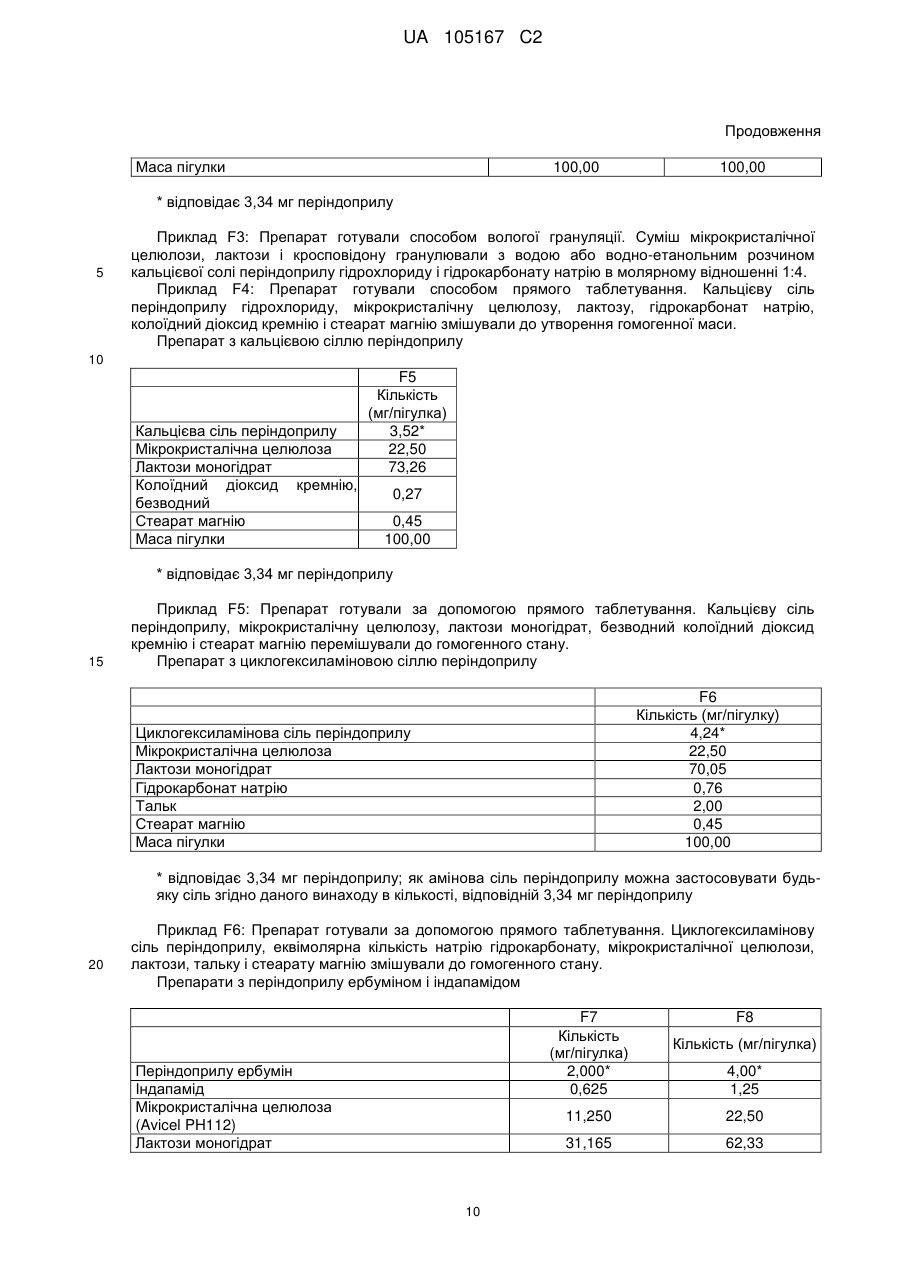
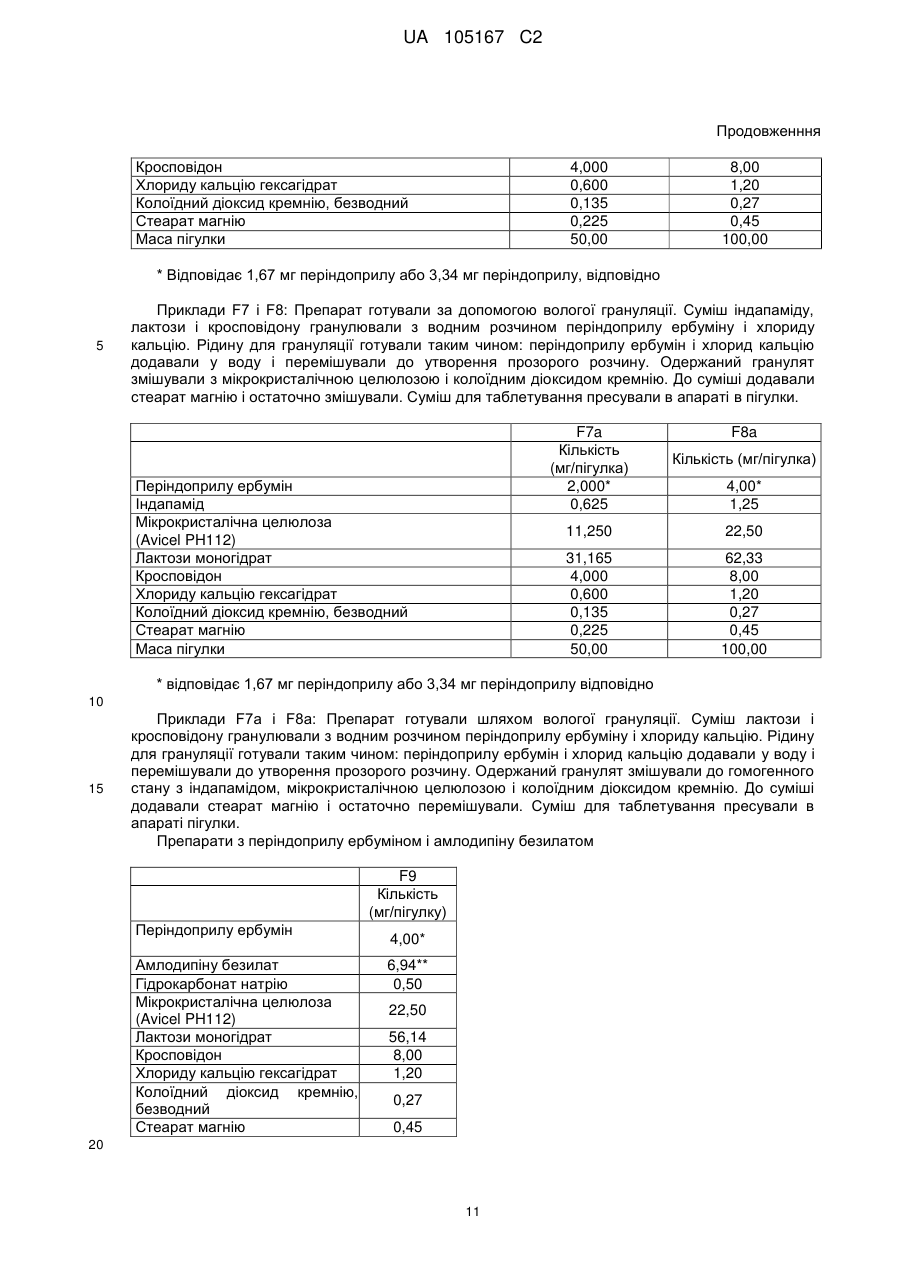
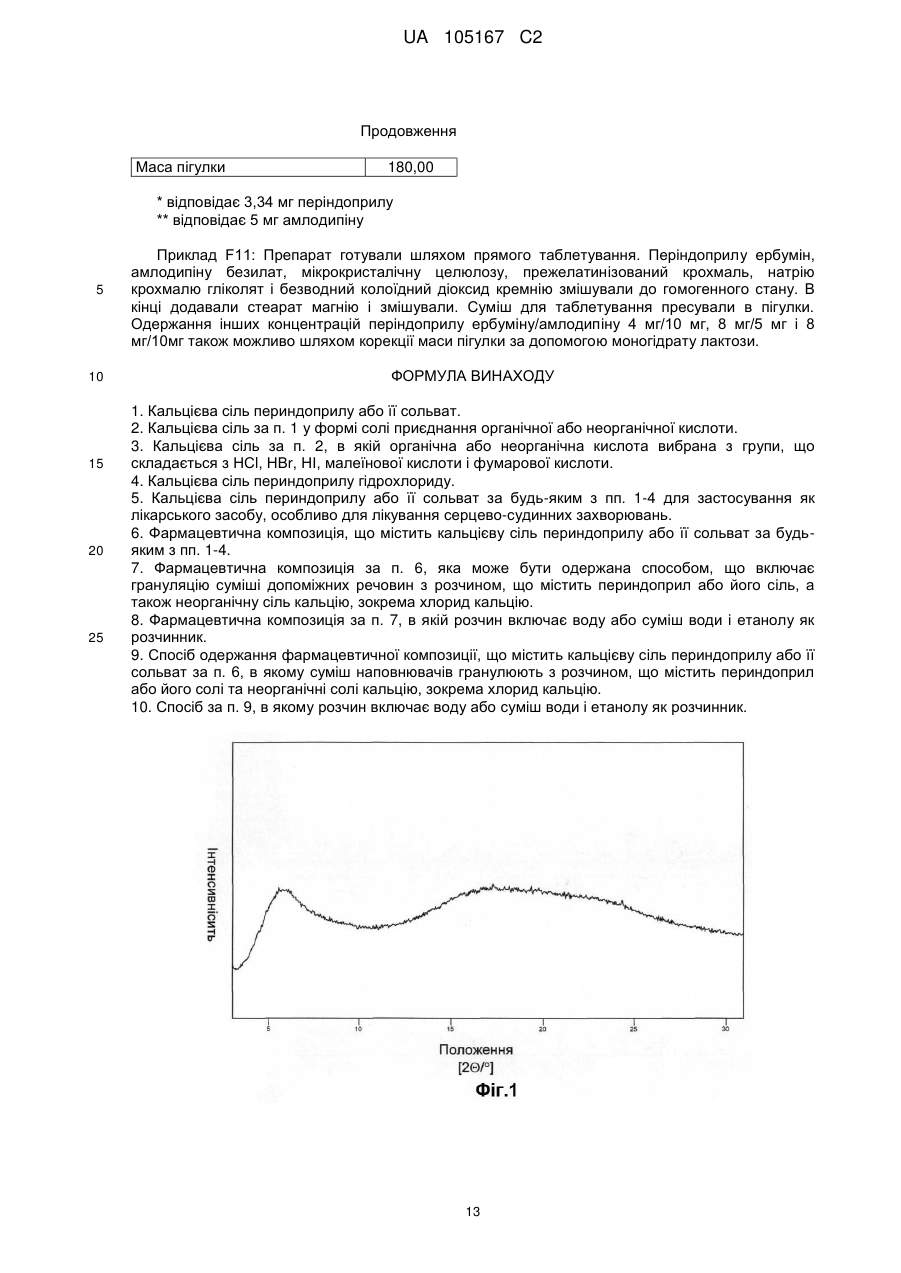
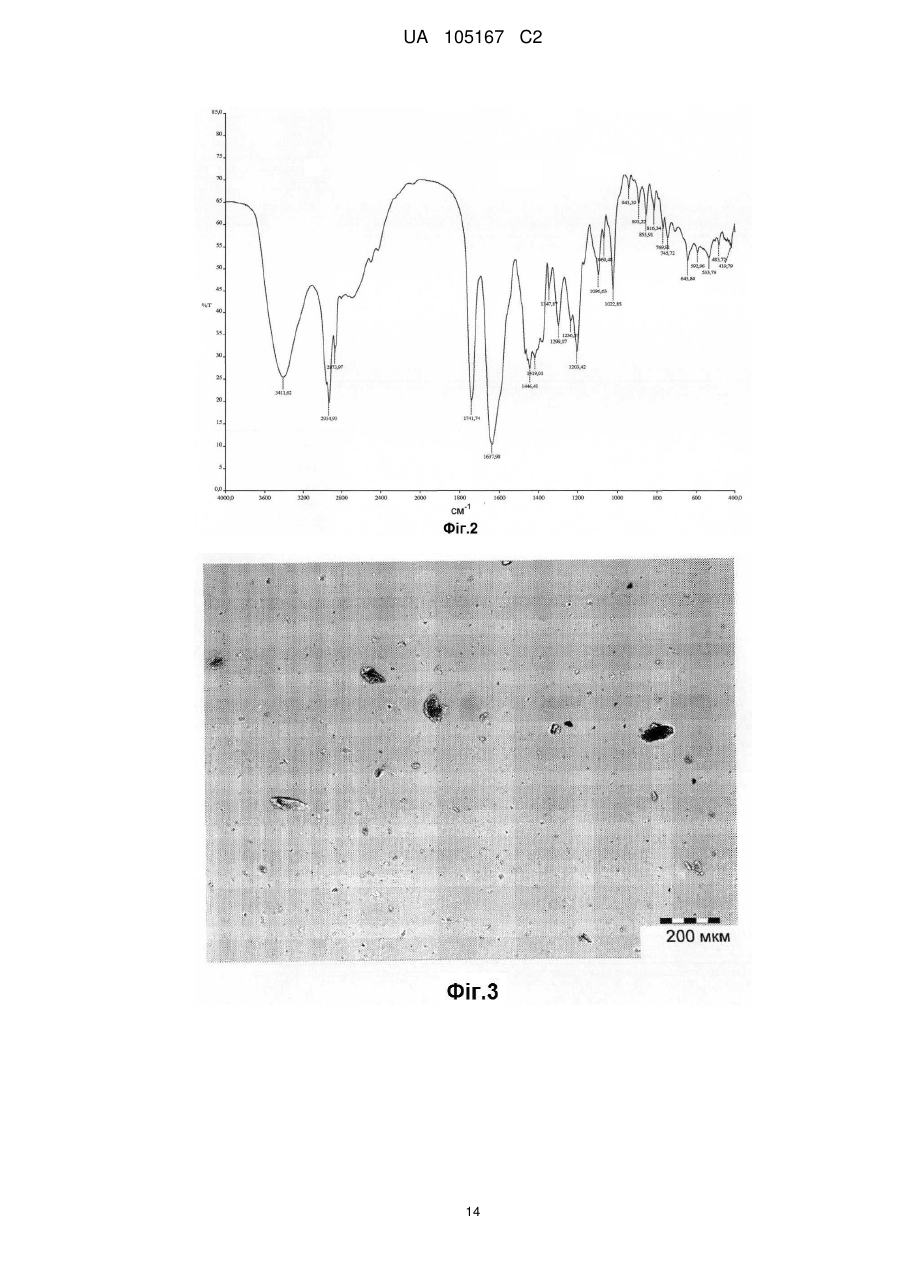
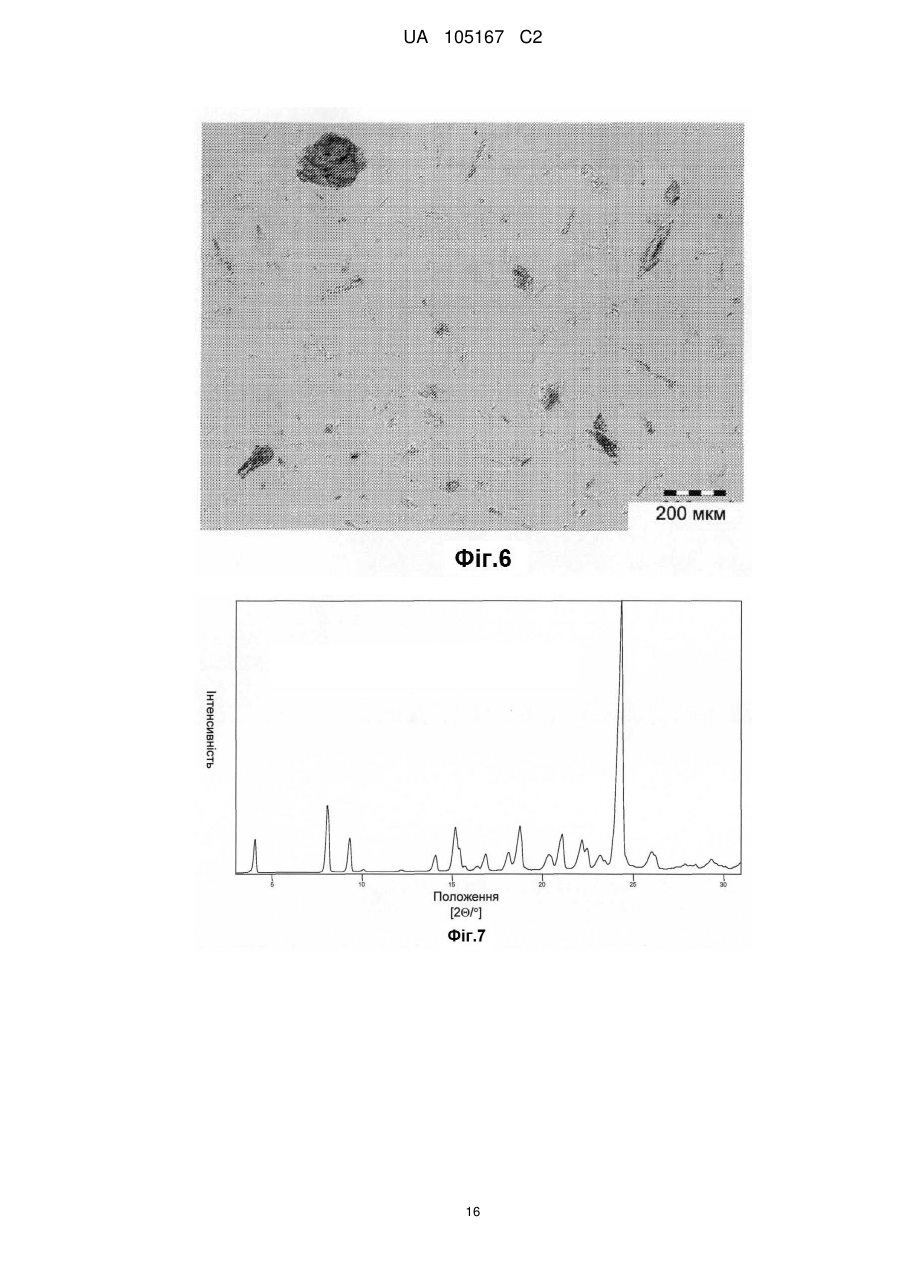
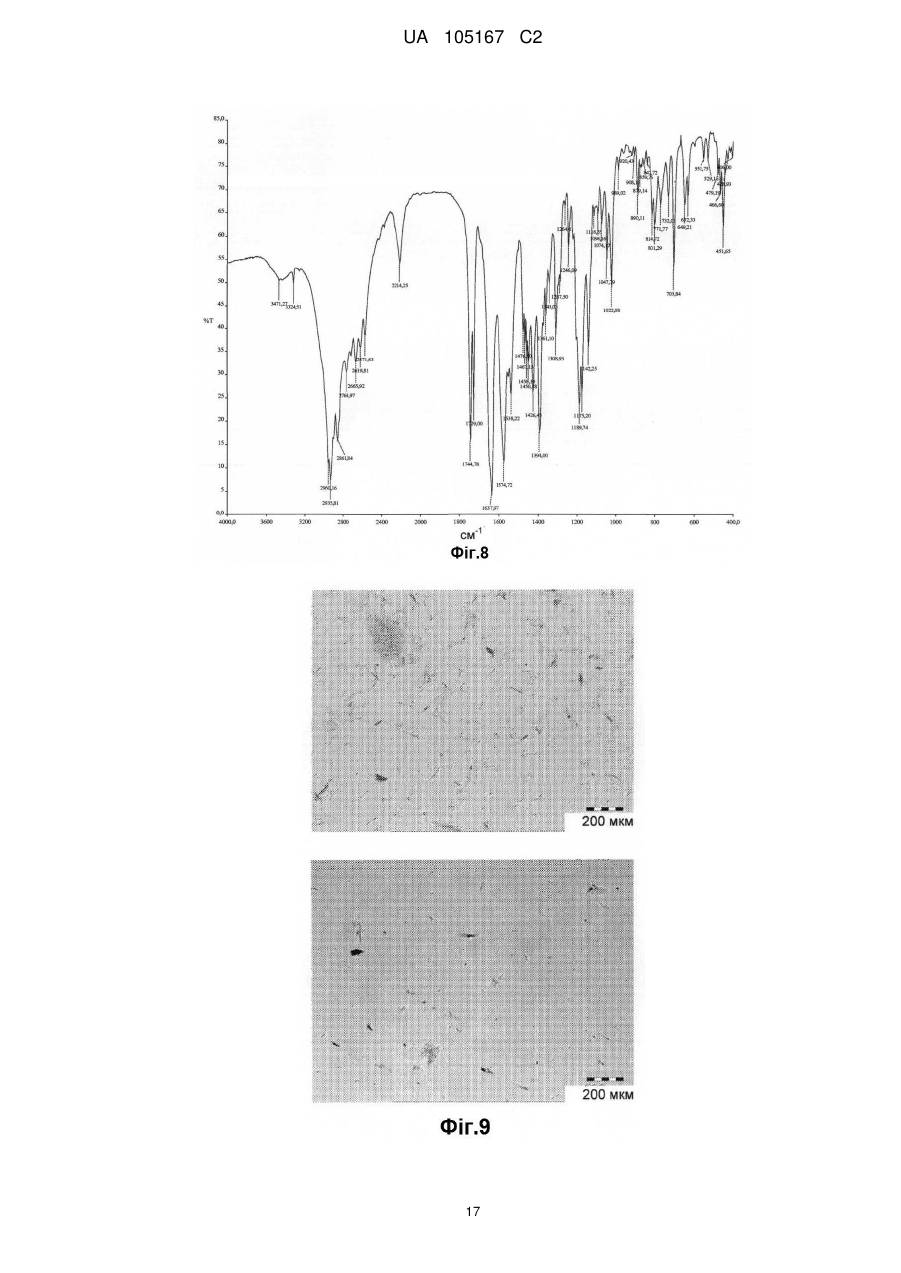
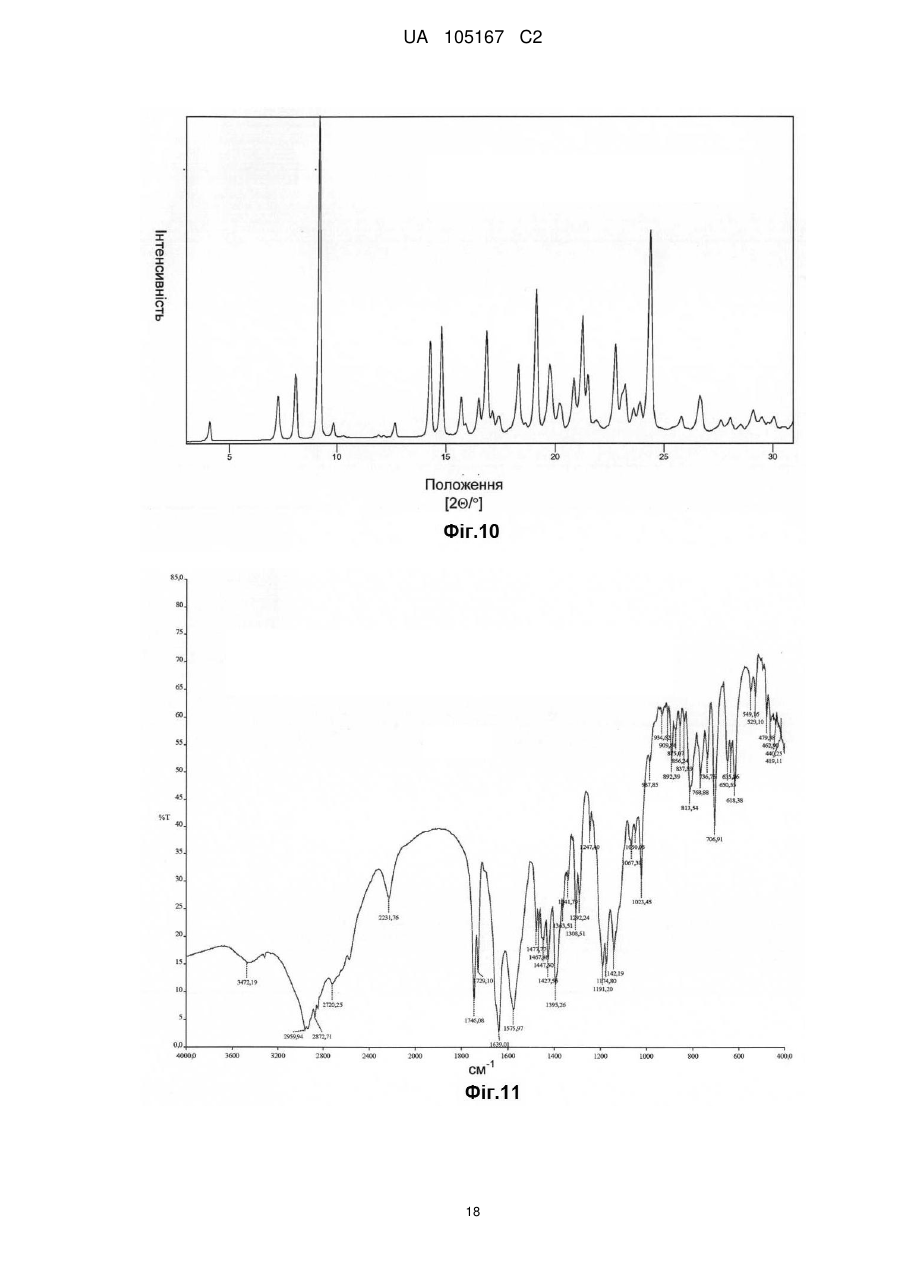
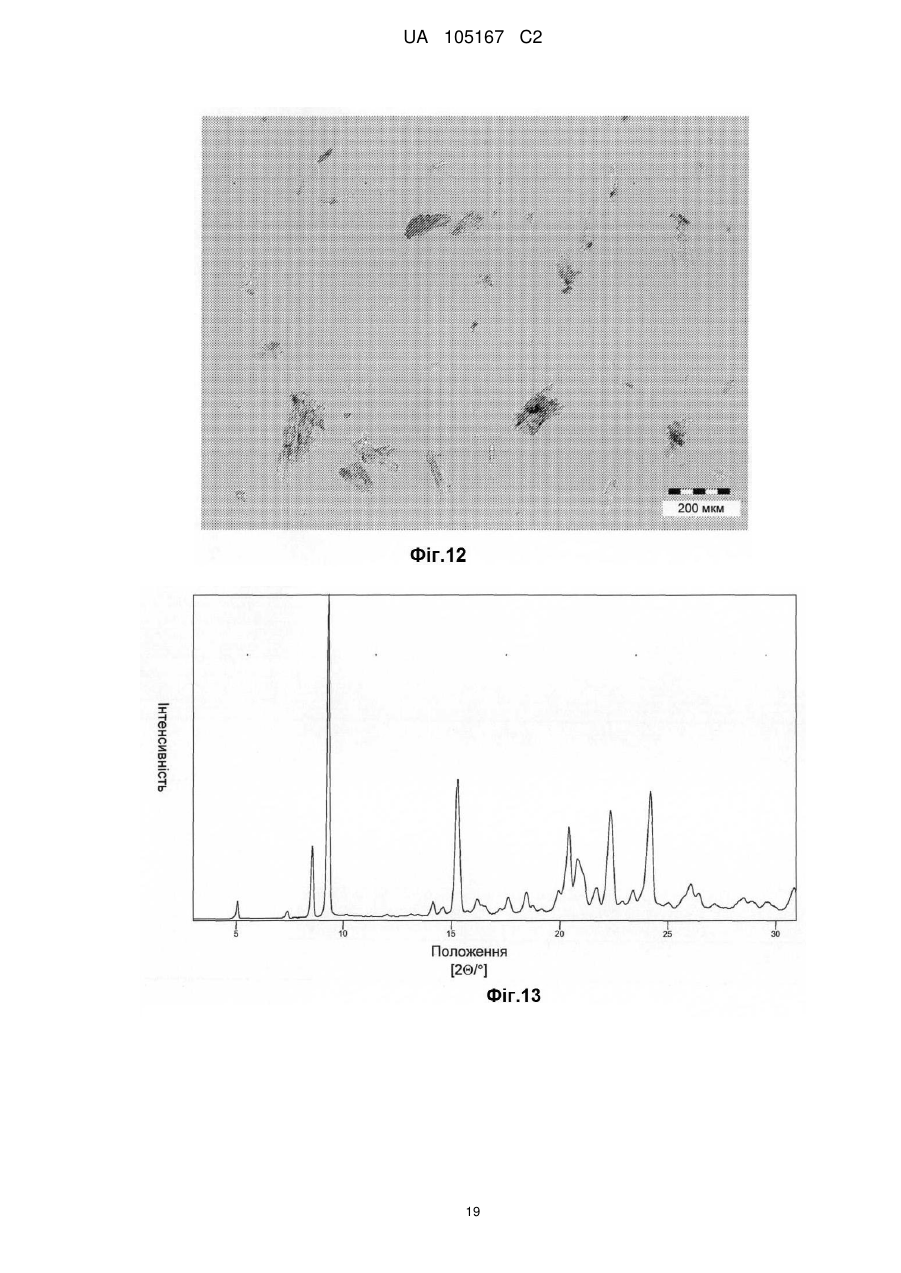
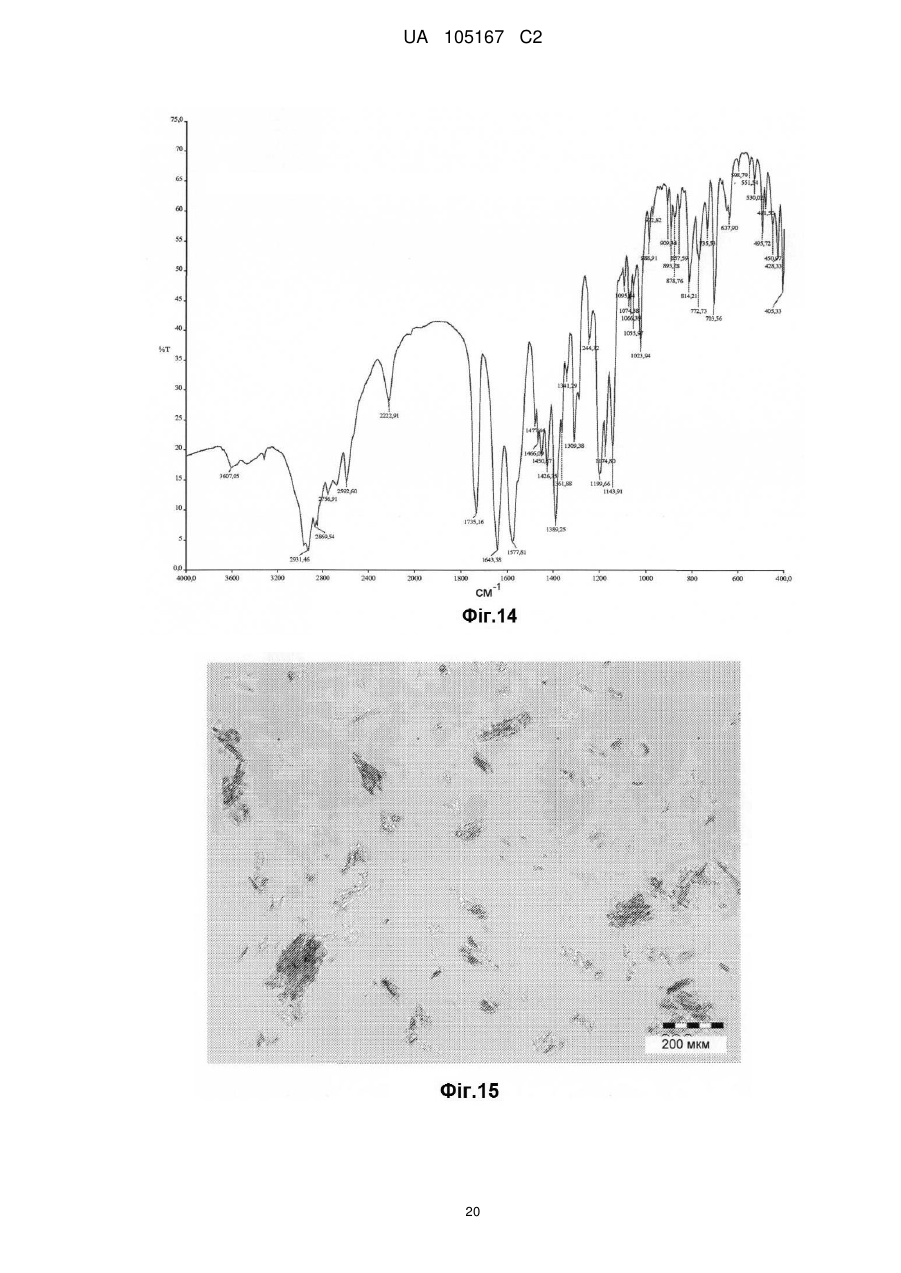
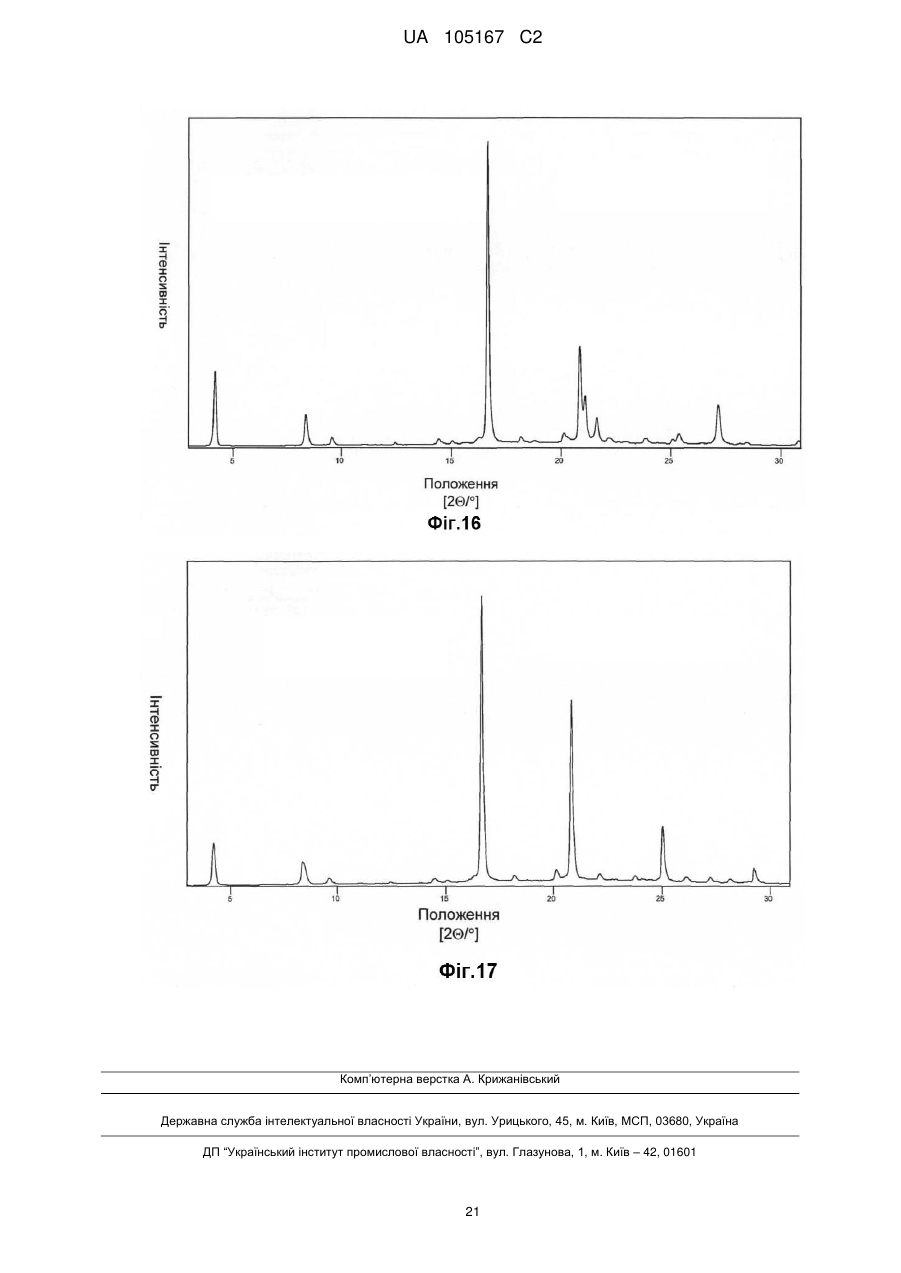
Реферат: Даний винахід стосується нових солей периндоприлу, зокрема нової кальцієвої солі та нових аміносолей периндоприлу, способу їх одержання та фармацевтичних препаратів, що містять ці солі. UA 105167 C2 (12) UA 105167 C2 UA 105167 C2 5 10 15 20 25 30 35 40 45 50 55 Область винаходу Даний винахід відноситься до області органічної хімії і до нових солей періндоприлу, способу виготовлення нових солей і фармацевтичних композицій, що включають ці солі. Періндоприл є сполукою, що має активність інгібуючу ACE, (ацетилхолінестеразу). Технічне завдання Існує потреба в нових солях періндоприлу, які можуть бути виготовлені простим і відповідним промисловим вимогам способом, а також можуть застосовуватися для виготовлення нових фармацевтичних композицій, що забезпечують прийнятну біодоступність і стабільність продукту. Попередній рівень техніки Періндоприл, що має хімічну назву (2S, 3aS, 7aS)-1-((2S)-2-(((1S)-1етоксикарбоніл)бутил)аміно-1-оксопропіл)окта гідро-1H-індол-2-карбонова кислота, описаний в EP 49 658. Його синтез є багатостадійним і включає розділення ізомерів за допомогою колоночної хроматографії. EP 308 341 розкриває покращуваний синтез періндоприлу у формі трет-бутиламінової солі в промисловому масштабі. Синтез включає реакцію між паратолуолсульфоновою сіллю бензилового ефіру (2S, 3aS, 7aS)-октагідроіндол-2-карбонової кислоти і N-((S)-1-карбетоксибутил) -L-аланіном у присутності триетиламіну, N, Nдициклогексилкарбодиіміду і 1-гідроксибензотріазолу. Після завершення реакції одержують бензиловий ефір періндоприлу, який потім відновлюють, ліофілізують і перетворюють на сіль за допомогою трет-бутиламіну в етилацетаті. Поліморфні форми трет-бутиламінової солі періндоприлу описані в EP 1 296 947, який розкриває форму альфа, одержану з етилацетату, в EP 1 294 689, який розкриває форму бета, одержану з дихлорметану або етилацетату, в EP 1 296 948, який розкриває форму гамма, одержану з хлорформа. У заявці на патент WO 2004/113293 компанія Azad розкриває нові дельта і іпсилон форми, одержаного за допомогою перекристалізації з трет-бутилметилового ефіру, що містить від 0,9 % до 2,5 % (об./об.) води. Кристалізація з різних розчинників і опис поліморфних форм розкриті в WO 2005/37788 від Lupin. У GB 2 395 195 і WO 2004/46172 компанія Cipla описує періндоприлу трет-бутиламіну моногідрат. У EP 1 647 547 від компанії Diagen описані форми гідратів, одержані за допомогою ліофілізації. Одержання поліморфних форм також описане в JP 2006-169169, JP 2006-290825, SI 21801, WO 2005/68425, WO 2007/17894, WO 2007/17893, WO 2007/20012, WO 2007/17087 і WO 2007/20009. Аміносолі періндоприлу також описані в WO 2006/97941 і WO 2007/17087. Препарати описані в WO 2005/94793, WO 2005/68490, WO 2006/101462, WO 2007/25695, WO 2007/58634, RU 2 280 450 і RU 2 282 443. В даний час виявлено, що нові солі відповідно даного винаходу несподівано є стабільними і придатними для одержання фармацевтичних препаратів. Короткий опис графічних матеріалів. На Фіг. 1 представлена порошкова дифрактограма рентгенівських променів для кальцієвої солі періндоприлу гідрохлориду. На Фіг. 2 представлений спектр FT-IR (інфрачервоний спектр з перетворенням Фур'є) кальцієвої солі періндоприлу гідрохлориду|. На Фіг. 3 представлено мікроскопічне зображення частинок кальцієвої солі періндоприлу гідрохлориду. На Фіг. 4 представлена порошкова дифрактограма рентгенівських променів для циклогептиламінової солі періндоприлу. На Фіг. 5 представлений спектр FT-IR циклогептиламінової солі періндоприлу. На Фіг. 6 представлено мікроскопічне зображення частинок циклогептиламінової солі періндоприлу. На Фіг. 7 представлена порошкова дифрактограма рентгенівських променів для циклогептиламінової солі періндоприлу. На Фіг. 8 представлений спектр FT-IR циклогептиламінової солі періндоприлу. На Фіг. 9 представлено два мікроскопічні зображення частинок циклогексиламінової солі періндоприлу, частинок, що розрізняються розміром. На Фіг. 10 представлена порошкова дифрактограма рентгенівських променів для циклопентиламінової солі періндоприлу. На Фіг. 11 представлений спектр FT-IR циклопентиламінової солі періндоприлу. На Фіг. 12 представлено мікроскопічне зображення частинок циклопентиламінової солі періндоприлу. 1 UA 105167 C2 5 10 15 20 25 30 35 40 45 50 На Фіг. 13 представлена порошкова дифрактограма рентгенівських променів для вторбутиламінової солі періндоприлу. На Фіг. 14 представлений спектр FT-IR втор-бутиламінової солі періндоприлу. На Фіг. 15 представлено мікроскопічне зображення частинок втор-бутиламінової солі періндоприлу. На Фіг. 16 представлена порошкова дифрактограма рентгенівських променів для поліморфної форми Ml періндоприлу ербуміну. На Фіг. 17 представлена порошкова дифрактограма рентгенівських променів для поліморфної форми M2 періндоприлу ербуміну. Порошкові дифрактограми рентгенівських променів одержували за допомогою дифрактометра Phillips PW3040/60 X'Pert PRO з використанням CuKa-випромінювання 1,541874. Спектри FT-IR реєстрували за допомогою FT-IR апарату System Spectrum GX Perkin Elmer з -1 -1 дозволом 4 см , інтервал 4000-400 см з використанням KBr-дисків. Розмір частинок визначали за допомогою приладу Malvern Mastersizer на основі лазерної дифракції. Докладний опис винаходу Об'єктом даного винаходу є нові солі періндоприлу, спосіб їх одержання і фармацевтичні композиції, що містять нові солі. У першому аспекті даний винахід відноситься до кальцієвої солі періндоприлу або її сольвату. Кальцієву сіль згідно даного винаходу можна одержати відповідно до способу, що включає реакцію періндоприлу, який частково може знаходитися у формі солей або гідратів, з солями кальцію, такими як галогенові солі, карбонати, сульфати, ацетати, фосфати, і переважно, з хлоридом кальцію, в органічному розчиннику. Зазвичай одержану реакційну суміш нагрівають до температури від 30 °C до точки кипіння суміші, потім охолоджують і виділяють продукт. Переважно суміш охолоджують до температури від 25 °C до -5 °C, і особливо переважно, від 25 °C до 0 °C. Охолоджування можна проводити з використанням загальноприйнятих способів охолоджування, включаючи інкубацію при кімнатній температурі, а також його можна проводити при перемішуванні або без перемішування. Як органічні розчинники можна застосовувати нітрил, ефіри, вуглеводи, галогеновані вуглеводи, кетон, ефіри або суміші цих розчинників з водою. Переважно, застосовують ефіри і нітрил, такі як етилацетат і ацетонітрил. Кальцієва сіль згідно даного винаходу також може знаходитися у формі солі приєднання органічних або неорганічних кислот, таких як HCl, HBr, HI, малеїнова кислота і фумарова кислота, і, переважно, HCl. Особливо переважно кальцієва сіль періндоприлу гідрохлориду також характеризується картиною дифракції рентгенівських променів на порошці, яка по суті є такою, як представлено на Фіг. 1, або спектром FT-IR, який по суті є таким, як представлено на Фіг. 2. Солі приєднання кислоти згідно винаходу можна одержати шляхом реакції кальцієвої солі періндопилу у відповідному розчиннику з органічною або неорганічною кислотою. Особливо переважним розчинником є етилацетат. Іншим аспектом винаходу є нові алкіламінові солі періндоприлу, представлені структурною формулою: де R представляє C5-C7 циклоалкіл або втор-бутил. Група R переважно є циклопентил, циклогексил, циклогептил або втор-бутил. Нові солі згідно даного винаходу можна приготувати у формі сольватів, гідратів або в безводній формі. Автори винаходу виявили, що алкіламінові солі періндоприлу згідно винаходу несподівано можуть бути одержані в стабільній кристалічній формі, конкретніше, вони існують у формі, що має сильну кристалічність. Крім того, нові солі демонструють виняткову хімічну стабільність і, таким чином, їх застосовують для одержання стабільних фармацевтичних форм. Крім того, солі згідно даного винаходу можна застосовувати для очищення періндоприлу. Наступний аспект винаходу є нова циклогептиламінова сіль періндоприлу, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ° 2 UA 105167 C2 приблизно при (4,0, 9,0, 14,1, 15,2, 16,8, 18,1, 21,0, 24,1) ± 0,2. Далі вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, приведеними в таблиці 1. Таблиця 1 No. 1 2 3 4 5 6 7 8 Поз. [2Θ°] 4,0 9,0 14,1 15,2 16,8 18,1 21,0 24,1 d-значення [Å] 22,12 9,81 6,28 5,81 5,27 4,90 4,23 3,70 Відносн. Інт. [%] 18 46 41 47 41 57 57 100 5 10 Циклогептиламінова сіль відповідно до винаходу також характеризується порошковою дифрактограмою рентгенівських променів, по суті такою, як представлено|уявляти| на Фіг. 4, або спектром FT-IR, по суті таким, як представлено на Фіг. 5. Наступний аспект винаходу є нова циклогексиламінова сіль періндоприлу, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ° приблизно при (4,1, 8,1, 9,3, 15,2, 18,8, 21,1, 22,2, 24,3) ± 0,2. Крім того, вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, приведеними в таблиці 2. Таблиця 2 No. 1 2 3 4 5 6 7 8 Поз. [2Θ°] 4,0 9,0 14,1 15,2 16,8 18,1 21,0 24,1 d-значення [Å] 22,12 9,81 6,28 5,81 5,27 4,90 4,23 3,70 Відносн. Інт. [%] 18 46 41 47 41 57 57 100 15 20 Циклогексиламінова сіль згідно винаходу також характеризується дифракцією рентгенівських променів на порошці, по суті такою, як представлена на Фіг. 7 або спектром FTIR, по суті таким, як представлено на Фіг. 8. Наступний аспект винаходу є нова циклопентиламінова сіль періндоприлу, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ° приблизно при (8,1, 9,2, 16,9, 19,1, 19,8, 21,3, 22,8, 24,4) ± 0,2. Крім того, вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, представленими в таблиці 3. Таблиця 3 No. 1 2 3 4 5 6 7 8 Поз. [2Θ°] 8,1 9,2 16,9 19,1 19,8 21,3 22,8 24,4 d-значення [Å] 10,92 9,59 5,26 4,64 4,49 4,18 3,91 3,65 25 3 Відносн. Інт. [%] 21 100 34 47 24 39 31 65 UA 105167 C2 5 Циклопентиламінова сіль згідно винаходу також характеризується порошковою дифрактограмою рентгенівських променів, по суті такою, як представлено на Фіг. 10, або спектром FT-IR, по суті таким, як представлено на Фіг. 11. Наступний аспект винаходу є нова втор-бутиламінова сіль періндоприлу, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ° приблизно при (5,0, 8,6, 9.3, 15.3, 20.4, 20,8, 22.4, 24.2, 26.1) ± 0,2. Крім того, вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, представленими в таблиці 4. Таблиця 4 No. 1 2 3 4 5 6 7 8 9 Поз. [2Θ°] 5,0 8,6 9,3 15,3 20,4 20,8 22,4 24,2 26,1 d-значення [Å] 17,50 10,29 9,47 5,80 4,35 4,26 3,98 3,68 3,42 Відносн. Інт. [%] 5 23 100 45 29 19 34 40 10 10 15 20 25 30 Втор-бутіламінова сіль періндоприлу згідно винаходу також характеризується порошковою дифрактограмою рентгенівських променів, по суті такою, як представлено на Фіг. 13 або спектром FT-IR, по суті таким, як представлено на Фіг. 14. Наступним об'єктом винаходу є спосіб одержання аміносолей періндоприлу згідно винаходу, що включає додавання відповідного аміну в розчин періндоприлу в органічному розчиннику, нагрівання одержаної реакційної суміші до температури від 30 °C до точки кипіння реакційної суміші і виділення продукту. Як розчинник можна застосовувати нітрил, ефіри, вуглеводні, галогеновані вуглеводні, кетон, ефіри або суміші цих розчинників з водою. Переважно застосовують ефіри і нітрил, такі як етилацетат і ацетонітрил. Зокрема, суміш охолоджують до температури від 25 °C до -5 °C, переважно, від 25 °C до 0 °C. Після охолоджування до бажаної температури кристалізаційну суміш, як правило, далі перемішують при цій температурі в продовж від 15 хвилин до 24 годин, переважно, від 1 до 12 годин. У переважному втіленні осаджений продукт виділяють і сушать при зниженому тиску, переважно, від 30 мбар (30000 Па) до 100 мбар (100000 Па), і при температурі нижче 50 °C, переважно, при температурі від 30 °C до 45 °C. Зазвичай його сушать до досягнення постійної маси продукту. Вміст води в продукті після висушування складає у разі безводного продукту менше 1 %, переважно менше 0,5 %, і у разі гідратів менше 5 %, переважно, менше 4 %. Наступний аспект винаходу є новою поліморфною формою M1 періндоприлу ербуміну, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ приблизно при (4,2, 16,6, 21,1, 21.6, 25,4, 27.2) ± 0,2. Крім того, вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, представленими в таблиці 5. 35 Таблиця 5 No. 1 2 3 4 5 6 Поз. [2Θ] 4,2 16,6 21,1 21,6 25,4 27,2 d-значення [Å] 21,06 5,33 4,21 4,11 3,51 3,28 Відносн. Інт. [%] 25 100 16 9 4 13 Нова поліморфна форма M1 періндоприлу ербуміну також характеризується порошковою дифрактограмою рентгенівських променів, як представлено на Фіг. 16. 4 UA 105167 C2 5 Поліморфну форму M1 періндоприлу ербуміну одержують за допомогою мацерації в ацетонітрилі або етилацетаті. Мацерацію переважно здійснюють протягом приблизного 10 годин. Наступний аспект винаходу є нова поліморфна форма M2 періндоприлу ербуміну, що характеризується картиною дифракції рентгенівських променів на порошці, що має піки 2Θ° приблизно при (4,2, 16,6, 20,8, 25,0, 29,3) ± 0,2. Крім того, вона характеризується картиною дифракції рентгенівських променів на порошці і має піки з відносними інтенсивностями, приведеними в таблиці 6. Таблиця 6 No. 1 2 3 4 5 Поз.[2Θ] 4,2 16,6 20,8 25,0 29,3 d-значення [Å] 20,97 5,33 4,27 3,56 3,05 Відносн. Інт. [%] 15 100 65 20 5 10 15 20 25 30 35 40 45 50 Нова поліморфна форма M2 періндоприлу ербуміну також характеризується порошковою дифрактограмою рентгенівських променів, як представлено на Фіг. 17. Поліморфну форму M2 одержують при зберіганні форми M1 в закритих умовах при кімнатній температурі протягом тривалого періоду, зокрема, протягом приблизного 7 місяців. Зберігання переважно здійснюють в закритому скляному контейнері. Розмір частинок солей періндоприлу відповідно до даного винаходу може складати 0,1-300 мкм, переважно, 5-150 мкм, найпереважніше, 20-100 мкм. Розмір одержаних частинок залежить від рівня охолоджування розчину. Якщо потрібні дрібніші частинки, їх можна перемолоти або тонко подрібнити з іншими наповнювачами. В якості початкового матеріалу застосовують періндоприл, можна застосовувати неочищений продукт, одержаний відповідно до будь-якого відомого способу, наприклад, за допомогою способу синтезу, описаного в WO 05/113500 і WO 2007/62865, або будь-яку відому поліморфну форму, а також сольвати або гідрати періндоприлу і інші солі періндоприлу. Нові солі періндоприлу згідно даного винаходу можна застосовувати як терапевтично активні речовини, які разом з фармацевтично відповідним носієм можна застосовувати як лікарський засіб. Даний лікарський засіб можна застосовувати для лікування серцево-судинних захворювань, зокрема, для лікування гіпертонії і серцевої недостатності. Наступний об'єкт даного винаходу є фармацевтична композиція, що містить нові аміносолі періндоприлу або кальцієву сіль періндоприлу згідно даного винаходу, а також їх комбінації з індапамідом або амлодипіном, або їх солями. Як фармацевтично придатні допоміжні речовини можна застосовувати речовини, загалом відомі фахівцям в області фармакології. Фармацевтичний препарат можна одержати за допомогою способів, відомих фахівцям в області фармакології, таких як пряме пресування, суха грануляція або волога грануляція. Фармацевтичні препарати, що містять нові солі згідно даного винаходу, можна одержати відповідно до прикладів, описаних в попередньому рівні техніки, наприклад в WO 2005/094793, FR 2 771 010 і GB 2 394 660. Фармацевтичні препарати згідно даного винаходу містять, щонайменше, одну допоміжну речовину, вибрану з групи наповнювачів або носіїв, зв'язуючих речовин, розпушувачів, стабілізаторів, змащуючих, ковзаючих речовин, поверхнево-активних речовин, підсолоджувачів, ароматизаторів і так далі. Наповнювачі можна вибрати (без обмеження) з лактози в різних формах (безводної, моногідрата, висушеної розпилюванням лактози і так далі), мікрокристалічної целюлози, порошкоподібної целюлози, силікатованої мікрокристалічної целюлози, крохмалів, фосфату кальцію, гідрофосфата кальцію, карбонату кальцію, сахарози, глюкози, фруктози, декстратів, мальтодекстринів, інших сахарів, таких як маніт, лактит, ксиліт, сорбіт, лактат кальцію, або комбінованих наповнювачів. Фармацевтичні препарати згідно винаходу переважно містять 6080 % моногідрата лактози і 15-30 % мікрокристалічної целюлози. Фармацевтичні препарати згідно даного винаходу також можуть містити зв'язуючі речовини, такі як повідон, мікрокристалічна целюлоза, гідроксиетилцелюлоза, гідроксипропілцелюлоза, слабозаміщена гідроксипропілцелюлоза, гідроксипропілметилцелюлоза або інші ефіри целюлози, крохмаль, пептизований крохмаль, желатин, поліметакрилат або суміш зв'язуючих речовин. 5 UA 105167 C2 5 10 15 20 25 30 35 40 45 50 55 Крім того, можуть бути присутніми розпушувачі і/або суперрозпушувачі, такі як крохмалі (наприклад, кукурудзяний крохмаль, картопляний крохмаль), модифіковані крохмалі (натрію крохмалю гліколят), модифікована целюлоза (кроскармелоза, тобто поперечна зшита натрій карбоксиметилцелюлоза), поперечний зшитий полівінілпіролідон (кросповідон), мікрокристалічна целюлоза, натрій карбоксиметилцелюлоза, Amberlite®, альгінова кислота, альгінат натрію, гуарова камедь, гелланова камедь, ксантан SM або силікат кальцію. Переважно, допоміжні речовини включають, щонайменше, один розпушувач або суперрозпушувач, вибраний з кроскармелози, кросповідону і мікрокристалічної целюлози. Переважніше застосовують суперрозпушувач кросповідон в кількості 2-10 %, і ще переважніше в кількості 4-9 %. Як додаткові допоміжні речовини можуть бути присутніми змащуючі речовини, такі як стеаринова кислота, стеарат магнію, стеарат кальцію, натрію лаурилсульфат, гідрогенізована рослинна олія, гідрогенізована касторова олія, натрію стеарилфумарат, тальк, поліетиленгліколі. Переважно, допоміжні речовини включають, щонайменше, одну змащуючу речовину, вибрану із стеарату магнію, натрію стеарилфумарату і тальку. До композиції згідно винаходу також можна додавати ковзаючі речовини. Їх можна вибрати з групи, що містить тальк і силікон різних типів (таких як колоїдний або осаджений|осаджений| діоксид кремнію) і так далі. Допоміжні речовини можуть мати декілька функцій, тобто одна допоміжна речовина може бути наповнювачем і додатковою зв'язуючою речовиною, зв'язуючою речовиною і розпушувачем, і так далі. Для одержання фармацевтичних композицій згідно даного винаходу можна застосовувати будь-який відповідний спосіб, такий як пряме пресування, вологу (водна або спиртна) або суху грануляцію, і так далі. У переважному втіленні винахід також відноситься до фармацевтичної композиції, яку одержують за допомогою способу, що включає грануляцію суміші допоміжних речовин з розчином, що містить періндоприл, або його сіль, а також неорганічну сіль кальцію. Переважно неорганічна сіль кальцію є хлоридом кальцію. Розчинник зокрема є сумішшю води з етанолом. Фармацевтичні композиції зазвичай представлені в упаковці, причому переважною блистерна упаковка. Композиції можуть бути упаковані|пакувати| в матеріал, який у великій мірі|великою мірою непроникний для газообміну, такий як упаковка, що має атмосферу із зниженим наскільки це потрібно вмістом кисню. Переважно, упаковку, по суті непроникну для газообміну, вибирають з групи, що складається з Al/Al блістера, Al-поліхлор-3фторетиленгомополімерного/PVC ламінатного блістера або пляшки. Даний винахід проілюстрований наступними прикладами, але не обмежений ними. Приклади Одержання періндоприлу ербуміну Приклад 1 2-метилпропан-2-амінова сіль періндоприлу (2S, 3aS, 7aS) -1-((2S)-2-(((1R)-1етоксикарбоніл)бутил)аміно-1-оксопропіл)октогідро-1H-індол-2-карбонової кислоти) або періндоприлу ербумін| До (2S, 3aS, 7aS)-октоідроіндол-2-карбонової кислоти (7,44 г) в дихлорметані (80 мл) при 2025 °C додавали триметилхлорсилан (5,84 мл) і триетиламін (6,4 мл), і цю суміш перемішували при 20-25 °C протягом двох годин. Через 2 години додавали триетиламін (5,54 мл), суспензію охолоджували до -15 °C, вливали в неї суспензію N-((S)-1-карбетоксибутил) -L-аланілхлориду гідрохлориду (11 г) в дихлорметані (80 мл), охолоджену до -15 °C, і продовжували перемішування при температурі від 0 °C до -5 °C протягом двох годин. Реакційний розчин нагрівали до 0 °C, осаджений триетиламін гідрохлорид фільтрували і промивали дихлорметаном (20 мл), і до фільтрату додавали воду (66 мл), в якій був розчинений NаOH (1,6 г), і доводили pH до 4,2 20 % розчином NаOH. Органічну фазу відокремлювали, а водний шар відмивали удвічі більшою кількістю дихлорметану (40 мл). Об'єднані дихлорметанові шари упарювали, залишок розчиняли в ізопропілуцетаті (250 мл), нерозчинену частину фільтрували і до фільтрату додавали трет-бутиламін (4,4 мл). Осаджені кристали розчиняли при точці кипіння розчину, прозорий розчин охолоджували до 10-20 °C, після цього продовжували перемішувати протягом двох годин. Через дві години осаджені кристали фільтрували, промивали ізопропілуцетатом (30 мл) і сушили при 35-40 °C в повітряній сушарці. Одержували 15,3 г періндоприлу ербуміну у формі альфа з чистотою більше 99 %, вміст окремих домішок не перевищував 0,1 %. Приклад 2 Періндоприлу ербумін 6 UA 105167 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суспензії (2S, 3aS, 7aS)-октогідро-1H-індол-2-карбонової кислоти (1,86 г; 0,011 M) в дихлорметані (40 мл) додавали триметилхлорсилан (2,93 мл; 0,22 M) і триетиламін (3,07 мл; 0,022 M), і услід за цим продовжували перемішування протягом 3 годин при 20-25 °C. Через 3 години до суспензії, охолодженої до -10 °C, додавали охолоджений розчин заздалегідь приготованого активованого N-((S)-1-карбетоксибутил) -(S) -аланіну, який готували таким чином: розчин N-((S)-1-карбетоксибутил) -(S) -аланіну (2,17 г; 0,01 M) і імідазолу (2,73 г; 0,04 M) в дихлорметані (40 мл) охолоджували до -10 °C, і до нього додавали тіонілхлорид (0,76 мл; 0,0115 M), і потім продовжували перемішувати протягом 2 годин при 20-25 °C. Через дві години імідазолу гідрохлорид фільтрували, і фільтрат охолоджували до -10 °C. Після закінчення додавання активованого N-((S)-1-карбетоксибутил) -(S) -аланіну продовжували перемішування протягом 3 годин при -10 °C, і потім протягом наступних 18 годин при 20-25 °C. Після завершення реакції додавали воду (25 мл), pH доводили до 5-6 20 % розчином NаOH, шари розділяли, і водний шар екстрагували удвічі більшою кількістю дихлорметану (15 мл). Летючі компоненти об'єднаних органічних шарів випаровували, маслянистий залишок суспендували в ацетонітрилі (75 мл), нерозчинену частину фільтрували, і до фільтрату додавали третбутиламін (1,11 мл; 0,01 M). Суспензію нагрівали до точки кипіння розчину, прозорий розчин охолоджували до 20-25 °C, і осаджені кристали фільтрували. Після висушування при 40-45 °C одержували 2,69 г періндоприлу ербуміну. Приклад 3 Періндоприлу ербумін Періндоприлу ербумін (6,0 г) розчиняли в розчиннику - суміші етилацетату (90 мл) і води (1,2 мл), і до неї додавали трет-бутиламін (0,1 мл). Реакційну суміш нагрівали до температури дефлегмації. Розчин охолоджували до кімнатної температури і мацерували при кімнатній температурі протягом ночі. Його охолоджували до 3 °C і мацерували протягом ще двох годин при цій температурі. Охолоджений осад фільтрували і ретельно подрібнювали на фільтрі. Ретельно подрібнений продукт сушили у вакуумній сушарці при 40 °C протягом ночі. Одержували 5,48 г (91 %) періндоприлу ербуміну (KF=0,82 %). ("KF" відноситься до вмісту води, визначуваного способом згідно Карла Фішера) Приклад 4 Періндоприлу ербумін Періндоприлу ербумін (3,0 г) розчиняли в суміші розчинників ізопропілу ацетату (45 мл) і води (0,6 мл). Реакційну суміш нагрівали до температури дефлегмації. Розчин охолоджували до кімнатної температури і мацерували при кімнатній температурі протягом ночі. Його охолоджували до -10 °C і мацерували протягом ще чотирьох годин при цій температурі. Охолоджений осад фільтрували і ретельно подрібнювали на фільтрі. Відфільтрований продукт сушили у вакуумній сушці при 40 °C протягом ночі. Одержали 2,81 г (93 %) періндоприлу ербуміну (KF = 0,85 %). Одержання періндоприлу Приклад 5 Одержання періндоприлу з періндоприлу ербуміну Періндоприлу ербумін (151,2 г) суспендували в етанолі (1500 мл), по краплях додавали H2SO4 (11,2 мл) при 20-25 °C, і далі перемішували протягом 1,5 годин. Осад фільтрували, а фільтрат упарювали. До маслянистого залишку додавали дихлорметан (625 мл) і воду (625 мл), і pH доводили до 4,2 за допомогою 10 % розчину NaOH. Органічний шар відокремлювали, а водний шар знову екстрагували дихлорметаном (500 мл). Об'єднані органічні шари упарювали, і одержували 125,3 г пінистого залишку періндоприлу. Приклад 6 Одержання періндоприлу з періндоприлу ербуміну з СаСl2 Періндоприлу ербумін (5,5 г) суспендували в етилацетаті (82 мл), додавали гексагідрат хлориду кальцію (1,375 г), і суспензію нагрівали до температури кипіння суспензії. Суспензію охолоджували до 20-25 °C і далі перемішували протягом 2 годин. Осад фільтрували, до фільтрату додавали воду (40 мл), pH доводили до 5, шари розділяли, і водний шар знову екстрагували етилацетатом (40 мл). Об'єднані шари етилацетату упарювали, і одержували 3,27 г пінистого залишку періндоприлу. Одержання аміносолей періндоприлу Приклад 7 Одержання циклогексиламінової солі періндоприлу Періндоприл (88,34 г), одержаний відповідно до описаного вище способу (синтез за прикладом 1 або 2, де після екстракції дихлорметанові шари об'єднували і упарювали), розчиняли в ацетонітрилі (1700 мл), до них додавали циклогексиламін (29 мл), і суспензію 7 UA 105167 C2 5 10 15 20 25 30 35 40 45 50 55 60 нагрівали до точки кипіння розчину. Прозорий розчин охолоджували до 20-25 °C, і потім перемішували протягом ще двох годин, осаджені кристали фільтрували, відмивали 2×200 мл ацетонітрилу| і сушили у вакуумній сушці при 40 °C. Одержували 93 г циклогексиламінової солі періндоприлу, чистота відповідно до ВЕРХ 99,8 %. Приклад 8 Одержання (±) втор-бутиламінової солі періндоприлу Періндоприл (41,6 г), одержаний відповідно до описаного вище способу (синтез за прикладом 1 або 2, де після екстракції дихлорметанові шари об'єднували і випаровували), розчиняли в ацетонітрилі (627 мл), і додавали (±) втор-бутиламінову сіль (11,48 мл), суспензію нагрівали до точки кипіння розчину. Прозорий розчин охолоджували до 20-25 °C, і потім перемішували протягом ночі. Суспензію охолоджували до 10-15 °C, осаджені кристали фільтрували, промивали 100 мл охолодженого ацетонітрилу і висушували. Одержували 43 г (±) втор-бутиламінової солі, чистота відповідно до ВЕРХ 99,9 %. Приклад 9 Одержання циклопентиламінової солі періндоприлу Періндоприл (41,6 г), одержаний відповідно до описаного вище способу, розчиняли в ацетонітрилі (627 мл), додавали циклопентиламін (11,2 мл), і суспензію нагрівали до точки кипіння розчину. Прозорий розчин охолоджували до 20-25 °C, і потім перемішували протягом ночі. Суспензію охолоджували до 10-15 °C, осаджені кристали фільтрували і промивали 100 мл охолодженого ацетонітрилу. Їх знову суспендували в ацетонітрилі| (310 мл), а осад фільтрували і висушували. Одержували|одержували 20 г циклопентиламінової солі періндоприлу, чистота відповідно до ВЕРХ 99,9 %. Приклад 10 Одержання циклогептиламінової солі періндоприлу Періндоприл (41,6 г), одержаний| відповідно до описаного вище способу, розчиняли в ацетонітрилі (627 мл), додавали циклогептиламін (14,47 мл), і суспензію нагрівали до точки кипіння розчину. Прозорий розчин охолоджували до 20-25 °C, і потім перемішували протягом ночі. Суспензію охолоджували до 10-15 °C, осаджені кристали фільтрували, відмивали 100 мл охолодженого ацетонітрилу і висушували. Одержували 49,7 г циклогептиламінової солі періндоприлу, чистота відповідно до ВЕРХ 99,9 %. Одержання кальцієвої солі періндоприлу Приклад 11 Одержання кальцієвої солі періндоприлу гідрохлориду Періндоприлу ербумін (110 г) суспендували в етилацетаті (1650 мл), додавали кальцію хлориду гексагідрат (27,5 г), і суспензію нагрівали до точки кипіння суспензії. Суспензію охолоджували до 20-25 °C і потім перемішували протягом ночі. Осад фільтрували, фільтрат упарювали, маслянистий осад розчиняли в етилацетаті (1500 мл), і в розчин вводили хлорид водню (10,2 г). Через дві години перемішування при 20-25 °C осад фільтрували, відмивали етилацетатом (100 мл) і висушували в умовах вакууму. Одержували 96,5 г кальцієвої солі періндоприлу гідрохлориду, чистота відповідно до ВЕРХ 99,4 %. Приклад 12 Одержання кальцієвої солі періндоприлу Періндоприлу ербумін (5,5 г) суспендували в етилацетаті (82 мл), додавали кальцію хлориду гексагідрат (1,375 г), і суспензію нагрівали до точки кипіння суспензії. Суспензію охолоджували до 20-25 °C і потім перемішували протягом ночі. Осад фільтрували, а фільтрат випаровували. Одержували 4,9 г склоподібної кальцієвої солі періндоприлу. Одержання поліморфної форми M1 періндоприлу ербуміну Приклад 13 Періндоприлу ербумін| (10 г) мацерували в ацетонітрилі (100 мл) протягом 10 годин, і після цього продукт фільтрували. Приклад 14 Періндоприлу ербумін (10 г) мацерували в етилацетаті (100 мл) протягом 10 годин і після цього продукт фільтрували. Одержання поліморфної форми M2 періндоприлу ербуміну Приклад 15 Поліморфну форму M1 зберігали в герметичних умовах при кімнатній температурі протягом 7 місяців. Наступними прикладами є приклади препаратів з новими солями періндоприлу відповідно до винаходу. Препарати з періндоприлу ербуміном 8 UA 105167 C2 F1 Кількість (мг/пігулка) 4,00* 22,50 63,26 8,00 1,52 0,27 0,45 100,00 Періндоприлу ербумін Мікрокристалічна целюлоза Лактози моногідрат Кросповідон Гідрокарбонат натрію Хлориду кальцію гексагідрат Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки F2 Кількість (мг/пігулка) 4,00* 22,50 63,78 8,00 1,00 0,27 0,45 100,00 * відповідає 3,34 мг періндоприлу 5 10 Приклад F1: Препарат готували за допомогою вологої грануляції. Суміш мікрокристалічної целюлози, лактози і кросповідону гранулювали з водою або водно-етанольним розчином періндоприлу ербуміну і гідрокарбонату натрію в молярному відношенні 1:2. Приклад F2: Препарат готували шляхом вологої грануляції. Суміш мікрокристалічної целюлози, лактози і кросповідону гранулювали з водою або водно-етанольним розчином періндоприлу ербуміну і хлориду кальцію з молярним відношенням 2:1. Рідину для грануляції готували таким чином: періндоприл ербумін і хлорид кальцію в молярному відношенні 2:1 додавали до води або водно-етанольного розчину, і потім перемішували до утворення прозорого розчину. Періндоприлу ербумін Мікрокристалічна целюлоза (Avicel PH112) Лактози моногідрат Кросповідон Хлориду кальцію гексагідрат Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки F2a Кількість (мг/пігулка) 8,00* 45,00 127,16 16,00 2,40 0,54 0,90 200,00 * відповідає 6,68 мг періндоприлу 15 20 Приклад F2a: Препарат готували способом вологої грануляції. Суміш лактози і кросповідону гранулювали з водним розчином періндоприлу ербуміну і хлориду кальцію. Грануляційну рідину готували таким чином: періндоприлу ербумін і хлорид кальцію додавали у воду і перемішували до утворення прозорого розчину. Одержаний гранулят змішували з мікрокристаліновою целюлозою і колоїдним діоксидом кремнію. До суміші додавали стеарат магнію і остаточно змішували. Потім суміш, що таблетують, пресували в пігулковому апараті. Препарати з кальцієвою сіллю періндоприлу гідрохлорида F3 Кількість (мг/пігулка) 3,84* 22,50 66,42 5,00 1,52 0,27 0,45 Кальцієва сіль періндоприлу гідрохлорида Мікрокристалічна целюлоза Лактози моногідрат Кросповідон Гідрокарбонат натрію Колоїдний діоксид кремнію, безводний Стеарат магнію 9 F4 Кількість (мг/пігулка) 3,84* 22,50 71,42 1,52 0,27 0,45 UA 105167 C2 Продовження Маса пігулки 100,00 100,00 * відповідає 3,34 мг періндоприлу 5 Приклад F3: Препарат готували способом вологої грануляції. Суміш мікрокристалічної целюлози, лактози і кросповідону гранулювали з водою або водно-етанольним розчином кальцієвої солі періндоприлу гідрохлориду і гідрокарбонату натрію в молярному відношенні 1:4. Приклад F4: Препарат готували способом прямого таблетування. Кальцієву сіль періндоприлу гідрохлориду, мікрокристалічну целюлозу, лактозу, гідрокарбонат натрію, колоїдний діоксид кремнію і стеарат магнію змішували до утворення гомогенної маси. Препарат з кальцієвою сіллю періндоприлу 10 Кальцієва сіль періндоприлу Мікрокристалічна целюлоза Лактози моногідрат Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки F5 Кількість (мг/пігулка) 3,52* 22,50 73,26 0,27 0,45 100,00 * відповідає 3,34 мг періндоприлу 15 Приклад F5: Препарат готували за допомогою прямого таблетування. Кальцієву сіль періндоприлу, мікрокристалічну целюлозу, лактози моногідрат, безводний колоїдний діоксид кремнію і стеарат магнію перемішували до гомогенного стану. Препарат з циклогексиламіновою сіллю періндоприлу F6 Кількість (мг/пігулку) 4,24* 22,50 70,05 0,76 2,00 0,45 100,00 Циклогексиламінова сіль періндоприлу Мікрокристалічна целюлоза Лактози моногідрат Гідрокарбонат натрію Тальк Стеарат магнію Маса пігулки * відповідає 3,34 мг періндоприлу; як амінова сіль періндоприлу можна застосовувати будьяку сіль згідно даного винаходу в кількості, відповідній 3,34 мг періндоприлу 20 Приклад F6: Препарат готували за допомогою прямого таблетування. Циклогексиламінову сіль періндоприлу, еквімолярна кількість натрію гідрокарбонату, мікрокристалічної целюлози, лактози, тальку і стеарату магнію змішували до гомогенного стану. Препарати з періндоприлу ербуміном і індапамідом F7 Кількість (мг/пігулка) 2,000* 0,625 Періндоприлу ербумін Індапамід Мікрокристалічна целюлоза (Avicel PH112) Лактози моногідрат F8 Кількість (мг/пігулка) 4,00* 1,25 11,250 31,165 10 22,50 62,33 UA 105167 C2 Продовженння Кросповідон Хлориду кальцію гексагідрат Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки 4,000 0,600 0,135 0,225 50,00 8,00 1,20 0,27 0,45 100,00 * Відповідає 1,67 мг періндоприлу або 3,34 мг періндоприлу, відповідно 5 Приклади F7 і F8: Препарат готували за допомогою вологої грануляції. Суміш індапаміду, лактози і кросповідону гранулювали з водним розчином періндоприлу ербуміну і хлориду кальцію. Рідину для грануляції готували таким чином: періндоприлу ербумін і хлорид кальцію додавали у воду і перемішували до утворення прозорого розчину. Одержаний гранулят змішували з мікрокристалічною целюлозою і колоїдним діоксидом кремнію. До суміші додавали стеарат магнію і остаточно змішували. Суміш для таблетування пресували в апараті в пігулки. F7a Кількість (мг/пігулка) 2,000* 0,625 Періндоприлу ербумін Індапамід Мікрокристалічна целюлоза (Avicel PH112) Лактози моногідрат Кросповідон Хлориду кальцію гексагідрат Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки F8a Кількість (мг/пігулка) 4,00* 1,25 11,250 22,50 31,165 4,000 0,600 0,135 0,225 50,00 62,33 8,00 1,20 0,27 0,45 100,00 * відповідає 1,67 мг періндоприлу або 3,34 мг періндоприлу відповідно 10 15 Приклади F7a і F8a: Препарат готували шляхом вологої грануляції. Суміш лактози і кросповідону гранулювали з водним розчином періндоприлу ербуміну і хлориду кальцію. Рідину для грануляції готували таким чином: періндоприлу ербумін і хлорид кальцію додавали у воду і перемішували до утворення прозорого розчину. Одержаний гранулят змішували до гомогенного стану з індапамідом, мікрокристалічною целюлозою і колоїдним діоксидом кремнію. До суміші додавали стеарат магнію і остаточно перемішували. Суміш для таблетування пресували в апараті пігулки. Препарати з періндоприлу ербуміном і амлодипіну безилатом F9 Кількість (мг/пігулку) Періндоприлу ербумін Амлодипіну безилат Гідрокарбонат натрію Мікрокристалічна целюлоза (Avicel PH112) Лактози моногідрат Кросповідон Хлориду кальцію гексагідрат Колоїдний діоксид кремнію, безводний Стеарат магнію 4,00* 6,94** 0,50 22,50 56,14 8,00 1,20 0,27 0,45 20 11 UA 105167 C2 Продовження Маса пігулки 100,00 * відповідає 3,34 мг періндоприлу ** відповідає 5 мг амлодипіну 5 10 Приклад F9: Препарат готували шляхом вологої грануляції. Суміш лактози і кросповідону гранулювали з водним розчином періндоприлу ербуміну і хлориду кальцію. Рідину для грануляції готували таким чином: періндоприлу ербумін і хлорид кальцію додавали у воду і перемішували до утворення прозорого розчину. Одержаний гранулят змішували з амлодипіну безилатом, мікрокристалічною целюлозою, гідрокарбонатом натрію і безводним колоїдним діоксидом кремнію. До суміші додавали стеарат магнію і остаточно змішували. Суміш для таблетування пресували в апараті пігулки. Також можна застосовувати безводний гідрофосфат кальцію (DiCafos A) або будь-який інший основний стабілізуючий агент замість гідрокарбонату натрію для корекції значення pH пігулки. Одержання інших концентрацій періндоприлу ербуміну/амлодипіну 4 мг/10 мг, 8 мг/5 мг і 8 мг/10 мг також можливо шляхом корекції маси пігулки за допомогою моногідрату лактози. 15 Періндоприлу ербумін Амлодипіна безилат Мікрокристалічна целюлоза Лактози моногідрат Гідрокарбонат натрію Колоїдний діоксид кремнію, безводний Стеарат магнію Маса пігулки F10 Кількість (мг/пігулку) 4,00* 6,94** 22,50 65,34 0,50 0,27 0,45 100,00 * відповідає 3,34 мг періндоприлу ** відповідає 5 мг амлодипіну 20 Приклад F10: Препарат готували шляхом прямого таблетування. Періндоприлу ербумін, амлодипіну безилат, гідрокарбонат натрію, мікрокристалічну целюлозу, безводну лактозу і безводний колоїдний кремній змішували до гомогенного стану. Додавали стеарат магнію і остаточно змішували. Одержану суміш для таблетування пресували в пігулки. Також замість гідрокарбонату натрію можна застосовувати безводний гідрофосфат кальцію (DiCafos A) для корекції значення pH пігулки. Одержання інших концентрацій періндоприлу ербуміну/амлодипіну 4 мг/10 мг, 8 мг/5 мг і 8 мг/10 мг також можливо шляхом корекції маси пігулки за допомогою моногідрату лактози 25 Періндоприлу ербумін Амлодипіну безилат Мікрокристалічна целюлоза (Avicel PH200 LM) Прежелатінізованний крохмаль (Крохмаль 1500) Натрію крохмалю гліколят (Тип A) Колоїдний діоксид кремнію, безводний Стеарат магнію F11 Кількість (мг/пігулку) 4,00* 6,94** 128,71 27,00 11,00 0,55 1,80 12 UA 105167 C2 Продовження Маса пігулки 180,00 * відповідає 3,34 мг періндоприлу ** відповідає 5 мг амлодипіну 5 10 15 20 25 Приклад F11: Препарат готували шляхом прямого таблетування. Періндоприлу ербумін, амлодипіну безилат, мікрокристалічну целюлозу, прежелатинізований крохмаль, натрію крохмалю гліколят і безводний колоїдний діоксид кремнію змішували до гомогенного стану. В кінці додавали стеарат магнію і змішували. Суміш для таблетування пресували в пігулки. Одержання інших концентрацій періндоприлу ербуміну/амлодипіну 4 мг/10 мг, 8 мг/5 мг і 8 мг/10мг також можливо шляхом корекції маси пігулки за допомогою моногідрату лактози. ФОРМУЛА ВИНАХОДУ 1. Кальцієва сіль периндоприлу або її сольват. 2. Кальцієва сіль за п. 1 у формі солі приєднання органічної або неорганічної кислоти. 3. Кальцієва сіль за п. 2, в якій органічна або неорганічна кислота вибрана з групи, що складається з НСl, НВr, НІ, малеїнової кислоти і фумарової кислоти. 4. Кальцієва сіль периндоприлу гідрохлориду. 5. Кальцієва сіль периндоприлу або її сольват за будь-яким з пп. 1-4 для застосування як лікарського засобу, особливо для лікування серцево-судинних захворювань. 6. Фармацевтична композиція, що містить кальцієву сіль периндоприлу або її сольват за будьяким з пп. 1-4. 7. Фармацевтична композиція за п. 6, яка може бути одержана способом, що включає грануляцію суміші допоміжних речовин з розчином, що містить периндоприл або його сіль, а також неорганічну сіль кальцію, зокрема хлорид кальцію. 8. Фармацевтична композиція за п. 7, в якій розчин включає воду або суміш води і етанолу як розчинник. 9. Спосіб одержання фармацевтичної композиції, що містить кальцієву сіль периндоприлу або її сольват за п. 6, в якому суміш наповнювачів гранулюють з розчином, що містить периндоприл або його солі та неорганічні солі кальцію, зокрема хлорид кальцію. 10. Спосіб за п. 9, в якому розчин включає воду або суміш води і етанолу як розчинник. 13 UA 105167 C2 14 UA 105167 C2 15 UA 105167 C2 16 UA 105167 C2 17 UA 105167 C2 18 UA 105167 C2 19 UA 105167 C2 20 UA 105167 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюSalts of perindopril
Автори англійськоюMerslavic, Marjo, Bombek, Sergeja, Gojak, Urska, Smrkolj, Matej, Zupet, Rok
Автори російськоюМерславик Марио, Бомбек Сергея, Гойяк Урска, Смрколь Матей, Зупет Рок
МПК / Мітки
МПК: A61P 9/00, C07D 209/34, A61K 31/404
Мітки: сіль, периндоприлу, сольват, кальцієва
Код посилання
<a href="https://ua.patents.su/23-105167-kalciehva-sil-perindoprilu-abo-solvat.html" target="_blank" rel="follow" title="База патентів України">Кальцієва сіль периндоприлу або її сольват</a>
Попередній патент: Вакуумний вимикач
Наступний патент: Позиціонер (варіанти)
Випадковий патент: Спосіб обробки матеріалів лазерним випромінюванням