Азациклогексапептидні сполуки, фармацевтична композиція і спосіб лікування (варіанти)
Номер патенту: 59329
Опубліковано: 15.09.2003
Автори: Блек Регіна М., БУФФАРД Френсіс Ейлін, БАЛКОВЕК Джеймс М.
Формула / Реферат
1. Соединения формулы
, (І)
где
R1 - Н или ОН;
R2 - Н, СН3 или ОН;
R3 - Н, СН3, CH2CN, CH2CH2NH2 или CH2CONH2;
RІ - С9 - С21 алкил, С9 - С21 алкенил, С1 – С10 алкоксифенил или С1 – С10 алкоксинафтил;
RІІ - Н, С1 - С4 алкил, С3 - С4 алкенил, (СН2)2-4ОН, (СН2)2-4NRIVRV, CO(CH2)1-4NH2;
RIII - Н, С1 - С4 алкил, С3 - С4 алкенил, (СН2)2-4OН, (CH2)2-4NRIVRV или
RІІ и RIII, взятые вместе -(СН2)4-, -(СН2)5-, -(СН2)2О(СН2)2-, -(CH2)2NH(CH2)2-;
RІV – Н или С1 - С4 алкил,
RV - Н или С1 - С4 алкил; и
их аддитивные соли кислоты.
2. Соединения по п. 1, где R1 - ОН, R2 - Н, R3 - CH2CONH2, RI - 9,11-диметилтридецил, RII - Н и RIII - CH2CH2NH2 и их аддитивные соли кислоты.
3. Соединения по п. 1, где R1 - ОН, R2 - Н, R3 - CH2CH2NH2, RI - 9,11-диметилтридецил, RII - Н и RIII - CH2CH2NH2 и их аддитивные соли кислоты.
4. Соединения по п. 1, где R1 - ОН, R2 - Н, R3 - CH2CONH2, RI - 9,11-диметилтридецил, RII и RIII - H и их аддитивные соли кислоты.
5. Соединения по п. 1, где R1 - Н, R2 - Н, R3 - CH2CONH2, RI -9,11-диметилтридецил, RII и RIII - H и их аддитивные соли кислоты.
6. Соединения по п. 1, где R1 - Н, R2 - Н, R3 - CH2CONH2, RI - 9,11-диметилтридецил, RII - Н, RIII - COCH2CH2NH2 и их аддитивные соли кислоты.
7. Соединения по п. 1, где R1 - Н, R2 - Н, R3 - CH2CONH2, RI - 9,11-диметилтридецил, RII - Н, RIII - CH2CH2NH2 и их аддитивные соли кислоты.
8. Соединения по п. 1, где R1 - Н, R2 - Н, R3 - CH2CH2NH2, RI - 9,11-диметилтридецил, RII и RIII - H и их аддитивные соли кислоты.
9. Соединения по п. 1, где R1 - Н, R2 - Н, R3 - CH2CH2NH2, RI - 9,11-диметилтридецил, RII – Н и RIII - CH2CH2NH2 и их аддитивные соли кислоты.
10. Антимикробная композиция, содержащая соединение по п. 1 в смеси с фармацевтически приемлемым носителем.
11. Антимикробная композиция, содержащая соединение по п. 2 в смеси с фармацевтически приемлемым носителем.
12. Способ лечения грибковых инфекций, включающий в себя введение противогрибковой дозы соединения по п. 1 особям рода млекопитающих в лечебных целях.
13. Способ лечения пневмоцистической пневмонии у пациентов с пониженным иммунитетом, включающий в себя введение терапевтически эффективной дозы соединения по п. 1.
14. Соединение формулы:
и его аддитивные соли кислоты.
Текст
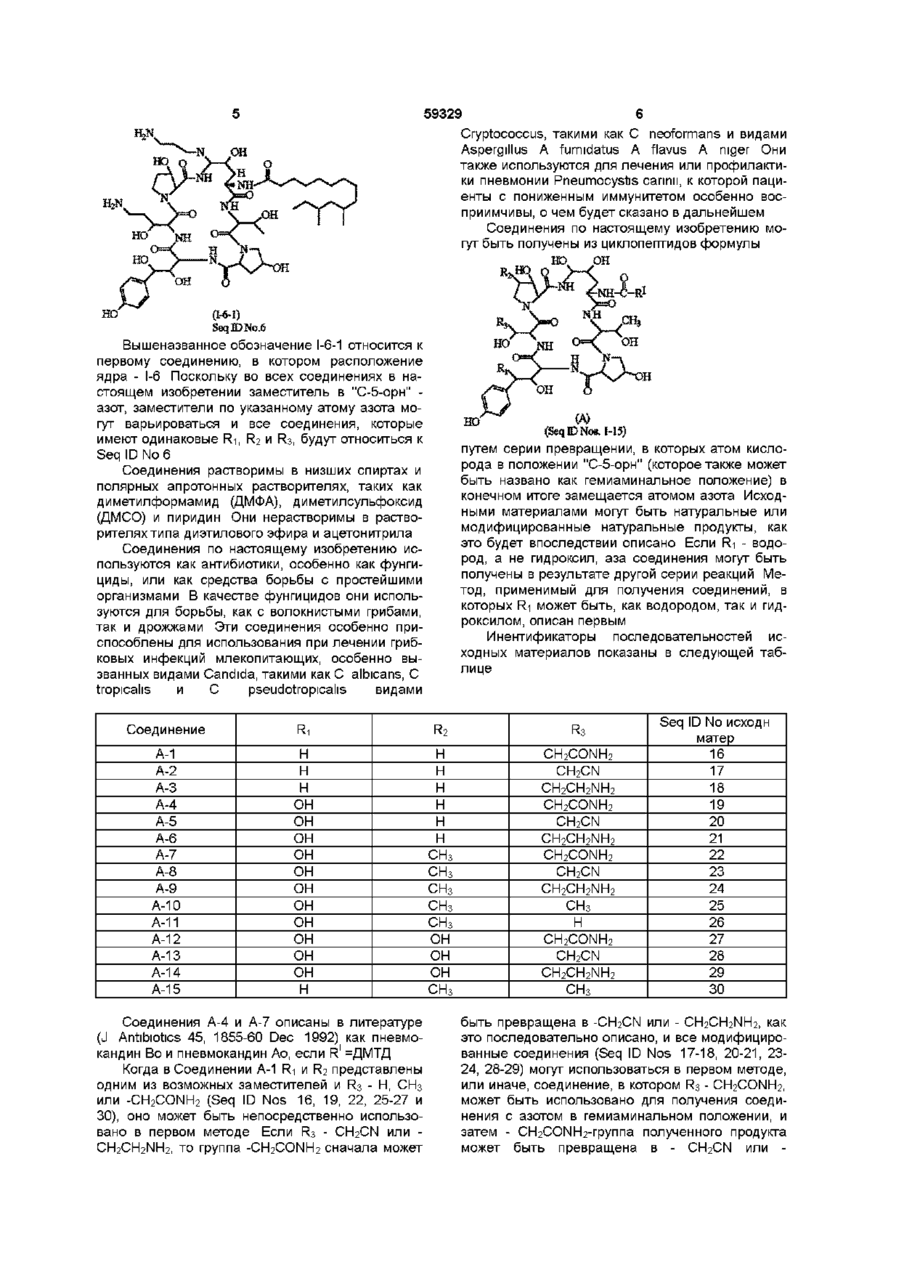
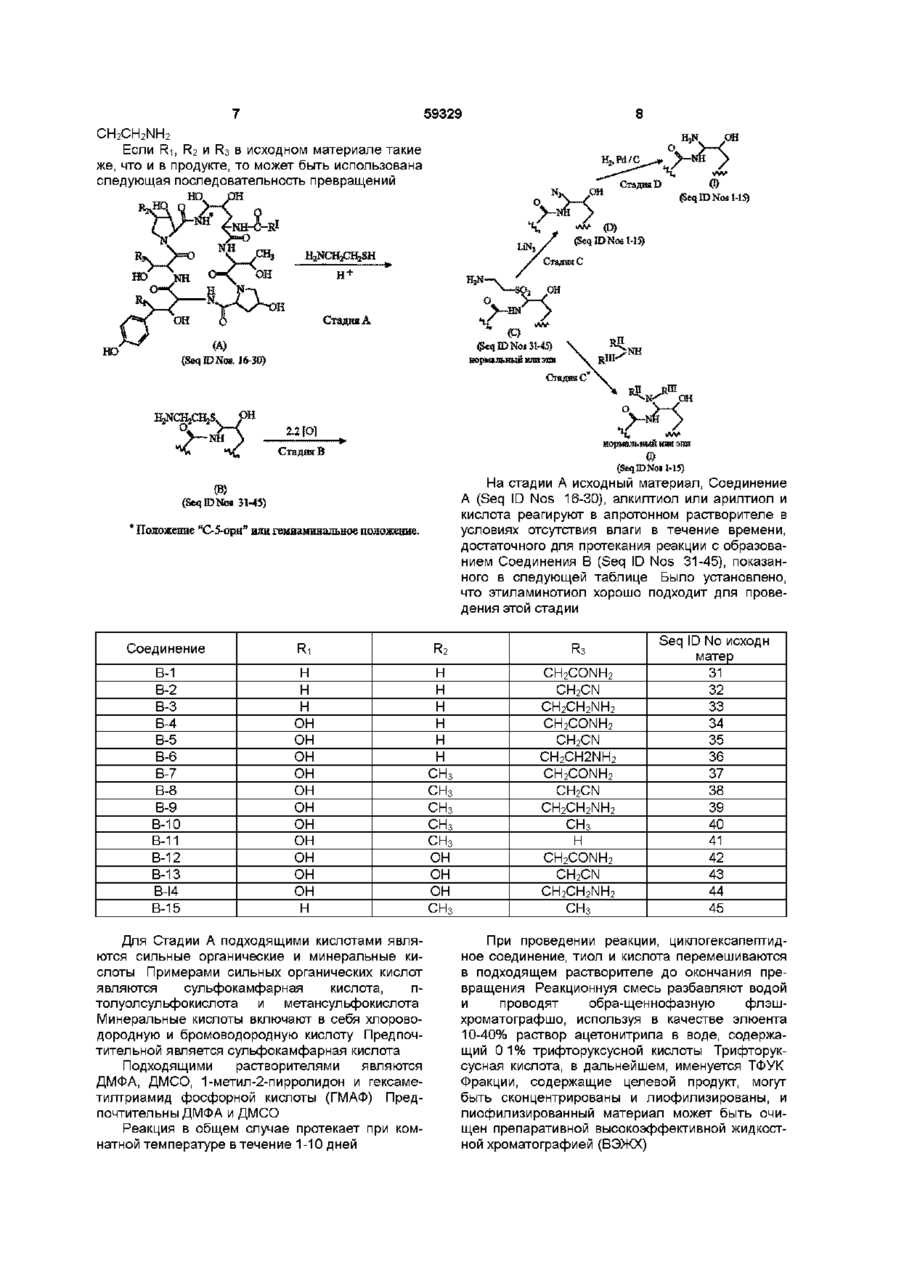
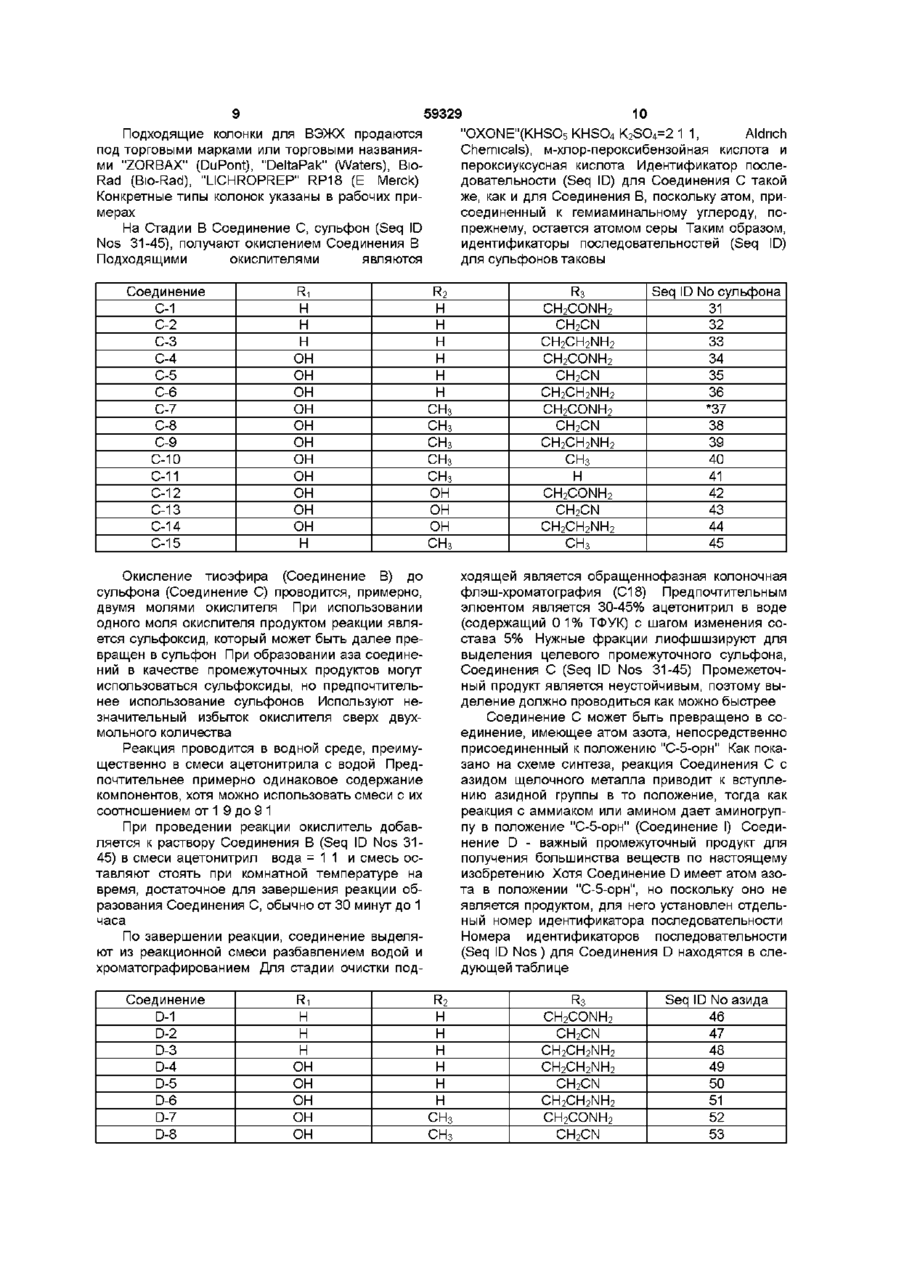
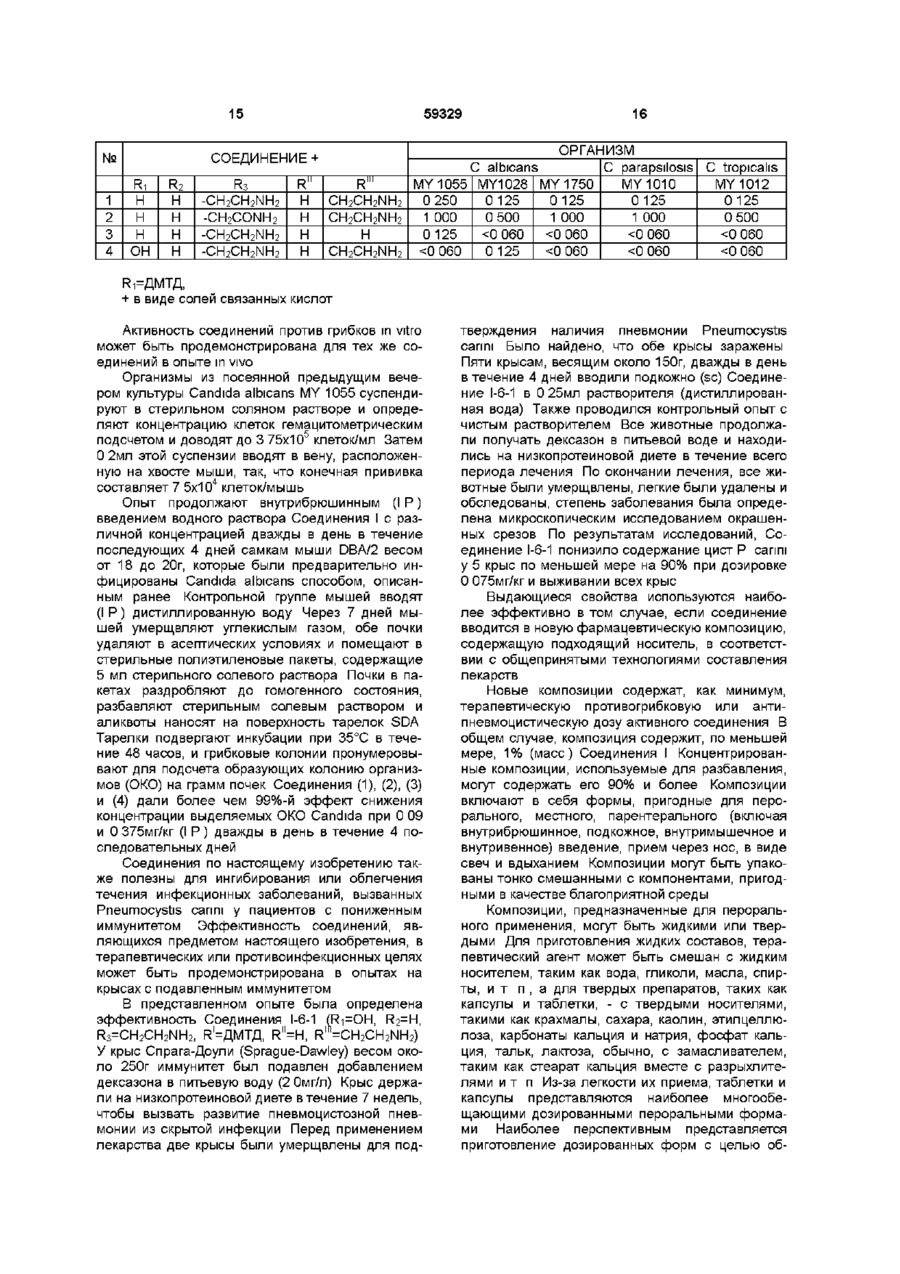
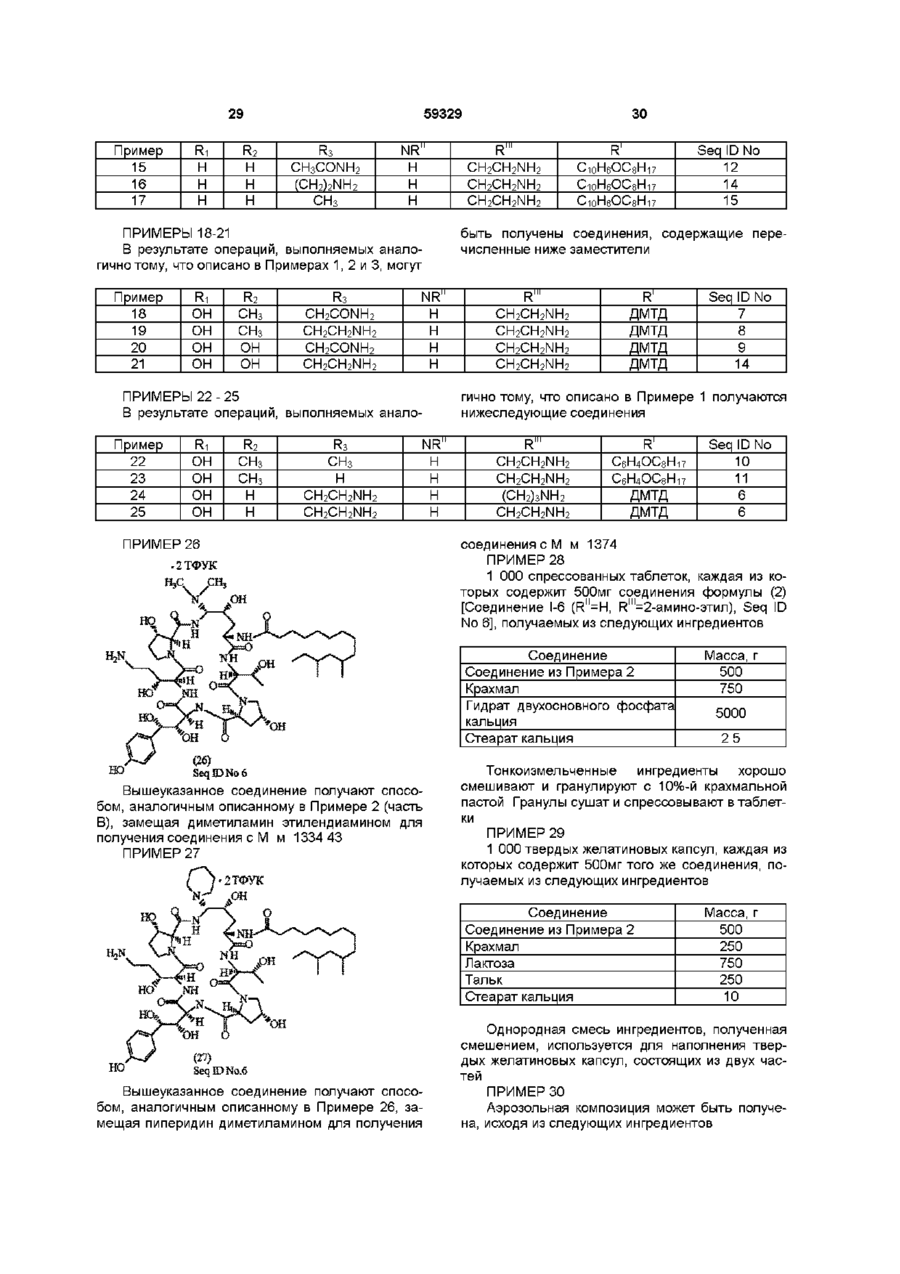
1 Соединения формулы где Ri - Н или ОН, R2- H, СНз или ОН, R3 - Н, СНз, CH2CN, CH2CH2NH2 или CH2CONH2, R1 - Cg - C21 алкил, Cg - С21 алкенил, Сі - Сю алкоксифенил или Сі - Сюалкоксинафтил, R" - Н, C-i - С4 алкил, Сз - С4 алкенил, (СН 2 ) 2 4 ОН, (CH 2 ) 2 4NR I V R V , C O ( C H 2 ) i 4 N H 2 , R1" - Н, Сі - С4 алкил, Сз - С4 алкенил, (СН 2 ) 2 4 ОН, (CH2)24NRlvRVHnH R" и R1", взятые вместе -(СН2)4-, -(СН 2 ) 5 -, (СН 2 ) 2 О(СН 2 ) 2 -, -(CH 2 ) 2 NH(CH 2 ) 2 -, R IV - Н или Сі - С4 алкил, R v - Н или Сі - С4 алкил, и их аддитивные соли кислоты 2 Соединения по п 1, где Ri - ОН, R2 - Н, R3 CH 2 CONH 2 , R1 - 9,11-диметилтридецил, R" - Н и R1" - CH 2 CH 2 NH 2 и их аддитивные соли кислоты 3 Соединения по п 1, где Ri - ОН, R2 - Н, R3 CH 2 CH 2 NH 2 , R1 - 9,11-диметилтридецил, R" - Н и R1" - CH 2 CH 2 NH 2 и их аддитивные соли кислоты 4 Соединения по п 1, где Ri - ОН, R2 Н, R3 CH2CONH2, R1 - 9,11-диметилтридецил, R и R m -H и их аддитивные соли кислоты 5 Соединения по п 1, где Ri - Н, R2 Н, R3 CH2CONH2, R1 - 9,11-диметилтридецил, R и R m -H и их аддитивные соли кислоты 6 Соединения по п 1, где Ri - Н, R2 - Н, R3 CH2CONH2, R1 - 9,11-диметилтридецил, RN - Н, R1" COCH2CH2NH2 и их аддитивные соли кислоты 7 Соединения по п 1, где Ri - Н, R2 - Н, R3 CH2CONH2, R1 - 9,11-диметилтридецил, RN - Н, R CH2CH2NH2 и их аддитивные соли кислоты 8 Соединения по п 1, где Ri - Н, R2 - Н, R3 CH2CH2NH2, R1 - 9,11-диметилтридецил, RN и R1" Н и их аддитивные соли кислоты 9 Соединения по п 1, где Ri - Н, R2 - Н, R3 CH2CH2NH2, R1 - 9,11-диметилтридецил, RN - Н и R1" - CH2CH2NH2 и их аддитивные соли кислоты 10 Антимикробная композиция, содержащая соединение по п 1 в смеси с фармацевтически приемлемым носителем 11 Антимикробная композиция, содержащая соединение по п 2 в смеси с фармацевтически приемлемым носителем 12 Способ лечения грибковых инфекций, включающий в себя введение противогрибковой дозы соединения по п 1 особям рода млекопитающих в лечебных целях 13 Способ лечения пневмоцистической пневмонии у пациентов с пониженным иммунитетом, включающий в себя введение терапевтически эффективной дозы соединения по п 1 14 Соединение формулы но. =Ч_н Ън Г^і б и его аддитивные соли кислоты о го ю 59329 R - Н или Сі-С4алкил, и их аддитивные соли кислоты Использованные здесь выражения "алкил", "алкенил" или "алкокси" подразумевают радикалы как с разветвленными, так и с нормальными цепями Соединения в настоящем изобретении главным образом получены в виде смесей стереоизомерных форм, в которых обычно преобладает одна форма Подбор условий с целью получения целевого изомера в качестве преобладающего не выходит за рамки обычных навыков опытного синтетика Соединения в предпочтительной стереоизомерной форме, указанной здесь как "нормальная" форма, показаны в рабочих примерах с пунктирными линиями связей, лежащих за плоскостью в положении "С-5-орн" Обозначение "эпи" применяется к тем соединениям, в которых группа в положении "С-5-орн" находится над плоскостью Настоящее изобретение относится к некоторым аза циклогексапептидным соединениям и способам их получения Аза циклогексапептидные соединения, в настоящем изобретении - Соединение I (Seq ID Nos 1-15), отличаются тем, что имеют атом азота, присоединенный к циклогексапептидному кольцу по 5му атому углерода компонента 4-гидроксиорнитина (в дальнейшем- "С-5-оря") и могут быть представлены формулой к* .но о Фармацевтически применимые соли, получаемые в качестве солей связанных кислот, образуются с такими кислотами, как хлороводородная, бромоводородная, фосфорная, серная, малеиновая, лимонная, уксусная, винная, сукциновая, щавелевая, малоновая, глутаминовая и им подобными, и включают другие кислоты, дающие фармацевтически применимые соли, перечисленным в Journal of Pharmaceutical Science, 66, 2, (1977) Характерные ядра для аза производных в настоящем изобретении (Соединение I) и идентификатор последовательности (Sequence ID) для этих соединений представлены в нижеследующей таблице Поскольку пептидные ядра являются неизменными, независимо от заместителей R1, R11 или R1", и поскольку номер идентификатора последовательности назначен для вариаций ядер, то амины и соли имеют те же идентификаторы последовательностей С О - Н или ОН R2- Н.СНз или ОН R3 - Н, СНз, CH 2 CN, CH2CH2NH2 или CH2CONH2 R1 С9-С21 алкен ил, dСюалкоксифенил или СгСюалкоксинафтил R" - Н, Сі-С4алкил, Сз-С4алкенил, (CH2)24NRIVRV, CO(CH 2 )i 4 NH 2 '" , Сз-С4алкенил, 4 lv V (CH 2 ) 2 4NR R HnH R" и -(СН2)5-, R1" взятые в м есте-(С Н 2)4-, (СН2)2О(СН2)2-, -(CH2)2NH(CH2)2RIV - Н или Сі-С4алкил, Аза соединение Ri 1-1 I-2 I-3 I-4 I-5 I-6 I-7 I-8 I-9 Н Н 1-10 1-11 1-12 1-13 1-14 1-15 н он он он он он он он он он он он н Одно из соединений, особенно выделяющееся из остальных, поскольку способно бороться с грибковыми инфекциями, обозначено как Соединение I-6, где R1' - Н, R1" - CH2CH2NH2 и R1 - 9,11 R2 н н н н н н СНз СНз СНз СНз СНз он он он СНз R3 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 СНз н C2OH HC N 2 CH2CN C 2 HN 2 HC 2 H СНз Seq ID No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 диметилтридецил (ДМТД), и которое может быть отмечено как Соединение 1-6-1 (Seq ID No 6) 59329 Cryptococcus, такими как С neoformans и видами Aspergillus A fumidatus A flavus A mger Они также используются для лечения или профилактики пневмонии Pneumocystis саппм, к которой пациенты с пониженным иммунитетом особенно восприимчивы, о чем будет сказано в дальнейшем Соединения по настоящему изобретению могут быть получены из циклопептидов формулы т (1-6-1) SeqlDNo.6 Вышеназванное обозначение 1-6-1 относится к первому соединению, в котором расположение ядра - I-6 Поскольку во всех соединениях в настоящем изобретении заместитель в "С-5-орн" азот, заместители по указанному атому азота могут варьироваться и все соединения, которые имеют одинаковые Ri, R2 и R3, будут относиться к Seq ID No 6 Соединения растворимы в низших спиртах и полярных апротонных растворителях, таких как диметилформамид (ДМФА), диметилсульфоксид (ДМСО) и пиридин Они нерастворимы в растворителях типа диэтилового эфира и ацетонитрила Соединения по настоящему изобретению используются как антибиотики, особенно как фунгициды, или как средства борьбы с простейшими организмами В качестве фунгицидов они используются для борьбы, как с волокнистыми грибами, так и дрожжами Эти соединения особенно приспособлены для использования при лечении грибковых инфекций млекопитающих, особенно вызванных видами Candida, такими как С albicans, С tropicahs и С pseudotropicahs видами Соединение Ri А-1 А-2 А-3 А-4 А-5 А-6 А-7 А-8 А-9 А-10 А-11 А-12 А-13 А-14 А-15 Н Н н он он он он он он он он он он он н Соединения А-4 и А-7 описаны в литературе (J Antibiotics 45, 1855-60 Dec 1992) как пневмокандин Во и пневмокандин Ао, если R1 =ДМТД Когда в Соединении А-1 Ri и R2 представлены одним из возможных заместителей и R3 - Н, СНз или -CH2CONH2 (Seq ID Nos 16, 19, 22, 25-27 и 30), оно может быть непосредственно использовано в первом методе Если R3 - CH2CN или CH2CH2NH2, то группа -CH2CONH2 сначала может но он (А) (Seq Ю Nos. 1-15) путем серии превращении, в которых атом кислорода в положении "С-5-орн" (которое также может быть названо как гемиаминальное положение) в конечном итоге замещается атомом азота Исходными материалами могут быть натуральные или модифицированные натуральные продукты, как это будет впоследствии описано Если Ri - водород, а не гидроксил, аза соединения могут быть получены в результате другой серии реакций Метод, применимый для получения соединений, в которых Ri может быть, как водородом, так и гидроксилом, описан первым Инентификаторы последовательностей исходных материалов показаны в следующей таблице R2 н н н н н н СНз СНз СНз СНз СНз он он он СНз R3 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 СНз н C2OH HC N 2 CH2CN C 2 HN 2 HC 2 H СНз Seq ID No исходи матер 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 быть превращена в -CH2CN или - CH2CH2NH2, как это последовательно описано, и все модифицированные соединения (Seq ID Nos 17-18, 20-21, 2324, 28-29) могут использоваться в первом методе, или иначе, соединение, в котором R3 - CH2CONH2, может быть использовано для получения соединения с азотом в гемиаминальном положении, и затем - CH2CONH2-rpynna полученного продукта может быть превращена в - CH2CN или 59329 CH2CH2NH2 HjN Если R-і, R2 и R3 в исходном материале такие же, что и в продукте, то может быть использована следующая последовательность превращений во. ОН .он Н+ Стадия А (Seq I D N e s . 16-30) нормальный иша зпн (О (SeqJDNo»M5) На стадии А исходный материал, Соединение A (Seq ID Nos 16-30), алкилтиол или арилтиол и кислота реагируют в апротонном растворителе в условиях отсутствия влаги в течение времени, достаточного для протекания реакции с образованием Соединения В (Seq ID Nos 31-45), показанного в следующей таблице Было установлено, что этиламинотиол хорошо подходит для проведения этой стадии (B) (SeqlDNoH 31-45) * Положение "С-5-орн" или гемязминальное положение. Соединение Ri В-1 В-2 В-3 В-4 В-5 В-6 В-7 В-8 В-9 В-10 В-11 В-12 В-13 B-I4 В-15 Н Н н он он он он он он он он он он он н Для Стадии А подходящими кислотами являются сильные органические и минеральные кислоты Примерами сильных органических кислот являются сул ьфо камфарная кислота, птолуолсульфокислота и метансульфокислота Минеральные кислоты включают в себя хлороводородную и бромоводородную кислоту Предпочтительной является сул ьфо камфарная кислота Подходящими растворителями являются ДМФА, ДМСО, 1-метил-2-пирролидон и гексаметилтриамид фосфорной кислоты (ГМАФ) Предпочтительны ДМФА и ДМСО Реакция в общем случае протекает при комнатной температуре в течение 1-10 дней R2 н н н н н н СНз СНз СНз СНз СНз он он он СНз R3 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 СНз H CH2CONH2 CH2CN CH2CH2NH2 СНз Seq ID No исходи матер 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 При проведении реакции, циклогексапептидное соединение, тиол и кислота перемешиваются в подходящем растворителе до окончания превращения Реакционнуя смесь разбавляют водой и проводят обра-щеннофазную флэшхроматографшо, используя в качестве элюента 10-40% раствор ацетонитрила в воде, содержащий 0 1% трифторуксусной кислоты Трифторуксусная кислота, в дальнейшем, именуется ТФУК Фракции, содержащие целевой продукт, могут быть сконцентрированы и лиофилизированы, и лиофилизированный материал может быть очищен препаративной высокоэффективной жидкостной хроматографией (ВЭЖХ) Подходящие колонки для ВЭЖХ продаются под торговыми марками или торговыми названиями "ZORBAX" (DuPont), "DeltaPak" (Waters), BioRad (Вю-Rad), "LICHROPREP" RP18 (E Merck) Конкретные типы колонок указаны в рабочих примерах На Стадии В Соединение С, сульфон (Seq ID Nos 31-45), получают окислением Соединения В Подходящими окислителями являются Соединение С-1 С-2 С-3 С-4 С-5 С-6 С-7 С-8 С-9 С-10 С-11 С-12 С-13 С-14 С-15 Ri Н Н н он он он он он он он он он он он н 59329 10 "OXONE"(KHSO5 KHSO4 K2SO4=2 1 1, Aldnch Chemicals), м-хлор-пероксибензойная кислота и перо кс и уксусная кислота Идентификатор последовательности (Seq ID) для Соединения С такой же, как и для Соединения В, поскольку атом, присоединенный к гемиаминальному углероду, попрежнему, остается атомом серы Таким образом, идентификаторы последовательностей (Seq ID) для сульфонов таковы R2 н н н н н н СНз СНз СНз СНз СНз он он он СНз Окисление тиоэфира (Соединение В) до сульфона (Соединение С) проводится, примерно, двумя молями окислителя При использовании одного моля окислителя продуктом реакции является сульфоксид, который может быть далее превращен в сульфон При образовании аза соединений в качестве промежуточных продуктов могут использоваться сульфоксиды, но предпочтительнее использование сульфонов Используют незначительный избыток окислителя сверх двухмольного количества Реакция проводится в водной среде, преимущественно в смеси ацетонитрила с водой Предпочтительнее примерно одинаковое содержание компонентов, хотя можно использовать смеси с их соотношением от 1 9 до 9 1 При проведении реакции окислитель добавляется к раствору Соединения В (Seq ID Nos 3145) в смеси ацетонитрил вода = 1 1 и смесь оставляют стоять при комнатной температуре на время, достаточное для завершения реакции образования Соединения С, обычно от 30 минут до 1 часа По завершении реакции, соединение выделяют из реакционной смеси разбавлением водой и хроматографированием Для стадии очистки подСоединение D-1 D-2 D-3 D-4 D-5 D-6 D-7 D-8 Ri Н Н н он он он он он R3 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN CH2CH2NH2 СНз н C2OH HC N 2 CH2CN C 2 HN 2 HC 2 H СНз Seq ID No сульфона 31 32 33 34 35 36 *37 38 39 40 41 42 43 44 45 ходящей является обращеннофазная колоночная флэш-хроматография (С18) Предпочтительным элюентом является 30-45% ацетонитрил в воде (содержащий 0 1% ТФУК) с шагом изменения состава 5% Нужные фракции лиофшшзируют для выделения целевого промежуточного сульфона, Соединения С (Seq ID Nos 31-45) Промежеточный продукт является неустойчивым, поэтому выделение должно проводиться как можно быстрее Соединение С может быть превращено в соединение, имеющее атом азота, непосредственно присоединенный к положению "С-5-орн" Как показано на схеме синтеза, реакция Соединения С с азидом щелочного металла приводит к вступлению азидной группы в то положение, тогда как реакция с аммиаком или амином дает аминогруппу в положение "С-5-орн" (Соединение I) Соединение D - важный промежуточный продукт для получения большинства веществ по настоящему изобретению Хотя Соединение D имеет атом азота в положении "С-5-орн", но поскольку оно не является продуктом, для него установлен отдельный номер идентификатора последовательности Номера идентификаторов последовательности (Seq ID Nos) для Соединения D находятся в следующей таблице R2 н н н н н н СНз СНз R3 CH2CONH2 CH2CN CH2CH2NH2 CH2CH2NH2 CH2CN CH2CH2NH2 CH2CONH2 CH2CN Seq ID N0 азида 46 47 48 49 50 51 52 53 11 59329 12 Продовження таблиці Соединение D-9 D-10 D-11 D-12 D-I3 D-14 D-15 Ri OH OH OH OH OH OH H Азид может быть получен добавлением азида щелочного металла к раствору сульфона (Соединения С, Seq ID Nos 31-45) в апротонном растворителе при перемешивании при комнатной температуре в течение времени, достаточного для завершения реакции образования азида, определяемого методом ВЭЖХ После этого реакционная смесь может быть разбавлена водным раствором кислоты, например ТФУК, и затем целевой азид (Соединение D) может быть выделен из реакционной смеси хроматографически Для этого подходящей является обращеннофазная колоночная флэш-хроматография (С 18) с использованием 1025% ацетонитрила в воде (содержащего 0 1 % ТФУК) с шагом изменения состава 5% Азид (Соединение D) может быть восстановлен до соединения, имеющего свободную аминогруппу, которое представлено среди продуктов в настоящем изобретении (Seq ID Nos 1-15) Восстановление может быть проведено путем смешивания азида (Соединение I) с палладием, нанесенным на уголь (Pd/C), в растворителе типа ледяной уксусной кислоты и насыщения водородом под давлением, равным давлению в питающем баллоне, в течение 10-20 часов Для выделения продукта сначала отфильтровывают катализатор, а фильтрат лиофшшзируют для получения аминосоединения (Seq ID 1-15), в котором аминогруппа является первичной Полученный таким образом амин может быть превращен в замещенный амин, как это описано далее Соединение І, в котором - N R ' R ' " представлен NHCH2CH2NH2 или гомологами группои NH(CH2)24NRIVRV может быть получен из сульфона по методу, согласно которому диамин v 4 NR Rv реагирует с сульфоном (Соединение С, Seq ID Nos 31-45) Реакция проводится в указанном ранее апротонном растворителе при комнатной температуре Используемый избыток амина составляет порядка Юмоль Реакция проводится в течение времени от одного до нескольких часов При проведении реакции соответствующий амин добавляется в раствор сульфона в безводном апротонном растворителе, и реакционная смесь перемешивается при комнатной температуре до получения Соединения I (Seq ID Nos 1-15), в котором заместитель в положении "С-5орн" NR'R1" Целевое соединение может быть выделено разбавлением реакционной смеси водным раствором ТФУК с последующим хроматографическим разделением Для этого подходящей являет R2 СНз СНз СНз R3 CH2CH2NH2 СНз СНз СНз н CH2CONH2 CH2CN C 2 HN 2 HC 2 H он он он Seq ID No азида 54 55 56 57 58 59 60 ся обращеннофазная колоночная флэшхроматография (С18) с использованием 10-25% ацетонитрила в воде (содержащего 0 1% ТФУК) с шагом изменения состава 5% Соответствующие фракции могут быть лиофилизированы для выделения продукта в виде трифторацетата Трифторацетат может быть превращен в гидрохлорид путем растворения в воде и пропускания через колонку Вю-Rad AG2-X8(CI-) Если в формуле (I) Ri - водород, Соединение Г (Seq ID Nos 1-3, 15), то атом азота может быть непосредственно введен в гемиаминальное положение путем реакции образования азида, который затем восстанавливают в амин, который, в свою очередь, может быть частично алкилирован или ацилирован для получения конечного продукта Реакция показана на приведенной ниже схеме синтеза Щ, 10%МС HjN, Хотя в некоторых натуральных циклогексапептидах Ri - водород, более часто Ri - гидроксил Таким образом, для некоторых соединений, Соединение А на схеме синтеза получено на первой стадии из соответствующего соединения, в котором Ri - гидроксил Получение восстановленного соединения может быть выполнено при перемешивании соответствующего гидроксисоединения в растворе L1CIO4 в диэтиловом эфире при комнатной температуре, добавлении ТФУК и последующем прибавлении триэтилсилана После этого смесь подвергают быстрому перемешиванию (4-10 часов) до тех пор, пока исходное гидроксисоединение более не обнаруживается аналитической ВЭЖХ После этого реакционную смесь выливают в дистиллированную воду, чтобы получить восстановленный продукт в виде осадка, который потом отделяется обычными методами Полученный таким образом восстановленный продукт может использоваться для получения азида в очищенном либо неочищенном виде Продукты, в которых Ri - водород, могут быть 14 13 59329 получены прибавлением модифицированного ствующих компонентов циклогексапептида к предварительно приготовИзобретение также охватывает соли связанленному раствору HN3 HN3 может быть получен ных кислот Соединение, при обычном способе его из азида натрия и ТФУК Реакция протекает при выделения, получается в виде соли с какой-либо комнатной температуре с получением продукта, кислотой (связанной кислотой) Обычно, это соль содержащего азидную группу, и который может ТФУК Полученная таким образом соль может быть выделен обычными методами и очищен быть растворена в воде и пропущена через аниоВЭЖХ нообменную колонку, несущую целевой анион Элюат, содержащий целевую соль, может быть Очищенный азид может быть восстановлен сконцентрирован для получения соли в виде водородом на палладии, нанесенном на уголь, в твердого продукта аминосоединение способом, подобным вышеописанному Соединения по настоящему изобретению активны против многих грибков, в частности - против Амины, полученные как это указано выше, и видов Candida Фунгицидные свойства могут быть имеющие первичную аминогуппу - NH2, затем проиллюстрированы минимальной фунгицид ной могут быть алкилированы обычными способами концентрацией (МФК), определенной для некотодля получения замещенной аминогруппы Короче рых организмов вида Candida в опыте по разбавговоря, алкилирование может проводиться взаилению культуры микроорганизмов, выполненном в модействием соответствующего ал кил галоген ид а среде азотной грибковой основы с добавкой 1% с амином (Соединение I, NR'R'"=NH2), Seq ID Nos декстрозы (Yeast Nitrogen Base (DIFCO) medium 1-15) в апротонном растворителе в присутствии with 1% dextrose (YNBD) основания для получения монозамещенного амина (Соединение I, N R V - N H R " , где R11 - С г В представленном опыте, соединения с начальной концентрацией 5мг/мл были солюбилизиС4ЭЛКИЛ, Сз-С43ЛКЄНИЛ, (СЬІ2)2 4ОН, (СНгЬ рованы в 100%-ом ДМСО Приготовленный рас4NRIVRV) Последние могут быть выделены из ретвор лекарства разбавлением водой был доведен акционной смеси обычными методами до концентрации 512мкг/мл, так что окончательАмины, полученные как это описывалось выное содержание ДМСО было около 10%, Затем ше, и имеющие первичную aMHHorynny-NH2, могут раствор распределялся из многоканального дозабыть ацшшрованы обычными способами для потора в первую колонку 96-ячеечной тарелки (кажлучения замещенной аминогруппы Предполагадая ячейка содержала 0 075мл YNBD), так, что ется, что ацильная группа - СО(СЬІ2)і 4NH2 Пополученная концентрация лекарства составила скольку ацилирующая кислота содержит 256мкг/мл Соединения из первой колонки разбавпервичную аминогруппу, то до проведения ацилилялись от ряда к ряду в 2 раза, при этом конценрования она защищена заместителем типа бензитрация лекарства изменялась от 256 до локсикарбонильной группы Предпочтительным 0 12м кг/мл является использование активированного эфира типа пентафторфенилового Ацилирование можно С использованием спектрофотометра при проводить в апротонном растворителе в присутстбООнм было установлено, что культуры микроорвии основания, такого как ди(изоганизмов возрастом 4 часа, подлежащие испытапропил)этиламин, при комнатной температуре в нию, соответствуют 0 5 стандарта Мак Фарланда течение времени от одного до нескольких часов Эта суспензия была разбавлена в YNBD в соотдо получения продукта ацилирования Продукт ношении 1 100 до достижения в ячейке конценможет быть выделен разбавлением реакционной трации клеток 1-5x104, образующих колонию оргасмеси метанолом и очищен ВЭЖХ (Соединение I, низмов (ОКО)/мл Аликвоты суспензии (0 075мл) NR'R'"=-NH CO(CH2)i 4NH2) были привиты в каждую ячейку микротитровой тарелки, что выразилось в конечной концентрации Аминосоединение, в котором аминогруппа в клеток 5-25x103 ОКО/мл и конечной концентрации гемиаминальном положении является полностью 1 лекарства от 128 до 0 06мкг/мл Каждый опыт замещенной, т е в которой ни R" ни R " не являвключал один ряд контрольных ячеек, не содерются атомами водорода, жащих лекарства, и один ряд контрольных ячеек, не содержащих клеток ОН После 24 часов инкубации микротитровые тарелки осторожно встряхнули на вибростоле для \ перемешивания суспензии клеток Для перенесения 1 5мкл образцов из каждой ячейки 96предпочтительнее получать из сульфона (Соедиячеечной микротитровой тарелки в одиночные нение В, Seq ID Nos 31-45) взаимодействием с ячейки, содержащие декстрозный агар Sabouraud соответствующим замещенным амином NHRV" (SDA), был использован микродозатор MIC-2000 Реакция может быть проведена путем добавления Привитые ячейки с SDA подвергли инкубации в амина к перемешиваемому раствору сульфона в течение 24 часов при 35°С Результаты были слетечение времени, достаточного для протекания дующими реакции Продукт может быть выделен и очищен препаративной ВЭЖХ с лиофилизацией соответ 15 N o 59329 СОЕДИНЕНИЕ+ Ri H H 1 2 3 н 4 он R ? Н Н Н Н R3 -CH2CH2NH2 -CH2CONH2 -CH2CH2NH2 -CH2CH2NH2 M R Н Н н н R'" CH2CH2NH2 CH2CH2NH2 н C 2 HN 2 HC 2 H 16 ОРГАНИЗМ С albicans С parapsilosis С tropicahs MY 1055 MY1028 MY 1750 MY 1010 MY 1012 0 250 0 125 0 125 0 125 0 125 1 000 0 500 1 000 1 000 0 500 0 125
ДивитисяДодаткова інформація
Назва патенту англійськоюAza cyclohеxapеptide compounds, pharmaceutical composition and method for treatment (variants)
Назва патенту російськоюАзациклогексапептидные соединения, фармацевтическая композиция и способ лечения (варианты)
МПК / Мітки
МПК: A61P 31/04, A61P 31/10, C07K 7/56, C07K 7/54, A61K 38/00, A61P 31/00, C07K 7/06
Мітки: варіанти, композиція, лікування, азациклогексапептидні, сполуки, спосіб, фармацевтична
Код посилання
<a href="https://ua.patents.su/23-59329-azaciklogeksapeptidni-spoluki-farmacevtichna-kompoziciya-i-sposib-likuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Азациклогексапептидні сполуки, фармацевтична композиція і спосіб лікування (варіанти)</a>
Попередній патент: Спосіб одержання сульфату амонію гранульованого
Наступний патент: Синтаксичний аналізатор контекстовільних граматик
Випадковий патент: Термопластична формувальна композиція для отримання ультратонких синтетичних волокон