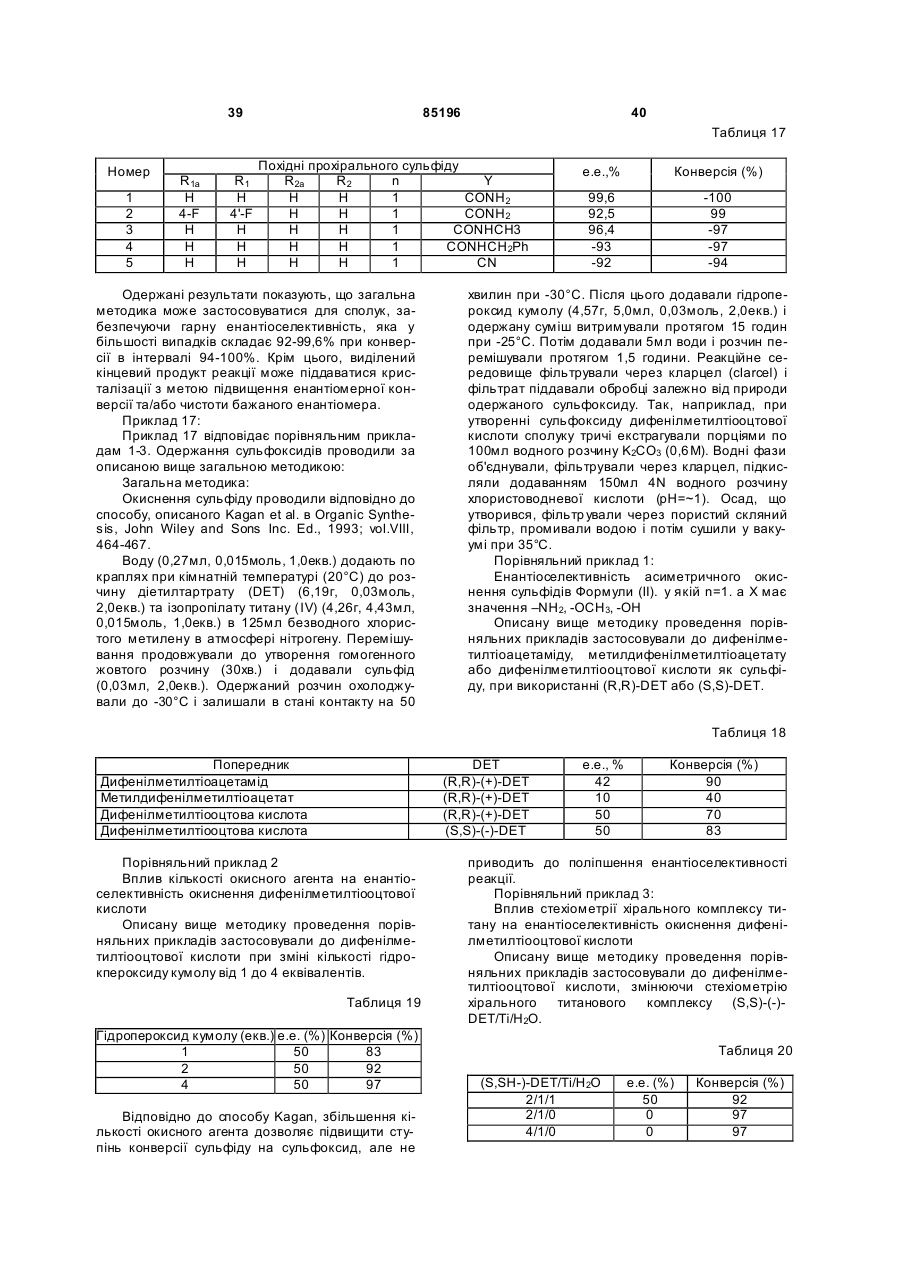
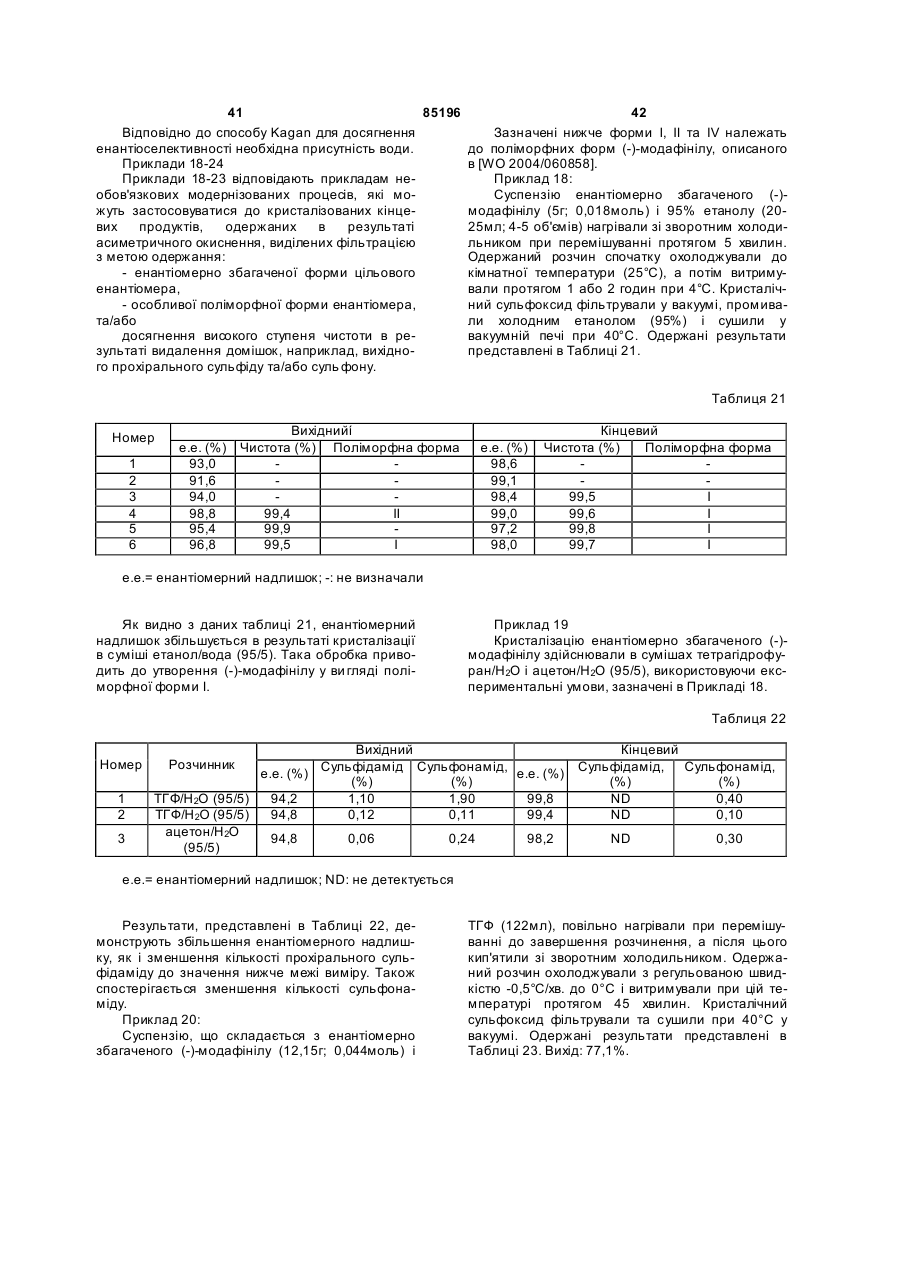
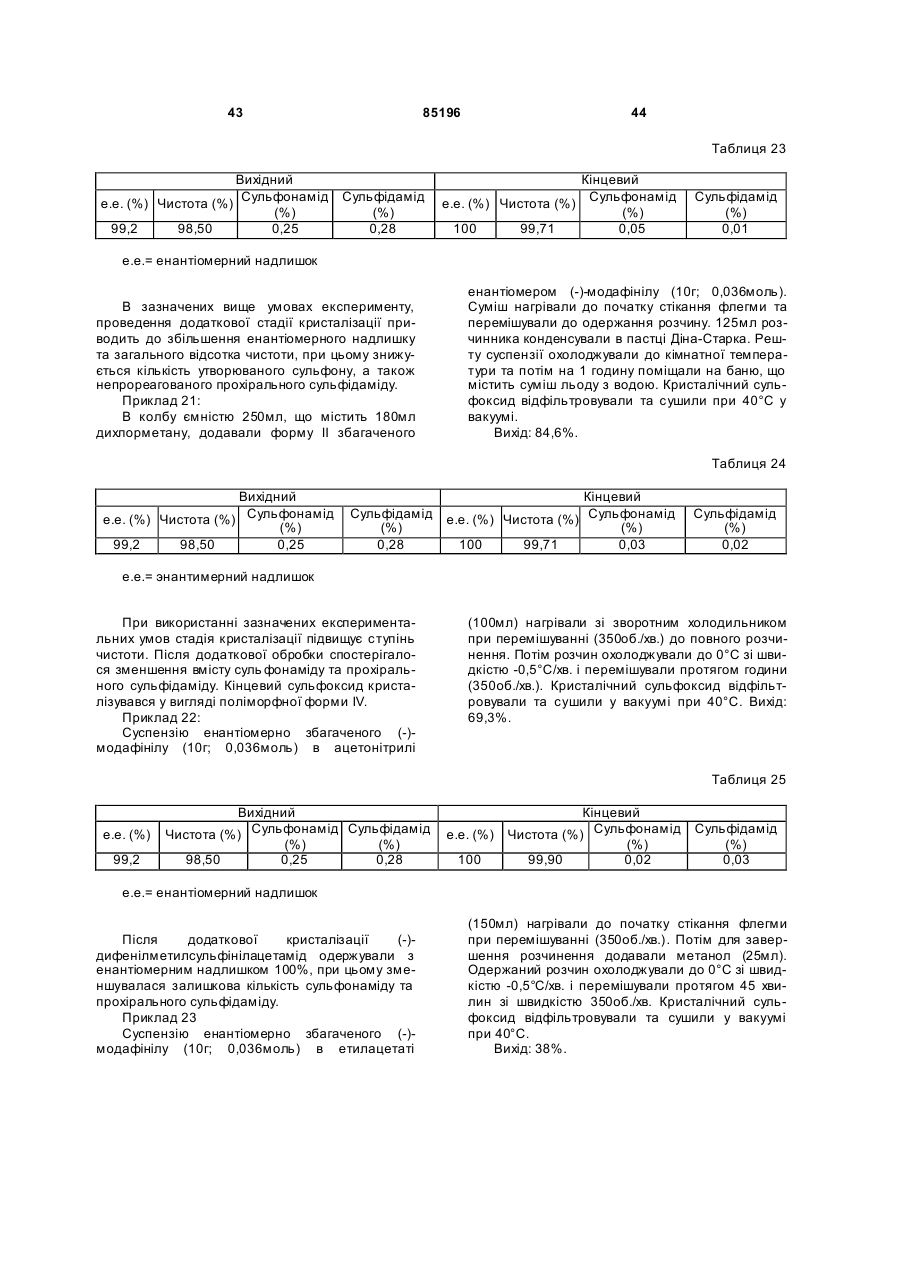
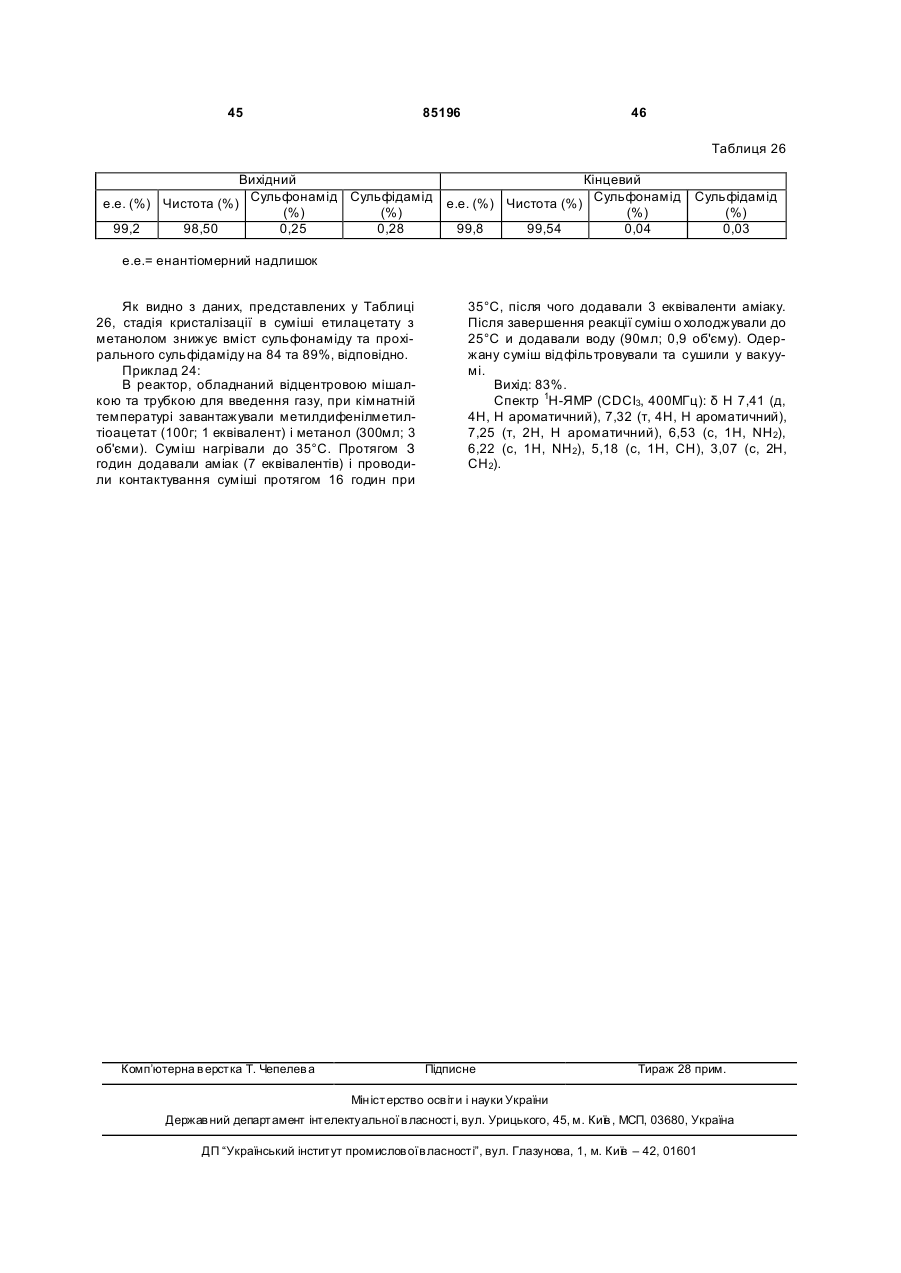
Спосіб одержання сульфоксиду у вигляді окремого енантіомеру або енантіомерно збагаченої форми
Формула / Реферат
1. Спосіб одержання сульфоксиду формули (І) у вигляді окремого енантіомера або енантіомерно збагаченої форми:
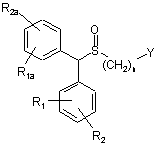 , I
, I
у якій:
- Y позначає -CN, -С(=O)Х, де Х вибирають з -NR3R4, -OH, -OR5, -NHNH2;
- R1, R1a, R2, R2a, що мають однакові або різні значення, вибирають з Н, гало, (С1-С8)-алкілу, (С2-С8)-алкенілу, (С2-С8)-алкінілу, (С6-С10)-арилу, (C5-C10)-гетероарилу, -CN, -CF3, -NO2, -ОН, (С1-С8)-алкокси, -O(CH2)mNR6R7, -OC(=O)R8, -C(=O)OR8, -C(=O)R8, -OC(=O)NR6R7,
-O(СН2)mОR8, -(CH2)mOR8, -NR6R7, -C(=O)NR6R7;
- R3 та R4 мають однакові або різні значення і вибирають з Н, (С1-С6)-алкілу, гідроксі-(С1-С6)-алкілу, -NHOH або ОН, або R3 та R4 можуть бути зв'язані через атом нітрогену з утворенням 5-7-членної N-гетероциклічної групи;
- R5 позначає алкіл, циклоалкіл, аралкіл, алкарил або арил;
- R6 та R7 мають однакові або різні значення та вибирають з Н, (С1-С6)-алкілу, гідроксі-(С1-С6)-алкілу, або R6 та R7 також можуть бути зв'язані один з одним через атом N з утворенням 5-7-членної N-гетероциклічної групи;
- R8 позначає Н, алкіл, циклоалкіл, аралкіл, алкарил або арил;
- n дорівнює 1, 2 або 3; і
- m вибирають зі значень, рівних 1, 2, 3 або 4;
який відрізняється тим, що включає стадії:
а) взаємодії прохірального сульфіду формули (II)
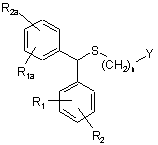 , II
, II
у якій R1, R2, R1a, R2a Y та n мають зазначені вище значення, із комплексом металу з хіральним лігандом, який вибирають з комплексу титану з хіральним лігандом, цирконію, марганцю або ванадію, органічною основою та окисним агентом у середовищі органічного розчинника;
b) виділення одержаного сульфоксиду формули (І).
2. Спосіб за п. 1, який відрізняється тим, що Y позначає -С(=O)Х.
3. Спосіб за п. 1 або 2, який відрізняється тим, що R1, R2, R1a та R2a позначають Н.
4. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що n дорівнює 1.
5. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що Х позначає NH2 або NHOH.
6. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що комплекс металу з хіральним лігандом є комплекс титану з хіральним лігандом.
7. Спосіб за п. 6, який відрізняється тим, що комплекс титану з хіральним лігандом є діалкілтартратним комплексом титану.
8. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що хіральний комплекс металу одержують зі сполуки металу, хірального ліганду та води.
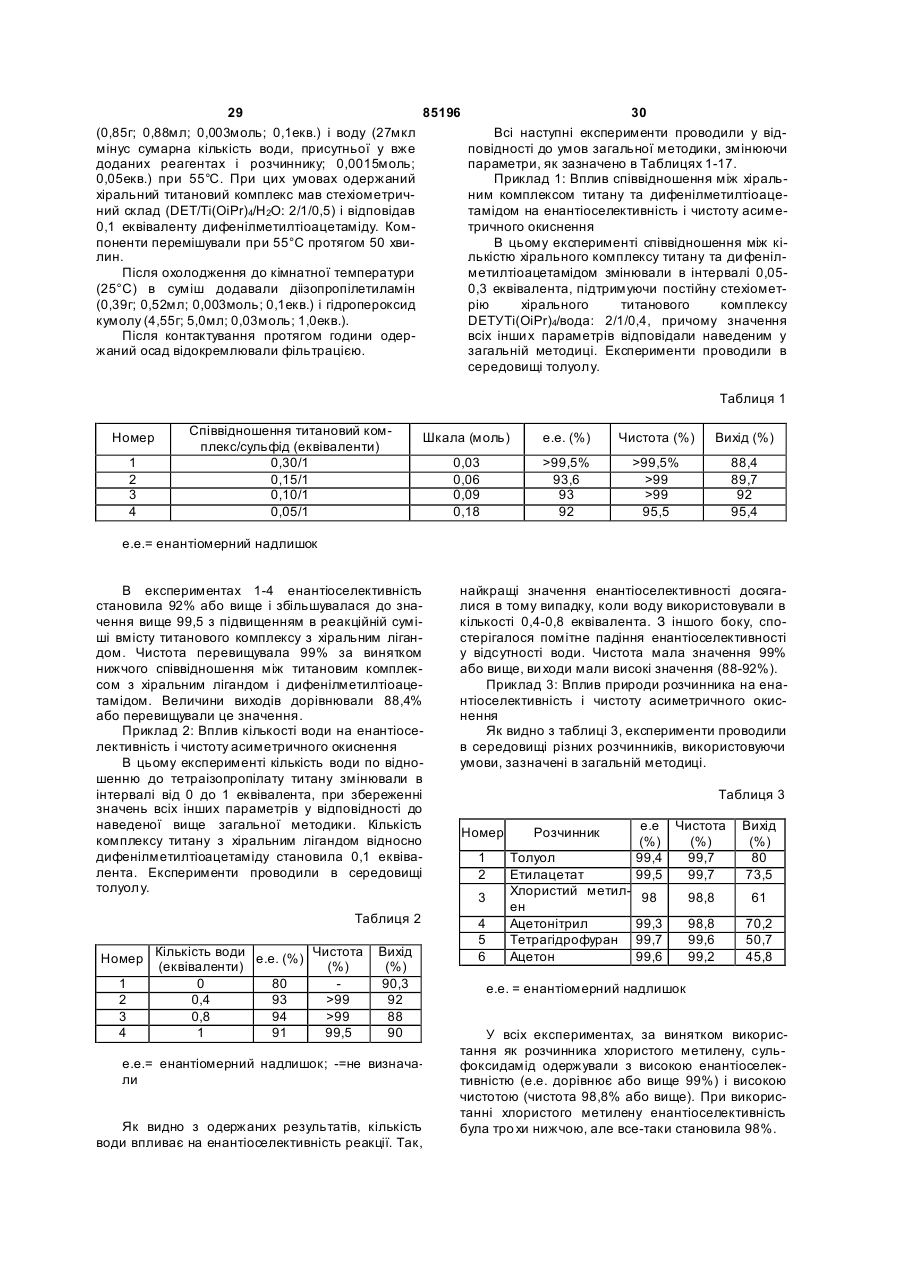
9. Спосіб за п. 8, який відрізняється тим, що комплекс металу з хіральним лігандом одержують із використанням 0,1-1 еквівалента води по відношенню до кількості сполуки металу.
10. Спосіб за п. 9, який відрізняється тим, що комплекс металу з хіральним лігандом одержують із використанням 0,40-0,8 еквівалента води по відношенню до кількості сполуки металу.
11. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що основа є третинним аміном.
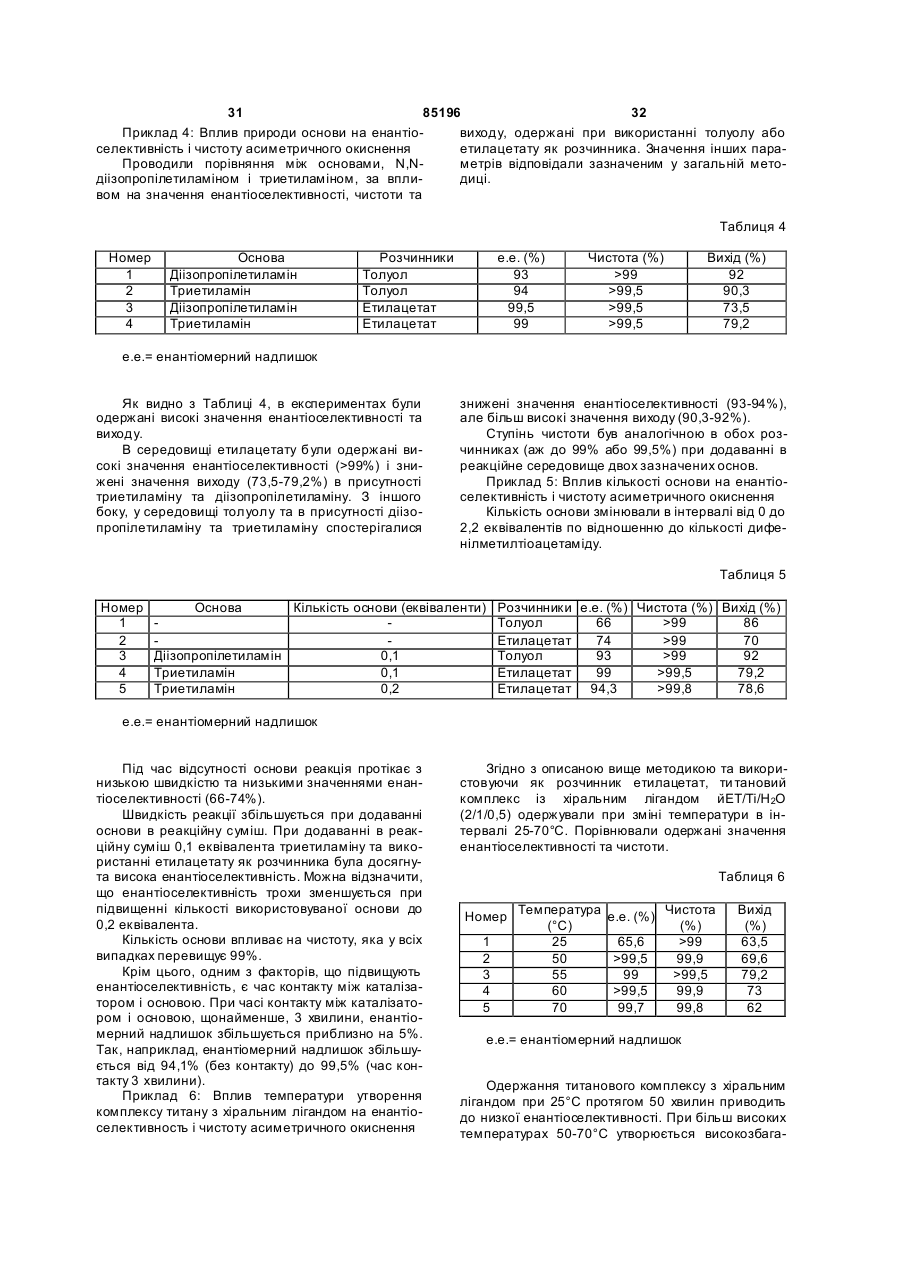
12. Спосіб за п. 11, який відрізняється тим, що третинний амін є діізопропілетиламіном або триетиламіном.
13. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що стадію а) здійснюють в присутності 0,05-0,5 еквівалента основи по відношенню до кількості сульфіду.
14. Спосіб за п. 13, який відрізняється тим, що стадію а) здійснюють в присутності 0,1-0,3 еквівалента основи.
15. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що стадію а) здійснюють в присутності 0,05-0,5 еквівалента комплексу металу з хіральним лігандом по відношенню до кількості сульфіду.
16. Спосіб за п. 15, який відрізняється тим, що стадію а) здійснюють в присутності 0,1-0,3 еквівалента комплексу металу з хіральним лігандом.
17. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що комплекс металу з хіральним лігандом одержують при температурі 20-70 °С.
18. Спосіб за п. 17, який відрізняється тим, що комплекс металу з хіральним лігандом одержують при температурі 40-60 °С.
19. Спосіб за п. 18, який відрізняється тим, що комплекс металу з хіральним лігандом одержують при температурі 50-55 °С.
20. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що окисник контактує із сульфідом, комплексом металу з хіральним лігандом і основою при температурі 0-60 °С.
21. Спосіб за п. 20, який відрізняється тим, що окисник контактує із сульфідом, комплексом металу з хіральним лігандом і основою при кімнатній температурі.
22. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що окисник є пероксидом водню, трет-бутилгідропероксидом або гідропероксидом кумолу.
23. Спосіб за п. 22, який відрізняється тим, що окисник є гідропероксидом кумолу.
24. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що одержаний сульфоксид безпосередньо виділяють фільтрацією.
25. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що додатково включає стадію кристалізації продукту, одержаного на стадії b).
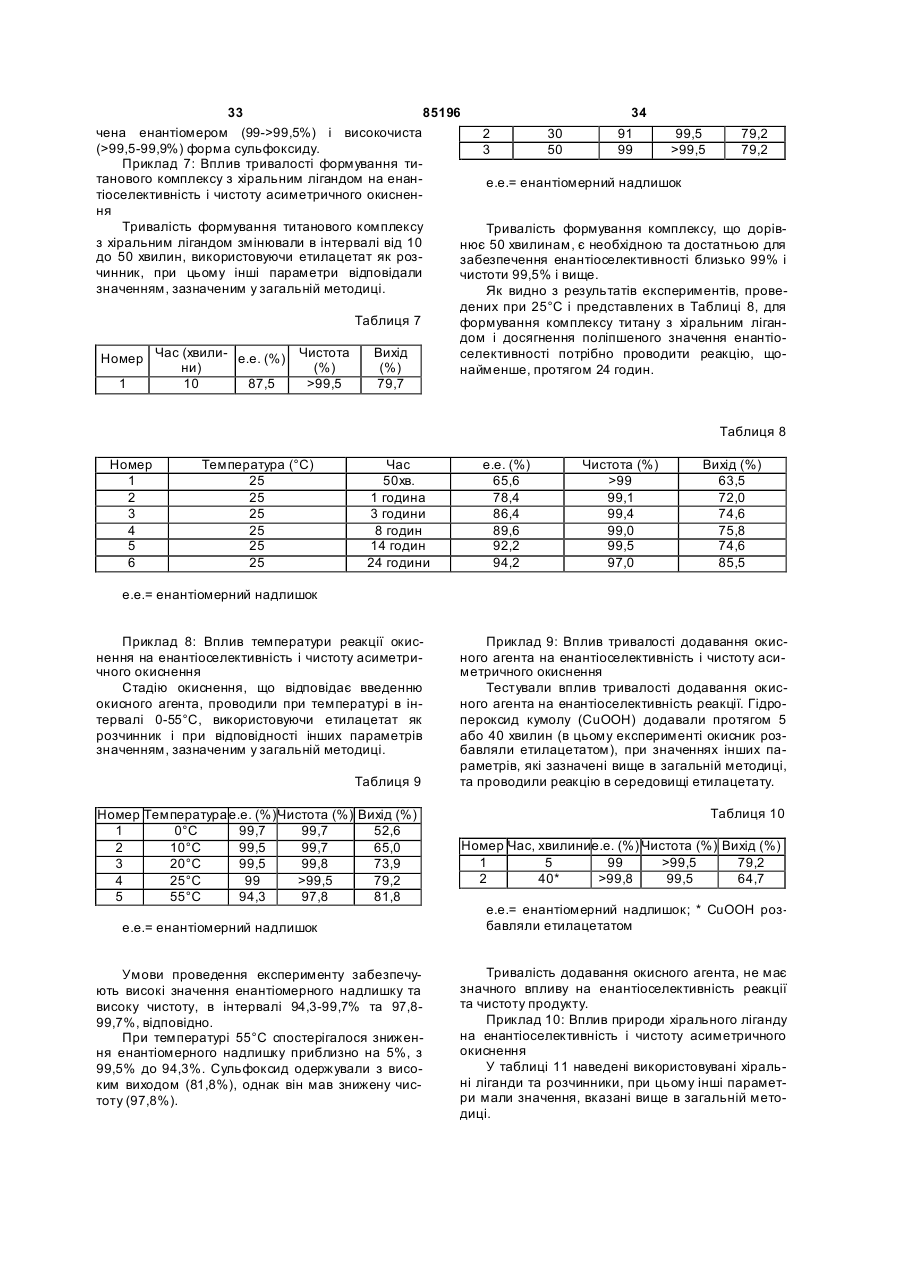
26. Спосіб за п. 25, який відрізняється тим, що кристалізацію здійснюють в суміші органічного розчинника з водою.
27. Спосіб за п. 26, який відрізняється тим, що органічний розчинник є спиртом.
28. Спосіб за будь-яким з пунктів 26 або 27, який відрізняється тим, що кількість води становить 40 % від об'єму суміші.
29. Спосіб за п. 25, який відрізняється тим, що кристалізація є вибірною кристалізацією.
30. Спосіб за будь-яким з пунктів 1-4 та 6-29, який відрізняється тим, що замісник Y в похідному сульфоксиду формули (І) позначає -С(=O)Х, а Х позначає -ОН.
31. Спосіб за п. 30, який відрізняється тим, що похідне сульфоксиду формули (І) є модафіновою кислотою.
32. Спосіб за п. 30 або 31, який відрізняється тим, що додатково включає стадії перетворення Х=-ОН в сульфоксиді формули (І) на Х=-NH2.
33. Спосіб за п. 32, який відрізняється тим, що включає стадії:
a) етерифікації карбоксильної функції; і
b) амідування одержаного складного ефіру.
34. Спосіб за будь-яким з пунктів 1-4 та 6-29, який відрізняється тим, що Y в молекулі сульфоксиду формули (І) позначає -С(=O)Х, а Х позначає OR5, де R5 має значення, вказані в п. 1.
35. Спосіб за п. 34, який відрізняється тим, що похідне сульфоксиду формули (І) є складним ефіром модафінової кислоти.
36. Спосіб за будь-яким з пунктів 34 або 35, який відрізняється тим, що додатково включає стадію перетворення Х=OR5 в похідному сульфоксиду формули (І) на Х=-NH2.
37. Спосіб за п. 36, який відрізняється тим, що Х=OR5 в похідному сульфоксиду формули (І) перетворюють на Х=-NH2 за реакцією амідування.
38. Спосіб за будь-яким з пунктів 1, 3, 4-29, який відрізняється тим, що Y в сульфоксиді формули (І) позначає CN.
39. Спосіб за п. 38, який відрізняється тим, що додатково включає стадію перетворення Y=CN похідного сульфоксиду формули (І) на Y=C(=O)NH2.
40. Спосіб за п. 39, який відрізняється тим, що Y=CN перетворюють на Y=C(=O)NH2 окисненням або гідролізом групи CN.
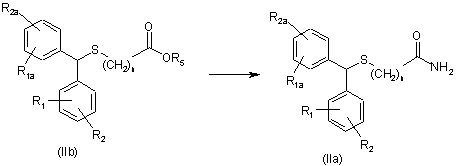
41. Спосіб за п. 39 або 40, який відрізняється тим, що дифенілметилсульфінілацетонітрил перетворюють на модафініл.
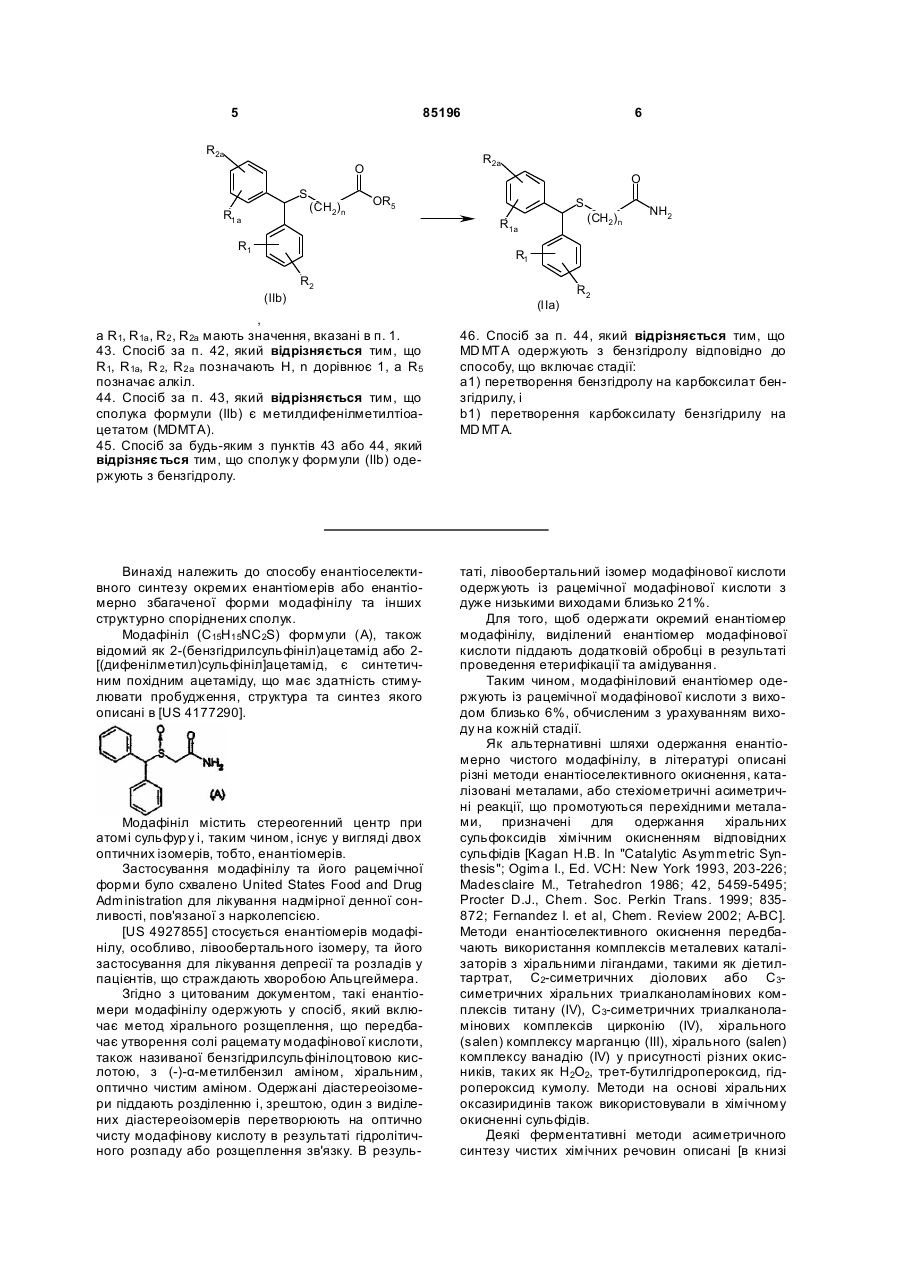
42. Спосіб за п. 4, який відрізняється тим, що сульфід формули (ІІа), у якому Х=-NH2, одержують із сульфіду формули (ІІb), де Х=-OR5
 ,
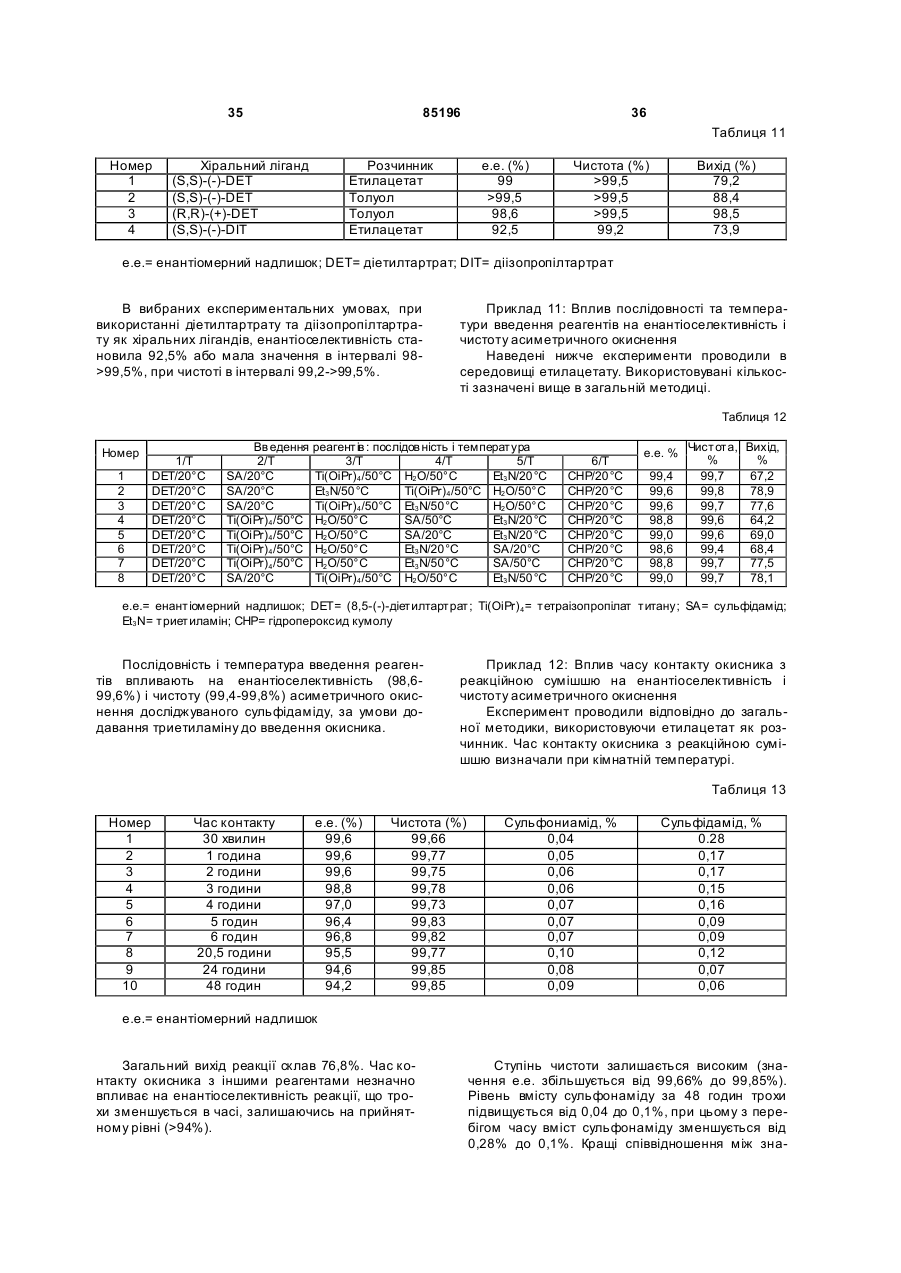
,
a R1, R1a, R2, R2a мають значення, вказані в п. 1.
43. Спосіб за п. 42, який відрізняється тим, що R1, R1a, R2, R2a позначають Н, n дорівнює 1, a R5 позначає алкіл.
44. Спосіб за п. 43, який відрізняється тим, що сполука формули (ІІb) є метилдифенілметилтіоацетатом (MDMTA).
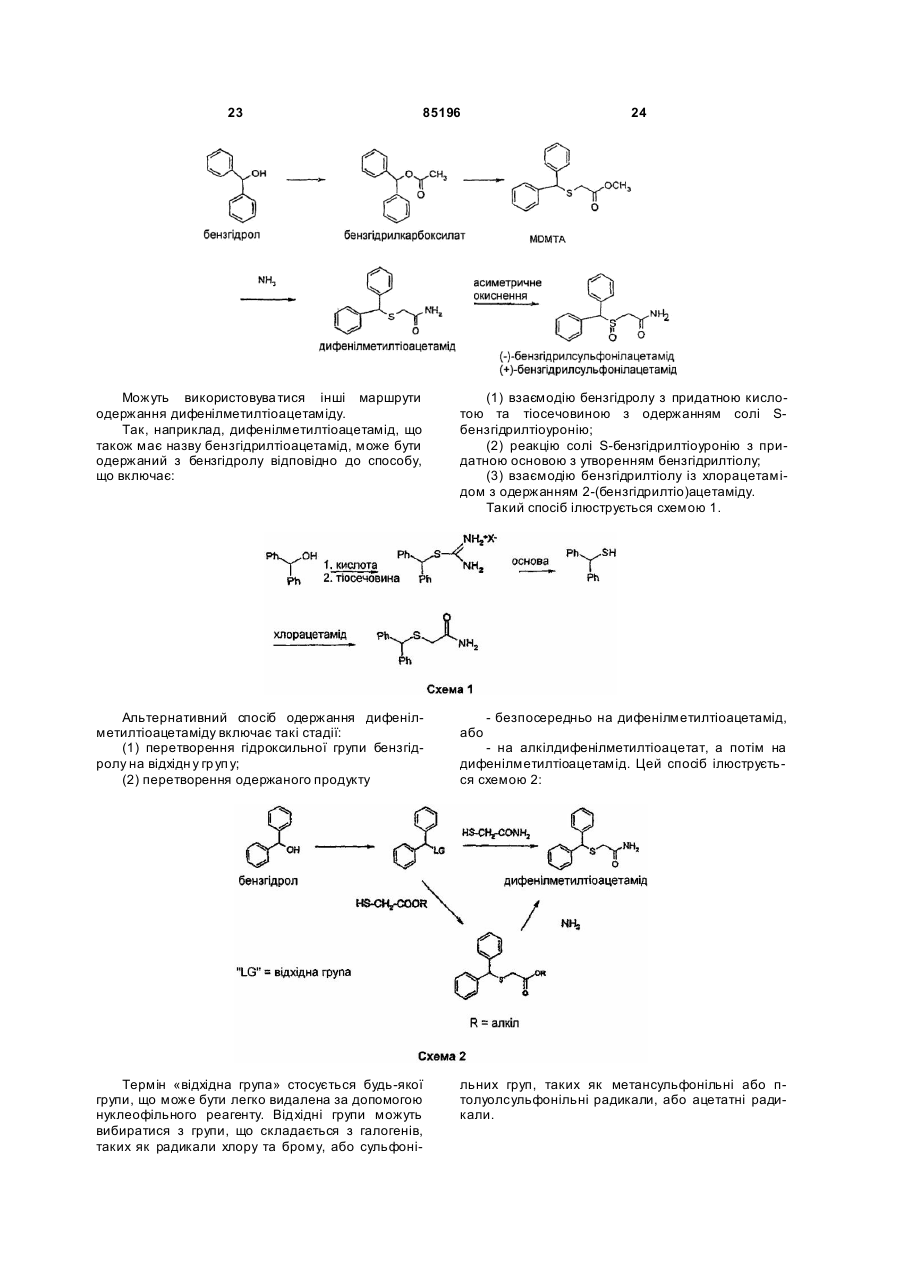
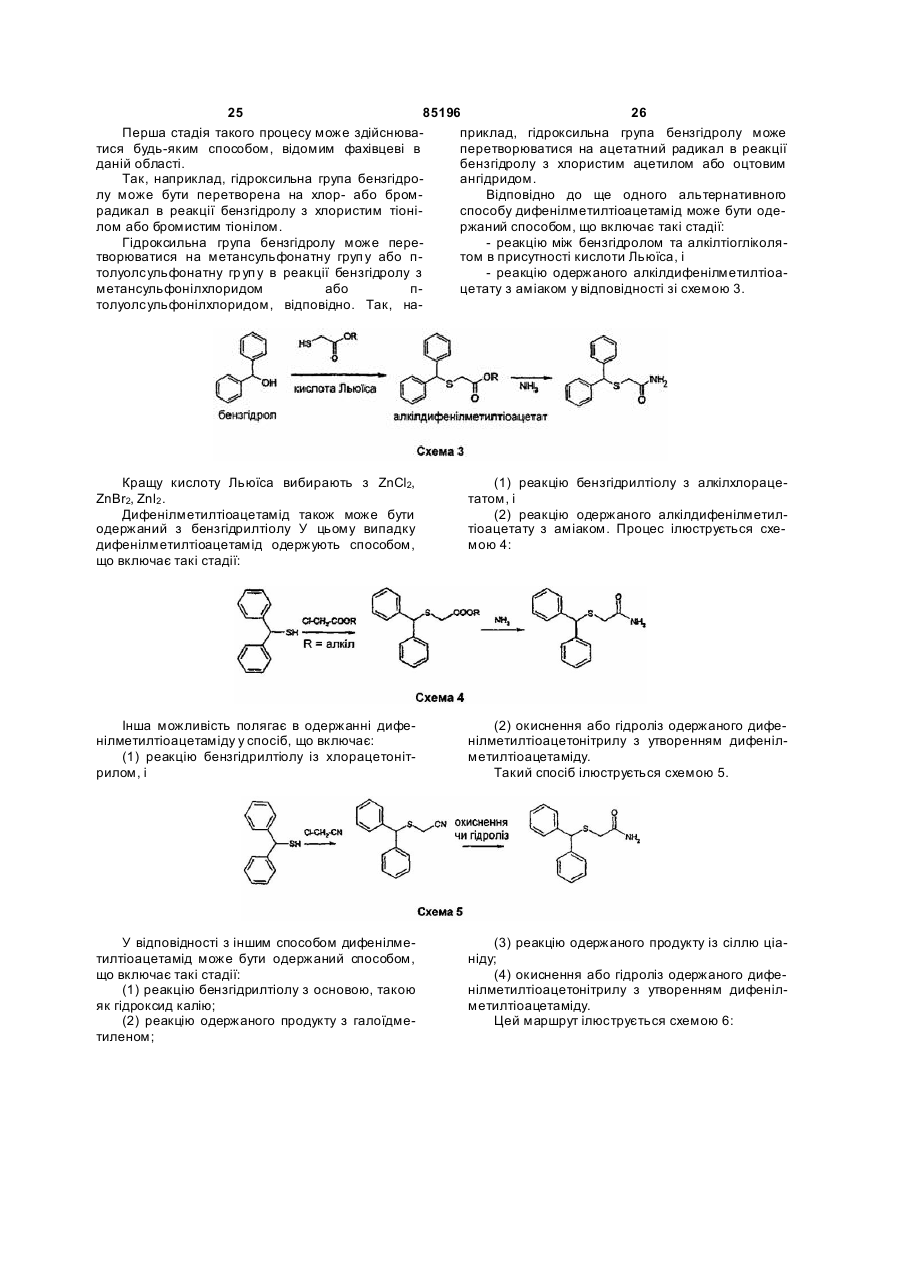
45. Спосіб за будь-яким з пунктів 43 або 44, який відрізняється тим, що сполуку формули (ІІb) одержують з бензгідролу.
46. Спосіб за п. 44, який відрізняється тим, що MDMTA одержують з бензгідролу відповідно до способу, що включає стадії:
а1) перетворення бензгідролу на карбоксилат бензгідрилу, і
b1) перетворення карбоксилату бензгідрилу на MDMTA.
Текст
1. Спосіб одержання сульфоксиду формули (І) у вигляді окремого енантіомера або енантіомерно збагаченої форми: R2a S ЕНАНТІОМЕРУ (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 85196 4 7. Спосіб за п. 6, який відрізняється тим, що ком24. Спосіб за будь-яким з попередніх пунктів, який плекс титану з хіральним лігандом є діалкілтартвідрізняє ться тим, що одержаний сульфоксид ратним комплексом титану. безпосередньо виділяють фільтрацією. 8. Спосіб за будь-яким з попередніх пунктів, який 25. Спосіб за будь-яким з попередніх пунктів, який відрізняє ться тим, що хіральний комплекс металу відрізняє ться тим, що додатково включає стадію одержують зі сполуки металу, хірального ліганду кристалізації продукту, одержаного на стадії b). та води. 26. Спосіб за п. 25, який відрізняється тим, що 9. Спосіб за п. 8, який відрізняється тим, що комкристалізацію здійснюють в суміші органічного плекс металу з хіральним лігандом одержують із розчинника з водою. використанням 0,1-1 еквівалента води по відно27. Спосіб за п. 26, який відрізняється тим, що шенню до кількості сполуки металу. органічний розчинник є спиртом. 10. Спосіб за п. 9, який відрізняється тим, що 28. Спосіб за будь-яким з пунктів 26 або 27, який комплекс металу з хіральним лігандом одержують відрізняє ться тим, що кількість води становить 40 із використанням 0,40-0,8 еквівалента води по від% від об'єму суміші. ношенню до кількості сполуки металу. 29. Спосіб за п. 25, який відрізняється тим, що 11. Спосіб за будь-яким з попередніх пунктів, який кристалізація є вибірною кристалізацією. відрізняє ться тим, що основа є третинним амі30. Спосіб за будь-яким з пунктів 1-4 та 6-29, який ном. відрізняє ться тим, що замісник Y в похідному 12. Спосіб за п. 11, який відрізняється тим, що сульфоксиду формули (І) позначає -С(=O)Х, а Х третинний амін є діізопропілетиламіном або трипозначає -ОН. етиламіном. 31. Спосіб за п. 30, який відрізняється тим, що 13. Спосіб за будь-яким з попередніх пунктів, який похідне сульфоксиду формули (І) є модафіновою відрізняє ться тим, що стадію а) здійснюють в кислотою. присутності 0,05-0,5 еквівалента основи по відно32. Спосіб за п. 30 або 31, який відрізняється шенню до кількості сульфіду. тим, що додатково включає стадії перетворення 14. Спосіб за п. 13, який відрізняється тим, що Х=-ОН в сульфоксиді формули (І) на Х=-NH2. стадію а) здійснюють в присутності 0,1-0,3 еквіва33. Спосіб за п. 32, який відрізняється тим, що лента основи. включає стадії: 15. Спосіб за будь-яким з попередніх пунктів, який a) етерифікації карбоксильної функції; і відрізняє ться тим, що стадію а) здійснюють в b) амідування одержаного складного ефіру. присутності 0,05-0,5 еквівалента комплексу металу 34. Спосіб за будь-яким з пунктів 1-4 та 6-29, який з хіральним лігандом по відношенню до кількості відрізняє ться тим, що Y в молекулі сульфоксиду сульфіду. формули (І) позначає -С(=O)Х, а Х позначає OR5, 16. Спосіб за п. 15, який відрізняється тим, що де R5 має значення, вказані в п. 1. стадію а) здійснюють в присутності 0,1-0,3 еквіва35. Спосіб за п. 34, який відрізняється тим, що лента комплексу металу з хіральним лігандом. похідне сульфоксиду формули (І) є складним ефі17. Спосіб за будь-яким з попередніх пунктів, який ром модафінової кислоти. відрізняє ться тим, що комплекс металу з хіраль36. Спосіб за будь-яким з пунктів 34 або 35, який ним лігандом одержують при температурі 20-70 відрізняє ться тим, що додатково включає стадію °С. перетворення Х=OR5 в похідному сульфоксиду 18. Спосіб за п. 17, який відрізняється тим, що формули (І) на Х=-NH2. комплекс металу з хіральним лігандом одержують 37. Спосіб за п. 36, який відрізняється тим, що при температурі 40-60 °С. Х=OR5 в похідному сульфоксиду формули (І) пе19. Спосіб за п. 18, який відрізняється тим, що ретворюють на Х=-NH2 за реакцією амідування. комплекс металу з хіральним лігандом одержують 38. Спосіб за будь-яким з пунктів 1, 3, 4-29, який при температурі 50-55 °С. відрізняє ться тим, що Y в сульфоксиді формули 20. Спосіб за будь-яким з попередніх пунктів, який (І) позначає CN. відрізняє ться тим, що окисник контактує із суль39. Спосіб за п. 38, який відрізняється тим, що фідом, комплексом металу з хіральним лігандом і додатково включає стадію перетворення Y=CN основою при температурі 0-60 °С. похідного сульфоксиду формули (І) на 21. Спосіб за п. 20, який відрізняється тим, що Y=C(=O)NH2. окисник контактує із сульфідом, комплексом мета40. Спосіб за п. 39, який відрізняється тим, що лу з хіральним лігандом і основою при кімнатній Y=CN перетворюють на Y=C(=O)NH2 окисненням температурі. або гідролізом групи CN. 22. Спосіб за будь-яким з попередніх пунктів, який 41. Спосіб за п. 39 або 40, який відрізняється відрізняє ться тим, що окисник є пероксидом водтим, що дифенілметилсульфінілацетонітрил переню, трет-бутилгідропероксидом або гідроперокситворюють на модафініл. дом кумолу. 42. Спосіб за п. 4, який відрізняється тим, що 23. Спосіб за п. 22, який відрізняється тим, що сульфід формули (ІІа), у якому Х=-NH2, одержують окисник є гідропероксидом кумолу. із сульфіду формули (ІІb), де Х=-OR5 5 85196 R2a R2a O S R1 a (CH2) n 6 O OR5 S (CH2) n R1a R1 NH2 R1 R2 (IIb) , a R1, R1a , R2 , R2a мають значення, вказані в п. 1. 43. Спосіб за п. 42, який відрізняється тим, що R1, R1a, R 2, R2a позначають Н, n дорівнює 1, a R5 позначає алкіл. 44. Спосіб за п. 43, який відрізняється тим, що сполука формули (ІІb) є метилдифенілметилтіоацетатом (MDMTA). 45. Спосіб за будь-яким з пунктів 43 або 44, який відрізняє ться тим, що сполук у формули (ІІb) одержують з бензгідролу. Винахід належить до способу енантіоселективного синтезу окремих енантіомерів або енантіомерно збагаченої форми модафінілу та інших структурно споріднених сполук. Модафініл (C15H15NC2S) формули (А), також відомий як 2-(бензгідрилсульфініл)ацетамід або 2[(дифенілметил)сульфініл]ацетамід, є синтетичним похідним ацетаміду, що має здатність стимулювати пробудження, структура та синтез якого описані в [US 4177290]. Модафініл містить стереогенний центр при атомі сульфур у і, таким чином, існує у вигляді двох оптичних ізомерів, тобто, енантіомерів. Застосування модафінілу та його рацемічної форми було схвалено United States Food and Drug Administration для лікування надмірної денної сонливості, пов'язаної з нарколепсією. [US 4927855] стосується енантіомерів модафінілу, особливо, лівообертального ізомеру, та його застосування для лікування депресії та розладів у пацієнтів, що страждають хворобою Альцгеймера. Згідно з цитованим документом, такі енантіомери модафінілу одержують у спосіб, який включає метод хірального розщеплення, що передбачає утворення солі рацемату модафінової кислоти, також називаної бензгідрилсульфінілоцтовою кислотою, з (-)-α-метилбензил аміном, хіральним, оптично чистим аміном. Одержані діастереоізомери піддають розділенню і, зрештою, один з виділених діастереоізомерів перетворюють на оптично чисту модафінову кислоту в результаті гідролітичного розпаду або розщеплення зв'язку. В резуль (IIa) R2 46. Спосіб за п. 44, який відрізняється тим, що MD MTA одержують з бензгідролу відповідно до способу, що включає стадії: а1) перетворення бензгідролу на карбоксилат бензгідрилу, і b1) перетворення карбоксилату бензгідрилу на MD MTA. таті, лівообертальний ізомер модафінової кислоти одержують із рацемічної модафінової кислоти з дуже низькими виходами близько 21%. Для того, щоб одержати окремий енантіомер модафінілу, виділений енантіомер модафінової кислоти піддають додатковій обробці в результаті проведення етерифікації та амідування. Таким чином, модафініловий енантіомер одержують із рацемічної модафінової кислоти з виходом близько 6%, обчисленим з урахуванням виходу на кожній стадії. Як альтернативні шляхи одержання енантіомерно чистого модафінілу, в літературі описані різні методи енантіоселективного окиснення, каталізовані металами, або стехіометричні асиметричні реакції, що промотуються перехідними металами, призначені для одержання хіральних сульфоксидів хімічним окисненням відповідних сульфідів [Kagan Η.В. In "Catalytic Asymmetric Synthesis"; Ogima I., Ed. VCH: New York 1993, 203-226; Madesclaire M., Tetrahedron 1986; 42, 5459-5495; Procter D.J., Chem. Soc. Perkin Trans. 1999; 835872; Fernandez I. et al, Chem. Review 2002; Α-ВС]. Методи енантіоселективного окиснення передбачають використання комплексів металевих каталізаторів з хіральними лігандами, такими як діетилтартрат, С2-симетричних діолових або С 3симетричних хіральних триалканоламінових комплексів титану (IV), С3-симетричних триалканоламінових комплексів цирконію (IV), хірального (salen) комплексу марганцю (III), хірального (salen) комплексу ванадію (IV) у присутності різних окисників, таких як Н2О2, трет-бутилгідропероксид, гідропероксид кумолу. Методи на основі хіральних оксазиридинів також використовували в хімічному окисненні сульфідів. Деякі ферментативні методи асиметричного синтезу чистих хімічних речовин описані [в книзі 7 85196 8 Kaber K. "Biotransformation in Organic Chemistry", особливо таких, що містять ефірну функцію, в цих Springer Ed. 3rd ed. 1997, та в огляді Fernandes I. et умовах протікає з меншою енантіоселективністю. al. (Chem. Review 2002, Α-ВС)]. Як приклад можна Повідомляється, що сполуки, які несуть на відзначити, що тіоефіри можуть бути піддані асистереогенному центрі, тобто, атомі сульфур у, алметричному окисненню як бактеріями [наприклад, кільний фрагмент з ефірною функцією, розташоCorynebacterium equi (Ohta H. et al. Agng. Biol. ваною поблизу атома сульфур у, такі як метилфеChem. 1985; 49: 2229), Rhodococcus equi (Ohta H. нілтіоацетат, етил мети лтіоацетат та et al. Chem. Lett. 1989; 625], так і грибками метилметилтіопропаноат, характеризуються зна[Helminthosporium sp., Mortieralla isabellina sp. ченням е.е. тільки 63-64% [H.B.Kagan, Phosphorus (Holland H.L. et al. Bioorg. Chem. 1983; 12:1)]. Різand Sulfur, 1986; 27, 127-132.]. номанітні арилалкілтіоефіри піддавали окисненню Аналогічно, окиснення арилметилсульфідів з з утворенням сульфоксидів гарної чи відмінної метилефірною функцією в орто-положенні до ариоптичної чистоти [Ohta Η. et al. Agrig. Biol. Chem. льної групи супроводжується низьким надлишком 1985; 49:671; Abushanab E. et al., Tetrahedron Lett. енантіомерів (60%) і низьким виходом (50%) у по1978; 19: 3415 Holland H.L. et al, Can. J. Chem. рівнянні з пара-заміщеним похідним (е.е. 91%, 1985; 63: 1118)]. Монооксигенази та пероксидази вихід 50%) або п-толілиметилсульфідом (е.е. 91%, належать до важливого класу ферментів, здатних вихід 90%) [Pitchen, P. et al., J. Am. Chem. Soc, каталізувати окиснення ряду сульфідів до сульфо1984; 106, 8188-8193]. ксидів [Colonna S. et al., Tetrahedron: Assymetry Отже, навіть у тому випадку, коли замісники на 1993; 4: 1981]. Було показано, що стереохімічний атомі сульфуру відрізняються за розміром, наяврезультат ферментативних реакцій сильно заленість ефірної функції поблизу від атома сульфуру жить від структури сульфіду. сильно впливає на енантіоселективність асиметЯк альтернатива ферментативному підходу ричного окиснення. були також описані оптично чисті метиларилсульПредставлені результати також показують, що фінілацетати з великим надлишком енантіомерів енантіоселективність процесу сильно залежить від (>98%), одержані каталізованим ліпазою розщепструктури і, особливо, від функціональності субленням відповідного рацемату [Burgess K. et al. страту. Більш конкретно, окиснення сульфідів з Tetrahedron Letter 1989; 30: 3633]. ефірною функцією поблизу атома сульфуру приЯк спосіб енантіоселективного окиснення водить до низької індукції асиметрії. Kagan зі співробітниками розробили спосіб асимеДотепер у літературі не було відомостей про тричного окиснення сульфідів [Pitchen, P.; енантіоселективні реакції субстратів, що включаDeshmukh, M., Dunach, Ε.; Kagan, Η.В.; J. Am. ють фрагмент ацетаміду або оцтової кислоти, безChem. Soc, 1984; 106, 8188-8193]. В цьому способі посередньо зв'язаний з атомом сульфуру. асиметричного окиснення сульфідів до сульфокРобилися спроби поліпшення енантіоселектисидів окиснення здійснюють із використанням вності зміною умов асиметричного окиснення сутрет-бутилгідропероксиду (ТВНР) як окисного агельфідів. Так, наприклад, Kagan із сотр [Zhao, S, нта в присутності одного еквівалента хірального Samuel О.; Kagan, H.В., Tetrahedron 1987; 43 (21), комплексу, одержаного з Ті(ОіРr)4/(+) чи (-)5135-5144] виявили, що енантіоселективність окидіетилтартрату/води, узятих в молярному співвідснення може бути підвищена в результаті викориношенні 1:2:1. стання гідропероксиду кумолу замість третЗагальний метод сульфідного окиснення згідбутилгідропероксиду (е.е. до 96%). Однак викорино Kagan передбачає попереднє утворення хірастання таких умов не вирішує проблеми окиснення льного комплексу при кімнатній температурі в сесульфідів з ефірною, амідною або карбоксильною редовищі хлористого метилену перед додаванням функціями поблизу атома сульфур у. сульфіду. Після цього здійснюють реакцію окисАвтори заявки одержали описаним способом нення при -20°С в присутності третнеочищений (-)-модафініл зі звичайним надлишбутилгідропероксиду. ком енантіомерів, що складає максимум 42% при В результаті здійснення такого способу може використанні умов, описаних Kagan H.В. [Organic бути реалізоване пряме окиснення ряду сульфідів, Synthesis, John Wiley and Sons Inc., ed. 1993, особливо, аралкілсульфідів до оптично активних vol.VIII, 464-467] (див. Приклад 17, порівняльний сульфоксидів з надлишком енантіомерів (e.e.) в приклад 1, наведені нижче). інтервалі 80-90%. Недавно Н. Cotton із сотр. [Tetrahedron: AsymKagan зі співробітниками повідомили, що суmetry 2000; 11, 3819-3825] повідомили про синтез льфоксидні продукти можуть бути одержані з ви(S)-енантіомера омепразолу в результаті асиметсокою енантіоселективністю при асиметричному ричного окиснення відповідного прохірального окисненні сульфідів із двома замісниками, які сисульфіду. Омепразол, також називаний 5-метоксильно відрізняються у розмірі. Так, наприклад, у 2-[[(4-метокси-3,5-диметил-2-піридиніл]сульфініл]тому випадку, коли арилметилсульфіди піддають 1Н-бензімідазолом, відповідає такій формулі: окисненню, можуть бути одержані арилметилсульфоксиди з переважним вмістом енантіомерів (e.e.), що становить більше 90%. Відповідно до описаного способу, утворюється циклопропілфенілсульфоксид з 95% е.е. Однак було встановлено, що асиметричне окиснення функціональних похідних сульфідів, 9 85196 10 Асиметричне окиснення досягалося в резульсполук з високими виходами та високим енантіотаті титан-опосередкованого окиснення гідроперомерним надлишком. ксидом кумолу (СНР) в присутності (S,S)-(-)Додаткова перевага полягає в тому, що продіетилтартрату [(S,S)-(-)-DET]. Ти тановий комплекс цес передбачає використання як каталізатора маготовили в присутності прохірального сульфіду лих кількостей похідного титану, що не має еколота/або протягом тривалого часу, проводячи окисгічної токсичності та є відносно дешевою нення в присутності Ν,Ν-діізопропілетиламіну. У речовиною. цьому методі була досягнута енантіоселективність Модафініл може бути, краще, одержаний у ви>94%, тоді як в оригінальному методі Kagan були гляді окремого енантіомера або енантіомерно збаодержані скромні значення енантіомерного надгаченої форми більш прямим способом, без застолишку в сирому продукті (30%). сування методу хірального розщеплення На думку авторів, поліпшена енантіоселективмодафінової кислоти. ність процесу щодо омепразолу ймовірно пов'язаВинахід також забезпечує деякі способи одерна із присутністю бензімідазольної або імідазольжання модафінілу як окремого енантіомера або ної групи поблизу атома сульфур у, яка визначає енантіомерно збагаченої форми. Такі способи, стереохімію утворюваного сульфоксиду. Крім цьокраще, обмежуються трьома або менше стадіями го, автори передбачають використання цього типу при використанні бензгідролу або бензгідротіолу функціональностей як напрямних груп при синтезі як вихідного матеріалу, при цьому окремий модахіральних сульфоксидів в асиметричному синтезі. фініловий енантіомер одержують із високими виРозглянута публікація в основному сфокусоходами. вана на омепразолі, прохіральному сульфіді, який Виявлено, що асиметричне окиснення модамістить замісники приблизно однакового розміру, i фінілових попередників, особливо, дифенілметилякий включає імідазольну груп у, що, як відзначатіооцтової кислоти, її аміду та складних е фірів, ється, відіграє важливу роль в ініціюванні асиметможе здійснюватися з несподівано високою енанричного синтезу. тіоселективністю, що досягає 99,5% в результаті У зв'язку із цим існує необхідність у розробці проведення реакції, опосередкованої хіральним поліпшеного енантіоселективного процесу для комплексом титану в присутності основи. виробництва оптично чистого модафінілу, а також Винахід стосується способу одержання похідінших стр уктурно споріднених сульфоксидів, особного сульфоксиду формули (І) у вигляді окремого ливо, 2-(бензгідрилсульфініл)оцтової кислоти та 2енантіомера або енантіомерно збагаченої форми: (бензгідрилсульфініл)алкілацетату, який позбавлений недоліків відомих способів та забезпечує високі виходи. Винахід забезпечує новий спосіб енантіоселективного синтезу окремих енантіомерів модафінілу, а также інших стр уктурно споріднених сульфоксидів, причому в цьому процесі несподівано поєднуються висока енантіоселективність та висоде: кий вихід. - Υ позначає -CN, -С(=О)Х, де X вибирають з Новий спосіб відрізняється тим, що прохіральNR3R4, -OH, -OR 5, -NHNH2; ний сульфід асиметрично окиснюється в окремий - R1, R1a, R2 та R2a мають однакові або різні енантіомер або енантіомерно збагачену форму значення та вибрані з Н, гало, (С1-С8)-алкілу, (С2відповідного сульфоксиду. С8)-алкенілу, (С2-С8)-алкінілу, (С6-С10)-арилу, (С5Винахід також забезпечує спосіб одержання С10)-гетероарилу, -CN, -CF3, -NO2, -ОН, (С1-C8)сульфоксиду у вигляді окремого енантіомера або алкокси, -O(CH2)mNR6R7, -OC(=O)R8, -OC(O)NR6R7, енантіомерно збагаченої форми з відповідного -C(=O)OR8, -C(=O)R8 , -O(CH2) mOR8, -(CH2)mOR8, прохірального високочистого сульфіду, краще, з NR6R7, -C(O)NR6R7; чистотою більше 99,5-99,8%. - R3 та R 4 мають однакові або різні значення та Використовуваний у тексті термін «прохіральвибрані з Н, (С1-С6)-алкілу, гідрокси-(1С6)-алкілу, ний сульфід» застосовується для позначення суNHOH або ОН, або R3 та R4 можуть бути зв'язані льфідів, після окиснення яких на атомі сульфуру через атом нітрогену з утворенням 5-7-членної Nутворюється стереогенний центр. На сульфіди, що гетероциклічної групи; містять додаткові стереогенні центри в інших по- R5 позначає алкіл, циклоалкіл, аралкіл, алказиціях, також посилаються як на «прохіральні сурил або арил; льфіди». - R6 та R 7 мають однакові або різні значення та Новий спосіб асиметричного окиснення забезвибрані з Н, (С1-С6)-алкілу, гідрокси-(С1-С6)-алкілу, печує доступ до цікавих сполук з екстремально або R6 та R7 також можуть бути зв'язані один з високим енантіомерним надлишком навіть у томуодним через атом N з утворенням 5-7-членної Nвипадку, коли відповідні хіральні сульфіди є функгетероциклічної групи; ционалізованими речовинами, тобто, містять - R8 позначає Н, алкіл, циклоалкіл, аралкіл, алскладноефірні, амідні, карбоксильні або нитрильні карил або арил; замісники. - n дорівнює 1,2 або 3; і Розглянутий процес простий, причому одно- m вибрано зі значень, рівних 1,2, 3 або 4; стадійна реакція робить процес придатним для який включає стадії: великомасштабного виробництва енантіомерних 11 85196 12 а) взаємодії прохірального сульфіду формули пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н(II) пентил, циклопентилметил. Термін «циклоалкіл» стосується неароматичної моно- або поліциклічної кільцевої системи з 310 вуглецеви х атомів, краще, 5-10 вуглецевих атомів. Прикладами моноциклічних циклоалкільних груп можуть служити циклопентил, циклогексил, циклогептил і т.п. Термін «аралкіл» позначає арилалкільну гр уде R1, R2, R1a , R2a, Υ та n мають вказані вище пу, у якій арил та алкіл мають вказані вище зназначення, з комплексом металу з хіральним ліганчення. Кращі аралкіли містять нижчий алкільний дом, основою та окисним агентом у середовищі фрагмент. Приклади аралкільних груп включають органічного розчинника; і, при необхідності, бензил, 2-фенетил і нафталінметил. b) виділення одержаного сульфоксиду формуТермін «арил» стосується ароматичної моноли (І). циклічної або поліциклічної кільцевої системи з 6Описаний спосіб дозволяє одержувати суль10 вуглецевих а томів. Арил може бути необов'язфоксид формули (І) з енантіомерним надлишком, ково заміщений одним або декількома «заміснизвичайно, більше 80%. Кращий енантіомерний ками на основі кільцевих систем», які можуть бути надлишок звичайно становить більше 80%, краще, однаковими або різними та мають вказані вище більше 90%, ще краще, більше 95% і найкраще, значення. Прикладами арильних груп можуть слублизько 99% або більше. жити феніл або нафтил. Розглянутий спосіб також забезпечує одерТермін «алкарил» позначає алкіларильну гружання сульфоксидів формули (І) зі ступенем чиспу, у якій арил та алкіл мають зазначені вище знатоти вище 90%, краще, більше 98%, ще краще, чення. Прикладом алкарильних груп може служити вище 99% толіл. Для пари енантіомерів, енантіомерний надлиТермін «гало» стосується атома галогену і шок (e.e.) енантіомера Е1 відносно енантіомера Е2 включає фтор, хлор, бром або йод. Кращими атоможе бути розрахований з використанням такого мами є фтор, хлор або бром, ще кращими - фтор рівняння: або хлор. % енантіомерного надлишку =(Е1Термін «алкеніл» стосується алифатичної вугЕ2)/(Е1+Е2)´100 леводневої групи, що містить вуглець-вуглецевий Відносні кількості Е1 та Е2 можуть бути визнаподвійний зв'язок, вуглецевий ланцюжок якої місчені методом хіральної HPLC (високоефективна тить 2-8 вуглецевих атомів і може мати нормальну або розгалужену структур у. Кращі алкенільні групи рідинна хроматографія). Термін «чистота» стосується кількості енантімістять у ланцюзі 2-4 вуглецевих атоми. Термін омерів Е1 та Е2 відносно кількості інших матеріа«розгалужений» означає, що одна або кілька алкілів, які можуть включати побічні продукти, особлильних груп, таких як метил, етил або пропіл, приво, сульфон і непрореагований сульфід. Чистота єднані до лінійного алкенільного ланцюга. Алкенільна група може бути заміщена однією або також може бути визначена методом HPLC. Використовуваний у тексті термін «близько декількома гало або циклоалкільними групами. (приблизно)» стосується інтервалу значень ±10% Приклади алкенільних груп включають етенил, від заданої величини. Так, наприклад, «близько пропеніл, н-бутеніл, ізобутеніл, З-метилбут-2-еніл, 20» включає ±10% від 20, або 18-22. н-пентеніл, гептеніл, октеніл, циклогексилбутеніл та деценіл. Термін «комплекс металу з хіральними лігандами» стосується комплексу, що складається з Термін «алкініл» стосується алифатичної вугпохідного металу, хірального ліганду та необов'язлеводневої групи, що містить вуглець-вуглецевий кової води. потрійний зв'язок, яка може мати нормальну або Термін «хіральний ліганд» стосується групи, розгалужену структур у та містити 2-8 вуглецевих атомів у ланцюзі. Кращі алкінільні групи містять у що включає, щонайменше, один хіральний центр і має абсолютну конфігурацію. Хіральний ліганд ланцюзі 2-4 вуглецевих атоми. Термін «розгалумає (+)- або (-)-обертання площини поляризованожений» означає, що одна або кілька нижчих алкіго світла. льних груп, таких як метил, етил або пропіл, приВикористовуваний у тексті термін «алкіл» стоєднані до лінійного алкінільного ланцюга. Алкінільна група може бути заміщена однією або сується алифатичної вуглеводневої групи нормальної чи ізобудови, яка містить у ланцюзі 1-12 вугдекількома гало групами. Прикладами алкінільних лецевих атомів. Кращі алкільні групи містять у груп можуть служити етиніл, пропініл, н-бутиніл, 2ланцюзі 1-6 вуглецевих атомів. бутиніл, 3-метилбутиніл, н-пентиніл, гептиніл, окТермін «нижчий алкіл» стосується групи, що тиніл та дециніл. Термін «алкокси» позначає групу алкіл-О-, у містить 1-4 вуглецевих атоми в ланцюзі, який може мати нормальну будову або бути розгалужеякій алкільна група має зазначені вище значення. ним. Термін «розгалужений» означає, що одна або Кращі алкокси групи містять у ланцюзі 1-6 атомів кілька алкільних груп, таких як метил, етил або карбону, ще краще, 2-4 атоми карбону. Прикладапропіл, приєднана до лінійного алкільного ланцюми алкокси груп можуть служити метокси, етокси, н-пропокси, ізопропокси, н-бутокси та гептокси га. Алкіл може бути заміщений однією або декількома «циклоалкільними групами». Прикладами групи. алкільних груп можуть служити метил, етил, н 13 85196 14 Термін «гетероарил» стосується ароматичної з'єднані один з одним, утворюють 5-7-членну Nмоноциклічної або поліциклічної кільцевої системи гетероциклічну груп у. з 5-10 вуглецевими атомами, у якій один або кільЯкщо X=ОН, то суль фоксид формули (І) може ка вуглецевих атомів у кільцевій системі є гетеробути одержаний у вигляді солі, особливо, солі луелементами, відмінними від карбону, наприклад, жного металу, такої як натрієва, калієва, літієва нітрогеном, оксигеном або сульфуром. Кращі кільсіль або сіль амонію, або у вигляді фармацевтичця в кільцевій системі містять 5-6 кільцевих атомів. но застосовної солі. «Гетероарил» також може бути заміщений одним Термін «фармацевтично застосовні солі» поабо декількома «замісниками на основі кільцевої значає відносно нетоксичні, неорганічні та органічсистеми», які можуть бути однаковими або різними ні солі приєднання кислоти та основні адитивні та мають зазначені вище значення. Атом нітрогену солі сполуки за винаходом. Такі солі можуть бути в гетероарилі може бути основним атомом нітроодержані in situ в ході кінцевого виділення та очигену і може бути необов'язково окислений до відщення згаданих сполук. Кислі адитивні солі моповідного N-оксиду. Приклади гетероарильних і жуть бути одержані в результаті окремої реакції заміщених гетероарильних груп включають піраочищеної сполуки у вигляді її вільної основи з зиніл, тієніл, ізотіазоліл, оксазоліл, піразоліл, фупридатною органічною або неорганічною кислотою разаніл, піроліл, 1,2,4-тіадіазоліл, піридазиніл, хіз наступним виділенням одержаної солі. Прикланоксалініл, фталазиніл, імідазо[1,2-а]піридин, дами кислих адитивних солей можуть служити імідазо[2,1-b]тіазоліл, бензофуразаніл, азаіндоліл, гідробромід, гідрохлорид, сульфат, бісульфат, бензімідазоліл, бензотієніл, тієнопіридил, тієнопифосфа т, нітрат, ацетат, оксалат, валерат, олеат, рімідил, піролпіридил, імідазопіридил, бензоазаінпальмітат, стеарат, лаурат, борат, бензоат, лакдол, 1,2,4-триазиніл, бензтіазоліл, фураніл, імідатат, тозилат, цитрат, малеат, фумарат, сукцинат, золіл, індоліл, індолізиніл, ізоксазоліл, ізохінолініл, тартрат, нафтилат, мезилат, глюкогептонат, лактіізотіазоліл, оксадіазоліл, піразиніл, піридазиніл, обионат, сульфамати, малонати, саліцилати, пропіразоліл, піридил, піримідиніл, піроліл, хіназоліпіонати, метилен-біс-b-гідроксинафтоати, гентисаніл, хінолініл, 1,3,4-тіадіазоліл, тіазоліл, тієніл і ти, изетіонати, ди-п-толуоїлтартрати, триазоліл. Кращі гетероарильні групи включають метансульфонати, етансульфонати, бензолсульпіразиніл, тієніл, піридил, піримідиніл, ізоксазоліл фонати, п-толуолсульфонати, циклогексилсульта ізотіазоліл. фамати та квінатеслаурилсульфонати і т.п. [див., Термін «гідроксіалкіл» стосується групи НОнаприклад, статтю S.M. Berg et al., "Pharmaceutical алкіл-, у якій алкіл має зазначені вище значення. Salts", J. Pharm. Sci., 66: p.1-19 (1977)], на яку поКращі гідроксіалкіли містять нижчий алкіл. Присилаються в даному описі. Основні адитивні солі кладами гідроксіалкільних груп можуть служити також можуть бути одержані за окремою реакцією гідроксиметил та 2-гідроксіетил. очищеної сполуки у вигляді вільної кислоти з приТермін «N-гетероциклічна група» позначає недатною органічною або неорганічною основою з ароматичну насичену моноциклічну систему з 5-7 наступним виділенням одержаної солі. Основні кілець, що містить один атом нітрогену, яка може адитивні солі включають фармацевтично застосоміститидругий гетероелемент, такий як нітроген, вні солі металів та амінів. Придатні солі металів оксиген і сульфур. Гетероцикліл може бути необовключають солі натрію, калію, кальцію, барію, лів'язково заміщений одним або декількома «кільцетію, цинку, магнію і алюмінію. Солі натрію та калію вими замісниками», які можуть бути однаковими є кращими. Придатні неорганічні основні адитивні або різними і мають зазначені вище значення. У солі одержують з металевих основ, які включають тому випадку, коли є присутнім другий гетероелегідрид натрію, гідроксид натрію, гідроксид калію, мент, вибраний з атомів нітрогену або сульфур у, гідроксид кальцію, гідроксид алюмінію, гідроксид такий гетероелемент N-гетероциклічної групи молітію, гідроксид магнію, гідроксид цинку. Придатні же бути необов'язково окиснений до відповідного солі приєднання амінів одержують з амінів, які N-оксиду, S-оксиду або S,S-діоксиду. Краща Nмають достатню основність для утворення стійкої гетероциклічна група включає піперидил, піролідисолі, і вони, краще, включають ті аміни, які часто ніл, піперазиніл, морфолініл і т.п. N-гетероциклічна використовують у медичній хімії через їхню низьку група може бути необов'язково заміщена одним токсичність і прийнятність для медичного застосуабо декількома «кільцевими замісниками». Кращі вання. Прикладами основних адитивних солей замісники N-гетероциклічної групи включають (С1можуть служити солі амонію, етилендіаміну, NС4)-алкіл, (С6-С10)-арил, необов'язково заміщений метилглюкаміну, лізину, аргініну, орнітину, холіну, одним або декількома атомами галогену, наприΝ,Ν'-дибензилетилендіаміну, хлорпрокаїну, діетаклад, парахлорфеніл. ноламіну, прокаїну, N-бензилфенетиламіну, діетиТермін «замісники кільцевої системи» стосуламіну, піперазину, трис(гідроксиметил)ється замісників, приєднаних до ароматичних або амінометану, гідроксиду тетраметиламонію, тринеароматичних кільцевих систем, які включають Н, етиламіну, дибензиламіну, е фенаміну, дегідроабігало, (С1-С8)-алкіл, (С2-С8)-алкеніл, (С2-С8)-алкініл, єтиламіну, N-етилпіперидину, бензиламіну, тетра(С6-С10)-арил, (С5-С10)-гетероарил, -CN, -CF3, -NO2, метиламонію, тетраетиламонію, метиламіну, ОН, (С1-С8)-алкокси, -O(CH2)mNRR', -OC(=O)R, диметиламіну, триметиламіну, етиламіну, основOC(O)NRR', -O(CH2)mOR, -CH2OR, -NRR', них амінокислот, наприклад, лізину та аргініну, а C(O)NRR', -C(=O)OR та -C(O)R, де R та R' познатакож дициклогексиламіну і т.п. чають Н, алкіл, циклоалкіл, аралкіл, алкарил або Використовуваний в тексті вираз «від [...] до арил, а у випадку, коли замісник позначає -NRR', R [...]» стосується інтервалу значень. та R' разом з атомом нітрогену, через який вони 15 85196 16 У відповідності з кращим аспектом винаходу, таким як С 2-симетричний хіральний діол або С 3R1, R2, R1a і R2a незалежно один від одного вибисиметричний хоральний діол. Хіральний спирт рають з групи, що складається з Η і гало, причому може бути розгалуженим або нерозгалуженим гало, краще, є F. алкіловим спиртом або ароматичним спиртом. Краще, щоб один з радикалів R1, R2 та/або R1a , Кращими хіральними лігандами є бінафтол, R2a позначав Η, а інший радикал - F. Атом фтору мигдалева кислота, гідробензоїн, складні ефіри може находитися в орто-, мета-, пара-положенні, винної кислоти, такі як (+)-діалкіл-L-тартрат або (-)причому пара-положення є кращим. діалкіл-D-тартрат, краще, (+)-ді-(С1-С4)-алкіл-LКраще значення n дорівнює 1. тартрат або (-)-ді-(С1-С4)-алкіл-D-тартрат, особлиНайкращі сульфоксиди, одержані новим спово (+)-диметил-L-тартрат або (-)-диметил-Dсобом, є сульфоксидами формули (І), у якій Υ потартрат, (+)-діетил-L-тартрат або (-)-діетил-Dзначає CN або -С(=О)Х. тартрат, (+)-діізопропіл-L-тартрат або (-)Краще, коли X позначає -NR3R4, -OH, -OR 5, ще діізопропіл-D-тартрат, (+)-дибутил-L-тартрат або (краще, -NR3R4, і найкраще, -NH 2 або -NHOH. )-дибутил-D-тартрат та (+)-ди-трет-бутил-LКраще, щоб R5 був алкілом або аралкілом. тартрат або (-)-ди-трет-бутил-D-тартрат. Особливо Особливо краща група R5 включає метил, етил, кращими речовинами є (+)-діетил-L-тартрат та (-)ізопропіл, бензил і толіл. діетил-D-тартрат. Найкращий сульфоксид, одержаний новим Кращі хіральні ліганди також включають С 3способом, є модафінілом, що відповідає сульфоксиметричні триалканоламіни, особливо ті, що відсиду формули (І), у якій n дорівнює 1, R1, R2 , R1a та повідають формулі (1): R2a позначають Η, а Υ є гр упою -С(=О)Х, де X = ΝΗ2. Використовуваний у тексті термін «модафінова кислота», також називана «дифенілметилсульфінілоцтовою кислотою», стосується сполуки формули (І), у якій n дорівнює 1, R1, R2, R1a та R2a позначають Η, а X позначає ОН. у якій R позначає нижчий алкіл або арил, наТермін «складний ефір модафінової кислоти» приклад, метил, трет-бутил і феніл Кращі хіральні стосується сполуки формули (І), у якій n дорівнює ліганди також включають основу Шифа загальної 1, R1, R2, R1a та R2a позначають Η, а X позначає формули (2а) або (2b): OR5. Стадія (а) Реакцію окиснення проводили в середовищі органічного розчинника Відповідно до винаходу, несподівано було встановлено, що природа розчинника не має істотного впливу на енантіоселективність окиснення. Отже, розчинник може вибиратися у відповідності до придатних умов з у якій R має зазначені вище значення і є нижурахуванням технологічних міркувань та екологіччим алкілом або арилом, таким як метил або фених аспектів. Особливо придатними розчинниками ніл, або два таких радикали приєднані один до є толуол, етилацетат, тетрагідрофуран, ацетонітодного з утворенням циклоалкільної групи, такої як рил, ацетон і хлористий метилен, а його вибір моциклогексил; R' позначає нижчий алкіл або алкокже бути легко зроблений фахівцем в даній області. си; З екологічної точки зору, краще використовувати нехлоровані розчинники. Через це, особливо краще застосовувати етилацетат і толуол. Одержання комплексу металу з хіральними лігандами Комплекс металу з хіральними лігандами одержували з хірального ліганду та сполуки металу. Краща сполука металу є сполукою титану, цирконію, ванадію або марганцю, ще краще, сполукою титану. Таким чином, кращі комплекси металів з хірау якій R позначає нижчий алкіл або NO2; R' польними лігандами є хіральними лігандними комзначає нижчий алкіл або алкокси групу. плексами титану, цирконію, ванадію або марганТакі основи Шифа можуть утворювати з метацю, ще краще, комплексами титану з хіральними лом хіральний лігандний комплекс, відомий як хілігандами. ральний (salen)-металевий комплекс. Сполука титану звичайно є сполукою титану Кращими прикладами комплексів металів з хі(IV), краще, алкоголятом титану (IV), зокрема, ізоральними лігандами можуть служити комплекси пропілатом або пропілатом титану (IV). титану (IV) з С2-симетричними діолами або С 3Хіральний ліганд є хіральною сполукою, здатсиметричним триалканоламіном, комплекси цирною реагувати зі сполукою титану. Такі сполуки, конію (IV) з С3-симетричним триалканоламіном, краще, вибирають з гідроксизаміщених сполук, які, хіральні (salen) комплекси марганцю (III), хіральні краще, містять більше однієї гідрокси групи. Так, (salen) комплекси ванадію (IV), особливо ті, що хіральний ліганд, краще, є хіральним спиртом, 17 85196 18 описані [Fernandez et al., American Chemical Sociхіральним лігандом може бути одержаний приблиety, 2002, Α-ВС]. зно за 24 години. Особливо кращі комплекси металу з хіральниВведення основи ми лігандами є хіральними діоловими комплексаВідповідно до винаходу, асиметричне окисми титану і, найкраще, комплексами діетилтартранення здійснюють в присутності основи. ту ти тану (IV). Дійсно, енантіоселективність реакції несподіСтехіометрія комплексу металу з хіральним лівано підвищується в присутності основи в ході гандом може змінюватися та не має вирішального окиснення. В результаті може бути досягнута сезначення для винаходу. лективність більше 99%. Черговість введення осЗокрема, співвідношення між хіральним ліганнови не є вирішальною обставиною за умови, що її дом і сполукою металу може змінюватися в діападодають до введення окисного агента. Основа зоні від 1 до 4 еквівалентів і, краще, становить 2 може вводитися до або після додавання прохіраеквіваленти. льного сульфіду, краще, після утворення комплекУ відповідності до кращого аспекту винаходу, су металу з хіральним лігандом. при одержанні хірального комплексу металу викоОснову краще вводити після утворення комристовують воду. Було встановлено, що присутплексу металу з хіральним лігандом і після доданість води в комплексі металу з хіральним ліганвання прохірального сульфіду. дом додатково підвищує енантіоселективність Відповідно до іншого кращого варіанта здійсреакції. нення винаходу, з метою підвищення енантіоселеКількість води в комплексі металу з хіральним ктивності реакції, основу вводять в контакт із комлігандом може змінюватися від 0,1 до 1 еквіваленплексом металу з хіральним лігандом та та по відношенню до кількості сполуки титану. Згіпрохіральним сульфідом протягом декількох хвидно з особливо кращим варіантом здійснення, кілин, краще, протягом щонайменше 3 хвилин пелькість води становить 0,4-0,8 еквівалента по ред додаванням окисника. відношенню до сполуки металу. Відповідно до кращого варіанта здійснення Кількість комплексу металу з хіральним ліганвинаходу, основу вводять при температурі здійсдом, використовувана в способі, не має вирішальнення реакції окиснення, яку далі називають «темного значення. Однак було встановлено, що вигідпературою окиснення». но використовувати менше 0,50 еквівалента Основа має бути розчинною в реакційній сукомплексу по відношенню до кількості прохіральміші. Краща основа є органічною основою, наприного сульфіду, особливо, 0,05-0,30 еквівалента, і клад, аміном. Особливо придатними основами є найкраще, 0,1-0,30 еквівалента. Несподівано було аміни, краще, третинні аміни, такі як триетиламін, встановлено, що в способі відповідно до винаходу Ν,Ν-діізопропілетиламін, диметилетаноламін, триможна використовувати дуже малі кількості кометаноламін і, найкраще, Ν,Ν-діізопропілетиламін і плексу, наприклад, 0,05 еквівалента, з одержантриетиламін. ням відмінних результатів. Кількість основи, що додається в реакційну Комплекс металу з хіральним лігандом може суміш, не повинна перевищувати певного значенбути одержаний в присутності прохірального суня, оскільки вона може впливати на енантіоселекльфіду або перед тим, як прохіральний сульфід тивність реакції Зокрема, показано, що корисно додають в реакційну посудину. використовува ти основу в кількості менше 0,5 екВідповідно до одного із кращих варіантів здійвівалента по відношенню до прохірального сульснення винаходу, одержання комплексу металу з фіду, особливо, 0,05-0,5 еквівалента і, найкраще, хіральним лігандом здійснюють в присутності про0,1-0,3 еквівалента хірального сульфіду, тобто, прохіральний сульфід Окиснення завантажують в реакційну посудину до введення Несподівано було встановлено, що процес некомпонентів, використовуваних для одержання обов'язково проводити при дуже низькій темперахірального комплексу. турі, наприклад, -20°С, що, на думку Kagan зі співТривалість реакції одержання комплексу меробітниками, вважалося істотним фактором для талу з хіральним лігандом залежить від темперадосягнення високої енантіоселективності. Ця осотури. бливість представляється досить цікавою, оскільки Було встановлено, що кінетика реакції одервикористання низьких температур обумовлює біжання комплексу металу з хіральним лігандом, польші часи реакції. видимому, залежить від температури сполучення Разом з тим, температуру слід вибирати таким та тривалості реакції. Чим вище температура, тим чином, щоб уникнути розкладання реагентів і надменше час проведення реакції. І навпроти, чим мірної тривалості реакції. нижче температура, тим вище тривалість реакції. Відповідно до кращого втілення винаходу, Так, наприклад, при підвищеній температурі, окисний агент приводять у контакт із сульфідом, що передбачає використання температури в інкомплексом металу з хіральним лігандом та оснотервалі 20-70°С, краще, 40-60°С, найкраще, 50вою при температурі 0-60°С, краще, 15-40°С і, ще 55°С, для одержання комплексу металу з хіралькраще, при кімнатній температурі, тобто, при 20ним лігандом звичайно досить проводити реакцію 25°С. протягом менше двох годин. Так, при 55°С комПридатний окисний агент для асиметричного плекс металу з хіральним лігандом може бути окиснення може бути гідропероксидом, краще, одержаний за 50 хвилин. При більш низькій темпероксидом водню, трет-бутилпероксидом або пературі, наприклад, при 25°С, комплекс металу з гідропероксидом кумолу, найкраще використовувати останню із зазначених речовин. 19 85196 20 Окисний агент залишається в контакті з іншиПрикладами придатних розчинників можуть ми реагентами протягом достатнього часу, що служити метанол, етанол, пропанол, ізопропіловий забезпечує задовільну швидкість перетворення, спирт, трет-бутанол, 2-метил-1-бутанол, бензилоале не занадто довго, оскільки він може впливати вий спирт. на чистоту та енантіоселективність одержаного Як хлоровані розчинники можна відзначити продукту. дихлорметан. У відповідності із кращим втіленням, окисний Серед кетонів можуть бути згадані ацетон, меагент залишається в контакті з іншими реагентами тилетилкетон, 2-пентанон, циклогексанон. протягом часу від 30 хвилин до 3 годин. Як прості ефіри можна використовувати тетраКількість окисного агента не чинить вирішальгідрофуран, діоксан. ного впливу на енантіоселективність реакції. ОдІнші придатні розчинники можуть бути легко нак, надлишкова кількість окисного агента може підібрані фахівцем у даній області. впливати на чистоту одержаного продукту, сприяНесподівано було встановлено, що наявність ючи утворенню сульфону. води в кристалізаційному розчиннику забезпечує Кількість окисного агента менше 2 еквівалентів підвищення енантіомерного надлишку та чистоти. по відношенню до кількості сульфідаміду звичайно Крім цього, проведення стадії кристалізації з виковважається кращою, а особливо краща кількість ристанням суміші органічний розчинник/вода застановить 0,8-1,2 еквіваленти і, ще краще, 1,0 екбезпечує одержання поліморфної форми І і дозвовівалент. ляє зменшити об'єм органічного розчинника, Стадія b) використовуваного в способі. Сульфоксид, одержаний в ході реакції окисТаким чином, кращими кристалізаційними рознення, може бути виділений традиційними спосочинниками є спиртові розчинники, а також суміші бами. органічних розчинників з водою, ще краще, суміші Так, у відповідності із літературними даними, органічних розчинників з водою, причому найкрареакційну суміш можна обробляти водою або водщою системою є органічний розчинник, який місним розчином гідроксиду, що приводить до утвотить до 40% води. Особливо краще використовурення гелю, який містить солі металу. Гель може вати суміші органічних розчинників, що містять до бути відфільтрований і ретельно промитий органі25% води. чним розчинником. Фільтрат можна екстрагувати Продукт, одержаний на стадії b), при необхідорганічним розчинником. Також він може кристаліності може бути підданий додатковому збагаченню зуватися з органічного або водного розчинника з енантіомером. Такі способи відомі в даній області одержанням бажаного енантіомера. та включають вибірну кристалізацію. Відповідно до одного з вигідних аспектів винаВідповідно до особливого варіанта здійснення ходу, одержаний сульфоксид утворює осад, який винаходу, спосіб додатково включає стадію вибірможе бути безпосередньо виділений фільтрацією ної кристалізації з метою підвищення енантіомерта необов'язково промитий водою або органічним ного надлишку. розчинником, таким як етилацетат, толуол, е таПодібний спосіб оптичного розділення (+)нол, хлористий метилен. Одержаний осад є крисмодафінової кислоти за допомогою вибірної кристалічною речовиною високого ступеня чистоти. талізації описаний у заявці на патент Франції [WO Сприятливою обставиною є те, що такий спосіб 2004/060858]. дозволяє виключити відзначені вище складні наОдержаний енантіомер може бути підданий ступні обробки. додатковій обробці з метою одержання партій Стадія с) продукту з особливим розміром частинок. Такі Відповідно до кращого втілення, спосіб винатрадиційні способи, як розмелювання, просівання, ходу додатково включає стадію с) кристалізації здрібнювання у мікронному колоїдному млині, розпродукту, виділеного на стадії b). пилення, розділення за масою або густиною відомі Така стадія кристалізації може виявитися кофа хівцю в даній області техніки. Відповідний спорисною для підвищення чистоти виділеного продусіб одержання партій модафінілу з обмеженим кту та/або одержання бажаної поліморфної форми інтервалом діаметра частинок описаний в [WO та/або збільшення енантіомерного надлишку ці2004/006905]. льового енантіомера та/або одержання партії проЕнантіомери сульфоксидних сполук формули дукту зі спеціальним розміром частинок. (І), у якій Υ позначає -С(=О)Х, а X позначає -ОН У цьому контексті можна послатися на [WO або –OR5, можуть бути перетворені на відповідні 2004/060858], де описуються поліморфні форми аміди, тобто, сульфоксидну сполуку формули (І), у модафінілових енантіомерів. Наприклад, (-)якій X=-ΝΗ2. модафініл, одержаний у вигляді форми II, може Енантіомери модафінової кислоти або її склабути перетворений на форму І за допомогою крисдного ефіру, одержані описаним вище способом, талізаційної стадії с), причому використовувалися можуть бути додатково перетворені на відповідний форми І та II, охарактеризовані в [WO амід, який є енантіомером модафінілу. 2004/060858]. Так, відповідно до особливого втілення, склаКристалізацію можна проводити в органічних дні ефіри енантіомерів модафінової кислоти морозчинниках, необов'язково, в суміші з водою. жуть бути перетворені на відповідні енантіомери Особливо придатними органічними розчинниками модафінілу за допомогою реакції амідування з є спирти, кетони, складні ефіри, прості ефіри, хловикористанням аміаку. ровані розчинники, полярні та апротонні розчинниТаким чином, модафінова кислота може бути ки та їхні суміші, або суміш із водою. перетворена на модафініл в результаті: 21 85196 22 - етерифікації карбоксильної функції за допомогою будь-якого придатного способу, наприклад, за реакцією з нижчим алкіловим спиртом, в присутності диметилсульфату. Одержаний в результаті відповідний складний ефір може бути далі трансформований - амідуванням з використанням будь-якого придатного способу, особливо, в присутності аміаОдержання сульфідів формули (II) ку. Сульфіди формули (II) можуть бути одержані Такі способи описані в [патенті США № будь-яким придатним способом, відомим в даній 4927855]. області. Відповідно до іншого особливого втілення, Так, сульфіди формули (IIа) можуть бути одеенантіомери сульфоксидних сполук формули (І), у ржані з відповідного сульфіду формули (lIb), у якій якій Υ позначає CN, можуть бути перетворені на Υ позначає С(=О)Х, а X позначає OR5. відповідний амід, який є похідним сульфоксиду формули (І), у якій Υ позначає С(=О)Х, де X=ΝΗ2. Таке перетворення може бути реалізовано будь-яким придатним способом, відомим у даній області. Прикладами придатних способів можуть служити окиснення або гідроліз нітрильної групи, наприклад, в результаті каталітичного фазового перенесення за участю пероксидів або основного чи кислотного гідролізу відповідною неорганічною Сульфід формули (lIb) може бути одержаний з основою чи кислотою в м'яких умовах проведення відповідного заміщеного бензгідролу: експерименту. Бажаний енантіомер модафінілу може бути одержаний з дифенілметилсульфінілацетонітрильних енантіомерів, наприклад, в результаті окиснення пероксидом водню в присутності бісульфату тетрабутиламонію в лужних умовах або також в результаті основного чи кислотного гідролізу. У відповідності з іншим втіленням, спосіб відповідно до винаходу забезпечує одержання сульфіду формули (II), у якому Υ=С (=О)Х, де X представляє ΝΗΟΗ, який може бути одержаний будьяким придатним способом, відомим в даній області, особливо способом, описаним в [US 4098824]. У відповідності з іншим варіантом здійснення, спосіб відповідно до винаходу забезпечує одержання сульфіду формули (IIа), у якій Υ позначає С(=О)Х, а X позначає ΝΗ 2. У відповідності з кращим втіленням, сульфід формули (IIа) є сульфідом, у якому R1, R1a, R2 , R2a позначає Η, n дорівнює 1, також називаним дифенілметилтіоацетамідом, що може бути одержаний з ефіру сульфіду формули (lIb), в якому R5 позначає алкіл, краще, (С1-С4)-алкіл, особливо, метил, що має хімічну назву метилдифенілметилтіоацетат (MD MTA). Такий сульфідний ефір формули (lib) і, особливо, MD MTA можуть бути одержані з бензгідролу. Відповідно до кращого втілення, MDMTA одержують відповідно до способу, що включає стадії: а1) конверсії бензгідролу на бензгідрилкарбоксилат, і b1) конверсії бензгідрилкарбоксилату на MD MTA. Стадії а1) і b1) можуть здійснюватися будьяким придатним способом, краще, ці стадії здійснюють у спосіб, описаний в [WO 2004/063149]. Енантіомери модафінілу можуть бути одержані, наприклад, у відповідності з такими реакційними стадіями: 23 85196 Можуть використовува тися інші маршрути одержання дифенілметилтіоацетаміду. Так, наприклад, дифенілметилтіоацетамід, що також має назву бензгідрилтіоацетамід, може бути одержаний з бензгідролу відповідно до способу, що включає: Альтернативний спосіб одержання дифенілметилтіоацетаміду включає такі стадії: (1) перетворення гідроксильної групи бензгідролу на відхідн у гр уп у; (2) перетворення одержаного продукту Термін «відхідна група» стосується будь-якої групи, що може бути легко видалена за допомогою нуклеофільного реагенту. Відхідні групи можуть вибиратися з групи, що складається з галогенів, таких як радикали хлору та брому, або сульфоні 24 (1) взаємодію бензгідролу з придатною кислотою та тіосечовиною з одержанням солі Sбензгідрилтіоуронію; (2) реакцію солі S-бензгідрилтіоуронію з придатною основою з утворенням бензгідрилтіолу; (3) взаємодію бензгідрилтіолу із хлорацетамідом з одержанням 2-(бензгідрилтіо)ацетаміду. Такий спосіб ілюструється схемою 1. - безпосередньо на дифенілметилтіоацетамід, або - на алкілдифенілметилтіоацетат, а потім на дифенілметилтіоацетамід. Цей спосіб ілюструється схемою 2: льних груп, таких як метансульфонільні або птолуолсульфонільні радикали, або ацетатні радикали. 25 85196 26 Перша стадія такого процесу може здійснюваприклад, гідроксильна група бензгідролу може тися будь-яким способом, відомим фахівцеві в перетворюватися на ацетатний радикал в реакції даній області. бензгідролу з хлористим ацетилом або оцтовим Так, наприклад, гідроксильна група бензгідроангідридом. лу може бути перетворена на хлор- або бромВідповідно до ще одного альтернативного радикал в реакції бензгідролу з хлористим тіоніспособу дифенілметилтіоацетамід може бути оделом або бромистим тіонілом. ржаний способом, що включає такі стадії: Гідроксильна група бензгідролу може пере- реакцію між бензгідролом та алкілтіогліколятворюватися на метансульфонатну груп у або птом в присутності кислоти Льюїса, і толуолсульфонатну гр уп у в реакції бензгідролу з - реакцію одержаного алкілдифенілметилтіоаметансульфонілхлоридом або пцетату з аміаком у відповідності зі схемою 3. толуолсульфонілхлоридом, відповідно. Так, на Кращу кислоту Льюїса вибирають з ZnCl2, ZnBr2, Znl2 . Дифенілметилтіоацетамід також може бути одержаний з бензгідрилтіолу У цьому випадку дифенілметилтіоацетамід одержують способом, що включає такі стадії: (1) реакцію бензгідрилтіолу з алкілхлорацетатом, і (2) реакцію одержаного алкілдифенілметилтіоацетату з аміаком. Процес ілюструється схемою 4: Інша можливість полягає в одержанні дифенілметилтіоацетаміду у спосіб, що включає: (1) реакцію бензгідрилтіолу із хлорацетонітрилом, і (2) окиснення або гідроліз одержаного дифенілметилтіоацетонітрилу з утворенням дифенілметилтіоацетаміду. Такий спосіб ілюструється схемою 5. У відповідності з іншим способом дифенілметилтіоацетамід може бути одержаний способом, що включає такі стадії: (1) реакцію бензгідрилтіолу з основою, такою як гідроксид калію; (2) реакцію одержаного продукту з галоїдметиленом; (3) реакцію одержаного продукту із сіллю ціаніду; (4) окиснення або гідроліз одержаного дифенілметилтіоацетонітрилу з утворенням дифенілметилтіоацетаміду. Цей маршрут ілюструється схемою 6: 27 85196 28 Нарешті, дифенілметилтіоацетамід може бути одержаний з дифенілметилтіооцтовою кислоти за допомогою способу, що включає: (1) реакцію дифенілметилтіооцтової кислоти з таким галоїдуючим агентом, як хлористий тіо ніл, або активуючим агентом, який є карбоновою кислотою, і (2) реакцію одержаного продукту з NH3. Цей маршрут ілюстр ується схемою 7. Нарешті, дифенілметилтіооцтова кислота може бути одержана способом відповідно до схем 1-6. Далі винахід ілюструється більш докладно за допомогою наступних прикладів. Приклади Матеріали та методи Визначення енантіомерного надлишку в прикладах і порівняльних прикладах Величина енантіомерного надлишку в кожному з наведених вище прикладів служить вказівкою відносних кількостей кожного з одержаних енантіомерів. Це значення визначають як різницю між відповідними процентними кількостями двох енантіомерів. Енантіомерний склад одержаного сульфоксиду визначали методом хіральної високоефективної рідинної хроматографії (HPLC) при таких умовах: Колонка: AGP (150´4,0мм; 5мкм) Температура термостата: 40°С Елюент: ацетат натрію +0,5% н-бутанолу Лінійна швидкість потоку: 0,9мл/хв. Довжина хвилі: D AD l=230нм Як приклад: - час утримання (-)-2-[(дифеніл) метилсульфініл]ацетаміду: 6,5хв. - час утримання (+)-2-[(дифеніл) метилсульфініл]ацетаміду: 8,3хв. або Колонка: Chiralpak AS (250´4,6мм) Температура термостата: 40°С Елюент: ізопропанол/етанол у співвідношенні 85/15 Лінійна швидкість потоку: 0,45мл/хв. Довжина хвилі: 222нм Як приклад: - час утримання (-)-2-[(дифеніл) метилсульфініл]ацетаміду: 27,2хв. - час утримання (+)-2-[(дифеніл) метилсульфініл]ацетаміду: 14,6хв. Визначення чистоти в прикладах і порівняльних прикладах Значення чистоти в кожному прикладі визначають як відношення кількості одержаних після фільтрації енантіомерів до загальної кількості присутніх продуктів. Дослідження домішок показало, що головним чином вони є непрореагованою вихідною речовиною (прохіральний сульфід) і сульфоном, що утворився в ході окиснення, продуктами потенційної деградації, інтермедіатами синтезу прохірального сульфіду. Чистоту одержаного сульфоксиду визначали методом високоефективної рідинної хроматографії (HPLC) при таких умовах: Колонка: Zorbax RX 38 (150´4,6мм; 5мкм) або Zorbax Eclipce XDB 38 (150´4,6мм; 5мкм) Температура термостата: 25°С Елюент: А=вода +0,1% трифтороцтової кислоти В= нітрилацетат +0,1% трифтороцтової кислоти з градієнтом від 90% А до 100% В протягом 20 хвилин. Лінійна швидкість потоку: 1мл/хв. Довжина хвилі DAD l-230нм (колонка Zorbax RX 38) і 220нм (колонка Zorbax Eclipce XDB 38) Приклад елюювання (колонка Zorbax RX 38): - час утримання 2-[(дифеніл) метилсульфініл]ацетаміду: 8,8хв. - час утримання 2-[(дифеніл) метилтіо]ацетаміду: 11,8хв. - час утримання 2-[(дифеніл) метилсульфоніл]ацетаміду: 10,5хв. Приклади 1-16 Асиметричний синтез (-)-2-[(дисренілметил) сульфінілацетаміду Загальна методика прикладів 1-16: Дифенілметилтіоацетамід (7,70г; 0,03моль; 1,0екв.) розчиняли в розчиннику (77мл; 10об.). В розчин додавали (3,8)-(-)-діетилтартрат (1,23г; 0,006моль; 0,2екв.), тетраізопропілат титану (IV) 29 85196 30 (0,85г; 0,88мл; 0,003моль; 0,1екв.) і воду (27мкл Всі наступні експерименти проводили у відмінус сумарна кількість води, присутньої у вже повідності до умов загальної методики, змінюючи доданих реагентах і розчиннику; 0,0015моль; параметри, як зазначено в Таблицях 1-17. 0,05екв.) при 55°С. При цих умовах одержаний Приклад 1: Вплив співвідношення між хіральхіральний титановий комплекс мав стехіометричним комплексом титану та дифенілметилтіоацений склад (DET/Ti(OiPr)4/H2O: 2/1/0,5) і відповідав тамідом на енантіоселективність і чистоту асиме0,1 еквіваленту дифенілметилтіоацетаміду. Комтричного окиснення поненти перемішували при 55°С протягом 50 хвиВ цьому експерименті співвідношення між кілин. лькістю хірального комплексу титану та ди фенілПісля охолодження до кімнатної температури метилтіоацетамідом змінювали в інтервалі 0,05(25°С) в суміш додавали діізопропілетиламін 0,3 еквівалента, підтримуючи постійну стехіомет(0,39г; 0,52мл; 0,003моль; 0,1екв.) і гідропероксид рію хірального титанового комплексу кумолу (4,55г; 5,0мл; 0,03моль; 1,0екв.). DЕТУТі(ОіРr)4/вода: 2/1/0,4, причому значення Після контактування протягом години одервсіх інши х параметрів відповідали наведеним у жаний осад відокремлювали фільтрацією. загальній методиці. Експерименти проводили в середовищі толуолу. Таблиця 1 Номер 1 2 3 4 Співвідношення титановий комплекс/сульфід (еквіваленти) 0,30/1 0,15/1 0,10/1 0,05/1 Шкала (моль) e.e. (%) Чистота (%) Вихід (%) 0,03 0,06 0,09 0,18 >99,5% 93,6 93 92 >99,5% >99 >99 95,5 88,4 89,7 92 95,4 e.e.= енантіомерний надлишок В експериментах 1-4 енантіоселективність становила 92% або вище і збільшувалася до значення вище 99,5 з підвищенням в реакційній суміші вмісту титанового комплексу з хіральним лігандом. Чистота перевищувала 99% за винятком нижчого співвідношення між титановим комплексом з хіральним лігандом і дифенілметилтіоацетамідом. Величини виходів дорівнювали 88,4% або перевищували це значення. Приклад 2: Вплив кількості води на енантіоселективність і чистоту асиметричного окиснення В цьому експерименті кількість води по відношенню до тетраізопропілату титану змінювали в інтервалі від 0 до 1 еквівалента, при збереженні значень всіх інших параметрів у відповідності до наведеної вище загальної методики. Кількість комплексу титану з хіральним лігандом відносно дифенілметилтіоацетаміду становила 0,1 еквівалента. Експерименти проводили в середовищі толуолу. Таблиця 2 Номер Кількість води е.е. (%) Чистота (еквіваленти) (%) 1 0 80 2 0,4 93 >99 3 0,8 94 >99 4 1 91 99,5 Вихід (%) 90,3 92 88 90 е.е.= енантіомерний надлишок; -=не визначали Як видно з одержаних результатів, кількість води впливає на енантіоселективність реакції. Так, найкращі значення енантіоселективності досягалися в тому випадку, коли воду використовували в кількості 0,4-0,8 еквівалента. З іншого боку, спостерігалося помітне падіння енантіоселективності у відсутності води. Чистота мала значення 99% або вище, ви ходи мали високі значення (88-92%). Приклад 3: Вплив природи розчинника на енантіоселективність і чистоту асиметричного окиснення Як видно з таблиці 3, експерименти проводили в середовищі різних розчинників, використовуючи умови, зазначені в загальній методиці. Таблиця 3 Номер Розчинник 1 2 Толуол Етилацетат Хлористий метилен Ацетонітрил Тетрагідрофуран Ацетон 3 4 5 6 е.е Чистота (%) (%) 99,4 99,7 99,5 99,7 Вихід (%) 80 73,5 98 98,8 61 99,3 99,7 99,6 98,8 99,6 99,2 70,2 50,7 45,8 е.е. = енантіомерний надлишок У всіх експериментах, за винятком використання як розчинника хлористого метилену, сульфоксидамід одержували з високою енантіоселективністю (е.е. дорівнює або вище 99%) і високою чистотою (чистота 98,8% або вище). При використанні хлористого метилену енантіоселективність була тро хи нижчою, але все-таки становила 98%. 31 85196 32 Приклад 4: Вплив природи основи на енантіовиходу, одержані при використанні толуолу або селективність і чистоту асиметричного окиснення етилацетату як розчинника. Значення інших параПроводили порівняння між основами, Ν,Νметрів відповідали зазначеним у загальній методіізопропілетиламіном і триетиламіном, за вплидиці. вом на значення енантіоселективності, чистоти та Таблиця 4 Номер 1 2 3 4 Основа Діізопропілетиламін Триетиламін Діізопропілетиламін Триетиламін Розчинники Толуол Толуол Етилацетат Етилацетат е.е. (%) 93 94 99,5 99 Чистота (%) >99 >99,5 >99,5 >99,5 Вихід (%) 92 90,3 73,5 79,2 е.е.= енантіомерний надлишок Як видно з Таблиці 4, в експериментах були одержані високі значення енантіоселективності та виходу. В середовищі етилацетату були одержані високі значення енантіоселективності (>99%) і знижені значення виходу (73,5-79,2%) в присутності триетиламіну та діізопропілетиламіну. З іншого боку, у середовищі толуолу та в присутності діізопропілетиламіну та триетиламіну спостерігалися знижені значення енантіоселективності (93-94%), але більш високі значення виходу (90,3-92%). Ступінь чистоти був аналогічною в обох розчинниках (аж до 99% або 99,5%) при додаванні в реакційне середовище двох зазначених основ. Приклад 5: Вплив кількості основи на енантіоселективність і чистоту асиметричного окиснення Кількість основи змінювали в інтервалі від 0 до 2,2 еквівалентів по відношенню до кількості дифенілметилтіоацетаміду. Таблиця 5 Номер 1 2 3 4 5 Основа Кількість основи (еквіваленти) Діізопропілетиламін 0,1 Триетиламін 0,1 Триетиламін 0,2 Розчинники e.e. (%) Чистота (%) Вихід (%) Толуол 66 >99 86 Етилацетат 74 >99 70 Толуол 93 >99 92 Етилацетат 99 >99,5 79,2 Етилацетат 94,3 >99,8 78,6 е.е.= енантіомерний надлишок Під час відсутності основи реакція протікає з низькою швидкістю та низькими значеннями енантіоселективності (66-74%). Швидкість реакції збільшується при додаванні основи в реакційну суміш. При додаванні в реакційну суміш 0,1 еквівалента триетиламіну та використанні етилацетату як розчинника була досягнута висока енантіоселективність. Можна відзначити, що енантіоселективність трохи зменшується при підвищенні кількості використовуваної основи до 0,2 еквівалента. Кількість основи впливає на чистоту, яка у всіх випадках перевищує 99%. Крім цього, одним з факторів, що підвищують енантіоселективність, є час контакту між каталізатором і основою. При часі контакту між каталізатором і основою, щонайменше, 3 хвилини, енантіомерний надлишок збільшується приблизно на 5%. Так, наприклад, енантіомерний надлишок збільшується від 94,1% (без контакту) до 99,5% (час контакту 3 хвилини). Приклад 6: Вплив температури утворення комплексу титану з хіральним лігандом на енантіоселективность і чистоту асиметричного окиснення Згідно з описаною вище методикою та використовуючи як розчинник етилацетат, ти тановий комплекс із хіральним лігандом йЕТ/Ті/Н 2О (2/1/0,5) одержували при зміні температури в інтервалі 25-70°С. Порівнювали одержані значення енантіоселективності та чистоти. Таблиця 6 Номер Температура е.е. (%) Чистота (°С) (%) 1 25 65,6 >99 2 50 >99,5 99,9 3 55 99 >99,5 4 60 >99,5 99,9 5 70 99,7 99,8 Вихід (%) 63,5 69,6 79,2 73 62 е.е.= енантіомерний надлишок Одержання титанового комплексу з хіральним лігандом при 25°С протягом 50 хвилин приводить до низкої енантіоселективності. При більш високих температурах 50-70°С утворюється високозбага 33 85196 34 чена енантіомером (99->99,5%) і високочиста 2 30 91 99,5 79,2 (>99,5-99,9%) форма сульфоксиду. 3 50 99 >99,5 79,2 Приклад 7: Вплив тривалості формування титанового комплексу з хіральним лігандом на енане.е.= енантіомерний надлишок тіоселективність і чистоту асиметричного окиснення Тривалість формування титанового комплексу Тривалість формування комплексу, що дорівз хіральним лігандом змінювали в інтервалі від 10 нює 50 хвилинам, є необхідною та достатньою для до 50 хвилин, використовуючи етилацетат як роззабезпечення енантіоселективності близько 99% і чинник, при цьому інші параметри відповідали чистоти 99,5% і вище. значенням, зазначеним у загальній методиці. Як видно з результатів експериментів, проведених при 25°С і представлених в Таблиці 8, для Таблиця 7 формування комплексу титану з хіральним лігандом і досягнення поліпшеного значення енантіоЧас (хвили- е.е. (%) Чистота Вихід селективності потрібно проводити реакцію, щоНомер ни) (%) (%) найменше, протягом 24 годин. 1 10 87,5 >99,5 79,7 Таблиця 8 Номер 1 2 3 4 5 6 Температура (°С) 25 25 25 25 25 25 Час 50хв. 1 година 3 години 8 годин 14 годин 24 години е.е. (%) 65,6 78,4 86,4 89,6 92,2 94,2 Чистота (%) >99 99,1 99,4 99,0 99,5 97,0 Вихід (%) 63,5 72,0 74,6 75,8 74,6 85,5 е.е.= енантіомерний надлишок Приклад 8: Вплив температури реакції окиснення на енантіоселективність і чистоту асиметричного окиснення Стадію окиснення, що відповідає введенню окисного агента, проводили при температурі в інтервалі 0-55°С, використовуючи етилацетат як розчинник і при відповідності інших параметрів значенням, зазначеним у загальній методиці. Таблиця 9 Номер Температура е.е. (%)Чистота (%) Вихід (%) 1 0°С 99,7 99,7 52,6 2 10°С 99,5 99,7 65,0 3 20°С 99,5 99,8 73,9 4 25°С 99 >99,5 79,2 5 55°С 94,3 97,8 81,8 е.е.= енантіомерний надлишок Умови проведення експерименту забезпечують високі значення енантіомерного надлишку та високу чистоту, в інтервалі 94,3-99,7% та 97,899,7%, відповідно. При температурі 55°С спостерігалося зниження енантіомерного надлишку приблизно на 5%, з 99,5% до 94,3%. Сульфоксид одержували з високим виходом (81,8%), однак він мав знижену чистоту (97,8%). Приклад 9: Вплив тривалості додавання окисного агента на енантіоселективність і чистоту асиметричного окиснення Тестували вплив тривалості додавання окисного агента на енантіоселективність реакції. Гідропероксид кумолу (CuOOH) додавали протягом 5 або 40 хвилин (в цьому експерименті окисник розбавляли етилацетатом), при значеннях інших параметрів, які зазначені вище в загальній методиці, та проводили реакцію в середовищі етилацетату. Таблиця 10 Номер Час, хвилиние.е. (%) Чистота (%) Вихід (%) 1 5 99 >99,5 79,2 2 40* >99,8 99,5 64,7 е.е.= енантіомерний надлишок; * CuOOH розбавляли етилацетатом Тривалість додавання окисного агента, не має значного впливу на енантіоселективність реакції та чистоту продукту. Приклад 10: Вплив природи хірального ліганду на енантіоселективність і чистоту асиметричного окиснення У таблиці 11 наведені використовувані хіральні ліганди та розчинники, при цьому інші параметри мали значення, вказані вище в загальній методиці. 35 85196 36 Таблиця 11 Номер 1 2 3 4 Хіральний ліганд (S,S)-(-)-DET (S,S)-(-)-DET (R,R)-(+)-DET (S,S)-(-)-DIT Розчинник Етилацетат Толуол Толуол Етилацетат е.е. (%) 99 >99,5 98,6 92,5 Чистота (%) >99,5 >99,5 >99,5 99,2 Вихід (%) 79,2 88,4 98,5 73,9 e.e.= енантіомерний надлишок; DET= діетилтартрат; DIT= діізопропілтартрат В вибраних експериментальних умовах, при використанні діетилтартрату та діізопропілтартрату як хіральних лігандів, енантіоселективність становила 92,5% або мала значення в інтервалі 98>99,5%, при чистоті в інтервалі 99,2->99,5%. Приклад 11: Вплив послідовності та температури введення реагентів на енантіоселективність і чистоту асиметричного окиснення Наведені нижче експерименти проводили в середовищі етилацетату. Використовувані кількості зазначені вище в загальній методиці. Таблиця 12 Номер 1 2 3 4 5 6 7 8 1/T DET/20°С DET/20°С DET/20°С DET/20°С DET/20°С DET/20°С DET/20°С DET/20°С Вв едення реагентів : послідов ність і температура 2/T 3/T 4/Т 5/Т SA/20°С Ті(ОіРr) 4/50°С Н2О/50°С Et3N/20°С SA/20°С Et3N/50°С Ті(ОіРr) 4/50°С Н2О/50°С SA/20°С Ті(ОіРr) 4/50°С Et3N/50°С Н2О/50°С Ті(ОіРr) 4/50°С Н2О/50°С SA/50°С Et3N/20°С Ті(ОіРr) 4/50°С Н2О/50°С SA/20°C Et3N/20°С Ті(ОіРr) 4/50°С Н2О/50°С Et3N/20°С SA/20°С Ті(ОіРr) 4/50°С Н2О/50°С Et3N/50°С SA/50°С SA/20°С Ті(ОіРr) 4/50°С H2O/50°С Et3N/50°С 6/T CHP/20°С CHP/20°С CHP/20°С CHP/20°С CHP/20°С CHP/20°С CHP/20°С CHP/20°С e.e. % 99,4 99,6 99,6 98,8 99,0 98,6 98,8 99,0 Чистота, % 99,7 99,8 99,7 99,6 99,6 99,4 99,7 99,7 Вихід, % 67,2 78,9 77,6 64,2 69,0 68,4 77,5 78,1 e.e.= енантіомерний надлишок; DET= (8,5-(-)-діетилтартрат; Ti(OiPr) 4= тетраізопропілат титану; SA= сульфідамід; Et3N= триетиламін; CHP= гідропероксид кумолу Послідовність і температура введення реагентів впливають на енантіоселективність (98,699,6%) і чистоту (99,4-99,8%) асиметричного окиснення досліджуваного сульфідаміду, за умови додавання триетиламіну до введення окисника. Приклад 12: Вплив часу контакту окисника з реакційною сумішшю на енантіоселективність і чистоту асиметричного окиснення Експеримент проводили відповідно до загальної методики, використовуючи етилацетат як розчинник. Час контакту окисника з реакційною сумішшю визначали при кімнатній температурі. Таблиця 13 Номер 1 2 3 4 5 6 7 8 9 10 Час контакту 30 хвилин 1 година 2 години 3 години 4 години 5 годин 6 годин 20,5 години 24 години 48 годин е.е. (%) 99,6 99,6 99,6 98,8 97,0 96,4 96,8 95,5 94,6 94,2 Чистота (%) 99,66 99,77 99,75 99,78 99,73 99,83 99,82 99,77 99,85 99,85 Сульфониамід, % 0,04 0,05 0,06 0,06 0,07 0,07 0,07 0,10 0,08 0,09 Сульфідамід, % 0.28 0,17 0,17 0,15 0,16 0,09 0,09 0,12 0,07 0,06 е.е.= енантіомерний надлишок Загальний вихід реакції склав 76,8%. Час контакту окисника з іншими реагентами незначно впливає на енантіоселективність реакції, що трохи зменшується в часі, залишаючись на прийнятному рівні (>94%). Ступінь чистоти залишається високим (значення е.е. збільшується від 99,66% до 99,85%). Рівень вмісту сульфонаміду за 48 годин трохи підвищується від 0,04 до 0,1%, при цьому з перебігом часу вміст сульфонаміду зменшується від 0,28% до 0,1%. Кращі співвідношення між зна 37 85196 38 ченням енантіоселективності та чистотою досяВідповідно до описаної вище загальної ексгаються через 3 години після ведення окисника в периментальної методики, кількість окисника вареакційну суміш. ріювали в інтервалі 0,9-2 еквівалента по відноПриклад 13: Вплив кількості окисника на енашенню до кількості сульфідаміду, що становить 1 нтіоселективність і чистоту асиметричного окисеквівалент. Як розчинник використовували етинення лацетат. Таблиця 14 Номер 1 2 3 4 СuООН/сульфідамід 0,9/1 1/1 1,1/1 2/1 е.е. (%) 99,2 99,6 99,6 99,5 Чистота (%) 98,88 99,88 99,87 99,29 Сульфониамід, % 0,08 0,02 0,13 0,70 Сульфідамід, % 0,91 0,10 >DL >DL Вихід, % 72,8 72 77,5 67,8 е.е.= енантіомерний надлишок; CuOOH= гідропероксид кумолу; DL= межа визначення Результати, представлені в Таблиці 14, показують, що енантіоселективність реакції має високі значення, рівні або більші 99,2%. Чистота асиметричного окиснення також має високі значення, зокрема, становлячи 99,87% при додаванні в реакційну суміш 1 та 1,1 еквівалента окисника по відношенню до кількості сульфідаміду (1 еквівалент). При введенні 0,1 еквівалента окисника, вміст сульфіду становить усього 0,02%. При введенні окисника в кількості 1,1-2 еквівалентів кількість сульфіду ви ходить за межу точності визначення. Приклад 14: Вплив кількості хірального ліганду на енантіоселективність i чистоту асиметричного окиснення Відповідно до наведеної вище загальної методики кількість хірального ліганду [(S,S)-(-)діетилтартрату] варіювали в інтервалі 1-2 еквіваленти по відношенню до кількості ізопропілату титану, що становить 1 еквівалент, який входить до складу титанового комплексу з хіральним лігандом. Як розчинник використовували етилацетат. Таблиця 15 Номер DET/Ti/H 2O е.е. (%) Чистота (%) Вихід (%) 1 2/1/0,5 99,4 99,7 71,4 2 1,5/1/0,5 94,8 99,7 76,9 3 1/1/0,5 69,4 е.е.= енантіомерний надлишок; DET= [(S,S)-(-)діетилтартрат; Ті= ізопропілат титану; -= не визначали При стехіометрії титанового комплексу з хіральним лігандом в інтервалі 1,5/1/0,5-2/1/0,5 енантіоселективність становила близько 95% або вище 99% при чистоті асиметричного окиснення вище 99%. Приклад 15: Відтворюваність реакції асиметричного окиснення Відтворюваність результатів реакції асиметричного окиснення дифенілметилтіоацетаміду, здійснюваної відповідно до наведеної вище загальної методики, оцінювали в чотирьох незалежних експериментах, використовуючи як розчинник етилацетат. Таблиця 16 Номер 1 2 3 4 е.е. (%) 99,6 99,6 99,6 99,6 Чистота (%) 99,84 99,86 99,79 99,88 Сульфідамід, % 0,10 0,05 0,13 0,10 Сульфонамід, % 0,05 0,09 0,05 0,02 Вихід, % 73,3 74 73,9 72 е.е.= енантіомерний надлишок Як видно з даних, представлених у таблиці 16, одержані результати характеризуються високою відтворюваністю. Енантіоселективність у всіх випадках вище або дорівнює 99,6%, а чистота вище або дорівнює 99,8%. Вміст домішок є надзвичайно низьким, і детектується лише сульфонамід у кількості 0,02-0,09%, а кількість вихідного сульфідаміду, що залишився, становить 0,050,13%. Інші домішки, наприклад, відповідна кис лота чи складний ефір сульфіду або їхні сульфонові похідні, не визначаються. Приклад 16: Вплив структури прохіральних похідних сульфіду на енантіоселективність і чистоту асиметричного окиснення. Представлені нижче похідні прохірального сульфіду випробовували в умовах, вказаних вище в загальній методиці, при використанні етилацетату як розчинника. 39 85196 40 Таблиця 17 Номер 1 2 3 4 5 R1a Η 4-F Η Η Η R1 Η 4'-F Η Η Η Похідні прохірального сульфіду R2a R2 n Υ Η Η 1 CONH2 Η Η 1 CONH2 Η Η 1 CONHCH3 Η Η 1 CONHCH2Ph Η Η 1 CN Одержані результати показують, що загальна методика може застосовуватися для сполук, забезпечуючи гарну енантіоселективність, яка у більшості випадків складає 92-99,6% при конверсії в інтервалі 94-100%. Крім цього, виділений кінцевий продукт реакції може піддаватися кристалізації з метою підвищення енантіомерної конверсії та/або чистоти бажаного енантіомера. Приклад 17: Приклад 17 відповідає порівняльним прикладам 1-3. Одержання сульфоксидів проводили за описаною вище загальною методикою: Загальна методика: Окиснення сульфіду проводили відповідно до способу, описаного Kagan et al. в Organic Synthesis, John Wiley and Sons Inc. Ed., 1993; vol.VIII, 464-467. Воду (0,27мл, 0,015моль, 1,0екв.) додають по краплях при кімнатній температурі (20°С) до розчину діетилтартрату (DET) (6,19г, 0,03моль, 2,0екв.) та ізопропілату титану (IV) (4,26г, 4,43мл, 0,015моль, 1,0екв.) в 125мл безводного хлористого метилену в атмосфері нітрогену. Перемішування продовжували до утворення гомогенного жовтого розчину (30хв.) і додавали сульфід (0,03мл, 2,0екв.). Одержаний розчин охолоджували до -30°С і залишали в стані контакту на 50 e.e.,% Конверсія (%) 99,6 92,5 96,4 -93 -92 -100 99 -97 -97 -94 хвилин при -30°С. Після цього додавали гідропероксид кумолу (4,57г, 5,0мл, 0,03моль, 2,0екв.) і одержану суміш витримували протягом 15 годин при -25°С. Потім додавали 5мл води і розчин перемішували протягом 1,5 години. Реакційне середовище фільтрували через кларцел (сlаrсеl) і фільтрат піддавали обробці залежно від природи одержаного сульфоксиду. Так, наприклад, при утворенні сульфоксиду дифенілметилтіооцтової кислоти сполуку тричі екстрагували порціями по 100мл водного розчину K2СО3 (0,6 М). Водні фази об'єднували, фільтрували через кларцел, підкисляли додаванням 150мл 4N водного розчину хлористоводневої кислоти (рН=~1). Осад, що утворився, фільтр ували через пористий скляний фільтр, промивали водою і потім сушили у вакуумі при 35°С. Порівняльний приклад 1: Енантіоселективність асиметричного окиснення сульфідів Формули (II). у якій n=1. а X має значення –ΝΗ2, -ОСН3, -ОН Описану вище методику проведення порівняльних прикладів застосовували до дифенілметилтіоацетаміду, метилдифенілметилтіоацетату або дифенілметилтіооцтової кислоти як сульфіду, при використанні (R,R)-DET або (S,S)-DET. Таблиця 18 Попередник Дифенілметилтіоацетамід Метилдифенілметилтіоацетат Дифенілметилтіооцтова кислота Дифенілметилтіооцтова кислота DET (R,R)-(+)-DET (R,R)-(+)-DET (R,R)-(+)-DET (S,S)-(-)-DET Порівняльний приклад 2 Вплив кількості окисного агента на енантіоселективність окиснення дифенілметилтіооцтової кислоти Описану вище методику проведення порівняльних прикладів застосовували до дифенілметилтіооцтової кислоти при зміні кількості гідрокпероксиду кумолу від 1 до 4 еквівалентів. Таблиця 19 Гідропероксид кумолу (екв.) е.е. (%) Конверсія (%) 1 50 83 2 50 92 4 50 97 Відповідно до способу Kagan, збільшення кількості окисного агента дозволяє підвищити ступінь конверсії сульфіду на сульфоксид, але не e.e., % 42 10 50 50 Конверсія (%) 90 40 70 83 приводить до поліпшення енантіоселективності реакції. Порівняльний приклад 3: Вплив стехіометрії хірального комплексу титану на енантіоселективність окиснення дифенілметилтіооцтової кислоти Описану вище методику проведення порівняльних прикладів застосовували до дифенілметилтіооцтової кислоти, змінюючи стехіометрію хірального титанового комплексу (S,S)-(-)DET/Ti/H 2O. Таблиця 20 (S,SH-)-DET/Ti/H 2O 2/1/1 2/1/0 4/1/0 е.е. (%) 50 0 0 Конверсія (%) 92 97 97 41 85196 42 Відповідно до способу Kagan для досягнення Зазначені нижче форми І, II та IV належать енантіоселективності необхідна присутність води. до поліморфних форм (-)-модафінілу, описаного Приклади 18-24 в [WO 2004/060858]. Приклади 18-23 відповідають прикладам неПриклад 18: обов'язкових модернізованих процесів, які моСуспензію енантіомерно збагаченого (-)жуть застосовуватися до кристалізованих кінцемодафінілу (5г; 0,018моль) і 95% етанолу (20вих продуктів, одержаних в результаті 25мл; 4-5 об'ємів) нагрівали зі зворотним холодиасиметричного окиснення, виділених фільтрацією льником при перемішуванні протягом 5 хвилин. з метою одержання: Одержаний розчин спочатку охолоджували до - енантіомерно збагаченої форми цільового кімнатної температури (25°С), а потім витримуенантіомера, вали протягом 1 або 2 годин при 4°С. Кристаліч- особливої поліморфної форми енантіомера, ний сульфоксид фільтрували у вакуумі, промивата/або ли холодним етанолом (95%) і сушили у досягнення високого ступеня чистоти в ревакуумній печі при 40°С. Одержані результати зультаті видалення домішок, наприклад, вихіднопредставлені в Таблиці 21. го прохірального сульфіду та/або суль фону. Таблиця 21 Номер 1 2 3 4 5 6 e.e. (%) 93,0 91,6 94,0 98,8 95,4 96,8 Вихіднийί Чистота (%) Поліморфна форма 99,4 II 99,9 99,5 І е.е. (%) 98,6 99,1 98,4 99,0 97,2 98,0 Кінцевий Чистота (%) Поліморфна форма 99,5 І 99,6 І 99,8 І 99,7 І е.е.= енантіомерний надлишок; -: не визначали Як видно з даних таблиці 21, енантіомерний надлишок збільшується в результаті кристалізації в суміші етанол/вода (95/5). Така обробка приводить до утворення (-)-модафінілу у ви гляді поліморфної форми І. Приклад 19 Кристалізацію енантіомерно збагаченого (-)модафінілу здійснювали в сумішах тетрагідрофуран/Н2О і ацетон/Н 2О (95/5), використовуючи експериментальні умови, зазначені в Прикладі 18. Таблиця 22 Номер 1 2 3 Вихідний Кінцевий Сульфідамід Сульфонамід, е.е. (%) Сульфідамід, Сульфонамід, е.е. (%) (%) (%) (%) (%) ΤΓΦ/Η2Ο (95/5) 94,2 1,10 1,90 99,8 ND 0,40 ТГФ/Н2О (95/5) 94,8 0,12 0,11 99,4 ND 0,10 ацетон/Н2О 94,8 0,06 0,24 98,2 ND 0,30 (95/5) Розчинник е.е.= енантіомерний надлишок; ND: не детектується Результати, представлені в Таблиці 22, демонструють збільшення енантіомерного надлишку, як і зменшення кількості прохірального сульфідаміду до значення нижче межі виміру. Також спостерігається зменшення кількості сульфонаміду. Приклад 20: Суспензію, що складається з енантіомерно збагаченого (-)-модафінілу (12,15г; 0,044моль) і ТГФ (122мл), повільно нагрівали при перемішуванні до завершення розчинення, а після цього кип'ятили зі зворотним холодильником. Одержаний розчин охолоджували з регульованою швидкістю -0,5°С/хв. до 0°С і витримували при цій температурі протягом 45 хвилин. Кристалічний сульфоксид фільтрували та сушили при 40°С у вакуумі. Одержані результати представлені в Таблиці 23. Вихід: 77,1%. 43 85196 44 Таблиця 23 Вихідний е.е. (%) Чистота (%) Сульфонамід (%) 99,2 98,50 0,25 Сульфідамід (%) 0,28 Кінцевий е.е. (%) Чистота (%) Сульфонамід (%) 100 99,71 0,05 Сульфідамід (%) 0,01 е.е.= енантіомерний надлишок В зазначених вище умовах експерименту, проведення додаткової стадії кристалізації приводить до збільшення енантіомерного надлишку та загального відсотка чистоти, при цьому знижується кількість утворюваного сульфону, а також непрореагованого прохірального сульфідаміду. Приклад 21: В колбу ємністю 250мл, що містить 180мл дихлорметану, додавали форму II збагаченого енантіомером (-)-модафінілу (10г; 0,036моль). Суміш нагрівали до початку стікання флегми та перемішували до одержання розчину. 125мл розчинника конденсували в пастці Діна-Старка. Решту суспензії охолоджували до кімнатної температури та потім на 1 годину поміщали на баню, що містить суміш льоду з водою. Кристалічний сульфоксид відфільтровували та сушили при 40°С у вакуумі. Вихід: 84,6%. Таблиця 24 Вихідний е.е. (%) Чистота (%) Сульфонамід (%) 99,2 98,50 0,25 Сульфідамід (%) 0,28 Кінцевий е.е. (%) Чистота (%) Сульфонамід (%) 100 99,71 0,03 Сульфідамід (%) 0,02 е.е.= энантимерний надлишок При використанні зазначених експериментальних умов стадія кристалізації підвищує ступінь чистоти. Після додаткової обробки спостерігалося зменшення вмісту суль фонаміду та прохірального сульфідаміду. Кінцевий сульфоксид кристалізувався у вигляді поліморфної форми IV. Приклад 22: Суспензію енантіомерно збагаченого (-)модафінілу (10г; 0,036моль) в ацетонітрилі (100мл) нагрівали зі зворотним холодильником при перемішуванні (350об./хв.) до повного розчинення. Потім розчин охолоджували до 0°С зі швидкістю -0,5°С/хв. і перемішували протягом години (350об./хв.). Кристалічний сульфоксид відфільтровували та сушили у вакуумі при 40°С. Вихід: 69,3%. Таблиця 25 е.е. (%) 99,2 Вихідний Чистота (%) Сульфонамід Сульфідамід (%) (%) 98,50 0,25 0,28 е.е. (%) 100 Кінцевий Чистота (%) Сульфонамід (%) 99,90 0,02 Сульфідамід (%) 0,03 е.е.= енантіомерний надлишок Після додаткової кристалізації (-)дифенілметилсульфінілацетамід одержували з енантіомерним надлишком 100%, при цьому зменшувалася залишкова кількість сульфонаміду та прохірального сульфідаміду. Приклад 23 Суспензію енантіомерно збагаченого (-)модафінілу (10г; 0,036моль) в етилацетаті (150мл) нагрівали до початку стікання флегми при перемішуванні (350об./хв.). Потім для завершення розчинення додавали метанол (25мл). Одержаний розчин охолоджували до 0°С зі швидкістю -0,5°С/хв. і перемішували протягом 45 хвилин зі швидкістю 350об./хв. Кристалічний сульфоксид відфільтровували та сушили у вакуумі при 40°С. Вихід: 38%. 45 85196 46 Таблиця 26 Вихідний е.е. (%) Чистота (%) Сульфонамід Сульфідамід (%) (%) 99,2 98,50 0,25 0,28 Кінцевий е.е. (%) Чистота (%) Сульфонамід (%) 99,8 99,54 0,04 Сульфідамід (%) 0,03 е.е.= енантіомерний надлишок Як видно з даних, представлених у Таблиці 26, стадія кристалізації в суміші етилацетату з метанолом знижує вміст сульфонаміду та прохірального сульфідаміду на 84 та 89%, відповідно. Приклад 24: В реактор, обладнаний відцентровою мішалкою та трубкою для введення газу, при кімнатній температурі завантажували метилдифенілметилтіоацетат (100г; 1 еквівалент) і метанол (300мл; 3 об'єми). Суміш нагрівали до 35°С. Протягом З годин додавали аміак (7 еквівалентів) і проводили контактування суміші протягом 16 годин при Комп’ютерна в ерстка Т. Чепелев а 35°С, після чого додавали 3 еквіваленти аміаку. Після завершення реакції суміш о холоджували до 25°С и додавали воду (90мл; 0,9 об'єму). Одержану суміш відфільтровували та сушили у вакуумі. Вихід: 83%. Спектр 1Н-ЯМР (CDCI3, 400МГц): δ Η 7,41 (д, 4Н, Η ароматичний), 7,32 (т, 4Η, Η ароматичний), 7,25 (т, 2Η, Η ароматичний), 6,53 (с, 1Н, ΝΗ2), 6,22 (с, 1Н, ΝΗ2), 5,18 (с, 1Н, СН), 3,07 (с, 2Н, СН2). Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing a sulphide as a single enantiomer or an enantiomerically enriched form
Автори англійськоюRebiere Francois, Duret Gerard, Prat Laurence
Назва патенту російськоюСпособ получения сульфоксида в виде отдельного энантиомера или энантиомерно обогащенной формы
Автори російськоюРибьер Франсуа, Дюре Жерар, Пра Лоранс
МПК / Мітки
МПК: C07C 315/00, C07C 327/00
Мітки: сульфоксиду, окремого, форми, енантіомерно, одержання, спосіб, вигляді, енантіомеру, збагаченої
Код посилання
<a href="https://ua.patents.su/23-85196-sposib-oderzhannya-sulfoksidu-u-viglyadi-okremogo-enantiomeru-abo-enantiomerno-zbagacheno-formi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сульфоксиду у вигляді окремого енантіомеру або енантіомерно збагаченої форми</a>
Наступний патент: Композиція, стабілізована відносно дії світла і/або тепла
Випадковий патент: Спосіб вирощування озимої пшениці в зрошуваній сівозміні