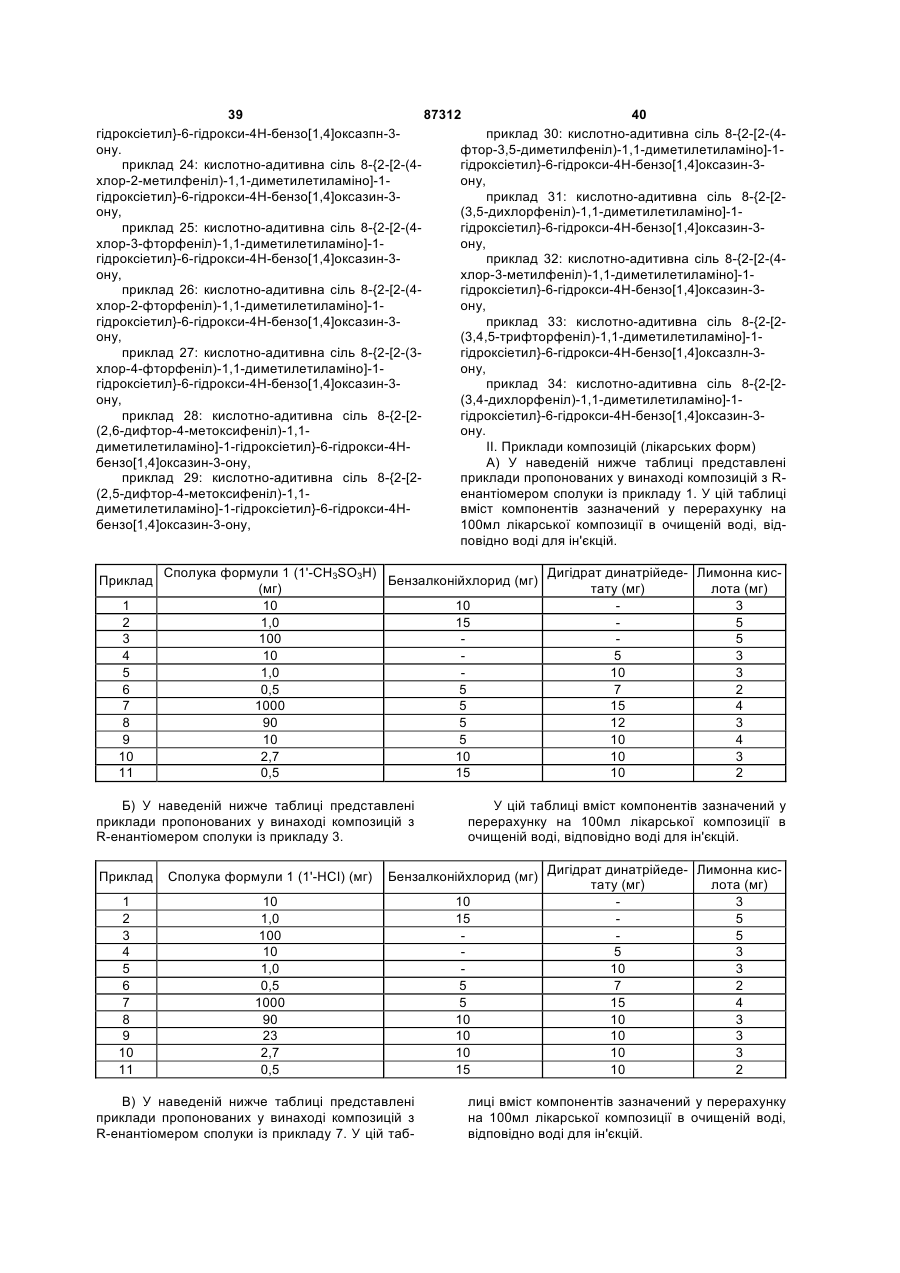
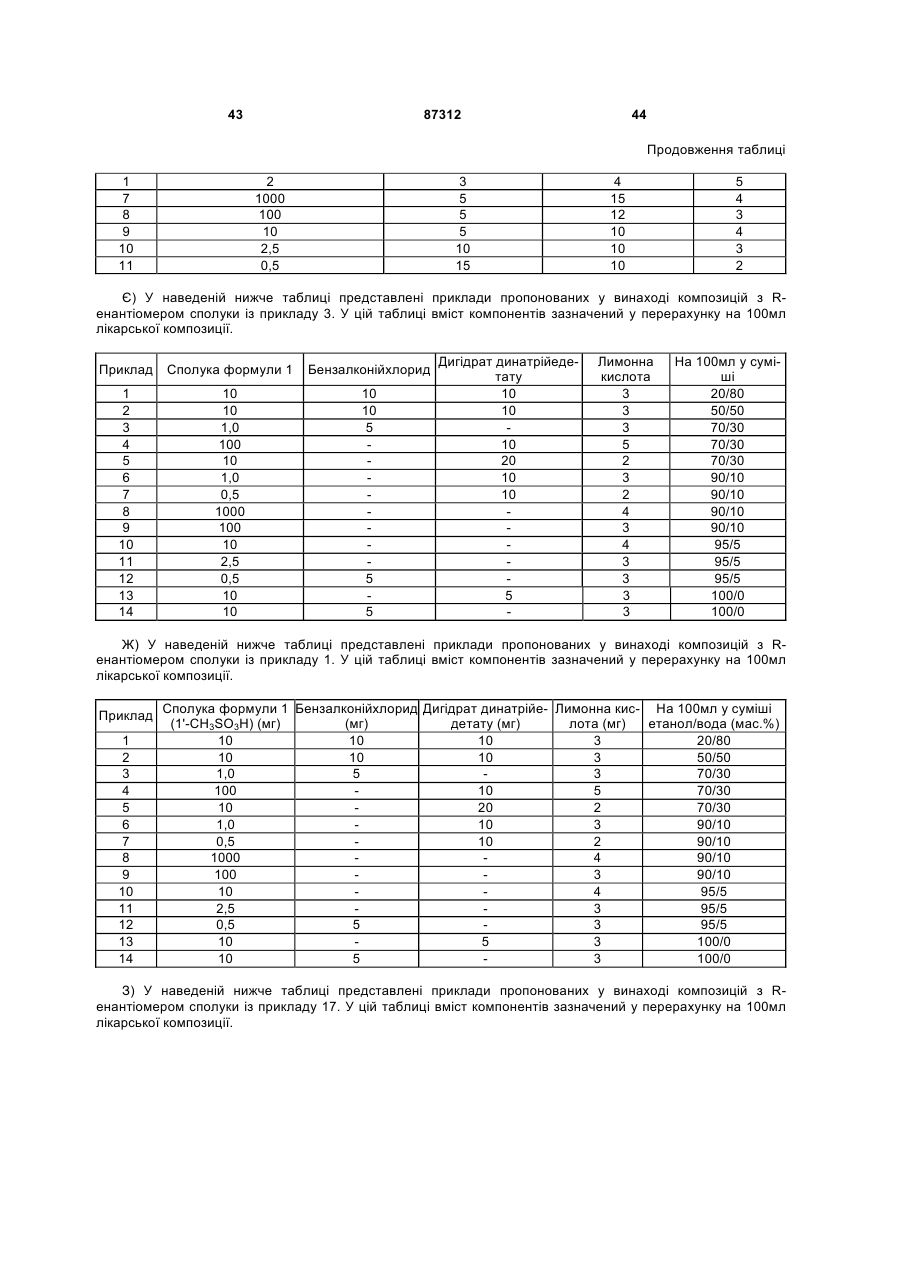
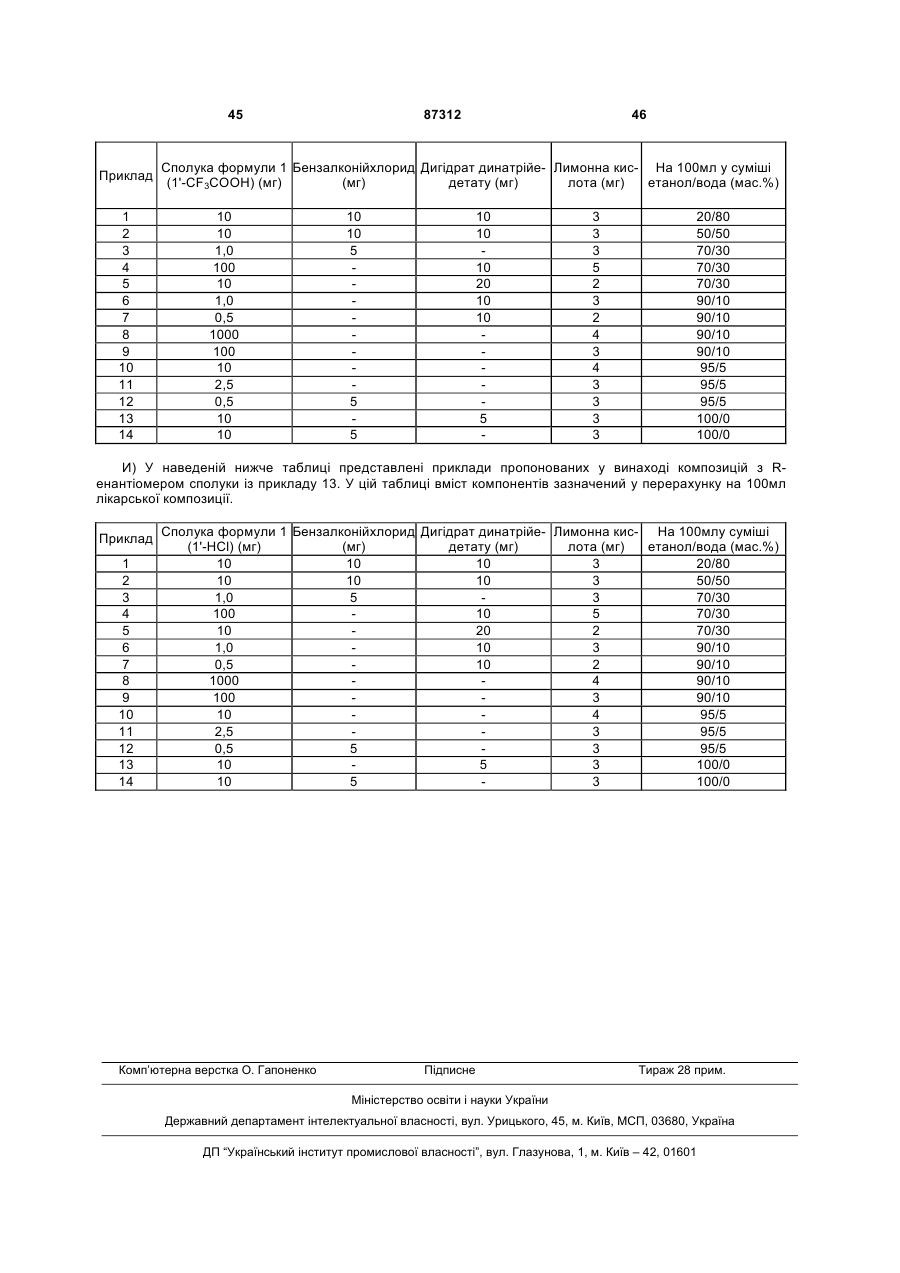
Композиція для аерозольної інгаляції b-агоністів
Формула / Реферат
1. Лікарська композиція, яка містить як єдину діючу речовину одну або декілька сполук загальної формули 1
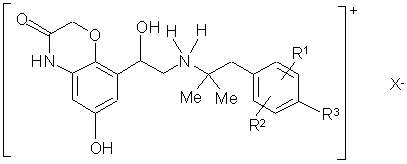 1,
1,
у якій
R1 означає водень, С1-С4алкіл, С1-С4алкоксигрупу або галоген,
R2 означає водень, С1-С4алкіл, С1-С4алкоксигрупу або галоген,
R3 означає водень, С1-С4алкіл, С1-С4алкоксигрупу, галоген, ОН, -О-С1-С4алкілен-СООН або -О-С1-С4алкілен-СОО-С1-С4алкіл, та
X- означає однозарядний аніон, бажано однозарядний аніон, вибраний із групи, яка включає хлорид, бромід, йодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, бензоат, цитрат, саліцилат, трифторацетат, фумарат, тартрат, оксалат, сукцинат, бензоат та n-толуолсульфонат,
необов'язково у вигляді їх таутомерів, енантіомерів, сумішей енантіомерів, рацематів або сольватів, принаймні одну фармакологічно прийнятну кислоту, необов'язково інші фармакологічно прийнятні допоміжні речовини і/або комплексоутворювачі, а також воду, етанол або суміш води з етанолом як розчинник.
2. Лікарська композиція за п. 1, яка відрізняється тим, що вона містить одну або декілька сполук формули 1, у якій
R1 означає водень, метил, етил, фтор або хлор,
R2 означає водень, метил, етил, фтор або хлор,
R3 означає водень, метил, етил, пропіл, ОН, метоксигрупу, етокси групу, фтор, хлор, бром, -О-СН2-СООН, -О-СН2-СООметил, -О-СН2-СООетил, -О-СН2-СН2СООН, -О-СН2-СН2СООметил, -О-СН2-СН2СООетил, -О-СН2-СН2-СН2СООН, -О-СН2-СН2-СН2СООметил або -О-СН2-СН2-СН2СООетил, а
X- означає однозарядний аніон, бажано однозарядний аніон, вибраний із групи, яка включає хлорид, бромід, йодид, сульфат, фосфат, метансульфонат, нітрат, малеат, ацетат, бензоат, цитрат, саліцилат, трифторацетат, фумарат, тартрат, оксалат, сукцинат, бензоат і n-толуолсульфонат,
необов'язково у вигляді їх таутомерів, енантіомерів, сумішей енантіомерів, рацематів або сольватів.
3. Лікарська композиція за п. 1, яка відрізняється тим, що вона містить одну або декілька сполук формули 1, у якій
R1 означає водень або метил, краще водень,
R2 означає водень або метил, краще водень,
R3 означає метил, ОН, метоксигрупу, фтор, хлор, бром, -О-СН2-СООН або -О-СН2-СООетил, а
X- означає однозарядний аніон, вибраний із групи, яка включає хлорид, бромід, сульфат, метансульфонат, малеат, ацетат, бензоат, цитрат, саліцилат, трифторацетат, фумарат, тартрат і сукцинат,
необов'язково у вигляді їх таутомерів, енантіомерів, сумішей енантіомерів, рацематів або сольватів.
4. Лікарська композиція за п. 1, 2 або 3, у якій фармакологічно прийнятна кислота вибрана із групи неорганічних кислот, яка включає соляну кислоту, бромистоводневу кислоту, азотну кислоту, сірчану кислоту та фосфорну кислоту, або із групи органічних кислот, яка включає аскорбінову кислоту, лимонну кислоту, яблучну кислоту, винну кислоту, малеїнову кислоту, бурштинову кислоту, фумарову кислоту, оцтову кислоту, мурашину кислоту та пропіонову кислоту.
5. Лікарська композиція за будь-яким з пп. 1-4, яка відрізняється тим, що її значення рН становить від 2,5 до 6,5.
6. Лікарська композиція за будь-яким з пп. 1-5, яка відрізняється тим, що як допоміжну речовину вона містить бензалконійхлорид.
7. Лікарська композиція за п. 6, яка відрізняється тим, що вона містить бензалконійхлорид від 1 до 50 мг на 100 мл розчину.
8. Лікарська композиція за будь-яким з пп. 1-7, яка відрізняється тим, що вона містить сполуку формули 1’ приблизно від 0,1 до 1600 мг на 100 мл розчину.
9. Лікарська композиція за будь-яким з пп. 1-8, яка відрізняється тим, що як додатковий компонент вона містить комплексоутворювач.
10. Лікарська композиція за п. 9, яка відрізняється тим, що вона містить комплексутворювач від 1 до 50 мг на 100 мл розчину.
11. Лікарська композиція за будь-яким з пп. 1-10, яка відрізняється тим, що як розчинник вона містить чисту воду.
12. Лікарська композиція за будь-яким з пп. 1-10, яка відрізняється тим, що як розчинник вона містить чистий етанол.
13. Лікарська композиція за будь-яким з пп. 1-10, яка відрізняється тим, що як розчинник вона містить суміш води з етанолом.
14. Лікарська композиція за п. 13, яка відрізняється тим, що як розчинник вона містить суміш води з етанолом, у якій на масову частку етанолу припадає від 5 до 99 %.
15. Лікарська композиція, яка містить як єдину діючу речовину вільну основу формули 1’
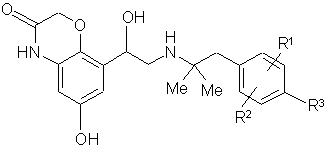 1’,
1’,
у якій залишки R1, R2 і R3 можуть мати зазначені в пп. 1-3 значення, необов'язково у вигляді її таутомерів, енантіомерів, сумішей енантіомерів, рацематів або сольватів, принаймні одну фармакологічно прийнятну кислоту, необов'язково інші фармакологічно прийнятні допоміжні речовини і/або комплексоутворювачі, а також воду, етанол або суміш води з етанолом як розчинник.
16. Застосування лікарської композиції за будь-яким з пп. 1-15 для одержання лікарського засобу, призначеного для лікування захворювань дихальних шляхів.
17. Набір для інгаляції, який складається з лікарської композиції за будь-яким з пп. 1-15 та придатного для її розпилення інгалятора.
18. Набір для інгаляції за п. 17, у якому інгалятор являє собою інгалятор Respimat®.
Текст
частково виступає в циліндр вому напрямку на корпусну деталь для розміщенкорпусу насоса. На одному з кінців цього порожниня пружини і закриває елементи кріплення, відпостого поршня розташований клапанний елемент відно опорні елементи, привід шпинделя і (58). Порожнистий поршень ущільнений ущільненвитратну ємність з рідиною. ням (59). Ведений фланець має упор (60), яким При приведенні інгалятора в дію верхню коробмежується хід цього веденого фланця усередині пусну деталь повертають відносно нижньої корпуверхньої корпусної деталі при розжатій пружині. сної деталі, разом з якою одночасно повертається Ведений фланець має також упор (61), що обмеі корпусна деталь для розміщення пружини. При жує хід цього веденого фланця при стиснутій пруцьому пружина стискується і зводиться за допоможині. Після стиску пружини стопор (62) зміщується гою гвинтової передачі, і стопорний механізм авв проміжок між упором (61) і опорою (63) у верхній томатично фіксується в застопореному положенні. корпусній деталі. Зі стопором з'єднана спускова Краще, щоб кут повороту верхньої корпусної детакнопка (64). Верхня корпусна деталь закінчується лі відносно нижньої корпусної деталі був у ціле мундштуком (65) і закрита знімним захисним ковчисло раз менше 360°, наприклад дорівнював пачком (66), що надягається на неї. 180°. Одночасно із стискуванням пружини ведена Корпусна деталь (67) разом з розміщеною в деталь (ведений фланець) переміщується у верхній пружиною (68) стиснення закріплена на верхній ній корпусній деталі на задану відстань, а порожкорпусній деталі за допомогою фіксаторів-засувок нистий поршень відводиться назад усередину ци(69) і змонтована в поворотній опорі з можливістю 19 87312 20 повороту відносно цієї верхньої корпусної деталі. На корпусну деталь для розміщення пружини наЦя сполука відома з US 4460581. саджена нижня корпусна деталь (70). Усередині У наступних прикладах розглянутий синтез нокорпусної деталі для розміщення пружини розтавих, застосовуваних у пропонованих у винаході шована змінна витратна ємність (71) (змінний балікарських композиціях сполук. Однак ці приклади, лончик), заповнена рідиною (72), що розпилюєтьякі носять винятково ілюстративний характер, вися. Витратна ємність закрита пробкою (73), крізь користовуються для більш докладного пояснення яку проходить виступаючий у витратну ємність даного винаходу й не обмежують його обсяг опипорожнистий поршень, занурений одним з його саними нижче конкретними варіантами його здійснення. кінців у рідину (у розчин діючої речовини). Приклад 2: Кислотно-адитивна сіль 8-{2-[2-(4У бічну зовнішню стінку корпусної деталі для фторфеніл)-1,1-диметилетиламіно]-1розміщення пружини вбудований ходовий гвинт гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3(74) механічного лічильника. На тому кінці цього ону шпинделя, що напрямлений до верхньої корпусної деталі, розташована привідна шестерня (75). На шпинделі встановлений бігунок (76). Описаний вище інгалятор може використовуватися для розпилення пропонованих у винаході аерозольних складів у вигляді придатного для інгаляції аерозолю. При використанні для розпилення пропонованої у винаході композиції описаного вище пристрою (Respimat®) порція композиції, яка видаєть300мг (0,91ммоль) 6-бензилокси-8-(2,2ся принаймні при 97%, краще принаймні при 98%, дигідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та всіх циклів приведення інгалятора в дію (ходів по183мг (1,09ммоль) 2-(4-фторфеніл)-1,1ршня), повинна відповідати деякій заданій кількосдиметилетиламіну розчиняють в 3мл етанолу. Даті лікарського препарату при припустимому відхилі додають молекулярне сито й нагрівають до ленні від цієї кількості, що дорівнює максимум 80°С з витримкою при цій температурі протягом 25%, краще 20%. При цьому така задана порція 30хв. Після охолодження до кімнатної температукомпозиції, що видається за один хід поршня, пори додають 35мг (0,91ммоль) боргідриду натрію. винна краще складати від 5 до 30мг, найбільше Потім суміш протягом 1год при кімнатній темперакраще від 5 до 20мг. турі перемішують, після чого до реакційної суміші Для розпилення пропонованої у винаході комдодають розчин гідрокарбонату натрію та екстрапозиції можна, однак, використовувати не тільки гують етилацетатом. Органічні фази концентрують описаний вище інгалятор, але й інгалятори інших і залишок хроматографують (елюент: гектипів, наприклад струминні інгалятори. сан/етилацетат/метанол). Одержаний таким шляУ даному винаході пропонується далі набір хом етаноламін (223мг) для відщеплення бензильдля інгаляції, що складається з однієї з описаних ної захисної групи розчиняють у метанолі та потім вище пропонованих у винаході лікарських компогідрують при кімнатній температурі й нормальному зицій і придатного для її розпилення інгалятора. У тиску в присутності 150мг гідроксиду паладію як кращому варіанті у винаході пропонується набір каталізатора. Після цього каталізатор відокремдля інгаляції, що складається з однієї з описаних люють шляхом фільтрації суміші через Celite®, з вище пропонованих у винаході лікарських компофільтрату видаляють розчинник і залишок хромазицій і описаного вище інгалятора Respimat®. тографують (силікагель, елюент: дихлормеНижче, як приклади, що ілюструють, але не тан/метанол). Таким шляхом одержують тверду обмежують обсяг винаходу, представлені конкретречовину бежевого кольору. ні склади пропонованих у винаході композицій або Вихід: 76мг (22%). + препаратів. Mac-спектрометрія: [М+Н] =375. Представлені нижче приклади синтезу сполук і Одержаний продукт можна шляхом його взаєприклади пропонованих у винаході композицій модії з відповідною кислотою НХ перевести в непризначені для більше докладного пояснення даобхідну кислотно-адитивну сіль. ного винаходу і не обмежують його об'єм описа(R)- та (S)-енантіомери одержаної в цьому ними нижче конкретними варіантами його здійсприкладі сполуки можна одержувати розділенням нення. рацемату аналогічно до традиційних, відомих з І. Одержання сполук формули 1 рівня техніки методів. Приклад 1: Метансульфонат 6-гідрокси-8-{1Приклад 3: Гідрохлорид 6-гідрокси-8-{1гідрокси-2-[2-(4-гідрокси-2,6-диметилфеніл)-1,1гідрокси-2-[2-(4-метоксифеніл)-1,1диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3ону ону 21 а) 8-{2-[1,1-диметил-2-(4метоксифеніл)етиламіно]-1-гідроксіетил}-6бензилокси-4Н-бензо[1,4]оксазин-3-он До розчину 3,6г 1,1-диметил-2-(4метоксифеніл)етиламіну в 100мл етанолу при 70°С додають 7,5г гідрату (6-бензилокси-4Нбензо[1,4]оксазин-3-он)гліоксалю та перемішують протягом 15хв. Потім протягом 30хв при 10-20°С додають 1г боргідриду натрію. Далі суміш перемішують протягом години, після чого додають 10мл ацетону та перемішують ще протягом наступних 30хв. Потім реакційну суміш розбавляють 150мл етилацетату, промивають водою, сушать над сульфатом натрію та концентрують. Залишок розчиняють в 50мл метанолу й 100мл етилацетату та підкисляють концентрованою соляною кислотою. Після додавання 100мл діетилового ефіру продукт випадає в осад. Кристали відфільтровують, промивають і перекристалізовують в 50мл етанолу. Вихід: 7г (68%, гідрохлорид). Температура плавлення 232-234°С. б) Гідрохлорид 8-{2-[1,1-диметил-2-(4метоксифеніл)етиламіно]-1-гідроксіетил}-6гідрокси-4Н-бензо[1,4]оксазин-3-ону 6,8г одержаної на попередній стадії бензильної сполуки гідрують при кімнатній температурі й нормальному тиску в 125мл метанолу з додаванням 1г паладію на вугіллі (5%-вому). Після цього каталізатор відфільтровують і з фільтрату видаляють розчинник. Після перекристалізації залишку в 50мл ацетону й невеликій кількості води одержують тверду речовину, яку відфільтровують і промивають. Вихід: 5,0г (89%, гідрохлорид). Температура плавлення 155-160°С. (R)- та (S)-енантіомери сполуки із прикладу 3 можна одержати з рацемату, наприклад, за допомогою ВЕРХ на хіральних фазах (наприклад, з використанням колонки Chirobiotic Τ фірми Astec, 250×22,1мм). Як рухливу фазу можна використовувати метанол з 0,05% триетиламіну та 0,05% оцтової кислоти. Як матеріал колонки можна використовувати силікагель із розміром частинок 5мкм, з яким ковалентно зв'язаний глікопротеїн тейкопланін (Teicoplanin). Час утримання R-енантіомера становить 40,1хв, а S-енантіомера - 45,9хв. Обидва енантіомери одержують цим методом у вигляді вільних основ, які можна шляхом взаємодії з необхідною кислотою (наприклад, соляною кислотою) загальновідомими з рівня техніки методами перевести у відповідні кислотно-адитивні солі. Відповідно до винаходу особливе значення має R-енантіомер сполуки із прикладу 3. Приклад 4: Гідрохлорид 6-гідрокси-8-{1гідрокси-2-[2-(4-феноксіетилацетат)-1,1диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3ону 87312 22 а) 8-{2-[1,1-диметил-2-(4феноксіетилацетат)етиламіно]-1-гідроксіетил}-6бензилокси-4Н-бензо[1,4]оксазин-3-он Зазначену в заголовку сполуку одержують аналогічно прикладу 3а) з 15г гідрату (6бензилокси-4Н-бензо[1,4]оксазин-3-он)гліоксалю та 11,8г гідрохлориду 1,1-диметил-2-(4феноксіетилацетат)етиламіну. Вихід: 16,5г (69%, гідрохлорид). Температура плавлення 212-214°С. б) Гідрохлорид 8-{2-[1,1-диметил-2-(4феноксіетилацетат)етиламіно]-1-гідроксіетил}-6гідрокси-4Н-бензо[1,4]оксазин-3-ону 8г одержаного на попередній стадії бензилового спирту розчиняють в 100мл етанолу, 100мл метанолу та 10мл води та гідрують у присутності 1г паладію на вугіллі (5%-вому). Після поглинання теоретично розрахованої кількості водню каталізатор відфільтровують і фільтрат концентрують. Продукт, який викристалізувався при відгоні розчинника відокремлюють вакуум-фільтрацією й промивають. Вихід: 5,5г (81%, гідрохлорид). Температура плавлення 137-140°С. (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 5: Гідрохлорид 6-гідрокси-8-{1гідрокси-2-[2-(4-феноксіоцтова кислота)-1,1диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3ону 11г гідрохлориду 8-{2-[1,1-диметил-2-(4феноксіетилацетат)етиламіно]-1-гідроксіетил}-6бензилокси-4Н-бензо[1,4]оксазин-3-ону (приклад 4а)) розчиняють в 125мл метанолу й гідрують у присутності 1г паладію на вугіллі (5%-вому). Після поглинання теоретично розрахованої кількості водню каталізатор відфільтровують. До фільтрату додають 2,6г гідроксиду натрію, розчиненого в 20мл води. Після цього суміш протягом 30хв кип'ятять зі зворотним холодильником, відганяють метанол і додають 10мл води, 20мл н-бутанолу та 3,9мл оцтової кислоти. Тверду речовину, яка випала в осад, відокремлюють вакуум-фільтрацією й промивають діетиловим ефіром. Вихід: 7г (87%). Після перекристалізації з 0,5молярної соляної кислоти одержують гідрохлорид. Температура плавлення 152°С. 23 87312 (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 6: Гідрохлорид 8-{2-[1,1-диметил-2(2,4,6-триметилфеніл)етиламіно]-1-гідроксіетил}-6гідрокси-4Н-бензо[1,4]оксазин-3-ону а) 1-(6-бензилокси-4Н-бензо[1,4]оксазин-3-он)2-[1,1-диметил-2-(2,4,6триметилфеніл)етиліміно]етанон 7,2г гідрату (6-бензилокси-4Нбензо[1,4]оксазин-3-он)гліоксалю та 3,6г 1,1диметил-2-(2,4,6-триметилфеніл)етиламіну нагрівають до 70°С в 100мл етанолу з витримкою при цій температурі протягом години. Кристали, які випали після охолодження в осад, відфільтровують і промивають етанолом і діетиловим ефіром. Вихід: 8,6г (94%). Температура плавлення 175°С. б) 8-{2-[1,1-диметил-2-(2,4,6триметилфеніл)етиламіно]-1-гідроксіетил}-6бензилокси-4Н-бензо[1,4]оксазин-3-он 8,6г одержаної в прикладі 6а) основи шиффа розчиняють в 100мл етанолу й 20мл ТГФ, змішують протягом 30хв при 10-20°С з 0,7г боргідриду натрію й перемішують протягом години. Після додавання 10 мл ацетону суміш перемішують ще протягом 30хв і потім розбавляють етилацетатом і водою. Продукт, який викристалізувався при підкисленні концентрованою соляною кислотою, відфільтровують і промивають. Вихід: 7,4г (80%, гідрохлорид). Температура плавлення 235°С (з розкладанням). в) Гідрохлорид 8-{2-[1,1-диметил-2-(2,4,6триметилфеніл)етиламіно]-1-гідроксіетил}-6гідрокси-4Н-бензо[1,4]оксазин-3-ону 7,4г одержаної на стадії б) бензильної сполуки гідрують при кімнатній температурі й нормальному тиску в 125мл метанолу з додаванням 1г паладію на вугіллі (5%-вому). Після цього каталізатор відфільтровують і фільтрат концентрують. Продукт, який викристалізувався при додаванні ацетону, відокремлюють вакуум-фільтрацією й промивають ацетоном і діетиловим ефіром. Вихід: 5г (78%, гідрохлорид). Температура плавлення 160°С (з розкладанням). (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 7: Гідрохлорид 6-гідрокси-8-{1гідрокси-2-[2-(4-гідроксифеніл)-1,1диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3ону 24 а) 8-{2-[1,1-диметил-2-(4гідроксифеніл)етиламіно]-1-гідроксіетил}-6бензилокси-4Н-бензо[1,4]оксазин-3-он Зазначену в заголовку сполуку одержують аналогічно прикладу 3а) з 10г гідрату (6бензилокси-4Н-бензо[1,4]оксазин-3-он)гліоксалю та 4,6г 1,1-диметил-2-(4-гідроксифеніл)етиламіну. Вихід: 9,0г (64%, гідрохлорид). Температура плавлення 255-258°С. б) Гідрохлорид 8-{2-[1,1-диметил-2-(4гідроксифеніл)етиламіно]-1-гідроксіетил}-6гідрокси-4Н-бензо[1,4]оксазин-3-ону 5,7г одержаного на попередній стадії продукту реакції сполучення гідрують в 100мл метанолу в присутності 0,6г паладію на вугіллі (5%-вому). Після поглинання теоретично розрахованої кількості водню каталізатор відфільтровують і з фільтрату видаляють розчинник. Залишок при нагріванні розчиняють в етанолі й потім змішують із діетиловим ефіром. Продукт, який випав в осад, відокремлюють вакуум-фільтрацією й однократно перекристалізовують у воді. Вихід: 3,6г (72%, гідрохлорид). Температура плавлення 159-162°С. (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 8: Гідрохлорид 6-гідрокси-8-{1гідрокси-2-[2-(4-ізопропілфеніл)-1,1диметилетиламіно]етил}-4Н-бензо[1,4]оксазин-3ону а) 1-(4-ізопропілфеніл)-2-метилпропан-2-ол Необхідну сполуку одержують у вигляді безбарвного масла взаємодією сполуки Гриньяра, одержаної з 20г (119ммоль) 4ізопропілбензилхлориду, з 11,4мл (155ммоль) ацетону. Вихід: 13,0г (57%). + Mac-спектрометрія: [М+Н] =193. б) N-[2-(4-ізопропілфеніл)-1,1диметилетил]ацетамід Аналогічно прикладу 9б) проводять реакцію Ріттера з використанням 10,2г (53ммоль) 1-(4ізопропілфеніл)-2-метилпропан-2-олу. Потім реакційну суміш зливають у суміш води з льодом і підлуговують розчином їдкого натру, що супроводжується випаданням в осад твердої речовини. Його відокремлюють вакуум-фільтрацією та сушать. Вихід: 9,90г (80%). 25 87312 26 Mac-спектрометрія: [М+Н]+=234. а) 1-(4-етилфеніл)-2-метилпропан-2-ол в) 2-(4-ізопропілфеніл)-1,1-диметилетиламін До 39мл 3-молярного розчину метилмагнійбЗазначену в заголовку сполуку одержують пероміду в діетиловому ефірі при охолодженні льоретворенням 9,80г (42ммоль) N-[2-(4дяною банею по краплях додають 14,8г (90ммоль) ізопропілфеніл)-1,1-диметилетил]ацетаміду анало1-(4-етилфеніл)пропан-2-ону, розчиненого в діетигічно прикладу 9в). ловому ефірі, таким чином, щоб температура не Вихід: 7,00г (71%, гідрохлорид). піднімалася вище 30°С. По завершенні цієї операТемпература плавлення 202-206°С. ції додавання реакційну суміш протягом 1,5год г) 6-бензилокси-8-{1-гідрокси-2-[2-(4ізопропілфеніл)-1,1-диметилетиламіно]етил}-4Нкип'ятять зі зворотним холодильником і потім гідбензо[1,4]оксазин-3-он ролізують 10%-вим розчином хлориду амонію. 2,18г (6,1ммоль) бензилокси-8-(2-етокси-2Після відділення органічної фази водну фазу екстгідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та 1,1г рагують діетиловим ефіром. Об'єднані ефірні фази (5,8ммоль) 2-(4-ізопропілфеніл)-1,1промивають водою, сушать над сульфатом натрію диметилетиламіну перемішують протягом години та концентрують. Одержане таким шляхом масло при 50-80°С в 40мл етанолу. Після охолодження безпосередньо використовують у наступній реакдо кімнатної температури додають 0,24г ції. (6,3ммоль) боргідриду натрію. Потім суміш переВихід: 15,5г (90%). мішують протягом години, після чого розбавляють б) N-[2-(4-етилфеніл)-1,15мл ацетону й перемішують ще протягом 30хв. диметилетил]ацетамід Далі реакційну суміш підкисляють соляною кислоДо 15,5г (87ммоль) 1-(4-етилфеніл)-2тою, змішують з 100мл води та 80мл етилацетату метилпропан-2-олу в 4,8мл (91ммоль) ацетонітрий підлуговують аміаком. Органічну фазу відокремлу та 15мл льодяної оцтової кислоти протягом люють, сушать над сульфатом натрію й видаля15хв по краплях додають 6,2мл концентрованої ють розчинник. Залишок розчиняють в 20мл етисірчаної кислоти, що супроводжується підвищенлацетату й 10мл води, підкисляють ням температури до 65°С. Після цього суміш пеконцентрованою соляною кислотою та розбавляремішують протягом години, розбавляють сумішють діетиловим ефіром. Після додавання речовишю води з льодом і підлуговують концентрованим ни, яка сприяє кристалізації, тверду речовину, яка розчином їдкого натру. Потім перемішують ще протягом 30хв і тверду речовину, яка випала в випала в осад, відокремлюють вакуумосад, відокремлюють вакуум-фільтрацією й профільтрацією та промивають. Одержаний таким шляхом продукт являє собою білу тверду речовимивають водою. Сирий продукт розчиняють в етину. лацетаті, сушать над сульфатом натрію й конценВихід: 1,7г (52%, гідрохлорид). трують. Одержане як залишок масло змішують із Температура плавлення 220-222°С. петролейним ефіром, що супроводжується випад) Гідрохлорид 6-гідрокси-8-{1-гідрокси-2-[2-(4данням в осад твердої речовини, яку відфільтровують і сушать. ізопропілфеніл)-1,1-диметилетиламіно]етил}-4НВихід: 16,3г (85%). бензо[1,4]оксазин-3-ону Температура плавлення 90-92°С. 1,6г (3,0ммоль) 6-бензилокси-8-{1-гідрокси-2в) 2-(4-етилфеніл)-1,1-диметилетиламін [2-(4-ізопропілфеніл)-1,1-диметилетиламіно]етил}16,3г (74ммоль) N-[2-(4-етилфеніл)-1,14Н-бензо[1,4]оксазин-3-ону розчиняють у метанолі диметилетил]ацетаміду та 8,0г гідроксиду калію та гідрують при нормальному тиску й кімнатній протягом 15год кип'ятять зі зворотним холодильтемпературі в присутності паладію на вугіллі як ником в 60мл етиленгліколю. Далі реакційну суміш каталізатор. Потім каталізатор відокремлюють змішують із сумішшю води з льодом і тричі екстравакуум-фільтрацією, відганяють розчинник і залигують діетиловим ефіром. Об'єднані органічні фашок викристалізовують в ізопропанолі. Одержаний зи промивають водою, сушать над сульфатом натаким шляхом продукт являє собою білу тверду трію та видаляють розчинник. Для одержання речовину. гідрохлориду сирий продукт розчиняють в ацетоніВихід: 1,1г (85%, гідрохлорид). трилі й послідовно змішують із розчином соляної Температура плавлення 248-250°С. + кислоти в діетиловому ефірі та діетиловим ефіMac-спектрометрія: [М+Н] =399. ром. Тверду речовину, яка випала в осад, відо(R)- та (S)-енантіомери одержаної в цьому кремлюють вакуум-фільтрацією й сушать. прикладі сполуки можна одержувати розділенням Вихід: 11,0г (69%, гідрохлорид). рацемату аналогічно до традиційних, відомих з Температура плавлення 165-167°С. рівня техніки методів. г) 6-бензилокси-8-{2-[2-(4-етилфеніл)-1,1Приклад 9: Гідрохлорид 8-{2-[2-(4-етилфеніл)диметилетиламіно]-1-гідроксіетил}-4Н1,1-диметилетиламіно]-1-гідроксіетил}-6-гідроксибензо[1,4]оксазин-3-он 4Н-бензо[1,4]оксазин-3-ону Необхідну сполуку одержують аналогічно прикладу 8г) з 2,14г (6,0ммоль) 6-бензилокси-8-(2етокси-2-гідроксіацетил)-4Н-бензо[1,4]оксазин-3ону та 1,0г (5,6ммоль) 2-(4-етилфеніл)-1,1диметилетиламіну. Одержаний таким шляхом продукт являє собою білу тверду речовину. Вихід: 1,7г (54%, гідрохлорид). Температура плавлення 210-214°С. 27 87312 28 д) Гідрохлорид 8-{2-[2-(4-етилфеніл)-1,1безпосередньо використовують у наступній реакдиметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Нції. бензо[1,4]оксазин-3-ону Вихід: 4,3г (87%). Необхідну сполуку одержують у вигляді білої в) 2-(4-фтор-3-метилфеніл)-1,1твердої речовини гідрогенолізом 1,45г (2,75ммоль) диметилетиламін 6-бензилокси-8-{2-[2-(4-етилфеніл)-1,14,3г (20,6ммоль) N-[2-(4-фтор-3-метилфеніл)диметилетиламіно]-1-гідроксіетил}-4Н1,1-диметилетил]формаміду, 20мл концентрованої бензо[1,4]оксазин-3-ону, одержаного в прикладі соляної кислоти та 20мл води протягом 2год нагрі8д). вають зі зворотним холодильником. Потім реакВихід: 1,07г (92%, гідрохлорид). ційну суміш розбавляють водою, підлуговують Температура плавлення 266-269°С. концентрованим розчином їдкого натру й екстраMac-спектрометрія: [М+Н]+=385. гують дихлорметаном. Органічні фази сушать над сульфатом натрію та концентрують. Залишок роз(R)- та (S)-енантіомери одержаної в цьому чиняють в етилацетаті, змішують із розчином соприкладі сполуки можна одержувати розділенням ляної кислоти в діетиловому ефірі й охолоджують. рацемату аналогічно до традиційних, відомих з Кристали, які випали в осад, відокремлюють вакурівня техніки методів. ум-фільтрацією, промивають діетиловим ефіром і Приклад 10: Гідрохлорид 8-{2-[2-(4-фтор-3сушать. Одержаний таким шляхом продукт являє метилфеніл)-1,1-диметилетиламіно]-1собою білу тверду речовину. гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3Вихід: 3,9г (87%, гідрохлорид). ону Температура плавлення 196-198°С. г) 6-бензилокси-8-{2-[2-(4-фтор-3-метилфеніл)1,1-диметилетиламіно]-1-гідроксіетил}-4Нбензо[1,4]оксазин-3-он 1,10г (3,1ммоль) бензилокси-8-(2-етокси-2гідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та 0,50г (2,8ммоль) 2-(4-фтор-3-метилфеніл)-1,1диметилетиламіну піддають хімічному перетворенню й переробці аналогічно прикладу 8г). Одержаний таким шляхом продукт являє собою білу а) 1-фтор-2-метил-4-(2-метилпропеніл)бензол тверду речовину. 100мл 0,5-молярного розчину 4-фтор-3Вихід: 0,75г (47%, гідрохлорид). метилфенілмагнійброміду в ТГФ протягом 30хв Температура плавлення 228-230°С. змішують із 4,7мл (50ммоль) ізопропілальдегіду, д) Гідрохлорид 8-{2-[2-(4-фтор-3-метилфеніл)що супроводжується підвищенням температури до 1,1-диметилетиламіно]-1-гідроксіетил}-6-гідрокси45°С. Далі суміш перемішують протягом 30хв, про4Н-бензо[1,4]оксазин-3-ону тягом 1год кип'ятять зі зворотним холодильником і Необхідну сполуку одержують у вигляді білої потім гідролізують 10%-вим розчином хлориду твердої речовини гідруванням 0,70г (1,4ммоль) 6амонію. Після відділення органічної фази екстрабензилокси-8-{2-[2-(4-фтор-3-метилфеніл)-1,1гують діетиловим ефіром. Органічні фази об'єднудиметилетиламіно]-1-гідроксіетил}-4Нють, сушать і концентрують. Одержаний таким бензо[1,4]оксазин-3-ону. шляхом спирт розчиняють в 100мл толуолу, зміВихід: 0,50г (87%, гідрохлорид). шують із 1г моногідрату n-толуолсульфонової кисТемпература плавлення 278-280°С. лоти й протягом трьох годин нагрівають зі зворот+ Mac-спектроскопія: [М+Н] =389. ним холодильником на водовіддільнику. Далі (R)- та (S)-енантіомери одержаної в цьому реакційну суміш зливають у воду та підлуговують прикладі сполуки можна одержувати розділенням концентрованим розчином їдкого натру. Після відрацемату аналогічно до традиційних, відомих з ділення органічної фази її промивають водою, сурівня техніки методів. шать над сульфатом натрію та видаляють розчинПриклад 11: Гідрохлорид 8-{2-[2-(4-фтор-2ник. Залишок піддають фракційній перегонці, метил феніл)-1,1-диметилетиламіно]-1одержуючи продукт у вигляді безбарвної рідини гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3(температура кипіння 80-85°С при 10мбар). ону Вихід: 4,1г (50%). б) Ν-[2-(4-фтор-3-метилфеніл)-1,1диметилетил]формамід До 1,5г (31ммоль) ціаніду натрію в 5мл льодяної оцтової кислоти при 5-15°С по краплях додають 4,9мл концентрованою сірчаної кислоти. Потім суміш змішують з 3,9г (24ммоль) 1-фтор-2-метил4-(2-метилпропеніл)бензолу, розчиненого в 10мл льодяної оцтової кислоти, і перемішують протягом 1год при 50-60°С. Далі реакційну суміш розбавляа) 1-(4-фтор-2-метилфеніл)-2ють сумішшю води з льодом, підлуговують конценметилпропіловий ефір оцтової кислоти трованим розчином їдкого натру й екстрагують дихлорметаном. Органічну фазу сушать над су500мл 0,5-молярного розчину 4-фтор-6льфатом натрію та розчинники видаляють у вакуметилфенілмагнійброміду та 23,2мл (260ммоль) умі. Одержане таким шляхом світло-жовте масло ізопропілальдегіду піддають взаємодії між собою 29 87312 30 аналогічно прикладу 10а). Після гідролізу 10%-вим розчином хлориду амонію водну фазу відокремлюють і екстрагують діетиловим ефіром. Об'єднані органічні фази сушать над сульфатом натрію та концентрують. Одержаний таким шляхом спирт потім розчиняють в 50мл оцтового ангідриду, змішують із 1мл концентрованої сірчаної кислоти й перемішують протягом трьох годин при кип'ятінні зі а) 1-(2,4-дифторфеніл)-2-метилпропан-2-ол зворотним холодильником. Далі реакційну суміш До 500мл 0,25-молярного розчину 2,4зливають у воду, перемішують протягом наступної дифторбензилмагнійброміду в діетиловому ефірі години та підлуговують. Потім екстрагують дихлопротягом 20хв по краплях додають 11,0мл ацеторметаном, органічні фази сушать над сульфатом ну, розведеного 50мл діетилового ефіру. Після натрію й відганяють розчинники. Залишок піддацього перемішують протягом 1,5год при кип'ятінні ють фракційній перегонці, одержуючи продукт у зі зворотним холодильником і потім гідролізують вигляді безбарвної рідини (температура кипіння 10%-вим розчином хлориду амонію. Ефірну фазу 105-110°С при 8мбар). відокремлюють, промивають водою, сушать над Вихід 29,0г (52%). сульфатом натрію та концентрують. Залишок підб) N-[2-(4-фтор-2-метилфеніл)-1,1дають фракційній перегонці, одержуючи спирт у диметилетил]формамід вигляді безбарвної рідини (температура кипіння 29,0г (130ммоль) 1-(4-фтор-2-метилфеніл)-270-73°С при 2мбар). метилпропілового ефіру оцтової кислоти піддають Вихід: 20,0г (86%). хімічному перетворенню й переробці аналогічно б) N-[2-(2,4-дифторфеніл]-1,1прикладу 10б). Одержаний таким шляхом продукт диметилетил]формамід являє собою жовте масло. Зазначену в заголовку сполуку одержують Вихід: 27,0г (99%). описаним у прикладі 10б) методом за реакцією в) 2-(4-фтор-2-метилфеніл)-1,1Ріттера з використанням 20г (110ммоль) 1-(2,4диметилетиламін дифторфеніл)-2-метилпропан-2-олу. Одержаний Для одержання аміну 27,0г (130ммоль) N-[2-(4таким шляхом продукт являє собою жовте масло. фтор-2-метилфеніл)-1,1-диметилетил]формаміду Вихід: 22,0г (94%). піддають хімічному перетворенню аналогічно прив) 2-(2,4-дифторфеніл)-1,1-диметилетиламін кладу 10в). Одержаний таким шляхом продукт Зазначену в заголовку сполуку одержують пеявляє собою білу тверду речовину. ретворенням 22,0г (100ммоль) N-[2-(2,4Вихід: 15,5г (55%, гідрохлорид). дифторфеніл]-1,1-диметилетил]формаміду аналоТемпература плавлення 277-280°С. гічно прикладу 10в). г) 6-бензилокси-8-{2-[2-[4-фтор-2-метилфеніл)Вихід: 16,0г (72%, гідрохлорид). 1,1-диметилетиламіно]-1-гідроксіетил)-4НТемпература плавлення 201-203°С. бензо[1,4]оксазин-3-он г) 6-бензилокси-8-{2-[2-(2,4-дифторфеніл)-1,1Зазначену в заголовку сполуку одержують диметилетиламіно]-1-гідроксіетил}-4Наналогічно прикладу 8г) з 0,95г (2,66ммоль) бенбензо[1,4]оксазин-3-он зилокси-8-(2-етокси-2-гідроксіацетил)-4НЗазначену в заголовку сполуку одержують бензо[1,4]оксазин-3-ону та 0,43г (2,37ммоль) 2-(4аналогічно прикладу 8г) взаємодією 0,89г фтор-2-метилфеніл)-1,1-диметилетиламіну. бензилокси-8-(2-етокси-2(2,49ммоль) Вихід: 0,75г (55%, гідрохлорид). гідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та Температура плавлення 233-236°С. 0,40г (2,16ммоль) 2-(2,4-дифторфеніл)-1,1д) Гідрохлорид 8-{2-[2-(4-фтор-2-метилфеніл)диметилетиламіну. 1,1-диметилетиламіно]-1-гідроксіетил}-6-гідроксиВихід: 0,80г (62%, гідрохлорид). 4Н-бензо[1,4]оксазин-3-ону Температура плавлення 245-247°С. Необхідну сполуку одержують у вигляді білої д) Гідрохлорид 8-{2-[2-(2,4-дифторфеніл)-1,1твердої речовини дебензилуванням 0,70г диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Н(1,36ммоль) 6-бензилокси-8-{2-[2-[4-фтор-2бензо[1,4]оксазин-3-ону метилфеніл)-1,1-диметилетиламіно]-1Необхідну сполуку одержують у вигляді білої гідроксіетил}-4Н-бензо[1,4]оксазин-3-ону. твердої речовини гідрогенолізом 0,70г (1,35ммоль) Вихід: 0,50г (87%, гідрохлорид). 6-бензилокси-8-{2-[2-(2,4-дифторфеніл)-1,1Температура плавлення 278-280°С. + диметилетиламіно]-1-гідроксіетил}-4НМас-спектроскопія: [М+Н] =389. бензо[1,4]оксазин-3-ону. (R)- та (S)-енантіомери одержаної в цьому Вихід: 0,48г (83%, гідрохлорид). прикладі сполуки можна одержувати розділенням Температура плавлення 279-280°С. рацемату аналогічно до традиційних, відомих з + Mac-спектроскопія: [М+Н] =393. рівня техніки методів. (R)- та (S)-енантюмери одержаної в цьому Приклад 12: Гідрохлорид 8-{2-[2-(2,4прикладі сполуки можна одержувати розділенням дифторфеніл)-1,1-диметилетиламіно]-1рацемату аналогічно до традиційних, відомих з гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3рівня техніки методів. ону Приклад 13: Гідрохлорид 8-{2-[2-(3,5дифторфеніл)-1,1-диметилетиламіно]-1 31 гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3ону а) 1-(3,5-дифторфеніл)-2-метилпропан-2-ол Необхідну сполуку одержують взаємодією сполуки Гриньяра, одержаної з 25,0г (121ммоль) 3,5-дифторбензилброміду, з 12,6мл (171ммоль) ацетону. Одержаний таким шляхом продукт являє собою жовте масло. Вихід: 13,5г (60%). б) 2-(3,5-дифторфеніл)-1,1-диметилетиламін За реакцією Ріттера взаємодією 5,5г (29,5ммоль) 1-(3,5-дифторфеніл)-2-метилпропан2-олу та 1,8г ціаніду натрію одержують 7,0г формаміду, який для відщеплення формільної групи обробляють соляною кислотою. Одержаний таким шляхом продукт являє собою світло-жовте масло. Вихід: 4,6г (75%). в) 6-бензилокси-8-{2-[2-(3,5-дифторфеніл)-1,1диметилетиламіно]-1-гідроксіетил}-4Нбензо[1,4]оксазин-3-он Зазначену в заголовку сполуку одержують звичайним шляхом з 1,73г (4,84ммоль) бензилокси-8-(2-етокси-2-гідроксіацетил)-4Нбензо[1,4]оксазин-3-ону та 0,80г (4,32ммоль) 2(3,5-дифторфеніл)-1,1-диметилетиламіну. Вихід: 1,50г (58%, гідрохлорид). Температура плавлення 240-244°С. г) Гідрохлорид 8-{2-[2-(3,5-дифторфеніл)-1,1диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Нбензо[1,4]оксазин-3-ону Необхідну сполуку одержують у вигляді білої твердої речовини гідрогенолізом 1,30г (2,43ммоль) 6-бензилокси-8-{2-[2-(3,5-дифторфеніл)-1,1диметилетиламіно]-1-гідроксіетил}-4Нбензо[1,4]оксазин-3-ону. Вихід: 0,90г (86%, гідрохлорид). Температура плавлення 150-158°С. + Mac-спектроскопія: [М+Н] =393. (R)- та (S)-енантіомери одержаної в цьому прикладі спол>ки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 14: Гідрохлорид 8-{2-[2-(4етоксифеніл)-1,1-диметилетиламіно]-1гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3ону а) Бензиловий ефір [2-(4-етоксифеніл)-1,1диметилетил]карбамінової кислоти 87312 32 15,0г (50ммоль) бензилового ефіру [2-(4гідроксифеніл)-1,1-диметилетил]карбамінової кислоти протягом 10год перемішують при 90-100°С з 7,5мл (92ммоль) етилйодиду та 21г (150ммоль) карбонату калію. Далі реакційну суміш змішують із етилацетатом, двічі промивають водою та сушать над сульфатом натрію. Після відгону розчинників залишається жовте масло (15,0г, 92%), яке безпосередньо використовують у наступній реакції. б) 2-(4-етоксифеніл)-1,1-диметилетиламін Розчин 15,0г (49ммоль) бензилового ефіру [2(4-етоксифеніл)-1,1-диметилетил]карбамінової кислоти змішують в 100мл льодяної оцтової кислоти з 2г паладію на вугіллі (10%-вому) і потім гідрують при тиску 5бар і температурі 40-50°С. Після цього каталізатор відфільтровують і з фільтрату видаляють розчинник. Залишок розчиняють у невеликій кількості води, підлуговують концентрованим розчином їдкого натру й екстрагують етилацетатом. Органічну фазу промивають водою, сушать над сульфатом натрію й концентрують. Сирий продукт розчиняють в ацетонітрилі та підкисляють розчином соляної кислоти в діетиловому ефірі. Тверду речовину, яка випала в осад після додавання діетилового ефіру відокремлюють вакуумфільтрацією та сушать. Вихід: 8,8г (гідрохлорид, 84%). Температура плавлення 198-200°С. в) 6-бензилокси-8-{2-[2-(4-етоксифеніл)-1,1диметилетиламіно]-1-гідроксіетил}-4Нбензо[1,4]оксазин-3-он 2,14г (6,0ммоль) 6-бензилокси-8-(2-етокси-2гідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та 1,0г (5,2ммоль) 2-(4-етоксифеніл)-1,1диметилетиламіну протягом години перемішують при 50-80°С в 40мл етанолу. Після охолодження температури додають 0,23г до кімнатної (6,0ммоль) боргідриду натрію та перемішують ще протягом години. Далі реакційну суміш змішують із 5 мл ацетону, перемішують протягом 30хв, підкисляють льодяною оцтовою кислотою й концентрують. Залишок змішують із водою й етилацетатом та підлуговують. Органічну фазу відокремлюють, промивають водою, сушать над сульфатом натрію й у вакуумі видаляють розчинник. Залишок знову розчиняють в етилацетаті та воді, змішують із концентрованою соляною кислотою й розбавляють діетиловим ефіром. Тверду речовину, яка випала в осад, відокремлюють вакуум-фільтрацією та промивають діетиловим ефіром. Одержаний таким шляхом продукт являє собою білу тверду речовину. Вихід: 2,0г (61%, гідрохлорид). Температура плавлення 214-216°С. г) Гідрохлорид 8-{2-[2-(4-етоксифеніл)-1,1диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Нбензо[1,4]оксазин-3-ону 1,5г (2,8ммоль) 6-бензилокси-8-{2-[2-(4етоксифеніл)-1,1-диметилетиламіно]-1гідроксіетил}-4Н-бензо[1,4]оксазин-3-ону в 80мл метанолу гідрують при кімнатній температурі та нормальному тиску з 250мг паладію на вугіллі (10%-вому) як каталізатор. Потім каталізатор відокремлюють вакуум-фільтрацією й фільтрат концентрують. Залишок розчиняють в 5мл етанолу шляхом нагрівання, вводять затравку і розбавляють 33 87312 34 етилацетатом. Тверду речовину, яка випала в рацемату аналогічно до традиційних, відомих з осад, відфільтровують і промивають. Одержаний рівня техніки методів. таким шляхом продукт являє собою білу тверду Приклад 16: Кислотно-адитивна сіль 4-(4-{2-[2речовину. гідрокси-2-(6-гідрокси-3-оксо-3,4-дигідро-2НВихід 1,0г (83%, гідрохлорид). бензо[1,4]оксазин-8-іл)етиламіно]-2Температура плавлення 232-235°С. метилпропіл}фенокси)масляної кислоти Mac-спектрометрія: [М+Н]+=401. (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 15: Гідрохлорид 8-{2-[2-(3,5диметилфеніл)-1,1-диметилетиламіно]-1гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3ону а) Етиловий ефір 4-[4-(2-аміно-2метилпропіл)фенокси]масляної кислоти 4,5г (15,0ммоль) бензилового ефіру [2-(4гідроксифеніл)-1,1-диметилетил]карбамінової кислоти, 2,3мл (16,0ммоль) етилового ефіру 4броммасляної кислоти, 2,3г (16,6ммоль) карбонату калію та 0,3г (1,8ммоль) йодиду калію в 20мл диметилформаміду нагрівають до 120°С і витримують при цій температурі протягом 13год. Далі реакційну суміш розбавляють етилацетатом і послідовно промивають водою, розчином гідроа) 1-(3,5-диметилфеніл)-2-метилпропанол-2-ол ксиду натрію й водою. Органічну фазу сушать над Зазначену в заголовку сполуку одержують сульфатом натрію й концентрують. Залишок очивзаємодією (3,5-диметилфеніл)етилацетату з мещають шляхом хроматографії (елюент: циклогектилмагнійбромідом. сан/етилацетат у співвідношенні 9:1). Таким шляб) 2-(3,5-диметилфеніл)-1,1-диметилетиламін хом виділяють 5,0г жовтого масла, яке розчиняють За реакцією Ріттера взаємодією 6,00г в 50мл оцтової кислоти та гідрують при темпера(34ммоль) 1-(3,5-диметилфеніл)-2турі 40°С і тиску 3бар в присутності 1,0г паладію метилпропанол-2-олу та 2,00г (41ммоль) ціаніду на вугіллі як каталізатор. Після цього каталізатор натрію одержують 2,40г 2-(3,5-диметилфеніл)-1,1відфільтровують і з фільтрату видаляють розчиндиметилетилформаміду (вихід 35%). Для вивільник. Залишок розчиняють у діетиловому ефірі й нення аміну формамід (2,40г, 11,7ммоль) обробзмішують з розчином соляної кислоти в діетилоляють соляною кислотою. Наступну переробку вому ефірі. Тверду речовину, яка випала в осад, проводять аналогічно прикладу 10в). Одержаний відокремлюють вакуум-фільтрацією та сушать. таким шляхом продукт являє собою масло. Вихід: 2,9г (66% за двома стадіями, гідрохлоВихід: 1,70г (82%). + рид). Mac-спектроскопія: [M+H] =178. Температура плавлення 103-105°С. в) 6-бензилокси-8-{2-[2-(3,5-диметилфеніл)б) Етиловий ефір 4-(4-{2-[2-(6-бензилокси-31,1-диметилетиламіно]-1-гідроксіетил}-4Ноксо-3,4-дигідро-2Н-бензо[1,4]оксазин-8-іл)-2бензо[1,4]оксазин-3-он гідроксіетиламіно]-2Зазначену в заголовку сполуку одержують метилпропіл}фенокси)масляної кислоти аналогічно прикладу 8г) з 1,47г (4,1ммоль) бензи1,20г (3,36ммоль) бензилокси-8-(2-етокси-2локси-8-(2-етокси-2-гідроксіацетил)-4Нгідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону піддабензо[1,4]оксазин-3-ону та 0,65г (3,7ммоль) 2-(3,5ють взаємодії з 0,90г (3,22ммоль) етилового ефіру диметилфеніл)-1,1-диметилетиламіну. 4-[4-(2-аміно-2-метилпропіл)фенокси]масляної Вихід: 1,1г (51%, гідрохлорид). кислоти аналогічно прикладу 8г). Сирий продукт Температура плавлення 220-222°С. розчиняють в 10мл етилацетату й 10мл води та г) Гідрохлорид 8-{2-[2-(3,5-диметилфеніл)-1,1при перемішуванні змішують із щавлевою кислодиметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Нтою. Розчин розбавляють діетиловим ефіром, твебензо[1,4]оксазин-3-ону рду речовину, яка випала в осад відокремлюють Необхідну сполуку одержують гідрогенолізом вакуум-фільтрацією та промивають діетиловим 0,90г (1,71ммоль) 6-бензилокси-8-{2-[2-(3,5ефіром. диметилфеніл)-1,1-диметилетиламіно]-1Вихід: 1,20г (54%, оксалат). гідроксіетил}-4Н-бензо[1,4]оксазин-3-ону й переТемпература плавлення 223-227°С. кристалізацією сирого продукту з ізопропанолу. в) 4-(4-{2-[2-(6-бензилокси-3-оксо-3,4-дигідроОдержаний таким шляхом продукт являє собою 2Н-бензо[1,4]оксазин-8-іл)-2-гідроксіетиламіно]-2білу тверду речовину. метилпропіл}фенокси)масляна кислота Вихід: 0,50г (69%, гідрохлорид). Розчин 1,00г (1,73ммоль) етилового ефіру 4Температура плавлення 235-238°С. + (4-{2-[2-(6-бензилокси-3-оксо-3,4-дигідро-2НMac-спектроскопія: [М+Н] =385. бензо[1,4]оксазин-8-іл)-2-гідроксіетиламіно]-2(R)- та (S)-енантіомери одержаної в цьому метилпропіл}фенокси)масляної кислоти в 25мл прикладі сполуки можна одержувати розділенням метанолу змішують із 2,5мл 1н. розчину гідроксиду 35 87312 36 натрію, протягом 30хв кип'ятять зі зворотним хо4,00г (18,5ммоль) N-[2-(3,4-дифторфеніл)-1,1лодильником і потім нейтралізують 1н. соляною диметилетил]формаміду розчиняють в етанолі, кислотою. Розчин концентрують і масло, яке зазмішують із концентрованою соляною кислотою та лишилося, розчиняють шляхом нагрівання в 5мл залишають на ніч кип'ятитися зі зворотним холон-бутанолу. Після додавання речовини, яка сприяє дильником. Потім реакційний розчин зливають у кристалізації, в осад випадає тверда речовина, яку суміш води з льодом, підлуговують гідроксидом відокремлюють вакуум-фільтрацією та промиванатрію й екстрагують тpет-бутилметиловим ефіють ацетоном і діетиловим ефіром. ром. Органічні фази промивають водою, сушать Вихід: 0,75г (79%). над сульфатом натрію й концентрують. ОдержаТемпература плавлення 216-218°С. ний таким шляхом продукт являє собою жовте г) 4-(4-{2-[2-гідрокси-2-(6-гідрокси-3-оксо-3,4масло. дигідро-2Н-бензо[1,4]оксазин-8-іл)етиламіно]-2Вихід: 3,2г (92%). + метилпропіл}фенокси)масляна кислота Mac-спектрометрія: [М+Н] =186. г) 8-{2-[2-(3,4-дифторфеніл)-1,10,70г (1,28ммоль) 4-(4-{2-[2-(6-бензилокси-3диметилетиламіно[-1-гідроксіетил}-6-гідрокси-4Ноксо-3,4-дигідро-2Н-бензо[1,4]оксазин-8-іл)-2бензо[1,4]оксазин-3-он гідроксіетиламіно]-2357мг (1ммоль) 6-бензилокси-8-(2-етокси-2метилпропіл}фенокси)масляної кислоти розчинягідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та ють в 25мл метанолу та 2мл оцтової кислоти й 185мг (1ммоль) 2-(3,4-дифторфеніл)-1,1гідрують при кімнатній температурі й нормальному диметилетиламіну протягом 30хв перемішують в тиску в присутності 150мг паладію на вугіллі (10%5мл тетрагідрофурану при кімнатній температурі. вому). Після цього каталізатор відфільтровують і з Після цього суміш охолоджують до 0°С і в атмосфільтрату видаляють розчинник. Продукт одержуфері аргону по краплях додають 1,5мл 2ють шляхом кристалізації із суміші метанолу з молярного розчину боргідриду літію в тетрагідроацетоном. фурані. Потім суміш протягом 30хв перемішують Вихід: 0,40г (68%). при кімнатній температурі, змішують із 10мл дихТемпература плавлення 201-204°С. + лорметану та 3мл води, перемішую і ь протягом Mac-спектроскопія: [М+Н] =459. Одержаний продукт можна його взаємодією з наступної години й після цього фільтрують через відповідною кислотою НХ перевести в необхідну Extrelut®. З елюату, який містить етаноламін, викислотно-адитивну сіль. даляють розчинник. Залишок розчиняють у мета(R)- та (S)-енантюмери одержаної в цьому нолі та гідрують при тиску 2,5бар та кімнатній темприкладі сполуки можна одержувати розділенням пературі в присутності паладію на вугіллі (10%рацемату аналогічно до традиційних, відомих з вому) як каталізатор. Після цього каталізатор відорівня техніки методів. кремлюють і сирий продукт очищають хроматогПриклад 17: Трифторацетат 8-{2-[2-(3,4рафією (ацетонітрил/вода/0,1% трифтороцтової дифторфеніл)-1,1-диметилетиламіно]-1кислоти). Одержаний таким шляхом продукт являє гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3собою білу тверду речовину. ону Вихід: 31мг (6%, трифторацетат). + Mac-спектроскопія: [М+Н] =393. (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Приклад 18: Трифторацетат 8-{2-[2-(2-хлор-4фторфеніл)-1,1-диметилетиламіно]-1гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3ону а) 1-(3,4-дифторфеніл)-2-метилпропан-2-ол З 23,0г (111ммоль) 3,4-дифторбензилброміду одержують реактив Гриньяра, який потім піддають взаємодії з 11,6мл (158ммоль) ацетону. Одержаний таким шляхом продукт являє собою світложовте масло. Вихід: 9,7г (47%). Значення Rf: 0,55 (етилацетат/петролейний ефір у співвідношенні 1:3). б) N-[2-(3,4-дифторфеніл)-1,1а) 1-(2-хлор-4-фторфеніл)-2-метилпропан-2-ол диметилетил]формамід Зазначену в заголовку сполуку одержують Необхідну сполуку одержують за реакцією Рітаналогічно прикладу 8а) з 20г (97ммоль) метилтера з використанням 4,0г (21,5ммоль) 1-(3,4ового ефіру (2-хлор-4-фторфеніл)оцтової кислоти дифторфеніл)-2-метилпропан-2-олу. Одержаний та 98мл 3-молярного розчину метилмагнійброміду. таким шляхом продукт являє собою світло-жовте б) N-[2-(2-хлор-4-фторфеніл)-1,1масло. диметилетил]формамід Вихід: 4,0г (87%). 7,5г (37ммоль) 1-(2-хлор-4-фторфеніл)-2+ Mac-спектрометрія: [М+Н] =214. метилпропан-2-олу піддають хімічному перетвов) 2-(3,4-дифторфеніл)-1,1-диметилетиламін ренню та переробці аналогічно прикладу 10б). 37 87312 38 Одержане таким шляхом масло для наступного сан/етилацетаі/метанол), одержуючи 305мг етаноочищення хроматографують на короткій силікагеламіну. Його розчиняють в 3мл дихлорметану та в левій колонці (петролейний ефір/етилацетат у атмосфері аргону охолоджують до -78°С. Далі по співвідношенні 9:1). Одержаний таким шляхом краплях додають 3мл 1-молярного розчину трипродукт являє собою масло. броміду бору в дихлорметані та перемішують проВихід 7,4г (87%). тягом години при -78°С, а потім протягом 20хв при Mac-спектрометрія: [М+Н]+=230/232. кімнатній температурі. Потім при -78°С по краплях в) 2-(2-хлор-4-фторфеніл)-1,1додають 3мл концентрованого розчину аміаку та диметилетиламін перемішують протягом 5хв. Далі реакційну суміш Зазначену в заголовку сполуку одержують змішують із розчином хлориду амонію й екстрагуаналогічно прикладу 17в) перетворенням 7,4г ють етилацетатом. Об'єднані органічні фази кон(32ммоль) N-[2-(2-хлор-4-фторфеніл)-1,1центрують і залишок для наступного очищення диметилетил]формаміду. Одержаний таким шляхроматографують (силікагель; елюент: дихлормехом продукт являє собою коричневе масло. тан/метанол+1% аміаку). Таким шляхом одержуВихід: 5,14г (79%). ють 93мг (26%) твердої речовини бежевого кольоMac-спектрометрія: [M+H]+=202/204. ру. + г) 8-{2-[2-(2-хлор-4-фторфеніл)-1,1Mac-спектрометрія: [М+Н] =391. Одержаний продукт можна його взаємодією з диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Нвідповідною кислотою НХ перевести в необхідну бензо[1,4]оксазин-3-он кислотно-адитивну сіль. 357мг (1ммоль) 6-бензилокси-8-(2-етокси-2(R)- та (S)-енантіомери одержаної в цьому гідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та прикладі сполуки можна одержувати розділенням 202мг (1ммоль) 2-(2-хлор-4-фторфеніл)-1,1рацемату аналогічно до традиційних, відомих з диметилетиламіну піддають взаємодії аналогічно рівня техніки методів. прикладу 10г) з боргідридом літію. Для дебензилуПриклад 20: Кислотно-адитивна сіль 8-{2-[2-(4вання одержаного таким шляхом етаноламіну його бромфеніл)-1,1-диметилетиламіно]-1розчиняють в 3мл дихлорметану й охолоджують гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3до -78°С. При цій температурі по краплях додають 2мл 1-молярного розчину триброміду бору в дихону лорметані та суміші дають повільно нагрітися до кімнатної температури. Далі реакційну суміш змішують з 10мл дихлорметану й 3мл води та фільтрують через Extrelut®. З елюату видаляють розчинник і залишок очищають хроматографією (ацетонітрил/вода/0,1% трифтороцтової кислоти). Одержаний таким шляхом продукт являє собою білу тверду речовину. Вихід: 70мг (13%, трифторацетат). + З 300мг (0,91ммоль) 6-бензилокси-8-(2,2Mac-спектроскопія: [М+Н] =409/11. дигідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та (R)- та (S)-енантіомери одержаної в цьому 250мг (1,09ммоль) 2-(4-бромфеніл)-1,1прикладі сполуки можна одержувати розділенням диметилетиламіну аналогічно прикладу 19 одеррацемату аналогічно до традиційних, відомих з жують етаноламін, який дебензилують. Одержарівня техніки методів. ний таким шляхом продукт являє собою тверду Приклад 19: Кислотно-адитивна сіль 8-{2-[2-(4речовину бежевого кольору. хлорфеніл)-1,1-диметилетиламіно]-1-гідроксіетил}Вихід: 54мг (14%). 6-гідрокси-4Н-бензо[1,4]оксазин-3-ону + Mac-спектрометрія: [M+H] =435, 437. Одержаний продукт можна його взаємодією з відповідною кислотою НХ перевести в необхідну кислотно-адитивну сіль. (R)- та (S)-енантіомери одержаної в цьому прикладі сполуки можна одержувати розділенням рацемату аналогічно до традиційних, відомих з рівня техніки методів. Аналогічно до описаних вище прикладів синтезу можна також одержати наступні пропоновані Розчин 300мг (0,91ммоль) 6-бензилокси-8-(2,2у винаході сполуки формули 1: дигідроксіацетил)-4Н-бензо[1,4]оксазин-3-ону та приклад 21: кислотно-адитивна сіль 8-{2-[2-(3200мг (1,09ммоль) 2-(4-хлорфеніл)-1,1метилфеніл)-1,1-диметилетиламіно]-1диметилетиламіну в 3мл етанолу змішують з могідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3лекулярним ситом і перемішують протягом 90хв ону, при 80°С. Після цього суміші дають остудитися до приклад 22: кислотно-адитивна сіль 8-{2-[2-(4кімнатної температури, додають 35мг (0,91ммоль) фтор-3-метоксифеніл)-1,1-диметилетиламіно]-1боргідриду натрію та перемішують протягом 1год. гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3Потім реакційну суміш змішують із розчином гідроону, карбонату натрію й екстрагують етилацетатом. З приклад 23: кислотно-адитивна сіль 8-{2-[2-(4об'єднаних органічних фаз видаляють розчинник і фтор-2,6-диметилфеніл)-1,1-диметилетиламіно]-1залишок хроматографують (елюент: гек 39 87312 40 гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазпн-3приклад 30: кислотно-адитивна сіль 8-{2-[2-(4ону. фтор-3,5-диметилфеніл)-1,1-диметилетиламіно]-1приклад 24: кислотно-адитивна сіль 8-{2-[2-(4гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3хлор-2-метилфеніл)-1,1-диметилетиламіно]-1ону, гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3приклад 31: кислотно-адитивна сіль 8-{2-[2ону, (3,5-дихлорфеніл)-1,1-диметилетиламіно]-1приклад 25: кислотно-адитивна сіль 8-{2-[2-(4гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3хлор-3-фторфеніл)-1,1-диметилетиламіно]-1ону, гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3приклад 32: кислотно-адитивна сіль 8-{2-[2-(4ону, хлор-3-метилфеніл)-1,1-диметилетиламіно]-1приклад 26: кислотно-адитивна сіль 8-{2-[2-(4гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3хлор-2-фторфеніл)-1,1-диметилетиламіно]-1ону, гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3приклад 33: кислотно-адитивна сіль 8-{2-[2ону, (3,4,5-трифторфеніл)-1,1-диметилетиламіно]-1приклад 27: кислотно-адитивна сіль 8-{2-[2-(3гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазлн-3хлор-4-фторфеніл)-1,1-диметилетиламіно]-1ону, приклад 34: кислотно-адитивна сіль 8-{2-[2гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3(3,4-дихлорфеніл)-1,1-диметилетиламіно]-1ону, гідроксіетил}-6-гідрокси-4Н-бензо[1,4]оксазин-3приклад 28: кислотно-адитивна сіль 8-{2-[2ону. (2,6-дифтор-4-метоксифеніл)-1,1диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4НII. Приклади композицій (лікарських форм) А) У наведеній нижче таблиці представлені бензо[1,4]оксазин-3-ону, приклади пропонованих у винаході композицій з Rприклад 29: кислотно-адитивна сіль 8-{2-[2енантіомером сполуки із прикладу 1. У цій таблиці (2,5-дифтор-4-метоксифеніл)-1,1вміст компонентів зазначений у перерахунку на диметилетиламіно]-1-гідроксіетил}-6-гідрокси-4Н100мл лікарської композиції в очищеній воді, відбензо[1,4]оксазин-3-ону, повідно воді для ін'єкцій. Приклад 1 2 3 4 5 6 7 8 9 10 11 Сполука формули 1 (1'-CH3SO3H) Дигідрат динатрійеде- Лимонна кисБензалконійхлорид (мг) (мг) тату (мг) лота (мг) 10 10 3 1,0 15 5 100 5 10 5 3 1,0 10 3 0,5 5 7 2 1000 5 15 4 90 5 12 3 10 5 10 4 2,7 10 10 3 0,5 15 10 2 Б) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з R-енантіомером сполуки із прикладу 3. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції в очищеній воді, відповідно воді для ін'єкцій. Приклад Сполука формули 1 (1'-НСI) (мг) Бензалконійхлорид (мг) 1 2 3 4 5 6 7 8 9 10 11 10 1,0 100 10 1,0 0,5 1000 90 23 2,7 0,5 10 15 5 5 10 10 10 15 В) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з R-енантіомером сполуки із прикладу 7. У цій таб Дигідрат динатрійеде- Лимонна кистату (мг) лота (мг) 3 5 5 5 3 10 3 7 2 15 4 10 3 10 3 10 3 10 2 лиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції в очищеній воді, відповідно воді для ін'єкцій. 41 87312 Приклад Сполука формули 1 (1'-HCl) (мг) 1 2 3 4 5 6 7 8 9 10 11 10 1,0 100 10 1,0 0,5 1000 100 10 2,5 0,5 42 Дигідрат динатрійеде- Лимонна кисБензалконійхлорид (мг) тату (мг) лота(мг) 10 3 15 5 5 5 3 10 3 5 7 2 5 15 4 5 12 3 5 10 4 10 10 3 15 10 2 Г) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з R-енантіомером сполуки із прикладу 9. У цій таб лиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції в очищеній воді, відповідно воді для ін'єкцій. Приклад Сполука формули 1 (1'-НСl) (мг) Бензалконійхлорид (мг) 1 2 3 4 5 6 7 8 9 10 11 10 1,0 100 10 1,0 0,5 1000 100 10 2,5 0,5 10 15 5 5 5 5 10 15 Д) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з R-енантіомером сполуки із прикладу 14. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції в очищеній воді, відповідно воді для ін'єкцій. Приклад Сполука формули 1 (1'-НСl) (мг) Бензалконійхлорид (мг) 1 2 3 4 5 6 7 8 9 10 11 10 1,0 100 10 1,0 0,5 1000 100 10 2,5 0,5 10 15 5 5 5 5 10 15 Ε) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з R-енантіомером сполуки із прикладу 17. У цій Приклад 1 1 2 3 4 5 6 Дигідрат динатрійеде- Лимонна кистату (мг) лота (мг) 3 5 5 5 10 3 7 2 15 4 12 3 10 4 10 3 10 2 Дигідрат динатрійеде- Лимонна кистату (мг) лота (мг) 3 5 5 5 3 10 з 7 2 15 4 12 3 10 4 10 3 10 2 таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції в очищеній воді, відповідно воді для ін'єкцій. Сполука формули 1 (1'-CF3COOH) Дигідрат динатрійеде- Лимонна кисБензалконійхлорид (мг) (мг) тату (мг) лота (мг) 2 3 4 5 10 10 3 1,0 15 5 100 5 10 5 3 1,0 10 3 0,5 5 7 2 43 87312 44 Продовження таблиці 1 7 8 9 10 11 2 1000 100 10 2,5 0,5 3 5 5 5 10 15 4 15 12 10 10 10 5 4 3 4 3 2 Є) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з Rенантіомером сполуки із прикладу 3. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції. Приклад Сполука формули 1 Бензалконійхлорид 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 10 1,0 100 10 1,0 0,5 1000 100 10 2,5 0,5 10 10 10 10 5 5 5 Дигідрат динатрійедетату 10 10 10 20 10 10 5 Лимонна кислота 3 3 3 5 2 3 2 4 3 4 3 3 3 3 На 100мл у суміші 20/80 50/50 70/30 70/30 70/30 90/10 90/10 90/10 90/10 95/5 95/5 95/5 100/0 100/0 Ж) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з Rенантіомером сполуки із прикладу 1. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції. Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Сполука формули 1 Бензалконійхлорид Дигідрат динатрійе- Лимонна кис- На 100мл у суміші (1'-CH3SO3H) (мг) (мг) детату (мг) лота (мг) етанол/вода (мас.%) 10 10 10 3 20/80 10 10 10 3 50/50 1,0 5 3 70/30 100 10 5 70/30 10 20 2 70/30 1,0 10 3 90/10 0,5 10 2 90/10 1000 4 90/10 100 3 90/10 10 4 95/5 2,5 3 95/5 0,5 5 3 95/5 10 5 3 100/0 10 5 3 100/0 З) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з Rенантіомером сполуки із прикладу 17. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції. 45 Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 87312 46 Сполука формули 1 Бензалконійхлорид Дигідрат динатрійе- Лимонна кис- На 100мл у суміші (1'-CF3COOH) (мг) (мг) детату (мг) лота (мг) етанол/вода (мас.%) 10 10 1,0 100 10 1,0 0,5 1000 100 10 2,5 0,5 10 10 10 10 5 5 5 10 10 10 20 10 10 5 3 3 3 5 2 3 2 4 3 4 3 3 3 3 20/80 50/50 70/30 70/30 70/30 90/10 90/10 90/10 90/10 95/5 95/5 95/5 100/0 100/0 И) У наведеній нижче таблиці представлені приклади пропонованих у винаході композицій з Rенантіомером сполуки із прикладу 13. У цій таблиці вміст компонентів зазначений у перерахунку на 100мл лікарської композиції. Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Сполука формули 1 Бензалконійхлорид Дигідрат динатрійе- Лимонна кис- На 100млу суміші (1'-НСl) (мг) (мг) детату (мг) лота (мг) етанол/вода (мас.%) 10 10 10 3 20/80 10 10 10 3 50/50 1,0 5 3 70/30 100 10 5 70/30 10 20 2 70/30 1,0 10 3 90/10 0,5 10 2 90/10 1000 4 90/10 100 3 90/10 10 4 95/5 2,5 3 95/5 0,5 5 3 95/5 10 5 3 100/0 10 5 3 100/0 Комп’ютерна верстка О. Гапоненко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for aerosol inhalation of b-agonists
Автори англійськоюAven Michael
Назва патенту російськоюКомпозиция для аэрозольной ингаляции b-агонистов
Автори російськоюЭйвен Майкл
МПК / Мітки
МПК: A61P 11/06, A61K 31/536
Мітки: b-агоністів, аерозольної, композиція, інгаляції
Код посилання
<a href="https://ua.patents.su/23-87312-kompoziciya-dlya-aerozolno-ingalyaci-b-agonistiv.html" target="_blank" rel="follow" title="База патентів України">Композиція для аерозольної інгаляції b-агоністів</a>
Попередній патент: Фітотерапевтичний засіб для лікування бронхолегеневих захворювань
Наступний патент: Застосування похідної конденсованого азепінону для регулювання росту рослин, композиція на її основі та спосіб регулювання росту рослин
Випадковий патент: Синтетично-елективне поживне середовище для виділення та вирощування сальмонел