Введення інгібітору ферменту, що активує nedd8, і гіпометилуючого засобу
Формула / Реферат
1. Спосіб лікування раку, що включає введення пацієнтові, який потребує такого лікування, терапевтично ефективної загальної кількості:
- інгібітору ΝΑΕ або його фармацевтично прийнятної солі і
- гіпометилуючого засобу або його фармацевтично прийнятної солі,
де гіпометилуючим засобом є азацитидин або децитабін або їх фармацевтично прийнятні солі, а інгібітором ΝΑΕ є ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іл)-7Н-піроло[2,3-d]-піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат [MLN4924] або {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамат [I-216] або їх фармацевтично прийнятні солі.
2. Спосіб за п. 1, який відрізняється тим, що гіпометилуючий засіб є азацитидином або його фармацевтично прийнятною сіллю.
3. Спосіб за п. 1, який відрізняється тим, що гіпометилуючий засіб є децитабіном або його фармацевтично прийнятно сіллю.
4. Спосіб за п. 1, який відрізняється тим, що інгібітор ΝΑΕ є ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфаматом або його фармацевтично прийнятною сіллю.
5. Спосіб за п. 1, який відрізняється тим, що інгібітор ΝΑΕ є {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфаматом або його фармацевтично прийнятною сіллю.
6. Спосіб за п. 4, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять на кожен з 1, 3 і 5 днів 28-денного циклу.
7. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 20 мг/м2.
8. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 25 мг/м2.
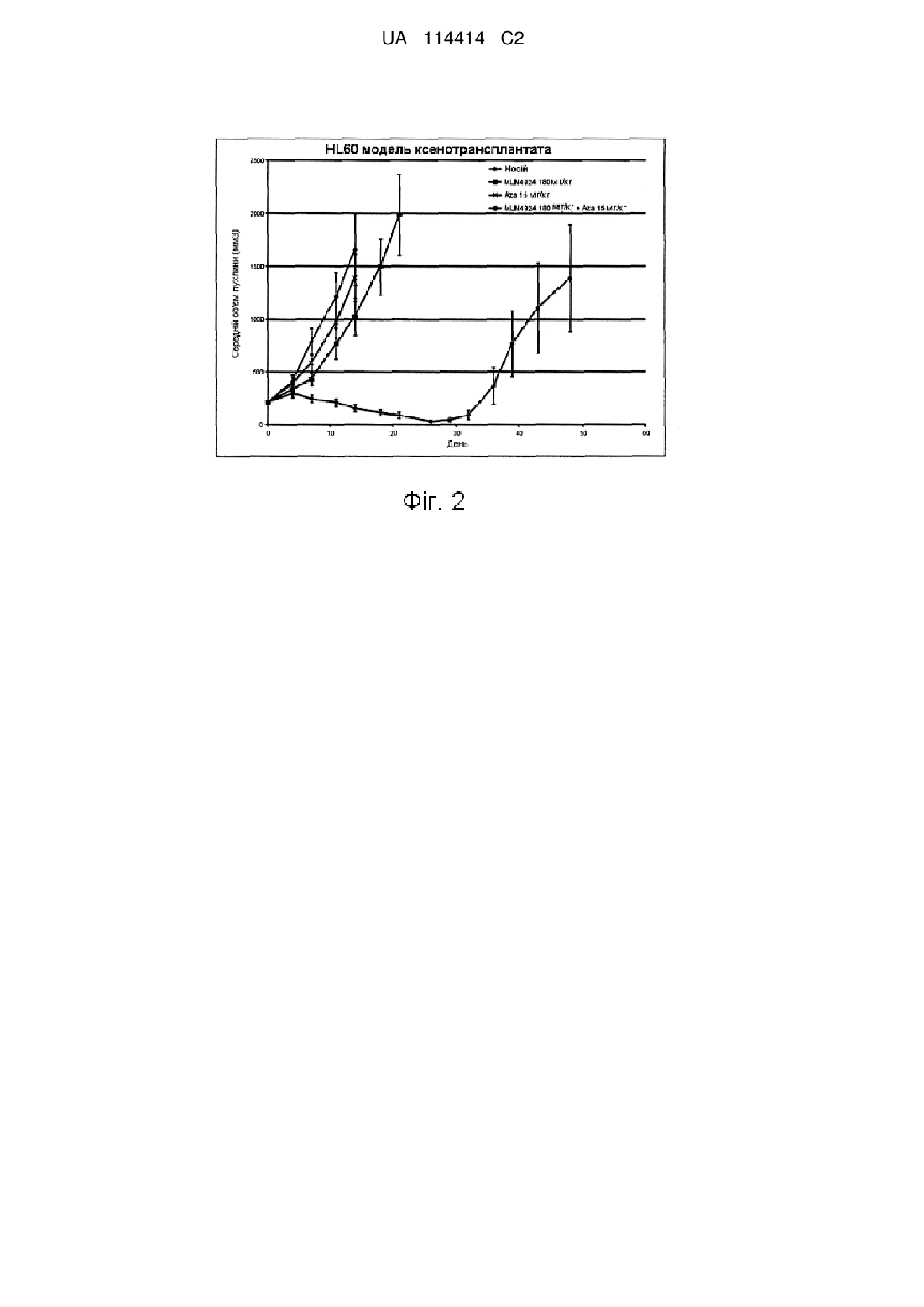
9. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 30 мг/м2.
10. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 40 мг/м2.
11. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 50 мг/м2.
12. Спосіб за п. 6, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять у дозі, що знаходиться в діапазоні від близько 20 мг/м2 до близько 30 мг/м2.
13. Спосіб за будь-яким з пп. 6-12, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять внутрішньовенно.
14. Спосіб за будь-яким з пп. 6-12, який відрізняється тим, що ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат або його фармацевтично прийнятну сіль вводять підшкірно.
15. Спосіб за будь-яким з пп. 1-2 і 4-14, який відрізняється тим, що гіпометилуючий засіб є азацитидином або його фармацевтично прийнятною сіллю і його вводять на кожен з 1, 2, 3, 4, 5, 8 і 9 днів 28-денного циклу.
16. Спосіб за п. 15, який відрізняється тим, що азацитидин або його фармацевтично прийнятну сіль вводять у дозі, що становить близько 75 мг/м2.
17. Спосіб за п. 15 або 16, який відрізняється тим, що азацитидин або його фармацевтично прийнятну сіль вводять підшкірно.
18. Спосіб за п. 15 або 16, який відрізняється тим, що азацитидин або його фармацевтично прийнятну сіль вводять внутрішньовенно.
19. Спосіб за будь-яким з пп. 1-18, який відрізняється тим, що інгібітор ΝΑΕ або його фармацевтично прийнятну сіль вводять у комбінації з гіпометилуючим засобом або його фармацевтично прийнятною сіллю у вигляді єдиної лікарської форми.
20. Спосіб за будь-яким з пп. 1-18, який відрізняється тим, що інгібітор ΝΑΕ або його фармацевтично прийнятну сіль вводять у комбінації з гіпометилуючим засобом або його фармацевтично прийнятною сіллю у вигляді окремих лікарських форм.
21. Спосіб за будь-яким з пп. 1-20, який відрізняється тим, що рак є гематологічним злоякісним захворюванням.
22. Спосіб за п. 21, який відрізняється тим, що рак є гострим мієлоїдним лейкозом (ГМЛ).
23. Спосіб за п. 21, який відрізняється тим, що рак є мієлодиспластичними синдромами (МДС).
24. Спосіб за п. 23, який відрізняється тим, що мієлодиспластичні синдроми (МДС) діагностують як будь-який з перерахованих: рефрактерна анемія (РА), рефрактерна анемія з кільцевими сидеробластами (РАКС), рефрактерна анемія з надлишком бластів (РАНБ) і РАНБ на стадії трансформації (РАНБ-Т).
25. Спосіб за п. 24, який відрізняється тим, що діагноз є переважно одним типом мієлодиспластичних синдромів.
26. Спосіб за п. 24, який відрізняється тим, що діагнозом є більше одного типу мієлодиспластичних синдромів.
27. Спосіб за п. 21, який відрізняється тим, що рак діагностований як будь-який з хронічного мієлоїдного лейкозу (ХМЛ), гострого лімфобластного лейкозу (ГЛЛ), хронічного лімфоцитарного лейкозу (ХЛЛ), хвороби Ходжкіна (XX), неходжкінської лімфоми (НХЛ), Т-клітинної лімфоми, множинної мієломи (MM), макроглобулінемії Вальденстрема, мієлодиспластичних синдромів (МДС) і мієлопроліферативних синдромів.
28. Спосіб за п. 27, який відрізняється тим, що діагнозом є переважно один тип раку.
29. Спосіб за п. 27, який відрізняється тим, що діагнозом є більше одного типу раку.
30. Набір для лікування раку у суб'єкта зі встановленою у цьому необхідністю, що містить:
- щонайменше один лікарський засіб, що містить щонайменше одну дозу інгібітору ΝΑΕ або його фармацевтично прийнятної солі, і
- щонайменше один лікарський засіб, що містить щонайменше одну дозу гіпометилуючого засобу або його фармацевтично прийнятної солі;
де гіпометилуючим засобом є азацитидин або децитабін або їх фармацевтично прийнятні солі, а інгібітором ΝΑΕ є ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іл)-7Н-піроло[2,3-d]-піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат [MLN4924] або {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамат [I-216] або їх фармацевтично прийнятні солі;
причому вказаний набір для лікування раку додатково містить інструкції по дозуванню лікарських засобів для введення при лікуванні суб'єкта зі встановленою в них необхідністю.
31. Застосування інгібітору ΝΑΕ або його фармацевтично прийнятної солі з гіпометилуючим засобом або його фармацевтично прийнятною сіллю для лікування раку у пацієнта, який потребує такого лікування,
де гіпометилуючим засобом є азацитидин або децитабін або їх фармацевтично прийнятні солі, а інгібітором ΝΑΕ є ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іл)-7Н-піроло[2,3-d]-піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат [MLN4924] або {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамат [I-216] або їх фармацевтично прийнятні солі.
32. Застосування інгібітору ΝΑΕ або його фармацевтично прийнятної солі у виробництві щонайменше одного лікарського засобу для лікування раку, яке відрізняється тим, що інгібітор ΝΑΕ або його фармацевтично прийнятну сіль вводять з гіпометилуючим засобом або його фармацевтично прийнятною сіллю пацієнтові, який потребує такого лікування, де гіпометилуючим засобом є азацитидин або децитабін або їх фармацевтично прийнятні солі, а інгібітором ΝΑΕ є ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іл)-7Н-піроло[2,3-d]-піримідин-7-іл)-2-гідроксициклопентил)метилсульфамат [MLN4924] або {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамат [I-216] або їх фармацевтично прийнятні солі.
Текст
Реферат: Винахід стосується способу лікування раку у пацієнтів зі встановленою необхідністю у такому лікуванні, що включає введення такому пацієнтові інгібітору ΝΑΕ або його фармацевтично прийнятної солі ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Н-інден-1-іламіно)-7Н-піроло[2,3d]піримідин-7-іл)-2-гідроксициклопентил)метилсульфамату (MLN4924) або {(1S,2S,4R)-4-[(6{1(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2гідроксициклопентил}метилсульфамату (I-216), і гіпометилуючого засобу або його фармацевтично прийнятної солі - азацитидин або децитабін. UA 114414 C2 (12) UA 114414 C2 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 60 [001] Ця заявка заявляє пріоритет за попередньою заявкою США номер 61/555049, поданою 3 листопада 2011 р. [002] Було продемонстровано, що інгібування ферменту, що активує NEDD8 (NAE) викликає смерть ракових клітин і інгібує зростання пухлин у моделях ксенотрансплантату. Див., наприклад, T.A. Soucy et al., Nature, 2009, 458, 732-737; T.A. Soucy et al., Clin. Cancer Res., 2009, 15 (12), 3912-3916; і J.E. Brownell et al., Mol. Cell., 2010, 37 (1), 102-111. Звіти Фази I клінічних досліджень інгібітору NAE включають R.T. Swords et al., Blood, 2010, 115, 3796-3800; J.S. Kauh et al., J. Clin. Oncol., 2011, 29, реферат 3013; і S. Bhatia et al., J. Clin. Oncol., 2011, 29, реферат 8529. Інгібітори NAE описані у заявках на патент США під номерами: 11/346469 (Публ. № 2006/0189636, Патент № 7951810), 11/700614 (Публ. № 2007/0191293) і 11/890338 (Публ. № 2008/0051404, Патент № 8008307), кожна з вищезгаданих публікацій включена у цей опис повністю шляхом посилання. Якщо між будь-яким з цих документів і цим описом є яка-небудь невідповідність, то цей опис є контрольним. [003] Гіпометилуючі засоби були схвалені для лікування раку Управлінням США по санітарному нагляду за якістю харчових продуктів і лікарських засобів (FDA). Наприклад, препарат VIDAZA® (азацитидин для ін'єкцій) показаний для лікування пацієнтів з наступними підтипами мієлодиспластичних синдромів згідно франко-американо-британської класифікації (ФАБ): рефрактерна анемія (РА) або рефрактерна анемія з кільцевими сидеробластами (якщо вони супроводжуються нейтропенією або тромбоцитопенією або вимагають проведення гемотрансфузій), рефрактерна анемія з надлишком бластів (РАНБ), рефрактерна анемія з надлишком бластів на стадії трансформації (РАНБ-T) і хронічний мієломоноцитарний лейкоз (ХММоЛ). Препарат DACOGEN® (децитабін для ін'єкцій) показаний для лікування пацієнтів з мієлодиспластичними синдромами (МДС), включаючи пролікованих і непролікованих раніше, de novo і вторинних МДС усіх підтипів згідно франко-американо-британської класифікації (рефрактерна анемія, рефрактерна анемія з кільцевими сидеробластами, рефрактерна анемія з надлишком бластів, рефрактерна анемія з надлишком бластів на стадії трансформації і хронічний мієломоноцитарний лейкоз) і груп проміжного-1, проміжного-2, і високого ризику згідно Міжнародної прогностичної бальної системи. [004] Як правило, для засобів для лікування раку встановлюють найвищу можливу дозу (МПД: максимальну переносиму дозу), тому що, як вважають, користь від лікування зростає з дозою. Див., наприклад, Y. Lin and W.J. Shih, Biostatistics, 2001, 2 (2), 203-215. Синергічна комбінація засобів - тобто комбінація засобів, яка є ефективнішою, ніж очікувана ефективність складових, також без компаундування побічних ефектів лікування - може забезпечити можливість доставляти навіть велику ефективність з МПД. Таким чином, може бути бажаним виявлення синергічних комбінацій протиракових засобів для найбільш ефективного лікування онкологічних хворих без перевантаження пацієнта побічними ефектами. [005] На даний час було виявлено, що введення інгібітору NAE або його фармацевтично прийнятної солі і гіпометилуючого засобу або його фармацевтично прийнятній солі забезпечує синергічний ефект. Синергічні ефекти були виявлені in vitro і in vivo. Синергію in vitro вимірювали за допомогою комбінаторного індексу (M.C. Berenbaum, J. Theor. Biol., 1985, 114, 413-431), як описано детальніше нижче. Синергію in vivo вимірювали згідно способу визначення синергії відносно виживаності або способу визначення синергії відносно зростання пухлини, як описано детальніше нижче. [006] Щонайменше, один з аспектів цього винаходу відноситься до способів лікування раку, що включають введення пацієнтові, який потребує такого лікування, терапевтично ефективної загальної кількості інгібітору NAE або його фармацевтично прийнятної солі і гіпометилуючого засобу або його фармацевтично прийнятної солі. [007] Щонайменше, один з аспектів цього винаходу також відноситься до застосування інгібітору NAE або його фармацевтично прийнятній солі з гіпометилуючим засобом або його фармацевтично прийнятною сіллю для лікування раку у пацієнта, який потребує такого лікування. [008] Щонайменше, один з аспектів цього винаходу відноситься до набору, що містить, щонайменше, один лікарський засіб для застосування у лікуванні раку у суб'єкта зі встановленою у ньому необхідністю. Наприклад, набір може містити, щонайменше, один лікарський засіб, що містить, щонайменше, одну дозу інгібітору NAE або його фармацевтично прийнятної солі і інструкції по введенню, щонайменше, одного лікарського засобу з гіпометилуючим засобом або його фармацевтично прийнятною сіллю; або набір може містити, щонайменше, один лікарський засіб, який містить, щонайменше, одну дозу гіпометилуючого засобу або його фармацевтично прийнятної солі і інструкції по введенню лікарського засобу з інгібітором NAE або його фармацевтично прийнятною сіллю. У різних варіантах реалізації набір 1 UA 114414 C2 5 10 15 20 25 30 35 40 45 може містити, щонайменше, один лікарський засіб, який містить, щонайменше, одну дозу інгібітору NAE або його фармацевтично прийнятної солі і, щонайменше, один лікарський засіб, який містить, щонайменше, одну дозу гіпометилуючого засобу або його фармацевтично прийнятній солі і інструкції по введенню лікарського засобу. Більше того, наприклад, набір може містити діючі протиракові засоби, що складаються з, щонайменше, одного лікарського засобу, що містить, щонайменше, одну дозу інгібітору NAE або його фармацевтично прийнятної солі і, щонайменше, один лікарський засіб, який містить, щонайменше, одну дозу гіпометилуючого засобу або його фармацевтично прийнятної солі; вказаний набір для лікування раку додатково містить інструкції по дозуванню лікарських засобів для введення при лікуванні суб'єкта зі встановленою у них необхідністю. [009] Щонайменше, один з аспектів цього винаходу відноситься, щонайменше, до одного лікарського засобу для застосування у лікуванні раку у суб'єкта, який потребує такого лікування. Наприклад, щонайменше, один лікарський засіб може містити інгібітор NAE або його фармацевтично прийнятну сіль або гіпометилуючий засіб або його фармацевтично прийнятну сіль, або їх комбінацію. [010] Щонайменше, один з аспектів цього винаходу відноситься до застосування інгібітору NAE або його фармацевтично прийнятної солі у виробництві, щонайменше, одного лікарського засобу для лікування раку, при цьому інгібітор NAE або його фармацевтично прийнятну сіль вводять з гіпометилуючим засобом або його фармацевтично прийнятною сіллю пацієнтові, який потребує такого лікування. [011] Щонайменше, один з аспектів цього винаходу відноситься до застосування гіпометилуючого засобу або його фармацевтично прийнятної солі у виробництві, щонайменше, одного лікарського засобу для лікування раку, при цьому гіпометилуючий засіб або його фармацевтично прийнятну сіль вводять з інгібітором NAE або його фармацевтично прийнятною сіллю пацієнтові, який потребує такого лікування. КОРОТКИЙ ОПИС ФІГУР [012] На ФІГ. 1 показані значення комбінаторного індексу окремо для кожного з інгібіторів NAE MLN4924 і I-216 у комбінації з азацитидином або децитабіном у клітинних лініях HL60, OCIM2, NB4 і THP-1. [013] На ФІГ. 2 показаний графік об'єму пухлини залежно від часу у моделі підшкірного ксенотрансплантату HL-60 після підшкірного лікування: лише носієм, препаратом MLN4924 як єдиним засобом, азацитидином ("Aza") як єдиним засобом і спільним введенням (п.к.) MLN4924 і азацитидина на 1, 4, 8, 11, 15 і 18 дні у вказаних дозах. [014] На ФІГ. 3 показаний графік об'єму пухлини залежно від часу у моделі підшкірного ксенотрансплантату THP-1 після підшкірного лікування: лише носієм, препаратом MLN4924 як єдиним засобом, азацитидином ("Aza") як єдиним засобом і спільним введенням (п.к.) MLN4924 і азацитидина на 1, 4, 8, 11, 15 і 18 дні у вказаних дозах. [015] На ФІГ. 4 показаний графік об'єму пухлини залежно від часу у моделі підшкірного ксенотрансплантату OCI-M2 після підшкірного лікування: лише носієм, препаратом MLN4924 як єдиним засобом, азацитидином ("Aza") як єдиним засобом і спільним введенням (п.к.) MLN4924 і азацитидина на 1, 4, 8, 11, 15 і 18 дні у вказаних дозах. [016] На ФІГ. 5 показаний графік процентної долі виживаності залежно від часу у диссемінованій моделі HL60 після підшкірного лікування: лише носієм, препаратом MLN4924 як єдиним засобом, азацитидином ("AzaC") як єдиним засобом і спільним введенням (п.к.) MLN4924 і азацитидина на 22, 25, 29, 32, 36, 39 дні у вказаних дозах. [017] У цьому документі можуть бути використані наступні визначення і скорочення: ЛФ АЛТ ГМЛ АЧН АСТ AUC ППТ ПВ МПП CYP ДККЛ ДЛТ БПФП лужна фосфатаза аланінамінотрансфераза гострий мієлоїдний лейкоз абсолютне число нейтрофілів аспартатамінотрансфераза площа під кривою залежності концентрації від часу площа поверхні тіла повна відповідь метод постійної переоцінки цитохром P450 дифузна крупноклітинна В-клітинна лімфома дозолімітуюча токсичність біохімічні показники функції печінки 2 UA 114414 C2 ФВЛШ МДС MM МПД NAE NEDD8 СТЛА ЧВ ОРД ДРЛ 5 10 15 20 25 30 35 40 45 фракція викиду лівого шлуночку мієлодиспластичні синдроми множинна мієлома максимальна переносима доза фермент, активуючий Nedd8 експресуємий попередниками нервових клітин, білок 8, що зменшується у міру розвитку систолічний тиск крові у легеневій артерії часткова відповідь один раз на день дрібноклітинний рак легені [018] Використаний у цьому описі термін "дозолімітуюча токсичність" (ДЛТ) визначається як негативна подія, яка розцінюється лікарем, який призначив лікування, як пов'язана з терапією MLN4924, при цьому лікар, який призначив лікування, вважає, що дози необхідно обмежити у кількості або взагалі зупинити їх введення. Приклади таких подій включають: 3 - нейтропенію 4 ступеня (АЧН < 500 клітин/мм ) тривалістю більше 7 послідовних днів - нейтропенію 3 ступеня, ускладнену супутньою лихоманкою та/або інфекцією, при цьому лихоманка характеризується оральною температурою ≥ 38,5 °C 3 3 - тромбоцитопенію 4 ступеня (кількість тромбоцитів 10000/мм ) тривалістю більше 7 послідовних днів - тромбоцитопенію 3 ступеня, ускладнену кровотечею 3 - кількість тромбоцитів < 10000/мм у будь-який час - нудоту 3 ступеня або вище та/або блювоту, не дивлячись на застосування оптимальної протиблювотної профілактики (при цьому "оптимальна протиблювотна профілактика" визначається як протиблювотна схема, в якій застосовують антагоніст 5-HT3, що призначається у стандартних дозах і відповідно до стандартних схем). Дексаметазон застосовувати не слід через його вплив на індукцію CYP3A. - діарею 3 ступеня або вище, яка виникає, не дивлячись на максимальну підтримуючу терапію - зниження абсолютних показників ФВЛЖ на ≥ 10 % до показників < 50 % (наприклад, ФВЛЖ = 45 % у пацієнта з первинним показником ФВЛЖ = 55 %) - зниження ФВЛЖ до 50 мм.рт.ст. або у 3 рази від первинних показників - будь-яку іншу негематологічну токсичність 3 ступеня або вище з наступними виключеннями: o артралгія/міалгія 3 ступеня o нетривала втома (< 1 тижня) 3 ступеня o лихоманка 3 ступеня, яка виникає за відсутності нейтропенії 3 ступеня або вище, або зареєстрована інфекція після щоденного введення MLN4924 - затримку лікування більше ніж на 1 тиждень через відсутність адекватного відновлення гематологічної або негематологічної токсичності, пов'язаної із застосуванням MLN4924 - токсичність, пов'язану із застосуванням MLN4924, яка вимагає пропуску яких-небудь доз MLN4924 під час циклу або припинення терапії MLN4924. [019] Використаний у цьому описі термін "клінічно ефективна кількість" і "терапевтично ефективна" означає кількість лікарського засобу, яка є достатньою при відповідному введенні пацієнтові протягом відповідного періоду часу для того, щоб (a) викликати зниження важкості розладу або стану захворювання, що виявляється та підлягає лікуванню; (б) послабляти або полегшувати у пацієнта симптоми захворювання або розладу; або (в) уповільнювати або запобігати прогресуванню або іншим способом стабілізувати або пролонгувати стабілізацію розладу або стану захворювання, що підлягає лікуванню (наприклад, для запобігання додатковому зростанню пухлини або придушення зростання клітин раку). [020] При введенні більше одного лікарського засобу "клінічно ефективна загальна кількість" або "терапевтично ефективна загальна кількість" означає, що сума окремих кількостей кожного лікарського засобу відповідає визначенню "клінічно ефективної кількості", навіть якщо окремі кількості будь-якого числа окремих лікарських засобів не відповідають. Наприклад, якщо 10 мг A не є клінічно ефективною кількістю, а 20 мг B не є клінічно ефективною кількістю, але введення 10 мг A+20 мг B призводить у результаті, щонайменше, до одного з результатів, перерахованих у визначенні "клінічно ефективної кількості", тоді сума 10 мг A+20 мг B вважатиметься "клінічно ефективною загальною кількістю". 3 UA 114414 C2 5 10 15 [021] У будь-якій формі або композиції, доза(и) або клінічно ефективна (загальна) кількість, що вводиться, можуть бути виражені як кількість (кількості) лікарського засобу (лікарських 2 засобів) на ППТ пацієнта, наприклад, як мг/м . [022] Використаний у цьому описі термін "пацієнт" означає людину, зі встановленим діагнозом, яка демонструє симптоми або в якої за іншими причинами передбачають ураження захворюванням, розладом або станом і, таким чином, у неї встановлена необхідність у лікуванні, описаному в цьому документі. [023] Використані у цьому описі ілюстративні терміни "включати", "такий як", "наприклад" і подібні (і їх варіації, наприклад, "включає" і "включаючи", "приклади"), якщо не вказане інше, призначені бути необмежуючими. Тобто, якщо явно не вказане інше, такі терміни призначені позначати "але, не обмежуючись цим", наприклад, термін той, що "включає" означає включаючи, але, не обмежуючись цим. [024] Використаний у цьому описі термін "площа поверхні тіла" (ППТ) розраховують з використанням стандартної номограми, наприклад Лікарські засоби - інгібітори NAE. [025] Повідомлялося, що сполука ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1H-інден-1-іламіно)-7Hпіроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метил сульфамат: MLN4924 HN N N 20 25 30 N O O S H2N O OH також відома як MLN4924, є інгібітором ферменту, що активує NEDD8 (NAE). Див., наприклад, T.A. Soucy et al., Nature, 2009, 458, 732-737; T.A. Soucy et al., Clin. Cancer Res., 2009, 15 (12), 3912-3916; і J.E. Brownell et al., Mol. Cell., 2010, 37 (1), 102-111. Як обговорювалося вище, MLN4924, її фармацевтично прийнятні солі, фармацевтичні композиції MLN4924 або її фармацевтично прийнятної солі, процеси синтезу і їх поліморфні форми були описані раніше. Див., наприклад, Заявки на патент США під номерами 11/700614 (Публ. № 2007/0191293), 12/221399 (Публ. № 2009/0036678) і 12/779331 (Публ. № 2011/0021544). Лікарська речовина MLN4924 ("MLN4924-ЛВ") є гідрохлоридною сіллю MLN4924, тобто, гідрохлорид ((1S,2S,4R)-4(4-((1S)-2,3-дигідро-1H-інден-1-іламіно)-7H-піроло[2,3-d]піримідин-7-іл)-2гідроксициклопентил)метил сульфамату. [026] Повідомлялося, що сполука {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро1H-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамат: Cl I-216 OCH3 NH N O O H2N S O O N HO 4 UA 114414 C2 5 також відома як I-216, є інгібітором NAE. Див. Заявку на патент США № 13/592389, подану 23 серпня 2012 року, що заявляє пріоритет за попередньою патентною заявкою США № 61/526830, поданою 24 серпня 2011 року, які включені у цей опис як посилання у повному обсязі. Якщо між будь-яким із цих документів і цим описом є яка-небудь невідповідність, то цей опис є контрольним. Лікарські засоби-гіпометилуючі засоби. [027] Азацитидин є 4-аміно-1-β-D-рибофуранозил-s-триазин-2(1H)-оном (назва згідно IUPAC: 4-аміно-1-β-D-рибофуранозил-1,3,5-триазин-2(1H)-он): NH2 N N N HO O O 10 15 OH OH . ® Як обговорювалося вище, препарат VIDAZA (азацитидин для ін'єкцій, від компанії Celgene ® Corporation (Самміт, Нью Джерси); VIDAZA є зареєстрованим товарним знаком компанії Celgene Corporation) показаний і схвалений FDA США для лікування пацієнтів з наступними підтипами мієлодиспластичних синдромів згідно франко-американо-британської класифікації (ФАБ): рефрактерна анемія (РА) або рефрактерна анемія з кільцевими сидеробластами (якщо вони супроводжуються нейтропенією або тромбоцитопенією або вимагають проведення гемотрансфузій), рефрактерна анемія з надлишком бластів (РАНБ), рефрактерна анемія з надлишком бластів на стадії трансформації (РАНБ-T) і хронічний мієломоноцитарний лейкоз ® (ХММоЛ). Повна інформація про призначення препарату VIDAZA є доступною у вкладиші комерційної упаковки. [028] Децитабін є 4-аміно-1-(2-дезокси-β-D-еритропентофуранозил)-1,3,5-триазин-2(1H)оном: NH2 N N N HO O O 20 25 30 35 40 OH . [029] Препарат DACOGEN® (децитабін для ін'єкцій від компанії Eisai, Inc., Вудкліфф Лейк, Нью Джерсі; DACOGEN® є зареєстрованим товарним знаком компанії SuperGen, Inc., Дублін, Каліфорнія) показаний і схвалений FDA США для лікування пацієнтів з мієлодиспластичними синдромами (МДС), включаючи пролікованих і непролікованих раніше, de novo і вторинних МДС усіх підтипів згідно франко-американо-британської класифікації (рефрактерна анемія, рефрактерна анемія з кільцевими сидеробластами, рефрактерна анемія з надлишком бластів, рефрактерна анемія з надлишком бластів на стадії трансформації і хронічний мієломоноцитарний лейкоз) і груп проміжної-1, проміжної-2, і високої риски згідно Міжнародної прогностичної бальної системи. Повна інформація про призначення препарату DACOGEN® є доступною у вкладиші комерційної упаковки. Введення сполуки [030] На даний час було виявлено, що введення інгібітору NAE або її фармацевтично прийнятної солі і гіпометилуючого засобу або його фармацевтично прийнятній солі може забезпечити синергічний ефект. [031] Інгібітор NAE або його фармацевтично прийнятну сіль (NAEі) можна вводити у комбінації з гіпометилуючим засобом або його фармацевтично прийнятною сіллю (ГМЗ) у вигляді єдиної лікарської форми або у вигляді окремої лікарської форми. При введенні у вигляді окремої лікарської форми гіпометилуючий засіб або його фармацевтично прийнятну сіль можна вводити перед, у той же час або після введення інгібітору NAE або його фармацевтично прийнятної солі. Як використовується у цьому документі, введення в "комбінації" NAEі і ГМЗ відноситься не лише до одночасного або послідовного введення двох засобів, але також до введення обох сполук протягом одного циклу лікування, як зрозуміло фахівцеві у даній області техніки. 5 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 [032] У деяких варіантах реалізації цей винахід відноситься до лікування раку у пацієнта шляхом введення пацієнтові інгібітору NAE або його фармацевтично прийнятної солі (NAEі) і гіпометилуючого засобу або його фармацевтично прийнятноїй солі (ГМЗ) відповідно до 28денного циклу таким чином: вводять NAEі на 1, 4, 8 і 11 дні; і вводять ГМЗ на 1, 2, 3, 4, 5, 8 і 9 дні. Необов'язково, перший цикл складає 35 днів із введенням NAEі на 1, 4, 11 і 15 дні і введенням ГМЗ на 8, 9, 10, 11, 12, 15 і 16 днів із подальшими циклами з 28 днів, як описано у попередній пропозиції. [033] У деяких варіантах реалізації цей винахід відноситься до лікування раку у пацієнта шляхом введення пацієнтові інгібітору NAE або його фармацевтично прийнятної солі (NAEі) і гіпометилуючого засобу або його фармацевтично прийнятній солі (ГМЗ) відповідно до 28денного циклу таким чином: вводять NAEі на 1, 3 і 5 дні; і вводять ГМЗ на 1, 2, 3, 4, 5, 8 і 9 дні. Необов'язково, перший цикл складає 35 днів з введенням NAEі на 1, 3 і 5 дні і введенням ГМЗ на 8, 9, 10, 11, 12, 15 і 16 дні з подальшими циклами з 28 днів, як описано у попередній пропозиції. [034] У різних варіантах реалізації NAEі може бути ((1S,2S,4R)-4-(4-((1S)-2,3-дигідро-1Hінден-1-іламіно)-7H-піроло[2,3-d]піримідин-7-іл)-2-гідроксициклопентил)метил сульфаматом ("MLN4924") або {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфаматом ("I-216"). Щонайменше, в одному варіанті реалізації NAEі є MLN4924. Щонайменше, в одному варіанті реалізації NAEі є I-216. [035] У різних варіантах реалізації ГМЗ може бути азацитидином або децитабіном. Щонайменше, в одному варіанті реалізації ГМЗ є азацитидином. Щонайменше, в одному варіанті реалізації ГМЗ є децитабіном. [036] У різних варіантах реалізації MLN4924 вводять у комбінації з азацитидином. У різних варіантах реалізації MLN4924 вводять у комбінації з децитабіном. У різних варіантах реалізації I-216 вводять у комбінації з азацитидином. У різних варіантах реалізації I-216 вводять у комбінації з децитабіном. 2 [037] У різних варіантах реалізації NAEі вводять у дозі, що становить близько 20 мг/м , 30 2 2 2 2 2 2 мг/м , 40 мг/м , 45 мг/м , 50 мг/м , 60мг/м або 75 мг/м . У різних варіантах реалізації ГМЗ 2 вводять у дозі, що становить близько 75 мг/м . [038] У різних варіантах реалізації NAEі вводять внутрішньовенно. У різних варіантах реалізації NAEі вводять перорально. У різних варіантах реалізації NAEі вводять підшкірно. У різних варіантах реалізації ГМЗ вводять внутрішньовенно або підшкірно. [039] У деяких варіантах реалізації цей винахід відноситься до лікування раку у пацієнта шляхом введення пацієнтові NAEі і гіпометилуючого засобу ГМЗ відповідно до 28-денного циклу таким чином: вводять NAEі на 1, 4, 8 і 11 дні; і вводять ГМЗ на 1, 2, 3, 4, 5, 8 і 9 дні; при цьому NAEі є MLN4924, а ГМЗ є азацитидином; при цьому MLN4924 вводять внутрішньовенно у дозі, 2 2 2 2 2 2 що становить близько 20 мг/м , 30 мг/м , 40мг/м , 45 мг/м , 60мг/м або 75 мг/м ; при цьому 2 азацитидин вводять у дозі, що становить близько 75 мг/м ; і при цьому рак є гематологічним злоякісним захворюванням. У різних варіантах реалізації гематологічне злоякісне захворювання є гострим мієлоїдним лейкозом (ГМЛ) або мієлодиспластичними синдромами (МДС). У різних варіантах реалізації гематологічне злоякісне захворювання є ГМЛ. У різних варіантах реалізації гематологічне злоякісне захворювання є МДС. [040] У деяких варіантах реалізації цей винахід відноситься до лікування раки у пацієнта шляхом введення пацієнтові NAEі і гіпометилуючого засобу ГМЗ відповідно до 28-денного циклу таким чином: вводять NAEі на 1, 3 і 5 дні; і вводять ГМЗ на 1, 2, 3, 4, 5, 8 і 9 дні; при цьому NAEі є MLN4924, а ГМЗ є азацитидином; при цьому MLN4924 вводять внутрішньовенно у дозі, що 2 2 2 2 2 2 2 становить близько 20 мг/м , 30 мг/м , 40мг/м , 45 мг/м , 50 мг/м , 60мг/м або 75 мг/м ; при цьому 2 азацитидин вводять у дозі, що становить близько 75 мг/м ; і при цьому рак є гематологічним злоякісним захворюванням. У різних варіантах реалізації гематологічне злоякісне захворювання є гострим мієлоїдним лейкозом (ГМЛ) або мієлодиспластичними синдромами (МДС). У різних варіантах реалізації гематологічне злоякісне захворювання є ГМЛ. У різних варіантах реалізації гематологічне злоякісне захворювання є МДС. Лікарський засіб; фармацевтичні композиції. [041] Лікарський засіб може бути фармацевтично прийнятною сіллю. У деяких варіантах реалізації такі солі отримують з неорганічних або органічних кислот або основ. Огляд прийнятних солей див., наприклад, у публікації Berge et al., J. Pharm. Sci., 1977, 66, 1-19 і Remington: The Science and Practice of Pharmacy, 20е видання., A. Gennaro (ред.), Lippincott Williams & Wilkins (2000). 6 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 60 [042] Приклади прийнятних кислотно-аддитивних солей включають ацетат, адіпат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, лактат, малеат, метансульфонат, 2нафталінсульфонат, нікотинат, оксалат, памоат, пектинат, персульфат, 3-фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, тартрат, тіоціанат, тозилат і ундеканоат. [043] Приклади прийнятних основно-аддитивних солей включають солі амонію; солі лужних металів, такі як солі натрію і калію; солі лужноземельних металів, такі як солі кальцію і магнію; солі, утворені органічними основами, наприклад, солі дициклогексиламіна, N-метил-D-глюкамін і солі амінокислот, наприклад, аргініну і лізину і тому подібне. [044] Наприклад, Berge перераховує наступні схвалені FDA комерційно доступні солі: аніони: ацетати, безилат (бензолсульфонат), бензоат, бікарбонат, бітартрат, бромід, едетат кальцію (етилендіамінтетраацетат), камсилат (камфорсульфонат), карбонат, хлорид, цитрат, дигідрохлорид, едетат (етилендіамінтетраацетат), едизилат (1,2-етандисульфонат), естолат (лаурилсульфат), езилат (етансульфонат), фумарат, глюцептат (глюкогептонат), глюконат, глутамат, гліколліларсанілат (гліколламідофеніларсонат), гексилрезорцинат, гідрабамін (N,N'-ди(дегідроабиетил)-етилендіамін), гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат (2-гідроксіетансульфонат), лактат, лактобіонат, малат, малеат, манделат, мезилат (метансульфонат), метилбромід, метилнітрат, метилсульфат, мукат, напсилат (2нафталінсульфонат), нітрат, памоат (ембонат), пантотенат, фосфат/дифосфат, полігалактуронат, саліцилат, стеарат, субацетат, сукцинат, сульфат, танат, тартрат, теоклат(8хлортеофіллінат) і триетіодид; органічні катіони: бензатин (N,N'-дибензилетилендіамін), хлорпрокаїн, холін, діетаноламін, етилендіамін, меглумін (N-метилглюкамін) і прокаїн; і катіони металів: алюміній, кальцій, літій, магній, калій, натрій і цинк. [045] Berge додатково перераховує наступні не схвалені FDA комерційно доступні (за межами США) солі: аніони: адіпат, альгінат, аміносаліцилат, ангідрометиленцитрат, ареколін, аспартат, бісульфат, бутилбромід, камфорат, диглюконат, дигідробромід, дисукцинат, гліцерофосфат, гемісульфат, гідрофторид, гідройодид, метиленбіс(саліцилат), нападизилат (1,5-нафталіндисульфонат), оксалат, пектинат, персульфат, фенілетилбарбітурат, пікрат, пропіонат, тіоціанат, тозилат і ундеканоат; органічні катіони: бенетамін (N-бензилфенетиламін), клемізол (1-p-хлорбензил-2-піролілдин-1'-ілметилбензімідазол), діетиламін, піперазин і трометамін (трис(гідроксиметил)амінометан); і катіони металів: барій і вісмут. [046] Використаний у цьому описі термін "фармацевтично прийнятний носій" відноситься до матеріалу, що сумісний з суб'єктом-реципієнтом (ссавцем, наприклад людиною), і є прийнятним для доставки активного засобу до цільової ділянки без припинення активності засобу. Пов'язані з носієм токсичність або побічні ефекти, якщо такі мають місце, є, наприклад, співрозмірними з раціональним співвідношенням риск/користь для використання активного засобу за призначенням. [047] Фармацевтичні композиції для застосування за цим винаходом можуть бути виготовлені способами, такими як, наприклад, способи звичайного гранулювання, змішування, розчинення, інкапсулювання, ліофілізації або емульгування серед інших. Композиції можуть бути виготовлені у різних формах, включаючи гранули, преципітат, суспензії, порошки, включаючи висушені виморожуванням, висушені за допомогою центрифугування або висушені розпилювальним сушінням порошки, аморфні порошки, пігулки, капсули, сироп, супозиторії, ін'єкції, емульсії, еліксири, суспензії або розчини. Композиції можуть містити стабілізатори, модифікатори рН, поверхнево-активні речовини, солюбілізуючі засоби, модифікатори біодоступності і їх комбінації. [048] Фармацевтично прийнятні носії, що можуть бути використані у композиції за цим винаходом, включають: іоніти, окись алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як людський сироватковий альбумін, буферні речовини, такі як фосфати або карбонати, гліцин, сорбінова кислота, сорбат калію, суміш часткових гліцеридів насичених рослинних жирних кислот, вода, солі або електроліти, такі як протамінсульфат, динатрійгідрофосфат, калійгідрофосфат, хлорид натрію, солі цинку, колоїдний діоксид кремнію, трисилікат магнію, полівінілпіролідон, речовини на основі целюлози, поліетиленгліколь, натрійкарбоксиметилцелюлоза, поліакрилат, віски, блок-полімери поліетилена і поліоксипропілена і ланолін. [049] Фармацевтичні композиції за цим винаходом сформовані для фармацевтичного введення ссавцеві, такому як людина. Такі композиції можна вводити перорально, парентерально, шляхом аерозольної інгаляції, місцево, ректально, назально, трансбукально, 7 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 вагінально або через імплантований резервуар. Використаний у цьому описі термін "парентеральний" включає підшкірний, внутрішньовенний, внутрішньоочеревинний, внутрішньом'язовий, внутрішньосуставний, внутрішньосиновіальний, інтрастернальний, інтратекальний, внутрішньопечінковий, в осередок ураження і інтракраніальний спосіб введення ін'єкції або інфузії. У деяких варіантах реалізації композиції вводять перорально, внутрішньовенно або підшкірно. У деяких варіантах реалізації композиції вводять перорально. У деяких варіантах реалізації композиції вводять внутрішньовенно. Вказані композиції можуть бути розроблені з короткочасною дією, зі швидким вивільненням або з пролонгованою дією. Крім того, композиції можна вводити місцевими, а не системними способами, такими як введення (наприклад, шляхом ін'єкції) у місце локалізації пухлини. [050] Фармацевтичні композиції можуть бути приготовані у вигляді рідких суспензій або розчинів з використанням рідини, наприклад олії, води, спирту та їх комбінацій. Можуть бути включені солюбілізуючі засоби, такі як циклодекстрини. Для перорального або парентерального введення можуть бути додані фармацевтично придатні поверхнево-активні речовини, суспендуючі засоби або емульгуючі засоби. Суспензії можуть включати масла, такі як арахісова олія, кунжутна олія, бавовняна олія, кукурудзяна олія і оливкова олія. Препарати у формі суспензії можуть також містити складні ефіри жирних кислот, такі як етилолеат, ізопропілміристат, гліцериди жирних кислот і ацетильовані гліцериди жирних кислот. Композиції у формі суспензії можуть включати спирти, такі як етанол, ізопропіловий спирт, гексадециловий спирт, гліцерин і пропіленгліколь; прості ефіри, такі як полі(етиленгліколь); нафтові вуглеводні, такі як мінеральне масло і вазелін, і воду. [051] Стерильні ін'єкційні форми цих фармацевтичних композицій можуть бути водними або олійними суспензіями. Ці суспензії можуть бути складені відповідно до способів, відомих у цій області техніки з використанням прийнятних диспергуючих або зволожуючих засобів і суспендуючих засобів. Стерильний препарат для ін'єкцій може також бути стерильним розчином або суспензією для ін'єкцій у нетоксичному прийнятному для парентерального введення розчиннику або розчиннику, такому як, наприклад, розчин в 1,3-бутандіолі. Серед ілюстративних носіїв і розчинників, які можуть бути використані, знаходиться вода, розчин Рінгера і ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище, зазвичай використовують стерильні нелеткі масла. З цією метою може бути використане будь-яке м'яке нелетке масло, включаючи синтетичні моно- або ди-гліцериди. Жирні кислоти, такі як олеїнова кислота та її гліцеридні похідні придатні для приготування препаратів для ін'єкцій, також як і природні фармацевтично прийнятні олії, такі як оливкова олія або касторова олія, наприклад, в їх поліоксіетильованих варіантах. Ці олійні розчини або суспензії можуть також містити довголанцюжковий спиртовий розчинник або диспергуючий засіб, такий як карбоксиметилцелюлоза або подібні диспергуючі засоби, які зазвичай використовують у складі фармацевтично прийнятних лікарських форм, включаючи емульсії і суспензії. Інші зазвичай використовуємі поверхнево-активні речовини, такі як Твін, Спан та інші емульгатори або підсилювачі біодоступності, які зазвичай використовують при виготовленні фармацевтично прийнятних твердих, рідких або інших лікарських форм, також можуть бути використані для цілей композиції. Сполуки можуть бути складені для парентерального введення шляхом ін'єкції, наприклад, шляхом болюсної ін'єкції або безперервної інфузії. Стандартна лікарська форма для ін'єкцій може знаходитися в ампулах або в багатодозових контейнерах. [052] Наприклад, у різних варіантах реалізації цього розкриття NAEі є лікарським продуктом для ін'єкцій (IDP від англ. Injection Drug Product) MLN4924 ("MLN4924-IDP"). MLN4929-IDP входить до складу лікарського засобу разом з наступними наповнювачами: лимонна кислота; гідроксид натрію; сульфобутилефіри циклодекстрина, солі натрію (Captisol®) і вода для ін'єкцій. Щонайменше, в одному варіанті реалізації MLN4929-IDP складається з 10 мг/мл MLN4924 (у вигляді вільної основи) у розчині, що містить 50 мМ цитратного буфера і 100 мг/мл сульфобутилового ефіру β-циклодекстрина, pH 3,3. [053] При розбавленні MLN4924-IDP у сольовому розчині виникали проблеми зі стабільністю. Препарат MLN4924-IDP може бути використаний протягом періоду повторного дослідження, вказаного у сертифікаті аналізу. На практиці MLN4924-IDP зберігали у холодильнику при температурі 5 °C ± 3 °C. Кожен скляний флакон типа I, що номінально містить 5 мл компаундованого стерильного розчину, герметично закупорюють пробкою з бутилового каучуку з покриттям із Teflon® і запечатують зверху алюмінієвим ковпачком з відривною пластмасовою накладкою Flip-Off®. [054] У різних варіантах реалізації цього розкриття ГМЗ є азацитидином. Азацитидин є комерційно доступним препаратом VIDAZA® (азацитидин для ін'єкцій), що поставляється у 8 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 60 вигляді ліофілізованого порошку в одноразових флаконах по 100 мг. За додатковою інформацією про препарат VIDAZA® звертайтеся до вкладишу в упаковці. [055] Ці фармацевтичні композиції можна вводити перорально у будь-якій прийнятній для перорального введення лікарській формі, включаючи капсули, пігулки, водні суспензії або розчини. Коли для перорального застосування необхідні водні суспензії, активний інгредієнт може бути об'єднаний із емульгуючими та суспендуючими засобами. За бажанням також можуть бути додані визначені підсолоджувачі, ароматизатори або барвники. Для перорального введення у формі капсули, придатні розчинники включають лактозу і висушений кукурудзяний крохмаль. У разі пігулок для перорального застосування, зазвичай носії, що використовуються, включають лактозу і кукурудзяний крохмаль. Також зазвичай додають змащуючі засоби, такі як стеарат магнію. Покриття можуть бути використані для різних цілей, наприклад, щоб приховати смак, щоб впливати на місце розчинення або поглинання або для того, щоб продовжити дію лікарського засобу. Покриття можуть наносити на пігулку або на гранульовані частки для використання у капсулі. [056] Крім того, ці фармацевтичні композиції можна вводити у формі супозиторіїв для ректального введення. Вони можуть бути приготовані шляхом змішування засобу з прийнятним неподразнюючим носієм, який є твердим при кімнатній температурі, але рідким при ректальній температурі і, отже, плавитиметься у прямій кишці з вивільненням лікарського засобу. Такі матеріали включають масло какао, бджолиний віск і поліетиленгліколі. [057] Ці фармацевтичні композиції можна також застосовувати місцево, наприклад, коли мета лікування включає області або органи, легко доступні для місцевого нанесення, включаючи захворювання очей, шкіри або нижнього відділу кишковика. Прийнятні для місцевого застосування композиції можуть бути легко приготовані для кожної з цих областей або органів. [058] Місцеве застосування для нижнього відділу кишковика може бути здійснене за допомогою композиції у формі ректальних супозиторіїв (див. вище) або у формі прийнятної композиції для клізми. Також можна застосовувати місцеві трансдермальні пластири. Для місцевого застосування фармацевтичні композиції можуть бути складені у вигляді прийнятної мазі, що містить активний компонент, суспендований або розчинений в одному або декількох носіях. Носії для місцевого застосування сполук за цим розкриттям включають мінеральне масло, рідкий вазелін, білий вазелін, пропіленгліколь, поліоксіетилен, сполуку поліоксипропілена, емульгуючий віск і воду. Крім того, фармацевтичні композиції можуть бути сформовані у вигляді прийнятного лосьйону або крему, що містить активний(і) компонент(и), суспендований або розчинений, щонайменше, в одному фармацевтично прийнятному носієві. Прийнятні носії включають мінеральне масло, сорбітан моностеарат, полісорбат 60, віск цетилових ефірів, цетеариловий спирт, 2-октилдодеканол, бензиловий спирт і воду. [059] Для офтальмологічного застосування фармацевтичні композиції можуть бути сформовані у вигляді мікронізованих суспензій в ізотонічному стерильному фізіологічному розчині зі встановленим рівнем рН, або, наприклад, у вигляді розчинів в ізотонічному стерильному фізіологічному розчині зі встановленим рівнем рН, з консервантом або без, таким як хлорид бензилалконію. Крім того, для офтальмологічного застосування фармацевтичні композиції можуть бути введені до складу мазі, такої як вазелін. [060] Фармацевтичні композиції можна також вводити за допомогою назального аерозоля або інгаляції. Такі композиції можуть бути приготовані відповідно до способів, відомих в області фармацевтичних композицій і можуть бути приготовані у вигляді розчинів у фізіологічному розчині з використанням бензилового спирту або інших прийнятних консервантів, підсилювачів абсорбції для підвищення біодоступності, фторвуглеводнів та/або інших звичайних солюбілізуючих або диспергуючих засобів. [061] Розкриті у цьому документі способи можуть бути використані для лікування захворювань, розладів і станів, при яких інгібування активності ферменту NAE є згубним для виживаності та/або зростання хворих клітин або тканини (наприклад, клітини, чутливі до інгібування NAE; інгібування активності NAE руйнує механізми захворювання, зниження активності NAE стабілізує білки, які є інгібіторами механізмів хвороби, зниження активності NAE призводить до інгібування білків, які є активаторами механізмів захворювання). Захворювання, розлади і стани також можуть включати ті, що вимагають ефективної активності кулліна та∕або убіквітинування, цю активність можна регулювати шляхом зменшення активності ферменту NAE. [062] Наприклад, розкриті у цьому документі способи можуть бути придатні у лікуванні розладів, що залучають клітинну проліферацію, включаючи розлади, які вимагають ефективної метаболічного шляху куллін-залежного убіквітинування і протеоліза (наприклад, убіквітинпротеасомний метаболічний шлях) для підтримання та∕або прогресування хворобливого стану. 9 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 Способи за цим розкриттям можуть бути придатні в лікуванні розладів, опосередкованих Kip WAF/CIP1 білками (наприклад, активація NFκB, активація p27 , активація p21 , активація p53), які регулюються активністю NAE. Репрезентативні розлади включають проліферативні розлади, особливо онкологічні захворювання і запальні розлади (наприклад, ревматоїдний артрит, запальні захворювання кишковика, астму, хронічну обструктивну хворобу легенів (ХОХЛ), остеоартрит, дерматоз (наприклад, атопічний дерматит, псоріаз), судинні проліферативні розлади (наприклад, атеросклероз, рестеноз) аутоіммунні захворювання (наприклад, розсіяний склероз, відторгнення тканини і органу)); а також запалення, пов'язане з інфекцією (наприклад, імунні відповіді), нейродегенеративні розлади (наприклад, хворобу Альцгеймера, хворобу Паркінсона, захворювання рухомих нейронів, невропатичний біль, розлади триплетного повтору, астроцитому і нейродегенерацію в результаті алкогольної хвороби печінки), ішемічне пошкодження (наприклад, інсульт) і кахексію (наприклад, прискорений розпад білків м'язів, супроводжуючий різні фізіологічні і патологічні стани (наприклад, пошкодження нерва, голодування, лихоманка, ацидоз, ВІЛ-інфекція, ракове захворювання і деякі ендокринопатії)). [063] Розкриті у цьому документі способи можуть бути придатні, наприклад, для лікування раку. Використаний у цьому описі термін "рак" відноситься до клітинного розладу, що характеризується неконтрольованою або з порушеним регулюванням клітинною проліферацією, зниженням клітинної диференціації, патологічною здатністю вторгатися в оточуючі тканини та∕або здатністю створювати новоутворення в ектопічних ділянках. Термін "рак" включає тверді пухлини і пухлини, що походять з кровотворної тканини. Термін "рак" охоплює захворювання шкіри, тканин, органів, кісток, хрящів, крові, і судин. Термін "рак" додатково охоплює первинні і метастатичні ракові захворювання. [064] У деяких варіантах реалізації рак є твердою пухлиною. Приклади твердих пухлин, які можна лікувати за допомогою способів за цим розкриттям, включають рак підшлункової залози; рак сечового міхура; колоректальний рак; рак молочної залози, включаючи метастатичний рак молочної залози; рак передміхурової залози, включаючи андроген-залежний і андрогеннезалежний рак передміхурової залози; рак нирки, включаючи, наприклад, метастатичну нирково-клітинну карциному; гепатоцелюлярний рак; рак легені, включаючи, наприклад, дрібноклітинний рак легені (ДРЛ), недрібноклітинний рак легені (НДРЛ), бронхіолоальвеолярну карциному (БАК) і аденокарциному легені; рак яєчників, включаючи, наприклад, прогресивний епітеліальний або первинний перитонеальний рак; рак шийки матки; рак шлунку; рак стравоходу; рак голови і шиї, включаючи, наприклад, плоскоклітинний рак голови і шиї; меланому; нейроендокринний рак, включаючи метастатичні нейроендокринні пухлини; пухлини головного мозку, включаючи, наприклад, гліому, анапластичну олігодендрогліому, мультиформну гліобластому дорослих і анапластичну астроцитому дорослих; рак кісток і саркому м'яких тканин. [065] У деяких варіантах реалізації рак є гематологічним злоякісним захворюванням. Приклади гематологічних злоякісних захворювань включають гострий мієлоїдний лейкоз (ГМЛ); хронічний мієлоїдний лейкоз (ХМЛ), включаючи акселерацію ХМЛ і ХМЛ у бластній фазі (ХМЛ-БФ); гострий лімфобластний лейкоз (ГЛЛ); хронічний лімфоцитарний лейкоз (ХЛЛ); хвороба Ходжкіна (ХХ); неходжкінську лімфому (НХЛ), включаючи фолікулярну лімфому і лімфому з клітин зони мантії; B-клітинну лімфому; T-клітинну лімфому; множинну мієлому (MM); макроглобулінемію Вальденстрема; мієлодиспластичні синдроми (МДС), включаючи рефрактерную анемію (РА), рефрактерную анемію з кільцевими сидеробластами (РАКС) (рефрактерную анемію з лишком бластів (РАНБ) і РАНБ на стадії трансформації (РАНБ-T) і мієлопроліферативні синдроми. [066] У деяких варіантах реалізації лікар може поставити пацієнтові діагноз переважно одного типа раку. У деяких варіантах реалізації лікар може поставити пацієнтові діагноз наявності більше одного типа раку. У деяких варіантах реалізації діагноз є переважно одним типом мієлодиспластичних синдромів. У деяких варіантах реалізації діагноз є більше одного типу мієлодиспластичних синдромів. [067] У деяких варіантах реалізації способи за цим розкриттям застосовують для лікування пацієнта, який має ракову пухлину, або з ризиком розвитку, або такого, який випробовує рецидив ракової пухлини, такої як колоректальний рак, рак яєчників, рак легенів, рак молочної залози, рак шлунку, рак передміхурової залози і рак підшлункової залози. У деяких варіантах реалізації способи за цим розкриттям застосовують для лікування пацієнта, який має гематологічний рак, або з ризиком розвитку, або такого, який випробовує рецидив гематологічного раку, такого як ГМЛ, ХМЛ, ХМЛ-BP, ГЛЛ або ХЛЛ. 10 UA 114414 C2 5 10 15 20 25 30 35 40 45 [068] Для повнішого розуміння цього розкриття, представлені нижченаведені приклади. Ці приклади є лише ілюстративними і в будь-якому разі не призначені для обмеження обсягу цього розкриття. ПРИКЛАДИ 1. Аналізи життєздатності клітин in vitro [069] У протоколі дослідження використовували чорні/прозорі 384-лункові планшети Biocoat™, покриті полі-D-лізином (Becton Dickinson, Франклін Лейкс, Нью-Джерсі). Відповідний інгібітор NAE розчиняли в ДМСО і вносили до лунок з використанням пристрою обробки рідини Echo (Labcyte, Саннівейл, Каліфорнія). Клітинні лінії HL60 і ТНР-1 були отримані з АТСС (Американської колекції типових культур, Манассас, Вірджінія), тоді як лінії NB4 і OCI-M2 були отримані з DSMZ (Німецької колекції мікроорганізмів і клітинних культур GmbH, Брауншвейг, Німеччина). У лунки кожного планшета додавали клітинну суспензію з однієї з ліній. Частину лунок використовували як позитивні контролі (не додавали сполука), тоді як іншу частину лунок використовували як негативні контролі (не додавали клітини). Планшети інкубували протягом 72 годин, а потім вимірювали життєздатність клітин за допомогою аналізу ATPLite (PerkinElmer, Уолтем, Массачусетс). Статистичні аналізи. [070] Нормалізація. Дані життєздатності нормалізувалися окремо для кожного планшета шляхом масштабування даних так, щоб медіана негативних контролів дорівнювала 0, а медіана позитивних контролів дорівнювала 100. Формальніше: де Vi є нормалізованою життєздатністю i лунки, Ui є необробленими вимірами життєздатності, медіана (U-) є медіаною негативних контролів, а медіана (U+) є медіаною позитивних контролів. Після нормалізації контролі утилізували. [071] Модель поверхні відгуку і приведення у відповідність. Модель поверхні відгуку використовувалася для того, щоб описати взаємозв'язок між нормалізованою життєздатністю і концентрацією лікарського засобу. Нехай для даного планшета: де E1, E2, E3, E4, I1, I2, I3, S1, S2, S3 і S4 є параметрами, CA і CB є відповідними концентраціями лікарських засобів A і B, а V є показником нормалізованої життєздатності. Передбачалося, що значення помилок були незалежними і однаково розподіленими нормальними випадковими величинами. Ця модель є продовженням рівняння Хілла (A.V. Hill, J. Physiol., 1910, 40, iv-vii), яке зазвичай використовується для моделювання ефекту одного лікарського засобу. Дані приводили у відповідність з цією моделлю за допомогою способу максимальної правдоподібності за допомогою програми статистичного програмного забезпечення R R Development Core Team (2008) (R: мова програмування і програмне середовище для статистичних розрахунків. R Фонд статистичних розрахунків, Відень, Австрія. ISBN 3-900051-070, URL http://www.R-project.org). [072] Контроль якості. До планшетів застосовували три типи контролю якості. Спочатку перевірили, що зміна позитивних контролів і середнє значення негативних контролів були незначними. Потім, перевірили, що нові дані узгоджуються з даними попередніх досліджень з одним лікарським засобом. І, нарешті, проаналізували відповідність залишків поверхні відгуку, щоб гарантувати, що залишкова сума квадратів достатньо мала. Всі ці види контролю якості були засновані на чисельних порогах для ухвалення рішення "пройшов / не пройшов", і ті ж самі порогові значення були використані для всіх планшетів у дослідженні. Якщо планшет не проходив будь-який вид контролю якості, його видаляли з аналізу. [073] Вимір синергії in vitro. Як показник синергії лікарських засобів був використаний комбінаторний індекс (M.C. Berenbaum, J. Theor. Biol., 1985, 114, 413-431). Комбінаторний індекс обчислюють на основі ізоболограми, яка є зрізом поверхні доза-відповідь при постійній 11 UA 114414 C2 5 10 15 20 25 30 35 життєздатності. Для цього аналізу використовують 50 % ізоболограмму, яка є контуром дози, що має 50 % життєздатність. Величини EC50A і EC50B визначаються як відповідні дози лікарських засобів А і В поодинці, що мають життєздатність 50 %. Для точки (DA, DB) за 50 % ізоболограмою, комбінаторний індекс визначають як (D A / EC50A) + (DB / EC50B). Оскільки вибір (DA, DB) може бути довільним, використовують обмежувальну умову DA / DB=EC50A / EC50B. Якщо комбінаторний індекс дорівнює менше 1, це означає, що ізоболограма увігнута всередину, і що поєднання лікарських засобів є синергічним. Навпаки, якщо комбінаторний індекс більше 1, 50 % ізоболограма вигнута назовні, вказуючи на антагонізм. У способі точнішого аналізу, який застосовується відповідно до цього розкриття, значення комбінаторного індексу у діапазоні 0,81,2 вважаються аддитивними. Це правило запобігає класифіцикації невеликих відхилень від аддитивності, таких як синергичність. [074] Для кожної умови був виконаний двосторонній t-тест, щоб визначити, чи відрізнявся середній комбінаторний індекс від 1. Для коректування результуючих р-значений для багатократної перевірки гіпотез був використаний спосіб Бенджаміні-Хохберга (Y. Benjamini and Y. Hochberg, J. R. Stat. Soc., Series B (Stat. Methodol.), 1995, 57 (1), 289-300). Скоректоване pзначення нижче 0,05 вважалося статично значимим. Для того, щоб класифікувати комбінацію як синергічну, автори винаходу зажадали обов'язкового виконання трьох критеріїв: середній комбінаторний індекс для умови має бути менше 1, відмінність має бути статистично значимою, і комбінаторний індекс має бути за межами діапазону (0,8, 1,2). Цей третій критерій попереджав класифікацію невеликих відхилень від аддитивності як синергію. Комбінації, для яких pзначення було вище 0,05 або комбінаторний індекс знаходився у межах діапазону (0,8, 1,2), класифікували як аддитивні. [075] Аналізи життєздатності клітин були використані для оцінки ефекту комбінації in vitro для кожного з двох інгібіторів NAE: MLN4924 і I-216 з кожним з двох гіпометилуючих засобів: азацитидином і децитабіном, на чотирьох клітинних лініях: HL60, OCIM2, NB4 і THP-1. На фігурі 1 показаний комбінаторний індекс для всіх досліджень, прошедших контроль якості серед кожної тестуємої комбінації. Результати розташовані за умовою. Нижче у Таблиці 1 приведений список середнього комбінаторного індексу, скоректованого p-значения і висновок для кожної визначеної комбінації. Як показано в Таблиці 1, усі вісім комбінацій інгібітору NAE і гіпометилуючого засобу продемонстрували синергічний ефект на обох клітинних лініях OCIM2 і NB4. На лінії HL60 обидва інгібітори NAE продемонстрували синергію з децитабіном і показали аддитивний ефект з азацитидином. На лінії THP-1 обидва інгібітори NAE продемонстрували аддитивний ефект з азацитидином. У зв'язку з відсутністю активності єдиного засобу децитабіна на лінію THP-1, комбінаторний індекс для досліджень in vitro інгібіторів NAE і децитабіна на лінію THP-1 не міг бути розрахований. 12 UA 114414 C2 [076] Таблиця 1. Коротке викладення значень комбінаторного індексу. Інгібітор NAE Клітинна лінія MLN4924 Децитабін I-216 Кількість планшетів, що пройшли Середній комбінаторний індекс Скоректоване Pзначення HL60 6 0,45 6,2 × 10 -4 Синергія Децитабін HL60 4 0,46 5,8 × 10 -3 Синергія MLN4924 Азацитидин HL60 5 1,03 1,1 × 10 -1 Аддитивність I-216 Азацитидин HL60 3 0,97 4,9 × 10 -1 Аддитивність MLN4924 Децитабін OCIM2 7 0,52 1,4 × 10 -4 Синергія I-216 Децитабін OCIM2 5 0,45 4,0 × 10 -5 Синергія MLN4924 Азацитидин OCIM2 5 0,44 4,8 × 10 -6 Синергія I-216 Азацитидин OCIM2 3 0,41 2,7 × 10 -3 Синергія MLN4924 Децитабін NB4 5 0,61 1,4 × 10 -4 Синергія I-216 Децитабін NB4 4 0,61 2,7 × 10 -3 Синергія MLN4924 Азацитидин NB4 4 0,52 5,8 × 10 -3 Синергія I-216 Азацитидин NB4 4 0,56 5,3 × 10 -3 Синергія MLN4924 Децитабін THP-1 4 НД НД НД I-216 Децитабін THP-1 4 НД НД НД MLN4924 Азацитидин THP-1 4 1,10 2,4 × 10 -2 Аддитивність I-216 5 Гіпометилуючий засіб Висновок Азацитидин THP-1 4 1,11 2,7 × 10 -2 Аддитивність [077] На фігурі 1 показані значення комбінаторного індексу для кожного планшета, розташовані за умовою (тобто дана комбінація лікарських засобів, що застосовується до даної клітинної лінії). Ці результати були узагальнені шляхом розрахунку середнього комбінаторного індексу для кожної умови, як показано в Таблиці 1. 2. Моделі ефективності в пухлині in vivo. Модель підшкірних ксенотрансплантатів 13 UA 114414 C2 6 5 10 15 20 25 30 35 40 45 50 55 [078] Суб'єкти дослідження. Пухлинні клітини лінії HL-60 (2 × 10 ) в 100 мкл забуференного фосфатом фізіологічного розчину з Матрігель™ (BD Biosciences, Бедфорд, Массачусетс) асептично вводили за допомогою ін'єкції у підшкірний простір правої бічної спинної поверхні самок голих мишей лінії Ncr (у віці 5-8 тижнів, Charles River Laboratories, Уїлмінгтон, 6 Массачусетс) за допомогою голки 26 калібру. Пухлинні клітини лінії THP-1 (2,5 × 10 ) або OCI6 M2 (5 × 10 ) у 100 мкл забуференного фосфатом фізіологічного розчину з Матрігель™ асептично вводили за допомогою ін'єкції у підшкірний простір правої бічної спинної поверхні самкам мишей лінії CB.17 SCID (у віці 5-8 тижнів, Charles River Laboratories) за допомогою голки 26 калібру. [079] Починаючи з сьомого дня (7) після інокуляції, пухлини вимірювали двічі на тиждень, використовуючи штангенциркуль. Об'єми пухлин розраховували з використанням стандартних 2 3 способів (0,5 x (довжина x ширина )). Після того, як пухлини досягали об'єму близько 200 мм , мишей рандомізували у групи по 10 і вводили підшкірно за допомогою ін'єкції сполука-інгібітор (200 мкл) у різних дозах і схемах, при цьому перший день введення дози визначали як День 1. Усі контрольні групи отримували лише носій. Розмір пухлини і масу тіла вимірювали приблизно двічі на тиждень протягом усього терміну дослідження. Мишей убивали, коли об'єм пухлини досягав 10 % від їх маси тіла, або коли середній об'єм пухлини в групі лікування або в 3 контрольній групі складав близько 2000 мм . Схема введення доз лікарських засобів для кожного дослідження була наступною: MLN4924 і азацитидин вводили окремо або спільно шляхом підшкірної ін'єкції на 1, 4, 8, 11, 15 і 18 дні у вказаних дозах. За зростанням пухлини продовжували спостерігати після періоду введення доз. Зареєстрований середній об'єм пухлини залежно від часу показаний на Фігурах 2-4. [080] Статистичні аналізи синергії відносно зростання пухлини у моделях підшкірного ксенотрансплантату. [081] Для моделей THP-1 і OCI-M2 аналізували виміри з 0 до 21 дня. Для моделі HL60 використовували виміри з 0 до 14 дня, оскільки у деяких мишей після 14 дня пухлини перевищували допустимий об'єм. До всіх об'ємів пухлини додавали 1 до log 10 перетворення. Ці значення порівнювали між групами лікування для оцінки того, чи були відмінності у тенденціях з часом статистично значимими. Для порівняння пар груп лікування, наступну модель змішаних ефектів лінійної регресії приводили у відповідність з даними за допомогою способу максимальної правдоподібності: 2 2 Yijk-Yi0k=Yi0k + лікуванняi + деньj + деньj + (лікування*день)ij + (лікування*день )ij+eijk де Yijk є log10 об'єму пухлини у точці часу j у тварини k при лікуванні i, Yi0k є log10 об'єму пухлини на 0 день у тварини k при лікуванні i, день j є середнєцентрованою точкою часу і розглядається як постійна змінна, і eijk є залишковою помилкою. Для обліку повторних вимірів у тієї ж самої тварини з часом застосовують просторову коваріаційну матрицю ступеневої 2 залежності. Умови взаємодії, а також умови день j , якщо вони не є статистично значимими, видаляють. [082] Тест відношення правдоподібності використовують для оцінки того, чи демонструє дана пара груп лікування відмінності, які є статистично значимими. -2 log правдоподібності повної моделі порівнюють з моделлю без яких-небудь умов лікування (спрощена модель) і різницю значень досліджують за допомогою тесту хі-квадрат. Ступені свободи тесту розраховують як різницю між ступенями свободи повної моделі і спрощеної моделі. [083] На додаток до статистичної значущості, була знайдена міра величини ефекту для кожного лікування. Прогнозовані відмінності у log об'ємах пухлин(Yijk-Yi0k) залежно від часу беруть з вищезгаданої моделі для розрахунку значень середньої площі під кривою (AUC) для кожної групи лікування. Значення dAUC розраховують таким чином: [084] Для аналізів синергії спостережувані відмінності у log об'ємах пухлин використовують для розрахунку значень AUC для кожної тварини. У тих випадках, коли тварину у групі лікування видаляють з дослідження, останній спостережуваний об'єм пухлини просувають через усі подальші моменти часу. Для підвищення надійності аналізу синергії, до значень AUC з кожної групи лікування застосовують наступну процедуру. Нехай х буде множиною значень AUC для даної групи лікування. Діапазон інтересів визначають як: (медіана(x) - 5 * МАВ(x), медіана(x)+ 5 * МАВ(x)). Тут МАВ є медіаною абсолютного відхилення x. Якщо яке-небудь значення у множині х випадає за межі цього діапазону, то це значення замінюють на найближче пограничне значення. 14 UA 114414 C2 5 10 15 20 25 30 35 40 45 50 55 Процедура була неітеративною, так що діапазон був розрахований лише один раз для кожної групи лікування. [085] Оцінку синергії у балах для комбінації лікувань A і B визначають як 100 * (середня(AUCAB) – середня(AUCA) – середня(AUCB)+ середня(AUCктр)) / середня(AUCктр) де AUCAB, AUCA, AUCB і AUCктр є значення AUC для тварин у групі комбінованої терапії, групі A, групі B і в контрольній групі, відповідно. Стандартну помилку оцінки синергії розраховують на основі коливань значень AUC у тварин. Для визначення того, чи суттєво відрізняється оцінка синергії у балах від нуля, використовують двосторонній t-тест. Якщо P-значення знаходиться нижче 0,05, а оцінка синергії у балах менше нуля, то комбінація вважається синергічною. Якщо P-значення знаходиться вище 0,05, то комбінація вважається аддитивною. [086] Мишачі моделі ксенотрансплантату використовують для in vivo оцінки ефекту комбінованого лікування інгібітору NAE препарату MLN4924 і гіпометилуючого засобу азацитидина. На фігурах 2-4 показаний об'єм пухлини залежно від часу у трьох моделях підшкірного ксенотрансплантату після лікування носієм як єдиного засобу, препаратом MLN4924 як єдиного засобу, азацитидином ("Aza") як єдиного засобу і спільним введенням (п.к.) MLN4924 і азацитидина на 1, 4, 8, 11, 15 і 18 дні у вказаних дозах. [087] У моделі підшкірного ксенотрансплантату HL-60 (ФІГ. 2), MLN4924 і азацитидин як єдиний засіб чинили незначний вплив на зростання пухлини. На відміну від цього, спільне введення доз MLN4924 і азацитидина призвело до регресії пухлини із статистичною оцінкою синергії. [088] У моделі ксенотрансплантату THP-1 (ФІГ. 3), азацитидин як єдиний засіб чинив незначний вплив на зростання пухлини, тоді як препарат MLN4924 як єдиний засіб пригнічував зростання пухлини. На відміну від цього, спільне введення доз MLN4924 і азацитидина призвело до регресії пухлини. Не дивлячись на статистичну оцінку аддитивності у цій моделі, а не синергії, фігура чітко показує перевагу комбінації: придушення зростання пухлини (один засіб) у порівнянні з регресією пухлини при застосуванні комбінації. [089] Додатковою демонстрацією покращеної активності у ТНР-1 є затримка відновлення зростання пухлини при застосуванні комбінації у порівнянні із застосуванням кожного засобу окремо. Додаткова перевага, що забезпечується лікуванням комбінацією відносно лікування одним засобом, була статистично значимою, як показано у Таблиці 3b (P-значення < 0,05). [090] У моделі підшкірного ксенотрансплантату OCI-M2 (ФІГ. 4) MLN4924 і азацитидин як єдиний засіб пригнічували зростання пухлини. На відміну від цього, спільне введення доз MLN4924 і азацитидина призвело до регресії пухлини із статистичною оцінкою синергії. Діссемінована модель ксенотрансплантату 7 [091] Суб'єкти дослідження. Пухлинні клітини лінії HL-60 (1 × 10 ) у 100 мкл середовища IMDM інокулювали у латеральну вену самкам мишей лінії CB-17 SCID (у віці 8-10 тижнів, Charles River Laboratories, Уїлмінгтон, Массачусетс) за допомогою голки 27 калібру. На 20 день після інокуляції, мишей рандомізували у групи по 10. Починаючи з 22 дня мишам вводили підшкірно носій, 180 мг/кг MLN4924, 10 мг/кг азацитидина або комбінацію 180 мг/кг MLN4924 і 10 мг/кг азацитидина, з використанням тієї ж самої схеми двічі на тиждень, яка описана у дослідженнях підшкірного ксенотрансплантату (введення дози на 22, 25, 29, 32, 36, 39 дні). За втратою маси тіла і ознаками захворювання, включаючи парез або параліч задніх кінцівок і появу пальпованих і внутрішніх твердих пухлин у мишей спостерігали, щонайменше, двічі на тиждень. Реєстрували день, на який тварина вмирає або її вбивають через важкості хвороб. Час виживаності показаний на Фігурі 5. Статистичний аналіз синергії для виживаності у диссемінованій моделі ксенотрансплантату. [092] Щоб визначити синергію відносно часу виживаності, для кожної групи лікування розраховують середній час виживаності і відповідні стандартні помилки. Синергію виживаності визначають як де виживаністьAB, виживаністьA, виживаністьB, і виживаністьктр є часом виживаності тварин у групі комбінованого лікування, групі A, групі B і контрольній групі, відповідно. Стандартну помилку синергії виживаності знаходять шляхом додавання стандартної помилки кожної з чотирьох умов у квадраті. Для визначення того, чи істотно відрізняється виживаність від нуля, використовують двосторонній Z-тест. Якщо P-значення знаходиться нижче 0,05, а синергія виживаності більше нуля, то комбінація вважається синергічною. Якщо P-значення знаходиться вище 0,05, то комбінація вважається аддитивною. 15 UA 114414 C2 5 10 [093] На Фігурі 5 показана виживаність залежно від часу у диссемінованій моделі ксенотрансплантату, в якій клітини лінії HL-60 інокулюють за допомогою внутрішньовенної ін'єкції і мишей лікують носієм, препаратом MLN4924 як єдиним засобом, азацитидином як єдиним засобом і спільним введенням п.к. MLN4924 і азацитидина починаючи на 22 день після інокуляції у вказаних дозах, з використанням тієї ж самої схеми двічі на тиждень, яка описана для досліджень на Фігурах 2-4. У диссемінованій моделі HL-60 (ФІГ. 5), MLN4924 і азацитидин, що застосовуються як єдиний засіб, обидва збільшували середній час виживаності у порівнянні з контрольною групою (8,4 дня збільшення для MLN4924 і 21,1 дня збільшення для азацитидина). Комбінація MLN4924 і азацитидина збільшувала середній час виживаності на 36,7 днів, що на 7,2 днів довше, ніж можна було б очікувати від аддитивної комбінації (ФІГ. 5). Синергія виживаності є статистично значимою. Таблиця 2a. Оцінка синергії для підшкірних ксенотрансплантатних пухлин HL60. Вид лікування Оцінка Стандартна Pсинергії помилка значення оцінки синергії MLN4924 180 мг/кг + азацитидин 15 -54,8 17,6 0,005 мг/кг 15 Оцінка Синергія Таблиця 2b. Парні порівняння груп лікування для підшкірних ксенотрансплантатних пухлин лінії HL60. Еталон Лікування dAUC P-значення для відмінності ефектів MLN4924 180 мг/кг MLN4924 180 мг/кг + азацитидин 15 118,3
ДивитисяДодаткова інформація
Автори англійськоюSmith, Peter G.
Автори російськоюСмит Питер Дж.
МПК / Мітки
МПК: A61K 31/706
Мітки: засобу, гіпометилуючого, введення, nedd8, інгібітору, ферменту, активує
Код посилання
<a href="https://ua.patents.su/24-114414-vvedennya-ingibitoru-fermentu-shho-aktivueh-nedd8-i-gipometiluyuchogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Введення інгібітору ферменту, що активує nedd8, і гіпометилуючого засобу</a>
Попередній патент: Пристрій для обробки курильного виробу
Наступний патент: Стабілізація йодовмісних сполук азотовмісними полімерами
Випадковий патент: Пристрій для герметизації порожнистих виробів типу труб