Спіроазабіциклічні гетероциклічні сполуки, фармацевтична композиція на їх основі, спосіб лікування чи профілактики (варіанти), спосіб одержання сполуки (варіанти) та проміжні спіроазабіциклічні гетероциклічні с
Номер патенту: 61964
Опубліковано: 15.12.2003
Автори: Філліпс Ейфіон, Мек Роберт, Мейкор Джон, Семас Саймон
Формула / Реферат
1. Спіроазабіциклічні гетероциклічні сполуки формули І
,
де n дорівнює 0 чи 1,
m дорівнює 0 чи 1,
p дорівнює 0 чи 1,
Х являє собою оксиген чи сульфур,
Y являє собою CH, N чи NO,
W являє собою оксиген, H2 чи F2,
A являє собою N чи C(R2),
G являє собою N чи C(R3),
D являє собою N чи C(R4)
за умови, що не більш ніж один з A, G та D являє собою нітроген, але принаймні один з Y, A, G та D являє собою нітроген чи NO,
R1 являє собою гідроген чи С1-С4-алкіл,
R2, R3 та R4 являють собою, незалежно, гідроген, галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, арил, гетероарил, ОН, ОС1-С4-алкіл, CO2R1, -CN, -NO2, -NR5R6, -CF3 чи -OSO2CF3 або R2 та R3 чи R3 та R4, відповідно, можуть разом, за участю A та G або G та D, відповідно, утворювати інше шестичленне ароматичне чи гетероароматичне кільце, яке не містить або містить до двох атомів нітрогену і є заміщеним одним чи двома такими замісниками: незалежно гідрогеном, галогеном, С1-С4-алкілом, С2-С4-алкенілом, С2-С4-алкінілом, арилом, гетероарилом, ОН, ОС1-С4-алкілом, CO2R1, -CN, -NO2, -NR5R6, -CF3 чи -OSO2CF3,
R5 та R6, незалежно, являють собою гідроген, С1-С4-алкіл, C(O)R7, C(O)NHR8, C(O)OR9, SO2R10 або можуть разом представляти (CH2)jQ(CH2)k, де Q являє собою O, S, NR11 чи зв’язок,
j дорівнює числу від 2 до 7,
k дорівнює числу від 0 до 2,
R7, R8, R9 та R10 являють собою, незалежно, С1-С4-алкіл, арил чи гетероарил,
або їх енантіомер,
або їх фармацевтично прийнятні солі.
2. Сполука за п. 1, де m дорівнює 1.
3. Сполука за будь-яким з пп. 1-2, де n дорівнює 0.
4. Сполука за будь-яким з пп. 1-3, де p дорівнює 0.
5. Сполука за будь-яким з пп. 1-4, де X являє собою оксиген.
6. Сполука за будь-яким з пп. 1-5, де A являє собою C(R2), G являє собою C(R3) і D являє собою C(R4).
7. Сполука за будь-яким з пп. 1-6, де m дорівнює 1, n дорівнює 0, p дорівнює 0, X являє собою оксиген, A являє собою C(R2), G являє собою C(R3), D являє собою C(R4).
8. Сполука за п.1, де вказаною сполукою є:
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-бромспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-фенілспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-нітроспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
1’-хлорспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(фенілкарбоксамідо)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(феніламінокарбоніламіно)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(фенілсульфоніламідо)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-аміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N-метиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N,N-диметиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N,N-діетиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N-етиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N-бензиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N-формамідоспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N-ацетамідоспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]ізохінолін],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]хінолін],
5’-етенілспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(Е)-(фенілетеніл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(4-морфоліно)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(1-азетидиніл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(Е)-(2-(4-піридил)етеніл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(Е)-(2-(2-піридил)етеніл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(2-триметилсилілетиніл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-етинілспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(2-фурил)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-(3-піридил)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-метилспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин-5’-карбонітрил],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин-5’-карбоксамід],
5’-N’-(3-хлорфеніл)уреїдоаміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
5’-N’-(2-нітрофеніл)уреїдоаміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-хлорспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-метоксиспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-фенілтіоспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-(N-2-аміноетил)аміноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-феніламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-метиламіноспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-(4-N-метилпіперазин-1-іл)спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
4’-хлорспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-с]піридин],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-c]піридин],
6’-фторспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин-6’-карбонітрил],
6’-хлорспіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин],
або її енантіомер чи фармацевтично прийнятна сіль.
9. Сполука за будь-яким з пп. 1-7, де Y є NO.
10. Сполука за п. 9, яка є спіро[1-азабіцикло[2.2.2]октан-3,2’-(3’Н)-фуро[2,3-b]піридин-7’-оксидом] або її фармацевтично прийнятна сіль чи її енантіомер.
11. Сполука за будь-яким з пп. 1-10 для використання у терапії.
12. Сполука за будь-яким з пп. 1-10 для одержання лікарського засобу для лікування чи профілактики хвороб чи станів людини, при яких є корисною активація a7-нікотинового рецептора.
13. Сполука за будь-яким з пп. 1-10 для одержання лікарського засобу для лікування чи профілактики психотичних порушень чи порушень типу зниження інтелектуальної діяльності.
14. Сполука за п. 13, де стан чи порушення є хворобою Альцгеймера, розладом навчання, порушенням пізнавальної здатності, розладом уваги, втратою пам’яті, порушенням типу гіперактивності, яке виявляється у розладі уваги.
15. Сполука за п. 13, де порушення є станом страху, шизофренією або манією чи маніакальною депресією.
16. Сполука за п. 13, де порушення є хворобою Паркінсона, хворобою Гентингтона, хворобою Туретта або нейродегенеративними порушеннями, при яких спостерігається втрата холінергічних синапсів.
17. Сполука за будь-яким з пп. 1-10 для одержання лікарського засобу для лікування чи профілактики розладу нормального циркадного ритму, стану після припинення куріння, пристрасті до нікотину, включаючи пристрасть, яка є результатом дії продуктів, що містять нікотин, болю та неспецифічного виразкового коліту.
18. Фармацевтична композиція, яка містить сполуку за будь-яким одним з пп. 1-10 у суміші з інертним фармацевтично прийнятним розріджувачем чи носієм.
19. Фармацевтична композиція за п. 18 для використання при лікуванні чи профілактиці хвороб чи станів людини, при яких є корисною активація a7-нікотинового рецептора.
20. Фармацевтична композиція за п. 18 для використання при лікуванні чи профілактиці психотичних порушень або порушень типу зниження інтелектуальної діяльності.
21. Фармацевтична композиція за п. 18 для використання при лікуванні чи профілактиці хвороби Альцгеймера, розладу здатності (дефіциту) до навчання, порушення пізнавальної здатності, розладу уваги, втрати пам’яті, порушення типу гіперактивності, яке виявляється у розладі уваги, стану страху, шизофренії або манії чи маніакальної депресії, хвороби Паркінсона, хвороби Гентингтона, хвороби Туретта, нейродегенеративних порушень, при яких спостерігається втрата холінергічних синапсів, розладу нормального циркадного ритму, стану після припинення куріння, пристрасті до нікотину, включаючи пристрасть, яка є результатом дії продуктів, що містять нікотин, болю та неспецифічного виразкового коліту.
22. Спосіб лікування чи профілактики хвороб чи станів людини, при яких є корисною активація 7-нікотинового рецептора, при якому вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10.
23. Спосіб лікування чи профілактики психотичних порушень чи порушень типу зниження інтелектуальної діяльності, при якому вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10.
24. Спосіб за п. 23, де порушення є хворобою Альцгеймера, розладом здатності до навчання, порушенням пізнавальної здатності, розладом уваги, втратою пам’яті чи порушенням типу гіперактивності, яке виявляється у розладі уваги.
25. Спосіб за п. 23, де порушення є хворобою Паркінсона, хворобою Гентингтона, хворобою Туретта або нейродегенеративними порушеннями, при яких є втрата холінергічних синапсів.
26. Спосіб за п. 23, де порушення є станом страху, шизофренією або манією чи маніакальною депресією.
27. Спосіб лікування чи профілактики розладу нормального циркадного ритму, стану після припинення куріння, нікотинової аддикції, болю та неспецифічного виразкового коліту, при якому вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10.
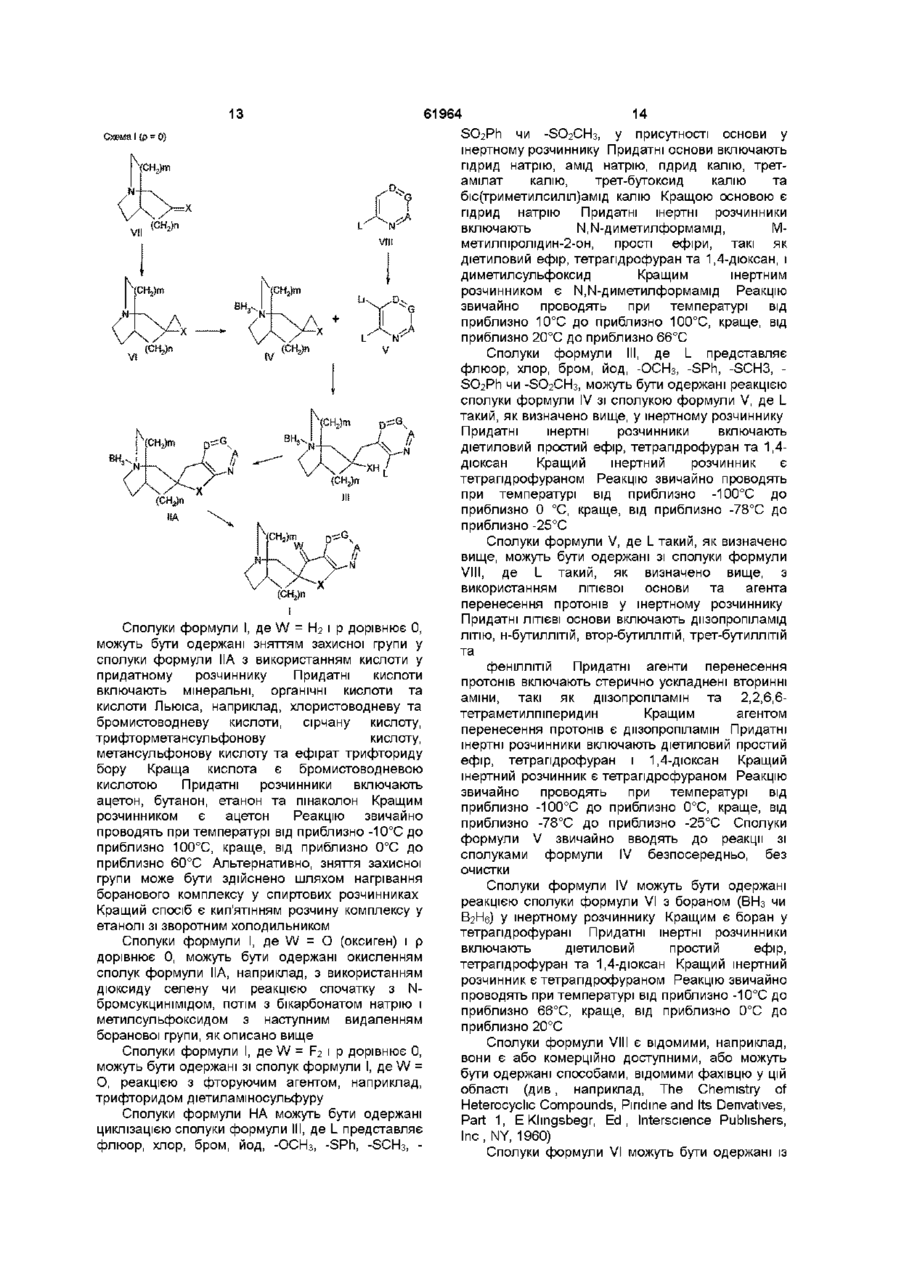
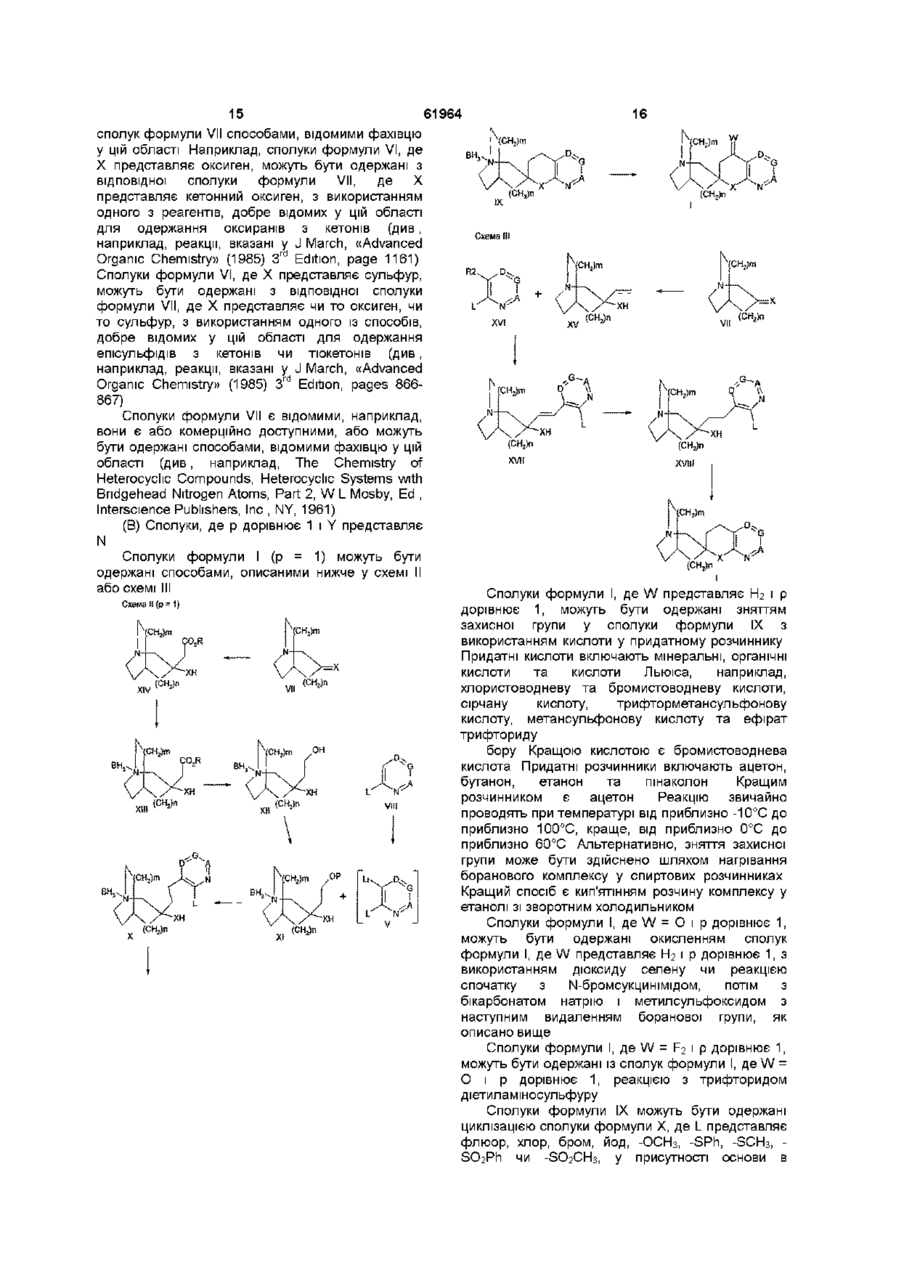
28. Спосіб одержання сполуки формули І за будь-яким одним з пп. 1-8, де Y являє собою N, її енантіомера чи фармацевтично прийнятної солі, при якому здійснюють:
видалення боранового комплексу у сполуці формули ІІ з використанням кислоти у придатному розчиннику чи нагріванням комплексу у спиртовому розчиннику
і коли W = F2, наступну взаємодію з трифторидом диметиламіносульфуру і, де бажано чи необхідно, перетворення одержуваної сполуки формули І або її енантіомера чи її кислотно-адитивної солі на її фармацевтично прийнятну кислотно-адитивну сіль чи перетворення одержуваної рацемічної суміші сполуки формули І на її енантіомер.
29. Спосіб одержання сполуки формули І за п. 1, де R1 являє собою гідроксид і Y являє собою N, перегрупуванням сполуки формули І за п.1, де Y являє собою NO, з використанням ангідриду карбонової кислоти у придатному розчиннику.
30. Спосіб одержання сполуки формули І за п. 1, де R1 являє собою хлор і Y являє собою N, перегрупуванням сполуки формули І за п. 1, де Y являє собою NO, з використанням хлоруючого джерела, такого як оксихлорид фосфору, у придатному розчиннику.
31. Спосіб одержання сполуки формули І за п. 1, де R1 являє собою ціано і Y являє собою N, перегрупуванням сполуки формули І за п.1, де Y являє собою NO, з використанням джерела ціаніду, такого як триметилсилілціанід, у придатному розчиннику.
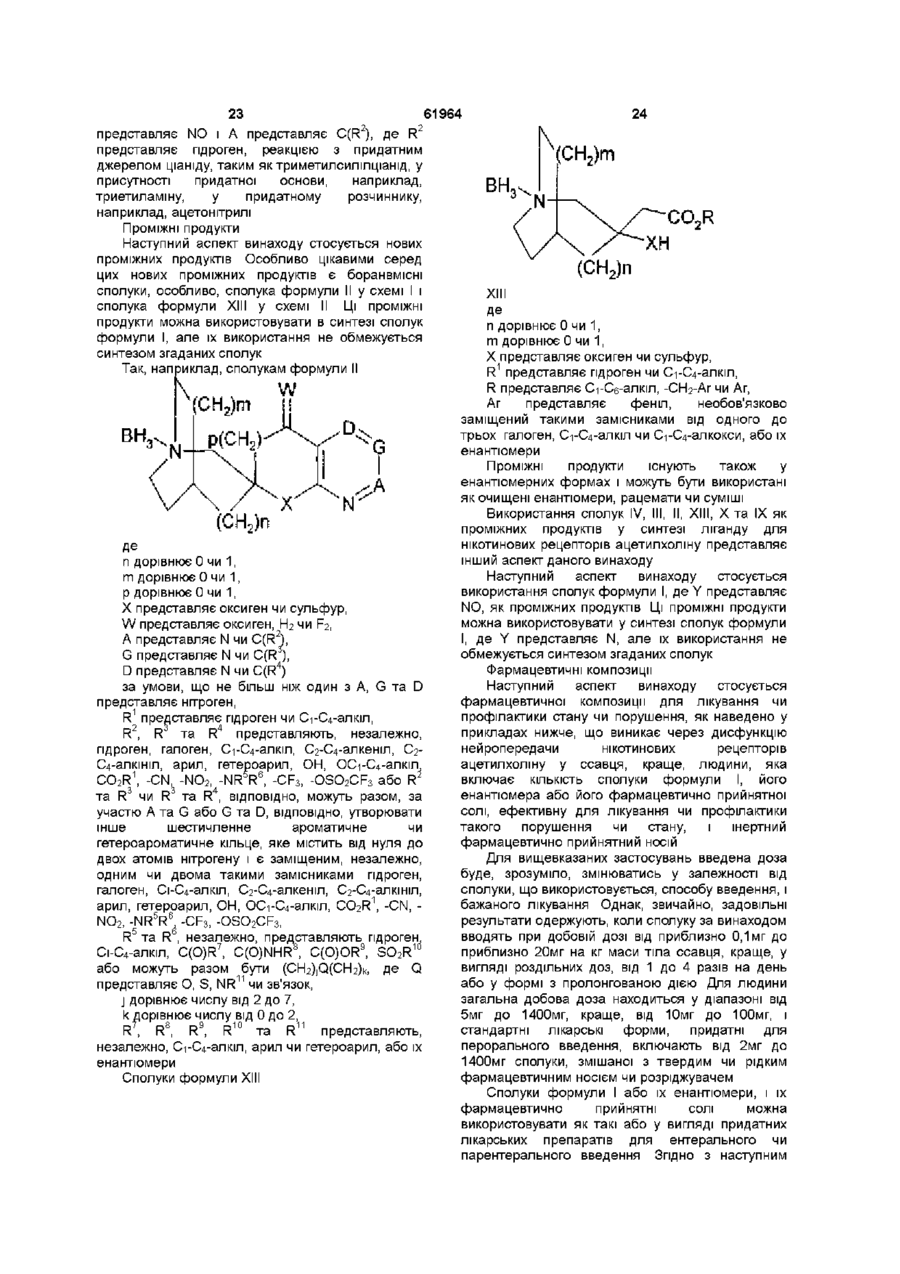
32. Проміжні спіроазабіциклічні гетероциклічні сполуки формули
,
де n дорівнює 0 чи 1, m дорівнює 0 чи 1, p дорівнює 0 чи 1,
Х являє собою оксиген чи сульфур,
W являє собою оксиген, H2 чи F2,
A являє собою N чи C(R2),
G являє собою N чи C(R3),
D являє собою N чи C(R4)
за умови, що не більш ніж один з A, G та D являє собою нітроген,
R1 являє собою гідроген чи С1-С4-алкіл,
R2, R3 та R4 являють собою, незалежно, гідроген, галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, арил, гетероарил, ОН, ОС1-С4-алкіл, CO2R1, -CN, -NO2, -NR5R6, -CF3, -OSO2CF3, або R2 та R3 чи R3 та R4, відповідно, можуть разом, за участю A та G або G та D, відповідно, утворювати інше шестичленне ароматичне чи гетероароматичне кільце, яке містить від нуля до двох атомів нітрогену і є заміщеним одним чи двома такими замісниками: незалежно, гідроген, галоген, С1-С4-алкіл, С2-С4-алкеніл, С2-С4-алкініл, арил, гетероарил, ОН, ОС1-С4-алкіл,
CО2R1, -CN, -NO2, -NR5R6, -CF3, -OSO2CF3,
R5 та R6, незалежно, являють собою гідроген, С1-С4-алкіл, C(O)R7, C(O)NHR8, C(O)OR9, SO2R10 або можуть разом бути (CH2)jQ(CH2)k, де Q являє собою O, S, NR11 чи зв’язок,
j дорівнює числу від 2 до 7,
k дорівнює числу від 0 до 2,
R7, R8, R9, R10 та R11 являють собою, незалежно, С1-С4-алкіл, арил чи гетероарил,
або їх енантіомер.
Текст
1 Спіроазабіциклічні гетероциклічні сполуки формули І (CH2)n X Y де п дорівнює 0 чи 1, m дорівнює 0 чи 1, р дорівнює 0 чи 1, X являє собою оксиген чи сульфур, Y являє собою СН, N чи NO, W являє собою оксиген, ЬІ2 чи F2, А являє собою N чи C(R2V G являє собою N чи C(R ), D являє собою N чи C(R 4 ) за умови, що не більш ніж один з A, G та D являє собою нітроген, але принаймні один з Y, A, G та D являє собою нітроген чи NO, R1 являє собою гідроген чи Сі-С4-алкіл, R2, R3 та R4 являють собою, незалежно, гідроген, галоген, Сі-С4-алкіл, С2-С4-алкеніл, С2-С4-алкшіл, арил, гетероарил, ОН, ОСі-С4-алкіл, CO2R1, -CN, NO2, -NR5R6, -CF3 чи -OSO2CF3 або R2 та R3 чи R3 та R , ВІДПОВІДНО, можуть разом, за участю А та G або G та D, ВІДПОВІДНО, утворювати інше шестичленне ароматичне чи гетероароматичне кільце, яке не містить або містить до двох атомів нітрогену і є заміщеним одним чи двома такими замісниками незалежно гідрогеном, галогеном, Сі-С4-алкілом, С2-С4-алкенілом, С2-С4-алкшілом, арилом, гетероарилом, ОН, ОСі-С4-алкілом, CO?R1, -CN, -NO?, -NR 5 R 6 , -CF 3 чи -OSO?CF з, RD та RD, незалежно, являють собою гідроген, d С 4 -алкіл, C(O)R 7 , C(O)NHR 8 , C(O)OR 9 , SO 2 R 1 0 або можуть разом представляти (CH2)jQ(CH2)k, де Q являє собою О, S, NR 1 1 чи зв'язок, j дорівнює числу від 2 до 7, k дорівнює числу від 0 до 2, R , R8, R9 та R 10 являють собою, незалежно, С1-С4алкіл, арил чи гетероарил, або їх енантюмер, або їх фармацевтично прийнятні солі 2 Сполука за п 1, де m дорівнює 1 3 Сполука за будь-яким з пп 1-2, де п дорівнює 0 4 Сполука за будь-яким з пп 1 -3, де р дорівнює 0 5 Сполука за будь-яким з пп 1-4, де X являє собою оксиген 6 Сполука за будь-яким з пп 1-5, де А являє собою C(R 2 ), G являє собою C(R 3 ) і D являє собою 4 C(R ) 7 Сполука за будь-яким з пп 1-6, де m дорівнює 1, п дорівнює 0, р дорівнює 0, X являє собою оксиген, А являє собою C(R 2 ), G являє собою C(R 3 ), D являє собою C(R 4 ) 8 Сполука за п 1, де вказаною сполукою є спіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин], 5'-бромспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин], 5'-фенілспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин], 5'-нітроспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин], 1'-хлорспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин], 5'-(фенілкарбоксамідо)спіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин], О л £2 " ^ f (О O> ^™ 10 карбонатом натрію і екстрагують хлороформом (3x15мл) Об'єднані екстракти сушать (MgSO4), фільтрують і упарюють при зниженому тиску, одержуючи вказану у заголовку сполуку (110мг, 0,37 ммоль, 81%) у вигляді не зовсім білого твердого продукту МС з електророзпиленням 295 ([МН] + , з 7 9 Вг, 100), 297 ([МН]+, з 8 1 Вг, 98) Приклад 2В (Р)-(-)-5'-Бромспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] Енантюмер, (R)-(-)спіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (1,95г, 9 ммоль), оброблений таким самим способом, як описано у прикладі 2А, дає вказану у заголовку сполуку (1,77г, 6 ммоль, 67%) ([а] 2 3 = -45,5° (с = 1, МеОН)) 34 33 61964 Приклад 3 дає вказану у заголовку сполуку (7,75г, 29,7 ммоль, 99%) МС з електророзпиленням (m/z, 5'-Фенілспіро[1-азабіцикло[2 2 2]октан-3,2'+ відносна інтенсивність) 262 ([МН] , 100) (3'Н)-фуро[2,3-Ь]піридин] В атмосфері азоту 5'бромспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)Приклад 5 фуро[2,3-Ь]піридин] (118мг, 0,4 ммоль), СпіроИ -азабіцикло[2 2 2]октан-3,2'-(3'Н)фенілборонову кислоту (54мг, 0,443 ммоль) і фуро[2,3-Ь]хшолш] тетракіс(трифенілфосфш)паладій(0) (11 мг, 2,3 Вказану у заголовку сполуку одержують мол %) перемішують у розчині 1,2-диметоксіетану методикою, аналогічною методиці, описаній у (Змл) та етанолу (0,75мл), що містить 2М водний прикладі 1, з 2-хлорхінолшу (0,99г, 6,06 ммоль) та карбонат натрію (0,65мл, 1,3 ммоль) Суміш комплексу спіро[1-азабіцикло[2 2 2]октан-3,2'нагрівають при КИП'ЯТІННІ ЗІ зворотним оксиран]-І\І-боран (0,31 г, 2,0 ммоль), одержуючи холодильником протягом 18 годин Реакційну вказану у заголовку сполуку (0,135г) у вигляді суміш потім упарюють при зниженому тиску, білого порошку, МС з електророзпиленням 267 + залишок розчиняють у хлороформі (15мл) і [МН] екстракт промивають насиченим водним Ці два енантюмери розділяють на колонці карбонатом натрію (5мл) Водний шар екстрагують Chiral OD шляхом елюювання з градієнтом суміші хлороформом (2x15мл), і органічні шари 8-10% ЕЮН/гексан та УФ-детектування Перший об'єднують, сушать (MgSC^), фільтрують і енантюмер 100% хіральна чистота за даними РХ, упарюють при зниженому тиску Очистка флешRt = 12,32 хвилин, [a] D при 23°С в ЕЮН = +47,9° хроматографією скрізь силікагель з елююванням Другий енантюмер 99,4% хіральна чистота, Rt = сумішшю насичений аміаком хлороформом етанол 17,84 хвилин, [a] D = -48,5° (від 95 5 до 9%1) дає вказану у заголовку сполуку Приклад 6 (80мг, 0,274 ммоль, 68%) у вигляді рудувато1'-Хлорспіро[1-азабіцикло[2 2 2]октан-3,2'коричневого твердого продукту МС з (3'Н)-фуро[2,3-Ь]ізохінолш] Вказану у заголовку електророзпиленням 293 ([МН]+, 100) сполуку одержують методикою, аналогічною Приклад 4А методиці, описаній у прикладі 1, з 1,35'-НітроспІро[1-азабіцикло[2 2 2]октан-3,2'дихлорізохшоліну (2,41г 12,2 ммоль) та комплексу (3'Н)-фуро[2,3-Ь]піридин] Суміш спіро[1спіро[1-азабіцикло[2 2 2]октан-3,2'-оксиран]-І\Іазабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3боран (0,62г, 4,05 ммоль), одержуючи 0,86г Ь]піридину] (325мг, 1,5 ммоль) та димлячої азотної комплексу 1'-хлорспіро[1-азабіцикло[2 2 2]октанкислоти (0,27мл, 5,74 ммоль) у сірчаній кислоті 3,2'-(3'Н)-фуро[2,3-Ь]ізохінолш]-М-боран, МС з (0,75мл) нагрівають при температурі від 70°С до електророзпиленням 314 [МН]+ Видалення 80°С протягом 24 годин В'язкий розчин, що боранової групи у 65мг N-боранового комплексу одержують, виливають на 15г льоду і роблять дає ЗОмг вказаної у заголовку сполуки, МС з основним до рН > 10 твердим карбонатом натрію електророзпиленням 301 [МН]+ Суміш, що одержують, екстрагують хлороформом Приклад 7 (4x15мл),сушать (MgSC^), фільтрують і упарюють СпіроИ -азабіцикло[2 2 2]октан-3,2'-(3'Н)при зниженому тиску Очистка флешфуро[2,3-Ь]ізохшолш] Захищений бораном хлорид хроматографією скрізь силікагель з елююванням прикладу 6 (0,3г або 0,96 ммоль) суспендують у сумішшю насичений аміаком хлороформом етанол суміші льодяної оцтової кислоти (6,0мл) та води (95 5) дає вказану у заголовку сполуку (200мг, (0,5мл) Суспензію поміщають до атмосфери азоту 0,765 ммоль, 51%) у вигляді блідо-жовтого і додають цинковий пил (150мг) Реакційну суміш твердого продукту МС з електророзпиленням 262 перемішують при 70°С протягом 5 годин + ([МН] , 100) Реакційну суміш залишають для охолодження і потім виливають до насиченого ЫаНСОз Додають Приклад 4В достатню КІЛЬКІСТЬ водного ЫаНСОз для (Р)-(-)-5'-Нітроспіро[1-азабіцикло[2 2 2]октандосягнення основного значення рН, і продукти 3,2'-(3'Н)-фуро[2,3-Ь]піридин] (R)-(-)-Cmpo[1екстрагують трьома порціями хлороформу азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Об'єднаний екстракт у хлороформі сушать Ь]піридин] (3,03г, 14 ммоль) розчиняють у (MgSO4), фільтрують і упарюють у вакуумі концентрованій сірчаній кислоті (7мл) при 0-5°С, Продукти двох ДОСЛІДІВ об'єднують для очистки на протягом 10 хвилин додають димлячу азотну колонці з силікагелем, використовуючи градієнт кислоту (3,3мл, 70,2 ммоль), суміш перемішують від 2 1 суміші гексан//етилацетат до 100% протягом 1 години і нагрівають при 65-70°С етилацетату Сполука, що елююється швидше, є протягом 24 годин Охолоджують, виливають на комплексом спіро[1-азабіцикло[2 2 2]октан-3,2'лід (200мг), додають ЗООмл води, роблять (3'Н)-фуро[2,3-Ь]ізохінолш]-г\І-боран, і сполука, що основною до рН 10 твердим карбонатом калію, елююється повільніше, є вказаною у заголовку перемішують протягом 1 години, фільтрують і сполукою Вихід 100% МС з ХІМІЧНОЮ іонізацією сушать тверду вказану у заголовку сполуку (3,6г, 279 [МН]+-ЬІ2 для N-боранового комплексу і 267 13,8 ммоль, 98%) МС з електророзпиленням (m/z, + [МН]+ для вказаної у заголовку сполуки відносна інтенсивність) 262 ([МН] , 100) Видалення боранової групи за умов прикладу 1 з Приклад 4С наступною флеш-хроматографією дає вказану у (3)-(+)-5'-Нітроспіро[1-азабіцикло[2 2 2]октанзаголовку сполуку у вигляді коричневого 3,2'-(3'Н)-фуро[2,3-Ь]піридин] Енантюмер, (S)напівтвердого продукту МС з ХІМІЧНОЮ іонізацією нітроспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)267 [МН]+ фуро[2,3-Ь]піридин] (6,5г, ЗО ммоль), оброблений таким самим способом, як описано у прикладі 4В, Приклад 8А 36 35 61964 5'-Амшоспіро[1-азабіцикло[2 2 2]октан-3,2'хроматографією скрізь силікагель з елююванням (3'Н)-фуро[2,3-Ь]піридин] сумішшю насичений аміаком хлороформом етанол (9 1) дає вказану у заголовку сполуку (125мг, 0,372 Суміш 5'-нітроспіро[1-азабіцикло[2 2 2]октанммоль, 75%) у вигляді жовтого твердого продукту 3,2'-(3'Н)-фуро[2,3-Ь]піридину] (1,4г, 5,36 ммоль) та МС з електророзпиленням (m/z, відносна 10% паладій на вугіллі (48% вологи, 270мг) у + інтенсивність) 336 ([МН] , 100) метанолі (90мл) гідрують протягом 1 години при тиску 345кПа (50psi) водню Каталізатор Приклад 10 відокремлюють фільтруванням скрізь подушку 5'-Феніламінокарбоніламшоспіро[1целіту і розчинник упарюють при зниженому тиску, азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3одержуючи амін (1,2г, 5,25 ммоль, 98%) у вигляді Ь]піридин] рудувато-коричневого твердого продукту МС з В атмосфері азоту фенілізоціанат (0,056мл, електророзпиленням (m/z, відносна інтенсивність) 0,515 ммоль) додають до суспензії 5'-амшоспіро[1+ 232([МН] , 100) азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (119мг, 0,514 ммоль) у безводному Вказану у заголовку сполуку розділяють на тетрапдрофурані (5мл) і перемішують протягом 12 (RJ-та (З)-енантюмери таким способом годин Розчинник упарюють при зниженому тиску і 150мг вказаної у заголовку сполуки розділяють залишок очищають флеш-хроматографією скрізь хіральною ВЕРХ з використанням колонки силікагель з елююванням сумішшю насичений 2смх25см CHIRACEL-OD у системі препаративної аміаком хлороформ/метанол (92,5 7,5), хроматографії Waters Delta Prep 4000 одержуючи вказану у заголовку сполуку (155мг, [гексан//етанол (від 85 15 до 8 2)] при швидкості 0,442 ммоль, 86%) у вигляді не зовсім білого потоку 20мл//хв Це дає 52мг (S)-emMepy ([a] 22 = твердого продукту МС з електророзпиленням +62° (с = 1, етанол) і 52мг (RJ-епімеру ([а] 23 = -64° (m/z, відносна інтенсивність) 351 ([МН]+, 100) (с = 1, етанол) Приклад 11 Приклад 8В 5'-Фенілсульфоніламідоспіро[1 (R)-(-)-5'-AMiHocmpo[1 -азабіцикло[2 2 2]октаназабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,33,2'-(3'Н)-фуро[2,3-Ь]піридин] Енантюмер, (R)-(-)-5'Ь]піридин] нітроспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)В атмосфері азоту бензолсульфонілхлорид фуро[2,3-Ь]піридин] (3,8г, 13,3 ммоль), оброблений (0,07мл, 0,55 ммоль) додають до розчину 5'таким самим способом, як описано у прикладі 8А, і амшоспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)очищений флеш-хроматографією (елюювання фуро[2,3-Ь]піридину] (115 мг, 0,5 ммоль) у сумішшю насичений аміаком хлороформ/метанол, безводному піридині і перемішують протягом 4 від 95 5 до 85 15), дає вказану у заголовку сполуку годин Розчинник упарюють при високому вакуумі, (2,5г, 10,8 ммоль, 81%) МС з електророзпиленням залишок розподіляють між насиченим водним (m/z, відносна інтенсивність) 232 ([МН]+, 100) карбонатом натрію (2мл) і хлороформом (Юмл), Приклад 8С розділяють і водну фазу екстрагують (S)-(+)-5'-AMiHocmpo[1 -азабіцикло[2 2 2]октанхлороформом (2х5мл) Об'єднані органічні шари 3,2'-(3'Н)-фуро[2,3-Ь]піридин] Енантюмер, (S)-(+)сушать (МдБОД розчинник упарюють при 5'-нітроспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)зниженому тиску і залишок знов упарюють з фуро[2,3-Ь]піридин] (6,85г, 26,2 ммоль), етанолу (3x1 Омл) при зниженому тиску Це дає оброблений таким самим способом, як описано у вказану у заголовку сполуку (179мг, 0,5 ммоль, прикладі 8А, у насиченому аміаком метанолі, дає 100%) у вигляді жовтого твердого продукту МС з вказану у заголовку сполуку (5,55г, 24 ммоль, електророзпиленням (m/z, відносна інтенсивність) 92%) МС з електророзпиленням (m/z, відносна 372([МН] + , 100) інтенсивність) 262 ([МН]+, 100) Приклад 9 5'-Фенілкарбоксамідоспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] В атмосфері азоту бензойну кислоту (67мг, 0,55 ммоль), тетрафторборат О-(1 Н-бензотриазол1-іл)-М,г\І,г\Г,І\Г-тетраметилуронію («TBTU», 176мг, 0,55 ммоль), гідрат 1-пдроксибензотриазолу («НОВТ», 78мг, 0,55 ммоль) та дмзопропілетиламін (0,193мл, 1,1 ммоль) змішують у безводному N,Nдиметилформаміді (8мл) і перемішують протягом 10 хвилин 5'-Амшоспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] (115мг, 0,5 ммоль) додають у твердій формі у вигляді однієї порції і перемішування продовжують протягом 3 днів Розчинник упарюють при високому вакуумі і при нагріванні до 55°С і залишок розподіляють між насиченим водним карбонатом натрію (2мл) і дихлорметаном (Юмл) Після розділення водну фазу екстрагують дихлорметаном (2х5мл) Органічні шари об'єднують, сушать (MgSC^) і упарюють при зниженому тиску Очистка флеш Приклад 12 5'-(г\І-Метиламіно)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] В атмосфері азоту натрій (50мг, 2,17 ммоль) повільно додають (реакція екзотермічна) до метанолу (1 мл) і перемішують протягом 1 години Додають 5'-амшоспіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (115мг, 0,5 ммоль) та параформальдегід (35мг, 1,17 ммоль) і перемішують протягом 16 годин Реакційну суміш нагрівають при 50°С протягом 4 годин, додають боропдрид натрію (53мг, 1,4 ммоль) і нагрівають при КИП'ЯТІННІ ЗІ зворотним холодильником протягом 1 години Потім додають 1Н водний гідроксид калію (0,4мл) і кип'ятіння зі зворотним холодильником продовжують протягом більше 2 годин Розчинник упарюють при зниженому тиску, залишок розподіляють між водою (1 мл) і хлороформом (4мл), розділяють і водну фазу екстрагують хлороформом (2х4мл) Об'єднані органічні шари промивають насиченим сольовим 37 61964 розчином (1мл), сушать (MgSO4), упарюють при зниженому тиску і очищають флешхроматографією скрізь силікагель (елюювання сумішшю насичений аміаком хлороформ/Ллетанол (95 5), одержуючи вказану у заголовку сполуку (78мг, 0,32 ммоль, 64%) у вигляді не зовсім білого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 246 ([МН] + , 100) Приклад 13А 5'-(г\І,г\І-Диметаламіно)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Ціаноборопдрид натрію (63мг, 1 ммоль) розчиняють у метанолі (2,5мл), додають безводний хлорид цинку (69мг, 0,5 ммоль), перемішують протягом ЗО хвилин, розчин, що одержують, додають до розчину 5'-амшоспіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (115мг, 0,5 ммоль) та 37% водного формальдегіду (0,12мг, 1,6 ммоль) у метанолі (2,5 мл) і перемішують протягом 20 годин Виливають до 1Н водного гідроксиду калію (Юмл), перемішують протягом 1 години, упарюють при зниженому тиску і екстрагують водний залишок хлороформом (4x1 Омл) Об'єднані екстракти сушать (MgSO4), упарюють при зниженому тиску і очищають флеш-хроматографією скрізь силікагель (елюювання сумішшю насичений аміаком хлороформ//метанол, 97,5 2,5), одержуючи вказану у заголовку сполуку (85мг, 0,33 ммоль, 66%) у вигляді не зовсім білого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 260 ([МН] + , 100) Приклад 13В (Р)-(-)-5'-(г\І,г\І-Диметиламіно)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Енантюмер, (R)-(-)-5'-aMiHocmpo[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (231 мг, 1 ммоль), оброблений таким самим способом, як описано у прикладі 13А, дає вказану у заголовку сполуку (178мг, 0,69 ммоль, 69%) МС з електророзпиленням (m/z, відносна інтенсивність) 260 ([МН] + , 100) Приклад 14А (3)-(+)-5'-(Е)-(Фенілетеніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Розчин (S)-(+)-5 -бромспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (150мг, 0,51 ммоль), стиролу (0,07мл, 0,61 ммоль), ацетату паладію(ІІ) (1,2мг, 0,0053 ммоль), три-о-толілфосфіну (6,4мг, 0,021 ммоль) та триетиламшу (0,5мл, 3,6 ммоль) у безводному ацетонітрилі (0 5мл) у ТОВСТОСТІННІЙ нарізній скляній трубці, яка містить магнітний стрижень, що перемішує, продувають аргоном і герметизують тефлоновою пробкою та FETFE О-кільцем Суміш перемішують і нагрівають при 100°С протягом 2 годин, охолоджують до кімнатної температури, розчиняють у хлороформі (Юмл), промивають насиченим водним карбонатом натрію (1мл), сушать (MgSC^) і упарюють при зниженому тиску Перекристалізація з етилацетату дає вказану у заголовку сполуку (90мг, 0,28 ммоль, 55%) у вигляді світло-рудувато-коричневого твердого 38 продукту МС з електророзпиленням (m/z, відносна інтенсивність) 319 ([МН] + , 100) Приклад 14В (Р)-(-)-5'-(Е)-(Фенілетеніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Обробка енантюмера, (R)-(-)-5'-6poMcmpo[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (295мг, 1 ммоль), таким самим способом, як описано у прикладі 14А, і очистка флеш-хроматографією (елюювання сумішшю насичений аміаком хлороформ//метанол, від 98 2 до 96 4) дає вказану у заголовку сполуку (132мг, 0,41 ммоль, 41%) МС з електророзпиленням (m/z, відносна інтенсивність) 319 ([МН] + , 100) Приклад 15А (3)-(+)-5'-(4-Морфолшо)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] трет-Бутоксид натрію (56,6мг, 0,59 ммоль), трис(дибензиліденацетон)-дипаладій (15,4мг, 0,017 ммоль) та 2,2'-біс(дифенілфосфшо)-1,1'динафтил (21 мг, 0,034 ммоль) змішують у ТОВСТОСТІННІЙ нарізній скляній трубці, яка містить магнітний стрижень, що перемішує, і продувають аргоном Додають (S)-(+)-5'-6poMcnipo[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (130мг, 0,44 ммоль), морфолін (0,066мл, 0,76 ммоль) і безводний тетрапдрофуран (Змл), герметизують тефлоновою пробкою та FETFE-Oкільцем, перемішують і нагрівають при 100°С протягом 72 годин Суміш охолоджують до кімнатної температури, розчиняють у хлороформі (25мл), промивають насиченим сольовим розчином (Зх2мл), сушать (МдБОД упарюють при зниженому тиску, очищають флешхроматографією скрізь силікагель (елюювання сумішшю насичений аміаком хлороформ//метанол, 4 1) і перекристалізовують з етилацетату, одержуючи вказану у заголовку сполуку (35мг, 0,12 ммоль, 26%) у вигляді рудувато-коричневого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 302 ([МН] + , 100) Приклад 15В (Р)-(-)-5'-(4-Морфолшо)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Обробка енантюмера, (R)-(-)-5'-6poMcmpo[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (580мг, 1,965 ммоль), таким самим способом, як описано у прикладі 15А, дає вказану у заголовку сполуку (187мг, 0,62 ммоль, 32%) МС з електророзпиленням (m/z, відносна інтенсивність) 302 ([МН] + , 100) Приклад 16 (Р)-(-)-5'-(1-Азетидиніл)спіро[1азабіциісло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (Р)-(-)-5'-Бромспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] (295мг, 1 ммоль), азетидин (0,101мл, 1,5 ммоль), трет-бутоксид натрію (135мг, 1,4 ммоль), трис(дибензиліденацетон)дипаладій (46мг, 0,05 ммоль), 2,2'-біс(дифенілфосфіно)-1,1'-бшафтил (62мг, 0,1 ммоль) та безводний тетрапдрофуран (9мл) змішують у ТОВСТОСТІННІЙ нарізній скляній 40 39 61964 трубці, яка містить магнітний стрижень, що нарізній скляній трубці, яка містить магнітний перемішує, продувають аргоном і герметизують стрижень, що перемішує, продувають аргоном і тефлоновою пробкою та FETFE-O-кільцем Суміш герметизують тефлоновою пробкою та FETFE-Oперемішують і нагрівають при 75°С протягом 4 кільцем Суміш перемішують і нагрівають при годин, охолоджують до кімнатної температури, 100°С протягом 4 годин, охолоджують до кімнатної розчиняють у хлороформі (20мл), промивають температури, розчиняють у хлороформі (25мл), насиченим сольовим розчином (ЗхЮмл), сушать промивають насиченим водним карбонатом натрію (MgSO4), упарюють при зниженому тиску і (2мл), сушать (MgSO4) і упарюють при зниженому очищають флеш-хроматографією скрізь силікагель тиску Очистка флеш-хроматографією скрізь (елюювання сумішшю насичений аміаком силікагель (елюювання сумішшю насичений хлороформ//метанол, 95 5), одержуючи вказану у аміаком простий ефір//метанол, 9 1) дає вказану у заголовку сполуку (230мг, 0,085 ммоль, 85%) у заголовку сполуку (280мг, 0,90 ммоль, 90%) МС з вигляді світло-рудувато-коричневого твердого електророзпиленням (m/z, відносна інтенсивність) + продукту МС з ХІМІЧНОЮ іонізацією (m/z, відносна 313([МН] , ЗО) + інтенсивність) 272 ([МН] , 56) Приклад 20 Приклад 17 (Р)-(-)-5'-(2-(4-Піридил)етеніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (Р)-(-)-5'-Бромспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] (295мг, 1 ммоль), 4вшілпіридин (0,135мл, 1,25 ммоль), ацетат паладію(ІІ) (7,2мг, 0,032 ммоль), три-отолілфосфш (38,7мг, 0,127 ммоль) та триетиламш (0,5мл, 3,6 ммоль) у безводному ацетонітрилі (0,5мл) змішують у ТОВСТОСТІННІЙ нарізній скляній трубці, яка містить магнітний стрижень, що перемішує, продувають аргоном і герметизують тефлоновою пробкою та FETFE-O-кільцем Суміш перемішують і нагрівають при температурі від 100°С до 105°С протягом 48 годин, охолоджують до кімнатної температури, розчиняють у хлороформі (25мл), промивають насиченим водним карбонатом натрію (2мл), сушать (MgSC^) і упарюють при зниженому тиску Очистка флешхроматографією скрізь силікагель (елюювання сумішшю насичений аміаком хлороформ/метанол, 95 5) з наступною перекристалізацією з ацетону дає вказану у заголовку сполуку (230мг, 0,72 ммоль, 72%) МС з електророзпиленням (m/z, відносна інтенсивність) 320 ([МН]+, 100) Приклад 18 (Р)-(-)-5'-(2-(2-Піридил)етеніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (Р)-(-)-5'-Бромспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] (150мг, 0,5 ммоль) обробляють 2-ВІНІЛ піридином (0,070мл, 0,65 ммоль) таким самим способом, як описано у прикладі 16 Очистка флеш-хроматографією скрізь силікагель (елюювання сумішшю насичений аміаком простий ефір//метанол, від 95 5 до 9 1) з наступною перекристалізацією з ацетонітрилу дає вказану у заголовку сполуку (37мг, 0,12 ммоль, 23%) МС з електророзпиленням (m/z, відносна інтенсивність) 320 ([МН]+, 100) Приклад 19 (Р)-(-)-5'-(2-Триметилсилілетеніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (R)-(-)-5'-BpoMcmpo[1 -азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] (295мг, 1 ммоль), триметилсилілацетилен (0,355мл, 2,5 ммоль), тетракіс(трифенілфосфш)паладій (230мг, 0,2 ммоль), триетиламш (2мл) та безводний ацетонітрил (2мл) змішують у ТОВСТОСТІННІЙ (Р)-(-)-5'-Етинілспіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] В атмосфері аргону 1М розчин фториду тетрабутиламонію у тетрапдрофурані (1,3мл, 1,3 ммоль) додають при 0°С до розчину (R)-(-)-5'-(2триметилсилілетиніл)спіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] (265мг, 0,85 ммоль) у безводному тетрапдрофурані (5мл) і перемішують при кімнатній температурі протягом 2 годин Реакційну суміш гасять насиченим водним розчином хлориду амонію (2мл), екстрагують простим ефіром (5x15мл), сушать (МдБОД упарюють при зниженому тиску і очищають флешхроматографією скрізь силікагель (елюювання сумішшю насичений аміаком хлороформ//метанол, 95 5), одержуючи вказану у заголовку сполуку (121мг, 0,50 ммоль, 59%) МС з ХІМІЧНОЮ іонізацією (m/z, відносна інтенсивність) 241 ([МН]+, 19) Приклад 21 5'-(2-Фурил)спіро[1-азабіцикло[2 2 2]октан-3,2'(3'Н)-фуро[2,3-Ь]піридин] Розчин, який містить 5'бромспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин] (103,5мг, 0,351 ммоль), трис(дибензиліденацетон)дипаладій(0) (14 мг, 0,015 ммоль), три-(о-толіл)фосфін (44,4 мг, 0,146 ммоль, хлорид ЛІТІЮ (62мг, 1,46 ммоль) та 2-(трин-бутилстаніл)фуран (0,17г, 0,476 ммоль) у 1,2диметоксіетані (1 мл), нагрівають при КИП'ЯТІННІ ЗІ зворотним холодильником протягом 2год Розчин упарюють і залишок розчиняють у хлороформі і фільтрують Фільтрат упарюють, потім очищають ВЕРХ з використанням градієнта 0-25% суміші 112 7М розчин аміаку у метанолі метанол хлороформ і хлороформу, одержуючи вказану у заголовку сполуку (89мг, 0,313 ммоль, 89%) у вигляді палевого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 283 ([МН]+, 100) Приклад 22 5'-(3-Піридил)спіро[1 -азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин] Розчин, що містить 5'-бромспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (158мг, 0,535 ммоль), трис(дибензиліденацетон)дипаладій(0) (23мг, 0,025 ммоль), три-(о-толіл)сросфш (66мг, 0,217 ммоль), хлорид ЛІТІЮ (99мг, 2,34 ммоль) та 3-(трин-бутилстаніл)піридин (0,2мл, приблизно 0,3г, приблизно 0,82 ммоль) у 1,2-диметоксіетані (2мл), нагрівають при КИП'ЯТІННІ ЗІ зворотним 61964 42 41 холодильником протягом 6 годин Розчин 0,024 ммоль), три-(о-толіл)фосфш (63мг, 0,206 упарюють і залишок розчиняють у хлороформі і ммоль), хлорид ЛІТІЮ (103мг, 2,43 ммоль) та три-нфільтрують Фільтрат упарюють, потім очищають бутилвшілстанан (188мг, 0,592 ммоль) у 1,2ВЕРХ з використанням градієнта 0-20% суміші диметоксіетані (10мл), нагрівають при КИП'ЯТІННІ ЗІ 112 7М розчин аміаку у зворотним холодильником протягом ночі Розчин метанолі метанол хлороформ та хлороформу, упарюють і залишок розчиняють у хлороформі і одержуючи вказану у заголовку сполуку (58 мг, фільтрують Фільтрат упарюють, потім очищають 0,198 ммоль, 37%) у вигляді палевого твердого ВЕРХ з використанням градієнта 0-25% суміші продукту МС з електророзпиленням (m/z, 112 7М розчин аміаку у + відносна інтенсивність) 294 ([МН] , 80), 273 (100) метанолі метанол хлороформ та хлороформу, одержуючи вказану у заголовку сполуку (93мг, Приклад 23 0,385 ммоль, 76%) у вигляді палевого твердого 5'-Метилспіро[1-азабіцикло[2 2 2]октан-3,2'продукту МС з електророзпиленням (m/z, (3'Н)-фуро[2,3-Ь]піридин] Розчин, що містить 5'+ відносна інтенсивність) 243 ([МН] , 100) бромспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)Приклад 26 фуро[2,3-Ь]піридин] (203мг, 0,687 ммоль), трис(дибензиліденацетон)дипаладій(0) (ЗЗмг, 0,036 ммоль), три-(о-толіл)фосфш (95мг, 0,312 Хлорфеніл)амшокарбоніламіноспіро[1ммоль), хлорид ЛІТІЮ (241 мг, 5,69 ммоль) та азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3тетраметилстанан (1,0мл, 1,3г, 7,2 ммоль) у 2Ь]піридин] метоксіетиловому простому ефірі (5мл), (В)-(-)-5'-Амшоспіро[1-азабіцикло[2 2 2]октаннагрівають у бані, яку підтримують при 100°С 3,2'-(3'Н)-фуро[2,3-Ь]піридин] (65мг або 0,28 Через 3 години додають наступну порцію ммоль) суспендують у 2,7мл безводного тетраметилстанану (1 мл, 1,3г, 7,2 ммоль) і тетрапдрофурану в атмосфері азоту Додають 3нагрівання продовжують протягом ночі Розчин хлорфенілізоціанат (35 мкл) і суспензію фільтрують і піддають очистці ВЕРХ з перемішують при кімнатній температурі протягом 5 використанням градієнта 0-20% суміші 1 1 2 7М годин Тетрапдрофуран видаляють у вакуумі і розчин аміаку у метанолі метанол хлороформ та сировинний продукт очищають флешхлороформу, одержуючи вказану у заголовку хроматографією Елюювання 20-40% розчином сполуку (120 мг, 0,519 ммоль, 76%) у вигляді метанол//хлороформ (який містить NH4OH) дає палевого твердого продукту МС з цільовий продукт Розчинники видаляють у вакуумі електророзпиленням (m/z, відносна інтенсивність) і залишок розчиняють у хлороформі та сушать + 231 ([МН] , 100) (MgSC^) Упарювання з витисненням двома порціями простого ефіру дає ЮОмг (92%) білого Приклад 24 твердого продукту МС з електророзпиленням 385 СпіроИ -азабіцикло[2 2 2]октан-3,2'-(3'Н)та 387 [МН]+ фуро[2,3-Ь]піридин-5'-карбонітрил] та сп1 ро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]п1 ридин-5'-карбоксамід] Розчин, що містить 5'-бромспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] (165мг, 0,558 ммоль) та ціанід купруму(І) (600мг, 1,3г, приблизно 7,2 ммоль) у 1метил-2-піролідиноні (5мл), нагрівають на бані, яку підтримують при 180°С, протягом ночі і потім залишають для охолодження Розчин потім розподіляють між водним аміаком та хлороформом і органічний шар відокремлюють, потім сушать (сульфат магнію), фільтрують і упарюють Залишок піддають очистці ВЕРХ з використанням градієнта 0-20% суміші 1 1 2 7М розчин аміаку у метанолі метанол хлороформ та хлороформу, одержуючи спіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин-5'-карбонітрил] (52мг, 0,216 ммоль, 39%) у вигляді палевого твердого продукту DCI МС з електророзпиленням (m/z, відносна інтенсивність) 242 ([МН]+, 100), і спіро[1-азабіцикло[2 2 2]октан3,2'-(3'Н)-фуро[2,3-Ь]піридин-5'-карбоксамід] (71 мг, 0,274 ммоль, 49%) у вигляді палевого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 260 ([МН]+, 100) Приклад 25 5'-Етенілспіро[1-азабіцикло[2 2 2]октан-3,2'(3'Н)-фуро[2,3-Ь]піридин] Розчин, що містить 5'бромспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин] (150мг, 0,508 ммоль), трис(дибензиліденацєтон)дипаладій(0) (22мг, Приклад 27 Нітрофеніл)амінокарбоніламшоспіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] З використанням того самого способу, як у прикладі 27, але замінюючи 3-хлорфенілізоціанат на 2-нітрофенілізоціанат, одержують вказану у заголовку сполуку, вихід 97 мг (88%) жовтого порошку МС з електророзпиленням 396 [МН]+ Приклад 28 (R)-(-)-5'-N,N-flie™-iaMiHocmpo[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Ціаноборопдрид натрію (190мг або 3,0 ммоль) та хлорид цинку (206мг або 1,5 ммоль) додають до 3,0мл безводного метанолу в атмосфері азоту Перемішування протягом 5 хвилин призводить до повного розчинення Додають (R)-(-)-5'амшоспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин] (230мг або 1,0 ммоль), потім ацетальдепд (0,335мл або 6,0 ммоль) Суспензію перемішують при кімнатній температурі протягом 16 годин Метанол концентрують у вакуумі і суспензію виливають до 20мл 0,1Н гідроксиду натрію Водний шар екстрагують чотирма порціями по 20мл хлороформу, шари хлороформу об'єднують, сушать (MgSC^) і упарюють у вакуумі Сировинний продукт очищають флешхроматографією, починаючи елюювання сумішшю 6//3//1//0.1 етилацетат//метанол//Ьода (містить 44 43 61964 ІЧЬЦОН) і потім сумішшю 3//6//1//0 1 Розчинники (R)-(-)-5'-AMiHocmpo[1 -азабіцикло[2 2 2]октанвидаляють у вакуумі і залишок розчиняють у 3,2'-(3'Н)-фуро[2,3-Ь]піридин] (230мг або 1,0 хлороформі і сушать (MgSO4) Одержують 0,227 г ммоль) розчиняють у Змл безводного піридину в (79%) світло-коричневого сиропу МС з атмосфері азоту Додають оцтовий ангідрид + електророзпиленням 288 [МН] (0,1мл або 1,1 ммоль) і розчин нагрівають при 100°С протягом 40 годин Піридин видаляють у Приклад 29 вакуумі і залишок розчиняють у 8мл хлороформу і (Р)-(-)-5'-М-Етиламшоспіро[1 промивають 4мл насиченого бікарбонату натрію азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Водний шар екстрагують ще два рази Ь]піридин] хлороформом і об'єднані органічні шари сушать (R)-(-)-5'-AMiHocmpo[1 -азабіцикло[2 2 2]октан(MgSO4) і упарюють у вакуумі Очистка флеш3,2'-(3'Н)-фуро[2,3-Ь]піридин] (230мг або 1,0 хроматографією з використанням градієнта 3-20% ммоль) та ціаноборопдрид натрію суспендують у суміші насичений аміаком метанол//хлороформ 6,2мл безводного метанолу Додають дає цільовий продукт Розчинники видаляють у ацетальдепд (90мкл або 1,1 ммоль), і розчин вакуумі і витісняють двома порціями простого перемішують при кімнатній температурі протягом ефіру Одержують 154мг (56%) білого твердого 16 годин Метанол видаляють у вакуумі і залишок + продукту МС з електророзпиленням 274 [МН] розчиняють у 2 мл води та 8 мл хлороформу Шари розділяють і водний шар екстрагують ще З Приклад 33 рази Об'єднані органічні шари сушать (MgSO4) і 4'-Хлорспіро[1-азабіцикло[2 2 2]октан-3,2'упарюють у вакуумі Сировинний продукт (3'Н)-фуро[2,3-Ь]піридин] та 4-хлорспіро[1очищають флеш-хроматографією з використанням азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3градієнта 3-15% метанол//хлороформ (насичений с]піридин] аміаком) Розчинники упарюють у вакуумі і Комплекс 4'-хлорспіро[1витісняють двома порціями простого ефіру азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Залишок суспендують у простому ефірі і збирають Ь]піридин]-боран та комплекс 4'-хлорспіро[1фільтруванням Після промивання простим ефіром азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3та сушіння у високому вакуумі одержують 81 мг с]піридин]-боран одержують з 2,36г (7,84 ммоль) (31%) білого порошку МС з електророзпиленням комплексу 3-(2,4-дихлорпіридин-3-ілметил)-3+ 260 [МН] пдрокси-1-азабіцикло[2 2 2]октан-І\І-боран та 319мг (7,97 ммоль) гідриду натрію у диметилформаміді, Приклад ЗО як у одержанні 2 Цю суміш обробляють водною (R)-(-)-5'-N-BeH3HnaMiHocmpo[1бромистоводневою кислотою в ацетоні, азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3одержуючи, після флеш-хроматографм на Ь]піридин] нейтральному силікагелі з використанням суміші Одержують способом прикладу 12 3 1,0 98 2 насичений аміаком хлороформй/іетанол, ммоль одержують 247мг (77%) білого порошку МС 559мг 4'-хлорспіро[1-азабіцикло[2 2 2]октан-3,2'з електророзпиленням 322 [МН]+ (3'Н)-фуро[2,3-Ь]піридину], т пл 109-110°С Приклад 31 (етиловий простий ефір) та 463мг 4'-хлорспіро[1(Р)-(-)-5'-г\І-Формамідоспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3с]піридину], т пл 113-115°С Ь]піридин] 98% Мурашину кислоту (2,1 мл) та оцтовий Приклад 34 ангідрид (0,7мл) змішують в атмосфері азоту і СпіроИ -азабіцикло[2 2 2]октан-3,2'-(3'Н)охолоджують льодяною банею Додають (R)-(-)-5'фуро[2,3-с]піридин] 4'-Хлорспіро[1амшоспіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3фуро[2,3-Ь]піридин] (230мг або 1,0 ммоль) і с]піридин] (125мг або 5,0 ммоль) з прикладу 33 реакційну суміш залишають для нагрівання до розчиняють у 50мл безводного метанолу і кімнатної температури Реакційну суміш додають 25мг 10% паладію на вугіллі Посудину перемішують протягом 26 годин і потім виливають поміщають на апарат Пара в атмосфері водню і з перемішуванням до насиченого карбонату струшують протягом 2,5 годин Pd/C видаляють натрію ТвердийЫагСОз додають доти, доти рН не фільтруванням і промивають метанолом стане знов лужним, і потім водний шар Розчинник видаляють у вакуумі і залишок екстрагують чотирма порціями хлороформу Ці розчиняють у хлороформі та метанолі і шари хлороформу об'єднують, сушать (MgSO4) і переносять до пробірки Розчинник видаляють у упарюють у вакуумі Сировинний продукт вакуумі і витісняють двома порціями простого очищають флеш-хроматографією, елююючи з ефіру Після сушіння у високому вакуумі градієнтом 2-10% суміші насичений аміаком одержують 112мг не зовсім білого порошку (104% метанол//хлороформ Розчинники видаляють у із залишковим розчинником) МС з вакуумі і залишок розчиняють у хлороформі, електророзпиленням 217[МН]+ сушать (MgSO4) і упарюють у вакуумі Розчинник Приклад 35 витісняють двома порціями простого ефіру, 4'-Метоксиспіро[1-азабіцикло[2 2 2]октан-3і2'одержуючи 0,2г (77%) білого твердого продукту (3'Н)-фуро[2,3-Ь]піридин] Гідрид натрію (241 мг, 6,0 МС з електророзпиленням 260 [МН]+ ммоль) додають до розчину 76мг (0,30 ммоль) 4'хлорспіро[1-азабіцикло[2 2 2]октан-3,2'-(3'Н)Приклад 32 фуро[2,3-Ь]піридину] у 25мл охолодженого льодом ^)-(-)-5'-г\І-Ацетамідоспіро[1метанолу в атмосфері азоту Розчин, що азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3одержують, нагрівають для кип'ятіння зі зворотним Ь]піридин] 46 45 61964 холодильником і перемішують протягом 4 днів, флеш-хроматографують на нейтральному потім охолоджують до кімнатної температури, силікагелі з використанням суміші 4 1 насичений виливають до ЗОмл води і екстрагують аміаком хлороформ//метанол, одержуючи 59мг хлороформом (ЗхЗОмл) Об'єднаний органічний (48%) вказаної у заголовку сполуки у вигляді екстракт сушать над безводним сульфатом бурштинового масла МС з електророзпиленням + магнію, концентрують у вакуумі і залишок флеш(m/z, відносна інтенсивність) 315 [МН] хроматографують на нейтральному силікагелі з Приклад 39 використанням суміші 9 1 насичений аміаком 4'-(Фенілметил)амшоспіро[1хлороформ//метанол, одержуючи 50мг (67%) азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3вказаної у заголовку сполуки у вигляді білого Ь]піридин] твердого продукту МС з електророзпиленням Розчин 97мг (0,387 ммоль) 4'-хлорспіро[1(m/z, відносна інтенсивність) 247 [МН] азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] у 5мл бензиламшу нагрівають для Приклад 36 кип'ятіння ЗІ зворотним холодильником в 4'-Фенілтюспіро[1-азабіцикло[2 2 2]октан-3,2'атмосфері азоту і перемішують протягом 18 годин (3'Н)-фуро[2,3-Ь]піридин] Гідрид натрію (151мг, Після охолодження до кімнатної температури 3,77 ммоль) додають до розчину 97мг (0,387 розводять 40мл води, роблять основним 2мл ммоль) 4'-хлорспіро[1-азабіцикло[2 2 2]октан-3,2'насиченого водного карбонату натрію і (3'Н)-фуро[2,3-Ь]піридину], 0,40мл (3,91 ммоль) екстрагують хлороформом (Зх25мл) Об'єднаний тюфенолу та Юмл метанолу у 15мл діоксану в органічний екстракт сушать над безводним атмосфері азоту Реакційну суміш кип'ятять зі сульфатом магнію, концентрують у вакуумі і зворотним холодильником протягом 4 днів, флеш-хроматографують на нейтральному охолоджують до кімнатної температури, розводять силікагелі з використанням суміші 9 1 насичений ЗОмл води і екстрагують хлороформом (ЗхЗОмл) аміаком хлороформ//метанол, одержуючи 42мг Об'єднаний органічний екстракт сушать над (34%) вказаної у заголовку сполуки у вигляді безводним сульфатом магнію, концентрують у білого твердого продукту МС з вакуумі і залишок флеш-хроматографують на електророзпиленням (m/z, відносна інтенсивність) нейтральному силікагелі з використанням суміші 322 ([МН]+) 98 2 насичений аміаком хлороформ//метанол, одержуючи 65мг (52%) вказаної у заголовку Приклад 40 сполуки у вигляді безбарвного масла МС з 4'-(Метиламшо)спіро[1-азабіцикло[2 2 2]октанелектророзпиленням (m/z, відносна інтенсивність) 3,2'-(3'Н)-фуро[2,3-Ь]піридин] Розчин 151 мг (0,60 325 ([МН]+) ммоль) 4'-хлорспіро[1-азабіцикло[2 2 2]октан-3,2'Приклад 37 4'-(г\І-2-Аміноетил)амшоспіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Розчин 74мг (0,295 ммоль) 4'-хлорспіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] у Юмл етилендіаміну нагрівають для кип'ятіння ЗІ зворотним холодильником в атмосфері азоту і перемішують протягом 4 днів Після охолодження до кімнатної температури розчинник видаляють у вакуумі Залишок розчиняють у 20мл насиченого водного карбонату натрію і екстрагують хлороформом (Зх25мл) Об'єднаний органічний екстракт сушать над безводним сульфатом магнію і концентрують у вакуумі, одержуючи вказану у заголовку сполуку у вигляді темного масла, 80мг (100%) МС з електророзпиленням (m/z, відносна інтенсивність) 275 ([МН]+) Приклад 38 4'-(4-І\І-Метилпіперазин-1 -іл)спіро[1 азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридин] Розчин 97мг (0,387 ммоль) 4'-хлорспіро[1азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3Ь]піридину] у 1мл 1-метилпіперазину нагрівають для кип'ятіння ЗІ зворотним холодильником в атмосфері азоту і перемішують протягом 18 годин Після охолодження до кімнатної температури розводять 40мл води, роблять основним 2 мл насиченого водного карбонату натрію і екстрагують хлороформом (Зх25мл) Об'єднаний органічний екстракт сушать над безводним сульфатом магнію, концентрують у вакуумі і (3'Н)-фуро[2,3-Ь]піридину] у 25мл 40% водного метиламіну нагрівають до 175°С у сталевому автоклаві протягом 18 годин, потім охолоджують до кімнатної температури і концентрують у вакуумі Залишок розчиняють у Юмл етанолу, який містить 0,4мл концентрованої хлористоводневої кислоти, і розчин залишають стояти протягом ночі Після фільтрування розчин концентрують у вакуумі і залишок кристалізують з ізопропанолу, одержуючи 147мг вказаної у заголовку сполуки у вигляді білого твердого продукту МС з електророзпиленням (m/z, відносна інтенсивність) 246 ([МН]+) Приклад 41 СпіроИ -азабіцикло[2 2 2]октан-3,2'-(3'Н)фуро[2,3-Ь]піридин-7'-оксид] Розчин спіро[1-азабіцикло[2 2 2]октан-3,2'(3'Н)-фуро[2,3-Ь]піридину] (2,88г, 13,3 ммоль) та водного пероксиду гідрогену (30%, 5мл) у оцтовій кислоті (20мл) нагрівають при КИП'ЯТІННІ ЗІ зворотним холодильником Через 16год та 24год додають додаткові порції пероксиду гідрогену і нагрівання продовжують протягом усього 48год Розчин потім упарюють, потім залишок знов розчиняють в етанолі (40мл), який був насичений дюксидом сульфуру Через 4год розчин упарюють і залишок очищають ВЕРХ на силікагелі, використовуючи як елюент градієнт 0-50% суміші розчинників (7М розчин аміаку у метанолі (25%)/метанол (25%)/хлороформ (50%)) та хлороформу Вказана у заголовку сполука (934мг, 4,0 ммоль, 30%) ствердим продуктом МС DCI 233 + Приклад 42 48 47 61964 Спіро[1 -азабіцикло[2 2 2]октан-3,2'-(3'Н)мл) додають до ТГФ (15мл) в атмосфері аргону фуро[2,3-Ь]піридин-6'-карбонітрил] Додають дмзопропіламін (0,5мл) і розчин охолоджують до -78°С (температура бані сухий Розчин спіро[1-азабіцикло[2 2 2]октан-3,2'лід/ацетон) До розчину, що одержують, по (3'Н)-фуро[2,3-Ь]піридин-7'-оксиду] (95мг, 0,41 краплях додають 2,6-дифторпіридин (1,23мл, ммоль) розчиняють у ацетонітрилі (2 мл) Додають 1,56г, 13,6 ммоль), потім через 1год по краплях триетиламш (0,12мл, 87мг, 0,86 ммоль) і потім додають розчин комплексу спіро[1триметилсилілціанід (0,2мл, 149мг, 1,5 ммоль) азабіцикпо[2 2 2]октан-3,2'-оксиран]-М-боран Розчин перемішують при кімнатній температурі (765мг, 5,0 ммоль) у тетрапдрофурані Розчин протягом ночі, потім нагрівають до температури перемішують при -78°С протягом 1год і вказану флегми Приблизно через 8год додають охолоджувальну баню потім замінюють на баню додатковий триметилсилілціанід (0,2мл) Після сухий лідацетонітрил Розчин потім перемішують нагрівання при КИП'ЯТІННІ ЗІ зворотним протягом ночі, нагрівають до кімнатної холодильником протягом ночі розчин залишають температури для охолодження Додають надлишок метанолу і розчин витримують при кімнатній температурі Додають насичений водний бікарбонат натрію протягом 4год , потім упарюють Залишок і розчин потім екстрагують хлороформом Екстракт очищають ВЕРХ на силікагелі, використовуючи як потім сушать (MgSC^), фільтрують і упарюють елюент градієнт 0-25% суміші розчинників (7М Залишок розчиняють у ДМФ (20мл) і потім розчин аміаку у метанолі (25%)/метанол додають до суспензії промитого гексаном гідриду (25%)/хлороформ (50%)) та хлороформу Вказана натрію (60% суміш з мінеральним маслом, 507мг, у заголовку сполука (50мг, 0,21 ммоль, 51%) є 12,7 ммоль) у ДМФ (20мл), яку перемішують при твердим продуктом МС з електророзпиленням 0°С, Розчин перемішують протягом ночі, + 242 ([МН] ) нагрівають до кімнатної температури До розчину додають насичений водний бікарбонат натрію і Приклад 43 потім екстрагують хлороформом Екстракт потім 6'-Хлорспіро[1-азабіцикло[2 2 2]октан-3,2'сушать (MgSO4), фільтрують і упарюють, і залишок (3'Н)-фуро[2,3-Ь]піридин] Розчин спіро[1очищають ВЕРХ з використанням градієнта 5-50% азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3етилацетату та гексану, одержуючи вказану у Ь]піридин-7'-оксиду] (98мг, 0,42 ммоль) в підзаголовку сполуку (102мг, 8%, 0,41 ммоль) МС оксихлориді фосфору (2мл) нагрівають при з електророзпиленням (m/z) 247 [М-Н]+ КИП'ЯТІННІ ЗІ зворотним холодильником протягом 2год Розчин упарюють, залишок розподіляють між (б) 6'-Фторспіро[1-азабіцикло[2 2 2]октан-3,2'водним карбонатом калію та хлороформом, потім (3'Н)-фуро[2,3-Ь]піридин] Комплекс 6'-фторспіро[1органічний шар сушать (сульфат магнію), азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3фільтрують та упарюють Залишок очищають Ь]піридин]-І\І-боран (98мг, 0,40 ммоль) розчиняють ВЕРХ на силікагелі, використовуючи як елюент в ацетоні (5мл) 48% Водну бромистоводневу градієнт 0-25% суміші розчинників (7М розчин кислоту (2мл) розводять водою (2мл) і потім аміаку у метанолі (25%)/метанол додають до розчину Суміш, що одержують, (25%)/хлороформ (50%)) та хлороформу Вказана перемішують при кімнатній температурі протягом у заголовку сполука (26мг, 0,10 ммоль, 25%) є ночі Розчин потім упарюють і розподіляють між твердим продуктом МС з електророзпиленням водним карбонатом натрію та хлороформом 251 ([МН]+ з 3jC\) та 253 ([МН]+ з 37СІ) Органічний екстракт потім сушать (MgSC^), фільтрують і упарюють, і залишок очищають ВЕРХ Приклад 44 з використанням градієнта 0-25% суміші 1 1 2 7М 6'-Фторспіро[1-азабіцикло[2 2 2]октан-3,2'розчин аміаку у метанолі метанол хлороформ та (3'Н)-фуро[2,3-Ь]піридин] хлороформу, одержуючи вказану у заголовку (а) Комплекс 6'-фторспіро[1 сполуку (39мг, 0,168 ммоль, 43%) у вигляді азабіцикло[2 2 2]октан-3,2'-(3'Н)-фуро[2,3твердого продукту МС з електророзпиленням Ь]піридин]-І\І-боран + (m/z, відносна інтенсивність) 235 ([МН] , 100) Розчин феніллітію (1,8М у циклогексані, 13,5 Комп'ютерна верстка О Кураєв Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюNew spiroazabicyclic heterocyclic compounds
Назва патенту російськоюНовые спироазабициклические гетероциклические соединения
МПК / Мітки
МПК: A61P 25/34, A61K 31/5377, C07D 491/22, A61P 43/00, A61P 25/00, A61K 31/496, A61P 25/14, A61K 31/439, A61P 25/16, A61P 25/22, A61K 31/4738, A61K 31/695, A61P 25/04, A61K 31/444, A61P 25/18, A61P 1/04, A61P 25/24, C07F 5/00, A61P 25/28, C07F 7/18
Мітки: спіроазабіциклічні, одержання, спосіб, фармацевтична, профілактики, основі, композиція, гетероциклічні, лікування, варіанти, проміжні, сполуки
Код посилання
<a href="https://ua.patents.su/24-61964-spiroazabiciklichni-geterociklichni-spoluki-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-likuvannya-chi-profilaktiki-varianti-sposib-oderzhannya-spoluki-varianti-ta-promizhni-spi.html" target="_blank" rel="follow" title="База патентів України">Спіроазабіциклічні гетероциклічні сполуки, фармацевтична композиція на їх основі, спосіб лікування чи профілактики (варіанти), спосіб одержання сполуки (варіанти) та проміжні спіроазабіциклічні гетероциклічні с</a>
Попередній патент: Спосіб корекції апоптозу тимоцитів
Наступний патент: Культиватор для обробітку грунту
Випадковий патент: Пластинчастий теплообмінник