Заміщені бензимідазол-, бензтриазол- та бензимідазолон-о-глюкозиди
Формула / Реферат
1. Сполука формули (III):
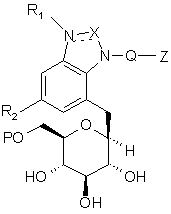 , (III)
, (III)
в якій:
X являє собою СН, N або C=О;
R1 являє собою Н або відсутній;
R2 являє собою Н, F, Сl, ОСН3, ОСН2СН3 або С1-4алкіл, CF3, SCH3, заміщений або незаміщений феніл та NR3R4;
R3 та R4 являють собою Н, С1-6алкіл або взяті разом з атомом азоту, до якого вони обидва приєднані, утворюють 5-6-членний гетероцикліл з необов’язково 1-2 додатковими гетероатомами, незалежно вибраними з О, S та N;
Q являє собою -(СН2)n-, де n означає 1 або 2;
Р являє собою Н, С1-7ацил або (С1-6алкокси)карбоніл; та
Z є заміщеним або незаміщеним та вибраний з С3-7циклоалкілу, фенілу, 5- або 6-членного гетероарилу, який містить 1 або 2 гетероатоми, незалежно вибрані з N, О та S, біарилу та 9- або 10-членного конденсованого біциклілу або конденсованого гетеробіциклілу, де зазначений конденсований гетеробіцикліл містить 1-4 гетероатоми, незалежно вибрані з N, О та S;
або її фармацевтично прийнятна сіль.
2. Сполука за пунктом 1, яка відрізняється тим, що R1 являє собою Н або відсутній.
3. Сполука за пунктом 1, яка відрізняється тим, що R2 являє собою Н, метил або етил.
4. Сполука за пунктом 1, яка відрізняється тим, що Q являє собою -(СН2)n- та n означає 1.
5. Сполука за пунктом 1, яка відрізняється тим, що Z незалежно заміщений 1-3 замісниками, незалежно вибраними з С1-4алкокси, фенокси, С1-4алкілу, С3-6циклоалкілу, гало, гідрокси, ціано, аміно, С1-4алкілтіо, С1-4алкілсульфонілу, С1-4алкілсульфінілу, С1-4аміноалкілу, моно- та ді(С1-4алкіл)аміно, фенілу, С1-4алкіламіносульфонілу (SO2NHR), аміно(алкілсульфоніл) (-NHSO2R-), C1-4діалкіламіносульфінілу (SONHRR), С1-4алкіламідо (NHCOR), С1-4алкілкарбамідо (CONHR), 5-6 членного гетероциклілу, який містить 1-3 гетероатоми, незалежно вибрані з N, S та О; та де замісник(и) на Z може бути додатково незалежно заміщений 1-3 замісниками, незалежно вибраними з С1-4алкокси, С1-4алкілу, гало, гідрокси, ціано, аміно, моно або діС1-4алкіламіно та С1-4алкілтіо.
6. Сполука за пунктом 1, яка відрізняється тим, що Z являє собою 4-заміщений феніл, 3,4-дизаміщений феніл, бензгідрил, заміщений або незаміщений тіофен, біарил, бензофураніл, дигідробензофураніл, 4-заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3-дигідробензо[1,4]діоксаніл.
7. Сполука за пунктом 4, яка відрізняється тим, що Z є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу.
8. Сполука за пунктом 1, яка відрізняється тим, що Z являє собою біфеніл, 4-(3-піридил)феніл, 4-(2-тієніл)феніл, 4-(1Н-імідазол-1-іл)-феніл, 4-(1Н-піразол-1-іл)-феніл, (4-етил)феніл, (4-пропіл)феніл, (4-метоксифеніл), дигідробензофуран-5-іл або дигідробензофуран-6-іл.
9. Сполука за пунктом 1, яка відрізняється тим, що R1 відсутній, X являє собою СН та R2 являє собою Н, метил, етил або метокси.
10. Сполука за пунктом 1, яка відрізняється тим, що Q являє собою -(CH2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил.
11. Сполука за пунктом 10, яка відрізняється тим, що R1 відсутній.
12. Сполука за пунктом 1, яка відрізняється тим, що R1 відсутній; Q являє собою -(CH2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил; та Z являє собою 4-заміщений феніл, 3,4-дизаміщений феніл, бензгідрил, заміщений або незаміщений тіофен, біарил, бензофураніл, гідробензофураніл, дигідробензофураніл, 4-заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3-дигідробензо[1,4]діоксаніл.
13. Сполука за пунктом 1, яка відрізняється тим, що Z являє собою біфеніл, 4-(3-піридил)феніл, 4-(2-тієніл)феніл, 4-(1Н-імідазол-1-іл)феніл, 4-(1Н-піразол-1-іл)феніл, (4-етил)феніл, (4-пропіл)феніл, (4-метоксифеніл), дигідробензофуран-5-іл або дигідробензофуран-6-іл; та Z незаміщений або заміщений 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу.
14. Сполука за пунктом 1, яка відрізняється тим, що вибрана з:
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду та
-D-глюкопіранозиду та
2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]-![]() -D-глюкопіранозиду.
-D-глюкопіранозиду.
15. Сполука за пунктом 1, яка відрізняється тим, що вибрана з:
2-[3-(4-етилбензил)-6-метил-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензотриазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(2-нафтален-2-ілетил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду та
-D-глюкопіранозиду та
2-[3-(4-етилбензил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-![]() -D-глюкопіранозиду.
-D-глюкопіранозиду.
16. Сполука за пунктом 1, яка відрізняється тим, що вибрана з:
2-[3-(2-нафтален-2-ілетил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-![]() -D-глюкопіранозиду та
-D-глюкопіранозиду та
2-[3-(2-(4-метоксифеніл)-етил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-![]() -D-глюкопіранозиду.
-D-глюкопіранозиду.
17. Сполука за пунктом 1, яка відрізняється тим, що вибрана з:
2-[3-(5-етилтіофен-2-ілметил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етоксибензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етоксибензил)-3Н-бензотриазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-тіофен-3-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-піразол-1-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-піридин-3-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-пірол-1-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-імідазол-1-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-(3-біфеніл-4-ілметил-3Н-бензоімідазол-4-ілокси)-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-6-метокси-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-6-трифторметил-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]-6-О-етоксикарбоніл-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]-6-О-етоксикарбоніл-![]() -D-глюкопіранозиду та
-D-глюкопіранозиду та
2-[3-(4-етилбензил)-6-метил-3Н-бензотриазол-4-ілокси]-![]() -D-глюкопіранозиду.
-D-глюкопіранозиду.
18. Сполука за пунктом 1, яка відрізняється тим, що вибрана з:
2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-етилбензил)-6-метил-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензотриазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(5-етилтіофен-2-ілметил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-тіофен-3-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-[3-(4-пірол-1-ілбензил)-3Н-бензоімідазол-4-ілокси]-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензоімідазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензотриазол-4-ілокси}-![]() -D-глюкопіранозиду;
-D-глюкопіранозиду;
2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Н-бензотриазол-4-ілокси}-![]() -D-глюкопіранозиду та 2-[3-(4-етилбензил)-6-метил-3Н-бензотриазол-4-ілокси]-
-D-глюкопіранозиду та 2-[3-(4-етилбензил)-6-метил-3Н-бензотриазол-4-ілокси]-![]() -D-глюкопіранозиду.
-D-глюкопіранозиду.
19. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1, 5, 6, 11, 12, 14, 15, 16, 17 або 18 та фармацевтично прийнятний носій.
20. Фармацевтична композиція за пунктом 19, яка відрізняється тим, що містить сполуку за пунктом 14 та фармацевтично прийнятний носій.
21. Спосіб лікування діабету у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19.
22. Спосіб за пунктом 21, де зазначений діабет є діабетом II типу.
23. Спосіб зниження рівня глюкози в сироватці у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19.
24. Спосіб лікування порушеної толерантності до глюкози у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19.
25. Спосіб лікування або інгібування порушеної толерантності до глюкози у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19.
26. Спосіб зниження індексу маси тіла, маси тіла або відсотка жиру в тілі у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19.
27. Спосіб за пунктом 26, який відрізняється тим, що зазначене зниження індексу маси тіла є способом лікування ожиріння або стану надлишкової ваги.
28. Спосіб інгібування транспортеру натрій/глюкози в клітині, який включає піддавання зазначеної клітини впливу сполуки за пунктом 1 або її метаболіту.
29. Спосіб лікування діабету або Синдрому X, або симптомів, пов’язаних з ними, або їх ускладнень у суб’єкта, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості
(a) сполуки формули (III) або її фармацевтично прийнятної солі; та
(b) другого антидіабетичного агента,
де зазначене спільне введення проводять в будь-якому порядку.
30. Спосіб за пунктом 29, який відрізняється тим, що другим антидіабетичним агентом є агоніст RXR.
31. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення вибрані з IDDM NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, ретинопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт.
32. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою IDDM.
33. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою NIDDM.
34. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою IGT або IFG.
35. Спосіб за пунктом 29, який відрізняється тим, що додатково включає введення зазначеному суб’єкту спільно ефективної кількості третього антидіабетичного агента.
36. Спосіб за пунктом 35, який відрізняється тим, що третій антидіабетичний агент вибраний з:
(аа) інсулінів,
(bb) аналогів інсуліну;
(сс) модуляторів секреції інсуліну та
(dd) стимуляторів секреції інсуліну.
37. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT.
38. Спосіб за пунктом 37, який відрізняється тим, що спільно ефективна кількість інгібітора SGLT складає від приблизно 10 до 1000 мг.
39. Спосіб за пунктом 37, який відрізняється тим, що спільно ефективна кількість інгібітора SGLT являє собою кількість, достатню для зменшення коливань рівня глюкози в плазмі після їжі.
40. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT1.
41. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT2.
42. Спосіб інгібування початку діабету або Синдрому X, або симптомів, пов’язаних з ними, або їх ускладнень у суб’єкта, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості
(a) сполуки Формули (III) та
(b) другого антидіабетичного агента,
де спільне введення проводять в будь-якому порядку.
43. Спосіб за пунктом 42, який відрізняється тим, що зазначеним початком є стан від переддіабетичного стану до NIDDM.
44. Фармацевтична композиція, яка містить сполуку Формули (III) або її фармацевтично прийнятну сіль, другий антидіабетичний агент та фармацевтично прийнятний носій.
45. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT
46. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT1.
47. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT2.
48. Спосіб одержання фармацевтичної композиції, який включає поєднання разом сполуки Формули (ІІІ) або її фармацевтично прийнятної солі, другого антидіабетичного агента та фармацевтично прийнятного носія.
49. Спосіб за пунктом 48, який відрізняється тим, що включає змішування однієї або більше сполук Формули (ІІІ) або її фармацевтично прийнятної солі в комбінації з другим антидіабетичним агентом для одержання лікарського засобу для лікування стану, вибраного з IDDM, NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, ретинопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт.
50. Спосіб інгібування розвитку переддіабетичного стану у суб’єкта в діабетичний стан, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості
(a) сполуки Формули (ІІІ) або її фармацевтично прийнятної солі та
(b) другого антидіабетичного агента,
де спільне введення проводять в будь-якому порядку.
51. Спосіб за пунктом 50, який відрізняється тим, що зазначеним станом є IGT або IFG.
52. Спосіб за пунктом 50, який відрізняється тим, що зазначеним інгібуванням розвитку переддіабетичного стану є попередження розвитку переддіабетичного стану в діабетичний стан.
53. Спосіб за пунктом 50, який відрізняється тим, що сполука Формули (III) або її фармацевтично прийнятна сіль містить одну або більше гідроксил- або діолзахисних груп.
Текст
1. Сполука формули (III): R1 2 (19) 1 3 незаміщений тіофен, біарил, бензофураніл, дигідробензофураніл, 4-заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3-дигідробензо[1,4]діоксаніл. 7. Сполука за пунктом 4, яка відрізняється тим, що Z є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу. 8. Сполука за пунктом 1, яка відрізняється тим, що Z являє собою біфеніл, 4-(3-піридил)феніл, 4(2-тієніл)феніл, 4-(1Н-імідазол-1-іл)-феніл, 4-(1Нпіразол-1-іл)-феніл, (4-етил)феніл, (4пропіл)феніл, (4-метоксифеніл), дигідробензофуран-5-іл або дигідробензофуран-6-іл. 9. Сполука за пунктом 1, яка відрізняється тим, що R1 відсутній, X являє собою СН та R2 являє собою Н, метил, етил або метокси. 10. Сполука за пунктом 1, яка відрізняється тим, що Q являє собою -(CH2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил. 11. Сполука за пунктом 10, яка відрізняється тим, що R1 відсутній. 12. Сполука за пунктом 1, яка відрізняється тим, що R1 відсутній; Q являє собою -(CH2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил; та Z являє собою 4-заміщений феніл, 3,4-дизаміщений феніл, бензгідрил, заміщений або незаміщений тіофен, біарил, бензофураніл, гідробензофураніл, дигідробензофураніл, 4-заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3-дигідробензо[1,4]діоксаніл. 13. Сполука за пунктом 1, яка відрізняється тим, що Z являє собою біфеніл, 4-(3-піридил)феніл, 4(2-тієніл)феніл, 4-(1Н-імідазол-1-іл)феніл, 4-(1Нпіразол-1-іл)феніл, (4-етил)феніл, (4-пропіл)феніл, (4-метоксифеніл), дигідробензофуран-5-іл або дигідробензофуран-6-іл; та Z незаміщений або заміщений 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу. 14. Сполука за пунктом 1, яка відрізняється тим, що вибрана з: 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Нбензоімідазол-4-ілокси}- b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]- b D-глюкопіранозиду та 2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]- b D-глюкопіранозиду. 15. Сполука за пунктом 1, яка відрізняється тим, що вибрана з: 2-[3-(4-етилбензил)-6-метил-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензоімідазол-4ілокси}- b -D-глюкопіранозиду; 2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензотриазол-4ілокси}- b -D-глюкопіранозиду; 2-[3-(2-нафтален-2-ілетил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду та 2-[3-(4-етилбензил)-1,3-дигідробензоімідазол-2-он4-ілокси]- b -D-глюкопіранозиду. 16. Сполука за пунктом 1, яка відрізняється тим, що вибрана з: 86599 4 2-[3-(2-нафтален-2-ілетил)-1,3дигідробензоімідазол-2-он-4-ілокси]- b -D-глюкопіранозиду та 2-[3-(2-(4-метоксифеніл)-етил)-1,3-дигідробензоімідазол-2-он-4-ілокси]- b -D-глюкопіранозиду. 17. Сполука за пунктом 1, яка відрізняється тим, що вибрана з: 2-[3-(5-етилтіофен-2-ілметил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-етоксибензил)-3Н-бензоімідазол-4-ілокси]b -D-глюкопіранозиду; 2-[3-(4-етоксибензил)-3Н-бензотриазол-4-ілокси]b -D-глюкопіранозиду; 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензоімідазол-4-ілокси}- b -D-глюкопіранозиду; 2-[3-(4-тіофен-3-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-піразол-1-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-піридин-3-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-пірол-1-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-імідазол-1-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-(3-біфеніл-4-ілметил-3Н-бензоімідазол-4-ілокси)b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-6-метокси-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-6-трифторметил-3Нбензоімідазол-4-ілокси]- b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]-6О-етоксикарбоніл- b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]-6О-етоксикарбоніл- b -D-глюкопіранозиду та 2-[3-(4-етилбензил)-6-метил-3Н-бензотриазол-4ілокси]- b -D-глюкопіранозиду. 18. Сполука за пунктом 1, яка відрізняється тим, що вибрана з: 2-[3-(4-етилбензил)-3Н-бензоімідазол-4-ілокси]- b D-глюкопіранозиду; 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Нбензоімідазол-4-ілокси}- b -D-глюкопіранозиду; 2-[3-(4-етилбензил)-3Н-бензотриазол-4-ілокси]- b D-глюкопіранозиду; 2-[3-(4-етилбензил)-6-метил-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-{3-[2-(4-метоксифеніл)-етил]-3Н-бензотриазол-4ілокси}- b -D-глюкопіранозиду; 2-[3-(5-етилтіофен-2-ілметил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6метил-3Н-бензоімідазол-4-ілокси}- b -D-глюкопіранозиду; 2-[3-(4-тіофен-3-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 2-[3-(4-пірол-1-ілбензил)-3Н-бензоімідазол-4ілокси]- b -D-глюкопіранозиду; 5 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6метил-3Н-бензоімідазол-4-ілокси}- b -D-глюкопіранозиду; 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-6метил-3Н-бензотриазол-4-ілокси}- b -D-глюкопіранозиду; 2-{3-[2-(2,3-дигідробензофуран-5-іл)-етил]-3Нбензотриазол-4-ілокси}- b -D-глюкопіранозиду та 2[3-(4-етилбензил)-6-метил-3Н-бензотриазол-4ілокси]- b -D-глюкопіранозиду. 19. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1, 5, 6, 11, 12, 14, 15, 16, 17 або 18 та фармацевтично прийнятний носій. 20. Фармацевтична композиція за пунктом 19, яка відрізняється тим, що містить сполуку за пунктом 14 та фармацевтично прийнятний носій. 21. Спосіб лікування діабету у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19. 22. Спосіб за пунктом 21, де зазначений діабет є діабетом II типу. 23. Спосіб зниження рівня глюкози в сироватці у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19. 24. Спосіб лікування порушеної толерантності до глюкози у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19. 25. Спосіб лікування або інгібування порушеної толерантності до глюкози у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19. 26. Спосіб зниження індексу маси тіла, маси тіла або відсотка жиру в тілі у ссавця, який включає введення ссавцю, що потребує лікування, ефективної кількості фармацевтичної композиції за пунктом 19. 27. Спосіб за пунктом 26, який відрізняється тим, що зазначене зниження індексу маси тіла є способом лікування ожиріння або стану надлишкової ваги. 28. Спосіб інгібування транспортеру натрій/глюкози в клітині, який включає піддавання зазначеної клітини впливу сполуки за пунктом 1 або її метаболіту. 29. Спосіб лікування діабету або Синдрому X, або симптомів, пов’язаних з ними, або їх ускладнень у суб’єкта, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості (a) сполуки формули (III) або її фармацевтично прийнятної солі; та (b) другого антидіабетичного агента, де зазначене спільне введення проводять в будьякому порядку. 30. Спосіб за пунктом 29, який відрізняється тим, що другим антидіабетичним агентом є агоніст RXR. 31. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення вибрані з IDDM NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, рети 86599 6 нопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт. 32. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою IDDM. 33. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою NIDDM. 34. Спосіб за пунктом 29, який відрізняється тим, що діабет або Синдром X, або симптоми, пов’язані з ними, або їх ускладнення являють собою IGT або IFG. 35. Спосіб за пунктом 29, який відрізняється тим, що додатково включає введення зазначеному суб’єкту спільно ефективної кількості третього антидіабетичного агента. 36. Спосіб за пунктом 35, який відрізняється тим, що третій антидіабетичний агент вибраний з: (аа) інсулінів, (bb) аналогів інсуліну; (сс) модуляторів секреції інсуліну та (dd) стимуляторів секреції інсуліну. 37. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT. 38. Спосіб за пунктом 37, який відрізняється тим, що спільно ефективна кількість інгібітора SGLT складає від приблизно 10 до 1000мг. 39. Спосіб за пунктом 37, який відрізняється тим, що спільно ефективна кількість інгібітора SGLT являє собою кількість, достатню для зменшення коливань рівня глюкози в плазмі після їжі. 40. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT1. 41. Спосіб за пунктом 29, який відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT2. 42. Спосіб інгібування початку діабету або Синдрому X, або симптомів, пов’язаних з ними, або їх ускладнень у суб’єкта, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості (a) сполуки Формули (III) та (b) другого антидіабетичного агента, де спільне введення проводять в будь-якому порядку. 43. Спосіб за пунктом 42, який відрізняється тим, що зазначеним початком є стан від переддіабетичного стану до NIDDM. 44. Фармацевтична композиція, яка містить сполуку Формули (III) або її фармацевтично прийнятну сіль, другий антидіабетичний агент та фармацевтично прийнятний носій. 45. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT 46. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT1. 7 86599 8 47. Фармацевтична композиція за пунктом 44, яка відрізняється тим, що сполука Формули (ІІІ) або її фармацевтично прийнятна сіль являє собою інгібітор SGLT2. 48. Спосіб одержання фармацевтичної композиції, який включає поєднання разом сполуки Формули (ІІІ) або її фармацевтично прийнятної солі, другого антидіабетичного агента та фармацевтично прийнятного носія. 49. Спосіб за пунктом 48, який відрізняється тим, що включає змішування однієї або більше сполук Формули (ІІІ) або її фармацевтично прийнятної солі в комбінації з другим антидіабетичним агентом для одержання лікарського засобу для лікування стану, вибраного з IDDM, NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, ретинопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт. 50. Спосіб інгібування розвитку переддіабетичного стану у суб’єкта в діабетичний стан, який передбачає введення суб’єкту, що потребує лікування, спільно ефективної кількості (a) сполуки Формули (ІІІ) або її фармацевтично прийнятної солі та (b) другого антидіабетичного агента, де спільне введення проводять в будь-якому порядку. 51. Спосіб за пунктом 50, який відрізняється тим, що зазначеним станом є IGT або IFG. 52. Спосіб за пунктом 50, який відрізняється тим, що зазначеним інгібуванням розвитку переддіабетичного стану є попередження розвитку переддіабетичного стану в діабетичний стан. 53. Спосіб за пунктом 50, який відрізняється тим, що сполука Формули (III) або її фармацевтично прийнятна сіль містить одну або більше гідроксилабо діолзахисних груп. Даний винахід відноситься до заміщених бензимідазол-О-глюкозидів, бензтриазол-Оглюкозидів та бензимідазолон-О-глюкозидів, композицій, що їх містять, та способів їх використання, наприклад, для лікування або профілактики діабету та Синдрому X. Діабет - хронічний розлад, що впливає на метаболізм вуглеводів, жирів та протеїнів у тварин. Цукровий діабет І типу, що включає приблизно 10% від усіх випадків діабету, раніше відносили до інсулін-залежного цукрового діабету ("IDDM") або до діабету, що починається у ранньому віці. Ця хвороба характеризується поступовою втратою бета-клітинами підшлункової залози функції секреції інсуліну. Ця характеристика також розповсюджується на не-ідіопатичний або "вторинний" діабет, що виникає внаслідок хвороби підшлункової залози. Цукровий діабет І типу пов'язаний із наступними клінічними ознаками або симптомами: постійно підвищена концентрація глюкози у плазмі або гіперглікемія; поліурія; полідипсія та/або гіперфагія; хронічні мікросудинні ускладнення, такі, як ретинопатія, нефропатія та нейропатія; та макросудинні ускладнення, такі, як гіперліпідемія та гіпертензія, що можуть призвести до сліпоти, хвороби нирок останньої стадії, ампутації кінцівок та інфаркту міокарду. Цукровий діабет II типу (не-інсуліно-залежний цукровий діабет або NIDDM) - метаболічний розлад, що включає недостатню регуляцію метаболізму глюкози та погіршену чутливість до інсуліну. Цукровий діабет II типу зазвичай розвивається у зрілих осіб та пов'язаний із неспроможністю тіла вживати або виробляти достатню кількість інсуліну. Додатково до резистентності до інсуліну, що спостерігалась у тканинах, що вивчались, пацієнти, хворі на цукровий діабет II типу, мали відносну інсулінову недостатність - тобто, пацієнти мали рівень інсуліну менший, ніж розрахований для даної концентрації глюкози у плазмі. Цукровий діабет II типу характеризується наступними клінічними ознаками або симптомами: постійно підвищена концентрація глюкози у плазмі або гіперглікемія; поліурія; полідипсія та/або гіперфагія; хронічні мікросудинні ускладнення, такі, як ретинопатія, нефропатія та нейропатія; та макросудинні ускладнення, такі як гіперліпідемія та гіпертензія, що можуть призвести до сліпоти, хвороби нирок останньої стадії, ампутації кінцівок та інфаркту міокарду. Синдром X, що також має назву синдрому резистентності до інсуліну (IRS), метаболічного синдрому, або метаболічного синдрому X, зустрічається у 2% діагностичних коронарних характеристик. Часто призводячи до інвалідності, він є симптомом або фактором ризику для розвитку цукрового діабету II типу та серцево-судинного захворювання, включаючи порушену толерантність до глюкози (IGT), знижений рівень глюкози крові натщесерце, гіперінсулінемію, резистентність до інсуліну, дисліпідемію (наприклад, високий рівень тригліцеридів, низький вміст HDL), гіпертензію та ожиріння. Терапія пацієнтів з IDDM завжди концентрувалась на прийманні зовнішнього інсуліну, що може бути отриманий з різних джерел (наприклад, людський, коров'ячий, свинячий інсулін). Використання матеріалу гетерологічних видів призводить до утворення анти-інсулінових антитіл, що мають дію, яка обмежує активність, та призводить до прогресуючої потреби у більших дозах для досягнення бажаного гіпоглікемічного ефекту. Типове лікування цукрового діабету II типу концентрується на підтримці якомога близького до нормального рівня глюкози у крові за допомогою зміни способу життя в тому, що стосується дієти та фізичного навантаження, та, у разі необхідності, лікування антидіабетичними агентами, інсуліном або їх комбінацією. NIDDM, що не можна контролювати за допомогою дієт, лікують за допомогою перорального приймання антидіабетичних агентів. 9 Хоча резистентність до інсуліну не завжди лікується в усіх пацієнтів із синдромом X, тих, хто проявляє переддіабетичний стан (наприклад, IGT, IFG), коли рівень глюкози у крові натщесерце може перевищувати нормальний, але не відповідає критерію діагностики діабету, у деяких країнах (наприклад, у Німеччині) лікують метформіном для запобігання діабету. Антідіабетичні агенти можуть бути поєднані з фармакологічними агентами для лікування супутніх захворювань (наприклад, антигіпертензивними засобами для лікування гіпертензії, гіполіпідемічними агентами для лікування ліпідемії). Пріоритетна терапія зазвичай включає метформін та сульфонілсечовини, а також тіазолідиндіони. Монотерапія метформіном є пріоритетним вибором, особливо для лікування пацієнтів, хворих на діабет II типу, які також страждають на ожиріння та/або дисліпідемію. Відсутність належної реакції на метформін часто призводить до наступного лікування метформіном у поєднанні з сульфонілсечовинами, тіазолідиндіонами або інсуліном. Монотерапія сульфонілсечовинами (включаючи усі покоління ліків) є також розповсюдженим пріоритетним терапевтичним вибором. Іншим пріоритетним терапевтичним вибором можуть бути тіазолідіндіони. Інгібітори альфа-глюкозидази також використовують як пріоритетну та вторинну терапії. Пацієнтам, в яких була відсутня адекватна реакція на пероральну антидіабетичну терапію, дають комбінації вищевказаних агентів. Коли глікемічний контроль не може бути підтриманий лише за допомогою перорального приймання антидіабетичних агентів, застосовують терапію інсуліном, або як монотерапію, або у комбінації з пероральними антидіабетичними агентами. Одна остання розробка у терапії гіперліпідемії сконцентрована на виведенні надлишкової глюкози безпосередньо із сечею. Було показано, що специфічні інгібітори SGLT підвищують виведення глюкози із сечею та знижують рівень глюкози у крові у зразків гризунів з IDDM або NIDDM. Один аспект даного винаходу направлений на способи та композиції для лікування або профілактики діабету, Синдрому X або симптомів, пов'язаних з ними, чи їх ускладнень. Більш особливо, даний винахід направлений на новий спосіб лікування діабету або Синдрому X, або симптомів, пов'язаних з ними, чи їх ускладнень у суб'єкта, що страждає від такого стану, зазначений спосіб включає введення одного або більше інгібіторів реабсорбції глюкози та введення одного або більше антидіабетичного агенту(ів) для лікування діабету або Синдрому X, або симптомів, пов'язаних з ними, чи їх ускладнень. Інший аспект винаходу розкриває сполуки формули (III): 86599 10 в якій: X являє собою СН, N або С=О; R1 являє собою Η або відсутній; R2 являє собою Н, F, СІ, ОСН3, ОСН2СН3, С14алкіл, CF3, SCH3, заміщений або незаміщений феніл та NR3R4; R3 та R4 являють собою Н, С1-6алкіл, або взяті разом з атомом азоту, до якого вони обидва приєднані, утворюють 5-6-членне гетероциклічне кільце з необов'язково 1-2 додатковими гетероатомами, незалежно вибраними з О, S та N; Q являє собою -(СН2)n-, де n означає 1 або 2; Ρ являє собою Н, С2-7ацил або (С16алкокси)карбоніл; та Ζ є заміщеним або незаміщеним та вибраний з С3-7циклоалкілу, фенілу, 5-або 6-членного гетероарилу, який містить 1 або 2 гетероатоми, незалежно вибрані з Ν, О та S, біарилу та 9- або 10членного конденсованого біциклілу або конденсованого гетеробіциклілу, де зазначений конденсований гетеробіцикліл містить 1-4 гетероатоми, незалежно вибрані з Ν, Ο та S; або їх фармацевтично прийнятну сіль. Один аспект винаходу розкриває фармацевтичну композицію, що містить інгібітор реабсорбції глюкози, принаймні, один додатковий антидіабетичний агент та фармацевтично прийнятний носій. Винахід також забезпечує спосіб одержання фармацевтичної композиції, який включає поєднання разом інгібітора реабсорбції глюкози, одного або більше антидіабетичного агента(ів) та фармацевтично прийнятного носія. Втіленням винаходу є спосіб лікування діабету або Синдрому X, або симптомів, пов'язаних з ними, або їх ускладнень у суб'єкта, зазначений спосіб включає введення зазначеному суб'єкту спільно ефективної кількості інгібітора реабсорбції глюкози та введення зазначеному суб'єкту спільно ефективної кількості, принаймні, одного антидіабетичного агента, зазначене об'єднане введення забезпечує бажаний терапевтичний ефект. Іншим втіленням винаходу є спосіб інгібування початку діабету або Синдрому X, або симптомів, пов'язаних з ними, або їх ускладнень у суб'єкта, зазначений спосіб включає введення зазначеному суб'єкту спільно ефективної дози інгібітора реабсорбції глюкози та введення зазначеному суб'єкту спільно ефективної кількості одного або більше антидіабетичного агенту(ів), зазначене об'єднане введення забезпечує бажаний профілактичний ефект. 11 У розкритих способах діабет або Синдром X або симптоми, пов'язані з ними, або їх ускладнення вибрані з IDDM, NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, ретинопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт. Також винахід включає використання одного або більше інгібіторів реабсорбції глюкози в комбінації з одним або більше антидіабетичними агентами для одержання лікарських засобів для лікування стану, вибраного з IDDM, NIDDM, IGT, IFG, ожиріння, нефропатії, невропатії, ретинопатії, атеросклерозу, синдрому полікістозного яєчника, гіпертензії, ішемії, інсульту, серцевої хвороби, синдрому подразненого кишечнику, запалення та катаракт. Всі діабетики, незалежно від їх генетичного та екологічного середовища, сукупно мають виражену нестачу інсуліну або неадекватну функцію інсуліну. Оскільки перенесення глюкози з крові в м'яз та жирову тканину залежить від інсуліну, діабетики відчувають нестачу здатності використовувати глюкозу відповідно, що призводить до небажаного накопичення глюкози в крові (гіперглікемія). Хронічна гіперглікемія призводить до зниження секреції інсуліну та сприяє збільшеній резистентності до інсуліну, та в результаті концентрація глюкози в крові збільшується, так що діабет самозагострюється [Diabetologia, 1985, "Hyperglycaemia as an inducer as well as a consequence of impaired isle cell function and insulin resistance: implications for the management of diabetes", Vol.28, p.119); Diabetes Cares, 1990, Vol.13, No.6, "Glucose Toxicity", pp.610-630]. Таким чином, за допомогою лікування гіперглікемії вищезазначений самозагострений цикл переривається, так що стає можливим профілактика або лікування діабету. [Патент US 6,153,632 R. Rieveley] розкриває спосіб та композицію, заявлені для лікування цукрового діабету (І тип, Порушена толерантність до глюкози ["IGТ"] та II тип), що включають терапевтичну кількість одного або більше сенсибілізаторов інсуліну разом з одним або більше інсуліном, який приймають всередину перорально, інсуліном, який вводять за допомогою ін'єкції, сульфонілсечовиною, бігуанідом або інгібітором альфаглюкозидази для лікування цукрового діабету. Відповідно до одного аспекту, винахід розкриває комбінацію модулятора PPAR, переважно агоніста PPARδ, та інгібітора SGLT, переважно інгібітора SGLT2 або селективного інгібітора SGLT2. А. Терміни Деякі терміни визначено нижче та при їх використанні в цьому описі. Якщо не зазначено інше, як використовується в даній заявці, терміни "алкіл" та "алкокси", які використовуються самі по собі або як частина заміщуючої групи, включають алкіл з прямим, циклічним та розгалуженим ланцюгом, що містить від 1 до 8 атомів вуглецю або будь-яку їх кількість в межах цього діапазону. Наприклад, алкільні радикали включають метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, 2бутеніл, 2-бутиніл, н-пентил, 3-(2-метил)бутил, 2 86599 12 пентил, 2-метилбутил, неопентил, н-гексил, 2гексил та 2-метилпентил. Алкокси радикали являють собою кисневі ефіри, утворені з попередньо описаних алкільних груп з прямим або розгалужених ланцюгом. Алкільна та алкокси група може бути незалежно заміщена від однієї до п'яти, переважно від однієї до трьох, групами, вибраними з галогену (F, СІ, Вr, І), оксо, ОН, аміно, карбоксилу та алкокси. Алкільна та алкокси група також може бути незалежно зв'язана з одним або більше PEG радикалами (поліетилен гліколь). Як використовується в даній заявці, термін "ацил", який використовується сам по собі або як частина замішуючої групи, означає органічний радикал, що містить карбонільну групу, зв'язану з гідрокарбільною групою, що містить від 1 до 7 атомів вуглецю (прямий чи розгалужений ланцюг або циклічний), отриманий з органічної кислоти видаленням гідроксильної групи. Наприклад, С4ацил може включати (СО)СН2СН2СН2СН3 та (СО)(СН2(СН)(СН3)2; так само, С6ацил включає як (СО)(С6Н13), так і (СО)(С6Н5). Термін "Ас", як використовується в даній заявці, який використовується сам по собі або як частина заміщуючої групи, означає ацетил. Термін "арил" являє собою карбоциклічний ароматичний радикал, включаючи, але не обмежуючись, феніл, 1- або 2-нафтил та подібні. Карбоциклічний ароматичний радикал може бути заміщений шляхом незалежної заміни 1-3 атомів водню на ньому на галоген, ОН, CN, меркапто, нітро, аміно, ціано, необов'язково заміщений С1С8-алкіл, необов'язково заміщений алкокси, алкілтіо, алкілсульфініл, алкілсульфоніл, алкіл-аміно, ді(С1-С8-алкіл)аміно, форміл, карбоксил, алкоксикарбоніл, алкоксикарбонілокси, алканоїлокси, феніл, карбамоїл, карбоксамід, ди-нижчий алкілкарбамоїлокси, феноксикарбонілокси групу, нижчий алкілендіокси, бензоїлокси, алкіл-СО-О-, алкіл-ОСО-, -CONH2, алкіл-О-СО-О- або алкіл-CO-NH-. Приклади арильних радикалів включають, наприклад, феніл, нафтил, біфеніл, інден (( дан ( ), ін ), фторфеніл, дифторфеніл, бензил, бензоїлоксифеніл, карбоетоксифеніл, ацетилфеніл, етоксифеніл, феноксифеніл, гідроксифеніл, карбоксифеніл, трифторметилфеніл, метоксіетилфеніл, ацетамідофеніл, толіл, ксиліл, диметилкарбамілфеніл та подібні. "Ph" або "РН" означає феніл. Термін "гетероарил", як використовується в даній заявці, представляє стійку п'яти або шестичленну моноциклічну або біциклічну ароматичну кільцеву систему, яка містить атоми вуглецю та від одного до трьох гетероатомів, вибраних з Ν, Ο та S. Гетероарильна група може бути приєднана при будь-якому гетероатомі або атомі вуглецю, що приводить до утворення стійкої структури. Приклади гетероарильних груп включають, але не обмежуються, бензофураніл, бензотіофеніл, піридиніл, піразиніл, піридазиніл, піримідиніл, тіофеніл, фураніл, імідазоліл, ізоксазоліл, оксазоліл, піразоліл, піроліл, тіазоліл, тіадіазоліл, триазоліл, бензимідазоліл, бензофураніл, бензотієніл, бензизок 13 86599 14 сазоліл, бензоксазоліл, бензопіразоліл, індоліл, бензотіазоліл, бензотіадіазоліл, бензотриазоліл або хінолініл. Переважні гетероарильні групи включають піридиніл, тіофеніл, фураніл та хінолініл. Коли гетероарильна група є заміщеною, гетероарильна група може мати від одного до трьох замісників, які незалежно вибрані з галогену, ОН, CN, меркапто, нітро, аміно, ціано, необов'язково заміщеного С1-С8-алкілу, необов'язково заміщеного алкокси, алкілтіо, алкілсульфінілу, алкілсульфонілу, алкіл-аміно, ді(С1-С8-алкіл)аміно, формілу, карбоксилу, алкоксикарбонілу, алкоксикарбонілокси, алканоїлокси, фенілу, карбамоїлу, карбоксаміду, ди-нижчий алкілкарбамоїлокси, феноксикарбонілокси групи, нижчого алкілендіокси, бензоїлокси, алкіл-СО-О-, алкіл-О-СО-, -CONH2, алкіл-О-СО-Оабо алкіл-СО-NH-. Терміни "гетероцикл", "гетероциклічний" та "гетероцикліл" відносяться до необов'язково заміщеної, повністю або частково насиченої, ароматичної або неароматичної, циклічної групи, яка являє собою, наприклад, 4-7-членну моноциклічну, 7-11членну (або 9-10-членну) біциклічну (або гетеробіциклічну) або 10-15-членну трициклічну кільцеву систему, яка містить, принаймні, один гетероатом в, принаймні, одному кільці, що містить атоми вуглецю. Кожне кільце гетероциклічної групи, що містить гетероатом, може мати 1, 2 або 3 гетероатоми, вибрані з атомів азоту, кисню та сірки, де гетероатоми азоту та сірки також можуть бути необов'язково окиснені. Атоми азоту необов'язково можуть бути кватернізовані. Гетероциклічна група може бути приєднана при будь-якому гетероатомі або атомі вуглецю. Приклади моноциклічних гетероциклічних груп включають піролідиніл; оксетаніл; піразолініл; імідазолініл; імідазолідиніл; оксазоліл; оксазолідиніл; ізоксазолініл; тіазолідиніл; ізотіазолідиніл; тетрагідрофурил; піперидиніл; піперазиніл; 2оксопіперазиніл; 2-оксопіперидиніл; 2оксопіролідиніл; 4-піперидоніл; тетрагідропіраніл; тетрагідротіопіраніл; тетрагідротіопіраніл сульфон; морфолініл; тіоморфолініл; тіоморфолініл сульфоксид; тіоморфолініл сульфон; 1,3-діоксолан; діоксаніл; тієтаніл; тіїраніл; та подібні. Приклади біциклічних гетероциклічних груп (або гетеробіциклілів) включають хінуклідиніл; тетрагідроізохінолініл; дигідроізоіндоліл; дигідрохіназолініл (як наприклад 3,4-дигідро-4-оксо-хіназолініл); дигідробензофурил; дигідробензотієніл; дигідробензотіопіраніл; дигідробензотіопіраніл сульфон; дигідробензопіраніл; індолініл; ізохроманіл; ізоіндолініл; бензимідазоліл, бензтіазоліл; піпероніл; тетрагідрохінолініл; та подібні. Коли гетероарильна група є заміщеною, гетероцикліл незалежно може бути заміщений від однієї до п'яти, переважно від однієї до трьох, групами, вибраними з галогену, ОН, CN, меркапто, нітро, аміно, ціано, необов'язково заміщеного С1-С8-алкілу, необов'язково заміщеного алкокси, алкілтіо, алкілсульфінілу, алкілсульфонілу, алкіл-аміно, ді(С1-С8-алкіл)аміно, формілу, карбоксилу, алкоксикарбонілу, алкоксикарбонілокси, алканоїлокси, фенілу, карбамоїлу, карбоксаміду, ди-нижчий алкілкарбамоїлокси, феноксикарбонілокси групи, нижчого алкілендіокси, бензоїлокси, алкіл-СО-О-, алкіл-О-СО-, -CONH2, алкіл-О-СО-Оабо алкіл-CO-NH-. Термін "біарил" включає гетероарил, зв'язаний з фенілом, феніл, зв'язаний з гетероарилом (таким як тіофен, піридин та піразол) та феніл, зв'язаний з фенілом. Приклади феніл-фенілу, гетероарилфенілу, гетероарил-фенілу та феніл-гетероарилу, відповідно, включають: Під терміном "композиція" мається на увазі продукт, що містить вказані інгредієнти у вказаних кількостях, а також будь-який продукт, який виникає, безпосередньо або побічно, з комбінації вказаних інгредієнтів у вказаних кількостях. Термін "об'єднане введення" включає спільне введення, де: 1) два або більше агентів вводять суб'єкту в, по суті, один і той же час; та 2) два або більше агентів вводять суб'єкту в різний час, з незалежними проміжками, які можуть або не можуть частково перекриватися або співпадати. Термін "суб'єкт", як використовується в даній заявці, відноситься до тварини, переважно ссавця, найбільш переважно людини, яка є об'єктом лікування, нагляду або експерименту. Термін "модулятор RXR", як використовується в даній заявці, відноситься до агоністів, часткових агоністів або антагоністів рецептора ретиноїда X. Переважно модулятор збільшує чутливість до інсуліну. Відповідно до одного аспекту, модулятор є агоністом RXR. Діабет, Синдром X та симптоми, пов'язані з ними, або їх ускладнення включають такі стани, як IDDM, NIDDM, IGT, IFG, ожиріння, нефропатія, невропатія, ретинопатія, атеросклероз, синдром полікістозного яєчника, гіпертензія, ішемія, інсульт, серцева хвороба, синдром подразненого кишечнику, запалення та катаракти. Приклади переддіабетичного стану включають IGT та IFG. З рівня техніки відомі способи визначення ефективних доз для терапевтичних та профілактичних цілей для описаних фармацевтичних композицій або описаних лікарських комбінацій, так чи інакше виготовлених в тих же самих композиціях. Для терапевтичних цілей, термін "спільно ефективна кількість", як використовується в даній заявці, означає ту кількість кожної активної сполуки або фармацевтичного агента, самого по собі або в комбінації, яка викликає біологічну або лікарську реакцію в тканинній системі, тварині або людині, що шукає дослідник, ветеринар, медичний лікар або інший клінічній лікар, яка включає полегшення 15 симптомів хвороби або розладу, що лікують. Для профілактичних цілей (тобто, інгібування початку або розвитку розладу) термін "спільно ефективна кількість" відноситься до тієї кількості кожної активної сполуки або фармацевтичного агента, самого по собі або в комбінації, яка інгібує у суб'єкта початок або розвиток розладу, яку шукає дослідник, ветеринар, медичний лікар або інший клінічній лікар, затримка цього розладу опосередкована модуляцією активності реабсорбції глюкози або іншої активності антидіабетичного агента або обох. Таким чином, даний винахід забезпечує комбінації двох або більше лікарських засобів, де, наприклад, (а) кожний лікарський засіб вводять в незалежно терапевтично або профілактично ефективній кількості; (b) принаймні, один лікарський засіб в комбінації вводять в кількості, яка є субтерапевтичною або суб-профілактичною, якщо вводять лише його, але є терапевтичною або профілактичною, коли його вводять в комбінації з другим або додатковим лікарським засобом відповідно до винаходу; або (с) обидва лікарські засоби вводять в кількості, яка є суб-терапевтичною або суб-профілактичною, якщо їх вводять по-одному, але є терапевтичною або профілактичною, коли їх вводять разом. Термін "захисні групи" відноситься до тих компонентів, відомих з рівня техніки, які використовують для маскування функціональних груп; захисні групи можуть бути видалені протягом подальших синтетичних перетворень або за допомогою метаболічних або інших in vivo умов введення. Протягом будь-якого з процесів одержання сполук за даним винаходом, може бути необхідним та/або бажаним захистити чутливі або хімічно активні групи на будь-якій з молекул, яких це стосується. Це може бути досягнуто за допомогою традиційних захисних груп, таких як описано в [Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; та T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley & Sons, 1999]. Захисні групи можуть бути видалені на придатній подальшій стадії, використовуючи способи, відомі з рівня техніки. Приклади гідроксил та діол захисних груп наведено нижче. Захист для гідроксильних груп включає метилові ефіри, заміщені метилові ефіри, заміщені етилові ефіри, заміщені бензилові ефіри та силілові ефіри. Заміщені метилові ефіри Приклади заміщених метилових ефірів включають метилоксиметил, метилтіометил, третбутилтіометил, (фенілдиметилсиліл)метоксиметил, бензилоксиметил, рметоксибензилоксиметил, (4метоксифенокси)метил, трет-бутоксиметил, 4пентенілоксиметил, силоксиметил, 2метоксіетоксиметил, 2,2,2-трихлоретоксиметил, біс(2-хлоретокси)метил, 2(триметилсиліл)етоксиметил, тетрагідропіраніл, 3бромтетрагі дропіраніл, тетрагідротіопіраніл, 1метоксициклогексил, 4-метокситетрагідропіраніл, 4-метокситетрагідротіопіраніл, 4метокситетрагідротіопіраніл 8,8-діоксидо, 1-[(2 86599 16 хлор-4-метил)феніл]-4-метоксипіперидин-4-іл, 1,4діоксан-2-іл, тетрагідрофураніл, тетрагідротіофураніл та 2,3,3а,4,5,6,7,7а-октагідро-7,8,8-триметил4,7-метанобензофуран-2-іл. Заміщені етилові ефіри Приклади заміщених етилових ефірів включають 1-етоксіетил, 1-(2-хлоретоксі)етил, 1-метил-1метоксіетил, 1-метил-1-бензилоксіетил, 1-метил-1бензилокси-2-фторетил, 2,2,2-трихлоретил, 2триметилсилілетил, 2-(фенілселеніл)етил, третбутил, аліл, р-хлорфеніл, р-метоксифеніл, 2,4динітрофеніл, бензил та ефіри поліетиленгліколю. Заміщені бензилові ефіри Приклади заміщених бензилових ефірів включають р-метоксибензил, 3,4-диметоксибензил, онітробензил, р-нітробензил, р-галобензил, 2,6дихлорбензил, р-ціанобензил, р-фенілбензил, 2та 4-піколіл, З-метил-2-піколіл N-оксид, дифенілметил, p,p'-динітробензгідрил, 5-дибензосуберіл, трифенілметил, α-нафтилдифенілметил, рметоксифенілдифенілметил, ди(рметоксифеніл)фенілметил, три(рметоксифеніл)метил, 4-(4'бромфенацилокси)фенілдифенілметил, 4,4',4"трис(4,5-дихлорфталімідофеніл)метил, 4,4',4''трис(левуліноїлоксифеніл)метил, 4,4',4"трис(бензоїлоксифеніл)метил, 3-(імідазол-1ілметил)біс(4',4"-диметоксифеніл)метил, 1,1-біс(4метоксифеніл)-1'-піренілметил, 9-антрил, 9-(9феніл)ксантеніл, 9-(9-феніл-10-оксо)антрил, 1,3бензодитіолан-2-іл та бензизотіазоліл 8,8діоксидо. Силілові ефіри Приклади силілових ефірів включають триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилтексилсиліл, трет-бутилдиметилсиліл, третбутилдифенілсиліл, трибензилсиліл, три-рксилілсиліл, трифенілсиліл, дифенілметилсиліл та трет-бутилметоксифенілсиліл. Складні ефіри На додаток до простих ефірів, гідроксильна група може бути захищена як складний ефір. Приклади складних ефірів включають форміат, бензоїлформіат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксіацетат, трифенілметоксіацетат, феноксіацетат, рхлорфеноксіацетат, р-Р-фенілацетат, 3фенілпропіонат, 4-оксопентаноат(левулінат), 4,4(етилендитіо)пентаноат, півалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, рфенілбензоат, 2,4,6-триметилбензоат(мезитоат) та ефіри поліетиленгліколю. Карбонати Приклади карбонатів включають метил, 9флуоренілметил, етил, 2,2,2-трихлоретил, 2(триметилсиліл)етил, 2-(фенілсульфоніл)етил, 2(трифенілфосфоніо)етил, ізобутил, вініл, аліл, рнітрофеніл, бензил, р-метоксибензил, 3,4диметоксибензил, о-нітробензил, р-нітробензил, Sбензил тіокарбонат, 4-етокси-1-нафтил, метил дитіокарбонат та карбонати поліетиленгліколю. Допоміжне розщеплення Приклади допоміжного розщеплення включають 2-йодобензоат, 4-азідобутират, 4-нітро-4 17 86599 метилпентаноат, о-(дибромметил)бензоат, 2формілбензолсульфонат, 2-(метилтіометоксі)етил карбонат, 4-(метилтіометокси)бутират та 2(метилтіометоксиметил)бензоат. Змішані ефіри Приклади змішаних ефірів включають 2,6дихлор-4-метилфеноксіацетат, 2,6-дихлор-4(1,1,3,3-тетраметилбутил)феноксіацетат, 2,4біс(1,1-диметилпропіл)феноксіацетат, хлордифенілацетат, ізобутират, моносукциноат, (Е)-2-метил2-бутеноат(тиглоат), о-(метоксикарбоніл)бензоат, р-Р-бензоат, α-нафтоат, нітрат, алкіл Ν,Ν,Ν',Ν'тетраметилфосфородіамідат, N-фенілкарбамат, борат, диметилфосфінотіоїл та 2,4динітрофенілсульфенат. Сульфонати Приклади сульфонатів включають сульфат, метансульфонат(мезилат), бензилсульфонат та тозилат. Захист для 1,2- та 1,3-діолів Циклічні ацеталі та кеталі Приклади циклічних ацеталів та кеталів включають метилен, етиліден, 1-трет-бутилетиліден, 1фенілетиліден, (4-метоксифеніл)етиліден, 2,2,2трихлоретиліден, ацетонід (ізопропіліден), циклопентиліден, циклогексиліден, циклогептиліден, бензиліден, р-метоксибензиліден, 2,4диметоксибензиліден, 3,4-диметоксибензиліден та 2-нітробензиліден. Циклічні орто ефіри Приклади циклічних орто ефірів включають метоксиметилен, етоксиметилен, диметоксимети 18 лен, 1-метоксіетиліден, 1-етоксіетиліден, 1,2диметоксіетиліден, α-метоксибензиліден, 1-(N,Nдиметиламіно)етиліден похідне, α-(N,Nдиметиламіно)бензиліден похідне та 2оксациклопентиліден. Похідні силілу Приклади похідних силілу включають групу дитрет-бутилсилілен та 1,3-(1,1,3,3тетраізопропілдисилоксаніліден) похідне. Інгібітори реабсорбції глюкози Одним з методів лікування гіперглікемії є виведення надлишкової глюкози безпосередньо із сечею, нормалізуючи таким чином концентрацію глюкози у крові. Наприклад, ко-транспортери натрію/глюкози (SGLT), що, в основному, знаходяться у хоріонічній мембрані кишечнику та нирок, є родиною протеїнів, що приймають активну участь у нормальному процесі абсорбції глюкози. Серед них, SGLT1 присутній в клітинах епітелію кишечнику та нирок [Lee at al., 1994], тоді як SGLT2 знайдено в епітелію нирок [You et al., 1995, MacKenzie et al., 1994]. Абсорбція глюкози у кишечнику відбувається, головним чином, через SGLT1, транспортер з високою афінністю та низькою здатністю до перенесення, із співвідношенням переносу Na+:глюкоза-2:1. SGLT2, відомий також як SAAT1, переносить Na+ та глюкозу у співвідношенні 1:1 та діє як транспортер із низькою афінністю та високою здатністю до перенесення. Ці SGLT охарактеризовані у Таблиці 1: Таблиця 1 Ізоформ Тканина Стехіометрія Тонкий кишечник 2:1 Нирки (S1,S3) 2:1 Нирки (S3) 1:1 SGLT1 SGLT2 SAAT1 Переважний субстрат D-глюкоза D-галактоза D-глюкоза D-галактоза D-глюкоза Km*, in vitro TmG** in vitro Km*, in vivo од Дані відсутні Дані відсутні 0,39 7,9 0,3 1,64 83 6 *(мМ) для D-глюкози ** Максимальна швидкість перенесення пмоль/хв/мм Ниркова реабсорбція глюкози відбувається через SGLT1 та SGLT2 [Silverman et al., 1992; Deetjen et al., 1995]. Глюкоза у плазмі фільтрується у гломерулах та трансепітеліально реабсорбується у проксимальних трубочках. SGLT1 та SGLT2 розташовані в апікальних плазматичних мембранах епітелію та отримують енергію із внутрішнього градієнту концентрацій натрію, що створюється АТР-насосами Na+/K+, розташованими у базолатеральній мембрані. Після реабсорбції підвищена цитозольна глюкоза переноситься до міжвузловини полегшеними транспортерами глюкози (GLUT1 та GLUT2). Тому інгібування SGLT зменшує рівень глюкози у плазмі шляхом пригнічення реабсорбції глюкози у нирках. Терапевтично або профілактично ефективну кількість інгібітору SGLT, наприклад, достатню для підвищення виве дення глюкози із сечею, або для зниження вмісту глюкози у плазмі, у суб'єкта по відношенню до бажаної кількості на день, може бути легко визначена за допомогою способів, відомих з рівня техніки. Нещодавно було знайдено, що флоризин, природний глюкозид, що знаходиться у корі та стеблі Rosaceae (наприклад, яблук, груш та інш.), інгібує ко-транспортери Nа+-глюкози, розташовані у хоріонічній мембрані кишечнику та нирок. Шляхом інгібування активності ко-транспортеру №+-глюкози, флоризин інгібує реабсорбцію глюкози у ниркових канальцях та сприяє виведенню глюкози таким чином, що рівень глюкози у плазмі зберігається на нормальному рівні протягом тривалого часу за допомогою підшкірного щоденного введення [Journal of Clinical Investigation, 1987, Vol.79, p.1510]. 19 Інші інгібітори SGLT включають алкіл- та фенил-глюкозиди, 1-5-ізохінолінсульфоніл)-2метилпіперазин-НСl (опосередковано через протеїн кіназу С), р-хлорртутьбензоат (РСМВ), Ν,Ν'дициклогексилкарбодіімід (DCCD), іони міді та кадмію та тривалентні лантаніди. В. Сполуки Винахід розкриває сполуки Формули (III): в якій: X являє собою СН, N або С=О; R1 являє собою Η або відсутній; R2 являє собою Н, F, СІ, ОСН3, ОСН2СН3, С14алкіл, CF3, SCH3, заміщений або незаміщений феніл та NR3R4; R3 та R4 являють собою Н, С1-6алкіл, або взяті разом з атомом азоту, до якого вони обидва приєднані, утворюють 5-6-членне гетероциклічне кільце з необов'язково 1-2 додатковими гетероатомами, незалежно вибраними з О, S та N; Q являє собою -(СН2)n-, де n означає 1 або 2; Ρ являє собою Н, С2-7ацил або (С16алкокси)карбоніл; та Ζ є заміщеним або незаміщеним та вибраний з С3-7циклоалкілу, фенілу, 5-або 6-членного гетероарилу, який містить 1 або 2 гетероатоми, незалежно вибрані з Ν, Ο та S, біарилу та 9- або 10членного конденсованого біциклілу або конденсованого гетеробіциклілу, де зазначений конденсований гетеробіцикліл містить 1-4 гетероатоми, незалежно вибрані з Ν, Ο та S; або їх фармацевтично прийнятну сіль. Приклади сполук Формули (III) включають сполуки, в яких: (a) R1 являє собою Η або відсутній; (b) R2 являє собою Н, метил або етил; (с) Q являє собою -(СН2)n- та n означає 1; (d) Z незалежно заміщений 1-3 замісниками, незалежно вибраними з С1-4алкокси, фенокси, С1-4алкілу, С36циклоалкілу, гало, гідрокси, ціано, аміно, С14алкілтіо, С1-4алкілсульфонілу, С1-4алкілсульфінілу, С1-4аміноалкілу, моно- та ді(С1-4алкіл)аміно, фенілу, С1-4алкіламіносульфонілу (SO2NHR), аміно(алкілсульфоніл) (-NHSO2R-), С14діалкіламіносульфінілу (SONHRR), С1-4алкіламідо (NHCOR), С1-4алкілкарбамідо (CONHR), 5-6 членного гетероциклілу, який містить 1-3 гетероатоми, незалежно вибрані з N, S та О; та де замісник(и) на Ζ може бути додатково незалежно заміщений 1-3 замісниками, незалежно вибраними з С14алкокси, С1-4алкілу, гало, гідрокси, ціано, аміно, моно або діС1-4алкіламіно та С1-4алкілтіо; (e) Ζ являє собою 4-заміщений феніл, 3,4-дизаміщений феніл, бензгідрил, заміщений або незаміщений тіофен, біарил, бензофураніл, дигідробензофура 86599 20 ніл, 4-заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3дигідро-бензо[1,4]діоксаніл; (f) Z є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу; (g) Z являє собою біфеніл, 4-(3-піридил)феніл, 4-(2тієніл)феніл, 4-(1Н-імідазол-1-іл)-феніл, 4-(1Нпіразол-1-іл)-феніл, (4-пропіл)феніл, (4етил)феніл, (4-метоксифеніл), дигідробензофуран5-іл, або дигідробензофуран-6-іл; (h) R1 відсутній, X являє собою СН; та R2 являє собою Н, метил, етил або метокси; (і) Q являє собою -(СН2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил; (j) обмеження (і) та R1 відсутній; (k) R1 відсутній; Q являє собою -(СН2)n-; n означає 1 або 2; та R2 являє собою Н, метил або етил; та Ζ являє собою 4-заміщений феніл, 3,4-дизаміщений феніл, бензгідрил, заміщений або незаміщений тіофен, біарил, бензофураніл, дигідробензофураніл, 4заміщений піридил, бензо[b]тієніл, хроманіл, бензотіофеніл, інденіл, інданіл, нафтил або 2,3дигідро-бензо[1,4]діоксаніл; (l) Ζ являє собою біфеніл, 4-(3-піридил)феніл, 4-(2-тієніл)феніл, 4-(1Німідазол-1-іл)-феніл, 4-(1Н-піразол-1-іл)-феніл, (4етил)феніл, (4-метоксифеніл), дигідробензофуран5-іл або дигідробензофуран-6-іл; та Ζ незаміщений або заміщений 1-2 замісниками, незалежно вибраними з метокси, етокси, фтору, хлору, метилу, етилу, пропілу, бутилу та ізопропілу; (m) та комбінації зазначеного вище. Приклади найбільш переважних сполук включають сполуки, вибрані з 2-{3-[2-(2,3-Дигідробензофуран-5-іл)-етил]-3Н-бензоімідазол-4ілокси}-β-D-глюкопіранозиду; 2-[3-(4-Етил-бензил)3Н-бензотриазол-4-ілокси]-β-D-глюкопіранозиду та 2-[3-(4-Етил-бензил)-3Н-бензоімідазол-4-ілокси]-βD-глюкопіранозиду. Додаткові приклади переважних сполук включають сполуки, вибрані з 2-[3-(4-Етил-бензил)-6метил-3Н-бензоімідазол-4-ілокси]-β-Dглюкопіранозиду; 2-{3-[2-(4-Метоксифеніл)-етил]3Н-бензоімідазол-4-ілокси}-β-D-глюкопіранозиду; 2-{3-[2-(4-Метоксифеніл)-етил]-3Н-бензотриазол-4ілокси}-β-D-глюкопіранозиду; 2-[3-(2-Нафтален-2іл-етил)-3Н-бензоімідазол-4-ілокси]-β-Dглюкопіранозиду та 2-[3-(4-Етил-бензил)-1,3дигідро-бензоімідазол-2-он-4-ілокси]-β-Dглюкопіранозиду. Подальші приклади сполук за винаходом включають сполуки, вибрані з 2-[3-(2-Нафтален-2іл-етил)-1,3-дигідро-бензоімідазол-2-он-4-ілокси]β-D-глюкопіранозиду та 2-[3-(2-(4-Метоксифеніл)етил)-1,3-дигідро-бензоімідазол-2-он-4-ілокси]-β-Dглюкопіранозиду. Додаткові переважні сполуки включають сполуки, вибрані з 2-[3-(5-Етил-тіофен-2-ілметил)-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-{3[2-(2,3-Дигідро-бензофуран-5-іл)-етил]-6-метил-3Нбензоімідазол-4-ілокси}-β-D-глюкопіранозиду; 2-[3(4-Тіофен-3-іл-бензил)-3Н-бензоімідазол-4-ілокси]β-D-глюкопіранозиду; 2-[3-(4-Піразол-1-iл-бeнзил)3H-бeнзoiмiдaзoл-4-iлoкcи]-β-D-глюкопіранозиду; 2-[3-(4-Піридин-3-іл-бензил)-3Н-бензоімідазол-4ілокси]-β-D-глюкопіранозиду; 2-[3-(4-Пірол-1-iл 21 бeнзил)-3H-бeнзoiмiдaзoл-4-iлoкcи]-β-Dглюкопіранозиду; 2-[3-(4-Імідозол-1-іл-бензил)-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-(3Бiфeнiл-4-iлмeтил-3H-бeнзoiмiдaзoл-4-iлoкcи)-β-Dглюкопіранозиду; 2-[3-(4-Етил-бензил)-6-метокси3Н-бензоімідазол-4-ілокси]-β-D-глюкoпipaнoзидy; 2-[3-(4-Етил-бензил)-6-трифторметил-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-{3[2-(2,3-Дигідро-бензофуран-5-іл)-етил]-6-метил-3Нбензотриазол-4-ілокси}-β-D-глюкопіранозиду; 2-{3[2-(2,3-Дигідро-бензофуран-5-іл)-етил]-3Нбензотриазол-4-ілокси}-β-D-глюкопіранозиду та 2[3-(4-Етил-бензил)-6-метил-3Н-бензотриазол-4ілокси}-β-D-глюкопіранозиду. Більш переважні сполуки за винаходом включають сполуки, вибрані з 2-[3-(4-Етил-бензил)-3Hбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-{3[2-(2,3-Дигідро-бензофуран-5-іл)-етил]-3Hбензоімідазол-4-ілокси}-β-D-глюкопіранозиду; 2-[3(4-Етил-бензил)-3H-бензотриазол-4-ілокси]-β-Dглюкопіранозиду; 2-[3-(4-Етил-бензил)-6-метил-3Hбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-{3[2-(4-метокси-феніл)-етил]-3H-бензотриазол-4ілокси}-β-D-глюкопіранозиду; 2-[3-(5-Етил-тіофен2-ілметил)-3Н-бензоімідазол-4-ілокси]-β-Dглюкопіранозиду; 2-{3-[2-(2,3-Дигідро-бензофуран5-іл)-етил]-6-метил-3H-бензоімідазол-4-ілокси}-βD-глюкопіранозиду; 2-[3-(4-Тіофен-3-іл-бензил)-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозиду; 2-[3(4-Пірол-1-іл-бензил)-3H-бензоімідазол-4-ілокси]β-D-глюкопіранозиду; 2-{3-[2-(2,3-Дигідробензофуран-5-іл)-етил]-6-метил-3Н-бензоімідазол4-ілокси}-β-D-глюкопіранозиду; 2-{3-[2-(2,3-Дигідробензофуран-5-іл)-етил]-6-метил-3H-бензотриазол4-ілокси}-β-D-глюкопіранозиду; 2-{3-[2-(2,3-Дигідробензофуран-5-іл)-етил]-3H-бензотриазол-4-ілокси} 86599 22 β-D-глюкопіранозиду та 2-[3-(4-Етил-бензил)-6метил-3H-бензотриазол-4-ілокси}-β-D-глюкопіранозиду. С. Способи синтезу. Один аспект винаходу описує сполуки формули (III). Ці сполуки можуть бути одержані за допомогою традиційних способів органічного синтезу або матриці чи способів комбінаторного синтезу. Наступні схеми та хімічні Приклади 1-10 забезпечують загальну інструкцію. Сполуки за даним винаходом, в яких η означає 1 або 2 та R1, R2, X та Ζ визначені, як у Формулі (III), можуть бути одержані, як наведено на Схемі 1. Сполуки Формули 1, в яких R2 являє собою Н, можуть бути одержані за допомогою перегрупування Курциуса комерційно доступної 3-метокси-2нітробензойної кислоти, з наступною обробкою трет-бутанолом при температурах кипіння зі зворотним холодильником, як описано Orjales et.al. [J. Med. Chem. 1997, 40, 586], та гідрогенізацією, що каталізована паладієм, для відновлення нітрогрупи. Подальше ацилювання одержаної проміжної сполуки діаміну заміщеними ацил хлоридами в присутності основи, такої як триетиламін, в хлорованому розчиннику або обробка заміщеною карбоновою кислотою, EDCI та HOBt у відповідному розчиннику, такому як DMF, з наступним відновленням одержаного аміду борановим комплексом тетрагідрофурану або алюмогідридом літію в розчиннику, такому як тетрагідрофуран (THF), при температурах від 20°С до температури кипіння зі зворотним холодильником може надати сполуки Формули 2, в яких η означає 1 або 2. Сполуки Формули 2 можуть бути одержані безпосередньо за допомогою обробки проміжної сполуки діаміну 23 заміщеними бензальдегідами в присутності оцтової кислоти та ціаноборгідриду натрію. Видаленням трет-бутоксикарбонільної (ВОС) захисної групи в присутності кислоти, такої як соляна або трифтороцтова кислота, одержують сполуки Формули 4, в яких R2 являє собою Н, та Р1 є метилом. Альтернативно, комерційно доступний 2аміно-3-нітрофенол може бути ацильований заміщеними ацил хлоридами або карбоновими кислотами, як описано вище, потім оброблений TBDMSCl або МОМВr, з одержанням сполук Формули 3, в яких m означає 0 або 1. Нітрогрупа потім може бути відновлена, використовуючи гідрогенізацією, що каталізована паладієм, з наступним борановим відновленням аміду з одержанням сполук Формули 4, в яких R2 являє собою Н, та Р1 являє собою TBDMS або MOM. Сполуки Формули 4, в яких R2 означає групи, крім Н, наведені у визначеннях вище, можуть бути одержані ацилюванням комерційно доступних 5заміщених 2-амінофенолів заміщеними ацил хлоридами або карбоновими кислотами, як описано вище, з наступним захистом фенольної гідроксильної групи метильною або півалоїльною групою, використовуючи методики, відомі з рівня техніки. Вихідні заміщені феноли, що не можуть бути легко отримані з комерційних джерел, можуть бути одержані, виходячи з відповідно заміщених фенолів, захищаючи гідроксильну групу, потім застосовуючи стандартні способи, відомі з рівня техніки [Ogawa, Μ. et. al. ЕР 579204; Widdowson, et. al. US 5780483], для обміну або розширення функціональності в положенні R2 одержують сполуки Формули 5, в яких R2 є таким, як визначено в Формулі (III). Сполуки Формули 5 можуть бути перетворені на сполуки Формули 6 прямим нітруванням або за допомогою початкової стадії бромування, використовуючи бром або N-бромсукцинамід (NBS) в розчинниках, таких як тетрахлорид вуглецю або хлороформ, з наступним нітруванням. Прийнятні реагенти для нітрування включають тетрафторборат нітронію, який може бути додавали до розчину проміжної сполуки в розчиннику, такому як ацетонітрил, при температурах між 0°С та 20°С або нітрит амонію в присутності трифтороцтового ангідриду в хлорованому розчиннику. Гідрогенізація, каталізована паладієм, в полярному розчиннику, подібному до метанолу, етанолу або 2-пропанолу, може одночасно відновлювати нітрогрупу та видаляти бром зі сполук Формули 6. Відновлення аміду, використовуючи борановий комплекс тетрагідрофурану, як попередньо описано, може забезпечити сполуки діаміну Формули 4, в яких R2 означає групи, визначені у Формулі (III). Сполуки Формули 2 можуть бути розчинені в DMF та нагріті в присутності основи, такої як карбонат калію, при 130°С на масляній бані протягом від однієї до двох годин, щоб безпосередньо одержати сполуки Формули 7, в яких Р1 є метилом. Альтернативно, сполуки Формули 4 можуть бути перетворені на сполуки Формули 7, в яких Ρ1 являє собою TBDMS, MOM або півалоїл, обробкою трифосгеном, сечовиною або карбонілдіімідазолом, використовуючи відомі методики. 86599 24 Крім того, сполуки Формули 4 можуть бути нагріті з триетилортоформіатом в присутності каталітичної кількості р-толуолсульфонової кислоти при 120°С протягом від трьох до чотирьох годин з одержанням сполук Формули 8 або оброблені нітритом натрію в кислих умовах при 0°С з одержанням сполук Формули 9. Видалення захисних груп Ρ1 з одержанням сполук Формули 10 може бути досягнуте, використовуючи відомі способи, описані Greene та Wuts [Protecting Groups in Organic Chemistry, 3rd. Ed; Wiley Interscience]. Сполуки Формули 11 можуть бути одержані зі сполук Формули 10 за допомогою глюкозидування фенольної групи 2,3,4,6-тетра-О-ацетил-α-Dглюкопіранозил бромідом у відповідному розчиннику, такому як ацетон, ацетонітрил або DMF, в основних умовах, таких як карбонат калію, карбонат літію або гідроксид літію, з наступним депротектуванням ацетильних груп в спиртовому розчиннику, такому як метанол, використовуючи м'які основні умови, такі як карбонат калію або метоксид натрію, при кімнатній температурі. Сполуки Формули 12 можуть бути одержані додаванням змішаних імідазоліл карбонатів до суміші сполук Формули 11 та основи, такої як NaH. Змішані імідазоліли можуть бути одержані за допомогою реакції еквімолярних кількостей спирту з карбонілдіімідазолом при 0°С та їм може бути віддана перевага над нестерично потрібними реагентами, такими як алкіл хлорформіат, щоб регіоселективно ацилювати 6-ОН групу глюкози [Bertolini, et.al. JOC 1998, 63, 6031]. D. Додаткові антидіабетичні агенти Антидіабетичні агенти, які можуть бути використані відповідно до винаходу, як другий, третій або подальший антидіабетичний агент, в композиції, препараті або комбінаційному способі лікування (режим дозування) включають, але не обмежуються, класи та сполуки, що наведені, як приклад в Таблиці 2. 25 86599 26 27 Ε. Комбінації Винахід розкриває комбінаційну терапію, що включає введення інгібітора реабсорбції глюкози, такого як інгібітор SGLT, та одного або більше антидіабетичного агенту(ів) для лікування діабету або Синдрому X, або симптомів, пов'язаних з ними, або їх ускладнень. Продемонстрована ефективність інгібіторів SGLT в численних моделях NIDDM підтверджує корисність цих лікарських засобів тільки для лікування NIDDM в людях. Оскільки інгібітори реабсорбції глюкози мають механізм дії, відмінний від механізму дії інших антидіабети 86599 28 чних агентів, таких як модулятори RXR, описана комбінація може мати перевагу щодо зниження кількості кожного лікарського засобу, необхідної для досягнення спільної терапевтичної або фармацевтичної ефективності, пов'язаної з використанням кожного лікарського засобу самого по собі, таким чином знижуючи один або більше несприятливих побічних ефектів, які часто включають приріст маси, набряк, гіпертрофію серця, гепатогіпертрофію, гіпоглікемію або гепатотоксичність, або будь-яку їх комбінацію. Винахід забезпечує спосіб лікування діабету або Синдрому X, або їх ускладнень у суб'єкта, який включає введення зазначеному суб'єкту спільно ефективної кількості інгібітора реабсорбції глюкози в комбінації із спільно ефективною кількістю антидіабетичного агента, такого як модулятор RXR. В одному аспекті винаходу, антидіабетичним агентом є агоніст RXR або антагоніст RXR, що збільшує чутливість до інсуліну у суб'єкта. Наприклад, сенсибілізатор інсуліну може збільшувати толерантність до глюкози у суб'єкта в пероральному випробуванні на толерантність до глюкози. Переважно, діабет або Синдром X, або симптоми, пов'язані з ними, або їх ускладнення вибрані з IDDM, NIDDM, IGT та IFG. Даний винахід також забезпечує фармацевтичну композицію, що містить один або більше інгібіторів реабсорбції глюкози (самих по собі або в комбінації з одним або більше антидіабетичними агентами) та фармацевтично прийнятний носій. В одному аспекті винаходу, антидіабетичним агентом є агоніст RXR або антагоніст RXR, що збільшує чутливість до інсуліну у суб'єкта. Зокрема, інгібітором реабсорбції глюкози є інгібітор SGLT1 та/або SGLT2. Для використання в медицині, сіль або солі сполук Формули (V) відносяться до нетоксичної "фармацевтично прийнятної солі або солей". Проте, інші солі можуть бути корисні при одержанні сполук відповідно до даного винаходу або їх фармацевтично прийнятних солей. Характерні органічні або неорганічні кислоти включають, але не обмежуються, соляну кислоту, бромистоводневу кислоту, йодистоводневу кислоту, перхлорну кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, молочну кислоту, бурштинову кислоту, малеїнову кислоту, фумарову кислоту, яблучну кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, гідроксіетансульфонову кислоту, бензолсульфонову кислоту, щавлеву кислоту, памову кислоту, 2-нафталенсульфонову кислоту, ртолуолсульфонову кислоту, циклогексансульфамінову кислоту, саліцилова кислоту, цукрову кислоту або трифтороцтову кислоту. Характерні основні/кислотні солі включають, але не обмежуються, солі бензатину, хлорпрокаїну, холіну, діетаноламіну, етилендіаміну, меглуміну, прокаїну, алюмінію, кальцію, літію, магнію, калію, натрію або цинку. Сполуки Формули (V) або їх фармацевтично прийнятна сіль можуть включати їх внутрішньомолекулярну сіль або їх сольват, або гідрат. 29 F. Введення, препарати та дозування Корисність розкритих сполук, композицій та комбінацій для лікування розладів в метаболізмі глюкози та ліпідів може бути визначена відповідно до методик, добре відомих з рівня техніки (див. посилання, наведені нижче), а також і всіх методик, описаних в патентах [US 5424406, 5731292, 5767094, 5830873, 6048842, WO01/16122 та WO01/16123], які включені в дану заявку за допомогою посилання. Сполука може бути введена пацієнту будь-яким традиційним шляхом введення, включаючи, але не обмежуючись, внутрішньовенне, пероральне, підшкірне, внутрішньом'язове, інтрадермальне та парентеральне введення. Переважно, препарати призначені для перорального введення. Даний винахід також забезпечує фармацевтичні композиції, що містять один або більше інгібіторів реабсорбції глюкози та один або більше модуляторів RXR в сполученні з фармацевтично прийнятним носієм. Щоденне дозування продуктів може змінюватися в широкому діапазоні від 1 до 1000мг для дорослої людини на день. Для перорального введення композиції переважно забезпечені у формі таблеток, що містять 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 або 500 міліграм активного інгредієнта для симптоматичного регулювання дозування для пацієнта, якого лікують. Сполуки можуть бути введені в режимі 1-2 рази на день. Проте, дозування може змінюватися, в залежності від потреб пацієнтів, тяжкості стану, що лікують, та сполуки, що застосовують. Може використовуватися або щоденне введення, або постперіодичне дозування. Переважно ці композиції знаходяться у формах одиничного дозування, таких як таблетки, пілюлі, капсули, порошки, гранули, стерильні парентеральні розчини або суспензії, дозований аерозоль або рідкі спреї, краплі, ампули, автоінжекторні пристрої або супозиторії; для перорального, парентерального, інтраназального, під'язикового або ректального введення, або для введення шляхом інгаляції або вдування. Альтернативно, композиція може бути представлена у формі, прийнятній для введення один раз на тиждень або один раз на місяць; наприклад, нерозчинна сіль активної сполуки, така як сіль деканової кислоти, може бути пристосована, щоб забезпечити запасну підготовку для внутрішньом'язової ін'єкції. Для одержання твердих композицій, таких як таблетки, основний активний інгредієнт або інгредієнти змішують з фармацевтичним носієм, наприклад традиційними таблетковими інгредієнтами, такими як кукурудзяний крохмаль, лактоза, сахароза, сорбіт, тальк, стеаринова кислота, стеарат магнію, фосфат дикальцію або смоли, та іншими фармацевтичними розріджувачами, наприклад водою, щоб отримати тверду попередню композицію, яка містить однорідну суміш одного або більше інгібіторів реабсорбції глюкози та одного або більше антидіабетичних агентів або її фармацевтично прийнятної солі. Посилання на ці попередні композиції, як на однорідні, означає, що активний інгредієнт або інгредієнти рівномірно розподілені в усій композиції, так що компо 86599 30 зиція легко може бути розділена на однаково ефективні форми дозування, такі як таблетки, пілюлі та капсули. Потім цю тверду попередню композицію розділяють на види форм одиничної дози, які описані вище, що містять від 0,1 до приблизно 500мг активного інгредієнта або інгредієнтів за даним винаходом. Таблетки або пілюлі нових композицій можуть бути покриті або комбіновані іншим шляхом, щоб забезпечити форму дозування, віддаючи перевагу пролонгованій дії. Наприклад, таблетка або пілюля може містити внутрішнє дозування та зовнішній компонент дозування, останній буде у формі оболонки над першим. Два компоненти можуть бути відділені за допомогою кишкового прошарку, що підходить, щоб не піддаватися дезинтеграції в шлунку та дозволити внутрішньому компоненту пройти непошкодженим в дванадцятипалу кишку або бути затриманим при вивільненні. Для таких кишкових прошарків або покриттів можуть бути використані різноманітні речовини, такі речовини включають ряд полімерних кислот з такими речовинами як шелак, ацетиловий спирт та ацетат целюлози. Рідкі форми, в яких нові композиції за даним винаходом можуть бути поєднані для введення перорально або за допомогою ін'єкції, включають водні розчини, прийнятні ароматизовані сиропи, водні або маслянисті суспензії та ароматизовані емульсії з харчовими маслами, такими як бавовняне масло, масло сезаму, кокосове масло або арахісове масло, а також еліксири та подібні фармацевтичні наповнювачі. Прийнятні диспергуючі або суспендуючі агенти для водних суспензій включають синтетичні та природні смоли, такі як трагакант, гуміарабік, альгінат, декстран, натрієва карбоксиметилцелюлоза, метилцелюлоза, полівінілпіролідон або желатин. Рідкі форми в прийнятно ароматизованих суспендуючих або диспергуючих агентах також можуть включати синтетичні та природні смоли, наприклад, трагакант, гуміарабік, метилцелюлозу та подібні. Для парентерального введення бажані стерильні суспензії та розчини. Коли бажаним є внутрішньовенне введення, використовують ізотонічні препарати, які звичайно містять прийнятні консерванти. Переважно, комбінації одного або більше інгібіторів реабсорбції глюкози за даним винаходом, самі по собі або в комбінації з одним або більше додатковим антидіабетичним агентом, можуть бути введені в одиничній денній дозі, або кількість денного дозування може бути введена розділеними дозами два, три або чотири рази на день. Крім того, один або більше інгібіторів реабсорбції глюкози та/або один або більше антидіабетичних агентів відповідно до даного винаходу можуть бути введені в інтраназальній формі за допомогою місцевого використання прийнятних інтраназальних засобів або за допомогою трансдермальних пластирів, які добре відомі кваліфікованому фахівцю в даній галузі техніки. При введенні у формі трансдермальної системи доставки дозоване введення, звичайно, буде переважно безперервним, ніж переривчастим, протягом усього режиму дозування. Наприклад, для перорального введення у формі таблетки або капсули активний лікарський 31 компонент може бути поєднаний з пероральним, нетоксичним фармацевтично прийнятним інертним носієм, таким як етанол, гліцерин, вода та їм подібні. Крім того, коли бажано або необхідно, прийнятні зв'язуючі речовини; змащуючі речовини, агенти дезінтеграції та барвники також можуть бути поєднані в суміш. Прийнятні зв'язуючі речовини включають, без обмеження, крохмаль, желатин, природні цукри, такі як глюкоза або беталактоза, кукурудзяні підсолоджувачі, природні та синтетичні смоли, такі як гуміарабік, трагакант або олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію та їм подібні. Дезінтегратори включають, без обмеження, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову смолу та їм подібні. Коли даний винахід направлений на введення комбінації, сполуки можуть бути спільно введені одночасно, послідовно або в одній фармацевтичній композиції. Коли сполуки вводять окремо, кількість дозувань кожної сполуки, надана на день, не обов'язково може бути такою ж, наприклад, коли одна сполука може мати більшу тривалість активності, та, таким чином, буде введена менш часто. Оптимальні дозування для введення можуть бути легко визначені кваліфікованими фахівцями в даній галузі техніки та будуть змінюватися в залежності від конкретної сполуки, що використовують, концентрації препарату, способу введення та розвитку хворобливого стану. Крім того, чинники, пов'язані з індивідуальним пацієнтом, якого лікують, включаючи вік пацієнта, вагу, режим харчування та час введення, призведуть до необхідності пристосувати дозування. Нові композиції за даним винаходом також можуть бути введені у формі ліпосомних систем доставки, таких як малі одношарові везикули, великі одношарові везикули та багатошарові везикули. Ліпосоми можуть бути утворені з різноманітності ліпідів, включаючи, але не обмежуючись, амфіпатичні ліпіди, такі як фосфатидилхоліни, сфінгомієліни, фосфатидилетаноламіни, фосфатидилхоліни, кардіоліпіни, фосфатидилсеріни, фосфатидилгліцерини, фосфатидні кислоти, фосфатидилінозитоли, пропани діацил триметиламонію, пропани діацил диметиламонію та стеариламін, нейтральні ліпіди, як наприклад тригліцериди, та їх комбінації. Вони можуть або містити холестерин або можуть бути вільними від холестерину. З Формули (III) та інших наведених формул очевидно, що деякі сполуки в композиціях за винаходом можуть мати один або більше асиметричних атоми вуглецю в їх структурі. Мається на увазі, що стереохімічно чисті ізомерні форми сполук, а також їх рацемати, включені в межі даного винаходу. Стереохімічно чисті ізомерні форми можуть бути одержані, використовуючи методики, відомі з рівня техніки. Діастереоізомери можуть бути розділені за допомогою фізичних способів розділення, таких як фракційна кристалізація, та хроматографічних способів, та енантіомери можуть бути відділені один від одного за допомогою селективної 86599 32 кристалізації діастереомерних солей з оптично активними кислотами або основами, або хіральною хроматографією. Чисті стереоізомери також можуть бути синтетично одержані з відповідних стереохімічно чистих вихідних речовин, або використовуючи стереоспецифічні реакції. Деякі сполуки в композиціях за даним винаходом можуть мати різні індивідуальні ізомери, як наприклад транс та цис, та різні альфа та бета приєднання (нижче та вище намальованої площини). Крім того, якщо способи одержання сполук за даним винаходом дають суміш стереоізомерів, ці ізомери можуть бути розділені традиційними способами, такими як препаративна хроматографія. Сполуки можуть бути одержані у формі індивідуального стереоізомеру або в рацемічній формі, як суміш декількох можливих стереоізомерів. Нерацемічні форми можуть бути одержані або синтезом, або розділенням. Сполуки можуть, наприклад, бути розділені на їх складові енантіомери стандартними способами, такими як утворення діастереомерних пар шляхом утворення солі. Сполуки також можуть бути розділені за допомогою ковалентного сполучення з хіральною допоміжною речовиною, з наступним хроматографічним розділенням та/або кристалографічним розділенням та видаленням хіральної допоміжної речовини. Альтернативно, сполуки можуть бути розділені, використовуючи хіральну хроматографію. Якщо не зазначено інше, мається на увазі, що в межі даного винаходу включені всі такі ізомери або стереоізомери per se, а також суміші цис та транс ізомерів, суміші діастереомерів та рацемічні суміші енантіомерів (оптичні ізомери). Терапевтичний ефект інгібітора реабсорбції глюкози, введеного в комбінації з одним або більше антидіабетичним агентом(ами) при лікуванні діабету, Синдрому X, або симптомів, пов'язаних з ними, або їх ускладнень, може бути показаний за допомогою способів, відомих з рівня техніки. Мається на увазі, що подальші приклади комбінаційного лікування з інгібіторами SGLT та іншими антидіабетичними агентами, такими як модулятори RXR, наведено для ілюстрації винаходу, не обмежуючи його. G. Хімічні приклади синтезу. Один аспект винаходу розкриває сполуки формули (III), як описано вище в Короткому описі суті винаходу, описі та доданій формулі винаходу. Ці описані сполуки можуть бути одержані відповідно до традиційних способів синтезу органічної хімії або матриці чи способів комбінаторного хімії. Схеми та Приклади 1-9, наведені нижче, забезпечують загальну інструкцію та детальні приклади того, як описані сполуки можуть бути одержані. Спектри 1Н ЯМР були виміряні на спектрометрі Brucker AC-300 (300МГц), використовуючи тетраметилсилан (TMS), як внутрішній стандарт. Приклад 1 2-[3-(2-Нафтален-2-іл-етил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-β-D-глюкопіранозид 33 А. трет-Бутиловий ефір (2-аміно-3-метоксифеніл)-карбамінової кислоти 1а: Тіоніл хлорид (2,3мл, 32ммоль) додавали до суспензії комерційно доступної 3-метокси-2-нітробензойної кислоти (4,2г, 21,3ммоль) в толуолі (20мл). Суміш перемішували при кипінні зі зворотним холодильником протягом 30 хвилин, охолоджували до кімнатної температури (RT) та концентрували насухо. Хлорангідрид кислоти потім розчиняли в ацетоні (стадія ВЕРХ, 20мл) та по краплям додавали через додавальну воронку до холодного (0°С) розчину азиду натрію (2,2г, 33,8ммоль) у воді (30мл) з перемішуванням. Одержану суспензію перемішували при 0°С протягом 10 хвилин, потім при RT протягом 50хв. Додавали воду (150мл) та білий твердий продукт збирали фільтруванням. Твердий продукт розбавляли трет-бутанолом (25мл) та нагрівали до кипіння зі зворотним холодильником на масляній бані. Через 20 хвилин при кипінні зі зворотним холодильником надлишок трет-бутанолу видаляли під зниженим тиском та залишок очищали за допомогою хроматографії на силікагелі (ЕtOАстексан; 5:100), одержуючи бажаний продукт у вигляді жовтої твердої речовини (4,59г, 80%). Цей продукт (2,48г, 9,2ммоль) потім розчиняли в етанолі (40мл) та гідрогенували понад 10% Pd/C (250мг) під тиском Н2 40фунт/дюйм2 протягом 3 годин. Каталізатор видаляли фільтруванням та відфільтровану речовину концентрували у вакуумі, одержуючи зазначену у заголовку сполуку у вигляді твердої речовини (2,2г, 100%). B. трет-Бутиловий ефір [3-метокси-2-(2нафтален-2-іл-ацетиламіно)-феніл]-карбамінової кислоти 1b: Суміш 1а (0,413г, 1,74ммоль), одержану на Стадії А, 2-нафтилоцтову кислоту (0,32г, 1,74ммоль), 1-гідроксибензотриазол гідрат (0,53г, 3,5ммоль) та 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид (0,83г, 4,3ммоль) в сухому DMF (4мл) перемішували при RT протягом ночі, виливали в Н2О (40мл) та екстрагували ЕtOАс (2´60мл). Об'єднаний ЕtOАс екстракт промивали сольовим розчином, сушили над MgSO4, фільтрували та концентрували, одержуючи неочищене масло. Колоночною хроматографією одержували зазначену у заголовку сполуку у вигляді білої твердої речовини (0,5г, 70%). C. трет-Бутиловий ефір [3-метокси-2-(2нафтален-2-іл-етиламіно)-феніл]-карбамінової кислоти 1с та 3-Метокси-(2-нафтален-2-іл-етил)бензол-1,2-діамін 1d: До холодного (0°С) розчину 1b (0,423г, 1,04ммоль), одержаного на Стадії В, в сухому тетрагідрофурані (30мл) повільно додавали борановий комплекс тетрагідрофурану (1Μ розчин, 2мл). Реакційну суміш перемішували при кипінні зі зворотним холодильником протягом 2 годин, охолоджували до 0°С та повільно додавали 1N розчин NaOH (3мл). Додавали воду (5мл) та 86599 34 суміш перемішували при RT протягом ночі. Суміш розбавляли водою (50мл) та водну суміш екстрагували етил ацетатом (2´60мл). Об'єднані органічні екстракти промивали сольовим розчином, сушили над MgSO4, концентрували та хроматографували (силікагель, EtOАс/Гексан; співвідношення 1:4), одержуючи зазначені у заголовку сполуки, трет-бутиловий ефір [3-метокси-2(2-нафтален-2-іл-етиламіно)-феніл]-карбамінової кислоти 1с (0,26г, 64%) у вигляді прозорого масла та 3-Метокси-N2-(2-нафтален-2-іл-етил)-бензол1,2-діамін 1d (80мг, 20%) у вигляді білої твердої речовини. D. 7-Метокси-1-(2-нафтален-2-іл-етил)-1,3дигідро-бензоімідазол-2-он 1е: Суміш карбамату 1с (0,48г, 1,2ммоль), одержану на Стадії С, та K2СО3 ( 0,24г, 1,5ммоль) в DMF (10мл) нагрівали на 150°С масляній бані протягом 1,5 годин, охолоджували до RT, виливали в Н2О (30мл), перемішували при RT протягом 20 хвилин та фільтрували, одержуючи неочищений твердий продукт. Тверді речовини промивали Et2O та сушили, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білої твердої речовини (0,28г, 72%). E. 7-Гідрокси-1-(2-нафтален-2-іл-етил)-1,3дигідро-бензоімідазол-2-он 1f: Суміш 1е (0,28г, 0,88ммоль), одержану на Стадії D, в дихлорметані (50мл) охолоджували до -78°С та повільно додавали трибромід бору (1М розчин в СН2Сl2; 4,4мл). Реакційну суміш перемішували при -78°С протягом 30 хвилин, потім повільно нагрівали до RT та перемішували при RT протягом 24 годин. По краплям додавали 1Μ розчин НСl (5мл), з наступним додаванням льодяної Н2О (50мл). Метилен хлорид видаляли під зниженим тиском та водну суміш екстрагували EtOAc (2´60мл). Об'єднаний EtOAc екстракт промивали сольовим розчином, сушили над MgSO4 та концентрували, одержуючи зазначену у заголовку сполуку у вигляді жовтої твердої речовини (0,267г, 100%). F. 2-[3-(2-Нафтален-2-іл-етил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-β-D-глюкопіранозид 1: До розчину 1f (0,26г, 0,87ммоль), одержаного на Стадії Е, в DMF (5мл) додавали карбонат калію (0,30г, 2,2ммоль), з наступним додаванням 2,3,4,6тетра-О-ацетил-α-D-глюкопіранозил броміду (0,54г, 1,3ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 24 годин. Потім тверді речовини відфільтровували та промивали етил ацетатом. Етил ацетатний розчин промивали водою та сольовим розчином, сушили над MgSO4 та концентрували у вакуумі. Залишок хроматографували (силікагель, ЕtOАс/Гексан, 3:2), одержуючи чистий продукт (24% - базуючись на відновленій вихідній речовині) у вигляді твердої речовини. Твердий продукт розбавляли метанолом (3мл) та додавали метоксид натрію (1М розчин в МеОН, 0,2мл). Одержаний розчин перемішували при RT протягом 1 години, розбавляли водою (20мл) та упарювали, щоб видалити МеОН. Водну суміш екстрагували ЕtOАс (2´30мл). Об'єднані ЕtOАс екстракти промивали сольовим розчином, сушили над MgSO4, фільтрували та концентрували у вакуумі. Залишок очищали за допомогою хроматографії на силікагелі: елююючи 5% метано 35 лу в хлороформі, одержуючи зазначену у заголовку сполуку (0,023г, 57%) у вигляді білої твердої речовини. 1Н ЯМР (300МГц, CD3OD) δ 7,82-7,78 (m, 3Н), 7,72 (s, 1H), 7,47-7,42 (m, 3H), 7,04 (m, 2H), 6,82-6,79 (dd, J=6,25Гц, J=2,31Гц, 1H), 5,18 (d, J=7,73Гц, 1H), 4,47-4,41 (m, 2), 3,92 (d, J=10,9Гц, 1H), 3,74-3,63 (m, 2H), 3,54-3,46 (m, 3H), 3,28-3,23 (m, 2H). MS: m/z (МH+) 467. Приклад 2 2-[3-(2-Нафтален-2-іл-етил)-3Н-бензоімідазол4-ілокси]-β-D-глюкопіранозид А. 7-Метокси-1-(2-нафтален-2-іл-етил)-1Нбензоімідазол 2а: До 1d (0,66г, 2,26ммоль), одержаного на Стадії С Прикладу 1, та триетилортоформіату (0,45мл, 2,71ммоль) додавали каталітичну кількість р-толуолсульфонової кислоти. Суміш нагрівали на 120°С масляній бані протягом 5 годин, потім охолоджували до RT. Залишок очищали за допомогою хроматографії (силікагель, 10% ЕtOАc в гексані), одержуючи зазначену у заголовку сполуку (0,513г, 75%). В. 2-[3-(2-Нафтален-2-іл-етил)-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозид 2: Сполуку 2а, одержану на попередній стадії, деметилювали, потім глікозилювали таким же способом, як описано на Стадіях Ε-F, одержуючи зазначену у заголовку сполуку. 1Н ЯМР (400МГц, CD3OD) δ 7,79-7,68 (m, 3Н), 7,58 (s, 1Н), 7,47 (s, 1H), 7,42-7,39 (m, 2H), 7,13-7,15 (m, 4H), 5,24 (d, J=7,91Гц, 1H), 4,93 (m, 1H), 4,74 (m, 1H), 3,96-3,92 (dd, J=11,9Гц, J=1,8Гц, 1H), 3,77-3,65 (m, 2H), 3,573,33(m, 5H). MS: m/z (МH+) 451. Приклад 3 2[3-(4-Етил-бензил)-1,3-дигідро-бензоімі дазол-2-он-4-ілокси]-β-D-глюкопіранозид A. трет-Бутиловий ефір [2-(4-етилбензоїламіно)-3-метокси-феніл]-карбамінової кислоти 3а: До розчину 1а (1,5г, 6,3ммоль), одержаного на Стадії А Прикладу 1, та триетиламіну (1,3мл, 9,45ммоль) в метилен хлориді (40мл) по краплям додавали 4-етилбензоїл хлорид (1,06мл, 6,3ммоль). Одержану суміш перемішували при RT протягом 6,25 годин, виливали у воду (50мл) та шари розділяли. Органічний шар сушили над MgSO4, фільтрували та концентрували, одержуючи неочищену суміш зазначеної у заголовку сполуки з кількісними виходами. 86599 36 B. трет-Бутиловий ефір [2-(4-етилбензиламіно)-3-метокси-феніл]-карбамінової кислоти (3b) та N2-(4-Етил-бензил)-3-метокси-бензол1,2-діамін 3с: Обробкою сполуки 3а, одержаної на попередній стадії, борановим комплексом тетрагідрофурану, використовуючи таку ж методику, описану на Стадії С Прикладу 1, одержували зазначені у заголовку сполуки з кількісними виходами. С. 2-[3-(4-Етил-бензил)-1,3-дигідробензоімідазол-2-он-4-ілокси]-β-D-глюкопіранозид (3): Зазначену у заголовку сполуку одержували таким же способом, як описано на Стадіях D-F Прикладу 1, замінюючи 1с на 3b, одержаний на попередній стадії. 1Н ЯМР (300МГц, CD3OD) δ 7,24 (d, J=7,90Гц, 2H), 7,12 (d, J=8,14Гц, 2H), 7,02-6,93 (m, 2H) 6,80 (d, J=7,69Гц, 1Н) 5,44 (d, 15,51Гц, 1Н) 5,27 (d, J=15,61Гц, 1Н) 5,00 (d, J=7,33Гц, 1Н) 3,903,86 (dd, J=1,93, J=12,05, 1H) 3,69-3,66 (dd, J=5,53, J=12,00, 1H) 3,51-3,36 (m, 4H) 2,59 (q, 2H) 1,19 (t, 3H). MS: m/z (МH+) 431. Приклад 4 2-[3-(4-Етил-бензил)-3Н-бензоімідазол-4ілокси]-β-D-глюкопіранозид 2-[3-(4-Етил-бензил)-3Н-бензоімідазол-4ілокси]-β-D-глюкопіранозид 4: Сполуку 3с, одержану на Стадії В Прикладу 3, обробляли, як описано в Прикладі 2, замінюючи 1d на 3с, одержуючи зазначену у заголовку сполуку. 1Н ЯМР (300МГц, CD3OD) δ 8,09 (s, 1H) 7,34 (d, J=8,00, 1H), 7,20-7,13 (m, 5H), 7,09 (d, J=7,95, 1H), 5,86 (d, J=15,29, 1H), 5,61 (d, J=15,27, 1H), 5,09 (d, J=7,28, 1H), 3,89 (d, J=11,91, 1H), 3,71-3,67 (dd, J=5,48, J=11,86, 1H), 3,55-3,36 (m, 4H), 2,59 (q, J=7,7Гц, 2H), 1,18 (t, J=7,4Гц, 3H). MS: m/z (MH+) 415. Приклад 5 2-{3-[2-(4-Метоксифеніл)-етил]-3Н-бензоімідазол-4-ілокси}-β-D-глюкопіранозид A. N-(2-Гідрокси-6-нітро-феніл)-2-(4-метоксифеніл)-ацетамід 5а: До суміші комерційно доступного 2-Аміно-3-нітрофенолу (5г, 32,4ммоль) та триетиламіну (9мл, 64,9ммоль) в метилен хлориді (20мл) повільно додавали р-метоксифенілацетил хлорид (5мл, 32,4ммоль). Одержану суміш перемішували при RT протягом ночі, виливали у льодяну воду (30мл) та додавали 0,5Μ розчин НСl (20мл). Додавали додаткові 30мл метилен хлориду та шари розділяли. Шар метилен хлориду про 37 мивали водою, сольовим розчином та сушили над MgSO4. Розчин фільтрували та розчинник видаляли під зниженим тиском, одержуючи зазначену у заголовку сполуку у вигляді темної твердої речовини (9,45г, 96%). B. N-[2-(трет-Бутил-диметил-силанілокси)-6нітро-феніл]-2-(4-метокси-феніл)-ацетамід 5b: До холодного (0°С) розчину 5а (3,1г, 10,3ммоль), одержаного на Стадії А, та трет-Бутилдиметилсиліл хлориду (1,86г, 12,3ммоль) в сухому DMF (10мл) повільно додавали імідазол (1,7г, 25,7ммоль). Перемішування продовжували при 0°С протягом 30 хвилин, потім при RT протягом 3 годин. Одержану суміш виливали в льодяну воду (80мл) та екстрагували Et2O (2´80мл). Об'єднані ефірні екстракти сушили над MgSO4 та концентрували, одержуючи продукт у вигляді масла з кількісним виходом. C. Ν-[2-Аміно-6-(трет-бутил-диметилсиланілокси)-феніл]-2-(4-метокси-феніл)-ацетамід 5с: Розчин 5b (1,4г, 3,36ммоль), одержаний на Стадії В, в етанолі гідрогенували понад 10% Pd/C під тиском водню 40фунт/дюйм2 протягом 4 годин. Каталізатор відфільтровували через целіт та фільтрат концентрували у вакуумі. Зазначену у заголовку сполуку виділяли у вигляді не зовсім білої твердої речовини (0,693г, 53%) перекристалізацією з Et2O. D. 3-(трет-Бутил-диметил-силанілокси)-N2-[2(4-метокси-феніл)-етил]-бензол-1,2-діамін 5d та 3аміно-2-[2-(4-метокси-феніл)-етиламіно]-фенол 5е: До холодного (0°С) розчину 5с (0,693г, 1,8ммоль), одержаного на Стадії С, в сухому тетрагідрофурані (20мл) повільно додавали борановий комплекс тетрагідрофурану (1М розчин, 2,7мл). Реакційну суміш перемішували при кипінні зі зворотним холодильником протягом 2 годин, охолоджували до 0°С та повільно додавали 1N розчин NaOH (1,5мл). Додавали воду (5мл) та суміш перемішували при RT протягом ночі. Суміш розбавляли водою (25мл) та водну суміш екстрагували етил ацетатом (2´30мл). Об'єднані органічні екстракти промивали сольовим розчином, сушили над MgSO4, концентрували та хроматографували (силікагель, EtOAc/Гексан; співвідношення 1:4), одержуючи зазначену у заголовку сполуку 5d (0,4г, 60%) у вигляді білої твердої речовини та зазначену у заголовку сполуку 5е (0,7г, 35%). E. 7-(трет-Бутил-диметил-силанілокси)-1-[2-(4метокси-феніл)-етил]-1Н-бензоімідазол 5f: До суміші 5d (0,38г, 1,02ммоль), одержаної на Стадії D, та триетилортоформіату (023мл, 1,23ммоль) додавали каталітичну кількість р-толуолсульфонової кислоти. Суміш нагрівали на 120°С масляній бані протягом 5 годин, потім охолоджували до RT. Залишок очищали за допомогою хроматографії (силікагель, ЕtOАc/Гексан, 1:4), одержуючи зазначену у заголовку сполуку (0,33г, 84%). F. 3-[2-(4-Метокси-феніл)-етил]-3Нбензоімідазол-4-ол 5g: До холодного (0°С) розчину 5f (0,30г, 0,78ммоль), одержаного на Стадії Е, в сухому тетрагідрофурані (10мл) додавали фторид тетрабутиламонію (2мл, 1,96ммоль). Одержану суміш нагрівали до RT, перемішували протягом 1,5 години та додавали воду (15мл). Твердий осад збирали фільтруванням та сушили під зниженим 86599 38 тиском, одержуючи зазначену у заголовку сполуку (0,206г, 99%) у вигляді жовто-коричневої твердої речовини. G. 2-{3-[2-(4-Метоксифеніл)-етил]-3Нбензоімідазол-4-ілокси}-β-D-глюкопіранозид 5: Зазначену у заголовку сполуку одержували обробкою 5g 2,3,4,6-тетра-О-ацетил-α-D-глюкопіранозил бромідом, як описано в Стадії F Прикладу 1. 1Н ЯМР (400МГц, CD3OD) δ 7,59 (s, 1H), 7,31 (d, J=8,1Гц, 1Н), 7,20 (t, J=7,9Гц, 1H), 7,13 (d, 7,8Гц, 1H), 6,95 (d, J=8,4, 2H), 6,78 (d, J=8,5Гц, 2H), 5,21 (d, Η=7,8Гц, 1H), 4,62-4,58 (m, 1H), 3,95-3,91 (m, 1H), 3,76-3,72 (m, 4H), 3,65-3,45 (m, 5H), 3,27-3,12 (m, 2H). MS: m/z (МH+) 431. Приклад 6 2-[3-(2-(4-Метоксифеніл)-етил)-3Н-бензоімідазол-4-ілокси]-β-D-глюкопіранозид A. 7-(трет-Бутил-диметил-силанілокси)-1-[2-(4метокси-феніл)-етил]-1,3-дигідро-бензоімідазол-2он 6а: Трифосген (0,40г, 1,35ммоль) додавали до холодного (0°С) розчину 5d (0,50г 1,35ммоль), одержаного на Стадії D Прикладу 5, в сухому THF (20мл). Перемішування продовжували при 0°С протягом 30 хвилин, потім при RT протягом 2 годин. Повільно додавали насичений розчин NaHCCb (60мл) та суміш екстрагували EtOAc (2´60мл). Об'єднані ЕtOАс екстракти промивали сольовим розчином та сушили над MgSO4. Суміш фільтрували та фільтрат концентрували під зниженим тиском, одержуючи зазначену у заголовку сполуку у вигляді твердої речовини (0,53г, 98%). B. 2-[3-(2-(4-Метоксифеніл)-етил)-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозид 6: Зазначену у заголовку сполуку одержували таким же способом, як описано в Стадії F в Прикладі 5, замінюючи сполуку 5f на 6а, з наступною обробкою 2,3,4,6-тетра-О-ацетил-α-D-глюкопіранозил бромідом, як описано в Стадії F Прикладу 1. 1H ЯМР (400МГц, CD3OD) δ 7,17 (d, J=8,38Гц, 2H), 7,036,98 (m, 2H), 6,84-6,78 (m, 3Н), 5,14 (d, J=7,7Гц, 1Н), 4,37-4,26 (m, 2H), 3,90 (d, J=12,1Гц, 1H), 3,76 (s, 3H), 3,73-3,69 (m, 1H), 3,62-3,43 (m, 4H), 3,142,96 (m, 2H). MS: m/z (MH+) 447. Приклад 7 2-{3-[2-(2,3-Дигідро-бензофуран-5-іл)-етил]-3Нбензоімідазол-4-ілокси}-β-D-глюкопіранозид A. 2-[2-(2,3-Дигідро-бензофуран-5-іл)етиламіно]-3-нітро-фенол 7а: Суміш 2-Аміно-3нітрофенолу (1,0г, 6,6ммоль), (2,3-Дигідро 39 бензофуран-5-іл)-оцтової кислоти [1,07г, 6,5ммоль; Dunn, et. al. J. Med. Chem. 1986, 29, 2326], 1-Гідроксибензотриазол гідрату (3,0г, 19,5ммоль) та гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (3,73г, 19,5ммоль) в сухому DMF (10мл) перемішували при RT протягом ночі, виливали в Н2О (80мл) та екстрагували ЕtOАс (2´80мл). Об'єднаний EtOAc екстракт промивали сольовим розчином, сушили над MgSO4, фільтрували та концентрували, одержуючи неочищене масло. Колоночною хроматографією одержували зазначену у заголовку сполуку у вигляді білої твердої речовини (0,3г, 15%). B. 2-{3-[2-(2,3-Дигідро-бензофуран-5-іл)-етил]3Н-бензоімідазол-4-ілокси}-β-D-глюкопіранозид 7: Зазначену у заголовку сполуку одержували таким же способом, як описано в Стадіях В-G Прикладу 5, замінюючи сполуку 5а на 7а, одержану на попередній стадії. 1Н ЯМР (300МГц, Ацетон-d6) δ 7,71 (s, 1H), 7,32-7,29 (m, 1H), 7,09-7,04 (m, 3H), 6,87 (d, J=7,98Гц, 1Н), 6,58 (d, J=8,14Гц, 1H), 5,24 (d, J=7,5Гц, 1H), 4,79-4,75 (m, 2H), 4,59-4,45 (m, 5H), 3,89 (d, J=11,95Гц, 1H), 3,77-3,54 (m, 5H), 3,16-3,08 (m, 4H) MS: m/z (MH+) 443. Приклад 8 2-[3-(4-Етил-бензил)-6-метил-3Н-бензоімідазол-4-ілокси]-Р~0-глюкопіранозид A. 4-Етил-К-(2-гідрокси-4-метил-феніл)бензамід 8а: До розчину комерційно доступного 2Аміно-5-метилфенолу (6г, 48,7ммоль) та триетиламіну (7мл, 97,4ммоль) в метилен хлориді (80мл) по краплям додавали 4-етилбензоїл хлорид (7,2мл, 48,7ммоль). Одержану суміш перемішували при RT протягом 2 годин, виливали у воду (100мл) та шари розділяли. Шар метилен хлориду промивали розбавленим розчином НСI, потім знову Н2О та сушили над MgSO4. Суміш фільтрували та концентрували насухо, одержуючи напівтверду речовину. Перекристалізацією з гексану одержували зазначену у заголовку сполуку з кількісним виходом у вигляді твердої речовини. B. 4-Етил-N-(2-метокси-4-метил-феніл)бензамід 8b: Метилйодид (1,2мл, 19,2ммоль) по краплям додавали до суміші 8а (4,0г, 15,7ммоль), одержаної на Стадії А, та карбонату калію (5г, 36,2ммоль) в DMF (20мл). Одержану суміш перемішували при RT протягом 6 годин та додавали воду (60мл). Водну суміш екстрагували Еt2О (2´60мл). Об'єднані ЕtOАс екстракти сушили над MgSO4, концентрували у вакуумі та хроматографували (силікагель; 3% EtOAc в гексані), одержуючи зазначену у заголовку сполуку (3,58г, 85%). C. N-(5-Бром-2-метокси-4-метил-феніл)-4етил-бензамід 8с: До розчину 8b (3,58г, 13,3ммоль), одержаного на Стадії В, та йоду (3 86599 40 кристали) у тетрахлориді вуглецю (100мл) повільно додавали бром (0,75мл, 14,6ммоль). Додавали додаткових 100мл тетрахлориду вуглецю та одержану суспензію перемішували при RT протягом 6 годин. Суміш виливали 10% розчин сульфіту натрію (400мл), додавали дихлорметан (200мл) та шари розділяли. Органічний шар промивали насиченим NаНСО3 (1´), сушили над MgSO4, фільтрували та концентрували під зниженим тиском. Білу тверду речовину осаджували гексаном та виділяли за допомогою фільтрування, одержуючи зазначену у заголовку сполуку (3,1г, 67%). D. N-(3-Бром-6-метокси-4-метил-2-нітрофеніл)-4-етил-бензамід 8d: Тетрафторборат нітронію (0,434г, 3,3ммоль) однією частиною додавали до холодного (0°С) розчину 8с (1,13г, 3,2мМ), одержаного на Стадії С, в ацетонітрилі. Одержану суміш перемішували при 0°С протягом 11 хвилин, потім при RT протягом 15 хвилин та додавали Н2О (30мл). Твердий осад збирали фільтруванням та сушили під зниженим тиском, одержуючи зазначену у заголовку сполуку (0,93г, 73%) у вигляді не зовсім білої твердої речовини. E. N-(2-Аміно-6-метокси-4-метил-феніл)-4етил-бензамід 8е: Розчин 8d (1,2г, 3,1ммоль), одержаний на Стадії D, та K2СО3 (0,5г, 3,6ммоль) в етанолі гідрогенували понад 10% Pd/C під тиском водню 40фунт/дюйм2 протягом 6 годин. Каталізатор відфільтровували через целіт та фільтрат концентрували у вакуумі. Залишок розбавляли ЕtOАс (30мл), промивали Н2О (1´30мл) та сушили над MgSO4. Суміш фільтрували та концентрували, одержуючи зазначену у заголовку сполуку (0,728г, 83%) у вигляді твердої речовини. F. N2-(4-Етил-бензил)-3-метокси-5-метилбензол-1,2-діамін 8f: До холодного (0°С) розчину 8е (0,69г, 2,4ммоль), одержаного на Стадії Е, в сухому тетрагідрофурані (25мл) повільно додавали борановий комплекс тетрагідрофурану (1М розчин, 4,8мл). Реакційну суміш перемішували при RT протягом 6 годин, охолоджували до 0°С та повільно додавали 1N розчин NaOH (1,5мл). Додавали воду (5мл) та суміш перемішували при RT протягом ночі. Суміш розбавляли водою (25мл) та водну суміш екстрагували етил ацетатом (2´30мл). Об'єднані органічні екстракти промивали сольовим розчином, сушили над MgSO4, концентрували та хроматографували (силікагель, ЕtOАс/Гексан; співвідношення 1:4), одержуючи зазначену у заголовку сполуку (0,31г, 46%) у вигляді білої твердої речовини. G. 1-(4-Етил-бензил)-7-метокси-5-метил-1Нбензоімідазол 8g: До 8f (0,275г, 1,0ммоль), одержаного на Стадії F, та триетилортоформіату (0,20мл, 1,2ммоль) додавали каталітичну кількість р-толуолсульфонової кислоти. Суміш нагрівали на 120°С масляній бані протягом 3 годин, потім охолоджували до RT. Залишок очищали за допомогою хроматографії (силікагель, EtOAC/Гексан, 1:4), одержуючи зазначену у заголовку сполуку (0,253г, 88%). Н. 2-[3-(4-Етил-бензил)-6-метил-3Нбензоімідазол-4-ілокси]-β-D-глюкопіранозид 8: Зазначену у заголовку сполуку одержували обробкою 8g, як описано в Стадіях E-F Прикладу 1, за 41 мінюючи сполуку 1е на 8g. 1H ЯМР (400МГц, CD3OD) δ 8,03 (s, 1H), 7,21-7,14 (m, 5H), 6,95 (s, 1H), 5,81 (d, J=15,4Гц, 1Н), 5,58 (d, J=15,2Гц, 1Н), 5,07 (d, J=7,37Гц, 1Н), 3,88-3,92 (dd, J=12,1Гц, J=2,2Гц, 1H), 3,66 3,71 (dd, J=12,0Гц, J=5,8Гц, 1H), 3,52-3,37 (m, 4H), 2,63-2,58 (q, J=7,45Гц, 2H), 2,43 (s, 3H), 1,19 (t, J=7,62Гц, 3Н). MS: m/z (MH+) 429. Приклад 9 2-{3-[2-(4-метокси-феніл)-етил]-3Нбензотриазол-4-ілокси}-β-D-глюкопіранозид А. 3-[2-(4-Метокси-феніл)-етил]-3Нбензотриазол-4-ол (9а): До холодної (0°С) суміші 5е (0,49г, 1,9ммоль), одержаної на Стадії D Прикладу 5, в 3N розчині НСI (20мл) швидко додавали нітрит натрію (0,152г, 2,0ммоль). Одержану суміш перемішували при 0°С протягом 1,5 години, нейтралізували до рН6 3N NaOH та розбавляли Н2О (40мл). Водну суміш екстрагували EtOAc (2´60мл). Об'єднані EtOAc екстракти сушили над MgSO4, фільтрували та концентрували у вакуумі. Залишок очищали за допомогою хроматографії (силікагель, 10% ЕtOАс/Гексан), одержану зазначену у заголовку сполуку (0,25г, 49%). В. 2-{3-[2-(4-Метоксифеніл)-етил]-3Нбензотриазол-4-ілокси}-β-D-глюкопіранозид (9): Зазначену у заголовку сполуку одержували обробкою 9а 2,3,4,6-тетра-О-ацетил-α-D-глюкопіранозил бромід, як описано в Стадії F Прикладу 1. 1Н ЯМР (400МГц, CD3OD) δ 7,59 (d, J=8,12Гц, 1Н), 7,35 (t, J=8,1Гц, 1Н), 7,27 (d, J=7,67Гц, 1Н), 7,08 (d, J=8,51Гц, 2Н), 6,79 (d, J=8,5Гц, 2Н), 5,24 (d, J=7,95Гц, 1H), 5,17 (m, 1H), 5,06 (m, 1H), 3,93 (d, J=12,02Гц, 1Н), 3,74 (s, 3H), 3,73-3,64 (m, 2H), 3,573,46(m, 3H), 3,28-3,26 (m, 2H). MS: m/z (MH+) 432. Приклад 10 2-[3-(4-Етил-бензил)-3Н-бензотриазол-4ілокси]-β-D-глюкопіранозид A. 1-(4-Етил-бензил)-7-метокси-1Нбензотриазол 10а: До холодної (0°С) суміші 3с, одержаної на Стадії В Прикладу 3, (1,3г, 5,1ммоль) в 3N розчині НСI (40мл) швидко додавали нітрит натрію (0,39г, 5,6ммоль). Одержану суміш перемішували при 0°С протягом 2 годин, нейтралізували до рН6 3N NaOH та розбавляли Н2О (100мл). Водну суміш екстрагували ЕtOАс (3´60мл). Об'єднані ЕtOАс екстракти сушили над MgSO4, фільтрували та концентрували у вакуумі. Залишок очищали за допомогою хроматографії (силікагель, 10% 86599 42 ЕtOАс/Гексан), одержуючи зазначену у заголовку сполуку (0,69г, 51%). B. 3-(4-Етил-бензил)-3Н-бензотриазол-4-ол 10b: Суміш 10а, одержану на Стадії А, (0,69г, 2,58ммоль) в дихлорметані (20мл) охолоджували до -78°С та повільно додавали трибромід бору (1М розчин в СН2Сl2; 10мл). Реакційну суміш перемішували при -78°С протягом 30 хвилин, потім повільно нагрівали до RT та перемішували при RT протягом 24 годин. По краплям додавали 1Μ розчин НСI (20мл), з наступним додаванням льодяної Н2О (20мл). Дихлорметан видаляли під зниженим тиском та водну суміш екстрагували ЕtOАс (3´30мл). Об'єднаний ЕtOАс екстракт промивали сольовим розчином, сушили над MgSO4 та концентрували, одержуючи зазначену у заголовку сполуку у вигляді жовтої твердої речовини (0,5г, 77%). С. 2-[3-(4-Етил-бензил)-3Н-бензотриазол-4ілокси}-β-D-глюкопіранозид 10с: До розчину 10b (0,4г, 1,58ммоль), одержаного на Стадії В, в МеОН (10мл) додавали гідроксид літію (0,42г,1,74ммоль) та розчин перемішували при RT. Через 5хв. розчин випарювали насухо. Після розбавлення залишку в DMF (12мл) додавали 2,3,4,6-тетра-Оацетил-α-D-глюкопіранозил бромід (3,25г, 7,91ммоль). Після перемішування реакційної суміші при RT протягом ночі, додавали карбонат калію (2,2г, 1,58ммоль) та МеОН (5мл) та перемішували при RT протягом ночі. Одержаний розчин виливали у воду (50мл) та продукт екстрагували EtOAc (3´50мл), додавали ефір та органічний екстракт промивали водою (4´50мл) та сольовим розчином. Об'єднаний екстракт сушили над MgSO4, фільтрували та концентрували у вакуумі. Залишок очищали за допомогою хроматографії (силікагель, дихлорметан:метанол, 97:3), одержуючи зазначену у заголовку сполуку (0,1г, 15%) у вигляді білої твердої речовини. 1Н ЯМР (300МГц, CD3OD) δ 7,60 (d, J=7,78, 1H) 7,29 (m, 4H) 7,14 (d, J=8,09, 2H) 6,17 (d,J=15,04, 1H) 6,01 (d, J=15,06, 1H) 5,16 (d, J=7,70, 1H) 3,90 (dd, J=1,95, J=12,13, 1H) 3,68 (m, 2H) 3,51 (m, 3H) 2,59 (q, J=7,64, J=15,19, 2H) 1,17 (t, J=7,59, 3H). MS: m/z (MH+) 416. H. Біологічні приклади Приклад 1 Матеріали та способи Клонування сДНК SGLT1 людини та SGLT2 людини та складання вектору експресії ссавців: сДНК SGLT1 людини (банк генів М24847) була клонована з тонкої кишки людини. сДНК SGLT1 людини (банк генів М95549) була клонована з нирки людини. Обидві повні сДНК були субклоновані до псДНК та складені у послідовність для перевірки єдності конструкції. Генерація клітин СНО-K1, що стабільно експресують SGLT1 людини або SGLT2 людини: трансфекція клітин СНО-K1 була виконана із застосуванням реагенту DMRJE-C (Life Technologies, Gaithersburg, MD). Потім трансфектанти були відібрані у присутності антибіотику G418 (Gibco-BRL, Grand Island, NY) при 400мкг/мл. Потім індивідуальні клони були охарактеризовані із використанням функціонального аналізу, описаного нижче. 43 Аналіз переносу натрій-залежної глюкози, заснований на клітинах: колонії клітин, що стабільно експресують SGLT1 та SGLT2 людини, потім використовували для функціонального аналізу поглинання Na+-залежної глюкози. Коротко кажучи, клітини були поміщені на планшету з 96 лунками (густина становила 65000 клітин на лунку), де вони зростали протягом 48 годин. Потім клітини промили один раз буфером аналізу (50мМ HEPES рН7,4; 20мМ Тріс, 5мМ KСl, 1мМ MgCl2, 1мМ СаСl2 та 137мМ NaCl) та обробляли сполукою у відсутності або у присутності NaCl протягом 15 хвилин. Потім клітини помітили 14С-α-метилглюкопіранозидом (AMG, Sigma, St. Louis, МО), аналогом неметаболізуючої глюкози, специфічним для транспортерів натрій-залежної глюкози, як було описано вище [Peng, Η. та Lever J.E. Post-transcriptional regulation of Na+/glucose cotransporter (SGTL1) gene expression in LLC-PK1 cells. J. Biol. Chem 1995; 270: 20536-20542]. Через 2 години помічені клітини тричі промили льодяним PBS. Після аспірації клітини солюбілізовали за допомогою Microscint 20 (Packard, Meriden, СТ) та поглинання Na-залежної 14C-AMG визначали шляхом вимірювання радіоактивності. Планшети підраховували на TopCount (Packard, Meriden, СТ). Результати були повідомлені у вигляді % інгібування або значення ІС50, отриманого у типовому експерименті. Варіабельність функціонального аналізу зазвичай знаходилась в межах 20%. Приклад 2 Аналіз ефективності in vivo Хворі на цукровий діабет та ожиріння (ZDF) щури чоловічої статі (7-8 тижнів) були отримані від Charles River. Тварин утримували у кімнаті з регулюванням температури з циклом освітлення: 12 годин освітлення/темряви. Тваринам надавався вільний доступ до їжі (стандартна дієта для гризунів Purina 5008) та води. За 12 годин до початку експерименту тваринам протягом 12 годин їжі не давали. У ранок експерименту тваринам ввели наповнювач (0,5% метилцелюлозу) або сполуку перорально (1мл/кг). Через одну годину тварини отримали глюкозу перорально (4мл/кг 50% розчину) та були негайно поміщені до метаболічних кліток. Тваринам був наданий вільний доступ до води, та сечу збирали протягом 4 годин. Вміст глюкози у сечі визначали за допомогою Trinder Reagent (Sigma). Приклад 3 Вплив на вміст глюкози у плазмі, інсуліну у плазмі, тригліцеридів у плазмі, вільних жирних кислот у плазмі, масу печінки та масу тіла Для дослідження впливу інгібітору SGLT у комбінації з агоністом RXR, мишам db/db жіночої статі (віком 6-7 тижнів/Jackson Labs, ME) щоденно протягом 11 днів давали наповнювач (0,5% метилцелюлоза), агоніст RXR (0,1-10мпк (мг/кг)), інгібітор SGLT (100мпк), або агоніст RXR плюс інгібітор SGLT. Миші (n=8 тварин на групу) отримували тестові сполуки або наповнювач перорально в об'ємі 10мл/кг маси тіла. Масу тіла записували у перший день, до приймання ліків, та на 4, 8, та 11 день. Через вісімнадцять годин після останнього приймання, мишей зважили та піддали анестезії 86599 44 СО2/О2 (70:30). Потім у мишей взяли кров шляхом пункції ретро-орбітальних синусних пазух та налили її до 2мл гепарінізованих поліпропіленових трубочок, що охолоджувались льодом. Зразки плазми були потім проаналізовані на вміст глюкози, інсуліну, тригліцеридів та вільних жирних кислот. Печінку вирізали, зважили та заморозили. Інгібітори SGLT та агоністи RXR мають чіткі механізми дії. Покращений глікемічний контроль, виміряний як зменшення вмісту глюкози у плазмі, інсуліну у плазмі, вільних жирних кислот у плазмі або тригліцеридів у плазмі, або їх комбінації, може спостерігатись при більш низьких концентраціях агоністу RXR при його прийманні у комбінації з інгібітором SGLT. Тому, зсув вліво кривої дозареакція, викликаний впливом агоністу RXR на вказані вище параметри, може стати очевидним. Додатково, приріст маси, що спостерігався після лікування агоністами RXR, є менш вираженим при прийманні з інгібітором SGLT, так що сприяння інгібіторів SGLT виведенню глюкози з сечею та втраті тілом калорій було продемонстровано шляхом зменшення маси або приросту маси. Також, так як інгібітори SGLT сприяють помірному діурезу, то набряк (та приріст ваги, викликаний набряком), який, як правило, спостерігається після лікування агоністами RXR, може бути менш вираженим або відсутнім. Зменшення кількості агоністу RXR, необхідної для досягнення ефекту, в свою чергу, покращує профіль побічних ефектів. Зменшені побічні ефекти можуть включати такі стани, як ожиріння печінки, збільшення маси печінки, приріст маси тіла, приріст маси серця, набряк, гіпертрофію серця, гіпертрофію печінки, гіпоглікемію та гепатотоксичність, або будь-яку їх комбінацію. Приклад 4 Вплив на вміст глюкози у плазмі, НbА1с, гематокрит, вміст інсуліну у плазмі, вміст тригліцеридів у плазмі, вміст вільних жирних кислот у плазмі, загальний холестерин, HDL, концентрацію ліків у плазмі, масу печінки, масу серця, вміст жиру та масу тіла Для дослідження впливу інгібітору SGLT у сполученні укомбінації з агоністом RXR, щури чоловічої породи із ZDF (віком 6 тижнів/GMI) щодня лікувались протягом 28 днів наповнювачем (0,5% метилцелюлоза), агоністом RXR (0,1-10мпк), інгібітором SGLT (3-100мпк) або агоністом RXR плюс інгібітор SGLT. Щури (n=8 тварин на групу) отримували тестові сполуки або наповнювач перорально в об'ємі 2мл/кг маси тіла. Масу тіла записували у перший день, до приймання ліків, та двічі на тиждень протягом дослідження. За день до приймання останньої дози тваринам не давали їжу всю ніч. Через годину після приймання останньої дози щурів зважили та піддали анестезії СО2/О2 (70:30). Потім у щурів взяли кров шляхом пункції ретро-орбітальних синусних пазух та налили її до 2мл гепарінізованих поліпропіленових трубочок, що охолоджувались льодом. Потім щурам ввели глюкозу (2г/кг перорально) та помістили до метаболічних кліток для збирання сечі (4 години). Потім тварин вбили, а жирові тільця статевих залоз, печінки та серця вирізали, зважили та заморозили 45 для гістологічних досліджень. Потім зразки плазми були проаналізовані на вміст глюкози, НbА1с, інсуліну, гематокрит, концентрацію ліків у крові, загальний холестерин, HDL, вільні жирні кислоти та тригліцериди. Виміряли об'єм сечі та вміст глюкози у сечі, протеши, осмотичний тиск, електроліти (Na, K, СІ), BUN та креатинін. Інгібітори SGLT та агоністи RXR мають чіткі механізми дії. Покращений глікемічний контроль, виміряний як зменшення вмісту глюкози у плазмі, НbА1с, інсуліну у плазмі або тригліцеридів у плазмі, або їх комбінації, може спостерігатись при більш низьких концентраціях агоністів RXR при їх прийманні у комбінації з інгібітором SGLT. Тому, зсув вліво кривої доза-реакція, викликаний впливом агоністів RXR на вказані вище параметри може стати очевидним. Додатково, приріст маси, що спостерігався після лікування агоністами RXR, є менш вираженим при прийманні з інгібітором SGLT, так що сприяння інгібіторів SGLT виведенню глюкози з сечею та втраті тілом калорій було продемонстровано шляхом зменшення маси або приросту маси. Також, так як інгібітори SGLT сприяють помірному діурезу, то набряк (та приріст ваги, викликаний набряком), який, як правило, спостерігається після лікування агоністами RXR, може бути менш вираженим або відсутнім. Це може бути продемонстровано зниженням приросту ваги серця, викликаного агоністами RXR. Зменшення кількості агоністу RXR, необхідної для досягнення ефекту, в свою чергу, покращує профіль побічних ефектів. Зменшені побічні ефекти можуть включати такі стани, як ожиріння печінки, збільшення маси печінки, приріст маси тіла, приріст маси серця, набряк, гіпертрофію серця, гіпертрофію печінки, гіпоглікемію та гепатотоксичність, або будь-яку їх комбінацію. Приклади, наведені вище, можуть також вказувати на те, що пероральне введення інгібітору SGLT у комбінації із антидіабетичними агентами, такими, як модулятор RXR, покращує стан інших маркерів цукрового діабету, включаючи концентрацію глікозованого гемоглобіну (Hgb A1С). Зокрема, пероральне введення інгібітору SGLT у комбінації з одним чи більше модуляторами RXR може зменшувати масу тіла або знижувати приріст маси тіла, а також зменшувати масу печінки або знижувати приріст маси печінки, порівняно із введенням одного чи більше модуляторів RXR самих по собі. Таким чином, для лікування діабету, особливо цукрового діабету II типу, або Синдрому X, може застосовуватись сполука Формули (III) в комбінації з одним або більше антидіабетичними агентами, такими як агоніст RXR, що збільшує чутливість до інсуліну, включаючи введення повторних пероральних доз сполуки Формули (III) в діапазоні від приблизно 25 до 1000мг один раз або двічі на день та повторних доз анти-діабетичного агента або агентів в спільно ефективних дозуваннях. Спільно ефективне дозування для антидіабетичних агентів, описаних в даній заявці, може бути легко визначене кваліфікованим фахівцем в даній галузі техніки, базуючись на стандартних методиках визначення дозування. Зокрема, таке об'єднане вве 86599 46 дення може бути ефективним для досягнення зниження маси тіла, приросту маси тіла, маси печінки або приросту маси печінки у суб'єкта. Додатково, спосіб, що включає (а) введення суб'єкту спільно ефективної кількості інгібітора реабсорбції глюкози; та (b) введення суб'єкту спільно ефективної кількості антидіабетичного агента, такого як модулятор RXR, може використовуватись для зниження маси тіла, приросту маси тіла або маси печінки у суб'єкта, що цього потребує, де об'єднане введення може проводитись в будь-якому порядку та об'єднані спільно ефективні кількості забезпечують бажаний терапевтичний ефект. Також, спосіб, що включає (а) введення суб'єкту спільно ефективної кількості інгібітора реабсорбції глюкози; та (b) введення суб'єкту спільно ефективної кількості антидіабетичного агента, може використовуватись для контролю над масою тіла, приростом маси тіла, масою печінки або приростом маси печінки у суб'єкта, що страждає на діабет, Синдром X, або симптоми, пов'язані з ними, або їх ускладнення, де об'єднане введення може проводитись в будь-якому порядку та об'єднані спільно ефективні кількості забезпечують бажаний терапевтичний ефект. Оптимальні дозування для введення, можуть бути легко визначені кваліфікованим фахівцем в даній галузі техніки та будуть змінюватися в залежності від конкретної сполуки, що використовують, способу введення, концентрації препарату та розвитку хворобливого стану. Крім того, чинники, пов'язані з індивідуальним пацієнтом, якого лікують, включаючи стать пацієнта, вік, вагу, режим харчування, час введення та супутні захворювання призведуть до необхідності пристосувати дозування. Тоді як вищенаведений опис викладає принципи даного винаходу, з прикладами, наведеними з метою ілюстрації, слід розуміти, що застосування винаходу включає всі звичайні варіації, адаптації та/або модифікації, які входять в межі наступної формули винаходу, та їх еквіваленти. Таблиця 3 № прикладу 7 4 8 5 2 9 3 1 6 10 CHOK-SGLT1 ІС50 CHOK-SGLT2 ІС50 (uМ) (uМ) 0,70 0,038 1,12 0,016 1,12 0,061 61% Інг. при 0,365 10мкМ 55% Інг. при 0,334 10мкМ 40% Інг. при 0,39 10мкМ 1% Інг. при 10мкМ 1,02 0 31% Інг. при 10мкМ 0 18% Інг. при 10мкМ 0,59 0,008 47 Комп’ютерна верстка Т. Чепелева 86599 Підписне 48 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted benzimidazole-, benztriazole- and benzimidazolone-о-glucosides
Автори англійськоюUrbanski Maud
Назва патенту російськоюЗамещенные бензимидазол-, бензтриазол- и бензимидазолон-о-глюкозиды
Автори російськоюУрбански Мод
МПК / Мітки
МПК: A61K 31/70, A01N 43/04, C07G 3/00, C07G 11/00, C07H 15/00, C07H 17/00
Мітки: бензімідазол-2, бензтриазол, заміщені, бензимідазолон-о-глюкозиди
Код посилання
<a href="https://ua.patents.su/24-86599-zamishheni-benzimidazol-benztriazol-ta-benzimidazolon-o-glyukozidi.html" target="_blank" rel="follow" title="База патентів України">Заміщені бензимідазол-, бензтриазол- та бензимідазолон-о-глюкозиди</a>
Попередній патент: Носовий стимулятор
Випадковий патент: Розподільник гравітаційної рідинної плівки












