Спосіб одержання 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с]піридину, кристалічна форма і 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину як проміжна сполука
Номер патенту: 110608
Опубліковано: 25.01.2016
Автори: Надь Кальман, БАРКОЦІ Йожеф, Грегор Тамаш, Мезеі Тібор, Брода Юдіт, Мольнар Єнікьйо, Ньюлаші Балінт, Волк Балаж, Ружич Дьйордь, Порч-Маккаі Марта, Дебрецені Йожеф, Сент-Кіраллі Жужанна, Пандур Ангела
Формула / Реферат
1. Спосіб одержання 2-ацетокси-5-(2-фтор-a-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-с]піридину (прасугрелю) формули (І)
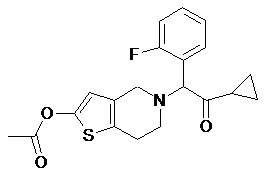 I
I
шляхом перетворення 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI)
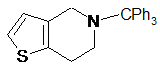 VI
VI
в тритил-4,5,6,7-тетрагідротієно[3,2-с]піридин-2-он формули (V)
 , V
, V
перетворення одержаної сполуки на 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-ону пара-толуолсульфонат формули (II)
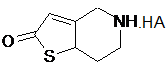 , ІІ
, ІІ
в якій НА є п-ТСК (пара-толуолсульфонова кислота), шляхом реакції сполуки формули (V) з пара-толуолсульфоновою кислотою;
подальше перетворення одержаної таким чином сполуки у сполуку формули (ІV)
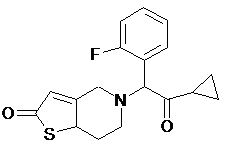 ІV
ІV
шляхом реакції зі сполукою формули (ІІІ)
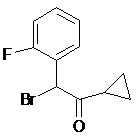 ІІІ
ІІІ
в органічному розчиннику в присутності основи; і перетворення одержаної сполуки в прасугрель формули (І) шляхом реакції з оцтовим ангідридом в органічному розчиннику, причому вихідна сполука є 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридином формули (VI) в кристалічній формі І.
2. Спосіб за п. 1, який відрізняється тим, що вихідну сполуку 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридин формули (VI) в кристалічній формі І перетворюють на 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридін-2-ону пара-толуолсульфонат формули (II) без виділення 5-тритил-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридін-2-ону формули (V)
 V.
V.
3. Кристалічна форма І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI), яка демонструє порошкову рентгенівську дифрактограму, що має характеристичні піки при куті відображення 2θ (±0,2° 2θ) приблизно 10,236; 11,938; 17,929; 19,527; 24,427.
4. Кристалічна форма І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридіну формули (VI) за п. 3, яка демонструє порошкову рентгенівську дифрактограму у відповідності з наступною таблицею (відносна інтенсивність більше 5 %):
Пік
Кут
d-значення
Інтенсивність
Пік
Кут
d-значення
Інтенсивність
№
2-тета (°)
Ангстрем
%
№
2-тета (°)
Ангстрем
%
1
5,790
15,25071
39,1
21
20,254
4,38092
18,9
2
5,986
14,75396
16,2
22
20,536
4,32133
30,4
3
10,236
8,63495
62,5
23
20,853
4,25637
21,8
4
10,594
8,34411
39
24
21,525
4,12511
29,1
5
11,553
7,65334
40,5
25
21,907
4,05403
9,1
6
11,938
7,40748
48,7
26
22,343
3,97587
22,8
7
12,718
6,95478
15,7
27
22,894
3,88134
6,4
8
13,336
6,63384
30,2
28
23,240
3,82430
11,9
9
13,543
6,53296
20,6
29
23,593
3,76788
23,7
10
14,308
6,18523
6,1
30
23,903
3,71978
21,7
11
14,685
6,02737
18,5
31
24,427
3,64109
58,6
12
15,357
5,76519
10,8
32
25,575
3,48021
6,2
13
15,555
5,69199
14,5
33
27,268
3,26790
9,1
14
16,139
5,48733
7,1
34
27,590
3,23049
6,6
15
17,929
4,94340
100
35
27,791
3,20752
5,9
16
18,259
4,85488
16
36
28,809
3,09645
10,8
17
18,598
4,76707
7
37
29,107
3,06544
7,1
18
19,052
4,65440
13
38
30,996
2,88284
5,9
19
19,527
4,54244
79,8
39
33,051
2,70808
4,7
20
20,032
4,42890
16,9
5. Спосіб одержання кристалічної форми І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI) за будь-яким з пп. 3-4, який відрізняється тим, що 4,5,6,7-тетрагідротієно[3,2-с]піридину гідрохлорид приводять у взаємодію з тритилхлоридом без виділення відповідної основи формули (VIIа)
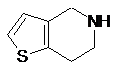 VIIа
VIIа
в присутності основи із застосуванням органічного розчинника, з якого кристалічний продукт осаджують без осадження солі основи і який застосовують як речовину, що зв'язує кислоти.
6. Спосіб за п. 5, який відрізняється тим, що органічну основу застосовують як речовину, що зв'язує кислоти.
7. Спосіб за п. 6, який відрізняється тим, що органічною основою є третинний амін, переважно N,N-діізопропілетиламін, триетиламін, азотовмісна гетероциклічна сполука, переважно піридин.
8. Спосіб за п. 5, який відрізняється тим, що органічним розчинником є ароматичний вуглеводень, переважно толуол; розчинник ефірного типу, переважно тетрагідрофуран, діоксан або метил-трет-бутиловий ефір; розчинник типу кислотного аміду, переважно N,N-диметилформамід, N,N-диметилацетамід або N-метилпіролідон; розчинник нітрильного типу, переважно ацетонітрил; або розчинник кетонового типу, переважно метилетилкетон.
Текст
Реферат: Даний винахід стосується способу одержання 2-ацетокси-5-(2-фтор-циклопропілкарбінолбензил)-4,5,6,7-тетрагідро-4Н-тієно[3,2-c]піридину (прасугрелю) формули (І). Спосіб починається з кристалічного 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридіну формули (VI). Даний винахід також стосується нової кристалічної форми 5-тритил-4,5,6,7тетрагідротієно[3,2-с]піридину формули (VI) та її застосування для одержання сполуки формули (V) і способу її одержання. UA 110608 C2 (12) UA 110608 C2 UA 110608 C2 Спосіб одержання фармацевтичних сполук і проміжних сполук Область винаходу Даний винахід відноситься до способу одержання 2-ацетокси-5-(2-фтор-α-циклопропілкарбінол-бензил)-4,5,6,7-тетрагідро-4H-тієно[3,2-з]піридіну (прасугреля) формули 5 10 15 20 25 30 який сприятливо і безпечно застосується в промисловому масштабі. Даний винахід додатково відноситься до поліпшених способів для окремих стадій синтезу і кристалічним поліморфам проміжної сполуки формули 2-ацетокси-5-(2-фтор-α-циклопропіл-карбінол-бензил)-4,5,6,7-тетрагідро-4H-тієно[3,2з]піридіну (прасугрель) формули (I) є важливим представником тетрагідро-тієнопірідінових похідних, які використовують у фармацевтичній промисловості як інгібітори агрегації тромбоцитів. Рівень техніки Відомі шляхи синтезу для одержання прасугреля формули (I) Прасугрель та аналогічні сполуки і спосіб їх одержання вперше описані в US 5288726 B1. Спосіб одержання відповідно до US 5288726 B1 представлений на реакційної схемі 1. 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она гідрохлорид формули - де HA позначає HCl - приводять у взаємодію з 2-бром-1-циклопропіл-2-(2-фторфеніл)етаноном формули в диметилформаміді при кімнатній температурі протягом 5 годин в присутності безводного карбонату калію (мольне відношення: 1,0:1,0:2,2). Неочищений продукт очищають шляхом колоночної хроматографії, вихід становить 32 %. Продукт являє собою коричневий і маслянистий 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетіл]-5,6,7,7a-тетрагідро-4H-тієно[3,2c]піридін-2-он формули (IV), змішаний з відповідним 2-гідрокситаутомером. Масляний продукт кристалізують з диізопропілового ефіру, причому вихід не вказаний. В якості останньої стадії синтезу гідрид натрію додають до суміші формули (IV) і розчину диметилформаміду і оцтового ангідриду. Реакційну суміш перемішують протягом 3 годин при кімнатній температурі перед 1 UA 110608 C2 5 10 15 20 25 30 35 обробкою. Неочищений продукт очищають шляхом колонкової хроматографії. Після упарювання масляний продукт кристалізують з диізопропілового ефіру, і спосіб дозволяє одержати 65 % основи прасугрелю, в розрахунку на проміжну сполуку формули (IV), і дуже мале, 21 %, розрахунку на сполуку формули (II). Одержання вихідної речовини 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она гідрохлориду формули (II) - де HA позначає HCl - не приведено в US 5288726 B1, опис лише цитує відомі способи без будь-якої детальної інформації. Цитовані документи (M. Podesta et al., Eur. J. Med. Chem. - Chim. Ther. 9 (5), 487-490 (1974); і Japanese Patent Kokai Application No. Sho 61-246186) не розкривають який-небудь спосіб одержання ключовогї проміжної сполуки формули (II) (HA являеться Cl). Кілька додаткових заявок на винаходи цитують шлях синтезу відповідно до реакційної схеми 2. Недолік способу, розкритого в US 5288726 B1, полягає в тому, що сполуки формули (IV) і прасугрель формули (I) одержують з реакційної суміші шляхом колонкової хроматографії. Відомо, що колонкова хроматографія потребує великої кількості розчинника, таким чином, масштабування ускладнено, і в цьому випадку результати представлені з низьким виходом. Ще один недолік вищенаведеного способу полягає у використанні гідриду натрію на стадії ацилювання при отриманні кінцевого продукту. Застосування гідриду натрію в промислових способах небезпечно і має задовольняти жорстким вимогам безпеки. Ще один недолік використання гідриду натрію полягає в обробці парафіну, який використовують протягом стадії суспендування. Спосіб, розкритий в EP 1098132 B1, схожий на спосіб, описаний в основному патенті. 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она гідрохлорид формули (II) (HA являється HCl) приводять до взаємодії з 2-бром-1-циклопропіл-2- (2-фторфеніл) - етаноном формули (III) в диметилформаміді при кімнатній температурі, але відмінність від основного патенту полягає в тому, що в якості основи використовують гідрокарбонат калію, і також використовують відмінне мольне відношення (1,0:0,93:2,8). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, продукт розподіляється між водою і етилацетатом, і після упарювання продукт очищають шляхом хроматографії. Його кристалізують з диізoпропілового ефіру. Таким чином, вихід проміжної сполуки формули (IV) становить 35 %. Ацетилювання схоже на описане в основному патенті, але суміш толуолу і етилацетату щодо 3 до 1 використовують замість 100 до 3 для хроматографії в якості елюента. Вихід на останній стадії також становить 65 % і вихід на двох стадіях разом складає тільки 23 %. В W02007/115305 A1 описаний спосіб, в основному ідентичний способу, описаному в основному патенті. Розкриті способи засновані на тій же самій несприятливій стадії як і в основному патенті, і приводять у результаті до аналогічних низьких виходів. Відповідно до способу, описаного в US 5874581 B1, прасугрель формули (I) одержують, починаючи з 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она толуол-4-сульфонату формули (II) (HA являється пара-толуолсульфонатом, п-ТСК), де карбонільна група в позиції 2 силільована, і захищена проміжна сполука формули 40 45 50 пов'язано з відповідним кетоновим галогенідом, і видалення захисної групи і Oацетилювання утворюється in situ проміжна оксосполука формули (IV) здійснюють в одну стадію. Спосіб представлений на реакційній схемі 3. Більш докладно спосіб полягає в наступному: сіль толуол-4-сульфонат формули (II) приводять у взаємодію з трет-бутил-диметил-хлорсіланом в присутності триетиламіну в дихлорметановому розчиннику протягом 3 годин при кімнатній температурі, і утворюється 2(трет-бутил-диметилсілілоксі)-4,5,6,7-тетрагідротієно[3,2-c]піридін толуол-4-сульфонат. Утворену сполуку додатково наводять у взаємодію з 2-хлор-1-циклопропіл-2-(2-фторфеніл)етаноном формули 2 UA 110608 C2 5 10 15 20 25 без виділення в присутності йодиду натрію, шляхом додаткового додавання триетиламіну при 45 °C і перемішування протягом 12 годин. Після обробки реакційної суміші 2(трет-бутилдиметилсилілокси)-5-(α-циклопропілкарбоніл-2-фтор-бензил)-4,5,6,7-тетрагідротієно[3,2c]піридін формули кристалізують з ацетонітрилу. Вихід становить 73,3 %. Одержану сілільну похідну десілілірують в ТГФ (тетрагідрофурані) в присутності триетиламіну і 4-диметиламіно-піридіну і ацетилюють оцтовим ангідридом при перемішуванні протягом 4,5 годин при кімнатній температурі без виділення проміжної сполуки. Вихід основи прасугреля, розрахований за останньою реакційною стадією, становить 91 %. Вихід, розрахований по солі толуол-4сульфонати формули (II) (HA являє собою п-ТСК), становить 66,7 %. У способі відповідно до US 5874581 B1 трет-бутил-диметилсилілокси групу успішно використовують для захисту 2оксогрупи для зменшення утворення побічних продуктів, заміщених по оксогрупі. Таким чином, вихід, розрахований по солі толуол-4-сульфонату формули (II) (HA являє собою п-ТСК), краще, ніж у використаному способі, описаному в основному патенті. Крім того, використовують для одержання продукту переважний і простіший спосіб, ніж колонкова хроматографія. Тим не менш, недолік способу, описаного в US 5874581 B1, полягає у введенні в спосіб двох додаткових стадій. Таким чином, синтез є дорогим, і промислова придатність ускладнена внаслідок застосування чутливого до води трет-бутил-диметилсілану і токсичного 4диметиламіно-піридіну. CN 101250192 A, CN 101245072 A, CN 101245073 A і CN 101250193 A (Китайські заявки) описують той же самий новий спосіб синтезу прасугреля з відмінними деталями деяких проміжних сполук. CN 101250192 A описує одержання основи прасугреля з проміжної сполуки формули 30 35 де оксогрупа захищена алкільною групою. Спосіб представлений на реакційній схемі 4. Захисну групу видаляють з використанням кислотного і м'якого реакційного середовища. Перевага способу полягає в тому, що в ньому не використовують реагенти, які мають низьку температуру займання або вибухонебезпечні, і спосіб призводить в результаті до високого виходу. Відповідно до CN 101245072 A шляхом бензиліруваня 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули 3 UA 110608 C2 вихід проміжної сполуки формули (XI) становить 98,7 %. 2-бром-N-бензильну проміжну сполуку формули 5 10 одержують шляхом бромування сполуки формули (IX) з виходом 97,8 % відповідно до реакційної схеми 5. Сполуку формули (XII) перетворюють на прасугрель формули (I) в кілька додаткових стадій. CN 101245073 A розкриває покращений варіант способу, описаного в CN 101245072 A, де атом брому 2-бромної похідної формули (XII) замінюють на алкокси групу (переважно метокси групу) з метилат натрію, і вихід становить 82,2 %. Одержану 2-алкілокси проміжну сполуку формули 15 20 25 30 35 перетворюють на прасугрель формули (I) в кілька додаткових стадій відповідно до реакційної схеми 6. В CN 101250193 A 2-алкокси проміжна сполука утворюється шляхом зв'язування 2-алкокси4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули з 2-бром-1-циклопропіл-2-(2-фторфеніл)-етаноном формули (III) в присутності солі Cu (I) і солі йоду (реакційна схема 7.) Перевага способу полягає в тому, що в ньому не використовуються реагенти, які мають низьку температуру займання або вибухонебезпечні, і спосіб приводить в результаті до високого виходу. Недоліки способів, описаних в CN 101250192 A, CN 101245072 A, CN 101245073 A і CN 101250193 A, полягають в тому, що економічна обробка на стадії деалкілування алкокси групи (переважно деметилювання метокси групи) ускладненна. Додатково, недолік полягає в тому, що при каталітичному гідруванні захисної бензильної групи по атому азоту утворені тіофеновані сполуки, що діють як каталітична отрута. В W02008/108291 розкривається спосіб одержання прасугреля гідрохлориду, що включає зменшену кількість домішки 3-хлорпропіла, яка утворюється шляхом відкривання кільця при хлоруванні циклопропільного кільця прасугреля. 1-Циклопропіл-2-(2-фторфеніл)-етанон формули (XV) 4 UA 110608 C2 5 10 15 хлорують в позиції 2 при низькій температурі, і одержану проміжну сполуку формули (IIIa) при цьому пов'язану з 5,6,7,7 a-тетрагідро-4H-тієно[3,2-c]піридін-2-онів похідною формули (XIV, R = тріалкілсіліл), який захищений по атому кисню (реакційна схема 8.) EP 2003136 A1 описує спосіб одержання основи прасугреля високої чистоти і його солей приєднання кислоти (переважно гідрохлориду) із зменшеним вмістом дезацетильной домішки формули (IV). Спосіб, розкритий в WO96/11203, використовують для одержання солі прасугреля та очищення основи. Шляхом зв'язування використовують 2-хлор-1-циклопропіл-2-(2фторфеніл)-етанон формули (IlIa), який утворюється шляхом галогенування відповідного кетону формули (XV) газоподібним хлором з виходом 80 %. Основу прасугрелю високої чистоти перекристалізовують. Кілька розчинників, переважно ацетонітрил, згадуються для перекристалізації. Відомі шляхи синтезу та проміжні сполуки, які використовуються в способі. Недолік способу за даним винаходом полягає у використанні газоподібного хлору, який є отруйним, складним в обігу і в утилізації. WO2009/006859 описує спосіб, де сіль 5,6,7,7 a-тетрагідро-4H-тієно[3,2-c]піридін-2-он формули (II) пов'язана з відповідною 2-метоксипохідною формули 20 25 30 замість 2-бром-1-циклопропіл-2-(2-фторфеніл)-етанона формули (III). Після одержання проміжної сполуки формули (IV) за допомогою колонкової хроматографії вихід становить 23,7 % відповідно з одним з варіантів, і 65,4 % відповідно з іншим. Проміжну сполуку формули (XVI) одержують з 2-фторбензальдегіду і триметилсилілціаніду в кілька стадій з використанням дорогих реагентів і виходом 38,5 %. Неочищену маслянисту сполуку формули (II) одержують після ацилювання і подальшої колоночної хроматографії, і кристалічну сполуку одержують шляхом кристалізації з діетилового ефіру, де вихід становить 29,2 %. Спосіб не є економічним, і кінцевий продукт одержують в кожному варіанті шляхом колонкової хроматографії. Опис не розкриває будь-яких даних про профіль домішок в кінцевому продукті. WO2009/062044 розкриває два шляхи синтезу для одержання прасугреля. Один із шляхів дозволяє одержати 4,6 %, розраховані за 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII) або 3,7 % з урахуванням також стадії перекристалізації з використанням способу, описаного в основному патенті, з невеликою модифікацією. Інший шлях представлений на реакційної схемою 9. 5-Тритій-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-он формули 35 ацетилюють, при цьому утворюється сполука формули 5 UA 110608 C2 , і захисну групу видаляють з атома азоту. Одержана таким чином похідна формули 5 10 15 20 25 потім пов'язують з бром-кетоном формули (III). Вихід становить 4,1 %, розрахований по 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII), або 3,1 % з урахуванням також стадії перекристалізації. Вихід менше ніж у попередньому варіанті способу. WO2009/066326 описує поліпшений і масштабований спосіб основного патенту. Сіль 5,6,7,7a-тетрагідро-4H-тієно[3,2-c] піридін-2-он формули (II) і 2-бром-1-циклопропіл-2-(2фторфеніл)-етанон формули (III) пов'язують в присутності карбонату калію. Утворену сполуку формули (IV) одержують в масляній формі і ацетилюють в присутності речовини, що зв'язує кислоти, диізопропілетиламіну (ДІПЕА). Найбільший вихід, розрахований по 4,5,6,7-тетрагідротієно[3,2-c]піридіну гідрохлориду формули (VII), складає 19,3 або 13 %, якщо брати до уваги кінцеву стадію очистки. Додатково недоліком способу є застосування двох відмінних основ на двох стадіях і виділення проміжних сполук формули (VII), не є необхідними, таким чином економлячи людський ресурс і витрати на розчинники. Ранні стадії синтезу у відповідності з попереднім рівнем техніки Одержання 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) вперше описано в FR 2576901 B1. Вихід становить 96 %, і 4,5,6,7-тетрагідро-тієно[3,2-c]піридін формули (VIIa) приводять у взаємодію з трітілхлоридом в присутності триетиламіну в дихлорметановому середовищі при кімнатній температурі протягом 20 годин. Реакційну суміш потім змішують з водою. Після розділення фаз органічний шар сушать, упарюють і фільтрують з діхлорметаном на шарі силікагелю. Одержують пастоподібну сполуку формули (VI) , 30 35 40 45 яка має температуру плавлення 95 °C. Якість продукту не розкрито. Хоча вихід продукту є високим, спосіб скоріше не підходить для промислового застосування через галогеновий розчинник реакційного середовища, а крім того, якість продукту не визначено. Це може пояснити вихід 64 % на наступній стадії, де сполуки формули (VI) перетворюють у 5-тритію2,4,5,6,7,7a-гексагідротієно[3,2-c]піридін-2-он формули (V) В WO2009/062044 спосіб починається з 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII). Основу вивільняють з гідрохлориду в дихлорметані за допомогою амонійгідроксиду. Основу трітілюють в дихлорметані в присутності триетиламіну, перемішують протягом 1 години при кімнатній температурі. Вихід трітільної проміжної сполуки становить 74,8 %, і чистота продукту становить 89,16, Виміряно за допомогою ВЕРХ (високоефективна рідинна хроматографія). В WO2009/066326 спосіб починається з 4,5,6,7-тетрагідро-тієно [3,2-c]піридіну формули (VIla). Сполуку формули (VII) трітіліруют в діхлорметані в присутності триетиламіну, перемішують протягом 16 годин при 0-5 °C. Сполуку формули (VI) фільтрують з циклогексану з виходом 87,5 %. В US2009/066326 спосіб починається з 4,5,6,7-тетрагідро-тієно [3,2-c]піридіну формули (VIla), але умови реакції, що використовуються відрізняються. Вільну основу перетворюють в жовто-коричневий твердий 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридін формули (VI) в присутності гідриду натрію з використанням трітілхлорида в тетрагідрофурановому середовищі при 0 °C протягом однієї години шляхом флеш-хроматографії. Вихід продукту складає 50 %, і продукт характеризували за допомогою 1H-NMR (ядерний магнітний резонанс) і мас 6 UA 110608 C2 5 10 15 20 25 30 35 40 45 50 55 спектрометрією. Спосіб є швидким, але є наступні недоліки: низький вихід, гідрид натрію використовують в якості основи, і очищення за допомогою флеш-хроматографії не є промислово придатною. Ще один спосіб одержання 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) описаний в J. Am. Chem. Soc. 2007,10,2768, де сполуки формули (VI) перетворюють на 5тритію-2,4,5,6,7,7a-гексагідро-тієно[3,2-c]піридін формули шляхом окислення сульфурілхлоридом в діхлорметановому розчиннику при 0 °C. Продукт що залишився очищають шляхом колоночної хроматографії; жовта тверда сполука формули (VI) має температуру плавлення 85-87 °C, і спосіб дозволяє одержати 66 %. Недолік способу полягає в тому, що вихідна сполука важкодоступна; колонкова хроматографа, використовувана для масштабування, є дорогою і обмежена в застосуванні. Шлях синтезу представлений на реакційній схемі 10. FR 2576901 B1 розкриває одержання 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2она формули (V) з трітільної похідної формули (VI), і він додатково розкриває одержання 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она гідрохлориду формули (II) (де HA являє собою HCl), починаючи з сполуки формули (V). 5-Тритій-4,5,6,7-тетрагідро-тієно[3,2-c]піридін формули (VI) приводять у взаємодію з бутиллітєм, трібутилборатом і перекисом водню в тетрагідрофурановому середовищі. Реакційну суміш обробляють, і утворений маслянистий продукт перекрісталізовують з диізопропілового ефіру. Вихід становить 64 % сполуки формули (V). Трітільну захисну групу видаляють з проміжної сполуки формули (V) шляхом кип'ятіння з 98 мас. % мурашиної кислоти при 90 °C протягом 1 години. Після обробки реакційної суміші вихід 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она гідрохлориду формули (II), (де HA являє собою HCl) становить 81 %, розрахований по сполуці формули (V). Короткий виклад суті винаходу Мета даного винаходу полягає в тому, щоб запропонувати економічний простий шлях синтезу, який не вимагає колоночної хроматографії, застосовується в промисловому масштабі і забезпечує високий вихід, починається з 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII) і дозволяє одержати прасугрель формули (I). Вищенаведена мета досягається за допомогою способу за даним винаходом. Метою даного винаходу є спосіб одержання 2-ацетокси-5-(2-фтор-α-циклопропіл-карбонілбензил)-4,5,6,7-тетрагідро-4H-тієно[3,2-c]піридіну (прасугреля) формули (I). Спосіб починається з кристалічного 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI). Даний винахід додатково відноситься до способу одержання 5-тритію-4,5,6,7-тетрагідротієно[3,2-c]піридіну формули (VI), починаючи з 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII) Додатково, об'єктами даного винаходу є дві нові кристалічні форми 5-тритію-4,5,6,7тетрагідро-тієно[3,2-c]піридіну формули (VI) та їх застосування для одержання сполуки формули (V). Винахід додатково відноситься до поліпшеного способу одержання 5-тритію-5,6,7,7aтетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V), починаючи з нової кристалічної Форми I 5тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI). Винахід додатково відноситься до поліпшеного способу одержання 5,6,7,7a-тетрагідро-4Hтієно[3,2-c]піридін-2-она формули (II), починаючи з 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2c]піридін-2-она формули (V). Винахід додатково відноситься до поліпшеного способу одержання прасугреля формули (I), починаючи з нового кристалічного поліморфа I 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) з використанням 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) і 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (II) як проміжних сполук. Винахід додатково відноситься до поліпшеного способу одержання прасугреля формули (I), починаючи з 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII), з використанням нового кристалічного поліморфа I 5-тритію- 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI), 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) і 5,6,7,7a-тетрагідро-4Hтієно[3,2-c]піридін-2-она формули (II) в якості проміжних сполук. 7 UA 110608 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід додатково відноситься до поліпшеного способу одержання прасугреля формули (I), починаючи з 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII) з використанням нового кристалічного поліморфа I 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) і 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (II) в якості проміжних сполук. Детальний опис винаходу Мета даного винаходу полягає в тому, щоб запропонувати поліпшений спосіб, де трітіліровання 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII) здійснюють за допомогою способу, здійснюваного в єдиній ємності і без виділення 4,5,6,7-тетрагідро-тієно[3,2c]піридіну формули (VIla) в присутності основи, що підходить для вивільнення основи з солі гідрохлориду формули (VII) і для зв'язування гідрохлориду, який утворюється в реакції трітіліровання. Винахід відноситься до поліпшеного способу одержання 5-тритію-4,5,6,7-тетрагідротієно[3,2-c]піридіну формули (VI). Початкова сполука способу являє собою 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлорид формули (VII), який перетворюють на 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридін формули (VI) без виділення 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VIla). Додаткова мета полягала в тому, щоб запропонувати спосіб, де застосування дихлорметана не потрібно на противагу способу відповідно до FR 2576901 B1. Відомо, що способи, в яких використовують галогеновані розчинники, не сприятливі для навколишнього середовища, таким чином, доцільно уникнути їх застосування. Одна з переваг даного винаходу полягає в тому, що дихлорметан замінений на інший негалогеновий розчинник. Несподівано виявлено, що трітіліровання сполуки формули (VII) може бути здійснено в органічних розчинниках, що відрізняються від дихлорметана. Придатними розчинниками є ароматичні вуглеводні (наприклад толуол), ефірні розчинники (наприклад тетрагідрофуран / ТГФ), діоксан, метил-трет-бутиловий ефір, розчинники ацідамідного типу (наприклад N, Nдиметилформамід/ДМФ, N, N-диметилацетаміді, N-метил-піролідон), розчинники нітрильного типу (наприклад ацетонітрил), розчинники кетонового типу (наприклад метил-етил-кетон). Реакцію здійснюють у присутності органічної основи. Органічна основа може являти собою, наприклад, триетиламін, N, N-диізопропілетіламін, піридін і т.д. Спосіб за даним винаходом здійснюється несподівано протягом короткого часу (10-15 хвилин), тоді як час реакції в способі FR 2576901 B1 становить 20 годин. Переважно використовують розчинники, з яких трітілірованна кристалічна сполука осідає безпосередньо або після розведення реакційної суміші водою. Такі розчинники можуть являти собою, наприклад ацетонітрил, ДМФ і т.д. Таким чином, трітілірованний продукт може бути одержаний за допомогою простого фільтрування. Потребуюча час і трудовитрати обробка реакційної суміші не потрібна, і водний луг не утворюється. Одержаний таким чином продукт може бути використаний в подальших стадіях синтезу без очистки. Додатковими об'єктами даного винаходу є два нові поліморфа 5-тритію-4,5,6,7-тетрагідротієно[3,2-c]піридіну формули (VI). Несподівано виявлено, що одержаний 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридін формули (VI) знаходиться в кристалічній формі з високою температурою плавлення (169170 °C) в протилежність раніше відомим формам з низькою температурою плавлення (95 °C). Нова поліморфа являє собою Форму I і його порошкова рентгенівська дифрактограмаа представлена на Фіг. 1. При здійсненні способу, розкритого в FR 2576901 B1, відому сполуку з температурою плавлення 92-97 °C одержують шляхом упарювання реакційної суміші, що містить дихлорметан. Порошкова рентгенівська дифрактограма одержаної сполуки представлена на Фіг. 2., сполука являється аморфною і містить 5-25 моль. % дихлорметану. При зберіганні протягом декількох місяців або сушіння в вакуумі при 80 °C аморфна сполука перетворюється на поліморфну форму, названу Форма II. Порошкова рентгенівська дифрактограма Форми II представлена на Фіг. 3, і Форма II має температуру плавлення 147-152 °C. У фармацевтичній промисловості існує значна потреба в відтворюваних способах, які приводять в результаті до чистих і морфологічно однорідних активних посередників сполук. Морфологічно однорідний продукт також має технічну значимість, оскільки поодинокі поліморфи демонструють значно відмінні властивості, які впливають на обробку (розчинність, сушку і фільтрування). Додаткова вимога до відтворюваного способу, який приводить в результаті до чистого і морфологічно однорідного продукту, полягає в тому, що спосіб повинен бути економічним і застосовним в промисловому масштабі. Дві кристалічні форми 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) згідно даного винаходу одержують з високою чистотою, не містять будь-яких залишкових розчинників, 8 UA 110608 C2 5 володіють сприятливими фізико-хімічними властивостями і більш стабільні в порівнянні з аморфною формою формули (VI), відомої з попереднього рівня техніки. Крім того, нові поліморфи формули (VI) відтворювані в промисловому масштабі. Об'єкт даного винаходу представляє собою Форму I 5-тритію-4,5,6,7-тетрагідро-тієно[3,2c]піридіну формули (VI). Його порошкова рентгенівська дифрактограма представлена на Фіг. 1 і характеристична картина порошкової дифракції рентгенівських променів, позиція піків (Форма I) і відносна інтенсивність (більше 5 %) представлені в таблиці 1. Таблиця 1 Пік №. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 10 15 20 25 Кут 2-Тета 5,790 5,986 10,236 10,594 11,553 11,938 12,718 13,336 13,543 14,308 14,685 15,357 15,555 16,139 17,929 18,259 18,598 19,052 19,527 20,032 d значення Інтенсивність Пік Ангстрем % № 15,25071 14,75396 8,63495 8,34411 7,65334 7,40748 6,95478 6,63384 6,53296 6,18523 6,02737 5,76519 5,69199 5,48733 4,94340 4,85488 4,76707 4,65440 4,54244 4,42890 39,1 16,2 62,5 39 40,5 48,7 15,7 30,2 20,6 6,1 18,5 10,8 14,5 7,1 100 16 7 13 79,8 16,9 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Кут 2-Тета d значення Ангстрем Інтенсивність % 20,254 20,536 20,853 21,525 21,907 22,343 22,894 23,240 23,593 23,903 24,427 25,575 27,268 27,590 27,791 28,809 29,107 30,996 33,051 4,38092 4,32133 4,25637 4,12511 4,05403 3,97587 3,88134 3,82430 3,76788 3,71978 3,64109 3,48021 3,26790 3,23049 3,20752 3,09645 3,06544 2,88284 2,70808 18,9 30,4 21,8 29,1 9,1 22,8 6,4 11,9 23,7 21,7 58,6 6,2 9,1 6,6 5,9 10,8 7,1 5,9 4,7 Умови проведення порошкової рентгенівської кристалографії: Апарат: BRUKER D8 ADVANCE порошковий дифрактометр Випромінювання: CuKα1 (=1,54060 Å), CuK α2 (=1,54439 Å) Напруга: 40 кВ Анодний струм: 30 мА Додатково: дзеркало Гобеля, щілина Соллера, пробовідбірник, положення з пропущенням променів Детектор: LynxEye Вимірювання є статичне / сканування: 4-35°2 Величина кроку: 0.02° Зразок: не порошковий, вимірювали і зберігали при кімнатній температурі Позиції характеристичних піків порошкової дифракції рентгенівських променів Форми I є наступними: 2 (±0,2° 2): 10236; 11938; 17929; 19527; 24427. Переважно позиції характеристичних піків порошкової дифракції рентгенівських променів Форми I є наступними: 2 (±0,2° 2): 5790; 10236; 10594; 11553; 11938; 13336; 17929; 19527; 20536; 24427. Ще один об'єкт даного винаходу являє собою Форму II 5-тритію-4,5,6,7-тетрагідро-тієно[3,2c]піридіну формули (VI). Її порошкова рентгенівська дифрактограма представлена на Фіг. 3. і характеристична картина порошкової дифракції рентгенівських променів, позиція піків (Форма II) і відносна інтенсивність (більше 5 %) представлені в Таблиці 2. 30 9 UA 110608 C2 Таблиця 2 Пік № 10 15 20 25 30 d значення Ангстрем Інтенсивність % Пік № Кут 2-Тета d значення Ангстрем Інтенсивність % 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 5 Кут 2-Тета 5,484 9,139 9,768 10,059 10,887 11,614 12,446 14,015 14,488 14,675 15,058 15,317 15,522 15,864 16,106 16,810 18,001 18,357 19,351 19,594 20,098 20,389 16,10115 9,66847 9,04746 8,78663 8,12012 7,61336 7,10628 6,31409 6,10889 6,03144 5,87888 5,77991 5,70431 5,58185 5,49856 5,26998 4,92381 4,82905 4,58320 4,52707 4,41467 4,35215 6 13,7 35,8 37,7 100 10,6 5,5 9,1 15,9 7,5 5 18,9 11 9 9,8 49,5 49,8 91 93,2 28,2 5,4 30,2 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 21,078 21,347 22,275 22,492 23,003 23,383 23,585 24,290 24,842 25,184~ 25,852 26,886 27,193 27,675 28,257 28,613 29,109 29,563 30,010 30,901 33,457 4,21142 4,15895 3,98787 3,94986 3,86317 3,80124 3,76920 3,66131 3,581233,53333 3,44352 3,31343 3,27676 3,22069 3,15570 3,11721 3,06524 3,01920 2,97524 2,89148 2,67616 28 5,7 14,5 22 20,5 34,1 38,5 24,8 7,3 13,5 10,4 9,7 5,2 11,8 13 7,1 8,3 7,3 7,1 5 8,1 Умови проведення порошкової рентгенівської кристалографії являються тими ж самими, як розкрито вище. Ще один об'єкт даного винаходу являє собою поліпшений спосіб одержання 5-тритію5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V). Додаткова перевага способу за даним винаходом полягає в тому, що перетворення Форми (I) формули (VI) в 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-он формули (V) призводить в результаті до більш високого виходу в порівнянні з відомими способами перетворення. Одержання 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) здійснюють відповідно до способу, описаного в FR 2576901 B1, з деякими модифікаціями, які приводили в результаті до сприятливого для навколишнього середовища способу при більш хорошому виході. Відповідно до FR 2576901 B1 під час обробки реакційної суміші, що містить перекис водню, до реакційної суміші додають воду, і екстрагують дихлорметаном. Одержаний таким чином дихлорметан-тетрагідрофурановий розчинник упарюють у вакуумі. Залишковий продукт являє собою масло, з якого твердий кінцевий продукт одержують з допомогою диізопропілового ефіру. Вихід становить 64 %. Мета даного винаходу полягала в тому, щоб модифікувати кількість і ставлення ТГФ (який використовують як реакційного середовища) і води (яку додають до ТГФ в процесі реакції) таким чином, щоб виявилося можливим розділення двох фаз, таким чином, відсутня необхідність в додатковій екстракції дихлорметаном або будь-якими іншими органічними розчинниками. Кристалічну Форму I формули (VI), що має високу температуру плавлення, використовують в якості проміжної сполуки, таким чином, кристалічний продукт одержують шляхом упарювання органічної фази, яка може бути відфільтрована від органічних розчинників (наприклад, ацетонітрилу, толуолу, гексану, гептану, петролейного ефіру і т.д.), переважно нгептан. Вихід 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) становить 92 %. Ще один об'єкт даного винаходу являє собою поліпшений спосіб одержання 5,6,7,7aтетрагідро-4H-тієно[3,2-c]піридін-2-она формули (II). 10 UA 110608 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до способу, розкритого в US 5874581 B1, трітільну захисну групу видаляють з 5тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) за допомогою еквімолярної кількості пара-толуолсульфонової кислоти в розчиннику, що містить ТГФ, перемішують реакційну суміш протягом 2 годин при 50 °C. Спосіб дозволяє одержати 93 % 5,6,7,7aтетрагідро-4H-тієно[3,2-c]піридін-2-она пара-толуолсульфонату формули (II), де HA являє собою п-ТСК. У поліпшеному способі згідно данного винаходу реакція може бути здійснена при кімнатній температурі протягом 2 годин. Цей економічний варіант способу не потребує нагрівання. Вихід становить 96 %. Відповідно до ще одного варіанту способу за даним винаходом 5,6,7,7a-тетрагідро-4Hтієно[3,2-c]піридін-2-он формули (II) одержують простим і економічним шляхом. Шляхом синтезу 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) кристалічну проміжну сполуку формули (V) не відокремлюють від органічної фази (ТГФ). Розчин ТГФ безпосередньо використовують для одержання 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она паратолуолсульфоната формули (II) на наступній стадії синтезу. Якість і вихід одержаної таким чином проміжної сполуки формули (II) [розраховані по 5-тритію-4,5,6,7-тетрагідро-тієно[3,2c]піридіну формули (VI)] є такими ж, як якість і вихід проміжної сполуки формули (II), одержаної з кристалічного 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V). Ще один об'єкт даного винаходу являє собою поліпшений спосіб одержання 2-ацетокси-5-(2фтор-α-циклопропіл-карбоніл-бензил) -4,5,6,7-тетрагідро-4H-тієно[3,2-c]піридіну (прасугреля) формули (I), починаючи з нової Форми I 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI), або використання його в якості проміжної сполуки. Відомі способи описують двостадійні способи одержання прасугреля формули (I) з 5,6,7,7aтетрагідро-4H-тієно[3,2-c]піридін-2-она пара-толуолсульфоната формули (II), де одержують проміжну сполуку формули (IV). Відомі способи використовують дві відмінні основи на двох стадіях. Більшість із способів використовують займистий гідрид натрію в процесі ацилювання. Перевага способу за даним винаходом полягає в тому, що він може бути безпечно масштабований шляхом заміни гідроксиду натрію на будь-який інший органічний розчинник. Несподівано виявлено, що дві стадії можуть бути здійснені в одному і тому ж органічному розчиннику (ДМФ) та в присутності однієї і тієї ж органічної основи, незважаючи на те, що використані органічні основи являють собою значно більш слабкі основи ніж гідроксид натрію. Будь-які третичні аміни (наприклад, триетиламін, N, N-диізопропіл-етиламін, піридін і т.д.) можуть бути переважно використані в якості основи замість раніше використовуваного карбонату калію і гідрокарбонату (для реакції зв'язування), і гідриду натрію (для ацетилювання). Реакційна суміш розділяється між не змішуваним з водою органічним розчинником і водою, і після виділення з органічної фази, продукт одержують у вигляді кристалічної сполуки. Кінцевий продукт очищають шляхом перекристалізації з органічного розчинника без використання колонкової хроматографії. Відповідно до способу згідно даного винаходу 5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2она пара-толуолсульфонат (HA являє собою п-ТСК) формули (II) і 2 - бром-1-циклопропіл-2-(2фторфеніл)-етанон формули (III) перемішують в органічному розчиннику (переважно в ДМФ, ТГФ, толуолі, ацетонітрилі) шляхом додавання 1-3 моль еквівалентів, переважно 2-2,5 моль еквівалентів аміну, при 20-50 °C, переважно 20-30 °C, протягом 1-3, переважно 1-2 годин. Реакційна суміш потім розділяється між водою і етилацетатом, і органічну фазу сушать і упарюють. Залишковий продукт розчиняють в органічному розчиннику (переважно в ДМФ, ТГФ, толуолі, ацетонітрилі) без виділення кристалічної 5-[2-циклопропіл-1-(2-фторфеніл)-2-оксоетил]5,6,7,7a-тетрагідро-4H-тієно[3,2-з]піридін-2-она формули (IV). Потім 1-2 еквівалента, переважно 1-1,5 еквівалента аміну і 1-3 еквівалента, переважно 1-2 еквівалента ангідриду оцтової кислоти додають до реакційної суміші, і її додатково перемішують при 20-50 °C, переважно 20-30 °C, протягом 1-3 годин, переважно 1-2 годин. Реакційна суміш потім розділяється між водою і етилацетатом, і органічну фазу сушать і упарюють. Залишковий продукт перекрісталізовують з відповідного органічного розчинника (ацетонітрилу, диізопропілового ефіру, етанолу), з суміші органічного розчинника і води, або з суміші відповідних органічних розчинників (толуолетилацетат, гексан-етилацетат). Спосіб за даним винаходом дозволяє одержати прасугрель формули (I) з виходом 38,2 %, розрахованим за вихідною сполукою формули (VII), і 46 %, розрахованим за проміжною сполукою формули (II). Ці результати демонструють, що спосіб згідно даного винаходу є більш продуктивним у порівнянні з відомими способами. Спосіб за даним винаходом простий при застосуванні в промисловому масштабі і не вимагає спеціальних або екстремальних умов реакції і апаратів. У способі згідно даного винаходу відсутня необхідність в застосуванні низьких 11 UA 110608 C2 5 10 15 20 25 30 35 40 45 50 55 температур (-78 °C), у використанні несприятливих для навколишнього середовища, отруйних, висококорозійних сполук, або можна уникнути великої кількості розчинників або будь-яких способів, складних для масштабування (таких як колонкової хроматографії). Винахід додатково розкривається за допомогою наступних Прикладів, не обмежуюваючих обсяг захисту винаходу. Приклади Приклад 1 Одержання кристалічної Форми I 5-тритію-4,5,6,7-тетрагідро-тієно [3,2-c] піридіну формули (VI) 3 3 Спосіб A: 530 см ацетонітрилу і 108,0 см (81,8 г; 0,63 моль) N, N-діізопропіл-етиламін додають до 52,7 г (0,30 моль) 4,5,6,7-тетрагідро -тієно[3,2-c]піридіну гідрохлориду (VII). При перемішуванні 87,0 г (0,312 моль) тритію-хлориду додають до суспензії. Суміш перемішують протягом 3 годин і осаджені кристали фільтрують. Одержану таким чином проміжну сполуку використовують на додаткових стадіях синтезу без будь-якої додаткової очистки. Вихід: 108,0 г (94 %) безбарвний кристалічний продукт. Температура плавлення (Тпл): 169-170 °C, Форма I, що характеризується порошковою рентгенівською дифрактограмою, представленою на Фіг. 1. -1 IR (інфрачервоний спектр) (KBr, см ): 3425, 3055, 2828,1595, 1487,1447, 710. 1 H-NMR (DMSO-d6, 500 МГц): 7,46 (6H, m); 7,31 (6H, m); 7,21 1H, d, J=5,0 Гц); 7,18 (3H, m); 6,72 (1H, d, J=5,0 Гц); 3,28 (2H, s), 2,94 (2H, m); 2,45 (2H, m). 13 C-NMR (DMSO-d6, 125 МГц): 142,3; 134,6; 132,9; 128,9; 127,8; 126,3; 125,8; 123,0; 76,8; 47,5; 46,7; 25,9. Елементний аналіз [розрахунок на підставі формули C26H23NS (M: 381,54)] Обчислено: C 81,85; H 6,08; N 3,67; S 8,40. Виміряно: C 81,64; H 6,19; N 3,65; S 8,31. 3 3 Спосіб Б: 530 см ДМФ і 108,0 см (81,8 г; 0,63 моль) N, N-диізопропіл-етиламін додають до 52,7 г (0,30 моль) 4,5,6,7-тетрагідро -тієно [3,2-c] піридіну гідрохлориду (VII). При перемішуванні 87,0 г (0,312 моль) тритію-хлориду додають до суспензії Суміш перемішують протягом 4 годин, і осаджені кристали фільтрують з ДМФ і промивають водою. Одержану таким чином проміжну сполуку використовують на додаткових стадіях синтезу без будь-якої додаткової очистки. Вихід: 96,5 г (84 %) безбарвний кристалічний продукт Тпл: 167-170 °C, Форма I, що характеризується порошковою рентгенівською дифрактограмою, представленою на Фіг. 1. Приклад 2 Одержання кристалічної Форми II 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну формули (VI) 3 23 см (0,083 моль) тріетіл-аміну по краплях при кімнатній температурі додають до розчину 3 23 см дихлорметану і 11,5 г (0,083 моль) 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну і 23 г (0,083 моль) тритію-хлориду додатково додають до суміші. Реакційну суміш підтримують при кімнатній температурі протягом однієї ночі і виливають у 2000 мл води. Органічну фазу відокремлюють, сушать над сульфатом натрію і упарюють. Безбарвні пастоподібні кристали сушать у вакуумі протягом 5 годин при 80 °C під тиском 140 мбар (14000 Па). Вихід: 28,5 г (91 %) безбарвного кристалічного продукту. Тпл: 147-152 °C, Форма II, що характеризується порошковою рентгенівською дифрактограмою, представленою на Фіг. 3. Приклад 3 Одержання 5-тритію-5,6,7,7a-тетрагідро-4H-тієно[3,2-c]піридін-2-она формули (V) 3 750 см тетрагідрофурану додають до 95,3 г (0,25 моль) 5-тритію-4, 5,6,7 - тетрагідро3 тієно[3,2-c]піридіну (VI). Розчин охолоджують до -40 °C, і 150 см (0,375 моль) 2,5 M розчину гексан-бутил-літію додають по краплях при цій температурі в атмосфері аргону. Розчин потім нагрівають до +10 °C і перемішують протягом 30 хвилин при цій температурі. Розчин потім 3 охолоджують до -40 °C, і по краплях додають розчин 86,2 см (0,375 моль) триізопропіл-бората і 3 200 см ТГФ. Розчин потім знову нагрівають до +10 °C і перемішують протягом 1 годин при цій 3 температурі. Розчин потім знову охолоджують до -40 °C і 53,75 см 35 мас. % Розчину перекису водню повільно додають по краплях. Температуру розчину залишають повільно збільшуватися до кімнатної, і розчин перемішують протягом 1 годин при цій температурі. 3 300 см води додають до розчину при перемішуванні і охолодженні. Фази розділяють, і органічну фазу сушать над MgSO4 і упарюють у вакуумі. Залишковий твердий продукт змішують з гептаном. Осаджені кристали фільтрують і промивають гексаном. Одержаний таким чином 12 UA 110608 C2 5 10 15 20 25 30 35 40 45 50 55 60 продукт може бути використаний на додаткових стадіях синтезу без будь-якої додаткової очистки. Вихід: 91,4 г (92 %) безбарвного кристалічного продукту. Тпл: 194-200 °C -1 1 IR (KBr, см ): 3442, 3054,2823,1681, 1488, 1447, 1096. H-NMR (DMSO-d4, 500 МГц): 7,46 (6H, m); 7,30 (6H, m); 7,19 (3H, m); 6,07 (1H, s); 4,13 (1H, dd, J=12,1; 2,8 Гц); 3,98 (1H, dd, J=12,1; 6,3 Гц);), 3,34 (1H, dd, J=12,2; 3,2 Гц); 2,40 (1H, m); 2,18 (1H, d, J=12,1 Гц); 2,10 (1H, dd, J=12,2; 3,8 Гц); 1,68 (1H, dt, J=12,1; 1,8 Гц). 13 C-NMR (DMSO-d6, 125 МГц): 199,1; 169,8; 129,0; 127,8; 126,5; 125,7; 77,5; 51,6; 50,7; 47,6; 35,2. Елементний аналіз [розрахунок на підставі формули C26H23NOS (M: 397,54)] Обчислено: C 78,55; H 5,83; N 3,52; S 8,07. Виміряно: C 78,15; H 5,50; N 3,31; S 7,70. Приклад 4 Одержання 5,6,7,7 a-тетрагідро-4H-тієно[3,2-c]-піридін-2-она толуол-4-сульфоната формули II (HA являє собою п-ТСК) 3 Спосіб A: 1300 см тетрагідрофурану додають до 86,7 г (0,218 моль) 5 - тритію-5,6,7,7aтетрагідро-4H-тієно[3,2-c]піридін-2-она (V) і при інтенсивному перемішуванні додатково додають 41,5 г (0,218 моль) толуол-4-сульфонати-моногідрату. Реакційну суміш перемішують протягом 2 годин при кімнатній температурі. Реакційну суміш охолоджують в бані лід-вода до 0-5 °C, перемішують протягом 3-4 годин, фільтрують і промивають тетрагідрофураном. Одержаний таким чином продукт може бути використаний на додаткових стадіях синтезу без будь-якої додаткової очистки. Вихід: 68,2 г (96 %) безбарвного кристалічного продукту. Т пл: 198-200 °C -1 IR (KBr, см ): 3441, 3015, 2827, 1697, 1591, 1446, 1203, 1164, 1123, 1032, 1008. 1 H-NMR (DMSO-d6, 500 МГц): 9,30 (1H, bs); 8,98 (1H, bs); 7,53 (2H, d, J=8,1 Гц); 7,14 (2H, d, J=8,1 Гц); 6,45 (1H, t, J=1,5 Гц); 4,74 (1H, dd, J=12,1; 5,3 Гц); 4,40 (1H, d, J=13,9 Гц); 4,01 (1H, d, J=13,7 Гц); 3,46 (1H, d, J=11,5 Гц);), 3,28 (1H, t, J=13,0 Гц); 2,59 (1H, m); 2,39 (3H, s); 1,88 (1H, m). 13 C-NMR (DMSO-d4 125 МГц): 197,4; 163,9; 144,9; 138,5; 129,3; 128,5; 125,6; 47,7; 44,0; 42,6; 30,8,21,0. Елементний аналіз [розрахунок на підставі формули C14H17NO4S2 (M: 327,42)] Обчислено: C 51,36; H 5,23; N 4,28; S 19,59. Виміряно: C 51,17; H 5,25; N 4,13; S 19,63. 3 Спосі б Б: 750 см тетрагідрофурану додають до 95,3 г (0,25 моль) 5-тритію-4,5,6,73 тетрагідро-тієно[3,2-c]піридіну (VI). Розчин охолоджують до -40 °C і 150 см (0,375 моль) 2,5 M розчину гексан-бутил-літію додають по краплях при цій температурі в атмосфері аргону. Розчин потім нагрівають до +10 °C і перемішують протягом 30 хвилин при цій температурі. Розчин потім 3 охолоджують до -40 °C і по краплях додають 86,2 см (0,375 моль) розчину триізопропіл-борату і 3 200 см ТГФ. Розчин потім знову нагрівають до +10 °C і перемішують протягом 1 години при цій 3 температурі. Розчин потім знову охолоджують до -40 °C і 53,75 см 35 мас. % розчину перекису водню повільно додають по краплях. Температурі розчину дають можливість повільно збільшуватися до кімнатної, і розчин перемішують протягом 1 годин при цій температурі. 3 300 см води додають до розчину при перемішуванні і охолодженні. Фази розділяють, і органічний шар сушать над MgSO4, і 47,5 г (0,25 моль) толуол-4-сульфонати-моногідрату додають при інтенсивному перемішуванні. Реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Реакційну суміш охолоджують в лазні лід-вода до 0-5 °C, перемішують протягом 3-4 годин, фільтрують і промивають тетрагідрофураном. Одержаний таким чином продукт може бути використаний на додаткових стадіях синтезу без будь-якої додаткової очистки. Вихід: 73,8 г (90 %) безбарвний кристалічний продукт. Тпл: 198-200 °C Приклад 5 Одержання 2-ацетокси-5-(2-фтор-α-циклопропіл-карбоніл-бензил) - 4,5,6,7-тетрагідро-4Hтієно[3,2-c]піридіну (прасугрель, I) 3 1я стадія: 150 см ДМФ додають до 65,5 г (0,2 моль) 5,6,7,7 a-тетрагідро-4H-тієно [3,2-c]3 піридін-2-она пара-толуолсульфонату (II, HA являє собою п-ТСК). 75,3 см (56,9 г; 0,44 моль) N, N-диізопропіл-етил-аміну (ДІПЕА) додають в розчин, і 55,4 г 2-бром-1-циклопропіл-2-(23 фторфеніл) -етанона (III) (з вмістом основної речовини 92,8 %), розчиненого в 94 см (88,7 г) диметил-формамід додають по краплях протягом приблизно 30 хвилин при охолодженні в суміші лід-вода. Суміш перемішують протягом 1 годин при кімнатній температурі. Реакційну суміш виливають в суміш льоду з водою і етилацетатом. Фази розділяють, і водну фазу 13 UA 110608 C2 5 10 15 20 25 30 35 екстрагують етилацетатом. Об'єднані органічні фази сушать над MgSO 4. Розчинник видаляють у вакуумі. 3 2га стадія: 28,4 см (30,6 г; 0,30 моль) оцтового ангідриду додають по краплях до суміші 70 3 мл ДМФ і 37,65 см (28,43 г; 0,22 моль) ДІПЕА при 15-20 °C при інтенсивному перемішуванні. Розчин залишкового продукту стадії 1 і 120 мл ДМФ додають по краплях до реакційної суміші при інтенсивному перемішуванні при 20-25 °C. Суміш перемішують протягом 1 години при кімнатній температурі. Реакційну суміш виливають в суміш льоду з водою і етилацетатом. Фази розділяють, і водну фазу екстрагують етилацетатом. Об'єднані органічні фази сушать над MgSO4. Розчинник видаляють у вакуумі, і етанол додають до залишкового продукту. Після охолодження до 0-5 °C осаджені кристали фільтрують, промивають етанолом. Вихід становить 38,1 г (51 %) неочищеного прасугреля. Неочищений продукт перекристалізовують з ацетонітрилу. Вихід: 34,4 г (46,0 %) безбарвного кристалічного продукту. Вихід для всього способу синтезу, розрахований по 4,5,6,7-тетрагідро-тієно[3,2-c]піридіну гідрохлориду формули (VII), становить 38,2 %. Тпл: 120-121 °C -1 IR (KBr, см ): 3388, 2920, 2767, 1758, 1704, 1586, 1488, 1369, 1217, 1194, 1127,1011. 1 H-NMR (CDCl3, 500 МГц): 7,47 (1H, td, J=7,5; 1,8 Гц); 7,30 (1H, m); 7,16 (1H, td, J=7,5; 1,1 Гц); 7,10 (1H, td, .7=8,2; 1,1 Гц); 6,26 (1H, s); 4,82 (1H, s); 3,56 (1H, d, 7=14,3 Гц); 3,48 (1H, d, J=14,3 Гц); 2,90 (1H, m); 2,78 (3H, m); 2,28 (1H, m); 2,23 (3H, s); 1,05 (1H, m); 1,00 (1H, m); 0,84 (2H, m). 13 C-NMR (CDCL3, 125 МГц): 207,4; 167,5; 161,1; 149,4; 130,4; 129,7; 129,3; 125,6; 124,2; 122,0; 115,6; 112,8; 71,5; 50,3; 48,3, 24,9; 20,4; 18,1, 11,8, 11,3. Елементний аналіз [розрахунок на підставі формули of C20H20FNO3S (M: 373,45)] Обчислено: C 64,33; H 5,40; N 3,75; S 8,59. Виміряно: C 64,18; H 5,50; N 3,69; S 8,75. Референсний приклад 1 Одержання 5-тритію-4,5,6,7-тетрагідро-тієно[3,2-c]піридіну (VI) відповідно до прикладу 1 US 4740510. 3 20 см (0,079 моль) триетиламіну додають по краплях до розчину 10 г (0,072 моль) 4,5,6,73 тетрагідро-тієно[3,2-c]піридіну в 20 см дихлорметану при кімнатній температурі, і додають 20,02 г (0,072 моль) трифену-метил-хлориду. Реакційну суміш підтримують при кімнатній температурі 3 протягом ночі і виливають в 200 см води. Фази поділяють; органічну фазу сушать над сульфатом натрію і упарюють досуха. Залишковий продукт очищають шляхом хроматографії на силікагелі з використанням дихлорметану як елюенту. Вихід: 28,9 г (96 %) аморфної речовини. Рентгенівська дифрактограма представлена на Фіг. 2. Тпл: 92-97 °C, безбарвне, пастоподібне. 1 H-NMR (CDCl3) 7-57-6,90 (15H, m); 6,80 (1H, d, J=6,5 Гц); 6,43 (1H, d, J=6,5 Гц); 3,35 (2H, s); 3,00-2,33 (4H, m). ФОРМУЛА ВИНАХОДУ 40 1. Спосіб одержання 2-ацетокси-5-(2-фтор--циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4Нтієно[3,2-с]піридину (прасугрелю) формули (І) F N O O S O I шляхом перетворення 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI) N 45 S CPh3 VI 14 UA 110608 C2 в тритил-4,5,6,7-тетрагідротієно[3,2-с]піридин-2-он формули (V) N O CPh3 S ,V перетворення одержаної сполуки на 5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридин-2-ону паратолуолсульфонат формули (II) NH.HA O 5 S , ІІ в якій НА є п-ТСК (пара-толуолсульфонова кислота), шляхом реакції сполуки формули (V) з пара-толуолсульфоновою кислотою; подальше перетворення одержаної таким чином сполуки у сполуку формули (ІV) F N O O S 10 ІV шляхом реакції зі сполукою формули (ІІІ) F Br O 15 ІІІ в органічному розчиннику в присутності основи; і перетворення одержаної сполуки в прасугрель формули (І) шляхом реакції з оцтовим ангідридом в органічному розчиннику, причому вихідна сполука є 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридином формули (VI) в кристалічній формі І. 2. Спосіб за п. 1, який відрізняється тим, що вихідну сполуку 5-тритил-4,5,6,7тетрагідротієно[3,2-с]піридин формули (VI) в кристалічній формі І перетворюють на 5,6,7,7атетрагідро-4Н-тієно[3,2-с]піридін-2-ону пара-толуолсульфонат формули (II) без виділення 5тритил-5,6,7,7а-тетрагідро-4Н-тієно[3,2-с]піридін-2-ону формули (V) N O 20 25 CPh3 S V. 3. Кристалічна форма І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI), яка демонструє порошкову рентгенівську дифрактограму, що має характеристичні піки при куті відображення 2θ (±0,2° 2θ) приблизно 10,236; 11,938; 17,929; 19,527; 24,427. 4. Кристалічна форма І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридіну формули (VI) за п. 3, яка демонструє порошкову рентгенівську дифрактограму у відповідності з наступною таблицею (відносна інтенсивність більше 5 %): 15 UA 110608 C2 Пік № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 5 Кут 2-тета (°) 5,790 5,986 10,236 10,594 11,553 11,938 12,718 13,336 13,543 14,308 14,685 15,357 15,555 16,139 17,929 18,259 18,598 19,052 19,527 20,032 d-значення Ангстрем 15,25071 14,75396 8,63495 8,34411 7,65334 7,40748 6,95478 6,63384 6,53296 6,18523 6,02737 5,76519 5,69199 5,48733 4,94340 4,85488 4,76707 4,65440 4,54244 4,42890 Інтенсивність % 39,1 16,2 62,5 39 40,5 48,7 15,7 30,2 20,6 6,1 18,5 10,8 14,5 7,1 100 16 7 13 79,8 16,9 Пік № 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Кут 2-тета (°) 20,254 20,536 20,853 21,525 21,907 22,343 22,894 23,240 23,593 23,903 24,427 25,575 27,268 27,590 27,791 28,809 29,107 30,996 33,051 d-значення Ангстрем 4,38092 4,32133 4,25637 4,12511 4,05403 3,97587 3,88134 3,82430 3,76788 3,71978 3,64109 3,48021 3,26790 3,23049 3,20752 3,09645 3,06544 2,88284 2,70808 Інтенсивність % 18,9 30,4 21,8 29,1 9,1 22,8 6,4 11,9 23,7 21,7 58,6 6,2 9,1 6,6 5,9 10,8 7,1 5,9 4,7 5. Спосіб одержання кристалічної форми І 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину формули (VI) за будь-яким з пп. 3-4, який відрізняється тим, що 4,5,6,7-тетрагідротієно[3,2с]піридину гідрохлорид приводять у взаємодію з тритилхлоридом без виділення відповідної основи формули (VIIа) NH S 10 15 VIIа в присутності основи із застосуванням органічного розчинника, з якого кристалічний продукт осаджують без осадження солі основи і який застосовують як речовину, що зв'язує кислоти. 6. Спосіб за п. 5, який відрізняється тим, що органічну основу застосовують як речовину, що зв'язує кислоти. 7. Спосіб за п. 6, який відрізняється тим, що органічною основою є третинний амін, переважно N,N-діізопропілетиламін, триетиламін, азотовмісна гетероциклічна сполука, переважно піридин. 8. Спосіб за п. 5, який відрізняється тим, що органічним розчинником є ароматичний вуглеводень, переважно толуол; розчинник ефірного типу, переважно тетрагідрофуран, діоксан або метилтретбутиловий ефір; розчинник типу кислотного аміду, переважно N,Nдиметилформамід, N,N-диметилацетамід або N-метилпіролідон; розчинник нітрильного типу, переважно ацетонітрил; або розчинник кетонового типу, переважно метилетилкетон. 16 UA 110608 C2 17 UA 110608 C2 18 UA 110608 C2 19 UA 110608 C2 20 UA 110608 C2 21 UA 110608 C2 22 UA 110608 C2 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing pharmaceutical compounds and intermediate compounds
Автори англійськоюPorcs-Makkay, Marta, Volk, Balazs, Gregor, Tamas, Barkoczy, Jozsef, Mezei, Tibor, Broda, Judit, Nyulasi, Balint, Ruzsics, Gyorgy, Molnar, Eniko, Debreczeni, Jozsef, Nagy, Kalman, Pandur, Angela, Szent-Kirallyi, Zsuzsanna
Автори російськоюПорч-Маккаи Марта, Волк Балаж, Грегор Тамаш, Баркоци Йожеф, Мезеи Тибор, Брода Юдит, Ньюлаши Балинт, Ружич Дьйордь, Мольнар Енькьйо, Дебрецени Йожеф, Надь Кальман, Пандур Ангела, Сент-Киралли Жужанна
МПК / Мітки
МПК: C07D 495/04
Мітки: сполука, одержання, форма, проміжна, кристалічна, спосіб, 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с]піридину, 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину
Код посилання
<a href="https://ua.patents.su/25-110608-sposib-oderzhannya-2-acetoksi-5-2-ftor-alfa-ciklopropilkarbonilbenzil-4567-tetragidro-4n-tiehno32-spiridinu-kristalichna-forma-i-5-tritil-4567-tetragidrotiehno32-spiridinu-yak-prom.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2-ацетокси-5-(2-фтор-альфа-циклопропілкарбонілбензил)-4,5,6,7-тетрагідро-4н-тієно[3,2-с]піридину, кристалічна форма і 5-тритил-4,5,6,7-тетрагідротієно[3,2-с]піридину як проміжна сполука</a>
Попередній патент: Спосіб переробляння матеріалу, що містить лігноцелюлозу
Наступний патент: Сполуки для інгібування ферменту протеасоми
Випадковий патент: Спосіб сепарування сипучої суміші у текучому середовищі












