Спосіб інсерції бажаної днк на цільовому сайті в геномі клітини ссавця in vitro, векторна система та її застосування для здійснення вказаного способу
Номер патенту: 72436
Опубліковано: 15.03.2005
Автори: Барнетт Річард Спенс, МакЛеклен Карен Ретта, Рефф Мітчелл Е.
Формула / Реферат
1. Спосіб інсерції бажаної ДНК на цільовому сайті в геномі клітини ссавця in vitro, який включає наступні стадії:
(і) трансфекцію або трансформацію клітини ссавця in vitro маркерною плазмідою, що містить наступні послідовності:
(a) перший фрагмент ДНК, що включає область, яка є гетерологічною до геному клітини ссавця і забезпечує унікальний сайт для гомологічної рекомбінації, коли він інтегрований у геном клітини ссавця;
(b) другий фрагмент ДНК, що включає принаймні один екзон гена, який кодує перший селектабельний маркерний білок; та
(c) третій фрагмент ДНК, що включає область, яка кодує другий селектабельний маркерний білок, що відрізняється від першого селектабельного маркерного білка, і забезпечує селекцію клітини ссавця, що включає вказану маркерну плазміду, інтегровану у її геном;
(іі) селекцію клітини, яка включає маркерну плазміду, інтегровану у її геном, шляхом скринінгу in vitro для експресії селектабельного маркерного білка, що кодується вказаним третім фрагментом ДНК;
(ііі) трансфекцію або трансформацію вказаної вибраної клітини цільовою плазмідою, що містить принаймні одну ДНК, яку необхідно інсерціювати в геном зазначеної клітини, і додатково містить наступні послідовності:
(a) четвертий фрагмент ДНК, що включає область, яка є ідентичною або достатньо гомологічною до унікального сайту для гомологічної рекомбінації у маркерній плазміді, таким чином, щоб ця область ДНК могла рекомбінувати зі вказаною маркерною плазмідою ДНК шляхом гомологічної рекомбінації; та
(b) п'ятий фрагмент ДНК, що включає залишковий екзон або екзони гена, який кодує перший селектабельний маркерний білок, які не присутні у маркерній плазміді;
причому активний перший селектабельний маркерний білок продукується тільки у тому випадку, якщо принаймні один екзон гена, що кодує перший селектабельний маркерний білок, який міститься у цільовій плазміді, експресується разом із залишковим екзоном або екзонами гена, який кодує перший селектабельний маркерний білок, що міститься у маркерній плазміді; та
(iv) селекцію клітин, які включають цільову плазміду, інтегровану на унікальному сайті для гомологічної рекомбінації шляхом скринінгу in vitro для експресії першого селектабельного маркерного білка.
2. Спосіб за п. 1, який відрізняється тим, що принаймні одна ДНК, яку необхідно інсерціювати в геном зазначеної клітини, кодує бажаний білок.
3. Спосіб за п. 2, який відрізняється тим, що бажаний білок являє собою білок ссавця.
4. Спосіб за п. 3, який відрізняється тим, що білок ссавця являє собою імуноглобулін.
5. Спосіб за п. 1, який відрізняється тим, що принаймні одну ДНК, яку необхідно інсерціювати в геном зазначеної клітини, інсертують суміжною з екзоном зазначеного першого селектабельного маркера, що міститься у цільовій плазміді.
6. Спосіб за п. 1, який відрізняється тим, що перший селектабельний маркерний білок вибраний із групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
7. Спосіб за п. 6, який відрізняється тим, що принаймні один екзон гена, який кодує перший селектабельний маркерний білок у маркерній плазміді, містить частину гена неоміцинфосфотрансферази, а залишкові екзони у цільовій плазміді містять залишкові частини зазначеного гена неоміцинфосфотрансферази.
8. Спосіб за п. 1, який відрізняється тим, що додатково включає визначення рівнів РНК другого селектабельного маркера, що міститься у зазначеному третьому фрагменті ДНК маркерної плазміди перед інтеграцією цільового вектора.
9. Спосіб за п. 1, який відрізняється тим, що другий селектабельний маркерний білок, що відрізняється від першого селектабельного маркерного білка, вибраний з групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
10. Спосіб за п. 1, який відрізняється тим, що маркерна або цільова плазміда додатково включає ДНК, що кодує третій селектабельний маркерний білок, що відрізняється від першого і другого селектабельних маркерних білків.
11. Спосіб за п. 10, який відрізняється тим, що експресія ДНК, що кодує третій селектабельний маркерний білок, дозволяє ампліфікацію зазначеної ДНК, яку необхідно інсерціювати у геном зазначеної клітини.
12. Спосіб за п. 11, який відрізняється тим, що третій селектабельний маркерний білок являє собою дигідрофолатредуктазу.
13. Спосіб за п. 1, який відрізняється тим, що клітина ссавця вибрана з групи, яка включає клітини яєчника китайського хом'ячка (СНО), клітини мієломи, клітини нирок молодих хом'ячків, клітини COS, клітини NSO, клітини HeLa та клітини NIH 3ТЗ.
14. Спосіб за п. 13, який відрізняється тим, що клітина являє собою клітину СНО.
15. Спосіб за п. 1, який відрізняється тим, що маркерна плазміда додатково включає рідкісну рестрикційну ендонуклеазну послідовність, інсерційовану в межах області ДНК у першому фрагменті ДНК маркерної плазміди, що забезпечує унікальний сайт для гомологічної рекомбінації.
16. Спосіб за п. 1, який відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, містить принаймні 300 нуклеотидів.
17. Спосіб за п. 16, який відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 300 нуклеотидів до 20 т.п.н.
18. Спосіб за п. 17, який відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 2 до 10 т.п.н.
19. Спосіб за п. 1, який відрізняється тим, що ДНК, яка кодує перший селектабельний маркерний білок, розщеплюється принаймні на три екзони.
20. Спосіб за п. 1, який відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, являє собою ДНК бактерії, ДНК комахи, ДНК вірусу або синтетичну ДНК.
21. Спосіб за п. 20, який відрізняється тим, що у області ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, відсутні будь-які функціональні гени.
22. Спосіб за п. 1, який відрізняється тим, що маркерна плазміда включає нуклеотидну послідовність плазміди "Desmond", показаної на фіг. 7.
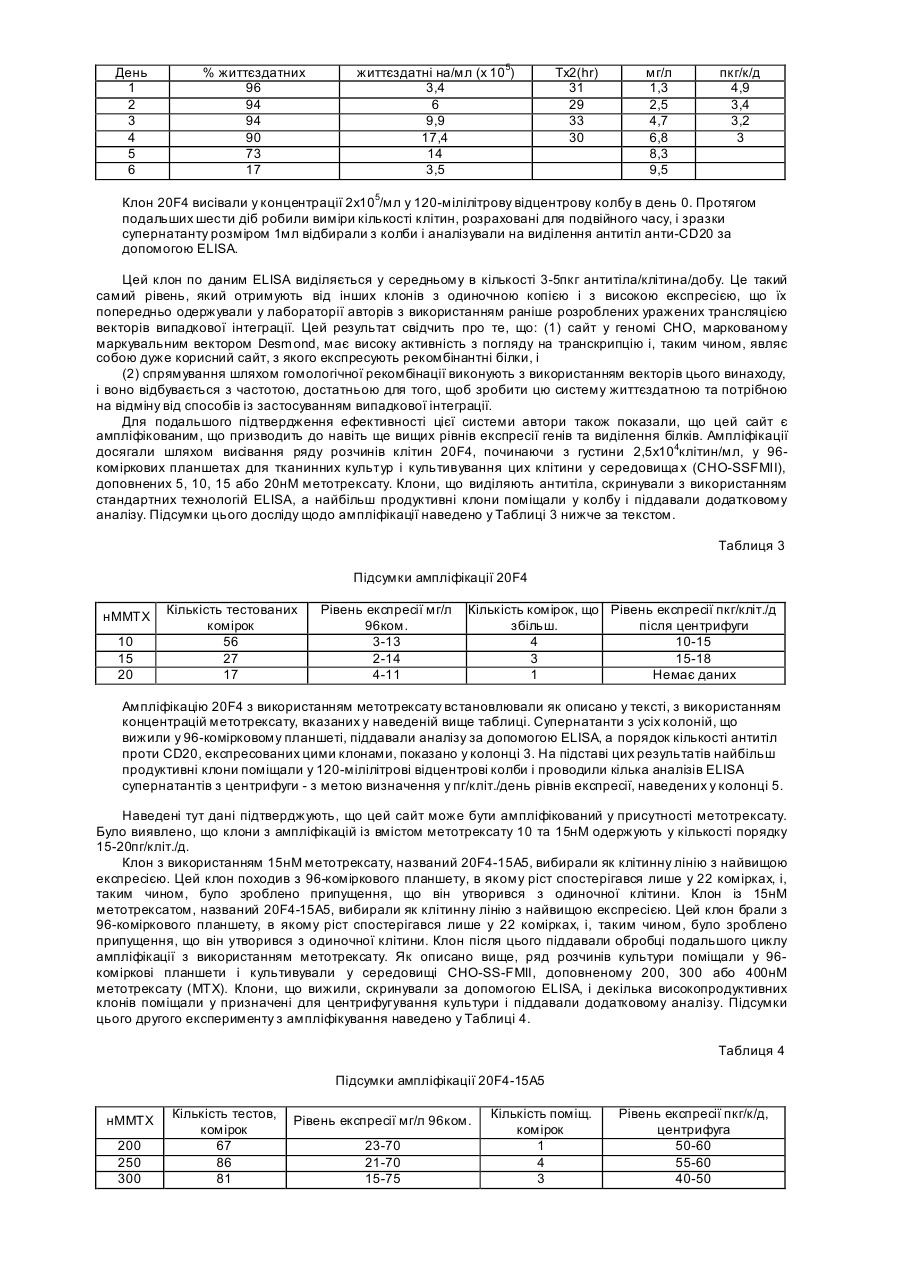
23. Спосіб за п. 1, який відрізняється тим, що цільова плазміда включає нуклеотидну послідовність плазміди "Molly", показаної на фіг. 8, причому цільова плазміда необов'язково не має нуклеотидних послідовностей, що кодують поліпептиди анти-СD20 антитіла.
24. Спосіб за п. 1, який відрізняється тим, що цільова плазміда включає нуклеотидну послідовність плазміди "Mandy", показаної на фіг. 10, причому цільова плазміда необов'язково не має нуклеотидних послідовностей, що кодують поліпептиди анти-СD23 антитіла.
25. Векторна система для інсерції бажаної ДНК на цільовому сайті в геномі клітини ссавця in vitro, яка включає принаймні:
(і) маркерну плазміду, що містить наступні послідовності:
(a) перший фрагмент ДНК, що включає область ДНК, яка є гетерологічною до геному клітини ссавця і забезпечує унікальний сайт для гомологічної рекомбінації, коли він інтегрований у геном клітини ссавця;
(b) другий фрагмент ДНК, що включає принаймні один екзон гена, який кодує перший селектабельний маркерний білок; та
(c) третій фрагмент ДНК, що включає область, яка кодує другий селектабельний маркерний білок, що відрізняється від першого селектабельного маркерного білка, і забезпечує селекцію клітини ссавця in vitro, що включає вказану маркерну плазміду, інтегровану у її геном; та
(іі) цільову плазміду, що містить принаймні одну ДНК, яку необхідно інсерціювати в геном зазначеної клітини, і додатково містить наступні послідовності:
(а) четвертий фрагмент ДНК, що включає область, яка є ідентичною або достатньо гомологічною до унікального сайту для гомологічної рекомбінації у маркерній плазміді, таким чином, щоб ця область ДНК могла рекомбінувати з вказаною маркерною плазмідою ДНК шляхом гомологічної рекомбінації;
(b) п'ятий фрагмент ДНК, що включає залишковий екзон або екзони гена, який кодує перший селектабельний маркерний білок, які не присутні у маркерній плазміді; причому принаймні один екзон гена, що кодує перший селектабельний маркерний білок у маркерній плазміді, та залишковий екзон або екзони гена, що кодує перший селектабельний маркерний білок у цільовій плазміді, разом кодують активний перший селектабельний маркерний білок.
26. Векторна система за п. 25, яка відрізняється тим, що принаймні одна ДНК, яку необхідно інсерціювати в геном зазначеної клітини, кодує бажаний білок.
27. Векторна система за п. 26, яка відрізняється тим, що бажаний білок являє собою білок ссавця.
28. Векторна система за п. 27, яка відрізняється тим, що білок ссавця являє собою імуноглобулін.
29. Векторна система за п. 25, яка відрізняється тим, що принаймні одна ДНК, яку необхідно інсерціювати в геном зазначеної клітини, інсерційована суміжною з екзоном зазначеного першого селектабельного маркера, що міститься у цільовій плазміді.
30. Векторна система за п. 25, яка відрізняється тим, що перший селектабельний маркерний білок вибраний із групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
31. Векторна система за п. 30, яка відрізняється тим, що принаймні один екзон гена, який кодує перший селектабельний маркерний білок у маркерній плазміді, містить частину гена неоміцинфосфотрансферази, а залишкові екзони у цільовій плазміді містять залишкові частини зазначеного гена неоміцинфосфотрансферази.
32. Векторна система за п. 25, яка відрізняється тим, що другий селектабельний маркерний білок, який відрізняється від першого селектабельного маркерного білка, вибраний з групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
33. Векторна система за п. 25, яка відрізняється тим, що маркерна або цільова плазміда додатково включає ДНК, що кодує третій домінантний селектабельний маркерний білок, що відрізняється від першого і другого селектабельних маркерних білків.
34. Векторна система за п. 33, яка відрізняється тим, що експресія ДНК, що кодує третій селектабельний маркерний білок, дозволяє ампліфікацію зазначеної ДНК, яку необхідно інсерціювати у геном зазначеної клітини.
35. Векторна система за п. 34, яка відрізняється тим, що третій селектабельний маркерний білок являє собою дигідрофолатредуктазу.
36. Векторна система за п. 25, яка відрізняється тим, що забезпечує інсерцію бажаної ДНК на цільовому сайті в геномі клітини ссавця, вибраної з групи, яка включає клітини яєчника китайського хом'ячка (СНО), клітини мієломи, клітини нирок молодих хом'ячків, клітини COS, клітини NSO, клітини HeLa та клітини NIH ЗТЗ.
37. Векторна система за п. 36, яка відрізняється тим, що клітина ссавця являє собою клітину СНО.
38. Векторна система за п. 25, яка відрізняється тим, що маркерна плазміда додатково включає рідкісну рестрикційну ендонуклеазну послідовність, інсерційовану в межах області ДНК у першому фрагменті ДНК маркерної плазміди, що забезпечує унікальний сайт для гомологічної рекомбінації.
39. Векторна система за п. 25, яка відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, містить принаймні 300 нуклеотидів.
40. Векторна система за п. 39, яка відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 300 нуклеотидів до 20 т.п.н.
41. Векторна система за п. 40, яка відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 2 до 10 т.п.н.
42. Векторна система за п. 25, яка відрізняється тим, що ДНК, яка кодує перший селектабельний маркерний білок, розщеплюється принаймні на три екзони.
43. Векторна система за п. 25, яка відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, являє собою ДНК бактерії, ДНК комахи, ДНК вірусу або синтетичну ДНК.
44. Векторна система за п. 43, яка відрізняється тим, що у області ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, відсутні будь-які функціональні гени.
45. Векторна система за п. 25, яка відрізняється тим, що маркерна плазміда включає нуклеотидну послідовність плазміди "Desmond", показаної на фіг. 7.
46. Векторна система за п. 25, яка відрізняється тим, що цільова плазміда включає нуклеотидну послідовність плазміди "Molly", показаної на фіг. 8, причому цільова плазміда необов'язково не має нуклеотидних послідовностей, що кодують поліпептиди анти-СD20 антитіла.
47. Векторна система за п. 25, яка відрізняється тим, що цільова плазміда включає нуклеотидну послідовність плазміди "Mandy", показаної на фіг. 10, причому цільова плазміда необов'язково не має нуклеотидних послідовностей, що кодують поліпептиди анти-СD23 антитіла.
48. Застосування векторної системи за п. 25 для інсерції бажаної ДНК на цільовому сайті в геномі клітини ссавця in vitro.
49. Застосування векторної системи за п. 48, яке відрізняється тим, що принаймні одна ДНК, яку необхідно інсертувати в геном зазначеної клітини, кодує бажаний білок.
50. Застосування векторної системи за п. 49, яке відрізняється тим, що білок являє собою білок ссавця.
51. Застосування векторної системи за п. 50, яке відрізняється тим, що білок ссавця являє собою імуноглобулін.
52. Застосування векторної системи за п. 48, яке відрізняється тим, що принаймні одна ДНК, яку необхідно інсерціювати в геном зазначеної клітини, інсерційована суміжною з екзоном зазначеного першого селектабельного маркера, що міститься у цільовій плазміді.
53. Застосування векторної системи за п. 48, яке відрізняється тим, що перший селектабельний маркерний білок вибраний із групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
54. Застосування векторної системи за п. 53, яке відрізняється тим, що принаймні один екзон гена, який кодує перший селектабельний маркерний білок у маркерній плазміді, містить частину гену неоміцинфосфотрансферази, а залишкові екзони у цільовій плазміді містять залишкові частини зазначеного гену неоміцинфосфотрансферази.
55. Застосування векторної системи за п. 48, яке відрізняється тим, що другий селектабельний маркерний білок, який відрізняється від першого селектабельного маркерного білка, вибраний з групи, до якої входять неоміцинфосфотрансфераза, гістидинолдегідрогеназа, дигідрофолатредуктаза, гідроміцинфосфотрансфераза, тимідинкіназа вірусу герпес симплекс, аденозиндеаміназа, глутамінсинтетаза та гіпоксантингуанінфосфорибозилтрансфераза.
56. Застосування векторної системи за п. 48, яке відрізняється тим, що маркерна або цільова плазміда додатково включає ДНК, що кодує третій селектабельний маркерний білок, який відрізняється від першого і другого селектабельних маркерних білків.
57. Застосування векторної системи за п. 56, яке відрізняється тим, що експресія ДНК, що кодує третій селектабельний маркерний білок, дозволяє ампліфікацію зазначеної ДНК, яку необхідно інсерціювати у геном зазначеної клітини.
58. Застосування векторної системи за п. 57, яке відрізняється тим, що третій селектабельний маркерний білок являє собою дигідрофолатредуктазу.
59. Застосування векторної системи за п. 48, яке відрізняється тим, що забезпечує інсерцію бажаної ДНК на цільовому сайті в геномі клітини ссавця, вибраної з групи, яка включає клітини яєчника китайського хом'ячка (СНО), клітини мієломи, клітини нирок молодих хом'ячків, клітини COS, клітини NSO, клітини HeLa та клітини NIH 3ТЗ.
60. Застосування векторної системи за п. 59, яке відрізняється тим, що клітина являє собою клітину СНО.
61. Застосування векторної системи за п. 48, яке відрізняється тим, що маркерна плазміда додатково включає рідкісну рестрикційну ендонуклеазну послідовність, інсерційовану в межах області ДНК у першому фрагменті ДНК маркерної плазміди, що забезпечує унікальний сайт для гомологічної рекомбінації.
62. Застосування векторної системи за п. 48, яке відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, містить принаймні 300 нуклеотидів.
63. Застосування векторної системи за п. 62, яке відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 300 нуклеотидів до 20 т.п.н.
64. Застосування векторної системи за п. 63, яке відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, має розмір від приблизно 2 до 10 т.п.н.
65. Застосування векторної системи за п. 48, яке відрізняється тим, що ДНК, яка кодує перший селектабельний маркерний білок, розщеплюється принаймні на три екзони.
66. Застосування векторної системи за п. 48, яке відрізняється тим, що область ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, являє собою ДНК бактерії, ДНК комахи, ДНК вірусу або синтетичну ДНК.
67. Застосування векторної системи за п. 66, яке відрізняється тим, що у області ДНК у першому фрагменті ДНК, що забезпечує унікальний сайт для гомологічної рекомбінації, відсутні будь-які функціональні гени.
Текст
Цей винахід стосується способу спрямування інтеграції потрібної екзогенної ДНК у специфічне місцеположення у геномі клітини ссавця. Якщо більш конкретно, винахід стосується нового способу ідентифікування активного з погляду на транскрипцію цільового сайта ("гаряча точка") у геномі ссавця, а також вставлення потрібної ДНК у цей сайт шляхом гомологічної рекомбінації. Завдяки цьому винаходу можна також за бажанням одержати у цьому положенні таку властивість потрібної ДНК, як ампліфікація гена, за допомогою коінтегрування маркера, здатного бути селектованим та ампліфікованим, наприклад, DHFR, у комбінації з екзогенним ДНК. Винахід, крім того, стосується створення нових векторів, придатних для здійснення згаданого вище способу, а також стосується клітинних ліній ссавців, що їх одержують за допомогою таких способів і які містять потрібну екзогенну ДНК, інтегровану на цільовій гарячій точці. Технологія експресування рекомбінантних білків як у прокаріотних, так і в еукаріотних організмах є добре відомою. Вважають, що клітини ссавців мають значну перевагу над бактеріями чи дріжджами з погляду на продукування білків, завдяки їхній здатності збирати у правильну структур у, глікозилювати та модифікувати після трансляції експресовані шляхом рекомбінації білки. Після трансфекції у клітини-хазяї, конструкти рекомбінантної експресії можуть зберігатися у вигляді позахромосомних елементів, або можуть бути інтегрованими у геном клітини-хазяїна. Утворення стабільно трансфікованих клітинних ліній ссавців зазвичай включає останній процес; конструкт ДНК, що кодує потрібний ген разом із геном опірності до ліків (домінантний селектований маркер) вводять у клітину-хазяїн, а подальший ріст у присутності лікувального препарату відкриває можливість селекції клітин, які успішно інтегрували екзогенну ДНК. У багатьох випадках потрібний ген зв'язується з опірним до ліків маркером, що може бути селектованим, який пізніше піддають ампліфікацію гена. Найчастіше з цією метою використовують ген, що кодує дигідрофолат редуктазу (DHFR). Ріст клітин у присутності метотрексату, конкурентного інгібітора DHFR, призводить до утворення більшої кількості DHFR шляхом ампліфікації гена DHFR. Оскільки фланкувальні ділянки ДНК також стануть ампліфікованими, одержувана в результаті коампліфікація зв'язаного із DHFR гена у трансфікованій клітинній лінії призводить до збільшення кількості утворюваного білка, внаслідок чого створюється високий рівень експресії потрібного гена. Незважаючи на те, що такий підхід було визнано успішним, існує ціла низка проблем із системою через те, що явище ітерації є випадковим по суті. Ці проблеми існують через те, що на рівні експресії сильно впливають ефекти локального генетичного середовища на генному локусі, феномен, добре зафіксований у спеціальних публікаціях і який загалом називають "ефекти положення" [див., наприклад, Al-Shawi et al, Моl. Cell. Вiol., 10:1192-1198 (1990); Yoshimura et al, Моl. Cell. Biol, 7:1296-1299 (1987)]. Оскільки у переважної більшості ссавців ДНК бувають у неактивному стані з погляду на транскрипцію, способи із застосуванням випадкової інтеграції не контролюють розвиток транскрипції інтегрованої ДНК. Таким чином, можуть мати місце значні зміни рівнів експресії інтегрованих генів, залежно від сайту інтеграції. Наприклад, інтеграція екзогенної ДНК у неактивні, або з погляду на транскрипцію "мовчазні", ділянки геному призводить до незначної експресії або до її відсутності. Навпаки, інтеграція у активний з погляду на транскрипцію сайт призводить до високого рівня експресії. Таким чином, якщо ціль роботи полягає у тому, щоб досягти високого рівня експресії генів - а це зазвичай і є бажаним результатом способів генної інженерії - для того, щоб знайти такий високопродуктивний клон, необхідно піддати скринінгу велику кількість трансфектантів. Крім того, випадкова інтеграція екзогенних ДНК у геном у деяких випадках руйнує важливі клітинні гени, що призводить до зміни фенотипу. Ці фактори провокують утворення стабільних клітинних ліній ссавців з високою експресією, ускладнюючи здійснення способу та роблячи його більш трудомістким. Останнім часом у лабораторії авторів цього винаходу описано застосування векторів ДНК, що містять змінені трансляцією домінантні маркери, які можуть бути селектабельними, для експресії генів ссавців. [Це описано у патенті US 5,648,467]. Ці вектори містять змінений трансляцією ген неоміцин фосфотрансферази (нео) як домінантний селектабельний маркер, який штучно обробляють для того, щоб він містив інтрон, в який вставляють ген DHFR разом із потрібним геном або генами. Виявлено, що використання цих векторів як конструктів експресії значно зменшує сумарну кількість утворюваних опірних до ліків колоній, полегшуючи таким чином процедуру скринінгу в порівнянні зі стандартними векторами експресії у ссавців. Крім того, значний відсоток клонів, одержуваних із використанням цієї системи, представлений клонами з високою експресією. Ці результати очевидно притаманні змінам, яким піддали селектований маркер nео. Через трансляційне пошкодження гена nео трансфіковані клітини не продукуватимуть білок nео у кількості, достатній для того, щоб вижити після селекції за допомогою ліків, внаслідок чого зменшується сумарна кількість колоній, опірних до ліків. Крім того, більш високий відсоток клонів, що вижили, відзначатиметься тим, що ці клони міститимуть вектор експресії, інтегрований у сайти в геномі, де базові рівні транскрипції є високими, що призводить до надмірного продукування nео, що дозволяє, таким чином, клітинам "подолати" пошкодження гена nео. При цьому на потрібні гени, зв'язані з nео, впливатимуть такі самі високі рівні транскрипції. Така сама перевага має місце в результаті створення в nео синтетичного інтрона; виживання залежить від синтезу функціонального гена nео, який, у свою чергу, залежить від правильного та ефективного сплайсингу інтронів nео. Крім того, ці критерії можуть існувати з більшою імовірністю, якщо вектор ДНК інтегровано у ділянку, яка вже є активною з погляду на транскрипцію. Після інтеграції вектора у активну з погляду на транскрипцію ділянку ампліфікацію гена здійснюють шляхом селекції гена DHFR. З використанням цієї системи стало можливим одержувати клони, селектовані з застосуванням низьких концентрацій метотрексату (50нМ), що містять небагато (55пг/кліт./день). Крім того, цього можна досягти за відносно короткий період часу. Проте ампліфікація відзначається змінним успіхом. Деякі активні з погляду на транскрипцію сайти не можна ампліфікувати і, таким чином, частоту і міру ампліфікації щодо конкретного сайта передбачити неможливо. В цілому застосування цих уражених трансляцією векторів відзначається значною перевагою над іншими способами випадкової інтеграції. Однак, як було згадано, проблема недостатнього контролю на сайтом інтеграції залишається. Один з підходів до подолання проблем випадкової інтеграції полягає у цілеспрямованому впливі на гени, суть якого у тому, що екзогенну ДНК спрямовують у специфічний у геномі хазяїна. Екзогенну ДНК вставляють шля хом гомологічної рекомбінації, яка відбувається між послідовностями ДНК у векторі експресії і відповідною гомологічною послідовністю в геномі. Однак у той час як цей тип рекомбінації досить часто спостерігається у дріжджах та інших грибкових організмах, у вищи х е укаріотних організмах він є надзвичайно рідким явищем. У клітинах ссавців частота гомологічної у порівнянні з частотою негомологічної (випадкова інтеграція) рекомбінації за відомими даними змінюється у діапазоні від 1/100 до 1/5000 [див., наприклад, Capecchi, Science, 244:1288-1292 (1989); Morrow and Kucherlapati, Curr. Op. Biotech., 4:577-582 (1993)]. В одній з найбільш ранніх доповідей, в яких описано гомологічні рекомбінації у клітинах ссавців, згадується штучна система, створена у фібробластах мишей [Thomas et al, Cell, 44:419-428 (1986)]. Було створено клітинну лінію, що містить мутовану, нефункціональну версію гена nео, інтегрованого у геном хазяїна, після чого цю лінію спрямовано другою нефункціональною копією nео, що містить іншу мутацію. Реконструкція функціонального гена nео може відбуватися тільки через цілеспрямований вплив на гени. Наявність гомологічних рекомбінантів ідентифікували шляхом селекції опірних клітин G418 і підтверджували за допомогою аналізу геномної ДНК, виділеної з опірних клонів. Останнім часом доповідалося про застосування гомологічної рекомбінації для заміщення тяжких та легких генів імуноглобуліну на ендогенних локусах у клітинах, що виділяють антитіла [патент США №5,202,238, Fell et al, (1993)]. Однак цей своєрідний підхід не є широко застосовуваним, оскільки він обмежений утворенням імуноглобулінів у клітинах, що відзначаються ендогенним експресуванням імуноглобулінів, наприклад, В-клітин і клітин мієломи. Також експресія обмежується на рівні єдиної копії генів, оскільки коампліфікація після гомологічної рекомбінації не включається. Крім того, спосіб ускладнюється тим, що для створення функціонального імуноглобуліну потрібно дві окремих фази інтеграції: одна фаза для легкого гена у ланцюзі, після якої - фаза для тяжкого гена у ланцюзі. Про додатковий приклад цього типу системи зроблено доповідь стосовно клітин NS/0, де рекомбінантні імуноглобуліни еспресуються шляхом гомологічної рекомбінації у локус імуноглобуліну гамма 2А [Hollis et al, міжнародна патентна заявка РСТ/ІВ95 (00014)]. Рівні експресії, одержані з цього сайта, були надзвичайно високими - порядку 20пг/кліт./день з інтегранта єдиної копії. Проте, як і у наведеному вище прикладі, експресія обмежується цим рівнем через те, що здатний до ампліфікування ген не коінтегрується у цю систему. Крім того, іншими дослідниками зроблено доповіді про аберантне глікозилювання рекомбінантних білків, експресованих у NS/0 клітини [див., наприклад, Flesher et al, Biotech, and Bioeng., 48:399-407 (1995)], що свідчить, таким чином, про обмеження сфери застосування цього підходу. Рекомбінаційну систему сrе-ІохР з бактеріофагу Р1 останнім часом адаптували й використовують як засіб цілеспрямованого впливу на гени у клітинах еукаріотних організмів. Якщо казати більш конкретно, описано сайт-специфічну інтеграцію екзогенної ДНК у геномі клітини яєчника китайскьго хом'ячка (СНО) з використанням рекомбінази еге та серії Іох-вмісних векторів. [Fukushige and Sauer, Proc. Nat1, Acad. Sci, USA, 89:7905-7909 (1992)]. Ця система є цікавою тим, що вона забезпечує репродуковану експресію у тому ж самому місцеположенні у хромосомі. Проте нічого не робилося для ідентифікації хромосомного сайта, з якого експресія гена є оптимальною, та як і у наведеному вище прикладі, експресія обмежується рівнями єдиної копії у цій системі. Крім того, вона ускладнюється тим, що необхідно забезпечити експресію функціонального фермента рекомбінази у клітині ссавців. Було також зроблено доповідь про застосування гомологічної рекомбінації між інтродукованою послідовністю ДНК та її ендогенним хромосомним локусом для забезпечення доцільного засобу генетичної маніпуляції у клітинах ссавців, а також у клітинах дріжджів, [див., наприклад, Bradley et al, Meth. En zymol., 223:855-879 (1993); Capecchi, Science, 244:1288-1292 (1989); Rothstein et al, Meth. Enzymol., 194:281-301 (1991)]. Останнім часом більшість досліджень цілеспрямованого впливу на гени у ссавців було спрямовано на розривання гена ("нокаут") або на сайт-специфічний мутагенез вибраних локусів цільового гена у клітинах стовбура мозку мишей (ES). створення цих моделей "нокауту" у мишей дало вченим можливість дослідити конкретні питання щодо стр уктури-функції і встановити біологічне значення величезної кількості генів мишей. Ця галузь досліджень також має важливе прикладне значення з погляду на потенційне застосування для цілей генної терапії. Крім того, останнім часом зроблено доповіді про вектори у Cell-tech (Кент, Великобританія), у яких йдеться про активні з погляду на транскрипцію сайта у клітинах NSO, в яких ампліфікація гена не є необхідною [Peakman et al, Hum. Antibod. Hybrldomas, 5:65-74 (1994)]. Проте цими дослідниками не було нічого сказано про те, що рівні виділення імуноглобуліну у ци х неампліфікованих клітинах перевищують 20пг/кліт./день/, у той час як в ампліфікованих клітинах СНО рівні можуть досягати 100пг/кліт./день (1д.)· Існує нагальна потреба у розробці системи цілеспрямованого впливу на гени, яка репродуктивно забезпечує інтеграцію екзогенної ДНК у заздалегідь визначений сайт у геномі, про який відомо, що він є активним з погляду на транскрипцію. Крім того, було б бажано, щоб така система цілеспрямованого впливу на гени також полегшувала коампліфікацію вставленої ДНК після інтеграції. Розробка такої системи дала б можливість одержувати репродуковану експресію високого рівня будь-якого потрібного клонованого гена у клітині ссавців і, безсумнівно, сильно зацікавила б багатьох дослідників. У цій заявці авторами запропоновано нову систему експресії у ссавців, яка грунтується на гомологічній рекомбінації, що має місце між двома штучними субстратами, що містяться у дво х різних векторах. Зокрема у цій системі використовують комбінацію двох нових векторів експресії у ссавців, що їх називають "маркувальний" вектор та "спрямувальний" вектор. По суті маркувальний вектор робить можливим ідентифікування та маркування сайта у геномі ссавця, який є активним з погляду на транскрипцію, тобто сайта, на якому рівні експресії гена є високими. Цей сайт можна вважати "гарячою точкою" в геномі. Після інтеграції маркувального вектора система експресії об'єкта робить можливими інтеграцію іншої ДНК на цей сайт, тобто спрямувальний вектор, шляхом гомологічної рекомбінації, що має місце між послідовностями ДНК, спільними для обох векторів. Ця система має суттєві переваги порівняно з іншими системами гомологічної рекомбінації. На відміну від більшості інших гомологічних систем, застосовуваних у клітинах ссавців, ця система відзначається відсутністю фона (фенотипу). Отже, клітини, які було піддано лише випадковій інтеграції вектора, не виживають після селекції. Таким чином, будь-який потрібний ген, клонований у спрямувальну плазміду, відзначається високими рівнями експресії з маркованої гарячої точки. Відповідно, спосіб експресії генів за цим винаходом у значній мірі або повністю усуває проблеми, притаманні системам випадкової інтеграції, що їх детально описано вище. Крім того, ця система забезпечує репродуковану експресію високого рівня будь-якого рекомбінантного білка у тому самому активному з погляду на транскрипцію сайті у геномі ссавця. До того ж на цьому конкретному активному з погляду на транскрипцію сайті може відбуватися ампліфікація гена, шляхом включення здатного ампліфікувати домінантний селектованого маркера (наприклад, DHFR) як частини маркувального вектора. Отже, метою винаходу є одержання удосконаленого способу спрямування потрібної ДНК у специфічний сайт у клітині ссавців. Більш конкретною задачею винаходу є одержання нового способу спрямування потрібної ДНК у специфічний сайт у клітині ссавців шляхом гомологічної рекомбінації. Ще однією конкретною задачею винаходу є одержання нових векторів з метою досягнення сайтспецифічної інтеграції потрібної ДНК у клітині ссавців. Ще однією задачею винаходу є одержання нових клітинних ліній ссавців, які містять потрібну ДНК, інтегровану на попередньо визначений сайт, який зумовлює високий рівень експресії. Більш конкретною задачею винаходу є одержання нового способу з метою досягнення сайтспецифічної інтеграції потрібної ДНК у клітині яєчника китайського хом'ячка (СНО). Іншою більш конкретною задачею винаходу є одержання нового способу інтегрування генів імуноглобуліну або будь-яких інших генів у клітинах ссавців на попередньо визначених хромосомних сайтах, що з умовлюють високий рівень експресії. Ще однією конкретною задачею винаходу є одержання нових векторів та комбінацій векторів, придатних для інтегрування генів імуноглобуліну у клітини ссавців на попередньо визначені сайти, що зумовлюють високий рівень експресії. Іншою задачею винаходу є одержання клітинних ліній ссавців, які містять гени імуноглобуліну, інтегровані на попередньо визначених сайтах, що зумовлюють високий рівень експресії. Ще більш конкретною задачею винаходу є одержання нового способу інтегрування генів імуноглобуліну у клітини СНО, що зумовлюють високий рівень експресії, а також нових векторів та комбінацій векторів, що зумовлюють таку інтеграцію генів імуноглобуліну у клітини СНО. Крім того, конкретною задачею винаходу є одержання нових клітинних ліній СНО, які містять гени імуноглобуліну, інтегровані на попередньо визначених сайтах, що зумовлюють високий рівень експресії, і є ампліфікованими за допомогою селекції з використанням метотрексату і з виділенням навіть більших кількостей функціональних імуноглобулінів. На Фіг.1 зображено карту маркувальної плазміди за цим винаходом, що її називають Desmond. Плазміду показано у вигляді кільця (1а), а також у лінійному варіанті, що його використовують для трансфекції (16). На Фіг.2(а) показано карту спрямувальної плазміди, названої "Molly". Molly показано тут як таку, що кодує спрямовані проти CD20 гени імуноглобуліну, експресію яких описано у Прикладі 1, На Фіг.2(б) показано лінійний варіант Molly після розщеплення рестрикційними ферментами КрnІ та Pact. Цю лінійну форму використовували для трансфекції. На Фіг.3 зображено потенційне групування послідовностей Desmond, інтегрованих у геном СНО, і вхідних спрямувальних послідовностей Molly. Також представлено одне потенційне компонування Molly, інтегрованої у Desmond після гомологічні рекомбінації. На Фіг.4 показано саузерн-блотинговий аналіз маркованих Desmond клонів єдиної копії. Застосовували такі зразки: Траса 1 маркер розміру ДНК lHindlll Траса 2 клон Desmond 10F3 Траса 3 клон Desmond 10C12 Траса 4 клон Desmond 15C9 Траса 5 клон Desmond 14B5 Траса 6 клон Desmond 9B2 На Фіг.5 показано нозерн-блотинговий аналіз маркованих Desmond клонів єдиної копії. Використовують такі зразки: Панель А: нозерн-блотинговий аналіз, виконаний зондами CAD та DHFR, як показано на фігурі. Панель В: подвійний нозерн-блотинговий аналіз, виконаний зондами CAD та HisD, як це теж показано на фігурі. Зразки РНК, що містяться на панелях А та В, є такими: Траса 1: клон 9В2, траса 2; клон 10С12, траса 3; клон 14В5, траса 4; клон 15С9, траса 5; контрольна РНК з СНО, трансфікована плазмідою, що містить HisD та DHFR, траса 6; нетрансфікована СНО. На Фіг.6 показано саузерн-блотинговий аналіз клонів, що утворилися в результаті гомологічної інтеграції Molly у Desmond. Використовують такі зразки: Траса 1: маркери розміру ДНК lHindlll, траса 2; 20F4, траса 3; 5F9, траса 4; 21С7, траса 5; 24G2, траса 6; 25Е1, траса 7; 28С9, траса 8; 29F9, траса 9; 39G11, траса 10; 42F9, траса 11; 50G10, траса 12; ДНК з плазмідою Molly, лінеаризована ВgІll (верхній диск) і зрізана Bglll та КрnІ (нижній диск), траса 13; нетрансфікована Desmond. На Фігурах від 7 А до 7Ж наведено перелік послідовностей для Desmond. На Фігурах від 8 А до 8l наведено перелік послідовностей для анти-СО20, що містять Molly. На Фіг.9 наведено карту спрямувальної плазміди "Mandy," що показана як така, що кодує гени антиСО23, експресію яких описано у Прикладі 5. На Фігурах від 10А до 10Н наведено перелік послідовностей "Mandy", що містять гени анти-СО23, як описано у Прикладі 5. Винахід стосується нового способу інтегрування потрібної екзогенної ДНК на цільовому сайті у геномі клітини ссавця шляхом гомологічної рекомбінації. Крім того, винахід стосується нових векторів, створених з метою досягнення сайт-специфічної інтеграції ДНК на цільовому сайті в геномі клітини ссавця. Якщо казати більш конкретно, спосіб клонування за цим винаходом зумовлює сайт-специфічну інтеграцію потрібної ДНК у клітині ссавців шляхом трансфекції такої клітини "маркерною плазмідою", яка містить унікальну послідовність, що є чужорідною до геному клітини ссавців, і яка забезпечує субстрат для гомологічної рекомбінації з подальшою трансфекцією "цільовою плазмідою", що містить послідовність, який зумовлює гомологічні рекомбінації з унікальною послідовністю, яка міститься у маркерній плазміді, і також включає потрібну ДНК, яка має бути інтегрована у клітину організму ссавця. Зазвичай інтегрована ДНК кодуватиме потрібний білок, такий як імуноглобулін або інший виділений глікопротеїн з організму ссавців. У показаній на прикладах системі гомологічної рекомбінації застосовують ген неоміцин фосфо трансферази як домінантний селектований маркер. Цей конкретний маркер застосовували на підставі таких попередньо опублікованих спостережень та досліджень: (і) виявленої здатності спрямовувати та відновлювати функцію у мутованій версії гена nео (згаданого вище) і (іі) розробки авторами уражених трансляцією векторів експресії, в яких ген nео штучно створили як два екзони з потрібним геном, вставленим у розташований між ними інтрон; екзони пео коректно сплайсуються та транслюються in vivo, створюючи функціональний білок і, таким чином, викликаючи опірність до G418 у одержаній клітинній популяції. Згідно з цією заявкою, ген nео розщеплюють на три екзони. Третій екзон nео є присутнім на "маркерній" плазміді і стає інтегрованим у геном клітини-хазяїна після інтеграції маркерної плазміди у клітини ссавців. Екзони 1 та 2 є присутніми на спрямувальній плазміді і розділяються розташованим між ними інтроном, у який клонують принаймні один потрібний ген. Гомологічна рекомбінація спрямувального вектора з інтегрованим маркувальним вектором призводить до коректного сплайсингу усі х трьох екзонів гена nео і, таким чином, до експресії функціонального білка nео (як визначено шляхом селекції опірних колоній G418). Перед розробкою цієї системи експресії автори експериментально перевірили функціональність такого тричі сплайсованого конструкта nео у клітинах ссавців. Результати цього контрольного експерименту показали, що усі три екзони nео нормально сплайсувалися, що, таким чином, дає можливість припустити можливість втілення цього винаходу. Оскільки цей винахід розкрито на прикладах, в яких використовували ген nео, а більш конкретно - тричі розщеплений ген nео, загальна технологія має бути ефективною з використанням інших домінантних маркерів, які можуть бути селектованими. Як було більш детально розглянуто нижче за текстом, цей винахід має численні переваги порівняно з традиційними способами експресії генів, включаючи як випадкову інтеграцію, так і способи цілеспрямованого впливу на гени. Якщо казати конкретно, цей винахід стосується способу, який репродуктивно дозволяє здійснювати сайт-специфічну інтеграцію потрібної ДНК у активний з точки зору транскрипції домен клітини ссавця. Крім того, оскільки спосіб цього винаходу передбачає штучн у ділянку "гомології", що діє як унікальний субстрат для гомологічної рекомбінації і вставлення потрібної ДНК, для ефективності цього винаходу немає потреби у тому, щоб клітина містила ендогенну або експресувала специфічну ДНК. Таким чином, цей спосіб за своєю природою є придатним для застосування у всі х клітинах ссавців і може використовуватися для експресування будь-якого типу рекомбінантного білка. Застосування тричі сплайсованого селектованого маркера, наприклад, наведеного як приклад тричі сплайсованого конструкта nео, гарантує те, що всі продуковані опірні колонії G418 з'являються в результаті акту гомологічної рекомбінації (випадкові інтегранти не продукуватимуть функціональний ген nео і, відповідно, не виживатимуть після селекції G418). Таким чином, цей винахід полегшує скринінг потрібної гомологічної події. Крім того, частота додаткових випадкових інтеграцій у клітині, яка пережила подію гомологічної рекомбінації, повинна бути низькою. Виходячи зі сказаного вище, очевидно, що важлива перевага винаходу полягає у тому, що він значно зменшує кількість колоній, які потрібно скринувати для ідентифікування високопродуктивних клонів, тобто клітинних ліній, що містять потрібну ДНК, які виділяють відповідний білок на високих рівнях. У середньому клони, що містять інтегровану потрібну ДНК, ідентифікують шляхом скринінгу від приблизно 5 до 20 колоній (порівняно з кількома тисячами, що їх треба скринувати під час використання стандартної технології випадкової інтеграції, або кількома сотнями, якщо використовувати описані вище інтронні вектори інсерції). Крім того, оскільки сайт інтеграції був вибраний заздалегідь і містить активний з погляду на транскрипцію домен, усі екзогенні ДНК, що експресуються на цей сайт, повинні були б продукувати співставні, тобто високі рівні потрібного білка. Крім того, цей винахід має ту перевагу, що він дозволяє вставляти здатний до ампліфікування ген в інтеграцію маркувального вектора. Таким чином, коли потрібний ген спрямовують на цей сайт шляхом гомологічної рекомбінації, запропонований винахід робить можливим додаткове підсилення експресії гена шляхом ампліфікації гена. У зв'язку з цим з літературних джерел відомо, що різні геномні сайти можуть порізному ампліфікувати гени [Meinkoth et al, Моl, Cell Вiol, 7:1415-1424 (1987)]. Таким чином, ця технологія має додаткову перевагу ще й в тому, що робить можливим розміщення потрібного шуканого гена на специфічному сайті, який з одного боку є активним з погляду на транскрипцію, а з другого - легко ампліфікується. Таким чином, це повинно значно зменшити кількість часу, необхідного для виділення таких продуктивних елементів. Якщо більш конкретно, у той час як традиційні способи створення клітинних ліній ссавців з високим рівнем експресії потребують від 6 до 9 місяців, цей винахід дає можливість виділяти такі клони в середньому приблизно через 3-6 місяців. Причина полягає у тому, що виділені стандартним способом клони зазвичай підлягають принаймні трьом циклам ампліфікації опірного до ліків гена з метою досягнення задовільних рівнів експресії генів. Оскільки гомологічно продуковані клони утворюються з попередньо вибраного сайта, який є сайтом з високим рівнем експресії, перед досягненням задовільного рівня експресії потрібна більша кількість циклів ампліфікації. До того ж цей винахід робить можливою репродуковану селекцію високопродуктивних клонів, в яких вектор інтегрується з малою кількістю копій, зазвичай з однією копією. Це дає певні переваги, оскільки сприяє підсиленню стійкості клонів і дає можливість уникнути інших потенційно шкідливих побічних ефектів, пов'язаних з великою кількістю копій. Як описано вище, у системі гомологічної рекомбінації цього винаходу використовують комбінацію "маркерної плазміди" та "спрямувальної плазміди", що їх описано більш детально нижче за текстом. "Маркерна плазміда", що її використовують для маркування та ідентифікування, гаряча з погляду на транскрипцію точки, міститиме принаймні такі послідовності: (і) ділянка ДНК, яка є гетерологічною або унікальною по відношенню до генома клітини організму ссавця, що діє як джерело гомології, дозволяє здійснити гомологічну рекомбінацію (з ДНК, що міститься у другій спрямувальній плазміді). Якщо казати більш конкретно, унікальна ділянка ДНК (і) зазвичай міститиме бактеріальну, вірусн у, синтетичн у дріжджову або іншу ДНК, яка, як правило, не є присутньою у геномі клітини ссавця і яка, до того ж, не має суттєвої гомології або ідентичності послідовностей з ДНК, що міститься в геномі клітини організму ссавця. Фактично ця послідовність повинна суттєво відрізнятися від ДНК ссавців тим, що вона практично не буде рекомбінувати з геномом клітини-хазяїна шляхом гомологічної рекомбінації. Розмір такої унікальної ДНК зазвичай становитиме принаймні від близько 2 до 10 т.п.н. або більше, краще принаймні близько 10т.п.н., оскільки деякі інші дослідники звернули увагу на зв'язок між зростанням частоти спрямованої рекомбінації та збільшення розміру ділянки гомології [Capecchi, Science, 244:1288-1292 (1989)]. Верхня границя розмірів унікальної ДНК, що діє як сайт для гомологічної рекомбінації з послідовністю у другому цільовому векторі в значній мірі залежить від потенційних обмежень стійкості та ускладнень в роботі з дуже великими ДНК (якщо ДНК є надто великою, вона тяжко інтегрується у хромосому). (іі) ДНК, що включає фрагмент ДНК селектованого маркера, зазвичай екзон гена домінантного селектованого маркера. Єдиною суттєвою рисою цієї ДНК є те, що вона не кодує білок функціонального селектованого маркера, якщо він не експресується у сукупності з послідовністю, що міститься у спрямувальній плазміді. Зазвичай цільова плазміда міститиме решту екзонів гена домінантного селектованого маркера (ті, що не містяться у "спрямувальній" плазміді). Фактично функціональний селектований маркер повинен продукуватися лише у тому разі, якщо має місце гомологічна рекомбінація (що призводить до об'єднання та експресії цієї послідовності ДНК маркера (і) разом із частиною (частинами) фрагмента ДНК селектованого маркера, котрий міститься (-яться) у спрямувальній плазміді). Як зазначено вище, цей винахід може бути ілюстрований прикладом застосування гена неоміцин фосфо трансферази як домінантного селектованого маркера, який "розщеплюється" на два вектори. Проте інші селектовані маркери також повинні бути придатними, наприклад, ген гістидин дегідрогенази в організмі Salmonella, ген гідроміцин фосфотрансферази, ген тимідин кінази віруса герпеса симлекс, ген аденозин деамінази, ген глутамін синтетази і ген фосфорибосил трансферази гіпоксантин-гуаніну. (ііі) ДНК, що кодує білок функціонального селектованого маркера, селектований маркер якого відрізняється від ДНК селектованого маркера (її). Цей селектований маркер забезпечує успішну селекцію клітин ссавців, коли маркерну плазміду успішно інтегрують у клітинну ДНК. У кращому варіанті бажано, щоб маркерна плазміда містила дві такі ДНК домінантного селектованого маркера, розташованих на протилежних кінцях вектора. Це надає перевагу, оскільки дає можливість селектувати інтегранти з використанням різних агентів селекції І, крім того, дозволяє селектува ти клітини, які містять повний вектор. Крім того, один з маркерів може бути ампліфікованим, що полегшує ампліфікацію гена, як це було описано раніше. Будь-який з домінантних селектованих маркерів, перелічених у (іі), може бути використаний так само, як і інші загальновідомі у галузі маркери. Крім того, маркерна плазміда як варіант може містити рідкісний рестрикційний сайт ендонуклеази. Це є потенціально бажаним, оскільки це може полегшува ти розщеплення. Якщо він є присутнім взагалі, такий рідкісний рестрикційний сайт повинен бути розташований поблизу від середини унікальної ділянки, яка діє як субстрат для гомологічної рекомбінації. В оптимальному варіанті така послідовність повинна включати принаймні близько 12 нуклеотидів. Було повідомлено про те, що введення двохниткового розриву за допомогою аналогічної технології підсилює частоту гомологічної рекомбінації. [Choulika et al, Моl. Cell. Biol., 15:1968-1973 (1995)]. Проте наявність такої послідовності не є вирішальною. "Спрямувальна плазміда" міститиме принаймні такі послідовності: (1) ту ж саму унікальну ділянку ДНК, що міститься у маркерній плазміді або таку, що має достатню гомологію чи ідентичність послідовності, з тим, що згадана ДНК є здатною комбінувати шляхом гомологічної рекомбінації з унікальною ділянкою (і) у маркерній плазміді. Прийнятні типи ДНК описано вище, в описі унікальної ділянки ДНК (1) у маркерній плазміді. (2) Решта екзонів домінантного селектованого маркера, один екзон з яких включений як (іі) у маркерній плазміді, згаданій вище. Суттєвими рисами цього фрагмента ДНК є те, що він призводить до утворення білка функціонального (селектованого) маркера тільки якщо цільова плазміда інтегрується шляхом гомологічної рекомбінації (коли така рекомбінація призводить до об'єднання цієї ДНК з іншим фрагментом ДНК селектованого маркера, що міститься у маркерній плазміді) і, крім того, те, що він дає можливість здійснювати інсерцію потрібної екзогенної ДНК. Зазвичай ця ДНК міститиме решту екзонів ДНК селектованого маркера, які розділяються інтроном. Наприклад, ця ДНК може містити перші два екзони гена nео, а маркерна плазміда може містити третій екзон (задню третину nео). (3) Спрямувальна плазміда також міститиме потрібну ДНК, наприклад, таку, що кодує потрібний поліпептид, в оптимальному варіанті вставлену усередині фрагмента ДНК селектованого маркера, що міститься у плазміді. Зазвичай ДНК вставляють в інтрон, який міститься між екзонами ДНК селектованого маркера. Цим забезпечується те, що потрібну ДНК, крім того, інтегрують у тому випадку, якщо відбувається гомологічна рекомбінація цільової плазміди та маркерної плазміди. Цей інтрон буває або природним, або штучно введеним у фрагмент ДНК домінантного селектованого маркера. Ця ДНК кодуватиме будь-який потрібний білок, в оптимальному варіанті такий, що має фармацевтичні або інші потрібні властивості. Частіше ДНК кодуватиме білок ссавців, і у даних прикладах представлено імуноглобулін або імуноадгезин. Проте винахід жодним чином не обмежується створенням імуноглобулінів. Як обговорювалося раніше, спосіб клонування за цим винаходом є придатним для будь-якої клітини організму ссавця, оскільки він не потребує тієї ефективності, як є у будь-якій специфічній послідовності або послідовностях в організмі ссавців. Загалом такі клітини ссавців міститимуть ті клітини, що їх зазвичай використовують для експресії білка, наприклад, клітини СНО, клітини мієломи, клітини COS, клітини ВНК, клітини Sp2/0, клітини NIH 3Т3 та HeLa. У наведених вище прикладах використовували клітини СНО. До переваг цього способу належить наявність придатного середовища для росту, їх здатність ефективно рости і досягати високої густини в культурі, а також їх здатність експресувати білки ссавців, такі як імуноглобуліни, у біологічно активній формі. Крім того, значну частину клітин СНО вибирали з урахуванням попереднього застосування такої клітини авторами винаходу для експресії імуноглобулінів (використовуючи уражений трансляцією домінантний селектований маркер, що містить описані раніше вектори). Таким чином, співробітники лабораторії, в якій розробляли цей винахід, мають великий досвід у використанні таких клітин для експресії. Проте на підставі наведених нижче прикладів є сенс очікувати, що аналогічні результати одержуватимуть для інших клітин ссавців. Загалом, трансформування або трансфекцію клітин ссавців за цим винаходом виконують згідно з традиційними способами. Для того, щоб краще зрозуміти цей винахід, в наведених нижче прикладах описано створення типових векторів та їх використання з метою продукування інтегрантів. Приклад 1 Схематична будова та приготування векторів ДНК маркерної та спрямувальної плазміди Маркерну плазміду за цим винаходом, що її називають "Desmond" збирали з таких елементів ДНК: (а) Ген мишачої дигідрофолат редуктази (DHFR), введений у касету транскрипції, що містить промотор 5’’ мишачого бетаглобіну на початковому сайті DHFR і сигнальну послідовність 3’’ поліаденілювання бичачого гормону росту на термінуючому кодоні. Касету транскрипції DHFR виділяли з ТСАЕ6, вектора експресії, створеного раніше у цій лабораторії [Newman et al, 1992, Biotechnology, 10:1455-1460]. (б) Ген b-галактозидази Е. соlі - комерційно доступний, отриманий від Promega у вигляді контрольного вектора pSV-b-галактозидази, каталог №Е1081. (в) ДНК бакуловірусу, комерційно доступна, що її придбано у Clontech у ви гляді pBAKPAKS, кат. №61451. (г) Касета, що містить елементи промотора та енхансера з цитомегаловірусу та вірусу SV40. Касету створювали за допомогою полімеразно-ланцюжкової реакції (PCR) з використанням похідної вектора експресії ТСАЕ8 [Reff et al, Blood, 83:435-445 (1994)]. Касету з ехансером вставляли всередину послідовності бакуловірусу, яку спочатку модифікували інсерцією сайта з багатократним клонуванням. (д) Ген GUS (глюкуронідази) Е, соІі, комерційно доступний, придбаний у Clontech у вигляді рВ101, кат. №6017-1, (е) Ген люциферази світлячка, комерційно доступний, отриманий від Promega у вигляді pGEM-Luc (каталог №E1541). (ж) Ген дегідрогенази гістидинолу S. tvphimurium гістидинол (HisD). Цей ген було спочатку подаровано [Donahue et el. Gene, 18:47-59 (1982)], після чого введено у касету транскрипції, що містить головний промотор 5' мишачого бетаглобіну для гена і сигнальну послідовність 3’ поліаденілювання SV40 для гена. Елементи ДНК, що їх описано в (а)-(ж), об'єднували у каркас похідної від pBR плазміди з одержанням зчепленого фрагмента секвенування ДНК (7,7т.п.н.), названого у доданих рисунках "гомологія". Гомологія у цьому розумінні стосується послідовностей ДНК, які не є частиною геному ссавців і які використовують для стимулюваннягомологічної рекомбінації між трансфікованими плазмідами, що поділяють між собою послідовності ДНК тієї ж самої гомології. (з) Ген неоміцин фосфотрансферази з TN5 [Davis and Smith, Ann. Rev. Micro., 32:469-518 (1978)]. Повний ген neo субклонували у pBluescript SK- [каталог Stratagene №212205] з метою полегшення виконання генетичної маніпуляції. Синтетичний лінкер після цього інсертували в унікальний сайт Psti, що міститься поперек кодонів для амінокислот 51 та 52 гена nео. Цей лінкер кодував необхідні елементи ДНК зі створенням штучного сайта-донора сплайсингу, розташованого між ними інтрона та сайта-акцептора сплайсингу у гені nео, створюючи, таким чином, два окремих екзона, що їх цього часу називають екзон 1 та 2. Екзон 1 nео кодує перші 51 амінокислот nео, у той час як екзон 2 кодує решту 203 амінокислот плюс термінуючий кодон сайта білка А. Сайт, що клонує Not1, також створювали у інтроні. (Bluescript зареєстрований знак для товарів і послуг). Екзон Neo 2 додатково підрозділяли з утворенням екзонів nео 2 та 3. Цього досягали таким чином: груп у праймерів PCR створювали для ампліфікування ділянки ДНК, що кодує екзон nео 1, інтрон та перші 111 2/3 амінокислот екзону 2. Праймер PCR 3' викликав інтродукцію нового сайта сплайсування 5' одразу за другим нуклеотидом кодону амінокислоти 111 у екзоні 2, таким чином створюючи новий менший екзон 2. Фрагмент ДНК, що вже кодував початковий екзон 1, інтрон та новий екзон 2, далі субклонували та розмножували у векторі на основі pBR. Решту початкового екзону 2 використовували як матрицю для іншого циклу ампліфікації PCR, після якого утворився "екзон 3". Праймер 5’ для цього циклу ампліфікації вводив новий сайт-акцептор сплайсингу на 5' сайті новоутвореного екзону 3, тобто перед кінцевим нуклеотидом кодону амінокислоти 111. Одержані 3 екзони nео кодують таку інформацію: екзон 1 - перші 51 амінокислот nео; екзон 2 - наступні 111 2/3 амінокислот і екзон 3 - кінцеві 91 1/3 амінокислот плюс трансляційний термінуючий кодон гена nео. Екзон nео 3 вводили разом із зазначеними вище елементами ДНК у маркувальну плазміду "Desmond". Екзони nео 1 та 2 вводили у спрямувальну плазміду "Molly". Клонувальний сайт Not1, створюваний усередині інтрона між екзонами 1 та 2, використовували у подальших стадіях клонування з метою вставлення потрібних генів у спрямувальну плазміду. Також створювали другу спрямувальну плазміду "Mandy". Ця плазміда є майже ідентичною "Molly" (деякі рестрикційні сайти у векторі було змінено), за винятком того, що початкові гени HisD та DHFR, що містяться у "Molly", були інактивованими. Ці зміни вводили через те, що клітинну лінію Desmond більш не культивували у присутності гістидинолу; таким чином не було очевидної необхідності включати другу копію гена HisD. Крім того, ген DHFR інактивували для забезпечення того, щоб тільки єдиний ген DHFR, а саме присутній у маркованому Desmond сайті, міг бути ампліфікований у будь-яких одержуваних клітинних лініях. "Mandy" одержували як похідну від "Molly" шляхом проведення таких змін: (і) Синтетичний лінкер вставляли усередині кодувальної ділянки DHFR. Цей лінкер створював термінуючий кодон і виштовхував решту кодувальної ділянки DHFR з рамки, таким чином роблячи ген нефункціональним. (іі) Частину гена HisD делетували і заміщували утвореним за допомогою PCR фрагмента HisD, в якому промотор та початковий кодон гена були відсутні. На Фіг.1 зображено компонування цих елементів ДНК у маркерній плазміді "Desmond". На Фіг.2 зображено компонування цих елементів у першій спрямувальній плазміді, "Molly". На Фіг.3 показано можливе компонування у геномі СНО різних елементів ДНК після спрямування та інтеграції ДНК Molly у марковані Desmond клітини СНО. На Фіг.9 зображено спрямувальну плазміду "Mandy." Створення маркувальної та спрямувальної плазмід з перелічених вище елементів ДНК виконували за традиційними способами технології клонування [див., наприклад, Molecular Cloning, A Laboratory Manual, J. Sambrook et al, 1987, Cold Spring Harbor Laboratory Press, and Current Protocols in Molecular Biology, F. M. Ausubel et al, eds., 1987, John Wiley and Sons]. Усі плазміди розмножували та зберігали в Е. coli XLI голубому [Stratagene, кат. №200236]. У широкому масштабі плазміди приготовляли з використанням Promega Wizard Maxiprep DNK Purification SystemÒ згідно із рекомендаціями виробника. Приклад 2 Створення маркованої клітинної лінії СНО 1. Клітинна культура та процедури трансфекції з утворенням маркованої клітинної лінії СНО Маркувальну плазміду ДНК лінеаризували шляхом розщеплення протягом доби при 37°С за допомогою Bst1107l. Лінеаризованим вектором був етанол, осаджений і знов перетворений на суспензію у стерильному ТЕ з одержанням концентрації 1мг/мл. Лінеаризований вектор вводили у клітини яєчника китайського хом'ячка (DHPR) (клітини СНО) клітини DG44 [Uriaub et al, Som. Cell and Моl. Gen., 12:555-566 (1986)] шляхом електропорації у такий спосіб. Клітини, кількість яких зростала по експоненті, збирали за допомогою центрифугування, один раз промивали у льодяному SBS (розчин із сахарозним буфером, 272мМ сахароза, 7мМ фосфат натрію, рН 7,4, 1мМ хлорид магнію), після чого знов перетворювали на суспензію у SBS з одержанням концентрації 107клітин/мл. Після 15-хвилинного інкубування на льоді 0,4мл суспензії клітин перемішували із 40мкг лінеаризованої ДНК у одноразовій кюветі для електропорації. Клітини піддавали шоковій обробці за допомогою ВТХ електричного клітинного маніпулятора (San Diego, CA) з використанням напруги 230 вольт, ємності 400 мікрофарад й опору 13 ом. Піддані шоковій обробці клітини після цього змішували з 20мл попередньо нагрітого середовища росту СНО [CHO-S-SFMII, Gibco/BRL, каталог №31033-012] і поміщали у 96-коміркові планшети для тканинної культури. Після сорока восьми годин проведення електропорації планшети наповнювали селекційним середовищем (у випадку трансфекції з використанням Desmond селекційним середовищем було CHO-S-SFMII без гіпоксантину або тимідину, доповнене 2мМ гістидинолом (Sigma, каталог №Н6647)). Планшети залишали у селекційному середовищі на термін до 30 діб, або доти, поки в деяких комірках не було виявлено росту клітин. Далі ці клітини видаляли з 96-коміркових планшетів і нарешті поміщали у 120-мілілітрові відцентрові колби, де їх залишали у селекційному середовищі на весь час. Приклад 3 Визначення характеристик маркованих клітинних ліній СНО (а) Саузерн-блотинговий аналіз Геномну ДНК виділяли з усіх стабільно зростаючих маркованих Desmond клітин СНО. ДНК виділяли з використанням комплекту Invitrogen EasyÒ ДНК згідно з рекомендаціями виробника. Геномну ДНК після цього розщеплювали за допомогою Hindlll протягом доби при 37°С і піддавали саузерн-блотинговому аналізу з використанням створеного за допомогою PCR міченого дигоксигеніном, специфічного до гена DHFR. Гібридизації та промивання виконували з використанням легкого гібридизатора Boehringer Mannheim's DIG [каталог №1603558] і DIG Wash and Block Buffer Set [каталог №1585762] згідно із рекомендаціями виробника. Припускали, що зразки ДНК, які містять одиночний диск, який гібридизується із зондом DHFR, повинні бути клонами Desmond, що виникали з одиночної клітини, яка інтегрувала одиночну копію плазміди. Ці клони залишали для подальшого аналізу. З усі х 45 виділених опірних до HisD клітинних ліній лише 5 були інтегрантами з одиночною копією. На Фіг.4 відображено саузерн-блоти, що містять усі ці 5 маркованих Desmond клонів з одиночною копією. Назви клонів представлено в умовних позначеннях до рисунків. (б) Нозерн-блотинговий аналіз Сумарну РНК виділяли з усіх маркованих Desmond клонів з одиночною копією, використовуючи реагент TRIzol [Gibco/BRL кат. №15596-026] згідно із рекомендаціями виробника. 10-20/мкг РНК з кожного клону аналізували на подвійних формальдегідних гелях (TRIzol - зареєстрований знак для товарів і послуг). Одержані блоти зондували з використанням утворених за допомгою PCR мічених дигокигеніном зондів ДНК на (і) інформацію DHFR, (іі) інформацію HisD та (ііі) інформацію CAD. CAD являє собою трифункціональний білок, включений у біосинтез уридину [Wahl et al, J. Biol. Chem., 254, 17:8679-8689 (1979)] і експресується однаковим чином в усіх типах клітин. Його використовують у цьому винаході для внутрішнього контролю для того, щоб оцінити навантаження РНК. Гібридизації та промивання виконували з використанням зазначених вище реагентів Boehringer Mannheim. Результати нозерн-блотингового аналізу показано на Фіг.5. Одиночною копією клону Desmond, яка відзначалася найвищими рівнями інформації як His D, так і DHFR, є клон 15С9, показаний в трасі 4 в обох панелях фігури. Цей клон названо "маркована клітинна лінія", і його використовують у майбутніх дослідах у СНО щодо спрямування, приклади яких наведено у наступних розділах. Приклад 4 Експресія антитіла, спрямованого проти-СР20 у маркованих Desmond клітинах СНО С2В8, химерне антитіло, яке розпізнає антиген CD20 на поверхні В-клітини, був попередньо клонований та експресований у лабораторії авторів винаходу. [Reff et al, Blood, 83:434-45 (1994)]. Фрагмент ДНК довжиною 4,1т.п.н., що містить гени С2В8 легкого та важкого ланцюгів, разом із необхідними регулювальними елементами (еукаріотний промотор та сигнали поліаденілювання), вставляли у штучний інтрон, створений між екзонами 1 та 2 гена nео, що міститься у похідному від pBR клонувальному векторі. Цей новоутворений фрагмент ДНК розміром 5т.п.н. (що містить екзон nео 1, С2В8 та екзон nео 2) вирізали та використовували для конструювання спрямувальної плазміди Molly. Інші елементи ДНК, використані для створення Molly, є ідентичними тим, які використовували для створення маркувальної плазміди Desmond, ідентифікованої раніше. Повну карту Molly показано на Фіг.2. Спрямувальний вектор Molly лінеаризували перед трансфекцією шляхом розщеплення Kpn1and Pac1, етанолом, осадженим і знов перетвореним на суспензію у стерильному ТЕ, з одержанням концентрації 1,5мг/мл. Лінеаризовану плазміду вводили в експоненційно зростаючі марковані клітини Desmond практично так само, як описано, за винятком того, що 80мкг ДНК використовували для кожної електропорації. Через сорок вісім годин після електропорації у 96-коміркові планшети додавали селекційне середовище -CHO-SSFMII, доповнене 400мкг/мл Geneticin [G418, Gibco/BRL каталог №10131-019]. Планшети витримували у селекційному середовищі протягом 30 діб, або доти, поки в деяких комірках не було виявлено ріст клітин. Припускали, що такий ріст є результатом клональної експансії одиночної опірної до G418 клітини. Супернатанти (поверхневі шари) з усіх опірних до G418 комірок піддавали аналізу на утворення С2В8 за допомогою стандартних технологій ELISA, а усі продуктивні клони після цього поміщали у 120-мілілітрові відцентрові колби і піддавали подальшому аналізу. Визначення характеристик цільових клітин, що виділяють антитіла У цьому експерименті виконували всього 50 електропорацій зі спрямувальною плазмідою Molly, кожну з яких поміщали в окремі 96-коміркові планшети. Усього 10 життєздатних клонів, що виділяють антитіла, спрямовані проти CD20, одержували та поміщали у 120-мілілітрові відцентрові колби. Геномну ДНК виділяли з усіх клонів, після чого виконували саузерн-блотинговий аналіз з метою визначення того, чи являли собою клони одиночні події гомологічної рекомбінації або чи відбулися додаткові випадкові інтеграції у тій самій клітині. Способи виділення ДНК та саузерн-гібридизація були такими, як описано попередньому розділі. Геномну ДНК розщеплювали EcoRI і зондували створеним за допомогою PCR міченим дигоксигеніном зондом до сегмента стабільної ділянки тяжкого ланцюга CD20. Результати цього саузерн-блотингового аналізу приведено на Фіг.6. Як видно на цій фігурі, 8 з 10 клонів відзначалися єдиною смугою, що гібридизувалася із зондом CD20, вказуючи на те, що у ци х клітинах відбулася одиночна подія гомологічної рекомбінації. Два з десяти клонів, 24G2 та 28С9, відзначалися наявністю додаткового диску(дисків), вказуючи на додаткову випадкову інтеграцію у якійсь частині геному. Автори дослідили рівні експресії антитіла, спрямованого проти CD20, в усіх ци х десяти клонах, відповідні дані показано у Таблиці 1 нижче за текстом. Таблиця 1 Рівень експресії анти-СО20 антитіла Виділення гомологічних інтегрантів Клон 20F4 25Е1 42F9 39G11 21С7 50G10 29F9 5F9 28С9* 24G2* Анти-СD20, пкг/к/д 3,5 2,4 1,8 1,5 1,3 0,9 0,8 0,3 4,5 2,1 * Ці клони, що містили додаткові випадково інтегровані копії антитіла анти-CD20. Рівні експресії цих клонів таким чином відображають участь як гомологічного, так і випадкового сайтів. Рівні експресії виражені у пікограмах на клітину на добу (пкг/к/д), які виділяються окремими клонами, і вони являють собою середні рівні, отримані в результаті трьох окремих аналізів ELISA на зразках, відібраних з 120-мілілітрової відцентрові колби. Як видно з цих даних, існує різниця приблизно у 10 разів у виділенні антитіл між вищими та нижчими клонами. Це було дещо несподіваним, оскільки автори прогнозували аналогічні рівні експресії з усіх клонів через той факт, що усі гени анти-СО20 інтегрували у тому самому маркованому Desmond сайті. Проте виявилося, що цей діапазон експресії є надзвичайно малим у порівнянні з тим, який спостерігався в результаті використання будь-яких традиційних способів випадкової інтеграції або за допомогою запропонованої авторами системи уражених трансляцією векторів. Клон 20F4, найвищий за продукуванням одиночної копії інтегрант, відбирали для подальшого вивчення. У Таблиці 2 (нижче) наведено дані про ELISA та клітинні культури, взяті на підставі семидобових циклів одержання цього клона. Таблиця 2 Дані 7-добового циклу одержання 20F4 День 1 2 3 4 5 6 % життєздатних 96 94 94 90 73 17 життєздатні на/мл (x 105) 3,4 6 9,9 17,4 14 3,5 Tx2(hr) 31 29 33 30 мг/л 1,3 2,5 4,7 6,8 8,3 9,5 пкг/к/д 4,9 3,4 3,2 3 Клон 20F4 висівали у концентрації 2х105/мл у 120-мілілітрову відцентрову колбу в день 0. Протягом подальших шести діб робили виміри кількості клітин, розраховані для подвійного часу, і зразки супернатанту розміром 1мл відбирали з колби і аналізували на виділення антитіл анти-СD20 за допомогою ELISA. Цей клон по даним ELISA виділяється у середньому в кількості 3-5пкг антитіла/клітина/добу. Це такий самий рівень, який отримують від інших клонів з одиночною копією і з високою експресією, що їх попередньо одержували у лабораторії авторів з використанням раніше розроблених уражених трансляцією векторів випадкової інтеграції. Цей результат свідчить про те, що: (1) сайт у геномі СНО, маркованому маркувальним вектором Desmond, має високу активність з погляду на транскрипцію і, таким чином, являє собою дуже корисний сайт, з якого експресують рекомбінантні білки, і (2) спрямування шляхом гомологічної рекомбінації виконують з використанням векторів цього винаходу, і воно відбувається з частотою, достатньою для того, щоб зробити цю систему життєздатною та потрібною на відміну від способів із застосуванням випадкової інтеграції. Для подальшого підтвердження ефективності цієї системи автори також показали, що цей сайт є ампліфікованим, що призводить до навіть ще вищих рівнів експресії генів та виділення білків. Ампліфікації досягали шляхом висівання ряду розчинів клітин 20F4, починаючи з густини 2,5x104клітин/мл, у 96коміркових планшетах для тканинних культур і культивування цих клітини у середовища х (CHO-SSFMII), доповнених 5, 10, 15 або 20нМ метотрексату. Клони, що виділяють антитіла, скринували з використанням стандартних технологій ELISA, а найбільш продуктивні клони поміщали у колбу і піддавали додатковому аналізу. Підсумки цього досліду щодо ампліфікації наведено у Таблиці 3 нижче за текстом. Таблиця 3 Підсумки ампліфікації 20F4 нММТХ 10 15 20 Кількість тестованих комірок 56 27 17 Рівень експресії мг/л 96ком. 3-13 2-14 4-11 Кількість комірок, що Рівень експресії пкг/кліт./д збільш. після центрифуги 4 10-15 3 15-18 1 Немає даних Ампліфікацію 20F4 з використанням метотрексату встановлювали як описано у тексті, з використанням концентрацій метотрексату, вказаних у наведеній вище таблиці. Супернатанти з усіх колоній, що вижили у 96-комірковому планшеті, піддавали аналізу за допомогою ELISA, а порядок кількості антитіл проти CD20, експресованих цими клонами, показано у колонці 3. На підставі цих результатів найбільш продуктивні клони поміщали у 120-мілілітрові відцентрові колби і проводили кілька аналізів ELISA супернатантів з центрифуги - з метою визначення у пг/кліт./день рівнів експресії, наведених у колонці 5. Наведені тут дані підтверджують, що цей сайт може бути ампліфікований у присутності метотрексату. Було виявлено, що клони з ампліфікацій із вмістом метотрексату 10 та 15нМ одержують у кількості порядку 15-20пг/кліт./д. Клон з використанням 15нМ метотрексату, названий 20F4-15A5, вибирали як клітинну лінію з найвищою експресією. Цей клон походив з 96-коміркового планшету, в якому ріст спостерігався лише у 22 комірках, і, таким чином, було зроблено припущення, що він утворився з одиночної клітини. Клон із 15нМ метотрексатом, названий 20F4-15A5, вибирали як клітинну лінію з найвищою експресією. Цей клон брали з 96-коміркового планшету, в якому ріст спостерігався лише у 22 комірках, і, таким чином, було зроблено припущення, що він утворився з одиночної клітини. Клон після цього піддавали обробці подальшого циклу ампліфікації з використанням метотрексату. Як описано вище, ряд розчинів культури поміщали у 96коміркові планшети і культивували у середовищі CHO-SS-FMII, доповненому 200, 300 або 400нМ метотрексату (МТХ). Клони, що вижили, скринували за допомогою ELISA, і декілька високопродуктивних клонів поміщали у призначені для центрифугування культури і піддавали додатковому аналізу. Підсумки цього другого експерименту з ампліфікування наведено у Таблиці 4. Таблиця 4 Підсумки ампліфікації 20F4-15А5 нММТХ 200 250 300 Кількість тестов, комірок 67 86 81 Рівень експресії мг/л 96ком. 23-70 21-70 15-75 Кількість поміщ. комірок 1 4 3 Рівень експресії пкг/к/д, центрифуга 50-60 55-60 40-50 Метотрексатну ампліфікацію 20F415A5 проводили та аналізували як описано у тексті, найбільш продуктивні комірки, кількості яких вказано у колонці 4, поміщали у 120-мілілітрові відцентрові колби. Рівні експресії клітинних ліній, одержаних з цих колонок, зафіксовано у пкг/к/д у колонці 5. Найпродуктивніший клон одержували в результаті амплфікації 250нМ метотрексатом. Клон, одержаний в результаті ампліфікації 250нМ МТХ, тобто 20F4-15A5-250A6, був взятий з 96-коміркового планшета, з єдиної комірки для росту, і, таким чином, припускається, він утворився з однієї клітини. Узяті разом, дані у Таблицях 3 та 4 чітко вказують на те, що двох циклів ампліфікації з використанням метотрексату достатньо для досягнення рівнів експресії 60пг/кліт./день, що наближається до максимально можливої продуктивності виділення імуноглобуліну у клітинах ссавців [Reff, Μ.Ε., Сurr. Opin. Biotech., 4:573-576 (1993)]. Властивість досягати такої продуктивності виділення потрібної речовини за допомогою лише двох стадій ампліфікації додатково підвищує ефективність цієї системи гомологічної рекомбінації. Зазвичай способи із застосуванням випадкової інтеграції потребують більш як двох стадій ампліфікації, для того, щоб досягти цього рівня експресії, і є в цілому менш надійними з погляду на зручність виконання процедури ампліфікації. Отже, гомологічна система дає можливість застосувати більш ефективний і швидкий спосіб досягнення високого рівня експресії гена у клітинах ссавців. Приклад 5 Експресія антитіла, спрямованого проти людського CD23 у маркованих Desmond клітинах СНО CD23 являє собою рецептор ІgЕ з низькою мірою спорідненості, який опосередковує зв'язування ІgЕ із В та Т-лімфоцитами [Sutton, B.J., and Gould, H.J., Nature, 366:421-428 (1993)]. Моноклональне антитіло 5Е8 проти людського CD23 являє собою людське моноклональне антитіло гамма-1, клоноване та експресоване у лабораторії авторів. Це антитіло описано в патенті US 6,011,138. Гени важкого та легкого ланцюгів 5Е8 клонували у вектор експресії в організмі ссавців N5KG1, похідної вектора MEOSPLA [Barnett et al, in Antibody Expression and Engineering, H.Y Yang and T. Imanaka, eds., pp.27-40 (1995)], після чого у генах робили дві зміни. Останнім часом автори спостерігали в лабораторних умовах де що ви щий рівень виділення легких ланцюгів імуноглобуліну у порівнянні з тяжкими ланцюгами у інших експресійних конструктах [Reff et al, 1997, неопубліковані дослідження]. Намагаючись компенсувати цей дефіцит, автори змінювали ген тяжкого ланцюга 5Е8 шляхом додавання більш сильного промотора/енхансера безпосередньо над початковим сайтом. Під час виконання подальших стадій фрагмент ДНК розміром 2,9т.п.н., що містив модифіковані 5Е8 гени легких та тяжких ланцюгів виділяли з вектора N5KG1 і вставляли у спрямувальний вектор Mandy. Приготування 5Е8-вмісного Molly і електропорація у клітини СНО з Desmond 15С9 виконували в цілому так, як описано у попередньому розділі. Одна із змін у попередньо описаному протоколі стосувалася типу використовуваного культурного середовища. Марковані Desmond клітини СНО культивували у безбілковому середовищі CD-CHO [GibcoBRL, каталог №AS21206], доповненому рекомбінантним інсуліном з концентрацією 3мг/л (вихідний продукт з концентрацією 3мг/мл, Gibco-BRL, каталог №AS22057) і 8мМ L-глутаміном (200мМ ви хідний продукт, Gibco-BRL, каталог №25030-081). Після цього трансфіковані клітини відбирали у зазначеному вище середовищі, доповненому генетицином в концентрації 400мкg/мл. У цьому експерименті виконували 20 електропорацій, і одержані продукти поміщали у 96-коміркові планшети для тканинних культур. Клітини росли і виділяли анти-СD23 усього в 68 комірках, причому припускалося, що в усіх з них були клони, що походили з одиночної клітини G418. Дванадцять з цих комірок поміщали у 120-мілілітрові відцентрові колби для подальшого аналізу. Автори вважають, що збільшення кількості клонів, виділених у цьому експерименті (68 у порівнянні з 10 для анти-CD20, як описано у Прикладі 4) зумовлене більш високою ефективністю клонування та більш високим коефіцієнтом виживання клітин, що зростають у середовищі CD-CHO, порівняно до тих, що зростають у середовищі CHO-SS-FMII. Рівні експресії для тих клонів, що їх аналізували в обробленій у центрифузі культурі, становили 0,5-3пкг/к/д, що практично відповідало рівням, які спостерігалися для клонів анти-СD20. Найпродуктивніший клон анти-СD23, названий 4Н12, піддавали ампліфікації з використанням метотрексату - з метою збільшення їхніх рівнів експресії. Цю ампліфікацію виконували у спосіб, аналогічний описаному для клону анти-СD20 у Прикладі 4. Послідовні розчини експоненційно зростаючих клітин 4Н12 поміщали у 96-коміркові планшети для тканинних культур і вирощували у середовищі CD-CHO, доповненому інсуліном у концентрації 3мг/л, 8мМ глутаміном та 30, 35 або 40нМ метотрексатом. Підсумки цього експерименту з ампліфікування наведено у Таблиці 5. Таблиця 5 Підсумки ампліфікації 2Н12 нММТХ 30 35 40 Кільк. аналізованих комірок 100 64 96 Рівень експресії мг/л 96комір. 6-24 4-27 4-20 Кількість поміщ. комірок 8 2 1 Рівень експресії пкг/к/д після центрифуги 10-25 10-15 немає даних Найвищу експресію з одержаних клонів мав клон 30нМ, виділений з планшета, в якому зросли 22 комірки. Цей клон, названий 4Н12 30G5, репродуктивно виділяв 18-22пг антитіла на клітину на добу. Ця такий самий порядок експресії, який спостерігали для першої ампліфікації клону 20F4, спрямованого проти CD20 (клон 20F4-15A5, який продукував 15-18пкг/к/д, як описано у Прикладі 4). Ці дані додатково підтверджують спостереження, згідно з яким ампліфікація на цьому маркованому сайті у СНО є репродуктивною і ефективною. Другу ампліфікацію цієї 30нМ клітинної лінії продовжують розробляти. Прогнозують, що рівня насичення експресії для антитіла анти-СD23 можна досягти за допомогою лише двох стадій ампліфікації, як це було для анти-СD20. Приклад 6 Експресія імуноадгезину у маркованих Desmond клітинах СНО CTLA-4, член суперродини Іg, знаходять на поверхні Т-лімфоцитів, вважаючи, що він відіграє роль у антиген-специфічній активації Т-клітин [Dariavach et al, Eur. J. Immunol., 18:1901-1905 (1988); and Linsley et al, J. Exp. Med., 174:561-569 (1991)]. З метою подальшого вивчення конкретної ролі молекули CTLA-4 у шляху активації створювали розчинний злитий білок, що містив позаклітинний домен CTLA-4, зв'язані зі зрізаною формою постійної ділянки людського IgGI (Linsley et al (Id.). Останнім часом автори експресували цей білок злиття CTLA-4 Іg у векторі експресії ВLЕСН1 з організму ссавців, по хідній плазміди NEOSPLA [Barnett et al, in Antibody Expression and Engineering, H.Y Yang and T. Imanaka, eds., pp.27-40 (1995)]. З цього вектора виділяли фрагмент довжиною 800п.н., що кодує CTLA-4 Іg, і вставляли його між сайтами Sacll та Bglll у Molly. Приготування СТLА-4Іg-МоІІу і електропорацію у клітини СНО з клоном Desmond 15C9 виконували як описано у попередньому прикладі стосовно анти-CD20. Виконували двадцять електропорацій, і продукти поміщали у 96-коміркові планшети з культурою, як описано раніше. З 96-коміркових планшетів виділяли вісімнадцять комірок, що експресували CTLA-4, вміст яких далі проходив стадію центрифугування у 120мілілітрових колбах. Після цього виконували саузерн-блотинговий аналіз на геномні ДНК, виділені з кожного з цих клонів, з метою визначення, скільки гомологічних клонів містили додаткові випадкові інтегранти. Геномну ДНК розщеплювали Bglll і зондували створеним за допомогою PCR міченим дигоксигеніном зондом на постійну ділянку людського IgGI. Результати цього аналізу вказували на те, що 85% клонів CTLA4 є тільки гомологічними інтегрантами; решта 15% містили один додатковий випадковий інтегрант. Цей результат підтверджує висновки щодо експресії анти-СD20, розглянуті вище, де 80% клонів були одиночними гомологічними інтегрантами. Таким чином, автори можуть зробити висновок, що ця система експресії дозволяє репродуктивно одержувати одиночні цільові гомологічні інтегранти принаймні у 80% усіх продукованих клонів. Рівні експресії для гомологічних клонів CTIA4-lg змінювалися в діапазоні 8-12пг/кліт./день. Це є дещо вищим показником, ніж виявлений та розглянутий вище діапазон для клонів антитіла проти CD20 та антитіла проти CD23. Проте авторами раніше було виявлено, що експресія цієї молекули з використанням системи вектора інтронної інсерції також зумовлювала значно вищі рівні експресії, ніж ті, що їх одержано для імуноглобулінів. На даний час автори не можуть пояснити такі результати спостережень. Приклад 7 Спрямування анти-СD20 в іншу марковану Desmond клітинну лінію СНО Як було описано у попередньому розділі, автори одержали 5 одиночних копій маркованих Desmond клітинних ліній СНО (див. Фігури 4 та 5). Для того, щоб показати, що успіх "стратегії" спрямування авторів не є наслідком якоїсь унікальної властивості клону Desmond 15C9 і обмежується тільки цим клоном, автори вводили Molly з анти-СD20 у маркований Desmond клон 9В2 (траса 6 на Фіг.4, траса 1 на Фіг.5). Приготування ДНК Molly і електропорація його у маркований Desmond 9B2 були точно такими, як описано у попередньому прикладі стосовно анти-СD20. Автори одержали один гомологічний інтегрант з цього експерименту. Цей клон поміщали у 120-мілілітрову відцентрову колбу, де він утворював в середньому 1,2пкг анти-СD20/клітину/добу. Це значно нижчий рівень експресії, ніж той, що автори спостерігали у випадку спрямування Molly у маркований Desmond 15C9. Проте це був прогнозований результат, що грунтувався на проведеному авторами нозерн-блотинговому аналізі маркованих Desmond клонів. Як видно на Фіг.5, рівні мРНК з клону 9В2 є значно нижчими, ніж рівні з 15С9, вказуючи на те, що сайт у цьому клоні не є таким активним з погляду на транскрипцію, як у 15С9. Таким чином, цей експеримент не тільки підтверджує репродуктивність системи (виходячи з припущення, що будь-який маркований Desmond сайт може бути спрямований Molly), але він також підтверджує дані за результатами нозерн-блотингового аналізу, згідно з якими сайт у міченому Desmond 15C9 є найактивнішим з погляду на транскрипцію. Виходячи з наведеного вище опису, слід зазначити, що, незважаючи на те, що з метою наведення наочних прикладів тут було описано конкретні варіанти реалізації винаходу, можливі різні зміни, які не відхиляються від об'єму винаходу. Відповідно, винахід не обмежується доданими пунктами формули.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for achieving site specific integration of a desired dna at a target site in a mammalian cell via homologous recombination and vectors for realizing this method
Назва патенту російськоюСпособ интеграции генов на специфические сайты в клетках млекопитающих путем гомологичной рекомбинации и векторы для осуществления этого способа
МПК / Мітки
МПК: C07K 14/705, C12N 15/09, C12N 5/10, C12N 15/85, C12N 15/90, C07K 16/28
Мітки: клітині, спосіб, днк, застосування, ссавця, векторна, бажаної, сайті, vitro, цільовому, способу, геномі, вказаного, інсерції, здійснення, система
Код посилання
<a href="https://ua.patents.su/25-72436-sposib-inserci-bazhano-dnk-na-cilovomu-sajjti-v-genomi-klitini-ssavcya-in-vitro-vektorna-sistema-ta-zastosuvannya-dlya-zdijjsnennya-vkazanogo-sposobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб інсерції бажаної днк на цільовому сайті в геномі клітини ссавця in vitro, векторна система та її застосування для здійснення вказаного способу</a>
Попередній патент: Заміщені азотвмісні гетероцикли як інгібітори р38 протеїнкінази
Наступний патент: Пристрій для перевантаження сільськогосподарських матеріалів із збиральної машини на транспортний контейнер
Випадковий патент: Розпилювальна сушильна установка для рідких харчових продуктів