С10-циклопентилкарбонілокси таксани, фармацевтична композиція на їх основі та спосіб інгібування росту пухлин
Формула / Реферат
1. Таксан, що має формулу:
 ,
,
де Х3 є тієніл, Ас є ацетил, a Bz є бензоїл.
2. Таксан за п. 1, що має структуру:
 .
.
3. Таксан за п. 1, в якому групи-замісники: гідроксигрупа в положенні С7 і циклопентилкарбонілоксигрупа в положенні С10 - обидві мають бета-стереохімічну конфігурацію.
4. Фармацевтична композиція, що містить таксан за будь-яким з пп. 1-3 та принаймні один фармацевтично прийнятний носій.
5. Композиція за п. 4, яка відрізняється тим, що концентрація таксану сягає між близько 0,01 мг/мл і 10 мг/мл.
6. Композиція за п. 4, яка відрізняється тим, що вона виготовлена у вигляді одноразової дозованої лікарської форми для перорального застосування і що дозована лікарська форма містить щонайменше 20 мг таксану на 1 м2 площі поверхні тіла пацієнта.
7. Композиція за п. 6, яка відрізняється тим, що дозована лікарська форма містить між близько 25 мг і близько 400 мг таксану на 1 м2 площі поверхні тіла пацієнта.
8. Композиція за п. 7, яка відрізняється тим, що дозована лікарська форма містить між близько 50 мг і близько 200 мг таксану на 1 м2 площі поверхні тіла пацієнта.
9. Композиція за п. 4, яка відрізняється тим, що вона виготовлена у вигляді одноразової дозованої лікарської форми для парентерального застосування і що дозована лікарська форма містить щонайменше 20 мг таксану на 1 м2 площі поверхні тіла пацієнта.
10. Композиція за п. 9, яка відрізняється тим, що дозована лікарська форма містить між близько 40 мг і близько 400 мг таксану на 1 м2 площі поверхні тіла пацієнта.
11. Композиція за п. 10, яка відрізняється тим, що дозована лікарська форма містить між близько 60 мг і близько 350 мг таксану на 1 м2 площі поверхні тіла пацієнта.
12. Композиція за п. 4, яка відрізняється тим, що вона містить до близько 10 % етанолу.
13. Композиція за п. 12, яка є композицією для перорального застосування.
14. Композиція за п. 13, яка відрізняється тим, що вона виготовлена у формі перорального розчину.
15. Композиція за п. 14, яка відрізняється тим, що вона містить щонайменше близько 90 % дистильованої води.
16. Композиція за п. 15, яка відрізняється тим, що вона містить менше ніж близько 10 % сурфактанта.
17. Композиція за п. 16, яка відрізняється тим, що сурфактант є вибраним з групи, яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію.
18. Композиція за п. 12, яка є композицією для парентерального застосування.
19. Композиція за п. 18, яка відрізняється тим, що вона виготовлена у формі емульсії.
20. Композиція за п. 19, яка відрізняється тим, що вона виготовлена шляхом комбінування етанольного розчину та жирової емульсії.
21. Композиція за п. 20, яка відрізняється тим, що жирова емульсія містить від близько 10 % до близько 20 % жиру.
22. Композиція за п. 18, яка відрізняється тим, що вона виготовлена у формі розчину.
23. Композиція за п. 22, яка відрізняється тим, що вона містить щонайменше близько 85 % сольового розчину.
24. Композиція за п. 23, яка відрізняється тим, що вона містить менше ніж близько 10 % сурфактанта.
25. Композиція за п. 24, яка відрізняється тим, що сурфактант є вибраним з групи, яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію.
26. Спосіб інгібування росту пухлин у ссавців, що включає введення терапевтично ефективної кількості фармацевтичної композиції, який відрізняється тим, що фармацевтична композиція містить таксан за п. 1 та принаймні один фармацевтично прийнятний носій.
27. Спосіб за п. 26, в якому вказану фармацевтичну композицію застосовують перорально.
28. Спосіб за п. 26, в якому вказану фармацевтичну композицію застосовують парентерально.
29. Спосіб за п. 28, який відрізняється тим, що ссавця попередньо лікують дексаметазоном, дифенгідраміном або іншим препаратом, що мінімізує відновлювальні реакції від застосування фармацевтичної композиції, а фармацевтична композиція містить сурфактант.
30. Спосіб за п. 29, який відрізняється тим, що сурфактант є вибраним з групи,яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію.
31. Спосіб за п. 26, в якому пухлиною є рак молочної залози, легенів, підшлункової залози, ободової кишки, яєчка чи простати.
32. Спосіб за п. 31, в якому пухлиною є аденокарцинома підшлункової залози Panc-1 чи карцинома ободової кишки НТ-29.
33. Спосіб за п. 26, в якому пухлина є резистентною до паклітакселу.
34. Спосіб за п. 33, в якому пухлина є карциномою ободової кишки людини.
35. Спосіб за п. 34, в якому пухлина є карциномою ободової кишки людини VM46.
36. Спосіб за п. 34, в якому пухлина є карциномою ободової кишки людини DLD-1.
Текст
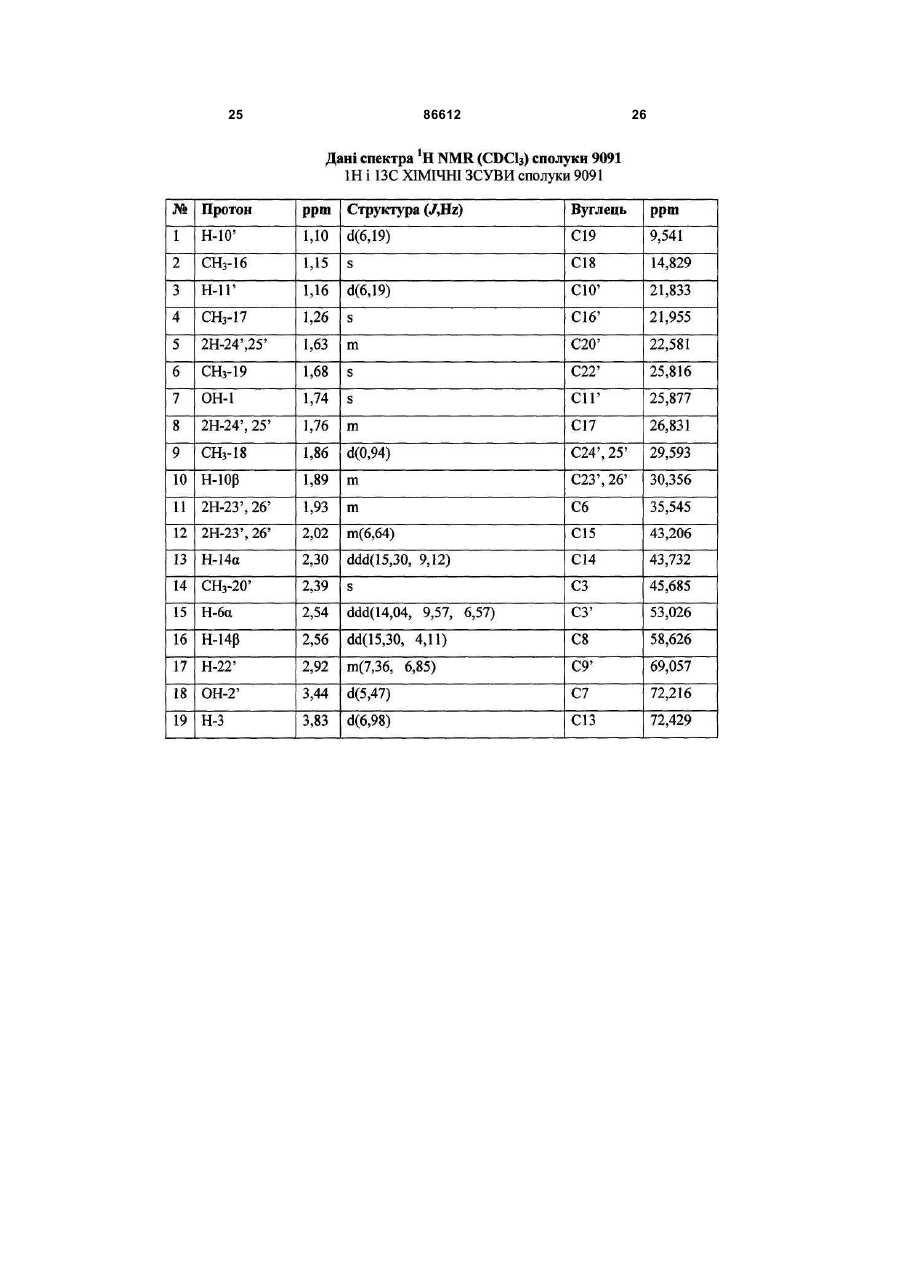
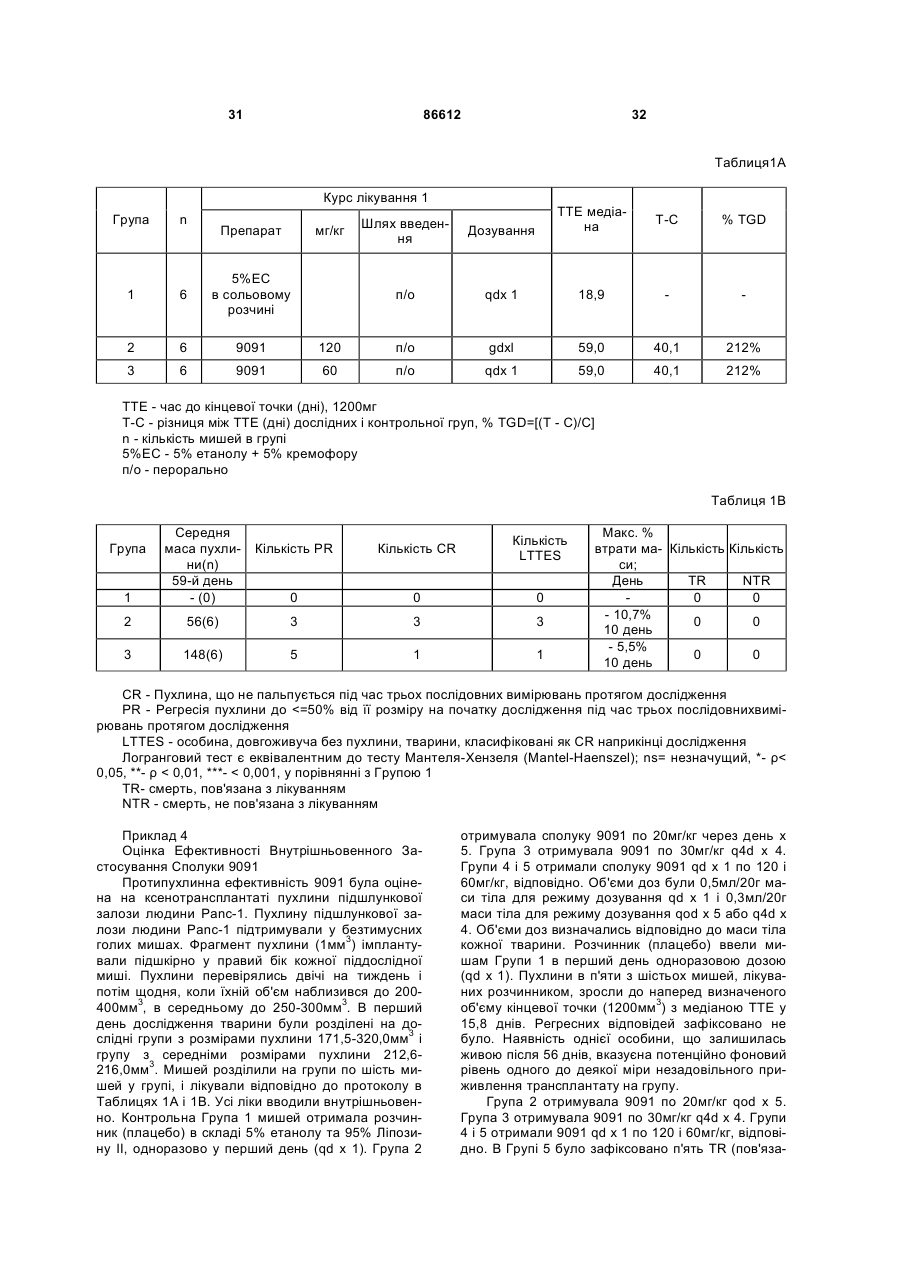
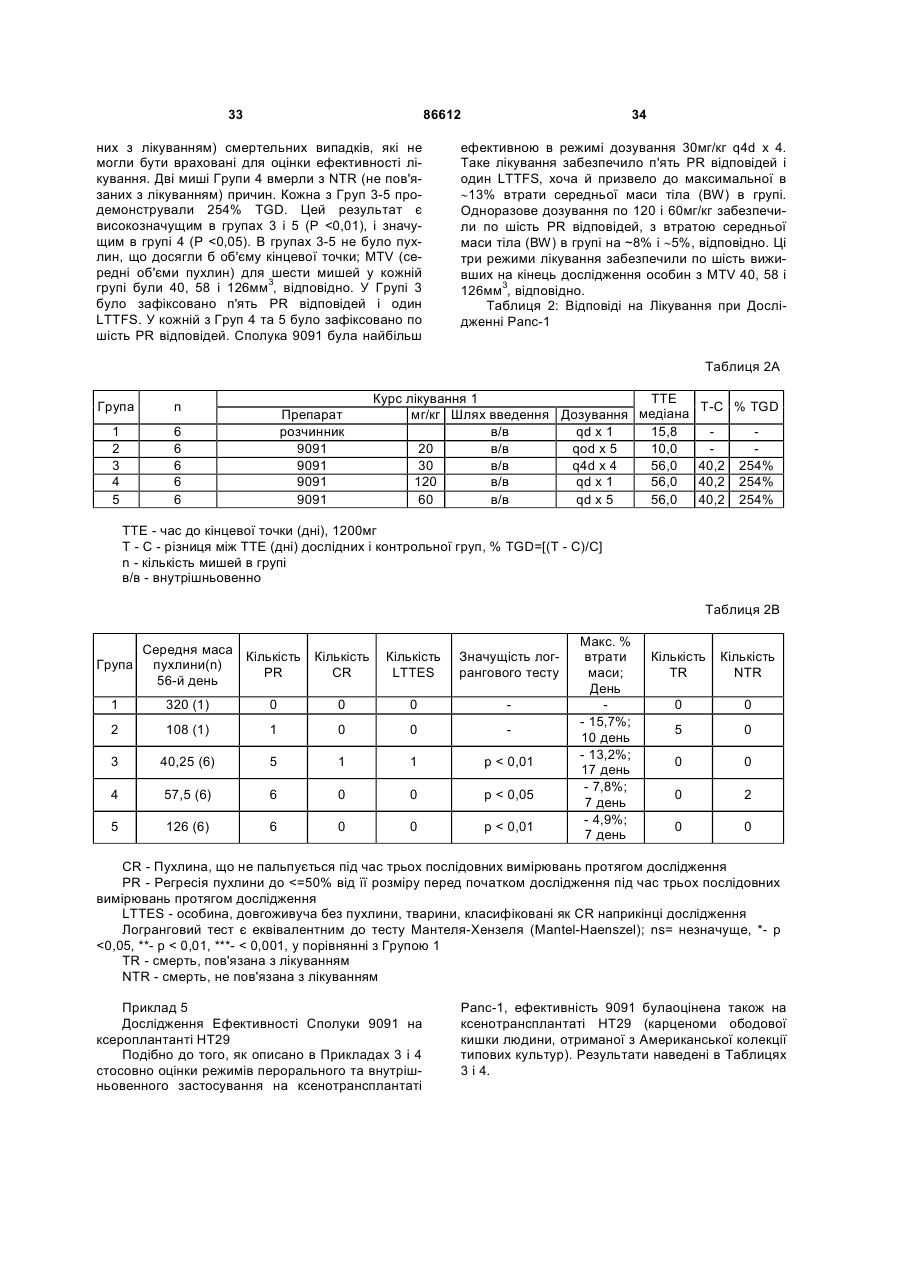
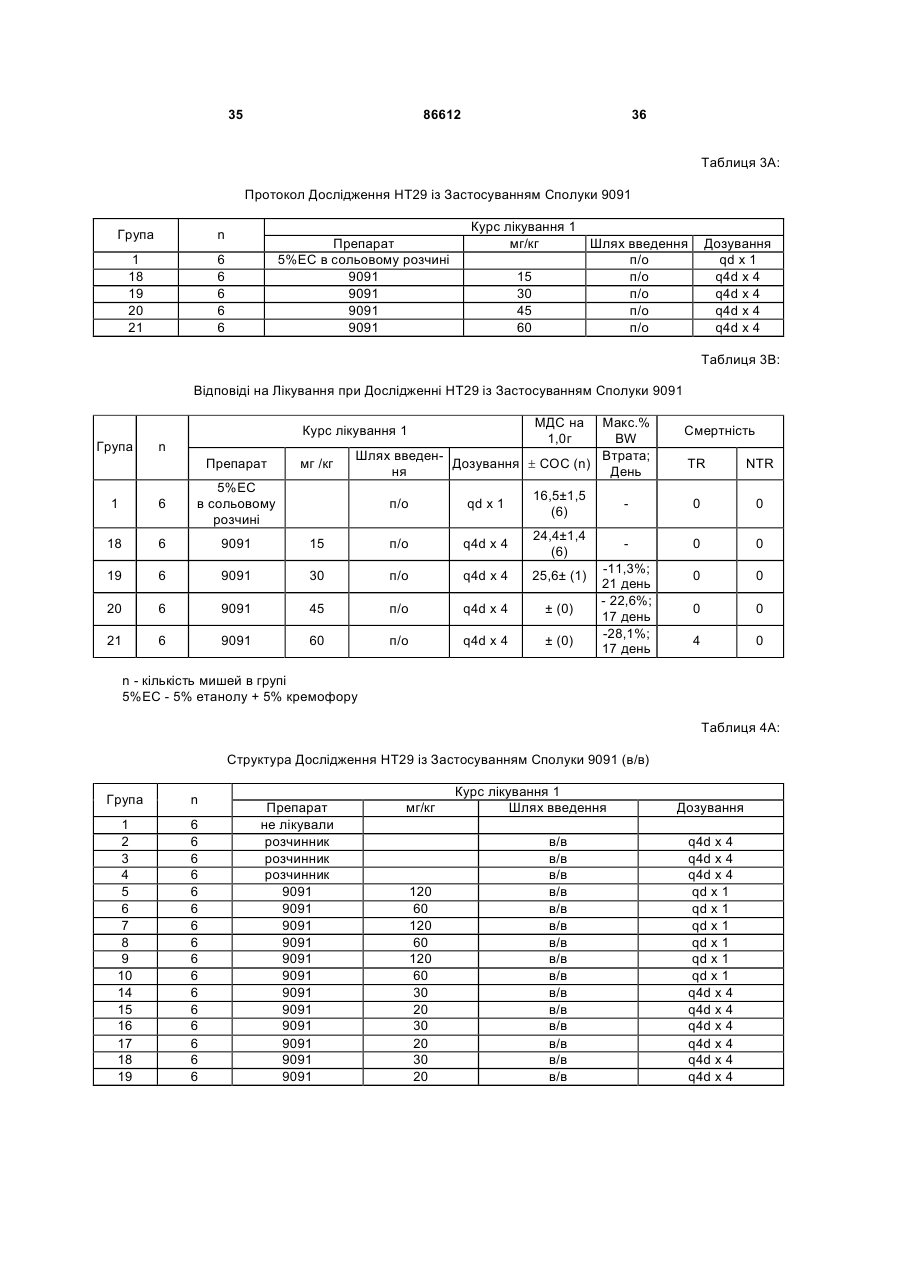
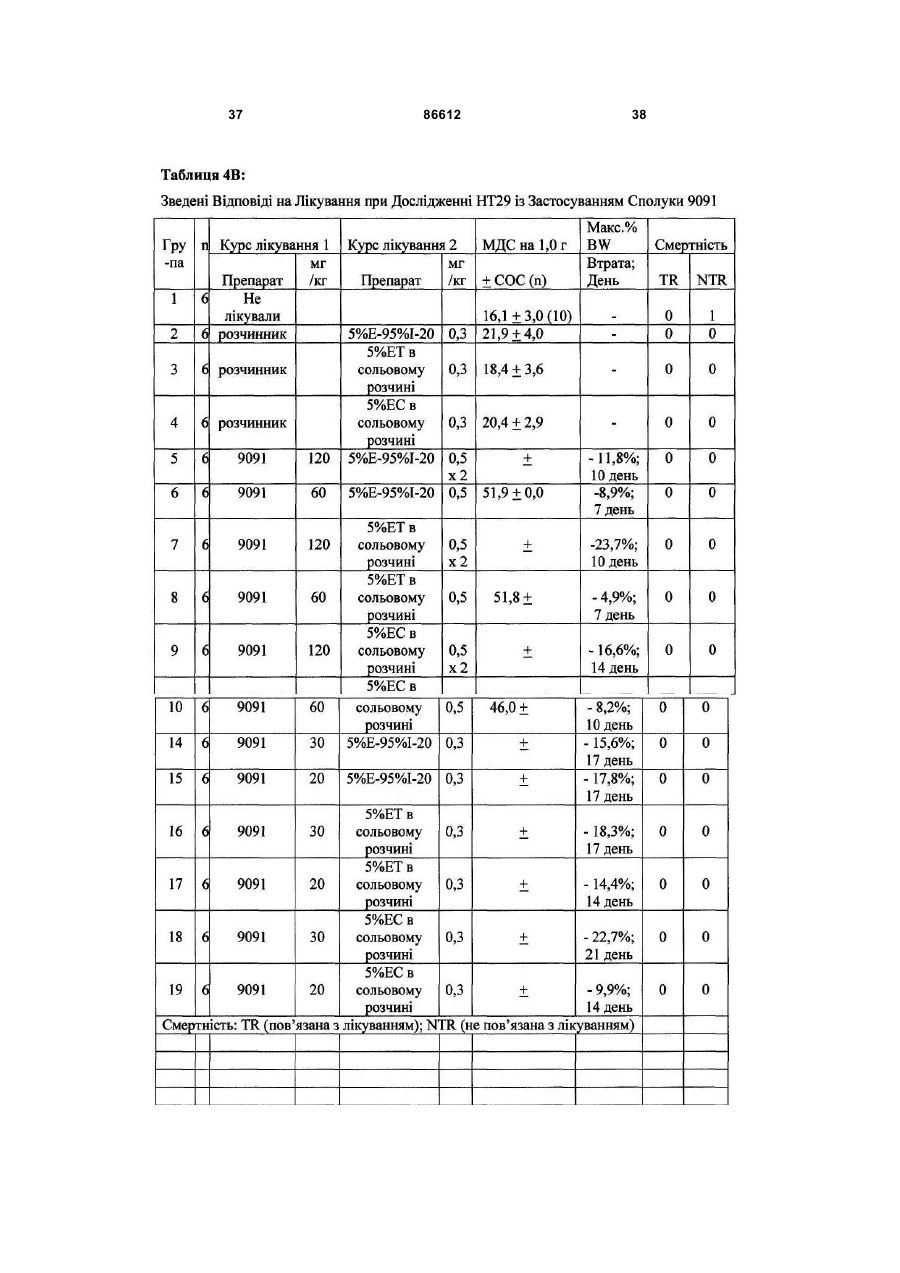
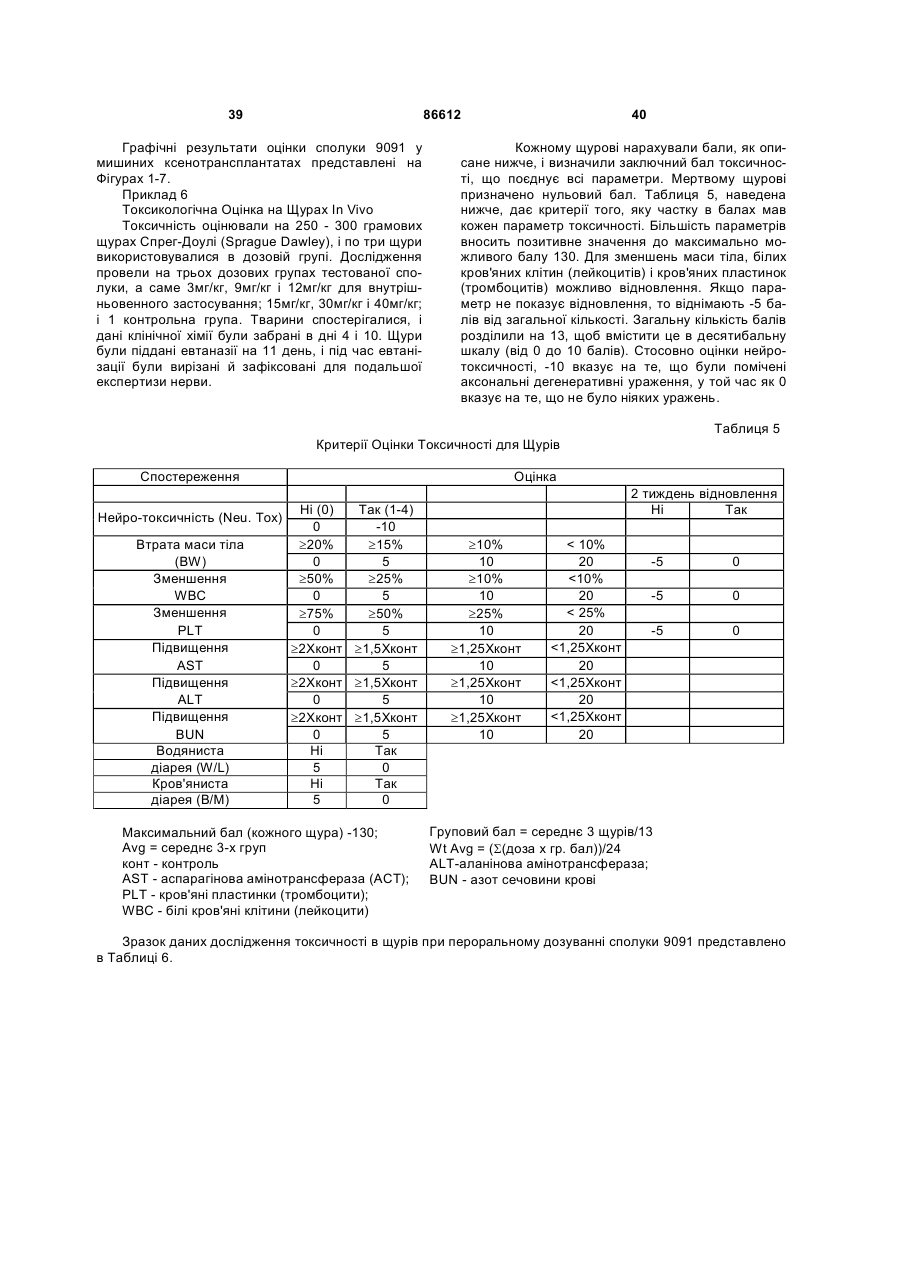
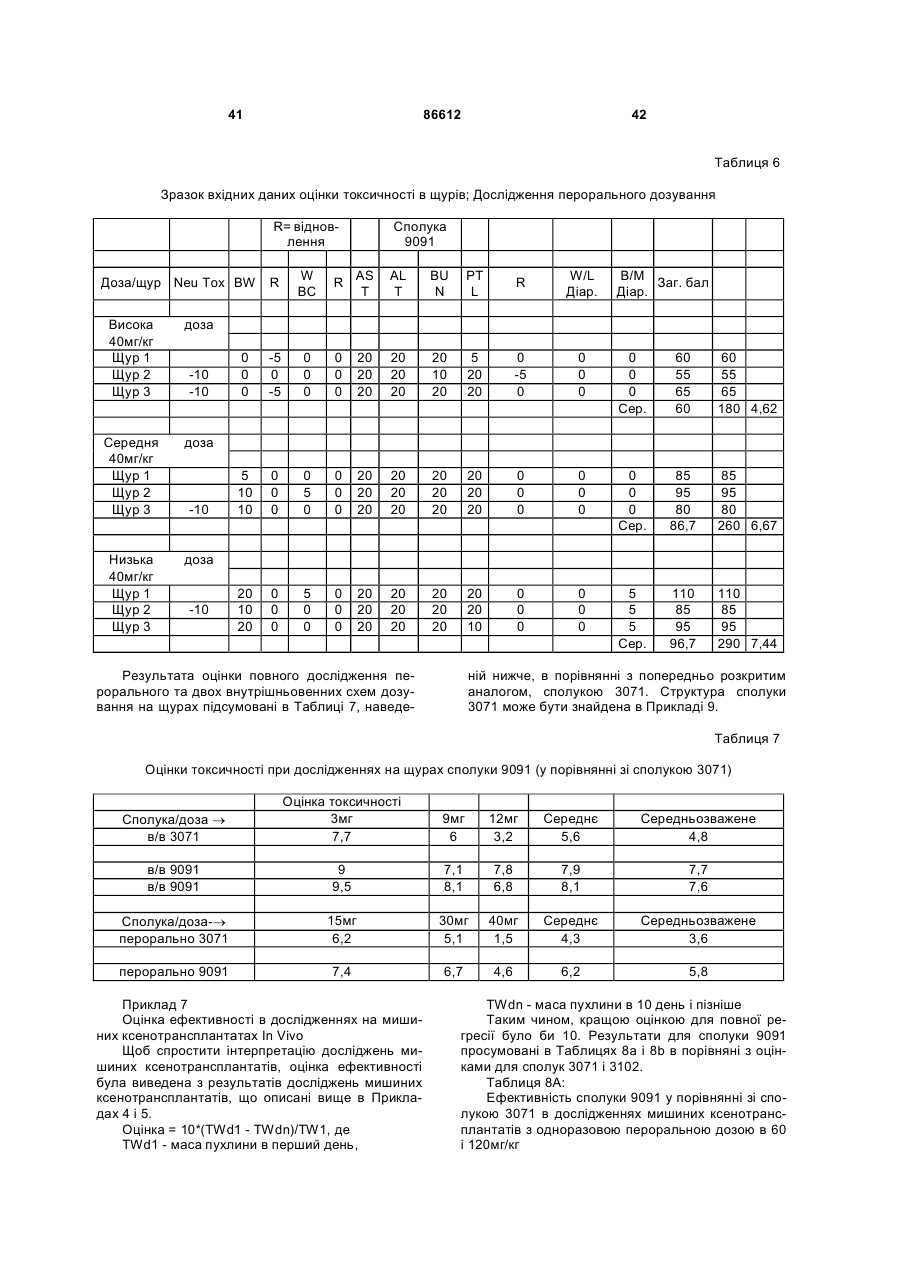
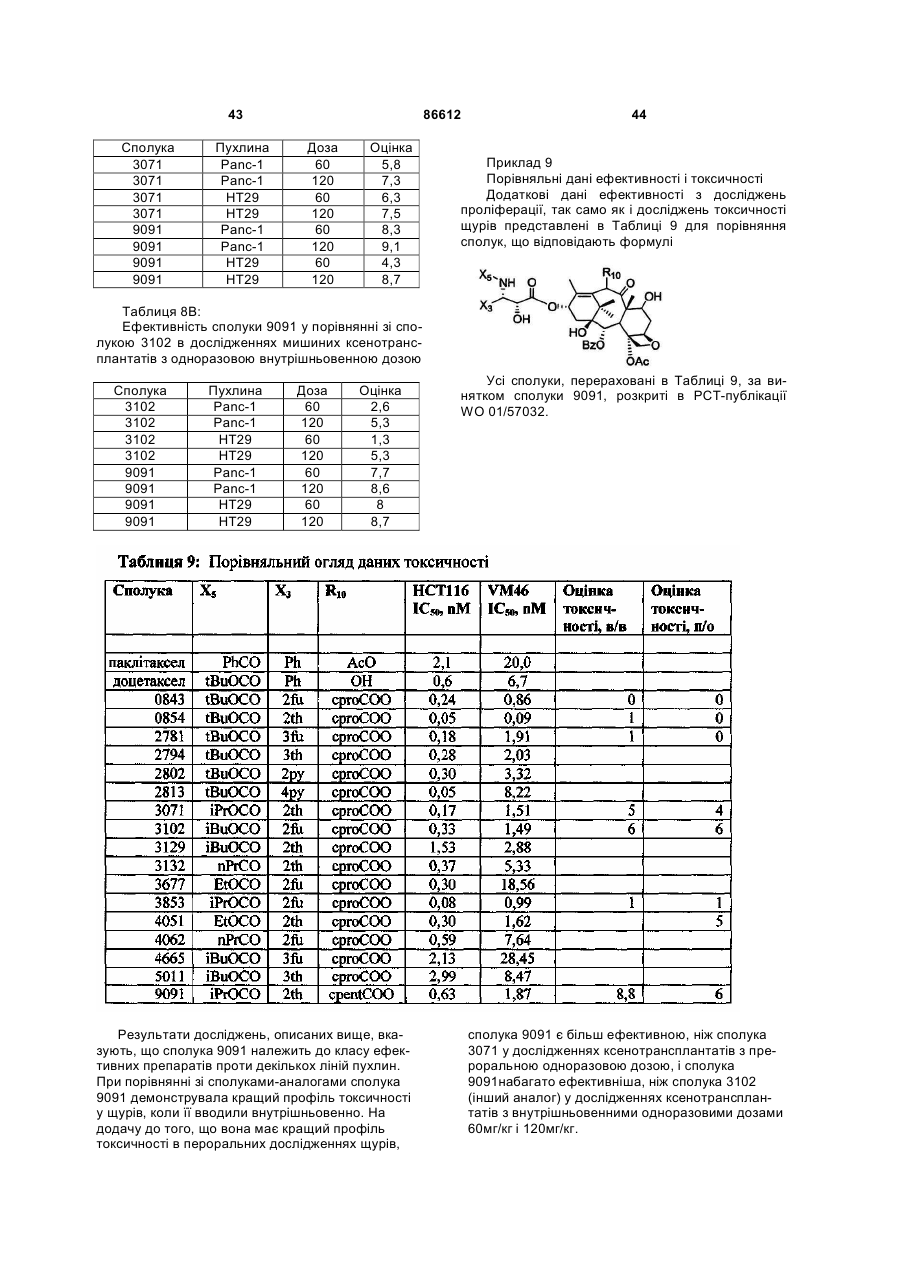
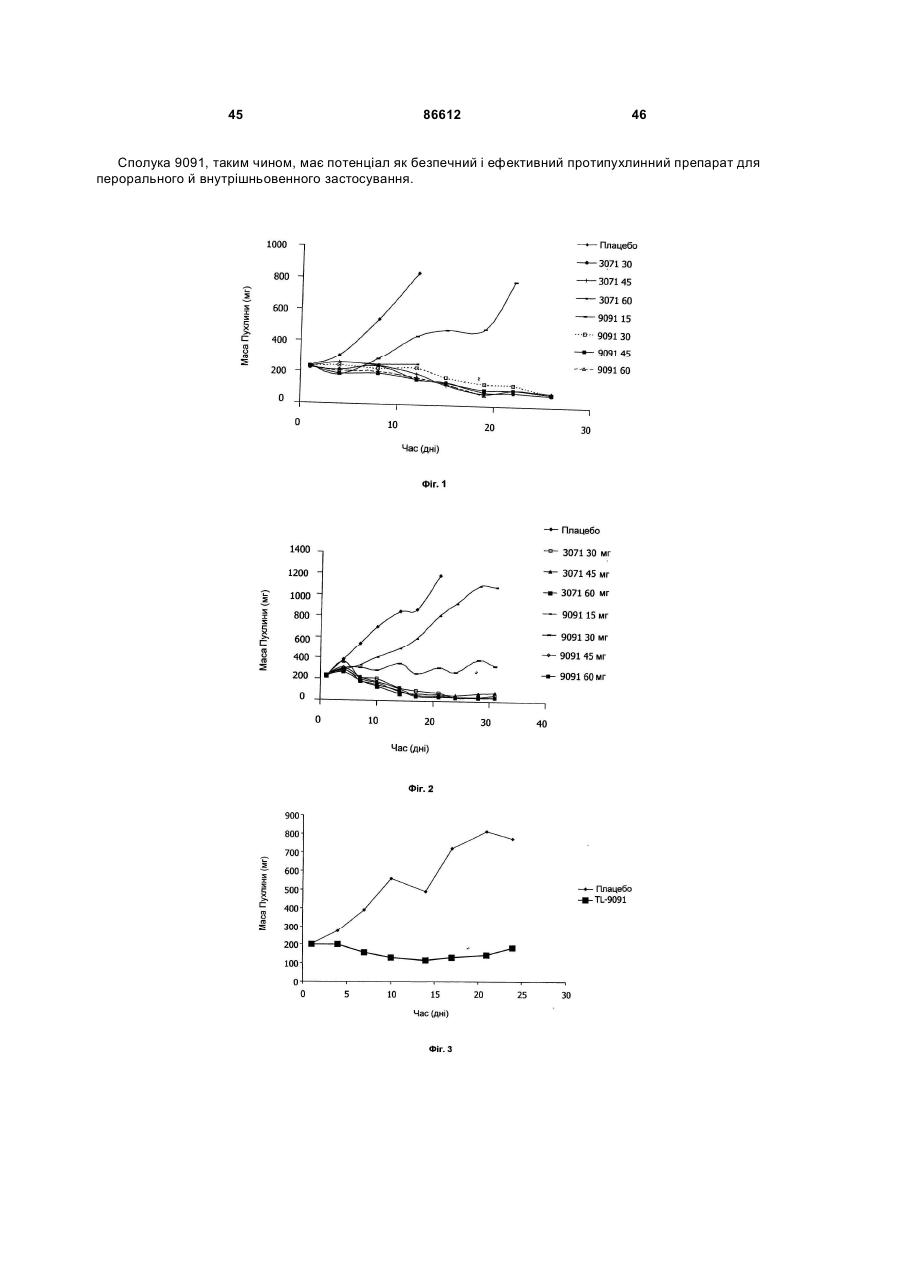
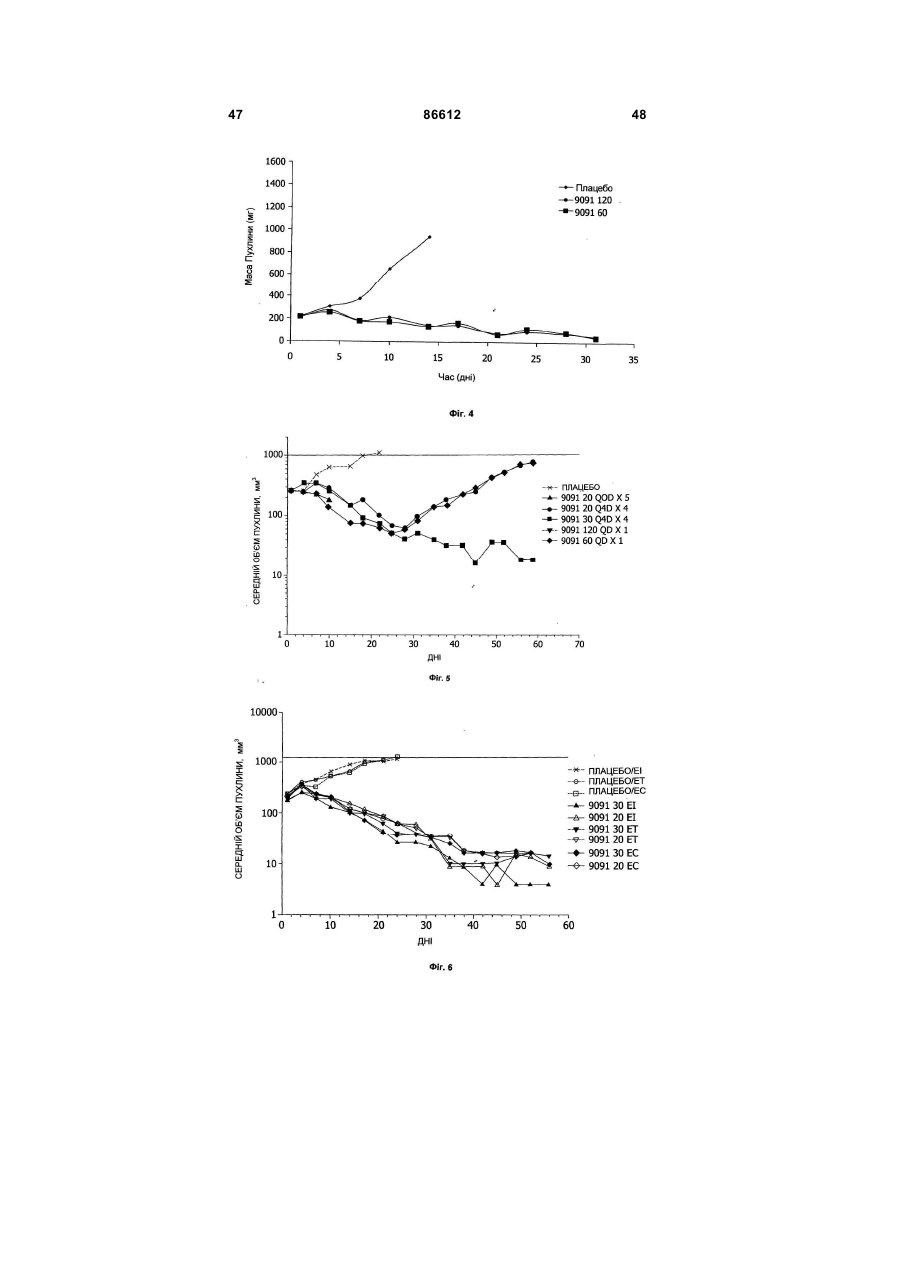
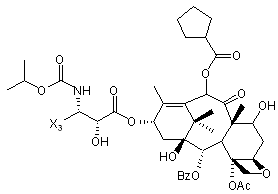
1. Таксан, що має формулу: 3 86612 4 40мг і близько 400 мг таксану на 1 м2 площі поверхні тіла пацієнта. 11. Композиція за п. 10, яка відрізняється тим, що дозована лікарська форма містить між близько 60мг і близько 350мг таксану на 1м2 площі поверхні тіла пацієнта. 12. Композиція за п. 4, яка відрізняється тим, що вона містить до близько 10% етанолу. 13. Композиція за п. 12, яка є композицією для перорального застосування. 14. Композиція за п. 13, яка відрізняється тим, що вона виготовлена у формі перорального розчину. 15. Композиція за п. 14, яка відрізняється тим, що вона містить щонайменше близько 90% дистильованої води. 16. Композиція за п. 15, яка відрізняється тим, що вона містить менше ніж близько 10% сурфактанта. 17. Композиція за п. 16, яка відрізняється тим, що сурфактант є вибраним з групи, яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію. 18. Композиція за п. 12, яка є композицією для парентерального застосування. 19. Композиція за п. 18, яка відрізняється тим, що вона виготовлена у формі емульсії. 20. Композиція за п. 19, яка відрізняється тим, що вона виготовлена шляхом комбінування етанольного розчину та жирової емульсії. 21. Композиція за п. 20, яка відрізняється тим, що жирова емульсія містить від близько 10% до близько 20% жиру. 22. Композиція за п. 18, яка відрізняється тим, що вона виготовлена у формі розчину. 23. Композиція за п. 22, яка відрізняється тим, що вона містить щонайменше близько 85% сольового розчину. 24. Композиція за п. 23, яка відрізняється тим, що вона містить менше ніж близько 10% сурфактанта. 25. Композиція за п. 24, яка відрізняється тим, що сурфактант є вибраним з групи, яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію. 26. Спосіб інгібування росту пухлин у ссавців, що включає введення терапевтично ефективної кількості фармацевтичної композиції, який відрізняється тим, що фармацевтична композиція містить таксан за п. 1 та принаймні один фармацевтично прийнятний носій. 27. Спосіб за п. 26, в якому вказану фармацевтичну композицію застосовують перорально. 28. Спосіб за п. 26, в якому вказану фармацевтичну композицію застосовують парентерально. 29. Спосіб за п. 28, який відрізняється тим, що ссавця попередньо лікують дексаметазоном, дифенгідраміном або іншим препаратом, що мінімізує відновлювальні реакції від застосування фармацевтичної композиції, а фармацевтична композиція містить сурфактант. 30. Спосіб за п. 29, який відрізняється тим, що сурфактант є вибраним з групи, яка містить полісорбат 80, поліетоксиловану рицинову олію та їх комбінацію. 31. Спосіб за п. 26, в якому пухлиною є рак молочної залози, легенів, підшлункової залози, ободової кишки, яєчка чи простати. 32. Спосіб за п. 31, в якому пухлиною є аденокарцинома підшлункової залози Panc-1 чи карцинома ободової кишки НТ-29. 33. Спосіб за п. 26, в якому пухлина є резистентною до паклітакселу. 34. Спосіб за п. 33, в якому пухлина є карциномою ободової кишки людини. 35. Спосіб за п. 34, в якому пухлина є карциномою ободової кишки людини VM46. 36. Спосіб за п. 34, в якому пухлина є карциномою ободової кишки людини DLD-1. Даний винахід стосується нових таксанів, що мають корисність як протипухлинні агенти. Таксани сімейства терпенів, до якого належать бакатин III та таксол, звичайно відомий також як палітаксел, є предметом значного інтересу як з біологічної, так і з хімічної точки зору. Таксол, зокрема, використовується як протираковий хіміотерапевтичний агент з широким діапазоном пухлинно-інгібуючої активності. Таксол має конфігурацію 2'R, 3'S та наступну структурну формулу: чайно відомий як доцетаксел (Taxotere®), має наступну структурну формулу: де Ас є ацетил, a Bz є бензоїл. Колін (Colin) та інші в описі до патенту США №4814470 повідомляють, що деякі аналоги таксолу мають активність, яка значно перевищує активність таксолу. Один із таких аналогів, що зви Незважаючи на те, що таксол і доцетаксел є придатними хіміотерапевтичними агентами, існує межа їхньої ефективності, в тому числі є обмеженою їхня ефективність проти деяких типів раку, та має місце токсичність для суб'єктів при застосуванні їх у різних дозах. Тому залишається потреба у додаткових хіміотерапевтичних агетах з підвищеною ефективністю та з меншою токсичністю. Таким чином, однією з задач даного винаходу є запровадження таксанів, що вигідно відрізняються від таксолу та доцетакселу в плані їх ефективності як протипухлинних агентів та в плані токсич 5 ності. Загалом, ці таксани є заміщеними циклопентиловим ефіром при С10, кето-групою при С9, гідрокси-групою при С7, тієнілом при С3' та ізопропоксикарбаматом при С3'. Отже, даний винахід стосується таксанів, по суті, їх проліків, фармацевтичних композицій, що містять таксан і фармацевтично прийнятний носій, способів їх застосування та до способів приготування медикаментів, що містять таксани чи проліки. Інші задачі та переваги даного винаходу будуть частково очевидними, а частково будуть вказані далі. Фігура 1 зображує криві середнього росту пухлини в мишей, яких лікували сполукою 9091 у порівнянні зі сполукою 3071, при дослідженні клітинної лінії Раnс-1 (пероральні дози q4dX4). Фігура 2 зображує криві середнього росту пухлини в мишей, яких лікували сполукою 9091 в порівнянні зі сполукою 3071, при дослідженні клітинної лінії НТ29 (пероральні дози q4dX4). Фігура 3 зображує криві середнього росту пухлини в мишей, яких лікували сполукою 9091 при дослідженні клітинної лінії НТ29 (пероральні одноразові дози по 60мг/кг). Фігура 4 зображує криві середнього росту пухлини в мишей, яких лікували сполукою 9091 при дослідженні клітинної лінії Раnс-1 (пероральні одноразові дози по 60мг/кг і 120мг/кг). Фігура 5 зображує криву середнього росту пухлини в мишей, яких лікували в/в (внутрішньовенними) дозами сполуки 9091 при дослідженні клітинної лінії НТ29. Фігура 6 зображує криві середнього росту пухлини в мишей, яких лікували плацебо (розчинами) чи q4dX4 в/в дозами сполуки 9091 в 5%Е-95%І-20, 5%ЕТ в сольовому розчині, та 5%ЕС в сольовому розчині, при дослідженні клітинної лінії НТ29; (Е етанол; І -інтраліпід; Τ - твін; С - кремофор; наприклад, 5% ЕС в сольовому розчині є 5% етанолу та 5% кремофору в сольовому розчині). Фігура 7 зображує криві середнього росту пухлини в мишей, яких лікували в/в дозами сполуки 9091 при дослідженні клітинної лінії Раnс-1. Таксан згідно з винаходом, що заявляється, має наступну хімічну структуру: де Х3 є тієніл, Ас є ацетил, а С7 гідрокси замісник і С10 циклопентилкарбонілокси замісник незалежно один від одного мають альфа чи бета стереохімічну конфігурацію. В одному із втілень винаходу Х3 є 2-тієніл. В одному з кращих втілень винаходу Х3 є 2-тієніл, а С7 гідрокси замісник і С10 циклопентилкарбонілокси замісник обидва мають бета стереохімічну конфігурацію. 86612 6 Сполуки згідно з винаходом, що заявляється, є більш активними проти ракових утворень, ніж таксани, які традиційно застосовуються, відносно певних типів пухлин, включаючи лінії пухлин, що є чутливим й стійкими до паклітакселу (таксолу). Сполуки згідно з винаходом, що заявляється, є однаково прийнятними як для перорального, так і внутрішньовенного застосування й можуть бути ефективними як одноразова чи багаторазова доза із покращеними профілями токсичності. Сполуки згідно з винаходом, що заявляється, також є еффективними з некремофорними носіями (наповнювачами). Таксани згідно з винаходом, що заявляється, можуть бути виготовлені шляхом оброблення βлактаму алкоксидом, що має таксанові тетрациклічні ядра та оксид металу як замісник при С-13, з утворенням сполук, які мають β-амідоефірний замісник при С-13 (як описано більш докладно в патенті Холтона(Нокоп) США №5466834), з наступним відщепленням гідрокси-захисних груп, βлактам має наступну структурну формулу (1): де P2 є гідрокси-захисною групою, Х3 є тієніл і Х5 є ізопропоксикарбоніл, а алкоксид має структурну формулу (2): де Μ є металом або амонієм, Р7 є гідроксизахисною групою, a R10 є циклопентилкарбонілокси. Алкоксид структурної формули (2) може бути одержаний із 10-деацетилбакатину III (або його похідного) шляхом селективного захисту С7 гідроксильної групи, наступної естерифікації С10 гідроксильної групи та наступною обробкою амідом металу. В одному з втілень даного винаходу С7 гідроксильна група 10-деацетилбакатину III є селективно захищена силільною групою, як це описано, наприклад, Денісом (Denis) та інш. (J. Am. Chem. Soc, 1988, 110, 5917). Загалом, силілувальні агенти можуть використовуватись кожен окремо чи в комбінації з каталітичною кількістю основи, такої як основа лужного металу. Як альтернатива, С10 гідроксильна група таксану може бути селективно ацилована у відсутності основи, як описано, наприклад, Холтоном та інш. (Holton et al.) в міжнародній патентній заявці РСТ № WO 99/09021. Ацилювальні агенти, що можуть використовуватись для селективного ацилювання С10 гідроксильної групи таксану, містять заміщені чи незаміщені алкільні чи арильні ангідриди. Хоча ацилювання С10 гідроксильної групи 7 таксану відбувається адекватним чином для багатьох ацилювальних агентів, було встановлено, що швидкість реакції може бути збільшена включенням кислоти Льюїса в реакційну суміш. Кращі кислоти Льюїса містять хлорид цинку, хлорид олова, трихлорид церію, хлорид міді, трихлорид лантану, трихлорид диспрозію та трихлорид ітербію. Хлорид цинку чи трихлорид церію є кращими, якщо ацилювальним агентом є ангідрид. Процеси одержання та розділення βлактамового вихідного матеріалу, загалом, добре відомі. Наприклад, β-лактам може бути одержаний, як описано Холтоном та інш. (Holton et al.) у патенті США №5430160 (кол. 9, рядки 2-50) або Холтоном (Holton) у патенті США №6649632 (кол. 7, рядок 45 - кол. 8, рядок 60), які обидва є включеними таким чином посиланнями на них у повному обсязі. Утворені в результаті енатіомерні суміші β-лактамів можуть бути розділені шляхом стереоселективного гідролізу з використанням ліпази чи ензиму, як описано, наприклад, у патентах Пателя (Patel) США №5879929 (кол. 16, рядок 1 - кол. 18, рядок 27) чи США №5567614, або гомогенату печінки, як описано, наприклад, у патенті Холтона (Holton) США №6548293 (кол. 3, рядки 30 - 61). Так, наприклад, у патенті США №6649632 розкрито приготування β-лактаму, який має фурильний замісник в С4 положенні β-лактаму. З деякими змінами, що є очевидними для фахівців, може бути приготовлений β-лактам, який має тієнільний замісник в С4 положенні, як це поілюстровано у вказаних патентах і як буде далі розкрито в Прикладі 1. Сполуки згідно з винаходом, що заявляється, можуть бути передбачені в формі проліків. Взагалі, фармацевтично прийнгятна похідна чи проліки - це будь-яка фармацевтично прийнятна сіль, ефір, сіль ефіру чи інша похідна сполуки згідно з винаходом, яка після введення отримувачеві є спроможною до забезпечення, безпосередньо чи опосередковано, сполуки згідно з винаходом або інгібіторно активного метаболіту чи його залишку. Особливо сприятливі похідні чи проліки - ті, що підвищують біологічну засвоюваність сполук згідно з винаходом, коли такі сполуки вводять пацієнту (наприклад, дозволяючи сполуці, яку вводять перорально, бути більш готовою до абсорбувння кров'ю), чи такі, що збільшують поставку вихідної сполуки до біологічного відділу (наприклад, мозкова чи лімфатична система) відносно вихідних різновидів. Фармацевтично прийнятні проліки включають, але не обмежуються цим вичерпно, таксани за винаходом, що заявляється, дериватизовані з однією чи декількома з наступних груп: фосфати, півалоїлоксиметил, ацетоксиметил, фталідил, інданіл, метоксиметил, мезилат метилпіридинія, бікарбонат, онійні солі, фосфонооксиметилкарбонат, цинамат, амінокислота, бензоїл, ацил, тіоарил, поліетилен гліколі, поліалкіленоксид, декстран, полівінілові спирти, полімери на основі вуглеводів, олігопептід, поліглутаминова кислота, поліамінова кислота, онійні солі 2галогенизованих азааренів, високополімерний аміноцукор, тощо. Положення в молекулі таксану згідно з винаходом, придатні для утворення пролі 86612 8 ків, включають, але не обмежуються цим вичерпно, положення С2’ та положення С7. Різні види проліків є відомими. Приклади таких похідних проліків див.: (a) Design of Prodrags, edited by Η. Bundgaard, (Elsevier, 1985) and Methods in Enzymology, Vol. 42, p. 309-396, edited by K. Widder, et al. (Acamedic Press, 1985); (b) A Textbook of Drug Design and Development, edited by Krosgaard-Larsen and H. Bundgaard, Chapter 5, "Design and Application of Prodrugs," by H. Bundgaard, p. 113-191 (1991); (с) Н. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992); (d) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77,285 (1988); and (e) N. Kakeya, et al., Chem Phar Bull, 32, 692 (1984). Сполуки згідно з винаходом, що заявляється, є придатними для інгібування росту пухлин у ссавців, включаючи людей, і застосовуються переважно у формі фармацевтичних композицій, що містять ефективну протипухлинну кількість сполуки згідно з даним винаходом у комбінації з, принаймні, одним фармацевтично чи фармакологічно прийнятним носієм. Носій, відомий також спеціалістам як наповнювач, розріджувач, допоміжний засіб, ад'ювант або розчинник, являє собою речовину, яка є фармацевтично інертною, надає відповідну консистенцію чи форму даній композиції, та не послабляє терапевтичної ефективності протипухлинних сполук. Носій є "фармацевтично чи фармакологічно прийнятним", якщо він не викликає несприятливих, алергічних або інших небажаних реакцій, коли вживається за призначенням ссавцем або людиною. Фармацевтичні композиції, що містять протипухлинні сполуки згідно з даним винаходом, можуть бути складені у будь-який звичайний спосіб. Відповідний рецепт залежить від обраної схеми їх введення. Композиції згідно з даним винаходом можуть призначатися для будь-якої схеми їх введення у такій мірі, наскільки доступною при цьому є потрібна тканина. Придатні схеми введення включають, але не обмежуються цим вичерпно, пероральне, парентеральне (наприклад, внутрішньовенне, внутрішньоартеріальне, підшкірне, ректальне, внутрішньом'язове, внутрішньоорбітальне, внутрішньокапсулярне, внутрішньоспінальне, внутрішньоперитонеальне чи внутрішньогрудне), місцеве (назальне, черезшкірне, внутрішньоочне), внутрішньоміхурове, внутрішньооболонкове, ентеральне, легеневе, внутрішньолімфатичне, внутрішньопорожнинне, вагінальне, трансуретральне, внутрішньошкірне, вушне, інтрамамарне, трансбукальне, ортотопічне, внутрішньосуглобове, внутрішньотрахеальне, черезранове, черезшкірне, ендоскопічне, через слизову оболонку, під'язичне та кишкове введення. Фармацевтично прийнятні носії для застосування в композиціях згідно з даним винаходом добре відомі звичайним спеціалістам і вибираються з урахуванням багатьох факторів: особливості використовуваної протипухлинної сполуки, її концентрація, стабільність та наперед призначена біологічна придатність; захворювання, розлад чи стан, що будуть лікуватися цією композицією; суб'єкт, його вік, розміри та загальний стан; схема 9 введення ліків. Придатні носії легко визначаються звичайним спеціалістом (див., наприклад, J.G.Nairn, в Remington's Pharmaceutical Science (A.Gennaro, ed.), Mack Publishing Co., Easton, Pa., (1985) pp. 1492-1517, зміст якої приєднується до цього посиланням). Композиції переважно призначаються як таблетки, дисперсні порошки, пілюлі, капсули, гелеві капсули, гелі, ліпосоми, гранули, розчини, суспензії, емульсії, сиропи, еліксири, драже або інші дозовані форми, які можуть застосовуватись для перорального пройому. Технічні прийоми та складові для виготовлення пероральних дозованих форм, що можуть бути використані в даному винаході, описані в таких публікаціях: 7 Modern Pharmaceutics. Chapters 9 and 10 (Banker & Rhodes, Editors, 1979); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1981); and Ansel, Introduction to Pharmaceutical Dosage Forms 2nd Edition (1976). Згідно з винаходом композиції для перорального застосування містять ефективну кількість протипухлинної сполуки згідно з винаходом у фармацевтично прийнятному носієві. Придатні носії для твердих дозованих форм містять цукри, крохмалі та інші загальноприйнятні речовини, в тому числі лактозу, тальк, сахарозу, желатин, карбоксиметилцелюлозу, агар, манітол, сорбітол, фосфат кальцію, карбонат кальцію, карбонат натрію, каолін, альгінову кислоту, акацієву смолу, кукурудзяний крохмаль, картопляний крохмаль, натрієвий сахарин, карбонат магнію, трагакант, мікрокристалічну целюлозу, колоїдний діоксид кремнію, кроскармелоз натрію, стеарат магнію та стеаринову кислоту. Крім того, такі тверді дозовані форми можуть бути як не покритими оболонками, так і покритими з використанням відомих технічних прийомів; наприклад, щоб затримати дезінтеграцію та абсорбцію. Протипухлинні сполуки згідно з даним винаходом також переважно призначаються для парентерального застосування, наприклад, для ін'єкції через внутрішньовенний, внутрішньоартеріальний, підшкірний, ректальний, внутрішньом'язовий, внутрішньоорбітальний, внутрішньокапсулярний, внутрішньоспінальний, внутрішньоперитонеальний чи внутрішньогрудний шляхи. Композиції згідно з винаходом для парентерального застосування містять ефективну кількість протипухлинної сполуки згідно з винаходом у фармацевтично прийнятному носієві. Дозовані форми, придатні для парентерального застосування містять мікстури, суспензії, дісперсії, емільсії або інші дозовані форми, які можуть застосовуватись для парентерального введення. Технічні прийоми та складові для приготування парентеральних дозованих форм відомі спеціалістам. Придатні носії, що використовуються для утворення рідких дозованих форм для перорального або парентерального введення, містять безводні фармацевтично прийнятні полярні розчинники, такі як олії, спирти, аміди, прості ефіри, складні ефіри, кетони, вуглеводні та їхні суміші, а також воду, фізіологічні розчини, розчини декстрози (на 86612 10 приклад, 5%-ний), електролітні розчини або будьяку іншу водну, фармацевтично прийнятну рідину. Придатні безводні, фармацевтично прийнятні полярні розчинники включають, але не обмежуються цим вичерпно, алкоголі (наприклад, α - гліцеролформаль, β-гліцеролформаль, 1,3бутиленгліколь, аліфатичні або ароматичні спирти, що мають 2-30 атомів вуглецю, таких як метанол, етанол, пропанол, ізопропанол, бутанол, третбутанол, гексанол, октанол, амілен-гідрат, бензиловий спирт, гліцерин (гліцерол), гліколь, гексиленгліколь, тетрагідрофурфуриловий спирт, лауриловий спирт, цетиловий спирт, чи стеариловий спирт, складні ефіри жирних кислот або жирних спиртів, такі як поліалкіленгліколі (наприклад, поліпропіленгліколь, поліетиленгліколь), сорбітан, сахароза та холестерол); аміди (наприклад, диметилацетамід (ДМА),бензилбензоат ДМА, диметилформамід, Ν-β-гідроксиетил)-лактамід, Ν,Νдиметилацетамід, 2-піролідінон, 1-метил-2піролідинон або полівінілпіролідон); складні ефіри (наприклад, 1-метил-2-піролідинон, 2-піролідинон, ацетатні ефіри, такі як моноацетин, діацетин та триацетин, аліфатичні та ароматичні ефіри, такі як етилкаприлат або етилоктаноат, алкілолеат, бензилбензоат, бензилацетат, диметилсульфоксид (ДМСО), гліцеринові ефіри, такі як моно-, ди- або тригліцерил цитрати чи тартрати, етилбензоат, етилацетат, етилкарбонат, етиллактат, етилолеат, складні ефіри жирних кислот сорбітану, складні ефіри ПЕГ жирних кислот, гліцерилмоностеарат, гліцеридові ефіри,такі як моно-, ди- або тригліцериди, складні ефіри жирних кислот, такі як ізопропилміристат, складні ефіри ПЕГ жирних кислот, такі як ПЕГ-гідроксиолеат та ПЕГ-гідроксистеарат, N-метилпіролідинон, плюронік 60, поліоксиетилен сорбітол олеїнові поліефіри, такі як полі(етоксилований)30-60 сорбітол полі(олеат)2-4, полі(оксиетилен)15-20 моноолеат, полі(оксиетилен)1520 моно 12- гідроксистеарат та полі(оксиетилен)1520 монорицинолеат, поліокси сорбітанові складні ефіри, такі як поліокси-етилен сорбітан моноолеат, поліокси-етилен сорбітан монопальмітат, поліоксиетилен сорбітан монолаурат, поліокси-етилен сорбітан моностеарат та полісорбат (Polysorbate®) 20, 40, 60 або 80 фірми ІСІ Americas, Wilmington, DE, полівінілпіролідон, модифіковані алкіленоксидами складні ефіри жирних кислот, такі як гідрогенізована поліоксилом 40 рицинова олія та поліоксиетиловані рицинові олії (наприклад, розчин Кремофору EL (Cremophor® EL) або розчин Кремофору RH 40(Cremophor® RH)), складні ефіри сахаридів жирних кислот (серед яких конденсований продукт моносахариду (наприклад, пентози, такі як рибоза, рибулоза, арабіноза, ксилоза, ліксоза та ксилулоза, гексози, такі як глюкоза, фруктоза, галактоза, маноза та сорбоза, тріози, тетрози, гептози та октози), дисахариди (наприклад, сукроза, мальтоза, лактоза та трегалоза) або олігосахарид чи його суміш з С4-С22 жирною кислотою (кислотами) (наприклад, насичені жирні кислоти, такі як каприлова кислота, лауринова кислота, міристинова кислота, пальмітинова кислота та стеаринова кислота, і ненасичені жирні кислоти, такі як пальмітолеїнова кислота, олеїнова кислота, 11 елаїдинова кислота, ерукова кислота та / лінолеїлова кислота), або стероїдні ефіри); алкілові, арилові або циклічні ефіри, що містять 2-30 атомів вуглецю (наприклад, діетиловий ефір, тетрагідрофуран, диметиловий ізосорбід, діетиленгліколь моноетиловий ефір); глікофурол (поліетиленгліколевий ефір тетрагідрофурфурилового спирту); кетони, що містять 3-30 атомів вуглецю (наприклад, ацетон, метил-етиловий кетон, метилізобутиловий кетон); аліфатичні, циклоаліфатичні або ароматичні вуглеводні, що містять 4-30 атомів вуглецю (наприклад, бензен, циклогексан, дихлорометан, діоксолани, гексан, n-декан, n-додекан, n-гексан, сульфолан, тетраметиленсульфон, толуен, диметилсульфоксид (ДМСО) або тетраметиленовий сульфоксид); мінеральні масла, рослинні олії, тваринні жири, ефірні олії та синтетичні масла (наприклад, мінеральні масла, такі як аліфатичні вуглеводні або вуглеводні на парафіновій основі, ароматичні вуглеводні, змішані аліфатичні та ароматичні вуглеводні, та рафіноване парафінове масло, рослинні олії, такі як льняна, тунгова, сафлорова, соєва, рицинова, бавовняна, свиріпова, кокосова, пальмова, маслинова, кукурудзяна, кунжутова, персикова та арахісова олія, та гліцериди, такі як моно-, ди- або тригліцериди, тваринні жири, такі як риб'ячий жир, жири морських тварин, спермацетовий жир, жир з печінки тріски, сквален, сквалан та жир з печінки акули, олеїнові олії, поліоксиетилована рицинова олія); алкілові або арилові галогеніди, що містять 1-30 атомів вуглецю та факультативно більш ніж один галоген-замісник; метиленхлорид; моноетаноломід; нафтовий бензин; троламін; омега-3 поліненасичені жирні кислоти (наприклад, альфа-лінолева кислота, ейкозапентаєнова кислота, докозапентаєнова кислота або докозагексаєнова кислота); полігліколевий ефір 12-гідроксистеаринової кислоти та поліетиленгліколь (солютол (Solutol®) HS-15 фірми BASF, Людвігсгафен, Німеччина); поліоксиетиленгліцероль; лаурат натрію; олеат натрію або сорбітан моноолеат. Інші фармацевтично прийнятні розчинники для застосування у винаході добре відомі звичайним спеціалістам та ідентифіковані в The Chemotherapy Source Book (Williams & Wilkens Publishing), The Handbook of Pharmaceutical Excipients, (American Pharmaceutical Association, Washington, D.C., and The Pharmaceutical Society of Great Britain, London, England, 1968), Modern Pharmaceutics. (G. Banker et al., eds., 3d ed.) (Marcel Dekker, Inc., New York, 1995), The Pharmacological Basis of Therapeutics, (Goodman & Gilman, McGraw Hill Publishing), Pharmaceutical Dosage Forms, (H. Lieberman et al., eds.,) (Marcel Dekker, Inc., New York, 1980), Remington's Pharmaceutical Sciences (A. Gennaro, ed., 19th ed.) (Mack Publishing, Easton, PA, 1995), The United States Pharmacopeia 24. The National Formulary 19. (National Publishing, Philadelphia, PA, 2000), A.J. Spiegel et al., та Use of Nonaqueuous Solvents in Parenteral Products, Journal of Pharmaceutical Sciences, Vol. 52, No. 10, pp. 917-927 (1963). Кращими розчинниками є ті, що відомі як стабілізатори протипухлинних сполук, такі як олії, ба 86612 12 гаті на тригліцериди, наприклад, сафлорова олія, соєва олія або їхні суміші, та модифіковані алкіленоксидами складні ефіри жирних кислот, такі як гідрогенізована поліоксилом 40 рицинова олія та поліоксиетиловані рицинові олії (наприклад, розчин Кремофору EL (Cremophor® EL) або розчин Кремофору RH 40(Cremophor® RH). Комерційно досяжні тригліцериди включають емульговану соєву олію Інтраліпід (Intralipid® Kabi-Pharmacia Inc., Stockholm, Sweden), емульсію Нутраліпід (Nutralipid®) (McGaw, Irvine, California), 20% емульсія Ліпозин II (Liposyn®II) (20% розчин жирової емульсії, яка містить 100мг сафлорової олії, 100мг соєвої олії, 12мг фосфатидів яєчного жовтка та 25мг гліцерину на 1мл розчину; Abbott Laboratories, Chicago, Illinois), 2% емульсія Ліпозин III (Liposin®III) (2% розчин жирової емульсії, яка містить 100мг сафлорової олії, 100мг соєвої олії, 12мг фосфатидів яєчного жовтка та 25мг гліцерину на 1мл розчину; Abbott Laboratories, Chicago, Illinois), похідні натурального або синтетичного гліцеролу, які містять докозагексаєнольну групу на рівні між 25% та 100% по масі від загального вмісту жирної кислоти (Dhasco® (фірми Martek Biosciences Corp., Columbia, MD), DHA Maguro® (Datio Enterprises, Los Angeles, CA), Soyacal® та Travemulsion®. Етанол є кращим розчинником для застосування при розчинянні протипухлинних сполук у форму розчинів, емульсій і тому подібне. Додаткові другорядні компоненти, які можуть бути включені в композиції згідно з винаходом для різноманітних цілей, добре відомі у фармацевтичному виробництві. Ці компоненти здебільшого надають властивостей, які покращують збереження протипухлинної сполуки в місцеположенні введення, захищають стабільність композиції, регулюють рН, полегшують приведення протипухлинної сполуки до фармацевтичних форм і тому подібне. Краще, коли кожен з цих компонентів є окремо присутнім в кількості менш ніж приблизно 15 масових % від загальної кількості композиції, ще краще - менш ніж приблизно 5 масових % та найкраще менш ніж приблизно 0,5 масових %. Деякі компоненти, такі як наповнювачі або розріджувачі, можуть становити до 90 масових % від загальної кількості композиції, як це добре відомо в рецептурній справі. Ці домішки включають кріозахисні речовини для запобігання репреципітації таксану, поверхнево-активні, рідкі або емульсовані речовини (наприклад, лецитин, полісорбат-80, Твін 80 (Tween®80), плюронік 60, поліоксиетиленовий стеарат), запобіжники (наприклад, етил-пгідробензоат), протимікробні запобіжники (наприклад, бензиловий спирт, фенол, м-крезол, хлоробутанол, сорбієва кислота, тимеросал та парабен), речовини для регулювання рН або буферні речовини (наприклад, кислоти, основи, ацетат натрію, сорбітан монолаурат), речовини для регулювання осмолярності (наприклад, гліцерин), загусники (наприклад, моностеарат алюмінію, стеаринова кислота, цетиловий спирт, стеариновий спирт, гуарова камедь, метилцелюлоза, гідроксипропіл целюлоза, тристеарин, цетиловий ефір, поліетиленгліколь), барвники, розріджувачі, нелетючі силікони (наприклад, циклометикон), глини (напри 13 клад, бентоніти), адгезиви, нагромаджувані, ароматизуючі речовини, підсолоджувачі, адсорбенти, наповнювачі (наприклад, цукри, такі як лактоза, цукроза, маніт або сорбіт, целюлоза або сульфат кальцію), розріджувачі (наприклад, вода, фізіологічний розчин, електролітні розчини), зв'язуючі речовини (наприклад, крохмалі, такі як маїсовий крохмаль, пшеничний крохмаль, рисовий крохмаль або картопляний крохмаль, желатин, трагакант, метилцелюлоза, гідроксипропілметилцелюлоза, натрій-карбокси-метилцелюлоза, полівінілпіролідон, цукри, полімери, камедь акацієвого дерева), дезінтегратори (наприклад, крохмалі, такі як кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль, картопляний крохмаль або карбоксиметиловий крохмаль, зшитий полівінілпіролідон, агар, альгінова кислота або її сіль, така як альгінат натрію, кроскармелоза натрію або кросповідон), мастила (наприклад, кремнезем, тальк, стеаринова кислота або її солі, такі як стеарат магнію або поліетиленгліколь), оболонкові речовини (наприклад, концентровані цукрові розчини, включаючи гуміарабік, тальк, полівініл піролідон, карбопол гель, поліетиленгліколь або діоксид титану), та антиоксиданти (наприклад, метабісульфіт натрію, бісульфіт натрію, сульфіт натрію, декстроза, феноли та тіофеноли). Застосування дозованої форми може бути безперервним або переривчатим в залежності, наприклад, від фізіологічного стану пацієнта, від того, чи є мета застосування терапевтичною або профілактичною, та від інших факторів, добре відомих кваліфікованим професіоналам. Дозування та схеми застосування фармацевтичних композицій згідно з винаходом можуть бути легко визначені тими, хто має досвід звичайного лікування раку. Зрозуміло, що доза протипухлинної сполуки залежатиме від віку, статі, стану здоров'я та ваги реципієнта, виду іншого одночасного лікування, частоти лікування та природи бажаного ефекту. При будь-якому способі застосування фактична кількість протипухлинної сполуки, що призначається, також як і схема дозування, необхідна для досягнення сприятливих ефектів, описаних тут, повинні залежати, зокрема, від таких факторів, як біопридатність протипухлинної сполуки, розлад, що потребує лікування, бажана терапевтична доза та інші фактори, очевидні для професіоналів. Доза, що застосовується для тварин, і особливо при лікуванні людей, в контексті даного винаходу повинна бути достатньою для того, щоб викликати бажану терапевтичну відповідь у тварини протягом поміркованого періоду часу. Краще, якщо ефективна кількість протипухлинної сполуки, котра застосовується пероральним чи іншим шляхом, є такою кількістю, яка призведе до бажаної терапевтичної відповіді, коли вона буде застосована таким шляхом. Краще, коли композиції для перорального застосування приготовані в такий спосіб, що поодинока доза в тому чи іншому з пероральних препаратів містить, принаймні, 20мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта або, принаймні, 50, 100, 150, 200, 300, 400 чи 500мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта, причому в середньому площа 86612 14 поверхні тіла людини сягає 1,8м2. Краще, якщо поодинока доза композиції для перорального застосування містить від приблизно 20мг до приблизно 600мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта, ще краще від приблизно 25 до приблизно 400мг/м2, також краще від приблизно 40 до приблизно 300мг/м2 та ще краще від приблизно 50 до приблизно 200мг/м2. Краще, коли композиції для парентерального застосування приготовані в такий спосіб, що поодинока доза містить, принаймні, 20мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта або, принаймні, 40, 50, 100, 150, 200, 300, 400 чи 500мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта. Краще, якщо поодинока доза в одному чи більше парентеральних препаратах містить від приблизно 20мг до приблизно 500мг протипухлинної сполуки на 1м2 площі поверхні тіла пацієнта, ще краще від приблизно 40 до приблизно 400мг/м та ще краще від приблизно 60 до приблизно 350мг/м2. Проте, дозування може змінюватись в залежності від схеми дозування, яка може бути встановлена як необхідна для досягнення бажаного терапевтичного ефекту. Потрібно звернути увагу на те, що діапазони ефективних доз, що передбачені тут, не призначені до обмеження винаходу і репрезентують діапазони доз, яким віддається перевага. Найбільш сприятливе дозування повинно бути пристосоване до індивідуального суб'єкта, як це розуміє і визначає кожен з обізнаних у справі фахівців без непідхожого експериментування. Концентрація протипухлинної сполуки в рідкій фармацевтичній композиції знаходиться переважно поміж приблизно 0,01мг та приблизно 10мг на 1мл композиції, краще між приблизно 0,1мг та приблизно 7мг на 1мл, ще краще між приблизно 0,5мг та приблизно 5мг на 1мл, та найкраще між приблизно 1,5мг та приблизно 4мг на 1мл. Відносно низькі концентрації є взагалі такими, яким надається перевага, бо протипухлинна сполука є найбільш розчинною в розчинах з низькою концентрацією. Концентрація протипухлинної сполуки у твердій фармацевтичній композиції для перорального застосування є переважно поміж приблизно 5 масових % та приблизно 50 масових % по відношенню до загальної ваги композиції, краще між приблизно 8 масових % та приблизно 40 масових %, та ще краще між приблизно 10 масових % та приблизно 30 масових %. Згідно з одним втіленням винаходу, розчини для перорального застосування готують шляхом розчинення протипухлинної сполуки в будь-якому фармацевтично прийнятному розчиннику (наприклад, етанолі чи поліетиленгліколі), здатному розчинити сполуку з утворенням розчину. Відповідну кількість носія, що є сурфактантом, такого як розчин Кремофора EL (Cremophor® EL), полісорбат 80, Солютол HS15 або вітамін E-TPGS, додають до розчину при помішуванні з утворенням фармацевтично прийнятного розчину для перорального застосування пацієнтом. Наприклад, отримані в результаті цього композиції можуть містити приблизно до 10% етанолу та/або приблизно до 10% сурфактанта, більш типові концентрації можуть 15 бути приблизно 5 - 10 об'ємних % етанолу з еквівалентним об'ємом сурфактанта та дистильованою водою в діапазоні 80 - 90% за об'ємом. Заради смаку, фракція дистильованої води може бути замінена розчином вишневого або малинового сиропу, краще 10 - 30% сиропу з водним залишком. В одному з втілень винаходу, концентрація сполуки 9091 в такому розчині сягає від 2 до 4мг/мл. При бажанні, ці розчини можуть бути утворені так, щоб вони містили мінімальну кількість етанолу або щоб вони взагалі були вільними від етанолу, який, як відомо спеціалістам, призводить до несприятливих фізіологічних реакцій, коли вживається в певних концентраціях в пероральних формах. В кращому втіленні, розчин містить приблизно 5% етанолу, приблизно 5% сурфактанта, що є вибраним з полісорбату 80 (напр., Tween®80), поліетоксильованих касторових олій (напр., Cremophor®) та їх сумішей, і приблизно 90% дистильованої води. В іншому втіленні винаходу, порошки або таблетки для перорального вживання готують шляхом розчинення протипухлинної сполуки у будь-якому фармацевтично прийнятному розчиннику (наприклад, в етанолі чи поліетиленгліколі), здатному розчинити сполуку з утворенням розчину. Розчинник факультативно може бути здатен випаровуватись, коли розчин сушиться у вакуумі. Додатковий носій, такий як розчин Кремофор EL (Cremophor® EL), може бути доданий до розчину перед сушінням. Розчин, одержаний таким чином, висушують у вакуумі до утворення склистої маси. Цю масу змішують потім зі зв'язуючим для утворення порошку. Порошок може бути змішаний з наповнювачами або з іншими загальноприйнятими таблетуючими речовинами та оброблений у форму таблеток для перорального вживання пацієнтом. Порошок може бути також додано до будь-якого рідкого носія, що був описаний раніше, щоб утворити розчин, емульсію, суспензію чи тому подібне для перорального застосування. Емульсії для парентерального застосування можуть бути приготовлені шляхом розчинення протипухлинної" сполуки у будь-якому фармацевтично прийнятному розчиннику (наприклад, в етанолі чи поліетиленгліколі), здатному розчинити сполуку з утворенням розчину. Відповідну кількість носія, що є жировою емульсією, такою як емульсія Ліпозин II (Liposyn II), Ліпозин III (Liposyn® III) або Інтраліпід (Intralipid®), додають до розчину при помішуванні для утворенням фармацевтично прийнятної емульсії для парентерального вживання пацієнтом. Наприклад, отримані в результаті цього композиції можуть містити приблизно до 10% етанолу та/або приблизно до 90% носія (жирової емульсії). В одному з втілень винаходу, концентрація сполуки 9091 в дозованому розчині складає приблизно 1-2мг/мл. Типово, емульсія містить приблизно від 10% до 20% жиру, краще приблизно 20% жиру. При бажанні, ці жирові емульсії можуть бути утворені так, щоб вони містили мінімальну кількість або щоб вони взагалі були вільними від етанолу чи розчину Кремофору (Cremophor®), які, як відомо спеціалістам, призводять до несприятливих фізіологічних реакцій, коли застосовуються 86612 16 в певних концентраціях у парентеральних формах. В кращому втіленні, емульсія містить приблизно 5% етанолу та приблизно 95% жирової емульсії (напр., Інтраліпіду 20%, Ліпозин II20%, або їх суміш). В цьому кращому втіленні, отримана в результаті композиція є вільною від агентів, які, як відомо спеціалістам, призводять до несприятливих фізіологічних реакцій, таких як поліетоксильовані касторові олії (напр., Cremophor® ) та полісорбат 80 (напр., Tween®80). Розчини для парентерального застосування можуть бути приготовані шляхом розчинення протипухлинної сполуки у будь-якому фармацевтично прийнятному розчиннику (наприклад, в етанолі чи поліетиленгліколі), здатному розчинити сполуку з утворенням розчину. Відповідну кількість носія, що є сурфактантом, такого як розчин Кремофора (Cremophor®), полісорбат 80, Солютол HS15, додають до розчину при помішуванні для утворення фармацевтично прийнятного розчину для парентерального вживання пацієнтом. Наприклад, отримана в результаті цього композиція може містити приблизно до 10% етанолу та/або приблизно до 10% сурфактанта, більш типова концентрація може бути приблизно 5 - 10 об'ємних % етанолу з еквівалентним об'ємом сурфактанта та сольового розчину в діапазоні 80 - 90% за об'ємом. При бажанні, ці розчини можуть бути утворені так, щоб вони містили мінімальну кількість або щоб вони взагалі були вільними від етанолу чи розчину Кремофора (Cremophor®), які, як відомо спеціалістам, призводять до несприятливих фізіологічних реакцій, коли застосовуються в певних концентраціях в парентеральних формах. В кращому втіленні, розчин містить приблизно 5% етанолу, приблизно 5% полісорбату 80 (напр., Tween®80) або поліетоксильованих касторових олій (напр., Cremophor®), то приблизно 90% сольового розчину (0,9% хлориду натрію). Для мінімізації потенційно можливих несприятливих фізіологічних реакцій (напр., реакцій гіперчутливості) є бажаним, щоб пацієнт, який отримує розчин згідно з цим втіленням винаходу, був попередньо пролікований дексаметазоном, дифенгідраміном або будь-якою іншою речовиною, відомою фахівцям, як засіб мінімізації чи елімінації цих несприятливих реакцій. Інші придатні парентеральні форми містять ліпосоми. Ліпосоми звичайно являють собою сферичні та сфероїдальні кластери чи агрегати амфіпатичних сполук, включно ліпідні сполуки, типово у вигляді одного чи більше концентричних шарів, наприклад, моношарів або бідарів. Ліпосоми можуть бути утворені з Іонних і неіонних ліпідів. Ліпосоми з неіонних ліпідів відносять також до ніосом. Посилання на ліпосоми містять: (a) Liposomes Second Edition: A Practical Approach, під редакцією V. Torchillin та V. Weissig, Oxford University Press, 2003; (b) M. Malmstein, Surfactants and Polymers in Drug Delivery, Marcel Dekker Inc., 2002; і (с) Muller та інші, Emulsions and Nanosuspensions for the Formulation of Poorly Soluble Drugs, Medpharm Scientific Publishers, 1998. При бажанні, описані вище емульсії або розчини для перорального чи парентерального засто 17 сування можуть бути впаковані в ампули, пляшечки або інші звичайні контейнери в концентрованій формі та розбавлені будь-якою фармацевтично прийнятною рідиною, такою як сольовий розчин, щоб перед застосуванням отримати прийнятну концентрацію таксану, як це відомо спеціалістам. Терміни „гідроксил-захисна група" та „гідроксизахисна група", які тут вживаються, означають групу, що здатна захистити вільну гідроксильну групу („захищений гідроксил"), яка, внаслідок проведення реакції для її захисту, може бути видалена без порушення залишку молекули. Різновиди захисних груп для гідроксильної групи та їх синтез можна знайти в книзі „Захисні групи в органічному синтезі" - "Protective Grups in Organic Synthesis" by T.W.Greene, John Wiley and Sons, 1981, or Fieser&Fieser. Типові гідроксил-захисні групи включають метоксиметил, 1-етоксиетил, бензилоксиметил, (бета-триметилсилілетокси)метил, тетрагідропіраніл, 2,2,2-трихлорометоксикарбоніл, трет-бутил(дифеніл)силіл, триалкілсиліл, трихлорометоксикарбоніл та 2,2,2-трихлороетоксиметил. Як тут вживається, "Ас" означає ацетил; "Bz" означає бензоїл; "TES" означає триетилсиліл; "TMS" означає триметилсиліл; "LAH" означає алюмогідрид літію; "10-DAB" означає 10дезацетилбакатин III; "THF" означає тетрагідрофуран; "DMAP" означає 4-диметиламінопіридин; "LHMDS" означає гексаметилдисілазанид літію; "TESCI" означає триетилсилілхлорид; "cPtc-Cl" означає циклопентанкарбоніл хлорид; "DMF" означає Ν,Ν-диметилформамід; "МОР" означає 2метилоксипропен; "іРrос" означає Νізопропоксикарбоніл; "iProc-СІ" означає ізопропілхлоромат; "LDA" означає діізопропіл літію. Наступні приклади ілюструють винахід. Приклад 1 Приготування сполуки 9091 Захист і ацилювання 10-DAB до SIT310. Застосовуючи наступну процедуру подвійної реакції захисту С7-гідроксилу 10-дезацетилбакатина III (10-DAB) триетилсилілхлоридом (TESCI) та ацилювання його С10-гідроксилу циклопентанкарбоніл хлоридом (cPtc-Cl), отримували SIT310. Переважно, реакція виконувалась з використанням прозорого розчину 6мл DMF на 1г 10-DAB (10-DAB розчиняється в DMF до ~ 5мл/г при 22° С, але розчинювання поліпшується при охолодженні до 0-5°С). Додавання DMAP до розчину 10-DAB в DMF при кімнатній температурі допомагає його розчинності. Краще, щоб безводні розчинники і реактори знаходились в атмосфері інертного газу азоту. Вода поглинатиме триетилсилілхлорид з молярним співвідношенням 1:2. 86612 18 У висушену в термошафі 1-літрову покриту тригорлову кругло донну колбу (RBF), обладнану магнітним перемішувачем, датчиком внутрішньої температури і краплинною лійкою, в атмосфері інертного газу азоту були поміщені 10-DAB (54,46г, 0,100моль), DMAP (36,60г, 0,300моль) і безводний DMF (330мл). Суміш (0,3М) розмішували при температурі 22°С до отримання прозорого світложовтого розчину. Реакційна суміш була охолоджена до внутрішньої температури реактора 0-5°С циркуляційним холодильником. 7-TES захист. В краплинну лійку ввели TESCI (17,6мл, 0,105моль, 1,05екв.). Коли внутрішня температура реактора була < 5°С, почали додавати краплинно TESCI, щоб контролювати екзотермічний процес і підтримувати внутрішню температуру реактора < 5°С (20-30 хвилин часу додавання). Після додавання 15мл TESCI почалось осадження солі DMAP-HCl. Після того, як додавання було завершено, реакційну суміш розмішували 2,5 години при температурі від 0 до 5°С. TLC (тонкошарова хроматографія) контроль (3:1, ЕtOАс:Гептани) показав невелику кількість початкового матеріалу (Rf=0,20) у порівнянні з 7-TES10-DAB продуктом (Rf=0,65). HNMR аналіз зразків реакційної суміші показав, що кількість початкового матеріалу склала 2,5% продукту відповідно до інтегралів протонних резонансів С10 карбінолу. Була введена додаткова кількість TESCI (0,45мл, 0,0027моль), і суміш розмішували при температурі від 0 до 5°С. Після 2 годин, HNMR аналіз зразків показав
ДивитисяДодаткова інформація
Назва патенту англійськоюC10 cyclopentylcarbonyloxy taxanes, pharmaceutical composition based thereon, method of inhibiting tumor growth
Автори англійськоюHolton Robert A., Vu Phong
Назва патенту російськоюС10-циклопентилкарбонилокси таксаны, фармацевтическая композиция на их основе и способ ингибирования роста опухолей
Автори російськоюХолтон Роберт А., Ву Фонг
МПК / Мітки
МПК: A61K 31/38, C07D 409/00
Мітки: композиція, с10-циклопентилкарбонілокси, інгібування, росту, спосіб, фармацевтична, таксани, основі, пухлин
Код посилання
<a href="https://ua.patents.su/25-86612-s10-ciklopentilkarboniloksi-taksani-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-ingibuvannya-rostu-pukhlin.html" target="_blank" rel="follow" title="База патентів України">С10-циклопентилкарбонілокси таксани, фармацевтична композиція на їх основі та спосіб інгібування росту пухлин</a>