Похідні імідазолу як інгібітори ферменту pde10a
Номер патенту: 112065
Опубліковано: 25.07.2016
Автори: Нільсен Якоб, Ланґґор Мортен, Кілберн Джон Пол, Маріґо Мауро, Кехлер Ян
Формула / Реферат
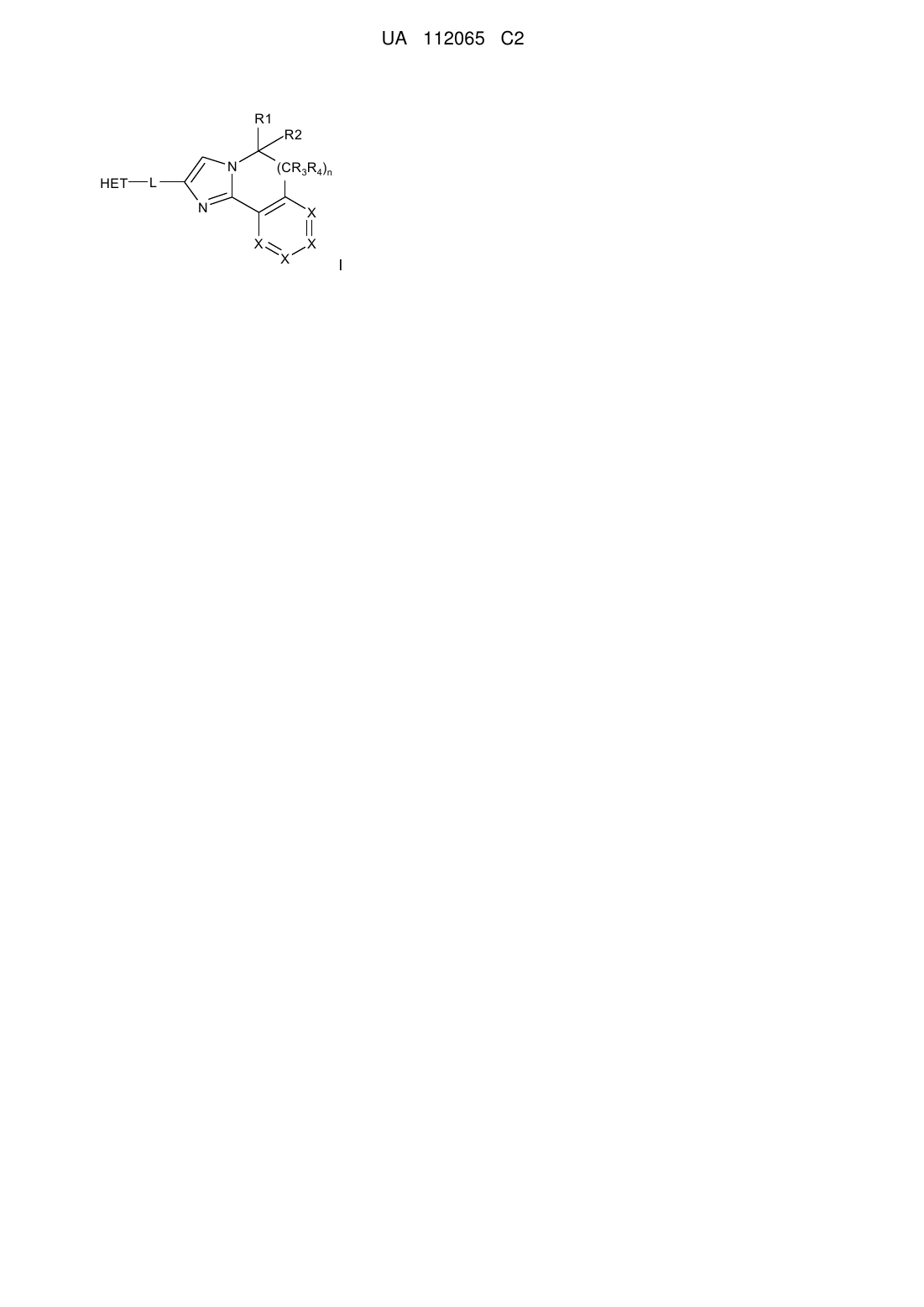
1. Сполука загальної структурної формули І
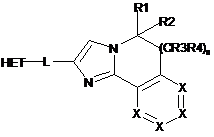 , I
, I
де
n являє собою 0 або 1,
X являє собою СН;
R1 і R2, кожен, вибрані незалежно з групи, що складається з Н; С1-С6-алкілу; С1-С6-алкіл(С3-С8)циклоалкілу; С1-С6-гідроксіалкілу; С1-С6-алкоксигрупи; CH2CN; CH2C(O)NH2; С1-С6-арилалкілу; С1-С6-алкілгетероциклоалкілу; галогену і гідроксигрупи;
R3 і R4, кожен, вибрані незалежно з групи, що складається з Н, ОН, F, СН3 і ОСН3;
L являє собою лінкер, вибраний з групи, що складається з -СН2-СН2-, -СН=СН-, -CH2-S- і -S-CH2-; i
НЕТ являє собою гетероароматичну групу, вибрану з групи, що складається з [1,2,4]триазоло[1,5-а]піразину, [1,2,4]триазоло[1,5-а]піридину і [1,2,4]триазоло[1,5-а]піримідину,
НЕТ може мати до трьох замісників R5, R6 і R7, індивідуально вибраних з групи, що складається з СН3 і ОСН3,
і фармацевтично прийнятні кислотно-адитивні солі сполук, що мають загальну структурну формулу І.
2. Сполука за п. 1, де n=0.
3. Сполука за п. 1, де
а) С1-С6-алкіл вибраний з групи, що складається з метилу, етилу, 1-пропілу, 2-пропілу, ізобутилу;
b) С1-С6-алкіл(С3-С8)циклоалкіл являє собою циклопропілметил;
c) С1-С6-гідроксіалкіл являє собою гідроксіетил;
d) С1-С6-алкоксигрупа вибрана з групи, що складається з метокси- і етоксигрупи;
e) С1-С6-арилалкіл вибраний з групи, що складається з бензилу і 4-хлорбензилу;
f) С1-С6-алкілгетероциклоалкіл вибраний з групи, що складається з тетрагідропіран-4-ілметилу і 2-морфолін-4-ілетилу;
g) галоген являє собою фтор.
4. Сполука за п. 3, де НЕТ вибраний з групи, що складається з 5,8-диметил[1,2,4]триазоло[1,5-а]піразину, 5,8-диметил[1,2,4]триазоло[1,5-а]піридину, 5-метил[1,2,4]триазоло[1,5-а]піридину і (5-метил[1,2,4]триазоло[1,5-а]піразин-8-іл)метанолу.
5. Сполука за п. 1, де R1 і R2 незалежно вибрані з групи, що складається з Н, ОН, F, CH3 і ОCH3.
6. Сполука за п. 1, де один або декілька атомів водню в сполуці замінено атомами дейтерію.
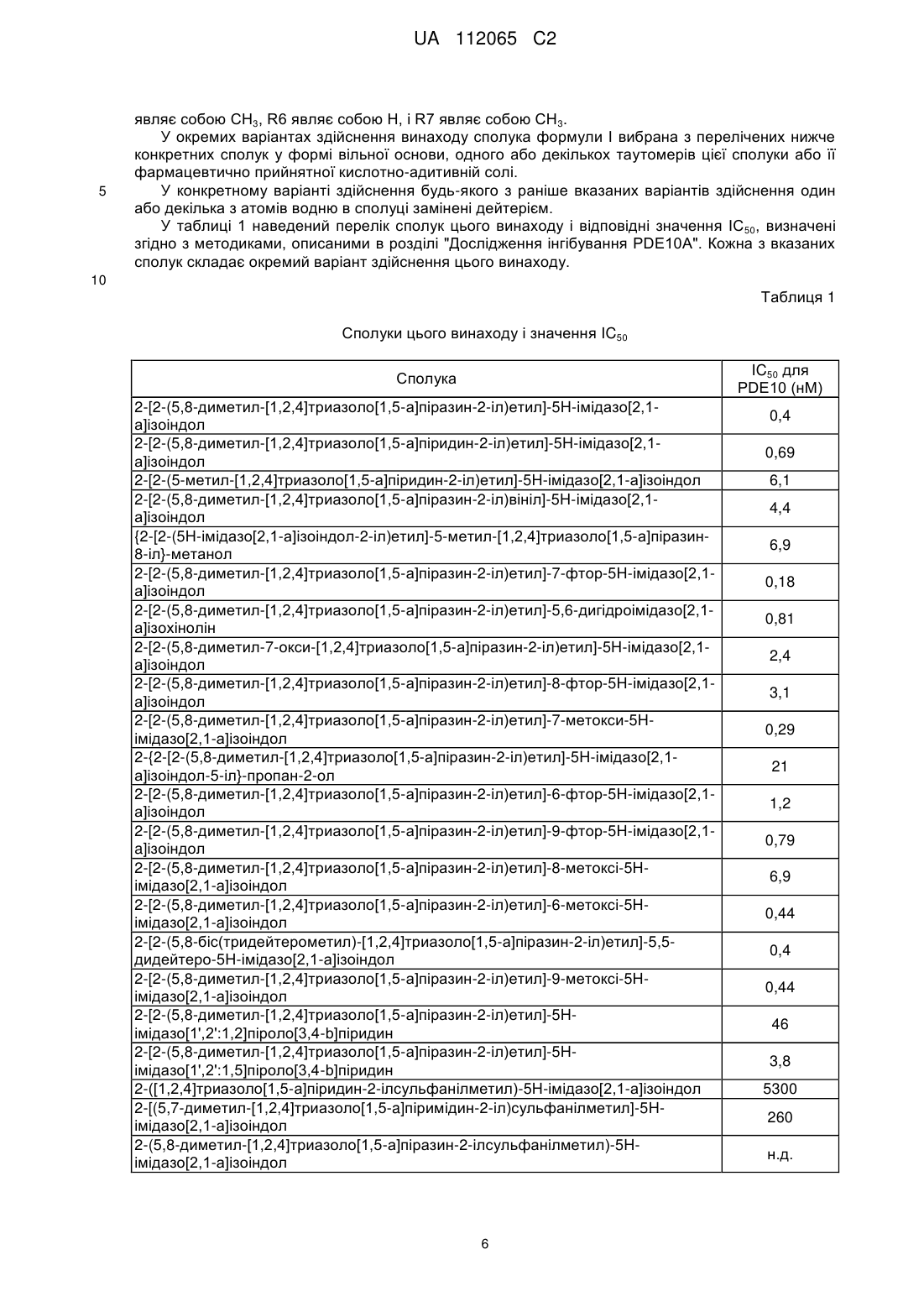
7. Сполука за п. 1, де сполука вибрана з групи, що складається з
2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу;
2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піридин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу;
2-[2-(5-метил[1,2,4]триазоло[1,5-а]піридин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу;
2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)вініл]-5Н-імідазо[2,1-а]ізоіндолу;
{2-[2-(5Н-імідазо[2,1-а]ізоіндол-2-іл)етил]-5-метил[1,2,4]триазоло[1,5-а]піразин-8-іл}-метанолу і
2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-7-фтор-5Н-імідазо[2,1-а]ізоіндолу,
2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-5,6-дигідроімідазо[2,1-а]ізохіноліну
і їх фармацевтично прийнятних кислотно-адитивних солей.
8. Сполука за будь-яким з пп. 1-7 як лікарський засіб.
9. Сполука за будь-яким з пп. 1-7 для використання при лікуванні нейродегенеративного або психічного розладу, самої по собі або в комбінації з одним або декількома нейролептичними засобами, де нейролептичний засіб вибраний з групи, що складається з сертиндолу, оланзапіну, рисперидону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипрасидону і озанетанту, причому нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, наприклад параноїдного, дезорганізованого, кататонічного, недиференційованого або резидуального типу; шизофреніформного розладу; шизоафективного розладу, наприклад маревного типу або депресивного типу; маревного розладу; біполярного розладу, наприклад біполярного розладу І типу, біполярного розладу II типу, і циклотимічного розладу.
10. Сполука за будь-яким з пп. 1-7 для приготування лікарського засобу для використання при лікуванні нейродегенеративного або психічного розладу, причому нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, наприклад параноїдного, дезорганізованого, кататонічного, недиференційованого або резидуального типу; шизофреніформного розладу; шизоафективного розладу, наприклад маревного типу або депресивного типу; маревного розладу; біполярного розладу, наприклад біполярного розладу І типу, біполярного розладу II типу.
11. Фармацевтична композиція для лікування нейродегенеративного або психічного розладу, яка містить сполуку за будь-яким з пп. 1-7 у терапевтично ефективній кількості як активне начало і один або декілька фармацевтично прийнятних носіїв, розріджувачів і ексципієнтів.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що містить один або декілька додаткових нейролептичних засобів.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що нейролептичний засіб вибраний з групи, що складається з сертиндолу, оланзапіну, рисперидону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипрасидону і озанетанту.
14. Фармацевтична композиція за будь-яким з пп. 11-13, яка відрізняється тим, що нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, шизофреніформного розладу; шизоафективного розладу; маревного розладу; біполярного розладу і циклотимічного розладу.
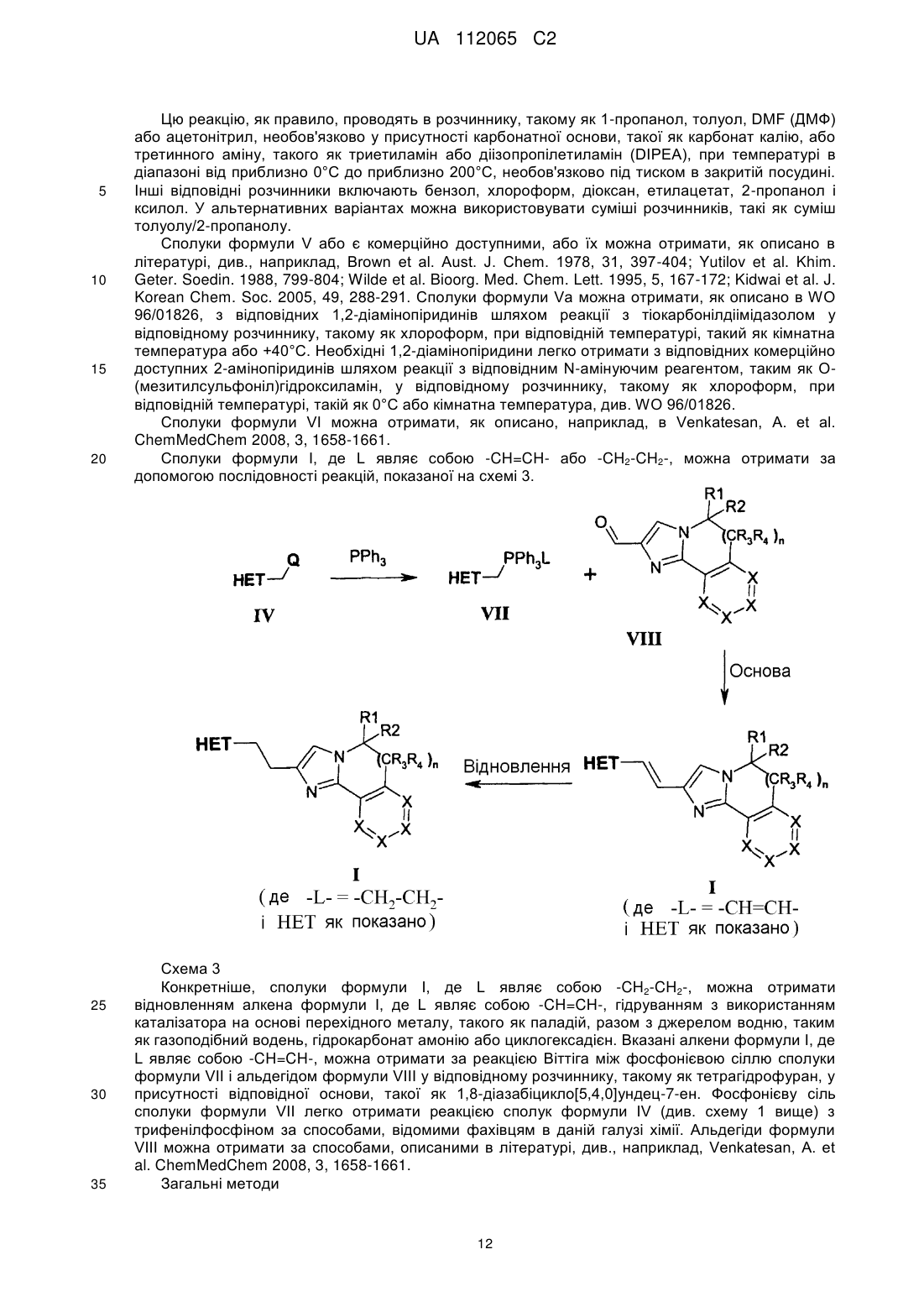
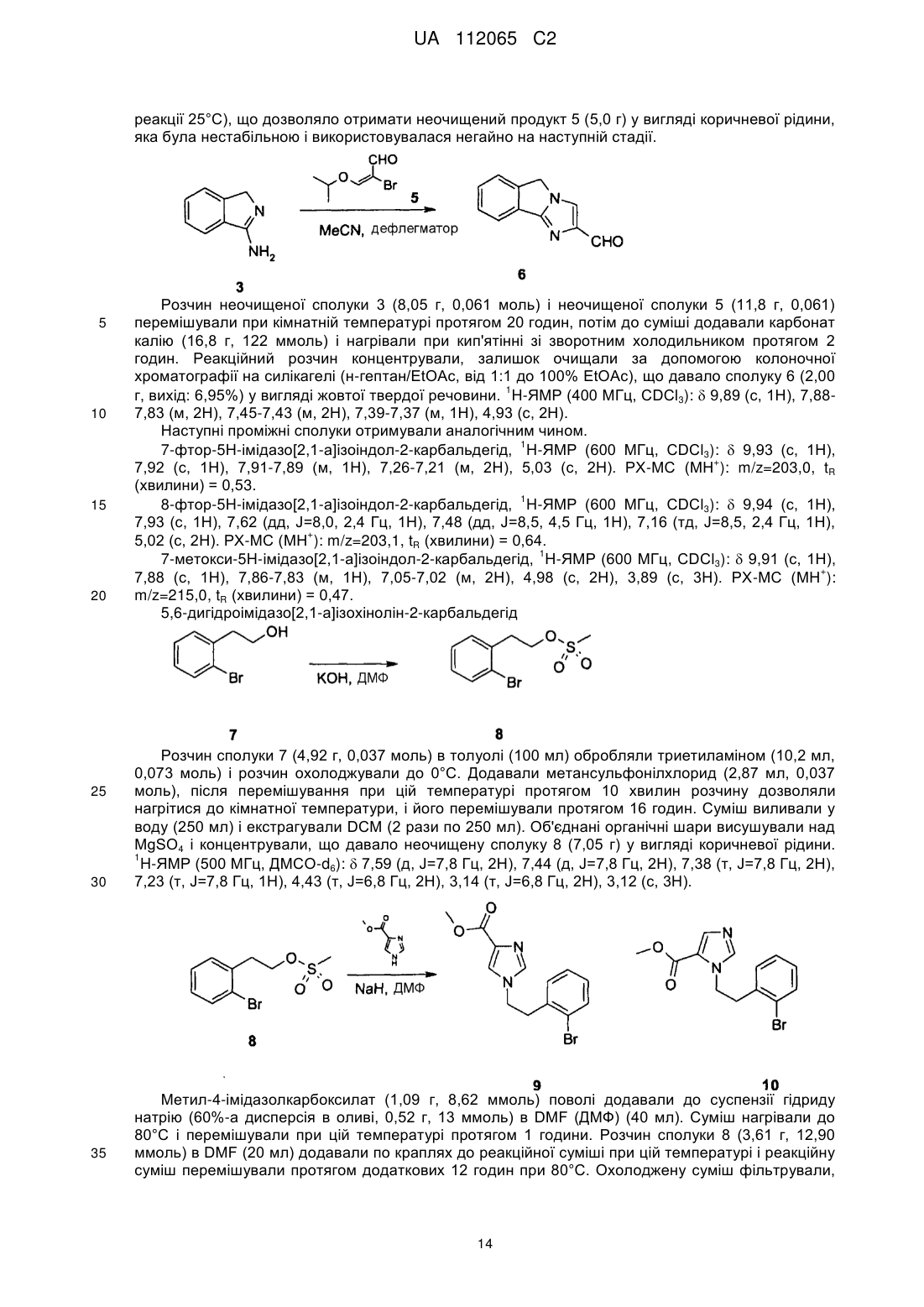
Текст
Реферат: Цей винахід направлений на сполуки (І), які є інгібіторами ферменту PDE10A. Винахід стосується фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки за винаходом і фармацевтично прийнятний носій. Цей винахід також стосується способу отримання сполук формули І. Цей винахід додатково стосується способу лікування суб'єкта, страждаючого від нейродегенеративного розладу, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули І. Цей винахід також стосується способу лікування суб'єкта, страждаючого від наркотичної залежності, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули І. Цей винахід додатково стосується способу лікування суб'єкта, страждаючого від психічного розладу, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули І. UA 112065 C2 (12) UA 112065 C2 R1 R2 N HET (CR3R4)n L N X X X X I UA 112065 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Цим винаходом пропонуються сполуки, які є інгібіторами ферменту PDE10A, і як такі корисні при лікуванні нейродегенеративних і психічних розладів. Зокрема, цим винаходом пропонуються сполуки, які є високоселективними відносно ферменту PDE10A в порівнянні з іншими підтипами PDE. Цим винаходом пропонуються також фармацевтичні композиції, які містять сполуки цього винаходу, і способи лікування розладів з використанням сполук цього винаходу. Попередній рівень техніки У даному описі надаються посилання на різні публікації у їх повному обсязі. Таким чином, зміст цих публікацій включений в даний опис за допомогою посилання для повнішого опису рівня галузі техніки, до якої відноситься цей винахід. Циклічні нуклеотиди - циклічний аденозинмонофосфат (сAMP (цАМФ)) і циклічний гуанозинмонофосфат (cGMP (цГМФ)) - функціонують як вторинні внутріклітинні месенджери, що регулюють широкий спектр процесів в нейронах. Внутріклітинні сAMP і cGMP генеруються аденіл- і гуанілциклазами і розкладаються циклонуклеотид-фосфодіестеразами (PDE) за допомогою гідролізу циклічних нуклеотидів до їх відповідних нуклеотидмонофосфатів. Фосфодіестераза 10А (PDE10A) є фосфодіестеразою подвійної специфічності, яка може перетворювати як сAMP в АМР, так і cGMP в GMP (Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076). PDE10A експресована, головним чином, в нейронах в смугастому тілі, прилеглому ядрі і в нюховому горбику (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557; та Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Дослідження вказують на те, що в головному мозку PDE10A експресується з високими рівнями середніми колючковими нейронами (medium spiny neurons - MSN) хвостового ядра, прилеглого ядра і відповідними нейронами нюхового горбика. MSN експресує два функціональні класи нейронів: клас D1, експресуючий D1-дофамінові рецептори, і клас D2, експресуючий D2дофамінові рецептори. Клас D1 нейронів є частиною "прямого" стріарного метаболічного шляху виходу, який вільно функціонує для посилення поведінкових відповідей. Клас D2 нейронів є частиною "непрямого" стріарного шляху виходу, який функціонує для пригнічення поведінкових відповідей, що конкурують з відповідями, яким сприяє "прямий" шлях. Антагонізм дофамінового D2-рецептора чітко встановлений при лікуванні шизофренії. Починаючи з 1950-х років антагонізм дофамінового D2-рецептора був головною основою лікування психозу, і всі ефективні антипсихотичні лікарські засоби протидіють D2-рецепторам. Дія D2, ймовірно, проводиться, головним чином, через нейрони в смугастому тілі, прилеглому ядрі і нюховому горбику, оскільки ці ділянки сприймають найбільш щільні дофамінергічні проекції і мають найбільш сильну експресію D2-рецепторів (Konradi, C. and Heckers, S. Society of Biological Psychiatry, 2001, 50, 729-742). Оскільки PDE10A в даному контексті має бажаний профіль експресії з високою і відповідною специфічною експресією в нейронах в смугастому тілі, прилеглому ядрі і нюховому горбику, то інгібування PDE10A, ймовірно, має ефекти, аналогічні антагонізму D2-рецептора, і, отже, має антипсихотичну дію. Хоча інгібування PDE10А, як очікується, частково імітує антагонізм D2-рецептора, можна чекати, що воно має інший профіль. D2-рецептор має, окрім сАМР, і інші компоненти проведення сигналу (Neve, K.A. et al. Journal of Receptors and Signal Transduction 2004, 24, 165205), а тому інтерференція з сАМР через інгібування PDE10A може понизити ризик екстрапірамідальних побічних ефектів, які спостерігалися при сильному антагонізмі D2. Навпаки, нгібування PDE10A може мати деякі ефекти, які не спостерігаються при антагонізмі D2-рецептора. PDE10A також експресована в стріарних нейронах, експресуючих D1-рецептор (Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Крім того, оскільки агонізм D1-рецептора приводить до стимулювання аденілат-циклази і, як результат, до підвищення рівнів сАМР, то інгібування PDE10A, ймовірно, також має ефекти, які імітують агонізм D1-рецептора. Нарешті, інгібування PDE10A не тільки підвищуватиме рівні сАМР в клітинах, але, як може очікуватися, також підвищуватиме рівні cGMP, оскільки PDE10A є фосфодіестеразою з подвійною специфічністю. сGMP активує ряд цільових білків в клітинах, подібних сАМР, а також взаємодіє з шляхами проведення сАМР сигналу. Висновок: інгібування PDE10A, ймовірно, частково імітує антагонізм D2-рецептора і, отже, має антипсихотичну дію, але його профіль може відрізнятися від профілю, який спостерігається у класичних антагоністів D2-рецептора. Було показано, що папаверин, інгібітор PDE10A, є активним на деяких антипсихотичних моделях. Папаверин підсилював каталептичну дію антагоніста D2-рецептора галоперидолу у щурів, але сам по собі не викликав каталепсії (WO 03/093499). Папаверин знижував підвищену 1 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 активність щурів, викликану РСР, тоді як зниження амфетамін-індукованої гіперактивності було незначним (WO 03/093499). Ці моделі показують, що інгібування PDE10A має класичний антипсихотичний потенціал, який є очікуваним з теоретичних міркувань, наведених в загальних рисах вище. У WO 03/093499 додатково описано застосування селективних інгібіторів PDE10 для лікування асоційованих неврологічних і психічних розладів. Крім того, інгібування PDE10A повертає назад підгострі PCP-індуковані дефіцити уваги в зсувах нервових відповідей у щурів (Rodefer et al. Eur. J. Neurosci. 2005, 4, 1070-1076). Дана модель підтверджує, що інгібування PDE10A може послаблювати когнітивні розлади, пов'язані з шизофренією. Розподіл PDE10A в тканинах показує, що інгібітори PDE10A можуть застосовуватися для підвищення рівнів сАМР і/або cGMP усередині клітин, які експресують фермент PDE10A, зокрема нейронів, які включають базальні ганглії, і, отже, інгібітори PDE10A цього винаходу можуть застосовуватися при лікуванні різних асоційованих нейропсихіатричних станів, в яких задіяні базальні ганглії, таких як неврологічні і психічні розлади, шизофренія, біполярний розлад, психоз і обсесивно-компульсивний розлад, і можуть мати перевагу завдяки відсутності небажаних побічних ефектів, які асоціюються з терапевтичними лікарськими засобами, що існують на ринку в даний час. Крім того, дані останніх публікацій (WO 2005/120514, WO 2005012485, Cantin et al., Bioorganic & Medicinal Chemistry Letters 17 (2007) 2869-2873) свідчать про те, що інгібітори PDE10A можуть бути корисними при лікуванні ожиріння та інсулін-незалежного цукрового діабету. Крім того, недавні публікації дозволяють припустити, що інгібітори PDE10A можна використовувати для лікування хворобі Хантінгтона (Giampa et al. PLoS One 2010, 5(10), Giampa et al. Neurobiology of Disease (2009), 34(3), 450-456, Hebb et al. Current Opinion in Pharmacology 2007, 7(1), 86-92). Що стосується інгібіторів PDE10A, то в ЕР 1250923 описано застосування селективних інгібіторів PDE10 в цілому і, зокрема, папаверину для лікування деяких неврологічних і психічних розладів. Піролодигідроізохіноліни і їх похідні описані як інгібітори PDE10 у WO 05/03129 і WO 05/02579. Піперидиніл-заміщені хіназоліни та ізохіноліни, які служать як інгібітори PDE10, описані в WO 05/82883. У WO 06/11040 описані заміщені похідні хіназоліну і ізохіноліну, які служать як інгібітори PDE10. У US 20050182079 описані заміщені тетрагідроізохінолінільні похідні хіназоліну і ізохіноліну, які служать як ефективні інгібітори фосфодіестерази (PDE). Зокрема, в US 20050182079 описані вказані сполуки, які є селективними інгібіторами PDE10. Аналогічно, в US 20060019975 описані піперидинові похідні хіназоліну і ізохіноліну, які служать як ефективні інгібітори фосфодіестерази (PDE). US 20060019975 також стосується сполук, які є селективними інгібіторами PDE10. У WO 06/028957 описані похідні цинноліну як інгібітори PDE10 для лікування психічних і неврологічних синдромів. У WO09/152825 розкриті похідні фенілімідазолу як сполуки, які служать як інгібітори PDE10. Проте, в наведених вище публікаціях не описані сполуки цього винаходу, які за своєю структурою не відносяться до жодного з відомих інгібіторів PDE10 (Kehler, J. et al. Expert Opin. Ther. Patents 2007, 17, 147-158) і які, як було виявлено авторами цього винаходу, є високоактивними і селективними інгібіторами ферменту PDE10A. Цим винаходом пропонуються сполуки, які є інгібіторами ферменту PDE10A і тому придатні для лікування нейродегенеративних і/або психічних розладів, які неоднаково ефективні для всіх пацієнтів. Тому все ще існує потреба в альтернативних способах лікування. Суть винаходу Завданням цього винаходу є надання сполук, які є селективними інгібіторами ферменту PDE10A. Іншим завданням цього винаходу є надання ефективного лікування, зокрема тривалого лікування, пацієнту, яким є людина, без побічних ефектів, зазвичай пов’язаних з вживаними в даний час терапевтичними засобами для лікування неврологічних і психічних розладів. Інші завдання цього винаходу стануть зрозумілими із цього опису. Відповідно, в одному аспекті цей винахід відноситься до сполук формули I: 2 UA 112065 C2 5 10 15 20 25 30 35 40 , де n являє собою 0 або 1; X вибраний з групи, що складається з CH, CF, COCH3, COH і N; з обмеженням, що не більше ніж один Х являє собою N; R1 і R2, кожен, вибрані незалежно з групи, що складається з H; C1-C6-алкілу, такого як метил, етил, 1-пропіл, 2-пропіл, ізобутил; C1-C6-алкіл(C3-C8)циклоалкілу, такого як циклопропілметил; C1-C6-гідроксіалкілу, такого як гідроксіетил; C1-C6-алкоксигрупи, такої як метокси- і етоксигрупа; CH2CN; CH2C(О)NH2; C1-C6-арилалкілу, такого як бензил і 4хлорбензил; і C1-C6-алкілгетероциклоалкілу, такого як тетрагідропіран-4-ілметил і 2-морфолін4-ілетил; галогену, такого як F; і гідроксигрупи; R3 і R4, кожен, вибрані незалежно з групи, що складається з H, OH, F, CH 3 і OCH3. Крім того, L являє собою лінкер, вибраний з групи, що складається з -CH=CH-, -CH2-S-, -CH2CH2- і -S-CH2-; і HET являє собою гетероароматичну групу формули II, що містить від 2 до 4 атомів азоту: , де Y може бути N або CH, Z може бути N або C; і HET, необов'язково, може мати до трьох замісників R5, R6 і R7, індивідуально вибраних з групи, що складається з H; C1-C6-алкілу, такого як метил; галогену, такого як хлор, фтор або бром; ціаногрупи; галоген(C1-C6)алкілу, такого як трифторметил; арилу, такого як феніл; алкоксигрупи, переважно, C1-C6-алкоксигрупи, такої як метокси-, диметокси-, етокси-, метоксіетокси- і етоксиметоксигрупа, і C1-C6-гідроксіалкілу, такого як CH2CH2OH; і "*" позначає місце приєднання. У переважному варіанті здійснення винаходу R1 і R2 незалежно вибрані з групи, що складається з H, OH, F, CH3 і OCH3. У іншому переважному варіанті здійснення винаходу R5, R6 і R7 незалежно вибрані з групи, що складається з H, CH3 і OCH3. У іншому переважному варіанті здійснення винаходу R1 і R2 незалежно вибрані з групи, що складається з H, OH, F, CH3 і OCH3, тоді як одночасно R5, R6 і R7 незалежно вибрані з групи, що складається з H, CH3 і OCH3. Крім того, винахід відноситься до таутомерів і фармацевтично прийнятних кислотноадитивних солей сполуки формули I або II та їх поліморфних форм. У конкретному варіанті здійснення винахід відноситься до сполуки формули I у вигляді одного таутомера або у вигляді поліморфної форми. У окремих варіантах здійснення винаходу сполуку формули I вибрано з конкретних сполук, розкритих в прикладах цієї заявки. Винахід додатково відноситься до сполуки формули I або її фармацевтично прийнятної кислотно-адитивної солі для використання як лікарського засобу. У іншому аспекті цей винахід відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули I і фармацевтично прийнятний носій, розріджувач або ексципієнт. 3 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід також відноситься до застосування сполуки формули I або її фармацевтично прийнятної кислотно-адитивної солі для приготування лікарського засобу для лікування нейродегенеративного або психічного розладу. Крім того, в ще одному аспекті цей винахід відноситься до способу лікування суб'єкта, страждаючого нейродегенеративним розладом, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули I. У ще одному аспекті цей винахід відноситься до способу лікування суб'єкта, страждаючого психічним розладом, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули I. У ще одному варіанті здійснення цей винахід відноситься до способу лікування суб'єкта, страждаючого наркотичною залежністю, такою як алкоголізм, амфетамінова, кокаїнова або опіатна наркоманія. Докладний опис винаходу Визначення замісників Терміни "гало" і "галоген", коли використовуються в контексті цього винаходу, є взаємозамінними і відносяться до фтору, хлору, брому або йоду. R1-R7 є коротким позначенням групи, що складається з R1, R2, R3, R4, R5, R6 і R7. Підгрупи R1-R7 визначаються аналогічним чином, наприклад, R5-R7 позначає групу, що складається з R5, R6 і R7. Нумерація замісників R1-R7 також може бути вказана нижнім індексом, наприклад, R1-R7. Аналогічним чином, число атомів (наприклад, атомів вуглецю) може бути вказане або як C1-C6, або як C1-C6, тобто від одного до шести атомів вуглецю. Термін "C1-C6 алкіл" відноситься до насиченого вуглеводню з прямим або розгалуженим ланцюгом, що містить від одного до шести атомів вуглецю, включно. Приклади таких груп включають, але не обмежуються тільки ними, метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-2-пропіл, 2-метил-1-бутил і н-гексил. Вираз "C1-C6 гідроксіалкіл" відноситься до C1-C6 алкільної групи, яку визначено вище, яка заміщена однією гідроксильною групою. Термін "галоген(C1-C6)алкіл" відноситься до C1-C6 алкільної групи, яку визначено вище, яка заміщена, аж до трьох, атомами галогену, наприклад, до трифторметилу. Вираз "C1-C6 алкокси" відноситься до насиченої алкоксигрупи з прямим або розгалуженим ланцюгом, що містить від одного до шести атомів вуглецю, включно, з відкритою валентністю на кисні. Приклади таких груп включають, але не обмежуються тільки ними, метокси, етокси, нбутокси, 2-метилпентокси і н-гексилокси. Термін "С3-С8 циклоалкіл" відноситься до циклопропілу, циклобутилу, циклопентилу, циклогексилу, циклогептилу або циклооктилу. Вираз "C 1-C6 алкіл(С3-С8)циклоалкіл" відноситься до С3-С8 циклоалкілу, який визначено вище, який заміщений C 1-C6 алкілом з прямим або розгалуженим ланцюгом. Приклади таких груп включають, але не обмежуються тільки ним, циклопропілметил. Термін "гетероциклоалкіл" відноситься до чотири - восьмичленного кільця, що містить атоми вуглецю і, аж до трьох, атоми N, O або S. Відкрита валентність знаходиться на гетероатомі або на атомі вуглецю. Приклади таких груп включають, але не обмежуються тільки ними, азетидиніл, оксетаніл, піперазиніл, морфолініл, тіоморфолініл і [1,4]діазепаніл. Термін "гідроксигетероциклоалкіл" відноситься до гетероциклоалкілу, який визначено вище, який заміщений однією гідроксильною групою. Термін "C1-C6-алкілгетероциклоалкіл" відноситься до гетероциклоалкільної групи, яку визначено вище, яка заміщена C1-C6 алкільною групою. Приклади таких груп включають, але не обмежуються тільки ними, тетрагідропіран-4-ілметил і 2-морфолін-4-ілетил. Термін "арил" відноситься до фенільного кільця, необов'язково заміщеного галогеном, C 1-C6 алкілом, C1-C6 алкокси або галоген(C1-C6)алкілом, які визначено вище. Приклади таких груп включають, але не обмежуються тільки ними, феніл і 4-хлорфеніл. Термін "C1-C6арилалкіл" відноситься до арилу, який визначено вище, який заміщений C 1-C6 алкілом з прямим або розгалуженим ланцюгом. Приклади таких груп включають, але не обмежуються тільки ними, бензил і 4-хлорбензил. Додатково, цей винахід також відноситься до певних варіантів здійснення цього винаходу, які описані нижче. У одному варіанті здійснення винаходу група HET являє собою гетероароматичну групу формули II, що містить 2 атоми азоту. У іншому варіанті здійснення винаходу HET являє собою гетероароматичну групу формули II, що містить 3 атоми азоту. У ще одному варіанті здійснення винаходу HET являє собою гетероароматичну групу формули II, що містить 4 атоми азоту. Група HET переважно вибрана з представлених нижче гетероароматичних груп, де "*" означає місце приєднання: 4 UA 112065 C2 5 10 15 20 25 30 35 40 У конкретному варіанті здійснення винаходу HET являє собою [1,2,4]триазоло[1,5-a]піразин. У другому конкретному варіанті здійснення винаходу HET являє собою [1,2,4]триазоло[1,5a]піридин. У третьому конкретному варіанті здійснення винаходу HET являє собою імідазо[1,2a]піридин. У четвертому конкретному варіанті здійснення винаходу HET являє собою імідазо[4,5-b]піримідин. У п'ятому конкретному варіанті здійснення винаходу HET являє собою піразоло[1,5-a]піридин. У шостому конкретному варіанті здійснення винаходу HET являє собою [1,2,4]триазоло[1,5-a]піримідин. У сьомому конкретному варіанті здійснення винаходу HET являє собою [1,2,4]триазоло[1,5-c]піримідин. У восьмому конкретному варіанті здійснення винаходу HET являє собою імідазо[1,2-a]піримідин. У іншому конкретному варіанті здійснення винаходу HET являє собою [1,2,4]триазоло[1,5a]піридин-6-карбонітрил. У іншому конкретному варіанті здійснення винаходу HET являє собою 1-метил-1H-бензімідазол. У іншому конкретному варіанті здійснення винаходу HET являє собою 1-феніл-1H-бензімідазол. У іншому конкретному варіанті здійснення винаходу HET являє собою 2-(6-хлорбензімідазол-1-іл)етанол. У іншому конкретному варіанті здійснення винаходу HET являє собою 5,7-диметил-[1,2,4]триазоло[1,5-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 5,7-диметилімідазо[1,2-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 5-хлорімідазо[1,2-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 5-метилімідазо[1,2-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 5-трифторметилімідазо[1,2a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 6-бром-5,7диметил-[1,2,4]триазоло[1,5-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 6-бром-7-метил-[1,2,4]триазоло[1,5-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 6-хлор-8-метил-[1,2,4]триазоло[1,5-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 6-хлорімідазо[1,2-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 7-метил[1,2,4]триазоло[1,5-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою 8-метилімідазо[1,2-a]піридин. У іншому конкретному варіанті здійснення винаходу HET являє собою імідазо[1,2-a]піридин-7-карбонітрил. У іншому конкретному варіанті здійснення винаходу HET являє собою 5,7-диметил-[1,2,4]триазоло[1,5-a]піримідин. Як правило, HET являє собою [1,2,4]триазоло[1,5-a]піразин, або 5,7-диметилімідазо[1,2a]піримідин, або [1,2,4]триазоло[1,5-c]піримідин. У іншому варіанті здійснення винаходу L являє собою -CH2-CH2-. У додатковому варіанті здійснення винаходу L являє собою -CH2-S-. У ще одному додатковому варіанті здійснення винаходу L являє собою -CH=CH-. У ще одному додатковому варіанті здійснення винаходу L являє собою -S-CH2-. У додатковому варіанті здійснення винаходу R1 і R2 незалежно вибрані з групи, що складається з H, OH, F, CH3 і OCH3; і R5, R6 і R7 незалежно вибрані з групи, що складається з H, CH3 і OCH3. У конкретному варіанті здійснення винаходу HET являє собою 5,8-диметил[1,2,4]триазол[1,5-a]піразин; L являє собою -CH2-CH2-; R1 і R2 незалежно вибрані з групи, що складається з H, OH, F, CH3 і OCH3, зокрема, R1 і R2 являє собою H; n=0, а R3 і R4 тому відсутні; і R5, R6 і R7 незалежно вибрані з групи, що складається з H, CH3 і OCH3, зокрема, R5 5 UA 112065 C2 5 являє собою CH3, R6 являє собою H, і R7 являє собою CH3. У окремих варіантах здійснення винаходу сполука формули I вибрана з перелічених нижче конкретних сполук у формі вільної основи, одного або декількох таутомерів цієї сполуки або її фармацевтично прийнятної кислотно-адитивній солі. У конкретному варіанті здійснення будь-якого з раніше вказаних варіантів здійснення один або декілька з атомів водню в сполуці замінені дейтерієм. У таблиці 1 наведений перелік сполук цього винаходу і відповідні значення IC50, визначені згідно з методиками, описаними в розділі "Дослідження інгібування PDE10A". Кожна з вказаних сполук складає окремий варіант здійснення цього винаходу. 10 Таблиця 1 Сполуки цього винаходу і значення IC50 IC50 для PDE10 (нМ) Сполука 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піридин-2-іл)етил]-5H-імідазо[2,1a]ізоіндол 2-[2-(5-метил-[1,2,4]триазоло[1,5-a]піридин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[2,1a]ізоіндол {2-[2-(5H-імідазо[2,1-a]ізоіндол-2-іл)етил]-5-метил-[1,2,4]триазоло[1,5-a]піразин8-іл}-метанол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-7-фтор-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5,6-дигідроімідазо[2,1a]ізохінолін 2-[2-(5,8-диметил-7-окси-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-8-фтор-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-7-метокси-5Hімідазо[2,1-a]ізоіндол 2-{2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1a]ізоіндол-5-іл}-пропан-2-ол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-6-фтор-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-9-фтор-5H-імідазо[2,1a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-8-метоксі-5Hімідазо[2,1-a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-6-метоксі-5Hімідазо[2,1-a]ізоіндол 2-[2-(5,8-біс(тридейтерометил)-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5,5дидейтеро-5H-імідазо[2,1-a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-9-метоксі-5Hімідазо[2,1-a]ізоіндол 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5Hімідазо[1',2':1,2]піроло[3,4-b]піридин 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5Hімідазо[1',2':1,5]піроло[3,4-b]піридин 2-([1,2,4]триазоло[1,5-a]піридин-2-ілсульфанілметил)-5H-імідазо[2,1-a]ізоіндол 2-[(5,7-диметил-[1,2,4]триазоло[1,5-a]піримідин-2-іл)сульфанілметил]-5Hімідазо[2,1-a]ізоіндол 2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-ілсульфанілметил)-5Hімідазо[2,1-a]ізоіндол 6 0,4 0,69 6,1 4,4 6,9 0,18 0,81 2,4 3,1 0,29 21 1,2 0,79 6,9 0,44 0,4 0,44 46 3,8 5300 260 н.д. UA 112065 C2 5 10 15 20 25 30 35 40 45 50 55 60 У особливому варіанті здійснення цього винаходу значення IC 50 сполук цього винаходу становить менше 20 нМ, наприклад, знаходиться в інтервалі 0,1 - 20 нМ, конкретно, в інтервалі 0,1 - 10 нМ, наприклад, в інтервалі 0,1 - 5 нМ або в інтервалі 0,1 - 1 нМ. Фармацевтично прийнятні солі Цей винахід включає також солі сполук, як правило, фармацевтично прийнятні солі. Такі солі включають фармацевтично прийнятні кислотно-адитивні солі. Кислотно-адитивні солі включають солі неорганічних кислот, а також солі органічних кислот. Типові приклади відповідних неорганічних кислот включають хлористоводневу, бромистоводневу, йодистоводневу, фосфорну, сірчану, сульфамінову, азотну і тому подібні кислоти. Типові приклади відповідних органічних кислот включають мурашину, оцтову, трихлороцтову, трифтороцтову, пропіонову, бензойну, коричну, лимонну, фумарову, гліколеву, ітаконову, молочну, метансульфонову, малеїнову, яблучну, малонову, мигдалеву, щавлеву, пікринову, піровиноградну, саліцилову, бурштинову, метансульфонову, етансульфонову, винну, аскорбінову, памову, біс-метиленсаліцилову, етандисульфонову, глюконову, цитраконову, аспаргінову, стеаринову, пальмітинову, EDTA, гліколеву, п-амінобензойну, глютамінову, бензолсульфонову, п-толуолсульфонову кислоти, теофіліноцтові кислоти, а також 8галогентеофіліни, наприклад, 8-бромтеофілін, і тому подібне. Додаткові приклади фармацевтично прийнятних неорганічних або органічних кислотно-адитивних солей включають фармацевтично прийнятні солі, перелічені в публікації Berge, S. M. et al., J. Pharm. Sci. 1977, 66, 2, зміст якої включений в даний опис за допомогою посилання. Крім того, сполуки цього винаходу можуть існувати в несольватованих, а також в сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол і тому подібне. Зазвичай сольватовані форми розглядаються як еквівалент несольватованим формам для цілей цього винаходу. Фармацевтичні композиції Цей винахід додатково відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули I і фармацевтично прийнятний носій або розріджувач. Цей винахід також відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість однієї з конкретних сполук, розкритих в експериментальній частині даного опису, і фармацевтично прийнятний носій або розріджувач. Сполуки цього винаходу можуть вводитися самі по собі або у поєднанні з фармацевтично прийнятними носіями, розріджувачами або ексципієнтами в разовій або множинних дозах. Фармацевтичні композиції цього винаходу можуть бути виготовлені змішуванням з фармацевтично прийнятними носіями або розріджувачами, а також з будь-якими іншими відомими ад’ювантами і ексципієнтами відповідно до стандартних методик, таких як ті, що th описані, наприклад, в Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтичні композиції можуть бути специфічно розробленими для введення будь-яким відповідним способом введення, таким як пероральний, ректальний, назальний, легеневий, місцевий (включаючи трансбукальний і під'язиковий), трансдермальний, інтрацистернальний, інтраперитонеальний, вагінальний і парентеральний (включаючи підшкірний, внутрішньом'язовий, інтратекальний, внутрівенний і внутрішньошкірний) способи введення. Очевидно, що спосіб введення залежатиме від загального стану і віку суб'єкта, що підлягає лікуванню, природи стану, що підлягає лікуванню, і активного інгредієнта. Фармацевтичні композиції для перорального введення включають тверді лікарські форми, такі як капсули, пігулки, драже, пілюлі, пастили, порошки і гранули. Коли це прийнятно, тоді композиції можуть бути виготовлені з покриттями, такими як ентеросолюбільні покриття, або вони можуть бути виготовлені так, щоб забезпечити контрольоване вивільнення активного інгредієнта, таке як поступове або тривале вивільнення, відповідно до способів, добре відомих в даній галузі техніки. Рідкі дозовані форми для перорального введення включають розчини, емульсії, суспензії, сиропи і еліксири. Фармацевтичні композиції для парентерального введення включають стерильні водні і неводні розчини, дисперсії, суспензії або емульсії для ін'єкцій, а також стерильні порошки, призначені для отримання стерильних розчинів або дисперсій для ін'єкції перед застосуванням. Інші відповідні форми для введення включають, але не обмежуються тільки ними, супозиторії, спреї, мазі, креми, гелі, лікарські форми для інгаляції, дермальні пластири і імпланти. Типові дозування для перорального введення знаходяться в інтервалі від приблизно 0,001 до приблизно 100 мг/кг маси тіла на день. Типові дозування для перорального введення також знаходяться в інтервалі від приблизно 0,01 до приблизно 50 мг/кг маси тіла на день. Типові дозування для перорального введення також знаходяться в інтервалі від приблизно 0,05 до 7 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 10 мг/кг маси тіла на день. Дозування для перорального введення зазвичай вводяться в одній або декількох дозах, зазвичай від однієї до трьох доз на день. Конкретна доза залежатиме від частоти і способу введення, статі, віку, маси тіла і загального стану суб'єкта, що підлягає лікуванню, природи і тяжкості стану, що підлягає лікуванню, і будь-яких супутніх захворювань, що підлягають лікуванню, а також інших чинників, очевидних для фахівця даної галузі техніки. Препарати також можуть бути представлені в стандартній лікарській формі за методами, відомими фахівцеві даної галузі техніки. Для ілюстрації: типова стандартна лікарська форма для перорального введення може містити від приблизно 0,01 до приблизно 1000 мг, від приблизно 0,05 до приблизно 500 мг або від приблизно 0,5 мг до приблизно 200 мг. Для парентеральних способів введення, таких як внутрівенне, інтратекальне, внутрішньом'язове і аналогічні способи введення, типова доза складає близько половини дози, вживаної для перорального введення. Цей винахід також відноситься до способу приготування фармацевтичної композиції, який включає змішування терапевтично ефективної кількості сполуки формули I і щонайменше одного фармацевтично прийнятного носія або розріджувача. У варіанті здійснення цього винаходу сполукою, використовуваною у вказаному вище способі, є одна з конкретних сполук, розкритих в експериментальній частині даного опису. Сполуки цього винаходу зазвичай використовуються у вигляді вільної основи або у вигляді її фармацевтично прийнятної солі. Одним з таких прикладів є кислотно-адитивна сіль сполуки, що має корисні властивості вільної основи. Коли сполука формули I містить вільну основу, тоді такі солі отримують за стандартним способом шляхом обробки розчину або суспензії вільної основи формули I молярним еквівалентом фармацевтично прийнятної кислоти. Типові приклади відповідних органічних і неорганічних кислот визначені вище. Для парентерального введення можуть використовуватися розчини сполук формули I в стерильному водному розчині, водному пропіленгліколі, водному вітаміні Е або кунжутній або арахісовій олії. Такі водні розчини мають бути відповідним чином забуферені, якщо це необхідно, і рідкому розріджувачу спочатку надається ізотонічність за допомогою достатньої кількості сольового розчину або глюкози. Водні розчини особливо підходять для внутрівенного, внутрішньом'язового, підшкірного і інтраперитонеального введення. Сполуки формули I можуть бути легко введені у відоме стерильне водне середовище з використанням стандартних методик, відомих фахівцеві даної галузі. Відповідні фармацевтичні носії включають тверді інертні розріджувачі або наповнювачі, стерильні водні розчини і різні органічні розчинники. Приклади твердих носіїв включають лактозу, каолін, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, гуміарабік, стеарат магнію, стеаринову кислоту і нижчі алкілові етери целюлози. Приклади рідких носіїв включають, але не обмежуються тільки ними, сироп, арахісову олію, оливкову олію, фосфоліпіди, жирні кислоти, аміни жирних кислот, поліоксіетилен і воду. Аналогічно, носій або розріджувач може включати будь-який матеріал для сповільненого вивільнення, відомий в даній галузі, такий як гліцерилмоностеарат або гліцерилдистеарат, сам по собі або в суміші з воском. Фармацевтичні композиції, отримані об'єднанням сполук формули I і фармацевтично прийнятного носія, потім легко вводяться в різні лікарські форми, відповідні для вказаних способів введення. Препарати можуть бути легко отримані в стандартній лікарській формі за способами, відомими в галузі фармації. Препарати цього винаходу, відповідні для перорального введення, можуть бути представлені у вигляді дискретних одиниць, таких як капсули або пігулки, кожна з яких містить обумовлену кількість активного інгредієнта і, необов'язково, відповідний ексципієнт. Крім того, перорально доступні препарати можуть бути представлені у формі порошку або гранул, розчину або суспензії у водній або неводній рідині або емульсії типу "масло-у-воді" або "вода-в-маслі". Якщо для перорального введення використовується твердий носій, тоді препарат може бути представлений у вигляді пігулки, поміщеного в тверду желатинову капсулу порошку або гранул, або він може бути представлений у формі коржика або пастилки. Кількість твердого носія змінюватиметься в широких межах, але знаходитиметься в інтервалі від приблизно 25 мг до приблизно 1 г на одиницю дози. Якщо використовується рідкий носій, то препарат може бути представлений у формі сиропу, емульсії, м'якої желатинової капсули або стерильної рідини для ін'єкції, такої як водна або неводна рідка суспензія або розчин. Фармацевтичні композиції цього винаходу можуть бути отримані за способами, традиційними для даної галузі техніки. Наприклад, пігулки можуть бути отримані змішуванням активного інгредієнта із звичайними ад’ювантами і/або розріджувачами і подальшим пресуванням суміші в стандартній таблетувальній машині, з отриманням пігулок. Приклади 8 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 55 60 ад’ювантів або розріджувачів включають кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, смоли і тому подібне. Можуть використовуватися будь-які інші ад’юванти або добавки, зазвичай використовувані для таких цілей, такі як барвники, смакові добавки, консерванти і так далі, за умови, що вони сумісні з активними інгредієнтами. Лікування розладів Як вказано вище, сполуки формули I є інгібіторами ферменту PDE10A і як такі можуть застосовуватися для лікування пов'язаних з ним неврологічних і психічних розладів. Таким чином, цей винахід відноситься до сполуки формули I або її фармацевтично прийнятної кислотно-адитивної солі, а також до фармацевтичної композиції, яка містить таку сполуку, для використання при лікуванні нейродегенеративного розладу, психічного розладу або наркотичної залежності у людини. У одному варіанті здійснення цього винаходу в нейродегенеративний розлад або стан залучена нейродегенерація стріарних середніх колючкових нейронів у людини. У конкретному варіанті здійснення цього винаходу нейродегенеративний розлад або стан являє собою хворобу Хантінгтона. У додатковому варіанті здійснення винаходу розладом є дискінезія, що асоціюється з терапією дофаміновим агоністом. У варіанті здійснення цього винаходу психічний розлад вибраний з групи, що складається з шизофренії, наприклад, параноїдного, дезорганізованого, кататонічного, недиференційованого або резидуального типу; шизофреніформного розладу; шизоафективного розладу, наприклад, маревного типу або депресивного типу; маревного розладу; психотичного розладу, викликаного речовиною, наприклад психозу, викликаного алкоголем, амфетаміном, марихуаною, кокаїном, галюциногенами, леткими сполуками, опіоїдами або фенциклідином; розладу особистості параноїдного типу і розладу особистості шизоїдного типу. Даний винахід додатково відноситься до способу лікування наркотичної залежності, наприклад, алкогольної, амфетамінової, кокаїнової або опіатної залежності, у людини, причому спосіб включає введення вказаній людині кількості сполуки формули I, ефективної для лікування наркотичної залежності. Термін "наркотична залежність", коли використовується в даному описі, означає патологічну потребу в наркотичному засобі і зазвичай характеризується мотиваційними порушеннями психічної рівноваги, такими як компульсивні спонуки приймати бажаний наркотичний засіб, і епізодами пристрасного бажання споживати наркотичний засіб. Наркотична залежність є достатньо патологічним станом, що широко вивчається. Розлад залежності включає прогрес розладу від гострого вживання наркотичних засобів до розвитку поведінки пошуку наркотичних засобів, сприйнятливості до рецидиву їх прийому і пониженої сповільненої здатності реагувати на природно-корисні стимули. Наприклад, в монографії Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM-IV) визначено три стадії залежності: захоплення/антиципація, зловживання/інтоксикація і абстиненція/негативна емоційна реакція. Ці стадії характеризуються, відповідно, повсюдною постійною сильною потребою вживання і заклопотаністю в отриманні речовини; використанням більшої кількості речовини, ніж це необхідно для відчуття ефектів інтоксикації; і відчуття симптомів толерантності і абстиненції, а також зниження мотивації до нормальної життєдіяльності. Інші розлади, які можна лікувати за цим винаходом, є обсесивно-компульсивні розлади, інсулін-незалежний цукровий діабет (NIDDM) і синдром Туретта та інші тикові розлади, а також синдром дефіциту уваги/гіперактивності (ADHD). Сполуки формули I або їх фармацевтично прийнятні солі можна використовувати в комбінації з одним або декількома іншими лікарськими засобами (включаючи типові і атипові антипсихотики) для лікування захворювань або станів, для яких застосовні сполуки за цим винаходом, причому комбінація лікарських сполук є безпечнішою або ефективнішою, ніж будьяка лікарська сполука окремо. Додатково, сполуки за цим винаходом можна використовувати в комбінації з одним або декількома іншими лікарськими засобами, які виліковують, попереджають, контролюють, послаблюють або знижують ризик побічних ефектів або токсичності сполук за цим винаходом. Комбінації, варіанти застосування і способи лікування за винаходом можуть також забезпечувати переваги в лікуванні пацієнтів, які не відповідають відповідним чином або які резистентні до інших відомих методів лікування. Такі інші лікарські засоби можна вводити шляхом і в кількості, зазвичай використовуваними для них, одночасно або послідовно із сполуками за цим винаходом. Відповідно, фармацевтичні композиції за цим винаходом включають композиції, що містять на додаток до сполук за цим винаходом один або декілька інших активних інгредієнтів. Комбінації можна вводити у складі об'єднаної стандартної лікарської форми або у вигляді набору або протоколу лікування, в яких один або декілька додаткових лікарських засобів вводять в окремих лікарських формах у складі 9 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 схеми лікування. Термін "нейролептичний засіб", коли використовується в даному описі, відноситься до лікарських засобів, що мають вплив на пізнавальну і поведінкову дію антипсихотичних лікарських засобів, які знижують сплутаність свідомості, марення, галюцинації, психомоторне збудження у пацієнтів з психозами. Нейролептичні засоби, відомі як основні транквілізатори і антипсихотичні лікарські засоби, включають також, але не обмежуються тільки ними, типові антипсихотичні лікарські засоби, такі як фенотіазини, які у свою чергу підрозділяються на аліфатичні похідні, піперидини і піперазини, тіоксантени (наприклад, цисординол), бутирофенони (наприклад, галоперидол), дибензоксазепіни (наприклад, локсапін), дигідроіндолони (наприклад, моліндон), дифенілбутилпіперидини (наприклад, пімозид), і нетипові антипсихотичні лікарські засоби, включаючи бензізоксазоли (наприклад, рисперидон), сертиндол, оланзапін, кветіапін, озанетант і зипрасидон. Особливо переважними нейролептиками для застосування у винаході є сертиндол, оланзапін, рисперидон, кветіапін, арипіпразол, галоперидол, клозапін, зипрасидон і озанетант. Термін "нейродегенеративний розлад або стан", коли використовується в даному описі і якщо не вказане інше, відноситься до розладу або стану, який викликаний дисфункцією і/або загибеллю нейронів центральної нервової системи. Лікуванню вказаних розладів і станів може сприяти введення засобу, який попереджає дисфункцію або загибель нейронів при ризику таких розладів або станів і/або підвищує функцію пошкоджених або здорових нейронів таким чином, що компенсує втрату функції, викликану дисфункцією або загибеллю нейронів підвищеного ризику. Термін "нейротрофічний (нейротропний) засіб", як використовується в даному описі, відноситься до речовини або засобу, який має деякі з вказаних властивостей або всі вказані властивості. Всі посилання, включаючи публікації, патентні заявки і патенти, що цитуються в даному описі, включені в даний опис за допомогою посилання у повному їх обсязі і в тому ж ступені, неначебто кожна публікація була окремо та специфічно вказана як введена в опис за допомогою посилання і внесена до опису у повному її обсязі (у максимальному ступені, дозволеному законом). Заголовки і підзаголовки використовуються в даному описі тільки для зручності і не повинні розглядатися як такі, що обмежують цей винахід будь-яким чином. Застосування будь-якого прикладу або всіх прикладів або виразів, що вказують на приклади (включаючи "наприклад" і "такий як"), в цьому описі призначено тільки для повнішого освітлення цього винаходу і не обмежує обсяг винаходу, якщо не вказане інше. Цитування і введення патентних документів виконане тільки для зручності, і не відображує будь-якої оцінки обґрунтованості, патентоспроможності і/або наявності позовної сили вказаних патентних документів. Слід розуміти, що різні аспекти, варіанти здійснення, варіанти реалізації і ознаки винаходу, вказані в цьому документі, можуть бути заявлені окремо або в будь-якому поєднанні, як проілюстровано нижченаведеними необмежувальними прикладами. Цей винахід включає всі модифікації і еквіваленти об'єктів, вказаних у формулі винаходу, що додається, наскільки це дозволено законом. Експериментальний розділ Отримання сполук за винаходом Сполуки загальної формули I цього винаходу можна отримати, як описано в нижченаведених схемах реакції. Сполуки формули I, деL являє собою -CH2-S-, можна отримати шляхом приєднання нуклеофіла формули III до електрофіла формули IV, де Q являє собою групу, що видаляється, наприклад, Cl, Br, I, метансульфоніл, 4-толуолсульфоніл, як показано на схемі 1 Схема 1 10 UA 112065 C2 5 10 15 20 25 30 35 Цю реакцію, як правило, проводять в розчиннику, такому як 1-пропанол, толуол, DMF (ДМФ) або ацетонітрил, необов'язково у присутності карбонатної основи, такої як карбонат калію, або третинного аміну, такого як триетиламін або діізопропілетиламін (DIPEA), при температурі в діапазоні від приблизно 0°C до приблизно 200°C, необов'язково під тиском в закритій посудині. Інші відповідні розчинники включають бензол, хлороформ, діоксан, етилацетат, 2-пропанол і ксилол. У альтернативних варіантах можна використовувати суміші розчинників, такі як суміш толуолу/2-пропанолу. Тіольні сполуки формули III можна отримати за способами, аналогічними описаним в літературі, наприклад, в Journal of Heterocyclic Chemistry 1977 14(5), 889-92, Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry 1979, 5, 1132-6, Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry 1997, 20, 2983-2988, Organic & Biomolecular Chemistry 2009, 7, 128-134. Деякі електрофіли формули IV є комерційно доступними, і в даній галузі відомо багато інших, див., наприклад, JP 59176277 і US 2010016303. Електрофіл IV, де Q являє собою групу, що видаляється, наприклад, Cl, Br, I, метансульфоніл, 4-толуолсульфоніл, також можна отримати перетворенням відповідного первинного спирту на вказану групу, що видаляється, за способами, відомими фахівцям в даній галузі хімії. Вказані способи, наприклад, можуть бути вибрані з проведення реакцій між сполуками відповідного первинного спирту з тіонілхлоридом, трихлоридом фосфору, трибромідом фосфору, метансульфонілхлоридом або 4толуолсульфонілхлоридом, необов'язково у присутності підхожого розчинника, такого як дихлорметан або 1,2-дихлоретан, і необов'язково у присутності основи, такої як триетиламін, діізопропілетиламін або піридин. У альтернативному варіанті електрофіли формули IV можна отримати шляхом реакції комерційно доступних гетероароматичних амінів з 1,3дигалоацетонами, наприклад, 1,3-дихлорацетоном, у відповідному розчиннику, такому як 1,2диметоксіетан або етанол, при відповідній температурі, такій як кімнатна температурі або температура дефлегмації. Деякі електрофіли формули IV є комерційно доступними, і в даній галузі відомо багато інших, див., наприклад, Tsuchiya, T.; Sashida, H. J. Chem. Soc., Chem. Commun. 1980, 1109-1110; Tsuchiya, T.; Sashida, H; Konoshita, A. Chem. Pharm. Bull. 1983, 31, 4568-4572. Сполуки формули I, де L являє собою -S-CH2-, можна отримати шляхом приєднання нуклеофіла формули V або Va до електрофіла формули VI, де Q являє собою групу, що видаляється, наприклад, Cl, Br, I, метансульфоніл, 4-толуолсульфоніл, як показано на схемі 2. У реакції V і Va з VI обидві події - алкілування атома сірки в V або Va сполукою VI і закриття кільця з утворенням триазольного кільця - відбуваються за одних реакційних умов в одній реакційній посудині. Схема 2 11 UA 112065 C2 5 10 15 20 25 30 35 Цю реакцію, як правило, проводять в розчиннику, такому як 1-пропанол, толуол, DMF (ДМФ) або ацетонітрил, необов'язково у присутності карбонатної основи, такої як карбонат калію, або третинного аміну, такого як триетиламін або діізопропілетиламін (DIPEA), при температурі в діапазоні від приблизно 0°C до приблизно 200°C, необов'язково під тиском в закритій посудині. Інші відповідні розчинники включають бензол, хлороформ, діоксан, етилацетат, 2-пропанол і ксилол. У альтернативних варіантах можна використовувати суміші розчинників, такі як суміш толуолу/2-пропанолу. Сполуки формули V або є комерційно доступними, або їх можна отримати, як описано в літературі, див., наприклад, Brown et al. Aust. J. Chem. 1978, 31, 397-404; Yutilov et al. Khim. Geter. Soedin. 1988, 799-804; Wilde et al. Bioorg. Med. Chem. Lett. 1995, 5, 167-172; Kidwai et al. J. Korean Chem. Soc. 2005, 49, 288-291. Сполуки формули Va можна отримати, як описано в WO 96/01826, з відповідних 1,2-діамінопіридинів шляхом реакції з тіокарбонілдіімідазолом у відповідному розчиннику, такому як хлороформ, при відповідній температурі, такий як кімнатна температура або +40°C. Необхідні 1,2-діамінопіридини легко отримати з відповідних комерційно доступних 2-амінопіридинів шляхом реакції з відповідним N-амінуючим реагентом, таким як О(мезитилсульфоніл)гідроксиламін, у відповідному розчиннику, такому як хлороформ, при відповідній температурі, такій як 0°C або кімнатна температура, див. WO 96/01826. Сполуки формули VI можна отримати, як описано, наприклад, в Venkatesan, A. et al. ChemMedChem 2008, 3, 1658-1661. Сполуки формули I, де L являє собою -CH=CH- або -CH2-CH2-, можна отримати за допомогою послідовності реакцій, показаної на схемі 3. Схема 3 Конкретніше, сполуки формули I, де L являє собою -CH2-CH2-, можна отримати відновленням алкена формули I, де L являє собою -CH=CH-, гідруванням з використанням каталізатора на основі перехідного металу, такого як паладій, разом з джерелом водню, таким як газоподібний водень, гідрокарбонат амонію або циклогексадієн. Вказані алкени формули I, де L являє собою -CH=CH-, можна отримати за реакцією Віттіга між фосфонієвою сіллю сполуки формули VII і альдегідом формули VIII у відповідному розчиннику, такому як тетрагідрофуран, у присутності відповідної основи, такої як 1,8-діазабіцикло[5,4,0]ундец-7-ен. Фосфонієву сіль сполуки формули VII легко отримати реакцією сполук формули IV (див. схему 1 вище) з трифенілфосфіном за способами, відомими фахівцям в даній галузі хімії. Альдегіди формули VIII можна отримати за способами, описаними в літературі, див., наприклад, Venkatesan, A. et al. ChemMedChem 2008, 3, 1658-1661. Загальні методи 12 UA 112065 C2 5 10 15 20 25 30 Дані аналізу LC-MS (РХ-МС) (рідинної хроматографії з мас-спектрометрією) були отримані з використанням наступного методу. Використовують апарат PE Sciex API 150EX, забезпечений фотоіонізацією при атмосферному тиску, і РХ-систему Shimadzu LC-8A/SLC-10A. Колонка: Waters Symmetry C18 (4,6 х 30 мм) з розміром частинок 3,5 мкм; температура колонки: 60°C; система розчинників: А = вода/трифтороцтова кислота (99,95:0,05) і B = метанол/трифтороцтова кислота (99,965:0,035); метод: елюювання з лінійним градієнтом A:B = від 83:17 до 0:100 протягом 2,4 хвилини і при витраті потоку 3,0 мл/хв. Очищення з використанням препаративної РХ-МС проводять на апараті PE Sciex API 150EX з хімічною іонізацією при атмосферному тиску. Колонка: YMC ODS-A (50 х 20 мм) з розміром частинок 5 мкм; метод: елюювання з лінійним градієнтом з A:B = від 80:20 до 0:100 за 7 хвилин і при витраті потоку 22,7 мл/хв. Збір фракцій проводять за допомогою МС детектора розділеного потоку. 1 Спектри Н ЯМР записують при 500,13 МГц на апараті Bruker Avance AV500 або при 600,16 МГц на апараті Bruker Avance Ultrashield plus. Як внутрішній стандарт використовують ТМС. Значення хімічного зсуву виражають в м.д. (ppm). Для позначення мультиплетності ЯМРсигналів використовують наступні абревіатури: с означає синглет, д означає дублет, т означає триплет, кв означає квартет, квінт означає квінтет, гепт означає гептет, дд означає подвійний дублет, дт означає подвійний триплет, дкв означає подвійний квартет, тд означає триплет дублетів, тт означає триплет триплетів, м означає мультиплет, ушир.с означає розширений синглет і ушир. означає розширений сигнал. Абревіатури відповідають ACS Style Guide: "The ACS Styleguide - A manual for authors and editors" Janet S. Dodd, Ed. 1997, ISBN: 0841234620. Отримання проміжних сполук 5H-імідазо[2,1-a]ізоіндол-2-карбальдегід Розчин сполуки 1 (19 г, 0,097 моль) і фталіміду калію (18 г, 0,097 моль) в ДМФ (100 мл) нагрівали при 100°C протягом 1 години. Суміш виливали у воду (500 мл) і осад відфільтрували і промивали водою. Осад висушували під вакуумом, отримуючи сполуку 2 (21 г, вихід: 65%) у 1 вигляді білої твердої речовини. H-ЯМР (400 МГц, CDCl3): 7,89-7,87 (м, 2H), 7,76-7,74 (м, 2H), 7,67 (д, J=6,8 Гц, 2H), 7,51 (т, J=7,6 Гц, 1H), 7,37 (т, J=8,0 Гц, 2H), 5,09 (с, 2H). 35 Суміш сполуки 2 (21 г, 0,080 моль) і KOH (13 г, 0,230 моль) в EtOH (150 мл) нагрівали при 80°C протягом 0,5 години. Густу суміш охолоджували і фільтрували. Фільтрат розводили водою (1 л) і екстрагували EtOAc (2 рази по 200 мл). Об'єднані органічні шари висушували над Na 2SО4 і концентрували, що давало неочищену сполуку 3 (8,05 г, 63%) у вигляді коричневої твердої речовини. 40 Суміш сполуки 4 (3,9 г, 26,9 ммоль), i-PrOH (7,8 мл), TsOHH2О (73 мг, 0,38 ммоль) і гексану (49 мл) переганяли (атмосферний тиск, температура реакції 67°C) для видалення розчинника, 27 мл розчину, що залишився, додатково переганяли під вакуумом (~8,5 кПа, температура 13 UA 112065 C2 реакції 25°C), що дозволяло отримати неочищений продукт 5 (5,0 г) у вигляді коричневої рідини, яка була нестабільною і використовувалася негайно на наступній стадії. 5 10 15 20 25 30 35 Розчин неочищеної сполуки 3 (8,05 г, 0,061 моль) і неочищеної сполуки 5 (11,8 г, 0,061) перемішували при кімнатній температурі протягом 20 годин, потім до суміші додавали карбонат калію (16,8 г, 122 ммоль) і нагрівали при кип'ятінні зі зворотним холодильником протягом 2 годин. Реакційний розчин концентрували, залишок очищали за допомогою колоночної хроматографії на силікагелі (н-гептан/EtOAc, від 1:1 до 100% EtOAc), що давало сполуку 6 (2,00 1 г, вихід: 6,95%) у вигляді жовтої твердої речовини. H-ЯМР (400 МГц, CDCl3): 9,89 (с, 1H), 7,887,83 (м, 2H), 7,45-7,43 (м, 2H), 7,39-7,37 (м, 1H), 4,93 (с, 2H). Наступні проміжні сполуки отримували аналогічним чином. 1 7-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, H-ЯМР (600 МГц, CDCl3): 9,93 (с, 1H), + 7,92 (с, 1H), 7,91-7,89 (м, 1H), 7,26-7,21 (м, 2H), 5,03 (с, 2H). РХ-МС (MH ): m/z=203,0, tR (хвилини) = 0,53. 1 8-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, H-ЯМР (600 МГц, CDCl3): 9,94 (с, 1H), 7,93 (с, 1H), 7,62 (дд, J=8,0, 2,4 Гц, 1H), 7,48 (дд, J=8,5, 4,5 Гц, 1H), 7,16 (тд, J=8,5, 2,4 Гц, 1H), + 5,02 (с, 2H). РХ-МС (MH ): m/z=203,1, tR (хвилини) = 0,64. 1 7-метокси-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, H-ЯМР (600 МГц, CDCl3): 9,91 (с, 1H), + 7,88 (с, 1H), 7,86-7,83 (м, 1H), 7,05-7,02 (м, 2H), 4,98 (с, 2H), 3,89 (с, 3H). РХ-МС (MH ): m/z=215,0, tR (хвилини) = 0,47. 5,6-дигідроімідазо[2,1-a]ізохінолін-2-карбальдегід Розчин сполуки 7 (4,92 г, 0,037 моль) в толуолі (100 мл) обробляли триетиламіном (10,2 мл, 0,073 моль) і розчин охолоджували до 0°C. Додавали метансульфонілхлорид (2,87 мл, 0,037 моль), після перемішування при цій температурі протягом 10 хвилин розчину дозволяли нагрітися до кімнатної температури, і його перемішували протягом 16 годин. Суміш виливали у воду (250 мл) і екстрагували DCM (2 рази по 250 мл). Об'єднані органічні шари висушували над MgSО4 і концентрували, що давало неочищену сполуку 8 (7,05 г) у вигляді коричневої рідини. 1 H-ЯМР (500 МГц, ДМСО-d6): 7,59 (д, J=7,8 Гц, 2H), 7,44 (д, J=7,8 Гц, 2H), 7,38 (т, J=7,8 Гц, 2H), 7,23 (т, J=7,8 Гц, 1H), 4,43 (т, J=6,8 Гц, 2H), 3,14 (т, J=6,8 Гц, 2H), 3,12 (с, 3H). Метил-4-імідазолкарбоксилат (1,09 г, 8,62 ммоль) поволі додавали до суспензії гідриду натрію (60%-а дисперсія в оливі, 0,52 г, 13 ммоль) в DMF (ДМФ) (40 мл). Суміш нагрівали до 80°C і перемішували при цій температурі протягом 1 години. Розчин сполуки 8 (3,61 г, 12,90 ммоль) в DMF (20 мл) додавали по краплях до реакційної суміші при цій температурі і реакційну суміш перемішували протягом додаткових 12 годин при 80°C. Охолоджену суміш фільтрували, 14 UA 112065 C2 5 10 15 20 25 30 леткі речовини видаляли під вакуумом і залишок очищали за допомогою колоночної хроматографії на силікагелі (від 100%-го н-гептану до 100%-го EtOAc), отримуючи спочатку + сполуку 10 (0,91 г, 34%) у вигляді жовтої напівтвердої речовини з РХ-МС (MH ): m/z=311,3, tR (хвилини) = 1,15, а потім сполуку 9 (1,38 г, вихід: 51%) у вигляді жовтої твердої речовини з РХ+ МС (MH ): m/z=311,3, tR (хвилини) = 1,16. До розчину метилового естеру 1-[2-(2-бромфеніл)етил]-1H-імідазол-4-карбонової кислоти (1,38 г, 4,46 ммоль) в толуолі (20 мл), дегазованому аргоном і нагрітому до 100°C, додавали розчин трибутилгерманій гідриду в толуолі (10 мл), дегазований аргоном. Додавали 2,2'-азо-бісізобутиронітрил (0,88 г, 5,36 ммоль) і реакційну суміш перемішували при 110°C протягом 16 годин. Додавали ще 2,2'-азо-біс-ізобутиронітрил (0,88 г, 5,36 ммоль), реакцію перемішували при 110°C протягом 4 годин. Реакцію гасили, виливаючи в 1М розчин HCl (100 мл), розділяли дві фази і водну фазу екстрагували н-гептаном (2 рази по 100 мл). Водну фазу підлужували насиченим розчином бікарбонату натрію і екстрагували DCM (3 рази по 100 мл). Об'єднані органічні фази висушували над MgSО4, фільтрували і леткі речовини видаляли під вакуумом, осад очищали колоночною хроматографією на силікагелі (від 100%-го н-гептану до 100%-го + EtOAc), отримуючи сполуку 11 (124 мг, 13%) РХ-МС (MH ): m/z=229,2, tR (хвилини) = 0,86. До розчину метилового естеру 5,6-дигідроімідазо[2,1-a]ізохінолін-2-карбонової кислоти (210 мг, 0,92 ммоль) в тетрагідрофурані (THF) (9,6 мл) в атмосфері азоту додали 1М розчин LiAlH 4 в THF (1,1 мл) і розчин перемішували при кімнатній температурі протягом 2 годин. Додали воду (0,5 мл), після чого додали EtOAc (50 мл), і розчин висушували над MgSО 4, фільтрували, і леткі + речовини видаляли під вакуумом, отримуючи сполуку 12 (177 мг, 96%) РХ-МС (MH ): m/z=201,2, tR (хвилини) = 0,29. До розчину (5,6-дигідроімідазо[2,1-a]ізохінолін-2-іл)метанолу (177 мг, 0,88 ммоль) в DCM (10 мл) в атмосфері аргону додали періодинан Десса-Мартіна (41 мг, 0,97 ммоль) і розчин перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш розводили EtOAc (100 мл) і промивали насиченим розчином бікарбонату натрію (3 рази по 50 мл), насиченим сольовим розчином (50 мл), потім висушували за допомогою Na 2SО4, фільтрували і леткі + речовини видаляли під вакуумом, отримуючи неочищену сполуку 13 (165 мг, 94%) РХ-МС (MH ): m/z=199,0, tR (хвилини) = 0,55. 2-хлорметил-5,8-диметил-[1,2,4]триазоло[1,5-a]піридин 15 UA 112065 C2 5 10 15 20 25 До розчину 3,6-диметил-2-піридинаміну (2,00 г, 16,4 ммоль) в 50 мл DCM по краплях додавали розчин гідроксиламін-2,4,6-триметилбензолсульфонату (4,22 г, 19,6 ммоль) в 50 мл CH2Cl2 при 0°C і суміш перемішували і дозволяли нагрітися до кімнатної температури. Розчинники випаровували, а залишок розчиняли в 80 мл MeOH, потім обробляли DBU (3,43 мл, 22,9 ммоль) і розчин перемішували протягом 5 хвилин. Після додавання метилового естеру хлороцтової кислоти (1,44 мл, 16,4 ммоль) отриману суміш перемішували при кімнатній температурі протягом 48 годин. Після концентрації при зниженому тиску залишок розводили водою (100 мл) і екстрагували EtOAc (3 рази по 100 мл). Об'єднані органічні шари промивали водою (50 мл), насиченим сольовим розчином (50 мл), висушували над MgSО 4, фільтрували і концентрували під вакуумом. Залишок очищали колоночною хроматографією на силікагелі (петролейний ефір/EtOAc = 2/1), що давало 2,65 г 2-хлорметил-5,8-диметил-[1,2,4]триазоло[1,5+ a]піридину з виходом 82%. РХ-МС (MH ): m/z=195,9, tR (хвилини) = 1,14. Наступні проміжні сполуки були отримані аналогічним чином. 2-хлорметил-5-метил-[1,2,4]-триазоло[1,5-a]піразин з 2-аміно-6-метилпіразину. Вихід 28%, + РХ-МС: m/z=181,8 (MH ), tR = 0,64 хв. 2-хлорметил-5,8-диметил-[1,2,4]-триазоло[1,5-a]піразин з 2-аміно-3,6-диметилпіразину. 1 Вихід 60%, H-ЯМР (500 МГц, CDCl3): 7,91 (с, 1H), 4,87 (с, 2H), 2,91 (с, 3H), 2,74 (с, 3H), РХ-МС: + m/z=196,9 (MH ), tR = 0,64 хв. 6-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід До розчину сполуки 2A (50 г, 0,37 моль) в CCl4 (500 мл) додали NBS (72,5 г, 0,408 моль) і AIBN (1,2 г, 0,037 моль), реакційний розчин кип'ятили зі зворотним холодильником протягом ночі, ТШХ показала, що реакція завершилася, реакційний розчин фільтрували і концентрували під вакуумом, що давало неочищений продукт, який очищали за допомогою флешхроматографії на силікагелі, проводячи елюювання петролейним ефіром/EtOAc (500:1), що давало цільову сполуку 2B (30 г, вихід: 40%) у вигляді білої твердої речовини. 16 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 До розчину сполуки 2B (60 г, 0,28 моль) і сполуки 1C (78 г, 0,44 моль) в DMF (500 мл) додали Cs2CО3 (150 г, 0,46 моль). Суміш перемішували при кімнатній температурі (12°C) протягом 2 годин. ТШХ вказала, що вся початкова речовина 2В була повністю витрачена. Суміш виливали у воду (2 л), відфільтрували осад, промивали водою (500 мл) і метанолом (500 мл), що давало продукт 2C (85 г, вихід: 92%) у вигляді білої твердої речовини. Суміш сполуки 2C (130 г, 0,466 моль) і KOH (80 г, 1,43 моль) в EtOH (1,8 л) нагрівали при 90°C протягом 0,5 години. ТШХ показала, що реакція завершилася. Суміш охолоджували і фільтрували, жовтуватий фільтрат концентрували під вакуумом, що давало коричневу тверду речовину, яку розводили EtOAc (1 л) і водою (300 мл), водний шар екстрагували EtOAc (5 разів по 300 мл), об'єднані органічні шари промивали насиченим сольовим розчином (300 мл), висушували над безводним Na2SО4, концентрували у вакуумі, що давало продукт 2D (65 г, неочищений) у вигляді коричневої твердої речовини, яка є достатньо чистою для наступної стадії реакції. Суміш сполуки 2D (25 г, неочищеної) і сполуки 1F (43 г, 0,185 моль) в сухому CH3CN (500 мл) перемішували при кімнатній температурі (27°C) протягом ночі. Отриману суміш фільтрували, і промивали MeCN, і висушували під вакуумом, що дозволило отримати сполуку 2E (37 г, вихід: 85%). Розчин сполуки 2E (23 г, 60 ммоль) і Et 3N (7,27 г, 72 ммоль) в сухому CH3CN (400 мл) перемішували при 90°C-100°C з кип'ятінням зі зворотним холодильником протягом 18 годин. Реакційний розчин концентрували. Залишок розводили EtOAc і промивали 20%-вим водним розчином гідрокарбонату калію. Після фільтрації через шар целіту органічний шар висушували (MgSО 4) і концентрували під вакуумом. Осад очищали за допомогою колоночної хроматографії на силікагелі (елюювали PE:EtOAc = 5:1), що давало 6-фтор-5Hімідазо[2,1-a]ізоіндол-2-карбальдегід (1,1 г, вихід: 10%) у вигляді жовтуватої твердої речовини. 1 H-ЯМР (CDCl3, 400 МГц): 9,9 (с, 1H), 7,89 (с, 1H), 7,69 (д, J=7,6 Гц, 1H), 7,50-7,44 (м, 1H), 7,11 (м, 1H), 5,04 (с, 2H). Наступні проміжні сполуки були отримані аналогічним чином: 5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 7-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 8-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 9-фтор-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 6-метоксі-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 7-метоксі-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 8-метоксі-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 9-метоксі-5H-імідазо[2,1-a]ізоіндол-2-карбальдегід, 5H-імідазо[1',2':1,5]піроло[3,4-b]піридин-2-карбальдегід (тобто 6-аза-5H-імідазо[2,1a]ізоіндол-2-карбальдегід), 8H-3,6,8a-триаза-циклопента[a]інден-2-карбальдегід (тобто 7-аза-5H-імідазо[2,1-a]ізоіндол-2карбальдегід), 8H-3,5,8a-триаза-циклопента[a]інден-2-карбальдегід (тобто 8-аза-5H-імідазо[2,1-a]ізоіндол-2карбальдегід), 5H-імідазо[1',2':1,2]піроло[3,4-b]піридин-2-карбальдегід (тобто 9-аза-5H-імідазо[2,1a]ізоіндол-2-карбальдегід). 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[2,1-a]ізоіндол Розчин 2-хлорметил-5,8-диметил-[1,2,4]триазоло[1,5-a]піразину (1,351 г, 6,87 ммоль) і трифенілфосфіну (1,80 г, 6,87 ммоль) в ацетонітрилі (150 мл) нагрівали з кип'ятінням зі зворотним холодильником протягом 12 годин. Розчинники видаляли у вакуумі і залишок суспендували в етері, відфільтрували і висушували, що давало хлорид (5,8-диметил[1,2,4]триазоло[1,5-a]піразин-2-ілметил)трифенілфосфонію у вигляді не зовсім білої твердої + речовини (2,412 г, 74,9%). РХ-МС: m/z=423,2 ([M-Cl] ), tR = 0,86 хв., метод A. Розчин 5H-імідазо[2,1-a]ізоіндол-2-карбальдегіду (150 мг, 0,81 ммоль) в сухому THF (5,3 мл) додавали до (5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-ілметил)-трифенілфосфонію хлориду (374 мг, 0,81 ммоль) під аргоном і додавали 1,8-діазабіцикло[5,4,0]ундец-7-ен (120 мкл, 0,81 17 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 12 годин, після чого її випаровували на силікагелі (2 г). Хроматографія на силікагелі (елюювання з градієнтом; A:B від 100:0 до 0:100, де A являє собою етилацетат, а B являє собою 10% MeOH в етилацетаті) дозволяла отримати вказану в заголовку сполуку у вигляді суміші цис- і транс-ізомерів (139 мг, + 52%). РХ-МС: m/z=329,3 (MH ), tR = 0,96 хв. Наступні проміжні сполуки були отримані аналогічним чином: 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-6-фтор-5H-імідазо[2,1-a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-7-фтор-5H-імідазо[2,1-a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-8-фтор-5H-імідазо[2,1-a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-9-фтор-5H-імідазо[2,1-a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-6-метоксі-5H-імідазо[2,1a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-7-метоксі-5H-імідазо[2,1a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-8-метоксі-5H-імідазо[2,1a]ізоіндол, 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-9-метоксі-5H-імідазо[2,1a]ізоіндол, 2-[(E)-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[1',2':1,2]піроло[3,4b]піридин, 2-[(E)-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[1',2':1,5]піроло[3,4b]піридин. Винахід, розкритий в цьому документі, додатково проілюстрований наступними необмежуючими прикладами. Приклад 1: 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[2,1a]ізоіндол Розчин 2-хлорметил-5,8-диметил-[1,2,4]триазоло[1,5-a]піразину (1,351 г, 6,87 ммоль) і трифенілфосфіну (1,80 г, 6,87 ммоль) в ацетонітрилі (150 мл) нагрівали з кип'ятінням зі зворотним холодильником протягом 12 годин. Розчинники видаляли у вакуумі і залишок суспендували в етері, відфільтрували і висушували, отримуючи 5,8-диметил-[1,2,4]триазоло[1,5a]піразин-2-ілметил)трифенілфосфонію хлорид у вигляді не зовсім білої твердої речовини + (2,412 г, 74,9%). РХ-МС: m/z=423,2 ([M-Cl] ), tR = 0,86 хв., метод A. Розчин 5H-імідазо[2,1-a]ізоіндол-2-карбальдегіду (150 мг, 0,81 ммоль) в сухому THF (5,3 мл) додавали до (5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-ілметил)-трифенілфосфонію хлориду (374 мг, 0,81 ммоль) під аргоном і додавали 1,8-діазабіцикло[5,4,0]ундец-7-ен (120 мкл, 0,81 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 12 годин, після чого її випаровували на силікагелі (2 г). Хроматографія на силікагелі (елюювання з градієнтом; A:B від 100:0 до 0:100, де A являє собою етилацетат, а B являє собою 10% MeOH в етилацетаті) дозволяла отримати вказану в заголовку сполуку у вигляді суміші цис- і транс-ізомерів (139 мг, + 52%). РХ-МС: m/z=329,3 (MH ), tR = 0,96 хв. Приклад 2: Синтез 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1a]ізоіндолу До розчину 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)вініл]-5H-імідазо[2,1a]ізоіндолу (139 мг, 0,423 ммоль) в метанолі (100 мл) додавали 10%-вий паладій на вуглецю (27 мг). Через розчин барботували водень і реакцію підтримували в атмосфері водню протягом ночі при перемішуванні. Після фільтрації органічні речовини випаровували на силікагелі (2 г). Хроматографія (елюювання з градієнтом; A:B від 100:0 до 0:100, де A являє собою етилацетат, а B являє собою 10% MeOH в етилацетаті) дозволяла отримати вказану в заголовку сполуку у 18 UA 112065 C2 вигляді білої твердої речовини (50,6 мг, 36%). H-ЯМР (500 МГц, CDCl3): 7,86-7,82 (м, 2H), 7,46-7,42 (м, 2H), 7,33 (т, J=7,5 Гц, 1H), 7,02 (с, 1H), 4,84 (с, 2H), 3,44 (дд, J=8,9, 6,6 Гц, 2H), 3,33 + (дд, J=8,9, 6,6 Гц, 2H), 2,91 (с, 3H), 2,73 (с, 3H). РХ-МС: m/z=331,0 (MH ), tR = 0,74 хв. Приклад 3: 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5,6-дигідроімідазо[2,1a]ізохінолін 1 5 10 15 20 25 30 35 40 45 50 55 Розчин 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5,6-дигідроімідазо[2,1a]ізохіноліну (210 мг, 0,61 ммоль) в метанолі:DCM (2:1, об./об., 30 мл) пропускали через реактор для гідрування H-Cube® Continuous-flow Hydrogenation Reactor (ThalesNano) із витратою потоку 1 мл/хв. через маленький картридж 10% Pd/C (THS01111) з внутрішньою температурою 25°C і тиском водню 1 бар. Випаровування летких речовин дозволило отримати вказану в заголовку 1 сполуку (75 мг, 19%). H-ЯМР (600 МГц, CDCl3): 8,02 (дд, J=7,7, 1,0 Гц, 1H), 7,83 (с, 1H), 7,33 (ддд, J=7,7, 1,3, 0,7 Гц, 1H), 7,26 (тд, J=7,4, 1,3 Гц, 1H), 7,21 (дд, J=7,4, 0,7 Гц, 1H), 6,73 (с, 1H), 4,10 (т, J=6,9 Гц, 2H), 3,41 (дд, J=9,6, 6,5 Гц, 2H), 3,28 (дд, J=9,6, 6,5 Гц, 2H), 3,13 (т, J=6,9 Гц, + 2H), 2,90 (с, 3H), 2,72 (с, 3H). РХ-МС: m/z=345,1 (MH ), tR = 0,83 хв. Наступні сполуки були отримані аналогічно. 1 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піридин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол, H-ЯМР (600 МГц, ДМСО): 7,67 (д, J=7,5 Гц, 1H), 7,57 (д, J=7,5 Гц, 1H), 7,44 (т, J=7,5 Гц, 1H), 7,38-7,32 (м, 2H), 7,27 (с, 1H), 6,92 (д, J=7,2 Гц, 1H), 4,99 (с, 2H), 3,23-3,16 (м, 2H), 3,09 (дд, J=9,7, 6,3 Гц, + 2H), 2,67 (с, 3H). РХ-МС: m/z=330,2 (MH ), tR = 0,91 хв. 1 2-[2-(5-метил-[1,2,4]триазоло[1,5-a]піридин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол, H-ЯМР (600 МГц, ДМСО): 7,67 (д, J=7,5 Гц, 1H), 7,63 (д, J=8,8 Гц, 1H), 7,59-7,52 (м, 2H), 7,44 (т, J=7,5 Гц, 1H), 7,35 (т, J=7,5 Гц, 1H), 7,26 (с, 1H), 7,03 (д, J=7,0 Гц, 1H), 4,98 (с, 2H), 3,20 (дд, J=9,5, 6,4 Гц, + 2H), 3,09 (дд, J=9,5, 6,4 Гц, 2H), 2,72 (с, 3H). РХ-МС: m/z=315,7 (MH ), tR = 0,78 хв. 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-7-фтор-5H-імідазо[2,1-a]ізоіндол, 1 H-ЯМР (600 МГц, CDCl3): 7,82 (д, J=1,0 Гц, 1H), 7,76 (дд, J=8,3, 5,0 Гц, 1H), 7,16-7,11 (м, 2H), 6,99 (с, 1H), 4,81 (с, 2H), 3,49-3,37 (м, 2H), 3,33-3,22 (м, 2H), 2,89 (с, 3H), 2,70 (с, 3H). РХ-МС: + m/z=349,1 (MH ), tR = 0,80 хв. 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-8-фтор-5H-імідазо[2,1-a]ізоіндол, 1 H-ЯМР (600 МГц, CDCl3): 7,82 (д, J=0,8 Гц, 1H), 7,50 (дд, J=8,3, 2,4 Гц, 1H), 7,37 (дд, J=8,3, 4,6 Гц, 1H), 7,02-6,99 (м, 2H), 4,80 (с, 2H), 3,41 (дд, J=9,0, 6,5 Гц, 2H), 3,31 (дд, J=9,0, 6,5 Гц, 2H), + 2,89 (с, 3H), 2,71 (с, 3H). РХ-МС: m/z=349,1 (MH ), tR = 0,80 хв. 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-7-метоксі-5H-імідазо[2,11 a]ізоіндол, H-ЯМР (600 МГц, CDCl3): 7,82 (д, J=0,7 Гц, 1H), 7,73 (д, J=8,4 Гц, 1H), 7,00-6,93 (м, 3H), 4,78 (с, 2H), 3,86 (с, 3H), 3,41 (дд, J=9,0, 6,6 Гц, 2H), 3,29 (дд, J=9,0, 6,6 Гц, 2H), 2,89 (с, 3H), + 2,71 (с, 3H). РХ-МС: m/z=361,2 (MH ), tR = 0,87 хв. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-7-метоксі-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=361,2 (MH ). Rt=0,87 хв.; метод = 131. 2-{2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол-5-іл}+ пропан-2-ол, РХ-МС: m/z=389,2 (MH ). Rt=0,88 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-6-фтор-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=349,1 (MH ). Rt=0,78 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-9-фтор-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=349,1 (MH ). Rt=0,74 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-8-метоксі-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=361,2 (MH ). Rt=0,85 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-6-метоксі-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=361,2 (MH ). Rt=0,87 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-9-метоксі-5H-імідазо[2,1-a]ізоіндол, + РХ-МС: m/z=361,2 (MH ). Rt=0,85 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[1',2':1,2]піроло[3,4+ b]піридин, РХ-МС: m/z=332,1 (MH ). Rt=0,62 хв.; метод = 131. 2-[2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[1',2':1,5]піроло[3,4+ b]піридин, РХ-МС: m/z=332,2 (MH ). Rt=0,48 хв.; метод = 131. Приклад 4: Синтез 2-[-2-(5,8-диметил-7-окси-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H 19 UA 112065 C2 імідазо[2,1-a]ізоіндолу 5 10 15 20 25 30 35 40 Розчин 2-[-2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндолу (500 мг, 1,51 ммоль) в AcOH (5 мл) обробляли 35%-м водним пероксидом водню (1,3 мл, 15,1 ммоль) і розчин перемішували при 40°C протягом 12 годин. Леткі речовини видаляли у вакуумі і неочищену оливу розчиняли у воді (10 мл) і підлужували до рН 10 за допомогою 2N розчину NaOH. Тверді речовини відфільтрували, промивали водою і висушували при 40°C, отримуючи 1 вказану в заголовку сполуку у вигляді не зовсім білої твердої речовини (101 мг, 20%). H-ЯМР (500 МГц, CDCl3): 7,85 (д, J=7,6 Гц, 1H), 7,70 (с, 1H), 7,49-7,39 (м, 2H), 7,34 (т, J=7,5 Гц, 1H), 7,02 (с, 1H), 4,85 (с, 2H), 3,38 (дд, J=8,8, 6,1 Гц, 2H), 3,34-3,23 (м, 2H), 2,80 (с, 3H), 2,70 (с, 3H). + РХ-МС: m/z=346,9 (MH ), tR = 0,53 хв. Приклад 5: Синтез {2-[2-(5H-імідазо[2,1-a]ізоіндол-2-іл)етил]-5-метил-[1,2,4]триазоло[1,5a]піразин-8-іл}метанолу Розчин 2-[-2-(5,8-диметил-7-окси-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1a]ізоіндолу (91 мг, 0,26 ммоль) в DCM (5 мл) обробляли трифтороцтовим ангідридом (93 мкл, 0,66 ммоль) і розчин перемішували при кімнатній температурі протягом 2 годин. Леткі речовини видаляли у вакуумі, і залишок розчиняли в DCM (10 мл), і додавали насичений розчин карбонату натрію (10 мл). Суміш інтенсивно перемішували протягом 3 годин. Фази розділяли і водну фазу екстрагували DCM (2 рази по 20 мл). Об'єднані органічні шари промивали водою, насиченим сольовим розчином і висушували над MgSО 4, Після випаровування летких речовин залишок очищали препаративною РХ-МС, отримуючи вказану в заголовку сполуку у вигляді не 1 зовсім білої твердої речовини (27 мг, 20%). H-ЯМР (600 МГц, CDCl3): 8,22-8,15 (м, 1H), 7,94 (с, 1H), 7,68-7,54 (м, 3H), 7,21 (с, 1H) 5,14 (с, 2H), 5,10 (с, 2H), 3,47 (ушир.с, 4H), 2,75 (с, 3H), 2,66 (с, + 1H). РХ-МС: m/z=346,9 (MH ), tR = 0,61 хв. Приклад 6: 2-([1,2,4]триазоло[1,5-a]піридин-2-ілсульфанілметил)-5H-імідазо[2,1-a]ізоіндол Використовували адаптацію способу, описаного в WO 96/01826. (2-Іміно-2H-піридин-1іл)амід імідазол-1-карботіонової кислоти (200 мг, 1,37 ммоль) і 2-хлорметил-5H-імідазо[2,1a]ізоіндол (300 мг, 1,46 ммоль) розчиняли в 1-пропанолі (25 мл) і суміш нагрівали з кип'ятінням зі зворотним холодильником протягом 2 годин. Розчинник видаляли при зниженому тиску і залишок розчиняли в дихлорметані. Розчин промивали водою і органічний шар висушували над Na2SО4 і концентрували. Залишок очищали хроматографією на силікагелі, отримуючи вказану в + заголовку сполуку (273 мг, 62%) у вигляді жовтої твердої речовини. РХ-МС: m/z=321,1 (MH ), tR = 1,40 хв., метод B. Наступні сполуки цього винаходу були отримані аналогічно. 2-[(5,7-диметил-[1,2,4]триазоло[1,5-a]піримідин-2-іл)сульфанілметил]-5H-імідазо[2,1+ a]ізоіндол; РХ-МС: m/z=349,1 (MH ), tR = 1,59 хв., метод B. 2-(5,8-диметил-[1,2,4]триазоло[1,5-a]піразин-2-ілсульфанілметил)-5H-імідазо[2,1-a]ізоіндол. Приклад 7: Синтез 2-[-2-(5,8-біс(тридейтерометил-[1,2,4]триазоло[1,5-a]піразин-2-іл)-етил]5,5-дидейтеро-5H-імідазо[2,1-a]ізоіндолу 20 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 До розчину натрію (30 мг, 1,3 ммоль) в дейтерометанолі (MeOD-d4, 4 мл) додали 2-[-2-(5,8диметил-[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол (25 мг, 0,076 ммоль) і розчин перемішували при кімнатній температурі протягом 48 годин. Розчинники видаляли у вакуумі, залишок розчиняли в DCM (10 мл), промивали насиченим розчином бікарбонату натрію, насиченим сольовим розчином і відокремлювали органічний шар. Органічний шар висушували (MgSО4), фільтрували і леткі речовини видаляли у вакуумі, отримуючи вказану в 1 заголовку сполуку у вигляді не зовсім білої твердої речовини (14 мг, 53%). H-ЯМР (600 МГц, MeOD-d4): 7,76 (с, 1H), 7,61 (д, J=7,5 Гц, 1H), 7,41 (д, J=7,5 Гц, 1H), 7,32 (т, J=7,5 Гц, 1H), 7,25 (т, J=7,5 Гц, 1H), 7,05 (с, 1H), 3,26 (дд, J=7,7 Гц, 2H), 3,13 (дд, J=7,7 Гц, 2H). РХ-МС: m/z=338,4 + (MH ), tR = 0,71 хв. Фармакологічне тестування Фермент PDE10A Активний фермент PDE10A отримують за декількома способами для використання в біологічних випробуваннях PDE (Loughney, K. et al. Gene 1999, 234, 109-117; Fujishige, K. et al. Eur J Biochem. 1999, 266, 1118-1127; та Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 70717076). PDE10A може експресуватися у вигляді первинних продуктів трансляції або у вигляді процесованих білків доти, доки вони експресують каталітичний домен. PDE10A може бути отриманий в клітинах різних типів, наприклад в клітинах комах або E. coli. Прикладом способу отримання каталітично активного PDE10A є наступний спосіб: каталітичний домен PDE10A людини (амінокислоти 440-779 з послідовності з номером доступу NP 006652) ампліфікують із загальної РНК мозку людини за допомогою стандартної RT-PCR і клонують в сайти BamH1 і Xho1 вектора pET28a (Novagen). Експресію в E. coli виконують відповідно до стандартних методик. Стисло: плазміди експресії трансформують в штам E. coli BL21 (DE3) і 50 мл культур, інокульованих клітинами, дають зростати до оптичної щільності OD600, рівній 0,4-0,6 перед експресією білка, яку індукують за допомогою 0,5 мМ IPTG (ізопропіл-тіогалактозид). Після індукції клітини інкубують протягом ночі при кімнатній температурі та потім збирають центрифугуванням. Клітини, що експресують PDE10A, знову суспендують в 12 мл (50 мМ TRISHCl, pH 8,0, 1 мМ MgCl2 та інгібітори протеази). Клітини піддають лізису обробкою ультразвуком і після лізування всіх клітин згідно з методиками Novagen додають TritonX100. PDE10A частково очищають на сефарозі Q і більшу частину активних фракцій об'єднують. Дослідження інгібування PDE10A Дослідження PDE10A можна проводити відповідно до наступної методики. Дослідження проводять в зразках об'ємом 60 мкл, що містять фіксовану кількість відповідного ферменту PDE (достатню для перетворення 20-25% циклонуклеотидного субстрату), буфер (50 мМ HEPES 7,6; 3 10 мМ MgCl2; 0,02% Tween 20), 0,1 мг/мл BSA, 225 пКi H-міченого циклонуклеотидного субстрату, міченого тритієм сАМР до кінцевої концентрації 5 нM та змінні кількості інгібіторів. Реакції ініціюють додаванням циклонуклеотидного субстрату і реакції дають можливість протікати протягом однієї години при кімнатній температурі до припинення шляхом змішування з гранулами SPA (15 мкл, 8 мг/мл) силікату ітрію (Amersham). Гранулам дають осідати протягом однієї години в темряві перед прочитуванням планшетів за допомогою лічильника Wallac 1450 Microbeta. Величину виміряного сигналу перетворюють в активність щодо неінгібованого контролю (100%), а значення IC50 можуть бути обчислені з використанням Xlfit-розширення в EXCEL. У контексті цього винаходу аналіз проводили в 60 мкл буфера для аналізу (50 мМ HEPES, рН 7,6; 10 мМ MgCl2; 0,02% Tween 20), що містить достатньо PDE10A, щоб перетворити 20-25% 3 10 нM H-cAMP, і різні кількості інгібіторів. Після 1 години інкубації реакції зупиняли, додаючи 15 мкл ітрій-силікатних SPA-кульок 8 мг/мл (Amersham). Кулькам дозволяли осідати протягом однієї години в темряві перед вимірюванням радіоактивності в лічильнику Wallac 1450 Microbeta. Значення IC50 обчислювали за допомогою нелінійної регресії, використовуючи XLfit (IDBS). Результати експериментів показали, що досліджувані сполуки цього винаходу інгібують фермент PDE10A із значеннями IC50 нижче 10 нМ. 21 UA 112065 C2 5 10 15 20 25 Гіперактивність, індукована фенциклідином (РСР) У дослідженні використовують самців мишей (NMRI, Charles River) з масою тіла 20-25 г. Кожна група мишей, що одержує випробовувану сполуку (5 мг/кг) плюс PCP (2,3 мг/кг), а також паралельні контрольні групи, що одержують ін'єкцією або наповнювач для випробовуваної сполуки плюс РСР, або тільки наповнювач, включає вісім мишей. Об'єм ін'єкції становить 10 мл/кг. Тест проводять в умовах нормального освітлення в кімнаті зі спокійними умовами. Випробовувану сполуку вводять перорально за 60 хвилин до ін'єкції PCP, яку роблять підшкірно. Одразу після ін'єкції РСР мишей поокремо поміщають в спеціально розроблену дослідницьку клітку (20 см х 32 см). Активність кількісно визначають за допомогою 5 х 8 джерел інфрачервоного світла і фотоелементів, розташованих на відстані 4 см. Промені світла проходять крізь клітку на 1,8 см вище за дно клітки. Для реєстрації одиничного пересування необхідний перетин суміжних світлових променів, що запобігає реєстрації руху мишей без пересування. Пересування записують з інтервалами у 5 хвилин протягом періоду в 1 годину. Дію лікарського засобу розраховують за загальною кількістю пересувань, зареєстрованих протягом періоду оцінки поведінки, рівному 1 годині, відповідно до наступної методики. Як початкове значення використовують середню кількість пересувань, викликаних наповнювачем у відсутності PCP. 100-відсотковий ефект PCP, відповідно, обчислюється як загальна кількість мимовільних пересувань за винятком початкового значення. Таким чином, реакцію в групах, що приймають випробовувану сполуку, визначають як обчислену кількість загальних пересувань за винятком початкового значення і виражають у відсотках від аналогічного результату, зафіксованого в паралельній контрольній групі тварин, що одержують РСР. Відсоток реакцій перетворюють у відсоток інгібування. Результати експериментів показали, що досліджувана сполука, 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-a]піразин-2-іл)етил]-5H-імідазо[2,1-a]ізоіндол, являє собою активну in vivo сполуку, яка інгібує гіперактивність, що викликається РСР. ED50=0,2 мг/кг; Інгібування складає 100% при 5 мг/кг. 30 ФОРМУЛА ВИНАХОДУ 1. Сполука загальної структурної формули І R1 R2 (CR3R4)n N HET L N X X 35 40 45 50 X X ,I де n являє собою 0 або 1, X являє собою СН; R1 і R2, кожен, вибрані незалежно з групи, що складається з Н; С1-С6-алкілу; С1-С6-алкіл(С3С8)циклоалкілу; С1-С6-гідроксіалкілу; С1-С6-алкоксигрупи; CH2CN; CH2C(O)NH2; С1-С6арилалкілу; С1-С6-алкілгетероциклоалкілу; галогену і гідроксигрупи; R3 і R4, кожен, вибрані незалежно з групи, що складається з Н, ОН, F, СН3 і ОСН3; L являє собою лінкер, вибраний з групи, що складається з -СН2-СН2-, -СН=СН-, -CH2-S- і -S-CH2;i НЕТ являє собою гетероароматичну групу, вибрану з групи, що складається з [1,2,4]триазоло[1,5-а]піразину, [1,2,4]триазоло[1,5-а]піридину і [1,2,4]триазоло[1,5-а]піримідину, НЕТ може мати до трьох замісників R5, R6 і R7, індивідуально вибраних з групи, що складається з СН3 і ОСН3, і фармацевтично прийнятні кислотно-адитивні солі сполук, що мають загальну структурну формулу І. 2. Сполука за п. 1, де n=0. 3. Сполука за п. 1, де 22 UA 112065 C2 5 10 15 20 25 30 35 40 45 50 а) С1-С6-алкіл вибраний з групи, що складається з метилу, етилу, 1-пропілу, 2-пропілу, ізобутилу; b) С1-С6-алкіл(С3-С8)циклоалкіл являє собою циклопропілметил; c) С1-С6-гідроксіалкіл являє собою гідроксіетил; d) С1-С6-алкоксигрупа вибрана з групи, що складається з метокси- і етоксигрупи; e) С1-С6-арилалкіл вибраний з групи, що складається з бензилу і 4-хлорбензилу; f) С1-С6-алкілгетероциклоалкіл вибраний з групи, що складається з тетрагідропіран-4-ілметилу і 2-морфолін-4-ілетилу; g) галоген являє собою фтор. 4. Сполука за п. 3, де НЕТ вибраний з групи, що складається з 5,8-диметил[1,2,4]триазоло[1,5а]піразину, 5,8-диметил[1,2,4]триазоло[1,5-а]піридину, 5-метил[1,2,4]триазоло[1,5-а]піридину і (5-метил[1,2,4]триазоло[1,5-а]піразин-8-іл)метанолу. 5. Сполука за п. 1, де R1 і R2 незалежно вибрані з групи, що складається з Н, ОН, F, CH3 і ОCH3. 6. Сполука за п. 1, де один або декілька атомів водню в сполуці замінено атомами дейтерію. 7. Сполука за п. 1, де сполука вибрана з групи, що складається з 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу; 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піридин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу; 2-[2-(5-метил[1,2,4]триазоло[1,5-а]піридин-2-іл)етил]-5Н-імідазо[2,1-а]ізоіндолу; 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)вініл]-5Н-імідазо[2,1-а]ізоіндолу; {2-[2-(5Н-імідазо[2,1-а]ізоіндол-2-іл)етил]-5-метил[1,2,4]триазоло[1,5-а]піразин-8-іл}-метанолу і 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-7-фтор-5Н-імідазо[2,1-а]ізоіндолу, 2-[2-(5,8-диметил[1,2,4]триазоло[1,5-а]піразин-2-іл)етил]-5,6-дигідроімідазо[2,1-а]ізохіноліну і їх фармацевтично прийнятних кислотно-адитивних солей. 8. Сполука за будь-яким з пп. 1-7 як лікарський засіб. 9. Сполука за будь-яким з пп. 1-7 для використання при лікуванні нейродегенеративного або психічного розладу, самої по собі або в комбінації з одним або декількома нейролептичними засобами, де нейролептичний засіб вибраний з групи, що складається з сертиндолу, оланзапіну, рисперидону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипрасидону і озанетанту, причому нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, наприклад параноїдного, дезорганізованого, кататонічного, недиференційованого або резидуального типу; шизофреніформного розладу; шизоафективного розладу, наприклад маревного типу або депресивного типу; маревного розладу; біполярного розладу, наприклад біполярного розладу І типу, біполярного розладу II типу, і циклотимічного розладу. 10. Сполука за будь-яким з пп. 1-7 для приготування лікарського засобу для використання при лікуванні нейродегенеративного або психічного розладу, причому нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, наприклад параноїдного, дезорганізованого, кататонічного, недиференційованого або резидуального типу; шизофреніформного розладу; шизоафективного розладу, наприклад маревного типу або депресивного типу; маревного розладу; біполярного розладу, наприклад біполярного розладу І типу, біполярного розладу II типу. 11. Фармацевтична композиція для лікування нейродегенеративного або психічного розладу, яка містить сполуку за будь-яким з пп. 1-7 у терапевтично ефективній кількості як активне начало і один або декілька фармацевтично прийнятних носіїв, розріджувачів і ексципієнтів. 12. Фармацевтична композиція за п. 11, яка відрізняється тим, що містить один або декілька додаткових нейролептичних засобів. 13. Фармацевтична композиція за п. 12, яка відрізняється тим, що нейролептичний засіб вибраний з групи, що складається з сертиндолу, оланзапіну, рисперидону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипрасидону і озанетанту. 14. Фармацевтична композиція за будь-яким з пп. 11-13, яка відрізняється тим, що нейродегенеративний розлад являє собою хворобу Хантінгтона, а психічний розлад вибраний з групи, що складається з шизофренії, шизофреніформного розладу; шизоафективного розладу; маревного розладу; біполярного розладу і циклотимічного розладу. 23 UA 112065 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazole derivatives as pde10a enzyme inhibitors
Автори англійськоюKehler, Jan, Nielsen, Jacob, Marigo, Mauro, Kilburn, John, Paul, Langgard, Morten
Автори російськоюКехлер Ян, Нильсен Якоб, Мариго Мауро, Килберн Джон Пол, Ланггор Мортен
МПК / Мітки
МПК: A61K 31/519, A61P 25/00, A61P 25/24, C07D 519/00, A61P 25/18
Мітки: похідні, імідазолу, інгібітори, ферменту, pde10a
Код посилання
<a href="https://ua.patents.su/26-112065-pokhidni-imidazolu-yak-ingibitori-fermentu-pde10a.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазолу як інгібітори ферменту pde10a</a>
Попередній патент: Спосіб покриття нарізного трубчастого компонента, нарізний трубчастий компонент і результуюче з’єднання
Наступний патент: Способи отримання енамінів
Випадковий патент: Коронувальний електрод