Похідні аміноциклобутану, спосіб їх одержання та їх застосування як лікарських засобів
Формула / Реферат
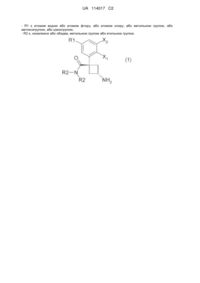
1. Сполука загальної формули (1)
 (1)
(1)
або її фармацевтично прийнятна сіль або сольват,
де:
Х1 є атомом водню або атомом фтору;
Х2 є атомом водню або атомом фтору, або атомом хлору;
R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою;
R2 є, незалежно або обидва, метильною групою або етильною групою.
2. Сполука за п. 1, яка відрізняється тим, що:
Х1 є атомом водню або атомом фтору;
Х2 є атомом водню або атомом фтору, або атомом хлору;
R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою;
R2 є етильною групою.
3. Сполука за п. 1 або 2, яка відрізняється тим, що вона вибрана з наступних сполук:
транс-3-аміно-N,N-діетил-1-фенілциклобутанкарбоксаміду,
транс-3-аміно-N,N-диметил-1-фенілциклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3-ціанофеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3,5-дифторфеніл)-циклобутанкарбоксаміду,
транс-3-аміно-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксаміду.
4. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу.
5. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу для лікування депресії.
6. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу для лікування болю, зокрема болю через надмірну ноцицепцію, невропатичного болю і болю змішаного типу.
7. Фармацевтична композиція, яка містить щонайменше одну сполуку загальної формули (1) за будь-яким з пп. 1-3 і щонайменше один фармацевтично прийнятний ексципієнт.
8. Фармацевтична композиція за п. 7 для застосування як лікарського засобу для лікування та/або профілактики депресії.
9. Фармацевтична композиція за п. 7 для застосування як лікарського засобу для лікування болю, зокрема болю через надмірну ноцицепцію, невропатичного болю і болю змішаного типу.
10. Фармацевтична композиція за будь-яким з пп. 7-9, яка відрізняється тим, що приготована для перорального введення.
11. Фармацевтична композиція за будь-яким з пп. 7-9, яка відрізняється тим, що приготована для місцевого введення.
12. Фармацевтична композиція за будь-яким з пп. 8-11, яка відрізняється тим, що представлена у вигляді щоденної дозованої лікарської форми, що містить від 1 до 1000 мг сполуки загальної формули (1).
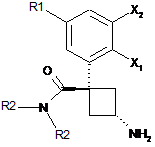
13. Спосіб одержання сполуки загальної формули (1), охарактеризованої в будь-якому з пп. 1-3, який відрізняється тим, що вторинний амін формули (R2)2NH піддають реакції із сполукою формули (С)
 (C)
(C)
з одержанням сполуки формули (D)
 , (D)
, (D)
потім сполуку формули (D) перетворюють на амін формули (1), де значення радикалів R1, R2, Х1 і Х2, присутніх у зазначених реагентах, визначені в п. 1.
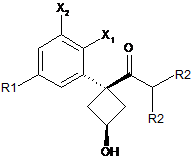
14. Проміжна сполука формули (D)
 , (D)
, (D)
де R1, R2, Х1 і Х2 є такими, як визначено в п. 1, що використовується для одержання сполуки загальної формули (1), охарактеризованої в будь-якому з пп. 1-3.
15. Проміжна сполука формули (С)
 , (C)
, (C)
де R1, Х1 і Х2 є такими, як визначено в п. 1, що використовується для одержання сполуки загальної формули (D), охарактеризованої в п. 14.
Текст
Реферат: Даний винахід стосується похідних аміноциклобутану, зокрема антагоністів NMDA-рецепторів, їх застосування для лікування людини, а також способу їх одержання. Ці сполуки відповідають загальній формулі (1): R1 X2 X1 O R2 N R2 NH2 , (1) де: - Х1 є атомом водню або атомом фтору; - Х2 є атомом водню або атомом фтору, або атомом хлору; UA 114017 C2 (12) UA 114017 C2 - R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою; - R2 є, незалежно або обидва, метильною групою або етильною групою. UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується похідних аміноциклобутану, а також способу їх одержання та їх застосування для лікування людини. Глутаматні NMDA-рецептори (N-метил-D-аспартатні) є іонотропними рецепторами, в ++ основному проникними для іонів Ca . Фізіологічно їх активація викликає відкриття іонного каналу і продукцію вхідного струму, який тільки повільно інактивується. Стимуляція цього рецептора вимагає одночасної присутності глутамату (ендогенного агоніста) і гліцину або Dсерину (ендогенних спів-агоністів), а також деполяризації плазматичної мембрани, що ініціюється не-NMDA струмами. NMDA-рецептори широко поширені по всій центральній нервовій системі, а також присутні на периферії. Вони виявлені в нейронах, астроцитах і олігодендроцитах (Karadottir et al., 2005, Nature, 438, 1162-1166). На рівні нейронів вони знаходяться, в основному, в пост-синапсі, але також і в екстра-синаптичних областях уздовж аксонів. NMDA-рецептори відіграють ключову роль в комунікації і нейронній пластичності, а також в ексайтотоксичності. Фізіологічна активність NMDA-рецепторів має важливе значення для нормального функціонування нейронів (Сhen and Lipton, 2006, J. Neurochem., 97, 1611-1626). З іншого боку, надактивація цих рецепторів залучена як в гострі нервові розлади, наприклад інсульти або черепні травми, так і в стани хронічного стресу, наприклад нейродегенеративні розлади. Вона також є однією з основних причин, які викликають сильне збудження, що приводить до епілептичних припадків. Існують численні патології, які вважають пов'язаними з гіперактивністю NMDA-рецпторів і, отже, потенційно чутливими до антагоністів NMDA. Як приклади можна привести наступне: епілепсія, нейродегенеративні розлади, такі як хвороба Хантінгтона, хвороба Паркінсона, хвороба Альцгеймера, інсульт, бічний амілотрофічний склероз або розсіяний склероз, СНІД-деменції, тривога, депресія і больові синдроми. У даному винаході заявник звертає особливу увагу на антидепресантні і анальгетичні властивостях антагоністів NMDA-рецепторів формули (1). У контексті даного винаходу термін "хронічний біль" означає больові симптоми, які прогресують протягом періоду часу більше трьох місяців, але тяжкість яких може змінюватися з часом. З іншого боку, термін "гострий біль" означає біль, який триває менше трьох місяців. В рамках даного винаходу біль визначений як ненормальний, неприємний, навіть болісний, чутливий і емоційний досвід, який сприймається і є інтегрованим на найвищому рівні кори головного мозку, яка додає йому емоційну і афектну природу. Під "аналгезією" мають на увазі зменшення інтенсивності болю, який відчувають у відповідь на хворобливий подразник. Під "анальгетичним лікарським засобом" (або "анальгетиком") мають на увазі лікарський засіб, який знімає або пригнічує біль, не приводячи до втрати чутливості або свідомості. Біль різної етіології вимагає різних терапевтичних стратегій. Загалом, є декілька категорій болю залежно від залучених механізмів: - біль через надмірну ноцицепцію в результаті пошкоджень або збудження (наприклад запалення) периферичних або вісцелярних тканин; - невропатичний (або нейрогенний) біль пов'язаний з пошкодженням, або з дисфункцією або порушенням соматосенсорної системи; він відрізняється від ноцицептивного болю тим, що має іншу симптоматику; - психогенний (або ідіопатичний) біль, який існує у відсутність пошкоджень. Фізіологічні механізми цього типу болю чітко не визначені. Він, як правило, стійкий до анальгетиків. Проте, деякі типи болю мають характеристики, які є загальними для декількох типів болю. Наприклад, це має місце при болі нижньої частини спини або ракового болю, який присутній у вигляді болю, викликаного надмірною ноцицепцією, або у вигляді невропатичного болю або, в більшості випадків, у вигляді комбінації того і іншого. Депресія визначається в психіатрії як розлад настрою. Вона характеризується втратою мотивації, зв'язаної або не пов'язаної з різними симптомами, такими як безвихідність, низька самооцінка,неспокій, біль і, в крайніх випадках, галюцинації. Вона часто є багатофакторною і, в цілому, має декілька причин. Повідомляється, що близько 7 % європейців страждають від депресії і третина з них стійка до клінічно використовуваних антидепресантів. Витрати на депресію в 15-44-річній віковій групі суспільства є одними з найвищих зі всіх відомих патологій. Одне із завдань даного винаходу полягає в розкритті нових антагоністів NMDA, які мають корисні властивості для такого призначення, для якого існуючі способи лікування не є повністю задовільними. Було показано на мишах, що постійне введення антидепресантів, які мають різні механізми дії (інгібітори моноаміноксидази, трицикліки, інгібітори зворотного захоплення серотоніну (ІЗЗС) або змішані інгібітори зворотного захоплення серотоніну і норадреналіну), змінює розподіл і щільність NMDA-рецепторів. У щурів одноразове внутрішньоочеревинне введення кетаміну, 1 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 60 антагоніста NMDA-рецепторів, зменшує час нерухомості в тесті примусового плавання, визнаної доклінічної моделі для визначення молекул з антидепресантною активністю. Крім того, недавні дослідження показують, що кетамін має властивості антидепресанту у людей. Таким чином, введення однієї субанестетичної дози кетаміну внутрішньовенно пацієнтам з резистентною депресією значно покращує їх стан, і це всього через 2 години після ін'єкції. Досягнуті антидепресантні ефекти продовжувалися більше тижня (Zarate et al., 2006, Arch. Gen. Psychiatry, 63, 856-864). Швидкість цієї дії контрастує з часом, необхідним для відповіді, яке потрібне для звичайних антидепресантів, іншими словами, трицикліків першого покоління і ІЗЗС або ІЗЗН, які вимагають декількох тижнів лікування для досягнення будь-якого позитивного ефекту. Таким чином, представляється, що антагоністи NMDA-рецепторів і, зокрема кетамін, ефективні в лікуванні депресії, особливо в лікуванні депресії, стійкої до існуючих ліків. Терапевтичні вимоги лікування болю значні. Насправді, незліченна кількість людей страждає від гострого болю і більше однієї п'ятої дорослих в Європі і в Сполучених Штатах страждає від хронічного болю (Johannes et al., 2010, J. Pain, 11, 1230-1239). Завданням даного винаходу є розкриття вигідних знеболюючих властивостей, які мають сполуки формули (I), і терапевтичних перспектив, які вони відкривають в лікуванні гострого і хронічного болю. Багато досліджень на тваринах і людях показали, що антагоністи NMDA-рецепторів, такі як кетамін, можуть полегшити біль багатьох типів етіологій, таку як, наприклад, невропатичний, післяопераційний або раковий біль (Cohen et al., 2011, Adv. Psychosom. Med., 30, 139-161). Таким чином, кетамін, що вводиться внутрішньовенно, зменшує невропатичний біль у пацієнтів, резистентних до лікування звичайними антидепресантами. Він також покращує алодинію і підвищену чутливість до болю у пацієнтів з КРБС (комплексним регіональним більовим синдромом) (Finch et al., 2009, Pain, 146, 18-25). Періопераційне введення низької дози кетаміну як ад'юванта знижує потребу в анальгетиках і обмежує гостру толерантність до морфіну після операції (Elia et Tramer, 2005, Pain, 113, 61-70). Як профілактичне лікування кетамін і декстрометорпан (інший антагоніст NMDA) покращують контроль післяопераційного болю (Muir, 2006, Current Opinion in Pharmacology, 6, 53-60). Також виявляється, що кетамін запобігає виникненню хронічного післяопераційного болю (Wilder-Smith et al., 2002, Pain, 97, 189-194). Результати, одержані з іншими антагоністами NMDA, такими як амантадин або МК-801, при невропатичному болю, проте, не є остаточними (Muir, 2006, див. вище). Відкриття каналів NMDA приводить до збільшення внутрішньоклітинного кальцію, який активує, зокрема, NO-синтетазу і циклооксигеназу II типу, що приводить до синтезу простагландинів (ПГ). Інгібуючи ПГ, особливо ПГЕ2, антагоністи NMDA, таким чином, мають прямий вплив на регулювання запальних станів (Beloeil et al., 2009, Anesth. Analg., 109, 943950). Ця додаткова протизапальна активність антагоністів NMDA може бути вигідною в лікуванні гострого або хронічного болю запального походження. Аналогічним чином, NMDA-рецептори експресуються в хондроцитах і сприяють механічній функції клітин (Salter et al., 2004, Biorheology, 41, 273-281). Зокрема, виявляється, що вони залучені в їх проліферацію і запалення, що веде до руйнування суглобового хряща (Piepoli et al., 2009, Osteoarthritis and Cartilage, 17, 1076-1083). Оскільки суглобовий хрящ не регенерується у дорослих, використання антагоніста NMDA, отже, представляється особливо вигідним для запобігання або уповільнення руйнування суглобового хряща, яке супроводжує деякі патологічні стани, такі як, наприклад, запальний моноартрит, ревматоїдний артрит, септичний артрит, остеоартрит, ревматоїдний артрит, подагра, спондилоартрит, гострий позасуглобовий ревматизм. Проте, клінічне застосування антагоністів NMDA у людей обмежене їх небажаними ефектами, зокрема, на центральну нервову систему, і особливо при повторному лікуванні. Серед побічних ефектів антагоністів NMDA можна привести, наприклад, галюцинації, сплутання свідомості, розлади особи, кошмари, тривожне збудження, відсутність концентрації, зміни настрою, судоми, гальмування, сонливість, нудоту (Aarts et Tymianski, 2003, Biochem. Pharmacol., 66, 877-886). Ці побічні ефекти пов'язані з тим, що антагоністи NMDA блокують не тільки надмірну активацію системи глутамат/NMDA, але і порушують її нормальне фізіологічне функціонування. Тому представляється істотним на практиці поліпшити співвідношення ризиккористь клінічно доступних антагоністів NMDA. Коли тип болю, що підлягає лікуванню, є відповідним, наприклад у разі артриту, співвідношення ризик-користь антагоністів NMDA може бути покращене шляхом обмеження його дії на центральну нервову систему, наприклад шляхом місцевого введення. Концентрація сполуки в тканині-мішені, отже, є вищою, ніж його концентрація в крові, тим самим знижуючи ризик токсичності. Тому досліджували епідуральне і місцеве введення деяких антагоністів NMDA. Було показано, що кетамін, який вводиться місцево, є ефективним при лікуванні невропатичного болю, який не проходив за допомогою звичайних ліків. Також були вивчені різні 2 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 комбінації антагоніста NMDA з одним або більше інших анальгетичних засобів при місцевому введенні. Наприклад, кетамін або інші антагоністи NMDA комбінували з антидепресантами або гіпотензивними засобами (US 6 387957), антиепілептичними засобами (WO 03/061656, WO 98/07447, WO 99/12537, US 20040204366, WO 2010036937), адренергічними антагоністами (US 20040101582) або опіоїдами (WO 2000003716). Враховуючи важливу роль, яку відіграють NMDA-рецептори у ряді психіатричних і неврологічних розладів, вони були предметом інтенсивних досліджень, і було описано безліч антагоністів/блокаторів/модуляторів. Вони можуть бути класифіковані в широкому сенсі на три основні групи залежно від їх сайту дії на NMDA-рецептори. Таким чином, вони включають: 1) Конкурентні антагоністи, націлені або на сайт зв'язування глутамату, наприклад, селфотел, перзінфотел і проліки (WO 2009029618), або на сайти зв'язування гліцину, наприклад гавестинел, GV-196771 (Wallace et al., 2002, Neurology, 59, 1694-1700), і хіноліни, розкриті в заявці на патент WO 2010037533. Ця категорія також включає часткові агоністи гліцинових сайтів, такі як D-циклосерин (US 2011160260). 2) Неконкурентні (або алостеричні) антагоністи, які діють на багато сайтів модуляторів регуляції рецепторів, такі як, наприклад, поліамінові і фенілетаноламінові сайти. Сполуки, що належать до цього сімейства, в даний час найбільш клінічно вивчені. Один з головних претендентів є іфенпродил (23210-56-2), і його більш селективні похідні до NMDA-рецептору, такі як, наприклад, траксодопіл, RGH-896, MK-0657, EVT-101 і EVT-103 в даний час проходять клінічні випробування (Mony et al., 2009, Br. J. Pharmacol., 157, 1301-1317). 3) Неконкурентні антагоністи, блокатори пор каналів. Це сімейство препаратів, які мали найбільший клінічний успіх, оскільки кетамін (Ketalar®, знеболювальне/анальгетик), декстрометорфан (Atuxane®, протикашльове), мемантин (Ebixa®, проти хвороби Альцгеймера), амантадин (Mantadix®, противірусне, потім противопаркінсонічне), фелбамат (Taloxa®, протисудомне) є комерційно доступними. Фенциклідин (Sernyl®), розроблений як знеболююче, був відкликаний з ринку, а дизоцилпін (МК-801) не є комерційно доступним як ліки. Сполуки згідно даному винаходу відносяться до цього останнього сімейства неконкурентних антагоністів, які блокують канали NMDA-рецепторів. Основною перевагою сполук цього типу є те, що вони не блокують канал за винятком випадків, коли він відкритий; тому вони є тим більш ефективними, ніж надмірніша активність NMDA-рецепторів. Також можна легко побачити, що біофізичні характеристики блокатора/антагоніста, який впливає на частоту і тривалість відкриття каналу, гратимуть вирішальну роль в його фармакологічній активності і співвідношенні ризик-користь. Було клінічно вивчено декілька сполук цього типу, таких як, наприклад, CNS-5161 (160754-76-7), нерамексан (219810-59-0), димірацетам (126100-97-8), V-3381 (1104525-45-2), NEU-2000 (640290-67-1). Інші знаходяться в доклінічній стадії, серед яких як приклади можна привести оксазолідини, заявлені в заявці на патент WO 2009092324, індани (WO 2009069610), діарилетиламіни (WO 2010074647), арилциклогексиламіни (WO 2010142890), аналоги кетаміну і фенциклідину (Zarantonello et al., 2011, Bioorg. Med. Chem. Lett., 21, 2059-2063). Даний винахід стосується похідних загальної формули (1): де: - X1 є атомом водню або атомом фтору; - X2 є атомом водню або атомом фтору, або атомом хлору; - R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою; - R2 є, незалежно або обидва, метильною групою або етильною групою. Переважно сполуки загальної формули (1) згідно винаходу є такими, де: - X1 є атомом водню або атомом фтору; - X2 є атомом водню або атомом фтору, або атомом хлору; - R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою; - R2 є етильною групою. 3 UA 114017 C2 5 10 15 20 25 Сполуки згідно винаходу можуть існувати у вигляді чистих діастереоізомерів або у вигляді сумішей діастереоізомерів. Конкретніше, даний винахід відноситься до чистих діастереоізомерів, де 1-карбоксамідна група і 3-аміногрупа знаходяться з протилежних сторін від площини, визначуваної циклобутаном. Це стереохімічне положення вказаних замісників називається в даному винаході "транс". Таким чином, винахід стосується чистих трансдіастереоізомерів наступних продуктів: - транс-3-аміно-N,N-діетил-1-фенілциклобутанкарбоксаміду, - транс-3-аміно-N,N-диметил-1-фенілциклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3-метоксифеніл)-циклобутан-карбоксаміду, - транс-3-аміно-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3-ціанофеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3,5-дифторфеніл)-циклобутанкарбоксаміду, - транс-3-аміно-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксаміду, а також їх фармацевтично прийнятних солей. Термін "чисті діастереоізомери" означає, що "транс" діастереоізомер сполуки загальної формули (1) містить менше 5 % "цис" діастереоізомера, тобто сполуки, в якої 1-карбоксамідна група і 3-аміногрупа знаходяться в одному напівпросторі від площини, визначуваної циклобутаном. Термін "діастереоізомери" означає в контексті даного винаходу стереоізомери, які не є дзеркальним відображенням один одного. Термін "стереомери" означає в контексті даного винаходу ізомери ідентичної будови, але які відрізняються по розташуванню атомів в просторі. Найбільш близький аналог представлений похідними, описаними в заявці на патент WO 2003063797 і які мають наступну формулу: () p () 30 35 40 45 m де: m і p незалежно дорівнюють 0, 1, 2 або 3; пунктирна лінія означає подвійний зв'язок, коли R1a відсутній; R1 може бути групою NR6R7, де R6 і R7 можуть бути атомом водню; R1a може бути атомом водню; R2 може бути заміщеною або незаміщеною арильною групою; J може бути зв'язком; R3 може бути групою –C(Z1)–R5, де R5 може бути групою NR6aR7a; R6a і R7a можуть бути заміщеною або незаміщеною алкільною групою, і Z1 можливо є карбонільною групою (C=O); Rx може бути однією або декількома заміщеними або незаміщеними групами, приєднаними до всіх доступних атомів вуглецю в кільці, а також атомом водню. Отже, ця заявка на патент охоплює значну кількість сполук, велика частина яких відноситься до типу циклобутану (m=0 і p=1). У цій заявці на патент як приклади представлено тільки чотири сполуки із зазначеної групи сполук. Це стосується сполук наступної формули: 4 UA 114017 C2 5 10 15 20 25 30 де G є групами NH2 або N(CH3)2, або NH(CH2CH3), або NH(CH2CHCH2). Заявлено, що сполуки цієї заявки на патент є інгібіторами струму, продукованого потенціалзалежними калієвими каналами типу Kv1, зокрема струму, що продукується ізоформою Kv1.5. Зазначено, що вони корисні в широкому діапазоні свідчень, які не включають лікування депресії або болю. Важливо відзначити, що сполуки згідно даному винаходу не взаємодіють з калієвими каналами і, зокрема, з каналами типу Kv1.5. Крім того, виявлено, що активність сполуки згідно винаходу як антагоніст NMDA є дуже чутливою до структурних змін сполук формули (1). Таким чином, активність антагоніста NMDA пригнічується, коли: 1) 1-карбоксамідна група відновлена в 1-амінометильну групу, як у циклобутанових сполук заявки на патент WO 2003/063797; 2) аміногрупа в положенні 3 в циклобутані відрізняється від первинної аміногрупи (NH2). У заявці на патент WO 2003063797 3-аміногрупу заміщено групою C(G)=NCN; 3) відсутня "цис" стереохімія між 1-арильною групою і 3-аміногрупою. Фактично, коли 1арильна група і 3-аміногрупа знаходяться в "транс" положеннях, відповідні сполуки не мають спорідненості до NMDA-рецептора. Рівень техніки також представлений похідними, описаними в заявці на патент WO 99/52848 і які мають наступну формулу: де: X не є атомом водню; A може бути групою NR7, де R7 не є атомом водню; R3 може бути групою C(O)NR8R10, де R8 і R10 можуть бути C1–C4 алкільними ланцюгами. Заявлено, що ці сполуки є селективними інгібіторами фосфодіестераз 4 типу, корисними для лікування запальних і аутоімунних захворювань. Отже, сполуки згідно даному винаходу відрізняються від сполук, описаних в заявці WO 99/52848, як в сенсі їх хімічної структури, так і в сенсі їх фармакологічної активності. Рівень техніки також представлений похідними, описаними в заявці на патент WO 2010/112597 і які мають наступну формулу: a де: а може бути одинарним зв'язком; 5 UA 114017 C2 5 10 15 20 25 30 35 40 45 Ar є заміщеною або незаміщеною фенільною групою або піридином-3-іл, заміщеним одним або більше атомами галогену або алкільними групами, або алкоксидними групами, або ціаногрупою; R1 і R2 можуть, незалежно або обидва, бути C1–C6 алкільною групою. На відміну від сполук заявки на патент WO 2010/112597 сполуки згідно даному винаходу не мають спорідненості до сайтів зворотного захоплення серотоніну і норадреналіну. Сполуки формули (1), отже, відрізняються від описаних в заявці WO 2010/112597, не тільки з точки зору їх хімічної структури, але також з точки зору їх фармакологічної активності. Рівень техніки, нарешті, також представлений сполуками, описаними в заявці на патент WO 2000/051607 і які мають наступну формулу: де R12 і R13 є C1–C6 алкільною групою або C2–C6 алкенільною групою, або C2–C6 алкінільною групою, заміщеною або незаміщеною. Зазначені похідні є модуляторами хемокінів, корисними для профілактики або лікування деяких запальних або імунних захворювань. Тут знову сполуки згідно даному винаходу, таким чином, відрізняються від описаних в заявці WO 2000/051607, з точки зору їх хімічної структури і їх фармакологічної активності. Даний винахід також охоплює солі похідних загальної формули (1) з фармацевтично прийнятними органічними або мінеральними кислотами. У даному винаході термін "фармацевтично прийнятний" відноситься до молекулярних фрагментів і композицій, які не мають негативного або алергічного ефекту, або будь-якої небажаної реакції при введенні людині. При використанні в даному описі термін "фармацевтично прийнятний ексципієнт" включає будь-які розчинники, ад'юванти або ексципієнти, такі як консерванти, наповнювачі, дезінтегруючі агенти, змочуючі агенти, емульгатори, диспергуючі агенти, антибактеріальні або протигрибкові агенти, або навіть агенти, які допомагають уповільнити поглинання і резорбцію в кишечнику і травному тракті. Використання цих середовищ або носіїв добре відоме фахівцям в даній області. Термін "фармацевтично прийнятні солі" сполуки відноситься до солей, визначених тут, які мають фармакологічну активність початкової сполуки. Такі солі включають кислотноадитивні солі, утворені з мінеральними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і тому подібне, або утворені з органічними кислотами, такими як оцтова кислота, бензолсульфонова кислота, бензойна кислота, камфорсульфонова кислота, лимонна кислота, етансульфонова кислота, фумарова кислота, глюкогептонова кислота, глюконова кислота, глутамінова кислота, гліколева кислота, гідроксинафтоєва кислота, 2-гідроксиетансульфонова кислота, молочна кислота, малеїнова кислота, яблучна кислота, мигдалева кислота, метансульфонова кислота, муконова кислота, 2нафталінсульфонова кислота, пропіонова кислота, саліцилова кислота, янтарна кислота, дибензоїл-L-винна кислота, винна кислота, п-толуолсульфонова кислота, триметилоцтова кислота, трифтороцтова кислота і т. п. Фармацевтично прийнятні солі також включають адитивні форми з розчинником (сольвати) або кристалічні форми (поліморфи), такі як визначено в даному описі, тих же кислотноадитивних солей. Даний винахід також охоплює сполуки формули (1) та їх фармацевтично прийнятні солі для застосування як лікарського засобу. Даний винахід відноситься до сполук формули (1) та їх фармацевтично прийнятних солей для застосування як антагоністів NMDA-рецепторів. Даний винахід також відноситься до сполук формули (1) та їх фармацевтично прийнятних солей для застосування як лікарського засобу для лікування та/або профілактики депресії. 6 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід також відноситься до сполук формули (1) та їх фармацевтично прийнятних солей для застосування як лікарського засобу для лікування болю, особливо болю, викликаному надмірною ноцицепцією, невропатичного болю і болю змішаного типу. Серед типів болю, потенційно чутливих до дії сполук загальної формули (1), можна привести, зокрема, в якості не обмежуючих прикладів: - периферійний або центральний невропатичний біль в результаті нервових поразок травматичного походження (наприклад інсульт), метаболічного походження (наприклад цукровий діабет), інфекційного походження (наприклад ВІЛ, оперізувальний лишай, герпес), невралгію трійчастого нерва, біль через хіміотерапію та/або променеву терапію; - запальний біль, наприклад, ревматоїдний артрит, септичний артрит, остеоартрит, поліартрит, подагра, спондилоартрит, гострий ревматизм, позасуглобовий вісцелярний біль, наприклад синдром подразненого кишечника, хвороба Крону; - біль через надмірну ноцицепцію, такий як посттравматичний біль, післяопераційний біль, опіки, скручування/розтягування, ниркова або печінкова коліка, біль в суглобах, артрит, спондилоартропатії; - біль змішаного типу, такий як біль, викликаний раком, біль в спині і поясниці, або інші типи болю, які важко класифікувати, наприклад головні болі, фіброміалгії, болі, пов'язані з судинними/ішемічними проблемами, такими як стенокардія, хвороба Рейно. Даний винахід також відноситься до сполук формули (1) та їх фармацевтично прийнятних солей для застосування як лікарського засобу для лікування та/або профілактики запалення суглобів. Серед видів запалення, потенційно чутливих до дії сполуки загальної формули (1), можна привести, зокрема, в якості не обмежуючих прикладів: запальний моноартрит, ревматоїдний артрит, септичний артрит, остеоартрит ревматоїдний поліартрит, подагра, спондилоартрит, гострий позасуглобовий ревматизм. Даний винахід, крім того, відноситься до фармацевтичної композиції, яка характеризується тим, що вона містить щонайменше одну сполуку загальної формули (1) або одну з її фармацевтично прийнятних солей як активний інгредієнт. Даний винахід також відноситься до фармацевтичної композиції для застосування як лікарського засобу для лікування та/або профілактики депресії. Даний винахід також відноситься до фармацевтичної композиції для застосування як лікарського засобу для лікування болю, особливо болю, викликаного надмірною ноцицепцією, невропатичному болю і болю змішаного типу. Фармацевтичні композиції відповідно до даного винаходу можуть бути приготовані для введення людині. Ці композиції одержують таким чином, що вони можуть бути введені перорально, сублінгвально, підшкірно, внутрішньом'язово, внутрішньовенно, локально, трансдермально або ректально. В цьому випадку активний інгредієнт може бути введений у вигляді одиничних форм введення, змішаних із звичайними фармацевтичними носіями для людини. Відповідні одиничні форми введення включають форми для перорального введення, такі як таблетки, капсули, порошки, гранули і пероральні розчини або суспензії, сублінгвальні і букальні форми введення, підшкірні, місцеві, внутрішньовенні, внутрішньом'язові, інтраназальні або внутрішньоочні форми введення і ректальні форми введення. Переважно фармацевтична композиція згідно даному винаходу приготована для введення пероральним або місцевим шляхом. Місцеве введення є переважним способом для лікування певних типів болю, наприклад, такий як суглобовий біль. Термін "місцеве введення" відноситься до місцевого введення на шкіру або слизисту оболонку. Відповідні композиції для вибраної форми введення відомі фахівцям в даній області і описані, наприклад, у виданні Remington, The Science і Practice of Pharmacy, 19th edition, 1995, Mack Publishing Company. Коли готують тверду композицію у формі таблеток, активний інгредієнт змішують з фармацевтичним носієм, таким як желатин, крохмаль, лактоза, стеарат магнію, тальк, гуміарабік, діоксид кремнію або тому подібне. Таблетки можуть бути покриті сахарозою або іншими відповідними матеріалами, або вони можуть бути оброблені таким чином, що вони матимуть пролонговану або сповільнену дію, і вивільнятимуть задану кількість активного інгредієнта в безперервному режимі. Композицію у формі капсули одержують шляхом змішування активного інгредієнта з розчинником і виливання одержаної суміші в м'які або тверді капсули. Композиція у формі сиропу або еліксиру може містити активний інгредієнт разом з підсолоджувачем і антисептиком, а також ароматизатором і відповідним барвником. 7 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 Порошки або гранули, диспергуючі у воді, можуть містити активний інгредієнт в суміші з диспергуючими агентами або змочуючими агентами, або суспендуючими агентами, а також з коригентами аромату або підсолоджувачами. Для ректального введення використовують супозиторії, які одержують із зв'язуючими агентами, які розчиняються при ректальній температурі, наприклад з маслом какао або поліетиленгліколями. Для парентерального (внутрішньовенного, внутрішньом'язового, внутрішньошкірного, підшкірного), інтраназального або внутрішньоочного введення використовують водні суспензії, ізотонічні сольові розчини або стерильні та ін'єкційні розчини, які містять диспергуючі агенти та/або фармакологічно прийнятні змочуючі агенти. Активні інгредієнти можуть бути також приготовані у вигляді мікрокапсул, можливо з однією або більше добавок-носіїв, якщо це необхідно. Місцеве введення фармацевтичної композиції можна здійснити шляхом нанесення розчину, дисперсії, гелю, лосьйону, молочка, мазі, мазеподібного крему, крапель або іншого носія, використовуваного для місцевого нанесення і добре відомого фахівцю в даній області техніки. Одним можливим способом є введення фармацевтичної композиції за допомогою аерозолю, що розпилює дрібні краплі рідини для розподілу по всій поверхні, належній обробці, або навпаки для обмеження розподілу по точно певній зоні, належній обробці, або в твердій формі, такій як олівець. Іншим прикладом є пластир або стрічка, яка забезпечує безперервне вивільнення місцевої композиції. Пластир може бути резервуаром або пористою мембраною, або твердою матрицею, добре відомою фахівцю в даній області техніки. Також можна використовувати інші способи введення, такі як іонофорез або електропорація. Композиції, описані в даному винаході, можуть також включати інгредієнти або сполуки, що зазвичай змішуються в таких місцевих композиціях, наприклад, композиції можуть також включати додаткові інгредієнти, такі як носії, зволожувачі, масла, жири, віск, поверхнево-активні речовини, загусники, антиоксиданти, стабілізатори в'язкості, хелатуючі агенти, буфери, консерванти, аромати, барвники, вологоутримуючі засоби, пом'якшувальні, диспергуючі агенти, сонцезахисні креми із сполуками, блокуючими випромінювання, і особливо з УФ-блокаторами, антибактеріальні, протигрибкові, дезинфікуючі засоби, вітаміни, антибіотики або інші засоби проти акне, а також інші адаптовані речовини, що не мають шкідливого негативного впливу на активність місцевої композиції. Наприклад, можна використовувати додаткові інгредієнти, такі як кислий фосфат натрію, екстракт гамамелісу, гліцерин, абрикосове масло, кукурудзяна олія. На додаток до сполук, описаних вище, композиції згідно даному винаходу можуть необов'язково містити інші інгредієнти. Наприклад, можна додавати триетаноламін як агент, утворюючий сітчасту структуру. Також можна додавати консервант, такий як бутильований гідрокситолуол. Також можна додавати інші агенти, що знижують подразнення, включаючи, але не обмежуючись гліцерином. Композиції для місцевого введення можуть містити звичайні пом'якшувальні речовини і емульгатори, включаючи альгінати, стеарат гліцерину, ПЕГ-100стеарат, кетиловий спирт, пропілпарабен, бутилпарабен, сорбітоли, етоксилований ангідросорбітолмоностеарат (Tween), білий вазелін (вазелін), триетаноламін, масло ему, алое віра, ланолін, масло какао та інші екстракти. Описані композиції можна наносити на область шкіри пацієнта, об'єкта лікування. Частота нанесення залежатиме від обставин і пацієнта. Наприклад, композиції можна наносити один раз на день, двічі на день або навіть частіше. Дози сполуки загальної формули (1) або однієї з її фармацевтично прийнятних солей в композиції за винаходом можна регулювати, щоб одержати кількість речовини, яка є ефективною для досягнення необхідної терапевтичної відповіді для композиції, яка є специфічною для способу введення. Ефективна доза сполуки згідно винаходу варіює залежно від багатьох параметрів, таких як, наприклад, вибраний спосіб введення, вага, вік, стать, вид захворювання, чутливість пацієнта, об'єкта лікування. Отже, оптимальне дозування може бути встановлено фахівцями в даній області залежно від параметрів, які фахівець вважає релевантними. Хоча ефективні дози можуть варіювати в широких пропорціях, добові дози можна масштабувати в діапазоні від 1 мг до 1000 мг за 24 г на дорослу людину середньої ваги 70 кг на одну або більше розділених доз. Нарешті, винахід включає спосіб синтезу сполук загальної формули (1), а також проміжних сполук формули (C) і (D). Сполуки загальної формули (1) можуть бути одержані способом, описаним нижче на схемі реакції. 8 UA 114017 C2 5 10 15 20 Схема реакції При одержанні сполук згідно винаходу як початковий матеріал використовують похідні бензолоцтової кислоти формули (A), які є у продажу, такі як бензолоцтова кислота (RN 103-822); 2-фторбензолоцтова кислота (RN 451-82-1); 3-фторбензолоцтова кислота (RN 331-25-9); 3хлорбензолоцтова кислота (RN 1878-65-5); 3-метилбензолоцтова кислота (RN 621-36-3); 3ціанобензолоцтова кислота (RN 1878-71-3); 3-метоксибензолоцтова кислота (RN 1798-09-0); 2,5-дифторбензолоцтова кислота (RN 85068-27-5); 3,5-дифторбензолоцтова кислота (RN 105184-38-1); 3,5-дихлорбензолоцтова кислота (RN 51719-65-4); 2-фтор-3-хлорбензолоцтова кислота (RN 261762-96-3). Похідні формули (A) конденсують з епіхлоргідрином відповідно до способу, який адаптований, виходячи із способу, описаного в заявці на патент WO 2007/038452, для одержання похідних формули (B), де групи спирту і карбонової кислоти мають "цис" стереохімію. Вказаний патент не описує проміжних продуктів формули (B). Лактони формули (С) потім одержують з похідних формули (В) за допомогою звичайного способу активації кислотної групи, наприклад такого, де використовують алкілхлорформіат, як описано в заявці WO 2008/092955. Відкриття лактону формули (С) потім переважно проводять з використанням магнієвої солі відповідного вторинного аміну згідно Williams et al. (Tetrahedron Lett., 1995, 36, 5461-5464) з одержанням відповідного карбоксаміду формули (D). Введення первинної аміногрупи в положенні 3 циклобутану з інверсією стереохімії може бути досягнуто через 9 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 60 проміжний азид формули (E) відповідно до Soltani Rad et al. (Tetrahedron Lett., 2007, 48, 34453449). Відновлення азидогрупи у відповідний первинний амін потім проводять або шляхом каталітичного гідрування, або шляхом реакції Штаудінгера. Альтернативне перетворення сполуки формули (D) на амін формули (1) може бути здійснено через проміжний фталімід формули (F) відповідно до звичайного способу Габріеля (див., наприклад, WO 2006081179). Наступні приклади ілюструють винахід без обмеження. У прикладах нижче: i. різні кристалічні форми можуть привести до різних температур плавлення; температури плавлення, приведені в цій заявці, є температурами плавлення продуктів, одержаних способами, які описані і не коректовані; ii. структура продуктів, одержаних згідно винаходу, підтверджена за допомогою спектрів ядерного магнітного резонансу (ЯМР) і мас-спектрометрією; чистота кінцевого продукту перевірена за допомогою ТШХ і процентного аналізу; iii. спектри ЯМР записані у вказаному розчиннику: хімічні зсуви (δ) виражені в частинах на мільйон (ppm) відносно тетраметилсилану; мультиплетність сигналів позначена: s - синглет; d дублет; t - триплет; q - квадруплет; qu - квінтуплет, m - мультиплет, l - великий; iv. різні символи для одиниць вимірювання мають звичайний сенс: мкг (мікрограм); мг (міліграм); г (грам); мл (мілілітр); мВ (мілівольт); °C (градус Цельсія); ммоль (мілімоль), нмоль (наномоль); см (сантиметр); нм (нанометр); хв (хвилина); мс (мілісекунда), Гц (герц); v. абревіатури мають наступні значення: т.пл. (температура плавлення); т.кип. (температура кипіння); vi. термін "температура навколишнього середовища" відноситься до температури між 20 °C і 25 °C. Приклад 1: транс-3-аміно-N,N-діетил-1-фенілциклобутанкарбоксамід (1a1) Стадія 1: цис-1-феніл-3-гідрокси-циклобутанкарбонова кислота (B1) Поміщають 2,2 екв ізопропілмагнійхлориду в трьохгорлову колбу і охолоджують реакційне середовище до 0 °C. Додають 1 екв фенілоцтової кислоти, розведеної в ТГФ; температура повинна бути між 40 і 50 °C. Охолоджують середовище до 20 °C і додають 1,8 екв епіхлоргідрину; температура повинна бути між 20 і 25 °C, і перемішують при цій температурі протягом 45 хв. Потім додають 2 екв ізопропілмагнійхлориду (2M в ТГФ) і перемішують при кімнатній температурі протягом 2 г. Потім нагрівають реакційне середовище до 60 °C протягом 19 г. Дають середовищу остигнути, потім підкислюють розчином HCl (1Н) до рН 1. Додають дихлорметан (ДХМ) і екстрагують. Декантують, органічну фазу сушать над MgSO4, потім випаровують ДХМ при зниженому тиску. Залишок очищають флеш-хроматографією з наступним елюентом: ДХМ, потім ДХМ/метанол 70:30. Продукт, вказаний в заголовку, одержують у вигляді блідо-жовтої твердої речовини (вихід = 70 %). C11H12O3 (молекулярна маса (МВ) = 192). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.50 (m, 2H), 2.74 (t, 2H, J=9.4 Гц), 3.32 (s, 1H), 3.85 (qu, 1H, J=7.2 Гц), 7.22–7.38 (m, 5H), 12.21 (s, 1H). + SM-ESI (мас-спектрометрія з іонізацією електророзпиленням): 193.1 (MH ). Стадія 2: 4-феніл-2-оксабіцикло[2.1.1]гексан-3-он (C1) Поміщають 1 екв сполуки (В1) у колбу, розбавляють в ТГФ і 1,03 екв триетиламіну. Перемішують при кімнатній температурі до повного розчинення, потім охолоджують реакційне середовище до 0 °C. Додають 1 екв етилхлорформіату і перемішують при цій температурі протягом 1 г, потім доводять до кімнатної температури і перемішують протягом 20 г. Випаровують ТГФ при зниженому тиску, відбирають залишок етилацетатом (AcOEt). Декантирують, сушать ацетат над MgSO4, потім випаровують при зниженому тиску. Залишок очищають флеш-хроматографією з наступним елюентом: гептан, потім гептан/етилацетат 60:40. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 87 %). C11H10O2 (МВ = 174). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.71 (m, 2H), 2.89 (m, 2H), 4.97 (s, 1H), 7.31–7.42 (m, 5H). + SM–ESI: 175 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-фенілциклобутанкарбоксамід (D1a) Поміщають 1 екв сполуки (C1), 2 екв діетиламіну і ТГФ в трьохгорлову колбу. Охолоджують реакційне середовище до -20 °C, потім додають по краплях 3 екв ізопропілмагнійхлориду (2M в ТГФ), підтримуючи температуру нижче -5 °C. Суміш перемішують протягом 2 г при температурі між -10 і -20 °C. Гідролізують реакційне середовище насиченим розчином NaCl, потім додають розчин HCl (1Н) і екстрагують етилацетатом. Органічну фазу сушать над MgSO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією з наступною сумішшю в якості елюента: ДХМ/метанол 85:15. Продукт, вказаний в заголовку, одержують у вигляді блідо-жовтої твердої речовини (вихід = 99 %). 10 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 60 C15H21NO2 (МВ = 247). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.63 (t, 3H, J=7.2 Гц), 1.08 (t, 3H, J=7.2 Гц), 2.72 (m, 2H), 2.82 (m, 2H), 2.90 (q, 2H, J=7.2 Гц), 3.21 (q, 2H, J=7.2 Гц), 4.36 (qu, 1H, J=7.4 Гц), 7.21–7.36 (m, 5H). Сигнал, відповідний H в OH, в спектрі не видний. + SM–ESI: 248 (MH ). Стадія 4: транс-3-азидо-N,N-діетил-1-фенілциклобутанкарбоксамід (E1a) Поміщають 1 екв сполуки (D1a), 1,5 екв N-(п-толуолсульфоніл)імідазолу, 2 екв триетиламіну, 0,025 екв йодиду тетрабутиламонію, 3 екв азиду натрію і ДМФ в колбу. Перемішують і нагрівають реакційне середовище при температурі 160 °C протягом 4 г. Виливають реакційне середовище на крижану воду і екстрагують етиловим ефіром. Органічну фазу сушать над MgSO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією з наступною сумішшю в якості елюента: гептан/AcOEt 70:30. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 65 %). C15H20N4O (МВ = 272). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.52 (t, 3H, J=7.2 Гц), 1.11 (t, 3H, J=7.2 Гц), 2.47 (m, 2H), 2.89 (q, 2H, J=7.2 Гц), 3.14 (m, 2H), 3.34 (q, 2H, J=7.2 Гц), 3.96 (qu, 1H, J=7.8 Гц), 7.23 (m, 3H), 7.35 (m, 2H). + SM–ESI: 273 (M+H ). Стадія 5: транс-3-аміно-N,N-діетил-1-фенілциклобутанкарбоксамід (1a1) Розчиняють 1 екв сполуки (E1a) в метанолі в колбі. Розчин дегазують протягом 30 хв азотом, потім додають Pd/C (20 мас. %). Систему продувають (цикл: вакуум/газообразний H2) і гідрують реакційне середовище протягом 3 г при кімнатній температурі при перемішуванні. Каталізатор фільтрують і випаровують розчинник. Осад очищають флеш-хроматографією з наступною сумішшю в якості елюента: ДХМ/метанол/NH4OH: 90:9:1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 70 %). C15H22N2O (МВ = 246). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.50 (t, 3H, J=7.2 Гц), 1.10 (t, 3H, J=7.2 Гц), 2.11 (m, 2H), 2.92 (q, 2H, J=6.8 Гц), 3.12 (m, 2H), 3.32 (q, 2H, J=6.8 Гц), 3.46 (qu, 1H, J=8.0 Гц), 7.18–7.35 (m, 5H). Сигнал, відповідний H в NH2, в спектрі не видний. + SM–ESI: 247 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 185 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.42 (t, 3H, J=7.0 Гц), 1.02 (t, 3H, J=7.0 Гц), 2.56 (m, 2H), 2.85–2.96 (m, 4H), 3,25 (q, 2H, J=6.8 Гц), 3.54 (qu, 1H, J=8.4 Гц), 6.03 (s, 2H), 7.26 (m, 3H), 7.39 (t, 2H, J=7.6 Гц), 8.00 (s, 2H). Сигнал, відповідний H в NH2, в спектрі не видний. 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.02, 12.15, 36.93, 39.19, 40.07, 41.19, 46.61, 124.87, 126.51, 128.71, 136.02, 142.69, 167.19, 171.10. % Теоретичний: C 62.97, H 7.23, N 7.73. % Виявлений: C 63.00, H 7.17, N 7.78. Приклад 2: транс-3-аміно-N,N-диметил-1-фенілциклобутанкарбоксамід (1a2) Стадія 3: цис-3-гідрокси-N,N-диметил-1-фенілциклобутанкарбоксамід (D1b) Ідентична стадії 3, описаній в Прикладі 1, при використанні диметиламіну замість діетиламіну. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 89 %). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.65 (m, 2H), 2.55 (s, 3H), 2.95 (s, 3H), 2.80 (m, 2H), 4.27 (qu, 1H, J=7.8 Гц), 7.19–7.35 (m, 5H). Сигнал, відповідний H в OH, в спектрі не видний. Стадія 4: транс-3-азидо-N,N-диметил-1-фенілциклобутанкарбоксамід (E1b) Ідентична стадії 4, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді бежевої твердої речовини (вихід = 95 %). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.50 (m, 2H), 2.54 (s, 3H), 2.96 (s, 3H), 3.18 (m, 2H), 3.97 (qu, 1H, J=7.8 Гц), 7.24 (m, 3H), 7.36 (m, 2H). Стадія 5: транс-3-аміно-N,N-диметил-1-фенілциклобутанкарбоксамід (1a2) Ідентична стадії 5, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 84 %). C13H18N2O (МВ = 218). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.13 (m, 2H), 2.55 (s, 3H),2.95 (s, 3H), 3.15 (m, 2H), 3.47 (qu, 1H, J=7.8 Гц), 7.19–7.35 (m, 5H). Сигнал, відповідний Н в NH2, в спектрі не видний. + SM–ESI: 219 (MH ). 11 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 60 Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 163 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.51 (m, 5H), 2.86 (s, 3H), 2.98 (m, 2H), 3.36 (s, 1H), 3.53 (qu, 1H, J=8.4 Гц), 6.03 (s, 2H), 7.26 (m, 3H), 7.39 (t, 2H, J=7.6 Гц), 8.05 (s, 3H). 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 35.80, 37.20, 37.34, 39.91, 46.54, 124.94, 126.59, 128.72, 136.00, 142.43, 167.15, 171.68. % Теоретичний: C 61.07, H 6.63, N 8.38. % Виявлений: C 60.73, H 6.43, N 8.15. Приклад 3: транс-3-аміно-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксамід (1b) Стадія 1: цис-3-гідрокси-1-(2-фторфеніл)-циклобутанкарбонова кислота (B2) Ідентична стадії 1, описаній в Прикладі 1, при використанні 2-фторфенілоцтової кислоти в якості початкового продукту. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 49 %). C11H11FO3 (МВ = 210). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.80 (m, 2H), 2.97 (m, 2H), 4.29 (qu, 1H, J=6.4 Гц), 7.04– 7.23 (m, 4H). Сигнали, відповідні H в OH в спирті і кислоті, в спектрі не видні. + SM–ESI: 211 (MH ). Стадія 2: 4-(2-фторфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C2) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 81 %). C11H9FO2 (МВ = 192). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.75 (m, 2H), 2.99 (m, 2H), 5.01 (s, 1H), 7.07–7.42 (m, 4H). + SM–ESI: = 193 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксамід (D2a) Ідентична стадії 3 Приклади 1. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 85 %). C15H20NO2F (МВ = 265). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.47 (t, 3H, J=6.8 Гц), 1.10 (t, 3H, J=6.8 Гц), 2.77–2.89 (m, 4H), 2.95 (m, 2H), 3.31 (m, 2H), 4.32 (qu, 1H, J=6.8 Гц), 7.04 (t, 1H, J=7.8 Гц), 7.15 (t, 1H, J=7.8 Гц), 7.26 (m, 1H), 7.37 (t, 1H, J=7.8 Гц). Сигнал, відповідний H в OH, в спектрі не видний. + SM–ESI: 266 (MH ). Стадія 4: транс-3-азидо-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксамід (E2a) Ідентична стадії 4, описаною в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 75 %). C15H19N4 °F (МВ = 290). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.42 (t, 3H, J=7.0 Гц), 1.10 (t, 3H, J=7.0 Гц), 2.55 (m, 2H), 2.98 (q, 2H, J=7.0 Гц), 3.19 (m, 2H), 3.31 (q, 2H, J=7.0 Гц), 4.02 (qu, 1H, J=8.0 Гц), 7.03 (m, 1H), 7.14–7.29 (m, 3H). + SM–ESI: 291 (MH ). Стадія 5: транс-3-аміно-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксамід (1b) Ідентична стадії 5, описаною в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 90 %). C15H21N2OF (МВ = 264). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.42 (t, 3H, J=6.8 Гц), 1.10 (t, 3H, J=6.8 Гц), 2.19 (m, 2H), 3.00 (q, 2H, J=6.8 Гц), 3.17 (m, 2H), 3.31 (q, 2H, J=6.8 Гц), 3.53 (qu, 1H, J=8.0 Гц), 7.00 (m, 1H), 7.11–7.31 (m, 3H). Сигнал, відповідний H в NH2, в спектрі не видний. + SM–ESI: 265 (MH ). Малеат сполуки, зазначеної в заголовку. Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 193 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.01 (t, 3H, J=6.8 Гц), 0.77 (t, 3H, J=6.8 Гц), 2.36 (m, 2H), 2.72 (m, 4H), 2.97 (q, 2H, J=6.8 Гц), 3.22 (s, 1H), 3.38 (qu, 1H, J=8.0 Гц), 5.81 (s, 2H), 6.94 (m, 1H), 7.04–7.14 (m, 2H), 7.33 (m, 1H), 7.75 (s, 3H). 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.00, 12.20, 36.14, 39.97, 40.60, 41.19, 43.60, 115.71 2 4 3 3 2 (d, JC–F=21 Гц), 124.64 (d, JC–F=4 Гц), 128.00 (d, JC–F=5 Гц), 128.80 (d, JC–F=8 Гц), 130.07 (d, JC– F=13 Гц), 136.04, 158.52, 160.96, 167.14, 169.93. % Теоретичний: C 59.99, H 6.62, N 7.36. 12 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 % Виявлений: C 60.15, H 6.48, N 7.20. Приклад 4: транс-3-аміно-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксамід (1c) Стадія 1: цис-3-гідрокси-1-(3-фторфеніл)-циклобутанкарбонова кислота (B3) Ідентична стадії 1 Прикладу 1 при використанні 3-фторфенілоцтової кислоти в якості початкової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 52 %). C11H11FO3 (МВ = 210). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.50 (m, 2H), 2.75 (m, 2H), 3.86 (qu, 1H, J=7.2 Гц), 5.18 (s, 1H), 7.07–7.21 (m, 3H), 7.40 (m, 1H), 12.40 (s, 1H). + SM–ESI: 211 (MH ). Стадія 2: 4-(3-фторфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C3) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 91 %). C11H9O2F (МВ = 192). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.83 (s, 4H), 5.09 (s, 1H), 7.15–7.22 (m, 3H), 7.38–7.47 (m, 1H). + SM–ESI: 193 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксамід (D3a) Ідентична стадії 3 Приклади 1. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 92 %). C15H20NO2F (МВ = 265). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.62 (t, 3H, J=7.2 Гц), 0.97 (t, 3H, J=7.2 Гц), 2.50 (m, 2H), 2.66 (m, 2H), 2.86 (q, 2H, J=7.2 Гц), 3.19 (q, 2H, J=7.2 Гц), 4.05 (m, 1H), 5.12 (d, 1H, J=6.8 Гц), 7.04–7.15 (m, 3H), 7.39 (m, 1H). + SM–ESI: 266 (MH ). Стадія 4: транс-3-азидо-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксамід (E3a) Ідентична стадії 4, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 72 %). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.59 (t, 3H, J=7.2 Гц), 1.00 (t, 3H, J=7.2 Гц), 2.40 (m, 2H), 2.86 (q, 2H, J=7.2 Гц), 3.04 (m, 2H), 3.24 (q, 2H, J=7.2 Гц), 4.07 (m, 1H), 7.04–7.15 (m, 3H), 7.39 (m, 1H). Стадія 5: транс-3-аміно-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксамід (1c) Ідентична стадії 5, описаною в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 93 %). C15H21N2OF (МВ = 264). + SM–ESI: 265 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 174 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.49 (t, 3H, J=7.0 Гц), 1.02 (t, 3H, J=7.0 Гц), 2.56 (m, 2H), 2.91 (m, 4H), 3.26 (q, 2H, J=7.0 Гц), 3.35 (s, 1H), 3.53 (qu, 1H, J=8.4 Гц), 6.03 (s, 2H), 7.01 (d, 1H, J=8.0 Гц), 7.09–7.20 (m, 2H), 7.42 (m, 1H), 7.99 (s, 3H). 13 2 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.10, 36.93, 39.23, 39.91, 41.18, 46.40, 111.03 (d, JC– 2 4 3 F=22 Гц), 113.39 (d, JC–F=21 Гц), 121.11 (d, JC–F=2 Гц), 130.77 (d, JC–F=9 Гц), 136.02, 145.55 (d, 3 JC–F=7 Гц), 161.21, 163.64, 167.14, 170.60. % Теоретичний: C 59.99, H 6.62, N 7.36. % Виявлений: C 59.11, H 6.40, N 7.07. Приклад 5: транс-3-аміно-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксамід (1d) Стадія 1: цис-3-гідрокси-1-(3-метоксифеніл)-циклобутанкарбонова кислота (B4) Ідентична стадії 1 Прикладу 1 при використанні 3-метоксифенілоцтової кислоти замість фенілоцтової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 50 %). C12H14O4 (МВ = 222). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.50 (m, 2H), 2.73 (m, 2H), 3.75 (s, 3H), 3.86 (qu, 1H, J=7.2 Гц), 5.14 (s, 1H), 6.82 (dd, 1H, J=8.0 Гц и J=2.0 Гц), 6.87 (s, 1H), 6.93 (d, 1H, J=8.0 Гц), 7.26 (t, 1H, J=8.0 Гц), 12.23 (s, 1H). SM–ESI: 222. Стадія 2: 4-(3-метоксифеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C4) 13 UA 114017 C2 5 10 15 20 25 30 35 40 45 50 55 Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 85 %). C12H12O2 (МВ = 188). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.80 (m, 4H), 3.76 (s, 3H), 5.06 (s, 1H), 6.87–6.91 (m, 3H), 7.30 (t, 1H, J=8.0 Гц). + SM–ESI: 189 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксамід (D4a) Ідентична стадії 3, описаній для Прикладу 1. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 92 %). C16H23NO3 (МВ = 277). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.62 (t, 3H, J=6.8 Гц), 0.97 (t, 3H, J=6.8 Гц), 2.50 (m, 2H), 2.64 (m, 2H), 2.86 (q, 2H, J=6.8 Гц), 3.19 (q, 2H, J=6.8 Гц), 3.73 (s, 3H), 4.06 (se, 1H, J=7.6 Гц), 5.08 (d, 1H, J=7.2 Гц), 6.81 (m, 2H), 6.89 (d, 1H, J=7.6 Гц), 7.27 (m, 1H). + SM–ESI: 278 (MH ). Стадія 4: транс-3-азидо-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксамід (E4a) Ідентична стадії 4, описаній для Прикладу 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 82 %). C16H22N4O2 (МВ = 302). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.59 (t, 3H, J=6.8 Гц), 1.00 (t, 3H, J=6.8 Гц), 2.40 (m, 2H), 2.86 (q, 2H, J=6.8 Гц), 3.05 (m, 2H), 3.24 (q, 2H, J=6.8 Гц), 3.74 (s, 3H), 3.95 (qu, 1H, J=7.6 Гц), 6.76 (m, 1H), 6.83 (m, 2H), 7.30 (m, 1H). + SM–ESI: 303 (MH ). Стадія 5: транс-3-аміно-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксамід (1d) Ідентична стадії 5, описаній для Прикладу 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 88 %). C16H24N2O2 (МВ = 276). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.50 (t, 3H, J=7.0 Гц), 1.00 (t, 3H, J=7.0 Гц), 2.02 (m, 2H), 2.83 (m, 4H), 3.10 (qu, 1H, J=8.0 Гц), 3.23 (q, 2H, J=7.2 Гц), 3.33 (s, 2H), 3.73 (s, 3H), 6.73– 6.79 (m, 3H), 7.25 (t, 1H, J=8.0 Гц). + SM–ESI: 277 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 156 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.47 (t, 3H, J=6.8 Гц), 1.02 (t, 3H, J=6.8 Гц), 2.55 (m, 2H), 2.89 (m, 4H), 3.26 (q, 2H, J=6.8 Гц), 3.35 (s, 1H), 3.52 (qu, 1H, J=8.4 Гц), 3.75 (s, 3H), 6.03 (s, 2H), 6.78–6.86 (m, 3H), 7.31 (t, 1H, J=8.0 Гц), 7.98 (s, 3H). 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.11, 36.98, 39.23, 39.99, 41.23, 46.57, 55.03, 111.05, 111.54, 117.12, 129.89, 136.03, 144.22, 159.54, 167.12, 171.02. % Теоретичний: C 61.21, H 7.19, N 7.14. % Виявлений: C 61.38, H 7.09, N 6.98. Приклад 6: транс-3-аміно-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксамід (1e) Стадія 1: цис-3-гідрокси-1-(3-хлорфеніл)-циклобутанкарбонова кислота (B5) Ідентична стадії 1, описаній в Прикладі 1, при використанні 3-хлорфенілоцтової кислоти в якості початкової кислоти. Сполуку, зазначену в заголовку, одержують у вигляді білої твердої речовини (вихід = 52 %). C11H11O3Cl (МВ = 226.5). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.50 (m, 2H), 2.75 (m, 2H), 3.86 (qu, 1H, J=7.2 Гц), 5.19 (s, 1H), 7.31–7.40 (m, 4H), 12.44 (s, 1H). Стадія 2: 4-(3-хлорфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C5) Ідентична стадії 2, описаній в Прикладі 1. Продукт, зазначений в заголовку, одержують у вигляді безбарвного масла (вихід = 78 %). C11H9O2Cl (МВ = 208). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.84 (m, 4H), 5.09 (s, 1H), 7.29–7.45 (m, 4H). + SM–ESI: 209 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксамід (D5a) Ідентична стадії 3, описаній в Прикладі 1. Сполуку, зазначену в заголовку, одержують у вигляді білої твердої речовини (вихід = 99 %). C15H20NO2Cl (МВ = 281.5). 14 UA 114017 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.63 (t, 3H, J=6.8 Гц), 0.96 (t, 3H, J=6.8 Гц), 2.51 (m, 2H), 2.66 (m, 2H), 2.86 (q, 2H, J=6.8 Гц), 3.19 (q, 2H, J=6.8 Гц), 4.05 (qu, 1H, J=7.6 Гц), 5.13 (s, 1H), 7.29–7.41 (m, 4H). + SM–ESI: 282.1 (MH ). Стадія 4: транс-3-(діоксоізоіндолін-2-іл)-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксамід (F5a). У колбу в атмосфері азоту додають 1 екв сполуки (D5a), 1,1 екв трифенілфосфіну, 1,05 екв фталіміду і ТГФ. Потім додають 1,2 екв діізопропілдіазодикарбоксилату (ДІАД) по краплях і перемішують при кімнатній температурі протягом 16 г. Додають воду і екстрагують ДХМ. Органічну фазу сушать над Na2SO4, фільтрують і концентрують. Залишок очищають флешхроматографією з наступною сумішшю в якості елюента: гептан/AcOEt: 80:20. Продукт, вказаний в заголовку, одержують з виходом 77 %. C23H23N2O3Cl (МВ = 410.5). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.67 (t, 3H, J=7.2 Гц), 1.18 (t, 3H, J=7.2 Гц), 2.91 (q, 2H, J=7.2 Гц), 3.11 (m, 2H), 3.35 (m, 2H), 3.42 (q, 2H, J=7.2 Гц), 4.79 (qu, 1H, J=8.8 Гц), 7.23 (m, 1H), 7.32 (m, 2H), 7.41 (s, 1H), 7.73 (m, 2H), 7.83 (m, 2H). + SM–ESI: 411.1 (MH ). Стадія 5: транс-3-аміно-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксамід (1e) Поміщають похідну (F5a) в розчині в етаноламіні в колбу. Нагрівають реакційне середовище при температурі 60 °C протягом 1 г 30 хв. Додають суміш льоду і води, перемішують протягом 15 хв і екстрагують етилацетатом. Промивають органічну фазу насиченим розчином NaCl і декантують. Органічну фазу сушать над MgSO4, фільтрують і концентрують. Залишок очищають флеш-хроматографією з наступною сумішшю в якості елюента: ДХМ/метанол/ NH4OH: 90:9:1. Продукт, вказаний в заголовку, одержують з виходом 40 %. C15H21N2OCl (МВ = 280.5). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.58 (t, 3H, J=7.2 Гц), 1.10 (t, 3H, J=7.2 Гц), 2.08 (m, 2H), 2.91 (q, 2H, J=7.2 Гц), 3.11 (m, 2H), 3.34 (q, 2H, J=7.2 Гц), 3.46 (qu, 1H, J=8,0 Гц), 7.12 (dd, 1H, J=7.6 Гц и J=1.2 Гц), 7.19 (m, 2H), 7.26 (m, 1H). Сигнал, відповідний H в NH2, в спектрі не видний. + SM–ESI: 281.1 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 167 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.50 (t, 3H, J=6.8 Гц), 1.02 (t, 3H, J=6.8 Гц), 2.56 (m, 2H), 2.86–2.95 (m, 4H), 3.26 (m, 2H), 3.34 (s, 1H), 3.54 (qu, 1H, J=8.0 Гц), 6.03 (s, 2H), 7.15 (d, 1H, J=7.6 Гц), 7.34–7.44 (m, 3H), 8.00 (s, 3H). 13 C–ЯМР (ДМСО d6. 100 МГц) δ (ppm): 12.09, 12.12, 36.88, 39.19, 39.90, 41.14, 46.37, 123.76, 124.94, 126.61, 130.65, 133.51, 136.00, 145.09, 167.14, 170.54. % Теоретичний: C 57.50, H 6.35, N 7.06. % Виявлений: C 57.36, H 6.26, N 6.68. Приклад 7: транс-3-аміно-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксамід (1f) Стадія 1: цис-3-гідрокси-1-(3-метилфеніл)-циклобутанкарбонова кислота (B6) Ідентична стадії 1 Прикладу 1 при використанні 3-метилфенілоцтової кислоти замість фенілоцтової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 40 %). C12H14O3 (МВ = 206). 1 H–ЯМР (CDCl3. 400 МГц) δ (ppm): 2.35 (s, 3H), 2.73 (m, 2H), 2.94 (m, 2H), 4.21 (qu, 1H, J=6.4 Гц), 7.08 (d, 1H, J=7.6 Гц), 7.16 (s, 2H), 7.24 (m, 1H). Сигнали, відповідні H в OH в спирті і кислоті, в спектрі не видні. SM–ESI: 205. Стадія 2: 4-(3-метилфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C6) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 74 %). C12H12O2 (МВ = 188). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.37 (s, 3H), 2.70 (m, 2H), 2.87 (m, 2H), 4.96 (s, 1H), 7.09–7.30 (m, 4H). + SM–ESI: 189 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксамід (D6a) Ідентична стадії 3, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують з виходом 77 %. 15 UA 114017 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.65 (t, 3H, J=7.2 Гц), 1.08 (t, 3H, J=7.2 Гц), 2.69 (s, 3H), 2.73 (m, 2H), 2.81 (m, 2H), 2.90 (q, 2H, J=7.2 Гц), 3.31 (q, 2H, J=7.2 Гц), 4.35 (qu, 1H, J=7.4 Гц), 7.04 (m, 1H), 7.11 (m, 2H), 7.23 (m, 1H). Сигнал, відповідний H в OH, в спектрі не видний. Стадія 4: транс-3-азидо-N,N-діетил-1-(3-метилфеніл)-циклобутан-карбоксамід (E6a) Ідентична стадії 4, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують з виходом 70 %. 1 H–ЯМР (CDCl3. 400 МГц) δ (ppm): 0.54 (t, 3H, J=7.2 Гц), 1.11 (t, 3H, J=7.2 Гц), 2.34 (s, 3H), 2.47 (m, 2H), 2.89 (q, 2H, J=7.2 Гц), 3.12 (m, 2H), 3.34 (q, 2H, J=7.2 Гц), 3.95 (qu, 1H, J=7.8 Гц), 7.04 (m, 3H), 7.23 (m, 1H). Стадія 5: транс-3-аміно-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксамід (1f) Ідентична стадії 5, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують з виходом 57 %. C16H24N2O (МВ =260). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0,52 (t, 3H, J=7,2 Гц), 1,10 (t, 3H, J=7,2 Гц), 2,11 (m, 2H), 2,33 (s, 3H), 2,92 (q, 2H, J=7,2 Гц), 3,10 (m, 2H), 3,33 (q, 2H, J=7,2 Гц), 3,44 (qu, 1H, J=8,0 Гц), 7,03 (m, 3H), 7,21 (m, 1H). Сигнал, відповідний H в NH2, в спектрі не видний. + SM–ESI: 261 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 173 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.45 (t, 3H, J=6.8 Гц), 1.02 (t, 3H, J=6.8 Гц), 2.31 (s, 3H), 2.52 (m, 2H), 2.89 (m, 4H), 3.25 (q, 2H, J=6.8 Гц), 3.52 (qu, 1H, J=8.4 Гц), 6.02 (s, 2H), 7.05 (m, 3H), 7.27 (t, 1H, J=7.6 Гц), 8.00 (s, 2H). Сигнал, відповідний H в NH2, в спектрі не видний. 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.07, 12.13, 21.05, 36.97, 39.15, 40.09, 41.18, 46.56, 48.53, 121.99, 125.43, 127.15, 128.63, 136.07, 137.88, 142.66, 167.21, 171.19. % Теоретичний: C 63.81, H 7.50, N 7.44. % Виявлений: C 63.93, H 7.45, N 7.27. Приклад 8: транс-3-аміно-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксамід (1g) Стадія 1: цис-3-гідрокси-1-(2-фтор-3-хлорфеніл)-циклобутанкарбонова кислота (B7) Ідентична стадії 1 Прикладу 1 при використанні 2-фтор-3-хлорфенілоцтової кислоти замість фенілоцтової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 30 %). C11H10FClO3 (МВ = 244.5). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.58 (m, 2H), 2.75 (m, 2H), 3.93 (qu, 1H, J=7.6 Гц), 5.33 (s, 1H), 7.22 (m, 1H), 7.52 (m, 2H), 12.56 (m, 1H). SM–ESI: 243,0. Стадія 2: 4-(2-фтор-3-хлорфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C7) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 66 %). C11H8O2ClF (МВ = 226.5). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.89 (s, 4H), 5.16 (s, 1H), 7.22–7.29 (m, 2H), 7.61 (m, 1H). + SM–ESI: 227 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксамід (D7a) Ідентична стадії 3, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують з виходом 87 %. C15H19NO2ClF (МВ = 299.5). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.35 (t, 3H, J=7.0 Гц), 0.96 (t, 3H, J=7.0 Гц), 2.57 (m, 2H), 2.67 (m, 2H), 2.87 (q, 2H, J=7.0 Гц), 3.16 (q, 2H, J=7.0 Гц), 4.00 (se, 1H, J=8.0 Гц), 5.02 (d, 1H, J=7.2 Гц), 7.27 (t, 1H, J=8.0 Гц), 7.50 (t, 1H, J=8.0 Гц), 7.65 (t, 1H, J=8.0 Гц). + SM–ESI: 300 (MH ). Стадія 4: транс-3-(діоксоізоіндолін-2-іл)-N,N-діетил-1-(2-фтор-3-хлорфеніл)циклобутанкарбоксамід (F7a) Ідентична стадії 4, описаній для Прикладу 6. Продукт, вказаний в заголовку, одержують з виходом 45 %. C23H22FClN2O3 (МВ = 428.5). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.29 (t, 3H, J=6.8 Гц), 1.04 (t, 3H, J=6.8 Гц), 2.94–3.04 (m, 4H), 3.22–3.28 (m, 4H), 4.61 (qu, 1H, J=8.8 Гц), 7.35 (t, 1H, J=8.0 Гц), 7.54 (t, 1H, J=8.4 Гц), 7.62 (t, 1H, J=7.2 Гц), 7.83 (s, 4H). 16 UA 114017 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 SM–ESI: 429 (MH ). Стадія 5: транс-3-аміно-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксамід (1g) Ідентична стадії 5, описаній для Прикладу 6. Продукт, вказаний в заголовку, одержують з виходом 93 %. C15H20FClN2O (МВ = 298.5). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.27 (t, 3H, J=6.8 Гц), 0.97 (t, 3H, J=6.8 Гц), 2.08 (m, 2H), 2.88–2.94 (m, 4H), 3.17–3.25 (m, 3H), 7.26 (t, 1H, J=8.0 Гц), 7.44–7.49 (m, 2H). Сигнал, відповідний H в NH2, в спектрі не видний. + SM–ESI: 299 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 179 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.26 (t, 3H, J=6.8 Гц), 0.99 (t, 3H, J=6.8 Гц), 2.60 (m, 2H), 2.91–3.00 (m, 4H), 3.20 (q, 2H, J=6.8 Гц), 3.34 (s, 1H), 3.61 (qu, 1H, J=8.4 Гц), 6.02 (s, 2H), 7.32 (t, 1H, J=8.0 Гц), 7.52–7.57 (m, 2H), 7.97 (s, 3H). 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.15, 12.21, 36.19, 40.08, 40.56, 41.16, 43.81, 120.16, 125.59, 127.11, 129.12, 132.00, 136.11, 153.74, 156.22, 167.19, 169.48. % Теоретичний: C 55.01, H 5.83, N 6.75. % Виявлений: C 54.73, H 5.98, N 6.46. Приклад 9: транс-3-аміно-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксамід (1h) Стадія 1: цис-3-гідрокси-1-(2,5-дифторфеніл)-циклобутанкарбонова кислота (B8) Ідентична стадії 1, описаній в Прикладі 1, при використанні 2,5-дифторфенілоцтової кислоти в якості початкової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 69 %). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.55 (m, 2H), 2.71 (m, 2H), 3.94 (qu, 1H, J=7.2 Гц), 5.32 (s, 1H), 7.12–7.23 (m, 2H), 7.41 (m, 1H), 12.48 (s, 1H). Стадія 2: 4-(2,5-дифторфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C8) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 91 %). C11H8F2O2 (МВ = 210). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.77 (m, 2H), 2.98 (m, 2H), 5.01 (s, 1H), 6.93–7.08 (m, 3H). + SM–ESI: 228 (M+NH4 ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксамід (D8a) Ідентична стадії 3 Прикладу 1. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 100 %). C15H19NO2F2 (МВ = 283). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.56 (t, 3H, J=6.8 Гц), 1.09 (t, 3H, J=6.8 Гц), 2.82 (m, 5H), 2.95 (q, 2H, J=6.8 Гц), 3.31 (q, 2H, J=6.8 Гц), 4.32 (qu, 1H, J=7.2 Гц), 6.91–7.11 (m, 3H). + SM–ESI: 284 (MH ). Стадія 4: транс-3-азидо-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксамід (E8a) Ідентична стадії 4, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 76 %). C15H18N4OF2 (МВ = 308). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.51 (t, 3H, J=7.2 Гц), 1,10 (t, 3H, J=7,2 Гц), 2.51 (m, 2H), 2.98 (q, 2H, J=7.2 Гц), 3.19 (m, 2H), 3.32 (q, 2H, J=7.2 Гц), 4.02 (qu, 1H, J=8.0 Гц), 6.90–7.04 (m, 3H). + SM–ESI: 309 (MH ). Стадія 5: транс-3-аміно-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксамід (1h) Поміщають 1 екв сполуки (Е8а) в колбу і розчиняють в 20 об'ємах ТГФ. Перемішують в атмосфері азоту, потім додають 1 об'єм води і 1,5 екв трифенілфосфіну. Продовжують перемішування протягом ночі. Випаровують ТГФ при зниженому тиску, відбирають одержаний залишок водою і екстрагують двічі ДХМ. Сушать органічну фазу над MgSO4, фільтрують, потім випаровують розчинник при зниженому тиску. Одержане масло очищають флешхроматографією з наступною сумішшю в якості елюента: ДХМ/метанол/NH4OH 95:4.5:0.5. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла з виходом 97 %. C15H20N2OF2 (МВ = 282). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0,51 (t, 3H, J=6,8 Гц), 1,10 (t, 3H, J=6,8 Гц), 2,15 (m, 2H), 2,99 (q, 2H, J=6,8 Гц), 3,16 (m, 2H), 3,32 (q, 2H, J=6,8 Гц), 3,52 (qu, 1H, J=8,0 Гц), 6,85–7,02 (m, 3H). Сигнал, відповідний H в NH2, в спектрі не видний. 17 UA 114017 C2 + 5 10 15 20 25 30 35 40 45 50 55 SM–ESI: 283 (MH ). Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.:184 °C. 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.31 (t, 3H, J=6.8 Гц), 0.99 (t, 3H, J=6.8 Гц), 2.58 (m, 2H), 2.93–2.97 (m, 4H), 3.20 (q, 2H, J=6.8 Гц), 3.34 (s, 1H), 3.59 (qu, 1H, J=8.4 Гц), 6.02 (s, 2H), 7.13–7.30 (m, 2H), 7.49–7.53 (m, 1H), 7.97 (s, 3H). 13 C–ЯМР (ДМСО d6, 100 МГц) δ (ppm): 12.04, 12.15, 36.08, 40.00, 40.61, 41.20, 43.48, 114.90, 117.2, 124.37, 132.1, 136.00, 154.6, 157.05, 157.13, 159.51, 167.12, 169.41. % Теоретичний: C 57.28, H 6.07, N 7.03. % Виявлений C: 57.21, H 6.01, N 6.66. Приклад 10: транс-3-аміно-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксамід (1i) Стадія 1: цис-3-гідрокси-1-(3,5-дихлорфеніл)-циклобутанкарбонова кислота (B9) Ідентична стадії 1, описаній в Прикладі 1, при завчасному синтезі 3,5-дихлорфенілоцтової кислоти, яку використовують в якості початкової кислоти. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 50 %). C11H10Cl2O3 (МВ = 261). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 2.53 (m, 2H), 2.77 (m, 2H), 3.87 (qu, 1H, J=7.4 Гц), 5.23 (s, 1H), 7.38 (m, 2H), 7.51 (m, 1H), 12.62 (s, 1H). SM–ESI: 259. Стадія 2: 4-(3,5-дихлорфеніл)-2-оксабіцикло[2.1.1]гексан-3-он (C9) Ідентична стадії 2, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 87 %). C11H8Cl2O2 (МВ = 243). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 2.72 (m, 2H), 2.88 (m, 2H), 4.99 (s, 1H), 7.21 (m, 2H), 7.34 (m, 1H). + SM-ESI: 244 (MH ). Стадія 3: цис-3-гідрокси-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксамід (D9a) Ідентична стадії 3 Прикладу 1. Продукт, вказаний в заголовку, одержують у вигляді білої твердої речовини (вихід = 100 %). C15H19Cl2O2N (МВ = 316). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.77 (t, 3H, J=7.2 Гц), 1.09 (t, 3H, J=7.2 Гц), 2.58 (s, 1H), 2.75 (m, 4H), 2.88 (q, 2H, J=7.2 Гц), 3.32 (q, 2H, J=7.2 Гц), 4.34 (qu, 1H, J=7.6 Гц), 7.20–7.27 (m, 3H). SM–ESI: 316. Стадія 4: транс-3-азидо-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксамід (E9a) Ідентична стадії 4, описаній в Прикладі 1. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла (вихід = 79 %). C15H18N4OCl2 (МВ = 341). 1 H–ЯМР (CDCl3, 400 МГц) δ (ppm): 0.67 (t, 3H, J=7.2 Гц), 1.12 (t, 3H, J=7.2 Гц), 2.40 (m, 2H), 2.87 (q, 2H, J=7.2 Гц), 3.15 (m, 2H), 3.36 (q, 2H, J=7.2 Гц), 3.99 (qu, 1H, J=7.6 Гц), 7.13 (m, 2H), 7.25 (m, 1H). SM–ESI: 341. Стадія 5: транс-3-аміно-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксамід (1i) Ідентична стадії 5 Прикладу 9. Продукт, вказаний в заголовку, одержують у вигляді безбарвного масла з виходом 78 %. C15H20N2OClF (МВ = 283). 1 H–ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.58 (t, 3H, J=7.2 Гц), 1.00 (t, 3H, J=7.2 Гц), 1.90 (s, 2H), 2.07 (m, 2H), 2.85 (m, 4H), 3.11 (qu, 1H, J=8.0 Гц), 3.25 (q, 2H, J=7.2 Гц), 7.23 (m, 2H), 7.48 (m, 1H). SM–ESI: 283. Малеат сполуки, зазначеної в заголовку Одержання солі попередньої сполуки з використанням малеїнової кислоти приводить до одержання малеату сполуки, зазначеної в заголовку, у формі білого порошку. Т.пл.: 180 °C. 1 H-ЯМР (ДМСО d6, 400 МГц) δ (ppm): 0.57 (t, 3H, J=6.8 Гц), 1.02 (t, 3H, J=6.8 Гц), 2.58 (m, 2H), 2.85–2.96 (m, 4H), 3.28 (q, 2H, J=6.8 Гц), 3.54 (qu, 1H, J=8.4 Гц), 6.02 (s, 2H), 7.28 (s, 2H), 7.56 (s, 1H), 7.99 (s, 3H). 18 UA 114017 C2 13 5 10 15 20 25 30 35 40 C-ЯМР (ДМСО d6, 100 МГц) δ (ppm): 11.96, 12.19, 36.83, 39.20, 41.10, 46.2, 124.03, 126.38, 134.50, 136.02, 146.66, 167.12, 170,04. % Теоретичний: C 52.91, H 5.61, N 6.50. % Виявлений: C 53.01, H 5.53, N 6.11. Наступні приклади дозволяють краще зрозуміти винахід, але не обмежують його об'єм ніяким чином. Сполуки загальної формули (1), а також їх фармацевтично прийнятні солі мають чудові фармакологічні властивості: в цілому, вони є більш сильними блокаторами NMDA-каналів, ніж кетамін, але в той же час мають менше небажаних ефектів на центральну нервову систему, ніж кетамін. Було досліджено вплив сполуки згідно винаходу на інгібування струму NMDA на жабі (Xenopus Laevis, звичайній шпорцевій жабі), експресуючій рекомбінантні людські NMDAрецептори, що складаються з NR1 і NR2B субодиниць. Струми, що продукуються шляхом стимуляції цих рецепторів за допомогою ендогенних агоністів, були вивчені відповідно до методу двоелектродної фіксації потенціалу, описаного в роботі Planells-Cases et al., 2002, J. Pharmacol. Exp. Ther., 302, 163-173. Протокол: у дорослих жаб видаляли хірургічним шляхом овоцити, їх ферментативно дефолікулували і зберігали при 17 °C у розчині, що містить: 96 мМ NaCl, 2 мМ KCl, 1 мМ MgCl2, 1,8 мМ CaCl2 і 5 мМ HEPES при рН 7,5 (NaOH) і 50 мг/л гентаміцину (Heusler et al., 2005, Neuropharmacology, 49, 963-976). Комплементарну ДНК (кДНК), кодуючу NR1 субодиниці, клонували за допомогою ПЦР з використанням праймерів для стартових і стоп-кодонів в опублікованій послідовності (номер доступу в Банку генів M_007327). кДНК, що кодує субодиницю NR2B, була синтезована компанією Eurogentec (Серен, Бельгія) відповідно до опублікованої послідовності (номер доступу в Банку генів NM_000834). NR 1 і NR2B кДНК потім субклонували в носій високої експресії pGEMHE для in vitro транскрипції кДНК. кРНК, кодуючу NR1 і NR2B, одержували відповідно до методу, описаного в роботі Heusler et al. (приведена вище). Аліквоти розчину кРНК ін'єктували в овоцити (20-500 пг/овоцит для NR1 і 40-1000 пг/овоцит для NR2B). В кожен овоцит вводили 100 нл розчину, що містить: 4 мМ Na+BAPTA (рН 7,2), для того, щоб блокувати всі залишкові струми хлору. Після стабілізації NMDA струми активували перфузією глутамату і гліцину, кожного при концентрації 10 мкМ. Сполуки, що ++ підлягають тестуванню, потім перфузували в розчині Рінгера Ba при збільшенні концентрацій у присутності глутамату і гліцину (було протестовано від 4 до 5 концентрацій на овоцит). Одержані показники концентрація-відповідь аналізували для кожного овоцита шляхом нелінійної регресії і розраховували значення pIC50. pIC50 означає негативний логарифм концентрації тестованої сполуки, необхідної для зменшення амплітуди струму NMDA наполовину. Результати: нижче в таблиці 1 приведені значення pIC50 для певних сполук згідно даному винаходу. Виявлено, що за умов тестування сполуки (1a1), (1b), (1c), (1d) і (1е) блокують струм NMDA залежним від концентрації чином і є сильнішими, ніж кетамін, який є клінічно використовуваним антагоністом NMDA. Таблиця 1 Сполука 1a1 1b 1c 1d 1e кетамін 45 50 Інгібування струму NMDA pIC50 6,3 6,3 6,8 6,4 7,1 6,1 Враховуючи низьку біодоступність кетаміну, що вводиться пероральним шляхом, був вибраний внутрішньочеревинний (ip) спосіб введення як єдиний спосіб введення для експериментів in vivo. Знеболююча дія сполук формули (1) і кетаміну, вибраного в якості контрольної сполуки, визначали на класичній моделі гострого запального болю внутрішньошкірною ін'єкцією формальдегіду (Bardin et al., 2001, Eur. J. Pharmacol., 421, 109114). Протокол: самців щурів (Sprague-Dawley Iffa Credo, Франція) поміщали для спостереження в коробки з плексигласу вище дзеркала, розташованого під кутом, щоб полегшити спостереження їх задніх лап. Через 30 хвилин акліматизації тварини одержували ін'єкції формальдегіду, 19 UA 114017 C2 5 10 15 20 розведеного до 2,5 %, на підошовну поверхню правої задньої лапи. Ін'єкції формальдегіду викликають поведінкові реакції, які відбуваються в дві фази: - рання фаза, через 0-5 хвилин після ін'єкції формальдегіду, відповідна стимулюванню рецепторів, що спеціалізуються на передачі ноцицептивних стимулів; - пізня фаза, яка має місце через 20-30 хвилин після ін'єкції. Ця фаза відповідає стимуляції рецепторів медіаторами запалення та/або надзбудженню рогу спинного мозку, які індуковані в ході першої фази. Тому ця пізня фаза запускає центральну сенситизацію системи больової нейротрансміссії, в якій важливу роль грає система глутамат/NMDA. Отже, біль в другій фазі є більш типовим зразком невропатичного болю, чим біль, який відбувається під час першої фази. З цієї причини в даній заявці розглядаються тільки результати, одержані в цій пізній фазі. Як поведінковий параметр для кількісного визначення болю був вибраний параметр "лизання лапи", в яку була зроблена ін'єкція, і як періоди спостережень були вибрані періоди, відповідні пізній фазі (іншими словами, через 22,5-27,5 хв після ін'єкції формальдегіду). Під час цього п'ятихвилинного періоду тварин спостерігали кожні 30 секунд для того, щоб відзначити, чи лиже тварину "ін'єктовану" лапу, чи ні; таким чином, максимальна оцінка рівна 10. Продукти згідно винаходу або носій вводили внутрішньочеревно за 15 хв до ін'єкції формальдегіду. Результати: у цьому тесті сполуки формули (1a1) і (1e), які є представниками сполук згідно винаходу, мали чудовий знеболюючий ефект (Таблиця 2). Таким чином, мінімальна значуща доза (МЗД, тобто доза, необхідна для істотного зниження лизання "ін'єктованої" лапи) для сполук формули (1a1) і (1e) менше, ніж мінімальна значуща доза для кетаміну. Інша перевага сполук формули (1a1) і (1e) в порівнянні з кетаміном відноситься до повноти знеболюючого ефекту. Фактично було відмічено, що при дозі 40 мг/кг сполуки (1a1) і (1e) повністю усунули лизання лапи, тоді як кетамін понизив лизання лапи тільки на 74 %. Тому сполуки (1a1) і (1e) є сильнішими і ефективнішими, чим кетамін. 25 Таблиця 2 Сполука 1a1 1e кетамін 30 35 40 45 Лизання лапи % зниження при 40 мг/кг 100 100 75 МЗД (мг/кг) 10 10 40 Таким чином, знеболюючий ефект сполук формули (1a1) і (1e), які є представниками сполук формули (1), є більш високим, ніж знеболюючий ефект кетаміну на моделі гострого запального болю у щурів. Також показано, що сполуки згідно винаходу мають антидепресантну активність in vivo. Антидепресантну активність сполук формули (1) і кетаміну визначали на моделі примусового плавання у щурів, яка широко використовується, оскільки є прогностичною відносно антидепресантної активності у людини. Протокол: самців щурів (Sprague-Dawley Iffa Credo, Франція) поміщають в циліндр (висотою 45 см і діаметром 20 см), заповнений водою з температурою 25 °C±0,5 °C до висоти 17 см. Ця висота дозволяє щурам плавати або триматися на поверхні без допомоги лап, торкаючись основи циліндра. За 24 години додня тестування щурів поміщають в циліндр на 15 хв, після цього періоду часу вони більше не намагаються втекти і залишаються нерухомими на поверхні. В день тестування сполуки, об'єкт тестування, або носій внутрішньочеревно вводять тварині, яку поміщають в циліндр на 30 хв пізніше. Тривалість нерухомості (визначається, коли щури просто тримаються на поверхні і лише роблять невеликі рухи, щоб залишатися на поверхні) вимірюють з точністю до 0,1 сек протягом 5 хвилин. Результати: У тесті примусового плавання сполуки формул (1c) і 1 (е), які є представниками серії, значно скорочують час нерухомості тварини. При порівнянні показників ED50, тобто доз, які зменшують час нерухомості наполовину в порівнянні з контрольними тваринами, виявлено, що ці показники для сполук (1c) і 1 (е) менше, ніж для кетаміну, див. Таблицю 3. Аналогічно, повнота ефекту анти-нерухомості, спостережуваного при дозі 20 мг/кг, є більшою для сполук (1с) і 1 (е), ніж для кетаміну. 20 UA 114017 C2 Таблиця 3 Сполука 1c 1e кетамін 5 10 15 20 25 30 35 40 45 50 Час нерухомості % зниження при 20 мг/кг 83 77 50 ED50 (мг/кг) 13 15 20 Таким чином, сполуки (1c) і 1(e), які є представниками сполук формули (1), є сильнішими і ефективнішими в прогностичному тесті антидепресантної активності. Ми вже підкреслювали важливість нормалізації функції NMDA-рецепторів, іншими словами, важливість блокування їх надмірної активності без втручання або з можливо меншим втручанням в їх нормальне фізіологічне функціонування. Як показник взаємозв'язку продуктів згідно винаходу і нормального функціонування NMDA-рецепторів вибраний тест преімпульсного інгібування рефлексу переляку (PPI). Цим тестом є вимірювання здатності організму до фільтрації неістотної інформації. Неконкурентні і конкурентні антагоністи, а також блокатори каналів знижують PPI у щурів (Depoortere et al., 1999, Behav. Pharmacol., 10, 51-62), причому таке зниження вважається прогностичним для психотоміметичних ефектів NMDA антагоністів у людини. Протокол: самців щурів (Sprague-Dawley Iffa Credo, Les Oncins, Франція) поміщали в циліндри висотою 18,4 см з діаметром 8,8 см на опорі, нижче за яку встановлено п'єзоелектричний акселерометр, що діє як детектор реакції переляку. Ця конструкція вкладена в коробку з гучномовцем, прикріплену до стелі, для забезпечення звукових імпульсів і попередніх імпульсів, і акустично ізольовану (SR LAB, San Diego Instruments, Сан-дієго, США). Всі події контролювали за допомогою програмного забезпечення. Спочатку тварин піддавали 13-ти хвилинному попередньому тесту, щоб привчити їх до процедури і виключити щурів, які не відповідають ряду мінімальних критеріїв реакції. Забезпечували три типи звукових подразників (білий шум); 1) імпульс 118 дБ (Р, тривалість 40 мс); 2) попередній імпульс 78 дБ (тривалість 20 мс), за яким слідує імпульс 118 дБ (pP); і 3) відсутність попереднього імпульсу або імпульсу (NP). Інтервал між початком попереднього імпульсу і початком імпульсу складає 100 мс з фоновим шумом 70 дБ. Реакцію переляку реєстрували протягом 100 мс, через 100 мс після початку стимулу (pP або NP) за допомогою цифрової/аналогової плати збору даних (12 біт). Сеанс починали з 5-ти хвилинного періоду без стимулу, після чого тварин піддавали 10 імпульсам P (неповним в середньому по 15 сек для стабілізації реакції переляку). Реакції, записані з цими 10 P не використовують для розрахунків. Після цього в напіввипадковому порядку проводили 10 P, 10 pP і 3 NP з середнім інтервалом в 15 сек між ними. В кінці цього попереднього тесту щурам робили внутрішньочеревинну ін'єкцію сполуки, об'єкта тестування, або фізіологічного розчину як контроль, і повертали в їх клітини. Сеанс фактичного тестування (аналогічний по кожному пункту попереднього тесту) здійснювали через 60 хвилин. Відсоток преімпульсного інгібування обчислювали з використанням даних цього сеансу тестування за формулою: (середня амплітуда P - середня амплітуда pP) 100/(середня амплітуда P). Результати: виходячи з фіг. 1 видно, що сполука (1a1) не порушує інгібування рефлексу переляку, викликаного попереднім імпульсом (PPI), за винятком дози 20 мг/кг. Проте, дивно, що зниження преімпульсного інгібування (PPI) набагато менш виражене, чим це спостерігалося для кетаміну. Фактично, в дозі 20 мг/кг ip кетамін приводить до повного зникнення PPI, тоді як сполука (1a1) тільки викликає 30 %-не зниження. Зниження PPI, проте, залишається помірним навіть в дозі 40 мг/кг. Отже, сполука (1a1) має явно менш виражену тенденцію викликати побічні ефекти центрального походження, ніж кетамін. Таким чином, сполуки згідно винаходу мають анальгетичну і антидепресантну активність, яка більш висока, ніж у кетаміну, на тваринній моделі, описаній вище. Дивно, що сполуки згідно винаходу викликають лише дуже помірні центральні ефекти. Тому з цих експериментів виходить, що співвідношення ризик/користь у сполук згідно винаходу явно сприятливіше, ніж у кетаміну. Отже, сполуки згідно даному винаходу, а також фармацевтичні композиції, що містять сполуку загальної формули (1) або одну з її фармацевтично прийнятних солей в якості активного інгредієнта, є потенційно корисними як лікарські засоби, зокрема, в лікуванні певних захворювань, таких як, наприклад, депресія і біль, особливо гострий або хронічний біль, в 21 UA 114017 C2 областях, в яких терапевтичні потреби не повністю задоволені і для яких тому дуже бажане відкриття нових способів лікування. ФОРМУЛА ВИНАХОДУ 5 1. Сполука загальної формули (1) R1 X2 X1 O R2 N R2 10 15 20 25 30 35 40 45 50 NH2 (1) або її фармацевтично прийнятна сіль або сольват, де: Х1 є атомом водню або атомом фтору; Х2 є атомом водню або атомом фтору, або атомом хлору; R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою; R2 є, незалежно або обидва, метильною групою або етильною групою. 2. Сполука за п. 1, яка відрізняється тим, що: Х1 є атомом водню або атомом фтору; Х2 є атомом водню або атомом фтору, або атомом хлору; R1 є атомом водню або атомом фтору, або атомом хлору, або метильною групою, або метоксигрупою, або ціаногрупою; R2 є етильною групою. 3. Сполука за п. 1 або 2, яка відрізняється тим, що вона вибрана з наступних сполук: транс-3-аміно-N,N-діетил-1-фенілциклобутанкарбоксаміду, транс-3-аміно-N,N-диметил-1-фенілциклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(2-фторфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3-метоксифеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3-фторфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3-хлорфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3-метилфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3-ціанофеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(2-фтор-3-хлорфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(2,5-дифторфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3,5-дифторфеніл)-циклобутанкарбоксаміду, транс-3-аміно-N,N-діетил-1-(3,5-дихлорфеніл)-циклобутанкарбоксаміду. 4. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу. 5. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу для лікування депресії. 6. Сполука за будь-яким з пп. 1-3 для застосування як лікарського засобу для лікування болю, зокрема болю через надмірну ноцицепцію, невропатичного болю і болю змішаного типу. 7. Фармацевтична композиція, яка містить щонайменше одну сполуку загальної формули (1) за будь-яким з пп. 1-3 і щонайменше один фармацевтично прийнятний ексципієнт. 8. Фармацевтична композиція за п. 7 для застосування як лікарського засобу для лікування та/або профілактики депресії. 9. Фармацевтична композиція за п. 7 для застосування як лікарського засобу для лікування болю, зокрема болю через надмірну ноцицепцію, невропатичного болю і болю змішаного типу. 10. Фармацевтична композиція за будь-яким з пп. 7-9, яка відрізняється тим, що приготована для перорального введення. 11. Фармацевтична композиція за будь-яким з пп. 7-9, яка відрізняється тим, що приготована для місцевого введення. 12. Фармацевтична композиція за будь-яким з пп. 8-11, яка відрізняється тим, що представлена у вигляді щоденної дозованої лікарської форми, що містить від 1 до 1000 мг сполуки загальної формули (1). 22 UA 114017 C2 13. Спосіб одержання сполуки загальної формули (1), охарактеризованої в будь-якому з пп. 1-3, який відрізняється тим, що вторинний амін формули (R2)2NH піддають реакції із сполукою формули (С) X2 X1 O R1 O 5 (C) з одержанням сполуки формули (D) X2 X1 O R2 R1 R2 OH , (D) потім сполуку формули (D) перетворюють на амін формули (1), де значення радикалів R1, R2, Х1 і Х2, присутніх у зазначених реагентах, визначені в п. 1. 14. Проміжна сполука формули (D) X2 X1 O R2 R1 R2 10 OH , (D) де R1, R2, Х1 і Х2 є такими, як визначено в п. 1, що використовується для одержання сполуки загальної формули (1), охарактеризованої в будь-якому з пп. 1-3. 15. Проміжна сполука формули (С) X2 X1 O R1 O 15 , (C) де R1, Х1 і Х2 є такими, як визначено в п. 1, що використовується для одержання сполуки загальної формули (D), охарактеризованої в п. 14. 23 UA 114017 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюAminocyclobutane derivatives, method for preparing same and the use thereof as drugs
Автори англійськоюVacher, Bernard, Blanc, Elodie, Depoortere, Ronan
Автори російськоюВашэ Бэрнар, Бланк Элоди, Дэпортэр Ронан
МПК / Мітки
МПК: C07D 307/00, C07C 237/24, C07C 235/40
Мітки: застосування, аміноциклобутану, лікарських, одержання, похідні, засобів, спосіб
Код посилання
<a href="https://ua.patents.su/26-114017-pokhidni-aminociklobutanu-sposib-kh-oderzhannya-ta-kh-zastosuvannya-yak-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Похідні аміноциклобутану, спосіб їх одержання та їх застосування як лікарських засобів</a>
Попередній патент: Композиції, що містять вортіоксетин та донепезил
Наступний патент: Композиції фарб, що висихають при окисненні
Випадковий патент: Спосіб зшивання документів