Спосіб визначення послідовності молекули нуклеїнової кислоти (варіанти) та набір для використання при визначенні послідовності нуклеїнової кислоти
Формула / Реферат
1. Способ определения последовательности молекулы нуклеиновой кислоты, отличающийся тем, что проводят гибридизацию молекулы с комплементарными последовательностями олигонуклеотидов из двух наборов малых олигонуклеотидных зондов известной последовательности, причем первый набор зондов прикреплен к твердой подложке, а второй набор зондов представляет собой меченые зонды, находящиеся в растворе, создают ковалентные связи между гибридизированным олигонуклеотидом из указанного первого набора зондов и гибридизированным олигонуклеотидом из указанного второго набора зондов, идентифицируют ковалентно связанные участки последовательности и определяют последовательность молекулы нуклеиновой кислоты с использованием указанных идентифицированных участков.
2. Способ по п. 1, отличающийся тем, что указанную гибридизацию осуществляют циклами.
3. Способ по п. 1, отличающийся тем, что предварительно проводят фрагментацию молекулы нуклеиновой кислоты с получением фрагментов нуклеиновой кислоты промежуточной длины.
4. Способ по п. 3, отличающийся тем, что полученные фрагменты последовательно гибридизируют с комплементарными последовательностями из указанных двух наборов малых олигонуклеотидных зондов известной последовательности.
5. Способ по п. 3, отличающийся тем, что полученные фрагменты одновременно гибридизируют с комплементарными последовательностями из двух наборов малых олигонуклеотидных зондов известной последовательности.
6. Способ по п. 3, отличающийся тем, что получают фрагменты молекулы нуклеиновой кислоты, длина которых составляет от примерно 10 до примерно 40 нуклеотидов, при этом используют малые олигонуклеотидные зонды, длина которых составляет примерно от 4 до 9 нуклеотидов.
7. Способ по п. 3, отличающийся тем, что проводят гибридизацию указанных олигонуклеотидных зондов с полностью комплементарными последовательностями указанных фрагментов.
8. Способ по п. 3, отличающийся тем, что проводят гибридизацию олигонуклеотидных зондов с непосредственно соседними последовательностями указанных фрагментов.
9. Способ по п. 8, отличающийся тем, что проводят гибридизацию олигонуклеотидных зондов с полностью комплементарными и непосредственно соседними последовательностями указанных фрагментов.
10. Способ по п. 3, отличающийся тем, что используют олигонуклеотидные зонды, ковалентно связанные ферментной связью.
11. Способ по п. 3, отличающийся тем, что используют олигонуклеотидные зонды, ковалентно связанные посредством химического лигирующего агента.
12. Способ по п. 3, отличающийся тем, что при гибридизации проводят контактирование указанного первого набора малых прикрепленных олигонуклеотидных зондов с указанными фрагментами нуклеиновой кислоты промежуточной длины в условиях, позволяющих только таким фрагментам с полностью комплиментарной последовательностью гибридизоваться с зондом с образованием первичных комплексов, в которых фрагмент имеет гибридизированные и свободные последовательности, проводят контактирование указанных первичных комплексов с указанным вторым набором малых меченных олигонуклеотидных зондов в условиях, позволяющих только таким зондам с полностью комплиментарными последовательностями гибридизоваться со свободной последовательностью фрагмента с образованием вторичных комплексов, в которых фрагмент гибридизирован с прикрепленным зондом и меченным зондом, образуют ковалентную связь между указанным прикрепленным зондом и указанным меченным зондом, удаляют из указанных вторичных комплексов меченных зондов, не связанных ковалентно с прикрепленным зондом, с образованием ковалентно связанных комплексов, идентифицируют ковалентно связанные комплексы путем обнаружения наличия метки, определяют последовательности фрагментов нуклеиновой кислоты в указанных ковалентно связанных комплексах путем соединения известных последовательностей гибридизированных прикрепленных и меченых зондов.
13. Способ определения последовательности молекулы нуклеиновой кислоты, отличающийся тем, что проводят фрагментацию молекулы нуклеиновой кислоты с получением фрагментов длиной Т, приготавливают ряд иммобилизированных олигонуклеотидных зондов с известными последовательностями и с длиной F и набора меченных олигонуклеотидных зондов в растворе с известными последовательностями и с длиной Р, причем F + Р < Т, производят контактирование указанного ряда иммобилизированных олигонуклеотидных зондов с указанными фрагментами нуклеиновой кислоты в условиях гибридизации, позволяющих образовываться первичным комплексам с гибридизированными, полностью комплиментарными последовательностями фрагментов с длиной F и с негибридизированными последовательностями фрагментов с длиной Т – F, производят контактирование указанных комплексов с указанным набором меченных олигонуклеотидых зондов в условиях гибридизации, позволяющих образовываться только вторичным комплексам с гибридизированными, полностью комплиментарными последовательностями с длиной F и с непосредственно соседними гибридизированными, полностью комплиментарными последовательностями с длиной Р, образуют ковалентную связь между указанными меченными олигонуклеотидными зондами и указанными непосредственно соседними иммобилизированными олигонуклеотидными пробами, обнаруживают указанные вторичные комплексы по присутствию метки, идентифицируют последовательности с длиной F+P фрагментов молекулы нуклеиновой кислоты в указанных комплексах путем объединения известных последовательностей гибридизированных иммобилизированных и меченых зондов, определяют перекрывающиеся участки указанных последовательностей с длиной F+P с последующим определением полной последовательности молекулы нуклеиновой кислоты.
14. Способ по п. 13, отличающийся тем, что длина Т примерно в три раза больше длины F.
15. Способ по п. 13, отличающийся тем, что длина Т составляет примерно от 10 до 100 нуклеотидов, длина F составляет примерно от 4 до 9 нуклеотидов, а длина Р составляет примерно от 4 до 9 нуклеотидов.
16. Способ по п. 15, отличающийся тем, что длина Т составляет примерно 20 нуклеотидов, длина F составляет примерно 6 нуклеотидов, а длина Р составляет примерно 6 нуклеотидов.
17. Способ по п. 13, отличающийся тем, что ковалентное связывание между непосредственно соседними иммобилизированными и меченными олигонуклеотидными зондами осуществляют ферментной связью.
18. Способ по п. 13, отличающийся тем, что ковалентную связь между непосредственно соседними иммобилизированными и меченными олигонуклеотидыми зондами образовывают с использованием химического лигирующего агента.
19. Способ по п. 13, отличающийся тем, что используют нуклеиновую кислоту, представляющую собой клонированную ДНК или хромосомную ДНК.
20. Способ по п. 13, отличающийся тем, что используют нуклеиновую кислоту, представляющую собой мРНК.
21. Способ по п. 13, отличающийся тем, что фрагментирование молекулы нуклеиновой кислоты проводят гидролизом рестриктазой, ультразвуковой обработкой, обработкой гидроксидом натрия или гидродинамическим фрагментированием при низком давлении.
22. Способ по п. 13, отличающийся тем, что используют иммобилизированные олигонуклеотиды, прикрепленные к стеклянной, полистирольной или тефлоновой твердой подложке.
23. Способ по п. 13, отличающийся тем, что используют иммобилизированные олигонуклеотиды, прикрепленные к твердой подложке посредством фосфодиэстерной связи.
24. Способ по п. 13, отличающийся тем, что используют иммобилизированные олигонуклеотиды, прикрепленные к твердой подложке посредством светоактивируемого механизма.
25. Способ по п. 13, отличающийся тем, что используют меченные меченые нерадиоактивным изотопом или флуоресцентным красителем олигонуклеотидные зонды.
26. Способ по п. 13, отличающийся тем, что используют меченные изотопами 35S,32Р или 33Р олигонуклеотидные зонды.
27. Способ по п. 13, отличающийся тем, что указанный фрагмент молекулы нуклеиновой кислоты или один из олигонуклеотидных зондов содержат модифицированную или универсальную основу.
28. Способ по п. 13, отличающийся тем, что меченые зонды, не связанные ковалентно с иммобилизированным зондом, удаляют из вторичных комплексов промывкой в строгих условиях.
29. Способ по п. 13, отличающийся тем, что используют множество рядов иммобилизированных олигонуклеотидов, расположенных в виде задающего последовательность чипа.
30. Набор для использования при определении последовательности молекулы нуклеиновой кислоты, отличающийся тем, что он содержит чип с твердой подложкой, имеющий прикрепленный комплект олигонуклеотидных зондов известных последовательностей, причем указанные олигонуклеотиды способны принимать участие в реакциях гибридизации, а также набор контейнеров с растворами меченных олигонуклеотидных зондов известных последовательностей и лигирующий агент.
31. Набор по п. 30, отличающийся тем, что используемое множество чипов иммобилизированных олигонуклеотидов установлено в виде ранжированного ряда.
32. Набор по п. 30, отличающийся тем, что используемые олигонуклеотидные зонды имеют в длину примерно от 4 до 9 нуклеотидов.
33. Набор по п. 32, отличающийся тем, что используемые олигонуклеотидные зонды имеют в длину примерно 6 нуклеотидов.
34. Набор по п. 30, отличающийся тем, что используемые олигонуклеотидные зонды прикреплены к стеклянной, полистирольной или тефлоновой твердой подложке.
35. Набор по п. 30, отличающийся тем, что олигонуклеотидные зонды прикреплены к твердой подложке посредством фосфодиэстерной связи.
36. Набор по п. 30, отличающийся тем, что олигонуклеотидные зонды прикреплены к твердой подложке посредством светоактивируемого механизма.
37. Набор по п. 30, отличающийся тем, что олигонуклеотидные зонды мечены нерадиоактивным изотопом или флуоресцентным красителем.
38. Набор по п. 30, отличающийся тем, что один из используемых олигонуклеотидов содержит модифицированную или универсальную основу.
39. Набор по п. 30, отличающийся тем, что олигонуклеотидные зонды мечены изотопами 35S, 32P или 33P.
40. Набор по п. 30, отличающийся тем, что в качестве лигирующего агента использован химически лигирующий агент.
41. Набор по п. 30, отличающийся тем, что в качестве лигирующего агента использован фермент лигазы ДНК.
Текст
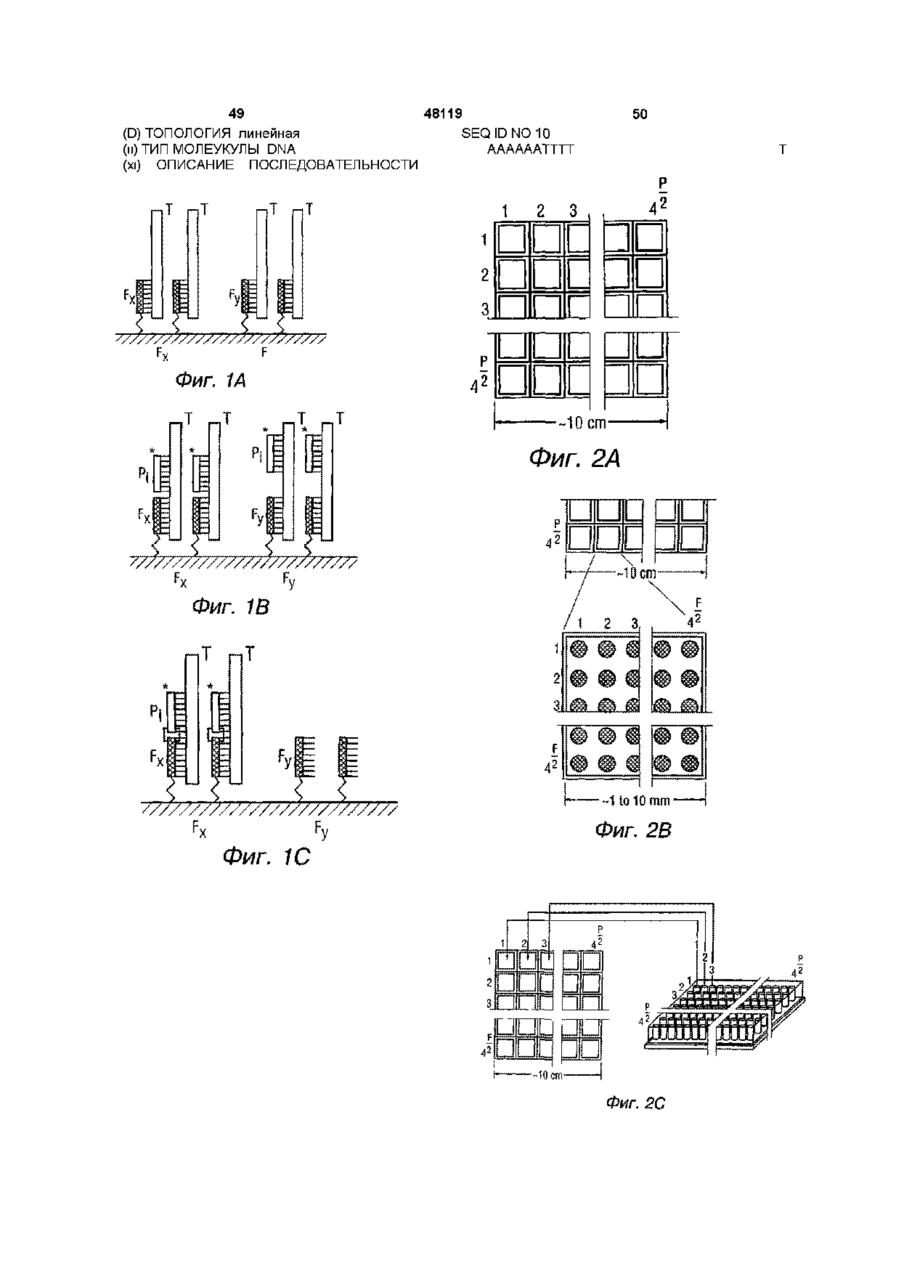
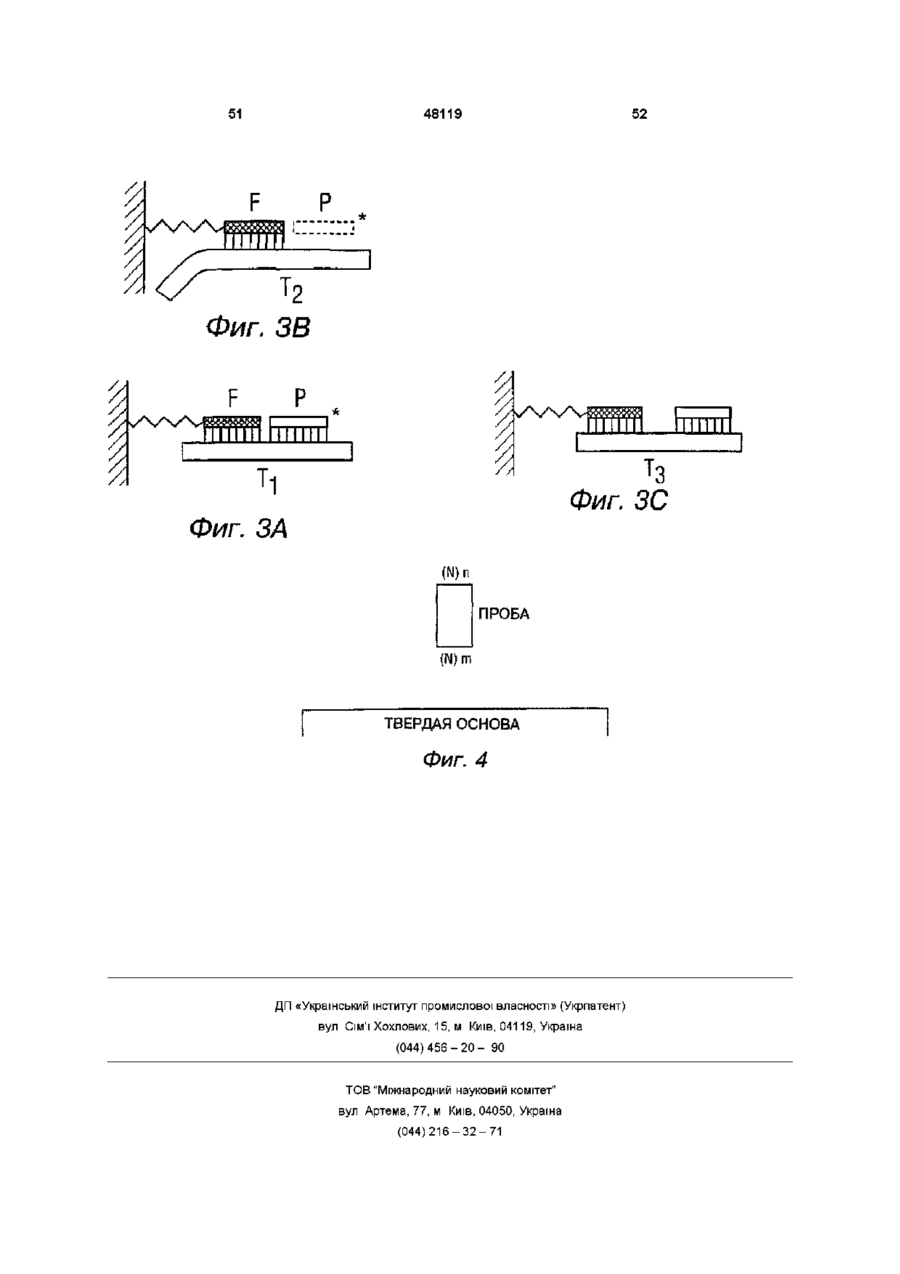
1 Способ определения последовательности молекулы нуклеиновой кислоты, отличающийся тем, что проводят гибридизацию молекулы с комплементарными последовательностями олигонуклеотидов из двух наборов малых олигонуклеотидных зондов известной последовательности, причем первый набор зондов прикреплен к твердой подложке, а второй набор зондов представляет собой меченые зонды, находящиеся в растворе, создают ковалентные связи между гибридизированным олигонуклеотидом из указанного первого набора зондов и гибридизированным олигонуклеотидом из указанного второго набора зондов, идентифицируют ковалентно связанные участки последовательности и определяют последовательность молекулы нуклеиновой кислоты с использованием указанных идентифицированных участков 2 Способ по п 1, отличающийся тем, что указанную гибридизацию осуществляют циклами 3 Способ по п 1, отличающийся тем, что предварительно проводят фрагментацию молекулы нуклеиновой кислоты с получением фрагментов нуклеиновой кислоты промежуточной длины 4 Способ по п 3, отличающийся тем, что полученные фрагменты последовательно гибридизируют с комплементарными последовательностями из указанных двух наборов малых олигонуклеотидных зондов известной последовательности 5 Способ по п 3, отличающийся тем, что полу ченные фрагменты одновременно гибридизируют с комплементарными последовательностями из двух наборов малых олигонуклеотидных зондов известной последовательности 6 Способ по п 3, отличающийся тем, что получают фрагменты молекулы нуклеиновой кислоты, длина которых составляет от примерно 10 до примерно 40 нуклеотидов, при этом используют малые олигонуклеотидные зонды, длина которых составляет примерно от 4 до 9 нуклеотидов 7 Способ по п 3, отличающийся тем, что проводят гибридизацию указанных олигонуклеотидных зондов с полностью комплементарными последовательностями указанных фрагментов 8 Способ по п 3, отличающийся тем, что проводят гибридизацию олигонуклеотидных зондов с непосредственно соседними последовательностями указанных фрагментов 9 Способ по п 8, отличающийся тем, что проводят гибридизацию олигонуклеотидных зондов с полностью комплементарными и непосредственно соседними последовательностями указанных фрагментов 10 Способ по п 3, отличающийся тем, что используют олигонуклеотидные зонды, ковалентно связанные ферментной связью 11 Способ по п 3, отличающийся тем, что используют олигонуклеотидные зонды, ковалентно связанные посредством химического лигирующего агента 12 Способ по п 3, отличающийся тем, что при гибридизации проводят контактирование указанного первого набора малых прикрепленных олигонуклеотидных зондов с указанными фрагментами нуклеиновой кислоты промежуточной длины в условиях, позволяющих только таким фрагментам с полностью комплиментарной последовательностью гибридизоваться с зондом с образованием первичных комплексов, в которых фрагмент имеет гибридизированные и свободные последовательности, проводят контактирование указанных первичных комплексов с указанным вторым набором малых меченных олигонуклеотидных зондов в условиях, позволяющих только таким зондам с полностью комплиментарными последовательностями гибридизоваться со свободной последовательностью фрагмента с образованием вторичных q 00 48119 комплексов, в которых фрагмент гибридизирован с прикрепленным зондом и меченным зондом, образуют ковалентную связь между указанным прикрепленным зондом и указанным меченным зондом, удаляют из указанных вторичных комплексов меченных зондов, не связанных ковалентно с прикрепленным зондом, с образованием ковалентно связанных комплексов, идентифицируют ковалентно связанные комплексы путем обнаружения наличия метки, определяют последовательности фрагментов нуклеиновой кислоты в указанных ковалентно связанных комплексах путем соединения известных последовательностей гибридизированных прикрепленных и меченых зондов 13 Способ определения последовательности молекулы нуклеиновой кислоты, отличающийся тем, что проводят фрагментацию молекулы нуклеиновой кислоты с получением фрагментов длиной Т, приготавливают ряд иммобилизированных олигонуклеотидных зондов с известными последовательностями и с длиной F и набора меченных олигонуклеотидных зондов в растворе с известными последовательностями и с длиной Р, причем F + Р NH), которые служат предмостными позициями для образования дальнейших ковалетных связей Модули CovaLmk можно закупить в Nunc Laboratories Молекулы ДНК могу быть связаны с CovaLmk исключительно у 5'-конца посредством связи фосфорамидата, что позволяет связывание (нейтрализацию) более чем 1 пмоля ДНК (Расмуссен и др , 1991), [40] Использование полосок CovaLmk NH для ковалентного связывания молекул ДНК у 5'-конца было описано (Расмуссен и др , 1991), [40] В этой технологии используется связь фосфорамидата (Чу и др ,1983) ,[6] Это полезно, так как предпочтительна связывание (нейтрализация) с использованием только одной ковалентной святи) Связьфосфорамидата связывает ДНК со вторичными амино-группами CovaLmk NH, которые расположены у конца плеч прокладки, ковалентно привитых на поверхность полистирена через плечо прокладки длиной 2нм Чтобы связать олигонуклеотид с CovaLmk NH через связь фосфорамидата, окончание олигонуклеотида должно иметь 5'-конец фосфатную группу Вероятно, даже можно ковалентно CovaLmk и затем использовать стрептавидин для связывания проб Более конкретно, способ образования связи включает в себя растворение ДНК в воде (7,5нг/мкл) и денатурирование в течение 10 мин при 95°С и охлаждение на Льве в течении 10 мин 0,1 М 1-метилимидазол с температурой льда, рН 7,0 (1-Melm7) затем доавляется к конечной концентрации 10 mM 1-Melm7 Затем раствор ss ДНКнаносится на полоски CovaLmk (75мкл/карман), стоящие на льду Карбодиимид 0,2 М 1-этил-3-(3- диметиламинопропил) карбодиимид (EDC), растворенным в 10 mM 1-Melm7, освежается и 25мкл добавляется на карман Полоски выдерживаются в термостате 5 часов при 50°С После выдержки полоски промываются с использованием, например Nunc-lmmuno Wash, сначала полоски промываются 3 раза, затем они промакиваются промывающим раствором в течении 5 мин и наконец они проміваются З раза (причем промывающий раствор это 0,4 N NaOH, 0,25% SDS, нагретого до 50°С) Считается,что еще один пригодный метод для использованиея с этим изобретением описан в заявке WC 90/03382 (Сазерн и Маскос), [48] Этот способ приготовления олигонуклеотида, связанного с основой, предполагает прикрепление нуклеозида З'-реагента через фосфотную группу ковалентной связью сложного двойного эфира фосфора к алифатическим гидроксильным группам, несомым основой Затем олигонуклеотид синтезируется на поддерживаемом нуклеозиде и защищающие группы удаляются из цепочки синтетического олигонуклеотида в стандартных условиях, которые не отщепляют олигонуклеотида от основы К числу пригодных реагентов относятся нуклеозид фосфорамидит и нуклеозид водород фосфорат Более конкретне, чтобы использовать этот метод, основа, например стеклянная пластина, дериватизируется при контакте со смесью ксилена, глицилоксипропилтриметоксилана и малым 26 количеством диизопропилэтиламина при 90°С в течение полусуток Затем она тщательно промывается метанолом, эфиром и высушивается на воздухе Затем дериватизированная основа, нагревается перемешиванием в гексаэтиленгликоле, содержащем каталитическое количество концентрированной серной кислоты, в течение полусуток в атмосфере аргона при 80°С с получением алкил гидроксил дериватизированной основы После промывания метанолом и эфиром основа высушивается в вакууме и хранится в аргоне при 20°С Затем синтез олигонуклеотида производится вручную в стандартных условиях с использованием дериватизированной стеклянной пластинки в качестве твердой основы Первый нуклеотид будет З'-водород фосфат, используемым в виде соли триэтиламмония Этот метод приводит к получению связанных с основой олигонуклеотидов высокой чистоты Можно применять стратегию "на чипе" для приготовления рядов проб ДНК Например, адресуемую приводимую в действие лазером фотолепротекцию можно использовать в химическом синтезе олигонуклеотидов прямо на стекляной поверхности, как описано Фодором и др , (1991), [22] Пробы также можно связать (нейтрализовать) на нейлоновых основах, как описано Ван Нессом и др (1991), [51], или связать с тефлоном с использованием метода Данкена и Кавальера (1988), [19] Фодор и др (1991), [22] описывают направляемый светом синтез динуклеотидов, который применим к пространственно направленному синтезу сложных соединений для применения в микро-производстве устройств Он основан на методе Использующем свет для направления одновременного синтеза химических соединений на твердой основе Структура воздействия света или других видов энергии через маску или другими пространственно адресуемыми средствами определяет то, какие области основы активизируются для создания химической связи Активизация светом поисходит из удаления фотолабильных защитных групп из выбранных участков После депротекции (снятия защиты) первое соединение, содержащее фотолабильную защищающую группу, подвергается воздействию по всей поверхности, однако реакция происходит только с участками, на которые попал свет на предыдущем этапе Затем подложка освещается через вторую маску, которая активизирует другую область для реакции со вторым защищенным стандартным блоком Структура масок, используемых в таком освещении, и последовательность реагентов определяют конечные продукты и их размещение При методе Фодора возможна высокая степень миниатюризации, потому что плотность мест синтеза связана только физическими ограничениями на пространственную 48119 адресуемость, т е дифракцией света Каждое соединение доступно и его положение точно известно Поэтому олиго-чип, получаемый таким образом, можно легко использовать в СПГ Фодор и др (1991), [22] описывают акутивизи 27 48119 рованное светом образование динуклеотидоа следующим образом 5'-Нитровератрил тими дин синтезировался из З'-О-тимидин ацетата После депротекции с базой 5'-нитровератрил тимидин прикреплялся к аминированной подложке через связь с З'-гидроксильной группой Защищающие группы нитровертрила удалялись освещением через 500мкм маску типа шахматной доски Затем подложка обрабатывалась активизированным фосфорамидитом 2'-диоксицидином Чтобы отслеживать реакцию флуорометрически, деоксицитидин модифицировался образователем связи, защищенным FMOC аминогексилом, прикрепленным к эксоциклическому амину После удаления FMOC-защищающей группы с базой области, которые содержали динуклеотид были флюоресцентно мечены обработкой подложки FITC Поэтому, следуя этому методу, можно синтезировать связанные с основой олигонуклеотиды Образование связи олигонуклеотида с нейлоновой основой, как описано Ван Нессом и др (1991), [51] требует активации нейлоновой поверхности через алкилацию и селективную активацию 5'-амина олигонуклеотидов цианурхлоридом следующим образом Нейлоновая поверхность этилируется с использованием триэтилоксоний тетрафторобората с образованием амин-реактивных имидат-сложных эфиров на поверхности нейлона и 1-метил-2-пирролилон используется как растворитель Поверхность нейлона не полируется, чтобы была максимально возможная площадь поверхности Затем активизированная поверхность реагирует с поли(этиленимин) (Mr приблизительно 10К70К) с образованием полимерного покрытия, которое создает расширенную поверхность амина для прикрепления олиго Олнгонуклеотид(ы) с аминным хвостом селективно реагирует с избытком цианур-хлорида, исключительно в аминном хвосте, давая 4,6-дихлоро-1,3,5-триазинилолигонуклеотид(ы) в количественном выходе Смещение одной хлорной среды цианур-хлорида амино-группой значительно уменьшает реактивность остающихся групп хлора Это приводит к повышенной гидролитической стабильности 4,6дихлоро-1,3,5-триазинил-олигонуклеотида (олигонуклеотидов), который стабилен значительные периоды времени в содержащих буфер водных растворах (рН 8,3,4 градуса С, 1 неделя) и легко изолируется и считается хроматографией размерного элюирования или ультрафильтрацией Эта реакция специфична для аминного хвоста без очевидной реакции на нуклеотидных средах Затем покрытая PEI поверхность нейлона реагирует с активизированным цианур-хлоридом олигонуклеотидом Высокие концентрации "захватывающей" последовательности легко связываются на поверхности и непрореагировавшие амины покрываются сукциновым ангидридом на конечном этапе процесса дериватизации Один конкретный способ приготовления олигонуклеотидов, связанных с основой, заключается в использовании генерируемого светом синтеза, описанного Пизом и др (1994), [36] Эти авторы использовали существующие методы фотолитографии для формирования рядов связанных проб 28 олигонуклеотидов (чипов ДНК) Эти методы, в которых свет используется, чтобы направлять синтез проб олигонуклеотидов в миниатюризованных рядах высокой плотности, используют фотолабильные 5'-защищенные N-ацил-деокси нуклеозид фосфорамидиты, химию поверхностного создателя связей и универсальные стратегии комбинаторного синтеза Матрица их 256 пространственно определенных проб олигонуклеотидов может формироваться таким образом и затем использоваться в удобной организации последовательности в формате 3, как здесь описано Пиз и др (1994), [36] представили стратегию, пригодную для использования в направляемом светом синтезе олигонуклеотидов В этом способе поверхности твердой опоры, модифицированная фотолабильными защищающими группами, освещается через фотолитографическую маску, давая реактивные гидроксильные группы в освещенных участках Затем 3'0-фосфорамидитактивизированный деоксинуклеозил (защищенный как 5"-гидроксил фотолабильной группой) подается на поверхность и связи образуются на местах, на которые воздействовал свет Вслед за покрытием окислением подложка промывается и поверхность освещается через 2-ю маску для воздействия на дополнительные гидроксильные группы для образования связей Второй 5'защищенный, 3'0-фосфорамидитактивизированный деоксинуклеозид наносится на поверхность Селективная фотодепротекция и циклы образования связей повторяются пока не получается желаемый набор продуктов Поскольку применяется фотолитография, процесс можно миниатюризовать для формирования рядов с высокой плотностью проб олигонуклеотидов- последовательность которых известна в каждом месте Путь синтеза для приготовления необходимых 5'0-(альфа-метил-6HHTponHnepoHHnoKCHKap6oHnn)-N-fwbk-2'деоксинуклеозид фосфорамидитов (MeNPoc-Nацил2'-деоксинуклеозид фосфорамидитов) предполагает на первом этапе наличие І\І-ацил-2'деоксинуклеозида, который реагирует с 1-(2нитро-4,5-метилендиоксифенил)-этил-1хлороформатом с получением 5'-МеМРос-І\І-ацил-2'деоксинуклеозида На втором этапе З'-гидроксил реагирует с 2-цианоэтил N,N'диизопропилхлорофосфорамидитом с использованием стандартных процедур с получением 5'МеМРос-г\І-ацил-2'-деоксинуклеозид -3'-0-(2цианоэтил-1\1-г\1-диизопропил)фосфорамидитов Светозащищающая группа стабильна в обычных условиях синтеза фосфорамидита и может удаляться водной базой Эти реагенты можно длительно хранить в аргоне при 4S00C Сообщалось о периодах полупроведения фотолиза 28 с, 31 с, 27 с и 18 с для MeNPoc-dT, MeNPoc-dclbu, MeNPoc-dGPAC MeNPoc-dAPAC соответственно (Пиз и др , 1994), [36] Поэтому в литографическом синтезе рекомендуется время освещения 4,5мин (9 х t1/2MeNPoc-dC) для обеспечения >99% удаления МеМРос защищающих групп Пригодная синтетическая основа это состоит из 5,1 X 7,6см стеклянной подложки, приготовлен 29 48119 ной путем чистки в концентрированной NaOH, за чем следует исчерпывающее полоскание в воде Затем поверхности дериватизируются 2 часа раствором 10% (объем/объем) бис(2-гидроксиэтил) аминопропилтриэтоксилана (фирма Petrarch Chemicals, Бристол, Пенсильвания) в 95% этанола, промываются тщательно этанолом и эфиром, высушиваются в вакууме при 40°С и нагреваются при 100°С в течение 15мин В таких исследованиях образователь связи синтеза прикрепляется реакцией дериватизированных подложек с 4,4' диметокситритил (0МТ)-гексаэтилокси-Оцианоэтил фосфорамидитом Резюмируя, чтобы инициировать синтез пробы олигонуклеотида, подходящая производная деоксинуклеозид фосфорамидита прикрепляется к синтетической основе через образователь связи Затем области основы активизируются для синтеза освещением через, например, отверстия 800 х 12800мкм фотолитографической маски Могут проводиться дополнительные циклы синтеза фосфорамидита (с DMT-защищенными деоксинуклеозидами) для формирования любой требуемой последовательности, такой как любая 4-,5-,6,7-,8-,9- или даже 10-мерная последовательность После удаления фосфата и экзоциклических амин-защищающих групп концентрированной NH4OH в течение 4 часов подложку можно установить в термостатически контролируемую камеру гибридизации с водяной рубашкой, готовую к работе Конечно, можно легко приобрести чип ДНК, такой как один из описанных выше активизируемых светом чипов, из промышленного источника В этом отношении можно связаться с фирмами Affymetnx из Санты-Клары, Калифорния 95051, и Beckman ПРИМЕРЕ МОДИФИЦИРОВАННЫЕ ОЛИГОНУКЛЕОТИДЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПРОБАХ Модифицированные олигонуклеотиды могут использоваться во всех процедурах этого изобретения для повышения специфичности или эффективности гибридизации Способ достижения этого - замена природных нуклеотидов модификацией базы Например, можно использовать пиримидины с галогеном у положения С5 Считается, что это улучшает стабильность дуплекса путем влияния на установку базы слоями Можно также применять 2,6-диаминопурин для придании -3-ей связи галогена в его базовом спаривании с тимином, что термически стабилизирует ДНК-дуплексы Сообщалось, что использование 2,6-диаминопурина приводит к значительному улучшению стабильности дуплекса коротких олигомеров Его включение, как предлагается, предоставляет более строгие условия отжига инициирующего вещества, тем самым улучшая специфичность образования дуплекса и подавляя фоновые проблемы или исключая использование более коротких олигомеров Синтез вариантов трифосфата этих модифицированных нуклеотидов описан Хохайзелем и Лерахом (1990), [23] 5-хлоро-2'-деоксиуридин и 2,6-диаминопурин 2'-деоксинуклеозид приобретаются, например, в фирме Sigma Фосфорилирова 30 ние выполняется следующие образом 50мг сухого 2-NH2-dAdo принимается в 500мкл сухого триэтил фосфата при перемешивании в аргоне Добавляется 25мкл РОСІз и смесь выдерживается у термостате при -20°С Тем временем 1ммоль пирофосфорной кислоты растворяется в 0,95мл три-пбутиламина и 2мл метанола и высушивается во вращающимся испарителе Затем она высушивается испарением дважды из 5мл пиридина, причем перед вторым разом также добавляется 70мкл три-п-бутиламина Наконец, это растворяется в 2мл сухого диметил формамида Спустя 90мин при -20°С смесь фосфорилирования испаряется для удаление избытка РОСІз добавляется три-п-бутиламмоний пирофосфат в диметил формамиде Выдерживание проводится в течение 1,5мин при комнатном температуре Реакция останавливается путем добавления 5мл 0,2М триэтиламмоний бикарбоната (рН 7,6) и смесь держится на льду 4 часа Для 5-CI-dUrd условия будут тождественны, но добавляется 50мкл РОСІз и фосфолирование проводится при комнатной температуре в течение 4 часов После гидролиза смесь испаряетеся, рН устанавливается на 7,5, и экстрагируется 1 объемом диэтил эфира Разделение продуктов производится например, на (2,5х20см) Q-Sepharose колонне с использованием линейного градиента 0,15М к 0,8М триэтиламмоний бикарбонату При хранении замороженными нуклеотиды стабильны длительное время Можно также использовать неизбирательный аналог базы или универсальную базу, как она сконструирована Николсом и др (1994), [35] Этот новый аналог, 1-(2'-деокси-бета-Орибофураносил)-3-нитропиррол (обозначаемый М) был сформирован для использования в пробах олигонуклеотидов и инициирующих веществах для решения проблем проектирования, которые возникают в результате вырождения генетического коды, или когда имеются только данные по фрагментарной последовательности пептидов Этот аналог повышает укладку слоями и одновременно минимизирует взаимодействия с образованием водородных связей, не разрушая пространственно дуплекс ДНК Аналог М нуклеозида был сконструирован чтобы максимально увеличить взаимодействия при укладке слоями с использованием апротических полярных заместителей, связанных с гетероароматическими кольцами, повышая внутри- и вне-прядевые взаимодействия при укладке, чтобы уменьшить роль водородных связей в специфичности базового спаривания Николе и др (1994), [35] предпочитают 3-нитропиррол 2'деоксирибонуклеоэид из-за его структурной и электронной схожести с р-нитроанилином, чьи производные относятся к самым малым известным пропласткам двойной свитой ДНК Диметокситритил-зашищенный фосфорамидит нуклеозида М также может включаться в нуклеозиды, используемые как инициирующие вещества дли образования последовательности и цепной реакции полимеразы (PCR) Николе и др (1994), [35] показали, что значительное количество нуклеотидов могут заменяться М без потери специфичности инициирующего вещества Уникальной свойство М -это его способность заметать длинные 31 48119 звенья смежных нуклеозидов и все же давать функциональные инициирующие вещества для образования последовательностей Как сообщалось, все последовательности с 3, 6 и 9 замещениями М дают читаемые "лестницы" образования последовательностей, и все PRC с 3-мя разными содержащими М инициирующими веществами привели к расширению правильного продукта (Николе и др , 1994), [35] Способность содержащих 3-нитропиррол олигонуклеотидов функционировать в качестве инициирующих веществ уверенно показывает, что дуплексная структура должна образовываться с дополняющими прядями Оптические тепловые профили, полученные для пар олигонуклеотидов d(5'-C2-T5XT5G2-3') и d(5'-C2A5YA5G2-3') (где X и Y могут быть А, С, G, Т или М), как сообщалось, подходят под обычный сигмоидальный рисунок, наблюдаемый для перехода от двойной к одной пряди (нити) ДНК Значения Т т олигонуклеотидов, содержащих базовые пары Х*М (где X было А, С, G или Т и Y было М), как сообщалось, все попадают в диапазон 3°С (Николе и дрт 1094), [35] ПРИМЕР III ПРИГОТОВЛЕНИЕ ОБРАЗУЮЩИХ ПОСЛЕДОВАТЕЛЬНОСТИ ЧИПОВ И РЯДОВ Этот пример описывает физические варианты осуществления образующих последовательности чипов, рассматриваемых изобретателем Основной пример это использование 6-меров, прикрепленных к поверхностями к 50 микрон для получения чипа с размерами 3 х Змм, который можно комбинировать с получением ряды 20 х 20см Другом пример это использование 9-мерных олигонуклеотидов, прикрепленных к поверхности в 10 х 10 микрон для создания 9-мерного чипа с размерами 5 х 5мм 4000 единиц таких чипов можно использовать для создания ряда 30 х 30см На фиг2А, фиг2В и фиг2С показан еще один пример ряда, в котором 4000-16000 олигочипов расположены по квадрату Пластина или набор трубочек, как также указано, можно упаковать с этим рядом как часть набора материалов для создания последовательностей Ряды можно отделить физически друг от друга или с помощью гидрофобных поверхностна Один возможный способ использовать разделение гидрофобной полоской - это применить такую технологию, как Iso-Gnd Microbiology System, выпускаемую фирмой QA Laboratories, Торонто, Канада Гидрофобные сеточные мембранные фильтры (HGMF) использовались в аналитической микробиологии пищевых продуктов уже около десятилетия, где они уникально привлекательны тем, что имеют расширенный числовой диапазон и автоматизированный подсчет колоний Одна промышленно поставляемая сетка это ISO-GRID(TM) от фирмы QA Laboratories Ltd (Торонто, Канада), которая состоит из квадрата (60 х 60см) полисульфонного полимера (Gelman Tuffryn HT-450, размер пор 0,45мю), на которое отпечатана краской черная гидрофобная сетка, состоящая из 1600 (40 х 40) квадратных ячеек HGMF был предварительно модифицирован добавкой бактериальных суспензий вакуумной фильтрацией и выдерживался на дифференциальной или селективной среде 32 по выбору Поскольку рост микробов ограничен ячейками сетки с известным положением и размером мембраны, HGMF функционирует более как аппарат MPN, чем обычная пластина или мембранный фильтр Петеркин и др (1987), [37] сообщили, что эти HGMF можно использовать для распространения и хранение геномных библиотек при использовании с репликатором HGMF Один такой инструмент реплицирует рост от каждой из 1600 ячеек ISO-GRIP и позволяем сделать много копий образцового HGMF (Петеркин и др , 1987), [37] Шарп и др (1989), [46] также применяли ISOGRID HGMF от QA Laboratories и автоматизированный счетчик HGMF (MI-100 Interpreter) и репликатор RP-100 Они сообщили о методе поддержания и сортировки многих культур микробов Петеркин и его коллеги после описали способ сортировки проб ДНК с использованием гидрофобного сеточно-мембранного фильтра (Петеркин и др, 1989), [38] Эти авторы сообщили о способах эффективной гибридизации колоний прямо на HGMF Раньше плохие результаты получались из-за низкой связующей ДНК способности полисульфонного полимера, на котором печатаются HGMF Однако Петеркин и др (1989), [38] сообщили, что связывание ДНК с поверхностью мембраны улучшилось при обработке реплицированных и выдержанных в термостате HGMF полиэтиленимином, поликатионом, до контакта с ДНК Хотя в этой ранней работе использовалось ячеистое прикрепление ДНК и цель была отличной от цели этого изобретения, описанную методологию можно легко адаптировать для формата З СПГ Для того, чтобы быстро идентифицировать полезные последовательности, Петеркин и др (1989), [38] использовали радио-меченную плазмидную ДНК из разных клонов и испытывали ее специфичность относительно ДНК на приготовленных HGMF Таким образом, ДНК из рекомбинантных плазмидов быстро сортировалась гибридизацией колоний относительно 100 организмов на репликатах HGMF, которые можно легко и воспроизводимо приготовить Нужно решить две основные проблеми Манипулирование с малыми (2-Змм чипами и параллельное выполнение тысяч реакций Решение, которое предлагает это изобретение, состоит в том, чтобы содержать чипы и пробы в соответствующих рядах в одном примере чипы, содержащие 250000 9-меров синтезируются на кремниевой подложке в форме пластин 8 х 8 т М (15мкМ/олигонуклеотид, Пиз и др , 1994), [36] выстроенных в формате 8 x 1 2 (96 чипов) с желобком между ними в 1 шМ Пробы добавляются либо многоканальной пипеткой, либо рядом штырьков, по одной пробе на 1 чип Для расчета всех 4000 6меров нужно применять 42 ряда чипов, или используя разные ряды, или повторно используя один набор рядов чипов несколько раз В указанном случае, при использовании ранней номенклатуры этой заявки, F=9, P=8, F+P=15 Чипы могут иметь пробы с формулой BxNn где х это число специфицированных баз В, a n это число неспецифицированных баз, так что х=4-10 и 33 48119 n=1-4 Чтобы достичь более эффективной гибридизации и избежать потенциального влияния любых олигонуклеотидов основы, специфицированные базы можно окружить неспецифицированными базами, что представляется такой формулой как (N)nBx(N)m (фиг 4) ПРИМЕР IV ПРИГОТОВЛЕНИЕ ФРАГМЕНТОВ НУКЛЕИНОВОЙ КИСЛОТЫ Нуклеиновые кислоты, последовательности которых нужно создать, можно получить из любого подходящего источника, такого, как сДНК, геномная ДНК, хромосомная ДНК, микрорассеченные хромосомный полосы, космидные или YAC вставки и РНК, включая тРНК без каких-либо этапов расширения Например, Сэмбрук и др (1989), [41] описывают 3 протокола для изолирования ДНК с высоким молекулярным весом от клеток млекопитающих (стр 9 14-9 23) Затем нуклеиновые кислоты фрагментируются любым из способов, известных специалистам, включая- например, использование ограничительных ферментов, как описано на стр 9 24-9 28 у Сэмбрука и др (1989), [41], сдвиг ультразвуком и обработку NaOH Сдвиг при низком давлении также уместен, как описано Шрифером и др (1990), [43] В этом способе образцы ДНК пропускаются через небольшой французский датчик давления с набором давлений от малого до промежуточного Рычажное устройство позволяет производить контролируемое приложение от малого до промежуточного давления к элементу Результаты этих исследований указывают, что сдвиг при малом давлении это полезная альтернатива звуковых и ферментных методов фрагментации ДНК Один особенно подходящий способ для разделения ДНК на фрагменты, как считается, это тот, где используются две эндонуклеазы с распознаванием базы, CviJI, описанный Фицджералдом и др (1992), [21] Эти авторы описали подход для быстрой фрагментации и фракционирования ДНК на конкретные размеры, которые они считали пригодными для "дробового" клонирования и создания последовательностей Настоящий изобретатель предусматривает, что это будет также особенно пригодно для генерирования произвольных, но относительно небольших фрагментов ДНК для использования в настоящей технологии образования связей Ограничительная эндонуклеаза CviJI обычно расщепляет распознавательную последовательность PuGCPy между G и С с оставлением тупых концов Нетипичные условия реакции, которые меняют специфичность этого фермента (CviJI**), дают квази-произвольное распределение фрагментов ДНК из малых молекул PUC19 (2688 базовых пар) Фицджералд и др (1992) количественно оценили произвольность этой стратегии фрагментирования с использованием CviJI** продукта вываривания pUC19, который был фракционирован по размерам способом быстрой гелевой фильтрации и непосредственно связан, без ремонта концов, вектором клонирования lacZ minus M13 Анализ последовательности 76 клонов показал, что CviJI** ограничивает PyGCPy и PuGCPu в допол 34 нение к местам PuGCPy и что новые данные и последовательность накапливаются со скоростью, согласующейся с проивольной фрагментацией Как сообщается в литературе, преимущества этого подхода по сравнению фракционированием соникацией (звуком) и агарозным гелем включают в себя требуются меньшее количество ДНК (0,20,5мкг вместо 2-5мкг), и имеется меньше этапов (не нужно предварительного связывания, ремонта концов, химической экстракции или электрофореза агарозного геля и элюирования) Предлагается, что эти преимущества также будут полезны при приготовлении ДНК для создания последовательностей по формату 3 Независимо оттого, как получаются или готовятся фрагменты нуклеиновой кислоты, важно денатурировать ДНК, чтобы получить для гибридизации одно-завитые кусочки Это достигается выдерживанием раствора ДНК в течение 2-5 минут при 80-90°С Затем раствор быстро охлаждают до 2°С для предотвращения повторной натурации Фрагментов ДНК до того, как они контактируют с чипом Фосфатные группы тоже нужно удалить из геномной ДНК, как описано в примере VI ПРИМЕРУ ПРИГОТОВЛЕНИЕ МЕЧЕННЫХ ПРОБ Пробы олигонуклеотидов можно готовить автоматизированным синтезом, что является рутинным для специалистов, например, с использованием системы Applied Biosystems В качестве альтернативы, пробы можно приготовить используя методы Biotechnologies Inc с помощью слоев пористых подложек тефлона Пробы олигонуклеотидов можно метить, например, радиоактивными метками (35р, 32р, ЗЗр и предпочтительно ЗЗр) для рядов с участками 100200мкм или 100-400мкм, нерадиоактивными изотопами (Якобсен и др , 1990), [25], или флуорофорами (Брамбо и др ,1988), [3] Все такие способы нанесения меток являются обычными в технике, как показано в соответствующих разделах у Сэмбрука и др (1989), [41] и в другой литературе, например, у Шуберта и др , (1990), [44], Мураками и др (1991), [33] и Кейта и др (1991), [5] В отношении радио-мечения обычные способы это мечение концов с использованием Т4 полинуклеотидной киназы или нанесение меток с высокой специфической активностью с использованием Кленов или даже Т7 полимеразы Это описывается следующим образом Синтетические олигонуклеотиды синтезируются без фосфатной группы у своих окончаниях 5' и поэтому легко метятся переносом гамма-32р или гамма-ЗЗр из (гамма-32р)дтр или (гамма-ЗЗ)дтр с использованием фермент бактериофаг Т4 нолинуклеотид киназы Если реакция проводится эффективно, специфическая активность таких проб может быть такой высокой, кап специфическая активность самих (гамма -32р)дтр или (гамма33р)дтр Описанная ниже реакция предназначена метить 10 пмолей олигонуклеотида до высокой специфической активности Нанесение меток на разные количества олигонуклеотида можно легко достичь путем увеличения или уменьшения размера реакции при поддержании постоянными кон 35 48119 центрации всех компонентов Реакционная смесь будет создаваться с использованием 1,0мкл олнгонуклеотида (10 нмолей/мкл), 2,0мкл 10х бактериофаг Т4 полинуклеотид киназного буфера, 5,0мкл (гамма-32р)дтр или (гамма-ЗЗр)дтр (пр акт 5000Сі/ммоль, 10тСі/мл в водном растворе) (10 пмолей) и 11,4мкл воды 8 единиц (около 1мкл) бактериофаг Т4 полинуклеотидной киназы добавляется к реакционной смеси, хорошо перемешивается и выдерживается 45 минут при 37°С Реакционная смесь нагревается в течение 10 минут при 68°С для инактивации бактериофаг Т4 полмнуклеотидной киназы Затем определяется эффективность переноса 32р или ЗЗр к олигонуклеотиду и его специфическая активность Если специфическая активность пробы приемлема, она очищается Если специфическая активность слишком низка, добавляются еще 8 единиц фермента и выдерживаются еще 30 минут при 37°С до нагревания реакционной смеси в течение 10 минут при 68°С для инактивации фермента Очистка радио-меченных олигонуклеотидов может достигаться путем осаждения с этанолом, осаждением с цетилпиридиний бромидом, хроматографией через био-гель Р-60, или хроматографией на колонне Sep-Pak C18 Пробы с более высокими специфическими активностями можно получить, используя фрагмент Кленова Е coli ДНК полимеразы I для синтезирования пряди ДНК дополняюще к синтетическому олигонуклеотиду Короткое инициирующее вещество гибридизирует к шаблону олигонуклеотида, чья последовательность является дополнением желаемой радио-меченной пробы Затем инициирующее вещество расширяется с использованием фрагмента Кленова Ecoli ДНК полимеразы I для включения (альфа-32р^ІЧТР или (raMMa-33p)dNTP в направляемой шаблоном манере После реакции шаблон и продукт разделяются денатурированием, за чем следует электрофорез через полиакриламидный гель в условиях денатурации С этим способом при желании можно формировать пробы олигонуклеотидов, содержащие несколько радиоактивных атомов на молекулу олигонуклеотида Чтобы использовать этот метод, нужно смешать в трубе микрофуги рассчитанные количества (альфа-32Р^ІЧТР или (альфа-ЗЗР^ІЧТР, необходимые для достижения желаемой специфической активности и достаточные для получения полного синтеза всех прядей шаблона Концентрация dNTP не должна быть меньше 1мкМ на любом этапе в ходе реакции Затек в трубу добавляются соответствующие количества инициирующего вещества и шаблона ДНК, причем инициирующее вещество в молярном отношении в 3-10 раз превышает шаблон Затем добавляется 0,1 объема 10 х буфера Кленова и хорошо перемешивается Затем добавляются 2-4 единицы фрагмента Кленова Е coli ДНК полимеразы I на Змкл реакционного объема, перемешавается и выдерживается 2-3 часа при 4°С При желании, течение реакции можно отслеживать путем удаления небольших (0,1 мкл) крат 36 ных и измерения доли радиоактивности, которая стала способна осаждаться, 10% трихлороуксусной кислотой (ТСА) Реакционная смесь разжижается равным объемом наполняющего гелем буфера, нагревается до 80°С в течение 3 минут и затем вся проба загружается на денатурирующий полиакриламидный гель После электрофореза гель авторадиографируется, что позволяет найти пробу и удалить ее из геля Имеются также следующие разные способы флуорофобного нанесения меток Брамбо и др (1988), [3], описывают синтез флуоресцентно меченных инициирующих веществ Аналог деоксиуридина с первичным аминовым "плечом образователя связи" из 12 атомов, прикрепленный у С-5, синтезируется Синтез аналога состоит из дериватизации 2'-деоксиуридина через органометаллические промежуточные вещества с получением 5'(метил пропеноил)-2'-деоксиуридина Реакция с диметокситритил-хлоридом дает соответствующий привод 5'-диметокситритил, Сложный эфир метила гидролизуется, активизируется и реагирует с соответствующим образом моноацилирозанным алкил диамином После очистки результирующие нуклеозиды плеча образователя связи преобразуются в аналоги нуклеозида, способные для химического синтеза олигонуклеотида Затем получаются олигонуклеотиды, которые содержат одну или 2 базы с плечом образователя связи с использованием модифицированной химии фосфоридитов В раствор 50нмолей олигонуклеотиде с плечом образоватоля связи в 25мкмл бикарбоната натрия 500тМ (рН 9,4) добавляются 20мкл FITC 300 т М в диметил сульфоксиде Смесь перемешивается при комнатной температуре 6 часов Олигонуклеотид отделяется от свободного FITC путем элюированин из колонны Sephadex G-25 1 х 30см с 20vV ацетата аммония (рН 6) с комбинированием фракций в первом пике УФ-поглощения В общем случае, флуоресцентное нанесение меток на олигонуклеотид у его 5'-конца в начале предполагало 2 этапа Сначала N-защищенная производная аминоалкил фосфорамидита добавляется к 5'-концу олигонуклеотида во время автоматизированного синтеза ДНК После удаления всех защищающих групп сложный эфир NHS соответствующего флуоресцентного красителя соединяется с 5'-амино-группой за полсуток, за чем следует очистка меченного олигонуклеотида от избытка красителя с использованием обратной фазы HPLC или PAGE Шуберт и др (1990) [44], описали синтез, фосфорамидита, который позволяет получать олигонуклеотиды, меченные флуоресцеином во время автоматизированного синтеза ДНК Метилсложный эфир флуоресцеина алкилируется 4хлоро(4,4'-диметокситритил) бутанолом-1 в присутствии К2СО3 и KI в DMF в течение 17 часов После удаления группы тритила 1% TFAB в хлороформе продукт фосфитилируется стандартными процедурами посредством бис (диизопропиламино)метоксифосфина Фосфорилирование указанной полученной производной флуоресцеина приводит к достаточному выходу Н-фосфоната Получающийся амидит (раствор 0,1М в сухом аце 37 48119 тонитриле) используется для автоматизированного синтеза разных инициирующих веществ с использованием бета-цианоэтил фосфорамидитной химии и синтезатора ДНК- Отщепление от основы и депротекция осуществляются с помощью 25% водного раствора аммиака в течение 36 часов при комнатной температуре Необработанный продукт очищается посредством PAGE, и меченное инициирующее вещество видимо как бледно-зеленая флуоресцентная полоса на ЗЮнм Элюирование и обессолевание с использованием патронов RP 18 дает желаемый продукт Флуоресцентное мечение 5'-конца пробы в методе Шуберта непосредственно достигается во время синтеза ДНК в последнем цикле образования связей, Выход связей так же высок, как и с обычными фосфорамитидами После депротекции и удаления аммиака путем лиофилиэирования с использованием скоростного вакуума или осаждения этанолом меченные флуоресцентно олигонуклеотиды могут прямо применяться для образования последовательностей ДНК в формате З СПГ Мураками и др [33] также описывали приготовление меченных флуоресцеином олнгонуклеотидов Этот синтез основан на методе поддерживаемого полимером фосфорамитида и Фосфоната водорода Этилендиамин или гексаметилендиамин используется как привязь Они вводятся через Фосфорамидатную связь, которая была образована окислением водород-фосфонатного промежуточного вещества в растворе ССЦ Модифицированные олигонуклеотиды подвергаются мечению с использованием первичного аминориентируюшегс реагента, FITC, на шариках Получающийся модифицированный олигонуклеотид отщепляется от шариков и затем очищается RPLC Кейт и др (1991), [5] описывают использование проб олигонуклеотидов, непосредственно сопряженных с алкалин фосфатазой в комбинации с прямой хемилюминесцентной подложкой (AMPPD), чтобы позволить обнаружение проб Фосфатазу алкалина можно ковалентне соединить с модифицированной базой олигонуклеотида После гибридизации олиго выдерживается в термостате с AMPDD Фермент алкалин фосфатазы разбивает AMPDD с получением соединения, которое дает флуоресценцию без возбуждения, т е лазер не нужен Считается, что сильный сигнал может формироваться с использованием такой технологии Меченные пробы можно свободно приобрести в разных промышленных источниках, включая GENsET, а не синтезировать ПРИМЕР VI УДАЛЕНИЕ ФОСФАТНЫХ ГРУПП Как алкалин фосфатаза бактерий (ВАР), так и кишечная алкалин фосфатаза телят (СІР) катализируют удаление радикалов 5'-фосфата из ДНУ и РНК Поэтому они уместны для удаления 5' фосфатов мз ДНК или/и РНК для предотвращения образования связей и неправильной гибридизации Удаление фосфатов, как оно описано Сэмбруком и др (1989), [41], осуществляется после разрезки или иного сдвига геномной ДНК 38 ВАР более активен из 2-х алкалин фосфатаз, но он также намного более стоек к нагреву и чистящим веществам Поэтому трудно замедлить ВАР полностью у конца реакций дефосфорилирования Протеиназа К применяется для вываривания СІР, который должен быть полностью удален, если последующие связи должны эффективно работать Альтернативный метод этг инактивация СІР нагреванием до 65°С в течение 1 часа (или 75°С в течение 10 минут) в присутствии 5 т М EDTA (рН 8,0) с последующей очисткой дефосфорилированнои ДНК экстрагированием с фенол хлороформом ПРИМЕР VII ПРОВЕДЕНИЕ ОБРАЗОВАНИЯ ПОСЛЕДОВАТЕЛЬНОСТИ ПУТЕМ ДВУХЭТАПНОЙ ГИБРИДИЗАЦИИ Ниже следуют некоторые примеры для описания выполнения методологии образования последовательностей, рассматриваемой изобретателем Сначала, весь чип гибридизируется смесью ДНК сложностью 100 миллионов бп (1 хромосома человека) Руководство по проведению гибридизации можно найти в статьях, таких как Дрманач и др (1990), [18], Храпко и др (1991), [28] и Бруд и др (1994), [2] В этих статьях указаны диапазоны температур гибридизации, буфери и этапы промывки, которые пригодны для использования на начальном этапе формата 3 СПГ Данный изобретатель в особенности рассматривает проведение гибридизации в течение до нескольких часов при высоких концентрациям соли и при низкой температуре (от -2 до 5°С из-за относительно малой концентрации получаемой целевой ДНК Для этой цели применяется буфер SSC вместо буфера фосфата натрия (Дрманач и др , 1990), [18] которым осаждается при 10°С Промывка не обязательно должна быть экстеноивной (несколько минут) из-за второго этапа и может быть полностью исключена, если проведение циклов гибридизации используется для создания последовательности в высшей степени сложных образцов ДНК Этот же буфер используется для этапов гибридизации и промывки, чтобы можно было продолжать второй этап гибридизации с меченными пробами После должной промывки с использованием простого робототехнического устройства на каждом ряде, например, ряде 8 х 8мм (пример III), добавляется одна меченная проба, например, 6мер Используется 96-кончиковое или 96штырьковое устройство, выполняя это за 42 операции Снова используется диапазон избирательных условий, как ранее описывалось в научной литературе Данным изобретатель в особенности рассматривает использование следующих условий Сначала, после добавления меченных проб и выдержки только в течение нескольких минут (из-за высокой концентрации добавленных олигонуклеотидов) при никой температуре (0-5°С) температура повышается до 3-10°С в зависимости от длины F+P и добавляется промывающий буфер В это время используемый промывающий буфер совместим с любой реакцией образования связей (например, в диапазоне концентрации соли 100 39 mM) После добавления лигазы температура снова повышается до 15-37°С, чтобы позволить быстрому образованию связей (менее ЗОмин) и дальнейшему избиранию гибридов с полным совпадением и несовпадениями Использование катионных чистящих (моющих) веществ также рассматривается для использования в формате З СПГ, как описано Понтиусом и Бергом (1991), [32] Эти авторы описывают использование двух простых катионных чистящих веществ, дедецил- и цетилтриметиламмоний бромида (DTAB и СТАВ) в повторной натурации ДНК DTAB и СТАВ это варианты четвертичного аминтетраметиламмоний бромида (ТМАВ), в котором одна из групп метила замещена либо 12углеродной (DTAB), либо 16-углеродной (СТАВ) алкильной группой ТМАВ это соль бромида иона тетраметиламмония, реагент, применяемый в экспериментах по повторному натурированию нуклеиновых кислот для уменьшения сдвига содержания G-C температуры расплавлении DTAB и СТАВ аналогичны по структуре натрий додецил сульфату (SDS) с замещением отрицательно заряженного сульфата SDS положительно заряженным четвертичным амином Хотя SDS обычно применяется в буферах гибридизации для уменьшения неспецифическоги образования связей и для замедления нуклеаз, он не сильно влияет на скорость повторного натурирования При проведении процесса образования связей можно добавить фермент в меченные пробы или после этапа должной промывки для снижения фона Хотя ее ранее не предлагали для использования с каким-либо методом СПГ, технология лигазы хорошо установлена в области молекулярной биологии Например Худ и коллеги описали метод обнаружения гена посредством лигазы (Ландегрен и др, 1988), [30] методологию которого можно легко приспособить для использования в формате 3 СПГ Ландегрен описывает анализ присутствия данных последовательностей ДНК на основе способности 2-х олигонуклеотидов отжигаться непосредственна рядом друг с другом на дополняющей целевой молекуле ДНК Затем 2 олигонуклеотида соединяются ковалентно под действием ДНК лигазы при условии, что нуклеотиды у места соединения правильно спарены базами Хотя это ранее не рассматривалось, эта ситуация теперь возникает в образовании последовательности в формате 3 By и Уоллас также описывают использование бактериофаг Т4 ДНЕ лигазы для соединения двух соседних коротких синтетических олигонуклеотидов Их реакции образовании связи олиго проводились в 50mM Tns HCI pH 7,6, 10 mM MgCI2, 1тМ ATP, 1mM DTT и 5% PEG Реакции образования связи проводились при нагревании до 100°С в течение 5-10 мин, за чем следовало охлаждение до 0°С до добавления Т4 ДНК лигазы (1 единица, Bethesda Research Laboratory) Большинство реакций образования связей проводились при 30°С и заканчивались нагреванием до 100°С в течение 5мин Затем проводится конечная промывка, пригодная для избирательного обнаружения гибрили 48119 40 зированных соседних, или образовавших связь, олигонуклеотидов о длиной (F+P) Этот этап промывки проводится в воде в течение нескольких минут при 40-60°С для вымывания всех необразовавших связи меченных проб и всех других соединений, чтобы максимально уменьшить фон Благодаря ковалентне связанным меченным олигонуклеотидам обнаружение упрощается (с ним не связаны ограничения по времени и низкой температуре) В зависимости от используемой метки получение изображений чинов производится на разных аппаратах Для радиоактивных меток можно использовать технологию хранения фосфора с экраном и Phosphorlmager в качестве сканера (фирма Molecular Dynamics, Саннивейл, Калифорния) Чипы помешаются в кассету и накрываются фосфористым экраном После 1-4 часов воздействия экран сканируется и файл изображения хранится на твердом диске компьютера Для обнаружения флуоресцентных меток используются камеры с ПЗС и эпифлуоресцентная или конфокальная микроскопия Для чипов, сформированных прямо ни элементах изображения камеры с ПЗС обнаружение может проводиться, как описано Эггерсом и др , (1994), [20] Детекторы с приборами с зарядовой связью (ПЗС) служат в качестве активных твердых основ, которые количественно обнаруживают и формируют изображение распределения меченных целевых молекул в анализах на основы проб В этих устройствах используются присущие микроэлектронике характеристики, которые сочетают в высшей степени параллельные анализы, сверхчувствительное обнаружение, высокую производительность (пропускную способность) интегральный сбор данных и вычисление Эггерс и др (1994) описывают применение ПЗС для основанных на пробах анализов, таких, как формат 3 СПГ настоящего изобретения, которые позволяют количественную оценку с точностью до секунд благодаря высокой чувствительности и применяемой прямой связи Подход интегрального обнаружения с ПЗС позволяет проводить обнаружение событий образования молекулярных связей на чипах Детектор быстро формирует двумерную картину, которая уникально характеризует образец В конкретной работе молекулярного детектора на базе ПЗС отдельные биологические пробы связываются (нейтрализуются) непосредственно на элементах изображения ПЗС и могут прикрепляться к одноразовой полоске-крышке, помещенной на поверхность ПЗС Молекулы образца можно метить радиоизотопом, хемилюмминесцентными или флуоресцентными ярлыками После воздействия на образец ряда проб на основе ПЗС Фотоны или продукта затухании радиоизотопа испускаются у местоположений элементов изображения, где образец образовал связи, в случае формата 2, с двумя дополняющими пробами В свою очередь, пары электрон-дырка генерируются в кремнии, когда заряженные частицы или излучение от меченных образцов падают на управляющие электроды ПЗС Затем электроны 41 48119 собираются под соседними управляющими электродами ПЗС и последовательно считываются на модуле дисплея Количество фотоэлектронов, генерируемое у каждого элемента изображения, прямо пропорционально количеству молекулярных событий образования связей в такой ближайшей области Следовательно, образование молекулярных связей можно определять количественно (Эггерс и др 1994), [20] Как недавно сообщалось, ПЗС на базе кремния имеют преимущества как полупроводниковые датчики обнаружения и формирования изображений, прежде всего благодаря высокой чувствительности устройств в широком диапазоне длин волн (от 1 до 10000 ангстрем) Кремний очень чувствителен к электромагнитному излучению от видимого спектра до мягких рентгеновских лучей Для видимого света один фотон, падающий на управляющий электрод ПЗС, приводит к появлению одного заряженного электроном пакета под электродом Одна бета-частица мягкого рентгеновского излучения (обычно в диапазоне КэВ до МэВ) генерирует от тысяч до десятков тысяч электронов В добавок к высокой чувствительности, ПЗС, описанные Эггерсом и др (1994), [20] предоставляют широкий динамический диапазон (4-5 порядков величины), поскольку обнаружаемый пакет заряда может включать от нескольких до 105 электронов Характеристика обнаружения является линейной в широком динамическом диапазоне Путем размещении создающего изображении ряда вблизи от образца эффективности сбора улучшается, как минимум, в 10 раз по сравнении с методами на основе линзы, такими, какие применяются в обычных камерах на ПЗС То есть образец (эмиттер) находится в близком контакте с детектором (матрицей формирования изображения) и это исключает обычную оптику формирования изображений, такую, как линзы и зеркала Когда радиоизотопы прикреплены кап сообщающие группы к целевым молекулам, энергетические частицы обнаруживаются Несколько сообщающих групп, которые излучают частицы с разной энергией, успешно использовались с микро-изготовленными детекторами, такие как 32р, ЗЗр, 35s, 14с, 1251 Частицы с более высокой энергией, такие как от 32р, обеспечивают самум высокую чувствительность молекулярного обнаружения, тогда как частицы с более низкой энергией, такие как от 35s, обеспечивают лучшее разрешение Поэтому, выбор сообщающего радиоизотопа может быть сделан по желанию Когда конкретная радиоизотопная метка выбрана, характеристики обнаружения можно предсказать путем расчета отношения сигнал-шум, как описано Эггерсом и др (1994), [20] Альтернативная процедура люминесцентного обнаружения предполагает использование флуоресцентных или хемилюминесцентных сообщающих групп, прикрепленных к целевым молекулам Флуоресцентные метки можно прикреплять ковалентне или через взаимодействие Флуоресцентные красители, такие, как бромид этидия с сильными полосами поглощения в диапазоне ближнего УФ (300-350нм) и основными полосами излучения в видимом диапазоне (500-650нм) наи 42 более пригодны дли используемых устройств с ПЗС, поскольку квантовая эффективность на несколько порядков величины ниже на длине волны возбуждения, чем на длине волны флоуресцентного сигнала С точки зрения обнаружения люминесценции, многокремниевые управляющие электроды (схемы) ПЗС имеют "встроенную" способность отфильтровывать вклад падающего света в УФдианазоне, но они очень чувствительны к видимой люминесценции, генерируемой флуоресцентными сообщающими группами Такая присущая большая избирательность относительно УФ-возбуждения позволяем достигать высоких отношений сигнал-шум (более 100) с помощью ПЗС, как указывалось в статье Эггерса и др (1994), [20] Для связывании проб на детекторе можно получить матрицы гибридизации на недорогих подложках из S1O2, которые затем помешаюі на поверхность ПЗГ после гибридизации и сушки Этот формат экономически эффективен, т п гибридизация ДНК проводится на недорогих одноразовых подложкам из S1O2, что позволяет повторно использовать более дорогой детектор на ПЗС В качестве альтернативы, пробы можно связывать прямо на ПЗС с созданием специализированной матрицы проб Чтобы связать пробы на покрытии S1O2, однородный эпоксидный слой связывается с поверхностью пленки с использованием эпоксидносиланового реагента и стандартной химии модификации S1O2 Затем амин-модифицированные пробы олигонуклеотидов связываются с поверхностью S1O2 посредством вторичного образования аминов с эпоксидным кольцом Получающаяся связь создает 17 способных вращаться связей разделения между 3' базой олигонуклеотида и поверхностью S1O2 Чтобы обеспечить полную депротонацию аминов и минимизировать образование вторичной структуры во время создания связи, реакцию проводят в 0,1 М КОН и выдерживают при 37°С 6 часов В формате З СПГ вообще сигналы считаются на каждую из миллиарда точек Будет необходимо гибридизировать все ряды, например, 4000 5 х 5мм за 1 раз и возможна последующее использование меньшего числа рядов Гибридизации с проведением циклов это один возможный способ увеличения сигнала гибридизации За 1 цикл большинство фиксированных проб гибридизируют с фрагментами ДНК с хвостовыми последовательностями, некомплементарными для меченных проб При увеличении температуры эти гибриды будут расплавляться (фигЗ) За следующий цикл некоторые из них (около 0,1%) гибридизируются с соответствующим фрагментом ДНК и дополнительные меченные пробы образуют связи В этом случае, происходит избирательное плавление гибридов ДНК с несовпадениями одновременно для обоих наборов проб В гибридизации с проведением циклов все компоненты добавляются до начала циклов при 37°С для Т4 или при более высокой температуре для термостабильной лигазы Затем температура снижается до 15-37°С и чип выдерживается до 10 43 48119 минут, а потом температура повышается до 37°С или выше в течение нескольких минут, и потом снова уменьшается Циклы можно повторять до 10 раз В одном варианте оптимальную более высокую температуру (10-50°С) можно использовать без циклов и можно провести более длинную реакции- образования связей (1-3 часа) Описанная здесь процедура позволяет изготовлять сложные чипы с использованием стандартного синтеза и точного определения мест олигонуклеотидов, потому что нужно относительно небольшое количество олигонуклеотидов Например, если все 7-мерные олиго синтезированы (16384 пробы), можно определить списки 256 миллиона 14-меров Один важный вариант изобретенного способа заключается в применении более чем 1 поразному меченную пробу на базовым ряд Это можно выполнить имея в виду 2 цели, мультиплексирование для снижения числа отдельно гибридизированных рядов, или определение списка еще более длинных олиго-последовательностей, таких, как 3 x 6 или 3 х 7 В этом случае, если используются 2 метки, специфичность 3 последовательных олигонуклеидов может быть почти абсолютной, потому что положительные места должны иметь достаточное количество сигналов обоих меток Еще один дополнительный вариант - использовать чипы, содержащие пробы BxNy, где у составляет от 1 до 4 Эти чипы позволяют считывать последовательности в разных кадрах Этого можно также достигнуть путем использования соответствующих наборов меченных проб или обе пробы F и Р могут иметь некоторые неспецифицированные концевые позиции (те некоторый элемент с оконечным вырождением) Можно также использовать универсальные базы как часть образователя связи для соединения проб с определенной последовательностью с твердой основой Это делает пробу более готовой к гибридизации и делает строение более стабильным Если проба имеет 5 баз, можно, например, использовать 3 универсальные базы как образователь связи (фиг 4) ПРИМЕР VIII АНАЛИЗ ПОЛУЧЕННЫХ ДАННЫХ Файлы с изображениями анализируются программой анализа изображений, такой, как программа DOTS (Дрманач и д р , 1993), [15,16] и шкалируются и оцениваются включенными статистическими функциями, например, в программу SCORES (Дрманач и др , 1994), [17] Из распределения сигналов определяется оптимальным порог для преобразования сигнала в +/- выход Из положения обнаруженной метки определяется F+P последовательности нуклеотидов из фрагментов путем комбинирования известных последовательностей связанных и меченных проб, соответствующих меченным позициям Полная последовательность нуклеиновой кислоты или подфрагменты последовательности первоначальной молекулы, такой, как хромосома человека, затем собираются из перекрывающихся последовательностей F+P, определенных вычислительным вычитанием 44 Один вариант состоит в преобразовании сигналов гибридизации, например меток, в +/- выход во время процесса сборки последовательности В этом случае сборка начинается с последовательности F+P с очень большим счетом, например, с F+P последовательности ААААААТТТТТТ (поел ид N 1) Счета всех 4-х возможных перекрывающихся проб АААААТТТТТТА (поел ид N 3), АААААТТТТТТТ (поел ид N 4), АААААТТТТТТС (поел ид N 5) и AAAAATTTTTTG (поел ид N 6) и 3 дополнительные пробы, которые отличны в начале (ТАААААТТТТТТ, поел ид N 7, САААААТТТТТТ, поел ид N 8, GAAAAATTTTTT, поел ид N 9) сравниваются и определяются 3 результата (1) только начальная проба и только 1 из 4-х перекрывающихся проб имеют счета, которые значительно положительны по отношении к другим Є пробам, в этом случае последовательность АААААААТТТТТТ (поел ид N 1) будет продлена на 1 нуклеотид вправо, (2) ни одна проба, за исключением начальной пробы, имеет значительно положительный счет, сборка остановится, например, последовательность ААААААТТТТТ (поел ид N 10) находится на конце молекулы ДНК, последовательность которой создается, (3) обнаружена более чем 1 значительно положительная проба среди перекрывшихся или/и других 3-х проб, сборка останавливается из-за ошибки или разветвления (Дрманач и др , 1989), [12] Процессы вычислительного вычитания используют компьютерные программы с применением существующих алгоритмов (см , например, Певзнер, 1989, Дрманач и др , 1991, [14], Лабат и Дрманач, 1993, [29]) Если, вдобавок к F+P, F(npocTpaHCTBO 1)P, F(npocTpaHCTBO 2)P, F(npocTpaHCTBO 3)P или F(npocTpaHCTBO 4)P определяются, алгоритмы будут использоваться, чтобы совместить все наборы данных для корректировки потенциальных ошибок или для разрешения ситуации, когда имеется проблема разветвления (см , например, Дрманач и др , 1989, [12] Бейнс и др , 1988, [1]) ПРИМЕР IX ПОВТОРНОЕ ИСПОЛЬЗОВАНИЕ СОЗДАНИЯ ПОСЛЕДОВАТЕЛЬНОСТИ ЧИПОВ Если образование связей используется в процессе создания последовательности, то обычный чип олигонуклеотидов нельзя сразу же повторно использовать Изобретатель рассматривает, что это можно решить разными способами Можно использовать рибонуклеотиды для второй пробы, пробы Р, так что эту пробу можно затем удалить обработкой РНКазой В обработке РНКазой может использоваться РНКаза А, эндорибонуклеаза, которая специфически разъедает одно-свитую РНК 3' до радикалов пиримидина и расщепляет связь фосфата до соседнего нуклеотида Конечными продуктами являются пиримидин 3' фосфаты и олигонуклеотиды с оконечными пиримидин 3' фосфатами РНКаза А работает в отсутствии адъюнктов и двухвалентных катионов Чтобы использовать РНКазу, обычно выдерживают чин в любом пригодном содержащем РНКазу буфере, как описано Сэмбруком и др , (1989), [41] Уместно использовать 30-50мкл содержащего РНКазу буфера на 8 х 8мм или 9 х Эмм 45 48119 матрицы при 37°С от 10 до 60 минут Затем промывают буфером гибридизации Хотя это не применяется широко, можно также использовать базу урацила, как описали Крейг и др (1989), [7], в конкретных примерах осуществления Разрушение комбинации связанной пробы для получения повторно используемого чипа можно достичь вывариванием ремонтным ферментом Е соїі, ураци-ДНК гликосилазой, которая удаляет урацил из ДНК Можно также сформировать специфично расщепляемую связь между пробами и затем расщепить связь после обнаружения Например, этого можно достичь химическим образованием связи, как описано Шабаровой и др (1991), [45], и Долинной и др (1988), [9] Шабарова и др (1991), [45] описывают конденсацию олигодеоксирибо нуклеотидов цианоген бромидом как конденсирующим веществом В их одноэтапной химической реакции образования связи олигонуклеотиды нагреваются до 97°С, медленно охлаждаются до 0°С, затем добавляется 1мкл Ю М BrCN в ацетонитриле Долинная и др (1988), [9] показывают как включать межнуклеотидные связи фосфорамидата и пирофосфата в дуплексы ДНК Они также используют метод образования химической связи для модификации сахаро-фосфатнего основания ДНК с растворимым в воде карбодиимидом (CDI) как связующим веществом Селективное расщепление фосфоамидных связей предполагает контакт с 15% СНзСООН в течение 5 мин при 95°С Селективное расщепление, связи пирофосфата предполагает контакт со смесью пиридин-вода (9 1) и столько что дистиллированным (СРзСО^О Хотя соединения и способы согласно этому, изобретению были описаны в терминах предпочтительных примеров его осуществления, для специалистов будет очевидно, что можно изменить соединение, способы и этапы или последовательность этапов описанного здесь способа, не отходя от замысла, духа и объема изобретения Более конкретно очевидно, что некоторые вещества, которые связаны химически и физиологически, могут заменяться описанными здесь веществами, и будут получены те же самые или похожие результаты Все такие аналогичные заменители и модификации, очевидные для специалистов, считаются находящимися в духе, рамках и замысле изобретении, определяемого прилагаемой формулой изобретения Все заявленное, вещества и способы, могут получаться и выполняться без ненужного экспериментирования ССЫЛКИ 1 Bams et al, 1988, J Theor Biol , 135 303-307 2 Broude et al , 1994, Proc Natl Acad Sci USA, 91 3072-3076 3 Brumbaugh et al , 1988, Proc Natl Acad Sci U S A , 85 5610-5614 4 Cantor etal , 1992, Genomics, 13, 1378 5 Gate etal ,1991, GATA, 8(3) 102-106 6 Chu et al , 1983, Nucleic Acids Res , 11 65136529 7 Craig et al , 1989, Nucleic Acids Research, 17(12) 4605 8 Dahlen et al , 1987, Мої Cell Probes 1 159 46 168 9 Dolmnaya et ai , 1988, Nucleic Acids Research, 16(9)3721-3738 10 Drmanac & Crkvenjakov, 1990, Scientia Yugoslavica, 16, 97 11 Drmanac & Crkvenjakov, U S Patent 5,202,231 12 Drmanac et al , 1989, Genomics, 4 114-128 13 Drmanac et al , 1991, J Biomol Struct & Dyn , 81085 14 Drmanac et al , 1991, In "Electrophoreses, Supercomputers and the Human Genome", pp 47-59, World Scientific Publishing Co , Singapore 15 Drmanac et ai , 1993a, Proceedings of 2nd International Conference on Bio informatics, Supercomputing, and Complex Genome Analysis, World Scientific Publishing Co / pp 121 -134 16 Drmanac, et ai , 1993b, DNA Sequence Determination by Hybridization a Strategy for Efficient Large-Scale Sequencing, Science, 260 1649-1652 17 Drmanac, 1994, Abstract Book for Genome Mapping and Sequencing, arranged by Richard Myers, David Porteous and Robert Waterstone, Cold Spring Harbor Laboratories, p 60 18 Drmanac et al , 1994, Proceedings of the 3rd International Workshop of Transcribed Sequences, In Press 19 Duncan & Cavalier, 1988, Analytical Biochemistry, 169 104-108, 20 Eggers ct al, 1994, BioTechmques, 17(3)516-524 21 Fitzgerald et al , 1992, Nucleic Acids Research, 20(14)3753-62 22 Fodoretal , 1991, Science, 251 767-768 23 Hoheisel & Lehrach, 1990, FEBS Lett, 274(1,2) 103-106 24 Inouye & Hondo, 1990, J Clm Microb, 28 1469-1472 25 Jacobsen etal , 1990, Genomics, 8 001-007 26 Keller et al , 1988, Anal Biochem , 170 441450 27 Keller et al , 1989, Anal Biochem, 177 2732 28 Khrapko et al , 1991, J DNA Sequencing Mapping, 1, 375 29 Labat and Drmanac, 1993, Proceedings of 2nd International Conference on Biomformations, Supercomputmg, and , Complex Genome Analysis, World Scientific Publishing Co , pp 555-565 30 Landegren et al 1988, Science, 241 10771080 31 Maxam & Gilbert, 1977, Proc Natl Acad Sci , 74, 560 32 Morney & Collins, 1989, Мої Cell Probes 3 189-207 33 Murakami et ai , 1991, Nucleic Acids Research, 19(15)4097-4102 34 Nagata et al , 1985, FEBS Letters, 183 379382 35 Nichols et al , 1994, Nature, 369 492 36 Pease et al , 1994 Proc Natl Acad Sci, 91 5022-5026 37 Peterkm et al , 1987, BioTechmques 5(2) 132-134 38 Peterkm et al , 1989, Food Microbiology 5(2)281-284 48 47 48119 (D) ТОПОЛОГИЯ линейная 39 Pontius & Berg, 1991, Proc Natl Acad Sci U S A , 88 8237-8241 (м) ТИП МОЛЕУКУЛЫ DNA (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ 40 Rasmussen et al, 1991, Analytical BiochemSEQ ID NO 4 istry, 198 138-142 АААААТТТТТ ТТ 41 Sambrook et al , 1989, Molecular cloning A laboratory manual Cold Spring Harbor Laboratory ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 3 Cold Spring Harbor, NY (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ 42 Sanger, et al , 1977, Proc Natl Acad Sci , 74, 5463, (A) ДЛИНА 12 пар оснований (B) ТИП нуклеиновая кислота 43 Schnefer et al , 1990, Nucleic Acids Research, 18(24)7455 (C) ЦЕННОСТЬ единичная (D) ТОПОЛОГИЯ линейная 44 Schubert et al , 1990, Nucleic Acids Re(м) ТИП МОЛЕУКУЛЫ DNA search, 18(11)3427 (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ 45 Shabarova et al , 1991, Nucleic Acids ReSEQ ID NO 5 search, 19(15)4247-4251 ААААААТТТТ ТС 46 Sharp et al , 1989 Food Microbiology, 6 261265 ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 6 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНО47 Southern, PCT Patent Application WO СТИ 89/10977 (A) ДЛИНА 12 пар оснований 48 Southern & Maskos, PCT Patent Application WO 90/03382 (B) ТИП нуклеиновая кислота (C) ЦЕННОСТЬ единичная 49 Southern etal , 1992, Genomics, 13, 1008 50, Strezoska et al , 1991, Proc Natl Acad Sci , (D) ТОПОЛОГИЯ линейная (м) ТИП МОЛЕУКУЛЫ DNA 88, 10089 (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ 51 Van Ness et al , 1991, Nucleic Acids ReSEQ ID NO 6 search, 19(12)3345 ААААААТТТТ TG 52 Wu & Wallace, 1989 Gene, 76 245-254 ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 7 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ СТИ ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 1 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНО(A) ДЛИНА 12 пар оснований СТИ (B) ТИП нуклеиновая кислота (C) ЦЕПНОСТЬ единичная (A) ДЛИНА 12 пар оснований (D) ТОПОЛОГИЯ линейная (B) ТИП нуклеиновая кислота (м) ТИПМОЛЕУКУЛЫ DNA (C) ЦЕННОСТЬ единичная (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ (D) ТОПОЛОГИЯ линейная SEQ ID NO 7 (м) ТИП МОЛЕУКУЛЫ DNA ТАААААТТТТ ТТ (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO 1 ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 8 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОААААААТТТТ ТТ СТИ ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 2 (A) ДЛИНА 12 пар оснований (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ (B) ТИП нуклеиновая кислота (C) ЦЕННОСТЬ единичная (A) ДЛИНА 13 пар оснований (D) ТОПОЛОГИЯ линейная (B) ТИП нуклеиновая кислота (м) ТИП МОЛЕУКУЛЫ DNA (C) ЦЕННОСТЬ единичная (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ (D) ТОПОЛОГИЯ линейная SEQ ID NO 8 (м) ТИП МОЛЕУКУЛЫ DNA САААААТТТТ ТТ (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO 2 ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 9 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОААААААТТТТ ТТС СТИ ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 3 (A) ДЛИНА 12 пар оснований (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ (B) ТИП нуклеиновая кислота (C) ЦЕННОСТЬ единичная (A) ДЛИНА 12 пар оснований (D) ТОПОЛОГИЯ линейная (B) ТИП нуклеиновая кислота (м) ТИП МОЛЕУКУЛЫ DNA (C) ЦЕННОСТЬ единичная (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ (D) ТОПОЛОГИЯ линейная SEQ ID NO 9 (м) ТИП МОЛЕУКУЛЫ DNA GAAAAATTTT ТТ (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO 3 ИНФОРМАЦИЯ ДЛЯ SEQID NO 10 (і) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОАААААТТТТТ ТА СТИ ИНФОРМАЦИЯ ДЛЯ SEQ ID NO 4 (A) ДЛИНА 11 пар оснований (A) ДЛИНА 12 пар оснований (B) ТИП нуклеиновая кислота (B) ТИП нуклеиновая кислота (C) ЦЕННОСТЬ единичная (C) ЦЕННОСТЬ единичная 48119 49 (D) ТОПОЛОГИЯ линейная ( ) ТИП МОЛЕУКУЛЫ D A м N (XI) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ 50 SQ N 1 E I O0 D ААААААТТТТ р 1 1 42 3 1 2 3 ^7777777777777777777777777 Р Фиг. 2А /////////////////У//////// х У Фиг. 1В Т -1 c -0 m F 2 1 2 34 -~1 t 1mn • o 0r Фиг. 1С Фиг, 2В Фиг. 2С 51 48119 52 Фиг. ЗС (N)n ПРОБА (Н)т ТВЕРДАЯ ОСНОВА Фиг. 4 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determining the nucleic acid molecule sequence (versions) and a set for use at the nucleic acid sequence
Назва патенту російськоюСпособ определения последовательности молекулы нуклеиновой кислоты (варианты) и набор для использования при определении последовательности нуклеиновой кислоты
МПК / Мітки
МПК: G01N 33/53, C12N 15/09, C12Q 1/68, G01N 37/00
Мітки: набір, кислоти, варіанти, нуклеїнової, молекули, спосіб, визначення, використання, послідовності, визначенні
Код посилання
<a href="https://ua.patents.su/26-48119-sposib-viznachennya-poslidovnosti-molekuli-nuklenovo-kisloti-varianti-ta-nabir-dlya-vikoristannya-pri-viznachenni-poslidovnosti-nuklenovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення послідовності молекули нуклеїнової кислоти (варіанти) та набір для використання при визначенні послідовності нуклеїнової кислоти</a>
Попередній патент: Бурошнекова машина
Наступний патент: Спосіб боротьби з ростом бур’янів, гербіцидна композиція, продукт, що містить синергічну гербіцидну композицію
Випадковий патент: Листорізозгинально-профілювальний прес і спосіб отримання довгомірних виробів з листопрокату